Document d’orientation aux fins de consultation sur les Lignes directrices
Novembre 2023
Document d'orientation
Table des matières
- Introduction
- Participation à la consultation
- Thèmes de la discussion
- Thème 1: Surveillance efficace sans fixation des prix
- Thème 2: Transition vers le CEPMB11 : nouveaux médicaments et médicaments existants
- Thème 3: Examen des prix durant le cycle de vie du produit
- Thème 4: Enquêtes et renvoi à une audience
- Thème 5: Relation avec les partenaires pancanadiens du domaine de la santé et les assureurs (publics et privés), et alignement avec les grandes initiatives du gouvernement
- Thème 6: S’engager avec les patients, les praticiens de soins de santé, les pharmaciens et d’autres parties prenantes
- Conclusion et suivi
Introduction
Le Conseil d’examen du prix des médicaments brevetés (CEPMB), créé par le Parlement en 1987 par le biais de la Loi sur les brevets (la « Loi »), est un organisme administratif quasi judiciaire qui exécute un double mandat d’examen des prix et de production de rapports. Dans le cadre de son mandat d’examen des prix, il s’assure que les médicaments brevetés ne sont pas vendus au Canada à des prix excessifs.
Les modifications au Règlement sur les médicaments brevetés (le « Règlement »), publiées dans la Gazette du Canada, Partie II, sont entrées en vigueur le 1er juillet 2022. Elles ont entraîné un nouvel ensemble de pays de comparaison (« CEPMB11 »)Note de bas de page 1 et une réduction des exigences de présentation pour les médicaments jugés comme ayant le risque le plus faible de prix excessifs. Il est maintenant nécessaire d’apporter des changements aux Lignes directrices du CEPMB afin de mettre en œuvre les modifications réglementaires et de donner suite à l’engagement du CEPMB de moderniser et simplifier son cadre administratif.
Le présent document d’orientation est conçu pour servir de catalyseur à un processus de consultation qui se veut plus éclairé, plus ciblé et plus efficace dans le cadre de l’élaboration des nouvelles Lignes directrices. Ainsi, on y présente les thèmes et les questions particulières sur lesquelles le CEPMB souhaite obtenir des commentaires. Le présent document a été conçu à des fins de discussion seulement; il ne constitue pas un énoncé définitif de la position du CEPMB sur ces enjeux.
Participation à la consultation
| Activité | Dates clés |
|---|---|
Table ronde – séance en anglais |
5 décembre 2023 8h45 à 17h
|
Table ronde – séance en français |
6 décembre 2023 8h45 à 15h |
Date limite d’inscription pour participer à la table ronde |
24 novembre 2023 |
Date limite des soumissions écrites |
20 décembre 2023 |
Rapport « Ce que nous avons entendu » |
Début 2024 |
Le CEPMB entame la première phase de consultations sur ses nouvelles Lignes directrices en invitant les intervenants à participer à une table ronde prévue le 5 décembre (séance en anglais) et le 6 décembre (séance en français). Les deux séances seront tenues en personne et virtuellement. Le but de ces rencontres est d’encourager une discussion productive, où toutes les parties peuvent exprimer leurs opinions et leurs préoccupations à propos des futures Lignes directrices.
Les parties intéressées sont invitées à soumettre leur présentation au CEPMB et à envoyer leur soumission écrite sur toute question soulevée dans le présent document d’orientation et tout autre sujet qu’elles considèrent comme pertinent à la discussion.
Les intervenants peuvent exprimer leurs opinions lors des séances ainsi que par soumission écrite d’ici le 20 décembre 2023. Un document « Ce que nous avons entendu » sera publié au début de 2024.
Thèmes de la discussion
Le CEPMB souhaite connaître l’avis des intervenants sur les thèmes suivants afin d’élaborer la version définitive des Lignes directrices du CEPMB. Toutefois, les commentaires sur d’autres enjeux connexes sont aussi les bienvenus.
- Surveillance efficace sans fixation des prix
- Transition vers le CEPMB11 : nouveaux médicaments et médicaments existants
- Examen des prix durant le cycle de vie du produit
- Enquêtes et renvoi à une audience
- Relation avec les partenaires pancanadiens du domaine de la santé et les assureurs (publics et privés), et alignement avec les grandes initiatives du gouvernement
- S’engager avec les patients, les praticiens de soins de santé, les pharmaciens et d’autres parties prenantes
Thème 1: Surveillance efficace sans fixation des prix
Les Lignes directrices détaillent les procédures utilisées par le personnel du CEPMB pour surveiller le prix des médicaments brevetés. Elles expliquent en particulier les critères dont le personnel tient compte pour déterminer si le prix d’un médicament justifie un examen plus approfondi dans le cadre d’une enquête. Comme les tribunaux l’ont récemment réitéré, bien que le Conseil ait le pouvoir d’ordonner que le prix d’un médicament soit réduit à un niveau non excessif à la suite d’une audience publique, le Conseil ne fixe et n’impose pas de prix pour les médicaments brevetés. Les Lignes directrices ne sont pas des lignes directrices sur les prix. Les ordonnances du Conseil sur la fixation des prix excessifs ne peuvent être émises qu’après une audience publique.
Le CEPMB n’a pas la capacité ni le besoin de tenir des audiences pour chaque médicament breveté relevant de sa compétence. Par conséquent, le CEPMB cherche à mettre au point un système d’examen qui permet de surveiller le plus efficacement possible les cas éventuels de prix excessifs. Le but de ce système est de fournir les orientations transparentes souhaitées par les titulaires de droits au cours de l’examen tout en définissant clairement les responsabilités et les rôles respectifs du Conseil et de son personnel. En particulier, les titulaires de droits devraient recevoir suffisamment d’informations leur permettant d’évaluer leur risque de faire l’objet d’une audience. Celles-ci devraient faire état de la manière dont le personnel analyse les informations sur les prix et formule des recommandations au président quant au résultat de l’enquête : clôture de l’enquête, clôture de l’enquête sous réserve d’un engagement de conformité volontaire ou délivrance d’un avis d’audience.
Question 1.1 : Quels éléments des Lignes directrices de 2010 devraient être gardés? Lesquels et pourquoi?
Question 1.2 : Dans les nouvelles Lignes directrices, doit-on continuer à catégoriser les médicaments en fonction des caractéristiques relatives aux comparateurs de catégorie thérapeutique, comme le niveau d’amélioration thérapeutique?
Question 1.3 : Le Conseil devrait-il accorder plus d’importance sur l’un ou l’autre des facteurs définis dans l’article 85 de la Loi lors de l’élaboration des Lignes directrices?
Conformément à l’alinéa 85(1)c) de la Loi sur les brevets, le CEPMB évalue et compare les prix des médicaments brevetés vendus au Canada avec ceux vendus sur d’autres marchés à l’échelle internationale. Les comparaisons de prix internationaux constituent souvent le type d’examen des prix le plus simple et le plus rapide que le CEPMB puisse effectuer, étant donné que toutes les informations pertinentes sont fournies par les détenteurs de droits dans leurs rapports semestriels et qu’aucune information externe supplémentaire (par exemple des examens scientifiques, des prix publics d’autres médicaments) n’est nécessaire.
Encadré 1 : Prix courants canadiens des médicaments brevetés au sein du CEPMB11.
- 28 % de tous les médicaments brevetés avaient des prix courants canadiens supérieurs au plus élevé des prix internationaux (PEPI) des pays du CEPMB11 en 2022, ce qui représente 22 % des ventes totales.
- 69 % de tous les médicaments brevetés avaient des prix courants canadiens supérieurs à la médiane des prix internationaux (MPI) des pays du CEPMB11 en 2022, ce qui représente 75 % des ventes totales.
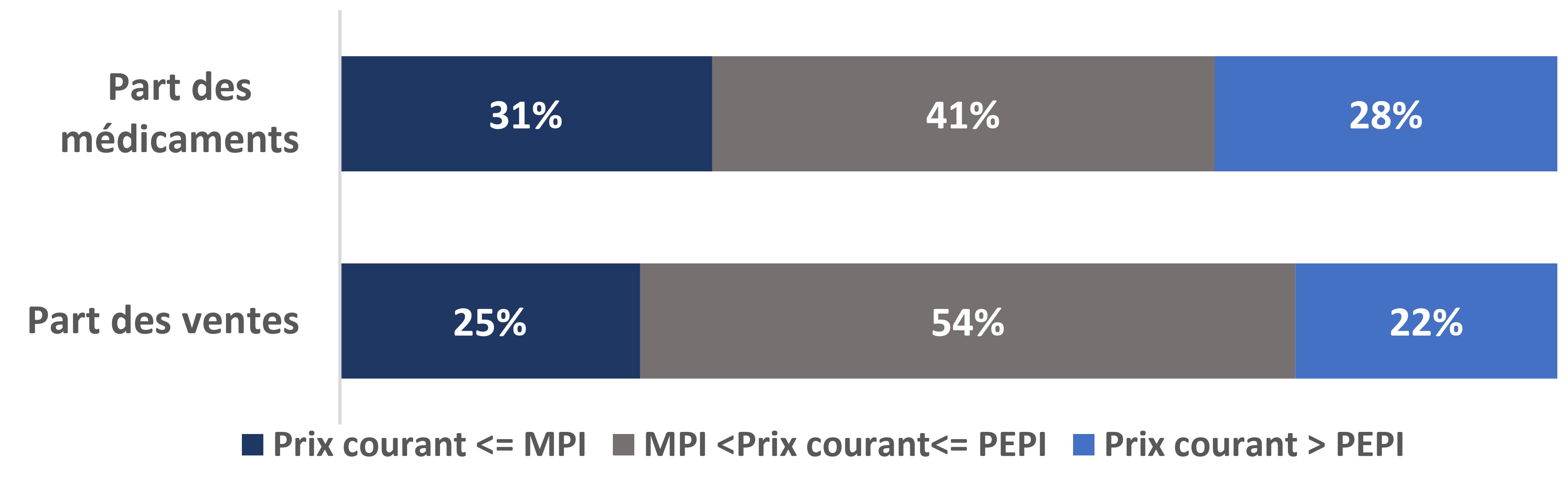
Remarque : Les valeurs peuvent ne pas correspondre aux totaux parce qu’elles ont été arrondies.
Source : CEPMB, 2022, comprenant tous les médicaments brevetés dont les prix au Canada et dans les pays du CEPMB11 sont accessibles (N = 880 numéros d’identification du médicament (DIN), représentant 78 % du total des DIN canadiens brevetés et 93 % des ventes totales en 2022).
Description de la figure
Ce diagramme à barres présente la part de tous les médicaments brevetés (partie supérieure) et leur part correspondante des ventes (partie inférieure) en 2022. Les barres sont subdivisées selon trois catégories afin de montrer les parts des médicaments et celles des ventes pour les prix courants canadiens : inférieurs ou égaux à la MPI (bleu foncé); supérieurs à la MPI et inférieurs ou égaux au PEPI (gris); et supérieurs au PEPI (bleu pâle).
| Prix courant <= MPI | MPI < Prix courant <= PEPI | Prix courant > PEPI | |
|---|---|---|---|
Part des médicaments |
31 % |
41 % |
28 % |
Part des ventes |
25 % |
54 % |
22 % |
Question 1.4 : Si on utilise les prix internationaux comme première mesure de triage pour l’ouverture d’une enquête, quels niveaux de prix, au sein du CEPMB11, doit-on utiliser (par exemple le PEPI ou la MPI)?
Question 1.5 : Comment le CEPMB doit-il procéder à un premier examen et surveiller les prix des médicaments brevetés qui ont peu ou pas de prix internationaux?
Question 1.6 : Un examen accéléré du prix (par exemple dans les 90 jours suivant la soumission initiale du formulaire 2) d’un nouveau médicament, sur la base d’un critère fondé uniquement sur les prix internationaux inférieurs à la MPI, accélèrerait-il l’adoption ou l’introduction de médicaments novateurs?
- Combien de temps après l’examen accéléré devrait-on procéder à l’examen complet du prix?
Thème 2: Transition vers le CEPMB11 : nouveaux médicaments et médicaments existants
En juillet 2022, le groupe de pays de comparaisons précisés dans le Règlement est passé du CEPMB7 au CEPMB11. Ce changement ne comprend pas de clause de droits acquis. Ainsi, dorénavant, toutes les informations doivent être fournies selon le CEPMB11, peu importe la date originale du lancement sur le marché.
Encadré 2 : Parts respectives des médicaments existants, par opposition à celles des nouveaux médicaments, dont les prix courants canadiens sont inférieurs ou égaux à la médiane des prix internationaux (MPI) du CEPMB11 de janvier à juin 2023.
- 24 % des médicaments brevetés existants avaient des prix courants canadiens inférieurs ou égaux à la MPI des pays du CEPMB11 entre janvier et juin 2023, ce qui représente 16 % des ventes totales de médicaments existants.
- 34 % des nouveaux médicaments brevetés avaient des prix courants canadiens inférieurs ou égaux à la MPI des pays du CEPMB11 entre janvier et juin 2023, ce qui représente 15 % des ventes totales de nouveaux médicaments.
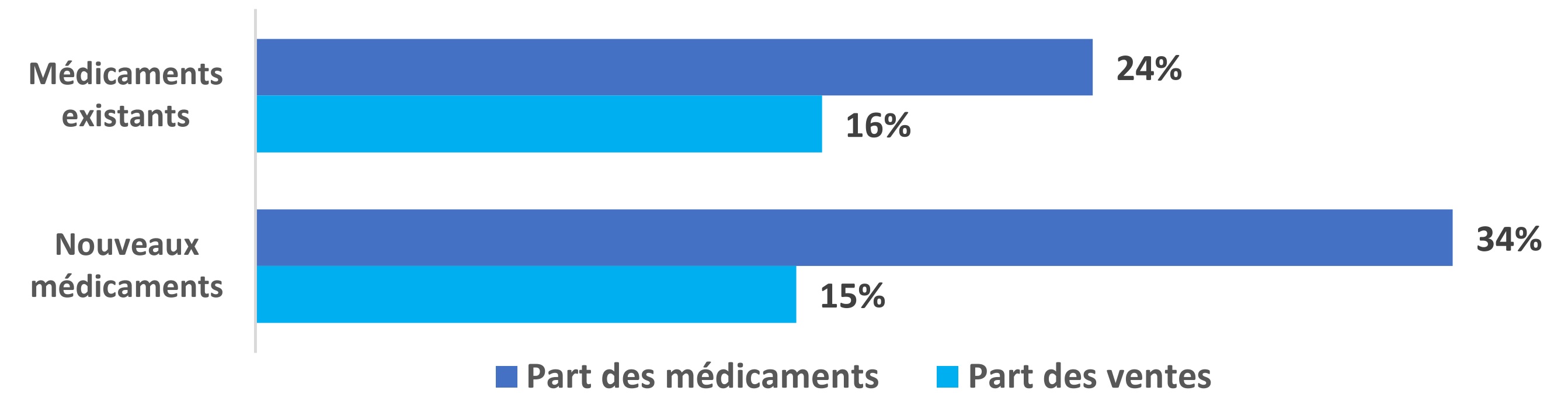
Remarque : Les valeurs peuvent ne pas correspondre aux totaux parce qu’elles ont été arrondies.
Source : CEPMB, de janvier à juin 2023, comprenant tous les médicaments brevetés dont les prix au Canada et dans les pays du CEPMB11 sont accessibles (N = 812 DIN, représentant 78 % du total des DIN canadiens brevetés et 96 % des ventes totales entre janvier et juin 2023; de ces 812 DIN, 68 étaient nouveaux et 744 étaient existants).
Description de la figure
Ce diagramme à barres présente les parts des médicaments brevetés existants (partie supérieure) et des nouveaux médicaments brevetés (partie inférieure) dont les prix courants canadiens sont inférieurs ou égaux à la MPI des 11 pays de comparaison (CEPMB11), et leurs parts correspondantes des ventes, de janvier à juin 2023.
| Part des médicaments (%) | Part des ventes (%) | |
|---|---|---|
Médicaments existants |
24 % |
16 % |
Nouveaux médicaments |
34 % |
15 % |
Question 2.1 : Dans les Lignes directrices, doit-il y avoir une distinction entre les médicaments existants en date de juillet 2022 (médicaments existants) et ceux lancés sur le marché par la suite (nouveaux médicaments)?
Question 2.2 : Quelle approche le Conseil doit-il adopter quant aux médicaments dont les prix sont supérieurs au PEPI des pays du CEPMB11? Le Conseil devrait-il se pencher sur ces prix et, dans l’affirmative, dans quel délai?
Thème 3: Examen des prix durant le cycle de vie du produit
Selon la Loi sur les brevets, le devoir du CEPMB de surveiller les prix excessifs s’étend à la durée du brevetNote de bas de page 2 ou du certificat de protection supplémentaire.
Dans de nombreux pays, il n’est pas rare que les prix courants des médicaments baissent au fil du temps. Les prix courants canadiens, quant à eux, ont tendance à rester stables ou à augmenter. La combinaison de ces tendances entraîne l’augmentation des prix canadiens comparativement à leurs équivalents étrangers, vers l’extrémité supérieure du groupe de pays du CEPMB11 au fil du temps. Comme l’indique le Rapport annuel 2021 du CEPMB, les prix courants au Canada se situaient au troisième rang des prix les plus élevés parmi les pays de l’Organisation de coopération et de développement économiques (OCDE), derrière seulement les États-Unis et la Suisse.
Encadré 3 : Tendances des prix au Canada et dans les pays du CEPMB11.
Entre 2012 et 2022, les prix courants des médicaments brevetés au Canada ont légèrement augmenté, soit de 5 %, alors que dans les pays du CEPMB11, ces prix ont diminué de 15 % en moyenne.
Indice des prix des médicaments brevetés, 2012-2022
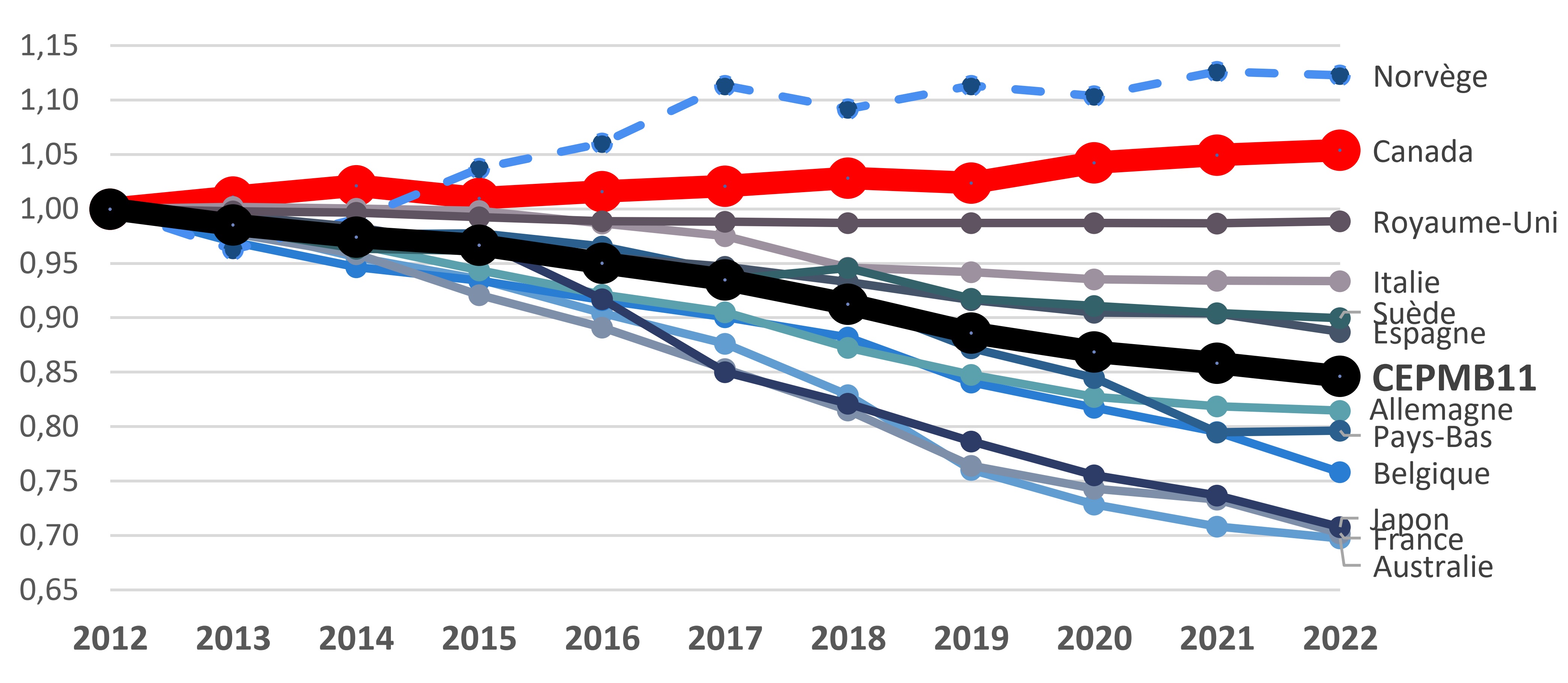
Remarque : Cet indice des prix mesure la variation annuelle moyenne des prix des médicaments brevetés pratiqués sur le marché canadien, calculée à l’aide de la moyenne de la variation des prix au niveau du médicament, pondérée en fonction des ventes. Il est fondé sur les prix courants et les informations sur les ventes provenant de la base de données MIDAS®.
Source des données : CEPMB; base de données MIDAS®, 2012-2022, IQVIA (tous droits réservés)
Description de la figure
Ce graphique linéaire montre le taux de croissance indexé des médicaments brevetés vendus au Canada et aux 11 pays du CEPMB11 au cours de la période entre 2012 et 2022.
| Pays | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | 2019 | 2020 | 2021 | 2022 |
|---|---|---|---|---|---|---|---|---|---|---|---|
Norvège |
1,00 |
0,96 |
0,99 |
1,04 |
1,06 |
1,11 |
1,09 |
1,11 |
1,10 |
1,13 |
1,12 |
Canada |
1,00 |
1,01 |
1,02 |
1,01 |
1,02 |
1,02 |
1,03 |
1,02 |
1,04 |
1,05 |
1,05 |
Royaume-Uni |
1,00 |
1,00 |
1,00 |
0,99 |
0,99 |
0,99 |
0,99 |
0,99 |
0,99 |
0,99 |
0,99 |
Italie |
1,00 |
1,00 |
1,00 |
1,00 |
0,99 |
0,97 |
0,95 |
0,94 |
0,94 |
0,93 |
0,93 |
Suède |
1,00 |
0,98 |
0,96 |
0,96 |
0,94 |
0,94 |
0,95 |
0,92 |
0,91 |
0,90 |
0,90 |
Espagne |
1,00 |
0,99 |
0,98 |
0,96 |
0,96 |
0,95 |
0,93 |
0,92 |
0,90 |
0,90 |
0,89 |
CEPMB11 |
1,00 |
0,99 |
0,97 |
0,97 |
0,95 |
0,94 |
0,91 |
0,89 |
0,87 |
0,86 |
0,85 |
Allemagne |
1,00 |
1,00 |
0,97 |
0,94 |
0,92 |
0,91 |
0,87 |
0,85 |
0,83 |
0,82 |
0,81 |
Pays-Bas |
1,00 |
0,99 |
0,98 |
0,98 |
0,97 |
0,94 |
0,92 |
0,87 |
0,84 |
0,79 |
0,80 |
Belgique |
1,00 |
0,97 |
0,95 |
0,93 |
0,92 |
0,90 |
0,88 |
0,84 |
0,82 |
0,80 |
0,76 |
Japon |
1,00 |
0,98 |
0,97 |
0,97 |
0,92 |
0,85 |
0,82 |
0,79 |
0,76 |
0,74 |
0,71 |
France |
1,00 |
0,98 |
0,96 |
0,92 |
0,89 |
0,85 |
0,82 |
0,76 |
0,74 |
0,73 |
0,70 |
Australie |
1,00 |
0,98 |
0,96 |
0,94 |
0,90 |
0,88 |
0,83 |
0,76 |
0,73 |
0,71 |
0,70 |
Puisque le contexte pharmaceutique évolue toujours, il est important de réfléchir à la manière dont les Lignes directrices et les examens des prix qui y sont associés restent pertinents à toutes les étapes du cycle de vie d’un médicament. Il est essentiel de trouver un équilibre permettant un suivi continu sans fardeau administratif excessif, tout en maintenant la prévisibilité
Question 3.1 : À quelle fréquence les examens des prix doivent-ils être effectués? (de 1 à 5 ans)
- Doivent-ils être différents pour les petites molécules (période d’exclusivité de 10 ans en moyenne) par opposition aux médicaments biologiques (période d’exclusivité de 20 ans ou plus en moyenne)? Devraient-ils être différents pour les médicaments destinés aux maladies rares?
Question 3.2 : Outre le temps, quels critères doit-on utiliser pour commencer un examen des prix?
- Approval of a significant new indication?
- Changement majeur des comparateurs de catégorie thérapeutique? Apparition de données probantes nouvelles ou plus solides quant aux comparateurs de catégorie thérapeutique?
- Écart par rapport aux seuils de fixation des prix déterminés?
Question 3.3 : La pondération relative accordée aux différents facteurs de l’article 85 de la Loi sur les brevets devrait-elle changer au cours du cycle de vie d’un médicament?
Question 3.4 : Comment le CEPMB doit-il traiter l’augmentation autorisée de l’indice des prix à la consommation dans un contexte de baisse des prix courants internationaux?
Question 3.5 : Quel est le meilleur moment pour procéder à l’examen scientifique et à l’identification des comparateurs thérapeutiques? À quelle(s) étape(s) de l’examen des prix l’examen scientifique doit-il avoir lieu?
Thème 4: Enquêtes et renvoi à une audience
Les enquêtes sont une procédure administrative qui se compose d’un examen approfondi des renseignements fournis par les titulaires de droits et de tout renseignement pertinent obtenu d’autres sources. Le but de ces enquêtes est de prioriser les cas qui pourraient être portés à l’attention du président et qui pourraient mener à une audience. Le personnel recommandera au président la tenue d’une audience ou la clôture de l’enquête. Le président prend la décision définitive de renvoyer une affaire à une audience.
Depuis 1993, plus de 210 millions de dollars ont été perçus en vertu d’engagements de conformité volontaire, de règlements négociés et d’ordonnances du Conseil par l’entremise de paiements versés au gouvernement du Canada.
- 162 engagements de conformité volontaire ont été acceptés.
- 31 avis d’audience ont été délivrés, dont 14 se sont traduits par un règlement avant la tenue de l’audience sur le fond et 17 se sont soldés par la tenue d’une audience publique sur le fond en bonne et due forme (10 audiences étaient liées à des allégations de prix excessifs et 7, à des allégations de défaut de présenter ses rapports).
Auparavant, pour déterminer si la tenue d’une enquête était justifiée, le Conseil utilisait une combinaison de prix plafonds établis dans les Lignes directrices avec des critères supplémentaires. La publication de ces critères dans les Lignes directrices a amélioré la transparence du CEPMB et a donné aux titulaires de droits une plus grande certitude quant à leur risque d’être pris en considération pour une audience. Par exemple, une enquête était déclenchée seulement lorsque les prix dépassaient les plafonds établis dans les Lignes directrices d’un pourcentage déterminé, les recettes excédentaires potentielles étaient supérieures à un montant déterminé ou des plaintes avaient été reçues.
Comme mentionné précédemment, le CEPMB n’a pas la capacité de tenir des audiences pour chaque médicament breveté relevant de sa compétence. Par conséquent, dans le passé, le CEPMB s’est fié à la conformité volontaire des titulaires de droits en leur donnant l’occasion de prendre des mesures correctives (par exemple des réductions volontaires de prix et le remboursement de trop-perçus) qui pouvaient entraîner la clôture d’une enquête, au lieu d’un renvoi à une audience.
Encadré 4 : Médicaments brevetés à usage humain vendus de 2012 à 2021 – Statut de l’examen du prix en date du 31 mars de l’année de rapport suivante.
- Au cours de la dernière décennie, la grande majorité des médicaments brevetés avaient des prix conformes aux seuils établis dans les Lignes directrices.
- Au cours des cinq dernières années, en moyenne, environ 11 % des médicaments brevetés signalés au CEPMB ont fait l’objet d’une enquête. Au cours de cette période, en moyenne, seulement 0,9 % des médicaments brevetés ont été soumis à une audience.
| 2012 | 2013 | 2014 | 2015 | 20161 | 2017 | 2018 | 2019 | 2020 | 2021 | |
|---|---|---|---|---|---|---|---|---|---|---|
Total |
1328 |
1343 |
1363 |
1359 |
1435 |
1391 |
1403 |
1364 |
1289 |
1177 |
Conformes aux seuils des Lignes directrices |
1090 |
1098 |
1038 |
960 |
901 |
950 |
968 |
948 |
892 |
783 |
Examen en cours |
7 |
2 |
34 |
30 |
66 |
25 |
51 |
60 |
54 |
43 |
Ne justifie pas une enquête |
139 |
164 |
227 |
265 |
267 |
239 |
232 |
205 |
169 |
165 |
Enquête en cours |
59 |
66 |
61 |
93 |
101 |
122 |
128 |
128 |
166 |
169 |
ECV |
31 |
13 |
2 |
10 |
60 |
54 |
21 |
19 |
5 |
12 |
Audience |
2 |
0 |
1 |
1 |
1 |
1 |
2 |
2 |
2 |
4 |
Assujetti à une ordonnance de réduction de prix (suspendue) |
|
|
|
|
|
|
1 |
1 |
1 |
1 |
1L’état de conformité de 39 DIN n’a pas été signalé en date de 2016.
Source : Rapport annuel 2012-2021.
Question 4.1 : Les critères énoncés dans les Lignes directrices de 2010 justifiant la tenue d’une enquête conviennent-ils toujours?
Question 4.2 : Dans quelle mesure les Lignes directrices doivent-elles détailler ce qui se passe lorsqu’une enquête est déclenchée?
Question 4.3 : Le CEPMB doit-il continuer à utiliser des engagements de conformité volontaire comme moyen de clore une enquête?
Thème 5: Relation avec les partenaires pancanadiens du domaine de la santé et les assureurs (publics et privés), et alignement avec les grandes initiatives du gouvernement
Le CEPMB s’efforce à s’aligner avec les objectifs et les priorités d’autres partenaires de la santé dans le contexte pharmaceutique canadien et à les compléter, y compris les objectifs plus larges en matière de soins de santé et d’innovation.
Le rôle du CEPMB fait partie d’un système complexe plus grand qui régit la manière dont les médicaments sont approuvés, réglementés et distribués à la population canadienne à travers le pays. L’élaboration de nouvelles lignes directrices présente une occasion pour le CEPMB de réduire l’incertitude quant à l’accès au marché pour les innovateurs, de coordonner les organismes réglementaires et de fixation de prix existants, de leur offrir un meilleur soutien, et de soutenir des initiatives d’activités fédérales, provinciales et territoriales au sein du secteur pharmaceutique.
Question 5.1 : Quels seraient les gains d’efficacité si l’on coordonnait les décisions et les échéanciers du CEPMB avec ceux de l’Agence canadienne des médicaments et des technologies de la santé (ACMTS), de l’Institut national d’excellence en santé et services sociaux (INESSS), de l’Alliance pancanadienne pharmaceutique (APP) ou des assureurs (publics et privés)?
Question 5.2 : Comment le CEPMB peut-il optimiser sa présence au sein de l’écosystème biopharmaceutique canadien afin de soutenir une approche gouvernementale globale des questions relatives aux médicaments brevetés?
Thème 6: S’engager avec les patients, les praticiens de soins de santé, les pharmaciens et d’autres parties prenantes
L’objectif est d’obtenir des commentaires provenant d’intervenants qui ne sont pas des titulaires de droits.
Le CEPMB reconnaît l’importance de solliciter l’avis d’une variété d’intervenants qui ne font pas partie de l’industrie ou d’une institution, et qui représentent la diversité des voix de la communauté élargie des consommateurs concernés par le CEPMB. Cette discussion est essentielle pour connaître le point de vue du public sur les médicaments brevetés et leur prix, en particulier dans le contexte des maladies rares et de l’évolution des données cliniques.
Encadré 5 : Les médicaments à coût élevé dominent le marché pharmaceutique.
- Les médicaments à coût élevé représentent une part croissante des ventes totales de médicaments brevetés, passant de 17,3 % en 2012 à 57,1 % en 2021.
- Bien qu’ils représentent plus de la moitié des ventes totales en 2021, moins de 1 % de la population utilise ces médicaments.
Part des ventes de médicaments brevetés à prixcoût élevé selon le coût annuel du traitement, de 2012 à 2021
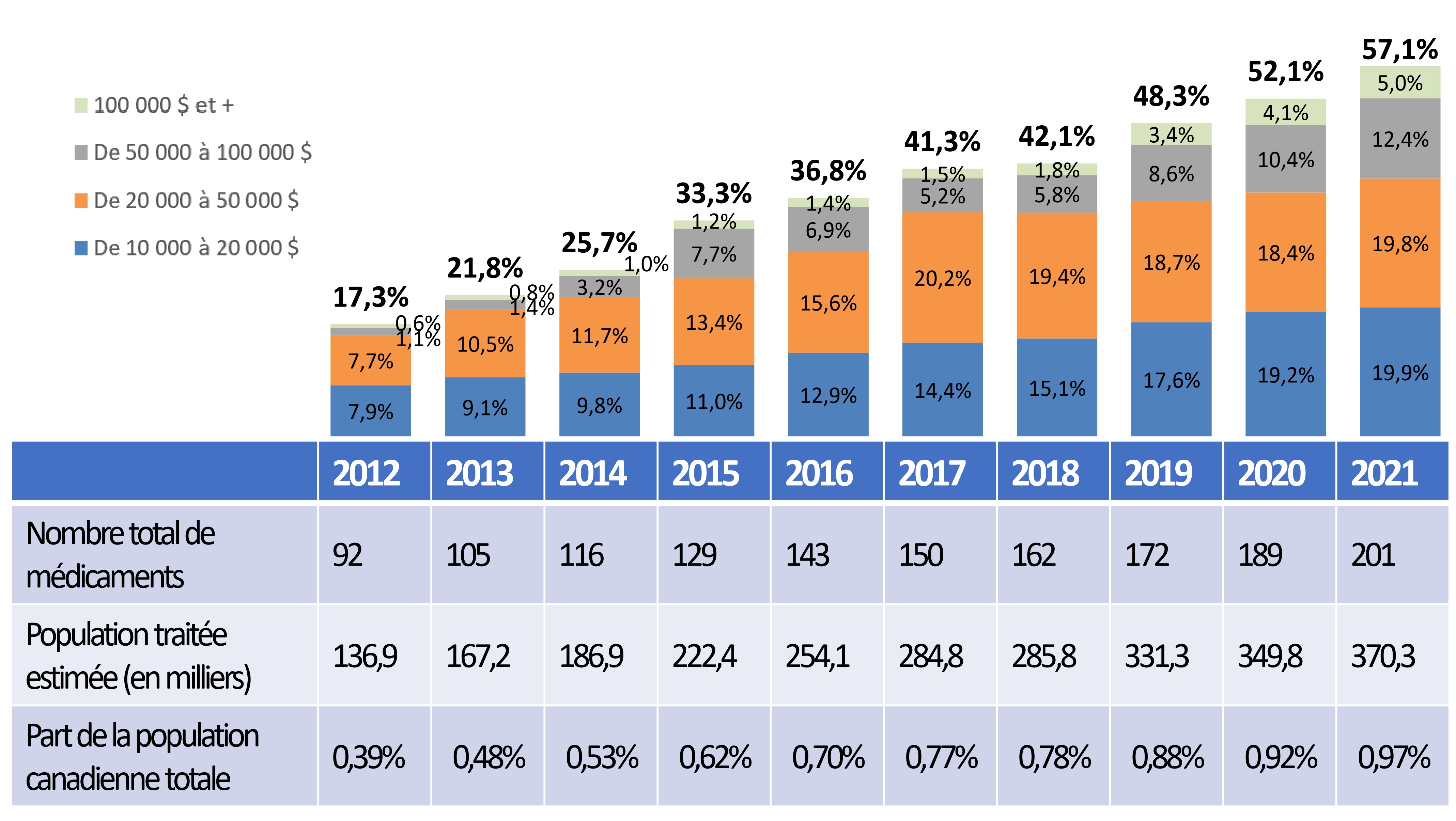
Remarque : La méthodologie de cette analyse a été révisée en 2018 et, par conséquent, les résultats historiques pourraient ne pas correspondre à ceux des éditions précédentes.
Source : Modification de la figure 10 du Rapport annuel 2021; CEPMB, base de données des régimes privés d’assurance-médicaments à paiement direct d’IQVIA, 2012-2021.
Description de la figure
Ce diagramme à barres montre la part en pourcentage des ventes totales de médicaments brevetés détenue par les médicaments à coût élevé, selon le coût annuel du traitement, pour la période de 2012 à 2021. Les barres sont subdivisées selon quatre catégories correspondant au coût annuel moyen de traitement : de 10 000 à 20 000 dollars; de 20 000 à 50 000 dollars; de 50 000 à 100 000 dollars; et 100 000 dollars et plus.
| Année | Part des ventes de médicaments dont le coût est de 10 000 à 20 000 $ | Part des ventes de médicaments dont le coût est de 20 000 à 50 000 $ | Part des ventes de médicaments dont le coût est 50 000 à 100 000 $ | Part des ventes de médicaments dont le coût est supérieur à 100 000 $ | Part totale des ventes de médicaments à coût élevé |
|---|---|---|---|---|---|
2012 |
7,9 % |
7,7 % |
1,1 % |
0,6 % |
17,3 % |
2013 |
9,1 % |
10,5 % |
1,4 % |
0,8 % |
21,8 % |
2014 |
9,8 % |
11,7 % |
3,2 % |
1,0 % |
25,7 % |
2015 |
11,0 % |
13,4 % |
7,7 % |
1,2 % |
33,3 % |
2016 |
12,9 % |
15,6 % |
6,9 % |
1,4 % |
36,8 % |
2017 |
14,4 % |
20,2 % |
5,2 % |
1,5 % |
41,3 % |
2018 |
15,1 % |
19,4 % |
5,8 % |
1,8 % |
42,1 % |
2019 |
17,6 % |
18,7 % |
8,6 % |
3,4 % |
48,3 % |
2020 |
19,2 % |
18,4 % |
10,4 % |
4,1 % |
52,1 % |
2021 |
19,9 % |
19,8 % |
12,4 % |
5,0 % |
57,1 % |
Question 6.1 : Quelle est votre expérience avec les médicaments novateurs et leurs prix courants au Canada?
Question 6.2 : Quel rôle les Lignes directrices du CEPMB jouent-elles dans votre processus de prise de décision, au Canada et dans le monde (le cas échéant)?
Question 6.3 : Le Canada et le monde doivent faire face à une génération de nouveaux médicaments à coût élevé pour traiter les maladies rares.
- Le CEPMB doit-il aborder la question de savoir si les prix de ces médicaments sont « excessifs » sous un angle différent de celui des autres médicaments?
- De quelle qualité de données probantes le Conseil doit-il prendre en compte lorsqu’il procède à l’examen scientifique de ces médicaments?
Question 6.4 : Comment le CEPMB peut-il améliorer ses communications et son engagement avec vous?
Conclusion et suivi
Le CEPMB remercie toutes les parties de leur intérêt pour cette table ronde et de leur participation.
Son ambition est de finaliser les nouvelles Lignes directrices en 2024, toujours à la suite d’un processus de consultation approprié.
Soumissions
Soumissions
Vous trouverez ci-dessous les sousmissions reçus par le CEPMB pendant la période de consultation.
Table ronde
| Activité | Dates clés |
|---|---|
Table ronde – séance en anglais |
5 décembre 2023 8h45 à 17h |
Table ronde – séance en français |
6 décembre 2023 8h45 à 15h |
Date limite d’inscription pour participer à la table ronde |
24 novembre 2023 |
Date limite des soumissions écrites |
20 décembre 2023 |
Rapport « Ce que nous avons entendu » |
Début 2024 |
Le CEPMB entame la première phase de consultations sur ses nouvelles Lignes directrices en invitant les intervenants à participer à une table ronde prévue le 5 décembre (séance en anglais) et le 6 décembre (séance en français). Les deux séances seront tenues en personne et virtuellement. Le but de ces rencontres est d’encourager une discussion productive, où toutes les parties peuvent exprimer leurs opinions et leurs préoccupations à propos des futures Lignes directrices.
Rapport « Ce que nous avons appris »
Rapport « Ce que nous avons appris »
Table ronde sur les politiques organisée les 5 et 6 décembre 2023 à Ottawa
Janvier 2024
1. Introduction
Le Conseil d’examen du prix des médicaments brevetés (CEPMB) a chargé Phoenix Strategic Perspectives Inc. (Phoenix SPI) d’agir à titre de modérateur dans le cadre d’une consultation avec des intervenants, soit une table ronde sur les politiques, et de rédiger un rapport sur les présentations et les discussions. Le présent rapport fournit un résumé de ce qui a été appris lors de la table ronde.
1.1 Contexte
Le CEPMB est un organisme administratif quasi judiciaire qui exécute un double mandat d’examen des prix et de production de rapports. Dans le cadre de son mandat d’examen des prix, le CEPMB s’assure que les prix des médicaments brevetés vendus au Canada ne sont pas excessifs. Il est maintenant nécessaire d’apporter des changements aux Lignes directrices du CEPMB pour mettre en œuvre des modifications réglementaires et donner suite à l’engagement du Conseil de moderniser et simplifier son cadre administratif.
Le 10 novembre 2023, le CEPMB a publié le document d’orientationNote de bas de page 1 aux fins de consultation sur les Lignes directrices du Conseil. On y présente les thèmes et les questions devant orienter la prochaine consultation menée auprès d’intervenants de l’industrie sur l’élaboration des nouvelles Lignes directrices. Les intervenants intéressés ont été invités à participer à la table ronde ou à préparer des soumissions en réponse aux questions et aux thèmes soulevés.
La table ronde a eu lieu les 5 et 6 décembre 2023 à Ottawa. Des intervenants des diverses régions du pays ont participé (en personne et virtuellement) à la consultation de deux jours organisée par le CEPMB. Malgré un nombre limité de personnes pouvant y prendre part en personne, tous les intervenants intéressés ont été en mesure de s’inscrire pour participer en ligne. L’objectif de la consultation était de mobiliser les intervenants pour une séance en personne afin d’explorer les thèmes importants concernant l’élaboration d’un nouvel ensemble de Lignes directrices du CEPMB. Des représentants des titulaires de droits et des associations industrielles, des groupes de patients, des pharmacies et des distributeurs, de la société civile, de milieux universitaires, et d’un organisme de financement de la recherche ainsi qu’un praticien de soins de santé et un particulier ont participé à l’événement.
Outre les séances de la table ronde, les intervenants ont été invités à envoyer une soumission écrite sur toute question soulevée dans le document d’orientation et tout autre sujet qu’ils considéraient comme relatif à la discussion. La date limite pour envoyer les soumissions était le 20 décembre 2023.
Le CEPMB a reçu 70 soumissions écrites de la part d’intervenants de divers secteurs. La plupart des soumissions ont été présentées par des titulaires de droits et des associations industrielles (n = 36, 51 %), suivis par des groupes de défense des droits des patients (n = 15, 21 %) et des pharmacies et distributeurs (n = 7, 10 %). Les autres soumissions (n = 12) provenaient de la société civile et des syndicats (n = 2), d’un payeur privé (n = 2), d’organismes pancanadiens de la santé, dont les gouvernements fédéral, provinciaux et territoriaux, l’Agence des médicaments et des technologies de la santé au Canada (ACMTS) et l’Alliance pharmaceutique pancanadienne (APP) (n = 4), d’un fournisseur et médecin (n = 1), d’une chercheuse universitaire en politiques (n = 1) et de deux particuliers (n = 2). Les soumissions peuvent être consultées en cliquant sur les liens suivants : français et anglais.
Le présent rapport ne comprend aucune analyse des soumissions écrites; le CEPMB les examinera séparément.
1.2 La consultation
L’événement, sous la forme d’une table ronde, était conçu de manière à permettre aux intervenants d’exprimer leurs opinions et leurs préoccupations concernant les Lignes directrices et le processus de consultation. Les parties désirant participer à l’événement ont été invitées à soumettre un formulaire d’inscription au plus tard le 24 novembre 2023. Avant l’événement, le CEPMB a publié un document d’orientation décrivant les thèmes et les enjeux précis sur lesquels le CEPMB voulait obtenir des commentaires.
Les séances ont eu lieu en personne et virtuellement. Les présentations pouvaient porter sur toute question soulevée dans le document d’orientation et tout autre sujet considéré comme relatif à la discussion. Une séance s’est déroulée en anglais et l’autre, en français. La séance en anglais s’est tenue le 5 décembre et s’est poursuivie pendant la deuxième partie de la séance du matin et la séance de l’après-midi du 6 décembre. La séance en français a eu lieu pendant la première partie de la séance du matin du 6 décembre.
Toutes les parties qui désiraient donner une présentation ont eu la possibilité de le faire. En tout, 34 présentations ont été faites par les intervenants, qui représentaient un groupe diversifié, au cours de la consultation de deux jours.
| Groupe d’intervenants | Nombre de présentations |
|---|---|
Titulaires de droits, industrie, associations industrielles |
15 |
Groupes de patients, de défense des droits des patients |
5 |
Distributeurs, pharmacies et association de pharmacies |
5 |
Société civile, syndicats |
3 |
Milieux universitaires |
3 |
Praticiens de soins de santé |
1 |
Particuliers |
1 |
Organismes de financement de la recherche |
1 |
Total |
34 |
Le temps alloué à chaque présentation, y compris les questions et les commentaires des membres du CEPMB, était de 15 minutes.
2. Ce que nous avons appris
Au cours de la consultation de deux jours, les intervenants ont discuté d’une gamme d’enjeux, exprimé diverses opinions et formulé de nombreuses recommandations, tant générales que précises, liées à des questions et à des thèmes jugés pertinents et importants pour une discussion sur les Lignes directrices et le processus de consultation. Les questions, les opinions et les recommandations soulevées par les intervenants ont souvent porté sur les thèmes suivants :
- Le mandat du CEPMB
- L’évaluation des prix excessifs
- Les facteurs à considérer pour l’élaboration des Lignes directrices du CEPMB
- La compréhension de l’écosystème des sciences de la vie
- L’alignement des Lignes directrices du CEPMB avec les grandes initiatives du gouvernement
- La participation des intervenants
Chacun de ces sujets présentés ci-dessous concerne ce qui a été appris à la lumière des commentaires des intervenants.
2.1 Le mandat du CEPMB
Les intervenants ont souvent fait référence au mandat législatif du CEPMB pour cerner les sujets et les enjeux jugés importants et pertinents et en discuter. Bien que le CEPMB ait un double mandatNote de bas de page 2, l’accent était généralement mis sur son rôle de réglementation. Il a été question à plusieurs reprises du mandat de protection contre l’exclusivité abusive du marché au moyen de la fixation de prix excessifs, les intervenants soulignant que les délibérations et les Lignes directrices du CEPMB devraient s’aligner sur ce mandat. Les intervenants ont fait part de deux craintes au sujet de l’exécution du mandat de réglementation : le CEPMB qui dépasserait les limites de celui-ci et le CEPMB qui ne s’en acquitterait pas.
Les intervenants qui se sont attardés au risque que le CEPMB outrepasse son mandat ont insisté sur le fait que ce mandat est étroit et précis. Par conséquent, le Conseil irait au-delà de son mandat s’il déployait des efforts pour assurer la protection des consommateurs, fixer, réglementer ou contrôler les prix, ou s’adonner à toute activité dans le but de réduire les prix des médicaments. Ces activités ne relèveraient pas de la compétence du CEPMB, car ce sont les gouvernements provinciaux et territoriaux qui ont l’autorité constitutionnelle du contrôle et de la réglementation des prixNote de bas de page 3. En revanche, certains intervenants se sont dit préoccupés par le fait que le CEPMB ne fait pas suffisamment d’efforts pour limiter ou contrôler le prix des médicaments au Canada. Selon eux, en n’adoptant pas de mesures pour éviter que les prix des médicaments brevetés ne deviennent excessifs, le CEPMB ne s’acquitterait pas de son mandat.
2.2 Les prix excessifs
Le plus élevé des prix internationaux ou la médiane des prix internationaux
Toutes les parties s’entendaient pour dire que le mandat du CEPMB consiste à empêcher la fixation de prix excessifs, mais il y avait des divergences d’opinions concernant l’interprétation du terme « excessif ». Différents points de vue ont été exprimés concernant notamment le seuil d’examen des prix. En utilisant les prix internationaux comme référence, précisément ceux des 11 pays de comparaisonNote de bas de page 4 indiqués dans les modifications apportées au Règlement sur les médicaments brevetés(le Règlement), les intervenants étaient divisés sur le prix qui devrait constituer la référence de base, ou la mesure de triage, pour les examens des prix : le plus élevé des prix internationaux ou la médiane des prix internationaux.
L’argument invoqué pour l’utilisation du plus élevé des prix internationaux comme mesure de triage initiale était fondé sur l’idée qu’il s’agit du point de référence qui concorde le plus avec le mandat du CEPMB. De ce point de vue, les prix équivalents ou inférieurs aux prix des pays de comparaison dans le Règlement devraient être jugés conformes et ne devraient pas être soumis à un examen des prix. Les intervenants ont averti le CEPMB au sujet de l’utilisation de la médiane des prix internationaux comme point de référence. Cette façon de faire va au-delà de la réglementation des prix excessifs et concerne plutôt la fixation des prix, ce qui ne relève pas du mandat du Conseil.
Les intervenants en faveur de l’utilisation de la médiane des prix internationaux comme mesure de triage initiale étaient d’avis que les tendances internationales dans les 11 pays de comparaison devraient être utilisées pour déterminer les prix excessifs. Si les prix internationaux ont tendance à baisser et que les prix canadiens sont stables ou à la hausse, les prix canadiens pourraient alors être jugés excessifs par rapport aux prix internationaux. De ce point de vue, les médicaments au Canada dont le prix est supérieur à la médiane des prix internationaux pourraient faire l’objet d’un examen des prix.
Outre la question du niveau de prix qui devrait être utilisé comme mesure de triage initiale, les intervenants ont régulièrement formulé des commentaires sur deux autres questions liées à la fixation des prix : la distinction entre les médicaments « nouveaux » et « existants » ainsi que la catégorisation des médicaments par niveau d’amélioration thérapeutique.
Nouveaux médicaments et médicaments existants
Les intervenants ont exprimé des points de vue différents sur la question de la distinction, faite par les Lignes directrices du CEPMB, entre les médicaments qui existaient en date de juillet 2022 (médicaments existants) et ceux lancés sur le marché par la suite (nouveaux médicaments). La question fondamentale consiste à déterminer si les produits doivent être évalués en fonction du régime de fixation de prix sous lequel ils ont été lancés. Dans les deux cas, il y aurait des répercussions potentielles sur la fixation des prix. Si on accepte cette distinction, les prix des médicaments brevetés existants jugés non excessifs en vertu du régime précédent d’établissement des prix continueraient d’être jugés conformes en vertu des régimes subséquents. Sinon, les médicaments existants pourraient faire l’objet d’un examen des prix dans le cadre du nouveau régime.
Le niveau d’amélioration thérapeutique
Les intervenants qui ont soulevé la question de la catégorisation des médicaments en fonction de l’amélioration thérapeutique étaient généralement d’avis que cette pratique devrait être maintenue. Le prix des médicaments pourrait donc être augmenté ou diminué en fonction du niveau d’amélioration thérapeutique. Les intervenants ont insisté sur le fait que ce type d’évaluation devrait être effectué par des organismes indépendants et que tout rajustement de prix devrait tenir compte de la nature et du degré de l’amélioration.
2.3 Les facteurs à considérer pour l’élaboration des Lignes directrices du CEPMB
Les intervenants ont employé certains termes à maintes reprises afin de cerner les caractéristiques jugées fondamentalement importantes pour l’élaboration des futures Lignes directrices du CEPMB. Il s’agissait notamment de « prévisibilité », de « stabilité », de « clarté », de « transparence » et de « cohérence ». Ces termes étaient généralement utilisés pour transmettre un message concernant les attentes et les exigences en matière de conformité : il faut offrir la plus grande certitude raisonnablement possible pour l’ensemble du cycle de vie des produits brevetés. Selon les intervenants, la certitude est importante pour contribuer à l’atteinte des objectifs suivants :
- Faire du Canada un endroit intéressant où les entreprises de l’industrie des sciences de la vie peuvent investir, établir une présence et mener des activités de recherche et développement;
- Créer un environnement qui permettra au système de soins de santé canadien de bénéficier hâtivement des innovations médicales et des lancements de produits sur le marché;
- Appuyer les pharmacies dans leur planification des affaires, ce qui les aidera à fournir aux patients un accès stable aux produits.
Les intervenants accordaient une importance primordiale à l’assurance d’un degré raisonnable de certitude, qui a orienté leur plaidoyer pour les deux recommandations susmentionnées concernant la fixation des prix, l’une ayant trait aux nouveaux médicaments et l’autre, aux médicaments existants.
- Pour les nouveaux médicaments, la recommandation était d’utiliser le plus élevé des prix internationaux comme référence. Elle se fondait notamment sur l’argument selon lequel ce prix est clair et facile à appliquer tout en fournissant un prix maximal prévisible non excessif tout au long du cycle de vie d’un produit breveté. En revanche, on a soulevé plusieurs préoccupations relatives à la prévisibilité concernant l’utilisation de la médiane des prix internationaux. Effectivement, dans le contexte d’un ensemble de 11 pays de comparaison, le prix médian peut fluctuer considérablement au cours du cycle de vie d’un produit breveté.
- Pour les médicaments brevetés existants, la recommandation était de les juger toujours conformes. Elle reposait notamment sur l’argument selon lequel les brevetés et d’autres intervenants de la chaîne d’approvisionnement ont pris des décisions d’investissement ou exécuté des plans d’affaires dans le cadre des anciennes Lignes directrices. Leur imposer un nouveau régime de prix pourrait être déstabilisant. Par exemple, cette situation pourrait compromettre les ententes d’inscription de produits en vigueur et perturber l’accès aux médicaments ou leur disponibilité.
2.4 L’écosystème des sciences de la vie
Les intervenants ont souvent décrit l’environnement des sciences de la vie au Canada comme étant un écosystème caractérisé par une multitude de composantes et un cadre réglementaire complexe qui comprend différents ordres de gouvernement et divers organismes, chacun ayant ses propres rôles, responsabilités et mandats. Comme tout autre écosystème, ce qui se produit dans l’une de ses parties peut avoir une incidence sur son ensemble.
Les intervenants ont fait remarquer que le CEPMB doit comprendre et prendre en compte les répercussions potentielles de ses Lignes directrices dans l’ensemble de l’écosystème des sciences de la vie, car des conséquences imprévues peuvent se répercuter à la fois « en amont » et « en aval ». Les intervenants ont essentiellement déclaré que les Lignes directrices et les décisions du CEPMB peuvent avoir une incidence tant positive que négative sur l’écosystème des sciences de la vie au Canada, particulièrement en ce qui concerne les éléments suivants :
- Le développement du secteur des sciences de la vie, comme les investissements, l’innovation, les essais cliniques, la recherche et le développement, et la commercialisation et les lancements de produits;
- Le service aux consommateurs et les soins aux patients, y compris la sécurité des chaînes d’approvisionnement en médicaments;
- L’accès aux médicaments existants et nouveaux et la disponibilité de ceux-ci.
Dans l’évaluation de l’incidence des Lignes directrices et des décisions du CEPMB, il faut également tenir compte de leurs répercussions sur la vie de la population canadienne. En analysant ces répercussions, les intervenants ont souligné l’importance de l’abordabilité et de la disponibilité comme facteurs à prendre en considération. L’accent mis sur l’abordabilité a mis en lumière le coût élevé des médicaments au Canada et les conséquences réelles qui en découlent. L’accent mis sur la disponibilité a également mis en évidence des conséquences réelles, les intervenants faisant remarquer que l’accès rapide à de nouveaux médicaments peut changer la vie des gens et réduire les coûts des soins de santé. Les intervenants ont soutenu que les deux questions devraient être prises en considération : en mettant l’accent sur seulement l’une d’elles, des effets non intentionnels et potentiellement néfastes sur l’autre peuvent en découler.
2.5 L’alignement des Lignes directrices avec les grandes initiatives du gouvernement
Certains intervenants se sont montrés explicitement en faveur de l’alignement des Lignes directrices du CEPMB avec les grandes initiatives et priorités du gouvernement du Canada dans le but de favoriser et de soutenir le secteur dynamique et durable de la biofabrication et des sciences de la vie. Ils ont notamment fait mention de l’alignement avec la Stratégie en matière de biofabrication et de sciences de la vie du gouvernement du Canada, la Stratégie nationale visant à soutenir l’accès aux médicaments pour les maladies rares et la stratégie nationale d’assurance-médicaments.
De même, les intervenants ont recommandé l’adoption d’une approche prudente pour l’alignement des Lignes directrices du CEPMB avec les grandes initiatives et priorités du gouvernement du Canada. Les intervenants ont laissé entendre qu’en explorant les relations entre le CEPMB et les organismes de la santé pancanadiens, particulièrement en ce qui a trait à la coordination des décisions et des échéanciers avec d’autres acteurs du contexte pharmaceutique canadien, le Conseil devrait garder à l’esprit que de telles considérations risquent de le faire errer au-delà de son mandat. À cet égard, il a également été noté que le contexte réglementaire est complexe et que les mandats des divers organismes sont distincts Note de bas de page 5 . Par conséquent, les intervenants étaient d’avis que le CEPMB devrait s’acquitter de son mandat particulier, indépendamment des autres organismes, mais qu’il devrait être à l’affût des activités des autres organismes et reconnaître que des gains d’efficacité peuvent être réalisés à ce chapitre.
2.6 La participation des intervenants
Il est dorénavant essentiel de mobiliser les intervenants. Ces derniers ont indiqué que cette participation devrait notamment inclure: solliciter leurs commentaires, les consulter et collaborer avec eux, et mettre de l’information et des ressources à leur disposition. La participation comprend un large éventail d’activités, y compris la reconnaissance et la mise à profit des connaissances et de l’expertise des intervenants, l’accès utile à ces connaissances et à cette expertise, la compréhension des activités des organisations d’intervenants et leur fonctionnement, et la mobilisation des membres des groupes représentés par les organisations via des moyens de communication appropriés pour mieux comprendre leur expérience vécue.
Voici des exemples concrets de participation utile, selon les intervenants :
- Créer des groupes de travail ou des groupes consultatifs qui tiennent compte à la fois de l’expertise technique et de l’expérience vécue;
- Effectuer des analyses d’impact et des études de cas, les mettre à la disposition des intervenants et rencontrer ces derniers pour en discuter;
- Surveiller le rendement du CEPMB pour ce qui est de répondre aux besoins des intervenants;
- S’engager dans l’application des connaissances et la mobilisation efficaces en fournissant de l’information et des ressources appropriées et utiles, dans un langage clair et des formats accessibles;
- Procéder à des vérifications pour déceler les idées et pratiques discriminatoires dans le fonctionnement ou les suppositions du CEPMB.
Bien qu’une participation utile des intervenants soit jugée essentielle, les intervenants ont également souligné le fait que le CEPMB doit préserver son indépendance, être conscient de son mandat et faire preuve de vigilance pour éviter tout risque de conflit d’intérêts pouvant miner sa crédibilité.
 Version PDF (540 Ko)
Version PDF (540 Ko)