Processus d’examen
Table des matières
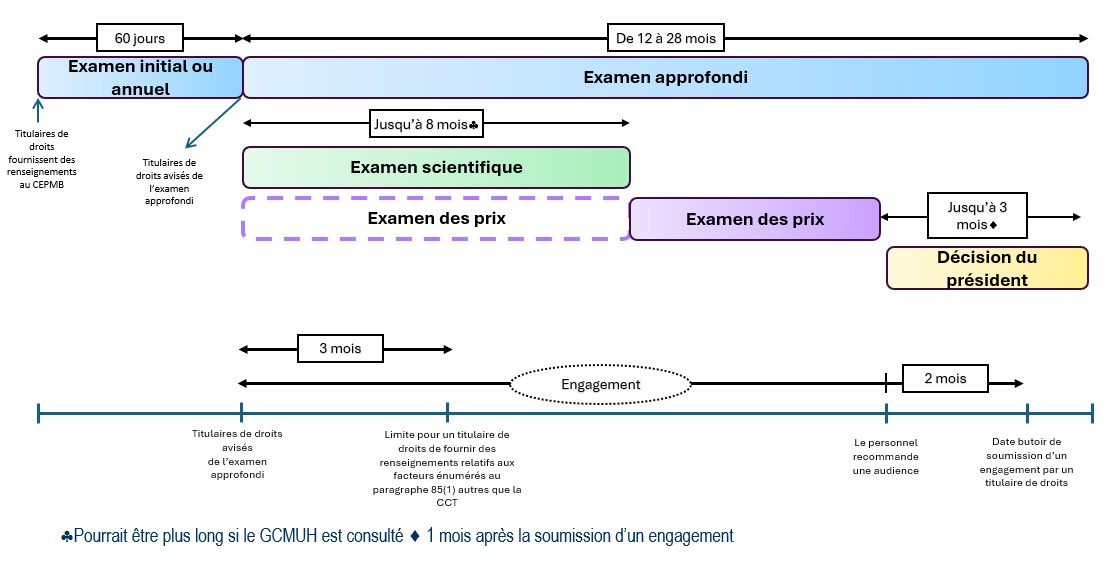
Description de la figure
Cette image présente une ligne du temps illustrant les normes de service appropriées pour l’examen initial ou annuel (60 jours), l’examen approfondi (de 12 à 28 mois), l’examen scientifique (jusqu’à 8 mois, mais peut durer plus longtemps si le GCMUH est consulté, et débute en même temps que l’examen approfondi) et l’examen des prix (débute en même temps que l’examen approfondi, mais l’analyse principale commence une fois l’examen scientifique terminé). Après avoir été avisé du début d’un examen approfondi, le titulaire de droits a jusqu’à trois mois pour soumettre des renseignements pertinents relatifs aux facteurs énumérés au paragraphe 85(1) dont le personnel doit tenir compte lors de son analyse. De plus, le titulaire de droits peut soumettre un engagement pour la considération du président jusqu’à deux mois après que le personnel recommande au président la tenue d’une audience. Le président décidera ensuite s’il clôt l’examen ou s’il publie un avis d’audience jusqu’à trois mois après la réception de la recommandation du personnel. Si le président publie un avis d’audience, le titulaire de droits ne peut plus proposer d’engagement. À la place, il peut présenter une proposition de règlement au panel d’audience.
Le CEPMB surveille de façon continue les prix des médicaments pratiqués par les titulaires de droits. Selon la Loi sur les brevets (la Loi) et le Règlement sur les médicaments brevetés (le Règlement), les titulaires de droits doivent transmettre les renseignements sur le prix et les ventes de leurs médicaments brevetés dans les 30 jours suivant la date à laquelle ceux-ci sont vendus pour la première fois au Canada. Les renseignements sur le prix et les ventes doivent ensuite être fournis deux fois par année pour chaque concentration et chaque forme posologique.
Le rôle des Lignes directrices est de mettre en place un cadre procédural général d’un processus d'examen qui aidera le personnel du CEPMB (le personnel) à déterminer si une recommandation pour une audience devrait être faite au président concernant le prix d'un médicament. Bien qu'elles s'adressent au personnel, ces Lignes directrices offrent aux titulaires de droits un processus d'examen des prix transparent, prévisible et équitable au regard de la loi qui peut être appliqué dans la plupart des situations.
Un « médicament existant » est défini comme étant un médicament breveté vendu pour la première fois avant le 1er juillet 2022, tandis qu’un « nouveau médicament » est un médicament breveté vendu pour la première fois le 1er juillet 2022 ou après cette date. Le processus d’examen débute une fois qu’un titulaire de droits soumet les renseignements relatifs au prix et aux ventes d’un médicament breveté au CEPMB.
- Pour plus de détails, veuillez consulter les Lignes directrices.
Examen initial
Lors de l'examen initial, le personnel utilise le premier rapport que fournit le titulaire de droits au sujet du prix d’un médicament breveté et compare le prix courant canadien le plus élevé à celui du plus élevé des prix internationaux (PEPI) parmi les 11 pays figurant à l’annexe du CEPMB11. Si le prix courant canadien le plus élevé pour un médicament breveté est supérieur au PEPI, ce médicament fait l'objet d'un examen approfondi. Les numéros d'identification du médicament (DIN) associés seront soumis à l'examen approfondi. Les DIN associés sont définis comme étant tous les DIN qui, selon les renseignements fournis par le titulaire de droits, sont liés à la ou les mêmes inventions brevetées, comme différentes formes posologiques du même médicament.
Les titulaires de droits peuvent s’attendre à recevoir les résultats de l'examen initial (soit « examiné » soit « fait l’objet d’un examen approfondi ») selon les normes de service de 60 jours suivant la date limite de dépôt du rapport.
Par exemple, si un médicament breveté est vendu pour la première fois le 1er septembre 2025, le premier dépôt requis sera pour la période de juillet à décembre 2025 et devra être soumis au plus tard le 30 janvier 2026. L'examen initial aura lieu juste après ce dépôt, et les résultats seront envoyés au titulaire des droits au plus tard le 31 mars 2026.
Examen annuel
L’examen annuel est effectué pour chaque médicament breveté au début de chaque année, après que tous les renseignements de l'année précédente ont été fournis par les titulaires de droits. Cet examen déterminera s'ils doivent faire l'objet d'un examen approfondi. Par exemple, l’examen annuel pour les prix de 2028 commencerait au début du mois de février 2029, après la réception du dernier dépôt de données de 2028. Lors de l’examen annuel, le personnel compare d'abord le prix courant canadien le plus élevé d'un médicament breveté contre le plus élevé des prix internationaux (PEPI) dans les pays du CEPMB11, tel que rapporté par le titulaire de droits. Il compare également la variation du prix canadien le plus élevé pour chaque médicament breveté aux variations de l'indice des prix à la consommation (IPC). Comme pour l’examen initial, les DIN associés sont également soumis à l’examen approfondi.
Les « nouveaux médicaments » et les « médicaments existants » sont soumis au même processus d’examen annuel. À partir de l'entrée en vigueur des Lignes directrices le 1er janvier 2026, les points suivants s'appliqueront :
Nouveaux médicaments :
- Le premier examen annuel des nouveaux médicaments ayant reçu un examen initial en 2026 commencera en février 2027.
- Si le prix d'un médicament breveté est supérieur à l'IPC sur un an, l'IPC sur deux ans sera pris en compte (le cas échéant).
Médicaments existants :
- Le premier examen annuel des médicaments existants débutera en février 2028, mais seul le critère du PEPI sera appliqué pour cette année.
Les titulaires de droits peuvent s’attendre à recevoir les résultats de l'examen annuel selon la norme de service de 60 jours suivant le 30 janvier, soit la date limite de dépôt du rapport des renseignements sur les prix et les ventes pour la seconde moitié de l'année précédente.
Plaintes
Un examen approfondi aura automatiquement lieu si une personne ou une organisation approuvée dépose une plainte concernant le prix excessif d’un médicament breveté sur un marché canadien. Cette condition s’applique indépendamment de la satisfaction des critères de l’examen initial ou annuel.
- Plus d’informations sur le processus de plaintes
Examen approfondi
Un examen approfondi est la démarche au cours de laquelle le personnel analyse et soupèse tous les renseignements se rapportant aux facteurs énumérés dans la Loi sur les brevets afin de formuler une recommandation au président quant à la tenue d’une audience. Cette démarche comprend une révision scientifique et une révision des prix.
Les critères utilisés lors des examens initiaux et annuels prennent en compte uniquement les prix internationaux et la variation du prix canadien par rapport à l'IPC. Lors de l'examen approfondi, on considère tous les facteurs, y compris la classe thérapeutique (tant à l’échelle nationale qu'internationale) identifiée lors de la révision scientifique. Les titulaires de droits doivent s'attendre à recevoir les résultats de l'examen approfondi dans un délai de 12 à 28 mois, selon sa complexité.
Examen scientifique
L’examen scientifique est un élément clé du processus de l’examen approfondi. Il est réalisé par l'équipe scientifique, qui est composée de professionnels de la santé ayant une formation, un parcours et une expérience considérables dans divers domaines de la pratique clinique, de l'évaluation des médicaments et de l'utilisation des médicaments. Un comité d'experts connu sous le nom de Groupe consultatif sur les médicaments pour usage humain (GCMUH) peut assister dans les évaluations scientifiques, de façon ponctuelle, si le personnel détermine que les circonstances justifient cette aide.
Lors de l’examen scientifique, le personnel déterminera des comparateurs qui seront ensuite utilisés pour effectuer une analyse de comparaison selon la catégorie thérapeutique (CCT). Pour chaque indication approuvée du médicament soumis à un examen approfondi, des comparateurs sont déterminés, et chaque comparateur se voit attribuer une cote de comparabilité ainsi qu'un schéma posologique comparable.
- Plus d’information sur le processus d'examen scientifique
- Plus d’information sur le Groupe consultatif sur les médicaments pour usage humain (GCMUH)
Examen des prix
L’examen des prix comprend une analyse plus complète du prix du médicament au Canada et dans tous les pays de l’annexe du CEPMB11, de l'historique des prix du médicament, et de toute autre information que le personnel juge pertinente. Ces renseignements incluent les données sur les prix et les ventes rapportées par le titulaire des droits, ainsi que les informations disponibles au public recueillies par le personnel qui se rapportent aux facteurs de l'article 85(1) de la Loi. Cette analyse est mise à jour tout au long de la durée de l’examen approfondi.
Lorsque le personnel reçoit les résultats de l’examen scientifique, il utilise la CCT pour faire une analyse domestique et internationale et compléter l'analyse préliminaire des prix avec ces informations.
Le personnel évalue et soupèse l’information pour faire une recommandation au président. Cette recommandation pourrait consister en la clôture de l’examen par le président (ce qui peut comprendre un engagement proposé au président par le titulaire de droits) ou en une demande au président de publier un avis d'audience.
- Plus d’information sur l’examen approfondi
Le délai prévu pour l’ensemble du processus de l’examen approfondi est 12 et 28 mois.
Engagements et propositions de règlement
Les titulaires de droits sont informés lorsque le personnel commence un examen approfondi. Les titulaires de droits peuvent choisir d’envoyer au CEPMB un engagement écrit de baisser le prix d'un médicament à l’étude ou de rembourser les recettes générées par la vente du médicament à un prix plus élevé. Le président peut tenir compte de tout engagement fait par le titulaire de droits lorsqu’il décide s’il publie un avis d’audience ou bien de clore l’examen. Cependant, si le président publie un avis d’audience, les titulaires de droits ne peuvent plus lui proposer un engagement. En revanche, ils peuvent présenter une proposition d’un règlement officiel au panel d'audience.
- Plus d’information sur les engagements et propositions de règlement
Recommandation au président et processus d'audience
À la fin de l'examen approfondi, le personnel fait une recommandation au président. Cette recommandation pourrait être la clôture de l’examen par le président (ce qui peut comprendre un engagement proposé au président par le titulaire de droits) ou la publication d’un avis d’audience par le président. Le président rendra sa décision au plus tard trois mois après avoir reçu la recommandation du personnel.
- Plus d’information sur le processus d'audience
- Plus d’information sur le l’état d’avancement des cas en cours