L’Observateur des médicaments émergents 2023

Novembre 2024
ISSN 2292-3144
No de cat. : H79-5F-PDF
Table des matières
- Sommaire
- Liste de termes
- Introduction
- Méthode
- Limites
- Aperçu des médicaments émergents en 2023
- L’Observateur des médicaments émergents 2023
- Tableau 4. Nouveaux médicaments sélectionnés en 2023
- Tableau 5. Mise à jour sur les médicaments émergents conservés de l’édition 2022 de L’Observateur des médicaments émergents
- Tableau 6. Médicaments émergents de l’édition 2022 de l’Observateur des médicaments émergents ayant reçu une autorisation de mise sur le marché
- Pleins feux sur le Canada
- Annexe A
- Références
Renseignements connexes
Conseil d’examen du prix des médicaments brevetés
Centre Standard Life
C.P. L40
333, avenue Laurier Ouest
Bureau 1400
Ottawa (Ontario) K1P 1C1
Tél. : 1-877-861-2350
ATS : 613-288-9654
Courriel : PMPRB.Information-Renseignements.CEPMB@pmprb-cepmb.gc.ca
Remerciements
Le présent rapport a été rédigé par le Conseil d’examen du prix des médicaments brevetés (CEPMB) dans le cadre de l’initiative de recherche du Système national d’information sur l’utilisation des médicaments prescrits (SNIUMP).
Le CEPMB tient à remercier les membres du Comité consultatif du SNIUMP pour leur supervision et leurs conseils avisés au cours de la rédaction du rapport. Veuillez noter que les déclarations et les constatations se rapportant au présent rapport ne reflètent pas nécessairement celles des membres ou de leurs organisations.
Nous remercions sincèrement Patricia Carruthers-Czyzewski, B. Sc. (phm.), M. Sc., Sintera Inc., pour son expertise du domaine pharmaceutique et sa contribution à l’évaluation scientifique.
Nous remercions Allison Carey d’avoir dirigé le projet, ainsi que Brian O’Shea et Kevin Pothier d’avoir supervisé la rédaction du rapport. Le CEPMB tient également à souligner la contribution de Shirin Paynter à la rédaction.
Avis de non‑responsabilité
L’initiative de recherche SNIUMP est une initiative de recherche qui fonctionne indépendamment des activités réglementaires du CEPMB. Les priorités de recherche, les données, les déclarations et les opinions présentées ou reproduites dans les rapports du SNIUMP ne représentent pas la position du CEPMB au sujet des questions réglementaires. Les rapports du SNIUMP ne contiennent aucune information confidentielle ou protégée en vertu des articles 87 et 88 de la Loi sur les brevets, et la mention d’un médicament dans un rapport du SNIUMP ne revient pas à reconnaître ou à nier qu’il fait l’objet d’une déclaration soumise en application des articles 80, 81 ou 82 de la Loi ou que son prix est ou n’est pas excessif au sens de l’article 85 de la Loi
Bien que ces renseignements soient en partie fondés sur des données obtenues avec l’autorisation de GlobalData et à partir de la base de données MIDAS©, propriété exclusive d’IQVIA Solutions Canada Inc. ou de ses sociétés affiliées (« IQVIA »), les déclarations, les résultats, les conclusions, les points de vue et les opinions exprimés dans le présent rapport sont exclusivement ceux du CEPMB et ne peuvent être attribués à GlobalData ou à IQVIA.
Citation suggérée
Conseil d’examen du prix des médicaments brevetés. (2024). L’Observateur des médicaments émergents, 2023. Ottawa : CEPMB.
Sommaire
L’Observateur des médicaments émergents (OMÉ) est un rapport d’analyse prospective qui présente une sélection de nouveaux médicaments en cours d’évaluation clinique ou en attente d’homologation qui pourraient avoir une incidence sur la pratique clinique future ou sur les dépenses en médicaments au Canada.
Dans la présente édition, la portée de l’examen visant les médicaments candidats en essais cliniques de phase III ou en attente d’homologation sélectionnés a été élargie et inclut désormais les médicaments en essais de phase II qui ont le même mécanisme d’action ou la même indication. Le fait de disposer de renseignements sur d’autres médicaments en cours d’évaluation (c.-à-d. en essais de phase II) peut aider à avoir une meilleure idée de la place que pourraient occuper ces médicaments candidats dans le traitement. Les médicaments en essais cliniques de phase III ou en attente d’homologation sont sélectionnés pour être ajoutés, en tant que médicaments candidats, à la liste des « nouveaux médicaments » s’ils peuvent répondre à un besoin thérapeutique non comblé, offrir un mécanisme d’action nouveau ou un avantage thérapeutique par rapport aux traitements existants, ou traiter une affection grave. Les médicaments en essais de phase II sont également examinés en vue de déceler d’autres médicaments qui en sont à des phases antérieures du processus et qui présentent la même indication ou le même mécanisme d’action que les médicaments candidats sélectionnés.
Le rapport rassemble des données provenant de deux sources principales : la base de données GlobalData Healthcare, qui permet de relever les médicaments en cours d’évaluation clinique, et les listes des présentations de médicaments et de produits de santé en cours d’examen (PCE) de Santé Canada, qui fournissent de l’information sur les nouveaux médicaments en cours d’examen au Canada.
Faits saillants relatifs aux médicaments émergents en 2023
- En avril 2024, plus de 12 000 nouveaux médicaments émergents étaient à divers stades de développement clinique, comparativement à un peu plus de 9 000 l’année précédente. Le nombre de médicaments émergents augmente en moyenne de 19 % par année depuis 2019.
- L’oncologie a continué de dominer l’éventail thérapeutique en 2023, les traitements oncologiques représentant un tiers (33 %) des médicaments à toutes les phases des essais cliniques. Les traitements contre les maladies infectieuses et les maladies du système nerveux central ont occupé les deuxième et troisième places, avec respectivement 13 % et 12 % des médicaments émergents.
- En moyenne, 20 % des médicaments en cours d’essais cliniques de phase III et en attente d’homologation en 2023 avaient obtenu une désignation rapide de médicament orphelin approuvée par la FDA des États-Unis ou l’EMA, ce qui représente une baisse d’environ 33 % par rapport aux années antérieures.
- Vingt nouveaux médicaments ont été sélectionnés pour être ajoutés à la liste des nouveaux médicaments de 2023 (tableau 4) en raison de leur incidence potentielle sur le système de soins de santé au Canada. Selon les prévisions, 14 des médicaments présentés dans le rapport de cette année (tableaux 4 à 7) devraient générer des recettes annuelles mondiales de plus d’un milliard de dollars américains d’ici 2029.
- Sur les 51 médicaments nouveaux et conservés présentés dans l’édition antérieure (l’OMÉ de 2022), 15 ont obtenu une autorisation de mise sur le marché, 23 ont été maintenus sur la liste, car ils répondaient toujours aux critères de sélection, et 13 ont été supprimés, car leurs essais cliniques avaient été abandonnés ou ils ne répondaient plus aux critères de sélection.
- Six nouveaux médicaments en cours d’examen par Santé Canada ont été sélectionnés pour ce rapport, car ils présentent un nouveau mécanisme d’action ou ont démontré une efficacité ou une innocuité améliorée dans le cadre d’essais cliniques.
Liste de termes
Les termes suivants et leurs définitions s’appliquent aux fins du présent rapport.
- Autorisation de mise en marché
- Processus d’approbation de la commercialisation d’un médicament dans un pays donné. Au Canada, l’approbation de la commercialisation est accordée à la suite d’une évaluation scientifique approfondie de l’innocuité, de l’efficacité et de la qualité d’un produit, conformément aux exigences de la Loi sur les aliments et drogues et de son RèglementNote de bas de page i.
- Efficacité clinique
- Réponse maximale possible d’un médicament en contexte de recherche médicale et capacité d’avoir un effet thérapeutique suffisant en contexte cliniqueNote de bas de page ii.
- Ingrédient médicinal
- Substance chimique ou biologique responsable de l’effet pharmacologique allégué d’un produit médicamenteux. Parfois appelé molécule, substance active ou ingrédient actifNote de bas de page iii.
- Médicament
- Terme général englobant à la fois le produit médicamenteux final et les ingrédients médicinaux, notamment les substances actives et les produits biologiques fabriqués chimiquement, ainsi que les produits de thérapie génique. Les médicaments sont déclarés par ingrédients médicinaux et peuvent faire référence à un seul ingrédient ou à une combinaison unique d’ingrédients.
- Médicament orphelin
- Médicament utilisé pour traiter une maladie rare. Pour les besoins de la présente étude, les médicaments orphelins sont définis comme ayant une désignation de médicament orphelin accordée par la Food and Drug Administration (FDA) des États-Unis ou par l’Agence européenne des médicaments (EMA) pour l’indication concernée.
- Nouveau médicament
- Ingrédient médicinal dont la mise sur le marché n’a pas encore été autorisée par un organisme de réglementationNote de bas de page iii.
- Perpétuation des brevets
- Pratique qui consiste à acquérir des brevets supplémentaires pour des modifications mineures apportées à un produit pharmaceutique existant dans le but de prolonger la durée de vie du brevet du produit (p. ex. nouveaux systèmes d’administration, nouvelles posologies, nouvelles utilisations, nouvelles combinaisons ou nouvelles formes)Note de bas de page iv.
- Thérapie cellulaire
- La transplantation de cellules humaines pour remplacer ou réparer des tissus ou des cellules endommagés.
- Thérapie génique
- Technique utilisée pour traiter des maladies génétiques, qui consiste à remplacer un gène absent ou défectueux par un gène sain, selon la définition de Santé CanadaNote de bas de page v.
- Phase I
- Dans cette phase, le médicament expérimental est mis à l’essai pour la première fois auprès d’un petit groupe de personnes. L’objectif est d’examiner l’innocuité du médicament, de déterminer une gamme posologique sûre et de détecter les effets secondaires.
- Phase II
- Dans cette phase, le médicament est administré à un plus grand groupe de personnes (généralement 100 ou plus) en vue de recueillir des données sur son efficacité dans le traitement d’une maladie ou d’un trouble particulier, de vérifier son innocuité sur un plus grand nombre de personnes et de déterminer la meilleure doseNote de bas de page vi.
- Phase III
- Dans cette phase, des essais, contrôlés ou non, sont effectués après que des données préliminaires qui permettent de penser que le médicament est efficace ont été obtenues. L’objectif est de recueillir des données supplémentaires afin de confirmer l’efficacité clinique et l’innocuité du médicament dans les conditions d’utilisation proposées,Note de bas de page v. Les essais de phase III sont habituellement des essais randomisés à double insu menés auprès de plusieurs centaines ou milliers de patients.
- En attente d’homologation
- Un médicament est en attente d’homologation lorsque tous les essais cliniques nécessaires sont terminés et que l’homologation ou l’approbation de l’utilisation du médicament est en cours d’examen par un organisme de réglementationNote de bas de page vii.
Phases des essais cliniques
Introduction
Cette édition de L’Observateur des médicaments émergents (OMÉ) présente une sélection de nouveaux médicaments en cours d’essais cliniques de phase III ou en attente d’homologation qui peuvent avoir une incidence sur la pratique clinique ou les dépenses en médicaments au Canada.
La méthodologie, qui est décrite en détail dans la section suivante, utilise un ensemble précis de critères pour dresser la liste des nouveaux médicaments tirés de la base de données GlobalData Healthcare, ainsi que la liste des médicaments en cours d’examen selon les listes des présentations de médicaments et de produits de santé en cours d’examen (PCE) de Santé Canada. Les nouveaux médicaments indiqués dans le présent rapport sont sélectionnés d’après une revue de la littérature scientifique et les résultats des essais cliniques en vue de déterminer si le médicament peut avoir une incidence sur le système de santé canadien en répondant à un besoin thérapeutique non comblé, en offrant un mécanisme d’action nouveau ou un avantage thérapeutique par rapport aux traitements existants, ou en traitant une affection grave. Les médicaments signalés dans les éditions précédentes de l’OMÉ sont également examinés et mis à jour dans le présent rapport. Les médicaments mentionnés dans l’édition de l’OMÉ de l’année précédente ont depuis reçu depuis une autorisation de mise sur le marché de la Food and Drug Administration (FDA) des États-Unis, de l’Agence européenne des médicaments (EMA) ou de Santé Canada. De même, les nouveaux médicaments figurant dans le présent rapport feront l’objet d’un suivi dans les prochaines éditions de l’OMÉafin de relever ceux qui réussissent à faire leur entrée sur le marché.
Pour mettre en contexte la sélection des médicaments, l’OMÉ comprend un aperçu du nombre de médicaments à chaque phase des essais cliniques portant sur les médicaments émergents d’année en année (2019-2023) et une ventilation des données par domaine thérapeutique pour chaque phase de développement clinique.
L’Observateur des médicaments émergents est une publication complémentaire à la Veille des médicaments mis en marché, qui analyse les tendances relatives au lancement sur le marché des médicaments nouvellement approuvés au Canada et à l’étranger. Ensemble, ces deux rapports du CEPMB permettent de surveiller le continuum de commercialisation des médicaments émergents aux dernières étapes de développement et des nouveaux médicaments approuvés, en plus de fournir de l’information sur les médicaments émergents et les pressions changeantes sur les coûts aux décideurs, aux chercheurs, aux patients, aux cliniciens et à d’autres intervenants.
Méthode
Aperçu des médicaments émergents
L’aperçu des médicaments émergents en 2023 présente la composition des médicaments qui en sont aux diverses étapes de développement clinique. Aux fins de l’analyse, une liste complète des médicaments émergents a été extraite de la base de données GlobalData Healthcare en avril 2024. Les médicaments candidats sélectionnés pour le rapport de cette année ont été validés au 30 août 2024.
Les nouveaux ingrédients médicinaux sont ceux qui n’ont pas été approuvés antérieurement par la FDA des États-Unis, l’EMA ou Santé Canada. La répartition des nouveaux médicaments par domaine thérapeutique correspond à l’indication en cours d’évaluation, selon les données de GlobalData. Il convient de préciser qu’un même médicament nouveau peut faire l’objet de plusieurs essais cliniques portant sur des indications distinctes.
L’Observateur des médicaments émergents
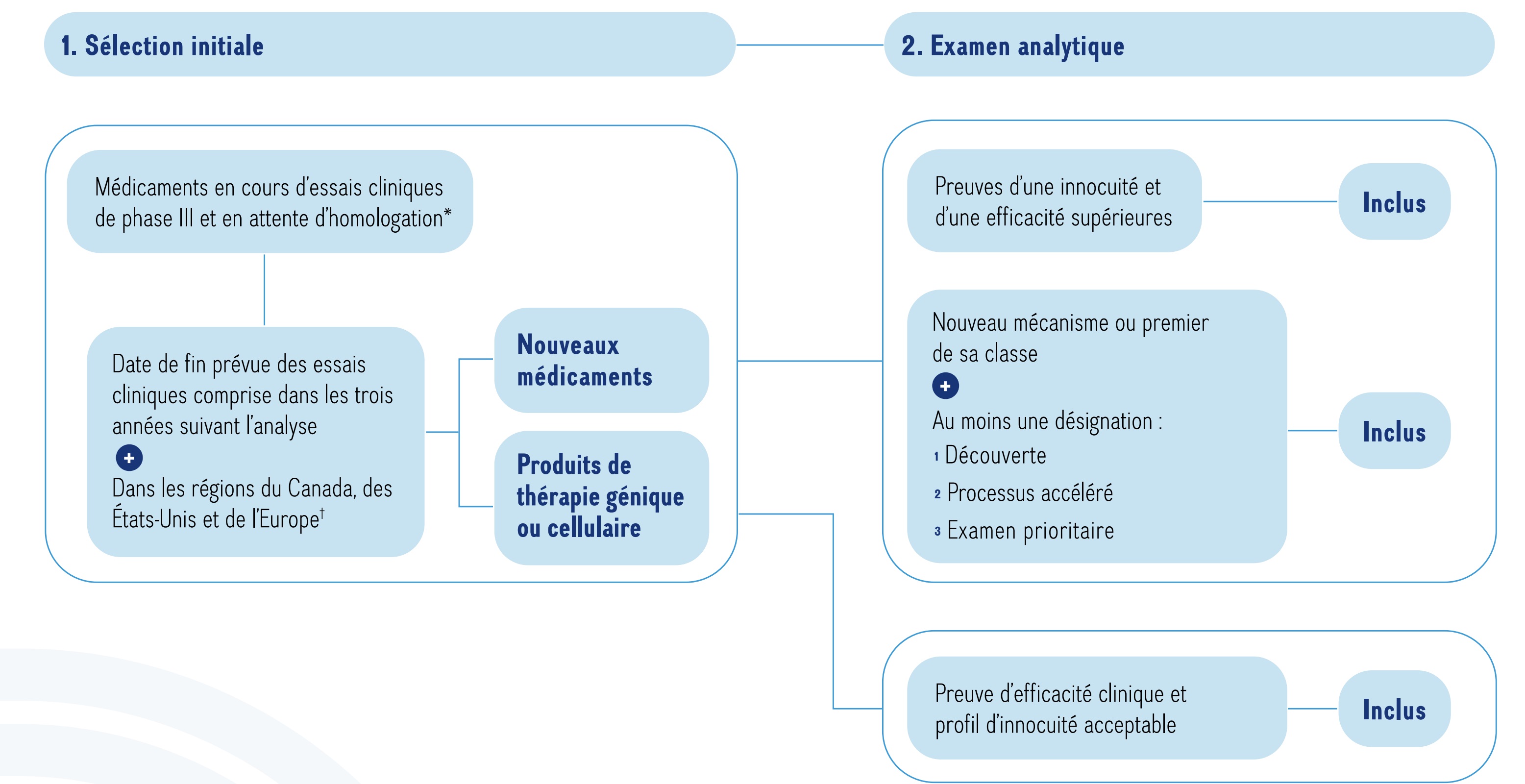
L’OMÉ retient les nouveaux médicaments qui sont en cours d’essais cliniques de phase III ou en attente d’homologation au Canada, aux États-Unis et en Europe. De nombreux médicaments candidats sont premiers de leur classe ou offrent des mécanismes nouveaux pour le traitement dans un domaine thérapeutique précis. Pour cette raison, ce rapport comporte un examen supplémentaire de médicaments qui font l’objet d’essais cliniques de phase II et qui ont la même indication ou le même mécanisme d’action aux étapes précédentes du processus (c’est-à-dire, la phase II). La sélection des médicaments émergents repose sur un processus en deux étapes (figure 1). À l’étape de la sélection initiale, les médicaments choisis en sont aux dernières étapes de l’évaluation clinique, tandis qu’à l’étape de l’examen analytique, une évaluation plus rigoureuse de chaque médicament potentiel est effectuée pour déterminer les médicaments qui pourraient avoir une incidence clinique ou budgétaire importante.
* En attente d’homologation par la FDA des États-Unis.
† Essais cliniques de phase III menés au Canada, aux États-Unis ou sur le continent européen (à l’exclusion de la Russie et de la Türkiye).
Description de la figure
Cet organigramme décrit la procédure de sélection des nouveaux médicaments inscrits. L’organigramme comprend deux étapes :
1. Sélection initiale
Cette étape comprend d’abord tous les médicaments faisant l’objet d’essais cliniques de phase III ou en attente d’homologation par la Food and Drug Administration des États-Unis. À l’étape suivante, les seuls médicaments retenus sont ceux dont la date de fin prévue des essais cliniques est comprise dans les trois années suivant l’analyse, dans les régions du Canada, des États-Unis et de l’Europe. Pour qu’un médicament satisfasse au critère géographique, des essais cliniques de phase III doivent être menés au Canada, aux États-Unis ou sur le continent européen (à l’exclusion de la Russie et de la Türkiye).
2. Examen analytique
L’étape d’examen analytique comprend deux parties : une voie pour les nouveaux médicaments et une autre pour les thérapies géniques.
Les nouveaux médicaments doivent satisfaire au moins l’une des exigences suivantes pour figurer dans la liste :
- Preuves d’une innocuité et d’une efficacité supérieures
- Nouveau mécanisme ou premier agent de sa classe, avec au moins une désignation parmi les suivantes : découverte, traitement accéléré ou évaluation prioritaire
Les thérapies géniques et cellulaires doivent présenter un profil d’innocuité ou d’efficacité clinique prometteur pour figurer dans la liste.
Étape 1. Sélection initiale
On utilise la base de données GlobalData Healthcare pour dresser une liste de médicaments en cours d’essais cliniques de phase III ou en attente d’homologation. Ces médicaments servent de fondement à l’étape de la sélection initiale.
La géographie des médicaments, qui s’entend de la région géographique ou du pays où le médicament est commercialisé ou en développement, se limite au Canada et à d’autres pays ayant des processus de réglementation et d’approbation semblables, soit les États-Unis et le continent européen (à l’exclusion de la Russie et de la Türkiye). Seuls les nouveaux ingrédients médicinaux dont l’innocuité et l’efficacité accrues démontrées dans les essais cliniques sont établies par des données adéquates peuvent être considérés pour la sélection.
Les médicaments approuvés ou vendus au Canada, aux États-Unis ou en Europe pour toute autre indication ou dans toute autre concentration ou formulation sont exclus du processus de sélection, tout comme les médicaments dont les essais cliniques sont inactifs, suspendus, retirés ou terminés.
Étape 2. Examen analytique
Critères de sélection
La seconde étape du processus tient compte d’un certain nombre de critères de sélection qui permettent de déterminer la liste finale des médicaments émergents. Ces critères sont exposés en détail dans le tableau 1.
Les étapes précédentes (c.-à-d. phase II) sont également examinées pour déterminer s’il existe d’autres médicaments ayant la même indication ou le même mécanisme d’action que les médicaments candidats en essais cliniques de phase III ou en attente d’homologation sélectionnés. Il est ainsi possible d’obtenir des renseignements supplémentaires sur le nombre de médicaments nouveaux, premiers de leur classe, qui font l’objet d’essais cliniques de phase II et qui pourraient avoir une incidence sur l’importance thérapeutique des médicaments candidats en essais de phase III ou en attente d’homologation sélectionnés.
Tableau 1. Critères de sélection des médicaments présentés dans l’OMÉ
| Critères de sélection |
|---|
| Amélioration de l’innocuité ou de l’efficacité démontrée dans les essais cliniques : médicament qui est associé à une innocuité accrue, à de nouvelles mesures des résultats, à une espérance de vie accrue ou à une meilleure qualité de vie. |
Nouveau mécanisme/premier de sa classe : médicament qui utilise un nouveau mécanisme d’interaction biochimique pour produire un effet médical, ou médicament qui est le premier de sa classe thérapeutique. De plus, le médicament doit correspondre à l’une ou à plusieurs des trois désignations suivantes de la FDA pour le développement et l’examen accélérés :
|
Renseignements descriptifs supplémentaires
Le profil de chaque médicament candidat retenu est fourni, ce qui comprend l’indication et le mécanisme d’action, ainsi qu’un résumé des résultats publiés pertinents provenant des essais cliniques. Les attributs particuliers qui peuvent influer sur l’adoption éventuelle ou le coût de chaque médicament sont également énoncés. Le tableau 2 fournit une description détaillée de ces principaux attributs.
Tableau 2. Principaux attributs des nouveaux médicaments sélectionnés pour l’OMÉ
| Attribut | Pertinence | Source des données |
|---|---|---|
| Essais cliniques de phase III au Canada | Les médicaments mis à l’essai au Canada sont susceptibles d’intéresser les Canadiens. |
Base de données GlobalData Healthcare; base de données sur les essais cliniques de Santé Canada; listes des présentations de médicaments et de produits de santé en cours d’examen de Santé Canada; registre des essais cliniques des National Institutes of Health (NIH) |
| Désignation de médicament rare ou orphelin | Les médicaments utilisés dans le traitement de maladies ou de problèmes de santé rares ont généralement des coûts de traitement élevés et peuvent entraîner des dépenses importantes. | GlobalData Healthcare |
| Produit biologique | Ces molécules complexes produites par des organismes vivants devraient avoir des coûts élevés et entraîner ainsi des dépenses importantes. | |
| Traitement d’appoint | Les médicaments conçus pour être utilisés en association avec des médicaments existants peuvent augmenter les coûts de traitement et contribuer à une augmentation des dépenses. | |
| Perpétuation possible | Formes modifiées du même produit afin de prolonger la durée de vie du brevet (par exemple, nouveaux systèmes d’administration, nouvelles posologies, nouvelles utilisations, nouvelles combinaisons ou nouvelles formes). |
Le profil précise également les répercussions possibles sur les coûts, le cas échéant, y compris les revenus mondiaux prévus déclarés par GlobalData.
Les indications et les domaines thérapeutiques des médicaments présentés sont ceux visés par le stade d’essais cliniques de phase III ou d’attente d’homologation. Un même essai clinique peut évaluer plusieurs indications dans le même domaine thérapeutique. Ces médicaments peuvent avoir d’autres indications à divers stades de l’évaluation clinique qui ne sont pas mentionnées dans le présent rapport. La description scientifique et les principaux attributs présentés portent sur l’indication ou les indications précisées pour les médicaments sélectionnés.
Les médicaments mentionnés pour une année donnée sont réévalués à chaque édition de l’OMÉ. Ils peuvent être conservés sur la liste de l’OMÉ s’ils répondent toujours aux critères de sélection. Les médicaments qui font l’objet d’essais cliniques ayant été interrompus ou qui ne répondent plus aux critères de sélection ne sont pas mentionnés dans les éditions suivantes.
Pleins feux sur le Canada
Les listes des présentations de médicaments et de produits de santé en cours d’examen (PCE) de Santé Canada sont évaluées selon une approche modifiée des critères de sélection en vue d’établir une liste de médicaments susceptibles d’avoir une incidence sur la pratique clinique ou sur les dépenses en médicaments au Canada.
Les médicaments inscrits sur les listes des PCE comprennent les présentations de drogues nouvelles contenant des ingrédients médicinaux qui n’ont pas été approuvés au Canada, quelle que soit l’indication, la concentration ou la formulation. Contrairement aux médicaments sélectionnés dans les listes de médicaments émergents, les médicaments inscrits sur les listes des PCE peuvent avoir déjà reçu une autorisation de mise sur le marché par la FDA des États-Unis ou par l’EMA.
Critères de sélection
Après la sélection initiale, le médicament doit satisfaire à au moins un des trois critères de sélection pour figurer dans le rapport. Ces critères sont présentés dans le tableau 3.
Tableau 3. Critères de sélection pour la liste des médicaments en cours d’examen par Santé Canada
| Critères de sélection |
|---|
| Amélioration de l’innocuité et de l’efficacité démontrée dans les essais cliniques : médicament qui est associé à une innocuité accrue, à de nouvelles mesures des résultats, à une espérance de vie accrue ou à une meilleure qualité de vie. |
| Nouveau mécanisme/premier de sa classe : médicament qui utilise un nouveau mécanisme d’interaction biochimique pour produire un effet médical, ou médicament qui est le premier de sa classe thérapeutique. |
| Thérapie génique ou cellulaire : technique utilisée pour traiter une maladie génétique, qui consiste à remplacer un gène absent ou défectueux par un gène sain, ou la transplantation de cellules humaines pour remplacer ou réparer des tissus ou des cellules endommagés. |
Renseignements descriptifs supplémentaires
Le profil de chaque médicament en cours d’examen comprend les principaux attributs énoncés au tableau 2, l’indication et le mécanisme d’action, ainsi qu’un résumé des résultats publiés pertinents provenant des essais cliniques. Les attributs particuliers qui peuvent influer sur l’adoption éventuelle ou le coût de chaque médicament sont également énoncés, tout comme les répercussions possibles sur les coûts, le cas échéant, y compris les revenus mondiaux prévus déclarés par GlobalData.
Bien que les désignations de la FDA pour le développement et l’examen accélérés ne constituent pas des critères de sélection pour cette liste, les désignations pertinentes (découverte, processus accéléré et examen prioritaire) sont mentionnées lorsqu’elles sont disponibles. Ces désignations sont décrites au tableau 1.
Les indications et les domaines thérapeutiques correspondent aux renseignements fournis par GlobalData. La description scientifique et les principaux attributs présentés portent sur l’indication précisée pour le médicament en question. Dans le cas des médicaments dont l’examen porte sur plusieurs indications, c’est l’indication principale qui est retenue.
Sources de données
La base de données GlobalData Healthcare est la principale source de données pour le repérage des médicaments émergents et des renseignements cliniques correspondants. GlobalData Healthcare permet de suivre les médicaments de leur découverte préclinique jusqu’au lancement sur le marché et aux ventes subséquentes, en passant par les essais cliniques. La base de données est une ressource complète qui répertorie les médicaments à divers stades de développement clinique. Les fonctions de recherche permettent une sélection contrôlée d’attributs particuliers, notamment la phase de développement clinique, le domaine thérapeutique, le type de molécule, l’indication, la géographie du médicament, le mécanisme d’action et les désignations réglementaires.
Les listes des PCE de Santé Canada sont utilisées pour déterminer la sélection présentée des nouveaux médicaments faisant actuellement l’objet d’un examen par Santé Canada. Elles constituent un ensemble de listes accessibles au public énumérant les présentations de produits pharmaceutiques et biologiques qui contiennent de nouveaux ingrédients médicinaux, lesquels n’ont pas encore été approuvés au Canada et qui ont été acceptées aux fins d’examen. Ceci s’applique aux présentations acceptées à partir du 1er avril 2015.
Étant donné que la sélection se limite aux nouveaux médicaments, d’autres sources d’information sont comparées pour confirmer que les médicaments candidats n’ont jamais été approuvés ou vendus dans le passé. Ces sources comprennent les données de vente enregistrées de la base de données MIDAS© d’IQVIA (tous droits réservés), les dossiers d’approbation réglementaire des National Institutes of Health (NIH), de la FDA des États-Unis, de l’EMA et de Santé Canada, et des renseignements issus de la base de données sur les essais cliniques de Santé Canada et du site ClinicalTrials.org.
Limites
La présente analyse offre un aperçu des médicaments émergents sur une période donnée. Bien qu’il soit censé être représentatif de la composition des médicaments au cours de l’année complète, l’ensemble des médicaments émergents est assez dynamique, et la part des médicaments dans un domaine thérapeutique particulier peut varier.
L’évaluation se limite aux médicaments en développement destinés à la commercialisation au Canada et dans d’autres pays ayant des processus de réglementation et d’approbation semblables, soit les États-Unis et l’Europe (à l’exclusion de la Russie et de la Türkiye). Les médicaments qui n’ont pas encore reçu d’autorisation de mise sur le marché dans ces pays ont été considérés comme des médicaments candidats potentiels, même s’ils ont été approuvés ailleurs dans le monde.
Certains des médicaments sélectionnés peuvent faire l’objet d’essais cliniques pour d’autres indications; la présente analyse ne fait état que des indications aux derniers stades de développement, c’est-à-dire lors des essais cliniques de phase III ou en attente d’homologation par la FDA des États-Unis, qui répondent aux critères de sélection énoncés dans la méthodologie.
Pour chaque médicament émergent sélectionné, les principaux fabricants et le nom commercial, le cas échéant, sont précisés avec l’indication. Dans certains cas, d’autres fabricants, y compris des filiales, peuvent également participer au développement du médicament avec les principales entreprises, ou d’autres fabricants peuvent mettre au point le même médicament pour d’autres indications.
Bien que le présent rapport tente de répertorier les médicaments émergents les plus importants, la sélection n’est pas exhaustive, et certains médicaments qui ne sont pas inclus dans cette sélection peuvent avoir une incidence importante sur la pratique clinique future ou sur les dépenses en médicaments au Canada.
Sauf indication contraire, les listes présentées rendent compte de la composition des médicaments émergents à partir d’avril 2024, et elles ont été validées à la fin du mois d’août 2024. En raison de la nature imprévisible et rapide de l’entrée sur le marché des médicaments émergents, certains des médicaments énumérés dans la présente édition peuvent avoir été approuvés ou commercialisés au Canada, aux États-Unis ou en Europe après cette date. Les médicaments émergents qui n’ont pas été inclus dans le rapport en raison du moment où la sélection a eu lieu peuvent actuellement répondre aux critères de sélection; ces médicaments, ainsi que le reste de la liste des médicaments émergents, seront pris en considération dans la prochaine édition du rapport.
Aperçu des médicaments émergents en 2023
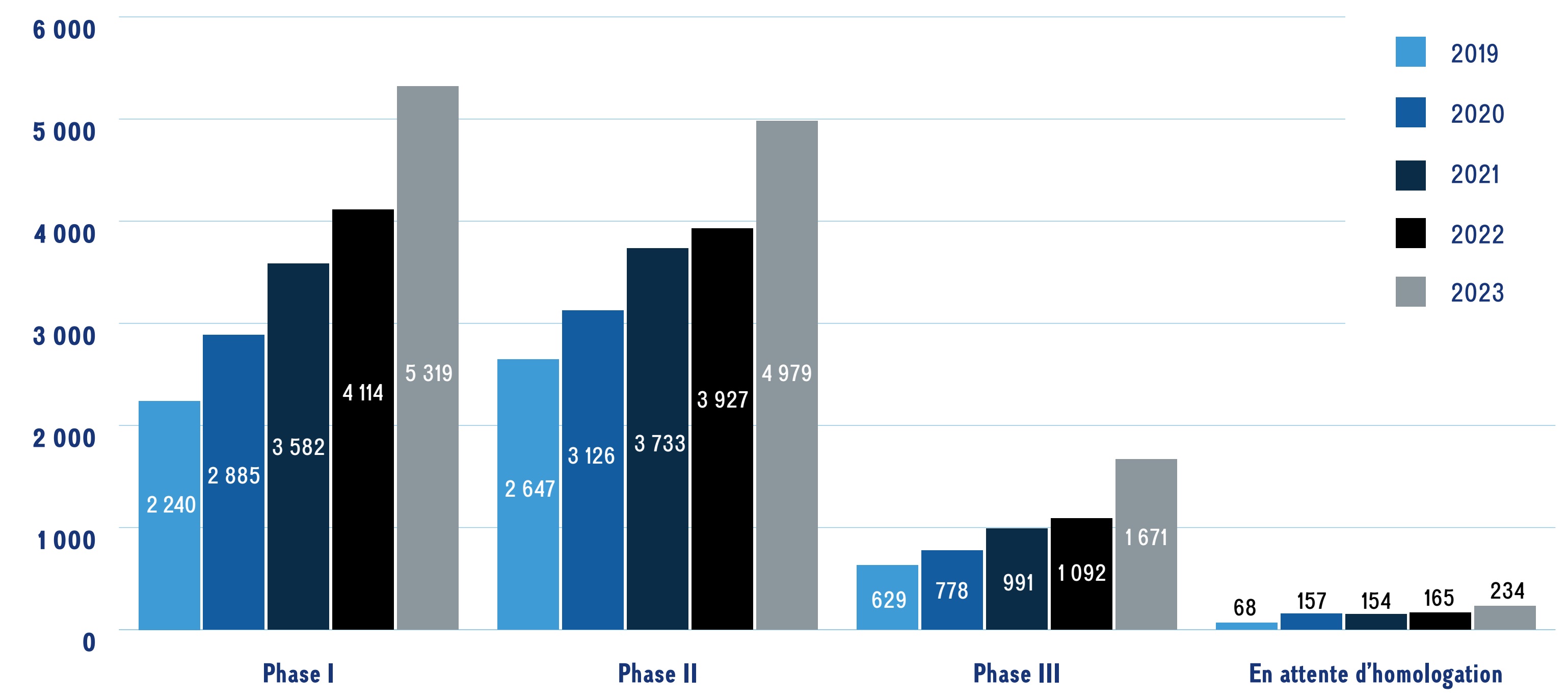
Le nombre de produits pharmaceutiques émergents augmente d’année en année. En 2023, plus de 12 000 nouveaux médicaments ont fait l’objet d’une évaluation clinique, ce qui représente une augmentation moyenne de 19 % par année depuis 2019.
La figure 2 donne un aperçu des médicaments émergents; on y présente le nombre de nouveaux ingrédients médicinaux pour chaque phase de développement clinique au cours des cinq dernières années.
Description de la figure
Ce graphique à barres montre le nombre total de nouveaux médicaments en cours de développement, selon la dernière phase de développement atteinte, de 2019 à 2023. Le nombre de nouveaux médicaments est indiqué pour chaque année et chaque phase.
| Phase I | Phase II | Phase III | Pré-homologation | |
|---|---|---|---|---|
2019 |
2 240 |
2 647 |
629 |
68 |
2020 |
2 885 |
3 126 |
778 |
157 |
2021 |
3 582 |
3 733 |
991 |
154 |
2022 |
4 114 |
3 927 |
1 092 |
165 |
2023 |
5 319 |
4 979 |
1 671 |
234 |
Sources de données : Base de données GlobalData Healthcare (consultée en avril 2024); base de données MIDAS© d’IQVIA.
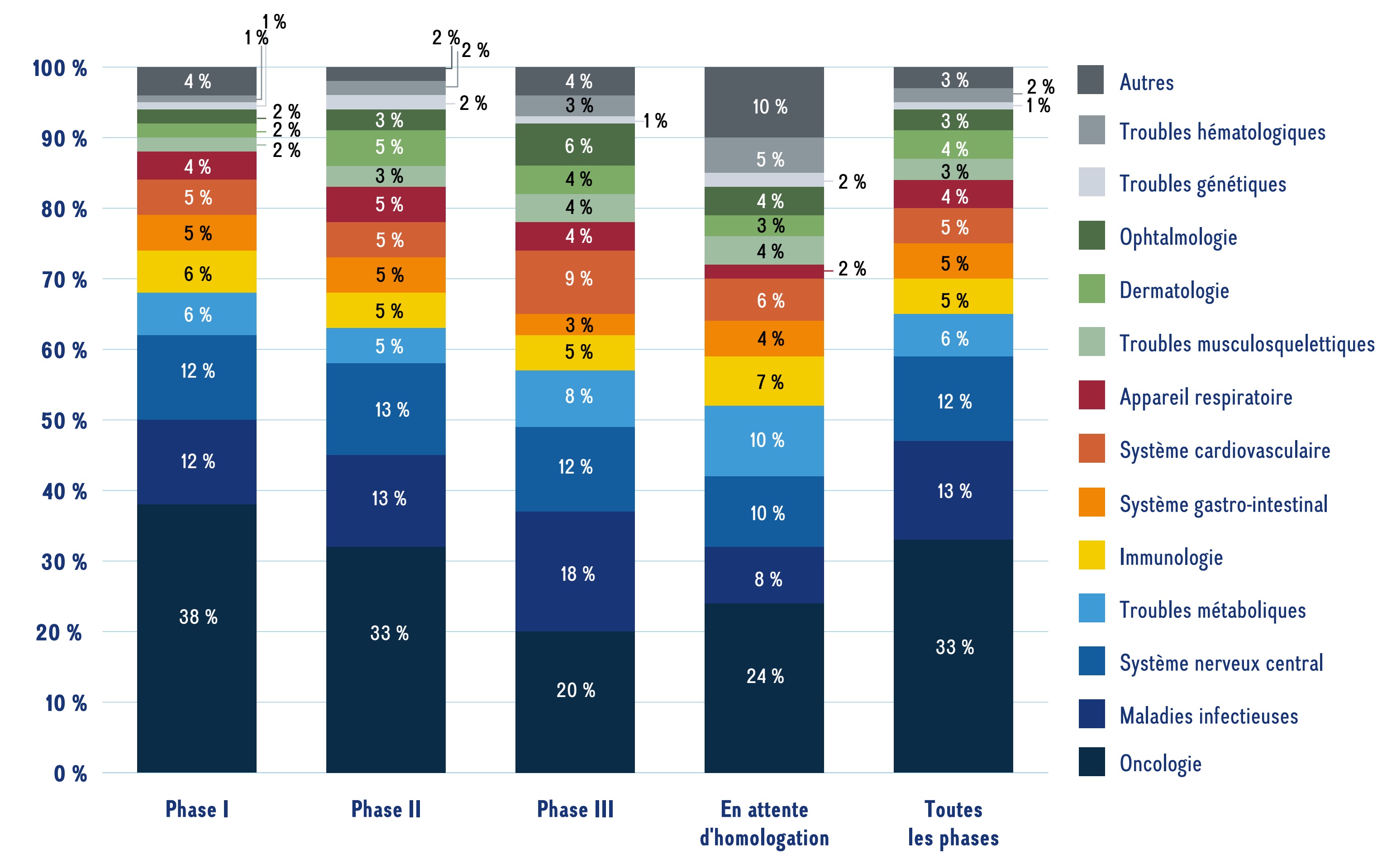
La figure 3a illustre la répartition des nouveaux médicaments par domaine thérapeutique, de la phase I à l’attente d’homologation. Bien que les résultats montrent que les médicaments émergents s’inscrivent dans un large éventail de domaines thérapeutiques en 2023, les traitements contre le cancer dominent la combinaison thérapeutique dans l’ensemble, représentant le tiers (33 %) des médicaments à toutes les phases d’évaluation clinique. D’autres domaines thérapeutiques importants comprennent les traitements contre les maladies infectieuses (13 %) et contre les maladies du système nerveux central (12 %).
Description de la figure
Ce graphique à barres empilées illustre la répartition des nouveaux médicaments par domaine thérapeutique, de la phase I à la pré-homologation.
| Domaine thérapeutique | Phase I | Phase II | Phase III | Pré-homologation | Toutes les phases |
|---|---|---|---|---|---|
Oncologie |
38 % |
33 % |
20 % |
24 % |
33 % |
Maladies infectieuses |
12 % |
13 % |
18 % |
8 % |
13 % |
Système nerveux central |
12 % |
13 % |
12 % |
10 % |
12 % |
Troubles métaboliques |
6 % |
5 % |
8 % |
10 % |
6 % |
Immunologie |
6 % |
5 % |
5 % |
7 % |
5 % |
Appareil digestif |
5 % |
5 % |
3 % |
4 % |
5 % |
Système cardiovasculaire |
5 % |
5 % |
9 % |
6 % |
5 % |
Appareil respiratoire |
4 % |
5 % |
4 % |
2 % |
4 % |
Troubles musculosquelettiques |
2 % |
3 % |
4 % |
4 % |
3 % |
Dermatologie |
2 % |
5 % |
4 % |
3 % |
4 % |
Ophtalmologie |
2 % |
3 % |
6 % |
4 % |
3 % |
Troubles génétiques |
1 % |
2 % |
1 % |
2 % |
1 % |
Troubles hématologiques |
1 % |
2 % |
3 % |
5 % |
2 % |
Autres |
4 % |
2 % |
4 % |
10 % |
3 % |
Sources des données : Base de données GlobalData Healthcare (consultée en avril 2024).
La figure 3b illustre les principales indications et le nombre de médicaments en cours d’essais cliniques de phase II ou de phase III, ou en attente d’homologation dans les domaines thérapeutiques majeurs dans lesquels s’inscrivent les médicaments émergents en 2023.

Description de la figure
Ce graphique à barres horizontales illustre les principales indications des médicaments émergents selon le nombre de médicaments, toutes phases de développement confondues.
| Domaine thérapeutique | Toutes les phases | |
|---|---|---|
Oncologie |
33 % |
Tumeur solide (228) Cancer du poumon non à petites cellules (94) Cancer de l’estomac (49) Carcinome épidermoïde de la tête et du cou (47) Cancer colorectal (46) Cancer du sein triple négatif (37) Cancer de l’ovaire (36) Leucémie myéloïde réfractaire et récidivante (35) Cancer du pancréas (33) Lymphome diffus à grandes cellules B (33) Mélanome (31) |
Maladies infectieuses |
13 % |
COVID-19 et symptômes connexes (29) Virus de l’immunodéficience humaine (VIH) (14) Infections à Acinetobacter (6) Infections causées par le virus de l’influenza A et B (6) Infections causées par le virus respiratoire syncytial (VRS) (5) |
Système nerveux central |
12 % |
Maladie d’Alzheimer (29) Maladie de Parkinson (22) Douleur postopératoire (15) Sclérose latérale amyotrophique (15) Douleur neuropathique (13) Sclérose en plaques (9) Dépendance à l’opium (9) Épilepsie (8) Trouble du spectre de l’autisme (5) |
Troubles métaboliques |
6 % |
Obésité (15) Diabète de type 2 (12) Diabète de type 1 (7) Dyslipidémie (7) Hypercholestérolémie (5) |
Immunologie |
5 % |
Polyarthrite rhumatoïde (15) Maladies auto-immunes (12) Lupus érythémateux disséminé (11) Psoriasis en plaques (7) Sclérodermie systémique (6) |
Appareil digestif |
5 % |
MASH (20) Colite ulcéreuse (18) Maladie de Crohn (8) Maladie intestinale inflammatoire (5) Syndrome du côlon irritable (5) Fibrose/cirrhose hépatique (3) |
Système cardiovasculaire |
5 % |
Insuffisance cardiaque (9) Hypertension artérielle pulmonaire (8) Hypertension (3) Thrombose (3) Cardiomyopathie (3) |
Appareil respiratoire |
4 % |
Fibrose pulmonaire idiopathique (14) Fibrose kystique (4) Pneumonie à streptocoque Tuberculose pulmonaire (3) |
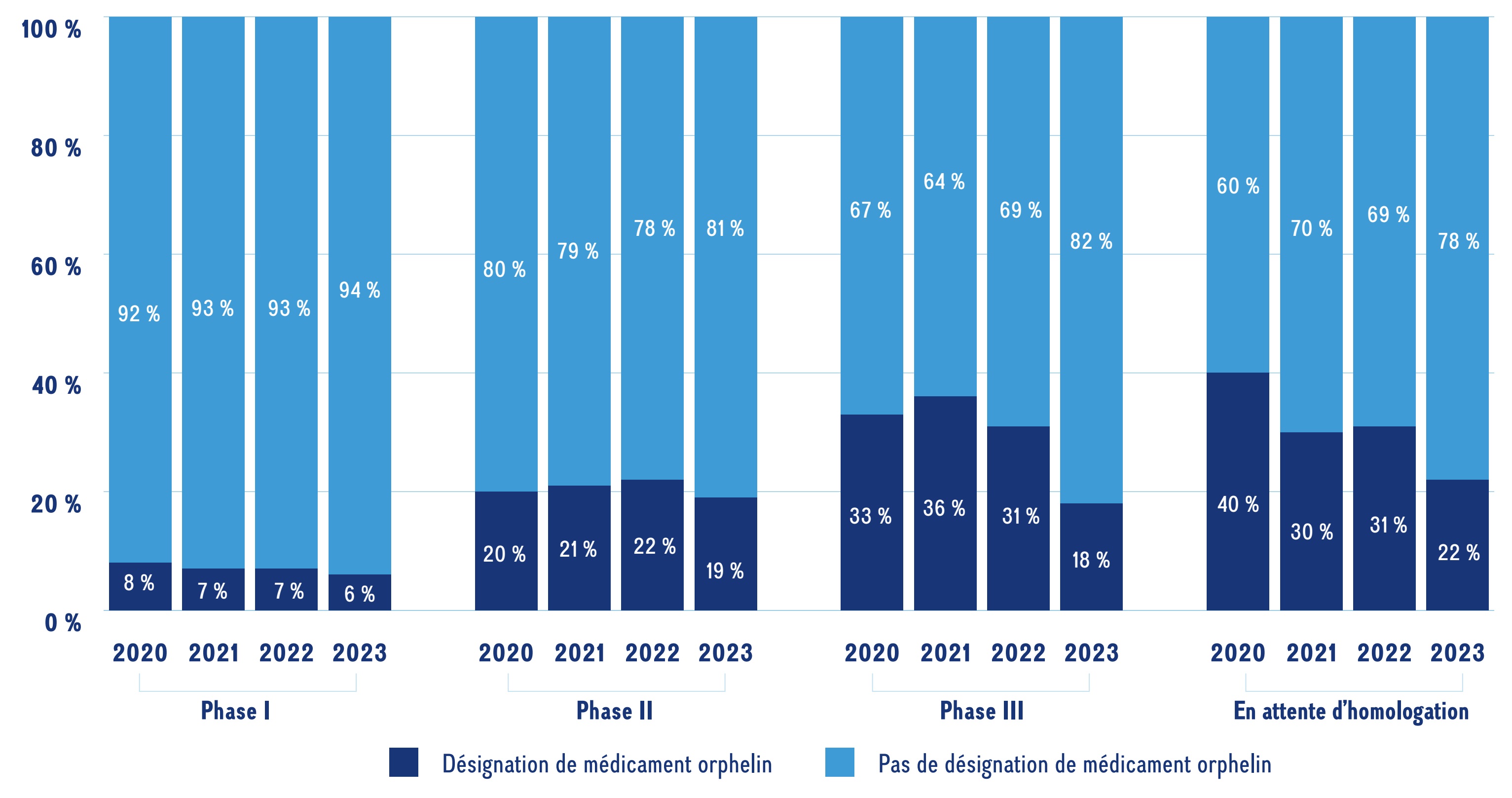
Les médicaments désignés orphelins par la FDA des États-Unis ou par l’EMA représentent une proportion considérable des médicaments émergents en 2023. La figure 4 présente les parts des médicaments désignés orphelins à toutes les phases de 2020 à 2023. Les médicaments désignés orphelins comptent pour une plus grande part des médicaments aux dernières étapes de l’évaluation clinique, représentant 6 % des médicaments émergents faisant l’objet d’essais de phase I contre 22 % des médicaments en attente d’homologation en 2023.
Description de la figure
Ce graphique à barres empilées illustre la part des médicaments orphelins et des médicaments non orphelins émergents, selon la phase de développement, de 2020 à 2023.
| Phase de développement | 2020 | 2021 | 2022 | 2023 | |
|---|---|---|---|---|---|
Médicaments orphelins |
Phase I |
8 % |
7 % |
7 % |
6 % |
Phase II |
20 % |
21 % |
22 % |
19 % |
|
Phase III |
33 % |
36 % |
31 % |
18 % |
|
Pré-homologation |
40 % |
30 % |
31 % |
22 % |
|
Médicaments non orphelins |
Phase I |
92 % |
93 % |
93 % |
94 % |
Phase II |
80 % |
79 % |
78 % |
81 % |
|
Phase III |
67 % |
64 % |
69 % |
82 % |
|
Pré-homologation |
60 % |
70 % |
69 % |
78 % |
Remarque : Comprend tous les médicaments émergents ayant atteint les essais de phase I jusqu’à l’attente d’homologation, mis au point pour le marché du Canada, des États-Unis ou du continent européen (à l’exclusion de la Russie et de la Türkiye). Les médicaments orphelins ont été définis comme des médicaments émergents qui ont reçu une désignation de médicament orphelin par la FDA des États-Unis ou l’Agence européenne des médicaments.
Sources des données : Base de données GlobalData Healthcare (consultée en avril 2024).
L’Observateur des médicaments émergents 2023
Les tableaux ci-après présentent la sélection de nouveaux médicaments candidats pour 2023 (tableau 4), les médicaments conservés des éditions précédentes de L’Observateur des médicaments émergents (tableau 5) et les médicaments figurant dans des éditions précédentes qui ont reçu depuis une autorisation de mise sur le marché (tableau 6).
Les médicaments en essais cliniques de phase III ou en attente d’homologation sont considérés pour la sélection aux fins d’inclusion dans l’Observateur des médicaments émergents (OMÉ) s’ils sont susceptibles d’avoir une incidence sur la pratique clinique future ou sur les dépenses en médicaments au Canada (p. ex. en répondant à un besoin thérapeutique non comblé, en offrant un mécanisme d’action nouveau ou un avantage thérapeutique par rapport aux traitements existants, ou en traitant une affection grave).
Sélection des nouveaux médicaments candidats
Parmi les 1 905 médicaments émergents en cours d’essais cliniques de phase III ou en attente d’homologation en 2023, vingt (20) nouveaux médicaments ont été retenus pour être ajoutés à la liste des nouveaux médicaments (tableau 4). De nombreux médicaments candidats sont premiers de leur classe ou offrent des mécanismes nouveaux pour le traitement dans des domaines thérapeutiques précis. Le fait de disposer de renseignements sur d’autres médicaments en cours d’évaluation (c.-à-d. en essais de phase II) peut aider à avoir une meilleure idée de la place que pourraient occuper ces médicaments candidats dans le traitement. Les médicaments en essais de phase II ont été examinés en vue de déceler d’autres médicaments émergents qui présentent la même indication ou le même mécanisme d’action que ceux énumérés dans la liste des nouveaux médicaments de 2023. La description de chaque médicament figurant dans la liste des nouveaux médicaments de 2023 comprend un énoncé indiquant s’il existe des médicaments en cours d’essais de phase II qui présentent la même indication ou le même mécanisme d’action. L’annexe A (tableau A2) fournit des renseignements supplémentaires sur les médicaments en cours d’essais de phase II répertoriés pour les indications ciblées par les médicaments candidats. Il est important de souligner que les médicaments en essais de phase II ne passeront pas tous aux essais de phase III. Selon une analyse de l’industrie, ce sont les programmes cliniques de phase II qui connaissent le taux de réussite le plus faible des phases de développement, avec seulement 28,9 % des médicaments candidats en développement passant à la phase III.1
Parmi les nouveaux médicaments présentés dans les rapports précédents, 23 ont été retenus, car ils satisfont toujours aux critères de sélection, et des données récentes continuent d’appuyer d’éventuels bienfaits cliniques prometteurs (tableau 5). Au 30 août 2024, quinze des médicaments émergents de 2022 avaient reçu une autorisation de mise sur le marché aux États-Unis, en Europe ou au Canada (tableau 6), tandis que 13 ont été retirés de la liste parce que les essais cliniques dont ils faisaient l’objet ont été interrompus ou parce qu’ils ne remplissaient plus les critères de sélection.
Sélection des produits biosimilaires
L’accès aux produits biosimilaires pourrait avoir une incidence de taille sur les coûts dans un large éventail de domaines thérapeutiques. L’annexe A (tableau A1) fournit une liste des produits biosimilaires en essais cliniques de phase III répertoriés et indique s’il existe actuellement un produit biosimilaire pour le médicament biologique d’origine.
Tableau 4. Nouveaux médicaments sélectionnés en 2023
Système cardiovasculaire
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
Aficamten Cytokinetics Inc.
|
Cardiomyopathie hypertrophique |
Essais cliniques
Revenus prévus
|
Nérinétide NoNO Inc.
|
AVC ischémique aigu |
Essais cliniques
Revenus prévus
|
Pelacarsen sodique Novartis AG
|
Maladie cardiovasculaire; hyperlipidémie |
Essais cliniques
Revenus prévus
|
Système nerveux central
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
Fosigotifator (ABBVCLS-7262) Calico Life Sciences LLC
|
Sclérose latérale amyotrophique (SLA) |
Essais cliniques
Revenus prévus
|
Iclepertine Boehringer Ingelheim International GmbH
|
Troubles cognitifs associés à la schizophrénie (CIAS) |
Essais cliniques
Revenus prévus
|
Résinifératoxine Grunenthal GmbH
|
Douleur liée à l’arthrose |
Essais cliniques
Revenus prévus
|
Xanoméline-trospium (KarXT) Karuna Therapeutics Inc.
|
Schizophrénie; psychose |
Essais cliniques
Revenus prévus
|
Dermatologie
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
Pradémagène zamikéracel Abeona Therapeutics Inc.
|
Épidermolyse bulleuse congénitale |
Essais cliniques
Revenus prévus
|
Troubles de l’appareil digestif
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
Efruxifermine Akero Therapeutics Inc.
|
Stéatohépatite associée à un dysfonctionnement métabolique (MASH) |
Essais cliniques
Revenus prévus
|
Obéfazimod Abivax SA
|
Colite ulcéreuse |
Essais cliniques
Revenus prévus
|
Troubles génétiques
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
Fazirsiran sodique Arrowhead Pharmaceuticals Inc.
|
Déficit en alpha-1-antitrypsine (A1AT) |
Essais cliniques
Revenus prévus
|
Système génito-urinaire et hormones sexuelles
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
Inaxapline (VX19-147) Vertex Pharmaceuticals Inc.
|
Glomérulosclérose segmentaire et focale (GSF); maladie rénale chronique (insuffisance rénale chronique) |
Essais cliniques
Revenus prévus
|
Troubles métaboliques
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
RGX-121 RegenxBio Inc.
|
Mucopolysaccharidose de type II (MPS II) (maladie de Hunter) |
Essais cliniques
Revenus prévus
|
Oncologie
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
Datopotamab déruxtécan Daiichi Sankyo Co Ltd.
|
Cancer du sein, à la fois HR positif/HER2 négatif et triple négatif |
Essais cliniques
Revenus prévus
|
Gemcitabine (GemRIS) Johnson & Johnson
|
Cancer de la vessie n’infiltrant pas le muscle (cancer superficiel de la vessie); cancer de la vessie infiltrant le muscle |
Essais cliniques
Revenus prévus
|
Chlorhydrate de patidégib Sol-Gel Technologies Ltd.
|
Syndrome de Gorlin (carcinome nævoïde basocellulaire/naevomatose basocellulaire) |
Essais cliniques
Revenus prévus
|
Citrate de révuménib (SNDX-5613) Syndax Pharmaceuticals Inc.
|
Leucémie lymphoïde aiguë (LLA); Leucémie lymphoblastique aiguë; Leucémie myéloïde aiguë réfractaire; Leucémie myéloïde aiguë récidivante |
Essais cliniques
Revenus prévus
|
Citrate de vorasidénib Les Laboratoires Servier SAS
|
Astrocytome; gliome de bas grade; oligodendrogliome |
Essais cliniques
Revenus prévus
|
Appareil respiratoire
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
AD-109 (atomoxétine + R-oxybutynine) Apnimed, Inc.
|
Apnée obstructive du sommeil (AOS) |
Essais cliniques
Revenus prévus
|
Brensocatib Insmed Inc.
|
Bronchectasie |
Essais cliniques
Revenus prévus
|
* Les prévisions consensuelles utilisées pour les données sur les revenus mondiaux ont été recueillies auprès de GlobalData (T2 de 2024) et sont présentées en dollars américains.
Source des données : Base de données GlobalData Healthcare.
Tableau 5. Mise à jour sur les médicaments émergents conservés de l’édition 2022 de L’Observateur des médicaments émergents
Système cardiovasculaire
| Médicament (nom commercial) Entreprise |
Indication(s) | Mise à jour |
|---|---|---|
Abélacimab Anthos Therapeutics Inc.
|
Thrombose veineuse profonde (TVP); embolie pulmonaire; fibrillation auriculaire |
Essais cliniques
Revenus prévus
|
Étripamil Milestone Pharmaceuticals Inc.
|
Tachycardie supraventriculaire |
Essais cliniques
Revenus prévus
|
Obicétrapib NewAmsterdam Pharma Company
|
Dyslipidémie; hypercholestérolémie familiale hétérozygote (HFHe); athérosclérose |
Essais cliniques
Revenus prévus
|
Système nerveux central
| Médicament (nom commercial) Entreprise |
Indication(s) | Mise à jour |
|---|---|---|
Soticlestat Takeda Pharmaceutical Co Ltd.
|
Syndrome de Lennox-Gastaut; syndrome de Dravet (épilepsie myoclonique sévère du nourrisson) |
Essais cliniques
Revenus prévus
|
Latozinémab (anciennement AL-001) Alector Inc.
|
Démence frontotemporale (DFT) |
Essais cliniques
Revenus prévus
|
Valiltramiprosate (anciennement ALZ-801) Alzheon Inc.
|
Maladie d’Alzheimer (MA) |
Essais cliniques
Revenus prévus
|
Midomafétamine (MDMA) Lykos Therapeutics (anciennementMultidisciplinary Association for Psychedelic Studies Public Benefit Corporation)
|
Trouble de stress post-traumatique (TSPT) |
Essais cliniques
Revenus prévus
|
ND-0612 (lévodopa-carbidopa pour perfusion sous-cutanée) Neuroderm, une filiale de Mitsubishi Tanabe Pharma Corp.
|
Maladie de Parkinson (MP) |
Essais cliniques
Revenus prévus
|
Troubles de l’appareil digestif
| Médicament (nom commercial) Entreprise |
Indication(s) | Mise à jour |
|---|---|---|
Séladelpar lysine CymaBay Therapeutics Inc.
|
Cholangite biliaire primitive (cirrhose biliaire primitive) |
Essais cliniques
Revenus prévus
|
Troubles génétiques
| Médicament (nom commercial) Entreprise |
Indication(s) | Mise à jour |
|---|---|---|
REC-2282 Recursion Pharmaceuticals Inc.
|
Neurofibromatose de type II (NF2) |
Essais cliniques
Revenus prévus
|
Système génito-urinaire et hormones sexuelles
| Médicament (nom commercial) Entreprise |
Indication(s) | Mise à jour |
|---|---|---|
Mésylate de gépotidacine GlaxoSmithKline PLC
|
Cystite; infections urinaires |
Essais cliniques
Revenus prévus
|
Troubles hématologiques
| Médicament (nom commercial) Entreprise |
Indication(s) | Mise à jour |
|---|---|---|
Bentracimab SFJ Pharmaceuticals Inc.
|
Troubles du saignement et de la coagulation |
Essais cliniques
Revenus prévus
|
Fitusiran Sanofi
|
Hémophilie A Hémophilie B |
Essais cliniques
Revenus prévus
|
Troubles hormonaux
| Médicament (nom commercial) Entreprise |
Indication(s) | Mise à jour |
|---|---|---|
Palopegtériparatide Ascendis Pharma AS
|
Hypoparathyroïdie |
Essais cliniques
Revenus prévus
|
Troubles immunologiques
| Médicament (nom commercial) Entreprise |
Indication(s) | Mise à jour |
|---|---|---|
Garadacimab CSL Ltd.
|
Angio-œdème héréditaire (AOH) (déficit en inhibiteur de la C1 estérase [C1-INH]) |
Essais cliniques
Revenus prévus
|
Maladies infectieuses
| Médicament (nom commercial) Entreprise |
Indication(s) | Mise à jour |
|---|---|---|
Zoliflodacine Innoviva Inc.
|
Gonorrhée urétrale et cervicale non compliquée |
Essais cliniques
Revenus prévus
|
Troubles métaboliques
| Médicament (nom commercial) Entreprise |
Indication(s) | Mise à jour |
|---|---|---|
Birtamimab Prothena Corp plc
|
Amylose systémique primaire |
Essais cliniques
Revenus prévus
|
Oncologie
| Médicament (nom commercial) Entreprise |
Indication(s) | Mise à jour |
|---|---|---|
Bémarituzumab Amgen Inc.
|
Adénocarcinome de la jonction œsophago-gastrique; cancer de l’estomac; cancer de la vessie; carcinome de la jonction œsophago-gastrique |
Essais cliniques
Revenus prévus
|
Dichlorhydrate de navitoclax AbbVie Inc.
|
Myélofibrose |
Essais cliniques
Revenus prévus
|
Acétate de rusfertide Protagonist Therapeutics Inc.
|
Polycythémie vraie (PV) |
Essais cliniques
Revenus prévus
|
SGX-301 - Hypéricine sodique (hypéricine synthétique) Soligenix Inc.
|
Lymphome T cutané (LTC) |
Essais cliniques
Revenus prévus
|
Zolbétuximab Astellas Pharma Inc.
|
Adénocarcinome de la jonction œsophago-gastrique; cancer de l’estomac |
Essais cliniques
Revenus prévus
|
Ophtalmologie
| Médicament (nom commercial) Entreprise |
Indication(s) | Mise à jour |
|---|---|---|
Lénadogène nolparvovec GenSight Biologics SA
|
Neuropathie optique héréditaire de Leber (atrophie optique de Leber) |
Essais cliniques
Revenus prévus
|
* Les prévisions consensuelles utilisées pour les données sur les revenus mondiaux ont été recueillies auprès de GlobalData (T2 de 2024) et sont présentées en dollars américains.
Source des données : Base de données GlobalData Healthcare.
Tableau 6. Médicaments émergents de l’édition 2022 de L’Observateur des médicaments émergents ayant reçu une autorisation de mise sur le marché
Système cardiovasculaire
| Médicament (nom commercial) Entreprise |
Indication(s) | Statut d’approbation et principaux attributs |
|---|---|---|
Aprocitentan (Tryvio) Idorsia Pharmaceutical Ltd.
|
Hypertension réfractaire |
Approbation
Revenus prévus
|
Sotatercept (Winrevair) Acceleron Pharma Inc.
|
Hypertension artérielle pulmonaire (HAP) |
Approbation
Revenus prévus
|
Dermatologie
| Médicament (nom commercial) Entreprise |
Indication(s) | Statut d’approbation et principaux attributs |
|---|---|---|
Bérémagène géperpavec (Vyjuvek) Krystal Biotech Inc.
|
Épidermolyse bulleuse |
Approbation
Revenus prévus
|
Troubles de l’appareil digestif
| Médicament (nom commercial) Entreprise |
Indication(s) | Statut d’approbation et principaux attributs |
|---|---|---|
RBX-2660 (Rebyota) Ferring Pharmaceuticals Inc.
|
Infections à Clostridium difficile (maladies associées à C. difficile) |
Approbation Approuvé par la FDA des États-Unis (Rebyota; 30 novembre 2023)195. Revenus prévus
|
Resmétirom (Rezdiffra) Madrigal Pharmaceuticals Inc.
|
Stéatohépatite associée à un dysfonctionnement métabolique (MASH) |
Approbation
Revenus prévus
|
Troubles génétiques
| Médicament (nom commercial) Entreprise |
Indication(s) | Statut d’approbation et principaux attributs |
|---|---|---|
Délandistrogène moxéparvovec (Elevidys) Sarepta Therapeutics Inc.
|
Dystrophie musculaire de Duchenne |
Approbation
Revenus prévus
|
Troubles hématologiques
| Médicament (nom commercial) Entreprise |
Indication(s) | Statut d’approbation et principaux attributs |
|---|---|---|
Danicopan (Voydeya) Alexion Pharmaceuticals Inc.
|
Hémoglobinurie paroxystique nocturne (HPN) |
Approbation
Revenus prévus
|
Fidanacogène (Beqvez) Pfizer Inc.
|
Hémophilie B (déficit en facteur IX) |
Approbation
Revenus prévus
|
Troubles immunologiques
| Médicament (nom commercial) Entreprise |
Indication(s) | Statut d’approbation et principaux attributs |
|---|---|---|
Omidubicel (Omisirge) Gamida Cell Ltd.
|
Greffe de cellules souches hématopoïétiques |
Approbation
Revenus prévus
|
Troubles métaboliques
| Médicament (nom commercial) Entreprise |
Indication(s) | Statut d’approbation et principaux attributs |
|---|---|---|
Donislecel (Lantidra) CellTrans Inc.
|
Diabète de type 1 (diabète insulinodépendant) |
Approbation
Revenus prévus
|
Insuline icodec (Awiqli) Novo Nordisk AS
|
Diabète de type 1 (diabète insulinodépendant); diabète de type 2 |
Approbation
Revenus prévus
|
Pégunigalsidase alfa (Elfabrio) Chiesi Farmaceutici SpA
|
Maladie de Fabry (MF) |
Approbation
Revenus prévus
|
Oncologie
| Médicament (nom commercial) Entreprise |
Indication(s) | Statut d’approbation et principaux attributs |
|---|---|---|
Imételstat sodique (Rytelo) Geron Corp
|
Syndrome myélodysplasique; myélofibrose secondaire à une thrombocytémie essentielle (MF post-TE); myélofibrose secondaire à une polycythémie vraie (MF post-PV) |
Approbation
Revenus prévus
|
Ophtalmologie
| Médicament (nom commercial) Entreprise |
Indication(s) | Statut d’approbation et principaux attributs |
|---|---|---|
Avacincaptad pégol sodique (Izervay) Astellas Pharma Inc.
|
Atrophie géographique (AG) |
Approbation
Revenus prévus
|
Ophtalmologie
| Médicament (nom commercial) Entreprise |
Indication(s) | Statut d’approbation et principaux attributs |
|---|---|---|
Fézolinétant (Veozah) Astellas Pharma Inc.
|
Symptômes vasomoteurs de la ménopause (bouffées de chaleur) |
Approbation
Revenus prévus
|
* Les prévisions consensuelles utilisées pour les données sur les revenus mondiaux ont été recueillies auprès de GlobalData (T2 de 2024) et sont présentées en dollars américains.
Source des données : Base de données GlobalData Healthcare.
Pleins feux sur le Canada
Cette section comprend une liste de certains médicaments en cours d’examen par Santé Canada qui pourraient avoir une incidence importante sur la pratique clinique future et sur les dépenses en médicaments. Les médicaments figurant dans cette liste peuvent être nouveaux au Canada, mais avoir été approuvés dans d’autres pays.
Le tableau 7 présente six nouveaux médicaments actuellement inscrits sur les listes des PCE de Santé Canada qui ont un nouveau mécanisme d’action ou dont l’innocuité et l’efficacité ont été améliorées dans le cadre d’essais cliniques. Sur les cinq médicaments figurant dans l’édition 2022, tous ont depuis reçu une autorisation de mise sur le marché de Santé Canada. Le mésylate de masitinib, un médicament agissant sur le système nerveux central indiqué dans la sclérose latérale amyotrophique (SLA), a fait l’objet d’un avis d’insuffisance (2024-02), et la demande a été retirée par Santé Canada.
Les listes des PCE constituent un ensemble de documents accessibles au public énumérant les présentations de produits pharmaceutiques et biologiques qui contiennent de nouveaux ingrédients médicinaux et qui ont été acceptés pour examen au Canada.
Tableau 7. Nouveaux médicaments sélectionnés en cours d’examen par Santé Canada, 2023
Troubles immunologiques
| Médicament (nom commercial) Entreprise |
Indication(s) anticipée(s)† | Description et principaux attributs |
|---|---|---|
Leniolisib Joenja (États-Unis) Pharming Technologies BV
|
Syndrome de la phosphoinositide 3-kinase delta activée (SPDA) |
Essais cliniques
Revenus prévus
|
Tapinarof Vtama (États-Unis) Dermavant Sciences GmbH
|
Psoriasis en plaques |
Essais cliniques
Revenus prévus
|
Oncologie
| Médicament (nom commercial) Entreprise |
Indication(s) anticipée(s)† | Description et principaux attributs |
|---|---|---|
Avapritinib Ayvakit (États-Unis) Blueprint Medicines Corporation
|
Tumeur stromale gastro-intestinale (GIST) |
Essais cliniques
Revenus prévus
|
Ivosidénib Tibsovo (États-Unis) Servier Canada Inc.
|
Leucémie myéloïde aiguë (LMA) |
Essais cliniques
Revenus prévus
|
Dichlorhydrate de momélotinib monohydraté Ojjaara (États-Unis) Omjjara (EMA) GlaxoSmithKline Inc.
|
Myélofibrose (MF) |
Essais cliniques
Revenus prévus
|
Ophtalmologie
| Médicament (nom commercial) Entreprise |
Indication(s) anticipée(s)† | Description et principaux attributs |
|---|---|---|
Perfluorohéxyloctane Miebo (États-Unis) Bausch & Lomb Inc.
|
Kérato-conjonctivite sèche (sécheresse oculaire) |
Essais cliniques
Revenus prévus
|
* Les prévisions consensuelles utilisées pour les données sur les revenus mondiaux ont été recueillies auprès de GlobalData (T2 de 2024) et sont présentées en dollars américains.
† Les listes des présentations de médicaments et de produits de santé en cours d’examen (PCE) de Santé Canada précisent le domaine thérapeutique du médicament en cours d’examen, mais pas l’indication. L’indication présentée au tableau 7 est fondée sur les renseignements sur le médicament issus de la littérature ou des approbations accordées dans d’autres pays. Dans certains cas, lorsque le médicament a fait l’objet d’un examen harmonisé, l’indication a été vérifiée dans le rapport d’examen en vue du remboursement de l’AMC.
Source des données : Base de données GlobalData Healthcare.
Annexe A
Tableau A1. Produits biosimilaires en cours d’essais cliniques de phase III (d’après les données extraites le 3 avril 2024)
| Médicament | Produit de référence au Canada | Autres produits biosimilaires commercialisés au Canada à l’heure actuelle (O/N) et produits biosimilaires en cours d’examen par SC | Entreprises mettant au point un produit biosimilaire | Indication |
|---|---|---|---|---|
Aflibercept |
Eylea (Bayer Inc.) |
N En cours d’examen par SC (en date du 3 avril) :
|
Alteogen Inc. Celltrion Inc. Formycon AG Sam Chun Dang Pharm Co Ltd. |
Dégénérescence maculaire humide (néovasculaire/exsudative) |
Amgen Inc. |
Œdème maculaire |
|||
Celltrion Inc. |
Dégénérescence maculaire liée à l’âge |
|||
Celltrion Inc. |
Néovascularisation choroïdienne |
|||
Celltrion Inc. |
Œdème maculaire cystoïde; œdème maculaire diabétique |
|||
Bévacizumab |
Avastin (Hoffmann-La Roche Limited) |
O |
Prestige BioPharma Ltd |
Cancer du poumon non à petites cellules |
Dénosumab |
Prolia/Xgeva (Amgen Canada Inc.) |
N En cours d’examen par SC (en date du 3 avril) :
|
Alvotech SA Biocon Ltd. Celltrion Inc. Eden Biologics Inc. Fresenius Kabi SwissBioSim GmbH Gedeon Richter plc I'rom Group Co Ltd. (Japon) Shanghai Henlius Biotech Inc. |
Ostéoporose postménopausique |
Biocon Ltd. |
Fracture osseuse |
|||
Biocon Ltd. |
Métastases osseuses |
|||
Éculizumab |
Soliris (Alexion Pharma GmbH) |
N En cours d’examen par SC (en date du 3 avril) :
|
Hémoglobinurie paroxystique nocturne |
|
Filgrastim |
Neulasta (Amgen Canada Inc.) |
O En cours d’examen par SC (en date du 3 avril) :
|
Neutropénie induite par la chimiothérapie |
|
Ocrélizumab |
Ocrevus (Hoffmann-La Roche Limited) |
N |
Celltrion Inc. |
Sclérose en plaques récurrente-rémittente (SEP-RR) |
Omalizumab |
Xolair (Novartis Pharmaceuticals Canada Inc.) |
N En cours d’examen par SC (en date du 3 avril) :
|
Celltrion Inc. |
Asthme allergique |
Celltrion Inc. |
Urticaire chronique |
|||
Celltrion Inc. |
Polypes nasaux (polypose nasale); rhinosinusite |
|||
Celltrion Inc. |
Allergie alimentaire |
|||
Pegfilgrastim |
Neulasta (Amgen Canada Inc.) |
O En cours d’examen par SC (en date du 3 avril) :
|
Curateq Biologics Pvt Ltd. |
Neutropénie induite par la chimiothérapie |
Pertuzumab |
Perjeta (Hoffmann-La Roche Limited) |
N |
Shanghai Henlius Biotech Inc. |
Cancer du sein positif pour le récepteur 2 du facteur de croissance épidermique humain (cancer du sein HER2+) |
Ranibizumab |
Lucentis (Novartis Pharmaceuticals Canada Inc.) |
O |
Lupin Ltd. |
Dégénérescence maculaire humide (néovasculaire/exsudative) |
Rituximab |
Rituxan (Hoffmann-La Roche Limited) |
O En cours d’examen par SC (en date du 3 avril) :
|
Lymphome non hodgkinien; leucémie lymphoïde chronique; polyarthrite rhumatoïde; granulomatose avec polyangéite et polyangéite microscopique |
|
Tocilizumab |
Actemra (Hoffmann-La Roche Limited) |
N En cours d’examen par SC (en date du 3 avril) :
|
Celltrion Inc. Otsuka Pharmaceutical Co Ltd. |
Polyarthrite rhumatoïde |
Trastuzumab |
Herceptin (Hoffmann-La Roche Limited) |
O En cours d’examen par SC (en date du 3 avril) :
|
Prestige BioPharma Ltd |
Cancer du sein positif pour le récepteur 2 du facteur de croissance épidermique humain (cancer du sein HER2+) |
Prestige BioPharma Ltd |
Adénocarcinome de la jonction œsophago-gastrique |
|||
Prestige BioPharma Ltd |
Cancer de l’estomac |
|||
Ustekinumab |
Stelara (Janssen Inc.) |
N En cours d’examen par SC (en date du 3 avril) :
|
Biocon Ltd. Samsung Bioepis Co Ltd. |
Arthrite psoriasique |
Biocon Ltd. Formycon AG Samsung Bioepis Co Ltd. STgen Bio Co Ltd. |
Psoriasis en plaques (psoriasis vulgaire) |
|||
Biocon Ltd. Samsung Bioepis Co Ltd. |
Maladie de Crohn (entérite régionale) |
|||
Samsung Bioepis Co Ltd. |
Colite ulcéreuse |
* Approuvé mais non commercialisé en date du 5 décembre 2022.
† Produit biosimilaire en cours d’examen par Santé Canada.
Tableau A2. Médicaments en cours d’essais de phase II pour des indications ciblées par des médicaments candidats émergents, 2023
| Médicament candidat émergent | Indication | Médicaments en cours d’essais de phase II et mécanisme d’action (MA)* |
|---|---|---|
ABBVCLS-7262 |
Sclérose latérale amyotrophique (SLA) |
Médicaments en cours d’essais de phase II pour cette indication et MA :
À l’heure actuelle, il n’y a pas d’autres médicaments en cours d’essais de phase II pour cette indication qui ont le même MA que ABBVCLS-7262 (activateur de la sous-unité bêta du facteur d’initiation de la traduction eucaryote 2).
|
AD109 (atomoxétine + R-oxybutynine) |
Apnée obstructive du sommeil (AOS) |
À l’heure actuelle, il n’y a aucun autre médicament en cours d’essais de phase II pour cette indication précise. |
Aficamten |
Cardiomyopathie hypertrophique |
À l’heure actuelle, il n’y a aucun autre médicament en cours d’essais de phase II pour cette indication précise. |
Brensocatib |
Bronchectasie |
Médicaments en cours d’essais de phase II pour cette indication et leur MA :
À l’heure actuelle, il n’y a pas d’autres médicaments en cours d’essais de phase II pour cette indication ayant le même MA que le brensocatib (un inhibiteur de la dipeptidyl peptidase 1). |
Datopotamab déruxtécan |
Cancer du sein, à la fois HR positif/HER2 négatif et triple négatif |
Médicaments en cours d’essais de phase II pour cette indication et leur MA :
À l’heure actuelle, il n’y a aucun autre médicament en cours d’essais de phase II pour tous les types de cancer du sein ciblés par le datopotamab (un conjugué anticorps-médicament ciblant TROP2). |
Efruxifermin |
Stéatohépatite associée à un dysfonctionnement métabolique (MASH) |
Médicaments en cours d’essais de phase II pour cette indication et leur MA :
À l’heure actuelle, il y a un autre médicament (NN-9499) en cours d’essais de phase II pour cette indication qui a le même MA que l’efruxifermine (un agoniste du récepteur du facteur de croissance des fibroblastes). |
Ensifentrine |
Bronchopneumopathie chronique obstructive. |
Médicaments en cours d’essais de phase II pour cette indication et leur MA :
À l’heure actuelle, il n’y a pas d’autres médicaments en cours d’essais de phase II pour cette indication ayant le même MA que l’ensifentrine (un inhibiteur de la PDE 3 et 4). |
Fazirsiran |
Déficit en alpha-1-antitrypsine (A1AT) |
Médicaments en cours d’essais de phase II pour cette indication et leur MA :
À l’heure actuelle, d’autres médicaments (belcesiran, INBRX-101) en cours d’essais de phase II pour cette indication ont le même MA que le fazirsiran (un inhibiteur de la protéine alpha-1 antitrypsine). |
Gemcitabine (GemRIS, TAR-200) |
Cancer de la vessie non invasif sur le plan musculaire (CVNIM) (cancer superficiel de la vessie); cancer de la vessie invasif sur le plan musculaire (CVIM) |
Médicaments en cours d’essais de phase II pour ces indications et leur MA :
À l’heure actuelle, il n’y a pas d’autres médicaments en cours d’essais de phase II pour ces deux indications qui ont le même MA que la gemcitabine (un inhibiteur de la grande sous-unité de la ribonucléotide diphosphate réductase). |
Iclepertine |
Rejet de greffe rénale |
Médicaments en cours d’essais de phase II pour cette indication et leur MA :
À l’heure actuelle, il n’y a pas d’autres médicaments en cours d’essais de phase II pour cette indication qui ont le même MA que l’iclepertin (un inhibiteur du transporteur de glycine dépendant du sodium et du chlorure 1). |
Inaxaplin |
Glomérulosclérose segmentaire et focale |
Médicaments en cours d’essais de phase II pour cette indication et leur MA :
À l’heure actuelle, il n’y a pas d’autres médicaments en cours d’essais de phase II pour cette indication qui ont le même MA que l’inaxaplin (un inhibiteur de l’apolipoprotéine L1). |
Nérinétide
|
AVC ischémique aigu |
Médicaments en cours d’essais de phase II pour cette indication et leur MA :
À l’heure actuelle, il n’y a pas d’autres médicaments en cours d’essais de phase II pour cette indication qui ont le même MA que le nérinétide (un éicosapeptide neuroprotecteur). |
Obéfazimod |
Colite ulcéreuse |
Médicaments en cours d’essais de phase II pour cette indication et leur MA :
À l’heure actuelle, il n’y a pas d’autres médicaments en cours d’essais de phase II pour cette indication qui ont le même MA que l’obefazimod (un inhibiteur du facteur d’initiation de la traduction eucaryote 4E / agoniste du récepteur de l’interleukine 22). |
Patidegib |
Syndrome de Gorlin (nævomatose basocellulaire / syndrome du carcinome basocellulaire naevoïde) |
Médicaments en cours d’essais de phase II pour cette indication et leur MA :
À l’heure actuelle, il n’y a pas d’autres médicaments en cours d’essais de phase II pour cette indication qui ont le même MA que le patidegib (un bloqueur de la voie de signalisation Hedgehog). |
Pelacarsen sodium |
Maladies cardiovasculaires; hyperlipidémie |
Médicaments en cours d’essais de phase II pour cette indication et leur MA :
À l’heure actuelle, il n’y a pas d’autres médicaments en cours d’essais de phase II pour cette indication qui ont le même MA que le pelacarsen (un inhibiteur de l’apolipoprotéine A). |
Pradémagène zamikéracel |
Épidermolyse bulleuse |
Médicaments en cours d’essais de phase II pour cette indication et leur MA :
À l’heure actuelle, il n’y a pas d’autres médicaments en cours d’essais de phase II pour cette indication qui ont le même MA que le pradémagène zamikéracel (remplacement du collagène de type 7). |
Résinifératoxine |
Douleur liée à l’arthrose |
Médicaments en cours d’essais de phase II pour cette indication et leur MA :
À l’heure actuelle, un autre médicament (CGS-2005) ciblant cette indication et ayant le même MA que la résinifératoxine (un activateur du membre 1 de la sous-famille V du canal cationique à potentiel transitoire) est en cours d’essais de phase II. |
Révuménib |
Leucémie lymphoïde aiguë (LLA); Leucémie lymphoblastique aiguë; Leucémie myéloïde aiguë réfractaire; Leucémie myéloïde aiguë récidivante. |
Médicaments en cours d’essais de phase II pour ces indications et leur MA :
À l’heure actuelle, d’autres médicaments (DS-1594b, DSP-5336, ziftomenib) ciblant toutes les indications et ayant le même MA que le révuménib (un inhibiteur de la leucémie à lignée mixte de la ménine) sont en cours d’essais de phase II. |
RGX-121 |
Mucopolysaccharidose de type II (MPS II) (maladie de Hurler) |
Médicaments en cours d’essais de phase II pour cette indication et leur MA :
À l’heure actuelle, il y a un autre médicament (RGX-111) en cours d’essais de phase II pour cette indication ayant le même MA que le produit RGX-121 (un activateur de l’iduronate 2 sulfatase). |
Xanoméline-trospium (KarXT) |
Schizophrénie; Psychose |
Médicaments en cours d’essais de phase II pour cette indication et leur MA :
À l’heure actuelle, d’autres médicaments (ANAVEX-371, NBI-1117568, RL-007) en cours d’essais de phase II ciblent la schizophrénie et ont un MA semblable à celui de la xanoméline-trospium (un agoniste du récepteur muscarinique de l’acétylcholine). |
Abréviation : AMP : adénosine monophosphate; GABA : acide gamma-aminobutyrique; GLP : peptide de type glucagon; GSK : glycogène synthase kinase; PDE : phosphodiestérase; PG : prostaglandine; PPAR : récepteur activé par les proliférateurs de peroxysomes; TNF : facteur de nécrose tumorale. |
||
Sources des données : Base de données GlobalData Healthcare (consultée en avril 2024).
Références
- Clinical Development Success Rates and Contributing Factors 2011–2020. https://go.bio.org/rs/490-EHZ-999/images/ClinicalDevelopmentSuccessRates2011_2020.pdf (consulté le 21 octobre 2024).
- Sebastian SA, Padda I, Lehr EJ, Johal G. Aficamten: A Breakthrough Therapy for Symptomatic Obstructive Hypertrophic Cardiomyopathy. Am J Cardiovasc Drugs. 2023 Sep;23(5):519-532. doi: 10.1007/s40256-023-00599-0. Epub 2023 Aug 1.
- O’Riordan M. 2024. SEQUOIA-HCM: Aficamten Boosts Exercise Capacity in Obstructive HCM. 13 mai 2024. https://www.tctmd.com/news/sequoia-hcm-aficamten-boosts-exercise-capacity-obstructive-hcm#:~:text=Effect%20on%20LVEF%3A%20No%20Worrisome%20Signs&text=To%20TCTMD%2C%20Maron%20explained%20that,wider%20therapeutic%20window%20than%20mavacamten.
- A Phase 3, Multi-Center, Randomized, Double-blind, Placebo-controlled Trial to Evaluate the Efficacy and Safety of CK-3773274 in Adults With Symptomatic Hypertrophic Cardiomyopathy and Left Ventricular Outflow Tract Obstruction. ClinicalTrials.gov:NCT05186818 (terminé). https://clinicaltrials.gov/study/NCT05186818?intr=Aficamten%20&aggFilters=phase:3&rank=5
- A Phase 3, Multi-Center, Randomized, Double-Blind Trial to Evaluate the Efficacy and Safety of Aficamten Compared to Placebo in Adults With Symptomatic Non-Obstructive Hypertrophic Cardiomyopathy. ClinicalTrials.gov : NCT06081894 (en cours de recrutement). https://clinicaltrials.gov/study/NCT06081894?intr=Aficamten%20&aggFilters=phase:3&rank=3
- A Phase 3, Multi-center, Randomized, Double-blind Trial to Evaluate the Efficacy and Safety of Aficamten Compared to Metoprolol in Adults With Symptomatic Obstructive Hypertrophic Cardiomyopathy. ClinicalTrials.gov : NCT05767346 (en cours de recrutement). https://clinicaltrials.gov/study/NCT05767346?intr=Aficamten%20&aggFilters=phase:3&rank=4
- An Open-Label Study of Aficamten for Chinese Patients With Symptomatic Obstructive Hypertrophic Cardiomyopathy. ClinicalTrials.gov : NCT06116968 (en cours de recrutement). https://clinicaltrials.gov/study/NCT06116968?intr=Aficamten%20&aggFilters=phase:3&rank=1
- A Phase 2/3 Multicenter, Randomized, Double-Blind, Placebo-Controlled and Open-Label Extension Trial to Evaluate the Efficacy and Safety of Aficamten in a Pediatric Population With Symptomatic Obstructive Hypertrophic Cardiomyopathy. ClinicalTrials.gov : NCT06412666 (recrutement non amorcé). https://clinicaltrials.gov/study/NCT06412666?intr=Aficamten%20&aggFilters=phase:3&rank=2
- Base de données GlobalData Healthcare (consultée en avril 2024; liste d’essais de phase II).
- Dammavalam V, Lin S, Nessa S, Daksla N, Stefanowski K, et al. Neuroprotection during Thrombectomy for Acute Ischemic Stroke: A Review of Future Therapies. Int J Mol Sci. 2024 Jan 10;25(2):891. doi: 10.3390/ijms25020891.
- A Multicentre, Randomized, Double-blinded, Placebo-controlled, Parallel Group, Single-dose Design to Determine the Efficacy and Safety of Nerinetide in Participants With Acute Ischemic Stroke Undergoing Endovascular Thrombectomy Excluding Thrombolysis. ClinicalTrials.gov : NCT04462536 (terminé). https://clinicaltrials.gov/study/NCT04462536?intr=Nerinetide&aggFilters=phase:3&rank=1
- A Multicenter, Randomized, Double-Blind, Placebo-Controlled Study to Determine the Efficacy and Safety of Intravenous NA-1 Initiated by Paramedics in the Field for Acute Cerebral Ischemia Within Three Hours of Symptom Onset. ClinicalTrials.gov : NCT02315443 (terminé). https://clinicaltrials.gov/study/NCT02315443?intr=Nerinetide&aggFilters=phase:3&rank=2
- A Multicentre, Randomized, Double-blinded, Placebo-controlled, Parallel Group, Single-dose Design to Determine the Efficacy and Safety of Intravenous NA-1 in Subjects With Acute Ischemic Stroke Undergoing Endovascular Thrombectomy. ClinicalTrials.gov : NCT02930018 (terminé). https://clinicaltrials.gov/study/NCT02930018?intr=Nerinetide&aggFilters=phase:3&rank=3
- Base de données GlobalData Healthcare (consultée en avril 2024; liste d’essais de phase II).
- Kosmas CE, Bousvarou MD, Papakonstantinou EJ, Tsamoulis D, Koulopoulos A, et al. Novel Pharmacological Therapies for the Management of Hyperlipoproteinemia(a). Int J Mol Sci. 2023 Sep 3;24(17):13622. doi : 10.3390/ijms241713622.
- A Single Arm, Open Label Extension (OLE), Multicenter Study to Evaluate Long-term Safety and Tolerability of Pelacarsen (TQJ230) in Patients With Cardiovascular Disease Who Have Successfully Completed the Apheresis Parent Study. ClinicalTrials.gov : NCT05900141 (en cours de recrutement). https://clinicaltrials.gov/study/NCT05900141?intr=pelacarsen%20&aggFilters=phase:3&rank=1
- A Randomized Double-blind, Placebo-controlled, Multicenter Study to Evaluate the Efficacy, Safety and Tolerability of Pelacarsen (TQJ230) in US Black/African American & Hispanic Patient Populations With Elevated Lp(a) and Established Atherosclerotic Cardiovascular Disease. ClinicalTrials.gov : NCT06267560 (recrutement non amorcé). https://clinicaltrials.gov/study/NCT06267560?intr=pelacarsen%20&aggFilters=phase:3&rank=2
- A Randomized, Double-blind, Placebo-controlled, Multicenter Trial Assessing the Reduction of the Rate of Lipoprotein Apheresis After Treatment With Pelacarsen (TQJ230) Compared to Placebo in Patients With Hyperlipoproteinemia(a) and Established Cardiovascular Disease Undergoing Weekly Lipoprotein Apheresis in Germany. ClinicalTrials.gov : NCT05305664 (actif, pas de recrutement). https://clinicaltrials.gov/study/NCT05305664?intr=pelacarsen%20&aggFilters=phase:3&rank=3
- A Randomized Double-blind, Placebo-controlled, Multicenter Trial Assessing the Impact of Lipoprotein (a) Lowering With Pelacarsen (TQJ230) on Major Cardiovascular Events in Patients With Established Cardiovascular Disease. ClinicalTrials.gov: NCT04023552 (actif, pas de recrutement). https://clinicaltrials.gov/study/NCT04023552?intr=pelacarsen%20&aggFilters=phase:3&rank=4
- Calico/AbbVie. ABBV-CLS-7262 for ALS. HEALEY ALS Platform Trial Regimen F. 2023. https://www.massgeneral.org/assets/mgh/pdf/neurology/als/regimenf_calicosabbv-cls-7262drugsciencewebinar_2023.pdf
- HEALEY ALS Platform Trial - Regimen F ABBV-CLS-7262. ClinicalTrials.gov : NCT05740813 (recrutement sur invitation). https://clinicaltrials.gov/study/NCT05740813?intr=NCT05740813&rank=1
- Base de données GlobalData Healthcare (consultée en avril 2024; liste d’essais de phase II).
- Rosenbrock H, Desch M, Wunderlich G(2). Development of the novel GlyT1 inhibitor, iclepertin (BI 425809), for the treatment of cognitive impairment associated with schizophrenia. Eur Arch Psychiatry Clin Neurosci. 2023 Oct;273(7):1557-1566. doi : 10.1007/s 00406-023-01576-z. Epub 2023 Mar 27.
- Dudzik P, Lustyk K, Pytka K. Beyond dopamine: Novel strategies for schizophrenia treatment. Med Res Rev. 2024 Apr 23. doi : 10.1002/med.22042. Publication en ligne avant impression.
- An Open Label, Single Arm, Extension Trial to Examine Long-term Safety of Iclepertin Once Daily in Patients With Schizophrenia Who Have Completed Previous Iclepertin Phase III Trials (CONNEX-X). ClinicalTrials.gov: NCT05211947 (recruiting). https://clinicaltrials.gov/study/NCT05211947?intr=Iclepertin&aggFilters=phase:3&rank=1
- A Phase III Randomized, Double-blinded, Placebo-controlled Parallel Group Trial to Examine the Efficacy and Safety of Iclepertin Once Daily Over 26 Week Treatment Period in Patients With Schizophrenia (CONNEX-2). ClinicalTrials.gov : NCT04846881 (actif, aucun recrutement). https://clinicaltrials.gov/study/NCT04846881?intr=Iclepertin&aggFilters=phase:3&rank=2
- A Phase III Randomized, Double-blind, Placebo-controlled Parallel Group Trial to Examine the Efficacy and Safety of Iclepertin Once Daily Over 26 Week Treatment Period in Patients With Schizophrenia (CONNEX-1). ClinicalTrials.gov : NCT04846868 (actif, aucun recrutement). https://clinicaltrials.gov/study/NCT04846868?intr=Iclepertin&aggFilters=phase:3&rank=3
- A Phase III Randomized, Double-blind, Placebo-controlled Parallel Group Trial to Examine the Efficacy and Safety of Iclepertin Once Daily Over 26 Week Treatment Period in Patients With Schizophrenia (CONNEX-3). ClinicalTrials.gov : NCT04860830 (actif, aucun recrutement). https://clinicaltrials.gov/study/NCT04860830?intr=Iclepertin&aggFilters=phase:3&rank=4
- A Phase 3, Multi-Center, Double-Blind, Randomized, Placebo-Controlled Trial to Evaluate the Efficacy and Safety of Reldesemtiv in Patients With Amyotrophic Lateral Sclerosis (ALS). NCT04944784 (en cours de recrutement). https://clinicaltrials.gov/ct2/show/NCT04944784?term=Reldesemtiv&phase=2&draw=2&rank=1
- A Phase 3, Open-Label Extension of COURAGE-ALS (CY 5031). NCT05442775 (en cours de recrutement). https://clinicaltrials.gov/ct2/show/NCT05442775?term=Reldesemtiv&phase=2&draw=2&rank=2
- Base de données GlobalData Healthcare (consultée en avril 2024; liste d’essais de phase II).
- Szallasi A. Resiniferatoxin: Nature's Precision Medicine to Silence TRPV1-Positive Afferents Int J Mol Sci. 2023 Oct 10;24(20):15042. doi: 10.3390/ijms242015042.
- Communiqué de presse Grünenthal. 2023. Grünenthal`s resinferatoxin receives Breakthrough Therapy Designation from U.S. FDA for pain associated with osteoarthritis of the knee. 22 mai 2023. https://www.grunenthal.com/en/press-room/press-releases/2023/pr-fda-breakthrough-therapy-designation-resiniferatoxin
- Base de données GlobalData Healthcare (consultée en avril 2024; liste d’essais de phase II).
- Kaul I, Sawchak S, Correll CU, Kakar R, Breier A, et al. Efficacy and safety of the muscarinic receptor agonist KarXT (xanomeline-trospium) in schizophrenia (EMERGENT-2) in the USA: results from a randomised, double-blind, placebo-controlled, flexible-dose phase 3 trial.Lancet. 2024 Jan 13;403(10422):160-170. doi: 10.1016/S0140-6736(23)02190-6. Epub 2023 Dec 14.
- Psychology Today. 2024. Why This Potential New Medication for Schizophrenia Is Important. 6 février 2024. https://www.psychologytoday.com/ca/blog/demystifying-psychiatry/202402/why-this-potential-new-medication-for-schizophrenia-is
- A Phase 3, Randomized, Double-blind, Parallel-group, Placebo-controlled, Multicenter Study to Evaluate the Efficacy and Safety of KarXT in Acutely Psychotic Hospitalized Adults With DSM-5 Schizophrenia. ClinicalTrials.gov : NCT04659161 (terminé). https://clinicaltrials.gov/study/NCT04659161?intr=KarXT&aggFilters=phase:3&page=1&rank=7
- An Open-label Extension Study to Assess the Long-term Safety, Tolerability, and Efficacy of KarXT in Subjects With DSM-5 Schizophrenia. ClinicalTrials.gov : NCT04659174 (terminé). https://clinicaltrials.gov/study/NCT04659174?intr=KarXT&aggFilters=phase:3&page=1&rank=8
- A Phase 3, Randomized, Double-blind, Parallel-group, Placebo-controlled, Multicenter Study to Evaluate the Efficacy and Safety of KarXT in Acutely Psychotic Hospitalized Adults With DSM-5 Schizophrenia. ClinicalTrials.gov : NCT04738123 (terminé). https://clinicaltrials.gov/study/NCT04738123?intr=KarXT&aggFilters=phase:3&page=2&rank=11
- An Open-label Extension Study to Assess the Long-term Safety and Tolerability of Adjunctive KarXT in Subjects With Inadequately Controlled Symptoms of Schizophrenia. ClinicalTrials.gov: NCT05304767 (enrolling by invitation). https://clinicaltrials.gov/study/NCT05304767?intr=KarXT&aggFilters=phase:3&page=1&rank=4
- A Phase 3, Randomized, Double-blind, Placebo-controlled Study to Evaluate the Safety and Efficacy of Adjunctive KarXT in Subjects With Inadequately Controlled Symptoms of Schizophrenia. ClinicalTrials.gov : NCT05145413 (en cours de recrutement). https://clinicaltrials.gov/study/NCT05145413?intr=KarXT&aggFilters=phase:3&page=1&rank=5
- An Open-label Study to Assess the Long-term Safety, Tolerability, and Efficacy of KarXT in De Novo Subjects With DSM-5 Schizophrenia. ClinicalTrials.gov : NCT04820309 (actif, aucun recrutement). https://clinicaltrials.gov/study/NCT04820309?intr=KarXT&aggFilters=phase:3&page=1&rank=9
- A Phase 3, Multicenter, Two-part Study With a 5-week Double-blind Part (Randomized, Parallel-group, Placebo-controlled) Followed by a 12-week Open-label Extension Part, to Evaluate the Efficacy and Safety of KarXT in Acutely Psychotic Hospitalized Chinese Adult Subjects With DSM-5 Schizophrenia. ClinicalTrials.gov: NCT05919823 (recruiting). https://clinicaltrials.gov/study/NCT05919823?intr=KarXT&aggFilters=phase:3&page=1&rank=10
- A Multi-center, Open-label Study to Assess the Effectiveness, Long-term Safety, Tolerability, and Durability of Effect of KarXT in Patients With DSM-5 Diagnosis of Schizophrenia. ClinicalTrials.gov : NCT05643170 (terminé). https://clinicaltrials.gov/study/NCT05643170?intr=KarXT&aggFilters=phase:3&page=1&rank=6
- A Phase 3 Global, Multicenter, Open-Label Extension Study to Assess the Long-Term Safety and Tolerability of KarXT in Subjects With Psychosis Associated With Alzheimer's Disease. ClinicalTrials.gov : NCT05980949 (recrutement sur invitation). https://clinicaltrials.gov/study/NCT05980949?intr=KarXT&aggFilters=phase:3&page=1&rank=1
- A Phase 3, Randomized, Double-Blind, Placebo-Controlled Relapse Prevention Study to Evaluate the Safety and Efficacy of KarXT for the Treatment of Psychosis Associated With Alzheimer's Disease. ClinicalTrials.gov : NCT05511363 (en cours de recrutement). https://clinicaltrials.gov/study/NCT05511363?intr=KarXT&aggFilters=phase:3&page=1&rank=2
- A Phase 3, Randomized, Double-Blind, Placebo-Controlled, Parallel Group Study to Evaluate the Safety and Efficacy of KarXT for the Treatment of Psychosis Associated With Alzheimer's Disease. ClinicalTrials.gov : NCT06126224 (en cours de recrutement). https://clinicaltrials.gov/study/NCT06126224?intr=KarXT&aggFilters=phase:3&page=1&rank=3
- Base de données GlobalData Healthcare (consultée en avril 2024; liste d’essais de phase II).
- Abeona Therapeutics Inc. Communiqué de presse, 2024. Abeona Therapeutics Provides Regulatory Update on Pz-cel, 22 avril 2024. https://investors.abeonatherapeutics.com/press-releases/detail/276/abeona-therapeutics-provides-regulatory-update-on-pz-cel
- VIITAL: A Phase 3 Study of EB-101 for the Treatment of Recessive Dystrophic Epidermolysis Bullosa (RDEB). ClinicalTrials.gov : NCT04227106 (terminé). https://clinicaltrials.gov/study/NCT04227106?intr=EB-101&aggFilters=phase:3&rank=1
- Ernst D. 2024. FDA’s Decision on Recessive Dystrophic Epidermolysis Bullosa Treatment Delayed. 24 avril 2024. https://www.empr.com/home/news/drugs-in-the-pipeline/fdas-decision-on-recessive-dystrophic-epidermolysis-bullosa-treatment-delayed/
- Abeona Therapeutics Inc. Press Release, 2024. Abeona Therapeutics Provides Regulatory Update on Pz-cel, 22 April 2024. https://investors.abeonatherapeutics.com/press-releases/detail/276/abeona-therapeutics-provides-regulatory-update-on-pz-cel
- A Phase 3b Study for the Treatment of Recessive Dystrophic Epidermolysis Bullosa (RDEB) in New and Previously EB-101 Treated Patients. ClinicalTrials.gov : NCT05725018 (en cours de recrutement). https://clinicaltrials.gov/study/NCT05725018?intr=EB-101&aggFilters=phase:3&rank=2
- Abeona Therapeutics® Reports Second Quarter 2024 Financial Results and Concludes Type A Meeting with FDA to Align on Upcoming Pz-cel BLA Resubmission. Press Release 2024. https://investors.abeonatherapeutics.com/press-releases/detail/285/abeona-therapeutics-reports-second-quarter-2024-financial
- Base de données GlobalData Healthcare (consultée en avril 2024; liste d’essais de phase II).
- Harrison SA, Ruane PJ, Freilich BL, Neff G, Patil R, et al. Efruxifermin in non-alcoholic steatohepatitis: a randomized, double-blind, placebo-controlled, phase 2a trial. Nat Med. 2021 Jul;27(7):1262-1271. doi: 10.1038/s41591-021-01425-3. Epub 2021 Jul 8.
- Harrison SA, Frias JP, Neff G, Abrams GA, Lucas KJ, et al; HARMONY Study Group. Safety and efficacy of once-weekly efruxifermin versus placebo in non-alcoholic steatohepatitis (HARMONY): a multicentre, randomised, double-blind, placebo-controlled, phase 2b trial.Lancet Gastroenterol Hepatol. 2023 Dec;8(12):1080-1093. doi: 10.1016/S 2468-1253(23)00272-8. Epub 2023 Oct 3.
- Harrison SA, Frias JP, Lucas KJ, Reiss G, Neff G, et al. Safety and Efficacy of Efruxifermin in Combination With a GLP-1 Receptor Agonist in Patients With NASH/MASH and Type 2 Diabetes in a Randomized Phase 2 Study. Clin Gastroenterol Hepatol. 2024 Mar 4:S1542-3565(24)00226-X. doi: 10.1016/j.cgh.2024.02.022. Publication en ligne avant impression.
- A Phase 3, Randomized, Double-Blind, Placebo-Controlled Study Evaluating the Safety and Efficacy of Efruxifermin in Subjects With Non-Cirrhotic Nonalcoholic Steatohepatitis (NASH)/Metabolic Dysfunction-Associated Steatohepatitis (MASH) and Fibrosis. ClinicalTrials.gov : NCT06215716 (en cours de recrutement). https://clinicaltrials.gov/study/NCT06215716?intr=Efruxifermin&aggFilters=phase:3&rank=1
- A Phase 3, Randomized, Double-Blind, Placebo-Controlled Study Evaluating the Safety and Efficacy of Efruxifermin in Subjects With Non-invasively Diagnosed Nonalcoholic Steatohepatitis (NASH)/Metabolic Dysfunction-Associated Steatohepatitis (MASH) and Nonalcoholic Fatty Liver Disease (NAFLD)/Metabolic Dysfunction-Associated Steatotic Liver Disease (MASLD). ClinicalTrials.gov : NCT06161571 (en cours de recrutement). https://clinicaltrials.gov/study/NCT06161571?intr=Efruxifermin&aggFilters=phase:3&rank=2
- Base de données GlobalData Healthcare (consultée en avril 2024; liste d’essais de phase II).
- Vermeire S, Solitano V, Peyrin-Biroulet L, Tilg H, Danese S, et al. Obefazimod: A First-in-class Drug for the Treatment of Ulcerative Colitis. J Crohns Colitis. 2023 Nov 8;17(10):1689-1697. doi: 10.1093/ecco-jcc/jjad067.
- A Randomized, Double-blind, Multicenter Phase III Study to Evaluate the Long-term Efficacy and Safety of ABX464 25 mg or 50 mg Once Daily as a Maintenance Therapy in Subjects With Moderately to Severely Active Ulcerative Colitis. ClinicalTrials.gov : NCT05535946 (en cours de recrutement). https://clinicaltrials.gov/study/NCT05535946?intr=obefazimod&aggFilters=phase:3&rank=1
- Étude de phase 3 randomisée, en double aveugle, contrôlée par placebo, visant à évaluer la sécurité et l’efficacité du fazirsiran dans le traitement de la maladie hépatique associée au déficit en alpha-1-antitrypsine avec une fibrose de stade F1 selon METAVIR. ClinicalTrials.gov : NCT06165341 (en cours de recrutement). https://clinicaltrials.gov/study/NCT06165341?intr=Fazirsiran%20&aggFilters=phase:3&rank=2
- A Randomized, Double-blind, Placebo-Controlled, Phase 3 Study to Evaluate the Efficacy and Safety of Fazirsiran in the Treatment of Alpha-1 Antitrypsin Deficiency-Associated Liver Disease With METAVIR Stage F2 to F4 Fibrosis. ClinicalTrials.gov : NCT05677971 (en cours de recrutement). https://clinicaltrials.gov/study/NCT05677971?intr=Fazirsiran%20&aggFilters=phase:3&rank=3
- Base de données GlobalData Healthcare (consultée en avril 2024; liste d’essais de phase II).
- A Phase 3, Open-Label Extension Study to Evaluate the Long-Term Safety and Efficacy of Fazirsiran in Participants With Alpha-1 Antitrypsin Deficiency-Associated Liver Disease. ClinicalTrials.gov : NCT05899673 (recrutement sur invitation). https://clinicaltrials.gov/study/NCT05899673?intr=Fazirsiran%20&aggFilters=phase:3&rank=1
- Étude de phase 3 randomisée, en double aveugle, contrôlée par placebo, visant à évaluer la sécurité et l’efficacité du fazirsiran dans le traitement de la maladie hépatique associée au déficit en alpha-1-antitrypsine avec une fibrose de stade F1 selon METAVIR. ClinicalTrials.gov : NCT06165341 (en cours de recrutement). https://clinicaltrials.gov/study/NCT06165341?intr=Fazirsiran%20&aggFilters=phase:3&rank=2
- A Randomized, Double-blind, Placebo-Controlled, Phase 3 Study to Evaluate the Efficacy and Safety of Fazirsiran in the Treatment of Alpha-1 Antitrypsin Deficiency-Associated Liver Disease With METAVIR Stage F2 to F4 Fibrosis. ClinicalTrials.gov : NCT05677971 (en cours de recrutement). https://clinicaltrials.gov/study/NCT05677971?intr=Fazirsiran%20&aggFilters=phase:3&rank=3
- Egbuna O, Zimmerman B, Manos G, Fortier A, Chirieac MC, et al; VX19-147-101 Study Group. Inaxaplin for Proteinuric Kidney Disease in Persons with Two APOL1 Variants. N Engl J Med. 2023 Mar 16;388(11):969-979. doi: 10.1056/NEJMoa2202396.
- Gbadegesin R, Lane B. Inaxaplin for the treatment of APOL1-associated kidney disease. Nat Rev Nephrol. 2023 Aug;19(8):479-480. doi: 10.1038/s41581-023-00721-0.
- A Phase 2/3 Adaptive, Double-blind, Placebo-Controlled Study to Evaluate the Efficacy and Safety of VX-147 in Adult and Pediatric Subjects With APOL1-mediated Proteinuric Kidney Disease. ClinicalTrials.gov : NCT05312879 (en cours de recrutement). https://clinicaltrials.gov/study/NCT05312879?intr=VX-147&aggFilters=phase:3&rank=1
- Base de données GlobalData Healthcare (consultée en avril 2024; liste d’essais de phase II).
- Communiqué de presse. REGENXBIO Inc. 2024. REGENXBIO Announces Pivotal Trial of RGX-121 for the Treatment of MPS II Achieves Primary Endpoint, February 2024. https://www.prnewswire.com/news-releases/regenxbio-announces-pivotal-trial-of-rgx-121-for-the-treatment-of-mps-ii-achieves-primary-endpoint-302056283.html
- A Phase 1/2/3 Multicenter, Open-Label Study to Evaluate the Efficacy, Safety, Tolerability, and Pharmacodynamics of RGX-121 in Pediatric Subjects With MPS II (Hunter Syndrome). ClinicalTrials.gov : NCT03566043 (actif, aucun recrutement). https://clinicaltrials.gov/study/NCT03566043?intr=RGX-121&aggFilters=phase:3&rank=1
- Base de données GlobalData Healthcare (consultée en avril 2024; liste d’essais de phase II).
- European Society for Medical Oncology (ESMO). News, 2024. Datopotamab Deruxtecan Shows Promising Activity in Heavily Pretreated Advanced HR-positive/HER2-negative and Triple-Negative Breast Cancers. 07 mai 2024. https://www.esmo.org/oncology-news/datopotamab-deruxtecan-shows-promising-activity-in-heavily-pretreated-advanced-hr-positive-her2-negative-and-triple-negative-breast-cancers
- AstraZeneca/Daiichi Sankyo. Communiqué de presse, 2024. Datopotamab deruxtecan Biologics License Application accepted in the US for patients with previously treated metastatic HR-positive, HER2-negative breast cancer. 2 avril 2024. https://www.astrazeneca.com/media-centre/press-releases/2024/fda-accepts-dato-dxd-bla-for-breast-cancer.html
- AstraZeneca. Communiqué de presse, 2024. Datopotamab deruxtecan Biologics License Application accepted in the US for patients with previously treated metastatic HR-positive, HER2-negative breast cancer. 2 avril 2024. https://www.astrazeneca.com/media-centre/press-releases/2024/fda-accepts-dato-dxd-bla-for-breast-cancer.html
- European Society for Medical Oncology (ESMO). News, 2024. Datopotamab Deruxtecan Shows Promising Activity in Heavily Pretreated Advanced HR-positive/HER2-negative and Triple-Negative Breast Cancers. 07 mai 2024. https://www.esmo.org/oncology-news/datopotamab-deruxtecan-shows-promising-activity-in-heavily-pretreated-advanced-hr-positive-her2-negative-and-triple-negative-breast-cancers
- A Phase 3, Open-label, Randomised Study of Datopotamab Deruxtecan (Dato-DXd) Versus Investigator's Choice of Chemotherapy in Patients Who Are Not Candidates for PD-1/PD-L1 Inhibitor Therapy in First-line Locally Recurrent Inoperable or Metastatic Triple-negative Breast Cancer (TROPION Breast02). ClinicalTrials.gov : NCT05374512 (en cours de recrutement). https://clinicaltrials.gov/study/NCT05374512?intr=Datopotamab%20&aggFilters=phase:3&rank=6
- A Phase III, Open-label, Randomised Study of Datopotamab Deruxtecan (Dato-DXd) With or Without Durvalumab Compared With Investigator's Choice of Chemotherapy (Paclitaxel, Nab-paclitaxel or Gemcitabine + Carboplatin) in Combination With Pembrolizumab in Patients With PD-L1 Positive Locally Recurrent Inoperable or Metastatic Triple-negative Breast Cancer (TROPION-Breast05). ClinicalTrials.gov : NCT06103864 (en cours de recrutement). https://clinicaltrials.gov/study/NCT06103864?intr=Datopotamab%20&aggFilters=phase:3&rank=8
- A Phase-3, Open-Label, Randomized Study of Dato-DXd Versus Investigator's Choice of Chemotherapy (ICC) in Participants With Inoperable or Metastatic HR-Positive, HER2-Negative Breast Cancer Who Have Been Treated With One or Two Prior Lines of Systemic Chemotherapy (TROPION-Breast01). ClinicalTrials.gov : NCT05104866 (actif, aucun recrutement). https://clinicaltrials.gov/study/NCT05104866?intr=Datopotamab%20&aggFilters=phase:3&rank=9
- A Phase 3 Open-label, Randomised Study of Datopotamab Deruxtecan (DatoDXd) With or Without Durvalumab Versus Investigator's Choice of Therapy in Patients With Stage I-III Triple-negative Breast Cancer Who Have Residual Invasive Disease in the Breast and/or Axillary Lymph Nodes at Surgical Resection Following Neoadjuvant Systemic Therapy (TROPION-Breast03). ClinicalTrials.gov : NCT05629585 (en cours de recrutement). https://clinicaltrials.gov/study/NCT05629585?intr=Datopotamab%20&aggFilters=phase:3&rank=10
- A Phase III, Open-label, Randomised Study of Neoadjuvant Datopotamab Deruxtecan (Dato-DXd) Plus Durvalumab Followed by Adjuvant Durvalumab With or Without Chemotherapy Versus Neoadjuvant Pembrolizumab Plus Chemotherapy Followed by Adjuvant Pembrolizumab With or Without Chemotherapy for the Treatment of Adult Patients With Previously Untreated Triple-Negative or Hormone Receptor-low/HER2-negative Breast Cancer (D926QC00001; TROPION-Breast04). ClinicalTrials.gov : NCT06112379 (en cours de recrutement). https://clinicaltrials.gov/study/NCT06112379?intr=Datopotamab%20&aggFilters=phase:3&page=2&rank=11
- AstraZeneca/Daiichi Sankyo. Communiqué de presse, 2024. Datopotamab deruxtecan Biologics License Application accepted in the US for patients with previously treated metastatic HR-positive, HER2-negative breast cancer. 2 avril 2024. https://www.astrazeneca.com/media-centre/press-releases/2024/fda-accepts-dato-dxd-bla-for-breast-cancer.html
- Base de données GlobalData Healthcare (consultée en avril 2024; liste d’essais de phase II).
- Broderick JM. 2023. TAR-200 Produces High CR Rates, Tolerability in BCG-unresponsive NMIBC. 1er mai 2023. https://www.onclive.com/view/tar-200-produces-high-cr-rates-tolerability-in-bcg-unresponsive-nmibc
- Johnson & Johnson. Communiqué de presse, 2024. TAR-200 monotherapy shows greater than 80% complete response rate in patients with high-risk non–muscle-invasive bladder cancer. 4 mai 2024. https://www.prnewswire.com/news-releases/tar-200-monotherapy-shows-greater-than-80-complete-response-rate-in-patients-with-high-risk-nonmuscle-invasive-bladder-cancer-302135628.html
- A Phase 3, Open-Label, Multi-Center, Randomized Study Evaluating the Efficacy and Safety of TAR-200 in Combination With Cetrelimab or TAR-200 Alone Versus Intravesical Bacillus Calmette-Guérin (BCG) in Participants With BCG-naïve High-Risk Non-Muscle Invasive Bladder Cancer. ClinicalTrials.gov : NCT05714202 (en cours de recrutement). https://clinicaltrials.gov/study/NCT05714202?intr=TAR-200&aggFilters=phase:3&rank=1
- A Phase 3, Randomized, Open-label, Multi-center Study Evaluating the Efficacy and Safety of TAR-200 Versus Investigator's Choice of Intravesical Chemotherapy in Participants Who Received Bacillus Calmette-Guérin (BCG) and Recurred With High-risk Non-muscle-invasive Bladder Cancer (HR-NMIBC) and Who Are Ineligible for or Elected Not to Undergo Radical Cystectomy. ClinicalTrials.gov : NCT06211764 (en cours de recrutement). https://clinicaltrials.gov/study/NCT06211764?intr=TAR-200&aggFilters=phase:3&rank=2
- A Phase 3, Multi-center, Randomized Study Evaluating Efficacy of TAR-200 in Combination With Cetrelimab Versus Concurrent Chemoradiotherapy in Participants With Muscle-Invasive Urothelial Carcinoma (MIBC) of the Bladder Who Are Not Receiving Radical Cystectomy. ClinicalTrials.gov : NCT04658862 (en cours de recrutement). https://clinicaltrials.gov/study/NCT04658862?intr=TAR-200&aggFilters=phase:3&rank=3
- Base de données GlobalData Healthcare (consultée en avril 2024; liste d’essais de phase II).
- Cosio T, Di Prete M, Di Raimondo C, Garofalo V, Lozzi F, et al. Patidegib in Dermatology : A Current Review. Int J Mol Sci. 2021 Oct 3;22(19):10725. doi: 10.3390/ijms221910725.
- A Multicenter, Randomized, Double-blind, Vehicle-controlled, Phase 3 Efficacy and Safety Study of Patidegib Topical Gel, 2%, for the Reduction of Disease Burden of Persistently Developing Basal Cell Carcinomas (BCCs) in Subjects With Basal Cell Nevus Syndrome. ClinicalTrials.gov : NCT03703310 (terminé). https://clinicaltrials.gov/study/NCT03703310?intr=patidegib%20&aggFilters=phase:3&rank=2
- A Multicenter, Randomized, Double Blind, Vehicle-controlled, Phase 3 Efficacy and Safety Study of Patidegib Gel 2% for the Reduction of Disease Burden of Persistently Developing Basal Cell Carcinomas (BCCs) in Subjects With Gorlin Syndrome. ClinicalTrials.gov : NCT06050122 (en cours de recrutement). https://clinicaltrials.gov/study/NCT06050122?intr=patidegib%20&aggFilters=phase:3&rank=1
- A Phase 3, Multicenter, Open-Label Extension Study of Patidegib Topical Gel, 2% in Subjects With Gorlin Syndrome (Basal Cell Nevus Syndrome). ClinicalTrials.gov : NCT04308395 (terminé). https://clinicaltrials.gov/study/NCT04308395?intr=patidegib%20&aggFilters=phase:3&rank=3
- Base de données GlobalData Healthcare (consultée en avril 2024; liste d’essais de phase II).
- Sava J. 2022. FDA Grants Breakthrough Therapy Designation to SNDX-5613 for R/R KMT2Ar Acute Leukemia. 6 décembre 2022. https://www.targetedonc.com/view/fda-grants-breakthrough-therapy-designation-to-sndx-5613-for-r-r-kmt2ar-acute-leukemia
- Base de données GlobalData Healthcare (consultée en avril 2024; liste d’essais de phase II).
- Mellinghoff IK, van den Bent MJ, Blumenthal DT, Touat M, Peters KB, et al.; INDIGO Trial Investigators. Vorasidenib in IDH1- or IDH2-Mutant Low-Grade Glioma. N Engl J Med. 2023 Aug 17;389(7):589-601. doi: 10.1056/NEJMoa2304194. Epub 2023 Jun 4.
- Corcept Therapeutics to Start Phase 3 Trial of Relacorilant Plus Nab-Paclitaxel in Patients With Platinum-Resistant Ovarian Cancer. Le 2 juin 2022. https://www.globenewswire.com/en/news-release/2022/06/06/2456669/0/en/Corcept-Therapeutics-to-Start-Phase-3-Trial-of-Relacorilant-Plus-Nab-Paclitaxel-in-Patients-With-Platinum-Resistant-Ovarian-Cancer.html
- A Phase 3, Multicenter, Randomized, Double-blind, Placebo-Controlled Study of AG-881 in Subjects With Residual or Recurrent Grade 2 Glioma With an IDH1 or IDH2 Mutation. ClinicalTrials.gov : NCT04164901 (actif, aucun recrutement). https://clinicaltrials.gov/study/NCT04164901?intr=Vorasidenib%20&aggFilters=phase:3&rank=1
- Base de données GlobalData Healthcare (consultée en avril 2024; liste d’essais de phase II).
- Apnimed, Inc. Communiqué de presse, 2023. Apnimed Announces First Patient Dosed in LunAIRo, the First Phase 3 Clinical Study of AD109, a Potential Nighttime Oral Treatment for Obstructive Sleep Apnea. 21 septembre 2023. https://apnimed.com/apnimed-apnimed-announces-first-patient-dosed-in-lunairo-the-first-phase-3-clinical-study-of-ad109-a-potential-nighttime-oral-treatment-for-obstructive-sleep-apnea/
- Rosenberg R, Abaluck B, Thein S. Combination of atomoxetine with the novel antimuscarinic aroxybutynin improves mild to moderate OSA. J Clin Sleep Med. 2022 Dec 1;18(12):2837-2844. doi: 10.5664/jcsm.10250.
- Schweitzer PK, Taranto-Montemurro L, Ojile JM, Thein SG, Drake CL, et al. The Combination of Aroxybutynin and Atomoxetine in the Treatment of Obstructive Sleep Apnea (MARIPOSA): A Randomized Controlled Trial.Am J Respir Crit Care Med. 2023 Dec 15;208(12):1316-1327. doi: 10.1164/rccm.202306-1036OC.
- Apnimed, Inc. Communiqué de presse, 2023. Apnimed Announces First Patient Dosed in LunAIRo, the First Phase 3 Clinical Study of AD109, a Potential Nighttime Oral Treatment for Obstructive Sleep Apnea. 21 septembre 2023. https://apnimed.com/apnimed-apnimed-announces-first-patient-dosed-in-lunairo-the-first-phase-3-clinical-study-of-ad109-a-potential-nighttime-oral-treatment-for-obstructive-sleep-apnea/
- Phase 3 Randomized Double-Blind Placebo-Controlled 1-year Parallel-Arm Study to Compare a Fixed Dose Combination of Aroxybutynin/Atomoxetine (AD109) to Placebo in Obstructive Sleep Apnea (LunAIRo Study). ClinicalTrials.gov : NCT05811247 (actif, aucun recrutement). https://www.clinicaltrials.gov/study/NCT05811247?intr=AD109&aggFilters=phase:3&rank=1
- Phase 3 Randomized Double-Blind Placebo-Controlled 6-month Parallel-Arm Study to Compare a Fixed Dose Combination of Aroxybutynin/Atomoxetine (AD109) to Placebo in Obstructive Sleep Apnea (SynAIRgy Study). ClinicalTrials.gov : NCT05813275 (en cours de recrutement). https://www.clinicaltrials.gov/study/NCT05813275?intr=AD109&aggFilters=phase:3&rank=2
- Base de données GlobalData Healthcare (consultée en avril 2024; liste d’essais de phase II).
- Gunsolley JC, Chalmers JD, Sibila O, Fernandez C, Scannapieco FA. Periodontal Effects of the Reversible Dipeptidyl Peptidase 1 Inhibitor Brensocatib in Bronchiectasis. JDR Clin Trans Res. 2023 Sep 25:23800844231196884. doi: 10.1177/23800844231196884. Publication en ligne avant impression.
- Chalmers JD, Haworth CS, Metersky ML, Loebinger MR, Blasi F, et al; WILLOW Investigators. Phase 2 Trial of the DPP-1 Inhibitor Brensocatib in Bronchiectasis. N Engl J Med. 2020 Nov 26;383(22):2127-2137. doi: 10.1056/NEJMoa2021713. Epub 2020 Sep 7.
- A Phase 3, Randomized, Double-Blind, Placebo-Controlled Study to Assess the Efficacy, Safety, and Tolerability of Brensocatib Administered Once Daily for 52 Weeks in Subjects With Non-Cystic Fibrosis Bronchiectasis - The ASPEN Study. ClinicalTrials.gov : NCT04594369 (actif, aucun recrutement). https://clinicaltrials.gov/study/NCT04594369?intr=Brensocatib&aggFilters=phase:3&rank=1
- A Randomised Double-blind Placebo-controlled Trial of Brensocatib (INS1007) in Patients With Severe COVID-19. ClinicalTrials.gov: NCT04817332 (terminé). https://clinicaltrials.gov/study/NCT04817332?intr=Brensocatib&aggFilters=phase:3&rank=2
- Base de données Healthcare de GlobalData (consultée en avril 2024; liste d’essais de phase II).
- Anthos Therapeutics. Communiqué de presse, 2024. First-Ever Cost-Effectiveness Analysis of a Factor XI Inhibitor Demonstrates that Abelacimab, if Approved, Could Offer Significant Cost Savings as Compared to a Current Standard of Care Anticoagulant. 6 mai 2024. https://anthostherapeutics.com/press-release/anthos_2024-08-15_release-16/
- A Multicenter, Randomized, Open-label, Blinded Endpoint Evaluation, Phase 3 Study Comparing the Effect of Abelacimab Relative to Apixaban on Venous Thromboembolism (VTE) Recurrence and Bleeding in Patients With Cancer Associated VTE. ClinicalTrials.gov: NCT05171049 (en cours de recrutement). https://clinicaltrials.gov/ct2/show/NCT05171049?term=Abelacimab&draw=2&rank=2
- A Multicenter, Randomized, Open-label, Blinded Endpoint Evaluation, Phase 3 Study Comparing the Effect of Abelacimab vs. Dalteparin on Venous Thromboembolism (VTE) Recurrence and Bleeding in Patients With GI/GU Associated VTE. ClinicalTrials.gov: NCT05171075 (en cours de recrutement). https://clinicaltrials.gov/ct2/show/NCT05171075?term=Abelacimab&draw=2&rank=3
- A Phase 3, Multicenter, Randomized, Double-blind, Placebo-controlled, Parallel-group Study to evaLuate the effIcacy and Safety of abeLacimab in High-risk Patients With Atrial Fibrillation Who Have Been Deemed Unsuitable for Oral antiCoagulation (LILAC-TIMI 76). ClinicalTrials.gov: NCT05712200 (en cours de recrutement). https://clinicaltrials.gov/study/NCT05712200?intr=Abelacimab&aggFilters=phase:3&rank=1
- Stambler BS, Camm AJ, Alings M, Dorian P, Heidbuchel H, et al; RAPID Investigators. Self-administered intranasal etripamil using a symptom-prompted, repeat-dose regimen for atrioventricular-nodal-dependent supraventricular tachycardia (RAPID): a multicentre, randomised trial. Lancet. 2023 Jul 8;402(10396):118-128. doi: 10.1016/S 0140-6736(23)00776-6. Epub 2023 Jun 15.
- Multi-Centre, Randomized, Double-Blind, Placebo-Controlled, Efficacy, and Safety Study of Etripamil Nasal Spray for the Termination of Spontaneous Episodes of Paroxysmal Supraventricular Tachycardia. NODE 301 Trial. ClinicalTrials.gov: NCT03464019 (terminé). https://clinicaltrials.gov/ct2/show/NCT03464019?term=Etripamil&phase=2&draw=2&rank=5
- The NODE-303 Study: Multi-Centre, Multi-National,Open Label, Safety Study of Etripamil Nasal Spray for Patients With Paroxysmal Supraventricular Tachycardia. ClinicalTrials.gov: NCT04072835 (terminé). https://clinicaltrials.gov/ct2/show/NCT04072835?term=Etripamil&phase=2&draw=2&rank=1
- Multi-Center, Randomized, Double-Blind, Placebo-Controlled, Efficacy and Safety Study of Etripamil Nasal Spray Self-Administration for the Termination of Spontaneous Episodes of Paroxysmal Supraventricular Tachycardia in Chinese Patients. ClinicalTrials.gov: NCT05410860 (en cours de recrutement). https://clinicaltrials.gov/ct2/show/NCT05410860?term=Etripamil&phase=2&draw=2&rank=3
- An Open Label Extension Study of Etripamil Nasal Spray in Patients With Paroxysmal Supraventricular Tachycardia. ClinicalTrials.gov : NCT04952610 (recrutement sur invitation). https://clinicaltrials.gov/ct2/show/NCT04952610?term=Etripamil&phase=2&draw=2&rank=2
- Iapoce C. 2023. Etripamil Nasal Spray Application Submitted to FDA for PSVT Treatment. 24 octobre 2023. https://www.hcplive.com/view/etripamil-nasal-spray-application-submitted-fda-psvt-treatment
- Rehman WU, Yarkoni M, Ilyas MA, Athar F, Javaid M, et al. Cholesteryl Ester Transfer Protein Inhibitors and Cardiovascular Outcomes: A Systematic Review and Meta-Analysis. J Cardiovasc Dev Dis. 2024 May 16;11(5):152. doi: 10.3390/jcdd11050152.
- A Placebo-Controlled, Double-Blind, Randomized, Phase 3 Study to Evaluate the Effect of 10 mg Obicetrapib in Participants With a History of HeFH Who Are Not Adequately Controlled by Their Lipid Modifying Therapies. ClinicalTrials.gov: NCT05425745 (actif, aucun recrutement). https://clinicaltrials.gov/ct2/show/NCT05425745?term=Obicetrapib&phase=2&draw=2&rank=1
- A Placebo-Controlled, Double-Blind, Randomized Phase 3 Study to Evaluate the Effect of 10mg Obicetrapib in Participants With HeFH and/or ASCVD Who Are Not Adequately Controlled by Their Lipid Modifying Therapies. ClinicalTrials.gov: NCT05142722 (actif, aucun recrutement). https://clinicaltrials.gov/ct2/show/NCT05142722?term=Obicetrapib&phase=2&draw=2&rank=2
- Placebo Controlled, Double Blind, Randomized Cardiovascular Outcome Study to Evaluate the Effect of 10 mg Obicetrapib in Participants With ASCVD Not Adequately Controlled Despite Maximally Tolerated Lipid Modifying Therapies. ClinicalTrials.gov: NCT05202509 (en cours de recrutement). https://clinicaltrials.gov/ct2/show/NCT05202509?term=Obicetrapib&phase=2&draw=2&rank=3
- A Placebo-Controlled, Double-Blind, Randomized, Phase 3 Study to Evaluate the Effect of Obicetrapib 10 mg and Ezetimibe 10 mg Fixed Dose Combination Daily on Top of Maximally Tolerated Lipid-Modifying Therapy in Participants With Heterozygous Familial Hypercholesterolemia (HeFH) and/or Atherosclerotic Cardiovascular Disease (ASCVD) or Multiple ASCVD Risk Factors. ClinicalTrials.gov: NCT06005597 (en cours de recrutement). https://clinicaltrials.gov/study/NCT06005597?intr=Obicetrapib&aggFilters=phase:3&rank=4
- A Placebo-controlled, Double-blind, Randomized, Phase 3 Study to Evaluate the Effect of Obicetrapib/Ezetimibe Fixed Dose Combination Daily on Coronary Plaque Characteristics in Participants With Atherosclerotic Cardiovascular Disease on Coronary CT Angiography (REMBRANDT Trial). ClinicalTrials.gov: NCT06305559 (recrutement non amorcé). https://clinicaltrials.gov/study/NCT06305559?intr=Obicetrapib&aggFilters=phase:3&rank=5
- A Multicenter, Randomized, Double-Blind, Placebo-Controlled, Parallel Group Study to Evaluate the Efficacy, Safety, and Tolerability of Soticlestat as Adjunctive Therapy in Pediatric and Young Adult Subjects With Dravet Syndrome (DS). ClinicalTrials.gov: NCT04940624 (terminé). https://clinicaltrials.gov/ct2/show/NCT04940624?term=Soticlestat&phase=2&draw=2&rank=2
- A Multicenter, Randomized, Double-Blind, Placebo-Controlled, Parallel Group Study to Evaluate the Efficacy, Safety, and Tolerability of Soticlestat as Adjunctive Therapy in Pediatric and Adult Subjects With Lennox-Gastaut Syndrome (LGS). ClinicalTrials.gov: NCT04938427 (terminé). https://clinicaltrials.gov/ct2/show/NCT04938427?term=Soticlestat&phase=2&draw=2&rank=3
- A Phase 3, Prospective, Open-Label, Multisite, Extension of Phase 3 Studies To Assess the Long-Term Safety and Tolerability of Soticlestat as Adjunctive Therapy in Subjects With Dravet Syndrome or Lennox-Gastaut Syndrome (ENDYMION 2). ClinicalTrials.gov: NCT05163314 (en cours de recrutement). https://clinicaltrials.gov/ct2/show/NCT05163314?term=Soticlestat&phase=2&draw=2&rank=1
- An Open-label, Nonrandomized, Phase 3 Study to Evaluate the Efficacy and Safety of Soticlestat in Participants With Dravet Syndrome or Lennox-Gastaut Syndrome Who Have Been Exposed to Fenfluramine. ClinicalTrials.gov: NCT06422377 (en cours de recrutement). https://clinicaltrials.gov/study/NCT06422377?intr=Soticlestat&aggFilters=phase:3&rank=1
- Meglio M. 2023. Latozinemab Shows No Impact on Disease Progression in C9orf72 Frontotemporal Dementia Despite increasing Progranulin Expression. 1er novembre 2023. https://www.neurologylive.com/view/latozinemab-shows-no-impact-disease-progression-c9orf72-frontotemporal-dementia-increasing-progranulin-expression
- A Phase 3, Multicenter, Randomized, Double Blind, Placebo Controlled Study to Evaluate the Efficacy and Safety of AL001 in Individuals at Risk for or With Frontotemporal Dementia Due to Heterozygous Mutations in the Progranulin Gene. ClinicalTrials.gov: NCT04374136 (actif, aucun recrutement). https://clinicaltrials.gov/ct2/show/NCT04374136?term=AL001&phase=2&draw=2&rank=1
- A Continuation Study of Latozinemab in Participants With Neurodegenerative Disease. ClinicalTrials.gov: NCT06111014 (recrutement sur invitation). https://www.clinicaltrials.gov/study/NCT06111014?intr=AL001&aggFilters=phase:3&rank=2
- Alector, Inc. Communiqué de presse. 2024. FDA Grants Latozinemab Breakthrough Therapy Designation for Frontotemporal Dementia Due to a Progranulin Gene Mutation (FTD-GRN). 7 février 2024. https://investors.alector.com/news-releases/news-release-details/fda-grants-latozinemab-breakthrough-therapy-designation
- A Phase 3, Multicenter, Randomized, Double-blind, Placebo-controlled Study of the Efficacy, Safety and Biomarker Effects of ALZ-801 in Subjects With Early Alzheimer's Disease and APOE4/4 Genotype. ClinicalTrials.gov: NCT04770220 (completed). https://clinicaltrials.gov/ct2/show/NCT04770220?term=NCT04770220&draw=2&rank=1
- Long-term Extension of a Phase 3, Multicenter, Randomized, Double-Blind, Placebo- Controlled Study of the Efficacy, Safety, and Biomarker Effects of ALZ-801 in Subjects With Early Alzheimer's Disease and APOE4/4 Genotype. ClinicalTrials.gov: NCT06304883 (recrutement sur invitation). https://clinicaltrials.gov/study/NCT06304883?intr=ALZ-801&aggFilters=phase:3&rank=1
- A Multi-Site Open-Label Safety Extension Study of Manualized MDMA-Assisted Psychotherapy for the Treatment of Participants With Posttraumatic Stress Disorder. ClinicalTrials.gov: NCT04714359 (terminé). https://clinicaltrials.gov/ct2/show/NCT04714359?term=NCT04714359&draw=2&rank=1.
- MDMA-assisted Massed Prolonged Exposure for PTSD. ClinicalTrials.gov: NCT06117306 (recrutement non amorcé). https://clinicaltrials.gov/study/NCT06117306?intr=Midomafetamine%20&aggFilters=phase:3&rank=4
- IISPT2: Examining 3,4-methylenedioxymethamphetamine (MDMA) Effects on Psychological, Relational and Hyperarousal-Related Neural Reactivity Mechanisms in Veterans With PTSD and MI. ClinicalTrials.gov: NCT06394284 (en cours de recrutement). https://clinicaltrials.gov/study/NCT06394284?intr=Midomafetamine%20&aggFilters=phase:3&rank=5
- Shinozuka K, Tabaac BJ, Arenas A, Beutler BD, Cherian K, et al. Psychedelic Therapy: A Primer for Primary Care Clinicians-3,4-Methylenedioxy-methamphetamine (MDMA). Am J Ther. 2024 Mar-Apr 01;31(2):e141-e154. doi: 10.1097/MJT.0000000000001722.
- Lykos Therapeutics Communiqué de presse. 2024. Lykos Therapeutics Announces FDA Acceptance and Priority Review of New Drug Application for MDMA-Assisted Therapy for PTSD. 9 février 2024. https://www.prnewswire.com/news-releases/lykos-therapeutics-announces-fda-acceptance-and-priority-review-of-new-drug-application-for-mdma-assisted-therapy-for-ptsd-302058901.html
- Formulary Watch. 2024. FDA Sets Date for Advisory Committee Meeting for Midomafetamine for PTSD. 8 mai 2024. https://www.formularywatch.com/view/fda-sets-date-for-advisory-committee-meeting-for-midomafetamine-for-ptsd
- NeuroDerm Ltd. Communiqué de presse. 2023. NeuroDerm Announces Highly Positive Results from the Pivotal Phase III BouNDless Trial Evaluating ND0612 in Parkinson's Disease Patients with Motor Fluctuations. 9 janvier 2023. https://www.prnewswire.com/news-releases/neuroderm-announces-highly-positive-results-from-the-pivotal-phase-iii-boundless-trial-evaluating-nd0612-in-parkinsons-disease-patients-with-motor-fluctuations-301715848.html
- Espay AJ, Stocchi F, Pahwa R, Albanese A, Ellenbogen A, et al; BouNDless Study Group. Safety and efficacy of continuous subcutaneous levodopa-carbidopa infusion (ND0612) for Parkinson's disease with motor fluctuations (BouNDless): a phase 3, randomised, double-blind, double-dummy, multicentre trial. Lancet Neurol. 2024 May;23(5):465-476. doi: 10.1016/S 1474-4422(24)00052-8. Epub 2024 Nov 15.
- A Multicenter, Randomized, Active-controlled, Double-blind, Double-dummy, Parallel Group Clinical Trial, Investigating the Efficacy, Safety, and Tolerability of Continuous Subcutaneous ND0612 Infusion in Comparison to Oral IR-LD/CD in Subjects With Parkinson's Disease Experiencing Motor Fluctuations (BouNDless). ClinicalTrials.gov: NCT04006210 (actif, aucun recrutement). https://clinicaltrials.gov/ct2/show/NCT04006210?term=NCT04006210&draw=2&rank=1.
- Hirschfield GM, Bowlus CL, Mayo MJ, Kremer AE, Vierling JM, et al; Groupe d’étude RESPONSE. A Phase 3 Trial of Seladelpar in Primary Biliary Cholangitis. N Engl J Med. 2024 Feb 29;390(9):783-794. doi: 10.1056/NEJMoa2312100. Epub 2024 Feb 21.
- A 52-week, Placebo-controlled, Randomized, Phase 3 Study to Evaluate the Safety and Efficacy of Seladelpar in Subjects With Primary Biliary Cholangitis (PBC) and an Inadequate Response to or an Intolerance to Ursodeoxycholic Acid (UDCA). ClinicalTrials.gov: NCT03602560 (terminé). https://clinicaltrials.gov/ct2/show/NCT03602560?term=Seladelpar&phase=2&draw=2&rank=2
- RESPONSE: A Placebo-controlled, Randomized, Phase 3 Study to Evaluate the Efficacy and Safety of Seladelpar in Patients With Primary Biliary Cholangitis (PBC) and an Inadequate Response to or an Intolerance to Ursodeoxycholic Acid (UDCA). ClinicalTrials.gov: NCT04620733 (terminé). https://clinicaltrials.gov/ct2/show/NCT04620733?term=Seladelpar&phase=2&draw=2&rank=3
- ASSURE: An Open Label Long-Term Study to Evaluate the Safety and Tolerability of Seladelpar in Subjects With Primary Biliary Cholangitis (PBC). ClinicalTrials.gov: NCT03301506 (en cours de recrutement). https://clinicaltrials.gov/ct2/show/NCT03301506?term=Seladelpar&phase=2&draw=2&rank=1
- CymaBay Therapeutics, Inc. Communiqué de presse, 2024. CymaBay Announces FDA Acceptance of NDA and Priority Review for Seladelpar for the Treatment of Primary Biliary Cholangitis. 12 février 2024. https://www.prnewswire.com/news-releases/cymabay-announces-fda-acceptance-of-nda-and-priority-review-for-seladelpar-for-the-treatment-of-primary-biliary-cholangitis-302059522.html
- A Parallel-group, Two-staged, Phase 2/3, Randomized, Multicenter Study to Evaluate the Efficacy and Safety of REC-2282 in Participants With Progressive NF2 Mutated Meningiomas. ClinicalTrials.gov: NCT05130866 (en cours de recrutement). https://clinicaltrials.gov/ct2/show/NCT05130866?term=REC-2282&draw=2&rank=1
- GSK to submit drug application for new antibiotic to US FDA. Le 4 novembre 2022. https://www.pmlive.com/pharma_news/gsk_to_submit_drug_application_for_new_antibiotic_to_us_fda_1480238
- The Pharmaceutical Journal. 2024. First-in-class antibiotic provides effective treatment for UTIs, trial results suggest. 14 février 2024. https://pharmaceutical-journal.com/article/news/first-in-class-antibiotic-provides-effective-treatment-for-utis-trial-results-suggest
- SERB Pharmaceuticals. News Release, 2024. FDA has accepted a BLA for bentracimab, the first and only ticagrelor reversal agent, for filing and priority review. August 2, 2024. https://finance.yahoo.com/news/fda-accepted-bla-bentracimab-first-123500872.html
- Young G, Srivastava A, Kavakli K, Ross C, Sathar J, et al. Efficacy and safety of fitusiran prophylaxis in people with haemophilia A or haemophilia B with inhibitors (ATLAS-INH): a multicentre, open-label, randomised phase 3 trial. Lancet. 2023 Apr 29;401(10386):1427-1437. doi: 10.1016/S0140-6736(23)00284-2. Epub 2023 Mar 29.
- Srivastava A, Rangarajan S, Kavakli K, Klamroth R, Kenet G, et al. Fitusiran prophylaxis in people with severe haemophilia A or haemophilia B without inhibitors (ATLAS-A/B): a multicentre, open-label, randomised, phase 3 trial. Lancet Haematol. 2023 May;10(5):e322-e332. doi: 10.1016/S 2352-3026(23)00037-6. Epub 2023 Mar 29.
- An Open-label, Long-term Safety and Efficacy Study of Fitusiran in Patients With Hemophilia A or B, With or Without Inhibitory Antibodies to Factor VIII or IX. ClinicalTrials.gov: NCT03754790 (actif, aucun recrutement). https://clinicaltrials.gov/ct2/show/NCT03754790?term=Fitusiran&phase=2&draw=2&rank=2
- ATLAS-PPX: an Open-label, Multinational, Switching Study to Describe the Efficacy and Safety of Fitusiran Prophylaxis in Patients With Hemophilia A and B Previously Receiving Factor or Bypassing Agent Prophylaxis. ClinicalTrials.gov: NCT03549871 (terminé). https://clinicaltrials.gov/study/NCT03549871?intr=fitusiran&aggFilters=phase:3&rank=5
- ATLAS-PEDS: An Open-label, Multinational Study of Fitusiran Prophylaxis in Male Pediatric Subjects Aged 1 to Less Than 12 Years With Hemophilia A or B. ClinicalTrials.gov: NCT03974113 (active not recruiting). https://clinicaltrials.gov/study/NCT03974113?intr=fitusiran&aggFilters=phase:3&rank=1
- Drugs.com. 2024. Ascendis Pharma Announces Extension of U.S. Food and Drug Administration Review Period for TransCon PTH for Adults with Hypoparathyroidism. 14 mai 2024. https://www.drugs.com/nda/transcon_pth_240514.html
- Craig TJ, Reshef A, Li HH, Jacobs JS, Bernstein JA, et al. Efficacy and safety of garadacimab, a factor XIIa inhibitor for hereditary angioedema prevention (VANGUARD): a global, multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2023 Apr 1;401(10382):1079-1090. doi: 10.1016/S0140-6736(23)00350-1. Epub 2023 Feb 28.
- A Multicenter, Double-blind, Randomized, Placebo-controlled, Parallel-arm Study to Investigate the Efficacy and Safety of Subcutaneous Administration of CSL312 (Garadacimab) in the Prophylactic Treatment of Hereditary Angioedema. ClinicalTrials.gov: NCT04656418 (terminé). https://clinicaltrials.gov/ct2/show/NCT04656418?term=Garadacimab&phase=2&draw=2&rank=1
- An Open-label Study to Evaluate the Long-term Safety and Efficacy of CSL312 (Garadacimab) in the Prophylactic Treatment of Hereditary Angioedema. ClinicalTrials.gov: NCT04739059 (actif, aucun recrutement). https://clinicaltrials.gov/ct2/show/NCT04739059?term=Garadacimab&phase=2&draw=2&rank=2
- Communiqué de presse CSL. 2023. CSL's Garadacimab, a First-in-Class Factor XIIa Inhibitor, Receives FDA and EMA Filing Acceptance. 14 décembre 2023. https://www.prnewswire.com/news-releases/csls-garadacimab-a-first-in-class-factor-xiia-inhibitor-receives-fda-and-ema-filing-acceptance-302016048.html#xd_co_f=NzVlYzk3NGEtZjE5OS00OGNmLTllYmQtOGE3Mzk1MTI4YzAw~
- Santé Canada. Présentations de médicaments et de produits de santé en cours d’examen (PCE) : Présentations de drogues en cours d’examen. https://www.canada.ca/fr/sante-canada/services/examen-et-approbation-medicaments-et-produit-sante/presentations-cours-examen/presentations-drogues-cours-examen.html
- Global Antibiotic Research & Development Partnership (GARDP) News. 2023. Positive results announced in largest pivotal phase 3 trial of a first-in-class oral antibiotic to treat uncomplicated gonorrhoea. 1er novembre 2023. https://gardp.org/positive-results-announced-in-largest-pivotal-phase-3-trial-of-a-first-in-class-oral-antibiotic-to-treat-uncomplicated-gonorrhoea/
- Gertz MA, Cohen AD, Comenzo RL, Kastritis E, Landau HJ, et al. Birtamimab plus standard of care in light-chain amyloidosis: the phase 3 randomized placebo-controlled VITAL trial. Blood. 2023 Oct 5;142(14):1208-1218. doi: 10.1182/blood.2022019406
- A Phase 3, Randomized, Multicenter, Double-Blind, Placebo-Controlled, Efficacy and Safety Study of Birtamimab Plus Standard of Care vs. Placebo Plus Standard of Care in Mayo Stage IV Subjects With Light Chain (AL) Amyloidosis. ClinicalTrials.gov: NCT04973137 (en cours de recrutement). https://clinicaltrials.gov/ct2/show/NCT04973137?term=NCT04973137&draw=2&rank=1
- Wainberg ZA, Kang YK, Lee KW, Qin S, Yamaguchi K, et al. Bemarituzumab as first-line treatment for locally advanced or metastatic gastric/gastroesophageal junction adenocarcinoma: final analysis of the randomized phase 2 FIGHT trial.Gastric Cancer. 2024 May;27(3):558-570. doi: 10.1007/s10120-024-01466-w. Epub 2024 Feb 3.
- A Phase 1b/3 Study of Bemarituzumab Plus Chemotherapy and Nivolumab Versus Chemotherapy and Nivolumab Alone in Subjects With Previously Untreated Advanced Gastric and Gastroesophageal Junction Cancer With FGFR2b Overexpression. ClinicalTrials.gov: NCT05111626 (en cours de recrutement). https://clinicaltrials.gov/ct2/show/NCT05111626?term=Bemarituzumab&phase=2&draw=2&rank=1
- A Randomized, Multi-center, Double-blind, Placebo-controlled Phase 3 Study of Bemarituzumab Plus Chemotherapy Versus Placebo Plus Chemotherapy in Subjects With Previously Untreated Advanced Gastric or Gastroesophageal Junction Cancer With FGFR2b Overexpression. ClinicalTrials.gov: NCT05052801 (en cours de recrutement). https://clinicaltrials.gov/ct2/show/NCT05052801?term=Bemarituzumab&phase=2&draw=2&rank=2
- A Randomized, Double-Blind, Placebo-Controlled, Phase 3 Study Of Navitoclax In Combination With Ruxolitinib Versus Ruxolitinib In Subjects With Myelofibrosis (TRANSFORM-1). ClinicalTrials.gov: NCT04472598 (actif, aucun recrutement). https://clinicaltrials.gov/ct2/show/NCT04472598?term=Navitoclax&phase=2&draw=2&rank=1
- A Randomized, Open-Label, Phase 3 Study Evaluating Efficacy and Safety of Navitoclax in Combination With Ruxolitinib Versus Best Available Therapy in Subjects With Relapsed/Refractory Myelofibrosis (TRANSFORM-2). ClinicalTrials.gov: NCT04468984 (actif, aucun recrutement). https://clinicaltrials.gov/ct2/show/NCT04468984?term=Navitoclax&phase=2&draw=2&rank=2
- Kremyanskaya M(1), Kuykendall AT(1), Pemmaraju N(1), Ritchie EK(1), Gotlib J(1), et al; REVIVE Trial Investigators. Rusfertide, a Hepcidin Mimetic, for Control of Erythrocytosis in Polycythemia Vera. N Engl J Med. 2024 Feb 22;390(8):723-735. doi: 10.1056/NEJMoa2308809.
- A Phase 3 Study of the Hepcidin Mimetic Rusfertide (PTG-300) in Patients With Polycythemia Vera. ClinicalTrials.gov: NCT05210790 (en cours de recrutement). https://clinicaltrials.gov/ct2/show/NCT05210790?term=Rusfertide&draw=2&rank=1
- Soligenix, Inc. Communiqué de presse 2023. Soligenix Receives Refusal to File Letter from U.S. FDA for HyBryte™ New Drug Application in the Treatment of Cutaneous T-Cell Lymphoma. 14 février 2023. https://ir.soligenix.com/2023-02-14-Soligenix-Receives-Refusal-to-File-Letter-from-U-S-FDA-for-HyBryte-TM-New-Drug-Application-in-the-Treatment-of-Cutaneous-T-Cell-Lymphoma
- Soligenix, Inc. Communiqué de presse. 2023. Soligenix Announces Scheduling of Type A Meeting with the U.S. FDA to Review Proposed Study Design for a Second Phase 3 Study Evaluating HyBryte™ in the Treatment of Cutaneous T-Cell Lymphoma, 11 mai 2023. https://ir.soligenix.com/2023-05-11-Soligenix-Announces-Scheduling-of-Type-A-Meeting-with-the-U-S-FDA-to-Review-Proposed-Study-Design-for-a-Second-Phase-3-Study-Evaluating-HyBryte-TM-in-the-Treatment-of-Cutaneous-T-Cell-Lymphoma
- Soligenix, Inc. Communiqué de presse. 2023. HyBryte™ Expanded Treatment Trial in Cutaneous T-Cell Lymphoma Opens Enrollment. 10 août 2023. https://ir.soligenix.com/2023-08-10-HyBryte-TM-Expanded-Treatment-Trial-in-Cutaneous-T-Cell-Lymphoma-Opens-Enrollment
- Astellas Pharma Inc. Nouvelles. 2024. Astellas’ VYLOY™ (zolbetuximab) Approved in Japan for Treatment of Gastric Cancer. 26 mars 2024. https://www.astellas.com/en/news/29026
- Conroy R. 2024. FDA Issues CRL for Zolbetuximab in Advanced CLDN18.2+ Gastric Cancer. 9 janvier 2024. https://www.cancernetwork.com/view/fda-issues-crl-for-zolbetuximab-in-advanced-cldn18-2-gastric-cancer
- Carelli V(1)(2), Newman NJ(3)(4)(5), Yu-Wai-Man P(6)(7)(8)(9), Biousse V(3)(4)(5),; the LHON Study Group. Indirect Comparison of Lenadogene Nolparvovec Gene Therapy Versus Natural History in Patients with Leber Hereditary Optic Neuropathy Carrying the m.11778G>A MT-ND4 Mutation. Ophthalmol Ther. 2023 Feb;12(1):401-429. doi: 10.1007/s 40123-022-00611-x. Epub 2022 Nov 30.
- Long-term Follow-up of ND4 LHON Subjects Treated With GS010 Ocular Gene Therapy in the RESCUE or REVERSE Phase III Clinical Trials (RESTORE). ClinicalTrials.gov: NCT03406104 (terminé). https://clinicaltrials.gov/study/NCT03406104?intr=Lenadogene%20nolparvovec%20&aggFilters=phase:3&rank=1
- Randomized, Double-Masked, Sham-Controlled Clinical Trial to Evaluate the Efficacy of a Single Intravitreal Injection of GS010 in Subjects Affected for More Than 6 Months and To 12 Months by LHON Due to the G11778A Mutation in the ND4 Gene. ClinicalTrials.gov: NCT02652780 (terminé). https://clinicaltrials.gov/study/NCT02652780?intr=Lenadogene%20nolparvovec%20&aggFilters=phase:3&rank=3
- A Randomized, Double-Masked, Sham-Controlled Clinical Trial to Evaluate the Efficacy of a Single Intravitreal Injection of GS010 in Subjects Affected for 6 Months or Less by LHON Due to the G11778A Mutation in the Mitochondrial ND4 Gene. ClinicalTrials.gov: NCT02652767 (terminé). https://clinicaltrials.gov/study/NCT02652767?intr=Lenadogene%20nolparvovec%20&aggFilters=phase:3&rank=4
- Efficacy and Safety of Bilateral Intravitreal Injection of GS010: A Randomized, Double-Masked, Placebo-Controlled Trial in Subjects Affected With G11778A ND4 Leber Hereditary Optic Neuropathy for Up to One Year. ClinicalTrials.gov: NCT03293524 (actif, aucun recrutement). https://clinicaltrials.gov/study/NCT03293524?intr=Lenadogene%20nolparvovec%20&aggFilters=phase:3&rank=2
- Tryvio (aprocitentan). Lettre d’approbation de la FDA: https://www.accessdata.fda.gov/drugsatfda_docs/appletter/2024/217686Orig1s000Correctedltr.pdf
- Winrevair (sotatercept). Lettre d’approbation de la FDA : https://www.accessdata.fda.gov/drugsatfda_docs/appletter/2024/761363Orig1s000ltr.pdf
- Vyjuvek (bérémagène géperpavec). Lettre d’approbation de la FDA : https://www.fda.gov/media/168356/download?attachment
- REBYOTA (microbiote fécal, live-jslm). Lettre d’approbation de la FDA : https://www.fda.gov/media/163586/download
- Rezdiffra (resmetirom). Lettre d’approbation de la FDA : https://www.accessdata.fda.gov/drugsatfda_docs/appletter/2024/217785Orig1s000ltr.pdf
- Communiqué de presse de la FDA. 2023. FDA Approves First Gene Therapy for Treatment of Certain Patients with Duchenne Muscular Dystrophy. 22 juin 2023. https://www.fda.gov/news-events/press-announcements/fda-approves-first-gene-therapy-treatment-certain-patients-duchenne-muscular-dystrophy
- Voydeya (danicopan). Lettre d’approbation de la FDA : https://www.accessdata.fda.gov/drugsatfda_docs/appletter/2024/218037Orig1s000ltr.pdf
- Santé Canada. Présentations de médicaments et de produits de santé en cours d’examen (PCE) : Présentations de drogues en cours d’examen. https://www.canada.ca/fr/sante-canada/services/examen-et-approbation-medicaments-et-produit-sante/presentations-cours-examen/presentations-drogues-cours-examen.html
- BEQVEZ (fidanacogène élaparvovec). Lettre d’approbation de la FDA. https://www.fda.gov/media/178139/download?attachment
- Communiqué de presse de la FDA. 2023. FDA approves omidubicel to reduce time to neutrophil recovery and infection in patients with hematologic malignancies. 17 avril 2023. https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-omidubicel-reduce-time-neutrophil-recovery-and-infection-patients-hematologic
- Lantidra (donislecel). Lettre d’approbation de la FDA : https://www.fda.gov/media/169921/download?attachment
- AWIQLI (insuline icodec). Santé Canada. Recherche de produits pharmaceutiques en ligne Accessible à l’adresse suivante : https://health-products.canada.ca/dpd-bdpp/?lang=fre
- Elfabrio (pégunigalsidase alfa). Lettre d’approbation de la FDA : https://www.accessdata.fda.gov/drugsatfda_docs/appletter/2023/761161Orig1s000ltr.pdf
- Elfabrio (pégunigalsidase alfa). Agence européenne des médicaments (EMA). https://www.ema.europa.eu/en/medicines/human/EPAR/elfabrio
- RYTELO (imételstat sodique). Lettre d’approbation de la FDA : https://www.accessdata.fda.gov/drugsatfda_docs/appletter/2024/217779Orig1s000ltr.pdf
- Izervay (avacincaptad pégol sodique). Lettre d’approbation de la FDA : https://www.accessdata.fda.gov/drugsatfda_docs/appletter/2023/217225Orig1s000ltr.pdf
- Veozah (fézolinétant). Lettre d’approbation de la FDA : https://www.accessdata.fda.gov/drugsatfda_docs/appletter/2023/216578Orig1s000ltr.pdf
- Veozah (fézolinétant). Agence européenne des médicaments (EMA). https://www.ema.europa.eu/en/medicines/human/EPAR/veoza
- De SK. Leniolisib: a novel treatment for activated phosphoinositide-3 kinase delta syndrome. Front Pharmacol. 2024 Feb 12;15:1337436. doi: 10.3389/fphar.2024.1337436. eCollection 2024.
- Joenja (leniolisib). Lettre d’approbation de la FDA : https://www.accessdata.fda.gov/drugsatfda_docs/appletter/2023/217759Orig1s000ltr.pdf
- Rao VK, Kulm E, Šedivá A, Plebani A, Schuetz C, et al. Interim analysis: Open-label extension study of leniolisib for patients with APDS. J Allergy Clin Immunol. 2024 Jan;153(1):265-274.e9. doi: 10.1016/j.jaci.2023.09.032. Epub 2023 Oct 4.
- Base de données Healthcare de GlobalData (consultée le 3 avril 2024; liste de la phase II).
- Bobonich M, Gorelick J, Aldredge L, Bruno MJ, DiRuggiero D, et al. Tapinarof, a Novel, First-in-Class, Topical Therapeutic Aryl Hydrocarbon Receptor Agonist for the Management of Psoriasis. J Drugs Dermatol. 2023 Aug 1;22(8):779-784. doi: 10.36849/jdd.7317.
- VTAMA (tapinarof ). Lettre d’approbation de la FDA : https://www.accessdata.fda.gov/drugsatfda_docs/appletter/2022/215272Orig1s000ltr.pdf
- Armstrong AW, McConaha JL. Tapinarof cream 1% once daily for the treatment of adults with mild to severe plaque psoriasis: A novel topical therapy targeting the aryl hydrocarbon receptor. J Manag Care Spec Pharm. 2023 Dec;29(12-a Suppl):S1-S13. doi: 10.18553/jmcp.2023.29.12-a.s1.
- FDA approves avapritinib for advanced systemic Mastocytosis. 16 juin 2021. https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-avapritinib-advanced-systemic-mastocytosis
- AYVAKIT (avapritinib). Agence européenne des médicaments. https://www.ema.europa.eu/en/medicines/human/EPAR/ayvakyt
- Gotlib J, Castells M, Elberink HO, Siebenhaar F, Hartmann K, et al. Avapritinib versus Placebo in Indolent Systemic Mastocytosis. NEJM Evid. 2023 Jun;2(6):EVIDoa2200339. doi: 10.1056/EVIDoa2200339. Epub 2023 May 23.
- Base de données Healthcare de GlobalData (consultée le 3 avril 2024; liste de la phase II).
- Bruzzese A, Labanca C, Martino EA, Mendicino F, et al. Ivosidenib in acute myeloid leukemia. Expert Opin Pharmacother. 2023 Sep-Dec;24(18):2093-2100. doi: 10.1080/14656566.2023.2272659. Epub 2024 Jan 5.
- La FDA approuve l’ivosidenib en association avec l’azacitidine pour la leucémie myéloïde aiguë nouvellement diagnostiquée. 1er août 2022. https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-ivosidenib-combination-azacitidine-newly-diagnosed-acute-myeloid-leukemia
- TIBSOVO (ivosidenib). Agence européenne des médicaments. https://www.ema.europa.eu/en/medicines/human/EPAR/tibsovo
- Bruzzese A, Labanca C, Martino EA, Mendicino F, et al. Ivosidenib in acute myeloid leukemia. Expert Opin Pharmacother. 2023 Sep-Dec;24(18):2093-2100. doi: 10.1080/14656566.2023.2272659. Epub 2024 Jan 5.
- Helwick C. Study Examines Real-World Outcomes With Ivosidenib vs Venetoclax in Acute Myeloid Leukemia. 2023. https://ascopost.com/issues/digital-supplement-ash-meeting-highlights-2023/study-examines-real-world-outcomes-with-ivosidenib-vs-venetoclax-in-acute-myeloid-leukemia/
- GSK plc. Ojjaara (momelotinib) approved in the US as the first and only treatment indicated for myelofibrosis patients with anaemia. 15 septembre 2023. https://www.gsk.com/en-gb/media/press-releases/ojjaara-momelotinib-approved-in-the-us-as-the-first-and-only-treatment-indicated-for-myelofibrosis-patients-with-anaemia/
- OJJAARA (momélotinib). Agence européenne des médicaments. https://www.ema.europa.eu/en/medicines/human/EPAR/omjjara
- Bruzzese A, Martino EA, Labanca C, Mendicino F, Lucia E, et al. Momelotinib in myelofibrosis. Expert Opin Pharmacother. 2024 Apr;25(5):521-528. doi: 10.1080/14656566.2024.2343780. Epub 2024 Apr 18.
- GSK. Communiqué de presse, 2024. GSK Canada’s submission for momelotinib for the treatment of myelofibrosis accepted for review by Health Canada. 30 janvier 2024. https://ca.gsk.com/en-ca/media/press-releases/gsk-canada-s-submission-for-momelotinib-for-the-treatment-of-myelofibrosis-accepted-for-review-by-health-canada/
- Gupta V, Oh S, Devos T, Dubruille V, Catalano J, et al. Momelotinib vs. ruxolitinib in myelofibrosis patient subgroups by baseline hemoglobin levels in the SIMPLIFY-1 trial. Leuk Lymphoma. 2024 Mar 19:1-13. doi: 10.1080/10428194.2024.2328800. Publication en ligne avant impression.
- Chifotides HT, Bose P, Verstovsek S. Momelotinib: an emerging treatment for myelofibrosis patients with anemia. J Hematol Oncol. 2022 Jan 19;15(1):7. doi: 10.1186/s 13045-021-01157-4.
- MIEBO (perfluorohexyloctane). Lettre d’approbation de la FDA : https://www.accessdata.fda.gov/drugsatfda_docs/appletter/2023/216675Orig1s000ltr.pdf
- Sheppard JD, Evans DG, Protzko EE. A review of the first anti-evaporative prescription treatment for dry eye disease: perfluorohexyloctane ophthalmic solution.Am J Manag Care. 2023 Nov;29(14 Suppl):S251-S259. doi: 10.37765/ajmc.2023.89464.