Exportation de médicaments aux pays en développement et les moins avancés : Régime canadien d'accès aux médicaments
le 6 décembre 2006
Avis
Notre référence: 06-127652-79
Publication de la ligne directrice Le Régime canadien d'accès aux médicaments : processus de demande pour l'exportation de médicaments aux pays en développement et aux pays les moins avancés
Cette ligne directrice vise à fournir des consignes aux fabricants qui soumettent une demande à la Direction des produits thérapeutiques (DPT) concernant un médicament breveté destiné à l'exportation vers les pays en développement et les pays les moins avancés en vertu du Régime canadien d'accès aux médicaments (RCAM). Il présente la façon dont la DPT gère l'information et la documentation soumises par les promoteurs conformément au Règlement modifiant le Règlement sur les aliments et drogues (RAD) (1402 - drogues pour des pays en développement).
Dans le contexte de l'examen du RCAM par le gouvernement du Canada, annoncé le 24 novembre 2006, les commentaires sur cette ligne directrice sont les bienvenus. Cette dernière sera modifiée le cas échéant dans le cadre de l'examen législatif en cours. On peut obtenir davantage d'information sur l'examen du RCAM à www.rcam.gc.ca.
Veuillez faire parvenir vos questions et vos commentaires à :
Bureau des politiques, sciences et programmes internationaux
Direction des produits thérapeutiques
Santé Canada
Tel: (613) 946-9491
Fax: (613) 941-1812
Courriel: bpsip_info_bpspi@hc-sc.gc.ca
Ligne directrice
Le Régime canadien d'accès aux médicaments : Processus de demande pour l'exportation de médicaments aux pays en développement et aux pays les moins avancés
Publication autorisée par le
ministre de la Santé
Date d'adoption : 2006/12/06
pDate d'entrée en vigueur : 2006/12/06
Direction générale des produits de santé et des aliments
Notre mission est d'aider les Canadiens et les Canadiennes à maintenir et à améliorer leur état de santé.
Santé Canada
Le mandat de la DGPSA est d'adopter une approche intégrée à la gestion des risques et des avantages pour la santé liés aux produits de santé et aux aliments :
- en réduisant les facteurs de risque pour la santé des Canadiens et Canadiennes tout en maximisant la protection offerte par le système réglementaire des produits de santé et des aliments; et
- en favorisant des conditions qui permettent aux Canadiens et Canadiennes de faire des choix sains ainsi qu'en leur donnant des renseignements afin qu'ils ou qu'elles puissent prendre des décisions éclairées en ce qui a trait à leur santé.
Direction générale des produits de santé et des aliments
© Ministre de Travaux publics et Services gouvernementaux Canada 2006
Also available in English under the following title: Canada's Access to Medicines Regime: Application Process for Drugs for Export to Developing and Least Developed Countries
L'avant-propos
Les lignes directrices sont destinées à guider l'industrie et les professionnels de la santé de la façon de se conformer aux lois et aux règlements en vigueur. Les lignes directrices fournissent également aux membres du personnel des renseignements concernant la façon de mettre en oeuvre le mandat et les objectifs de Santé Canada de manière juste, uniforme et efficace.
Les lignes directrices sont des outils administratifs n'ayant pas force de loi, ce qui permet une certaine souplesse d'approche. Les principes et les pratiques énoncés dans le présent document pourraient être remplacés par d'autres approches, à condition que celles-ci s'appuient sur une justification adéquate. Il faut tout d'abord discuter d'autres approches avec le programme concerné pour s'assurer qu'elles respectent les exigences des lois et des règlements applicables.
Corollairement à ce qui précède, il importe également de mentionner que Santé Canada se réserve le droit de demander des renseignements ou du matériel supplémentaire, ou de définir des conditions dont il n'est pas explicitement question dans la ligne directrice afin que le Ministère puisse être en mesure d'évaluer adéquatement l'innocuité, l'efficacité ou la qualité d'un produit thérapeutique donné. Santé Canada s'engage à justifier de telles demandes et à documenter clairement ses décisions.
Le présent document devrait être lu en parallèle avec l'avis d'accompagnement et les sections pertinentes des autres lignes directrices qui s'appliquent.
Table des matières
- 1. Introduction
- 2. Conseils sur la mise en oeuvre
- 2.1 Rôles et responsabilités
- 2.2 Définitions
- 2.3 Procédures de dépôt
- 2.4 Information préalable à la soumission de la présentation
- 2.5 Processus relatif aux présentations nationales
- 2.6 Processus relatif aux demandes en vertu du titre 7
- 2.7 Dernière étape
- 2.8 Remise des droits
- 2.9 Renouvellement d'une autorisation prévue à l'article 21.04 de la Loi sur les brevets
- 2.10 Demandes subséquentes relatives aux autres produits, pays et quantités
- 2.11 Le produit ne répond plus aux exigences de la loi sur les aliments et drogues et de son règlement
- Annexe A : Attestation de la demande en vertu du titre 7
- Annexe B : Processus et critères d'évaluation de la différence significative de couleur
- Annexe C : Diagramme du processus du rcam au sein de la DPT
1. Introduction
1.1 Objectifs de la politique
Le présent document fournit une orientation aux fabricants désireux de soumettre une demande à la Direction des produits thérapeutiques (DPT) concernant un médicament breveté destiné à l'exportation vers les pays en développement et les pays les moins avancés en vertu du Régime canadien d'accès aux médicaments (RCAM). Il présente la façon dont la DPT gère l'information et la documentation soumises aux promoteurs conformément au Règlement modifiant le Règlement sur les aliments et drogues (RAD) (1402 - drogues pour des pays en développement).
1.2 Énoncé de politique
Les médicaments exportés vers les pays les moins développés et les pays en développement en vertu du Régime canadien d'accès aux médicaments respecteront les mêmes normes rigoureuses en matière d'innocuité, d'efficacité et de qualité que ceux destinés à la population canadienne.
1.3 Portée et application
Les présentes lignes directrices traitent du processus de demande en usage au sein de la DPT relativement aux médicaments admissibles aux termes du RCAM et qui sont énumérés à l'annexe 1 de la Loi sur les brevets. Elles ne visent pas les instruments médicaux et les thérapies biologiques.
1.4 Contexte
Le 14 mai 2005, entraient en vigueur La loi modifiant la Loi sur les brevets et la Loi sur les aliments et drogues (engagement de Jean Chrétien envers l'Afrique), anciennement le projet de loi C-9, de même que son règlement connexe. Le projet de loi a été déposé afin de faciliter aux pays les moins développées et aux pays en développement l'accès en temps opportun à des médicaments génériques aux prix abordables basés sur les produits pharmaceutiques brevetés.
Ce cadre juridique modifiait la Loi sur les brevetsNote de bas de page 1 et la Loi sur les aliments et drogues en vigueur au Canada dans le but de mettre en oeuvre une décision de l'Organisation mondiale du commerce (OMC) datant du 30 août 2003 qui consistait à renoncer à certaines obligations énoncées dans les accords sur les aspects des droits de propriété intellectuelle qui touchent au commerce (ADPIC).Note de bas de page 2
Les modifications apportées à la Loi sur les aliments et drogues permettent d'assurer que les produits pharmaceutiques exportés en vertu du RCAM respectent les mêmes normes rigoureuses en matière d'innocuité, d'efficacité et de qualité que ceux vendus au Canada. Par conséquent, les produits exportés en application du RCAM doivent satisfaire aux exigences de la Loi sur les aliments et drogues et de son Règlement, ce qui implique l'examen des présentations en fonction des normes canadiennes relatives à l'innocuité, à l'efficacité et à la qualité. Un examen supplémentaire est entrepris conformément au nouveau titre 7 du RAD en vue de veiller à ce que le produit puisse se distinguer de la version brevetée disponible sur le marché canadien tel que l'exige la décision prise le 30 août 2003 par le Conseil général de l'Organisation mondiale du commerce.
2. Conseils sur la mise en oeuvre
2.1 Rôles et responsabilités
Direction des produits thérapeutiques (DPT) :
La DPT est investie des mêmes rôles et responsabilités concernant l'examen des produits thérapeutiques visés par le Régime canadien d'accès aux médicaments qu'envers les produits thérapeutiques équivalents destinés au marché intérieur. Les produits pharmaceutiques visés par ce régime doivent toujours répondre aux normes canadiennes et les fabricants sont tenus de respecter les bonnes pratiques de fabrication.
2.2 Définitions
Autorisation prévue à l'article 21.04 de la Loi sur les brevets : Il s'agit de l'autorisation d'utiliser une invention brevetée accordée par le commissaire aux brevets de l'Office de la propriété intellectuelle du Canada (OPIC) aux termes de l'article 21.04 de la Loi sur les brevets. Cette autorisation est souvent appelée « licence obligatoire ».
Suspension liée à l'OPIC : Aux termes de l'article 21.04 de la Loi sur les brevets, les fabricants doivent déposer une demande auprès du commissaire aux brevets de l'Office de la propriété intellectuelle du Canada (OPIC). Il s'agit d'une étape du processus du RCAM. Le fabricant doit envoyer une copie de cette demande à la DPT. Lorsque la demande en vertu du titre 7 (voir la définition ci-dessous) a été étudiée par la DPT et jugée acceptable à tout autre égard, elle peut faire l'objet d'une retenue administrative appelée suspension liée à l'OPIC jusqu'à ce que la DPT reçoive une copie de la demande envoyée à l'OPIC par le fabricant.
Demande en vertu du titre 7 : Cette demande est soumise par un fabricant à la Direction des produits thérapeutiques en vue d'obtenir l'autorisation de vendre un médicament aux termes du titre 7 du RAD (tel que l'énonce l'article C.07.003).Cette étape du processus vise les médicaments brevetés destinés à l'exportation et doit comprendre les documents et données servant à démontrerles différences dans le marquage et l'étiquetage des produits pour exportation dans le but de se conformer à l'article C.07.008 du RAD. Il importe de présenter une demande en vertu du titre 7 pour chaque pays concerné par l'exportation.
Suspension d'une demande en vertu du titre 7 : La demande en vertu du titre 7 fait référence à la présentation intérieure (définie ci-dessous). Par conséquent, si cette dernière n'a pas été recommandée pour approbation au moment de l'achèvement de l'examen des renseignements contenus dans la demande en vertu du titre 7, celle-ci fera l'objet d'une suspension jusqu'à ce que la recommandation finale pour la présentation intérieure soit complétée.
Présentation intérieure : La présentation/demande décrite aux alinéas C.07.003 b) et c) du RAD qui pourrait être l'un des éléments suivants :
Présentation de drogue nouvelle (PDN),
Supplément à une présentation de drogue nouvelle (SPDN),
Présentation abrégée de drogue nouvelle (PADN),
Supplément à une présentation de drogue nouvelle (SPADN)
Demande de numéro d'identification du médicament (DDIN)
La présentation intérieure respectera le processus et les délais précisés dans la Ligne directrice sur la gestion des présentations de drogues (LDGPD). Si la présentation de drogue nouvelle respecte le RAD, le produit recevra un avis de conformité (AC) ayant satisfait les exigences obligatoires du Règlement sur les médicaments brevetés (avis de conformité). Entre-temps, la présentation fera l'objet d'une suspension pour des motifs relatifs au brevet. Si la demande de DIN respecte le RAD, un numéro d'identification du médicament (DIN) sera émis.
XCL : Ce sigle réfère au terme anglais eXport under Compulsory Licence (exportation en vertu d'une licence obligatoire). Il doit être inscrit de façon permanente sur les produits de forme posologique solide ainsi que sur l'étiquette de tout produit destiné à l'exportation aux termes du RCAM.
Numéro de suivi d'exportation : Il s'agit d'un code alphanumérique émis par la DPT pour chaque produit approuvé à la suite d'une demande en vertu du titre 7 et imprimé sur l'étiquette du produit à exporter. Le code comprend le sigle XCL, sept chiffres et un code de pays formé de deux lettres.
2.3 Procédures de dépôt
2.3.1 Exemples de dépôt
Pour présenter une demande en vue de vendre et d'exporter un médicament aux termes du Régime canadien d'accès aux médicaments, il importe de se conformer aux deux composantes distinctes suivantes :
- la présentation intérieure;
- la demande en vertu du titre 7.
Ces deux composantes doivent intégrer des données, formulaires et délais distincts. La première doit comprendre tous les renseignements requis en vue d'obtenir l'autorisation de commercialiser le médicament au Canada et doit respecter le processus normal et les délais applicables pour ce type de présentation/demande (définis dans la LDGPD). La seconde doit comprendre les documents et les données indiquant les différences dans le marquage et l'étiquetage du produit à exporter dans le but de se conformer à l'article C.07.008 du Règlement sur les aliments et drogues. Enfin, des numéros de présentation distincts seront assignés à chaque composante.
Une demande en vertu du titre 7 peut être déposée en même temps que la présentation intérieure, au cours de la période d'examen de cette dernière ou après la fin de cet examen.
Veuillez vous référer au point 9 pour obtenir de l'information au sujet des exigences relatives au dépôt pour le renouvellement d'une autorisation aux termes de l'article 21.04 de la Loi sur les brevets et des demandes subséquentes pour d'autres produits, quantités et pays.
2.3.2 Exigences relatives aux présentations intérieures
La présentation intérieure pour une drogue nouvelle doit respecter les articles C.08.002, C.08.002.1 ou C.08.003, selon le cas, ainsi que l'article C.08.005.1 du RAD et suivre la ligne directrice Préparation de présentations de drogue nouvelle dans le format du CTD. La présentation intérieure pour une drogue qui n'est pas nouvelle doit se conformer à l'article C.01.014.1 et suivre la ligne directrice Présentation des demandes d'identification numérique de drogue. Les exigences ne diffèrent pas de celles relatives aux présentations ou demandes normales. Étant donné que le processus d'établissement du statut de bonnes pratiques de fabrication (BPF) peut être prolongé, les promoteurs doivent s'assurer que le respect des BPF a été établi pour les sites d'établissement de drogues avant de faire une présentation.
2.3.3 Exigences relatives aux demandes en vertu du titre 7
Les éléments qui suivent doivent être fournis dans la demande en vertu du titre 7. Veuillez prendre note que tous doivent être fournis en deux exemplaires, à l'exception des données décrites au point 6b pour lesquelles une seule copie suffit :
- une lettre d'accompagnement comprenant une déclaration attestant que le fabricant a présenté une demande au commissaire aux brevets aux termes de l'article 21.04 de la Loi sur les brevets, ou qu'il a l'intention de le faire;
- un formulaire d'attestation de la demande en vertu du titre 7 (annexe A);
- le formulaire de présentation de médicament (HC-SC3011);
- le numéro de présentation et la date du dépôt de la présentation intérieure, si elle a déjà été déposée;
- le numéro d'identification du médicament (DIN) de la présentation intérieure, si un tel numéro a été octroyé;
- pour un médicament de forme posologique solide,
- une description de la méthode suivie pour que le médicament porte de façon permanente la marque XCL conformément à l'alinéa C.07.008a) du RAD et pour que sa couleur soit nettement différente de celle de la version vendue au Canada selon l'alinéa C.07.008b);
- des données appuyant une modification de la couleur ou du marquage relativement au produit visé par la présentation intérieure doivent être soumises tel que le présente la ligne directrice Modifications de la couleur ou du marquage d'un produit. Ces données doivent être fournies selon le format établi dans la ligne directrice;
- des preuves doivent être présentées pour montrer que la couleur du produit destiné à l'exportation diffère nettement de celle de la version vendue au Canada. Par exemple, les promoteurs peuvent soumettre des échantillons des deux produits ou une photo couleur les montrant clairement l'un à côté de l'autre afin de permettre de déterminer si la couleur est nettement différente ou non. La photo devrait montrer le produit selon sa taille réelle ou agrandie. L'annexe B présente une description des critères et du processus qui serviront à l'évaluation de la différence significative de couleur. Si une telle évaluation ne peut se faire à l'aide d'une photo, des échantillons des produits peuvent être exigés et doivent être présentés dans les sept jours civils suivant la demande;
- une description de la méthode suivie pour que le médicament porte de façon permanente la marque XCL conformément à l'alinéa C.07.008a) du RAD et pour que sa couleur soit nettement différente de celle de la version vendue au Canada selon l'alinéa C.07.008b);
- pour un médicament dans une forme posologique non solide, une description de la manière dont le récipient immédiat porte de façon permanente la marque XCL aux termes de l'alinéa C.07.008a);
- un échantillon de l'étiquette du médicament marquée de façon permanente du sigle XCL en lettres majuscules suivi d'un endroit où inscrire le numéro de suivi d'exportation et des mots « POUR EXPORTATION AUX TERMES DE LA DÉCISION DU CONSEIL GÉNÉRAL. VENTE INTERDITE AU CANADA. » ou « FOR EXPORT UNDER THE GENERAL COUNCIL DECISION. NOT FOR SALE IN CANADA. » en lettes majuscules. Tous ces renseignements doivent figurer sur la partie principale de l'étiquette. Étant donné qu'aucun numéro d'identification du médicament (DIN) ne sera émis pour les produits destinés à l'exportation, il n'est pas nécessaire de réserver un espace sur l'étiquette pour l'y inscrire.
Une demande d'autorisation conformément à l'article 21.04 de la Loi sur les brevets est déposée par le fabricant auprès du commissaire aux brevets. Le fabricant est tenu de fournir une copie de cette demande à la DPT. La copie peut être envoyée à la suite du dépôt de la demande en vertu du titre 7, mais la DPT doit disposer de la copie de la demande avant qu'elle puisse aviser le commissaire aux brevets, tel que le prévoit l'article C.07.004 du RAD, du fait que le médicament du fabricant répond aux exigences de la Loi sur les aliments et drogues et de son Règlement. Pour de plus amples informations concernant le processus de demande auprès du commissaire aux brevets dans le but d'obtenir une autorisation aux termes de l'article 21.04 de la Loi sur les brevets, veuillez vous référer au site Web de l'OPIC.
2.4 Information préalable à la soumission de la présentation
2.4.1 Rencontre préalable à la soumission de la présentation/demande
Il est fortement conseillé aux promoteurs de tenir, avec la DPT, une rencontre préalable à la soumission de la présentation avant de déposer une présentation ou une demande conformément au RCAM. Les présentations intérieures et les demandes en vertu du titre 7 peuvent y faire l'objet de discussions. La LDGPD présente le processus et les exigences pour ce type de rencontre.
2.5 Processus relatif aux présentations intérieures
2.5.1 Processus et échéanciers relatifs aux présentations/demandes
La présentation intérieure respectera le processus et les délais précisés dans la LDGPD. L'annexe C contient un diagramme décrivant le processus du RCAM au sein de la DPT.
2.5.2 Traitement
La présentation intérieure sera traitée selon les procédures normales précisées dans la LDGPD.
2.5.3 Examen préliminaire
La présentation intérieure sera examinée en fonction du processus normal précisé dans la LDGPD. Dans le cas où elle serait reçue conjointement avec une demande en vertu du titre 7, l'objectif de rendement normal en matière d'examen préliminaire (habituellement 45 jours) lui sera assigné, mais elle sera traitée selon une liste d'attente du RCAM différente en ce qui concerne l'examen préliminaire. Par conséquent, ce dernier sera effectué sans délai.
2.5.4 Examen
La présentation intérieure sera examinée en fonction du processus normal précisé dans la LDGPD. Une fois associée avec une demande en vertu du titre 7, elle conservera l'objectif de rendement normal en matière d'examen (habituellement 180 jours pour une PADN et 300 pour une PDN), mais sera traitée selon une liste d'attente du RCAM différente en ce qui concerne l'examen, ce qui signifie que ce dernier sera effectué sans délai. Toutefois, si la demande en vertu du titre 7 est jugée non satisfaisante à la suite de l'examen ou si elle est annulée par le fabricant, la présentation intérieure connexe reprendra sa position initiale dans la liste d'attente régulière.
2.6 Processus relatif aux demandes en vertu du titre 7
2.6.1 Processus et échéanciers relatifs aux demandes
L'évaluation de l'information contenue dans la demande en vertu du titre 7 se verra attribuer une seule norme de rendement de 60 jours civils, qui comprendra les fonctions d'examen préliminaire et d'examen. La décision finale pour une telle demande dépend cependant du caractère admissible de la présentation intérieure et de sa conformité à la Loi sur les aliments et drogues et à son Règlement. Ainsi, une fois complété l'examen de la demande en vertu du titre 7 et celle-ci jugée admissible, il se peut qu'elle fasse l'objet d'une suspension jusqu'à ce qu'il soit déterminé que la présentation intérieure respecte la Loi sur les aliments et drogues et son Règlement.
Dans le cas où la présentation intérieure correspondante se verrait attribuer une demande de clarification (clarifax) ou une décision défavorable non définitive (avis d'insuffisance lors de l'examen préliminaire, avis d'insuffisance, avis de non conformité), l'examen de la demande en vertu du titre 7 se poursuivra sans tarder.
Dans le cas où la présentation intérieure correspondante est annulée par le fabricant ou se voit attribuer une décision défavorable définitive (rejet à l'examen préliminaire, retrait à la suite d'un avis d'insuffisance ou retrait à la suite d'un avis de non conformité selon la LDGPD), la demande en vertu du titre 7 sera jugée non satisfaisante, et un avis de non-satisfaction sera délivré au fabricant.
L'annexe C présente un diagramme de processus décrivant le processus du RCAM au sein de la DPT.
2.6.2 Traitement
Un numéro de présentation distinct sera assigné à chaque demande en vertu du titre 7 et une lettre d'accusé de réception sera transmise au fabricant.
2.6.3 Examen préliminaire/examen
Les fonctions d'examen préliminaire et d'examen seront conjuguées pour les demandes en vertu du titre 7 et traitées selon une liste d'attente du RCAM différente. Il se peut qu'une demande de clarification par télécopieur, dotée d'un temps de réponse de 15 jours civils, soit émise au fabricant en vue d'obtenir des renseignements supplémentaires au cours du processus d'examen.
2.7 Dernière étape
2.7.1 Dernière étape de la présentation intérieure
Une fois l'examen de la présentation intérieure achevé et la recommandation finale émise pour fins d'approbation, la présentation sera suspendue pour des motifs relatifs au brevet par le Bureau des médicaments brevetés et liaison (BMBL), au besoin. Un DIN sera créé pour le produit visé par une présentation intérieure, mais ne sera pas signifié au fabricant tant que cette dernière fera l'objet d'une suspension.
2.7.2 Dernière étape de la demande en vertu du titre 7
À la suite de la recommandation pour approbation finale de la proposition intérieure, la suspension de la demande en vertu du titre 7 sera retirée, s'il y a lieu.
Si le fabriquant n'a pas transmis une copie de la demande d'autorisation prévue à l'article 21.04 de la Loi sur les brevets, la demande en vertu du titre 7 fera l'objet d'une suspension liée à l'OPIC jusqu'à ce qu'à l'obtention d'une telle copie.
Une fois la demande en vertu du titre 7 recommandée pour approbation, un numéro de suivi d'exportation sera attribué au produit faisant l'objet d'une demande. Aucun DIN différent ne sera émis pour le produit destiné à l'exportation. Le Directeur général de la DPT transmettra une lettre au commissaire aux brevets (OPIC) ainsi qu'au fabricant sous forme d' Avis au commissaire aux brevets pour les besoins de l'alinéa 21.04 (3)b) de la Loi sur les brevets, indiquant que la drogue répond aux exigences de la Loi sur les aliments et drogues et de son Règlement. Une copie du formulaire d'obtention d'un numéro de suivi d'exportation accompagnera la lettre.
Lorsque la demande en vertu du titre 7 n'est pas recommandée pour approbation en raison de lacunes dans la demande ou d'une décision défavorable définitive relativement à la présentation intérieure correspondante (rejet à l'examen préliminaire, retrait à la suite d'un avis d'insuffisance ou retrait à la suite d'un avis de non conformité selon la LDGPD), le Directeur général de la DPT transmettra une lettre au commissaire aux brevets (OPIC) ainsi qu'au fabricant indiquant que la drogue ne répond pas aux exigences de la Loi sur les aliments et drogues et de son Règlement.
2.7.3 Délivrance de l'autorisation prévue à l'article 21.04 de la Loi sur les brevets par l'Office de la propriété intellectuelle du Canada (OPIC)
En vertu de l'article C.07.005 du RAD, le fabriquant ne peut vendre la drogue que si les conditions suivantes sont réunies :
- la DPT a avisé le commissaire aux brevets que la drogue satisfait aux exigences de la Loi et du Règlement;
- le fabricant a reçu l'autorisation prévue à l'article 21.04 de la Loi sur les brevets.
2.8 Remise des droits
2.8.1 Remise des droits
Les droits généralement associés à l'examen d'une présentation intérieure seront versés au fabricant par la DPT à la suite de l'approbation du Conseil du Trésor. Pour être admissible à la remise, le promoteur doit transmettre à la DPT une copie de l'autorisation prévue à l'article 21.04 de la Loi sur les brevets et lui présenter une demande de remise :
- dans les 45 jours suivant la délivrance, par l'OPIC, de l'autorisation prévue à l'article 21.04 de la Loi sur les brevets;
ou - dans le cas d'un supplément à une présentation de drogue nouvelle ou d'un supplément à une présentation abrégée de drogue nouvelle, dans les 45 jours suivant la délivrance de l'avis énonçant que l'examen du supplément est achevé.
Aucun droit n'est associé à l'évaluation d'une demande en vertu du titre 7 par la DPT.
2.9 Renouvellement d'une autorisation prévue à l'article 21.04 de la Loi sur les brevets
2.9.1 Renouvellement d'une autorisation prévue à l'article 21.04 de la Loi sur les brevets
Une autorisation prévue à l'article 21.04 de la Loi sur les brevets est octroyée pour une période de deux ans, pour une quantité précise de drogue qui sera exportée vers un pays particulier. En vertu de l'article 21.12 de la Loi sur les brevets, le commissaire aux brevets renouvelle l'autorisation si le demandeur certifie sous serment dans la demande que la quantité visée par l'autorisation n'a pas été exportée en totalité au moment de la cessation de validité de celle-ci. L'autorisation ne peut être renouvelée qu'une seule fois jusqu'à concurrence de deux années supplémentaires, et la demande de renouvellement doit être faite au cours des trente jours précédant la cessation de validité de l'autorisation.
Aucune demande ne doit être faite auprès de la DPT, et aucun nouveau numéro de suivi d'exportation ne sera émis. La DPT surveillera cependant le processus de renouvellement et veillera à ce que les renseignements contenus dans la base de données sur les numéros de suivi d'exportation soient exacts relativement à la date d'expiration de l'autorisation.
2.10 Demandes subséquentes relatives aux autres produits, pays et quantités
Une demande distincte en vertu du titre 7 est nécessaire pour chaque produit (notamment les différentes formes posologiques et concentrations), chaque pays de destination de même que pour une quantité maximale précisée pour chaque produit pharmaceutique qui sera exporté en vertu de l'autorisation. La quantité et le pays font partie de la demande d'autorisation prévue à l'article 21.04 de la Loi sur les brevets qui sera présentée à l'OPIC.
Des demandes subséquentes en vertu du titre 7 peuvent être déposées alors que d'autres demandes antérieures de ce genre font l'objet d'un examen ou une fois leur examen achevé. La demande en vertu du titre 7 peut être déposée avant ou après le dépôt de la demande d'autorisation prévue à l'article 21.04 de la Loi sur les brevets auprès du commissaire aux brevets.
2.10.1 Produits additionnels
Lorsqu'une autorisation prévue à l'article 21.04 de la Loi sur les brevets est demandée pour un produit additionnel, une présentation intérieure et une demande en vertu du titre 7 doivent être déposées et examinées afin d'assurer que le nouveau produit se conforme au RAD. Dans le cas où la présentation intérieure pour le nouveau produit a déjà fait l'objet d'un examen, la demande en vertu du titre 7 peut faire mention de cette présentation à titre de renvoi. Un nouveau numéro de suivi d'exportation sera émis, et le Directeur général de la DPT avisera le commissaire aux brevets (OPIC) et le fabricant du fait que le produit respecte les exigences du RAD.
2.10.2 Nouveau contrat pour le même produit et le même pays (c.-à-d. nouvelle quantité)
Il faut présenter une nouvelle demande en vertu du titre 7. La lettre d'accompagnement de cette demande doit référencer la présentation intérieure appropriée (et comprendre le numéro de la présentation), le numéro de présentation des demandes antérieures en vertu du titre 7 ainsi que leur statut, et doit préciser si les renseignements contenus dans la demande subséquente en vertu du titre 7 sont les mêmes que ceux contenus dans les demandes antérieures. Toute différence doit être clairement indiquée, et le contenu identique peut faire l'objet d'un renvoi vers des demandes déjà acceptées.
2.10.3 Nouveau contrat pour une quantité d'un même produit destiné à un nouveau pays
Il faut présenter une nouvelle demande en vertu du titre 7. La lettre d'accompagnement de cette demande doit référencerla présentation intérieure appropriée (et comprendre le numéro de la présentation), le numéro de présentation des demandes antérieures en vertu du titre 7 ainsi que leur statut, et doit préciser si les renseignements contenus dans la demande subséquente en vertu du titre 7 sont les mêmes que ceux contenus dans les demandes antérieures. Toute différence doit être clairement indiquée, et le contenu identique peut faire l'objet d'un renvoi vers des demandes déjà acceptées.
2.11 Le produit ne répond plus aux exigences de la loi sur les aliments et drogues et de son règlement
2.11.1 Avis au commissaire aux brevets
Lorsqu'une drogue dont la vente est autorisée en vertu du processus du RCAM est jugée ne plus répondre aux exigences de la Loi sur les aliments et drogues et de son Règlement, le Directeur général transmettra une lettre au commissaire aux brevets (OPIC) et au fabricant sous forme d' Avis au commissaire aux brevets indiquant que la drogue ne répond plus aux exigences de la Loi sur les aliments et drogues et de son Règlement.
Annexe A : Attestation de la demande en vertu du titre 7
Formulaire d'attestation de la demande en vertu du titre 7
Nous attestons que, à notre connaissance, dans le cadre de la demande relative au produit (nom du produit) présentée par (nom du fabricant)
- Tous les renseignements et éléments matériels contenus dans la présente demande, ainsi que tous les renseignements sollicités sont exacts et complets, et tous les documents récapitulatifs représentent fidèlement les renseignements et éléments matériels auxquels ils font référence dans la demande. Aucun renseignement n'est faux ou trompeur, ou ne comporte des omissions qui peuvent avoir une incidence sur son exactitude et son intégralité.
- Tous les aspects du produit représenté dans la présente demande et destiné à l'exportation en vertu du Régime canadien d'accès aux médicaments sont identiques à ceux décrits dans la présentation intérieure pour (nom du produit), (numéro de contrôle, si connu), présentée à la DPT le (date), y compris l'étiquetage, les sites et les procédés de fabrication, l'emballage et les essais, à l'exception des situations suivantes :
- pour un produit de forme posologique solide, la marque et la couleur du produit doivent être modifiées en vertu de l'article C.07.008 du Règlement sur les aliments et drogues;
- pour un produit de forme posologique non solide, l'étiquette du récipient immédiat doit être modifiée en vertu de l'article C.07.008;
- pour tous les produits, l'étiquetage doit être modifié en vertu de l'article C.07.008.
- Toute modification du produit à la suite de l'obtention d'une autorisation prévue à l'article 21.04 de la Loi sur les brevets doit être effectuée conformément à la politique Modifications aux drogues nouvelles sur le marché de Santé Canada. La politique indique notamment de déposer la demande appropriée (p. ex. supplément à une présentation de drogue nouvelle, modification nécessitant un préavis), s'il y a lieu, et de conserver les documents justificatifs appropriés.
Premier dirigeant au Canada :
Date :
Médecin hygiéniste en chef/Agent scientifique supérieur :
Date :
Annexe B : Processus et critères d'évaluation de la différence significative de couleur
Les couleurs pures qui constituent une teinte ou une nuance perceptible (p. ex. rouge, orange, jaune, vert, bleu, violet, blanc, noir, gris, brun) seront jugées nettement différentes. Par exemple, le rouge sera jugé nettement différent du jaune, et le jaune nettement différent du blanc.
Les teintes pures mélangées avec d'autres couleurs peuvent être considérablement différentes si aucune des couleursmélangées sont semblables. Par exemple, le rouge-orange sera jugé différent du bleu-vert; cependant, il pourrait ne pas être jugé suffisament différent du jaune-orange.
Les différentes luminosités ou pâleurs d'une même teinte (p. ex. bleu clair par rapport à bleu foncé, ou rouge par rapport à rose) pourrait ne pas êtrejugées suffisament différentes.
Lorsqu'il n'est pas évident que la couleur proposée d'un produit sous forme solide est acceptable, un comité d'examen des couleurs sera convoqué pour une évaluation. Cette décision sera prise en fonction de ce que la plupart des gens, de manière raisonnable, jugent être une couleur suffisament différente.
Cette évaluation, visant à déterminer si une forme posologique solide présentée conjointement à une demande en vertu du titre 7 est de couleur nettement différente de la version de la drogue vendue au Canada, sera effectuée au début de la période d'examen préliminaire/examen étant donné que le défaut de répondre à cette exigence entraînera une décision de non-satisfaction pour la demande en vertu du titre 7.
Annexe C : Diagramme du processus du rcam au sein de la DPT
L'examen de la présentation intérieure est achevé, et celle-ci est suspendue pour des motifs relatifs au brevet au moment du dépot de la demande en vertu du titre 7 :
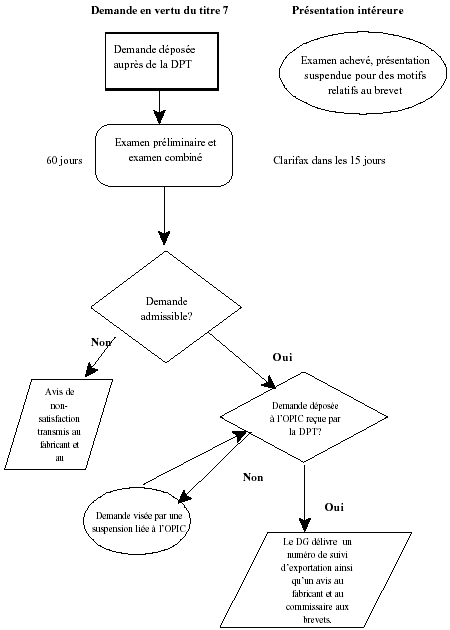
L'examen de la présentation intérieure est achevé, et celle-ci est suspendue pour des motifs relatifs au brevet au moment du dépot de la demande en vertu du titre 7 - Description textuel
Demande en vertu du titre 7 :
Demande déposée auprès de la direction des produits thérapeutique (DPT). Examen préliminaire et examen combiné, 60 jours, clarifax dans les 15 jours. Demande admissible? Non, avis de non-satisfaction transmis an fabricant et au commissaire aux brevets. Oui, demande déposée à l’Office de la propriété intellectuelle du Canada (l’OPIC) reçu par la DPT? Non, demande visée par une suspension liée à l’OPIC. Oui, le directeur générale délivré un numéro de suivi d’exportation ainsi q’un avis au fabricant et au commissaire aux brevets.
Présentation intéreure :
Examen achevé, présentation suspendue pour des motifs relatifs au brevet.
La présentation intérieure est déposée au même moment que la demande en vertu du titre 7
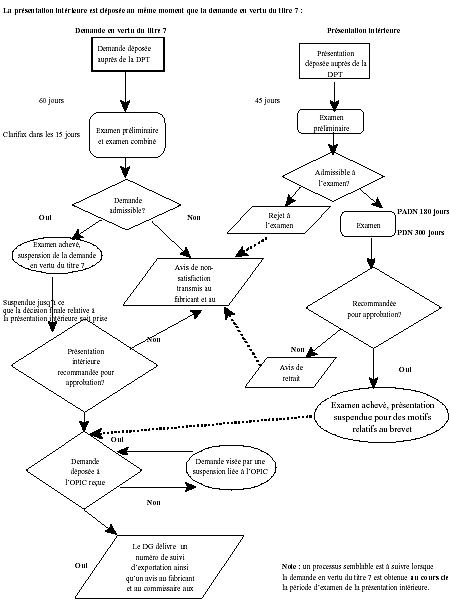
Notes de bas de page
La présentation intérieure est déposée au même moment que la demande en vertu du titre 7 - Description textuel
Demande en vertu du titre?
Demande déposé aupré de la direction des produits thérapeutique (DPT). Examen préliminaire et examen combiné, 60 jours, clarifax dans les 15 jours. Demande admissible? Non, avis de non-satisfaction transmis au fabricant et au commissaire aux brevets. Oui, examen achevé, suspension de la demande en vertu du titre 7. Suspendue jusq’à ce que la décision finale relative à la présentation intérieure soit prise. Présentation intérieure recommandée pour approbation? Non, avis de non-satisfaction transmis au fabricant et au commissaire aux brevets. Oui, demande déposée à l’Office de la propriété intellectuelle du Canada (l’OPIC) reçu. Non, demande visé par une suspension liée à l’OPIC. Oui, le directeur générale délivre un numéro de suivi d’exportation ainsi qu’un avis au fabricant et au commissaire aux brevets.
Présentation intérieure :
Présentation déposée auprès de la direction des produits thérapeutique (DPT). Examen préliminarie, 45 jours. Admissible à l’examen? Non, rejet à l’examen, avis de non-satisfaction transmis au fabricant et au commissaire aux brevets. Oui, examen, Présentation abrégée de drogue nouvelle (PADN) 180 jours, présentation de drogue nouvelle (PDN) 300 jours. Recommandée pour approbation? Non, avis de retrait. Oui, examen achevé, présentation suspendue pour des motifs relatifs au brevet.
Note : un processus semblable est à suivre lorsque la demande en vertu du titre 7 est obtenue au cours de la période d’examen de la présentation intérieure.
Notes de bas de page
- Note de bas de page 1
-
Article 21 de la Loi sur les brevets
- Note de bas de page 2
-
Le 6 décembre 2005, les membres de l'OMC ont approuvé les changements apportés à l'accord sur la propriété intellectuelle officialisant de façon permanente une décision sur les brevets et la santé publique adoptée à l'origine en 2003. Par cette décision, la renonciation du 30 août 2003 devient une modification permanente des accords sur les ADPIC.