Analyse approfondie: maladie respiratoire humaine associée à la grippe aviaire A(H5N6)
Table de matières
- Risque pour le Canada
- Contexte
- Renseignements virologiques
- Les infections animales et les détections environnementales
- Expositions
- Épidémiologie mondial
- Évolution clinique
- Mesures de santé publique
- Liens et ressources
- Références
Huit (8) cas humains de grippe aviaire A(H5N6), tous originaires de Chine, ont été signalés en janvier 2022. En incluant ces cas, à l'échelle mondiale, 66 cas humains de la grippe A(H5N6) ont été signalés depuis 2014 (dont 29 mortels). Pour de plus amples renseignements, veuillez consulter ci-dessous.
Risque pour le Canada
L'objectif de cette analyse approfondie est de résumer les renseignements actuellement disponibles sur l'épidémiologie de l'infection humaine par la grippe aviaire A(H5N6) [A(H5N6)].
De 2014 au 1er février 2022, 66 cas humains ont été signalés en République populaire de Chine (Chine) et en République démocratique populaire du Laos (Laos) depuis l'émergence de la grippe aviaire A(H5N6) dans la population humaine. Aucun cas de grippe aviaire A(H5N6) n'a été signalé chez les résidents canadiens. Bien que les renseignements actuellement disponibles laissent entendre que ce virus ne peut pas être transmis facilement entre humains, on s'attend à ce que d'autres cas humains sporadiques de grippe aviaire A(H5N6) soient signalés dans les régions où la grippe aviaire A(H5N6) continue de circuler chez les oiseaux sauvages et domestiques.
Plusieurs institutions, dont l'Organisation mondiale de la Santé (OMS), les Centers for Disease Control and Prevention (CDC) des États-Unis [à l'aide de l'outil d'évaluation des risques liés à l'influenza (outil)] et le Royaume-Uni, ont réalisé des évaluations des risques liés à la grippe aviaire A(H5N6). Aucune évaluation des risques liés à la grippe aviaire A(H5N6) n'a été réalisée pour le Canada.
Les lignes directrices sur les grippes aviaires comme la grippe aviaire A(H5N6), notamment le formulaire de déclaration des cas d'infections respiratoires aiguës sévères (IRAS) de l'Agence de la santé publique du Canada (ASPC), les directives des laboratoires pour les enquêtes concernant les IRAS, les directives sur l'épidémiologie pour les enquêtes concernant les IRAS, les directives sur la biosécurité pour les sous-types H5, H7 et H9 du virus de la grippe, les directives sur la surveillance de la grippe aviaire chez les humains [propre au virus A(H7N9), mais pouvant être appliqué au virus A(H5N6)] et le guide « Préparation du Canada en cas de grippe pandémique », sont disponibles en ligne.
Contexte
Les virus de la grippe aviaire peuvent toucher plusieurs espèces d'oiseaux domestiques ou sauvages. Ils sont classés en deux catégories : faiblement pathogènes (GAFP) ou hautement pathogènes (GAHP), selon leur pouvoir pathogène. Au cours des deux (2) dernières décennies, les virus de la grippe aviaire sont devenus enzootiques dans les populations de volailles domestiques de nombreux pays asiatiques Note de bas de page 1. Aujourd'hui, la Chine est reconnue comme un point chaud pour l'émergence, la transmission et la propagation des virus de la grippe aviaire en raison de leur persistance généralisée, de la nature et de la croissance de l'industrie de la production de volailles, du commerce de volailles vivantes et du mélange des espèces hôtes sur les marchés d'oiseaux vivants Note de bas de page 2Note de bas de page 3Note de bas de page 4.
La grippe aviaire A(H5N6) est un virus de la GAHP qui peut provoquer une maladie grave et entraîner des taux de mortalité élevés chez les volailles infectées Note de bas de page 3. Des flambées de cas de A(H5N6) ont été signalées chez des oiseaux au Laos, en Chine et au Vietnam avant la déclaration du premier cas humain en Chine en 2014 Note de bas de page 5. Les cas humains de A(H5N6) ont continué à être signalés depuis et on a enregistré une augmentation marquée des détections en 2021 [figure 1]. Bien qu'il soit possible que cette augmentation coïncide avec le renforcement des systèmes de surveillance et de diagnostic découlant de la pandémie de COVID-19, d'autres facteurs comme la propagation des virus de la grippe aviaire dans les populations de volailles jouent probablement aussi un rôle dans l'augmentation du nombre de cas Note de bas de page 6.
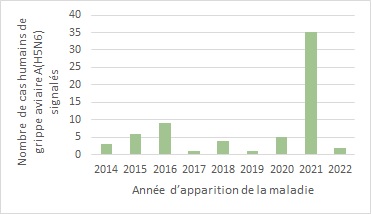
Figure 1 - Équivalent textuel
| Année d'apparition de la maladie | Nombre de cas humains de grippe aviaire A(H5N6) signalés |
|---|---|
| 2014 | 3 |
| 2015 | 6 |
| 2016 | 9 |
| 2017 | 1 |
| 2018 | 4 |
| 2019 | 1 |
| 2020 | 5 |
| 2021 | 35 |
| 2022 | 2 |
Remarque : Les données sur l'apparition de la maladie n'étaient pas disponibles pour trois (3) cas; pour ces cas, les données sur la date du signalement ont été utilisées pour créer cette figure. Les cas inclus dans cette figure sont les cas signalés jusqu'au 31 janvier 2022. Source : Outil international de surveillance et d'évaluation du Centre de l'immunisation et des maladies respiratoires infectieuses (CIMRI).
Il est essentiel d'approfondir la compréhension de l'épidémiologie humaine et animale de cette maladie pour caractériser le risque d'émergence de ce nouveau virus de la grippe et de son impact sur la santé humaine. Cette analyse approfondie est basée sur une analyse de la littérature publiée, complétée par une recherche sélective de documents officiels publiés par certaines organisations telles que l'OMS, les CDC des États-Unis, le Centre de protection de la santé de Hong Kong et l'Organisation mondiale de la santé animale (OIE). Les données tirées de ces sources ont été recueillies, vérifiées, enregistrées dans l'outil international de surveillance et d'évaluation et nettoyées afin de réaliser des analyses épidémiologiques sur les cas humains de A(H5N6) signalés à l'échelle mondiale.
Renseignements virologiques
La grippe aviaire A(H5N6) est un variant du virus de la GAHP A(H5) appartenant au nouveau clade 2.3.4.4 Note de bas de page 7Note de bas de page 8. L'analyse génétique des cas isolés de grippe aviaire et des isolats humains de 2014 à 2021 confirme que ce virus est un virus de la grippe aviaire réassorti dont l'hémagglutinine (HA) provient des virus A(H5) du clade 2.3.4.4 et de la neuraminidase (NA) des virus H5N6, H6N6, H3N6 ou H10N6. Les gènes internes proviennent soit des virus A(H5) du clade 2.3.4.4, soit des virus A(H5) du clade 2.3.2.1, soit des virus H3N2, H3N8, H4N2, H6N6, H7N9 et H9N2 [figure 2] Note de bas de page 7Note de bas de page 8Note de bas de page 9Note de bas de page 10Note de bas de page 11Note de bas de page 12Note de bas de page 13Note de bas de page 14Note de bas de page 15Note de bas de page 16Note de bas de page 17Note de bas de page 18Note de bas de page 19Note de bas de page 20Note de bas de page 21. Les espèces sources des gènes de ces isolats humains comprennent le poulet, l'oie, le cygne, le canard, le goéland et l'homme Note de bas de page 16Note de bas de page 17Note de bas de page 18Note de bas de page 19Note de bas de page 20Note de bas de page 21. Tous les virus A(H5N6) séquencés à partir de cas humains en Chine dont la date d'apparition de la maladie était postérieure à février 2021 (et antérieure au 29 novembre 2021) appartenaient au clade génétique 2.3.4.4b, bien qu'une séquence virale obtenue plus tôt dans l'année appartenait à un clade différent qui avait été couramment détecté chez les oiseaux jusqu'à cette date Note de bas de page 6.
Les analyses des signatures génétiques des isolats de A(H5N6) indiquent une liaison préférentielle aux récepteurs de type aviaire Note de bas de page 3Note de bas de page 4Note de bas de page 9Note de bas de page 22. Néanmoins, certaines séquences indiquent également des associations avec des adaptations de mammifères, telles qu'une liaison accrue avec les récepteurs cellulaires humains Note de bas de page 3Note de bas de page 4Note de bas de page 6Note de bas de page 9Note de bas de page 22. La diversité des virus de la grippe aviaire circulant en Chine, ainsi que l'interaction continue entre les espèces hôtes, permet un réassortiment continu de ces virus [figure 2].
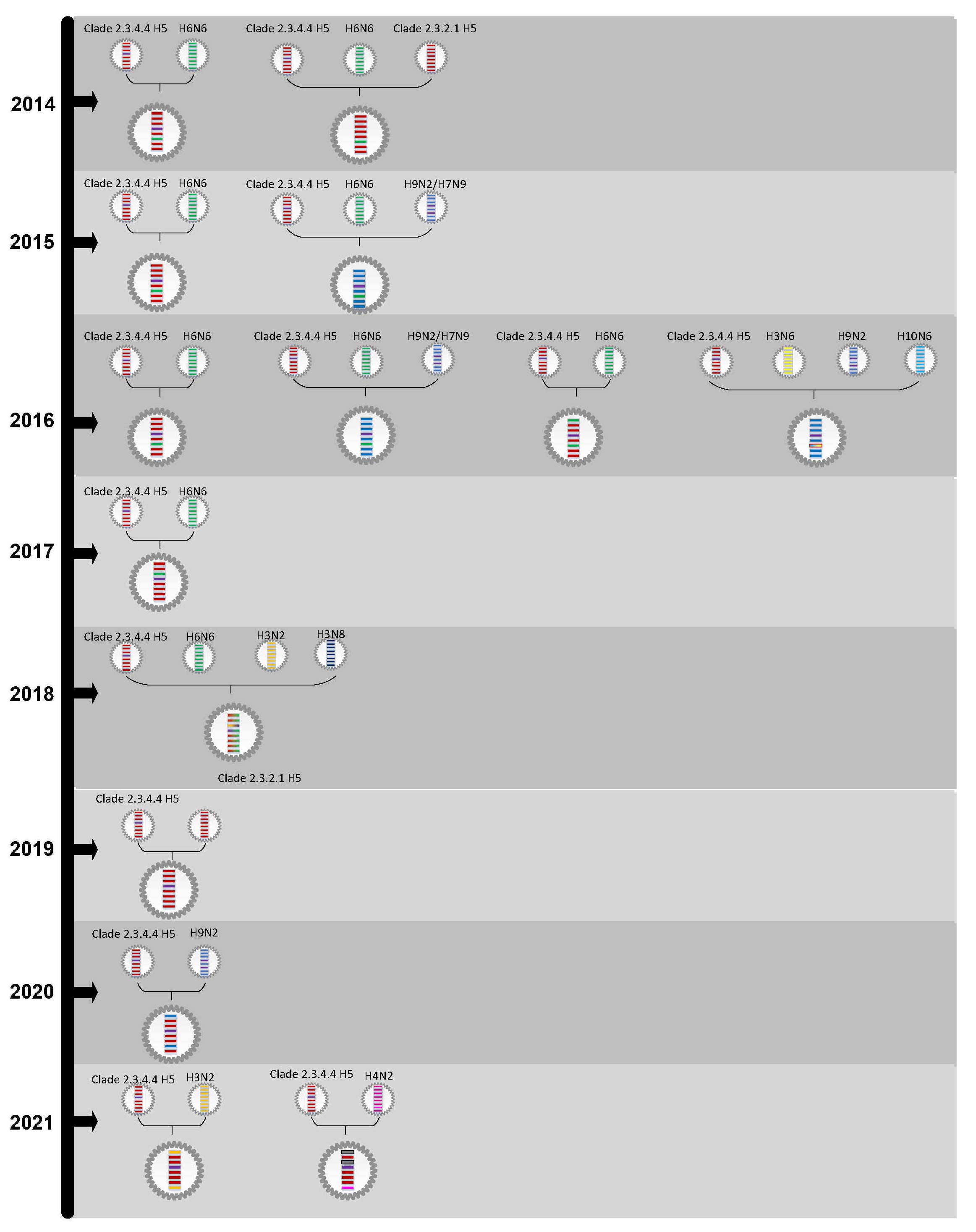
Figure 2 - Équivalent textuel
La figure 2 est une hypothèse de lignées génétiques pour certains isolats humains de la grippe aviaire A(H5N6) de 2014 à 2020.
Les lignées génétiques potentielles de deux (2) isolats humains de la grippe aviaire A(H5N6) ont été décrites en 2014. Les gènes du premier isolat peut être dérivé des H6N6 et H5 de clade 2.3.4.4 virus. Les gènes du deuxième isolat peut être dérivé des H6N6, H5 de clade 2.3.2.1 et H5 de clade 2.3.4.4 virus.
Les lignées génétiques potentielles de deux (2) isolats humains de la grippe aviaire A(H5N6) ont été décrites en 2015. Les gènes du premier isolat peut être dérivé des H6N6 et H5 de clade 2.3.4.4 virus. Les gènes du deuxième isolat peut être dérivé des H9N2/H7N9, H6N6 et H5 de clade 2.3.4.4 virus.
Les lignées génétiques potentielles de quatre (4) isolats humains de la grippe aviaire A(H5N6) ont été décrites en 2016. Les gènes du premier isolat peut être dérivé des H6N6 et H5 de clade 2.3.4.4 virus. Les gènes du deuxième isolat peut être dérivé des H9N2/H7N9, H6N6 et H5 de clade 2.3.4.4 virus. Les gènes du troisième isolat peut être dérivé des H6N6 et H5 de clade 2.3.4.4 virus. Les gènes du quatrième isolat peut être dérivé des H10N6, H9N2, H3N6 et H5 de clade 2.3.4.4 virus.
Les lignées génétiques potentielles d'un (1) isolat humain de la grippe aviaire A(H5N6) a été décrite en 2017. Les gènes peut être dérivé des H6N6 et H5 de clade 2.3.4.4 virus.
Les lignées génétiques potentielles d'un (1) isolat humain de la grippe aviaire A(H5N6) a été décrite en 2018. Les gènes peut être dérivé des H3N8, H3N2, H6N6 et H5 de clade 2.3.4.4 virus.
Les lignées génétiques potentielles d'un (1) isolat humain de la grippe aviaire A(H5N6) a été décrite en 2019. Les gènes peut être dérivé des H5 de clade 2.3.4.4 virus.
Les lignées génétiques potentielles d'un (1) isolat humain de la grippe aviaire A(H5N6) a été décrite en 2020. Les gènes peut être dérivé des H9N2 et H5 de clade 2.3.4.4 virus.
Les lignées génétiques potentielles de deux (2) isolats humains de la grippe aviaire A(H5N6) ont été décrites en 2021. Les gènes du premier isolat peut être dérivé des H3N2 et H5 de clade 2.3.4.4 virus. Les gènes du deuxième isolat peut être dérivé des H4N2 et H5 de clade 2.3.4.4 virus.
Remarque : Cette figure, une hypothèse de lignées génétiques pour certains isolats humains de la grippe aviaire A(H5N6), a été complétée à l'aide de données provenant de la littérature publiée revue par des pairs Note de bas de page 7Note de bas de page 8Note de bas de page 9Note de bas de page 10Note de bas de page 11Note de bas de page 12Note de bas de page 13Note de bas de page 14Note de bas de page 15Note de bas de page 16Note de bas de page 17Note de bas de page 18Note de bas de page 19Note de bas de page 20Note de bas de page 21. Il ne s'agit pas d'un schéma complet et il peut contenir des renseignements incomplets. Les virus sont représentés par des structures de forme circulaire. Les barres horizontales à l'intérieur des virus dans le diagramme font référence à des gènes viraux. De haut en bas, les huit (8) gènes de chaque virus sont : PB2, PB1, PA, HA, NP, NA, MP et NS.
Les infections animales et les détections environmentales
En 2014, la GAHP A(H5N6) a été détectée dans des populations d'oiseaux domestiques et sauvages en Asie, plus précisément en Chine, au Vietnam et au Laos. Depuis lors, des épidémies de grippe aviaire de grande ampleur sont toujours signalées dans les populations d'oiseaux du monde entier, des détections ayant été signalées à l'OIE dans 21 pays différents d'Asie, d'Europe et d'Afrique à ce jour [figure 3] Note de bas de page 23.
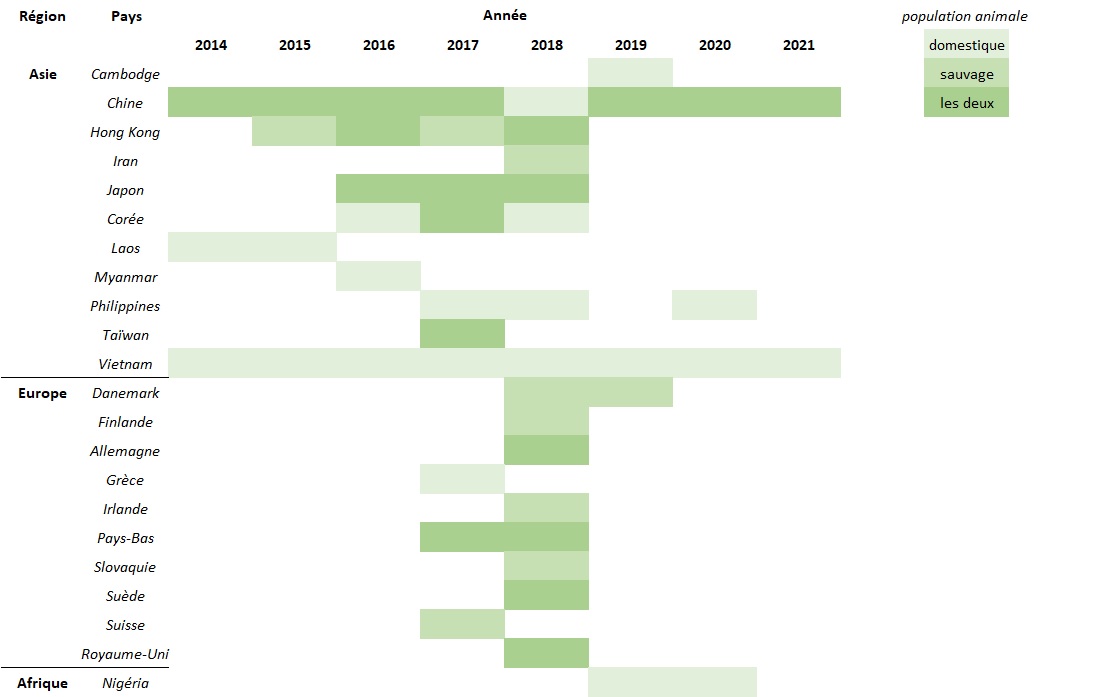
Figure 3 - Équivalent textuel
La figure 3 indique quels pays asiatiques, européens et africains ont signalé à l'OIE des épidémies animales de grippe aviaire A(H5N6) entre 2014 et 2021. Les foyers ont été signalés dans des populations animales domestiques, sauvages ou les deux.
En 2014, la Chine a signalé des foyers d'animaux domestiques et sauvages, la RDP lao a signalé des foyers d'animaux domestiques et le Vietnam a signalé des foyers d'animaux domestiques. En 2015, la Chine a signalé des foyers d'animaux domestiques et sauvages, Hong Kong a signalé des foyers d'animaux sauvages, la RDP lao a signalé des foyers d'animaux domestiques et le Vietnam a signalé des foyers d'animaux domestiques. En 2016, la Chine a signalé des foyers d'animaux domestiques et sauvages, Hong Kong a signalé des foyers d'animaux domestiques et sauvages, le Japon a signalé des foyers d'animaux domestiques et sauvages, la Corée a signalé des foyers d'animaux domestiques, le Myanmar a signalé des foyers d'animaux domestiques et le Vietnam a signalé des foyers d'animaux domestiques. En 2017, la Chine a signalé des foyers d'animaux domestiques et sauvages, Hong Kong a signalé des foyers d'animaux sauvages, le Japon a signalé des foyers d'animaux domestiques et sauvages, la Corée a signalé des foyers d'animaux domestiques et sauvages, les Philippines ont signalé des foyers d'animaux domestiques, Taïwan a signalé des foyers d'animaux domestiques et sauvages, le Vietnam a signalé foyers d'animaux domestiques, la Grèce a signalé des foyers d'animaux domestiques, les Pays-Bas ont signalé des foyers d'animaux domestiques et sauvages et la Suisse a signalé des foyers d'animaux sauvages. En 2018, des foyers d'animaux domestiques et sauvages ont été signalés par Hong Kong, le Japon, l'Allemagne, les Pays-Bas, la Suède et le Royaume-Uni. En 2018, des foyers d'animaux domestiques ont été signalés par la Chine, la Corée, les Philippines et le Vietnam. En 2018, des foyers d'animaux sauvages ont été signalés par l'Iran, le Danemark, la Finlande, l'Irlande et la Slovaquie. En 2019, des foyers d'animaux domestiques et sauvages ont été signalés par la Chine. En 2019, des foyers d'animaux domestiques ont été signalés par le Cambodge, le Vietnam et le Nigeria. En 2019, des foyers d'animaux sauvages ont été signalés par le Danemark. En 2020, des foyers d'animaux domestiques et sauvages ont été signalés par la Chine. En 2020, des foyers d'animaux domestiques ont été signalés par les Philippines, le Vietnam et le Nigeria. En 2021, des foyers d'animaux domestiques et sauvages ont été signalés par la Chine. En 2021, des foyers d'animaux domestiques ont été signalés par le Vietnam.
Remarque : Cette figure a été créée à partir des données extraites du Système Mondial d'information Zoosanitaire (OIE-WAHIS) le 16 décembre 2021.
Le virus A(H5N6) a été détecté dans de multiples environnements. Par exemple, des échantillons environnementaux prélevés dans des lieux d'élevage et de commerce de volailles vivantes (y compris des marchés d'oiseaux vivants) ont révélé la présence de la grippe aviaire A(H5N6) sur des planches à découper, des échantillons d'eaux usées (y compris l'eau utilisée pour nettoyer les volailles abattues, les outils de transformation et les cages) et des matières fécales, ainsi que sur des sites d'alimentation et de consommation de volailles Note de bas de page 17Note de bas de page 18Note de bas de page 19Note de bas de page 24Note de bas de page 25. Ce virus a également été détecté dans les résidences (p. ex. échantillons positifs provenant de volailles de basse-cour, environnements) de cas ayant des volailles domestiques ou des contacts avec des oiseaux Note de bas de page 26.
Exposition
Modes de transmission
La grippe aviaire A(H5N6) infecte principalement les oiseaux, mais aussi les mammifères, y compris les humains. Ce virus est transmis d'oiseau à oiseau par les sécrétions et les fientes Note de bas de page 27. La transmission asymptomatique est également possible, car certaines espèces d'oiseaux sauvages, comme les canards, peuvent être porteurs du virus et infecter d'autres oiseaux sans développer la maladie. Bien que la grippe aviaire A(H5N6) infecte rarement les humains, la transmission peut se faire par contact avec des environnements contaminés ou des oiseaux infectés Note de bas de page 27Note de bas de page 28. À ce jour, il n'y a aucune preuve de transmission interhumaine durable.
Sources d'exposition
Les marchés d'alimentation et de commerce de volailles vivantes sont considérés comme un facteur de risque pour les cas humains de divers virus de la grippe aviaire, dont la GAHP A(H5N6) Note de bas de page 24. L'exposition aux oiseaux dans ces environnements peut augmenter le risque d'infection par la grippe aviaire A(H5N6) par contact direct ou indirect avec des volailles infectées Note de bas de page 29. En fait, tous les cas dont les renseignements sur l'exposition étaient connus (53/53; 100 %) ont signalé un contact indirect ou direct avec des oiseaux avant l'apparition de la maladie dans des marchés d'oiseux vivants, d'ouvriers la volaille, de volailles abattues et cuites ou de volailles domestiques ou de basse-cour Note de bas de page 26. Les enquêtes épidémiologiques ont révélé des résultats positifs pour le virus H5 dans les arrière-cours de plusieurs cas en Chine qui élevaient des volailles domestiques ou dont les résidences étaient fréquentées par des oiseaux sauvages. Des cas humains de A(H5N6) confirmés étaient également liés à des marchés d'alimentation et de commerce de volailles vivantes locaux par le biais d'analyses génétiques et de comparaisons d'échantillons de cas viraux et d'échantillons environnementaux [figure 4] Note de bas de page 26Note de bas de page 24Note de bas de page 19Note de bas de page 21. Les ouvriers exposés professionnellement, tels que les vendeurs de volailles, présentent un risque plus élevé de sérologie positive et les enquêteurs ont observé par le passé des échantillons de sérologie de A(H5N6) positifs provenant de travailleurs du secteur de la volaille (remarque : cela ne constitue pas un cas positif). Ils ont également noté qu'un risque élevé existe pour les personnes âgées de plus de 55 ans et les individus exposés à des volailles malades ou mortes Note de bas de page 30. Cependant, le risque de transmission de l'animal à l'homme est réduit en présence d'équipement de protection individuelle (EPI) et d'autres mesures de biosécurité et de prévention telles que la prophylaxie antivirale après une exposition potentielle Note de bas de page 31.
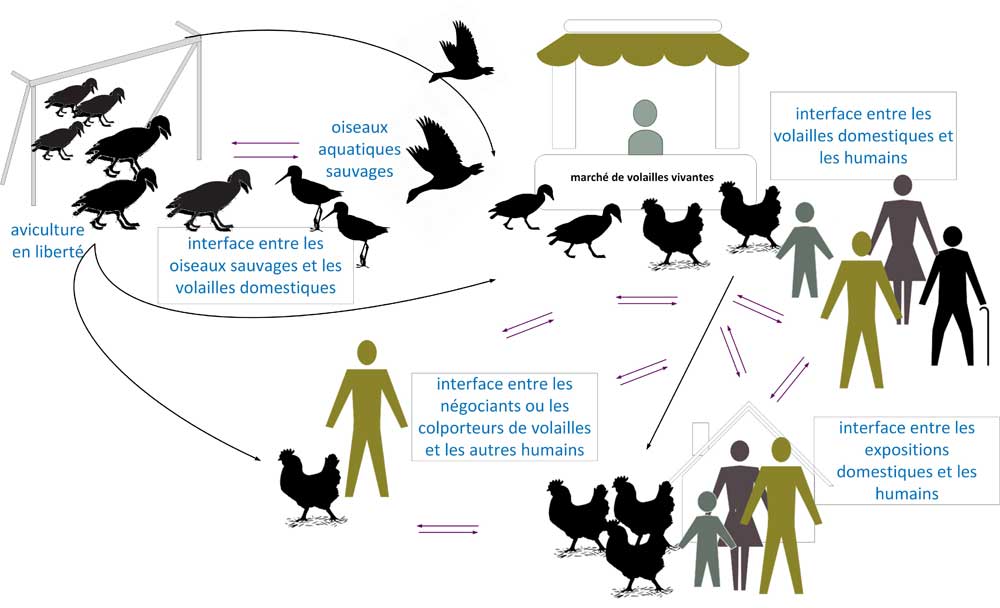
Figure 4 - Équivalent textuel
La figure 4 est un schéma des voies de transmission de la grippe aviaire A(H5N6) des oiseaux sauvages aux humains. Il démontre le rôle de l'aviculture en plein air, l'interface entre les oiseaux sauvages et la volaille domestique, les oiseaux aquatiques sauvages, les marchés de volailles vivantes, l'interface entre la volaille domestique et les humains, l'interface entre les commerçants de volaille/les humains et l'interface entre les expositions domestiques et les humains. avoir sur la transmission de la grippe aviaire A(H5N6).
Remarque : Cette figure, un schéma de la transmission du virus de la grippe aviaire A(H5N6) des oiseaux sauvages à l'homme, a été réalisée à partir de données tirées de la littérature publiée et évaluée par des pairs Note de bas de page 19Note de bas de page 21Note de bas de page 24Note de bas de page 26. Il ne s'agit pas d'un schéma complet et il peut contenir des renseignements incomplets.
Épidémiologie mondiale
Caractéristiques des cas
Alors que des flambées d'influenza aviaire A(H5N6) chez les oiseaux ont été observées dans le monde entier, la transmission de l'oiseau à l'homme n'a été détectée que dans deux (2) pays asiatiques. Depuis 2014, 66 cas humains de A(H5N6) ont été signalés partout dans le monde, tous en provenance de la Chine et de la République démocratique populaire du Laos (Laos). L'âge médian de ces cas était de 50,5 ans, avec une fourchette d'âge de 1 à 81 ans. Neuf (9) (9/66, 14 %) des cas rapportés étaient des enfants de moins de 18 ans [tableau 1]. La moitié (33/66; 50 %) des cas étaient des hommes [tableau 1]. Au moins 29 cas sont décédés [(taux de létalité) : 44 %] et parmi les cas dont l'issue est inconnue, mais pour lesquels on dispose de données, 84 % (21/25) étaient dans un état critique ou grave au moment du dernier rapport. Tous les cas dont les données d'exposition étaient connues (53/53; 100 %) ont signalé un contact avec des oiseaux avant l'apparition de la maladie. Sur les 22 cas dont le passé professionnel a été signalé, 82 % (18/22) avaient des associations évidentes avec le travail agricole ou l'exposition à la volaille en tant qu'agriculteurs (15/22; 68 %) ou négociants en contact avec des marchés d'oiseaux vivants (3/22; 14 %).

Tableau 1 - Équivalent textuel
| Variable | Sexe | Groupe d'âge | ||
| Hommes (n=33) | Femmes (n=33) | Enfants (moins de 18 ans) (n=9) | Adultes (plus de 18 ans) (n=57) | |
| Âge médian (fourchette) | 53 (3-75) | 47 (1-81) | 4 (1-11) | 52 (22-81) |
| Proportion d'hommes (%) | S/O | S/O | 22 | 54 |
| Proportion d'hospitalisés (%) | 97 | 91 | 56 | 100 |
| Délai d'hospitalisation (jours) | 3 | 3.5 | 3 | 3 |
| Taux de létalité (%) | 67 | 59 | 38 | 69 |
Remarque : 29 hommes, 32 femmes, 9 enfants et 52 adultes disposaient de données sur les hospitalisations, 28 hommes, 29 femmes, 5 enfants et 52 adultes ayant déclaré avoir été hospitalisés. Le délai d'hospitalisation correspond au nombre médian de jours entre l'apparition des symptômes et l'hospitalisation, pour les cas hospitalisés pour lesquels on disposait également de données sur l'apparition des symptômes et la date d'hospitalisation (23 hommes, 26 femmes, 4 enfants et 45 adultes). Quinze hommes, 22 femmes, 8 enfants et 29 adultes disposaient de données de résultats définitifs utilisées pour déterminer le taux de létalité. Les renseignements manquants sur les résultats peuvent affecter le taux de létalité des groupes rapportés. Ce tableau contient des données sur les cas signalés de 2014 au 31 janvier 2022.
Répartition géographique
Environ 98 % (65/66) des infections humaines par la grippe aviaire A(H5N6) ont été signalées en Chine. Un (1) cas a été signalé dans un pays limitrophe, la République démocratique populaire du Laos, en mars 2021. En Chine, les cas ont été détectés dans 14 régions différentes à ce jour : la province de Hunan (14 cas), la province de Guangdong (13 cas), la région autonome de Guangxi Zhuang (12 cas), la province du Sichuan (10 cas), la municipalité de Chongqing (3 cas), la province d'Anhui (2 cas), la province du Jiangsu (2 cas), la province du Yunnan (2 cas), la municipalité de Pékin (1 cas), la province du Guizhou (1 cas), la province de Hubei (1 cas), la province de Jiangxi (1 cas), la province de Fujian (1 cas), et la province de Zhejiang (2 cas) [figure 5].
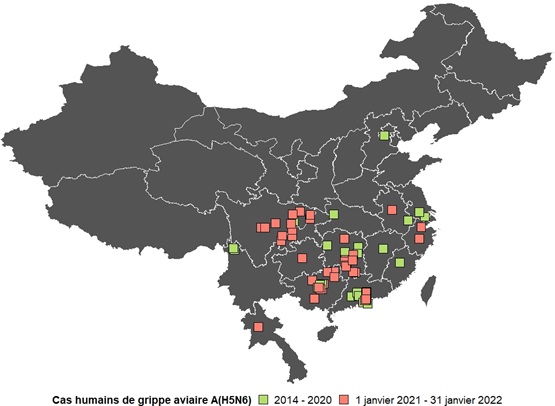
Figure 5. - Équivalent textuel
La figure 5 est une carte de la Chine et de Laos montrant la répartition spatiale des cas humains de grippe aviaire A(H5N6) en Chine et en Laos de 2014 au 31 janvier 2022.
Avant 2021, des cas humains de A(H5N6) ont été signalés dans : la province du Hunan, la province du Sichuan, la province du Guangdong, la province du Yunnan, la province du Jiangxi, la province du Hubei, la province de l'Anhui, la région autonome Zhuang du Guangxi, la province du Fujian, la province du Jiangsu et la municipalité de Pékin.
À partir de 2021, des cas humains de A(H5N6) ont été signalés dans : la municipalité de Chongqing, la province du Guizhou, la province de l'Anhui, la région autonome Zhuang du Guangxi, la province du Sichuan, la province du Hunan, la province du Guangdong, la province du Zhejiang et la province de Luang Prabang.
Remarque : Les cas inclus dans cette figure sont les cas signalés jusqu'au 31 janvier 2022. Source : Outil international de surveillance et d'évaluation du CIMRI.
La majorité de ces cas ont été signalés dans le sud ou le sud-est de la Chine, ce qui coïncide avec la forte densité et la popularité des marchés d'oiseaux vivants associés aux pratiques d'élevage en plein air dans cette région, ainsi qu'avec l'abondance des ressources en eau qui servent d'habitats aux hôtes du virus de la grippe aviaire Note de bas de page 30. Cependant, un (1) cas a été signalé dans le nord de la Chine pour la première fois en 2019 [figure 6] Note de bas de page 20. Ce cas, une femme de 59 ans, a développé la maladie après avoir cuisiné de la volaille Note de bas de page 20. Un (1) cas de la République démocratique populaire du Laos a été détecté chez un enfant de la province de Luang Prabang, qui a également signalé des antécédents d'exposition à la volaille.
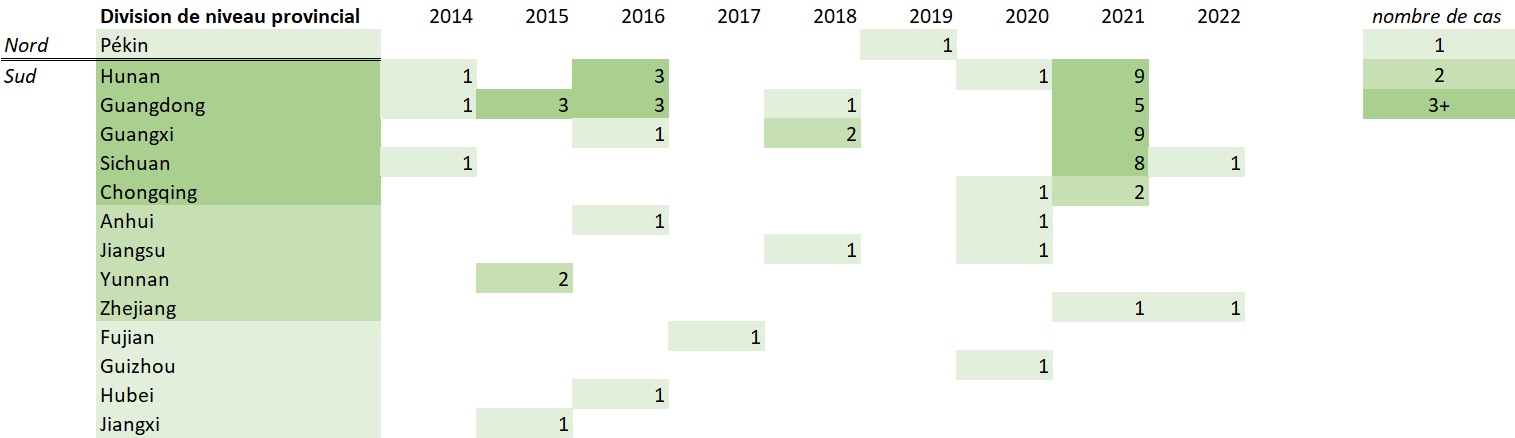
Figure 6. - Équivalent textuel
La figure 6 présente les cas humains de grippe aviaire A(H5N6) détectés dans les divisions provinciales en Chine par année d'apparition de la maladie (2014 - 31 janvier 2022).
En 2014, Hunan, Guangdong et Chongqing ont signalé un (1) cas chacun. En 2015, le Guangdong a signalé trois (3) cas et le Yunnan deux (2) cas. En 2016, le Hunan et le Guangdong ont signalé trois (3) cas chacun et le Guangxi, l'Anhui et le Hubei ont signalé un (1) cas chacun. En 2017, le Fujian a signalé un (1) cas. En 2018, le Guangdong et le Jiangsu ont signalé un (1) cas chacun et le Guangxi a signalé deux (2) cas. En 2019, Pékin a signalé un (1) cas. En 2020, Hunan, Chongqing, Anhui, Jiangsu et Guizhou ont signalé un (1) cas chacun. En 2021, le Hunan et l'Uangxi ont signalé neuf (9) cas chacun, le Sichuan a signalé huit (8) cas, le Guangdong a signalé cinq (5) cas, Chongqing a signalé deux (2) cas et le Zhejian a signalé un (1) cas. En 2022, le Sichuan et le Zhejiang ont signalé un (1) cas chacun. Dans l'ensemble, le Hunan, le Guangdong, le Guangxi, le Sichuan et Chongqing ont tous signalé plus de trois (3) cas, l'Anhui, le Jiangsu, le Yunnan et le Zhejiang ont tous signalé deux (2) cas, et Pékin, le Fujian, le Guizhou, le Hubei et le Jiangxi. signalé un (1) cas.
Remarque : Les données sur l'apparition de la maladie n'étaient pas disponibles pour trois (3) cas; pour ces cas, des données sur la date du signalement étaient utilisées pour créer cette figure. Les cas inclus dans cette figure sont les cas signalés jusqu'au 31 janvier 2022. Source : Outil international de surveillance et d'évaluation du CIMRI.
Chronologie des détections
Le premier cas d'infection humaine par la grippe aviaire A(H5N6) a été signalé le 5 mai 2014, lorsque la Chine a signalé un (1) cas mortel de A(H5N6) chez un marchand de volailles de la province du Sichuan. Cependant, les chercheurs ont cerné rétrospectivement une infection par le virus A(H5N6) chez un enfant qui a développé des symptômes en février 2014, faisant de lui le premier cas humain de A(H5N6) connu Note de bas de page 32. Ce cas a été identifié dans la province de Hunan, la région qui a signalé le plus grand nombre de cas (14/66; 21 %) [figure 6].
Il y a eu une augmentation marquée de l'incidence des cas en 2021, et près de la moitié des cas (32/66; 48 %) ont été signalés au cours de cette année [figure 1]. Trente cinq cas (35/66; 53%) ont vu leurs symptômes apparaître en 2021. Ces cas ont été signalés dans six (6) différentes régions de la Chine [figure 5] et la grippe aviaire A(H5N6) a infecté pour la première fois un résident d'un autre pays (République démocratique populaire du Laos), démontrant une plus grande répartition géographique par rapport aux années précédentes. Cependant, comme pour les cas précédents, les cas dont la maladie a commencé en 2021 avaient un âge médian de 54 ans (fourchette d'âge : 3 à 75 ans) et une répartition par sexe comparable (21/35; 60 % d'hommes). Des données sur les résultats étaient disponibles pour 13 des cas de 2021, dont dix (10/13; 77 %) sont décédés. Des cas humains de A(H5N6) continuent d'être signalés en 2022, avec deux (2) cas apparus en janvier 2022 signalés en date du 31 janvier 2022.
Bien qu'on suppose qu'une augmentation des cas puisse être observée en hiver et en automne, coïncidant avec la saisonnalité de la grippe A chez les humains et les voies migratoires aviaires, aucune saisonnalité n'a été observée dans les cas signalés à ce jour [figure 7] Note de bas de page 17. Des cas ont été détectés tout au long de l'année, avec une légère diminution des maladies au printemps.
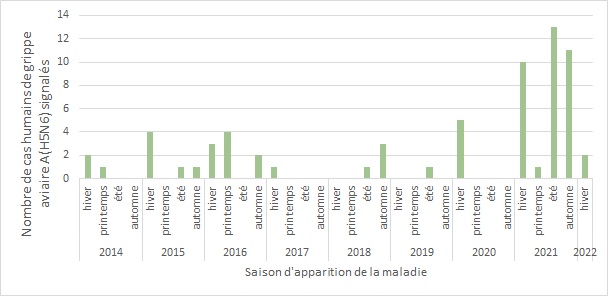
Figure 7. - Équivalent textuel
| Saison d'apparition de la maladie | Nombre de cas humains de grippe aviaire A(H5N6) signalés |
| 2014 hiver | 2 |
| 2014 printemps | 1 |
| 2014 été | 0 |
| 2014 automne | 0 |
| 2015 hiver | 4 |
| 2015 printemps | 0 |
| 2015 été | 1 |
| 2015 automne | 1 |
| 2016 hiver | 3 |
| 2016 printemps | 4 |
| 2016 été | 0 |
| 2016 automne | 2 |
| 2017 hiver | 1 |
| 2017 printemps | 0 |
| 2017 été | 0 |
| 2017 automne | 0 |
| 2018 hiver | 0 |
| 2018 printemps | 0 |
| 2018 été | 1 |
| 2018 automne | 3 |
| 2019 hiver | 0 |
| 2019 printemps | 0 |
| 2019 été | 1 |
| 2019 automne | 0 |
| 2020 hiver | 5 |
| 2020 printemps | 0 |
| 2020 été | 0 |
| 2020 automne | 0 |
| 2021 hiver | 10 |
| 2021 printemps | 1 |
| 2021 été | 13 |
| 2021 automne | 11 |
| 2022 hiver | 2 |
Remarque : Les données sur l'apparition de la maladie n'étaient pas disponibles pour trois (3) cas; pour ces cas, les données sur la date du signalement ont été utilisées pour créer cette figure. L'hiver comprend les mois de décembre, de janvier et de février; le printemps comprend les mois de mars, d'avril et de mai; l'été comprend les mois de juin, de juillet et d'août; et l'automne comprend les mois de septembre, d'octobre et de novembre. Les cas inclus dans cette figure sont les cas signalés jusqu'au 31 janvier 2022; il manque donc les données de l'hiver 2022 pour deux mois (février et décembre 2022). Source : Outil international de surveillance et d'évaluation du CIMRI.
Évolution clinique
Signes et symptômes
Comme pour d'autres infections humaines par des virus de la GAHP H5, la manifestation clinique des cas humains de grippe aviaire A(H5N6) commence souvent par de la fièvre, des symptômes des voies respiratoires supérieures et des myalgies. Cette manifestation se transforme rapidement en une infection des voies respiratoires inférieures, entraînant une pneumonie, une défaillance de plusieurs organes, un syndrome de détresse respiratoire aiguë (SDRA) et, souvent, le décès Note de bas de page 33. Le schéma ci-dessous [figure 8] présente l'évolution clinique des cas détectés à ce jour.

Figure 8. - Équivalent textuel
La figure 8 décrit l'évolution clinique de l'infection des cas humains de grippe aviaire A(H5N6) signalés jusqu'au 31 janvier 2022.
À la suite d'une période d'exposition non précisée, tous les cas ont commencé la maladie ou ont été signalés le jour 1. Le cas 1 a commencé la maladie le jour 1 (2014-02-16) et l'issue le jour 4. Le cas 2 a commencé la maladie le jour 1 (2014- 04-13), hospitalisation et prélèvement d'échantillons au jour 8, admission à l'unité de soins intensifs au jour 9 et résultat au jour 11. Le cas 3 a connu l'apparition de la maladie le jour 1 (2014-12-23). Le cas 4 a connu l'apparition de la maladie le jour 1 (2015-01-27), l'hospitalisation le jour 8, le prélèvement d'échantillons le jour 10 et le résultat le jour 11. Le cas 5 a connu l'apparition de la maladie le jour 1 (2015-07-06), l'hospitalisation le jour 4 et le résultat le jour 5. Le cas 6 a connu le début de la maladie le jour 1 (2015-10-20), l'hospitalisation le jour 9 et le résultat le jour 14. Le cas 7 a connu le début de la maladie le jour 1 (2015-12- 24), hospitalisation le jour 4 et résultat le jour 7. Le cas 8 a connu le début de la maladie le jour 1 (2015-12-22) et l'hospitalisation le jour 7. Le cas 9 a connu le début de la maladie le jour 1 (2016-01-01) , hospitalisation le jour 4 et sortie le jour 10. Le cas 10 a connu l'apparition de la maladie le jour 1 (2015-12-12), l'hospitalisation le jour 8 et le résultat le jour 10. Le cas 11 a connu le début de la maladie le jour 1 (2016-01-08). Le cas 12 a connu le début de la maladie le jour 1 (2016-02-20) et l'hospitalisation le jour 3. Le cas 13 a connu le début de la maladie le jour 1 (2016-04-09 ) et hospitalisation le jour 4. Le cas 14 a connu l'apparition de la maladie le jour 1 (2016-04-11) et l'hospitalisation le jour 2. Le cas 15 a connu l'apparition de la maladie le jour 1 (2016-04-24) et l'hospitalisation le jour 4. Cas 16 ont connu le début de la maladie le jour 1 (2016-05-23) et l'hospitalisation le jour 6. Le cas 17 a connu le début de la maladie et l'hospitalisation le jour 1 (2016-11-18) et l'issue le jour 3. Le cas 18 a connu le début de la maladie le jour 1 (2016-11-08) et hospitalisation le jour 11. Le cas 19 a commencé la maladie le jour 1 (2017-12-19) Le cas 20 a commencé la maladie le jour 1 (2018-08-01).
Le cas 21 a été atteint de la maladie le jour 1 (2018-09-25). Le cas 22 a connu le début de la maladie le jour 1 (2018-10-18), l'hospitalisation le jour 4 et le résultat le jour 10. Le cas 23 a connu le début de la maladie le jour 1 (2018-10-29), l'hospitalisation le jour 6 et l'USI admission le jour 9. Le cas 24 a connu le début de la maladie le jour 1 (2019-08-06), l'hospitalisation le jour 6 et le prélèvement d'échantillons le jour 11. Le cas 25 a connu le début de la maladie le jour 1 (2020-11-16), résultat le jour 12 et le prélèvement d'échantillons le jour 13. Le cas 26 a connu l'apparition de la maladie le jour 1 (2020-12-08), l'hospitalisation le jour 6 et le prélèvement d'échantillons le jour 10. 12-18). Le cas 28 a connu l'apparition de la maladie le jour 1 (2020-11-21). Le cas 29 a connu le début de la maladie le jour 1 (2020-12-22) et le résultat le jour 7. Le cas 30 a connu le début de la maladie le jour 1 (2021-02-16), le prélèvement d'échantillons le jour 12 et le résultat le jour 15. Le cas 31 a connu le début de la maladie le jour 1 (2021-02-28) et l'issue le jour 9. Le cas 32 a connu le début de la maladie le jour 1 (2021-05-13) et l'hospitalisation le jour 4. Le cas 33 a connu le début de la maladie le jour 1 (2021-06-30). Le cas 34 a connu le début de la maladie le jour 1 (2021-06-22) et l'hospitalisation le jour 14. Le cas 35 a connu le début de la maladie le jour 1 (2021-06-23). Le cas 36 a été malade le jour 1 (2021-06-25), hospitalisé le 8e jour et résultat le 10e jour. Le cas 37 a été malade le jour 1 (2021-07-06). Le cas 38 a été malade et hospitalisé le jour 1 (2021-07-13). Le cas 39 a connu le début de la maladie le jour 1 (2021-07-26) et l'hospitalisation le jour 5. Le cas 40 a connu le début de la maladie et l'hospitalisation le jour 1. Le cas 41 a connu le début de la maladie le jour 1 (2021-07-31). Le cas 42 a été malade et hospitalisé le jour 1 (2021-08-17). Le cas 43 a connu le début de la maladie le jour 1 (2021-08-25). Le cas 44 a connu le début de la maladie le jour 1 (2021-09-08) et l'hospitalisation le jour 2. Le cas 45 a connu le début de la maladie le jour 1 (2021-09-13) et l'hospitalisation le jour 6. Le cas 46 a connu le début de la maladie le jour 1 (2021-08-14) et hospitalisation le jour 6. Le cas 47 a été malade le jour 1 (2021-09-26). Le cas 48 a connu l'apparition de la maladie le jour 1 (2021-09-26). Le cas 49 a connu le début de la maladie le jour 1 (2021-09-26) et l'hospitalisation le jour 2. Le cas 50 a connu le début de la maladie le jour 1 (2021-10-03) et l'hospitalisation le jour 11. Le cas 51 a connu le début de la maladie le jour 1 (2021-10-20) et hospitalisation le jour 2. Le cas 52 a connu l'apparition de la maladie le jour 1 (2021-08-29) et l'hospitalisation le jour 3. Le cas 53 a connu l'apparition de la maladie le jour 1 (2021-11-17), hospitalisation le jour 3 et résultat le jour 7. Le cas 54 a connu le début de la maladie le jour 1 (2021-12-03) et l'hospitalisation le jour 5. Le cas 55 a connu le début de la maladie le jour 1 (2021-11-15) et l'hospitalisation le jour 2. Le cas 56 a connu le début de la maladie le jour 1 (2021-11-22) et l'hospitalisation le jour 4. Le cas 57 a connu le début de la maladie le jour 1 (2021-11-24) et l'hospitalisation le jour 6. Le cas 58 a connu le début de la maladie le jour 1 (2021-12-04). Le cas 59 a connu le début de la maladie le jour 1 (2021-12-04) et l'hospitalisation le jour 5. Le cas 60 a connu le début de la maladie le jour 1 (2021-12-04), l'hospitalisation le jour 4 et le résultat le jour 12. Cas 61 a été malade le jour 1 (2021-12-04) et hospitalisé le 9e jour. Le cas 62 a été malade le jour 1 (2021-12-04) et hospitalisé le 4e jour. -12-04) et hospitalisation le jour 5. Le cas 64 a été malade et hospitalisé le jour 1 (2021-12-04). Le cas 65 a connu le début de la maladie le jour 1 (2021-12-04) et l'hospitalisation le jour 2. Le cas 66 a connu le début de la maladie le jour 1 (2021-12-04) et l'hospitalisation le jour 4.
Remarque : Les données sur l'apparition de la maladie n'étaient pas disponibles pour trois (3) cas; pour ces cas, les données sur la date du signalement ont été utilisées pour déterminer le premier jour du tableau clinique du cas. Les dates d'hospitalisation, d'admission en soins intensifs, de sortie et des issues (décès ou survie) n'étaient pas disponibles pour plusieurs cas Note de bas de page 26. Source : Outil international de surveillance et d'évaluation du CIMRI.
Gravité de la maladie
À ce jour, le taux de létalité des infections humaines par la grippe aviaire A(H5N6) est de 44 % (29/66). Parmi les 61 cas pour lesquels des données sur l'hospitalisation étaient disponibles, 93 % (57/66) ont dû être hospitalisés, ce qui souligne encore la gravité de cette maladie. Toutefois, ce pourcentage doit être interprété avec prudence, car les données peuvent être sujettes à un biais de sélection. Il est possible que les cas soient testés plus souvent lorsqu'ils sont graves ou hospitalisés, ce qui conduit à une proportion plus élevée d'hospitalisations puisque le dénominateur pourrait ne pas saisir la plupart des cas bénins ou asymptomatiques. Inversement, il est également possible qu'il y ait un sous-dénombrement des décès communautaires, par exemple lorsque les personnes ne se présentent pas du tout à l'hôpital et ne sont pas testées pour des infections par la grippe aviaire. Les recherches laissent entendre qu'une maladie légère ou asymptomatique est rare avec la grippe aviaire A(H5N6) et moins probable par rapport aux autres virus de la grippe aviaire Note de bas de page 30. Les détails relatifs à l'admission en unité de soins intensifs étaient trop rares pour tirer des conclusions.
Les données sur les résultats n'étaient disponibles que pour 56 % des cas (37/66). Parmi ces individus, 38 % (14/37) ont survécu à leur infection, tandis que 62 % (23/37) sont morts. Si l'on compare les détails des cas mortels aux cas non mortels, les cas mortels étaient plus âgés, avaient une proportion plus élevée de cas hospitalisés et présentaient un plus grand délai d'hospitalisation [tableau 2]. Les chercheurs proposent que les retards plus longs dans l'administration des antiviraux puissent également contribuer à l'augmentation de la mortalité, et ont souligné l'importance d'un dépistage rapide de la grippe, d'un traitement antiviral et d'une sensibilisation accrue des professionnels de la santé pour atténuer les résultats négatifs Note de bas de page 25. Parmi les cas mortels dont les renseignements sur les comorbidités étaient connus, la moitié (3/6; 50 %) a signalé la présence de comorbidités, contre un tiers (1/3; 33 %) des cas non mortels. Aucune différence importante n'a été observée dans le rapport hommes/femmes des cas mortels et non mortels [tableau 2].

Tableau 2. - Équivalent textuel
| Issue de la maladie | Nombre de cas | Âge médian (fourchette) | Rapport hommes/femmes | Proportion d'hospitalisés (%) | Délai médian entre l'apparition des symptômes et l'hospitalisation (jours) |
|---|---|---|---|---|---|
| Vivant | 14 | 30.5 (1-65) | 1:1.8 | 71 | 3 |
| Décédé | 23 | 49 (3-81) | 1:1.3 | 100 | 5 |
Remarque : pour 20/23 (87 %) des cas mortels et 7/14 (50 %) des cas non mortels, on disposait de données sur l'apparition des symptômes et la date d'hospitalisation. Les données sur l'apparition des symptômes manquaient pour un (1) cas non fatal, mais les données sur l'hospitalisation étaient disponibles, et les données sur la date de déclaration étaient disponibles. Le temps médian entre l'apparition des symptômes et l'hospitalisation (jours) a été calculé pour ces 20 cas mortels et 8 (7 avec des données sur la date d'apparition des symptômes; 1 avec des données sur la date du signalement) non mortels. Les cas inclus dans cette figure sont les cas signalés jusqu'au 31 janvier 2022. Source : Outil international de surveillance et d'évaluation du CIMRI.
Les premiers cas humains de A(H5N6) ayant été détectés en 2014, aucune donnée n'est encore disponible sur les effets cliniques à long terme de l'infection par la grippe aviaire A(H5N6) chez l'homme.
Mesures de santé publique
Thérapeutique et vaccins
L'administration d'antiviraux peut également aider à traiter les cas humains de A(H5N6), mais les chercheurs ont insisté sur le fait que les antiviraux doivent être administrés en temps opportun pour réduire les effets indésirables Note de bas de page 25.
L'OMS coordonne la préparation des virus vaccinaux candidats qui peuvent être utilisés par les fabricants de vaccins pour produire des vaccins contre la grippe. Dans le cadre de la stratégie mondiale de préparation à une pandémie, l'OMS a sélectionné le virus A(H5N6) du clade 2.3.4.4 pour le développer en tant que virus vaccinal candidat. Deux virus vaccinaux candidats contre la grippe aviaire A(H5N6) du clade 2.3.4.4 ont déjà été développés (2.3.4.4e A/duck/Hyogo/1/2016 et 2.3.4.4a A/Sichuan/26221/2014) et cinq (5) autres sont en attente Note de bas de page 34Note de bas de page 6. Toutefois, compte tenu de l'évolution constante du profil génétique de la GAHP A(H5N6), il est important de mettre fréquemment à jour les virus vaccinaux candidats Note de bas de page 19.
Mesures de santé publique
Le respect des mesures de santé publique telles que le lavage régulier et complet des mains, le fait de rester à la maison si vous vous sentez malade et la réduction au minimum des contacts avec des oiseaux sauvages, malades ou morts et avec des environnements contaminés ou à haut risque (p. ex. les marchés d'oiseaux vivants) peuvent vous protéger, vous et d'autres personnes, de l'infection par la grippe aviaire A(H5N6). L'OMS recommande d'éviter tout contact avec des environnements à risque élevé comme les marchés de poulailles vivantes ou les surfaces contaminées Note de bas de page 26. Pour les personnes qui ne peuvent pas éviter d'entrer en contact avec les oiseaux, par exemple les aviculteurs ou d'autres personnes exposées professionnellement, l'utilisation d'équipement de protection individuelle (EPI) peut contribuer à prévenir l'infection par la grippe Note de bas de page 35. Pendant les épidémies ou à la suite d'une exposition à des oiseaux infectés, les recherches montrent également que des mesures de biosécurité comme la prophylaxie antivirale peuvent prévenir les infections Note de bas de page 35. La vaccination contre la grippe saisonnière peut également contribuer à prévenir les co-infections de la nouvelle grippe et de la grippe saisonnière, réduisant ainsi le risque de réassortiment.
À l'échelle nationale, le Canada s'est engagé dans plusieurs activités de préparation à une pandémie qui atténuent la probabilité et l'impact des infections par la nouvelle grippe [p. ex. A(H5N6)] chez les humains. Par exemple , l'ASPC a publié des guides de planification pour le secteur de la santé en cas d'une pandémie de grippe . L'ASPC peut également utiliser sa Réserve nationale stratégique d'urgence, qui contient des fournitures comme de l'équipement médical et des produits pharmaceutiques, afin de fournir aux régions provinciales ou territoriales des secours et un soutien en cas d'urgence, comme une épidémie de grippe.
Surveillance
Outre les mesures de santé publique décrites ci-dessus, l'OMS recommande une surveillance mondiale pour détecter les changements virologiques, épidémiologiques et cliniques associés à des virus comme la grippe aviaire A(H5N6) qui peuvent toucher la santé humaine et animale. Comme le virus de la grippe aviaire A(H5N6) continue de circuler chez les populations animales et de contaminer divers environnements, on s'attend à de nouvelles détections de cas humains sporadiques de A(H5N6). L'échange de renseignements en temps opportun sur ces cas, conformément au Règlement sanitaire international (2005), demeure essentiel pour l'évaluation et l'atténuation des risques d'infection humaine par la grippe aviaire A(H5N6) Note de bas de page 26.
Liens et ressources
- Surveillance ÉpiGrippe de l'ASPC
- Conseil de santé aux voyageurs de l'ASPC concernant la grippe aviaire
- Réserve nationale stratégique d'urgence de l'ASPC
- Protocole d'enquête microbiologique concernant de l'ASPC les Infections Respiratoires Aiguës Sévères (IRAS)
- Définition de cas - IRAS de l'ASPC
- Formulaire de déclaration des cas d'IRAS de l'ASPC
- Directives sur la biosécurité de l'ASPC pour les sous-types H5, H7 et H9 du virus de la grippe
- Directives de l'ASPC sur la surveillance de la grippe aviaire chez les humains [propre au virus A(H7N9), mais pouvant être appliqué au virus A(H5N6)]
- Préparation du Canada en cas de grippe pandémique de l'ASPC : Guide de planification pour le secteur de la santé
- Influenza aviaire (grippe aviaire) de l'Agence canadienne d'inspection des aliments (ACIA)
- Renseignements des CDC des États-Unis sur la grippe aviaire (disponible uniquement en anglais)
- Plan nord-américain contre l'influenza animale et la pandémie d'influenza (PNAIAPI)
- Influenza aviaire de l'OIE
- Influenza aviaire de l'Organisation des Nations Unies pour l'alimentation et l'agriculture (FAO)
- Surveillance de l'OMS - Influenza aviaire
- Résumés de l'évaluation des risques de l'influenza à l'interface animal-humain de l'OMS (disponible uniquement en anglais)
Références
- Note de bas de page 1
-
Xing G, Gu J, Yan L, Lei J, Lai A, Su S, et al. Human infections by avian influenza virus H5N6: Increasing risk by dynamic reassortment? Infec Genet Evol 2016;42:46-48.
- Note de bas de page 2
-
Li X., Yang J., Liu B., Jia Y., Guo J., Gao X., et al. Co-circulation of H5N6, H3N2, H3N8, and Emergence of Novel Reassortant H3N6 in a Local Community in Hunan Province in China. Sci Rep 2016;6:25549.
- Note de bas de page 3
-
Bi Y., Liu H., Xiong C., Liu D, Shi W., Li M., et al. Novel avian influenza A (H5N6) viruses isolated in migratory waterfowl before the first human case reported in China, 2014. Sci Rep 2016;6:29888.
- Note de bas de page 4
-
Su S., Bi Y., Wong G., Gray G.C., Gao G.F., Li S. Epidemiology, evolution, and recent outbreaks of avian influenza virus in China. J Virol 2015;89(17):8671-8676.
- Note de bas de page 5
-
World Organisation for Animal Health. Update on Avian Influenza - OIE. 2017; Available at: http://www.oie.int/animal-health-in-the-world/update-on-avian-influenza/2016/. Accessed January/10, 2017.
- Note de bas de page 6
-
World Health Organization. Assessment of risk associated with highly pathogenic avian influenza A(H5N6) virus. 2021.
- Note de bas de page 7
-
Ma M.-J., Chen S.-H., Wang G.-L., Zhao T., Qian Y.-H., Wu M.-N., et al. Novel highly pathogenic avian H5 influenza a viruses in live poultry markets, Wuxi City, China, 2013-2014. Open Forum Infect Dis 2016;3(2):ofw054.
- Note de bas de page 8
-
Zhang Z, Li R, Jiang L, Xiong C, Chen Y, Zhao G, et al. The complexity of human infected AIV H5N6 isolated from China. BMC Infect Dis 2016;16(1).
- Note de bas de page 9
-
Bi Y., Chen Q., Wang Q., Chen J., Jin T., Wong G., et al. Genesis, Evolution and Prevalence of H5N6 Avian Influenza Viruses in China. Cell Host and Microbe 2016;20(6):810-821.
- Note de bas de page 10
-
Shen HanQin, Wu BoLiang, Chen YiMin, Bi YingZuo, Xie Q. Influenza A(H5N6) virus reassortant, southern China, 2014. Emerging Infectious Diseases 2015;21(7):1261-1262. 11 ref.
- Note de bas de page 11
-
Wong FY, Phommachanh P, Kalpravidh W, Chanthavisouk C, Gilbert J, Bingham J, et al. Reassortant highly pathogenic infuenza a(h5n6) virus in laos. Emerg Infect Dis 2015;21(3):511-516.
- Note de bas de page 12
-
Wu H, Lu R, Peng X, Xu L, Cheng L, Lu X, et al. Novel reassortant highly pathogenic H5N6 avian influenza viruses in poultry in China. Infec Genet Evol 2015;31:64-67.
- Note de bas de page 13
-
Jiao P, Cui J, Song Y, Song H, Zhao Z, Wu S, et al. New reassortant H5N6 highly pathogenic avian influenza viruses in Southern China, 2014. Front Microbiol 2016;7(MAY).
- Note de bas de page 14
-
Yuan R, Wang Z, Kang Y, Wu J, Zou L, Liang L, et al. Continuing reassortant of H5N6 subtype highly pathogenic avian influenza virus in Guangdong. Front Microbiol 2016;7(APR).
- Note de bas de page 15
-
Shen Y-, Ke C-, Li Q, Yuan R-, Xiang D, Jia W-, et al. Novel reassortant avian influenza a(H5N6) viruses in Humans, Guangdong, China, 2015. Emerg Infect Dis 2016;22(8):1507-1509.
- Note de bas de page 16
-
He J., Liu B.-Y., Gong L., Chen Z., Chen X.-L., Hou S., et al. Genetic characterization of the first detected human case of avian influenza A (H5N6) in Anhui Province, East China. Sci Rep 2018;8(1):15282.
- Note de bas de page 17
-
Chen P, Xie J, Lin Q, Zhao L, Zhang Y, Chen H, et al. A study of the relationship between human infection with avian influenza a (H5N6) and environmental avian influenza viruses in Fujian, China. BMC Infect Dis 2019 20190902;19(1):762.
- Note de bas de page 18
-
Dong Z, Ya X, Wang D, Liu C, Shen Q, Xia Y. Genetic Characterization of a Novel Reassortant H5N6 Avian Influenza Virus Identified from a 10-Year-Old Girl. Jpn J Infect Dis 2020 20191031;73(1):36-43.
- Note de bas de page 19
-
Xiao C, Xu J, Lan Y, Huang Z, Zhou L, Guo Y, et al. Five Independent Cases of Human Infection with Avian Influenza H5N6 - Sichuan Province, China, 2021. China CDC wkly 2021;3(36):751-756.
- Note de bas de page 20
-
Yang L, Zhao X, Li X, Bo H, Li D, Liu J, et al. Case report for human infection with a highly pathogenic avian influenza A(H5N6) virus in Beijing, China 2019. Biosafety and Health 2020;2(1):49-52.
- Note de bas de page 21
-
Yu J, Hou S, Feng Y, Bu G, Chen Q, Meng Z, et al. Emergence of a young case infected with avian influenza A (H5N6) in Anhui Province, East China during the COVID-19 pandemic. J Med Virol 2021 20210714;93(10):5998-6007.
- Note de bas de page 22
-
Sun H, Pu J, Wei Y, Sun Y, Hu J, Liu L, et al. Highly Pathogenic Avian Influenza H5N6 Viruses Exhibit Enhanced Affinity for Human Type Sialic Acid Receptor and In-Contact Transmission in Model Ferrets. J Virol 2016 Jul 15;90(14):6235-6243.
- Note de bas de page 23
-
World Organisation for Animal Health. World Animal Health Information System (WAHIS). 2021.
- Note de bas de page 24
-
Zhang R, Lei Z, Liu C, Zhu Y, Chen J, Yao D, et al. Live poultry feeding and trading network and the transmission of avian influenza A(H5N6) virus in a large city in China, 2014-2015. Int J Infect Dis 2021 20210514;108:72-80.
- Note de bas de page 25
-
Chen L, Huo X, Qi X, Liu C, Huang H, Yu H, et al. A fatal paediatric case infected with reassortant avian influenza A(H5N6) virus in Eastern China. Transbound Emerg Dis 2020 20200405.
- Note de bas de page 26
-
World Health Organization. Posts: Influenza due to identified avian or animal influenza virus. 2018-2021.
- Note de bas de page 27
-
CDC (Centers for Disease Control and Prevention). Information on Avian Influenza. March 21, 2019; Available at: https://www.cdc.gov/flu/avianflu/index.html.
- Note de bas de page 28
-
Government of Canada. Avian Influenza (Bird Flu). 2008; Available at: https://www.canada.ca/en/health-canada/services/healthy-living/your-health/diseases/avian-influenza-bird-flu.html.
- Note de bas de page 29
-
Ryu S, Kim C-, Kim K, Woo SH, Chun BC. Serosurveillance of avian influenza A/H5N6 virus infection in poultry farmers, Gyeonggi Province, Republic of Korea, 2016-2017. Int J Infect Dis 2018;75:49-51.
- Note de bas de page 30
-
Quan C, Wang Q, Zhang J, Zhao M, Dai Q, Huang T, et al. Avian Influenza A Viruses among Occupationally Exposed Populations, China, 2014-2016. Emerg Infect Dis 2019;25(12):2215-2225.
- Note de bas de page 31
-
Ryu S, Lim J-, Cowling BJ, Chun BC. Low risk of avian influenza A (H5N6) transmission to depopulation workers in Korea. Influ Other Respir Viruses 2018;12(3):412-415.
- Note de bas de page 32
-
Zhang R, Chen T, Ou X, Liu R, Yang Y, Ye W, et al. Clinical, epidemiological and virological characteristics of the first detected human case of avian influenza A(H5N6) virus. Infec Genet Evol 2016;40:236-242.
- Note de bas de page 33
-
Bi Y, Tan S, Yang Y, Wong G, Zhao M, Zhang Q, et al. Clinical and Immunological Characteristics of Human Infections With H5N6 Avian Influenza Virus. Clin Infect Dis 2019;68(7):1100-1109.
- Note de bas de page 34
-
World Health Organization. Summary of status of development and availability of A(H5) non-A(H5N1) candidate vaccine viruses and potency testing reagents. 2021; Available at: https://cdn.who.int/media/docs/default-source/influenza/cvvs/cvv-zoonotic---southern-hemisphere-2022/h5-non-h5n1_20210930.pdf?sfvrsn=cb6745e5_8&download=true.
- Note de bas de page 35
-
Ryu S, Lim J-, Cowling BJ, Chun BC. Low risk of avian influenza A (H5N6) transmission to depopulation workers in Korea; 29236360. Influenza and other Respiratory Viruses 2018;12(3):412-415.