Ébauche d’évaluation - Terpènes et terpénoïdes - Sesquiterpènes tricycliques et triterpénoïdes
Titre officiel : Ébauche d’évaluation - Terpènes et terpénoïdes - Sesquiterpènes tricycliques et triterpénoïdes
Environnement et Changement climatique Canada
Santé Canada
Mars 2025
Résumé
En vertu de l’article 68 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE), les ministres de l’Environnement et de la Santé ont réalisé une évaluation de 14 substances ci-après désignées comme le Groupe des sesquiterpènes tricycliques et des triterpénoïdes. Les numéros de ces substances au registre du Chemical Abstracts Service (nos CASNote de bas de page 1), le sous-groupe, le nom sur la Liste intérieure (LI) et le nom commun de ces substances qui sont utilisés dans la présente évaluation sont indiqués dans le tableau ci-dessous.
| No CAS | Sous-groupe | Nom sur la LI | Nom commun |
|---|---|---|---|
| 469-61-4 | Sous-groupe 1 des sesquiterpènes tricycliques | 3R-(3α,3aβ,7β,8aα)]-2,3,4,7,8,8a-Hexahydro-3,6,8,8-tétraméthyl-1H-3a,7-méthanoazulène | Alpha-cédrène |
| 470-40-6 | Sous-groupe 1 des sesquiterpènes tricycliques | [1AS-(1aα,4aβ,8aRæ)]-1,1a,4,4a,5,6,7,8-Octahydro-2,4a,8,8-tétraméthylcyclopropa[d]naphtalène | Thujopsène |
| 489-40-7 | Sous-groupe 1 des sesquiterpènes tricycliques | 1AR-(1aα,4α,4aβ,7bα)]-1a,2,3,4,4a,5,6,7b-Octahydro-1,1,4,7-tétraméthyl-1H-cycloprop[e]azulène | Alpha-gurjunène |
| 514-51-2 | Sous-groupe 1 des sesquiterpènes tricycliques | [1S-(1α,4α,7α)]-1,2,3,4,5,6,7,8-Octahydro-1,4,9,9-tétraméthyl-4,7-méthanoazulène | Bêta-patchoulène |
| 546-28-1 | Sous-groupe 1 des sesquiterpènes tricycliques | [3R-(3α,3aβ,7β,8aα)]-Octahydro-3,8,8-triméthyl-6-méthylène-1H-3a,7-méthanoazulène | Bêta-cédrène |
| 8000-27-9a | Sous-groupe 1 des sesquiterpènes tricycliques | Essences de bois de cèdre | Essence de bois de cèdre |
| 68608-32-2a | Sous-groupe 1 des sesquiterpènes tricycliques | Terpènes et terpénoïdes de l’essence de cèdre | Terpènes et terpénoïdes de l’essence de cèdre |
| 68990-83-0a | Sous-groupe 1 des sesquiterpènes tricycliques | Essences de bois de cèdre du Texas | Essence de bois de cèdre du Texas |
| 59056-62-1 | Substance distincte (sesquiterpène tricyclique) | Acétate d’octahydro-7,7,8,8-tétraméthyl-2,3b-méthano-3bH-cyclopenta[1,3]cyclopropa[1,2]benzène-4-méthyle | Acétate amboryle |
| 471-53-4 | Sous-groupe 2 des triterpénoïdes | Énoxolone | Énoxolone |
| 4572-09-2a | Sous-groupe 2 des triterpénoïdes | Acide 3β-hydroxy-11-oxo-oléan-12-én-29-oïque composé (1:) préparé avec l’allantoïne | Acide glycyrrhétinique préparé avec l’allantoïne |
| 8031-03-6a | Substance distincte (triterpénoïde) | Essences de mimosa | Essence de mimosa |
| 84082-54-2a | Substance distincte (triterpénoïde) | Lierre, Hedera helix, extraits | Extrait de lierre |
| 90045-38-8a | Substance distincte (triterpénoïde) | Extrait de ginseng, Panax quinquefolium | Extrait de ginseng à 5 folioles |
a La substance de ce no CAS est une substance (substance de composition inconnue ou variable, produit de réaction complexe ou matière biologique).
Toutes les substances du Groupe des sesquiterpènes tricycliques et des triterpénoïdes ont fait l’objet d’enquêtes menées en vertu de l’article 71 de la LCPE. Selon les déclarations, le thujopsène, l’alpha-gurjunène, le bêta-patchoulène, le bêta-cédrène, les terpènes et terpénoïdes de l’essence de cèdre, l’acétate amboryle, l’énoxolone, l’acide glycyrrhétinique préparé avec l’allantoïne, l'essence de mimosa, l'extrait de lierre et l’extrait de ginseng à 5 folioles n’ont pas été fabriqués ni importés en quantités supérieures au seuil de déclaration de 100 kg en 2011. Toujours selon les déclarations, en 2011, l’alpha-cédrène et l'essence de bois de cèdre ont été importés au Canada en des quantités comprises entre 100 et 1 000 kg, mais il n’y a eu aucune production supérieure au seuil de déclaration de 100 kg. La même année, l'essence de bois de cèdre du Texas auraient été fabriquées et importées au Canada en des quantités de 277 et de 200 kg, respectivement. Les substances du Groupe des sesquiterpènes tricycliques et des triterpénoïdes sont généralement utilisées comme parfums dans des cosmétiques, des produits de santé naturels (PSN), des médicaments en vente libre (MVL), des produits de nettoyage et des assainisseurs d’air. Certaines se trouvent également dans des produits antiparasitaires en tant que produits de formulation. En particulier, l'essence de bois de cèdre est un ingrédient actif utilisé seulement pour fabriquer des produits antiparasitaires destinés à l’exportation hors du Canada. De plus, certaines de ces substances sont présentes à l’état naturel dans des aliments et sont possiblement utilisées comme des aromatisants alimentaires.
Les risques pour l’environnement associés aux substances du Groupe des sesquiterpènes tricycliques et des triterpénoïdes ont été caractérisés selon l’approche de Classification du risque écologique (CRE) des substances organiques, une méthode de classification des risques fondée sur l’utilisation de plusieurs paramètres de mesure du danger et de l’exposition, et sur l’examen pondéré de multiples éléments de preuve. Les profils de danger reposent principalement sur des paramètres liés au mode d’action toxique, à la réactivité chimique, aux seuils de toxicité interne établis à partir du réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. En ce qui concerne les profils d’exposition, les paramètres comprennent le taux d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. Ces profils servent ensuite à attribuer aux substances un degré de préoccupation potentielle faible, modéré ou élevé au moyen d’une matrice de risques. D’après les résultats de la CRE, les substances du Groupe des sesquiterpènes tricycliques et des triterpénoïdes sont considérées comme peu susceptibles de causer des effets nocifs sur l’environnement.
Compte tenu de tous les éléments de preuve contenus dans la présente ébauche d’évaluation, les 14 substances du Groupe des sesquiterpènes tricycliques et des triterpénoïdes présentent un faible risque d’effets nocifs sur l’environnement. Il est proposé de conclure que les 14 substances du Groupe des sesquiterpènes tricycliques et des triterpénoïdes ne satisfont pas aux critères énoncés aux alinéas 64a) ou b) de la LCPE, car elles ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
Aux fins de l’évaluation des risques pour la santé humaine, 10 des substances de ce groupe ont été divisées dans 2 sous-groupes en raison de similitudes dans leurs structures chimiques, leurs propriétés ou leur toxicité, tandis que les 4 autres substances ont été examinées individuellement. À la lumière des faibles quantités déclarées en réponse à une enquête menée en vertu de l’article 71 de la LCPE ou des estimations de l’exposition obtenues par la surveillance de l’environnement et la modélisation, il est estimé que l’exposition à ces substances par l’environnement ne devrait pas avoir d’effet sur la santé humaine. La caractérisation de l’exposition, le cas échéant, s’est fondée sur l’utilisation de cosmétiques, de PSN et de MVL, l’utilisation possible des substances comme aromatisants alimentaires, produits de nettoyage et assainisseurs d’air, et l’utilisation de produits faits soi-même contenant les sesquiterpènes tricycliques et les triterpénoïdes.
Pour le sous-groupe 1 des sesquiterpènes tricycliques (alpha-cédrène, thujopsène, alpha-gurjunène, bêta-patchoulène, bêta-cédrène, l'essence de bois de cèdre, terpènes et terpénoïdes de l’essence de cèdre, et l'essence de bois de cèdre du Texas), l’évaluation des risques pour la santé humaine s’est fondée sur les renseignements sur les dangers de l'essence de bois de cèdre. Il a été établi que le thujopsène, l’alpha-cédrène et le bêta-cédrène sont des composants importants de l'essence de bois de cèdre, des terpènes et terpénoïdes de l’essence de cèdre et de l'essence de bois de cèdre du Texas. Pour l’étude de la voie cutanée, la concentration entraînant un effet critique a été déterminée en fonction d’un effet systémique (diminution du poids du thymus), tandis que pour les voies orales et par inhalation, elle reposait sur les changements des hormones thyroïdiennes.
Il est estimé que les marges d’exposition relatives à l’exposition cutanée à l'essence de bois de cèdre qui découle de l’utilisation d’huiles de massage, de parfums, de déodorants ou antisudorifiques (solides), d’hydratants (pour le corps et le visage), de revitalisants (sans rinçage), d’exfoliants pour le corps (enfants de 14 à 18 ans), de produits après-rasage (pour le visage), de produits pour la peau (du corps) après épilation, de nettoyants antiseptiques pour la peau (en pulvérisateur) (PSN) (enfants de 2 à 8 ans, en cas de situations préoccupantes pour la santé publique entraînant une utilisation accrue), de contre-irritants (en pulvérisateur) (PSN) (enfants de 9 à 18 ans) et de baumes de soulagement de l’irritation (PSN) ne permettent peut-être pas de tenir adéquatement compte des incertitudes entourant les effets sur la santé et les données sur l’exposition ayant servi à caractériser les risques. Il en va de même pour les marges calculées pour l’exposition à l'essence de bois de cèdre par inhalation de parfums (enfants de 2 à 3 ans).
C’est également le cas pour les marges d’exposition associées à l’exposition cutanée quotidienne due à l’utilisation d’essence de bois de cèdre dans des diffuseurs d’arômes et assainisseurs d’air faits soi-même, des huiles de massage faites soi-même, des hydratants pour le corps faits soi-même et des brumisateurs faciaux faits soi-même, ainsi que pour les marges d’exposition associées à l’exposition quotidienne par inhalation due à l’utilisation d’essence de bois de cèdre dans des diffuseurs d’arôme et assainisseurs d’air faits soi-même et des brumisateurs faciaux faits soi-même.
Aucune source d’exposition de la population générale n’a été relevée pour le thujopsène, l’alpha-gurjunène, le bêta-patchoulène et le bêta-cédrène. Une approche qualitative de caractérisation des risques a donc été employée.
Il est jugé que les marges d’exposition aux terpènes et terpénoïdes de l’essence de cèdre provenant d’aliments, qui reposent sur l’utilisation potentielle de cette substance comme aromatisant alimentaire, permettent adéquatement de tenir compte des incertitudes entourant les effets sur la santé et les données sur l’exposition. Aucune autre source d’exposition de la population générale à cette substance n’a été relevée. Par conséquent, les terpènes et terpénoïdes de l’essence de cèdre sont considérés comme peu préoccupants pour la santé humaine aux niveaux d’exposition actuels.
Il est estimé que les marges d’exposition à l'essence de bois de cèdre du Texas découlant de l’exposition cutanée quotidienne à des huiles de massage, à des parfums, à des déodorants ou antisudorifiques (solides) et à des hydratants (pour le corps et le visage) ne permettent peut-être pas de tenir adéquatement compte des incertitudes entourant les effets sur la santé et les données sur l’exposition ayant servi à caractériser les risques.
Il en va de même pour les marges d’exposition associées à l’exposition cutanée qui découle de l’utilisation d’essence de bois de cèdre du Texas dans des diffuseurs d’arômes et assainisseurs d’air faits soi-même, des huiles de massage faites soi-même, des hydratants pour le corps faits soi-même et des brumisateurs faciaux faits soi-même, ainsi que pour les marges d’exposition associées à l’exposition quotidienne par inhalation qui découle de l’utilisation d’essence de bois de cèdre du Texas dans des diffuseurs d’arôme et assainisseurs d’air faits soi-même et des brumisateurs faciaux faits soi-même.
Dans le cas de l’acétate amboryle, aucun effet préoccupant sur la santé n’a été relevé, ni aucune source d’exposition de la population générale. Par conséquent, cette substance est considérée comme peu préoccupante pour la santé humaine aux niveaux d’exposition actuels.
Le sous-groupe 2 des triterpénoïdes se compose de l’énoxolone et de l’acide glycyrrhétinique préparé avec l’allantoïne. En ce qui concerne l’énoxolone, l’effet critique pour la santé identifié était la neurotoxicité pour le développement. Il est considéré que les marges d’exposition calculées pour cette substance relativement à sa présence dans des hydratants pour le visage, des hydratants pour le corps (en pulvérisateur et lotions), des colorants capillaires permanents, des écrans solaires (crèmes) (PSN et MVL), des timbres analgésiques (PSN) (enfants de 13 ans et moins), des produits de traitement contre l’acné (crèmes) (PSN), des produits médicamenteux de soins de la peau (crèmes) (PSN), du thé à la réglisse et des bonbons à la réglisse noire ne permettent peut-être pas de tenir adéquatement compte des incertitudes entourant les effets sur la santé et les données sur l’exposition ayant servi à caractériser les risques. En ce qui concerne l’acide glycyrrhétinique préparé avec l’allantoïne, aucune donnée empirique n’était disponible. De plus, aucune source d’exposition de la population générale à cette substance n’a été relevée. Par conséquent, cette substance est considérée comme peu préoccupante pour la santé humaine aux niveaux d’exposition actuels.
Dans le cas de l'essence de mimosa, nous avons caractérisé les risques des principaux composants, soit la lupénone et le lupéol, à l’aide des renseignements sur les effets sur la santé de l’énoxolone, la substance analogue. L’effet critique sur la santé identifié était la neurotoxicité pour le développement. Il est estimé que les marges d’exposition calculées pour l'essence de mimosa présentes dans des parfums (en applicateur à bille et en pulvérisateur), des hydratants pour le corps, des hydratants pour le visage, des huiles de massage (enfants de 1 an et moins), des pains de massage, des produits autobronzants, des produits de maquillage pour le visage (fonds de teint liquides), des rouges à lèvres (enfants de 8 ans et moins) et des écrans solaires (lotions) (PSN) (enfants de 3 ans et moins et enfants de 14 à 18 ans) ne permettent peut-être pas de tenir adéquatement compte des incertitudes entourant les effets sur la santé et les données sur l’exposition ayant servi à caractériser les risques. Il en va de même pour les marges d’exposition entre la concentration entraînant un effet critique et les estimations de l’exposition quotidienne découlant de l’utilisation d'essence de mimosa dans des diffuseurs d’arôme et assainisseurs d’air faits soi-même, des huiles de massage faites soi-même et des hydratants pour le corps faits soi-même.
En ce qui a trait à l'extrait de lierre, nous avons caractérisé les risques des principaux composants, soit l’hédéracoside C, l’hédéragénine et l’alpha-hédérine, à l’aide des renseignements sur les effets sur la santé de l’énoxolone, la substance analogue. L’effet critique sur la santé identifié était la neurotoxicité pour le développement. Il est estimé que les marges d’exposition à l'extrait de lierre découlant des huiles de massage, des hydratants pour le corps, des hydratants pour le visage, des fixateurs de maquillage facial (en pulvérisateur), des exfoliants pour le corps et des revitalisants capillaires (sans rinçage) ne permettent peut-être pas de tenir adéquatement compte des incertitudes entourant les effets sur la santé et les données sur l’exposition ayant servi à caractériser les risques. Il en va de même pour les marges d’exposition entre la concentration entraînant un effet critique et les estimations de l’exposition quotidienne due à l’utilisation d’extrait de lierre dans des huiles de massage faites soi-même et des hydratants pour le corps faits soi-même.
Dans le cas de l’extrait de ginseng à 5 folioles, nous avons évalué les effets sur la santé à l’aide d’un analogue de lecture croisée, le ginseng asiatique (Panax ginseng). Aucun effet préoccupant sur la santé n’a été relevé pour l’extrait de ginseng à 5 folioles. Par conséquent, cette substance est considérée comme peu préoccupante pour la santé humaine aux niveaux d’exposition actuels.
L’évaluation des effets sur la santé humaine causés par chaque substance a tenu compte des sous-groupes de la population canadienne qui pourraient être plus susceptibles de subir des effets nocifs en raison d’une plus grande sensibilité ou exposition. Certains sous-groupes, comme les nourrissons, les enfants et les personnes en âge de procréer, sont régulièrement étudiés tout au long de l’évaluation. Par exemple, les expositions spécifiques à l’âge sont systématiquement estimées, et les études de toxicité pour le développement et la reproduction sont examinées à la recherche de potentiels effets nocifs sur la santé. Ces sous-groupes potentiellement plus exposés ou plus sensibles ont été pris en compte dans les résultats de l’évaluation des risques pour la santé humaine.
À la lumière des renseignements contenus dans la présente ébauche d’évaluation, il est proposé de conclure que l'essence de bois de cèdre, l'essence de bois de cèdre du Texas, l’énoxolone, l'essence de mimosa et l'extrait de lierre satisfont aux critères énoncés à l’alinéa 64c) de la LCPE, car ils pénètrent ou peuvent pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines. À la lumière des renseignements contenus dans la présente ébauche d’évaluation, il est proposé de conclure que l’alpha-cédrène, le thujopsène, l’alpha-gurjunène, le bêta-patchoulène, le bêta-cédrène, les terpènes et terpénoïdes de l’essence de cèdre, l’acétate amboryle, l’acide glycyrrhétinique préparé avec l’allantoïne, et l’extrait de ginseng à 5 folioles ne satisfont pas aux critères énoncés à l’alinéa 64c) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est proposé de conclure que l'essence de bois de cèdre, l'essence de bois de cèdre du Texas, l’énoxolone, l'essence de mimosa et l'extrait de lierre satisfont à un ou plusieurs des critères énoncés à l’article 64 de la LCPE, et que l’alpha-cédrène, le thujopsène, l’alpha-gurjunène, le bêta-patchoulène, le bêta-cédrène, les terpènes et terpénoïdes de l’essence de cèdre, l’acétate amboryle, l’acide glycyrrhétinique préparé avec l’allantoïne, et l’extrait de ginseng à 5 folioles ne satisfont à aucun des critères énoncés à l’article 64 de la LCPE.
1. Introduction
En vertu de l’article 68 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE) (Canada, 1999), les ministres de l’Environnement et de la Santé ont réalisé l’évaluation de 14 des 76 substances appelées collectivement « Groupe des terpènes et des terpénoïdes » dans le cadre du Plan de gestion des produits chimiques (PGPC). Cette évaluation visait à déterminer si ces substances présentent ou peuvent présenter un risque pour l’environnement ou la santé humaine. Les substances de ce groupe ont été jugées prioritaires aux fins de l’évaluation, car elles répondaient aux critères de catégorisation décrits dans le document d’ECCC et de SC (modifié en 2017) ou ont été considérées comme prioritaires en vertu d’autres mécanismes (ECCC, SC [modifié en 2017]).
Parmi les autres substances du Groupe des terpènes et des terpénoïdes, 46 ont fait l’objet d’une évaluation des risques pour l’environnement et la santé humaine. Les décisions prises à leur égard sont présentées dans d’autres rapportsNote de bas de page 2. Les décisions concernant les substances restantes seront communiquées dans d’autres évaluations.
Les 14 substances visées par la présente ébauche d’évaluation seront ci-après désignées comme le Groupe des sesquiterpènes tricycliques et des triterpénoïdes. Certaines substances sont évaluées en sous-groupe, en raison des similitudes de leur structure chimique, de leurs propriétés ou de leur toxicité. Puisqu’elles sont potentiellement utilisées de manière semblable et dans des applications semblables, nous avons évalué les risques potentiels pour la santé humaine en posant des hypothèses d’exposition semblables.
Nous avons caractérisé les risques pour l’environnement associés aux substances du Groupe des sesquiterpènes tricycliques et des triterpénoïdes au moyen de l’approche de Classification du risque écologique (CRE) des substances organiques (ECCC, 2016a). La CRE décrit les dangers d’une substance à l’aide de paramètres clés, dont le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne établis à partir du réseau trophique, la biodisponibilité, ainsi que l’activité chimique et biologique. De plus, elle tient compte de l’exposition possible des organismes dans les milieux aquatiques et terrestres en fonction de facteurs comme les taux d’émission potentielle, la persistance globale et le potentiel de transport à grande distance dans l’atmosphère. Combinés ensemble, les divers éléments de preuve permettent de déterminer pour quelles substances il convient d’évaluer plus à fond le potentiel de causer des effets nocifs sur l’environnement, et d’établir lesquelles présentent une faible probabilité de causer de tels effets.
Certaines substances du Groupe des sesquiterpènes tricycliques et des triterpénoïdes ou leurs analogues de lecture croisée sont ou ont été étudiés par l’Environmental Protection Agency des États-Unis (US EPA), l’Agence européenne des produits chimiques (ECHA), l’Autorité européenne de sécurité des aliments (EFSA), le Comité mixte de l’Organisation des Nations Unies pour l’alimentation et l’agriculture et de l’Organisation mondiale de la Santé d’experts des additifs alimentaires (JECFA), le Comité scientifique européen pour la sécurité des consommateurs (CSSC), l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (ANSES) de la France, le comité scientifique norvégien pour l’alimentation et l’environnement (VKM), et l’Organisation mondiale de la Santé (OMS). Les études de ces organisations ont étayé la caractérisation des effets sur la santé humaine de la présente évaluation.
La présente ébauche d’évaluation tient compte des renseignements sur les propriétés chimiques, le devenir dans l’environnement, les dangers, les utilisations et l’exposition, ainsi que des renseignements supplémentaires soumis par les intervenants. Nous avons recensé les données pertinentes jusqu’en décembre 2021. Nous nous sommes servis de données empiriques tirées d’études clés ainsi que quelques résultats obtenus par modélisation pour formuler les conclusions proposées.
L’alpha-cédrène et l’alpha-gurjunène ont été décelés dans des produits de vapotage, aussi appelés cigarettes électroniques (US EPA, 2019). L’évaluation des risques pour la population générale découlant de cette utilisation, y compris la comparaison aux risques des cigarettes traditionnelles, et l’examen des options d’atténuation possibles de ceux-ci, est encadrée par un cadre législatif et réglementaire distinct (SC [modifié en 2020]).
La présente ébauche d’évaluation a été préparée par le personnel du Programme d’évaluation des risques en vertu de la LCPE de Santé Canada et d’Environnement et Changement climatique Canada. Elle tient compte de données provenant d’autres programmes de ces ministères. Son volet axé sur la santé humaine a fait l’objet d’un examen par des pairs ou d’une consultation externe. Jennifer Flippin, Theresa Lopez et Joan Garey, toutes affiliées à TetraTech inc., en ont commenté les parties techniques. Le volet de l’évaluation axé sur l’environnement repose sur le document de la CRE (publié le 30 juillet 2016), lequel a fait l’objet d’un examen externe et d’une consultation publique de 60 jours. Bien que les commentaires externes aient été pris en considération, Santé Canada et Environnement et Changement climatique Canada demeurent responsables du contenu final et des conclusions de la présente évaluation.
Pour établir si les substances répondent aux critères de l’article 64 de la LCPE, l’évaluation s’appuie sur des renseignements scientifiques essentiels. Ceux-ci comprennent, s’ils sont disponibles, des renseignements sur les sous-populations susceptibles d’être plus sensibles ou plus exposées, sur les environnements vulnérables et sur les effets cumulatifsNote de bas de page 3. En outre, l’évaluation repose sur une approche fondée sur le poids de la preuve et le principe de précautionNote de bas de page 4. Dans la présente ébauche d’évaluation, nous exposons les données essentielles et les considérations sur lesquelles les conclusions proposées sont fondées.
2. Identité des substances
Les tableaux 2-1 et 2-2 présentent les numéros au registre du Chemical Abstracts Service (nos CASNote de bas de page 5), les noms figurant sur la Liste intérieure (LI) et les noms communs des substances du Groupe des sesquiterpènes tricycliques et des triterpénoïdes. Ils montrent aussi les structures chimiques et les formules moléculaires de ces substances, ou bien les noms chimiques, les structures, les plages de concentrations dans les huiles essentielles et les formules moléculaires des substances représentatives des UVCB (substances de composition inconnue ou variable, produits de réaction complexes ou matières biologiques) comprises dans ce groupe. Les UVCB sont des substances d’origine naturelle ou produites par des réactions complexes. Elles ne sont pas des mélanges intentionnels de substances distinctes, et sont considérées comme une seule substance. La complexité et la variabilité de leur composition peuvent les rendre difficiles à caractériser de manière complète et systématique. Les substances visées par la présente évaluation ont été divisées en 4 substances individuelles et en 2 sous-groupes, en fonction de leur structure chimique, de leurs propriétés ou de leur toxicité.
Les terpènes sont des hydrocarbures simples constitués d’unités répétées d’isoprène comportant 5 atomes de carbone (figure 2-1). Les terpénoïdes sont une classe de terpènes modifiés portant différents groupes fonctionnels et possédant un groupe méthyle oxydé qui est déplacé vers différentes positions. Les terpènes et les terpénoïdes sont classés en fonction du nombre d’unités d’isoprène qu’ils contiennent (Caputi et Aprea, 2011; Perveen, 2018). Les monoterpènes contiennent 2 unités d’isoprène. Les préfixes di-, tri- et tétra- désignent respectivement deux, 3 et 4 unités de monoterpène. Les sesquiterpènes et les sesterterpènes contiennent 3 et 5 unités d’isoprène, respectivement.
Figure 2-1. Structure générale d’une unité d’isoprène

Description longue
Structure générale d'une unité d'isoprène (2-méthylbuta-1,3-diène)
Ces substances sont des composants d’huiles essentielles présentes dans un vaste éventail de végétaux. Les huiles essentielles sont des mélanges de composés organiques volatils provenant d’une seule source botanique qui contribuent à la saveur et au parfum de la plante. Elles comptent de nombreux composants pouvant être extraits de différentes parties de la plante (par exemple, feuilles, graines, tiges, fleurs, racines, fruits, bois, écorce, herbe, gomme, bulbes, et bourgeons d’arbres ou de fleurs) (Tisserand et Young, 2014). De plus, la concentration de ces principaux composants peut varier en fonction de différents facteurs, notamment l’origine et l’espèce de la plante, la température, le sol et le lieu géographique. Les huiles essentielles extraites des plantes d’un même genre et d’une même espèce peuvent donc être chimiquement différentes, même si leur origine est la même.
| Sous-groupea | No CAS | Nom sur la LI (nom commun) |
Structure chimique ou noms chimiques, structures et plages de concentrations dans les huiles essentielles des substances représentatives, et formule moléculaire |
|---|---|---|---|
| 1 | 469-61-4 | 3R-(3α,3aβ,7β,8aα)]-2,3,4,7,8,8a-Hexahydro-3,6,8,8-tétraméthyl-1H-3a,7-méthanoazulène (alpha-cédrène) |
![C[C@@H]1CC[C@@H]2[C@]13CC=C([C@H](C3)C2(C)C)C](/content/dam/eccc/images/pded/terpenes-group-4/Table2-1-1.jpg) C15H24 |
| 1 | 470-40-6 | [1AS-(1aα,4aβ,8aRæ)]-1,1a,4,4a,5,6,7,8-Octahydro-2,4a,8,8-tétraméthylcyclopropa[d]naphtalène (thujopsène) |
![CC1=CC[C@@]2(CCCC([C@]23[C@H]1C3)(C)C)C](/content/dam/eccc/images/pded/terpenes-group-4/Table2-1-2.jpg) C15H24 |
| 1 | 489-40-7 | 1 AR-(1aα,4α,4aβ,7bα)]-1a,2,3,4,4a,5,6,7b-Octahydro-1,1,4,7-tétraméthyl-1H-cycloprop[e]azulène (alpha-gurjunène) |
![C[C@@H]1CC[C@@H]2[C@@H](C2(C)C)C3=C(CCC13)C](/content/dam/eccc/images/pded/terpenes-group-4/Table2-1-3.jpg) C15H24 |
| 1 | 514-51-2 | [1S-(1α,4α,7α)]-1,2,3,4,5,6,7,8-Octahydro-1,4,9,9-tétraméthyl-4,7-méthanoazulène |
![C[C@H]1CCC2=C1C[C@H]3CC[C@@]2(C3(C)C)C](/content/dam/eccc/images/pded/terpenes-group-4/Table2-1-4.jpg) C15H24 |
| 1 | 546-28-1 | [3R-(3α,3aβ,7β,8aα)]-Octahydro-3,8,8-triméthyl-6-méthylène-1H-3a,7-méthanoazulène (bêta-cédrène) |
![C[C@@H]1CC[C@@H]2[C@]13CCC(=C)[C@H](C3)C2(C)C](/content/dam/eccc/images/pded/terpenes-group-4/Table2-1-5.jpg) C15H24 |
| 1 | 8000-27-9 | Essences de bois de cèdreb (essence de bois de cèdre) |
Alpha-atlantone |
| 1 | 68608-32-2 | Terpènes et terpénoïdes de l’essence de cèdreb (terpènes et terpénoïdes de l’essence de cèdre) |
|
| 1 | 68990-83-0 | Essences de bois de cèdre du Texasb (essence de bois de cèdre du Texas) |
|
| Substance individuelle | 59056-62-1 | Acétate d’octahydro-7,7,8,8-tétraméthyl-2,3b-méthano-3bH-cyclopenta[1,3]cyclopropa[1,2]benzène-4-méthyle (acétate amboryle) |
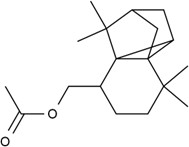 C18H28O2 |
Abréviations : No CAS = numéro au registre du Chemical Abstracts Service; LI = Liste intérieure.
a Le groupe des sesquiterpènes tricycliques a été évalué comme un sous-groupe et une substance individuelle. Le sous-groupe 1 des sesquiterpènes tricycliques comprend l’alpha-cédrène, le bêta-cédrène et le thujopsène en tant que substances discrètes et principaux composants de l'essence de bois de cèdre, de l'essence de bois de cèdre du Texas, et des terpènes et terpénoïdes de l’essence de cèdre, ainsi que l’alpha-gurjunène et le bêta-patchoulène, qui ont été évalués selon l’approche de lecture croisée avec l’alpha-cédrène. L’acétate amboryle a été évalué individuellement aux fins de la caractérisation des risques pour la santé humaine.
b Substance UVCB.
c Plage de concentrations de composants principaux de l'essence de bois de cèdre (Juniperus virginiana) et des terpènes et terpénoïdes de l’essence de cèdre établie par Du et al. (2011), le National Toxicology Program (NTP) (2016), et Tisserand et Young (2014).
d Plage de concentrations de composants principaux de l'essence de bois de cèdre (Cedrus atlantica) et des terpènes et terpénoïdes de l’essence de cèdre établie par Chalchat et al. (1994), Aberchane et al. (2004), Satrani et al. (2006), Tisserand et Young (2014), Zrira et Ghanmi (2016), et Uehara et al. (2017).
e Plage de concentrations de composants principaux de l'essence de bois de cèdre du Texas établie par Kamatou et al. (2010), Tisserand et Young (2014), et Surburg et Panten (2016).
| Sous-groupea | No CAS | Nom sur la LI (nom commun) |
Structure chimique ou noms chimiques, structures et plages de concentrations dans les huiles essentielles des substances représentatives, et formule moléculaire |
|---|---|---|---|
| 2 | 471-53-4 | Énoxolone (énoxolone) |
![C[C@]12CC[C@](C[C@H]1C3=CC(=O)[C@@H]4[C@]5(CC[C@@H](C([C@@H]5CC[C@]4([C@@]3(CC2)C)C)(C)C)O)C)(C)C(=O)O](/content/dam/eccc/images/pded/terpenes-group-4/Table2-2-1.jpg) C30H46O4 |
| 2 | 4572-09-2 | Acide 3β-hydroxy-11-oxo-oléan-12-én-29-oïque composé (1:) préparé avec l’allantoïneb (acide glycyrrhétinique préparé avec l’allantoïne) |
|
| Substance individuelle | 8031-03-6 | Essences de mimosab (essence de mimosa) |
|
| Substance individuelle | 84082-54-2 | Lierre, Hedera helix, extraitsb (extrait de lierre) |
|
| Substance individuelle | 90045-38-8 | Extrait de ginseng, Panax quinquefoliumb (extrait de ginseng à 5 folioles) |
![CC(=CCCC(C)([C@H]1CC[C@@]2(C1CC[C@H]3[C@]2(CC[C@@H]4[C@@]3(CC[C@@H](C4(C)C)O)C)C)C)O)C](/content/dam/eccc/images/pded/terpenes-group-4/Table2-2-10.jpg) Ginsénosides 70 à 90 %e C54H92O23 |
Abréviations : No CAS = numéro au registre du Chemical Abstracts Service; LI = Liste intérieure.
a Le groupe des triterpénoïdes a été évalué comme un sous-groupe et 3 substances individuelles. Pour le sous-groupe 2 des triterpénoïdes, la caractérisation des risques pour la santé humaine se fonde sur les renseignements sur les dangers posés par l’énoxolone. L’énoxolone est une substance discrète du sous-groupe et le principal composant de l’acide glycyrrhétinique préparé avec l’allantoïne. L’essence de mimosa, l’extrait de lierre et l’extrait de ginseng à cinq folioles ont été évalués individuellement.
b Substance UVCB.
c Plage de concentrations de composants principaux de l'essence de mimosa établie par Perriot et al. (2010) et Tisserand et Young (2014).
d Plage de concentrations de composants principaux de l'extrait de lierre établie par Lutsenko et al. (2010), Havlíková et al. (2015), Yu et al. (2015) et Bezruk et al. (2020).
e Plage de concentrations de composants principaux de l’extrait de ginseng à 5 folioles établie par Assinewe et al. (2003), Wang et al. (2015) et Han et al. (2016). Les composants dont le pourcentage de présence est le plus élevé sont les saponines triterpéniques ginsénosides (6 unités d’isoprène ou 3 unités de monoterpène) et les ginsénosides (G)-Rb1, G-Rb2, G-Rc, G-Rg1, G-Re, G-Rd, G-Rg3, G-Rh2, G-Rg2 et G-Rh1.
2.1 Choix des analogues et utilisation de modèles QSAR
Dans certains cas, nous avons suivi une approche de lecture croisée utilisant les données associées à des substances analogues et les résultats de modèles fondés sur les relations quantitatives structure-activité (QSAR) pour éclairer les évaluations relatives à l’environnement et à la santé humaine. Les analogues choisis possédaient une structure ou une fonctionnalité semblables à celles des substances du groupe (toxicocinétique et propriétés physico-chimiques semblables), et l’on disposait à leur sujet de données empiriques pertinentes pouvant servir à faire une extrapolation aux substances sur lesquelles il existait peu de telles données. Leur choix découlait d’une analyse effectuée à l’aide de la boîte à outils QSAR de l’Organisation de coopération et de développement économiques (OCDE), version 4.2 (OECD QSAR Toolbox, 2019). L’applicabilité des modèles QSAR a été déterminée au cas par cas. Des précisions sur les données d’extrapolation et les modèles QSAR utilisés aux fins de l’évaluation des effets sur la santé humaine du sous-groupe 2 des triterpénoïdes et de l’extrait de ginseng à 5 folioles sont données plus loin, dans les sections correspondantes du présent rapport. Une liste des analogues ayant servi à évaluer les risques pour la santé humaine figure dans le tableau 2-3, accompagnée d’une indication des données d’extrapolation disponibles pour différents paramètres.
| Substance ou sous-groupe évalué | No CAS de l’analogue | Nom commun | Structure chimique, formule moléculaire et chaîne du système de description linéaire de la structure des espèces chimiques (Simplified Molecular Input Line Entry System, SMILES) | Masse moléculaire (g/mol) |
|---|---|---|---|---|
| Sous-groupe 2 des triterpénoïdes | 1405-86-3 | Acide glycyrrhizique | ![[H][C@@]12C[C@](C)(CC[C@]1(C)CC[C@]1(C)C2=CC(=O)[C@]2([H])[C@@]3(C)CC[C@H](O[C@H]4O[C@@H]([C@@H](O)[C@H](O)[C@H]4O[C@@H]4O[C@@H]([C@@H](O)[C@H](O)[C@H]4O)C(O)=O)C(O)=O)C(C)(C)[C@]3([H])CC[C@@]12C)C(O)=O](/content/dam/eccc/images/pded/terpenes-group-4/Table2-3-1.jpg) C42H62O16 [H][C@@]12C[C@](C)(CC[C@]1(C)CC[C@]1(C)C2=CC(=O)[C@]2([H])[C@@]3(C)CC[C@H](O[C@H]4O[C@@H]([C@@H](O)[C@H](O)[C@H]4O[C@@H]4O[C@@H]([C@@H](O)[C@H](O)[C@H]4O)C(O)=O)C(O)=O)C(C)(C)[C@]3([H])CC[C@@]12C)C(O)=O |
822,9 |
| Extrait de ginseng à 5 folioles | 50647-08-0 | Panax ginseng | 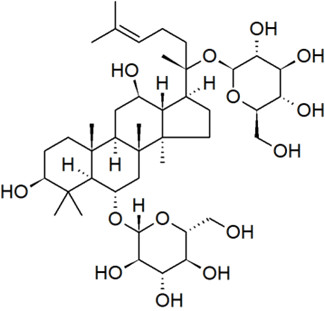 C42H66O17 UVCB, pas de chaîne SMILES |
843 |
Abréviation : No CAS = numéro au registre du Chemical Abstracts Service.
3. Propriétés physiques et chimiques
Le tableau 3-1 présente un résumé des propriétés physiques et chimiques des substances du Groupe des sesquiterpènes tricycliques et des triterpénoïdes. Il indique les plages de valeurs pour chaque propriété. Lorsque les données expérimentales sur une propriété étaient limitées ou indisponibles, nous avons utilisé des données de substances analogues pour faire une extrapolation ou bien des modèles QSAR pour obtenir des valeurs prédites. Les valeurs d’autres propriétés physiques et chimiques sont présentées dans le document d’ECCC (2016b).
| Substances | Nom commun des composants représentatifs (no CAS) | Masse moléculaire (g/mol)a | Solubilité dans l’eau (mg/L)a | Pression de vapeur (Pa)a | Log Koea |
|---|---|---|---|---|---|
| Alpha-cédrène | S.O. | 204,35 | 0,1504M | 0,0184M | 5,74M |
| Thujopsène | S.O. | 204,35 | 0,07152M | 9,37M | 6,12M |
| Alpha-gurjunène | S.O. | 204,35 | 0,0638M | 2,72M | 6,18M |
| Bêta-patchoulène | S.O. | 204,35 | 0,1165M | 3,25M | 5,87M |
| Bêta-cédrène | S.O. | 204,35 | 0,1289M | 6,08M | 5,82M |
| Essence de bois de cèdre Terpènes et terpénoïdes de l’essence de cèdre | Alpha-cédrène (469-61-4) | 204,35 | 0,1504M | 0,0184M | 5,74M |
| Essence de bois de cèdre Terpènes et terpénoïdes de l’essence de cèdre | Thujopsène (470-40-6) | 204,35 | 0,07152M | 9,37M | 6,12M |
| Essence de bois de cèdre Terpènes et terpénoïdes de l’essence de cèdre | Cédrol (77-53-2) | 222,37 | 21,88M | 0,019M | 4,33M |
| Essence de bois de cèdre Terpènes et terpénoïdes de l’essence de cèdre | Bêta-cédrène (546-28-1) | 204,35 | 0,1289M | 6,08M | 5,82M |
| Essence de bois de cèdre Terpènes et terpénoïdes de l’essence de cèdre | Alpha-himachalène (3853-83-6) | 204,19 | 0,05011M | 4,11M | 6,30M |
| Essence de bois de cèdre Terpènes et terpénoïdes de l’essence de cèdre | Bêta-himachalène (1461-03-6) | 204,19 | 0,04532M | 1,47M | 6,35M |
| Essence de bois de cèdre Terpènes et terpénoïdes de l’essence de cèdre | Gamma-himachalène (53111-25-4) | 204,19 | 0,05849M | 3,23M | 6,22M |
| Essence de bois de cèdre Terpènes et terpénoïdes de l’essence de cèdre | Alpha-atlantone (108645-54-1) | 218,34 | 1,078M | 0,43M | 5,28M |
| Essence de bois de cèdre du Texas | Thujopsène (470-40-6) | 204,35 | 0,07152M | 9,37M | 6,12M |
| Essence de bois de cèdre du Texas | Alpha-cédrène (469-61-4) | 204,35 | 0,1504M | 0,0184M | 5,74M |
| Essence de bois de cèdre du Texas | Cédrol (77-53-2) | 222,37 | 21,88M | 0,017M | 4,33M |
| Acétate amboryle | S.O. | 276,41 | 0,278M | 0,033M | 5,60M |
| Énoxolone | S.O. | 470,684 | 0,0114M | 3,88 × 10-13M | 6,90M |
| Acide glycyrrhétinique préparé avec l’allantoïne | Énoxolone (471-53-4) | 470,684 | 0,0114M | 3,88 × 10-13M | 6,90M |
| Acide glycyrrhétinique préparé avec l’allantoïne | Allantoïne (97-59-6) | 158,12 | 1 × 106M | 1,74 × 10-7M | -3,14M |
| Essence de mimosa | Lupénone (1617-70-5) | 424,70 | 7,64 × 10-5M | 3,88 × 10-6M | 8,72M |
| Essence de mimosa | Lupéol (545-47-1) | 426,72 | 8,783 × 10-5M | 6,7 × 10-9M | 9,23M |
| Extrait de lierre | Hédéracoside C (14216-03-6) | 1 221,41 | 0,103M | 0M | -1,20M |
| Extrait de lierre | Hédéragénine (465-99-6) | 472,71 | 3,4 × 10-3M | 2,07 × 10-13M | 6,90M |
| Extrait de lierre | Alpha-hédérine (27013-91-8) | 750,98 | 6,58 × 10-3M | 8,88 × 10-27M | 4,43M |
| Extrait de ginseng à 5 folioles | Ginsénoside-Rb1 (41753-43-9) | 1 109,30 | 0,551M | 0M | -1,14M |
| Extrait de ginseng à 5 folioles | Ginsénoside-Rb2 (11021-13-9) | 1 079,27 | 0,918M | 0M | -1,16M |
| Extrait de ginseng à 5 folioles | Ginsénoside-Rc (11021-14-0) | 1 079,27 | 0,364M | 0M | -0,69M |
| Extrait de ginseng à 5 folioles | Ginsénoside-Rg1 (22427-39-0) | 801,01 | 0,535M | 0M | 1,33M |
| Extrait de ginseng à 5 folioles | Ginsénoside-Re (52286-59-6) | 947,15 | 0,496M | 0M | 0,21M |
| Extrait de ginseng à 5 folioles | Ginsénoside-Rd (52705-93-8) | 947,15 | 0,053M | 0M | 1,35M |
| Extrait de ginseng à 5 folioles | Ginsénoside-Rg3 (14197-60-5) | 785,01 | 0,008M | 0M | 3,36M |
| Extrait de ginseng à 5 folioles | Ginsénoside-Rh2 (78214-33-2) | 622,87 | 0,005M | 0M | 5,15M |
| Extrait de ginseng à 5 folioles | Ginsénoside-Rg2 (52286-74-5) | 785,01 | 0,071M | 0M | 2,49M |
| Extrait de ginseng à 5 folioles | Ginsénoside-Rh1 (63223-86-9) | 638,89 | 0,073M | 0M | 3,61M |
Abréviations : No CAS = numéro au registre du Chemical Abstracts Service; S.O. = sans objet; Koe = coefficient de partage octanol-eau; M = modélisé.
a US EPA (2012a)
4. Sources et utilisations
Toutes les substances du Groupe des sesquiterpènes tricycliques et des triterpénoïdes ont fait l’objet d’une enquête menée en vertu de l’article 71 de la LCPE (Canada, 2012). Le tableau 4-1 présente un résumé des renseignements déclarés sur les quantités de fabrication et d’importation totales pour ce groupe (Environnement Canada, 2013).
| Nom commun | Quantité totale fabriquéea (kg) | Quantité totale importéea (kg) | Année de déclaration |
|---|---|---|---|
| Alpha-cédrène | AD | 100 à 1000 | 2011 |
| Thujopsène | AD | AD | 2011 |
| Alpha-gurjunène | AD | AD | 2011 |
| Bêta-patchoulène | AD | AD | 2011 |
| Bêta-cédrène | AD | AD | 2011 |
| Essence de bois de cèdre | AD | 100 à 1000 | 2011 |
| Terpènes et terpénoïdes de l’essence de cèdre | AD | AD | 2011 |
| Essence de bois de cèdre du Texas | 277 | 200 | 2011 |
| Acétate amboryle | AD | AD | 2011 |
| Énoxolone | AD | AD | 2011 |
| Acide glycyrrhétinique préparé avec l’allantoïne | AD | AD | 2011 |
| Essence de mimosa | AD | AD | 2011 |
| Extrait de lierre | AD | AD | 2011 |
| Extrait de ginseng à 5 folioles | AD | AD | 2011 |
Abréviation : AD = aucune déclaration de quantité supérieure au seuil de déclaration de 100 kg.
a Les valeurs correspondent aux quantités déclarées en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Canada, 2012). Consulter l’enquête pour connaître les inclusions et les exclusions particulières (annexes 2 et 3).
Les renseignements soumis en réponse à une enquête menée en vertu de l’article 71 de la LCPE indiquent que l'essence de bois de cèdre du Texas est utilisées comme agent odorant dans des produits de nettoyage et d’entretien des meubles, des détergents à lessive et à vaisselle, des produits de soins personnelsNote de bas de page 6, des produits d’hygiène de l’air ambiant, des produits d’entretien des vêtements et des chaussures, des produits de soins pour animaux domestiques, des produits d’entretien des automobiles, et des lubrifiants et graisses (Environnement Canada, 2013). Ils montrent également que l’alpha-cédrène est utilisé dans des produits de soins personnels, des produits de nettoyage et d’entretien des meubles et des produits d’hygiène de l’air ambiant (Environnement Canada, 2013). De plus, ils indiquent que le thujopsène, l’alpha-gurjunène, le bêta-patchoulène, l’acétate amboryle, le bêta-cédrène, l’essence de bois de cèdre et l’essence de mimosa sont utilisés dans des produits de soins personnels (Environnement Canada, 2013).
D’autres utilisations des substances du sous-groupe 1 des sesquiterpènes tricycliques, de l’acétate amboryle, des substances du sous-groupe 2 des triterpénoïdes, de l' essence de mimosa, de l'extrait de lierre et de l’extrait de ginseng à 5 folioles sont indiquées dans le tableau 4-2.
| Utilisation | Additif alim.a | Additif ind.a, b | Matériau d’emballage alim.a | Méd.c | PSNd | Cos.e | PAPf |
|---|---|---|---|---|---|---|---|
| Alpha-cédrène | N | N | N | N | N | O | O (F) |
| Thujopsène | N | N | N | N | N | N | N |
| Alpha-gurjunène | N | N | N | N | N | N | N |
| Bêta-patchoulène | N | N | N | N | N | N | O (F) |
| Bêta-cédrène | N | N | N | N | N | N | N |
| Essence de bois de cèdre | N | O | N | N | O (IM, INM) | O | O (A, F) |
| Terpènes et terpénoïdes de l’essence de cèdre | N | N | N | N | N | N | O (F) |
| Essence de bois de cèdre du Texas | N | O | N | N | O (INM) | O | O (F) |
| Acétate amboryle | N | N | N | N | N | N | N |
| Énoxolone | N | N | N | O (INM) | O (IM, INM) | O | N |
| Acide glycyrrhétinique préparé avec l’allantoïne | N | N | N | N | N | N | N |
| Essence de mimosa | N | N | N | N | O (INM) | O | N |
| Extrait de lierre | N | N | N | N | O (IM, INM) | O | N |
| Extrait de ginseng à 5 folioles | N | N | N | O (IM, INM) | O (IM, INM) | O | N |
Abréviations : A = ingrédient actif; alim. = alimentaire; cos. = cosmétique; F = produit de formulation; IM = ingrédient médicinal; ind. = indirect; INM = ingrédient non médicinal; méd. = médicament; N = non, utilisation non déclarée pour cette substance; O = oui, utilisation déclarée pour cette substance; PAP = produit antiparasitaire; PSN = produit de santé naturel.
a Communication personnelle, courriels de la Direction des aliments de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, 2017, 2021; source non citée.
b Bien qu’ils ne soient pas définis dans la Loi sur les aliments et drogues, les additifs indirects peuvent être considérés, à des fins administratives, comme les substances utilisées dans les usines de transformation des aliments qui sont donc susceptibles de se retrouver de manière fortuite dans les aliments sous forme de résidus (par exemple nettoyants, désinfectants).
c Listé dans la Base de données sur les produits pharmaceutiques comme étant présent en tant qu’ingrédient médicinal ou non médicinal dans des désinfectants ou des médicaments à usage humain ou vétérinaire au Canada. Communication personnelle, courriels de la Direction des produits thérapeutiques de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, 2017, 2021; source non citée.
d Listé dans la Base de données sur les produits de santé naturels homologués comme étant présent en tant qu’ingrédient médicinal ou non médicinal dans des PSN au Canada. Communication personnelle, courriels de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, 2017, 2021; source non citée.
e Présence signalée dans des cosmétiques selon les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques. Communication personnelle, courriels de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, 2017, 2020; source non citée.
f Ingrédient actif ou produit de formulation dans des produits antiparasitaires homologués au Canada. Communication personnelle, courriels de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, 2015, 2020; source non citée.
Nous avons examiné les déclarations concernant le Groupe des sesquiterpènes tricycliques et des triterpénoïdes faites à Santé Canada en vertu du Règlement sur les cosmétiques, la Base de données sur les produits de santé naturels homologués (BDPSNH [modifiée en 2024]), la Base de données sur les produits pharmaceutiques (BDPP [modifiée en 2021]), les sites Web et bases de données accessibles au public (par exemple, la Consumer Product Information Database [CPID], c2021), et les fiches de données techniques et de sécurité pour trouver les produits risquant d’entraîner une exposition. Ces produits et les expositions qui leur sont associées sont présentés ci-dessous.
Produits faits soi-même
Certains terpènes et terpénoïdes du Groupe des sesquiterpènes tricycliques et des triterpénoïdes qui ont des propriétés aromatiques sont commercialisés au Canada à des concentrations pouvant atteindre 100 %. Les consommateurs peuvent donc les acheter à l’état non dilué et les utiliser pour fabriquer eux-mêmes des produits. Les produits faits soi-même qui sont susceptibles d’entraîner une exposition élevée des consommateurs comprennent les diffuseurs d’arôme et assainisseurs d’air, les huiles de massage, les huiles pour le bain, les hydratants pour le corps, les brumisateurs faciaux et les nettoyants liquides pour plancher. Par conséquent, la présente évaluation vise également les utilisations de substances non diluées dans les produits faits soi-même. Les paramètres d’estimation de l’exposition cutanée et par inhalation aux produits faits soi-même sont présentés à l’annexe B.
Sous-groupe 1 des sesquiterpènes tricycliques (alpha-cédrène, thujopsène, alpha-gurjunène, bêta-patchoulène, bêta-cédrène, essence de bois de cèdre, terpènes et terpénoïdes de l’essence de cèdre, et essence de bois de cèdre du Texas)
Le sous-groupe 1 des sesquiterpènes tricycliques se compose de 5 substances distinctes (alpha-cédrène, thujopsène, alpha-gurjunène, bêta-patchoulène et bêta-cédrène) et de 3 UVCB (essence de bois de cèdre, terpènes et terpénoïdes de l’essence de cèdre et essence de bois de cèdre du Texas).
L’alpha-cédrène est une substance d’origine naturelle obtenue par distillation fractionnée des essence de bois de cèdre ou par déshydratation du cédrol (Opdyke, 1978). Il est un composant des essence de bois de cèdre, de sauge, de Saussurea costus et de lavande ainsi que d’autres essences (Opdyke, 1978). Il a été détecté dans une proportion variant de 21,1 à 38 % dans les essence de bois de cèdre et les terpènes et terpénoïdes de l’essence de cèdre, et dans une proportion variant de 15 à 30,7 % dans les essence de bois de cèdre du Texas.
Le thujopsène est une substance d’origine naturelle qui serait un composant de l’huile de bois et du duramen d’arbres de l’ordre des Cupressales (Dauben, 1963). Il a été détecté dans une proportion d’environ 27,6 % dans l’essence de bois de cèdre et les terpènes et terpénoïdes de l’essence de cèdre, et dans une proportion de 35 % à 60,4 % dans l’essence de bois de cèdre du Texas.
L’alpha-gurjunène est une substance d’origine naturelle présente dans des huiles essentielles, notamment celles du bois de cèdre, de l’eucalyptus, du labdanum, du laurier noble, de la verveine odorante, des baies du faux poivrier, de la sauge et du théier (Goodscents, 2017).
Le bêta-patchoulène est une substance odorante d’origine naturelle qui serait un composant de plusieurs huiles essentielles, notamment celles du patchouli (Zhang, 2016), du basilic et du tagète (Goodscents, 2017).
Le bêta-cédrène est une substance d’origine naturelle qui se retrouve dans l’essence de bois de cèdre. Il a été détecté dans une proportion de 8,2 % et de 9,2 % dans l’essence de bois de cèdre et les terpènes et terpénoïdes de l’essence de cèdre, respectivement.
L'essence de bois de cèdre sont une substance UVCB d’origine naturelle extraite du Juniperus virginiana, qui appartient à la famille des Cupressaceae (CIR, 2001; NTP, 2016). Ces arbres poussent dans certaines régions d’Europe, d’Asie et d’Amérique du Nord (CIR, 2001; Catlin, 2016). Cela dit, le no CAS de l'essence de bois de cèdre (8000-27-9) et la désignation « huile essentielle de cèdre » sont associés à l’essence de Cedrus atlantica, qui est extraite du Cedrus atlantica de la famille des Pinaceae (CosIng, 2021) et peut contenir des composants différents de ceux de l'essence du Juniperus virginiana, Cupressaceae, comme l’alpha-himachalène, le bêta-himachalène, le gamma-himachalène et l’alpha-atlantone. Les terpènes et terpénoïdes de l’essence de cèdre sont une substance UVCB d’origine naturelle qui se compose de la fraction de terpènes extraite du bois de cèdre (Burdock, 2010). Quant à l’essence de bois de cèdre du Texas, elle est une substance UVCB d’origine naturelle extraite du Juniperus mexicana ou du Juniperus ashei, tous 2 de la famille des Cupressaceae (NTP, 2016). Le Cupressus funebris (couramment appelé cyprès funèbre) est également considéré comme une source botanique potentielle de l'essence de bois de cèdre (Carroll et al., 2011).
Les composants de l'essence de bois de cèdre sont souvent isolés et acétylés (acétate de cédryle, éther méthylique de cédryle), et utilisés dans des cosmétiques comme des parfums, des lotions et des savons (Catlin, 2016). L'essence de bois de cèdre est également employées en aromathérapie et en médecine homéopathique (NTP, 2016).
L’alpha-cédrène, le thujopsène, l’alpha-gurjunène, le bêta-patchoulène et le bêta-cédrène sont des substances d’origine naturelle qui proviennent de végétaux ou sont présentes dans diverses huiles essentielles. L’alpha-cédrène, l'essence de bois de cèdre et l'essence de bois de cèdre du Texas font l’objet de déclarations à Santé Canada en vertu du Règlement sur les cosmétiques. Ils se trouvent dans divers cosmétiques appliqués avec et sans rinçage, notamment des produits parfumés, des hydratants, des produits pour le bain, des nettoyants, des produits de massage, des produits de rasage, des produits de soins capillaires et des antisudorifiques et déodorants.
D’après les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques, l’alpha-cédrène est utilisé dans un petit nombre de cosmétiques au Canada, et ceux-ci le contiennent à une concentration inférieure ou égale à 1 % (communication personnelle, courriels de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, 2017, 2021; source non citée).
D’après les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques, l'essence de bois de cèdreNote de bas de page 7 est utilisée dans 1 900 cosmétiques au Canada. La majorité des produits (plus de 90 %) les contiennent à une concentration inférieure ou égale à 3 % (communication personnelle, courriels de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, 2017, 2021; source non citée).
D’après les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques, l'essence de bois de cèdre du TexasNote de bas de page 8 est utilisée dans plus de 470 cosmétiques au Canada. La majorité des produits (plus de 90 %) les contiennent à une concentration inférieure ou égale à 3 % (communication personnelle, courriels de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, 2017, 2021; source non citée).
L'essence de bois de cèdreNote de bas de page 9 se trouvent également dans des PSN en tant qu’ingrédient médicinal ou non médicinal (communication personnelle, courriels de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, 2017, 2021; source non citée). Dans la Base de données sur les ingrédients des produits de santé naturels (BDIPSN), les préparations de Cedrus atlantica et de Juniperus virginiana répertoriées comme ayant un rôle médicinal ou non médicinal comprennent le Cedrus atlantica, l’huile essentielle de cèdre de l’Atlas, l’extrait d’écorce de Cedrus atlantica, l’huile d’écorce de Cedrus atlantica et l’huile de bois de Cedrus atlantica de même que le Juniperus virginiana et l’huile essentielle de Juniperus virginiana (BDIPSN [modifiée], 2024). L'essence de bois de cèdre du TexasNote de bas de page 10 se trouvent également dans des PSN en tant qu’ingrédient non médicinal (communication personnelle, courriels de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, 2017, 2021; source non citée). De plus, dans la BDIPSN, un rôle médicinal est donné au Juniperus mexicana en tant que synonyme taxonomique du Juniperus ashei (BDIPSN [modifiée], 2024).
L’alpha-cédrène, l'essence de bois de cèdre et l'essence de bois de cèdre du Texas sont utilisés comme parfums dans des produits comme des nettoyants tout usage, des produits d’entretien de la vaisselle, des produits d’entretien de textile et des assainisseurs d’air. L’alpha-gurjunène et le bêta-patchoulène sont répertoriés par l’Association internationale des matières premières pour la parfumerie (IFRA) comme des ingrédients de parfumerie utilisés dans des biens de consommation (IFRA Standards Library, 2021).
Au Canada, l’alpha-cédrène, le bêta-patchoulène, l'essence de bois de cèdre, l'essence de bois de cèdre du Texas et les terpènes et terpénoïdes de l’essence de cèdre sont déclarés comme étant utilisés dans des produits antiparasitaires en tant que produits de formulation (communication personnelle, courriels de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, 2021, 2023; source non citée). D’après les déclarations, l'essence de bois de cèdre sert d’ingrédient actif dans le cadre du Programme d’importation de produits antiparasitaires en vue de la fabrication suivie de l’exportation de l’Agence de réglementation de la lutte antiparasitaire. De ce fait, elles ne sont utilisées que pour fabriquer des produits antiparasitaires destinés à être exportés hors du Canada (communication personnelle, courriels de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, 2021, 2023; source non citée).
Il est indiqué qu’en Europe, l’alpha-gurjunène et le bêta-patchoulène sont utilisés dans des cosmétiques en raison de leur fonction de parfum (CosIng, 2021). Une telle utilisation est également signalée pour l’huile de Juniperus virginiana, en raison de ses fonctions d’arôme et d’agent de tonicité (CosIng, 2021). C’est également le cas pour l'essence de bois de cèdre, associées au nom « huile d’écorce de Cedrus atlantica », en raison de leurs fonctions de parfum, d’arôme et de revitalisation de la peau (CosIng, 2021). Enfin, l’huile de Juniperus mexicana est aussi répertoriée comme étant utilisée dans des cosmétiques en raison de sa fonction d’arôme (CosIng, 2021).
Le thujopsène, en tant que composant de l’extrait de racine de livèche, a été utilisé pour aromatiser des produits du tabac (communication personnelle, courriel de la Direction de la lutte contre le tabagisme de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, 2021; source non citée).
L’alpha-gurjunène est présent dans des produits de vapotage, où il sert d’agent aromatisant (communication personnelle, courriel de la Direction de la lutte contre le tabagisme de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, 2021; source non citée). Lui et l’alpha-cédrène ont été décelés dans des produits de vapotage, aussi appelés cigarettes électroniques (US EPA, 2019).
Aucune donnée définitive n’est disponible concernant l’utilisation possible des terpènes et terpénoïdes de l’essence de cèdre comme aromatisants dans les aliments vendus au Canada. Cependant, puisque l’on sait que cette substance est employée comme aromatisant alimentaire ailleurs dans le monde, il est possible qu’elle le soit également dans des aliments vendus au Canada.
Aux États-Unis, il est autorisé d’utiliser les terpènes et terpénoïdes de l’essence de cèdre (terpènes de l’essence de cèdre) en tant que substance aromatique artificielle ou adjuvant ajouté aux aliments de manière sécuritaire, conformément aux bonnes pratiques de fabrication (Burdock, 2010; US CFR, 2021a).
Aucune donnée définitive n’est disponible sur les utilisations potentielles de l’alpha-gurjunène et du bêta-patchoulène dans les cosmétiques, les PSN, les aromatisants alimentaires, les emballages alimentaires et les autres produits offerts à la population générale au Canada.
Acétate amboryle
L’acétate amboryle n’est pas présent naturellement dans l’environnement. Il s’agit d’une substance chimique synthétisée à partir de l’isolongifolène, du polyoxyméthylène et de l’acide acétique (Zhao et Li, 1998; Sell, 2003; Kirk-Othmer, 2012).
Aucune donnée définitive n’est disponible sur son utilisation potentielle dans les cosmétiques, les PSN, les aliments, les emballages alimentaires et les autres produits offerts à la population générale au Canada.
Il est indiqué qu’en Europe, l’acétate amboryle est utilisé dans des cosmétiques en raison de sa fonction de parfum (CosIng, 2021). Il est également répertorié par l’IFRA en tant qu’ingrédient de parfumerie utilisé dans des biens de consommation (IFRA Standards Library, 2021).
Sous-groupe 2 des triterpénoïdes (énoxolone et acide glycyrrhétinique préparé avec l’allantoïne)
Le sous-groupe 2 des triterpénoïdes se compose d’une substance distincte (l’énoxolone, aussi appelée acide glycyrrhétinique) et d’une UVCB (acide glycyrrhétinique préparé avec l’allantoïne). L’énoxolone est soit dérivée de l’acide glycyrrhizique, soit isolée des racines déchiquetées du Glycyrrhiza glabra (CIR, 2007). Couramment appelée réglisse, le Glycyrrhiza glabra est une herbe indigène de la région de la Méditerranée et de l’Asie centrale et du sud-ouest (Isbrucker et Burdock, 2006; VKM, 2018). Les racines de réglisse fraîche contiennent habituellement de 3 à 5 % d’acide glycyrrhizique (Isbrucker et Burdock, 2006), tandis que les extraits de racine de réglisse séchée en contiennent entre 4 et 25 % (WHO, 2005; VKM, 2018). L’acide glycyrrhizique se compose d’énoxolone (son aglycone) et d’un disaccharide de l’acide glucuronique (Isbrucker et Burdock, 2006). Il est mal absorbé par le tractus gastro-intestinal, où il est hydrolysé en énoxolone par la microflore intestinale (WHO, 2005).
L’acide glycyrrhétinique préparé avec l’allantoïne est une poudre blanc-jaunâtre dérivée de l’allantoïne et de l’énoxolone dans des rapports molaires de 1 pour 1, 1 pour 2 ou 1 pour 3 (Becker et al., 2010). En général, dans les cosmétiques, l’énoxolone sert d’agent de revitalisation de la peau (CIR, 2007). L’acide glycyrrhétinique préparé avec l’allantoïne est également utilisé à cette fin (EWG Skin Deep, 2021).
L’énoxolone est utilisée dans plusieurs produits disponibles aux consommateurs tels que des antisudorifiques et des déodorants, des produits de maquillage, des produits de massage, des produits de soins de la peau et des cheveux (lotions, nettoyants) et des dentifrices. D’après les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques, cette substance est présente dans plus de 160 cosmétiques au Canada. La majorité des produits (plus de 90 %) la contiennent à une concentration inférieure ou égale à 1 % (communication personnelle, courriels de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, 2017, 2021; source non citée). L’énoxoloneNote de bas de page 11 se trouve également dans des PSN en tant qu’ingrédient médicinal ou non médicinal (communication personnelle, courriels de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, 2017, 2021; source non citée), ainsi que dans des MVL en tant qu’ingrédient non médicinal (communication personnelle, courriels de la Direction des produits thérapeutiques de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, 2017, 2021; source non citée). Elle figure sous le nom d’acide glycyrrhétinique dans la BDIPSN, où elle est répertoriée comme ayant un rôle médicinal et non médicinal (BDIPSN [modifiée], 2024).
Il est indiqué qu’en Europe, l’énoxolone est utilisée dans des cosmétiques en raison de sa fonction de revitalisation de la peau, et l’acide glycyrrhétinique préparé avec l’allantoïne, en raison de ses fonctions de protection de la peau et d’apaisement (CosIng, 2021). L’information contenue dans la base de données en ligne sur les cosmétiques Skin Deep d’EWG laisse également penser que l’acide glycyrrhétinique préparé avec l’allantoïne est utilisé dans des produits de soins de la peau (hydratants) (EWG Skin Deep, 2021).
Aux États-Unis, l’énoxolone n’est pas établie comme un ingrédient alimentaire. Cependant, la racine de réglisse et ses dérivés sont généralement reconnus comme sûrs en tant qu’ingrédients alimentaires utilisés pour les fonctions de rehausseur de saveur, d’aromatisant et d’agent de surface (US CFR, 2021b).
Aucune donnée définitive n’est disponible sur l’utilisation potentielle de l’acide glycyrrhétinique préparé avec l’allantoïne dans les cosmétiques, les PSN, les aliments, les emballages alimentaires et les autres produits offerts à la population générale au Canada. Il a été indiqué que l’acide glycyrrhétinique préparé avec l’allantoïne est utilisé dans 6 cosmétiques, notamment une crème à raser et des produits de soins de la peau (Becker et al., 2010).
Essence de mimosa
L'essence de mimosa est une substance UVCB d’origine naturelle provenant de la plante Acacia decurrens, laquelle est indigène de l’Australie et est également cultivée en France et en Italie (Burdock, 2010).
L'essence de mimosa est utilisée dans plusieurs produits disponibles aux consommateurs, comme des produits de soins de la peau et des cheveux (lotions/nettoyants), des parfums et des produits de massages. D’après les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques, l'essence de mimosaNote de bas de page 12 sont utilisées dans plus de 740 cosmétiques au Canada. La majorité des produits (plus de 90 %) les contiennent à une concentration inférieure ou égale à 3 % (communication personnelle, courriels de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, 2017, 2022; source non citée). L'essence de mimosaNote de bas de page 13 se trouvent également dans des PSN en tant qu’ingrédient non médicinal (communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, 2021; source non citée). Dans la BDIPSN, les préparations d’Acacia decurrens répertoriées comme ayant un rôle non médicinal sont l’extrait de fleur/tige d’Acacia dealbata, l’extrait de fleurs d’Acacia decurrens, la cire de fleur d’Acacia decurrens et les esters d’Acacia decurrens/de jojoba/de cire de graine de tournesol/de poly(glycéryle-3) (BDIPSN [modifiée en 2024]).
L'essence de mimosa sont répertoriées par l’IFRA en tant qu’ingrédient de parfumerie utilisé dans des biens de consommation (IFRA Standards Library, 2021). L’information contenue dans la base de données en ligne sur les cosmétiques Skin Deep d’EWG laisse également penser qu’elles sont utilisées dans des produits de soins de la peau (EWG Skin Deep, 2021).
Il est indiqué qu’aux États-Unis, l'essence de mimosa est utilisée comme aromatisant alimentaire dans des boissons alcoolisées et non alcoolisées, des produits de boulangerie-pâtisserie, des bonbons, des produits laitiers glacés et des gelées et poudings (Burdock, 2010).
Aux États-Unis, l'extrait, essence, essence absolue et autres dérivés des fleurs de mimosa (Acacia decurrens var. dealbata) peuvent être utilisés de manière sécuritaire, conformément aux bonnes pratiques de fabrication, dans des aliments en tant qu’aromatisants et adjuvants naturels (US CFR, 2021c). Le groupe d’experts de la Flavor & Extract Manufacturers Association (FEMA) a jugé que l'essence de mimosa (no 2755 de la FEMA) pouvaient être généralement reconnues comme sûres (Hall et Oser, 1965), et cette substance est répertoriée dans la bibliothèque des arômes de la FEMA (FEMA, c2021).
Aucune donnée définitive n’est disponible sur l’utilisation potentielle l'essence de mimosa dans les aliments, les emballages alimentaires et les autres produits offerts à la population générale au Canada.
Extrait de lierre
L'extrait de lierre est une substance UVCB d’origine naturelle provenant de la plante Hedera helix, laquelle est indigène en Europe et est cultivée en Amérique du Nord et en Asie (Baharara et al., 2021). Le lierre est employé depuis longtemps dans les produits médicinaux traditionnels à base de plantes (Cwientzek et al., 2011; Mendel et al., 2011).
L'extrait de lierre est utilisé dans plusieurs produits disponibles aux consommateurs, comme des hydratants, des produits pour le bain, des nettoyants, des produits de soins capillaires, des produits de maquillage et des produits de massage. D’après les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques, l'extrait de lierreNote de bas de page 14 est utilisé dans plus de 390 cosmétiques au Canada. La majorité des produits (plus de 90 %) les contiennent à une concentration inférieure ou égale à 1 % (communication personnelle, courriels de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, 2017, 2021; source non citée). L'extrait de lierreNote de bas de page 15 se trouve également dans des PSN en tant qu’ingrédient médicinal ou non médicinal (communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, 2021; source non citée). Dans la BDIPSN, les préparations d’Hedera helix répertoriées comme ayant un rôle médicinal ou non médicinal sont l’Hedera helix et l’extrait d’Hedera helix (lierre) (BDIPSN [modifiée en 2024]).
Il est indiqué qu’en Europe, l'extrait de lierre est utilisé dans des cosmétiques pour leurs fonctions antipelliculaires, antiagglomérantes, antimicrobiennes, astringentes, apaisantes, toniques et revitalisantes pour la peau et les cheveux (CosIng, 2021). L’information contenue dans la base de données en ligne sur les cosmétiques Skin Deep d’EWG laisse également penser qu’ils sont utilisés dans des produits de soins de la peau et des cheveux (nettoyants/lotions/écrans solaires) (EWG Skin Deep, 2021).
Extrait de ginseng à 5 folioles
L’extrait de ginseng à 5 folioles est une substance UVCB d’origine naturelle qui est généralement obtenue du Panax quinquefolium par une extraction par solvant. Le Panax quinquefolium est une herbe vivace indigène de l’Amérique du Nord (Kitts et Hu, 2000; CIR, 2012). Le ginseng est largement utilisé en médecine traditionnelle comme plante médicinale, et il entre dans des cosmétiques (Kitts et Hu, 2000; CIR, 2012). Bien que plusieurs parties de la plante servent à obtenir de l’extrait, la majorité des utilisations concernent l’extrait provenant des racines (CIR, 2012).
L’extrait de ginseng à 5 folioles est utilisé dans plusieurs produits disponibles aux consommateurs, comme des produits de soins de la peau et des cheveux (lotions, nettoyants, shampooings et revitalisants) ainsi que dans des produits de maquillage, des bains de bouche, des dentifrices, des parfums et des produits de massage. D’après les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques, l’extrait de ginseng à 5 foliolesNote de bas de page 16 est utilisé dans plus de 190 cosmétiques au Canada. La majorité des produits (plus de 80 %) le contiennent à une concentration inférieure ou égale à 1 % (communication personnelle, courriels de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, 2017, 2021; source non citée).
L’extrait de ginseng à 5 foliolesNote de bas de page 17 se trouve également dans des PSN en tant qu’ingrédient médicinal ou non médicinal (communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, 2021; source non citée). Dans la BDIPSN, les préparations de Panax quinquefolius répertoriées comme ayant un rôle médicinal ou non médicinal sont le Panax quinquefolius, l’extrait de racines de Panax quinquefolius, et le radix panacis quinquefolii (BDIPSN [modifiée en 2024]).
Aucune donnée définitive n’est disponible sur l’utilisation potentielle de l’extrait de ginseng à 5 folioles dans les aliments, les emballages alimentaires et les autres produits offerts à la population générale au Canada. En 1993, 22 154 000 lb (10 049 000 kg) de ginseng (Panax quinquefolius ou Panax ginseng; no CAS 84650-12-4) ont été produites dans le monde (Burdock, 2010). Le ginseng est consommé sous forme de tisanes et comme ingrédient de gommes à mâcher et de bonbons (Burdock, 2010).
De plus, de l’extrait de ginseng à 5 folioles peut être présent dans des nécessaires de teinture pour cheveux (CPID, c2021). L’information contenue dans la base de données en ligne sur les cosmétiques Skin Deep d’EWG laisse d’ailleurs penser qu’il est utilisé dans des produits de soin de la peau et des cheveux (nettoyants, lotions, écrans solaires) (EWG Skin Deep, 2021). En Europe, l’extrait de ginseng à 5 folioles (extrait de racines de Panax quinquefolius) est répertorié comme étant utilisé dans des cosmétiques pour sa fonction astringente (CosIng, 2021).
5. Devenir et comportement dans l’environnement
5.1 Persistance et potentiel de bioaccumulation dans l’environnement
Selon les modèles utilisés aux fins de la CRE (ECCC, 2016b), l’alpha-cédrène, le bêta-cédrène, l'essence de bois de cèdre et l'essence de bois de cèdre du Texas devraient persister dans les sédiments, mais pas dans l’air, l’eau ou le sol. Les demi-vies du thujopsène, de l’alpha-gurjunène, de l’énoxolone, de l’acide glycyrrhétinique préparé avec l’allantoïne, de l'essence de mimosa, de l'extrait de lierre et de l’extrait de ginseng à 5 folioles indiquent que ces substances devraient persister dans l’eau, les sédiments et le sol, mais pas dans l’air. Le bêta-patchoulène, les terpènes et terpénoïdes de l’essence de cèdre et l’acétate amboryle ne devraient pas persister dans l’air, l’eau, les sédiments ou le sol.
Comme leurs log Koe et leurs facteurs de bioconcentration sont élevés (ECCC, 2016b), l’alpha-cédrène, le thujopsène, l’alpha-gurjunène, le bêta-patchoulène, le bêta-cédrène, l'essence de bois de cèdre, les terpènes et terpénoïdes de l’essence de cèdre et l'essence de bois de cèdre du Texas devraient considérablement se bioaccumuler dans les organismes. Cependant, bien que les valeurs de log Koe de l’acétate amboryle, de l’énoxolone et de l’acide glycyrrhétinique préparé avec l’allantoïne soient élevées, les facteurs de bioconcentration de ces substances sont faibles (456,6, 757,7 et 840,4 L/kg, respectivement). En outre, bien que les valeurs de log Koe de l’extrait de ginseng à 5 folioles varient de faibles à élevées (section 3), le facteur de bioconcentration de cette substance est faible (93,0 L/kg). Par conséquent, on ne s’attend pas à ce que l’acétate amboryle, l’énoxolone, l’acide glycyrrhétinique préparé avec l’allantoïne, et l’extrait de ginseng à 5 folioles se bioaccumulent de façon importante dans les organismes (ECCC, 2016b).
La plupart des données sur les facteurs de bioconcentration tirées du document d’ECCC (2016b) provenaient de l’application du modèle CATALOGIC à des structures représentatives convenables, mais certains des résultats portant sur l'essence de mimosa et l'extrait de lierre se trouvaient en dehors du domaine du modèle. Par conséquent, on a appliqué le modèle Arnot-Gobas (Arnot et al., 2010) aux composants des UVCB, et obtenu des données montrant un faible potentiel de bioaccumulation pour ces 2 substances. Les valeurs des facteurs de bioconcentration des composants individuels étaient faibles : elles variaient de 36 à 212 L/kg pour l'essence de mimosa, et de 262 à 1 820 L/kg pour l'extrait de lierre. Par ailleurs, aucune donnée empirique sur les composants des UVCB n’a été trouvée dans la littérature. Il convient également de noter que la biodisponibilité dans l’eau est réduite pour les substances chimiques ayant un log Koe élevé (c’est-à-dire certains composants de l'essence de mimosa et de l'extrait de lierre), ce qui peut diminuer l’efficacité de l’absorption chimique dans les branchies des poissons (Arnot et al., 2010). Dans le cas des substances ayant un log Koe supérieur à 7, l’efficacité d’absorption chimique diminue, car la diffusion devient contrôlée par la dissolution dans les couches aqueuses (Arnot et al., 2010).
Ainsi, il est attendu que l’alpha-gurjunène, le bêta-cédrène, l'essence de bois de cèdre et l'essence de bois de cèdre du Texas persisteront dans l’environnement et se bioaccumuleront dans les organismes. L’alpha-cédrène et le thujopsène, qui sont les principaux composants de l'essence de bois de cèdre (représentant respectivement 21,1 à 38 %, et 27,6 % de sa composition) et de l'essence de bois de cèdre du Texas (représentant respectivement 35 à 60,4 % et 15 à 30,7 % de sa composition), devraient également persister dans l’environnement et présenter un potentiel de bioaccumulation élevé.
6. Risques d’effets nocifs sur l’environnement
6.1 Caractérisation des risques pour l’environnement
Les risques pour l’environnement des substances du Groupe des sesquiterpènes tricycliques et des triterpénoïdes ont été caractérisés selon l’approche de CRE (ECCC, 2016a). La CRE est une méthode de classification des risques fondée sur l’utilisation de plusieurs paramètres de mesure du danger et de l’exposition, et sur l’examen pondéré de multiples éléments de preuve. La combinaison des divers éléments de preuve permet de différencier les substances en fonction de leur potentiel de toxicité et d’exposition dans divers milieux. Cette approche réduit l’incertitude globale associée à la caractérisation des risques par rapport à une méthode qui serait basée sur un seul paramètre mesuré dans un seul milieu (par exemple la concentration létale médiane). L’approche est résumée ci-dessous et décrite en détail dans un document d’ECCC (2016a). Il convient de noter que puisque l’extrait de ginseng à 5 folioles est une UVCB impossible à représenter adéquatement par une seule structure chimique, la classification a été faite selon une approche manuelle fondée sur le jugement.
Les données sur les propriétés physiques et chimiques, le devenir (demi-vies chimiques dans divers milieux et biotes, coefficients de partage et bioconcentration dans les poissons), l’écotoxicité aiguë pour les poissons et les volumes de substance importés et produits au Canada ont été extraites de publications scientifiques, de bases de données empiriques existantes (par exemple, la boîte à outils QSAR de l’OCDE, 2014) et de résultats d’enquêtes menées en vertu de l’article 71 de la LCPE, ou ont été générées à l’aide de modèles QSAR ou du bilan massique conçus pour prévoir le devenir et la bioaccumulation. Ces données ont été intégrées à d’autres modèles de bilan massique ou ont servi à définir les profils de danger et d’exposition des substances.
Les profils de danger reposaient principalement sur des paramètres liés au mode d’action toxique, à la réactivité chimique, aux seuils de toxicité interne induite par le réseau trophique, à la biodisponibilité et à l’activité biologique et chimique. Les profils d’exposition reposaient également sur plusieurs paramètres, dont le taux d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. Nous avons comparé ces 2 types de profils aux critères de décision, pour classer les potentiels de danger et d’exposition de chaque substance organique comme faible, modéré ou élevé. Nous avons appliqué des règles supplémentaires (par exemple cohérence de la classification, marge d’exposition) pour améliorer la classification préliminaire des dangers et de l’exposition. Cependant, nous n’avons pas pu définir pleinement les profils de danger et d’exposition de l’extrait de ginseng à 5 folioles, en raison de l’absence de structure représentative permettant d’estimer les propriétés étudiées et de l’absence de données empiriques sur ces propriétés. Par conséquent, nous avons manuellement classifié le danger et l’exposition en examinant les constituants de cette UVCB et les renseignements issus d’une enquête menée en vertu de l’article 71 de la LCPE, en prenant des décisions basées sur l’examen de substances similaires et en nous fiant à l’avis d’experts.
Nous avons attribué un potentiel de risque faible, modéré ou élevé à chaque substance au moyen d’une matrice des risques tenant compte de la classification du danger et de l’exposition. Les classifications des risques potentiels obtenues par la méthode de CRE ont fait l’objet d’une vérification en 2 étapes. La première étape consistait à faire passer la classification de modéré ou élevé à faible pour les substances associées à un faible taux estimé d’émission dans l’eau après le traitement des eaux usées, ce qui indique un potentiel d’exposition faible. La deuxième étape consistait à réexaminer les résultats montrant un potentiel de risque faible à l’aide de scénarios relativement prudents, à échelle locale (c’est-à-dire la zone entourant directement le point de rejet) et conçus pour protéger l’environnement, afin de déterminer si la catégorie de risque devait être augmentée.
La CRE se fonde sur une approche pondérée qui réduit au minimum le risque de sous-classifier ou de surclassifier les dangers et l’exposition ainsi que les risques qui en résultent. Le document d’ECCC (2016a) explique en détail les approches équilibrées utilisées pour traiter les incertitudes. Nous présentons ici 2 des plus importants domaines d’incertitude. Tout d’abord, des erreurs dans les valeurs de toxicité aiguë empiriques ou modélisées pourraient modifier des éléments de la classification des dangers, en particulier les paramètres dépendant des valeurs de résidus dans les tissus (c’est-à-dire le mode d’action toxique), dont bon nombre ont été prédites à l’aide de modèles QSAR (OECD QSAR Toolbox, 2014). Les conséquences de telles erreurs sont toutefois atténuées par le fait qu’une surestimation de la létalité médiane conduira à une valeur prudente (assurant la protection contre les effets nocifs) quant aux résidus présents dans les tissus, laquelle sera utilisée pour l’analyse critique des résidus corporels. Une erreur liée à la sous-estimation de la toxicité aiguë sera atténuée par le recours à d’autres paramètres de danger, comme le profilage structural du mode d’action, la réactivité et l’affinité de liaison aux œstrogènes. Ensuite, les changements ou les erreurs touchant les quantités de substances chimiques peuvent modifier la classification de l’exposition, puisque la classification de l’exposition et du risque est très sensible au taux d’émission et aux quantités d’utilisation. Les classements obtenus au moyen de la CRE représentent l’exposition et le risque au Canada qui découlent de l’estimation des quantités utilisées actuellement, mais pourraient ne pas rendre compte des tendances futures.
De plus, il faut noter que dans la présente évaluation, le potentiel d’effets nocifs sur l’environnement est examiné individuellement pour chaque substance. Une exposition simultanée à plusieurs substances pourrait entraîner des effets cumulatifs sur les organismes et présenter un risque accru. Le potentiel d’effets cumulatifs et la façon dont ceux-ci pourraient se manifester dans l’environnement n’ont pas été étudiés de manière approfondie, puisque le danger et l’exposition associés à ces substances ont permis de déterminer, selon l’approche de CRE, que le risque pour l’environnement était faible.
Les données critiques et les éléments à partir desquels nous avons élaboré les profils des substances comprises dans le Groupe des sesquiterpènes tricycliques et des triterpénoïdes ainsi que les résultats de la classification du danger, de l’exposition et du risque sont présentés dans le document d’ECCC (2016b).
Les classifications du danger et de l’exposition des 14 substances du Groupe des sesquiterpènes tricycliques et des triterpénoïdes sont résumées dans le tableau 6-1.
| Substance | Classification du danger selon la CRE | Classification de l’exposition selon la CRE | Classification du risque selon la CRE |
|---|---|---|---|
| Alpha-cédrène | Faible | Faible | Faible |
| Thujopsène | Élevé | Faible | Faible |
| Alpha-gurjunène | Élevé | Faible | Faible |
| Bêta-patchoulène | Faible | Faible | Faible |
| Bêta-cédrène | Faible | Faible | Faible |
| Essence de bois de cèdre | Faible | Faible | Faible |
| Terpènes et terpénoïdes de l’essence de cèdre | Faible | Faible | Faible |
| Essence de bois de cèdre du Texas | Faible | Faible | Faible |
| Acétate amboryle | Modéré | Faible | Faible |
| Énoxolone | Élevé | Faible | Faible |
| Acide glycyrrhétinique préparé avec l’allantoïne | Élevé | Faible | Faible |
| Essence de mimosa | Faible | Modéré | Faible |
| Extrait de lierre | Faible | Faible | Faible |
| Extrait de ginseng à 5 folioles | Élevé | Faible | Faible |
Étant donné les résultats de faible danger et de faible exposition découlant des renseignements pris en compte dans la CRE, l’alpha-cédrène, le bêta-patchoulène, le bêta-cédrène, l’essence de bois de cèdre, les terpènes et terpénoïdes de l’essence de cèdre, l’essence de bois de cèdre du Texas et l’extrait de lierre ont été classifiés comme ayant un faible potentiel de risque pour l’environnement. Il est peu probable que ces substances soient préoccupantes pour l’environnement au Canada.
Sur la base des renseignements pris en compte dans la CRE, le thujopsène, l’alpha-gurjunène, l’énoxolone, l’acide glycyrrhétinique préparé avec l’allantoïne, et l’extrait de ginseng à 5 folioles ont été classifiés comme ayant un faible potentiel d’exposition. Le potentiel de danger du thujopsène, de l’alpha-gurjunène, de l’énoxolone et de l’acide glycyrrhétinique préparé avec l’allantoïne a été jugé élevé en raison du potentiel élevé de ces substances à causer des effets nocifs dans les réseaux trophiques aquatiques. Dans le cas de l’énoxolone, nous nous basons également sur la concordance entre le mode d’action réactif de la substance et son ratio d’écotoxicité élevé, qui indiquent tous 2 qu’elle a probablement une puissance d’action élevée, ainsi que sur les alertes structurales de la boîte à outils QSAR de l’OCDE (2014), qui signalent que la substance pourrait se lier à des récepteurs endocriniens. Nous avons déterminé que l’extrait de ginseng à 5 folioles présentait un potentiel de danger élevé au moyen d’une classification manuelle prudente, laquelle a été faite en raison des incertitudes entourant les résultats du modèle pour cette substance. Nous avions classé ces 5 substances comme ayant un potentiel modéré de risque pour l’environnement. Cependant, nous avons revu ces classifications à la baisse (potentiel faible de risque pour l’environnement) après leur avoir apporté des modifications en fonction des quantités actuellement utilisées (voir la section 7.1.1 du document sur l’approche de CRE [ECCC, 2016a]). Les effets potentiels et leur manifestation possible dans l’environnement n’ont pas été davantage étudiés en raison du faible potentiel d’exposition à ces substances. Il est peu probable que le thujopsène, l’alpha-gurjunène, l’énoxolone, l’acide glycyrrhétinique préparé avec l’allantoïne, et l’extrait de ginseng à 5 folioles entraînent des préoccupations pour l’environnement au Canada.
Selon les données prises en compte dans la CRE, l’acétate amboryle a été classé comme ayant un faible potentiel d’exposition. Il présenterait par ailleurs un potentiel de danger modéré en raison de sa capacité modérée à provoquer des effets nocifs dans les réseaux trophiques aquatiques. En conséquence, il a été déterminé qu’il présentait un faible potentiel de risque pour l’environnement. Les effets potentiels et leur manifestation possible dans l’environnement n’ont pas été davantage étudiés en raison du faible potentiel d’exposition à cette substance. Il est peu probable que cette substance soit préoccupante pour l’environnement au Canada.
Sur la base des renseignements pris en compte dans la CRE, l’essence de mimosa a été classée comme ayant un potentiel d’exposition modéré en raison de leur longue persistance globale (c.-à-d. la somme des demi-vies chimiques dans tous les milieux, pondérée par la fraction massique de la substance dans le milieu) et de la quantité modérée qui est utilisée d’après les réponses à une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada, 2013). L’essence de mimosa a été classée comme ayant un faible potentiel de danger et un faible potentiel de risque pour l’environnement. Bien que les profils d’utilisation actuels donnent lieu à un potentiel d’exposition modéré, cette substance est peu susceptible d’entraîner des préoccupations pour l’environnement au Canada en raison de son faible potentiel de danger.
7. Risque d’effets nocifs sur la santé humaine
7.1 Sous-groupe 1 des sesquiterpènes tricycliques (alpha-cédrène, thujopsène, alpha-gurjunène, bêta-patchoulène, bêta-cédrène, essence de bois de cèdre, terpènes et terpénoïdes de l’essence de cèdre, et essence de bois de cèdre du Texas)
7.1.1 Évaluation de l’exposition
Milieux environnementaux
Compte tenu des faibles quantités fabriquées et importées (< 1 000 kg/substance) des substances qui ont été déclarées en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada, 2013), nous ne nous attendons pas à une exposition importante à l’alpha-cédrène, au thujopsène, à l’alpha-gurjunène, au bêta-patchoulène, au bêta-cédrène, à l’essence de bois de cèdre, aux terpènes et terpénoïdes de l’essence de cèdre et à l’essence de bois de cèdre du Texas par l’intermédiaire des milieux environnementaux au Canada. Nous n’avons trouvé aucun rapport de surveillance de l’alpha-cédrène, de l’alpha-gurjunène, du bêta-patchoulène, de l’essence de bois de cèdre, des terpènes et terpénoïdes de l’essence de cèdre et de l’essence de bois de cèdre du Texas dans les milieux environnementaux au Canada ou ailleurs.
Aux États-Unis, le thujopsène a été mesuré dans l’air intérieur au sous-sol et au rez-de-chaussée de 9 maisons à des concentrations moyennes respectives de 5,3 µg/m3 (plage allant de 2,9 à 8,8 µg/m3) et de 5,9 µg/m3 (plage allant de 3,2 à 9,8 µg/m3) (Ryan et Beaucham, 2013). L’alpha-cédrène et le bêta-cédrène ont été mesurés dans l’air intérieur de 20 maisons en Chine, et les concentrations étaient inférieures aux seuils de détection (qui étaient respectivement de 13 et de 12,9 µg/m3; Norris et al., 2019).
Aliments
Il a été déterminé que l'essence de bois de cèdre et l'essence de bois de cèdre du Texas étaient des additifs indirects de par leur présence dans des nettoyants pour surface en contact avec les aliments, des détergents à vaisselle, des savons à main et des dégraissants (communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, 2021; source non citée).
Les terpènes et terpénoïdes de l’essence de cèdre sont reconnus comme des aromatisants alimentaires à l’échelle internationale. Il est donc possible qu’ils soient présents en tant qu’aromatisants dans des aliments vendus au Canada. Le Fenaroli’s Handbook of Flavor Ingredients indique que l’ingestion estimée de terpènes et terpénoïdes de l’essence de cèdre par personne qui découle de l’utilisation de cette substance comme aromatisant alimentaire s’élève à 1,412 × 10-1 μg/kg poids corporel (p.c.)/jour (j) pour la population des États-Unis, selon les volumes de production déclarés par l’industrie alimentaire (Burdock, 2010). En l’absence de données sur l’utilisation réelle, le cas échéant, de cette substance comme aromatisant dans les aliments vendus au Canada, l’estimation de l’ingestion par personne aux États-Unis (Burdock, 2010) constitue une estimation acceptable de l’exposition par voie alimentaire possible de la population générale du Canada âgée d’un an et plus due à l’utilisation potentielle de cette substance comme aromatisant alimentaire (communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, 2021; source non citée).
Exposition due à la présence naturelle dans des aliments
Il a été signalé que l’alpha-cédrène, le thujopsène, l’alpha-gurjunène, le bêta-patchoulène et le bêta-cédrène sont présents naturellement à de faibles concentrations dans un petit nombre d’aliments et d’huiles essentielles (VCF, 2021). Il est attendu que l’exposition à ces substances par voie alimentaire qui découle de leur présence naturelle dans des aliments et dans des parties de plantes dont sont tirées des huiles essentielles soit limitée, voire nulle.
Produits disponibles aux consommateurs
Alpha-cédrène
L’alpha-cédrène est utilisé dans des produits disponibles aux consommateurs, comme des parfums, à une concentration de 1 %, des produits de rasage, à une concentration de 0,1 %, et des produits assainisseurs d’air (par exemple dispositifs enfichables et clips pour grille d’aération de voiture), à une concentration de 1 % (Outil de recherche de FDS, 2019). Il entre également dans des produits aérosols d’entretien du cuir, pour lesquels l’exposition a été quantifiée à une concentration maximale présumée de 5 %. De plus, il a été relevé dans des produits de nettoyage ou de désodorisation des toilettes ou des urinoirs (pour nettoyage automatique des cuvettes), pour lesquels l’exposition a été quantifiée à une concentration maximale présumée de 10 % (ACI, 2021).
Essence de bois de cèdre
Pour évaluer le potentiel d’exposition à l’essence de bois de cèdre provenant des cosmétiques et des PSN appliqués sur la peau ou inhalés, nous avons choisi des scénarios sentinelles en nous basant sur une combinaison de fréquences d’utilisation et de concentrations déclarées de la substance dans ces produits. Ces scénarios représentaient les expositions les plus élevées, par rapport aux autres cosmétiques appliqués sur la peau et aux PSN comprenant l'essence de bois de cèdre comme ingrédient non médicinal, parmi les produits pour lesquels la présence de cette substance avait été déclarée. Les scénarios sentinelles examinés pour les applications cutanées portaient sur l’exposition à l’essence de bois de cèdre due à l’utilisation d’huiles de massage, de parfums, de déodorants ou d’antisudorifiques (solides), d’hydratants pour le corps et le visage, de revitalisants (sans rinçage), de shampooings, de produits capillaires lissants ou pour permanentes, de produits pour le bain (sels, huiles), de nettoyants pour le corps (solides et liquides), d’exfoliants pour le corps, de produits de maquillage pour le visage (fonds de teint liquides), de crèmes à raser (pour le corps et le visage), de produits après-rasage (pour le visage), de produits pour la peau (du corps) après épilation, d’adhésifs pour le corps, de nettoyants antiseptiques pour la peau (en pulvérisateur) (PSN), de contre-irritants (en pulvérisateur) (PSN), de baumes de soulagement de l’irritation (PSN), de l’aromathérapie – liquides pour inhalation de vapeur provenant d’un bol (PSN), de l’aromathérapie – liquides pour inhalation au moyen d’un diffuseur (PSN), de l’aromathérapie – pulvérisateurs pour voies respiratoires (PSN) et de produits de traitement contre l’acné (gels) (PSN) (tableaux 7-1 et 7-2).
L’exposition à l’essence de bois de cèdre par voie orale qui découle de l’utilisation de baumes à lèvres, de bains de bouche et de dentifrices a également été évaluée (communication personnelle, courriels de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, 2017, 2021; source non citée).
Des renseignements provenant du site Web de l’American Cleaning Institute (ACI) indiquent que l'essence de bois de cèdre pourraient être utilisées comme parfum dans des nettoyants tout-usage, à des concentrations de 0,01 à 10 %, des produits d’entretien de la vaisselle, à des concentrations de 0,01 à 1 %, et des produits d’entretien des textiles, à des concentrations de 0,01 à 10 % (ACI, 2021). Lorsqu’aucune donnée sur la concentration n’était disponible, nous avons supposé une concentration maximale de 10 % dans les produits de nettoyage ou de désodorisation des toilettes ou des urinoirs afin de calculer les estimations de l’exposition (ACI, 2021). De plus, l'essence de bois de cèdre sont présentes dans divers produits assainisseurs d’air (par exemple chandelles, pulvérisateurs, dispositifs enfichables contenant du liquide, et gels solides). L’exposition a été quantifiée pour un produit assainisseur d’air enfichable ayant une concentration maximale présumée de 5 %.
Essence de bois de cèdre du Texas
L'essence de bois de cèdre du Texas est utilisée dans des produits disponibles aux consommateurs. Les scénarios sentinelles examinés pour les cosmétiques portaient sur l’exposition à cette substance due à l’utilisation d’huiles de massage, de parfums, de déodorants ou d’antisudorifiques (solides), d’hydratants (pour le corps et le visage), de shampooings, de colorants capillaires temporaires, de fixatifs pour cheveux, de produits pour le bain (sels, mousses ou bulles), de nettoyants pour le corps (solides), d’exfoliants pour le corps, de produits de maquillage pour le visage (fonds de teint liquides) et de crèmes à raser (pour le corps) (communication personnelle, courriels de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, 2017, 2021; source non citée). L'essence de bois de cèdre du Texas est utilisée dans des produits de nettoyage comme des détergents à lessive, et nous avons quantifié l’exposition cutanée et par inhalation potentielle qui découle de l’utilisation de cette substance dans les détergents à lessive liquides. De plus, l'essence de bois de cèdre du Texas se trouve dans des produits assainisseurs d’air (par exemple blocs de cire, gels solides), et nous avons quantifié l’exposition pour des blocs de cire. Elles sont également présentes dans des produits de nettoyage ou de désodorisation des toilettes ou des urinoirs, pour lesquels nous avons quantifié l’exposition à une concentration de 1 %.
Autres substances du sous-groupe1 des sesquiterpènes tricycliques (thujopsène, alpha-gurjunène, bêta-patchoulène, bêta-cédrène et terpènes et terpénoïdes de l’essence de cèdre)
Nous n’avons trouvé aucun produit contenant du thujopsène, de l’alpha-gurjunène, du bêta-patchoulène ou du bêta-cédrène qui serait offert aux consommateurs au Canada. Par conséquent, nous estimons que l’exposition des humains est minime. Comme mentionné plus haut, les terpènes et terpénoïdes de l’essence de cèdre sont reconnus comme des aromatisants alimentaires à l’échelle internationale. Il est donc possible qu’ils soient présents en tant qu’aromatisants dans des aliments vendus au Canada. En revanche, nous n’avons trouvé aucun produit contenant cette substance qui serait offert aux consommateurs au Canada. Par conséquent, nous jugeons que l’exposition humaine à cette substance est minime.
Produits faits soi-même
En ce qui concerne l’utilisation de l'essence de bois de cèdre et de l'essence de bois de cèdre du Texas à des concentrations de 100 % dans des produits faits soi-même, les expositions quotidiennes les plus élevées devraient provenir de l’utilisation des essences dans des diffuseurs d’arôme ou assainisseurs d’air, des huiles de massage, des hydratants pour le corps, des huiles pour le bain et des brumisateurs faciaux ainsi que de leur utilisation comme nettoyants liquides pour plancher. Bien que la concentration maximale de l'essence de bois de cèdre et de l'essence de bois de cèdre du Texas utilisée dans des huiles de massage soit présumée être de 100 %, les huiles de massage sont généralement diluées avant leur utilisation. Il est rapporté que les huiles essentielles et les extraits entrant dans des produits pour le corps sont habituellement dilués à des concentrations comprises entre 1 et 4 % (Tisserand Institute, 2021). À la lumière de cette information, il a été supposé que la concentration maximale de l'essence de bois de cèdre ou de l'essence de bois de cèdre du Texas dans les hydratants pour le corps faits soi-même était de 3 % (RIVM, 2006).
Absorption cutanée
Afin d’estimer la quantité de produit pouvant donner lieu à une exposition par inhalation après une exposition cutanée aux substances du sous-groupe 1 des sesquiterpènes tricycliques, nous avons utilisé une valeur d’absorption cutanée de 25 % pour toutes ces substances en fonction de l’information disponible et des considérations suivantes :
- L’alpha-cédrène (204,35 g/mol), une substance représentative du sous-groupe 1 des sesquiterpènes tricycliques, a un poids moléculaire semblable à celui de l’acétylcédrène (246,39 g/mol) et de la 1-(2,3-dihydro-1,1,2,6-tétraméthyl-3-(propane-2-yl)-1H-indène-5-yl)éthane-1-one (OTNE; 234,38 g/mol). Il a aussi une pression de vapeur modérée. Ces 3 substances (acétylcédrène, OTNE et alpha-cédrène) ont une faible solubilité dans l’eau (0,01 mg/L à 10 mg/L) et des valeurs de log Koe modérées (3 à 6). Ces ressemblances laissent à penser que le potentiel d’absorption cutanée de l’alpha-cédrène serait semblable à celui des 2 autres substances.
- Une valeur d’absorption cutanée maximale de 25 % a été prise en compte, sur la base d’une étude in vitro de l’absorption cutanée chez l’humain de substances analogues, soit l’acétylcédrène et l’OTNE (Belsito et al., 2013). Dans cette étude, des taux d’absorption cutanée de 11 et de 15 % ont été notés pour l’acétylcédrène et l’OTNE après 48 heures d’exposition à ces substances à une concentration de 1 % en poids/volume dans de l’éthanol. Cependant, le taux de récupération global était inférieur à 70 % pour ces substances. Étant donné les renseignements limités de l’étude et le faible taux de récupération, nous avons modifié le taux d’absorption cutanée maximal par souci de prudence.
Exposition par inhalation
Les substances du sous-groupe 1 des sesquiterpènes tricycliques ont des pressions de vapeur variant de 0,0184 à 9,37 Pa et sont considérées comme volatiles. De ce fait, nous avons également quantifié l’exposition par inhalation associée aux scénarios sentinelles. Pour obtenir la quantité de produit disponible pour l’inhalation, nous avons multiplié par 75 % la quantité de produit afin de tenir compte de la quantité absorbée par la voie cutanée. Dans le cas des lotions pour le corps, puisque la quantité de produit disponible pour l’inhalation avait été calculée en fonction de la surface exposée et que la valeur résultante était inférieure à 75 % de la quantité de produit, nous n’avons apporté aucune autre modification à cette quantité.
Les estimations de l’exposition due aux cosmétiques contenant des substances du sous-groupe 1 des sesquiterpènes tricycliques pour les groupes d’âge les moins exposés et les plus exposés sont résumées dans le tableau 7-1. Les estimations de l’exposition cutanée, par inhalation et par voie orale à ces substances qui découle de l’utilisation de PSN et d’autres produits sont respectivement présentées dans les tableaux 7-2 et 7-3. En outre, nous avons calculé les estimations de l’exposition associée aux produits faits soi-même pour les groupes d’âge les moins exposés et les plus exposés. Elles sont résumées dans le tableau 7-4.
| Scénario | % dans le produit | Exposition cutanéea (mg/kg p.c./j) | Exposition par inhalationa (mg/kg p.c./j)a | Exposition par voie oralea (mg/kg p.c./j) |
|---|---|---|---|---|
| Huile de massageb (essence de bois de cèdre, essence de bois de cèdre du Texas) | 3 | 1,30 (adultes) à 8,57 (bébés de 0 à 5 mois) | 6,12 × 10-2 (adultes) à 1,24 × 10-1 (enfants de 1 an) | Sans objet |
| Parfum (essence de bois de cèdre) | 100 | 6,33 (enfants de 14 à 18 ans) à 18,70 (enfants de 2 à 3 ans) | 1,50 × 10-1 (adultes) à 2,63 × 10-1 (enfants de 2 à 3 ans) | Sans objet |
| Parfum (essence de bois de cèdre du Texas) | 30 | 1,93 (adultes) à 5,61 (enfants de 2 à 3 ans) | 4,51 × 10-2 (adultes) à 8,19 × 10-2 (enfants de 2 à 3 ans) | Sans objet |
| Parfum (alpha-cédrène) | 1 | 0,06 (enfants de 14 à 18 ans) à 0,19 (enfants de 2 à 3 ans) | 3,62 x 10-4 (adultes) à 7,40 x 10-4 (enfants de 2 à 3 ans) | Sans objet |
| Déodorant ou antisudorifique (solide) (essence de bois de cèdre) | 42 | 4,40 (enfants de 9 à 13 ans) à 7,45 (enfants de 14 à 18 ans) | 6,62 × 10-2 (enfants de 9 à 13 ans) à 1,26 × 10-1 (enfants de 14 à 18 ans) | Sans objet |
| Déodorant ou antisudorifique (solide) (essence de bois de cèdre du Texas) | 10 | 1,05 (enfants de 9 à 13 ans) à 1,77 (enfants de 14 à 18 ans) | 1,56 × 10-2 (enfants de 9 à 13 ans) à 3,08 × 10-2 (enfants de 14 à 18 ans) | Sans objet |
| Hydratant pour le corps (essence de bois de cèdre, essence de bois de cèdre du Texas) | 10 | 13,51 (adultes) à 31,75 (bébés de 0 à 5 mois) | 7,63 x 10-2 (bébés de 0 à 5 mois) à 1,69 × 10-1 (enfants de 14 à 18 ans) | Sans objet |
| Hydratant pour le visage (essence de bois de cèdre) | 10 | 2,42 (enfants de 14 à 18 ans) à 4,05 (adultes) | 9,27 x 10-2 (enfants de 9 à 13 ans) à 1,57 x 10-1 (adultes) | Sans objet |
| Hydratant pour le visage (essence de bois de cèdre du Texas) | 5 | 1,21 (enfants de 14 à 18 ans) à 2,03 (adultes) | 6,29 x 10-2 (enfants de 9 à 13 ans) à 1,04 x 10-1 (adultes) | Sans objet |
| Revitalisant (sans rinçage) (essence de bois de cèdre) | 14 | 2,26 (enfants de 14 à 18 ans) à 4,85 (enfants de 2 à 3 ans) | 9,23 × 10-2 (enfants de 14 à 18 ans) à 1,35 ×10-1 (enfants de 4 à 8 ans) | Sans objet |
| Shampooing (essence de bois de cèdre, essence de bois de cèdre du Texas) | 5 | 8,39 × 10-2 (enfants de 14 à 18 ans) à 3,10 × 10-1 (bébés de 0 à 5 mois) | 1,47 × 10-4 (enfants de 2 à 3 ans) à 2,78 × 10-4 (enfants de 1 an) | Sans objet |
| Produit capillaire lissant ou pour permanente (essence de bois de cèdre) | 0,1 | 0,11 (adultes) à 0,29 (enfants de 4 à 8 ans) | 1,60 × 10-5 (enfants de 14 à 18 ans) à 2,51 ×10-5 (enfants de 4 à 8 ans) | Sans objet |
| Colorant capillaire temporaire (essence de bois de cèdre du Texas) | 0,1 | 4,73 × 10-2 (adultes) à 1,52 × 10-1 (enfants de 4 à 8 ans) | 7,55 × 10-4 (adultes) à 1,79 × 10-3 (enfants de 4 à 8 ans) | Sans objet |
| Fixatif pour cheveux (essence de bois de cèdre du Texas) | 5 | 0,16 (enfants de 14 à 18 ans) à 0,43 (enfants de 4 à 8 ans) | 9,79 × 10-4 (adultes) à 2,32 × 10-3 (enfants de 4 à 8 ans) | Sans objet |
| Produit pour le bain (sel) (essence de bois de cèdre, essence de bois de cèdre du Texas) |
10 | 1,09 × 10-2 (adultes) à 1,39 × 10-2 (enfants de 9 à 13 ans) | 3,21 x 10-2 (enfants de 9 à 13 ans) à 4,72 x 10-2 (adultes) | Sans objet |
| Produit pour le bain (mousse ou bulles) (essence de bois de cèdre du Texas) | 5 | 9,32 × 10-3 (enfants de 9 à 13 ans) à 2,99 × 10-2 (enfants de 14 à 18 ans) | 1,85 × 10-5 (bébés de 0 à 5 mois) à 1,04 × 10-3 (adultes) | Sans objet |
| Produit pour le bain (essence de bois de cèdre) | 3,5 | 6,53 × 10-3 (enfants de 9 à 13 ans) à 2,09 × 10-2 (enfants de 14 à 18 ans) | 4,05 × 10-4 (bébés de 0 à 5 mois) à 2,24 × 10-2 (enfants de 14 à 18 ans) | Sans objet |
| Nettoyant pour le corps (solide) (essence de bois de cèdre, essence de bois de cèdre du Texas) | 100 | 0,18 (adultes) à 0,31 (bébés de 0 à 5 mois) | 8,08 × 10-3 (bébés de 0 à 5 mois) à 2,14 × 10-2 (enfants de 14 à 18 ans) | Sans objet |
| Nettoyant pour le corps (liquide) (essence de bois de cèdre) | 3 | 0,06 (adultes) à 0,26 (bébés de 0 à 5 mois) | 6,61 × 10-4 (bébés de 0 à 5 mois) à 1,54 × 10-3 (enfants de 14 à 18 ans) | Sans objet |
| Exfoliant pour le corps (essence de bois de cèdre du Texas) | 1 | 0,14 (adultes) à 0,16 (enfants de 14 à 18 ans) | 2,93 × 10-3 (adultes) à 3,69 × 10-3 (enfants de 14 à 18 ans) | Sans objet |
| Exfoliant pour le corps (essence de bois de cèdre) | 3 | 0,41 (adultes) à 0,48 (enfants de 14 à 18 ans) | 1,06 × 10-3 (adultes) à 1,28 × 10-3 (enfants de 14 à 18 ans) | Sans objet |
| Produit de maquillage pour le visage (fond de teint liquide) (essence de bois de cèdre, essence de bois de cèdre du Texas) | 0,3 | 1,98 × 10-2 (enfants de 14 à 18 ans) à 4,43 × 10-2 (enfants de 4 à 8 ans) | 8,21 × 10-4 (enfants de 14 à 18 ans) à 1,25 × 10-3 (enfants de 4 à 8 ans) | Sans objet |
| Baume à lèvres (essence de bois de cèdre) | 3 | Sans objet | Sans objet | 1,78 × 10-2 (adultes) à 4,4 × 10-2 (enfants de 2 à 3 ans) |
| Bain de bouche (essence de bois de cèdre) | 0,1 | Sans objet | Sans objet | 2,02 × 10-2 (enfants de 9 à 13 ans) à 4,4 × 10-2 (enfants de 2 à 3 ans) |
| Dentifrice (essence de bois de cèdre) | 0,5 | Sans objet | Sans objet | 1,35 × 10-2 (adultes) à 2,03 × 10-1 (enfants de 2 à 3 ans) |
| Crème à raser (visage) (essence de bois de cèdre) | 5 | 4,59 × 10-2 (adultes) à 7,62 × 10-2 (enfants de 9 à 13 ans) | 3,47 × 10-4 (enfants de 14 à 18 ans) à 4,25 × 10-4 (adultes) | Sans objet |
| Crème à raser (corps) (essence de bois de cèdre du Texas) | 10 | 0,17 (adultes) à 0,24 (enfants de 9 à 13 ans) | 2,06 × 10-2 (adultes) à 2,45 × 10-2 (enfants de 9 à 13 ans) | Sans objet |
| Crème à raser (corps) (essence de bois de cèdre) | 6,66 | 0,11 (adultes) à 0,16 (enfants de 9 à 13 ans) | 1,49 × 10-2 (adultes) à 1,76 × 10-2 (enfants de 9 à 13 ans) | Sans objet |
| Crème à raser (corps) (alpha-cédrène) | 0,1 | 1,72 × 10-3 (adultes) à 2,36 × 10-3 (enfants de 9 à 13 ans) | 1,42 × 10-6 (adultes) à 1,69 × 10-6 (enfants de 14 à 18 ans) | Sans objet |
| Produit après-rasage (visage) (essence de bois de cèdre) | 5 | 1,08 (adultes) à 1,99 (enfants de 9 à 13 ans) | 5,71 × 10-2 (adultes) à 9,60 × 10-2 (enfants de 9 à 13 ans) | Sans objet |
| Produit pour la peau après épilation (corps) (essence de bois de cèdre) | 3 | 2,88 (adultes) à 3,93 (enfants de 9 à 13 ans) | 4,69 × 10-2 (adultes) à 5,96 × 10-2 (enfants de 9 à 13 ans) | Sans objet |
| Adhésif pour le corps (essence de bois de cèdre) | 0,1 | 0,14 (adultes) à 0,16 (enfants de 14 à 18 ans) | 5,31 × 10-3 (adultes) à 6,67 × 10-4 (enfants de 14 à 18 ans) | Sans objet |
a Voir l’annexe A pour connaître le détail des calculs.
b Bien que la concentration maximale déclarée pour les huiles de massage contenant de l'essence de bois de cèdre était de 100 %, les huiles de massage sont généralement diluées avant l’utilisation. Il a donc été supposé que la concentration maximale de la substance dans ces produits était de 3 % (RIVM, 2006).
| Scénario | % dans le produit | Exposition cutanéea (mg/kg p.c./j) | Exposition par inhalationa (mg/kg p.c./j) |
|---|---|---|---|
| Nettoyant antiseptique pour la peau (en pulvérisateur) (PSN) (essence de bois de cèdre) | 0,05 | 1,44 × 10-2 (enfants de 14 à 18 ans) à 4,25 x 10-2 (enfants de 2 à 3 ans) | 1,62 × 10-5 (enfants de 14 à 18 ans) à 3,05 × 10-5 (enfants de 4 à 8 ans) |
| Nettoyant antiseptique pour la peau (en pulvérisateur) (PSN)b (essence de bois de cèdre) | 0,05 | 0,22 (adultes) à 1,06 (enfants de 2 à 3 ans) | 2,30 × 10-4 (adultes) à 6,92 × 10-4 (enfants de 2 à 3 ans) |
| Contre-irritant (en pulvérisateur) (PSN) (essence de bois de cèdre) | 2 | 0,42 (adultes) à 0,74 (enfants de 9 à 13 ans) | 9,35 × 10-4 (adultes) à 1,52 × 10-3 (enfants de 9 à 13 ans) |
| Baume de soulagement de l’irritation (PSN) (essence de bois de cèdre) | 1,21 | 0,90 (adultes) à 3,03 (enfants de 1 an) | 1,45 × 10-2 (adultes) à 3,43 × 10-2 (enfants de 4 à 8 ans) |
| Aromathérapie – liquide pour inhalation de vapeurs provenant d’un bol (PSN) (essence de bois de cèdre) | 5 | Sans objet | 1,49 × 10-3 (adultes) |
| Aromathérapie – liquide pour inhalation au moyen d’un diffuseur (PSN) (essence de bois de cèdre) | 5 | Sans objet | 5,10 × 10-2 (adultes) |
| Aromathérapie – pulvérisateur pour voies respiratoires (PSN) (essence de bois de cèdre) | 0,68 | Sans objet | 3,19 × 10-4 (adultes) |
| Produit de traitement contre l’acné (gel) (PSN) (essence de bois de cèdre) | 0,02 | 1,22 × 10-2 (adultes) à 1,57 × 10-2 (enfants de 9 à 13 ans) | 4,69 × 10-4 (adultes) à 5,64 × 10-4 (enfants de 14 à 18 ans) |
Abréviation : PSN = produit de santé naturel.
a Voir l’annexe A pour connaître le détail des calculs.
b Dans des situations préoccupantes pour la santé publique, l’utilisation de nettoyants antiseptiques pour la peau par la population générale peut augmenter pour atteindre 25 utilisations par jour (utilisation personnelle par les adultes, utilisation accrue par les enfants dans les écoles et les garderies) (RIVM, 2021a).
| Scénario | % dans le produit | Exposition cutanéea (mg/kg p.c./j) | Exposition par inhalationa (mg/kg p.c./j) | Exposition par voie oralea (mg/kg p.c./j) |
|---|---|---|---|---|
| Assainisseur d’air (enfichable) (alpha-cédrène) | 1 | 7,20 × 10-2 (adultes) | 4,69 × 10-3 (adultes) à 1,67 × 10-2 (enfants de 1 an) | Sans objet |
| Assainisseur d’air (bloc de cire) (essence de bois de cèdre du Texas) | 1 | 3,80 × 10-2 (adultes) | 6,94 × 10-3 (adultes) à 2,47 × 10-2 (enfants de 1 an) | Sans objet |
| Détergent à lessive liquide (lavage à la main)b (essence de bois de cèdre du Texas) | 1 | 1,10 × 10-1 (adultes) | 7,30 × 10-5 (adultes) | Sans objet |
| Détergent à lessive liquide (lavage à la machine)c (essence de bois de cèdre du Texas) | 1 | 7,42 × 10-2 (adultes) | 6,13 × 10-6 (adultes) | Sans objet |
| Détergent à lessive liquided (essence de bois de cèdre du Texas) | 1 | 2,74 × 10-3 (enfants de 1 an) | Sans objet | 7,64 × 10-7 (enfants de 1 an) |
| Aérosol pour l’entretien du cuir (alpha-cédrène) | 5 | 3,97 × 10-1 (adultes) | 2,86 × 10-3 (adultes) | Sans objet |
| Produit de nettoyage ou de désodorisation des toilettes ou des urinoirs (nettoyage automatique des cuvettes) (alpha-cédrène) | 10 | Négligeable | 2,02 × 10-1 (enfants de 2 à 3 ans) | Sans objet |
| Produit de nettoyage ou de désodorisation des toilettes ou des urinoirs (application) (essence de bois de cèdre du Texas) | 1 | 5,22 × 10-2 (adultes) | 5,92 × 10-6 (adultes) | Sans objet |
a Voir l’annexe A pour connaître le détail des calculs.
b Exposition estimée due au mélange, au chargement, au lavage à la main et à l’étendage de la lessive.
c Exposition estimée due au mélange, au chargement et à l’étendage de la lessive.
d Exposition estimée des enfants de 1 an due à la migration à partir de textiles lavés.
| Scénario | % dans le produit | Exposition cutanéea (mg/kg p.c./j) | Exposition par inhalationa (mg/kg p.c./j) | Exposition par voie oralea (mg/kg p.c./j) |
|---|---|---|---|---|
| Diffuseur d’arôme/ assainisseur d’air (inhalation et remplissage) |
100 | 1,29 (adultes) à 2,27 (enfants de 9 à 13 ans) | 0,55 (adultes) à 0,89 (enfants de 9 à 13 ans) | Sans objet |
| Diffuseur d’arôme/ assainisseur d’air (exposition des non-utilisateurs) | 100 | Sans objet | 1,30 (enfants de 4 à 8 ans) à 1,96 (enfants de 1 an) | Sans objet |
| Huile de massage | 3 | 1,30 (adultes) à 8,57 (bébés de 0 à 5 mois) | 6,12 × 10-2 (adultes) à 1,24 × 10-1 (enfants de 1 an) | Sans objet |
| Hydratant pour le corps | 3 | 4,05 (adultes) à 9,52 (bébés de 0 à 5 mois) | 2,35 × 10-2 (bébés de 0 à 5 mois) à 5,13 × 10-2 (enfants de 14 à 18 ans) | Sans objet |
| Huile pour le bain | 100 | 9,40 × 10-3 (adultes) à 1,20 × 10-2 (enfants de 9 à 13 ans) |
4,16 x 10-6 (enfants de 9 à 13 ans) à 8,86 x 10-3 (adultes) | Sans objet |
| Brumisateur facialb (application) | 100 | 1,42 (adultes) à 4,57 (enfants de 4 à 8 ans) | 0,43 (adultes) à 1,03 (enfants de 4 à 8 ans) | Sans objet |
| Brumisateur facialb (exposition des non-utilisateurs) | 100 | Sans objet | 4,61 × 10-1 (enfants de 1 an) | Sans objet |
| Nettoyant liquide pour plancherc | 100 | 9,17 × 10-2 (adultes) | 2,24 × 10-4 (adultes) | Sans objet |
| Exposition après application à des planchers nettoyésd | 100 | 3,48 × 10-2 (enfants de 1 an) | 8,00 × 10-4 (enfants de 1 an) | 2,61 × 10-3 (enfants de 1 an) |
a Voir l’annexe B pour connaître le détail des calculs.
b Après un total de 4 heures d’exposition. Une fois l’appareil éteint après 20 minutes d’utilisation, il est supposé que la personne reste dans la pièce pendant 3 heures et 40 minutes.
c Exposition estimée due au mélange, au chargement et à l’application.
d Exposition estimée des enfants de 1 an due à la migration à partir de planchers lavés.
7.1.2 Évaluation des effets sur la santé
Il n’existe aucune donnée empirique ni évaluation internationale portant sur l’alpha-cédrène, le bêta-cédrène, le thujopsène, l’alpha-gurjunène, le bêta-patchoulène, l'essence de bois de cèdre du Texas et les terpènes et terpénoïdes de l’essence de cèdre.
L’alpha-cédrène et le bêta-cédrène sont des composés organiques classifiés comme des sesquiterpènes tricycliques, des alcènes et des isomères l’un de l’autre (91,77 % de similitude structurale dans la boîte à outils QSAR de l’OCDE [2019]). Ils présentent des propriétés physico-chimiques semblables.
Dans la boîte à outils QSAR de l’OCDE (2019), le thujopsène, l’alpha-cédrène, l’alpha-gurjunène et le bêta-patchoulène ont des structures et des métabolites semblables, ce qui a été établi au moyen du simulateur du métabolisme in vivo du rat, et ce sont tous des sesquiterpènes tricycliques comportant un cycloalcane et un groupe carbocyclique insaturé. Toujours dans cette boîte à outils, la plupart des indicateurs (par exemple liaison à l’ADN ou aux récepteurs des œstrogènes, sauf pour le glutathion se liant aux protéines [réactivité modérée], classification comme danger toxique par Cramer [classe 1 faible], système expert des récepteurs des œstrogènes chez la truite arc-en-ciel – US EPA [hydrocarbures multicycliques]) étaient négatifs pour les 4 substances. Il a été déterminé que l’alpha-cédrène était l’analogue le plus approprié pour le thujopsène, l’alpha-gurjunène et le bêta-patchoulène.
Puisqu’il a été établi que le thujopsène, l’alpha-cédrène et le bêta-cédrène sont des composants principaux des terpènes et terpénoïdes de l’essence de cèdre, de l'essence de bois de cèdre du Texas et de l'essence de bois de cèdre, nous nous sommes fondés sur les données sur l'essence de bois de cèdre pour évaluer les effets sur la santé de l’ensemble du sous-groupe.
Au cours d’une étude combinée à doses répétées avec évaluation préliminaire de la toxicité pour la reproduction et le développement menée conformément à la ligne directrice 422 de l’OCDE, des rats Wistar Han mâles et femelles (10/dose/sexe) ont reçu par voie orale 0, 750 ppm (62 et 104 mg/kg p.c./j, respectivement), 1 500 ppm (120 et 207 mg/kg p.c./j, respectivement) ou 5 000 ppm (381 et 560 mg/kg p.c./j, respectivement) d’essence de bois de cèdre dans des aliments pendant 28 jours pour les mâles et 49 à 62 jours pour les femelles (deux semaines avant l’accouplement, pendant l’accouplement et la gestation et jusqu’à 13 jours après la naissance). 5 mâles et 5 femelles du groupe témoin et du groupe ayant reçu la plus forte dose ont bénéficié d’une période de rétablissement de 14 jours (ECHA, 2018). Les rats des 2 sexes ont réduit leur consommation d’aliments par rapport à la période avant l’accouplement (-15 %), tandis que ce fût le cas pour les femelles seulement pendant la gestation et la lactation (-25 et -30 %, respectivement) à la dose de 560 mg/kg p.c./j. Le gain de poids corporel des mâles et des femelles a diminué en fonction de la dose (les valeurs n’ont pas été fournies par les auteurs). Cet effet était significatif à la dose la plus élevée, soit 381 mg/kg p.c./j pour les mâles et 560 mg/kg p.c./j pour les femelles. Il n’a toutefois pas été considéré comme nocif puisqu’il n’a jamais dépassé 10 %. Quoi qu’il en soit, le poids corporel des animaux mâles et femelles ayant respectivement reçu 381 et 560 mg/kg p.c./j était toujours significativement plus faible après la période de rétablissement. Les taux plasmatiques d’activité des phosphatases alcalines ont augmenté chez les 2 sexes, tandis que l’activité de l’alanine aminotransférase, de la bilirubine et du cholestérol ont augmenté chez les femelles uniquement à toutes les doses mises à l’essai. L’ampleur de ces changements n’est pas indiquée dans le dossier, et ceux-ci sont jugés non nocifs par les auteurs en l’absence de changements hépatiques inflammatoires. Une augmentation du poids (absolu et relatif) du foie et une diminution du poids (absolu) du thymus ont été observées chez les femelles à la dose de 560 mg/kg p.c./j. Après la période de rétablissement sans traitement, le poids du foie et du thymus de ces femelles était comparable à celui des femelles témoins. Une hypertrophie hépatocellulaire (centrolobulaire) a été observée chez les femelles recevant une dose de 207 mg/kg p.c./j et plus, mais ces animaux se sont complètement rétablis après une période sans traitement de 19 jours. Dans le groupe ayant reçu la plus forte dose, les concentrations sériques d’hormone thyroïdienne T4 ont diminué en fonction de la dose chez les animaux des 2 sexes de la génération F0, pour toutes les doses (-32, 43 et -59 % chez les mâles et -19, -28 et -53 % chez les femelles pour les doses de 62 et 104, 120 et 207, et 381 et 560 mg/kg p.c./j, respectivement). Un rétablissement complet a été observé chez les mâles ayant reçu une dose de 381 mg/kg p.c./j après une période sans traitement de 14 jours (non déterminé chez les femelles). Aucun changement de la glande thyroïde n’a été relevé. Quelques écarts de poids d’organes étaient statistiquement significatifs (chez les mâles) en comparaison avec le groupe témoin (c’est-à-dire cerveau, cœur, épididymes et reins), mais aucune précision supplémentaire n’était fournie. Les ratons du groupe ayant reçu 560 mg/kg p.c./j ont présenté une diminution du poids corporel moyen aux jours postnataux 1 (4 %), 4 (8 %), 7 (11 %) et 13 (17 %), mais les auteurs n’ont observé aucune modification des soins maternels ni aucun signe clinique. Aucun changement lié au traitement n’a été noté pour les autres paramètres de développement, pas plus que d’effet sur la concentration sérique de l’hormone thyroïdienne T4 chez les ratons aux jours postnataux 13 à 15. Dans la présente évaluation des effets sur la santé, nous avons établi une dose minimale avec effet nocif observé (DMENO) de 750 ppm (correspondant à 62 mg/kg p.c./j chez les mâles) sur la base d’une diminution liée à la dose des taux d’hormone thyroïdienne T4 chez les rats mâles (après 28 jours d’exposition) et femelles (après 62 jours d’exposition).
Dans le cadre d’une étude de l’exposition cutanée répétée, des rats F344/N mâles et femelles (10/sexe/dose) ont été traités par voie cutanée avec 0 (excipient seulement), 31,25, 62,5, 125, 250 ou 500 mg/kg p.c./j d’essence de bois de cèdre dissoutes dans de l’éthanol aqueux à 95 %. Le produit a été appliqué sur une zone rasée du dos sous l’omoplate 5 jours par semaine pendant 3 mois. Un autre groupe de 10 mâles et 10 femelles n’a reçu aucun traitement (NTP, 2016). Les préparations ont été administrées à raison de 0,5 mL/kg p.c./j. À l’exception de 2 mâles du groupe recevant une dose de 500 mg/kg p.c./j qui ont été retirés de l’étude en raison de graves lésions cutanées, tous les rats ont survécu jusqu’à la fin de l’étude. Les poids corporels moyens et les gains de poids corporels des mâles et des femelles appartenant aux groupes des doses de 250 et de 500 mg/kg p.c./j étaient significativement inférieurs. Le gain de poids corporel était également significativement inférieur pour les mâles du groupe de 125 mg/kg p.c./j. La principale observation clinique portait sur la peau au site d’application, où de l’irritation, un épaississement et des ulcérations ont été observées chez les mâles recevant des doses de 125 mg/kg p.c./j et plus et chez les femelles recevant des doses de 62,5 mg/kg p.c./j et plus. Le poids du foie a augmenté chez les mâles aux 2 doses les plus élevées et chez les femelles à la plus forte dose. Le poids absolu du thymus a diminué chez les mâles aux doses de 125 et 500 mg/kg p.c./j, tandis que les poids absolu et relatif du thymus ont diminué chez les femelles à la dose de 500 mg/kg p.c./j. De plus, de nombreuses lésions non néoplastiques, comme une hyperkératose et une hyperplasie de l’épiderme, une inflammation chronique et une hyperplasie du follicule pileux et de la glande sébacée, ont été observées au site d’application chez les femelles à toutes les doses et chez les mâles aux doses de 62,5 mg/kg p.c./j et plus. La présence d’hyperplasie de la moelle osseuse était significativement plus élevée chez les mâles et les femelles recevant une dose de 500 mg/kg p.c./j. Une augmentation significative du nombre total de globules blancs et de neutrophiles a été notée chez les femelles à la dose de 250 mg/kg p.c./j et chez les 2 sexes à la dose de 500 mg/kg p.c./j. Il s’agit probablement d’une réponse immunitaire, étant donné la présence d’ulcérations et d’inflammation chronique au site d’application chez les rats ayant reçu ces doses. La dose sans effet nocif observé (DSENO) de cette étude est de 62,5 mg/kg p.c./j compte tenu de la diminution du poids du thymus chez les mâles à la dose de 125 mg/kg p.c/j, de la diminution du poids corporel des mâles et des femelles aux doses de 250 et de 500 mg/kg p.c./j et de l’augmentation du poids du foie chez les mâles aux doses de 250 et de 500 mg/kg p.c./j et chez les femelles à la dose de 500 mg/kg p.c./j.
Au cours d’une étude similaire, des souris B6C3F1 (10/sexe/dose) ont été traitées par voie cutanée avec 0 (excipient seulement), 125, 250, 500, 1 000 ou 2 000 mg/kg p.c./j d’essence de bois de cèdre 5 jours par semaine pendant 3 mois (NTP, 2016). Les préparations ont été administrées à raison de 2,0 mL/kg p.c. mélangés à de l’éthanol aqueux à 95 %. L’étude a montré la présence d’irritation, de lésions et d’ulcérations de la peau au site d’application qui étaient si graves que toutes les souris recevant la dose la plus élevée ont été euthanasiées prématurément. Un mâle et une femelle du groupe recevant la dose de 1 000 mg/kg p.c./j ainsi qu’un mâle du groupe de 250 mg/kg p.c./j ont également été euthanasiés. Le poids corporel des mâles exposés aux doses de 500 et de 1 000 mg/kg p.c./j et des femelles exposées aux doses de 250 mg/kg p.c./j et plus a diminué de façon significative. Le poids absolu du foie des mâles et des femelles du groupe de 1 000 mg/kg p.c./j et le poids relatif du foie des mâles et des femelles de tous les groupes de doses étaient significativement plus élevés. Le poids absolu du thymus des mâles ayant reçu les doses de 500 et de 1 000 mg/kg p.c./j et des femelles ayant reçu les doses de 250 mg/kg p.c./j et plus avait diminué de manière significative. Le poids absolu des reins des femelles exposées à la dose de 1 000 mg/kg p.c./j et le poids relatif des reins des femelles exposées aux doses de 250 mg/kg p.c./j et plus étaient significativement plus élevés. De plus, de nombreuses lésions non néoplastiques, comme une hyperkératose et une hyperplasie de l’épiderme, une inflammation chronique et une hyperplasie du follicule pileux et de la glande sébacée, ont été observées au site d’application chez les mâles et les femelles à toutes les doses. Une augmentation de l’épuisement du glycogène dans les hépatocytes a été observée dans le foie des souris des 2 sexes exposées aux doses de 250 mg/kg p.c./j et plus. Des lésions non néoplastiques d’hyperplasie lymphoïde ont été notées dans les ganglions lymphatiques mandibulaires à toutes les doses, un effet secondaire des lésions de l’épiderme. L’incidence de l’hyperplasie des cellules myéloïdes de la moelle osseuse et de la prolifération des cellules hématopoïétiques dans la rate a augmenté à toutes les doses chez les 2 sexes. Une augmentation significative de l’atrophie du thymus a été observée chez les mâles exposés à la dose de 500 mg/kg p.c./j. Les effets hématologiques comprenaient une augmentation des leucocytes (globules blancs et formule leucocytaire) chez les femelles à la dose de 500 mg/kg p.c./j ainsi que des diminutions liées au traitement dans l’érythron (c’est-à-dire hématocrite, hémoglobine et nombre de globules rouges) chez les mâles aux doses de 250 mg/kg p.c./j et plus et les femelles aux doses de 500 et de 1 000 mg/kg p.c./j. Une DSENO de 125 mg/kg p.c./j a été sélectionnée d’après la diminution du poids du thymus chez les femelles exposées aux doses de 250 mg/kg p.c./j ou plus.
À la lumière de la diminution du poids du thymus chez les souris et les rats des 2 sexes, nous avons établi, dans la présente évaluation des effets sur la santé, une DSENO de 62,5 mg/kg p.c./j pour tenir compte des effets systémiques.
L'essence de bois de cèdre ne s'est pas avérées génotoxiques dans un essai de mutation inverse sur des bactéries Salmonella typhimurium de souches TA98, TA100, TA1535 et TA1537, dans des essais in vitro de mutation génique sur des cellules de mammifères utilisant le gène de la thymidine kinase (ECHA, 2018), ni dans un test du micronoyau in vivo chez la souris (NTP, 2016).
Les renseignements disponibles sur les effets sur la santé associés à l’autre composant principal de l'essence de bois de cèdre, le cédrol (12,3 à 22,2 %), ainsi qu’à l’alpha-himachalène (5,7 à 16,9 %), au bêta-himachalène (14,1 à 46 %), au gamma-himachalène (4,8 à 9,7 %) et à l’alpha-atlantone (5,2 à 31,9 %), ont également été examinés.
Cédrol
Il n’existe pas beaucoup de données internationales et empiriques sur le cédrol. En se fondant sur la seule étude de courte durée disponible et une lecture croisée de groupe, l’EFSA et le Research Institute for Fragrance Materials ont conclu que le cédrol ne soulevait aucun problème de sécurité (Bhatia et al., 2008; EFSA, 2015).
Dans le cadre d’une étude sur la chimiothérapie contre les tumeurs cérébrales, les auteurs ont traité des rats F344 femelles et des souris Foxn1 nu/nu femelles avec 0, 75 ou 150 mg/kg p.c./j de cédrol en leur faisant une injection sous-cutanée aux 2 jours pendant 10 jours (rats) ou 20 jours (souris) (Chang et al., 2020). Le cédrol a stoppé la croissance des tumeurs cérébrales chez les 2 espèces en ciblant le récepteur des androgènes et en réduisant sa translocation nucléaire induite par la dihydrotestostérone, l’expression du gène KLK3/TMPRSS2 en aval et la prolifération cellulaire. Les résultats indiquent que le cédrol pourrait agir comme un perturbateur endocrinien.
Lors d’une étude de courte durée, des rats Sprague-Dawley mâles et femelles (10/sexe/dose) ont ingéré par gavage 0 ou 8,4 mg/kg p.c./j de cédrol dans une solution de 1 % de carboxyméthylcellulose dans de l’eau distillée 7 jours par semaine pendant 4 semaines (Bhatia et al., 2008). Aucun effet clinique n’a été observé. Cependant, une diminution significative du poids absolu du cerveau et du rapport entre les poids du cerveau et du corps et entre les poids des ovaires et du corps a été notée chez les femelles exposées. Les auteurs de l’étude ont considéré que ces effets n’étaient pas nocifs, parce qu’ils n’étaient pas constants d’un sexe à l’autre et n’étaient pas accompagnés de changements cliniques. Aucun renseignement supplémentaire n’était fourni. Toutefois, compte tenu de la capacité du cédrol à réduire l’action de la dihydrotestostérone sur le récepteur des androgènes chez les femelles relevée dans l’étude décrite précédemment, nous n’avons pas fait abstraction de ces effets dans la présente évaluation des effets sur la santé. Nous considérons donc le cédrol comme une substance potentiellement anti-androgène chez les rongeurs femelles.
Le cédrol s’est révélé négatif dans un essai de mutation inverse sur de multiples souches de Salmonella typhimurium, avec et sans activation métabolique (Marnett et al., 2014).
Alpha-himachalène, bêta-himachalène et gamma-himachalène
Il n’existe aucune donnée empirique sur l’alpha-himachalène, le bêta-himachalène et le gamma-himachalène. Comme ni le bêta-himachalène, le gamma-himachalène et l’alpha-atlantone ne sont compris dans la boîte à outils QSAR de l’OCDE (2019), il n’a pas été possible d’appliquer une approche de lecture croisée. Une telle approche a été adoptée pour l’alpha-himachalène, l’alpha-cédrène et le thujopsène. Ces 3 composés se sont révélés être des analogues des uns des autres et présenter des propriétés physico-chimiques, des poids moléculaires, des volatilités et des valeurs de log Koe semblables. Ils sont des sesquiterpènes lipophiles et des hydrocarbures multicycliques comportant des cycloalcanes. À la lumière de ces renseignements, nous les avons évalués tous ensemble en utilisant les données sur les effets sur la santé de l'essence de bois de cèdre.
7.1.3 Caractérisation des risques pour la santé humaine
En ce qui concerne la voie cutanée, la concentration entraînant un effet critique établie pour les substances du sous-groupe 1 des sesquiterpènes tricycliques était une DSENO cutanée de 62,5 mg/kg p.c./j d’essence de bois de cèdre. Cette valeur est fondée sur une diminution du poids du thymus après une période d’exposition de 90 jours de rats mâles à des doses de 125 et de 500 mg/kg p.c./j et de rats femelles à une dose de 500 mg/kg p.c./j. Ce même effet a été observé chez les souris, à des doses de 250 mg/kg p.c./j et plus pour les femelles et à une dose de 500 mg/kg p.c./j pour les mâles (NTP, 2016). Cet effet systémique sur le thymus est étayé par une diminution du poids du thymus chez les rats femelles exposés à une dose de 560 mg/kg p.c./j d’essence de bois de cèdre par voie orale pendant 69 jours (ECHA, 2018).
En ce qui a trait à la voie orale et à l’inhalation, nous avons employé une DMENO de 62 mg/kg p.c./j (plus faible dose testée chez les mâles) d’essence de bois de cèdre, tirée de l’étude portant sur une génération susmentionnée, pour caractériser les risques. Cette valeur s’appuie sur l’effet critique sur la santé qu’est la diminution liée à la dose de l’hormone thyroïdienne T4 chez les rats mâles et femelles (période d’exposition de 28 et de 69 jours, respectivement) (ECHA, 2018). La DMENO chez les mâles est considérée comme protectrice des femelles, puisque les mêmes effets nocifs ont été notés chez les rats femelles à une dose de 104 mg/kg p.c./j. De plus, étant donné qu’il n’existe aucune évaluation des effets de l'essence de bois de cèdre sur le risque de neurotoxicité pour le développement, la DMENO de 62 mg/kg p.c./j d’essence de bois de cèdre chez les rats mâles sera utilisée relativement à ce paramètre. Ce point de départ a été jugé pertinent pour tous les groupes d’âge, indépendamment de la composition et de l’espèce du bois de cèdre duquel l'essence a été extraite. Il est considéré comme protecteur, autant en ce qui concerne les effets systémiques à court et à long terme que les effets localisés pendant l’exposition.
Les estimations de l’exposition quotidienne aux substances du sous-groupe 1 des sesquiterpènes tricycliques des groupes d’âge les plus exposés et les moins exposés ainsi que les marges d’exposition résultantes sont résumées dans les tableaux 7-5 et 76 en ce qui a trait aux cosmétiques et aux aromatisants alimentaires, dans les tableaux 7-7 et 7-8 en ce qui a trait aux PSN, et dans les tableaux 7-9 et 7-10 en ce qui a trait aux autres produits. Les estimations de l’exposition quotidienne à ces substances et les marges d’exposition résultantes associées aux produits faits soi-même sont présentées dans les tableaux 7-11 et 7-12.
| Scénario | % dans le produit | Exposition cutanée (mg/kg p.c./j) | MEa, b |
|---|---|---|---|
| Huile de massage (essence de bois de cèdre, essence de bois de cèdre du Texas) (tous) | 3 | 1,30 (adultes) à 8,57 (bébés de 0 à 5 mois) | 5 (bébés de 0 à 5 mois) à 34 (adultes) |
| Parfum (essence de bois de cèdre) (enfants de 2 à 3 ans à adultes) | 100 | 6,33 (enfants de 14 à 18 ans) à 18,70 (enfants de 2 à 3 ans) | 2 (enfants de 2 à 3 ans) à 7 (enfants de 14 à 18 ans) |
| Parfum (essence de bois de cèdre du Texas) (enfants de 2 à 3 ans à adultes) | 30 | 1,93 (adultes) à 5,61 (enfants de 2 à 3 ans) | 8 (enfants de 2 à 3 ans) à 23 (adultes) |
| Parfum (alpha-cédrène) (enfants de 2 à 3 ans à adultes) | 1 | 0,06 (enfants de 14 à 18 ans) à 0,19 (enfants de 2 à 3 ans) | 239 (enfants de 2 à 3 ans) à 704 (enfants de 14 à 18 ans) |
| Déodorant ou antisudorifique (solide) (essence de bois de cèdre) (enfants de 9 à 13 ans à adultes) | 42 | 4,40 (enfants de 9 à 13 ans) à 7,45 (enfants de 14 à 18 ans) | 6 (enfants de 14 à 18 ans) à 10 (enfants de 9 à 13 ans) |
| Déodorant ou antisudorifique (solide) (essence de bois de cèdre du Texas) (enfants de 9 à 13 ans à adultes) | 10 | 1,05 (enfants de 9 à 13 ans) à 1,77 (enfants de 14 à 18 ans) | 25 (enfants de 14 à 18 ans) à 43 (enfants de 9 à 13 ans) |
| Hydratant pour le corps (essence de bois de cèdre, essence de bois de cèdre du Texas) (tous) | 10 | 13,51 (adultes) à 31,75 (bébés de 0 à 5 mois) | 1 (bébés de 0 à 5 mois) à 3 (adultes) |
| Hydratant pour le visage (essence de bois de cèdre) (enfants de 9 à 13 ans à adultes) | 10 | 2,42 (enfants de 14 à 18 ans) à 4,05 (adultes) | 11 (adultes) à 18 (enfants de 14 à 18 ans) |
| Hydratant pour le visage (essence de bois de cèdre du Texas) (enfants de 9 à 13 ans à adultes) | 5 | 1,21 (enfants de 14 à 18 ans) à 2,03 (adultes) | 22 (adultes) à 37 (enfants de 14 à 18 ans) |
| Revitalisant (sans rinçage) (essence de bois de cèdre) (enfants de 2 à 3 ans à adultes) | 14 | 2,26 (enfants de 14 à 18 ans) à 4,85 (enfants de 2 à 3 ans) | 9 (enfants de 2 à 3 ans) à 20 (enfants de 14 à 18 ans) |
| Shampooing (essence de bois de cèdre, essence de bois de cèdre du Texas) (tous) | 5 | 8,39 × 10-2 (enfants de 14 à 18 ans) à 3,10 × 10-1 (bébés de 0 à 5 mois) | 144 (bébés de 0 à 5 mois) à 532 (enfants de 14 à 18 ans) |
| Produit capillaire lissant ou pour permanente (essence de bois de cèdre) (enfants de 4 à 8 ans à adultes) | 0,1 | 0,11 (adultes) à 0,29 (enfants de 4 à 8 ans) | 156 (enfants de 4 à 8 ans) à 413 (adultes) |
| Colorant capillaire temporaire (essence de bois de cèdre du Texas) (enfants de 4 à 8 ans à adultes) | 0,1 | 4,73 × 10-2 (adultes) à 1,52 × 10-1 (enfants de 4 à 8 ans) | 293 (enfants de 4 à 8 ans) à 944 (adultes) |
| Fixatif pour cheveux (essence de bois de cèdre du Texas) (enfants de 4 à 8 ans à adultes) | 5 | 0,16 (enfants de 14 à 18 ans) à 0,43 (enfants de 4 à 8 ans) | 105 (enfants de 4 à 8 ans) à 283 (enfants de 14 à 18 ans) |
| Produit pour le bain (sel) (essence de bois de cèdre, essence de bois de cèdre du Texas) (enfants de 9 à 13 ans à adultes) | 10 | 1,09 × 10-2 (adultes) à 1,39 × 10-2 (enfants de 9 à 13 ans) | 3 217 (enfants de 9 à 13 ans) à 4 098 (adultes) |
| Produit pour le bain (mousse/bulles) (essence de bois de cèdre du Texas) (tous) | 5 | 9,32 × 10-3 (enfants de 9 à 13 ans) à 2,99 × 10-2 (enfants de 14 à 18 ans) | 1 495 (enfants de 14 à 18 ans) à 4 788 (enfants de 9 à 13 ans) |
| Produit pour le bain (essence de bois de cèdre) | 3,5 | 6,53 × 10-3 (enfants de 9 à 13 ans) à 2,09 × 10-2 (enfants de 14 à 18 ans) | 2 135 (enfants de 14 à 18 ans) à 6 840 (enfants de 9 à 13 ans) |
| Nettoyant pour le corps (solide) (essence de bois de cèdre, essence de bois de cèdre du Texas) (tous) | 100 | 0,18 (adultes) à 0,31 (bébés de 0 à 5 mois) | 142 (bébés de 0 à 5 mois) à 250 (adultes) |
| Nettoyant pour le corps (liquide) (essence de bois de cèdre) (tous) | 3 | 0,06 (adultes) à 0,26 (bébés de 0 à 5 mois) | 174 (bébés de 0 à 5 mois) à 715 (adultes) |
| Exfoliant pour le corps (essence de bois de cèdre du Texas) (enfants de 14 à 18 ans à adultes) | 1 | 0,14 (adultes) à 0,16 (enfants de 14 à 18 ans) | 277 (enfants de 14 à 18 ans) à 330 (adultes) |
| Exfoliant pour le corps (essence de bois de cèdre) (enfants de 14 à 18 ans à adultes) | 3 | 0,41 (adultes) à 0,48 (enfants de 14 à 18 ans) | 92 (enfants de 14 à 18 ans) à 110 (adultes) |
| Produit de maquillage pour le visage (fond de teint liquide) (essence de bois de cèdre, essence de bois de cèdre du Texas) (enfants de 4 à 8 ans à adultes) | 0,3 | 1,98 × 10-2 (enfants de 14 à 18 ans) à 4,43 × 10-2 (enfants de 4 à 8 ans) | 1 007 (enfants de 4 à 8 ans) à 2 250 (enfants de 14 à 18 ans) |
| Crème à raser (visage) (essence de bois de cèdre) (enfants de 9 à 13 ans à adultes) | 5 | 4,59 × 10-2 (adultes) à 7,62 × 10-2 (enfants de 9 à 13 ans) | 586 (enfants de 9 à 13 ans) à 972 (adultes) |
| Crème à raser (corps) (essence de bois de cèdre du Texas) (enfants de 9 à 13 ans à adultes) | 10 | 0,17 (adultes) à 0,24 (enfants de 9 à 13 ans) | 189 (enfants de 9 à 13 ans) à 260 (adultes) |
| Crème à raser (corps) (essence de bois de cèdre) (enfants de 9 à 13 ans à adultes) | 6,66 | 0,11 (adultes) à 0,16 (enfants de 9 à 13 ans) | 284 (enfants de 9 à 13 ans) à 391 (adultes) |
| Crème à raser (corps) (alpha-cédrène) (enfants de 9 à 13 ans à adultes) | 0,1 | 1,72 × 10-3 (adultes) à 2,36 × 10-3 (enfants de 9 à 13 ans) | 18 930 (enfants de 9 à 13 ans) à 25 999 (adultes) |
| Produit après-rasage (visage) (essence de bois de cèdre) (enfants de 9 à 13 ans à adultes) | 5 | 1,08 (adultes) à 1,99 (enfants de 9 à 13 ans) | 22 (enfants de 9 à 13 ans) à 41 (adultes) |
| Produits pour la peau après épilation (corps) (essence de bois de cèdre) (enfants de 9 à 13 ans à adultes) | 3 | 2,88 (adultes) à 3,93 (enfants de 9 à 13 ans) | 11 (enfants de 9 à 13 ans) à 16 (adultes) |
| Adhésif pour le corps (essence de bois de cèdre) (enfants de 14 à 18 ans à adultes) | 0,1 | 0,14 (adultes) à 0,16 (enfants de 14 à 18 ans) | 277 (enfants de 14 à 18 ans) à 330 (adultes) |
Abréviation : ME = marge d’exposition.
a Selon une DSENO cutanée de 44,64 mg/kg p.c./j (62,5 mg/kg p.c./j, ajustée pour un traitement 5 j/sem.), qui repose sur un poids du thymus réduit aux doses élevées.
b ME cible = 100 (10x pour l’extrapolation interspécifique × 10x pour la variation intraspécifique). Les ME en gras sont considérées comme potentiellement inadéquates.
| Scénario | % dans le produit | Voie d’exposition | Exposition (mg/kg p.c./j) | MEa, b |
|---|---|---|---|---|
| Aromatisant alimentaire (terpènes et terpénoïdes de l’essence de cèdre) (enfants de 1 an et personnes plus âgées) | - | Orale | 1,41 × 10-4 (enfants de 1 an et personnes plus âgées) | 439 093 (enfants de 1 an et personnes plus âgées) |
| Huile de massage (essence de bois de cèdre, essence de bois de cèdre du Texas) (tous) | 3 | Inhalation | 6,12 × 10-2 (adultes) à 1,24 × 10-1 (enfants de 1 an) | 501 (enfants de 1 an) à 1 013 (adultes) |
| Parfum (essence de bois de cèdre) (enfants de 2 à 3 ans à adultes) | 100 | Inhalation | 1,50 × 10-1 (adultes) à 2,63 × 10-1 (enfants de 2 à 3 ans) | 236 (enfants de 2 à 3 ans) à 414 (adultes) |
| Parfum (essence de bois de cèdre du Texas) (enfants de 2 à 3 ans à adultes) | 30 | Inhalation | 4,51 × 10-2 (adultes) à 8,19 × 10-2 (enfants de 2 à 3 ans) | 757 (enfants de 2 à 3 ans) à 1 375 (adultes) |
| Parfum (alpha-cédrène) (enfants de 2 à 3 ans à adultes) | 1 | Inhalation | 3,62 × 10-4 (adultes) à 7,40 × 10-4 (enfants de 2 à 3 ans) | 83 736 (enfants de 2 à 3 ans) à 171 399 (adultes) |
| Déodorant ou antisudorifique (solide) (essence de bois de cèdre) (enfants de 9 à 13 ans à adultes) | 42 | Inhalation | 6,62 × 10-2 (enfants de 9 à 13 ans) à 1,26 × 10-1 (enfants de 14 à 18 ans) | 355 (enfants de 14 à 18 ans) à 674 (enfants de 9 à 13 ans) |
| Déodorant ou antisudorifique (solide) (essence de bois de cèdre du Texas) (enfants de 9 à 13 ans à adultes) | 10 | Inhalation | 1,56 × 10-2 (enfants de 9 à 13 ans) à 3,08 × 10-2 (enfants de 14 à 18 ans) | 1 451 (enfants de 14 à 18 ans) à 2 870 (enfants de 9 à 13 ans) |
| Hydratant pour le corps (essence de bois de cèdre, essence de bois de cèdre du Texas) (tous) | 10 | Inhalation | 7,63 × 10-2 (bébés de 0 à 5 mois) à 1,69 × 10-1 (enfants de 14 à 18 ans) | 366 (enfants de 14 à 18 ans) à 812 (bébés de 0 à 5 mois) |
| Hydratant pour le visage (essence de bois de cèdre) (enfants de 9 à 13 ans à adultes) | 10 | Inhalation | 9,27 × 10-2 (enfants de 9 à 13 ans) à 1,57 × 10-1 (adultes) | 395 (adultes) à 669 (enfants de 9 à 13 ans) |
| Hydratant pour le visage (essence de bois de cèdre du Texas) (enfants de 9 à 13 ans à adultes) | 5 | Inhalation | 6,29 × 10-2 (enfants de 9 à 13 ans) à 1,04 × 10-1 (adultes) | 596 (adultes) à 986 (enfants de 9 à 13 ans) |
| Revitalisant (sans rinçage) (essence de bois de cèdre) (enfants de 2 à 3 ans à adultes) | 14 | Inhalation | 9,23 × 10-2 (enfants de 14 à 18 ans) à 1,35 × 10-1 (enfants de 4 à 8 ans) | 459 (enfants de 4 à 8 ans) à 672 (enfants de 14 à 18 ans) |
| Shampooing (essence de bois de cèdre, essence de bois de cèdre du Texas) (tous) | 5 | Inhalation | 1,47 × 10-4 (enfants de 2 à 3 ans) à 2,78 × 10-4 (enfants de 1 an) | 223 200 (enfants de 1 an) à 421 928 (enfants de 2 à 3 ans) |
| Produit capillaire lissant ou pour permanente (essence de bois de cèdre) (enfants de 4 à 8 ans à adultes) | 0,1 | Inhalation | 1,60 × 10-5 (enfants de 14 à 18 ans) à 2,51 × 10-5 (enfants de 4 à 8 ans) | 1 780 000 (enfants de 4 à 8 ans) à 2 790 000 (adultes) |
| Colorant capillaire temporaire (essence de bois de cèdre du Texas) (enfants de 4 à 8 ans à adultes) | 0,1 | Inhalation | 7,55 × 10-4 (adultes) à 1,79 × 10-3 (enfants de 4 à 8 ans) | 34 721 (enfants de 4 à 8 ans) à 82 119 (adultes) |
| Fixatif pour cheveux (essence de bois de cèdre du Texas) (enfants de 4 à 8 ans à adultes) | 5 | Inhalation | 9,79 × 10-4 (adultes) à 2,32 × 10-3 (enfants de 4 à 8 ans) | 26 764 (enfants de 4 à 8 ans) à 63 300 (adultes) |
| Produit pour le bain (sel) (essence de bois de cèdre, essence de bois de cèdre du Texas) (enfants de 9 à 13 ans à adultes) | 10 | Inhalation | 3,56 x 10-2 (enfants de 9 à 13 ans) à 4,99 x 10-2 (adultes) | 1 242 (adultes) à 1 741 (enfants de 9 à 13 ans) |
| Produit pour le bain (mousse/bulles) (essence de bois de cèdre du Texas) (tous) | 5 | Inhalation | 2,54 × 10-3 (enfants de 9 à 13 ans) à 8,56 × 10-3 (enfants de 14 à 18 ans) | 7 243 (enfants de 14 à 18 ans) à 24 458 (bébés de 0 à 5 mois) |
| Produit pour le bain (essence de bois de cèdre) (tous) | 3,5 | Inhalation | 4,05 × 10-4 (bébés de 0 à 5 mois) à 2,24 × 10-2 (enfants de 14 à 18 ans) | 1 997 (enfants de 14 à 18 ans) à 110 314 (bébés de 0 à 5 mois) |
| Nettoyant pour le corps (solide) (essence de bois de cèdre, essence de bois de cèdre du Texas) (tous) | 100 | Inhalation | 8,08 × 10-3 (bébés de 0 à 5 mois) à 2,14 × 10-2 (enfants de 14 à 18 ans) | 2 089 (enfants de 14 à 18 ans) à 5 528 (bébés de 0 à 5 mois) |
| Nettoyant pour le corps (liquide) (essence de bois de cèdre) (tous) | 3 | Inhalation | 6,61 × 10-4 (bébés de 0 à 5 mois) à 1,54 × 10-3 (enfants de 14 à 18 ans) | 29 013 (enfants de 14 à 18 ans) à 67 568 (bébés de 0 à 5 mois) |
| Exfoliant pour le corps (essence de bois de cèdre du Texas) (enfants de 14 à 18 ans à adultes) | 1 | Inhalation | 2,93 × 10-3 (adultes) à 3,69 × 10-3 (enfants de 14 à 18 ans) | 12 000 (enfants de 14 à 18 ans) à 15 000 (adultes) |
| Exfoliant pour le corps (essence de bois de cèdre) (enfants de 14 à 18 ans à adultes) | 3 | Inhalation | 1,06 × 10-3 (adultes) à 1,28 × 10-3 (enfants de 14 à 18 ans) | 34 000 (enfants de 14 à 18 ans) à 42 000 (adultes) |
| Produit de maquillage pour le visage (fond de teint liquide) (essence de bois de cèdre, essence de bois de cèdre du Texas) (enfants de 4 à 8 ans à adultes) | 0,3 | Inhalation | 8,21 × 10-4 (enfants de 14 à 18 ans) à 1,25 × 10-3 (enfants de 4 à 8 ans) | 49 400 (enfants de 4 à 8 ans) à 75 550 (enfants de 14 à 18 ans) |
| Baume à lèvres (essence de bois de cèdre) (enfants de 2 à 3 ans à adultes) | 3 | Orale | 1,78 × 10-2 (adultes) à 4,40 × 10-2 (enfants de 2 à 3 ans) | 1 409 (enfants de 2 à 3 ans) à 3 476 (adultes) |
| Bain de bouche (essence de bois de cèdre) (enfants de 4 à 8 ans à adultes) | 0,1 | Orale | 2,02 × 10-2 (enfants de 9 à 13 ans) à 3,7 × 10-2 (enfants de 4 à 8 ans) | 1 678 (enfants de 4 à 8 ans) à 3 064 (enfants de 9 à 13 ans) |
| Dentifrice (essence de bois de cèdre) (enfants de 2 à 3 ans à adultes) | 0,5 | Orale | 1,35 × 10-2 (adultes) à 2,03 × 10-1 (enfants de 2 à 3 ans) | 305 (enfants de 2 à 3 ans) à 45 888 (adultes) |
| Crème à raser (visage) (essence de bois de cèdre) (enfants de 9 à 13 ans à adultes) | 5 | Inhalation | 3,47 × 10-4 (enfants de 14 à 18 ans) à 4,25 × 10-4 (adultes) | 105 014 (adultes) à 128 551 (enfants de 14 à 18 ans) |
| Crème à raser (corps) (essence de bois de cèdre du Texas) (enfants de 9 à 13 ans à adultes) | 10 | Inhalation | 2,06 × 10-2 (adultes) à 2,45 × 10-2 (enfants de 9 à 13 ans) | 1 824 (enfants de 9 à 13 ans) à 2 165 (adultes) |
| Crème à raser (corps) (essence de bois de cèdre) (enfants de 9 à 13 ans à adultes) | 6,66 | Inhalation | 1,49 × 10-2 (adultes) à 1,76 × 10-2 (enfants de 9 à 13 ans) | 2 539 (enfants de 9 à 13 ans) à 3 000 (adultes) |
| Crème à raser (corps) (alpha-cédrène) (enfants de 9 à 13 ans à adultes) | 0,1 | Inhalation | 1,42 × 10-6 (adultes) à 1,69 × 10-6 (enfants de 14 à 18 ans) | 36 702 980 (enfants de 9 à 13 ans) à 43 535 435 (adultes) |
| Produit après-rasage (visage) (essence de bois de cèdre) (enfants de 9 à 13 ans à adultes) | 5 | Inhalation | 5,71 × 10-2 (adultes) à 9,60 × 10-2 (enfants de 9 à 13 ans) | 646 (enfants de 9 à 13 ans) à 1 085 (enfants de 14 à 18 ans) |
| Produit pour la peau après épilation (corps) (essence de bois de cèdre) (enfants de 9 à 13 ans à adultes) | 3 | Inhalation | 4,69 × 10-2 (adultes) à 5,96 × 10-2 (enfants de 9 à 13 ans) | 1 041 (enfants de 9 à 13 ans) à 1 321 (adultes) |
| Adhésif pour le corps (essence de bois de cèdre) (enfants de 14 à 18 ans à adultes) | 0,1 | Inhalation | 5,31 × 10-3 (adultes) à 6,67 × 10-4 (enfants de 14 à 18 ans) | 11 686 (adultes) à 92 985 (enfants de 14 à 18 ans) |
Abréviation : ME = marge d’exposition.
a Selon une DMENO orale de 62 mg/kg p.c./j, qui repose sur un taux réduit d’hormone thyroïdienne T4 chez la génération F0.
b ME cible = 300 (10x pour l’extrapolation interspécifique × 10x pour la variation intraspécifique × 3x pour l’utilisation d’une DMENO). Les ME en gras sont considérées comme potentiellement inadéquates.
| Scénario | % dans le produit | Exposition cutanée (mg/kg p.c./j) | MEa, b |
|---|---|---|---|
| Nettoyant antiseptique pour la peau (en pulvérisateur) (PSN) (essence de bois de cèdre) (enfants de 2 à 3 ans à adultes) | 0,05 | 1,44 × 10-2 (enfants de 14 à 18 ans) à 4,25 × 10-2 (enfants de 2 à 3 ans) | 1 050 (enfants de 2 à 3 ans) à 3 100 (enfants de 14 à 18 ans) |
| Nettoyant antiseptique pour la peau (en pulvérisateur) (PSN)c (essence de bois de cèdre) (enfants de 2 à 3 ans à adultes) | 0,05 | 0,22 (adultes) à 1,06 (enfants de 2 à 3 ans) | 42 (enfants de 2 à 3 ans) à 207 (adultes) |
| Contre-irritant (en pulvérisateur) (PSN) (essence de bois de cèdre) (enfants de 9 à 13 ans à adultes) | 2 | 0,42 (adultes) à 0,74 (enfants de 9 à 13 ans) | 60 (enfants de 9 à 13 ans) à 106 (adultes) |
| Baume de soulagement de l’irritation (PSN) (essence de bois de cèdre) (enfants de 1 an à adultes) | 1,21 | 0,90 (adultes) à 3,03 (enfants de 1 an) | 15 (enfants de 1 an) à 50 (adultes) |
| Aromathérapie – liquide pour inhalation de vapeur provenant d’un bol (PSN) (essence de bois de cèdre) (adultes) | 5 | Sans objet | Sans objet |
| Aromathérapie – liquide pour inhalation au moyen d’un diffuseur (PSN) (essence de bois de cèdre) (adultes) | 5 | Sans objet | Sans objet |
| Aromathérapie – pulvérisateur pour voies respiratoires (PSN) (essence de bois de cèdre) (adultes) | 0,68 | Sans objet | Sans objet |
| Produit de traitement contre l’acné (gel) (PSN) (essence de bois de cèdre) (enfants de 9 à 13 ans à adultes) | 0,02 | 1,22 × 10-2 (adultes) à 1,57 × 10-2 (enfants de 9 à 13 ans) | 2 841 (enfants de 9 à 13 ans) à 3 671 (adultes) |
Abréviations : ME = marge d’exposition; PSN = produit de santé naturel.
a Selon une DSENO cutanée de 44,64 mg/kg p.c./j (62,5 mg/kg p.c./j, ajustée pour un traitement 5 j/sem.), qui repose sur un poids de thymus réduit aux doses élevées.
b ME cible = 100 (10x pour l’extrapolation interspécifique × 10x pour la variation intraspécifique). Les ME en gras sont considérées comme potentiellement inadéquates.
c Dans des situations préoccupantes pour la santé publique, l’utilisation de nettoyants antiseptiques pour la peau par la population générale peut augmenter pour atteindre 25 utilisations par jour (utilisation personnelle par les adultes, utilisation accrue par les enfants dans les écoles et les garderies) (RIVM, 2021a).
| Scénario | % dans le produit | Exposition par inhalation (mg/kg p.c./j) | MEa, b |
|---|---|---|---|
| Nettoyant antiseptique pour la peau (en pulvérisateur) (PSN) (essence de bois de cèdre) (enfants de 2 à 3 ans à adultes) | 0,05 | 1,62 × 10-5 (enfants de 14 à 18 ans) à 3,05 × 10-5 (enfants de 4 à 8 ans) | 2 032 908 (enfants de 4 à 8 ans) à 3 825 669 (enfants de 14 à 18 ans) |
| Nettoyant antiseptique pour la peau (en pulvérisateur) (PSN)c (essence de bois de cèdre) (enfants de 2 à 3 ans à adultes) | 0,05 | 2,30 × 10-4 (adultes) à 6,92 × 10-4 (enfants de 2 à 3 ans) | 89 579 (enfants de 2 à 3 ans) à 269 250 (adultes) |
| Contre-irritant (en pulvérisateur) (PSN) (essence de bois de cèdre) (enfants de 9 à 13 ans à adultes) | 2 | 9,35 × 10-4 (adultes) à 1,52 × 10-3 (enfants de 9 à 13 ans) | 40 874 (enfants de 9 à 13 ans) à 66 293 (adultes) |
| Baume de soulagement de l’irritation (PSN) (essence de bois de cèdre) (enfants de 1 an à adultes) | 1,21 | 1,45 × 10-2 (adultes) à 3,43 x 10-2 (enfants de 4 à 8 ans) | 1 809 (enfants de 4 à 8 ans) à 4 279 (adultes) |
| Aromathérapie – liquide pour inhalation de vapeur provenant d’un bol (PSN) (essence de bois de cèdre) (adultes) | 5 | 1,49 × 10-3 (adultes) | 41 670 (adultes) |
| Aromathérapie – liquide pour inhalation au moyen d’un diffuseur (PSN) (essence de bois de cèdre) (adultes) | 5 | 5,10 × 10-2 (adultes) | 1 215 (adultes) |
| Aromathérapie – pulvérisateur pour voies respiratoires (PSN) (essence de bois de cèdre) (adultes) | 0,68 | 3,19 × 10-4 (adultes) | 194 458 (adultes) |
| Produit de traitement contre l’acné (gel) (PSN) (essence de bois de cèdre) (enfants de 9 à 13 ans à adultes) | 0,02 | 4,69 × 10-4 (adultes) à 5,64 x 10-4 (enfants de 9 à 13 ans) | 109 891 (enfants de 9 à 13 ans) à 132 105 (adultes) |
Abréviations : ME = marge d’exposition; PSN = produit de santé naturel.
a Selon une DMENO de 62 mg/kg p.c./j, qui repose sur un taux réduit d’hormone thyroïdienne T4 chez la génération F0.
b ME cible = 300 (10x pour l’extrapolation interspécifique × 10x pour la variation intraspécifique × 3x pour l’utilisation d’une DMENO). Les ME en gras sont considérées comme potentiellement inadéquates.
c Dans des situations préoccupantes pour la santé publique, l’utilisation de nettoyants antiseptiques pour la peau par la population générale peut augmenter pour atteindre 25 utilisations par jour (utilisation personnelle par les adultes, utilisation accrue par les enfants dans les écoles et les garderies) (RIVM, 2021a).
| Scénario | % dans le produit | Exposition cutanée (mg/kg p.c./j) | MEa, b |
|---|---|---|---|
| Assainisseur d’air (enfichable) (alpha-cédrène) (adultes) | 1 | 7,20 × 10-2 (adultes seulement) | 620 (adultes seulement) |
| Assainisseur d’air (bloc de cire) (essence de bois de cèdre du Texas) (adultes) | 1 | 3,80 × 10-2 (adultes seulement) | 1 175 (adultes seulement) |
| Détergent à lessive liquide (lavage à la main) (essence de bois de cèdre du Texas) (adultes) | 1 | 0,11 (adultes) | 412 (adultes) |
| Détergent à lessive liquide (lavage à la machine) (essence de bois de cèdre du Texas) (adultes) | 1 | 7,42 × 10-2 (adultes) | 602 (adultes) |
| Détergent à lessive liquide (essence de bois de cèdre du Texas) (enfants de 1 an) | 1 | 2,74 × 10-3 (enfants de 1 an) | 16 297 (enfants de 1 an) |
| Aérosol pour l’entretien du cuir (alpha-cédrène) (adultes) | 5 | 3,97 × 10-1 (adultes) | 112 (adultes) |
| Produit de nettoyage ou de désodorisation des toilettes ou des urinoirs (nettoyage automatique des cuvettes) (alpha-cédrène) (enfants de 2 à 3 ans) | 10 | Négligeable | Sans objet |
| Produit de nettoyage ou de désodorisation des toilettes ou des urinoirs (application) (essence de bois de cèdre du Texas) (adultes) | 1 | 5,22 × 10-2 (adultes) | 856 (adultes) |
Abréviation : ME = marge d’exposition.
a Selon une DSENO cutanée de 44,64 mg/kg p.c./j (62,5 mg/kg p.c./j, ajustée pour un traitement 5 j/sem.), qui repose sur un poids de thymus réduit aux doses élevées.
b ME cible = 100 (10x pour l’extrapolation interspécifique × 10x pour la variation intraspécifique). Les ME en gras sont considérées comme potentiellement inadéquates.
| Scénario | % dans le produit | Voie d’exposition | Exposition (mg/kg p.c./j) | MEa, b |
|---|---|---|---|---|
| Assainisseur d’air (enfichable) (alpha-cédrène) (tous) | 1 | Inhalation | 4,69 × 10-3 (adultes) à 1,67 × 10-2 (enfants de 1 an) | 3 707 (enfants de 1 an) à 13 210 (adultes) |
| Assainisseur d’air (bloc de cire) (essence de bois de cèdre du Texas) (tous) | 1 | Inhalation | 6,94 × 10-3 (adultes) à 2,47 × 10-2 (enfants de 1 an) | 2 507 (enfants de 1 an) à 8 937 (adultes) |
| Détergent à lessive liquide (lavage à la main) (essence de bois de cèdre du Texas) (adultes) | 1 | Inhalation | 7,30 × 10-5 (adultes) | 849 438 (adultes) |
| Détergent à lessive liquide (lavage à la machine) (essence de bois de cèdre du Texas) (adultes) | 1 | Inhalation | 6,13 × 10-6 (adultes) | 10 108 730 (adultes) |
| Détergent à lessive liquide (essence de bois de cèdre du Texas) (enfants de 1 an, exposition accidentelle) | 1 | Orale | 7,64 × 10-7 (enfants de 1 an) | 81 142 255 (enfants de 1 an) |
| Aérosol pour l’entretien du cuir (alpha-cédrène) | 5 | Inhalation | 2,86 × 10-3 (adultes) | 21 703 (adultes) |
| Produit de nettoyage ou de désodorisation des toilettes ou des urinoirs (nettoyage automatique des cuvettes) (alpha-cédrène) | 10 | Inhalation | 2,02 × 10-1 (enfants de 2 à 3 ans) | 306 (enfants de 2 à 3 ans) |
| Produit de nettoyage ou de désodorisation des toilettes ou des urinoirs (application) (essence de bois de cèdre du Texas) | 1 | Inhalation | 5,92 × 10-6 (adultes) | 10 477 278 (adultes) |
Abréviation : ME = marge d’exposition.
a Selon une DMENO de 62 mg/kg p.c./j, qui repose sur un taux réduit d’hormone thyroïdienne T4 chez la génération F0.
b ME cible = 300 (10x pour l’extrapolation interspécifique × 10x pour la variation intraspécifique × 3x pour l’utilisation d’une DMENO). Les ME en gras sont considérées comme potentiellement inadéquates.
| Scénario | % dans le produit | Exposition cutanée (mg/kg p.c./j) | MEa, b |
|---|---|---|---|
| Diffuseur d’arôme ou assainisseur d’air (remplissage) (enfants de 9 à 13 ans à adultes) | 100 | 1,29 (adultes) à 2,27 (enfants de 9 à 13 ans) | 20 (enfants de 9 à 13 ans) à 35 (adultes) |
| Huile de massage (tous) | 3 | 1,30 (adultes) à 8,57 (bébés de 0 à 5 mois) | 5 (bébés de 0 à 5 mois) à 34 (adultes) |
| Hydratant pour le corps (tous) | 3 | 4,05 (adultes) à 9,52 (bébés de 0 à 5 mois) | 5 (bébés de 0 à 5 mois) à 11 (adultes) |
| Huile pour le bain (enfants de 9 à 13 ans à adultes) | 100 | 9,40 × 10-3 (adultes) à 1,20 × 10-2 (enfants de 9 à 13 ans) | 3 722 (enfants de 9 à 13 ans) à 4 751 (adultes) |
| Brumisateur facial (application) (enfants de 4 à 8 ans à adultes) | 100 | 1,42 (adultes) à 4,57 (enfants de 4 à 8 ans) | 10 (enfants de 4 à 8 ans) à 31 (adultes) |
| Nettoyant liquide pour plancher (adultes) | 100 | 9,17 × 10-2 (adultes) | 487 (adultes) |
| Exposition après application à des planchers nettoyés (enfants de 1 an) | 100 | 3,48 × 10-2 (enfants de 1 an) | 1 282 (enfants de 1 an) |
Abréviation : ME = marge d’exposition.
a Selon une DSENO cutanée de 44,64 mg/kg p.c./j (62,5 mg/kg p.c./j, ajustée pour un traitement 5 j/sem.), qui repose sur un poids de thymus réduit aux doses élevées.
b ME cible = 100 (10x pour l’extrapolation interspécifique × 10x pour la variation intraspécifique). Les ME en gras sont considérées comme potentiellement inadéquates.
| Scénario | % dans le produit | Voie d’exposition | Exposition (mg/kg p.c./j) | MEa, b |
|---|---|---|---|---|
| Diffuseur d’arôme ou assainisseur d’air (inhalation) (enfants de 9 à 13 ans à adultes) | 100 | Inhalation | 5,5 × 10-1 (adultes) à 8,9 × 10-1 (enfants de 9 à 13 ans) | 69 (enfants de 9 à 13 ans) à 113 (adultes) |
| Diffuseur d’arôme ou assainisseur d’air (exposition des non-utilisateurs) (enfants de 4 à 8 ans et moins) | 100 | Inhalation | 1,30 (enfants de 4 à 8 ans) à 1,96 (enfants de 1 an) | 32 (enfants de 1 an) à 48 (enfants de 4 à 8 ans) |
| Huile de massage (tous) | 3 | Inhalation | 6,12 × 10-2 (adultes) à 1,24 × 10-1 (enfants de 1 an) | 501 (enfants de 1 an) à 1 013 (adultes) |
| Hydratant pour le corps (tous) | 3 | Inhalation | 2,35 × 10-2 (enfants de 4 à 8 ans) à 5,13 × 10-2 (bébé de 0 à 5 mois) | 1 209 (enfants de 14 à 18 ans) à 2 639 (bébés de 0 à 5 mois) |
| Huile pour le bain (enfants de 9 à 13 ans à adultes) | 100 | Inhalation | 4,16 x 10-6 (enfants de 9 à 13 ans) à 8,86 x 10-3 (adultes) | 5 039 107 (adultes) à 10 737 523 (enfants de 9 à 13 ans) |
| Brumisateur facial (application) (enfants de 4 à 8 ans à adultes) | 100 | Inhalation | 4,27 × 10-1 (adultes) à 1,03 (enfants de 4 à 8 ans) | 60 (enfants de 4 à 8 ans) à 145 (adultes) |
| Brumisateur facial (exposition des non-utilisateurs) (enfants de 1 an) | 100 | Inhalation | 4,61 × 10-1 (enfants de 1 an) | 134 (enfants de 1 an) |
| Nettoyant liquide pour plancher (adultes) | 100 | Inhalation | 2,24 × 10-4 (adultes) | 276 219 (adultes) |
| Exposition après application à des planchers nettoyés (enfants de 1 an) | 100 | Inhalation | 8,00 × 10-4 (enfants de 1 an) | 77 500 (enfants de 1 an) |
| Exposition après application à des planchers nettoyés par contact de la bouche par les mains (enfants de 1 an) | 100 | Orale | 2,61 × 10-3 (enfants de 1 an) | 23 731 (enfants de 1 an) |
Abréviation : ME = marge d’exposition.
a Selon une DMENO de 62 mg/kg p.c./j, qui repose sur un taux réduit d’hormone thyroïdienne T4 chez la génération F0.
b ME cible = 300 (10x pour l’extrapolation interspécifique × 10x pour la variation intraspécifique × 3x pour l’utilisation d’une DMENO). Les ME en gras sont considérées comme potentiellement inadéquates.
Les marges d’exposition entre la concentration entraînant un effet critique et les estimations de l’exposition cutanée quotidienne découlant de l’utilisation de l'essence de bois de cèdre dans des huiles de massage, des parfums, des déodorants ou antisudorifiques (solides), des hydratants (pour le corps et le visage), des revitalisants (sans rinçage), des exfoliants pour le corps (enfants de 14 à 18 ans), des produits après-rasage (pour le visage), des produits pour la peau (du corps) après épilation, des nettoyants antiseptiques pour la peau (en pulvérisateur) (PSN) (enfants de 2 à 8 ans, lors de situations préoccupantes pour la santé publique qui entraînent une utilisation accrue), des contre-irritants (en pulvérisateur) (PSN) (enfants de 9 à 18 ans) et des baumes de soulagement de l’irritation (PSN) sont inférieures à la marge d’exposition cible de 100. Il est donc jugé qu’elles ne permettent peut-être pas de tenir adéquatement compte des incertitudes entourant les effets sur la santé et les données sur l’exposition ayant servi à caractériser les risques.
Ce jugement s’applique aussi à la marge d’exposition entre la concentration entraînant un effet critique et les estimations de l’exposition par inhalation quotidienne découlant de l’utilisation de l'essence de bois de cèdre dans des parfums (enfants de 2 à 3 ans), qui est inférieure à la marge d’exposition cible de 300.
C’est également le cas pour les marges d’exposition entre la concentration entraînant un effet critique et les estimations de l’exposition cutanée quotidienne découlant de l’utilisation de l'essence de bois de cèdre dans des diffuseurs d’arôme ou assainisseurs d’air faits soi-même, des huiles de massage faites soi-même, des hydratants pour le corps faits soi-même et des brumisateurs faciaux faits soi-même, qui sont inférieures à la marge d’exposition cible de 100.
Il en va de même pour les marges d’exposition entre la concentration entraînant un effet critique et les estimations de l’exposition par inhalation quotidienne découlant de l’utilisation de l'essence de bois de cèdre dans des diffuseurs d’arôme et assainisseurs d’air faits soi-même et des brumisateurs faciaux faits soi-même, qui sont inférieures à la marge d’exposition cible de 300.
Ce même jugement s’applique en outre aux marges d’exposition entre la concentration entraînant un effet critique et les estimations de l’exposition cutanée quotidienne découlant de l’utilisation de l'essence de bois de cèdre du Texas dans des huiles de massage, des parfums, des déodorants ou antisudorifiques (solides) et des hydratants (pour le corps et le visage), qui sont inférieures à la marge d’exposition cible de 100.
De plus, il s’applique aux marges d’exposition entre la concentration entraînant un effet critique et les estimations de l’exposition cutanée quotidienne découlant de l’utilisation de l'essence de bois de cèdre du Texas dans des diffuseurs d’arôme et assainisseurs d’air faits soi-même, des huiles de massage faites soi-même, des hydratants pour le corps faits soi-même et des brumisateurs faciaux faits soi-même, qui sont inférieures à la marge d’exposition cible de 100.
Il s’applique enfin aux marges d’exposition entre la concentration entraînant un effet critique et les estimations de l’exposition par inhalation quotidienne découlant de l’utilisation de l'essence de bois de cèdre du Texas dans des diffuseurs d’arôme et assainisseurs d’air faits soi-même et des brumisateurs faciaux faits soi-même, qui sont inférieures à la marge d’exposition cible de 300.
Comme nous n’avons relevé aucune source d’exposition significative de la population générale aux terpènes et terpénoïdes de l’essence de cèdre, nous avons adopté une approche qualitative pour caractériser les risques. Nous avons évalué que ceux pour la santé humaine étaient faibles. De même, nous n’avons recensé aucun produit contenant du thujopsène, de l’alpha-gurjunène, du bêta-patchoulène ou du bêta-cédrène. Par conséquent, nous avons jugé que l’exposition de la population générale était minime. Nous avons donc appliqué une approche qualitative pour caractériser les risques, et avons évalué que ceux posés pour la santé humaine par ces 4 substances étaient faibles.
7.1.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Les principales sources d’incertitude sont présentées dans le tableau ci-dessous.
| Principales sources d’incertitude | Effet |
|---|---|
| La concentration des principaux composants des huiles essentielles varie selon l’origine et l’espèce de la plante, la température, le sol et la géographie. De ce fait, la composition des huiles essentielles dans les produits disponibles aux consommateurs est variable, ce qui constitue une incertitude dans l’évaluation. | +/- |
| L’extrapolation des données d’absorption cutanée de l’acétylcédrène et de l’OTNE à l’essence de bois de cèdre est une source d’incertitude. | +/- |
| L’utilisation potentielle de plus d’un produit contenant la même substance par une même personne au cours d’une journée (c’est-à-dire l’exposition globale) n’a pas été examinée. Il pourrait en découler une sous-estimation de l’exposition de certaines personnes. | - |
| L'essence de bois de cèdre peut être utilisée dans des nettoyants antiseptiques pour la peau. Il existe une incertitude entourant la durée d’utilisation potentiellement accrue de tels nettoyants en cas de situation préoccupante pour la santé publique. | +/- |
| Il n’existe aucune donnée sur les dangers disponible pour l’alpha-cédrène, le thujopsène, l’alpha-gurjunène, le bêta-patchoulène et le bêta-cédrène. L'essence de bois de cèdre, qui constitut l’analogue de lecture croisée et font partie du sous-groupe 1 des sesquiterpènes tricycliques, ont éclairé l’évaluation des risques pour la santé humaine. | +/- |
+ = incertitude pouvant causer la surestimation de l’exposition ou du risque; - = incertitude pouvant causer la sous-estimation de l’exposition ou du risque; +/- = potentiel inconnu à causer une surestimation ou une sous-estimation du risque.
7.2 Acétate amboryle
7.2.1 Évaluation de l’exposition
Selon les renseignements soumis en réponse à une enquête menée en vertu de l’article 71 de la LCPE, l’acétate amboryle n’est pas fabriqué ou importé en quantités supérieures au seuil de déclaration de 100 kg (Environnement Canada, 2013). Nous n’avons trouvé aucun rapport sur la surveillance de cette substance dans les milieux environnementaux au Canada ou ailleurs. Étant donné les faibles quantités d’acétate amboryle au Canada, nous ne nous attendons à aucune exposition à cette substance dans les milieux environnementaux.
Les renseignements obtenus en vertu de l’article 71 de la LCPE indiquent que l’acétate amboryle est utilisé dans des produits de soins personnels. Cependant, l’exposition provenant de ces utilisations est minime, étant donné les faibles quantités déclarées (Environnement Canada, 2013).
Au Canada, on ne s’attend à aucune exposition à l’acétate amboryle dans des cosmétiques, des PSN, des aliments, des emballages alimentaires ou d’autres produits offerts à la population générale (communication personnelle, courriels de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, 2017, 2021; source non citée; communication personnelle, courriels de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau d’évaluation des risques pour les substances existantes de Santé Canada, 2017, 2021; source non citée; communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques pour les substances existantes de Santé Canada, 2021; source non citée).
7.2.2 Évaluation des effets sur la santé
Nous évaluons l’acétate amboryle de manière individuelle, car nous estimons qu’il n’est l’analogue d’aucune des substances visées par la présente évaluation.
À la lumière des classifications d’autres organismes nationaux ou internationaux fondées sur la cancérogénicité, la génotoxicité et la toxicité pour le développement ou la reproduction, nous avons déterminé que l’acétate amboryle ne posait pas de danger important pour la santé humaine. Cette substance ne figure pas non plus sur la Liste des substances extrêmement préoccupantes candidates en vue d’une autorisation de l’Agence européenne des produits chimiques (ECHA, 2019). Une étude plus approfondie des effets sur la santé n’est pas justifiée à ce stade, car aucune exposition de la population générale du Canada à l’acétate amboryle n’est attendue.
7.2.3 Caractérisation des risques pour la santé humaine
Nous ne nous attendons à aucun rejet d’acétate amboryle ni à une exposition de la population générale, et l’exposition de l’environnement devrait être limitée. De ce fait, le risque d’effets nocifs pour l’environnement ou la santé de la population générale du Canada devrait être faible.
7.3 Sous-groupe 2 des triterpénoïdes (énoxolone et acide glycyrrhétinique préparé avec l’allantoïne)
7.3.1 Évaluation de l’exposition
L’acide glycyrrhizique est isolé des racines séchées du Glycyrrhiza glabra, aussi appelé réglisse, qui est une herbe indigène de la région de la Méditerranée et de l’Asie centrale et du sud-ouest. Il est un conjugué de l’énoxolone et d’un disaccharide de l’acide glucuronique. L’énoxolone est son principal métabolite chez les humains et les rats (Isbrucker et Burdock, 2006; VKM, 2018). Les 2 substances ont des synonymes similaires, comme la glycyrrhizine, et risquent par conséquent d’être mélangées par les consommateurs.
Milieux environnementaux
Compte tenu des faibles quantités fabriquées et importées (< 100 kg) des substances qui ont été déclarées en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada, 2013), nous ne nous attendons à aucune exposition à l’énoxolone et à l’acide glycyrrhétinique préparé avec l’allantoïne par l’intermédiaire des milieux environnementaux. Nous n’avons trouvé aucun rapport sur la surveillance de ces substances dans les milieux environnementaux au Canada ou ailleurs.
Aliments
Aucune donnée définitive n’est disponible concernant l’utilisation possible de l’énoxolone et de l’acide glycyrrhétinique préparé avec l’allantoïne comme aromatisants dans les aliments vendus au Canada. De même, aucune donnée définitive n’est disponible sur la présence naturelle de ces substances dans des aliments. L’exposition directe à l’énoxolone découlant du régime alimentaire devrait être très faible, voire nulle. Une exposition endogène est cependant attendue, puisque l’acide glycyrrhizique est naturellement présent dans des aliments et qu’il est hydrolysé en énoxolone par la microflore intestinale (WHO, 2005; VKM, 2018).
Nous n’avons trouvé aucune donnée sur la consommation canadienne de thé à la réglisse et de bonbons à la réglisse noire. Une enquête nationale néerlandaise sur la consommation alimentaire rapporte une consommation quotidienne moyenne de 13 g de réglisse (Hulshof et Kistemaker, 1994). Dans 19 échantillons de bonbons à la réglisse offerts sur le marché néerlandais, la teneur en acide glycyrrhizique variait de 0,03 à 0,51 % (équivalant à 0,017 à 0,29 % d’énoxolone) (Maas, 2000). Dans le cadre d’une étude récente, une concentration moyenne d’acide glycyrrhizique de 0,1 % (équivalant à 0,057 % d’énoxolone) a été obtenue pour 137 échantillons de bonbons à la réglisse offerts sur le marché danois (Ballin et al., 2023). Une concentration moyenne d’acide glycyrrhizique de 114 mg/L (équivalant à 65 mg/L d’énoxolone) est indiquée pour les thés infusés (Ballin et al., 2023).
La quantité ingérée par personne (individuelle) étant donné l’utilisation de racine de réglisse, de poudre d’extrait de racine de réglisse, d’extrait de racine de réglisse et de glycyrrhizine ammoniacale dans des aliments est estimée être de 1,63 mg/j (0,027 mg/kg p.c./j, soit l’équivalent de 0,015 mg/kg p.c./j d’énoxolone, en supposant une hydrolyse complète de la glycyrrhizine dans l’intestin) pour la population des États-Unis, d’après les volumes de production déclarés par l’industrie alimentaire (Isbrucker et Burdock, 2006). En l’absence de données sur l’utilisation réelle, le cas échéant, de la racine de réglisse, de la poudre d’extrait de racine de réglisse, de l’extrait de racine de réglisse et de la glycyrrhizine ammoniacale dans les aliments vendus au Canada, la quantité ingérée par personne aux États-Unis constitue une estimation acceptable de l’exposition par le régime alimentaire quotidienne moyenne potentielle des membres de la population générale du Canada âgés d’un an et plus au cours de leur vie. La détermination de la quantité ingérée par personne repose sur une répartition égale de la consommation de ces ingrédients de la réglisse dans toute la population, ce qui peut entraîner une sous-estimation de l’exposition des consommateurs amateurs d’aliments contenant de la réglisse et une surestimation de l’exposition des personnes n’aimant pas la saveur de la réglisse. Il est possible que l’exposition aiguë de certains consommateurs ayant un penchant pour la saveur de la réglisse dépasse l’estimation de la quantité ingérée par personne, même si l’on ne s’attend pas à ce que la majorité des gens consomment des aliments contenant de la réglisse de manière excessive tous les jours. Afin d’évaluer l’exposition à l’énoxolone des personnes qui consomment régulièrement des aliments contenant de la réglisse, nous avons examiné les estimations de l’exposition due à une consommation régulière de thé à la réglisse et à une consommation élevée de courte durée de bonbons à la réglisse noire. Nous avons tenu compte de l’exposition la plus élevée à l’énoxolone associée à la consommation de thé à la réglisse ayant une concentration moyenne d’acide glycyrrhizique de 114 mg/L et de bonbons à la réglisse noire ayant une concentration moyenne d’acide glycyrrhizique de 0,1 % (Ballin et al., 2023).
Produits disponibles aux consommateurs
L’énoxolone est présente dans des produits disponibles aux consommateurs. Pour évaluer le potentiel d’exposition à l’énoxolone provenant des cosmétiques, des PSN et des MVL appliqués sur la peau, nous avons choisi des scénarios sentinelles en nous basant sur une combinaison de fréquences d’utilisation et de concentrations déclarées de la substance dans ces produits. Ces scénarios représentaient les expositions les plus élevées, par rapport aux autres cosmétiques appliqués sur la peau ainsi qu’aux PSN et MVL comprenant l’énoxolone comme ingrédient non médicinal, parmi les produits pour lesquels la présence de cette substance avait été déclarée. Les scénarios sentinelles examinés pour les applications cutanées portaient sur l’exposition à l’énoxolone due à l’utilisation de produits de maquillage pour le visage (fonds de teint liquides), d’hydratants pour le visage (cosmétiques et PSN), d’hydratants pour le corps (lotions et en pulvérisateur), de produits pour le bain (mousses/bulles), de nettoyants (pour le visage), de démaquillants (pour le visage et les yeux), de shampooings, de revitalisants (avec rinçage), de déodorants ou d’antisudorifiques (solides), de crèmes à raser (pour le visage), de fixatifs pour cheveux (pompes), de colorants capillaires permanents, d’écrans solaires (crèmes) (PSN et MVL), de timbres analgésiques (PSN), de produits de traitement contre l’acné (crèmes) (PSN) et de produits médicamenteux de soins de la peau (crèmes) (PSN).
Pour estimer l’exposition systémique due à l’exposition cutanée aux substances du sous-groupe 2 des triterpénoïdes, nous avons utilisé une valeur d’absorption cutanée de 25 % en nous fondant sur ce qui suit :
- L’énoxolone, une substance représentative du sous-groupe 2 des triterpénoïdes, a un poids moléculaire de 470 g/mol et un log Koe supérieur à 6. Une valeur de 10 % d’absorption cutanée est mentionnée (SCCS, 2010) pour une substance dont le poids moléculaire est supérieur à 500 g/mol et le log Koe est supérieur à 4. Puisque le poids moléculaire de l’énoxolone est inférieur à 500 g/mol, nous avons modifié de façon prudente un taux d’absorption cutanée par défaut.
L’exposition découlant des produits disponibles aux consommateurs devrait surtout se faire par la voie cutanée. Étant donné la faible pression de vapeur des substances du sous-groupe 2 des triterpénoïdes (3,88 × 10-13 Pa) et les utilisations recensées, nous ne nous attendons pas à ce que l’inhalation soit une voie d’exposition importante, sauf pour les hydratants pour le corps (en pulvérisateur), dans lesquels la concentration maximale déclarée est de 3 %, et les fixatifs pour cheveux (pompes), dans lesquels la concentration maximale déclarée est de 0,1 %. Pour ces produits, nous avons quantifié l’exposition par inhalation aux gouttelettes pendant l’application (communication personnelle, courriel de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, 2021; source non citée).
L’énoxolone est également présente dans des dentifrices (cosmétiques et PSN) et des baumes à lèvres (PSN). Nous avons quantifié les expositions par voie orale découlant de l’utilisation de dentifrices (cosmétiques), de dentifrices (PSN) et de baumes à lèvres ayant respectivement une concentration maximale de 0,1 %, de 0,05 % et de 1 % (communication personnelle, courriels de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada et de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, 2017, 2021; source non citée).
Aucun produit disponible aux consommateurs contenant de l’acide glycyrrhétinique préparé avec l’allantoïne n’a été trouvé au Canada.
Étant donné le nombre de produits contenant de l’énoxolone présents sur le marché canadien, une exposition à plusieurs types de produits (par exemple cosmétiques, PSN et MVL) et par différentes voies pourrait se produire le même jour (c’est-à-dire exposition globale). L’exposition devrait surtout se faire par les voies cutanée et orale.
Les expositions systémiques combinées dues aux produits disponibles aux consommateurs sont résumées dans le tableau 7-14.
| Scénario | % dans le produit | Voie d’exposition | Plage d’exposition systémique (mg/kg p.c./j)a |
|---|---|---|---|
| Produit de maquillage pour le visage (fond de teint liquide) | 0,1 | Cutanée | 1,65 × 10-3 (enfants de 14 à 18 ans) à 3,70 × 10-3 (enfants de 4 à 8 ans) |
| Hydratant pour le visage | 30 | Cutanée | 1,81 (enfants de 14 à 18 ans) à 3,04 (adultes) |
| Hydratant pour le corps (en pulvérisateur) | 3 | Cutanée et inhalation | 0,45 (adultes) à 2,53 (bébés de 0 à 5 mois) |
| Hydratant pour le corps (lotion) | 3 | Cutanée | 1,01 (adultes) à 2,38 (bébés de 0 à 5 mois) |
| Baume à lèvres | 1 | Orale | 5,95 × 10-3 (adultes) à 8,87 × 10-3 (enfants de 14 à 18 ans) |
| Produit pour le bain (mousse/bulles) | 3 | Cutanée | 1,40 × 10-3 (enfants de 9 à 13 ans) à 4,48 × 10-3 (enfants de 14 à 18 ans) |
| Nettoyant pour le visage | 10 | Cutanée | 1,60 × 10-2 (enfants de 14 à 18 ans) à 2,21 × 10-2 (enfants de 9 à 13 ans) |
| Démaquillant pour le visage (lotion) | 0,1 | Cutanée | 1,48 × 10-3 (adultes) à 2,37 × 10-3 (enfants de 4 à 8 ans) |
| Shampooing | 0,3 | Cutanée | 1,26 × 10-3 (enfants de 14 à 18 ans) à 4,64 × 10-3 (bébé de 0 à 5 mois) |
| Revitalisant (avec rinçage) | 0,3 | Cutanée | 1,21 × 10-3 (enfants de 14 à 18 ans) à 2,60 × 10-3 (enfants de 2 à 3 ans) |
| Déodorant ou antisudorifique (solide) | 0,1 | Cutanée | 6,18 x 10-4 (enfants de 9 à 13 ans) à 1,35 x 10-3 (adultes) |
| Crème à raser (visage) | 0,1 | Cutanée | 2,30 × 10-4 (adultes) à 3,81 × 10-4 (enfants de 9 à 13 ans) |
| Fixatif pour cheveux (pompe) | 0,1 | Cutanée et inhalation | 4,08 x 10-4 (enfants de 14 à 18 ans) à 1,59 x 10-3 (adultes) |
| Colorant capillaire permanent | 0,1 | Cutanée | 4,48 × 10-2 (adultes) à 5,35 × 10-2 (enfants de 14 à 18 ans) |
| Écran solaire (crème) (PSN) | 0,5 | Cutanée | 4,30 × 10-1 (adultes) |
| Écran solaire (crème) (MVL) | 0,5 | Cutanée | 2,63 × 10-1 (enfants de 9 à 13 ans) à 1,19 (bébés de 6 à 11 mois) |
| Timbre analgésique (PSN) | 0,18 | Cutanée | 1,10 × 10-2 (adultes) à 1,16 × 10-1 (enfants de 2 à 3 ans) |
| Produit de traitement contre l’acné (crème) (PSN) | 0,3 | Cutanée | 4,56 × 10-2 (adultes) à 5,89 × 10-2 (enfants de 9 à 13 ans) |
| Produit médicamenteux de soins de la peau (crème) (PSN) | 0,2 | Cutanée | 5,16 × 10-2 (enfants de 14 à 18 ans) à 1,52 × 10-1 (enfants de 1 an) |
| Écran solaire (lotion) (PSN) | 0,1 | Cutanée | 1,01 × 10-2 (adultes) |
| Dentifrice | 0,1 | Orale | 2,70 × 10-3 (adultes) |
| Dentifrice (PSN) | 0,05 | Orale | 1,35 × 10-3 (adultes) à 2,03 × 10-2 (enfants de 2 à 3 ans) |
Abréviations : PSN = produit de santé naturel; MVL = médicament en vente libre.
a Voir l’annexe A pour connaître le détail des calculs. L’absorption cutanée est présumée être de 25 %, sauf pour le scénario sur le produit médicamenteux de soins de la peau (crème) (PSN), dans lequel elle est présumée être de 100 %.
7.3.2 Évaluation des effets sur la santé
Il n’existe pas de donnée empirique ni d’évaluation internationale sur l’acide glycyrrhétinique préparé avec l’allantoïne. Il existe quelques données empiriques sur l’énoxolone.
Chez les rats, l’énoxolone peut franchir la barrière placentaire et être détectée dans le fœtus (Isbrucker et Burdock, 2006). Au cours d’une étude in vivo chez le rat, l’énoxolone a inhibé le métabolisme de la cortisone et du cortisol en inhibant la 11β-hydroxystéroïde déshydrogénase (11β-HSD) (Lin et al., 2012). Une étude ex vivo chez l’humain a montré une inhibition de l’activité enzymatique de la 11β-HSD des cellules du placenta (Blum et al., 1995; Benediktsson et al., 1997), qui peut s’accompagner d’une augmentation des taux de cortisol dans le sang du cordon ombilical ainsi que d’une diminution du poids du fœtus chez les patients prééclamptiques (McCalla et al., 1998).
Des rats Wistar gravides (6/dose) ont été exposés à 0, 10, 100 ou 1 000 mg/kg p.c./j d’énoxolone par le régime alimentaire du jour de gestation (JG) 13 jusqu’à la mise bas (Hundertmark et al., 2002). Les fœtus ont été analysés aux JG 17, 19 et 21 ainsi qu’au jour postnatal 1. Aucune toxicité maternelle n’a été observée. Cependant, dans des cellules pulmonaires fœtales qui provenaient des mères du groupe recevant la dose la plus élevée et avaient été mises en culture, une réduction de l’activité de la 11β-HDS de type 1 (11β-HSD1) a nui à la maturation des poumons fœtaux. Ces cellules présentaient des taux réduits de la protéine A du surfactant (ARN messager et protéine). L’histopathologie des fœtus associés à la dose élevée a révélé une paroi alvéolaire anormale. Les autres doses n’ont pas fait l’objet d’un examen. Une diminution du rapport entre la lécithine et la sphingomyéline du liquide amniotique qui était liée à la dose a été observée. L’évaluation de ce rapport est un test traditionnel standard élaboré dans les années 1970 qui vise à aider les cliniciens à évaluer, chez les personnes enceintes, la maturation des poumons fœtaux et le risque que le nouveau-né développe un syndrome de détresse respiratoire (Gluck et al., 1971).
Des rats Wistar mâles adultes (10/dose) ont reçu 0 ou 4,5 mg/kg p.c./j d’énoxolone ou d’acide glycyrrhizique par gavage pendant 20 jours (Sakamoto et Wakabayashi, 1988). Après le traitement, les testicules des rats ont été retirés, et la capacité des cellules de Leydig à produire de la testostérone a été mise à l’essai in vitro. L’acide glycyrrhizique et l’énoxolone ont causé une diminution significative de la production de testostérone, ainsi qu’une accumulation de la 17α-hydroxyprogestérone. Ils peuvent inhiber la conversion de l’androstènedione en testostérone en inhibant la 17β-hydroxystéroïde déshydrogénase. Dans la présente évaluation, l’énoxolone est classifiée comme un perturbateur endocrinien potentiel.
Des hommes et des femmes volontaires (15/sexe/dose), âgés en moyenne de 33,4 ans et de 35 ans, respectivement, ont consommé 100 g de réglisse contenant 150 mg d’énoxolone chaque jour pendant 9 semaines (équivalant à 1,7 mg/kg p.c./j d’énoxolone pour les hommes et à 2,1 mg/kg p.c./j d’énoxolone pour les femmes), avec une période de 4 semaines sans consommation de réglisse (Sigurjonsdottir et al., 2006). Une diminution significative du taux de déhydroépiandrostérone sérique a été observée après 4 semaines de consommation de réglisse chez les hommes. Le taux est cependant redevenu normal après l’arrêt de 4 semaines. En revanche, les taux de testostérone et de déhydroépiandrostérone sérique étaient significativement plus élevés chez les femmes après l’arrêt de 4 semaines. L’énoxolone semble perturber les concentrations sériques d’androgènes chez les humains, les effets étant différents chez les 2 sexes.
Dans un modèle d’essai in vivo de toxicité chez le poisson zèbre, les poissons ont été exposés à une dose d’énoxolone comprise entre 1 et 5 µM. Une diminution du taux de survie des embryons liée à la dose a été observée et a atteint 60 % à la dose la plus élevée après 96 heures. Le taux d’éclosion a réduit de manière significative à toutes les doses après 48 heures après la fécondation. Après 72 heures, il était également significativement réduit à toutes les doses et atteignait 57,8 % à la dose la plus élevée. De plus, les auteurs de l’étude ont noté une diminution significative du rythme cardiaque chez les embryons de poissons zèbres exposés aux 3 doses les plus élevées. Enfin, les 2 doses les plus élevées ont réduit de manière significative la longueur des animaux (Zhong et al., 2022). Cette étude appuie l’existence d’un risque d’effet négatif sur le développement du fœtus causé par l’énoxolone.
Puisque les données empiriques sur l’énoxolone sont limitées, nous avons utilisé les renseignements sur les dangers du précurseur, soit l’acide glycyrrhizique, pour éclairer l’évaluation des effets sur la santé.
Dans la boîte à outils QSAR de l’OCDE (2019), le simulateur du métabolisme in vivo du rat proposait l’énoxolone comme principal métabolite de l’acide glycyrrhizique, et ces 2 substances sont des triterpénoïdes pentacycliques comportant une cyclocétone et un acide carboxylique. Elles suscitent toutes 2 des alertes relatives à la puissance de liaison avec les protéines selon le test d’activation de la lignée cellulaire humaine (test h-CLAT), à l’expression génique des kératinocytes, à la mutagénicité in vitro et in vivo et à la cancérogénicité. Elles sont également toutes 2 non biodisponibles.
Le JECFA a confirmé que la consommation d’acide glycyrrhizique ne devrait pas dépasser 100 mg/j (environ 2 mg/kg p.c./j) et reconnu que des effets nocifs peuvent se produire en deçà de ce seuil chez les populations vulnérables (par exemple personnes enceintes et allaitantes, et enfants). Il n’a cependant pas pu fixer de dose journalière acceptable pour les populations vulnérables en raison de l’incertitude de la base de données (WHO, 2009). Le Nordic Council of Ministers a conclu qu’il n’était pas possible de déterminer une limite sécuritaire d’après les effets nocifs produits, par exemple l’hyperminéralocorticisme, qui entraîne une rétention du sodium, une perte de potassium, des œdèmes, une augmentation de la pression sanguine et une dépression du système rénine-angiotensine-aldostérone, avec de grandes variations entre les individus (Nordic Council of Ministers, 1993). Il a établi une DMENO provisoire d’environ 100 mg/j pour la consommation de courte durée (> 1 à 2 semaines) d’acide glycyrrhizique par des adultes sensibles (par exemple ayant des problèmes de santé préexistants), sur la base d’études cliniques comprenant des études de cas (Nordic Council of Ministers, 1993). L’Agence européenne des médicaments (EMA) a déterminé que la dose sécuritaire d’acide glycyrrhizique à court terme s’établissait entre 80 mg/j et 100 mg/j, en se fondant sur l’hypokaliémie et l’hypertension qui suivent l’ingestion chronique des doses les plus élevées (EMA, 2013). Elle a indiqué que cette dose n’était pas recommandée pour les personnes enceintes et allaitantes, les enfants et les adolescents (˂ 18 ans). La Food and Drug Administration des États-Unis (US FDA) a averti les consommateurs que la réglisse noire contient de la glycyrrhizine, laquelle peut causer une diminution des taux de potassium dans l’organisme, un rythme cardiaque anormal, une hypertension artérielle, des œdèmes (enflures), une léthargie et une insuffisance cardiaque congestive (US FDA, 2017). Elle a recommandé de ne pas manger de grandes quantités de réglisse noire en une seule fois et de s’abstenir d’en consommer encore si l’un ou l’autre des symptômes mentionnés apparaissent. Enfin, d’après l’étude qu’elle a menée en collaboration avec les centres antipoison de France de 2012 à 2021, l’ANSES recommande de ne pas consommer plus de 10 mg/j de glycyrrhizine, de n’en consommer qu’occasionnellement et d’éviter la consommation à partir de sources multiples (par exemple aliments, médicaments) (ANSES, 2022).
Selon les renseignements disponibles, il semble que l’absorption, la distribution, la métabolisation et l’excrétion de la glycyrrhizine soient relativement semblables chez l’humain et le rat (VKM, 2018). L’acide glycyrrhizique est très peu absorbé par le tractus gastro-intestinal. Il est plutôt hydrolysé en énoxolone par les bactéries intestinales, une substance qui est rapidement absorbée par l’intestin. Cette absorption est complète chez l’humain, que l’énoxolone ait été formée par hydrolyse de l’acide glycyrrhizique ou qu’elle ait été présente dès le départ sous forme de glycoside ou d’aglycone dans une matrice alimentaire (WHO, 2009). L’énoxolone est conjuguée dans le foie avant d’être excrétée dans la bile. Les bactéries de l’intestin hydrolysent les nouveaux métabolites, ce qui entraîne un recyclage entérohépatique chez le rat et, on peut le supposer, chez l’humain (WHO, 2009; EMA, 2013; VKM, 2018). En raison de ce recyclage, l’élimination complète de l’énoxolone peut prendre plusieurs jours, le potentiel d’accumulation augmentant avec une exposition prolongée (Isbrucker et Burdock, 2006).
Dans le cadre d’une étude de courte durée, des rats Wistar mâles et femelles (nombre inconnu) ont reçu par gavage 0, 310, 630, 1 250 ou 2 500 mg/kg p.c./j de réglisse contenant 53 % de glycyrrhizine, c’est-à-dire d’acide glycyrrhizique (équivalant à 0, 164,3, 333,9, 662,5 ou 1 325 mg/kg p.c./j), pendant 90 jours (Isbrucker et Burdock, 2006). Le poids corporel des rats des 2 sexes a diminué à la dose la plus élevée. Aux doses de 1 250 mg/kg p.c./j et plus, l’évaluation hématologique a révélé une diminution significative du nombre et du taux de globules rouges chez les mâles, mais pas chez les femelles. Un nombre significativement élevé de neutrophiles et un nombre significativement réduit de lymphocytes ont également été observés chez les mâles ayant reçu la plus forte dose. La biochimie du sérum a révélé des taux significativement élevés de protéines totales, d’albumine, d’aspartate transaminase et d’alanine aminotransférase chez les rats mâles, qui étaient cependant significativement réduits chez les femelles aux doses de 1 250 mg/kg p.c./j et plus. En outre, une diminution du cholestérol sérique a été observée chez les rats mâles et femelles à toutes les doses. Le poids du foie et des reins a augmenté chez les mâles et les femelles des groupes ayant reçu les doses de 1 250 et de 2 500 mg/kg p.c./j, mais aucun changement histopathologique n’a été noté dans ces organes. Chez les rats exposés à la dose la plus élevée, l’histopathologie a montré une atrophie de la médulla du thymus ainsi que quelques formations lymphofolluculaires. Une atrophie et un catarrhe de la muqueuse gastrique ont également été constatés.
Au cours d’une étude épidémiologique pilote, 16 volontaires en bonne santé (8 femmes et 8 hommes par dose), tous âgés de 19 à 30 ans et ayant un poids corporel entre 58 et 71 kg (femmes) ou entre 56 kg et 91 kg (hommes), ont reçu par voie orale, dans des gélules, 0, 400 ou 800 mg/j d’acide glycyrrhizique (équivalant à 0, 6,6 ou 13,3 mg/kg p.c./j d’après les auteurs) pendant 4 semaines, qui ont été suivies d’une période de rétablissement de 2 semaines (van Gelderen et al., 2000). Tous les volontaires ont présenté des œdèmes après une semaine d’ingestion, ainsi qu’une augmentation du poids corporel (atteignant 6 kg chez certains). La concentration sérique de potassium a diminué chez tous les volontaires, en particulier les femmes, aux 2 doses. Une diminution considérable de la concentration d’aldostérone et de l’activité rénine plasmatique a également été notée aux 2 doses chez les 2 sexes, de manière plus marquée chez les femmes cette fois encore. Les symptômes observés étaient semblables à ceux d’un excès apparent de minéralocorticoïdes.
Dans le cadre d’une étude épidémiologique, 39 femmes volontaires en bonne santé âgées de 19 à 40 ans et ayant un poids corporel entre 55 et 83 kg ont reçu par voie orale, dans des gélules, 0, 1, 2 ou 4 mg/kg p.c./j d’acide glycyrrhizique pendant 6 semaines, qui ont été suivies d’une période de rétablissement de 2 semaines (van Gelderen et al., 2000). L’expérience a été réalisée selon un plan de traitement randomisé à double insu. Les chercheurs ont demandé aux volontaires de remplir un questionnaire sur leur alimentation pendant 3 jours chaque 2 semaines, et ont évalué leur état physique chaque semaine. Aucun changement du poids corporel n’a été observé. Les auteurs de l’étude ont noté une augmentation liée à la dose des maux de tête, des nausées et des vomissements, un effet qui était significatif à la dose de 4 mg/kg p.c./j. Une hausse du taux de défécation, un visage enflé et des picotements dans les bras et les jambes ont été relevés chez le groupe exposé à la dose de 4 mg/kg p.c./j. Bien que la concentration d’aldostérone dans le sérum était significativement plus faible dans ce groupe, aucun écart significatif n’a été observé chez les groupes exposés aux doses de 1 et de 2 mg/kg p.c./j. L’activité rénine plasmatique a diminué à toutes les doses, mais cet effet n’était significatif que pour le groupe ayant reçu 4 mg/kg p.c./j. La tension artérielle systolique et diastolique a augmenté à la dose de 2 mg/kg p.c./j et était significativement plus élevée à la dose de 4 mg/kg p.c./j.
Dans le cadre d’une étude transversale, l’effet de la consommation maternelle de glycyrrhizine (acide glycyrrhizique) a été examiné chez un échantillon de 1 049 femmes finlandaises et leurs nourrissons en bonne santé (Strandberg et al., 2001). L’apport en glycyrrhizine a été évalué au moyen d’un questionnaire détaillé sur la consommation de réglisse, auquel les mères ont répondu pendant leur séjour à la maternité. L’apport quotidien en glycyrrhizine a été calculé à partir de la quantité déclarée (en grammes) et de la fréquence (jamais, parfois, chaque semaine, chaque jour) de la consommation de réglisse (marques indiquées). Une liste de toutes les marques de confiseries contenant de la réglisse vendues en Finlande, fondée sur un rapport préparé en 1993 par l’Administration nationale des aliments et mise à jour selon l’information des fabricants, a été utilisée. L’apport en glycyrrhizine a été analysé à la fois sous forme d’une variable continue et d’une variable nominale représentant 3 niveaux, soit faible (≤ 250 mg/sem.; n = 751), modéré (250 à 499 mg/sem.; n = 145) et élevé (≥ 500 mg/sem.; n = 110), lesquels comprenaient 75, 14 et 11 % des naissances, respectivement. Toutes les données sur la grossesse et les nourrissons ont été tirées des dossiers d’hospitalisation. Aucun changement du poids corporel des nourrissons n’a été relevé, mais le groupe exposé à la plus forte dose est né significativement plus tôt (avant 38 semaines).
Au cours d’une deuxième étude transversale, les mêmes auteurs ont cherché à voir si cette association s’appliquait aux naissances prématurées (avant 37 semaines). Ils ont comparé un échantillon de 95 femmes finlandaises ayant accouché de manière prématurée à un échantillon de 107 femmes ayant accouché après 38 semaines (Strandberg, 2002). L’apport en glycyrrhizine a été calculé au moyen d’une approche semblable à celle employée par Strandberg et al. (2001). L’exposition à la glycyrrhizine a été divisée en 3 niveaux : faible (≤ 250 mg/sem.), modéré (250 à 499 mg/sem.) et élevé (≥ 500 mg/sem.). Une consommation élevée a été associée à un risque plus de 2 fois plus élevé d’accouchement prématuré (avant 37 semaines) et 3 fois plus élevé d’accouchement très prématuré (avant 34 semaines) sur la base d’un modèle entièrement adapté (âge de la mère, sexe, parité et tabagisme). Les auteurs ont conclu qu’une exposition élevée à la glycyrrhizine était associée à un accouchement prématuré dû à une augmentation du taux de cortisol dans le placenta.
En examinant la même cohorte que celle visée par les 2 études précédentes, d’autres auteurs ont évalué le rendement cognitif des enfants exposés à la glycyrrhizine avant leur naissance (Räikkönen et al., 2009). Ils ont soumis 371 enfants en bonne santé, âgés en moyenne de 8,1 ans, à la troisième édition des tests de la Wechsler Intelligence Scale for Children et à une évaluation du développement neuropsychologique. Ils ont également étudié leur rendement cognitif en leur faisant passer le test d’intégration visiomotrice de Beery. Enfin, ils ont recherché leurs symptômes psychiatriques à l’aide de la Liste de comportement pour les enfants. Le statut professionnel, le niveau d’éducation, la santé de la mère, les habitudes de tabagisme, la consommation d’alcool et le stress ne différaient pas entre les groupes. Chez les enfants exposés à des taux élevés (≥ 500 mg/sem.) de glycyrrhizine, des régressions significatives des capacités verbales et visuospatiales et de la mémoire narrative ont été observées, ainsi qu’une présentation significativement accrue de symptômes d’externalisation et de problèmes d’attention, d’agression et de comportements contraires aux règles. Une association linéaire a été constatée entre la consommation maternelle de glycyrrhizine et les effets sur le rendement cognitif. Cependant, les auteurs n’ont pas fait état de la consommation de réglisse par les enfants eux-mêmes. Ils ont conclu qu’une surexposition prénatale potentielle aux glucocorticoïdes pourrait avoir entraîné les effets nocifs mentionnés.
Les mêmes auteurs ont mesuré les taux diurnes de cortisol dans la salive des mêmes enfants, âgés en moyenne de 8,1 ans (plage allant de 7,4 à 8,8 ans), alors que ceux-ci étaient soumis à l’essai de stress social chez les enfants de Trier (Räikkönen et al., 2010). Ce taux était significativement plus élevé chez les enfants exposés avant la naissance à des taux élevés de glycyrrhizine (≥ 500 mg/sem.) que chez les enfants du groupe exposé à la dose la plus faible (0 à 250 mg/sem.). Cet effet semblait lié à la dose. Les auteurs ont conclu qu’une exposition prénatale à des niveaux élevés de glycyrrhizine pouvait modifier la fonction de l’axe hypothalamo-hypophyso-surrénalien chez les enfants.
Plus tard, les mêmes auteurs ont évalué la maturité pubérale (par exemple taille, poids, indice de masse corporelle pour l’âge, écart entre la taille actuelle et la taille prévue à l’âge adulte, classification de Tanner, score sur l’échelle de développement pubertaire), la fonction neuroendocrinienne (par exemple cortisol salivaire diurne et freinage à la dexaméthasone), la cognition (par exemple tests neuropsychologiques) et les problèmes psychiatriques (par exemple à l’aide de la Liste de comportement pour les enfants) chez les mêmes enfants, qui avaient alors un âge moyen de 12,5 ans (n = 328) (Räikkönen et al., 2017). La consommation de réglisse des adolescents (jamais, moins d’une fois par semaine, une fois par semaine, de 2 à 4 fois par semaine, tous les jours, aucune réponse) était indiquée dans le cadre de cette étude. Elle y était utilisée comme variable confusionnelle potentielle. Les filles exposées avant la naissance à une consommation élevée de glycyrrhizine (≥ 500 mg/sem.) étaient significativement plus grandes, avaient un indice de masse corporelle plus élevé et présentaient un développement pubertaire plus avancé. Des résultats semblables n’ont pas été observés chez les garçons. Les garçons et les filles exposés avant la naissance à une consommation élevée de glycyrrhizine (≥ 500 mg/sem.) ont obtenu des notes significativement plus faibles aux tests du quotient intellectuel, avaient une moins bonne mémoire et étaient 3,3 fois plus susceptibles d’avoir un trouble de déficit d’attention avec hyperactivité. Aucune différence dans les taux de cortisol n’a été constatée à cet âge. Les auteurs ont déduit une DMENO inférieure ou égale à 500 mg/sem. (équivalant à 0,91 mg/kg p.c./j d’après l’apport minimal estimé par les auteurs qui entraîne des effets nocifs) en se fondant sur la neurotoxicité pour le développement.
Aucune génotoxicité n’a été observée pour l’acide glycyrrhizique pendant un test d’Ames sur le Salmonella typhimurium de souche TA98 avec ou sans activation métabolique, et lors d’un test des comètes sur divers organes de souris mâles (Isbrucker et Burdock, 2006).
7.3.3 Caractérisation des risques pour la santé humaine
La concentration entraînant un effet critique établi pour le sous-groupe 2 des triterpénoïdes était une dose orale minimale avec effet nocif de neurotoxicité pour le développement observé inférieure ou égale à 500 mg/sem. (équivalant à 0,91 mg/kg p.c./j d’après l’apport minimal estimé par les auteurs qui entraîne des effets nocifs) de glycyrrhizine chez les enfants exposés avant la naissance par la consommation maternelle pendant la grossesse (Räikkönen et al., 2009; Räikkönen et al., 2017). Une diminution des capacités verbales et visuospatiales ainsi que de la mémoire narrative, une augmentation des symptômes d’extériorisation, et des problèmes d’attention, d’agression et de comportements contraires aux règles ont été observés chez les enfants à l’âge moyen de 8,1 ans. À l’âge moyen de 12,5 ans, les mêmes enfants ont obtenu des scores plus faibles aux tests de quotient intellectuel, avaient une moins bonne mémoire, et présentaient plus souvent un trouble de déficit d’attention avec hyperactivité. Les effets de neurotoxicité pour le développement sont corroborés par la capacité de l’énoxolone à perturber l’enzyme 11β-HSD placentaire dans son inactivation du cortisol avant que ce dernier n’atteigne le fœtus, ce qui augmente l’exposition du fœtus au cortisol (Blum et al., 1995; Benediktsson et al., 1997). De plus, il existe un risque d’augmentation de la pression sanguine et des taux de potassium dans le sang, qui pourrait entraîner une arythmie chez la mère et des effets potentiellement mortels sur le fœtus. Étant donné la gravité des effets sur le développement et l’incertitude entourant les effets de perturbation du système endocrinien et du développement neurologique qu’a l’énoxolone chez les fœtus et les enfants, ce point de départ a été jugé pertinent pour les personnes enceintes, allaitantes et en âge de procréer, les fœtus et les enfants.
L’effet critique sur le développement est également corroboré par une DMENO orale de 10 mg/kg p.c./j d’énoxolone (plus faible dose mise à l’essai), d’après une réduction de l’activité pulmonaire de la 11β-HSD1 chez tous les fœtus exposés à l’énoxolone, une altération de la maturation pulmonaire fœtale chez le rat et une diminution des taux de la protéine A du surfactant (ARN messager et protéine). En outre, une réduction liée à la dose du rapport entre la lécithine et la sphingomyéline dans le fluide amniotique a été observée chez des fœtus de rat en l’absence de toxicité maternelle, ce qui est un marqueur du risque de développement du syndrome de détresse respiratoire chez le nouveau-né (Gluck et al.,1971; Hundertmark et al., 2002).
Les estimations de l’exposition systémique quotidienne à l’énoxolone des groupes d’âge les plus exposés et les moins exposés qui découle des cosmétiques, des PSN et des aliments, ainsi que les marges d’exposition résultantes, sont résumées dans le tableau 7-15.
| Scénario | % dans le produit | Voie d’exposition | Exposition systémique (mg/kg p.c./j) | MEa, b |
|---|---|---|---|---|
| Produit de maquillage pour le visage (fond de teint liquide) (enfants de 4 à 8 ans à adultes) | 0,1 | Cutanée | 1,65 × 10-3 (enfants de 14 à 18 ans) à 3,70 × 10-3 (enfants de 4 à 8 ans) | 246 (enfants de 4 à 8 ans) à 550 (enfants de 14 à 18 ans) |
| Hydratant pour le visage (enfants de 9 à 13 ans à adultes) | 30 | Cutanée | 1,81 (enfants de 14 à 18 ans) à 3,04 (adultes) | 0,30 (adultes) à 0,50 (enfants de 14 à 18 ans) |
| Hydratant pour le corps (en pulvérisateur) (tous) | 3 | Cutanée et inhalation | 0,45 (adultes) à 2,53 (bébés de 0 à 5 mois) | 2,03 (bébés de 0 à 5 mois) à 0,36 (adultes) |
| Hydratant pour le corps (lotion) (tous) | 3 | Cutanée | 1,01 (adultes) à 2,38 (bébés de 0 à 5 mois) | 0,38 (bébés de 0 à 5 mois) à 0,90 (adultes) |
| Baume à lèvres (enfants de 9 à 13 ans à adultes) | 1 | Orale | 5,95 × 10-3 (adultes) à 8,87 × 10-3 (enfants de 14 à 18 ans) | 103 (enfants de 14 à 18 ans) à 153 (adultes) |
| Produit pour le bain (mousse/bulles) (tous) | 3 | Cutanée | 1,40 × 10-3 (enfants de 9 à 13 ans) à 4,48 × 10-3 (enfants de 14 à 18 ans) | 203 (enfants de 14 à 18 ans) à 651 (enfants de 9 à 13 ans) |
| Nettoyant pour le visage (enfants de 9 à 13 ans à adultes) | 10 | Cutanée | 1,60 × 10-2 (enfants de 14 à 18 ans) à 2,21 × 10-2 (enfants de 9 à 13 ans) | 41 (enfants de 9 à 13 ans) à 57 (enfants de 14 à 18 ans) |
| Démaquillant pour le visage (lotion) (enfants de 4 à 8 ans à adultes) | 0,1 | Cutanée | 1,48 × 10-3 (adultes) à 2,37 × 10-3 (enfants de 4 à 8 ans) | 384 (enfants de 4 à 8 ans) à 613 (adultes) |
| Shampooing (tous) | 0,3 | Cutanée | 1,26 × 10-3 (enfants de 14 à 18 ans) à 4,64 × 10-3 (bébés de 0 à 5 mois) | 196 (bébés de 0 à 5 mois) à 723 (enfants de 14 à 18 ans) |
| Revitalisant (avec rinçage) (enfants de 2 à 3 ans à adultes) | 0,3 | Cutanée | 1,21 × 10-3 (enfants de 14 à 18 ans) à 2,60 × 10-3 (enfants de 2 à 3 ans) | 350 (enfants de 2 à 3 ans) à 752 (enfants de 14 à 18 ans) |
| Déodorant ou antisudorifique (solide) (enfants de 9 à 13 ans à adultes) | 0,1 | Cutanée | 6,18 x 10-4 (enfants de 9 à 13 ans) à 1,35 x 10-3 (adultes) | 672 (adultes) à 1 473 (enfants de 9 à 13 ans) |
| Crème à raser (visage) (enfants de 9 à 13 ans à adultes) | 0,1 | Cutanée | 2,30 × 10-4 (adultes) à 3,81 × 10-4 (enfants de 9 à 13 ans) | 2 389 (enfants de 9 à 13 ans) à 3 961 (adultes) |
| Fixatif pour cheveux (pompe) (enfants de 4 à 8 ans à adultes) | 0,1 | Cutanée et inhalation | 4,08 × 10-4 (enfants de 14 à 18 ans) à 1,59 × 10-3 (adultes) | 571 (adultes) à 2 232 (enfants de 14 à 18 ans) |
| Colorant capillaire permanent (enfants de 14 à 18 ans à adultes) | 0,1 | Cutanée | 4,48 × 10-2 (adultes) à 5,35 × 10-2 (enfants de 14 à 18 ans) | 17 (enfants de 14 à 18 ans) à 20 (adultes) |
| Écran solaire (crème) (PSN) (adultes) | 0,5 | Cutanée | 4,30 × 10-1 (adultes) | 2,11 (adultes) |
| Écran solaire (crème) (MVL) (bébés de 6 à 11 mois à adultes) | 0,5 | Cutanée | 2,63 × 10-1 (enfants de 9 à 13 ans) à 1,19 (bébés de 6 à 11 mois) | 0,77 (bébés de 6 à 11 mois) à 3,47 (enfants de 9 à 13 ans) |
| Timbre analgésique (PSN) (enfants de 2 à 3 ans à adultes) | 0,18 | Cutanée | 1,10 × 10-2 (adultes) à 1,16 × 10-1 (enfants de 2 à 3 ans) | 8 (enfants de 2 à 3 ans) à 83 (adultes) |
| Produit de traitement contre l’acné (crème) (PSN) (enfants de 9 à 13 ans à adultes) | 0,3 | Cutanée | 4,56 × 10-2 (adultes) à 5,89 × 10-2 (enfants de 9 à 13 ans) | 15 (enfants de 9 à 13 ans) à 20 (adultes) |
| Produit médicamenteux de soins de la peau (crème) (PSN) (bébés de 6 à 11 mois à adultes) | 0,2 | Cutanée | 5,16 × 10-2 (enfants de 14 à 18 ans) à 1,52 × 10-1 (enfants de 1 an) | 6 (enfants de 1 an) à 18 (enfants de 14 à 18 ans) |
| Écran solaire (lotion) (PSN) (adultes) | 0,1 | Cutanée | 1,01 × 10-2 (adultes) | 90 (adultes) |
| Dentifrice (adultes) | 0,1 | Orale | 2,70 × 10-3 (adultes) | 34 (adultes) |
| Dentifrice (PSN) (enfants de 2 à 3 ans à adultes) | 0,05 | Orale | 1,35 × 10-3 (adultes) à 2,03 × 10-2 (enfants de 2 à 3 ans) | 45 (enfants de 2 à 3 ans) à 673 (adultes) |
| Apport alimentaire (réglisse sous forme de glycyrrhizine) (enfants de 1 an et personnes plus âgées) | Divers | Orale | 1,55 × 10-2 (enfants de 1 an et personnes plus âgées) | 59 (enfants de 1 an et personnes plus âgées) |
| Consommation régulière de thé à la réglisse (adultes) | Divers | Orale | 2,09 × 10-1 (adultes) | 4 (adultes) |
| Consommation élevée de courte durée de bonbons à la réglisse noire (adultes) | Divers | Orale | 6,00 × 10-1 (adultes) | 1 (adultes) |
Abréviations : ME = marge d’exposition; PSN = produit de santé naturel; MVL = médicament en vente libre.
a La ME a été calculée à l’aide de la concentration entraînant un effet critique (une DMENO de 0,91 mg/kg p.c./j), qui repose sur la neurotoxicité pour le développement.
b ME cible = 30 (10x pour la variation intraspécifique × 3x pour l’utilisation d’une DMENO). Les ME en gras sont considérées comme potentiellement inadéquates.
Les marges d’exposition entre la concentration entraînant un effet critique et les estimations de l’exposition quotidienne découlant de l’utilisation de l’énoxolone dans des hydratants pour le visage, des hydratants pour le corps (en pulvérisateur et lotions), des colorants capillaires permanents, des écrans solaires (crèmes) (PSN et MVL), des timbres analgésiques (PSN) (enfants de 13 ans et moins), des produits de traitement contre l’acné (crèmes) (PSN) et des produits médicamenteux de soins de la peau (crèmes) (PSN), de la consommation régulière de thé à la réglisse et de l’exposition élevée sur une courte durée due à la consommation de bonbons à la réglisse noire sont inférieures à la marge d’exposition cible de 30. Il est jugé qu’elles ne permettent peut-être pas de tenir adéquatement compte des incertitudes entourant les effets sur la santé et les données sur l’exposition ayant servi à caractériser les risques. Étant donné le nombre de produits contenant de l’énoxolone présents sur le marché canadien, une exposition à plusieurs types de produits pourrait se produire le même jour (c’est-à-dire exposition globale), auquel cas la marge d’exposition serait encore plus faible.
Comme nous n’avons relevé aucune source d’exposition de la population générale à l’acide glycyrrhétinique préparé avec l’allantoïne, nous avons adopté une approche qualitative pour caractériser les risques. Nous avons évalué que ceux pour la santé humaine étaient faibles.
7.3.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Les principales sources d’incertitude sont présentées dans le tableau ci-dessous.
| Principales sources d’incertitude | Effet |
|---|---|
| Aucune étude sur l’absorption cutanée n’était disponible pour les substances du sous-groupe 2 des triterpénoïdes. | +/- |
| L’utilisation potentielle de plus d’un produit par une même personne au cours d’une journée (c’est-à-dire l’exposition globale) n’a pas été examinée. Il pourrait en découler une sous-estimation de l’exposition de certaines personnes. | - |
| La détermination de la quantité d’aliments contenant de la réglisse ingérée par personne repose sur une répartition égale de la consommation de ces aliments dans toute la population. Il pourrait en découler une sous-estimation de l’exposition des personnes qui aiment la saveur de la réglisse, et une surestimation de l’exposition des personnes qui ne l’aiment pas. | +/- |
| En l’absence de données sur la consommation de bonbons à la réglisse noire au Canada, nous avons supposé de manière prudente qu’une portion de 80 g de bonbons, fondée sur la quantité de référence pour les bonbons figurant dans le Tableau des quantités de référence pour les aliments de Santé Canada (Santé Canada, 2022), représentait la quantité élevée de bonbons à la réglisse noire consommés durant une courte période. Par ailleurs, il se peut que des aliments à saveur de réglisse comprennent des aromatisants ne contenant pas de réglisse (par exemple anéthole, anis) au lieu d’aromatisants à base de réglisse. De ce fait, l’exposition de certains consommateurs de bonbons à la réglisse noire pourrait être surestimée. | + |
| Il n’existe que peu de données sur les dangers de l’énoxolone et aucune sur ceux de l’acide glycyrrhétinique préparé avec l’allantoïne. La lecture croisée des données de l’analogue, la glycyrrhizine, a servi à réaliser l’évaluation des risques pour la santé humaine. | +/- |
| Nous manquons de données sur les effets de l’énoxolone en ce qui concerne la toxicité pour le développement et la reproduction ainsi que la neurotoxicité pour le développement. | - |
| Nous ne disposions d’aucune étude adéquate des voies d’exposition cutanée et par inhalation à l’énoxolone. Par conséquent, pour les scénarios associés à ces voies, nous avons effectué une extrapolation de voie à voie par comparaison avec une concentration entraînant un effet tirée d’une étude de la voie orale. | +/- |
+ = incertitude pouvant causer la surestimation de l’exposition ou du risque; - = incertitude pouvant causer la sous-estimation de l’exposition ou du risque; +/- = potentiel inconnu à causer une surestimation ou une sous-estimation du risque.
7.4 Essence de mimosa
7.4.1 Évaluation de l’exposition
Milieux environnementaux
Compte tenu des faibles quantités fabriquées et importées (< 100 kg) de la substance qui ont été déclarées en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada, 2013), nous ne nous attendons à aucune exposition à l’essence de mimosa par l’intermédiaire des milieux environnementaux. Nous n’avons trouvé aucun rapport sur la surveillance de cette substance dans les milieux environnementaux au Canada ou ailleurs.
Aliments
Exposition due à l’utilisation comme aromatisant alimentaire
Aucune donnée définitive n’est disponible concernant l’utilisation possible de l'essence de mimosa dans les aliments vendus au Canada. Cependant, puisque l’on sait que cette substance est employée comme aromatisant alimentaire ailleurs dans le monde, il est possible qu’elle le soit également dans des aliments vendus au Canada.
Le Fenaroli’s Handbook of Flavor Ingredients indique que l’ingestion estimée d'essence de mimosa (répertoriées comme l’essence absolue de mimosa) par personne qui découle de l’utilisation de cette substance comme aromatisant alimentaire s’élève à 3,8 × 10-2 μg/kg p.c./j pour la population des États-Unis, selon les volumes de production déclarés par l’industrie alimentaire (Burdock, 2010). En l’absence de données sur l’utilisation réelle, le cas échéant, de cette substance comme aromatisant dans les aliments vendus au Canada, l’estimation de l’ingestion par personne aux États-Unis (Burdock, 2010) constitue une estimation acceptable de l’exposition par voie alimentaire possible de la population générale du Canada âgée d’un an et plus due à l’utilisation de cette substance comme aromatisant alimentaire (communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, 2021; source non citée).
Exposition due à la présence naturelle dans des aliments
Aucune donnée définitive n’est disponible concernant la présence naturelle de l'essence de mimosa dans les aliments. L'essence de mimosa sont obtenues à partir de matériel végétal de la plante qui donne son nom à l’essence (Burdock, 2010). Nous nous attendons à ce que l’exposition alimentaire à cette substance qui découle de sa présence naturelle dans les aliments soit faible, voire nulle.
Produits disponibles aux consommateurs
L'essence de mimosa sont présentes dans des produits disponibles aux consommateurs. Pour évaluer le potentiel d’exposition à cette substance provenant des cosmétiques et des PSN appliqués sur la peau, nous avons choisi des scénarios sentinelles en nous basant sur une combinaison de fréquences d’utilisation et de concentrations déclarées de la substance dans ces produits. Ces scénarios représentaient les expositions les plus élevées, par rapport aux autres cosmétiques appliqués sur la peau ainsi qu’aux PSN comprenant l'essence de mimosa comme ingrédient non médicinal, parmi les produits pour lesquels la présence de cette substance avait été déclarée. Les scénarios sentinelles examinés pour les applications cutanées portaient sur l’exposition à l’essence de mimosa due à l’utilisation de parfums pour le corps (en applicateur à bille et en pulvérisateur), d’hydratants (pour le corps, le visage et les yeux), de produits de massage (huiles et pains), de déodorants ou d’antisudorifiques (solides), de produits autobronzants, de produits de maquillage pour le visage (fonds de teint liquides, ombres à paupières, fards), de nettoyants (pour le corps et le visage), d’exfoliants (pour le corps et le visage), de nettoyants (2 en 1 : shampooings et nettoyants pour le corps), de produits pour le bain (mousses/bulles), de démaquillants pour le visage, de produits de coiffure (gels/cires/pâtes, fixatifs, mousses), de shampooings, de revitalisants et d’écrans solaires (lotions) (PSN).
En ce qui concerne l’utilisation de l'essence de mimosa à des concentrations de 100 % dans des produits faits soi-même, les expositions quotidiennes les plus élevées devraient provenir de l’utilisation de l'essence dans des diffuseurs d’arôme ou assainisseurs d’air, des huiles de massage, des hydratants pour le corps et des brumisateurs faciaux. Bien que la concentration maximale d'essence de mimosa utilisée dans des huiles de massage soit présumée être de 100 %, les huiles de massage sont généralement diluées avant leur utilisation. Il a donc été supposé que la concentration maximale de la substance dans ces produits était de 3 % (RIVM, 2006). Il est rapporté que les huiles essentielles et les extraits entrant dans des produits pour le corps sont habituellement dilués à des concentrations comprises entre 1 et 4 % (Tisserand Institute, 2021). À la lumière de cette information, il a été supposé que la concentration maximale d'essence de mimosa dans les hydratants pour le corps faits soi-même était de 3 %.
Nous n’avons trouvé aucune étude de l’absorption cutanée de l'essence de mimosa. La lupénone et le lupéol, des composants de cette substance, ont un poids moléculaire de 424,70 et 426,72 g/mol, respectivement, et des valeurs de log Koe supérieures à 6 (tableau 3-1). Puisque les propriétés physico-chimiques des principaux composants de l'essence de mimosa et d’autres triterpénoïdes visés par la présente évaluation sont semblables et qu’aucune donnée sur l’absorption cutanée propre aux substances n’est disponible, nous avons adopté une approche de groupe dans le cadre de laquelle une même valeur a représenté l’absorption cutanée de tous les triterpénoïdes. Nous avons établi une absorption cutanée de 25 % aux sites occlus et non occlus de la peau en nous fondant sur l’information disponible. Des renseignements supplémentaires sur l’absorption cutanée sont fournis à la section 7.3.1, qui porte sur l’évaluation de l’exposition aux substances du sous-groupe 2 des triterpénoïdes.
L'essence de mimosa sont également présentes dans des rouges à lèvres et des écrans solaires (baumes à lèvres) (PSN). Nous avons quantifié les expositions par voie orale découlant de l’utilisation de rouges à lèvres et d’écrans solaires (baumes à lèvres) (PSN) en considérant une concentration maximale de 10 et de 3,2 %, respectivement (communication personnelle, courriels de la Direction de la sécurité des produits de consommation et des produits dangereux et de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, 2017, 2021; source non citée).
L’exposition découlant des produits disponibles aux consommateurs devrait surtout se faire par la voie cutanée. Étant donné la pression de vapeur négligeable des principaux composants de l'essence de mimosa et les utilisations recensées, nous ne nous attendons pas à ce que l’inhalation soit une voie d’exposition importante. Nous avons néanmoins tenu compte de l’exposition par inhalation dans le cas des parfums pour le corps et des fixatifs pour cheveux, afin d’estimer l’exposition systémique (somme de l’exposition cutanée et de l’exposition par inhalation) associée à ces produits.
Les estimations de l’exposition des groupes d’âge les moins exposés et les plus exposés qui découle des produits disponibles aux consommateurs sont résumées dans le tableau 7-17. Les estimations de l’exposition quotidienne due aux produits faits soi-même qui contiennent de l'essence de mimosa sont résumées dans le tableau 7-18.
| Scénario | % dans le produit | Voie d’exposition | Plage d’exposition systémique (mg/kg p.c./j)a |
|---|---|---|---|
| Parfum (en applicateur à bille) | 10 | Cutanée et inhalation | 5,59 × 10-2 (enfants de 14 à 18 ans) à 1,65 × 10-1 (enfants de 2 à 3 ans) |
| Parfum (en pulvérisateur) | 3 | Cutanée et inhalation | 4,84 × 10-2 (enfants de 14 à 18 ans) à 1,42 × 10-1 (enfants de 2 à 3 ans) |
| Hydratant pour le corps | 10 | Cutanée | 1,01 (adultes) à 2,38 (bébés de 0 à 5 mois) |
| Hydratant pour le visage | 10 | Cutanée | 1,81 x 10-1 (enfants de 14 à 18 ans) à 3,04 x 10-1 (adultes) |
| Hydratant pour les yeux | 3 | Cutanée | 1,52 × 10-2 (adultes) à 1,81 × 10-2 (enfants de 14 à 18 ans) |
| Huile de massage | 0,3 | Cutanée | 9,73 × 10-3 (adultes) à 6,43 × 10-2 (bébés de 0 à 5 mois) |
| Pain de massage | 1 | Cutanée | 3,24 × 10-2 (adultes) |
| Déodorant ou antisudorifique (solide) | 0,063 | Cutanée | 4,95 × 10-4 (enfants de 9 à 13 ans) à 8,38 × 10-4 (enfants de 14 à 18 ans) |
| Produit autobronzant | 10 | Cutanée | 1,58 (enfants de 9 à 13 ans) à 3,08 (enfants de 14 à 18 ans) |
| Produit de maquillage pour le visage (fond de teint liquide) | 10 | Cutanée | 4,96 × 10-2 (enfants de 14 à 18 ans) à 1,11 × 10-1 (enfants de 4 à 8 ans) |
| Ombre à paupières | 1 | Cutanée | 1,09 × 10-4 (enfants de 14 à 18 ans) à 2,93 × 10-4 (enfants de 4 à 8 ans) |
| Fard | 1 | Cutanée | 1,32 × 10-4 (adultes) à 4,57 × 10-4 (enfants de 4 à 8 ans) |
| Rouge à lèvres et baume à lèvres | 10 | Orale | 1,78 × 10-2 (adultes) à 4,40 × 10-2 (enfants de 2 à 3 ans) |
| Nettoyant pour le corps (liquide) | 0,3 | Cutanée | 4,68 × 10-4 (adultes) à 1,93 × 10-3 (bébés de 0 à 5 mois) |
| Nettoyant pour le visage | 1 | Cutanée | 4,79 × 10-4 (enfants de 14 à 18 ans) à 6,64 × 10-4 (enfants de 9 à 13 ans) |
| Exfoliant pour le corps | 0,3 | Cutanée | 3,39 × 10-3 (adultes) à 6,01 × 10-3 (enfants de 14 à 18 ans) |
| Exfoliant pour le visage | 1 | Cutanée | 3,14 × 10-3 (adultes) à 3,75 × 10-3 (enfants de 14 à 18 ans) |
| Nettoyant (2 en 1 : shampooing et nettoyant pour le corps) | 1 | Cutanée | 3,00 × 10-3 (enfants de 2 à 3 ans) à 7,14 × 10-3 (bébés de 0 à 5 mois) |
| Produit pour le bain (mousse/bulles) | 1 | Cutanée | 1,40 × 10-4 (enfants de 9 à 13 ans) à 4,48 × 10-4 (enfants de 14 à 18 ans) |
| Démaquillant pour le visage | 0,1 | Cutanée | 2,65 × 10-4 (adultes) à 7,11 × 10-4 (enfants de 4 à 8 ans) |
| Produit de coiffure (gel/cire/pâte) | 1 | Cutanée | 3,75 × 10-3 (adultes) à 1,40 × 10-2 (enfants de 2 à 3 ans) |
| Fixatif pour cheveux | 0,1 | Cutanée et inhalation | 2,37 × 10-4 (enfants de 14 à 18 ans) à 6,38 × 10-4 (enfants de 4 à 8 ans) |
| Produit de coiffure (mousse) | 0,1 | Cutanée | 7,80 × 10-4 (adultes) à 2,05 × 10-3 (enfants de 2 à 3 ans) |
| Shampooing | 0,1 | Cutanée | 1,26 × 10-4 (enfants de 14 à 18 ans) à 4,64 × 10-4 (bébés de 0 à 5 mois) |
| Revitalisant (avec rinçage) | 0,1 | Cutanée | 1,21 × 10-4 (enfants de 14 à 18 ans) à 2,60 × 10-4 (enfants de 2 à 3 ans) |
| Écran solaire (lotion) (PSN) | 0,105 | Cutanée | 1,65 × 10-2 (enfants de 9 à 13 ans) à 7,48 × 10-2 (bébés de 6 à 11 mois) |
| Écran solaire (baume à lèvres) (PSN) | 3,2 | Orale | 5,71 × 10-3 (adultes) à 2,32 × 10-2 (bébés de 6 à 11 mois) |
Abréviation : PSN = produit de santé naturel.
a Les estimations de l’exposition ont été modifiées de 30 % pour tenir compte de la quantité maximale des principaux composants dans l'essence de mimosa. Il a été supposé que l’absorption cutanée était de 25 %. Voir l’annexe A pour connaître le détail des calculs.
| Scénario | % dans le produit | Voie d’exposition | Plage d’exposition systémique (mg/kg p.c./j)a |
|---|---|---|---|
| Diffuseur d’arôme/assainisseur d’air (inhalation et remplissage) | 100 | Cutanée et inhalation | 0,70 (adultes) à 1,21 (enfants de 9 à 13 ans) |
| Diffuseur d’arôme/assainisseur d’air (exposition des non-utilisateurs) | 100 | Inhalation | 0,39 (enfants de 4 à 8 ans) à 0,59 (enfants de 1 an) |
| Huile de massage | 3 | Cutanée | 9,73 × 10-2 (adultes) à 6,43 × 10-1 (bébés de 0 à 5 mois) |
| Hydratant pour le corps | 3 | Cutanée | 0,30 (adultes) à 0,71 (bébés de 0 à 5 mois) |
| Brumisateur facial (application) | 100 | Cutanée et inhalation | 3,39 × 10-9 (adultes) à 1,03 × 10-8 (enfants de 4 à 8 ans) |
| Brumisateur facial (exposition des non-utilisateurs) | 100 | Inhalation | 3,96 × 10-9 (enfants de 1 an) |
a Les estimations de l’exposition ont été modifiées de 30 % pour tenir compte de la quantité maximale des principaux composants dans l'essence de mimosa. Il a été supposé que l’absorption cutanée était de 25 %. Voir l’annexe B pour connaître le détail des calculs.
7.4.2 Évaluation des effets sur la santé
Il n’existe pas de donnée empirique ni d’évaluation internationale sur l'essence de mimosa.
Dans le cadre de notre évaluation des effets sur la santé, nous avons tenu compte des renseignements sur les dangers disponibles au sujet des principaux composants de l'essence de mimosa, soit la lupénone (20 %) et le lupéol (7,8 %).
Lupénone et lupéol
Il n’existe aucune donnée empirique ni évaluation internationale sur la lupénone, qui ne figure d’ailleurs pas dans la boîte à outils QSAR de l’OCDE (2019). Sur le plan structural, la seule différence entre la lupénone et le lupéol est la présence d’une cétone sur la lupénone et d’un groupe hydroxyle sur le lupéol. Par conséquent, nous avons utilisé les données sur le lupéol pour évaluer la lupénone. Au cours d’une étude in silico, le lupéol et plusieurs analogues tels que la lupénone et l’acétate de lupéol ont présenté une forte propension à cibler et à lier des récepteurs nucléaires participant à la fertilité chez les mammifères, comme le récepteur des hydrocarbures aryliques et les récepteurs de la progestérone (Ruiz-Rodríguez et al., 2017).
Le lupéol a montré des effets anti-androgènes, soit une diminution de la prolifération des cellules testiculaires et de la biosynthèse in vitro de la testostérone dans des cellules testiculaires de rat (Ogunwole et al., 2019), ainsi qu’une inhibition de l’activité transcriptionnelle des récepteurs androgéniques dans les cellules épithéliales normales de la prostate (Siddique et al., 2011).
Dans une étude in vitro, le lupéol a réduit l’hyperactivation des spermatozoïdes après la capacitation, une condition obligatoire de la fertilisation d’un ovocyte, en inhibant la voie de la progestérone (Mannowetz et al., 2017).
En nous fondant sur la littérature (Siddique et al., 2011; Ruiz-Rodríguez et al., 2017; Ogunwole et al., 2019), nous avons déterminé que le lupéol et la lupénone pourraient être des perturbateurs endocriniens.
En raison des données limitées sur les effets sur la santé de ces substances, nous avons adopté une approche de lecture croisée. L’analogue le plus convenable pour lequel la boîte à outils QSAR de l’OCDE (2019) contenait des données empiriques était l’énoxolone, une substance suscitant la même alerte de liaison aux récepteurs des œstrogènes (forte liaison). Les 3 substances sont des triterpénoïdes pentacycliques comportant un cycloalcane, des groupes alcooliques et des carbocycles saturés fusionnés. Nous avons choisi l’analogue en nous fondant sur les propriétés de perturbation du système endocrinien qu’il partage avec les substances ciblées. Ce choix protège donc les populations vulnérables comme les enfants et les personnes enceintes.
Dans la présente évaluation des effets sur la santé, le paramètre déterminé pour l’énoxolone était une dose orale minimale entraînant un effet nocif observé de neurotoxicité pour le développement de 0,91 mg/kg p.c./j de glycyrrhizine chez les enfants exposés avant la naissance par la consommation maternelle pendant la grossesse (Räikkönen et al., 2009; Räikkönen et al., 2017). Des renseignements supplémentaires sur l’évaluation des effets sur la santé de l’énoxolone sont présentés dans la section 7.3.2.
7.4.3 Caractérisation des risques pour la santé humaine
En raison du peu de données sur les dangers disponibles pour l'essence de mimosa et leurs principaux composants (la lupénone et le lupéol), nous nous sommes servis de l’information sur les effets sur la santé de l’analogue énoxolone afin de caractériser les risques pour la santé humaine.
La concentration entraînant un effet critique établie pour l’énoxolone était une dose orale minimale avec effet nocif de neurotoxicité pour le développement observé inférieure ou égale à 500 mg/sem. (équivalant à 0,91 mg/kg p.c./j d’après l’apport minimal estimé par les auteurs qui entraîne des effets nocifs) de glycyrrhizine chez les enfants exposés avant la naissance par la consommation maternelle pendant la grossesse (Räikkönen et al., 2009; Räikkönen et al., 2017). Une diminution des capacités verbales et visuospatiales ainsi que de la mémoire narrative, une augmentation des symptômes d’extériorisation, et des problèmes d’attention, d’agression et de comportements contraires aux règles ont été observés chez les enfants à l’âge moyen de 8,1 ans. À l’âge moyen de 12,5 ans, les mêmes enfants ont obtenu des scores plus faibles aux tests de quotient intellectuel, avaient une moins bonne mémoire, et présentaient plus souvent un trouble de déficit d’attention avec hyperactivité. Les effets de neurotoxicité pour le développement sont corroborés par la capacité de l’énoxolone à perturber l’enzyme 11β-HSD placentaire dans son inactivation du cortisol avant que ce dernier n’atteigne le fœtus, ce qui augmente l’exposition du fœtus au cortisol (Blum et al., 1995; Benediktsson et al., 1997). De plus, en nous fondant sur la littérature (Siddique et al., 2011; Ruiz-Rodríguez et al., 2017; Ogunwole et al., 2019), nous avons déterminé que le lupéol et la lupénone (les principaux composants de l'essence de mimosa) pourraient être des perturbateurs endocriniens. Étant donné la gravité des effets sur le développement et l’incertitude entourant les effets de perturbation du système endocrinien et du développement neurologique qu’a l'essence de mimosa chez les fœtus et les enfants, ce point de départ a été jugé pertinent pour les personnes enceintes, allaitantes et en âge de procréer, les fœtus et les enfants.
Il a également été jugé pertinent pour tous les groupes d’âge et toutes les durées d’exposition.
Compte tenu des concentrations indiquées pour la lupénone (20 %) et le lupéol (7,8 %), nous avons supposé que la somme des principaux composants de l'essence de mimosa était de 30 %. Les estimations de l’exposition calculées pour cette substance ont été ajustées de 30 %.
Les estimations de l’exposition systémique quotidienne à l’essence de mimosa des groupes d’âge les plus exposés et les moins exposés qui découle des aromatisants alimentaires, des cosmétiques et des PSN, ainsi que les marges d’exposition résultantes, sont résumées dans le tableau 7-19. Les estimations de l’exposition systémique quotidienne à l’essence de mimosa qui découle des produits faits soi-même contenant cette substance, ainsi que les marges d’exposition résultantes, sont résumées dans le tableau 7-20.
| Scénario | % dans le produit | Voie d’exposition | Exposition systémique (mg/kg p.c./j) | MEa, b |
|---|---|---|---|---|
| Parfum (en applicateur à bille) (enfants de 2 à 3 ans à adultes) | 10 | Cutanée et inhalation | 5,59 × 10-2 (enfants de 14 à 18 ans) à 1,65 × 10-1 (enfants de 2 à 3 ans) | 6 (enfants de 2 à 3 ans) à 16 (enfants de 14 à 18 ans) |
| Parfum (en pulvérisateur) (enfants de 2 à 3 ans à adultes) | 3 | Cutanée et inhalation | 4,84 × 10-2 (enfants de 14 à 18 ans) à 1,42 × 10-1 (enfants de 2 à 3 ans) | 6 (enfants de 2 à 3 ans) à 19 (enfants de 14 à 18 ans) |
| Hydratant pour le corps (tous) | 10 | Cutanée | 1,01 (adultes) à 2,38 (bébés de 0 à 5 mois) | 0,38 (bébés de 0 à 5 mois) à 0,90 (adultes) |
| Hydratant pour le visage (enfants de 9 à 13 ans à adultes) | 10 | Cutanée | 1,81 x 10-1 (enfants de 14 à 18 ans) à 3,04 x 10-1 (adultes) | 3 (adultes) à 5 (enfants de 14 à 18 ans) |
| Hydratant pour les yeux (enfants de 14 à 18 ans à adultes) | 3 | Cutanée | 1,52 × 10-2 (adultes) à 1,81 × 10-2 (enfants de 14 à 18 ans) | 50 (enfants de 14 à 18 ans) à 60 (adultes) |
| Huile de massage (tous) | 0,3 | Cutanée | 9,73 × 10-3 (adultes) à 6,43 × 10-2 (bébés de 0 à 5 mois) | 14 (bébés de 0 à 5 mois) à 94 (adultes) |
| Pain de massage (adultes) | 1 | Cutanée | 3,24 × 10-2 (adultes) | 28 (adultes) |
| Déodorant ou antisudorifique (solide) (enfants de 9 à 13 ans à adultes) | 0,063 | Cutanée | 4,95 × 10-4 (enfants de 9 à 13 ans) à 8,38 × 10-4 (enfants de 14 à 18 ans) | 1 086 (enfants de 14 à 18 ans) à 1 838 (enfants de 9 à 13 ans) |
| Produit autobronzant (enfants de 9 à 13 ans à adultes) | 10 | Cutanée | 1,58 (enfants de 9 à 13 ans) à 3,08 (enfants de 14 à 18 ans) | 0,30 (enfants de 14 à 18 ans) à 0,58 (enfants de 9 à 13 ans) |
| Maquillant pour le visage (fond de teint liquide) (enfants de 4 à 8 ans à adultes) | 10 | Cutanée | 4,96 × 10-2 (enfants de 14 à 18 ans) à 1,11 × 10-1 (enfants de 4 à 8 ans) | 8 (enfants de 4 à 8 ans) à 18 (enfants de 14 à 18 ans) |
| Ombre à paupières (enfants de 4 à 8 ans à adultes) | 1 | Cutanée | 1,09 × 10-4 (enfants de 14 à 18 ans) à 2,93 × 10-4 (enfants de 4 à 8 ans) | 3 101 (enfants de 4 à 8 ans) à 8 359 (enfants de 14 à 18 ans) |
| Fard (enfants de 4 à 8 ans à adultes) | 1 | Cutanée | 1,32 × 10-4 (adultes) à 4,57 × 10-4 (enfants de 4 à 8 ans) | 1 993 (enfants de 4 à 8 ans) à 6 907 (adultes) |
| Rouge à lèvres (enfants de 2 à 3 ans à adultes) | 10 | Orale | 1,78 × 10-2 (adultes) à 4,40 × 10-2 (enfants de 2 à 3 ans) | 21 (enfants de 2 à 3 ans) à 51 (adultes) |
| Nettoyant pour le corps (liquide) (tous) | 0,3 | Cutanée | 4,68 × 10-4 (adultes) à 1,93 × 10-3 (bébés de 0 à 5 mois) | 472 (bébés de 0 à 5 mois) à 1 943 (adultes) |
| Nettoyant pour le visage (enfants de 9 à 13 ans à adultes) | 1 | Cutanée | 4,79 × 10-4 (enfants de 14 à 18 ans) à 6,64 × 10-4 (enfants de 9 à 13 ans) | 1 370 (enfants de 9 à 13 ans) à 1 900 (enfants de 14 à 18 ans) |
| Exfoliant pour le corps (enfants de 14 à 18 ans à adultes) | 0,3 | Cutanée | 3,39 × 10-3 (adultes) à 6,01 × 10-3 (enfants de 14 à 18 ans) | 152 (enfants de 14 à 18 ans) à 268 (adultes) |
| Exfoliant pour le visage (enfants de 14 à 18 ans à adultes) | 1 | Cutanée | 3,14 × 10-3 (adultes) à 3,75 × 10-3 (enfants de 14 à 18 ans) | 243 (enfants de 14 à 18 ans) à 290 (adultes) |
| Nettoyant (2 en 1 : shampooing et nettoyant pour le corps) (tous) | 1 | Cutanée | 3,00 × 10-3 (enfants de 2 à 3 ans) à 7,14 × 10-3 (bébés de 0 à 5 mois) | 127 (bébés de 0 à 5 mois) à 303 (enfants de 2 à 3 ans) |
| Produit pour le bain (mousse/bulles) (tous) | 1 | Cutanée | 1,40 × 10-4 (enfants de 9 à 13 ans) à 4,48 × 10-4 (enfants de 14 à 18 ans) | 2 031 (enfants de 14 à 18 ans) à 6 507 (enfants de 9 à 13 ans) |
| Démaquillant pour le visage (enfants de 4 à 8 ans à adultes) | 0,1 | Cutanée | 2,65 × 10-4 (adultes) à 7,11 × 10-4 (enfants de 4 à 8 ans) | 1 280 (enfants de 4 à 8 ans) à 3 436 (adultes) |
| Produit de coiffure (gel/cire/pâte) (enfants de 2 à 3 ans à adultes) | 1 | Cutanée | 3,75 × 10-3 (adultes) à 1,40 × 10-2 (enfants de 2 à 3 ans) | 65 (enfants de 2 à 3 ans) à 243 (adultes) |
| Fixatif pour cheveux (enfants de 4 à 8 ans à adultes) | 0,1 | Cutanée et inhalation | 2,37 × 10-4 (enfants de 14 à 18 ans) à 6,38 × 10-4 (enfants de 4 à 8 ans) | 1 427 (enfants de 4 à 8 ans) à 3 846 (enfants de 14 à 18 ans) |
| Produit de coiffure (mousse) (enfants de 2 à 3 ans à adultes) | 0,1 | Cutanée | 7,80 × 10-4 (adultes) à 2,05 × 10-3 (enfants de 2 à 3 ans) | 443 (enfants de 2 à 3 ans) à 1 166 (adultes) |
| Shampooing (tous) | 0,1 | Cutanée | 1,26 × 10-4 (enfants de 14 à 18 ans) à 4,64 × 10-4 (bébés de 0 à 5 mois) | 1 960 (bébés de 0 à 5 mois) à 7 233 (enfants de 14 à 18 ans) |
| Revitalisant (avec rinçage) (enfants de 2 à 3 ans à adultes) | 0,1 | Cutanée | 1,21 × 10-4 (enfants de 14 à 18 ans) à 2,60 × 10-4 (enfants de 2 à 3 ans) | 3 500 (enfants de 2 à 3 ans) à 7 523 (enfants de 14 à 18 ans) |
| Écran solaire (lotion) (PSN) (bébés de 6 à 11 mois à adultes) | 0,105 | Cutanée | 1,65 × 10-2 (enfants de 9 à 13 ans) à 7,48 × 10-2 (bébés de 6 à 11 mois) | 12 (bébés de 6 à 11 mois) à 55 (enfants de 9 à 13 ans) |
| Écran solaire (baume à lèvres) (PSN) (bébés de 6 à 11 mois à adultes) | 3,2 | Orale | 5,71 × 10-3 (adultes) à 2,32 × 10-2 (bébés de 6 à 11 mois) | 39 (bébés de 6 à 11 mois) à 159 (adultes) |
| Aromatisant alimentaire (enfants de 1 an et personnes plus âgées) | - | Orale | 1,14 × 10-5 (enfants de 1 an et personnes plus âgées) | 79 552 (enfants de 1 an et personnes plus âgées) |
Abréviations : ME = marge d’exposition; PSN = produit de santé naturel.
a La ME a été calculée à l’aide de la concentration d’énoxolone (analogue de lecture croisée) entraînant un effet critique (une DMENO de 0,91 mg/kg p.c./j), qui repose sur la neurotoxicité pour le développement.
b ME cible = 30 (10x pour la variation intraspécifique × 3x pour l’utilisation d’une DMENO). Les ME en gras sont considérées comme potentiellement inadéquates.
| Scénario | % dans le produit | Voie d’exposition | Exposition systémique (mg/kg p.c./j) | MEa, b |
|---|---|---|---|---|
| Diffuseur d’arôme ou assainisseur d’air (inhalation et remplissage) (enfants de 9 ans et personnes plus âgées) | 100 | Cutanée et inhalation | 0,70 (adultes) à 1,21 (enfants de 9 à 13 ans) | 0,75 (enfants de 9 à 13 ans) à 1,30 (adultes) |
| Diffuseur d’arôme ou assainisseur d’air (exposition des non-utilisateurs) (enfants de moins de 9 ans) | 100 | Inhalation | 0,39 (enfants de 4 à 8 ans) à 0,59 (enfants de 1 an) | 1,54 (enfants de 1 an) à 2,33 (enfants de 4 à 8 ans) |
| Huile de massage (tous) | 3 | Cutanée | 9,73 × 10-2 (adultes) à 6,43 x 10-1 (bébés de 0 à 5 mois) | 1 (bébés de 0 à 5 mois) à 9 (adultes) |
| Hydratant pour le corps (tous) | 3 | Cutanée | 0,30 (adultes) à 0,71 (bébés de 0 à 5 mois) | 1,27 (bébés de 0 à 5 mois) à 2,99 (adultes) |
| Brumisateur facial (application) (enfants de 4 à 8 ans à adultes) | 100 | Cutanée et inhalation | 3,39 × 10-9 (adultes) à 1,03 × 10-8 (enfants de 4 à 8 ans) | 8,85 x 107 (enfants de 4 à 8 ans) à 2,69 x 108 (adultes) |
| Brumisateur facial (exposition des non-utilisateurs) (enfants de 1 an) | 100 | Inhalation | 3,96 × 10-9 (enfants de 1 an) | 2,30 × 108 (enfants de 1 an) |
Abréviation : ME = marge d’exposition.
a La ME a été calculée à l’aide de la concentration d’énoxolone (analogue de lecture croisée) entraînant un effet critique (une DMENO de 0,91 mg/kg p.c./j), qui repose sur la neurotoxicité pour le développement.
b ME cible = 30 (10x pour la variation intraspécifique × 3x pour l’utilisation d’une DMENO). Les ME en gras sont considérées comme potentiellement inadéquates.
Les marges d’exposition entre la concentration entraînant un effet critique et les estimations de l’exposition quotidienne due à l’utilisation de l'essence de mimosa dans des parfums (en applicateur à bille et en pulvérisateur), des hydratants pour le corps, des hydratants pour le visage, des huiles de massage (enfants de 1 an et moins), des pains de massage, des produits autobronzants, des produits de maquillage pour le visage (fonds de teint liquides), des rouges à lèvres (enfants de 8 ans et moins) et des écrans solaires (lotions) (PSN) (enfants de 3 ans et moins et enfants de 14 à 18 ans) sont inférieures à la marge d’exposition cible de 30. Il est jugé qu’elles ne permettent peut-être pas de tenir adéquatement compte des incertitudes entourant les effets sur la santé et les données sur l’exposition ayant servi à caractériser les risques.
Ce jugement s’applique aussi aux marges d’exposition entre la concentration entraînant un effet critique et les estimations de l’exposition quotidienne découlant de l’utilisation de l'essence de mimosa dans des diffuseurs d’arôme ou assainisseurs d’air faits soi-même, des huiles de massage faites soi-même et des hydratants pour le corps faits soi-même, qui sont inférieures à la marge d’exposition cible de 30.
7.4.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Les principales sources d’incertitude sont présentées dans le tableau ci-dessous.
| Principales sources d’incertitude | Effet |
|---|---|
| La concentration des principaux composants des huiles essentielles varie selon l’origine et l’espèce de la plante, la température, le sol et la géographie. De ce fait, la composition des huiles essentielles dans les produits disponibles aux consommateurs est variable, ce qui constitue une incertitude dans l’évaluation. | +/- |
| Il existe une incertitude liée au facteur d’absorption cutanée utilisé pour l'essence de mimosa lorsque l’on se sert de l’énoxolone comme analogue de lecture croisée. | +/- |
| L’utilisation potentielle de plus d’un produit contenant la même substance par une même personne au cours d’une journée (c’est-à-dire l’exposition globale) n’a pas été examinée. Il pourrait en découler une sous-estimation de l’exposition de certaines personnes. | - |
| Il n’existe aucune donnée sur les dangers de l'essence de mimosa, et que des données limitées sur le lupéol et la lupénone. La lecture croisée des données de l’analogue, l’énoxolone, a servi à réaliser l’évaluation des risques pour la santé humaine. | +/- |
| Nous manquons de données sur les effets de l'essence de mimosa et de leurs principaux composants en ce qui a trait à la toxicité pour la reproduction et le développement ainsi que la neurotoxicité pour le développement. | +/- |
| Pour les scénarios d’exposition cutanée et par inhalation à l’essence de mimosa, nous avons effectué une extrapolation de voie à voie en utilisant une concentration entraînant un effet critique tirée d’une étude de toxicité par voie orale. | +/- |
+ = incertitude pouvant causer la surestimation de l’exposition ou du risque; - = incertitude pouvant causer la sous-estimation de l’exposition ou du risque; +/- = potentiel inconnu à causer une surestimation ou une sous-estimation du risque.
7.5 Extrait de lierre
7.5.1 Évaluation de l’exposition
Milieux environnementaux et aliments
Compte tenu des faibles quantités fabriquées et importées (< 100 kg) de la substance qui ont été déclarées en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada, 2013), nous ne nous attendons à aucune exposition à l’extrait de lierre par l’intermédiaire des milieux environnementaux. Nous n’avons trouvé aucun rapport sur la surveillance de l'extrait de lierre dans les milieux environnementaux au Canada ou ailleurs. Nous ne nous attendons pas à ce qu’au Canada, la population générale soit exposée à l’extrait de lierre dans des aliments (aliments ou aromatisants alimentaires) ou des emballages alimentaires.
Produits disponibles aux consommateurs
L'extrait de lierre est présent dans des produits disponibles aux consommateurs. Pour évaluer le potentiel d’exposition à cette substance provenant des cosmétiques et des PSN appliqués sur la peau, nous avons choisi des scénarios sentinelles en nous basant sur une combinaison de fréquences d’utilisation et de concentrations déclarées de la substance dans ces produits. Ces scénarios représentaient les expositions les plus élevées, par rapport aux autres cosmétiques appliqués sur la peau ainsi qu’aux PSN comprenant l'extrait de lierre comme ingrédient non médicinal, parmi les produits pour lesquels la présence de cette substance avait été déclarée. Les scénarios sentinelles examinés pour les applications cutanées portaient sur l’exposition à l’extrait de lierre due à l’utilisation de nettoyants (pour le visage et le corps), d’huiles de massage, d’hydratants (pour le corps, le visage et les yeux), de produits de maquillage pour le visage (fonds de teint liquides), de fixateurs de maquillage facial (en pulvérisateur), d’exfoliants (pour le visage et le corps), de démaquillants pour le visage, de produits pour le bain (mousses/bulles et sels), de revitalisants (avec et sans rinçage), de shampooings, de colorants capillaires (temporaires et permanents), de produits de coiffure (gels, mousses, fixatifs), d’adhésifs pour le corps et d’écrans solaires (poudres) (PSN).
Nous avons examiné l’utilisation d’extrait de lierre à une concentration de 100 % dans des produits faits soi-même, comme des huiles de massage et des hydratants pour le corps. Bien que la concentration maximale d'extrait de lierre utilisée dans des huiles de massage soit présumée être de 100 %, les huiles de massage sont généralement diluées avant leur utilisation. Il a donc été supposé que la concentration maximale de la substance dans ces produits était de 3 % (RIVM, 2006). Il est rapporté que les huiles essentielles et les extraits entrant dans des produits pour le corps sont habituellement dilués à des concentrations comprises entre 1 et 4 % (Tisserand Institute, 2021). À la lumière de cette information, il a été supposé que la concentration maximale d'extrait de lierre dans les hydratants pour le corps faits soi-même était de 3 %.
Nous n’avons trouvé aucune étude de l’absorption cutanée de l'extrait de lierre. Les composés à base de stéroïdes appelés hédéracoside C, hédéragénine et alpha-hédérine, qui sont des composants de l'extrait de lierre, ont des poids moléculaires de 1 221, 472 et 750 g/mol, respectivement, ainsi que des valeurs de log Koe supérieures à 4, sauf l’hédéracoside C (tableau 3-1). Puisque les propriétés physico-chimiques des principaux composants des extraits de lierre et d’autres triterpénoïdes visés par la présente évaluation sont semblables et qu’il n’existe aucune donnée sur l’absorption cutanée propre aux substances, nous avons adopté une approche de groupe dans le cadre de laquelle une même valeur a représenté l’absorption cutanée de tous les triterpénoïdes. Nous avons établi une absorption cutanée de 25 % aux sites occlus et non occlus de la peau en nous fondant sur l’information disponible. Des renseignements supplémentaires sur l’absorption cutanée sont fournis à la section 7.3.1, qui porte sur l’évaluation de l’exposition aux substances du sous-groupe 2 des triterpénoïdes.
L’exposition découlant des produits disponibles aux consommateurs devrait surtout se faire par la voie cutanée. Étant donné la pression de vapeur négligeable des principaux composants de l'extrait de lierre et les utilisations recensées, nous ne nous attendons pas à ce que l’inhalation soit une voie d’exposition importante. Nous avons néanmoins tenu compte de l’exposition par inhalation dans le cas des produits de maquillage facial en pulvérisateur, des fixatifs pour cheveux et des écrans solaires en poudre (PSN), afin d’estimer l’exposition systémique (somme de l’exposition cutanée et de l’exposition par inhalation) associée à ces produits.
Les estimations de l’exposition des groupes d’âge les moins exposés et les plus exposés qui découle des produits disponibles aux consommateurs sont résumées dans le tableau 7-22. Les estimations de l’exposition quotidienne due aux produits faits soi-même qui contiennent de l'extrait de lierre sont résumées dans le tableau 7-23.
| Scénario | % dans le produit | Voie d’exposition | Plage d’exposition systémique (mg/kg p.c./j)a |
|---|---|---|---|
| Nettoyant pour le visage | 3 | Cutanée | 2,40 × 10-3 (enfants de 14 à 18 ans) à 3,32 × 10-3 (enfants de 9 à 13 ans) |
| Huile de massage | 3 | Cutanée | 0,16 (adultes) à 1,07 (bébés de 0 à 5 mois) |
| Hydratant pour le corps | 5 | Cutanée | 0,84 (adultes) à 1,98 (bébés de 0 à 5 mois) |
| Hydratant pour le visage | 3 | Cutanée | 0,09 (enfants de 14 à 18 ans) à 0,15 (adultes) |
| Hydratant pour les yeux | 1 | Cutanée | 1,01 x 10-2 (enfants de 14 à 18 ans) à 1,69 x 10-2 (adultes) |
| Fixateur de maquillage facial (en pulvérisateur) | 6 | Cutanée et inhalation | 1,59 × 10-1 (adultes) à 4,24 × 10-1 (enfants de 4 à 8 ans) |
| Produit de maquillage pour le visage (fond de teint liquide) | 0,1 | Cutanée | 8,27 × 10-3 (enfants de 14 à 18 ans) à 1,85 × 10-2 (enfants de 4 à 8 ans) |
| Nettoyant pour le corps (liquide) | 0,1 | Cutanée | 2,60 × 10-4 (adultes) à 1,07 × 10-3 (bébés de 0 à 5 mois) |
| Exfoliant pour le visage | 1 | Cutanée | 5,25 × 10-3 (adultes) à 6,27 × 10-3 (enfants de 14 à 18 ans) |
| Démaquillant pour le visage | 0,2 | Cutanée | 1,31 × 10-3 (enfants de 9 à 13 ans) à 3,28 × 10-3 (enfants de 3 ans) |
| Exfoliant pour le corps | 30 | Cutanée | 0,56 (adultes) à 0,67 (enfants de 14 à 18 ans) |
| Produit pour le bain (mousse/bulles) | 0,3 | Cutanée | 6,99 × 10-5 (enfants de 9 à 13 ans) à 2,24 × 10-4 (enfants de 14 à 18 ans) |
| Produit pour le bain (sel) | 3 | Cutanée | 1,41 × 10-3 (adultes) à 1,80 × 10-3 (enfants de 9 à 13 ans) |
| Revitalisant (avec rinçage) | 1 | Cutanée | 2,02 × 10-3 (enfants de 14 à 18 ans) à 4,33 × 10-3 (enfants de 2 à 3 ans) |
| Shampooing | 3 | Cutanée | 6,29 × 10-3 (enfants de 14 à 18 ans) à 2,32 × 10-2 (bébés de 0 à 5 mois) |
| Colorant capillaire temporaire | 0,1 | Cutanée | 5,91 × 10-3 (adultes) à 1,90 × 10-2 (enfants de 4 à 8 ans) |
| Colorant capillaire permanent | 0,1 | Cutanée | 2,24 × 10-2 (adultes) à 2,67 × 10-2 (enfants de 14 à 18 ans) |
| Revitalisant capillaire (sans rinçage) | 3 | Cutanée | 6,05 × 10-2 (enfants de 14 à 18 ans) à 1,30 × 10-1 (enfants de 2 à 3 ans) |
| Produit de coiffure (gel) | 0,5 | Cutanée | 3,13 × 10-3 (adultes) à 1,17 × 10-2 (enfants de 2 à 3 ans) |
| Produit de coiffure (mousse) | 0,1 | Cutanée | 1,30 × 10-3 (adultes) à 4,75 × 10-3 (enfants de 2 à 3 ans) |
| Fixatif pour cheveux | 0,1 | Cutanée et inhalation | 1,38 x 10-3 (enfants de 14 à 18 ans) à 5,63 x 10-3 (adultes) |
| Adhésif pour le corps | 0,1 | Cutanée | 3,32 × 10-3 (adultes) à 4,27 × 10-3 (enfants de 14 à 18 ans) |
| Écran solaire (poudre) (PSN) | 0,1 | Cutanée et inhalation | 1,35 × 10-4 (adultes) |
Abréviation : PSN = produit de santé naturel.
a Voir l’annexe A pour connaître le détail des calculs. Les estimations de l’exposition ont été modifiées de 50 % pour tenir compte de la quantité maximale, dans l'extrait de lierre, des principaux composants qui se métabolisent en alpha-hédérine. Il a été supposé que l’absorption cutanée était de 25 %.
| Scénario | % dans le produit | Voie d’exposition | Plage d’exposition systémique (mg/kg p.c./j)a |
|---|---|---|---|
| Huile de massage | 3 | Cutanée | 1,62 × 10-1 (adultes) à 1,07 (bébés de 0 à 5 mois) |
| Hydratant pour le corps | 3 | Cutanée | 0,51 (adultes) à 1,19 (bébés de 0 à 5 mois) |
a Voir l’annexe B pour connaître le détail des calculs. Les estimations de l’exposition ont été modifiées de 50 % pour tenir compte de la quantité maximale, dans l'extrait de lierre, des principaux composants qui se métabolisent en alpha-hédérine. Il a été supposé que l’absorption cutanée était de 25 %.
7.5.2 Évaluation des effets sur la santé
Il existe peu d’évaluations internationales disponibles sur l'extrait de lierre. L’EMA a publié un rapport d’évaluation sur cette substance et examiné son utilisation en tant que produit médicinal à base de plante destiné au système respiratoire (EMA, 2017). Elle déconseille aux personnes enceintes et allaitantes d’utiliser la substance, en raison d’un manque de données et de la présence de l’alpha-hédérine parmi ses principaux composants. Il a été montré que l’alpha-hédérine perturbe la distribution du zinc chez la mère et entraîne des effets néfastes sur le développement des rats (EMA, 2017).
Il existe peu de données empiriques sur l'extrait de lierre. La base de données ne contient aucune étude de la génotoxicité, de la cancérogénicité ou de la toxicité pour la reproduction ou le développement.
Chez les rats, le principal composant d'extrait de lierre, l’alpha-hédérine, a encore pu être détecté dans le sang 3 heures après une seule exposition par voie orale à 1 000 mg/kg d’extrait de lierre. Cependant, il n’a pas été possible de mener des analyses sur les doses plus faibles, car le seuil de détection de l’alpha-hédérine indiquait une absorption potentiellement faible et une élimination rapide chez le rat (EMA, 2017). D’autres composants principaux, comme l’hédéracoside C, sont métabolisés en alpha-hédérine dans l’estomac (EMA, 2017).
Une seule étude à doses répétées d’extrait de lierre est disponible, sous forme de résumé dans le document de l’EMA (2017). L’exposition quotidienne par voie orale de rats (nombre et souche inconnus) à l'extrait de lierre à des concentrations de 0, 1 500 ou 4 000 mg/kg p.c./j pendant 100 jours n’a causé aucun effet toxique. Les paramètres hématologiques et biochimiques, les résultats histologiques et les poids des reins et du foie étaient normaux en comparaison à ceux des animaux témoins (EMA, 2017).
En raison de la popularité de l'extrait de lierre dans les remèdes naturels, plusieurs études de pharmacologie clinique sont disponibles.
Dans une étude, 268 enfants de 0 à 12 ans ont reçu par voie orale 0 mg/kg p.c./j ou entre 6,6 et 11 mg/kg p.c./j d’extrait de lierre sous forme de sirop ou de gouttes pour la toux ou la bronchite pendant 14 jours (Schmidt et al., 2012). Les effets nocifs rapportés étaient des diarrhées, des nausées, des vomissements et des dermatites. Ils ont disparu à l’arrêt du traitement.
Au cours d’une autre étude, 124 hommes et 206 femmes ayant une bronchite ont reçu par voie orale des comprimés contenant 25 mg d’extrait de lierre 2 fois par jour pendant une durée médiane de 8 jours, avant d’être évalués au moyen d’un questionnaire qui visait à évaluer la tolérabilité du traitement. Les résultats ont indiqué une tolérabilité bonne à très bonne. Les auteurs n’ont mesuré aucun paramètre et n’ont donné aucun autre détail sur l’état de santé des participants (Stauss-Grabo et al., 2011).
Une vaste étude a été réalisée auprès de 9 657 patients (188 de moins de un an, 2 822 de 1 à 5 ans, 1 843 de 6 à 12 ans, et 4 804 de plus de 12 ans). Ces personnes ont reçu par voie orale 52,2 à 157,5 mg (équivalant à entre 2,3 et 5,77 mg/kg p.c./j; aucun groupe témoin) d’extrait de lierre dans un sirop (Fazio et al., 2009). Les principaux effets nocifs notés par les auteurs étaient des troubles gastro-intestinaux, des diarrhées, des douleurs abdominales et épigastriques, des nausées et des vomissements (qui ont disparu à l’arrêt du traitement).
Dans le cadre de l’évaluation des effets sur la santé, nous avons examiné les renseignements sur les dangers disponibles sur les principaux composants de l'extrait de lierre, soit l’hédéracoside C (1,7 à 20 %), l’hédéragénine (7,4 à 18,4 %) et l’alpha-hédérine (0,8 à 2,3 %).
Hédéracoside C, hédéragénine et alpha-hédérine
Il n’existe aucune donnée empirique sur l’hédéracoside C, et que des données limitées sur l’hédéragénine et l’alpha-hédérine.
Une étude in vitro a révélé que l’hédéragénine pouvait inhiber l’enzyme 11β-HSD1 chez la souris (Yan et al., 2021).
L’alpha-hédérine n’a montré aucun potentiel de mutagénicité au cours d’un test d’Ames utilisant le Salmonella typhimurium, avec et sans activation métabolique (EMA, 2017).
Deux études de la toxicité pour le développement ont révélé une diminution du poids fœtal et une augmentation des anomalies fœtales telles qu’un retard dans l’ossification du squelette, un encéphalocèle ou une hernie ombilicale, et une résorption chez les rats gravides ayant reçu une dose comprise entre 0 et 225 µg/kg p.c./j au jour de gestation 11 ou du jour de gestation 6 au jour de gestation 15 par injection sous-cutanée (Daston et al., 1994; Duffy et al., 1997). Les auteurs des études ont montré que ces effets sur le développement étaient induits par l’augmentation des concentrations hépatiques de métallothionéine chez la mère causée par l’alpha-hédérine, qui avait entraîné une réduction des concentrations de Fe et de Zn dans le plasma maternel.
En raison des données limitées disponibles sur les effets sur la santé de l’hédéracoside C, de l’hédéragénine et de l’alpha-hédérine, nous avons adopté une approche de lecture croisée. L’analogue le plus convenable pour lequel la boîte à outils QSAR de l’OCDE (2019) contenait des données empiriques était l’énoxolone, une substance qui présente des structures et des métabolites semblables à ceux de l’hédéragénine et de l’alpha-hédérine, comme l’indique le simulateur in vivo du métabolisme chez le rat. Il partage également avec l’hédéragénine une alerte de liaison avec les récepteurs des œstrogènes (liaison forte). Les 4 substances sont des triterpénoïdes pentacycliques comportant un cycloalcane, des groupes alcooliques et des carbocycles saturés fusionnés. De plus, l’énoxolone et l’hédéragénine peuvent inhiber l’enzyme 11β-HSD chez les rongeurs. L’hédéragénine C ne figure pas dans la boîte à outils QSAR de l’OCDE (2019). Nous avons choisi l’analogue en nous fondant sur la capacité commune d’interférence avec le développement du fœtus. Ce choix protège donc les populations vulnérables comme les enfants et les personnes enceintes.
Dans la présente évaluation des effets sur la santé, le paramètre déterminé était une dose orale minimale entraînant un effet nocif observé de neurotoxicité pour le développement de 0,91 mg/kg p.c./j chez les enfants exposés avant la naissance par la consommation maternelle pendant la grossesse (Räikkönen et al., 2009; Räikkönen et al., 2017). Des renseignements supplémentaires sur l’évaluation des effets sur la santé de l’énoxolone sont présentés dans la section 7.3.2.
7.5.3 Caractérisation des risques pour la santé humaine
En raison du peu de données sur les dangers disponibles pour l'extrait de lierre et leurs principaux composants (hédéracoside C, hédéragénine et alpha-hédérine), nous nous sommes servi de l’information sur les effets sur la santé de l’analogue énoxolone afin de caractériser les risques pour la santé humaine.
La concentration entraînant un effet critique établie pour l’énoxolone était une dose orale minimale avec effet nocif de neurotoxicité pour le développement observé inférieure ou égale à 500 mg/sem. (équivalant à 0,91 mg/kg p.c./j d’après l’apport minimal estimé par les auteurs qui entraîne des effets nocifs) de glycyrrhizine chez les enfants exposés avant la naissance par la consommation maternelle pendant la grossesse (Räikkönen et al., 2009; Räikkönen et al., 2017). Une diminution des capacités verbales et visuospatiales ainsi que de la mémoire narrative, une augmentation des symptômes d’extériorisation, et des problèmes d’attention, d’agression et de comportements contraires aux règles ont été observés chez les enfants à l’âge moyen de 8,1 ans. À l’âge moyen de 12,5 ans, les mêmes enfants ont obtenu des scores plus faibles aux tests de quotient intellectuel, avaient une moins bonne mémoire, et présentaient plus souvent un trouble de déficit d’attention avec hyperactivité. Les effets de neurotoxicité pour le développement sont corroborés par la capacité de l’énoxolone à perturber l’enzyme 11β-HSD placentaire dans son inactivation du cortisol avant que ce dernier n’atteigne le fœtus, ce qui augmente l’exposition du fœtus au cortisol (Blum et al., 1995; Benediktsson et al., 1997). Étant donné la gravité des effets nocifs sur le développement et l’incertitude entourant les effets de perturbation du système endocrinien et du développement neurologique qu’a l'extrait de lierre chez les fœtus et les enfants, ce point de départ a été jugé pertinent pour les personnes enceintes, allaitantes et en âge de procréer, les fœtus et les enfants.
Compte tenu des concentrations rapportées de l’hédéracoside C (1,7 à 20 %), de l’hédéragénine (7,4 à 18,4 %) et de l’alpha-hédérine (0,8 à 2,3 %), ainsi que du fait que l’hédéracoside C est métabolisé en alpha-hédérine dans l’estomac, nous avons supposé que la somme des composants principaux de l'extrait de lierre était de 50 %, et avons modifié de cette valeur les estimations calculées de l’exposition à cette substance.
Les estimations de l’exposition quotidienne des groupes d’âge les plus exposés et les moins exposés qui découle des produits disponibles aux consommateurs, ainsi que les marges d’exposition résultantes, sont résumées dans le tableau 7-24. En outre, les estimations de l’exposition quotidienne des groupes d’âge les plus exposés et les moins exposés qui découle des produits faits soi-même, ainsi que les marges d’exposition résultantes, sont résumées dans le tableau 7-25.
| Scénario | % dans le produit | Voie d’exposition | Exposition systémique (mg/kg p.c./j) | MEa, b |
|---|---|---|---|---|
| Nettoyant pour le visage (enfants de 9 à 13 ans à adultes) | 3 | Cutanée | 2,40 × 10-3 (enfants de 14 à 18 ans) à 3,32 × 10-3 (enfants de 9 à 13 ans) | 274 (enfants de 9 à 13 ans) à 380 (enfants de 14 à 18 ans) |
| Huile de massage (tous) | 3 | Cutanée | 0,16 (adultes) à 1,07 (bébés de 0 à 5 mois) | 0,85 (bébés de 0 à 5 mois) à 5,61 (adultes) |
| Hydratant pour le corps (tous) | 5 | Cutanée | 0,84 (adultes) à 1,98 (bébés de 0 à 5 mois) | 0,46 (bébés de 0 à 5 mois) à 1,08 (adultes) |
| Hydratant pour le visage (enfants de 9 à 13 ans à adultes) | 3 | Cutanée | 9,07 × 10-2 (enfants de 14 à 18 ans) à 1,52 ×10-1 (adultes) | 6 (adultes) à 10 (enfants de 14 à 18 ans) |
| Hydratant pour les yeux (enfants de 14 à 18 ans à adultes) | 1 | Cutanée | 1,01 x 10-2 (enfants de 14 à 18 ans) à 1,69 x 10-2 (adultes) | 54 (adultes) à 90 (enfants de 14 à 18 ans) |
| Fixateur de maquillage facial (en pulvérisateur) (enfants de 4 à 8 ans à adultes) | 6 | Cutanée et inhalation | 1,59 × 10-1 (adultes) à 4,24 × 10-1 (enfants de 4 à 8 ans) | 2 (enfants de 4 à 8 ans) à 6 (adultes) |
| Produit de maquillage pour le visage (fond de teint liquide) (enfants de 4 à 8 ans à adultes) | 0,1 | Cutanée | 8,27 × 10-3 (enfants de 14 à 18 ans) à 1,85 × 10-2 (enfants de 4 à 8 ans) | 49 (enfants de 4 à 8 ans) à 110 (enfants de 14 à 18 ans) |
| Nettoyant pour le corps (liquide) (tous) | 0,1 | Cutanée | 2,60 × 10-4 (adultes) à 1,07 × 10-3 (bébés de 0 à 5 mois) | 849 (bébés de 0 à 5 mois) à 3 498 (adultes) |
| Exfoliant pour le visage (enfants de 14 à 18 ans à adultes) | 1 | Cutanée | 5,25 × 10-3 (adultes) à 6,27 × 10-3 (enfants de 14 à 18 ans) | 145 (enfants de 14 à 18 ans) à 173 (adultes) |
| Démaquillant pour le visage (enfants de 3 ans à adultes) | 0,2 | Cutanée | 1,31 × 10-3 (enfants de 9 à 13 ans) à 3,28 × 10-3 (enfants de 3 ans) | 278 (enfants de 3 ans) à 695 (enfants de 9 à 13 ans) |
| Exfoliant pour le corps (enfants de 14 à 18 ans à adultes) | 30 | Cutanée | 0,56 (adultes) à 0,67 (enfants de 14 à 18 ans) | 1,37 (enfants de 14 à 18 ans) à 1,63 (adultes) |
| Produit pour le bain (mousse/bulles) (tous) | 0,3 | Cutanée | 6,99 × 10-5 (enfants de 9 à 13 ans) à 2,24 × 10-4 (enfants de 14 à 18 ans) | 4 062 (enfants de 14 à 18 ans) à 13 014 (enfants de 9 à 13 ans) |
| Produit pour le bain (sel) (enfants de 9 à 13 ans à adultes) | 3 | Cutanée | 1,41 × 10-3 (adultes) à 1,80 × 10-3 (enfants de 9 à 13 ans) | 507 (enfants de 9 à 13 ans) à 647 (adultes) |
| Revitalisant (avec rinçage) (enfants de 2 à 3 ans à adultes) | 1 | Cutanée | 2,02 × 10-3 (enfants de 14 à 18 ans) à 4,33 × 10-3 (enfants de 2 à 3 ans) | 210 (enfants de 2 à 3 ans) à 451 (enfants de 14 à 18 ans) |
| Shampooing (tous) | 3 | Cutanée | 6,29 × 10-3 (enfants de 14 à 18 ans) à 2,32 × 10-2 (bébés de 0 à 5 mois) | 39 (bébés de 0 à 5 mois) à 145 (enfants de 14 à 18 ans) |
| Colorant capillaire temporaire (enfants de 4 à 8 ans à adultes) | 0,1 | Cutanée | 5,91 × 10-3 (adultes) à 1,90 × 10-2 (enfants de 4 à 8 ans) | 48 (enfants de 4 à 8 ans) à 154 (adultes) |
| Colorant capillaire permanent (enfants de 14 à 18 ans à adultes) | 0,1 | Cutanée | 2,24 × 10-2 (adultes) à 2,67 × 10-2 (enfants de 14 à 18 ans) | 34 (enfants de 14 à 18 ans) à 41 (adultes) |
| Revitalisant capillaire (sans rinçage) (enfants de 4 à 8 ans à adultes) | 3 | Cutanée | 6,05 × 10-2 (enfants de 14 à 18 ans) à 1,30 × 10-1 (enfants de 2 à 3 ans) | 7 (enfants de 2 à 3 ans) à 15 (enfants de 14 à 18 ans) |
| Produit de coiffure (gel) (enfants de 2 à 3 ans à adultes) | 0,5 | Cutanée | 3,13 × 10-3 (adultes) à 1,17 × 10-2 (enfants de 2 à 3 ans) | 78 (enfants de 2 à 3 ans) à 291 (adultes) |
| Produit de coiffure (mousse) (enfants de 2 à 3 ans à adultes) | 0,1 | Cutanée | 1,30 × 10-3 (adultes) à 4,75 × 10-3 (enfants de 2 à 3 ans) | 192 (enfants de 2 à 3 ans) à 700 (adultes) |
| Fixatif pour cheveux (enfants de 4 à 8 ans à adultes) | 0,1 | Cutanée et inhalation | 1,38 x 10-3 (enfants de 14 à 18 ans) à 5,63 x 10-3 (adultes) | 162 (adultes) à 658 (enfants de 14 à 18 ans) |
| Adhésif pour le corps (enfants de 14 à 18 ans à adultes) | 0,1 | Cutanée | 3,32 × 10-3 (adultes) à 4,27 × 10-3 (enfants de 14 à 18 ans) | 213 (enfants de 14 à 18 ans) à 274 (adultes) |
| Écran solaire (poudre) (PSN) (adultes) | 0,1 | Cutanée et inhalation | 1,35 × 10-4 (adultes) | 6 749 (adultes) |
Abréviations : ME = marge d’exposition; PSN = produit de santé naturel.
a La ME a été calculée à l’aide de la concentration d’énoxolone (analogue de lecture croisée) entraînant un effet critique (une DMENO de 0,91 mg/kg p.c./j), qui repose sur la neurotoxicité pour le développement.
b ME cible = 30 (10x pour la variation intraspécifique × 3x pour l’utilisation d’une DMENO). Les ME en gras sont considérées comme potentiellement inadéquates.
| Scénario | % dans le produit | Voie d’exposition | Exposition systémique (mg/kg p.c./j) | MEa, b |
|---|---|---|---|---|
| Huile de massage (tous) | 3 | Cutanée | 0,16 (adultes) à 1,07 (bébés de 0 à 5 mois) | 0,85 (bébés de 0 à 5 mois) à 5,61 (adultes) |
| Hydratant pour le corps (tous) | 3 | Cutanée | 0,51 (adultes) à 1,19 (bébés de 0 à 5 mois) | 0,76 (bébés de 0 à 5 mois) à 1,80 (adultes) |
Abréviation : ME = marge d’exposition.
a La ME a été calculée à l’aide de la concentration entraînant un effet critique (une DMENO de 0,91 mg/kg p.c./j), qui repose sur la neurotoxicité pour le développement.
b ME cible = 30 (10x pour la variation intraspécifique × 3x pour l’utilisation d’une DMENO). Les ME en gras sont considérées comme potentiellement inadéquates.
Les marges d’exposition entre la concentration entraînant un effet critique et les estimations de l’exposition quotidienne découlant de l’utilisation de l'extrait de lierre dans des huiles de massage, des hydratants pour le corps, des hydratants pour le visage, des fixateurs de maquillage facial (en pulvérisateur), des exfoliants pour le corps et des revitalisants capillaires (sans rinçage) sont inférieures à la marge d’exposition cible de 30. Il est jugé qu’elles ne permettent peut-être pas de tenir adéquatement compte des incertitudes entourant les effets sur la santé et les données sur l’exposition ayant servi à caractériser les risques.
Ce jugement s’applique aussi aux marges d’exposition entre la concentration entraînant un effet critique et les estimations de l’exposition quotidienne découlant de l’utilisation de l'extrait de lierre dans des huiles de massage faites soi-même et des hydratants pour le corps faits soi-même, qui sont inférieures à la marge d’exposition cible de 30.
7.5.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Les principales sources d’incertitude sont présentées dans le tableau ci-dessous.
| Principales sources d’incertitude | Effet |
|---|---|
| La concentration des principaux composants de l'extrait varie selon l’origine et l’espèce de la plante, la température, le sol et la géographie. De ce fait, la composition de l'extrait dans les produits disponibles aux consommateurs est variable, ce qui constitue une incertitude dans l’évaluation. | +/- |
| Il existe une incertitude liée au facteur d’absorption cutanée utilisé pour l'extrait de lierre lorsque l’on se sert de l’énoxolone comme analogue de lecture croisée. | +/- |
| L’utilisation potentielle de plus d’un produit contenant la même substance par une même personne au cours d’une journée (c’est-à-dire l’exposition globale) n’a pas été examinée. Il pourrait en découler une sous-estimation de l’exposition de certaines personnes. | - |
| Il n’existe que des données limitées sur les dangers de l'extrait de lierre, et aucune donnée sur l’hédéracoside C, l’hédéragénine ou l’alpha-hédérine. La lecture croisée des données de l’analogue, l’énoxolone, a servi à réaliser l’évaluation des risques pour la santé humaine. | +/- |
| Nous manquons de données sur les effets de l'extrait de lierre et de leurs principaux composants en ce qui a trait à la toxicité pour la reproduction et le développement ainsi que la neurotoxicité pour le développement. | +/- |
| Pour les scénarios d’exposition cutanée et par inhalation à l’extrait de lierre, nous avons effectué une extrapolation de voie à voie en utilisant une concentration entraînant un effet critique tirée d’une étude de toxicité par voie orale. | +/- |
+ = incertitude pouvant causer la surestimation de l’exposition ou du risque; - = incertitude pouvant causer la sous-estimation de l’exposition ou du risque; +/- = potentiel inconnu à causer une surestimation ou une sous-estimation du risque.
7.6 Extrait de ginseng à 5 folioles
7.6.1 Évaluation de l’exposition
Milieux environnementaux
Compte tenu des faibles quantités fabriquées et importées (< 100 kg) de la substance qui ont été déclarées en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada, 2013), nous ne nous attendons à aucune exposition à l’extrait de ginseng à 5 folioles par l’intermédiaire des milieux environnementaux.
Aliments
Nous ne nous attendons pas à ce qu’au Canada, la population générale soit exposée à l’extrait de ginseng à 5 folioles en raison de l’utilisation de cette substance comme aromatisant alimentaire ou dans des emballages alimentaires. L’extrait de ginseng à 5 folioles est obtenu à partir de matériel végétal de la plante qui donne son nom à l’extrait (Burdock, 2010). Il ne devrait y avoir que peu, sinon pas du tout, d’exposition par voie alimentaire à cette substance en raison de sa présence naturelle dans des aliments (communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, 2021; source non citée).
Produits disponibles aux consommateurs
L’extrait de ginseng à 5 folioles est présent dans des produits disponibles aux consommateurs. L’exposition à celui-ci par les voies orale et cutanée peut découler de l’utilisation de PSN et de cosmétiques (par exemple bains de bouche, dentifrices, parfums, produits de maquillage, hydratants, nettoyants et produits de soins capillaires). Puisque nous considérons que l’extrait de ginseng à 5 folioles présente un faible potentiel de danger (des renseignements supplémentaires sont donnés dans la section 7.6.2 ci-dessous), nous n’avons pas estimé quantitativement les expositions potentielles.
7.6.2 Évaluation des effets sur la santé
Il n’existe aucune donnée empirique ni évaluation internationale sur l’extrait de ginseng à 5 folioles. De ce fait, nous avons employé une approche de lecture croisée et examiné les renseignements sur les dangers de l’analogue, soit le ginseng asiatique (Panax ginseng), lors de notre évaluation des effets sur la santé. Comme le ginseng à 5 folioles, le ginseng asiatique se compose de centaines de ginsénosides, qui constituent les principaux composants biologiquement actifs (CIR, 2012; Chen et al., 2019). Ceux-ci se trouvent surtout dans la racine principale, les radicelles et les rhizomes (Chen et al., 2020). Par ailleurs, le terme Panax ginseng semble être utilisé indifféremment pour les 2 types de ginseng (Burdock, 2010; CIR, 2012).
L’EMA a réalisé une évaluation des risques portant sur les effets sur la santé et la sécurité du Panax ginseng et déterminé que les humains pouvaient consommer de manière sécuritaire une dose allant de 1 000 à 3 000 mg/j pendant 3 mois (EMA, 2014).
Plusieurs études de l’exposition de courte durée (15 à 25 jours) et de longue durée (90 jours) de rongeurs et de chiens recevant oralement de 1,5 à 100 mg/kg p.c./j de Panax ginseng par gavage ou dans l’eau potable n’ont révélé aucun effet nocif (CIR, 2012).
De plus, le NTP a mené des études sur la toxicologie et la cancérogénicité du Panax ginseng. Dans l’une d’elles, les auteurs ont conclu n’avoir observé aucun effet nocif chez des souris B6C3F1 ou des rats F344/N ayant reçu par gavage des doses de Panax ginseng pouvant atteindre 5 000 mg/kg p.c./j 5 jours par semaine pendant 3 mois (NTP, 2011).
Au cours d’une étude de la cancérogénicité, des souris B6C3F1 ou des rats F344/N ont reçu par gavage de 0 à 5 000 mg/kg p.c./j de Panax ginseng 5 jours par semaine pendant 2 ans (NTP, 2011). Les auteurs ont observé une diarrhée intermittente et une inflammation de l’épithélium respiratoire chez les rats femelles exposés à la dose de 5 000 mg/kg p.c./j ainsi qu’une tendance significativement négative de l’incidence de fibroadénomes dans la glande mammaire des rats femelles. Chez les souris, ils ont noté une diarrhée intermittente chez les mâles exposés à la dose de 5 000 mg/kg p.c./j. Dans l’ensemble, ils n’ont constaté aucun effet nocif ou cancérogène causé par le Panax ginseng jusqu’à la dose de 5 000 mg/kg p.c./j.
Le Panax ginseng ne s’est pas avéré génotoxique au cours d’un test des micronoyaux avec des souris B6C3F1 et d’un test d’Ames utilisant les souches TA97, TA98, TA100, TA102, TA104 et TA1535 de Salmonella typhimurium, avec et sans activation métabolique (NTP, 2011).
Lors de 2 études de la reproduction chez le mâle, des rats Wistar mâles ont reçu 0 ou 500 mg/kg p.c./j de Panax ginseng par gavage pendant 28 ou 50 jours (Akram et al., 2012; Hosseini et al., 2018). Les auteurs n’ont observé aucun effet nocif ou sur la reproduction.
Dans le cadre d’une étude du développement, des rates Wistar gravides (10/dose) ont reçu par gavage 0 ou 20 mg/kg p.c./j de Panax ginseng du jour de gestation 6 au jour de gestation 15 (Elsaieed et Nada, 2002). Les auteurs n’ont observé aucun effet nocif ou sur le développement.
Durant une étude de la toxicité pour la reproduction portant sur 2 générations, des rats Sprague-Dawley mâles et femelles (15/dose/sexe) ont consommé 0, 1,5, 5 ou 15 mg/kg p.c./j de Panax ginseng 3 semaines avant l’accouplement et pendant l’accouplement. Les femelles ont également été exposées pendant la gestation et l’allaitement. À son sevrage, la progéniture F1 a commencé à suivre le traitement, qui s’est poursuivi jusqu’à l’accouplement au 90e jour après la naissance. La progéniture F2 a été élevée jusqu’au 21e jour après la naissance (Hess et al., 1982). Les auteurs n’ont observé aucun effet nocif, sur le développement ou sur la reproduction.
Au cours de plusieurs études cliniques, des volontaires ont consommé quotidiennement entre 105 et 4 500 mg d’extrait de Panax ginseng sur une période allant de quelques jours à 9 mois (Coon et Ernst, 2002). Aucun effet nocif lié à cette consommation n’a été observé.
En nous fondant sur l’information disponible, nous n’avons cerné aucun effet préoccupant pour la santé causé par le Panax ginseng ou le ginseng à 5 folioles.
7.6.3 Caractérisation des risques pour la santé humaine
Nous n’avons cerné aucun effet préoccupant pour la santé causé par l’extrait de ginseng à 5 folioles en nous fondant sur l’information disponible. Pour cette raison, nous n’avons établi aucun point de départ et adopté une approche qualitative pour caractériser les risques. Nous considérons ainsi que l’exposition de la population générale à l’extrait de ginseng à 5 folioles présente un risque faible pour la santé humaine.
8. Prise en compte des sous-groupes de la population qui peuvent être plus sensibles ou plus exposés
L’évaluation des effets sur la santé humaine causés par chaque substance a tenu compte des sous-groupes de la population canadienne qui pourraient être plus susceptibles de subir des effets nocifs en raison d’une plus grande sensibilité ou exposition. Certains sous-groupes, comme les nourrissons, les enfants et les personnes en âge de procréer, sont régulièrement étudiés tout au long de l’évaluation. Par exemple, les expositions spécifiques à l’âge sont systématiquement estimées, et les études de toxicité pour le développement et la reproduction sont examinées à la recherche de potentiels effets nocifs sur la santé. Ces sous-groupes potentiellement plus exposés ou plus sensibles ont été pris en compte dans les résultats de l’évaluation des risques pour la santé humaine.
9. Conclusion
Compte tenu de tous les éléments de preuve contenus dans la présente ébauche d’évaluation, les 14 substances du Groupe des sesquiterpènes tricycliques et des triterpénoïdes présentent un faible risque d’effets nocifs sur l’environnement. Il est proposé de conclure que les 14 substances du Groupe des sesquiterpènes tricycliques et des triterpénoïdes ne satisfont pas aux critères énoncés aux alinéas 64a) ou b) de la LCPE, car elles ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
À la lumière des renseignements contenus dans la présente ébauche d’évaluation, il est proposé de conclure que l'essence de bois de cèdre, l'essence de bois de cèdre du Texas, l’énoxolone, l'essence de mimosa et l'extrait de lierre satisfont aux critères énoncés à l’alinéa 64c) de la LCPE, car ils pénètrent ou peuvent pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines. À la lumière des renseignements contenus dans la présente ébauche d’évaluation, il est proposé de conclure que l’alpha-cédrène, le thujopsène, l’alpha-gurjunène, le bêta-patchoulène, le bêta-cédrène, les terpènes et terpénoïdes de l’essence de cèdre, l’acétate amboryle, l’acide glycyrrhétinique préparé avec l’allantoïne, et l’extrait de ginseng à 5 folioles ne satisfont pas aux critères énoncés à l’alinéa 64c) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est proposé de conclure que l'essence de bois de cèdre, l'essence de bois de cèdre du Texas, l’énoxolone, l'essence de mimosa et l'extrait de lierre satisfont à un ou plusieurs des critères énoncés à l’article 64 de la LCPE, et que l’alpha-cédrène, le thujopsène, l’alpha-gurjunène, le bêta-patchoulène, le bêta-cédrène, les terpènes et terpénoïdes de l’essence de cèdre, l’acétate amboryle, l’acide glycyrrhétinique préparé avec l’allantoïne, et l’extrait de ginseng à 5 folioles ne satisfont à aucun des critères énoncés à l’article 64 de la LCPE.
Références
Avis sur les langues officielles
Les publications d’Environnement et Changement climatique Canada sont conformes à la Loi sur les langues officielles. Le Ministère s’est engagé à publier les renseignements en français et en anglais. Toutefois, les utilisateurs doivent savoir que certains documents cités à l’appui des données proviennent de sources non gouvernementales ou non canadiennes et ont été publiés dans la langue dans laquelle ils ont été rédigés. Citons notamment les publications d’organisations étrangères et les articles parus dans des revues savantes qui ne sont pas assujettis à cette Loi.
Aberchane M., Fechtal M., Chaouch A. 2004. Analysis of Moroccan atlas cedarwood oil (Cedrus atlantica Manetti). J Essent Oil Res. 16(6):542-547. DOI: 10.1080/10412905.2004.9698793. (Disponible en anglais seulement)
[ACI] American Cleaning Institute [base de données]. 2021. Washington (DC): ACI. [Consulté en juin 2021]. (Disponible en anglais seulement)
Akram H., Ghaderi Pakdel F., Ahmadi A., Zare S. 2012. Beneficial effects of American ginseng on epididymal sperm analyses in cyclophosphamide treated rats. Cell J. 14(2):116-121. (Disponible en anglais seulement)
[ANSES] Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail. 2022. Effets indésirables induits par la réglisse consommée dans le cadre alimentaire : étude des cas enregistrés par les centres antipoison (de janvier 2012 à décembre 2021), Rapport d’étude de toxicovigilance. Réglisse - 2022-AUTO-0077. Maison-Alford (FR): ANSES. 26 p.
Arnot J.A., Arnot M.I., Mackay D., Couillard Y., MacDonald D., Bonnell M., Doyle P. 2010. Molecular size cutoff criteria for screening bioaccumulation potential: fact or fiction? Integr Environ Assess Manag. 6(2):210-224. (Disponible en anglais seulement)
Assinewe V.A., Baum B.R., Gagnon D., Arnason J.T. 2003. Phytochemistry of wild populations of Panax quinquefolius L. (North American ginseng). J Agric Food Chem. 51(16):4549-4553. DOI: 10.1021/jf030042h. (Disponible en anglais seulement)
Baharara H., Moghadam A.T., Sahebkar A., Emami S.A., Tayebi T., Mohammadpour A.H. 2021. The effects of ivy (Hedera helix) on respiratory problems and cough in humans: a review. Adv Exp Med Biol. 1328:361-376. (Disponible en anglais seulement)
Ballin N.Z., Larsen D.M., Jensen S.T., Andersen L.B., Olesen P.T. 2023. Glycyrrhizinic acid in licorice products on the Danish market. Food Control. 143:109322. DOI: 10.1016/j.foodcont.2022.109322. (Disponible en anglais seulement)
Bánsághi S., Soule H., Guitart C., Pittet D., Haidegger T. 2020. Critical reliability issues of common type alcohol-based handrub dispensers. Antimicrob Resist Infect Control. 9(1):90. (Disponible en anglais seulement)
[BDIPSN] [Base de données d’ingrédients de produits de santé naturels] [base de données]. [Modifié le 19 mars 2024]. Ottawa (Ont.), gouvernement du Canada. [Consulté en juin 2024].
[BDPP] Base de données sur les produits pharmaceutiques [base de données ]. [Modifié le 3 nov. 2021]. Ottawa (Ont.), gouvernement du Canada. [Consulté en juillet 2021].
[BDPSNH] Base de données des produits de santé naturels homologués [base de données]. [Modifié le 10 avril 2024]. Ottawa (Ont.), gouvernement du Canada. [Consulté en juin 2024].
Becker L.C., Bergfeld W.F., Belsito D.V., Klaassen C.D., Marks Jr J.G., Shank R.C., Slaga T.J., Snyder P.W., Andersen F.A. 2010. Final report of the safety assessment of allantoin and its related complexes. Int J Toxicol. 29(3 Suppl):84S-97S. DOI: 10.1177/1091581810362805. (Disponible en anglais seulement)
Becker L.C., Bergfeld W.F., Belsito D.V., Hill R.A., Klaassen C.D., Liebler D.C., Marks Jr J.G., Shank R.C., Slaga T.J., Snyder P.W., et al. 2015. Safety assessment of Panax spp root-derived ingredients as used in cosmetics. Int J Toxicol. 34(3 Suppl):5S-42S. DOI: 10.1177/1091581815610508. (Disponible en anglais seulement)
Belsito D., Bickers D., Bruze M.L.U., Calow P., Dagli M.L., Fryer A.D., Greim H., Miyachi Y., Saurat J.H., Sipes I.G. 2013. A toxicological and dermatological assessment of alkyl cyclic ketones when used as fragrance ingredients. The RIFM expert panel. Food Chem Toxicol. 62(1 Suppl):S1-44. (Disponible en anglais seulement)
Benediktsson R., Calder A.A., Edwards C.R.W., Seckl J.R. 1997. Placental 11 beta-hydroxysteroid dehydrogenase: a key regulator of fetal glucocorticoid exposure. Clin Endocrinol (Oxf). 46(2):161-166. DOI: 10.1046/j.1365-2265.1997.1230939.x. (Disponible en anglais seulement)
Bezruk I., Kotvitska A., Korzh I., Materiienko A., Gubar S., Budanova L., Ivanauskas L., Vyshnevsky I., Georgiyants V. 2020. Combined approach to the choice of chromatographic methods for routine determination of hederacoside C in ivy leaf extracts, capsules, and syrup. Sci Pharm. 88(2):24. DOI: 10.3390/scipharm88020024. (Disponible en anglais seulement)
Bhatia S.P., McGinty D., Letizia C.S., Api A.M. 2008. Fragrance material review on cedrol. Food Chem Toxicol. 46(11):S100-S102. DOI: 10.1016/j.fct.2008.06.038. (Disponible en anglais seulement)
Blum S., Bühler H., Lichtenstein I., Siebe H. 1995. Characterization of human placental 11β-hydroxysteroid dehydrogenase, a key enzyme of corticosteroid metabolism. Cell Physiol Biochem. 5(3):167-175. DOI: 10.1159/000154751. (Disponible en anglais seulement)
Bremmer H.F., Prud’homme de Lodder L.C.H., van Engelen J.G.M. 2006. Cosmetics fact sheet. RIVM report 320104001/2006. (Disponible en anglais seulement)
Bucks D.A.W., Guy R.H., Maibach H.I. 1989. Percutaneous penetration and mass balance accountability: technique and implications for dermatology. J Toxicol Cutan Ocul Toxicol. 8(4):439-451. DOI: 10.3109/15569528909062949. (Disponible en anglais seulement)
Burdock G.A. 2010. Fenaroli’s handbook of flavor ingredients, 6th ed. Boca Raton (FL): CRC Press. (Disponible en anglais seulement)
Canada, ministère de l’Environnement. 2012. Loi canadienne sur la protection de l’environnement (1999) : avis concernant certaines substances de la Liste intérieure [PDF]. Gazette du Canada, Partie I, vol. 146, no 48, supplément.
Canada. 1978. Règlement sur les aliments et drogues. C.R.C., ch. 870.
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999). L.C. 1999, ch. 33. Gazette du Canada, Partie III, vol. 22, no 3.
Caputi L., Aprea E. 2011. Use of terpenoids as natural flavouring compounds in food industry. Recent Pat Food Nutr Agric. 3(1):9-16. (Disponible en anglais seulement)
Carroll J.F., Tabanca N., Kramer M., Elejalde N.M., Wedge D.E., Bernier U.R., Coy M., Becnel J.J., Demirci B., Başer K.H.C., et al. 2011. Essential oils of Cupressus funebris, Juniperus communis, and J. chinensis (Cupressaceae) as repellents against ticks (Acari: Ixodidae) and mosquitoes (Diptera: Culicidae) and as toxicants against mosquitoes. J Vector Ecol. 36(2):258-268. DOI: 10.1111/j.1948-7134.2011.00166.x. (Disponible en anglais seulement)
Catlin N.R., Herbert R., Janardhan K., Hejtmancik M.R., Fomby L.M., Vallant M., Kissling G.E., DeVito M.J. 2016. Dose-response assessment of the dermal toxicity of Virginia cedarwood oil in F344/N rats and B6C3F1/N mice. Food Chem Toxicol. 98:159-168. DOI: 10.1016/j.fct.2016.10.016. (Disponible en anglais seulement)
Chalchat J.C., Garry R.P., Michet A., Benjilali B. 1994. Essential oil components in sawdust of Cedrus atlantica from Morocco. J Essent Oil Res. 6(3):323-325. DOI: 10.1080/10412905.1994.9698386. (Disponible en anglais seulement)
Chang K.-F., Huang X.-F., Chang J.T., Huang Y.-C., Weng J.-C., Tsai N.-M. 2020. Cedrol suppresses glioblastoma progression by triggering DNA damage and blocking nuclear translocation of the androgen receptor. Cancer Lett. 495:180-190. DOI: 10.1016/j.canlet.2020.09.007. (Disponible en anglais seulement)
Chen W., Balan P., Popovich D.G. 2019. Comparison of the ginsenoside composition of Asian ginseng (Panax ginseng) and American ginseng (Panax quinquefolius L.) and their transformation pathways. In: Atta-ur-Rahman FRS, editor. Studies in natural products chemistry. Vol. 63. Amsterdam (NL): Elsevier. p. 161-195. [Consulté le 16 nov. 2021]. (Disponible en anglais seulement)
Chen W., Balan P., Popovich D.G. 2020. Comparison of ginsenoside components of various tissues of New Zealand forest-grown Asian ginseng (Panax ginseng) and American ginseng (Panax quinquefolium L.). Biomolecules. 10(3):372. DOI: 10.3390/biom10030372. (Disponible en anglais seulement)
[CIR] Cosmetic Ingredient Review. 2001. Final report on the safety assessment of Juniperus communis extract, Juniperus oxycedrus extract, Juniperus oxycedrus tar, Juniperus phoenicea extract, and Juniperus virginiana extract. Int J Toxicol. 20(2):41-56. DOI: 10.1080/10915810160233758. (Disponible en anglais seulement)
[CIR] Cosmetic Ingredient Review. 2007. Final report on the safety assessment of glycyrrhetinic acid, potassium glycyrrhetinate, disodium succinoyl glycyrrhetinate, glyceryl glycyrrhetinate, glycyrrhetinyl stearate, stearyl glycyrrhetinate, glycyrrhizic acid, ammonium glycyrrhizate, dipotassium glycyrrhizate, disodium glycyrrhizate, trisodium glycyrrhizate, methyl glycyrrhizate, and potassium glycyrrhizinate. Int J Toxicol. 26(2 Suppl):79-112. DOI: 10.1080/10915810701351228. (Disponible en anglais seulement)
[CIR] Cosmetic Ingredient Review. 2012. Safety assessment of Panax spp. root-derived ingredients as used in cosmetics. Washington (DC): CIR. (Disponible en anglais seulement)
Coon J.T., Ernst E. 2002. Panax ginseng: a systematic review of adverse effects and drug interactions. Drug Saf. 25(5):323-344. DOI: 10.2165/00002018-200225050-00003. (Disponible en anglais seulement)
[CosIng] European Commission Database for Information on Cosmetic Substances and Ingredients [base de données]. 2021. [Modifié le 7 déc. 2021]. Brussels (BE): European Commission Cosmetics Directive. [Consulté en juillet 2021]. (Disponible en anglais seulement)
[CPID] Consumer Product Information [base de données]. c2021. McLean (VA): Delima Associates. [Consulté en juillet 2021]. (Disponible en anglais seulement)
[CTFA] Cosmetic, Toiletry and Fragrance Association. 1983. Summary of the Results of Surveys of the amount and Frequency of use of cosmetic products by Women. Washington (DC): Environ Corporation. Report Prepared by Pitkin B., Rodericks J.V., Turnbull D. (Disponible en anglais seulement)
Cuzzolin L., Francini-Pesenti F., Verlato G., Joppi M., Baldelli P., Benoni G. 2010. Use of herbal products among 392 Italian pregnant women: focus on pregnancy outcome. Pharmacoepidemiol Drug Saf. 19(11):1151-1158. (Disponible en anglais seulement)
Cwientzek U., Ottillinger B., Arenberger P. 2011. Acute bronchitis therapy with ivy leaves extracts in a two-arm study. A double-blind, randomised study vs. an other ivy leaves extract. Phytomedicine. 18(13):1105-1109. DOI: 10.1016/j.phymed.2011.06.014. (Disponible en anglais seulement)
Daston G.P., Overmann G.J., Baines D., Taubeneck M.W., Lehman-McKeeman L.D., Rogers J.M., Keen C.L. 1994. Altered Zn status by alpha-hederin in the pregnant rat and its relationship to adverse developmental outcome. Reprod Toxicol. 8(1):15-24. DOI: 10.1016/0890-6238(94)90063-9. (Disponible en anglais seulement)
Dauben W.G., Ashcraft A.C. 1963. The total synthesis of (±)-Thujopsene. J Am Chem Soc. 85(22):3673-3676. DOI: 10.1021/ja00905a032. (Disponible en anglais seulement)
Du T., Shupe T.F., Hse C.Y. 2011. Antifungal activities of three supercritical fluid extracted cedar oils. Holzforschung. 65(2). DOI: 10.1515/hf.2011.005. [Consulté le 8 sept. 2021]. (Disponible en anglais seulement)
Duffy J.Y., Baines D., Overmann G.J., Keen C.L., Daston G.P. 1997. Repeated administration of alpha-hederin results in alterations in maternal zinc status and adverse developmental outcome in the rat. Teratology. 56(5):327-334. DOI: 10.1002/(SICI)1096-9926(199711)56:5<327::AID-TERA6>3.0.CO;2-U. (Disponible en anglais seulement)
[EC] European Commission. 2003. Technical Guidance Document on risk assessment, Part I [PDF]. 1998. Ispra (IT): Institute for Health and Consumer Protection, European Chemicals Bureau. (Disponible en anglais seulement)
[ECCC] Environnement et Changement climatique Canada. 2016a. Document sur l’approche scientifique : classification du risque écologique des substances organiques. Ottawa (Ont.), gouvernement du Canada.
[ECCC] Environnement et Changement climatique Canada. 2016b. Données utilisées pour établir les profils de danger et d’exposition propres aux substances et attribuer des classifications du risque dans la Classification du risque écologique des substances organiques. Gatineau (Qc). Disponible auprès de : substances@ec.gc.ca.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. [Modifié le 12 mars 2017]. Catégorisation de substances chimiques . Ottawa (Ont.), gouvernement du Canada. [Consulté en nov. 2023].
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2018a. Évaluation préalable rapide des substances pour lesquelles l’exposition de la population générale est limitée. Ottawa (Ont.), gouvernement du Canada.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2018b. Évaluation préalable substances jugées comme étant peu préoccupantes au moyen de l’approche de la Classification du risque écologique des substances organiques et de l’approche fondée sur le seuil de préoccupation toxicologique (SPT). Ottawa (Ont.), gouvernement du Canada.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2018c. Ébauche d’évaluation préalable : talc [PDF]. Ottawa (Ont.), gouvernement du Canada.
[ECHA] European Chemicals Agency. 2015. Biocides human health exposure methodology. 1st ed. Helsinki (FI): ECHA. (Disponible en anglais seulement)
[ECHA] European Chemicals Agency. 2018. Registration dossier: Juniper, Juniperus virginiana, ext. Helsinki (FI): ECHA. (Disponible en anglais seulement)
[ECHA] Agence européenne des produits chimiques. 2019. Liste des substances extrêmement préoccupantes candidates en vue d’une autorisation. Helsinki (FI), ECHA. [Consulté le 10 déc. 2021].
[EFSA] European Food Safety Authority. 2011. Scientific opinion on flavouring group evaluation 25, revision 2 (FGE.25Rev2): aliphatic and aromatic hydrocarbons from chemical group 31. EFSA J. 9(6):2177. [Consulté le 7 février 2022]. DOI: 10.2903/j.efsa.2011.2177. (Disponible en anglais seulement)
[EFSA] European Food Safety Authority. 2015. Scientific opinion on flavouring group evaluation 18, revision 3 (FGE.18Rev3): aliphatic, alicyclic and aromatic saturated and unsaturated tertiary alcohols, aromatic tertiary alcohols and their esters from chemical groups 6 and 8. EFSA J. 13(5):4118. (Disponible en anglais seulement)
Elsaieed E.M., Nada S.A. 2002. Teratogenicity of hexavalent chromium in rats and the beneficial role of ginseng. Bull Environ Contam Toxicol. 68(3):361-368. DOI: 10.1007/s001280262. (Disponible en anglais seulement)
[EMA] European Medicines Agency. 2013. Assessment report on Glycyrrhiza glabra L. and/or Glycyrrhiza inflata Bat. and/or Glycyrrhiza uralensis Fisch., radix [PDF]. London (GB): European Medicines Agency. EMA/HMPC/571122/2010. (Disponible en anglais seulement)
[EMA] European Medicines Agency. 2014. Assessment report on Panax ginseng C.A. Meyer, radix [PDF]. London (GB): European Medicines Agency. EMA/HMPC/321232/2012. (Disponible en anglais seulement)
[EMA] European Medicines Agency. 2017. Assessment report on Hedera helix L., folium Final. London (GB): European Medicines Agency. (Disponible en anglais seulement)
Environnement Canada. 2013. Données de la mise à jour de l’inventaire de la LI recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement (1999) : avis concernant certaines substances de la Liste intérieure. Données préparées par : Environnement Canada, Santé Canada; Programme des substances existantes.
Environnement Canada, Santé Canada. 2014. Approche d’identification des substances chimiques et des polymères jugés prioritaires pour l’évaluation des risques en vertu de la Partie 5 de la Loi canadienne sur la protection de l’environnement de 1999 [LCPE (1999)]. Ottawa (Ont.), gouvernement du Canada.
[EWG Skin Deep] EWG’s Skin Deep Cosmetics [base de données]. 2021. [Consulté en juillet 2021]. (Disponible en anglais seulement)
Fazio S., Pouso J., Dolinsky D., Fernandez A., Hernandez M., Clavier G., Hecker M. 2009. Tolerance, safety and efficacy of Hedera helix extract in inflammatory bronchial diseases under clinical practice conditions: a prospective, open, multicentre postmarketing study in 9657 patients. Phytomedicine. 16(1):17-24. DOI: 10.1016/j.phymed.2006.05.003. (Disponible en anglais seulement)
Feldmann R.J., Maibach H.I. 1969. Percutaneous penetration of steroids in man. J Invest Dermatol. 52(1):89-94. DOI: 10.1038/jid.1969.12. (Disponible en anglais seulement)
[FEMA] Flavor and Extract Manufacturers Association. Flavor Ingredient Library [base de données]. c2021. [Consulté en juillet 2021]. (Disponible en anglais seulement)
Ficheux A.S., Wesolek N., Chevillotte G., Roudot A.C. 2015. Consumption of cosmetic products by the French population. First part: frequency data. Food Chem Toxicol. 78:159-169. (Disponible en anglais seulement)
Ficheux A.S., Chevillotte G., Wesolek N., Morisset T., Dornic N., Bernard A., Bertho A., Romanet A., Leroy L., Mercat A.C., et al. 2016. Consumption of cosmetic products by the French population. Second part: amount data. Food Chem Toxicol. 90:130-141. (Disponible en anglais seulement)
Garcia-Hidalgo E., von Goetz N., Siegrist M., Hungerbühler K. 2017. Use-patterns of personal care and household cleaning products in Switzerland. Food Chem Toxicol. 99:24-39. (Disponible en anglais seulement)
Gluck L., Kulovich M.V., Borer R.C., Brenner P.H., Anderson G.G., Spellacy W.N. 1971. Diagnosis of the respiratory distress syndrome by amniocentesis. Am J Obstet Gynecol. 109(3):440-445. (Disponible en anglais seulement)
Gomez-Berrada M.-P., Gautier F., Parent-Massin D., Ferret P.-J. 2013. Retrospective exposure data for baby and children care products: an analysis of 48 clinical studies. Food Chem Toxicol. 57:185-194. (Disponible en anglais seulement)
[Goodscents] The Good Scents Company [base de données]. c2017. [Consulté en juillet 2017]. (Disponible en anglais seulement)
Hall R.L., Oser B.L. 1965. Recent progress in the consideration of flavoring Ingredients under the Food Additives Amendment. Ill. GRAS Substances [PDF]. Food Technol. 19:151-197. (Disponible en anglais seulement)
Hall B., Tozer S., Safford B., Coroama M., Steiling W., Leneveu-Duchemin M.C., McNamara C., Gibney M. 2007. European consumer exposure to cosmetic products, a framework for conducting population exposure assessments. Food Chem Toxicol. 45(11):2097-2108. (Disponible en anglais seulement)
Han L., Li Z., Zheng Q., Liu J.-P., Li P.-Y. 2016. A new triterpenoid compound from stems and leaves of American ginseng. Nat Prod Res. 30(1):13-19. DOI: 10.1080/14786419.2015.1030403. (Disponible en anglais seulement)
Havlíková L., Macáková K., Opleta L., Solich P. 2015. Rapid determination of α-Hederin and hederacoside C in extracts of Hedera helix leaves available in the Czech Republic and Poland. Nat Prod Commun. 10(9):1529-1531. DOI: 10.1177/1934578X1501000910. (Disponible en anglais seulement)
Heck J.D., Vollmuth T.A., Cifone M.A., Jagannath D.R., Myhr B., Curren R.D. 1989. An evaluation of food flavoring ingredients in a genetic toxicity screening battery. Toxicologist. 9:257-272. (Disponible en anglais seulement)
Hess F.G., Parent R.A., Cox G.E., Stevens K.R., Becci P.J. 1982. Reproduction study in rats of ginseng extract G115. Food Chem Toxicol. 20(2):189-192. DOI: 10.1016/S0278-6915(82)80246-9. (Disponible en anglais seulement)
Hosseini A., Zare S., Borzouei Z., Ghaderi Pakdel F. 2018. Cyclophosphamide-induced testicular toxicity ameliorate by American ginseng treatment: an experimental study. Int J Reprod Biomed. 16(11):711-718. (Disponible en anglais seulement)
Hulshof K.F.A.M., Kistemaker C. 1994. The consumption of licorice and the intake of ammonium chloride among Dutch population groups (second Dutch National Food Consumption Survey). TNO-report V 94.298. (Disponible en anglais seulement)
Hundertmark S., Dill A., Bühler H., Stevens P., Looman K., Ragosch V., Seckl J.R., Lipka C. 2002. 11beta-hydroxysteroid dehydrogenase type 1: a new regulator of fetal lung maturation. Horm Metab Res. 34(10):537-544. DOI: 10.1055/s-2002-35424. (Disponible en anglais seulement)
[IFRA] International Fragrance Association Standards Library [base de données]. 2021. Geneva (CH): IFRA. [Consulté en juillet 2021]. (Disponible en anglais seulement)
[IQWiG] Institute for Quality and Efficiency in Health Care. 2017. Eczema: steroids and other topical medications. Berlin (DE): IQWiG. (Disponible en anglais seulement)
Isbrucker R.A., Burdock G.A. 2006. Risk and safety assessment on the consumption of licorice root (Glycyrrhiza sp.), its extract and powder as a food ingredient, with emphasis on the pharmacology and toxicology of glycyrrhizin. Regul Toxicol Pharmacol. 46(3):167-192. DOI: 10.1016/j.yrtph.2006.06.002. (Disponible en anglais seulement)
Kamatou G.P.P., Viljoen A.M., Özek T., Başer K.H.C. 2010. Chemical composition of the wood and leaf oils from the “Clanwilliam Cedar” (Widdringtonia cedarbergensis J.A. Marsh): a critically endangered species. South Afr J Bot. 76(4):652-654. DOI: 10.1016/j.sajb.2010.04.002. (Disponible en anglais seulement)
Kampf G., Ruselack S., Eggerstedt S., Nowak N., Bashir M. 2013. Less and less–influence of volume on hand coverage and bactericidal efficacy in hand disinfection. BMC Infect Dis. 13:472. (Disponible en anglais seulement)
Kirk-Othmer. 2012. Kirk-Othmer Chemical Technology of Cosmetics. 1st ed. Hoboken, N.J., Somerset: Wiley, John Wiley & Sons, Incorporated Hoboken, N.J., Somerset. (Disponible en anglais seulement)
Kitts D., Hu C. 2000. Efficacy and safety of ginseng. Public Health Nutr. 3(4a):473-485. DOI: 10.1017/S1368980000000550. (Disponible en anglais seulement)
Lin D., Sun W., Wang Z., Chen L.-G., Chen X.-L., Wang S.-H., Li W.-S., Ge R.-S., Hu G.-X. 2012. The effect of glycyrrhetinic acid on pharmacokinetics of cortisone and its metabolite cortisol in rats. J Biomed Biotechnol. 2012:1-5. DOI: 10.1155/2012/856324. (Disponible en anglais seulement)
Loretz L.J., Api A.M., Barraj L.M., Burdick J., Dressler W.E., Gettings S.D., Han Hsu H., Pan Y.H.L., Re T.A., Renskers K.J., et al. 2005. Exposure data for cosmetic products: lipstick, body lotion, and face cream. Food Chem Toxicol. 43(2):279-291. (Disponible en anglais seulement)
Loretz L., Api A.M., Barraj L., Burdick J., Davis D.A., Dressler W., Gilberti E., Jarrett G., Mann S., Pan Y.H.L., et al. 2006. Exposure data for personal care products: hairspray, spray perfume, liquid foundation, shampoo, body wash, and solid antiperspirant. Food Chem Toxicol. 44(12):2008-2018. (Disponible en anglais seulement)
Loretz L.J., Api A.M., Babcock L., Barraj L.M., Burdick J., Cater K.C., Jarrett G., Mann S., Pan Y.H.L., Re T.A., et al. 2008. Exposure data for cosmetic products: facial cleanser, hair conditioner, and eye shadow. Food Chem Toxicol. 46(5):1516-1524. (Disponible en anglais seulement)
Lutsenko Y., Bylka W., Matlawska I., Darmohray R. 2010. Hedera helix as a medicinal plant. Herba Pol. 56(1):83-96. (Disponible en anglais seulement)
Maas P. 2000. Zoethout in levensmiddelen: onderzoek naar het glycyrrhizinegehalte van thee, kruidenmengsels, dranken en drop [Racine de réglisse dans les aliments : enquête sur la teneur en glycyrrhizine dans le thé, les mélanges d’herbes, les boissons alcoolisées et la réglisse]. De Ware(n)Chemicus. 30:10. (Disponible en néerlandais seulement)
Macinga D.R., Edmonds S.L., Campbell E., Shumaker B.S., Arbogast, J.W. 2013. Efficacy of novel alcohol-based hand rub products at typical in-use volumes. Infect Control Hosp Epidemiol. 34(3):299-301. (Disponible en anglais seulement)
Mannowetz N., Miller M.R., Lishko P.V. 2017. Regulation of the sperm calcium channel CatSper by endogenous steroids and plant triterpenoids. Proc Natl Acad Sci. 114(22):5743-5748. DOI: 10.1073/pnas.1700367114. (Disponible en anglais seulement)
Marnett L.J., Cohen S.M., Fukushima S., Gooderham N.J., Hecht S.S., Rietjens I.M.C.M., Smith R.L., Adams T.B., Bastaki M., Harman C.L., et al. 2014. GRASr2 evaluation of aliphatic acyclic and alicyclic terpenoid tertiary alcohols and structurally related substances used as flavoring ingredients. J Food Sci. 79(4):R428-R441. (Disponible en anglais seulement)
McCalla C.O., Nacharaju V.L., Muneyyirci-Delale O., Glasgow S., Feldman J.G. 1998. Placental 11 beta-hydroxysteroid dehydrogenase activity in normotensive and pre-eclamptic pregnancies. Steroids. 63(10):511-515. DOI: 10.1016/S0039-128X(98)00056-7. (Disponible en anglais seulement)
Mendel M., Chłopecka M., Dziekan N., Wiechetek M. 2011. The effect of the whole extract of common ivy (Hedera helix) leaves and selected active substances on the motoric activity of rat isolated stomach strips. J Ethnopharmacol. 134(3):796-802. DOI: 10.1016/j.jep.2011.01.036. (Disponible en anglais seulement)
Nordic Council of Ministers. 1993. Adverse health effects of glycyrrhizic acid in licorice: a risk assessment. Copenhagen (DK): Nordiske Seminar-og Arbejdsrapporter. (Disponible en anglais seulement)
Norris C., Fang L., Barkjohn K.K., Carlson D., Zhang Y., Mo J., Li Z., Zhang J., Cui X., Schauer J.J., et al. 2019. Sources of volatile organic compounds in suburban homes in Shanghai, China, and the impact of air filtration on compound concentrations. Chemosphere. 231:256-268. DOI: 10.1016/j.chemosphere.2019.05.059. (Disponible en anglais seulement)
[NTP] National Toxicology Program. 2002. NTP technical report on the toxicology and carcinogenesis studies of cedarwood oil (CAS No. 8000-27-9). Research Triangle Park (NC): US Department of Health and Human Services, National Toxicology Program. [Consulté en juillet 2021]. (Disponible en anglais seulement)
[NTP] National Toxicology Program. 2011. Toxicology and carcinogenesis studies of ginseng (CAS No. 50647-08-0) in F344/N rats and B6C3F1 mice (gavage studies). Research Triangle Park (NC): US Department of Health and Human Services, National Toxicology Program. (Disponible en anglais seulement)
[NTP] National Toxicology Program. 2016. NTP technical report on the toxicity studies of cedarwood oil (Virginia) (casrn 8000-27-9) administered dermally to F344/N rats and B6C3F1/N mice. Research Triangle Park (NC): US Department of Health and Human Services, National Toxicology Program. NTP TOX 86. (Disponible en anglais seulement)
O.Berk Leaders in Packing Solutions. O.Berk online product catalog – fine mist sprayers. (Disponible en anglais seulement)
OECD QSAR Toolbox [outil de lecture croisée]. 2014. Version. 3.3. Paris (FR): Organisation for Economic Co-operation and Development, Laboratory of Mathematical Chemistry. (Disponible en anglais seulement)
OECD QSAR Toolbox [outil de lecture croisée]. 2019. Version 4.2. Paris (FR): Organisation for Economic Co-operation and Development, Laboratory of Mathematical Chemistry. (Disponible en anglais seulement)
Ogunwole E., Kunle-Alabi O., Akindele O., Raji Y. 2019. Adverse effects of saccharum officinarum molasses on rat testicular cells. Adv Toxicol Toxic Eff. 3(1):001-008. DOI: 10.17352/atte.000003. (Disponible en anglais seulement)
Opdyke D. 1978. Fragrance raw materials monographs: alpha-Cedrene. Food Cosmet Toxicol. 16(5-6):679-680. (Disponible en anglais seulement)
Outil de recherche de fiches de données de sécurité (FDS) [base de données]. 2019. Ottawa (Ont.), gouvernement du Canada. [Mis à jour le 1er mars 2019; consulté le 10 août 2021]. [Accès restreint].
Perriot R., Breme K., Meierhenrich U.J., Carenini E., Ferrando G., Baldovini N. 2010. Chemical composition of French mimosa absolute oil. J Agric Food Chem. 58(3):1844-1849. DOI: 10.1021/jf903264n. (Disponible en anglais seulement)
Perveen S. 2018. Introductory chapter: terpenes and terpenoids. In: Perveen S., Al-Taweel A., editors. Terpenes and terpenoids. London (GB): IntechOpen. [Consulté le 18 déc. 2019]. (Disponible en anglais seulement)
Räikkönen K., Pesonen A.-K., Heinonen K., Lahti J., Komsi N., Eriksson J.G., Seckl J.R., Järvenpäa A.L., Strandberg T.E. 2009. Maternal licorice consumption and detrimental cognitive and psychiatric outcomes in children. Am J Epidemiol. 170(9):1137-1146. DOI: 10.1093/aje/kwp272. (Disponible en anglais seulement)
Räikkönen K., Seckl J.R., Heinonen K., Pyhälä R., Feldt K., Jones A., Pesonen A.-K., Phillips D.I.W., Lahti J., Järvenpää A.-L., et al. 2010. Maternal prenatal licorice consumption alters hypothalamic–pituitary–adrenocortical axis function in children. Psychoneuroendocrinology. 35(10):1587-1593. DOI: 10.1016/j.psyneuen.2010.04.010. (Disponible en anglais seulement)
Räikkönen K., Martikainen S., Pesonen A.-K., Lahti J., Heinonen K., Pyhälä R., Lahti M., Tuovinen S., Wehkalampi K., Sammallahti S., et al. 2017. Maternal licorice consumption during pregnancy and pubertal, cognitive, and psychiatric outcomes in children. Am J Epidemiol. 185(5):317-328. DOI: 10.1093/aje/kww172. (Disponible en anglais seulement)
Ramirez-Martinez A., Granda-Torres P., Wesolek N., Ficheux A.S., Roudot A.C. 2015. Exposure of hairdressers to the main cosmetics used in hairdressing salons in France: a preliminary study. Arch Environ Occup Health. 71(5):247-258. (Disponible en anglais seulement)
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [Institut national de la santé publique et de l’environnement]. 2006. Cosmetics fact sheet: to assess the risks for the consumer: updated version for ConsExpo 4. Bilthoven (NL): RIVM. Report No.: 320104001/2006. (Disponible en anglais seulement)
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [Institut national de la santé publique et de l’environnement]. 2018. ConsExpo. 2016. ConsExpo Web Consumer Exposure Models. Bilthoven (NL): RIVM. (Disponible en anglais seulement)
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [Institut national de la santé publique et de l’environnement]. 2018. Cleaning products fact sheet: default parameters for estimating consumer exposure – updated version 2018 [PDF]. Bilthoven (NL): RIVM. Report No. 2016-0179. Contains erratum d.d. 13-9-2018. (Disponible en anglais seulement)
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [Institut national de la santé publique et de l’environnement]. 2021a. Health risk assessment when using ethanol-containing hand gel. Bilthoven (NL): RIVM. Report No.: 2021-0026. (Disponible en anglais seulement)
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [Institut national de la santé publique et de l’environnement]. 2021b. Air fresheners fact sheet. Bilthoven (NL): RIVM. Report No.: 2021-0233. (Disponible en anglais seulement)
Roskos K.V., Maibach H.I., Guy R.H. 1989. The effect of aging on percutaneous absorption in man. J Pharmacokinet Biopharm. 17(6):617-630. DOI: 10.1007/BF01062121. (Disponible en anglais seulement)
Ruiz-Rodríguez M.A., Vedani A., Flores-Mireles A.L., Cháirez-Ramírez M.H., Gallegos-Infante J.A., González-Laredo R.F. 2017. In silico prediction of the toxic potential of lupeol. Chem Res Toxicol. 30(8):1562-1571. DOI: 10.1021/acs.chemrestox.7b00070. (Disponible en anglais seulement)
Ryan T.J., Beaucham C. 2013. Dominant microbial volatile organic compounds in 23 US homes. Chemosphere. 90(3):977-985. (Disponible en anglais seulement)
Sakamoto K., Wakabayashi K. 1988. Inhibitory effect of glycyrrhetinic acid on testosterone production in rat gonads. Endocrinol Jpn. 35(2):333-342. (Disponible en anglais seulement)
Santé Canada. 2015. Aromathérapie – Huiles Essentielles. Ottawa (Ont.), gouvernement du Canada.
Santé Canada. 2016. Document sur l’approche scientifique : approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances. Ottawa (Ont.), gouvernement du Canada.
Santé Canada. 2019. Les produits d’autosoins et Santé Canada. Ottawa (Ont.), gouvernement du Canada.
Santé Canada. 2020. [Modifié le 14 juillet 2020]. Règlements sur les produits de vapotage. Ottawa (Ont.), gouvernement du Canada. [Consulté le 22 avril 2021].
Santé Canada. 2021. Facteurs d’exposition utilisés dans les évaluations des risques pour la santé humaine au Canada. Ottawa (Ont.), gouvernement du Canada.
Santé Canada. 2022. Étiquetage nutritionnel - Tableau des quantités de référence pour les aliments. Ottawa (Ont.), gouvernement du Canada.
Satrani B., Aberchane M., Farah A., Chaouch A., Talbi M. 2006. Composition chimique et activité antimicrobienne des huiles essentielles extraites par hydrodistillation fractionnée du bois de Cedrus atlantica Manetti. Acta Bot Gallica. 153(1):97-104. DOI: 10.1080/12538078.2006.10515524.
[SCCS] Scientific Committee on Consumer Safety. 2010. Basic criteria for the in vitro assessment of dermal absorption of cosmetic ingredients adopted by the SCCS at its 7th plenary meeting of 22 June 2010. Brussels (BE): European Commission, Health & Consumers. (Disponible en anglais seulement)
[SCCS] Scientific Committee on Consumer Safety. 2015. The SCCS notes of guidance for the testing of cosmetic ingredients and their safety evaluation.. 9th revision [PDF]. Brussels (BE): European Commission. [Mis à jour le 25 avril 2016; consulté en avril 2020]. Report No. SCCS/1564/15. (Disponible en anglais seulement)
Schmidt M., Thomsen M., Schmidt U. 2012. Suitability of ivy extract for the treatment of paediatric cough: ivy extract in the treatment of paediatric cough. Phytother Res. 26(12):1942-1947. DOI: 10.1002/ptr.4671. (Disponible en anglais seulement)
Sell C.S. 2003. A fragrant introduction to terpenoid chemistry. Cambridge: Royal Society of Chemistry Camb://site.ebrary.com/id/10621154. (Disponible en anglais seulement)
Siddique H.R., Mishra S.K., Karnes R.J., Saleem M. 2011. Lupeol, a novel androgen receptor inhibitor: implications in prostate cancer therapy. Clin Cancer Res. 17(16):5379-5391. DOI: 10.1158/1078-0432.CCR-11-0916. (Disponible en anglais seulement)
Sigurjonsdottir H.A., Axelson M., Johannsson G., Manhem K., Nystrom E., Wallerstedt S. 2006. Liquorice in moderate doses does not affect sex steroid hormones of biological importance although the effect differs between the genders. Horm Res. 65(2):106-110. DOI: 10.1159/000091302. (Disponible en anglais seulement)
Statistique Canada. 2017. Tableau personnalisé des données sur les produits d’hygiène tirées de l’Enquête canadienne sur les mesures de la santé, Cycle 2 (2010-2011). [Accès restreint]. Préparé par Statistique Canada pour le Bureau de l’évaluation des risques pour les substances existantes, Santé Canada.
Stauss-Grabo M., Atiye S., Warnke A., Wedemeyer R.S., Donath F., Blume H.H. 2011. Observational study on the tolerability and safety of film-coated tablets containing ivy extract (Prospan® Cough Tablets) in the treatment of colds accompanied by coughing. Phytomedicine. 18(6):433-436. DOI: 10.1016/j.phymed.2010.11.009. (Disponible en anglais seulement)
Strandberg T.E., Järvenpää A.L., Vanhanen H., McKeigue P.M. 2001. Birth outcome in relation to licorice consumption during pregnancy. Am J Epidemiol. 153(11):1085-1088s://doi.org/10.1093/aje/153.11.1085. (Disponible en anglais seulement)
Strandberg T.E. 2002. Preterm birth and licorice consumption during pregnancy. Am J Epidemiol. 156(9):803-805. DOI: 10.1093/aje/kwf130. (Disponible en anglais seulement)
Strittholt C.A., McMillan D.A., He T., Baker R.A., Barker M.L. 2016. A randomized clinical study to assess ingestion of dentrifrice by children. Regul Toxicol Pharmacol. 75:66-71. (Disponible en anglais seulement)
Surburg H., Panten J. 2016. Common fragrance and flavor materials: preparation, properties and uses. 6th ed. Weinheim (DE): Wiley-VCH Verlag GmbH & Co. KGaA. (Disponible en anglais seulement)
Tisserand Institute. 2021. How to use essential oils safely. [Consulté en juillet 2021]. (Disponible en anglais seulement)
Tisserand R., Young R. 2014. Essential oil safety: a guide for health care professionals. 2nd ed. London (GB): Churchill Livingstone. (Disponible en anglais seulement)
Uehara A., Tommis B., Belhassen E., Satrani B., Ghanmi M., Baldovini N. 2017. Odor-active constituents of Cedrus atlantica wood essential oil. Phytochemistry. 144:208-215. (Disponible en anglais seulement)
[US CFR] US Code of Federal Regulations. 2021a. Title 21, vol. 3, c. I, part 172.515: synthetic flavoring substances and adjuvants [PDF]. Washington (DC): National Archives and Records Administration’s Office of the Federal Register (OFR); Government Publishing Office. [Consulté en août 2021]. (Disponible en anglais seulement)
[US CFR] US Code of Federal Regulations. 2021b. Title 21, part 184.1408: direct food substances affirmed as generally recognized as safe [PDF]. Washington (DC): National Archives and Records Administration’s Office of the Federal Register (OFR); Government Publishing Office. [Consulté en août 2021]. (Disponible en anglais seulement)
[US CFR] US Code of Federal Regulations. 2021c. Title 21, vol. 3, part 172.510: natural flavoring substances and natural substances used in conjunction with flavors. Washington (DC): National Archives and Records Administration’s Office of the Federal Register (OFR); Government Publishing Office. [Consulté en août 2021]. (Disponible en anglais seulement)
[US EPA] United States Environmental Protection Agency. 2012a. EPI Suite [modèle d’estimation]. c2000-2012. Ver. 4.11. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. (Disponible en anglais seulement)
[US EPA] United States Environmental Protection Agency. 2012b. Standard operating procedures for residential pesticide exposure assessment [PDF]. Washington (DC): Health Effects Division, Office of Pesticide Programs, Office of Chemical Safety and Pollution Prevention. (Disponible en anglais seulement)
[US EPA] United States Environmental Protection Agency. 2019. The Chemistry Dashboard. LIST: terpenes in vape. Research Triangle Park (NC): US EPA, Chemical Safety for Sustainability Research Program. (Disponible en anglais seulement)
[US FDA] United States Food and Drug Administration. 2017. Black licorice: trick or treat? [Mis à jour le 30 octobre 2017]. (Disponible en anglais seulement)
van Gelderen C.E.M., Bijlsma J.A., van Dokkum W., Savelkoull T.J.F. 2000. Glycyrrhizic acid: the assessment of a no effect level. Hum Exp Toxicol. 19(8):434-439. DOI: 10.1191/096032700682694251. (Disponible en anglais seulement)
[VCF] Volatile Compounds in Food [base de données]. 2021. Ver. 16.7. Van Dongen W.D., Donders J.J.H., editors – Reeuwijk (NL): BeWiDo B.V., 1963-2021. (Disponible en anglais seulement)
[VKM] Vitenskapskomiteen for mat og miljø [Comité scientifique norvégien de l’alimentation et de l’environnement]. 2018. Hazard assessment of glycyrrhizic acid from licorice. Oslo (NO): VKM. VKM Report 2019: 09. (Disponible en anglais seulement)
Wang Y., Choi H.-K., Brinckmann J.A., Jiang X., Huang L. 2015. Chemical analysis of Panax quinquefolius (North American ginseng): a review. J Chromatogr A. 1426:1-15. DOI: 10.1016/j.chroma.2015.11.012. (Disponible en anglais seulement)
Wester R.C., Bucks D.A.W., Maibach H.I. 1983. In vivo percutaneous absorption of hydrocortisone in psoriatic patients and normal volunteers. J Am Acad Dermatol. 8(5):645-647. DOI: 10.1016/S0190-9622(83)70072-1. (Disponible en anglais seulement)
[WHO] World Health Organization. 2005. Evaluation of certain food additives. Sixty-third report of the Joint FAO/WHO Expert Committee on Food Additives (JECFA). Geneva (CH): World Health Organization. WHO Technical Report Series: 928. (Disponible en anglais seulement)
[WHO] World Health Organization JECFA. 2009. Safety evaluation of certain food additives: Rome, Italy, from –17 - 26 June 2008. Geneva (CH): World Health Organization. WHO food additives series: 60. (Disponible en anglais seulement)
Wu X., Bennett D.H., Ritz B., Cassady D.L., Lee K., Hertz-Picciotto I. 2010. Usage pattern of personal care products in California households. Food Chem Toxicol. 48(11):3109-3119. (Disponible en anglais seulement)
Yan H., Li X., Ni W., Zhao Q., Leng Y., Liu H. 2021. Phytochemicals from the leaves of Cyclocarya paliurus and their 11β‐HSD1 enzyme inhibitory effects. Chem Biodivers. 18(1): e2000772. DOI: 10.1002/cbdv.202000772. [Consulté le 27 oct. 2021]. (Disponible en anglais seulement)
Yu M., Shin Y.J., Kim N., Yoo G., Park S., Kim S.H. 2015. Determination of saponins and flavonoids in ivy leaf extracts using HPLC-DAD. J Chromatogr Sci. 53(4):478-483. DOI: 10.1093/chromsci/bmu068. (Disponible en anglais seulement)
Zhang Z., Chen X., Chen H., Wang L., Liang J., Luo D., Liu Y., Yang H., Li Y., Xie J., et al. 2016. Anti-inflammatory activity of β-patchoulene isolated from patchouli oil in mice. Eur J Pharmacol. 781:229-238. DOI: 10.1016/j.ejphar.2016.04.028. (Disponible en anglais seulement)
Zhao L., Li X. 1998. Synthesis of amboryl acetate-A woody perfumery. Jiangsu Institute of Petrochemical Technology, 2. Résumé accessible en ligne : http://en.cnki.com.cn/KCMS/detail/detail.aspx?dbcode=CJFD&dbname=CJFD9899&filename=JSSY802.003&uniplatform=OVERSEA&v=BJJ13LiLvpzfLy3WA52qtVyyQLO9iAdV1sJdqTPliKCxK2XEuq1TdRW2_jcNNQ8w (Disponible en anglais seulement)
Zhong Y., Ding Y., Xiao D., Hu D., Li Y. 2022. New 18β-glycyrrhetinic acid-emodin esters synthetized by a one-step innovative route, its structural characterization, and in vivo toxicity assessed on zebrafish models. Chem Biodivers. 19(4):e202100928. DOI: 10.1002/cbdv.202100928. (Disponible en anglais seulement)
Zrira S., Ghanmi M. 2016. Chemical composition and antibacterial activity of the essential of Cedrus atlantica (cedarwood oil). J Essent Oil-Bear Plants. 19(5):1267-1272. DOI: 10.1080/0972060X.2015.1137499. (Disponible en anglais seulement)
Annexe A. Paramètres d’estimation de l’exposition cutanée, par inhalation et par voie orale aux produits disponibles aux consommateurs
L’exposition aux produits disponibles aux consommateurs a été estimée à l’aide de ConsExpo Web (2016). Les estimations de l’exposition ont été calculées à partir des poids corporels et des taux d’inhalation par défaut suivants : 74 kg/15,1 m3/j, 62 kg/15,9 m3/j, 42 kg/13,9 m3/j, 23 kg/11,1 m3/j, 15 kg/9,2 m3/j, 11 kg/8,0 m3/j, 9,1 kg/5,4 m3/j et 6,3 kg/3,7 m3/j pour les adultes (19 ans et plus), les enfants de 14 à 18 ans, les enfants de 9 à 13 ans, les enfants de 4 à 8 ans, les enfants de 2 à 3 ans, les enfants de 1 an, les bébés de 6 à 11 mois, et les bébés de 0 à 5 mois, respectivement (Santé Canada, 2021).
Un facteur d’absorption cutanée de 25 % a été employé pour les substances du sous-groupe 1 des sesquiterpènes tricycliques ainsi que pour tous les triterpénoïdes, y compris l’énoxolone, l’essence de mimosa et l’extrait de lierre, à moins d’indication contraire. Les estimations calculées de l’exposition à l’essence de mimosa ont été multipliées par 30 % pour tenir compte de la quantité maximale des composés apparentés au lupéol (lupénone et lupéol) dans l’essence de mimosa, et celles de l’exposition à l’extrait de lierre ont été multipliées par 50 % pour tenir compte des composés à base de stéroïdes (hédéracoside C, hédéragénine et alpha-hédérine) dans l’extrait de lierre.
L’exposition cutanée (mg/kg p.c./j) a été calculée à l’aide de la formule suivante, à moins d’indication contraire : [quantité moyenne de produit (g/application) * fréquence quotidienne moyenne * concentration dans le produit * facteur de rétention * facteur de conversion (1 000 mg/g)] ÷ poids corporel (kg). L’exposition systémique dérivée de l’exposition cutanée (mg/kg p.c./j) a été calculée à l’aide de la formule suivante : exposition cutanée * absorption cutanée.
L’exposition par inhalation (mg/kg p.c./j) a été calculée à l’aide de la formule suivante, à moins d’indication contraire : [concentration dans l’air (mg/m3) (moyenne pondérée sur 24 h) * taux d’inhalation (m3/j)] ÷ poids corporel (kg).
L’exposition par voie orale (mg/kg p.c./j) a été calculée à l’aide de la formule suivante : [quantité moyenne de produit (g/application) × fréquence quotidienne moyenne × concentration dans le produit × facteur de conversion (1 000 mg/g)] ÷ poids corporel (kg).
L’exposition combinée (mg/kg p.c./j) a été calculée à l’aide de la formule suivante : exposition cutanée systémique (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j) + exposition par voie orale (mg/kg p.c./j).
| Scénario d’exposition | Hypothèses |
|---|---|
| Produit de traitement contre l’acné (gel/crème) (essence de bois de cèdre, énoxolone) (PSN) | Concentration : 0,02 % d’essence de bois de cèdre (déclarées comme de l’extrait d’écorce de Cedrus atlantica), 0,3 % d’énoxolone (déclarée comme de l’acide glycyrrhétinique) Quantité de produit : 1,5 g (adultes, enfants de 14 à 18 ans), 1,1 g (enfants de 9 à 13 ans) (Ficheux et al., 2016) L’exposition par inhalation à l’énoxolone n’a pas été quantifiée, car cette substance n’était pas considérée comme volatile. Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la vapeur, évaporation et superficie de libération constante ». |
| Produit pour la peau après épilation (corps) (essence de bois de cèdre) | Concentration : 3 % d’essence de bois de cèdre Quantité de produit : 7,10 g (adultes, enfants de 14 à 18 ans) (Ficheux et al., 2016); 5,50 g (enfants de 9 à 13 ans) (valeur ajustée selon la surface exposée) Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la vapeur, évaporation et superficie de libération constante ». |
| Produit après-rasage (visage) (essence de bois de cèdre) | Concentration : 5 % d’essence de bois de cèdre Quantité de produit : 2,4 g (adultes, enfants de 14 à 18 ans) (Ficheux et al., 2016); 2,3 g (enfants de 9 à 13 ans) (valeur ajustée selon la surface exposée) Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la vapeur, évaporation et superficie de libération constante ». |
| Timbre analgésique (énoxolone) (PSN) | Concentration : 0,18 % d’énoxolone (déclarée comme de l’acide glycyrrhétinique) Quantité de produit : 0,453 g (adultes), 0,716 g (enfants de 14 à 18 ans), 0,757 g (enfants de 9 à 13 ans), 0,868 g (enfants de 4 à 8 ans), 0,963 g (enfants de 2 à 3 ans) L’exposition par inhalation à l’énoxolone n’a pas été quantifiée, car cette substance n’était pas considérée comme volatile. |
| Nettoyant antiseptique pour la peau (en pulvérisateur) (essence de bois de cèdre) (PSN) | Concentration : 0,05 % d’essence de bois de cèdre (en pulvérisateur) (déclarées comme de l’huile essentielle de bois de Cedrus atlantica) Quantité de produit : 1,5 g (tous les groupes d’âge, Kampf et al., 2013; Macinga et al., 2013; Bansaghi et al., 2020) Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la vapeur, évaporation et superficie de libération constante ». |
| Huile pour le bain (essence de bois de cèdre) | Concentration : 10 % d’essence de bois de cèdre Quantité de produit (ajustée pour tenir compte de la dilution) : 0,0219 g (adultes); 0,0206 g (enfants de 14 à 18 ans); 0,0159 g (enfants de 9 à 13 ans) (CFTA, 1983) Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la vapeur, évaporation et superficie de libération constante ». |
| Produit pour le bain (mousse/bulles) (essence de bois de cèdre, essence de bois de cèdre du Texas, énoxolone, essence de mimosa, extrait de lierre) | Concentration : 3,5 % d’essence de bois de cèdre, 5 % d’essence de bois de cèdre du Texas, 3 % d’énoxolone, 1 % d’essence de mimosa, 0,3 % d’extrait de lierre Quantité de produit (ajustée pour tenir compte de la dilution) : 0,0394 g (adultes), 0,0370 g (enfants de 14 à 18 ans) (Ficheux et al., 2016); 0,0078 g (enfants de 9 à 13 ans), 0,0051 g (enfants de 4 à 8 ans), 0,0055 g (enfants de 2 à 3 ans), 0,0041 g (enfants de 1 an), 0,0034 g (bébés de 6 à 11 mois), 0,0026 g (bébés de 0 à 5 mois) (Garcia-Hidalgo et al., 2017) L’exposition par inhalation à l’énoxolone, à l’essence de mimosa et à l’extrait de lierre n’a pas été quantifiée, car ces substances n’étaient pas considérées comme volatiles. Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la vapeur, évaporation et superficie de libération constante ». |
| Produit pour le bain (sel) (essence de bois de cèdre, essence de bois de cèdre du Texas, extrait de lierre) | Concentration : 10 % d’essence de bois de cèdre, 10 % d’essence de bois de cèdre du Texas, 3 % d’extrait de lierre. Quantité de produit : 0,0278 g (adultes), 0,0261 g (enfants de 14 à 18 ans), 0,0201 g (enfants de 9 à 13 ans) (Ficheux et al., 2016) L’exposition par inhalation à l’extrait de lierre n’a pas été quantifiée, car cette substance n’était pas considérée comme volatile. Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la vapeur, évaporation et superficie de libération constante ». |
| Fard (essence de mimosa) | Concentration : 1 % d’essence de mimosa Quantité de produit : 0,013 g (adultes, enfants de 14 à 18 ans et enfants de 9 à 13 ans) (Ficheux et al., 2016); 0,014 g (enfants de 4 à 8 ans) (valeur ajustée selon la surface exposée) L’exposition par inhalation à l’essence de mimosa n’a pas été quantifiée, car cette substance n’était pas considérée comme volatile. |
| Adhésif pour le corps (essence de bois de cèdre, extrait de lierre) | Concentration : 0,1 % d’essence de bois de cèdre, 0,1 % d’extrait de lierre Quantité de produit : 10 g (adultes, enfants de 14 à 18 ans) (Ficheux et al., 2016) pour l'essence de bois de cèdre; 1,97 g (adultes), 2,12 g (enfants de 14 à 18 ans) pour l'extrait de lierre (information sur le produit) L’exposition par inhalation à l’extrait de lierre n’a pas été quantifiée, car cette substance n’était pas considérée comme volatile. Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la vapeur, évaporation et superficie de libération constante ». |
| Nettoyant pour le corps (liquide) (essence de bois de cèdre, essence de mimosa, extrait de lierre) | Concentration : 3 % d’essence de bois de cèdre, 0,3 % d’essence de mimosa, 0,1 % d’extrait de lierre Quantité de produit : 11 g (adultes) (Loretz et al., 2006); 11 g (enfants de 14 à 18 ans) (Ficheux et al., 2016); 10,9 g (enfants de 9 à 13 ans, enfants de 4 à 8 ans) (Garcia-Hidalgo et al., 2017); 6,7 g (enfants de 2 à 3 ans) (Garcia-Hidalgo et al., 2017); 5,4 g (enfants de 1 an) (Ficheux et al., 2016); 4,9 g (bébés de 6 à 11 mois) (Gomez-Berrada et al., 2013); 4,5 g (bébés de 0 à 5 mois) (Gomez-Berrada et al., 2013) L’exposition par inhalation à l’extrait de lierre et à l’essence de mimosa n’a pas été quantifiée, car ces substances n’étaient pas considérées comme volatiles. Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la vapeur, évaporation et superficie de libération constante ». |
| Nettoyant pour le corps (solide) (essence de bois de cèdre, essence de bois de cèdre du Texas) | Concentration : 100 % d’essence de bois de cèdre, 100 % d’essence de bois de cèdre du Texas Quantité de produit : 1,1 g (adultes), 1,1 g (enfants de 14 à 18 ans) (Ficheux et al., 2016); 0,82 g (enfants de 9 à 13 ans), 0,53 g (enfants de 4 à 8 ans), 0,38 g (enfants de 2 à 3 ans), 0,29 g (enfants de 1 an), 0,24 g (bébés de 6 à 11 mois), 0,18 g (bébés de 0 à 5 mois) (valeur ajustée selon la surface exposée) Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la vapeur, évaporation et superficie de libération constante ». |
| Exfoliant pour le corps (essence de bois de cèdre, essence de bois de cèdre du Texas, essence de mimosa, extrait de lierre) | Concentration : 3 % d’essence de bois de cèdre, 1 % d’essence de bois de cèdre du Texas, 0,3 % d’essence de mimosa, 30 % d’extrait de lierre Quantité de produit : 10 g (adultes), 10 g (enfants de 14 à 18 ans) (Ficheux et al., 2016) L’exposition par inhalation à l’essence de mimosa et à l’extrait de lierre n’a pas été quantifiée, car ces substances n’étaient pas considérées comme volatiles. Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la vapeur, libération instantanée ». |
| Hydratant pour le corps (essence de bois de cèdre, essence de bois de cèdre du Texas, énoxolone, essence de mimosa, extrait de lierre) | Concentration : 10 % d’essence de bois de cèdre, 10 % d’essence de bois de cèdre du Texas, 3 % d’énoxolone, 10 % d’essence de mimosa, 5 % d’extrait de lierre Quantité de produit : 10 g (adultes, enfants de 14 à 18 ans) (Ficheux et al., 2016); 7,7 g (enfants de 9 à 13 ans), 5 g (enfants de 4 à 8 ans) (valeur ajustée selon la surface exposée); 4,1 g (enfants de 2 à 3 ans) (Ficheux et al., 2016); 3,1 g (enfants de 1 an), 2,5 g (bébés de 6 à 11 mois), 2 g (bébés de 0 à 5 mois) (valeur ajustée selon la surface exposée) L’exposition par inhalation à l’énoxolone, à l’essence de mimosa et à l’extrait de lierre n’a pas été quantifiée, car ces substances n’étaient pas considérées comme volatiles. Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la vapeur, évaporation et superficie de libération constante ». |
| Hydratant pour le corps (en pulvérisateur) (énoxolone) | Concentration : 3 % d’énoxolone Quantité de produit : 5,2 g (adultes, enfants de 14 à 18 ans), 3,1 g (enfants de 9 à 13 ans, enfants de 4 à 8 ans), 2,5 g (enfants de 2 à 3 ans, enfants de 1 an, bébés de 6 à 11 mois, bébés de 0 à 5 mois) (Ficheux et al., 2016) Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la pulvérisation, libération instantanée ». |
| Nettoyant (2 en 1 : shampooing et nettoyant pour le corps) (essence de mimosa) | Concentration : 1 % d’essence de mimosa Quantité de produit : 34,18 g (adultes), 31,75 g (enfants de 14 à 18 ans), 24,62 g (enfants de 9 à 13 ans), 16,22 g (enfants de 4 à 8 ans) (valeur ajustée selon la surface exposée), 6 g (enfants de 2 à 3 ans, enfants de 1 an, bébés de 6 à 11 mois, bébés de 0 à 5 mois) (Gomez-Berrada et al., 2013) L’exposition par inhalation à l’essence de mimosa n’a pas été quantifiée, car cette substance n’était pas considérée comme volatile. |
| Revitalisant (sans rinçage) (essence de bois de cèdre, extrait de lierre) | Concentration : 14 % d’essence de bois de cèdre, 3 % d’extrait de lierre Quantité de produit : 13,1 g (adultes); 10 g (enfants de 14 à 18 ans); 7,8 g (enfants de 9 à 13 ans, enfants de 4 à 8 ans); 5,2 g (enfants de 2 à 3 ans) (Ficheux et al., 2016; Garcia-Hidalgo et al., 2017) L’exposition par inhalation à l’extrait de lierre n’a pas été quantifiée, car cette substance n’était pas considérée comme volatile. Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la vapeur, évaporation et superficie de libération constante ». |
| Revitalisant (avec rinçage) (essence de bois de cèdre, essence de bois de cèdre du Texas, énoxolone, essence de mimosa, extrait de lierre) | Concentration : 5 % d’essence de bois de cèdre, 5 % d’essence de bois de cèdre du Texas, 0,3 % d’énoxolone, 0,1 % d’essence de mimosa, 1 % d’extrait de lierre Quantité de produit : 13,1 g (adultes) (Loretz et al., 2008); 10 g (enfants de 14 à 18 ans) (Ficheux et al., 2016); 7,8 g (enfants de 9 à 13 ans, enfants de 4 à 8 ans) (Ficheux et al., 2016); 5,2 g (enfants de 2 à 3 ans) (Garcia-Hidalgo et al., 2017) L’exposition par inhalation à l’énoxolone, à l’essence de mimosa et à l’extrait de lierre n’a pas été quantifiée, car ces substances n’étaient pas considérées comme volatiles. Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la vapeur, évaporation et superficie de libération constante ». |
| Déodorant ou antisudorifique (solide) (essence de bois de cèdre, essence de bois de cèdre du Texas, énoxolone, essence de mimosa) | Concentration : 42 % d’essence de bois de cèdre, 10 % d’essence de bois de cèdre du Texas, 0,1 % d’énoxolone, 0,063 % d’essence de mimosa Quantité de produit : 1 g (adultes, enfants de 14 à 18 ans); 0,4 g (enfants de 9 à 13 ans) (Ficheux et al., 2016) L’exposition par inhalation à l’énoxolone et à l’essence de mimosa n’a pas été quantifiée, car ces substances n’étaient pas considérées comme volatiles. Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la vapeur, évaporation et superficie de libération constante ». |
| Baume de soulagement de l’irritation (essence de bois de cèdre) (PSN) | Concentration : 1,21 % d’essence de bois de cèdre (déclarées comme de l’huile essentielle de bois de Cedrus atlantica) Quantité de produit : 5,5 g (adultes, enfants de 14 à 18 ans, enfants de 9 à 13 ans, enfants de 4 à 8 ans), 2,75 g (enfants de 2 à 3 ans, enfants de 1 an) (IQWiG, 2017) Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la vapeur, évaporation et superficie de libération constante ». |
| Démaquillant pour les yeux (énoxolone) | Concentration : 1 % d’énoxolone Quantité de produit : 0,5 g (EC, 2003; Bremmer et al., 2006) L’exposition par inhalation à l’énoxolone n’a pas été quantifiée, car cette substance n’était pas considérée comme volatile. |
| Hydratant pour les yeux (essence de mimosa, extrait de lierre) | Concentration : 3 % d’essence de mimosa, 1 % d’extrait de lierre Quantité de produit : 0,5 g (adultes, enfants de 14 à 18 ans). La quantité moyenne de produit repose sur les documents EC (2003) et RIVM (2006) qui portent sur un démaquillant pour les yeux. Le démaquillant pour les yeux a servi de substitut à l’hydratant pour les yeux. L’exposition par inhalation à l’essence de mimosa et à l’extrait de lierre n’a pas été quantifiée, car ces substances n’étaient pas considérées comme volatiles. |
| Ombre à paupières (essence de mimosa) | Concentration : 1 % d’essence de mimosa Quantité de produit : 0,09 g (Ficheux et al., 2016) L’exposition par inhalation à l’essence de mimosa n’a pas été quantifiée, car cette substance n’était pas considérée comme volatile. |
| Exfoliant pour le visage (essence de mimosa, extrait de lierre) | Concentration : 1 % d’essence de mimosa, 1 % d’extrait de lierre Quantité de produit : 3,1 g (adultes, enfants de 14 à 18 ans) (Ficheux et al., 2016) L’exposition par inhalation à l’essence de mimosa et à l’extrait de lierre n’a pas été quantifiée, car ces substances n’étaient pas considérées comme volatiles. |
| Écran solaire (lotion) (énoxolone) (PSN) | Concentration : 0,1 % d’énoxolone (déclarée comme de l’acide glycyrrhétinique) Quantité de produit : 1,5 g (adultes) (Ficheux et al., 2016) L’exposition par inhalation à l’énoxolone n’a pas été quantifiée, car cette substance n’était pas considérée comme volatile. |
| Hydratant pour le visage (essence de bois de cèdre, essence de bois de cèdre du Texas, énoxolone, essence de mimosa, extrait de lierre) | Concentration : 10 % d’essence de bois de cèdre, 5 % d’essence de bois de cèdre du Texas, 30 % d’énoxolone, 10 % d’essence de mimosa, 3 % d’extrait de lierre Quantité de produit : 1,5 g (adultes, enfants de 14 à 18 ans), 1,1 g (enfants de 9 à 13 ans) L’exposition par inhalation à l’énoxolone, à l’essence de mimosa et à l’extrait de lierre n’a pas été quantifiée, car ces substances n’étaient pas considérées comme volatiles. Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la vapeur, évaporation et superficie de libération constante ». |
| Nettoyant pour le visage (essence de bois de cèdre, essence de bois de cèdre du Texas, énoxolone, essence de mimosa, extrait de lierre) | Concentration : 10 % d’essence de bois de cèdre, 10 % d’essence de bois de cèdre du Texas, 10 % d’énoxolone, 1 % d’essence de mimosa, 3 % d’extrait de lierre Quantité de produit : 3,3 g (adultes, enfants de 14 à 18 ans) (Ficheux et al., 2016); 3,1 g (enfants de 9 à 13 ans) (valeur ajustée selon la surface exposée) L’exposition par inhalation à l’énoxolone, à l’essence de mimosa et à l’extrait de lierre n’a pas été quantifiée, car ces substances n’étaient pas considérées comme volatiles. Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la vapeur, évaporation et superficie de libération constante ». |
| Produit de maquillage pour le visage (fond de teint liquide) (essence de bois de cèdre, essence de bois de cèdre du Texas, énoxolone, essence de mimosa, extrait de lierre) | Concentration : 0,3 % d’essence de bois de cèdre, 0,3 % d’essence de bois de cèdre du Texas, 0,1 % d’énoxolone, 10 % d’essence de mimosa, 0,1 % d’extrait de lierre Quantité de produit : 0,54 g (adultes) (Loretz et al., 2016); 0,41 g (enfants de 14 à 18 ans) (Ficheux et al., 2016); 0,39 g (enfants de 9 à 13 ans) (valeur ajustée selon la surface exposée); 0,34 g L’exposition par inhalation à l’énoxolone, à l’essence de mimosa et à l’extrait de lierre n’a pas été quantifiée, car ces substances n’étaient pas considérées comme volatiles. Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la vapeur, évaporation et superficie de libération constante ». |
| Produit de maquillage pour le visage (en pulvérisateur) (extrait de lierre) | Concentration : 6 % d’extrait de lierre Quantité de produit : Calculée à partir de l’extrémité supérieure de la plage du volume par pulvérisation, soit 0,16 mL, et de l’hypothèse que le nombre maximal de pulvérisations par jour est de 8. Quantité moyenne de produit (g/j) = 0,16 mL/pulvérisation (catalogue de produits d’O.Berg) * 8 pulvérisations/j (directives du fabricant) * masse volumique (g/mL) = 1,28 g/j (adultes, enfants de 14 à 18 ans, enfants de 9 à 13 ans, enfants de 4 à 8 ans) L’exposition par inhalation aux aérosols des pulvérisations a été quantifiée à l’aide du mode « exposition à la pulvérisation, pulvérisation » et des paramètres ci-dessous. |
| Démaquillant pour le visage (énoxolone, essence de mimosa, extrait de lierre) | Concentration : 0,1 % d’énoxolone, 0,1 % d’essence de mimosa, 0,2 % d’extrait de lierre Quantité de produit : 4,4 g (adultes, enfants de 14 à 18 ans), 2,2 g (enfants de 9 à 13 ans, enfants de 4 à 8 ans) (Ficheux et al., 2016); 2,0 g (enfants de 3 ans) (valeur ajustée selon la surface exposée) L’exposition par inhalation à l’énoxolone, à l’essence de mimosa et à l’extrait de lierre n’a pas été quantifiée, car ces substances n’étaient pas considérées comme volatiles. |
| Parfum (en pulvérisateur) (alpha-cédrène, essence de bois de cèdre, essence de bois de cèdre du Texas, essence de mimosa) | Concentration : 1 % d’alpha-cédrène, 100 % d’essence de bois de cèdre, 30 % d’essence de bois de cèdre du Texas, 3 % d’essence de mimosa Quantité de produit : D’après une eau de toilette. 0,33 g (adultes, enfants de 14 à 18 ans, enfants de 9 à 13 ans, enfants de 4 à 8 ans, enfants de 2 à 3 ans) (Loretz et al., 2006) Pour les produits aérosols (essence de mimosa), les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la pulvérisation, libération instantanée ». Pour les autres produits (alpha-cédrène, essence de bois de cèdre et essence de bois de cèdre du Texas), les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la vapeur, évaporation et superficie de libération constante ». La moyenne pondérée dans le temps de l’exposition quotidienne par inhalation a été calculée à l’aide de la formule suivante : [((quantité d’aérosols inhalés (mg/m3) * durée (0,0833 h)) + (quantité d’évaporation inhalée (mg/m3) * durée (23,92 h))]/(durée totale (24 h)) |
| Parfum (en applicateur à bille) (essence de mimosa) | Concentration : 10 % d’essence de mimosa Quantité de produit : D’après une eau de toilette. 0,33 g (adultes, enfants de 14 à 18 ans, enfants de 9 à 13 ans, enfants de 4 à 8 ans, enfants de 2 à 3 ans) (Loretz et al., 2006) Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la vapeur, évaporation et superficie de libération constante ». Quantité de produit : Comme plus haut, modifiée pour tenir compte de la fréquence quotidienne et de la quantité restant sur la peau après l’absorption cutanée de la substance. Durée d’exposition et d’émission : 24 h |
| Produit capillaire lissant ou pour permanente (essence de bois de cèdre) | Concentration : 0,1 % d’essence de bois de cèdre Quantité de produit : 80 g (adultes, enfants de 14 à 18 ans) (Bremmer et al., 2006); 76 g (enfants de 9 à 13 ans) (valeur ajustée selon la surface exposée); 66 g (enfants de 4 à 8 ans) (valeur ajustée selon la surface exposée) Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la vapeur, évaporation et superficie de libération constante ». |
| Fixatif pour cheveux (en aérosol) (essence de bois de cèdre du Texas, essence de mimosa, extrait de lierre) | Concentration : 5 % d’essence de bois de cèdre du Texas, 0,1 % d’essence de mimosa, 0,1 % d’extrait de lierre Quantité de produit : 2,6 g (adultes) (Loretz et al., 2008); 2,3 g (enfants de 14 à 18 ans, enfants de 9 à 13 ans, enfants de 4 à 8 ans) (Ficheux et al., 2016) Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la pulvérisation, pulvérisation » (pulvérisation vers la personne exposée) et des paramètres ci-dessous. |
| Produit de coiffure (gel/cire/pâte) (essence de mimosa, extrait de lierre) | Concentration : 1 % d’essence de mimosa, 0,5 % d’extrait de lierre Quantité de produit : 3,7 g (adultes, enfants de 14 à 18 ans) (Ficheux et al., 2016); 3,5 g (enfants de 9 à 13 ans); 3,1 g (enfants de 4 à 8 ans); 2,8 g (enfants de 2 à 3 ans) (valeur ajustée selon la surface exposée) L’exposition par inhalation à l’essence de mimosa et à l’extrait de lierre n’a pas été quantifiée, car ces substances n’étaient pas considérées comme volatiles. |
| Produit de coiffure (mousse) (essence de mimosa, extrait de lierre) | Concentration : 0,1 % d’essence de mimosa, 0,1 % d’extrait de lierre Quantité de produit : 7,7 g (adultes, enfants de 14 à 18 ans) (Ficheux et al., 2016); 7,3 g (enfants de 9 à 13 ans); 6,3 g (enfants de 4 à 8 ans); 5,7 g (enfants de 2 à 3 ans) (valeur ajustée selon la surface exposée) L’exposition par inhalation à l’essence de mimosa et à l’extrait de lierre n’a pas été quantifiée, car ces substances n’étaient pas considérées comme volatiles. |
| Fixatif pour cheveux (pompe) (énoxolone) | Concentration : 0,1 % d’énoxolone Quantité de produit : 3,6 g (adultes), 1,1 g (enfants de 4 à 18 ans) Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la pulvérisation, pulvérisation » (pulvérisation vers la personne). |
| Produit médicamenteux de soins de la peau (crème) (énoxolone) (PSN) | Concentration : 0,2 % d’énoxolone (déclarée comme de l’acide glycyrrhétinique) Quantité de produit : 1,6 g (adultes, enfants de 14 à 18 ans), 1,2 g (enfants de 9 à 13 ans, enfants de 4 à 8 ans) (Ficheux et al., 2016); 0,87 g (enfants de 2 à 3 ans), 0,837 g (enfants de 1 an), 0,67 g (bébés de 6 à 11 mois) Il a été supposé que la crème médicamenteuse de soins de la peau est utilisée sur la peau endommagée; par conséquent, pour ce scénario, une absorption cutanée de 100 % est présumée. L’exposition par inhalation à l’énoxolone n’a pas été quantifiée, car cette substance n’était pas considérée comme volatile. |
| Rouge à lèvres et baume à lèvres (essence de bois de cèdre, essence de mimosa) | Concentration : 3 % d’essence de bois de cèdre, 10 % d’essence de mimosa Quantité de produit : 0,022 g (Ficheux et al., 2016) |
| Baume à lèvres (énoxolone) | Concentration : 1 % d’énoxolone Quantité de produit : 0,022 g (Ficheux et al., 2016) |
| Écran solaire (baume à lèvres) (essence de mimosa) (PSN) | Concentration : 3,2 % d’essence de mimosa (déclarées comme des esters d’Acacia decurrens/de jojoba/de cire de graine de tournesol/de poly[glycéryle-3]) Quantité de produit : 0,022 g (Ficheux et al., 2016) |
| Aromathérapie – liquide pour inhalation au moyen d’un diffuseur (PSN) (essence de bois de cèdre) | Concentration : 5 % d’essence de bois de cèdre (déclarées comme de l’huile d’écorce de Cedrus atlantica) Quantité de produit : 1,7136 g (4 à 12 gouttes par utilisation, 1 à 3 fois/j; volume par goutte : 0,05 mL; 0,05 mL * 12 gouttes * masse volumique * 3 fois/j) Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la vapeur, taux constant ». |
| Aromathérapie – liquide pour inhalation de vapeurs provenant d’un bol (PSN) (essence de bois de cèdre) | Concentration : 5 % d’essence de bois de cèdre (déclarées comme de l’huile d’écorce de Cedrus atlantica) Quantité de produit : 0,5712 g (4 à 12 gouttes par utilisation, 1 à 3 fois/j; volume par goutte : 0,05 mL; 0,05 mL * 12 gouttes * masse volumique * 1 application/j) Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la vapeur, évaporation et superficie de libération constante ». |
| Pain de massage (essence de mimosa) | Concentration : 1 % d’essence de mimosa Quantité de produit : 3,2 g (adultes, sous-population choisie en fonction des renseignements sur le produit) (Ficheux et al., 2016). L’huile de massage a servi de substitut pour le pain de massage. L’exposition par inhalation à l’essence de mimosa n’a pas été quantifiée, car cette substance n’était pas considérée comme volatile. |
| Huile de massage (essence de bois de cèdre, essence de bois de cèdre du Texas, énoxolone, essence de mimosa, extrait de lierre) | Concentration : 3 % d’essence de bois de cèdre, 3 % d’essence de bois de cèdre du Texas, 0,3 % d’essence de mimosa, 3 % d’extrait de lierre Quantité de produit : 3,2 g (adultes); 2,9 g (enfants de 14 à 18 ans); 2,3 g (enfants de 9 à 13 ans); 1,9 g (enfants de 4 à 8 ans); 1,8 g (enfants de 2 à 3 ans, enfants de 1 an, bébés de 6 à 11 mois, bébés de 0 à 5 mois) (Ficheux et al., 2016) L’exposition par inhalation à l’essence de mimosa et à l’extrait de lierre n’a pas été quantifiée, car ces substances n’étaient pas considérées comme volatiles. Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la vapeur, évaporation et superficie de libération constante ». |
| Écran solaire (poudre) (extrait de lierre) (PSN) | Concentration : 0,1 % d’extrait de lierre (déclarés comme de l’extrait d’Hedera helix [lierre]) Quantité de produit : 0,073 g (adultes) (Ficheux et al., 2016) Concentration dans l’air : 1,36 mg/m3 (ECCC, SC, 2018c) Exposition par inhalation (mg/kg p.c./j) = concentration dans l’air (mg/m3) * concentration dans le produit * durée d’exposition (h/j) * taux d’inhalation (m3/j) / poids corporel (kg) |
| Bain de bouche (essence de bois de cèdre) | Concentration : 0,1 % d’essence de bois de cèdre Quantité de produit : 1,7 g (adultes, enfants de 14 à 18 ans) (SCCS, 2015; Ficheux et al., 2016); 1 g (enfants de 9 à 13 ans, enfants de 4 à 8 ans) (étiquettes de produits; SCCS, 2015) |
| Contre-irritant (en pulvérisateur) (PSN) (essence de bois de cèdre) | Concentration : 2 % d’essence de bois de cèdre (déclarées comme de l’huile essentielle de bois de cèdre) Quantité de produit : 0,46 g [0,16 mL/pulvérisation (catalogue de produits d’O.Berg) * 3 pulvérisations * masse volumique] Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la pulvérisation, libération instantanée ». |
| Colorant capillaire permanent (énoxolone, extrait de lierre) | Concentration : 0,1 % d’énoxolone, 0,1 % d’extrait de lierre Quantité de produit : 132,6 g (adultes, enfants de 14 à 18 ans) (Ramirez-Martinez et al., 2015) L’exposition par inhalation à l’énoxolone et à l’extrait de lierre n’a pas été quantifiée, car ces substances n’étaient pas considérées comme volatiles. |
| Aromathérapie – pulvérisateur pour voies respiratoires (PSN) (essence de bois de cèdre) | Concentration : 0,68 % d’essence de bois de cèdre (déclarées comme de l’huile essentielle de bois de Cedrus atlantica) Quantité de produit : 0,46 g [0,16 mL/pulvérisation (catalogue de produits d’O.Berg) * 3 pulvérisations * masse volumique] Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la pulvérisation, libération instantanée ». |
| Shampooing (essence de bois de cèdre, essence de bois de cèdre du Texas, énoxolone, essence de mimosa, extrait de lierre) | Concentration : 5 % d’essence de bois de cèdre, 5 % d’essence de bois de cèdre du Texas, 0,3 % d’énoxolone, 0,1 % d’essence de mimosa, 3 % d’extrait de lierre Quantité de produit : 11,8 g (adultes) (Loretz et al., 2008); 10,4 g (enfants de 14 à 18 ans), 7,5 g (enfants de 9 à 13 ans) (Ficheux et al., 2016); 9,7 g (enfants de 4 à 8 ans), 7,9 g (enfants de 2 à 3 ans), 6,1 g (enfants de 1 an), 5,6 g (bébés de 6 à 11 mois), 3,9 g (bébés de 0 à 5 mois) (Gomez-Berrada et al., 2013) L’exposition par inhalation à l’énoxolone, à l’essence de mimosa et à l’extrait de lierre n’a pas été quantifiée, car ces substances n’étaient pas considérées comme volatiles. Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la vapeur, évaporation et superficie de libération constante ». |
| Crème à raser (corps) (alpha-cédrène, essence de bois de cèdre, essence de bois de cèdre du Texas) | Concentration : 0,1 % d’alpha-cédrène, 6,66 % d’essence de bois de cèdre, 10 % d’essence de bois de cèdre du Texas Quantité de produit : 12,7 g (enfants de 14 ans à adultes) (Ficheux et al., 2016); 9,9 g (enfants de 9 à 13 ans) (valeur ajustée selon la surface exposée) Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la vapeur, évaporation et superficie de libération constante ». |
| Crème à raser (visage) (essence de bois de cèdre, énoxolone) | Concentration : 5 % d’essence de bois de cèdre, 0,1 % d’énoxolone Quantité de produit : 6,8 g (enfants de 14 ans à adultes) (Ficheux et al., 2016); 6,4 g (enfants de 9 à 13 ans) (valeur ajustée selon la surface exposée) L’exposition par inhalation à l’énoxolone n’a pas été quantifiée, car cette substance n’était pas considérée comme volatile. Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la vapeur, évaporation et superficie de libération constante ». |
| Produit autobronzant pour le corps (essence de mimosa) | Concentration : 10 % d’essence de mimosa Quantité de produit : 18,2 g (enfants de 14 ans à adultes) (Ficheux et al., 2016) L’exposition par inhalation à l’essence de mimosa n’a pas été quantifiée, car cette substance n’était pas considérée comme volatile. |
| Écran solaire (crème/lotion) (énoxolone, essence de mimosa) (PSN et MVL) | Concentration : 0,5 % d’énoxolone (déclarée comme de l’acide glycyrrhétinique) (PSN), et 0,5 % (MVL), 0,105 % d’essence de mimosa (déclarées comme de la cire de fleur d’Acacia decurrens) Quantité de produit : 18,2 g (adultes, enfants de 14 à 18 ans), 6,3 g (enfants de 9 à 13 ans, enfants de 4 à 8 ans), 5,4 g (enfants de 2 à 3 ans, enfants de 1 an, bébés de 6 à 11 mois) (Ficheux et al., 2016) L’exposition par inhalation à l’énoxolone et à l’essence de mimosa n’a pas été quantifiée, car ces substances n’étaient pas considérées comme volatiles. |
| Colorant capillaire temporaire (essence de bois de cèdre du Texas, extrait de lierre) | Concentration : 0,1 % d’essence de bois de cèdre du Texas, 0,1 % d’extrait de lierre Quantité de produit : 35 g (adultes, enfants de 14 à 18 ans, enfants de 9 à 13 ans, enfants de 4 à 8 ans) (SCCS, 2015) L’exposition par inhalation à l’extrait de lierre n’a pas été quantifiée, car cette substance n’était pas considérée comme volatile. Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la vapeur, évaporation et superficie de libération constante ». |
| Dentifrice (essence de bois de cèdre, énoxolone) (cosmétique et PSN) | Concentration : 0,5 % d’essence de bois de cèdre, 0,1 % (cosmétique) et 0,05 % (PSN) d’énoxolone Quantité de produit : 0,08 g (adultes, enfants de 14 à 18 ans); 0,14 g (enfants de 9 à 13 ans) (SCCS, 2015; Ficheux et al., 2016); 0,21 g (enfants de 4 à 8 ans, enfants de 2 à 3 ans) (Strittholt et al., 2016) Fréquence : 2,5 (adultes); 2,6 (enfants de 14 à 18 ans, enfants de 9 à 13 ans); 2,9 (enfants de 4 à 8 ans, enfants de 2 à 3 ans) (Garcia-Hidalgo et al., 2017) Seuls les adultes sont considérés comme des utilisateurs de dentifrice cosmétique contenant de l’énoxolone. |
| Scénario d’exposition | Hypothèses |
|---|---|
| Assainisseur d’air (enfichable) (alpha-cédrène) | Concentration : 1 % d’alpha-cédrène Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la vapeur, taux constant ». Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air (mg/m3) (moyenne pondérée sur 24 h) * taux d’inhalation (m3/j)] ÷ poids corporel (kg) Quantité de produit sur la peau (adultes seulement) : 0,53 g (RIVM, 2021b) |
| Assainisseur d’air (bloc de cire) (essence de bois de cèdre du Texas) | Concentration : 1 % d’essence de bois de cèdre du Texas L’exposition cutanée a été calculée à l’aide du modèle de ConsExpo « contact direct avec le produit, application instantanée ». Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la vapeur, taux constant » et des paramètres ci-dessous. |
| Aérosol pour l’entretien du cuir (alpha-cédrène) | Concentration : 5 % d’alpha-cédrène Quantité de produit : 138 g (adultes) (selon le document RIVM [2018] en ce qui concerne un aérosol d’entretien du cuir en pulvérisateur à gâchette; le taux de contact est de 46 mg/min. Comme la durée de rejet est de 3 min, la quantité de produit résultante est de 138 mg.) Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la pulvérisation, libération instantanée » (pulvérisation de substances volatiles sur du cuir) et des paramètres ci-dessous. |
| Détergent à lessive liquide (mélange et chargement d’un liquide pour le lavage à la main, étendage de vêtements lavés à la machine) (adultes) (essence de bois de cèdre du Texas) | Concentration : 1 % d’essence de bois de cèdre du Texas Mélange et chargement (exposition cutanée) : Lavage (exposition cutanée) : Étendage (exposition cutanée) : Exposition cutanée totale (mg/kg p.c./j) = [exposition cutanée (mélange/chargement) (mg) + exposition cutanée (lavage) (mg) + exposition cutanée (étendage) (mg)] ÷ poids corporel (kg) Mélange et chargement (exposition par inhalation) : Lavage (exposition par inhalation) : Étendage (exposition par inhalation) : Concentration dans l’air (moyenne pondérée sur 24 h) = {[concentration moyenne dans l’air – mélange et chargement (mg/m3) * durée (0,75 min)] + [concentration moyenne dans l’air – lavage (mg/m3) * durée (10 min)] + [concentration moyenne dans l’air – étendage (mg/m3) * durée (240 min)]} ÷ {[durée totale (250,75 min)] * [250,75 min * (24 h/60 min)]} |
| Détergent à lessive liquide (migration à partir des vêtements lavés) (enfants de 1 an) (essence de bois de cèdre du Texas) | Concentration : 1 % d’essence de bois de cèdre du Texas Migration à partir de vêtements lavés à la machine (exposition cutanée) : Fraction massique du produit sur le textile : 7,6 × 10-4 (liquide ordinaire) (RIVM, 2018, tableau 6.7), valeur par défaut pour la fraction lixiviable – 3,8 g de résidu pour 150 g de produit sur 5 000 g de textile Exposition orale accidentelle (mordillage de textiles lavés) (enfants de 1 an) : Concentration résiduelle à la surface (mg/cm2) : Voir le calcul plus haut Exposition combinée (enfants de 1 an) = Exposition cutanée par migration à partir des vêtements lavés + exposition orale accidentelle par mordillage de vêtements ou de textiles lavés |
| Détergent à lessive liquide (mélange et chargement d’un liquide pour le lavage à la machine, étendage de vêtements lavés à la machine) (adultes) (essence de bois de cèdre du Texas) | Concentration : 1 % d’essence de bois de cèdre du Texas Mélange et chargement (exposition cutanée) : Étendage du linge (exposition cutanée) : Mélange et chargement (exposition par inhalation) : Étendage (exposition par inhalation) : Concentration dans l’air (moyenne pondérée sur 24 h) = {[concentration moyenne dans l’air – mélange et chargement (mg/m3) * durée (0,75 min)] + [concentration moyenne dans l’air – étendage (mg/m3) * durée (240 min)]} / {[durée totale (240,75 min)] * (240,75 min) (24 h/60 min)} Exposition cutanée totale = exposition cutanée pendant le mélange et le chargement + exposition cutanée pendant l’étendage des vêtements lavés |
| Produit de nettoyage ou de désodorisation des toilettes ou des urinoirs (nettoyage automatique des cuvettes) (alpha-cédrène) | Concentration : 10 % d’alpha-cédrène Application (exposition cutanée) : Application (exposition par inhalation) : |
| Produit de nettoyage ou de désodorisation des toilettes ou des urinoirs (essence de bois de cèdre du Texas) | Concentration : 1 % d’essence de bois de cèdre du Texas Application (exposition cutanée) : Application (exposition par inhalation) : |
| Scénario d’exposition | Hypothèses |
|---|---|
| Bonbon à la réglisse noire (énoxolone) | Concentration d’acide glycyrrhizique dans les bonbons : 0,1 % (Ballin et al., 2023) Consommation de bonbons à la réglisse noire : 80 g/portion/ja |
| Thé à la réglisse (énoxolone) | Concentration d’acide glycyrrhizique dans le thé : 114 mg/L (Ballin et al., 2023) 1 tasse : 237 mL |
Annexe B. Paramètres d’estimation de l’exposition cutanée, par inhalation et par voie orale à des produits faits soi-même
L’exposition aux produits disponibles aux consommateurs a été estimée à l’aide de ConsExpo Web (2016). Les estimations de l’exposition ont été calculées à partir des poids corporels et des taux d’inhalation par défaut suivants : 74 kg/15,1 m3/j, 62 kg/15,9 m3/j, 42 kg/13,9 m3/j, 23 kg/11,1 m3/j, 15 kg/9,2 m3/j, 11 kg/8,0 m3/j, 9,1 kg/5,4 m3/j et 6,3 kg/3,7 m3/j pour les adultes (19 ans et plus), les enfants de 14 à 18 ans, les enfants de 9 à 13 ans, les enfants de 4 à 8 ans, les enfants de 2 à 3 ans, les enfants de 1 an, les bébés de 6 à 11 mois, et les bébés de 0 à 5 mois, respectivement (Santé Canada, 2021).
Un facteur d’absorption cutanée de 25 % a été employé pour les substances du sous-groupe 1 des sesquiterpènes tricycliques ainsi que pour tous les triterpénoïdes, y compris l’essence de mimosa et l’extrait de lierre. Les estimations calculées de l’exposition à l’essence de mimosa ont été multipliées par 30 % pour tenir compte de la quantité maximale des composés apparentés au lupéol (lupénone et lupéol) dans l’essence de mimosa, et celles de l’exposition à l’extrait de lierre ont été multipliées par 50 % pour tenir compte des composés à base de stéroïdes (hédéracoside C, hédéragénine et alpha-hédérine) dans l’extrait de lierre.
L’exposition cutanée (mg/kg p.c./j) a été calculée à l’aide de la formule suivante, à moins d’indication contraire : [quantité moyenne de produit (g/application) * fréquence quotidienne moyenne * concentration dans le produit * facteur de rétention * facteur de conversion (1 000 mg/g)] ÷ poids corporel (kg). L’exposition systémique dérivée de l’exposition cutanée (mg/kg p.c./j) a été calculée à l’aide de la formule suivante : exposition cutanée * absorption cutanée.
L’exposition par inhalation (mg/kg p.c./j) a été calculée à l’aide de la formule suivante, à moins d’indication contraire : [concentration dans l’air (mg/m3) (moyenne pondérée sur 24 h) * taux d’inhalation (m3/j)] ÷ poids corporel (kg).
L’exposition par voie orale (mg/kg p.c./j) a été calculée à l’aide de la formule suivante : [quantité moyenne de produit (g/application) * fréquence quotidienne moyenne * concentration dans le produit * facteur de conversion (1 000 mg/g)] ÷ poids corporel (kg).
L’exposition combinée (mg/kg p.c./j) a été calculée à l’aide de la formule suivante : exposition cutanée systémique (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j) + exposition par voie orale (mg/kg p.c./j).
| Scénario d’exposition | Hypothèses |
|---|---|
| Diffuseur d’arôme ou assainisseur d’air fait soi-même (essence de bois de cèdre, essence de bois de cèdre du Texas, essence de mimosa) | Concentration : 100 % d’essence de bois de cèdre, 100 % d’essence de bois de cèdre du Texas, 100 % d’essence de mimosa Quantité de produit considérée pour l’exposition cutanée : Les concentrations dans l’air ont été modélisées au moyen d’un mode « exposition à la vapeur, taux constant ». Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air (mg/m3) (moyenne pondérée sur 24 h) * taux d’inhalation (m3/j) * fréquence (365 fois/365 (an))] ÷ poids corporel |
| Huile de massage faite soi-même (essence de bois de cèdre, essence de bois de cèdre du Texas, essence de mimosa, extrait de lierre) | Concentration : 3 % d’essence de bois de cèdre, 3 % d’essence de bois de cèdre du Texas, 3 % d’essence de mimosa, 3 % d’extrait de lierre Quantité de produit : 3,2 g (adultes); 2,9 g (enfants de 14 à 18 ans); 2,3 g (enfants de 9 à 13 ans); 1,9 g (enfants de 4 à 8 ans); 1,8 g (enfants de 2 à 3 ans, enfants de 1 an, bébés de 6 à 11 mois, bébés de 0 à 5 mois) (Ficheux et al., 2016) Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la vapeur, évaporation et superficie de libération constante ». |
| Produit pour le bain fait soi-même (essence de bois de cèdre, essence de bois de cèdre du Texas) | Concentration : 100 % d’essence de bois de cèdre, 100 % d’essence de bois de cèdre du Texas Quantité de produit : Selon l’ajout d’environ 10 gouttes d’huile essentielle pure à un bain rempli de 120 L d’eau (une goutte équivalant à 0,05 mL), ce nombre étant multiplié par la masse volumique de l’huile (RIVM, 2006). Superficie : 16 460 cm2 (enfants de 14 à 18 ans), 12 700 cm2 (enfants de 9 à 13 ans) |
| Hydratant pour le corps fait soi-même (essence de bois de cèdre, essence de bois de cèdre du Texas, essence de mimosa, extrait de lierre) | Concentration : 3 % d’essence de bois de cèdre, 3 % d’essence de bois de cèdre du Texas, 3 % d’essence de mimosa, 3 % d’extrait de lierre Quantité de produit : 10 g (adultes, enfants de 14 à 18 ans); 7,7 g (enfants de 9 à 13 ans); 5 g (enfants de 4 à 8 ans); 4,1 g (enfants de 2 à 3 ans); 3,1 g (enfants de 1 an); 2,5 g (bébés de 6 à 11 mois); 2 g (bébés de 0 à 5 mois) (Ficheux et al., 2016) Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la vapeur, évaporation et superficie de libération constante ». |
| Brumisateur facial fait soi-même (essence de bois de cèdre, essence de bois de cèdre du Texas, essence de mimosa) | Concentration : 100 % d’essence de bois de cèdre, 100 % d’essence de bois de cèdre du Texas, 100 % d’essence de mimosa Quantité de produit : Selon l’ajout d’environ 10 gouttes d’huile essentielle à l’appareil fixe (une goutte équivalant à 0,05 mL) * masse volumique (RIVM, 2006; Santé Canada, 2015). Fréquence : Supposée être de 1 (adultes, enfants de 14 à 18 ans, enfants de 9 à 13 ans, enfants de 4 à 8 ans) Les concentrations dans l’air ont été modélisées au moyen du mode de ConsExpo « exposition à la vapeur, taux constant ». Il est supposé que 50 % de la concentration moyenne par événement sera inhalée et que le reste causera une exposition cutanée. Pour l’exposition par inhalation après 20 minutes de brumisation du visage, il est supposé que la personne restera dans une pièce de 20 m3 pendant 3 h 40. Il est supposé qu’un non-utilisateur âgé de un an sera présent dans la pièce pendant 4 h. Exposition par inhalation pour 20 min (mg/kg p.c./j) = {concentration moyenne de l’événement (mg/m3) * 0,5 * [taux d’inhalation (m3/j) * durée d’exposition (20 min) ÷ (60 * 24)] * volume de la pièce} ÷ poids corporel Quantité de produit pour l’exposition cutanée : concentration moyenne de l’événement (mg/m3) * volume de la pièce (1 m3) * 0,5 Exposition par inhalation secondaire pendant 3 h 40 : Quantité totale inhalée en 20 min (mg) = concentration moyenne de l’événement (mg/m3) * 0,5 * air inhalé en 20 min (m3) Exposition par inhalation (mg/kg p.c./j) des non-utilisateurs (enfants de 1 an seulement) = quantité de produit dans l’air après 20 min répartie dans la pièce de 20 m3 (mg/m3) * taux d’inhalation (m3/j) * [220 min ÷ (60 min/h * 24 h/j)] ÷ poids corporel |
| Nettoyant liquide pour plancher fait soi-même (application) (adultes) (essence de bois de cèdre, essence de bois de cèdre du Texas) | Concentration : 100 % d’essence de bois de cèdre, 100 % d’essence de bois de cèdre du Texas Quantité de produit : 25 gouttes d’huile essentielle dans 3,8 L d’eau Application : Application (exposition par inhalation) : |
| Nettoyant liquide pour plancher fait soi-même (exposition par contact avec un plancher nettoyé) (enfants de 1 an) (essence de bois de cèdre, essence de bois de cèdre du Texas) | Concentration : 100 % d’essence de bois de cèdre, 100 % d’essence de bois de cèdre du Texas Exposition cutanée (mg/kg p.c./j) = [résidus déposés (mg/cm2) * fraction disponible pour transfert (%) * coefficient de transfert (cm2/h) * durée d’exposition (h) * absorption cutanée (%)] ÷ poids corporel (kg) Résidus déposés (mg/cm2) : 4 mg/cm2 (40 mL d’eau couvrant 1 m2 de plancher * masse volumique de l’eau) (RIVM, 2018) Coefficient de transfert : 1 927 cm2/h (coefficient de transfert pour un adulte [6 800 cm2/h] multiplié par un facteur 0,28 pour tenir compte de la superficie corporelle d’un enfant de 1 à 2 ans [5 300 cm2/18 700 cm2]) (Santé Canada, 2021). Fraction disponible pour transfert : 8 % Durée d’exposition : 2 h (temps passé dans les cuisines et les salles de bain) Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air (mg/m3) (moyenne pondérée sur 24 h) * taux d’inhalation (m3/j)] ÷ poids corporel (kg) Exposition orale accidentelle (mg/j) = [RM (mg/cm2) * (FM * SM (cm2)) * (DE * N_Régén) * (1 − (1 − FES)Freq_M-B/N_Régén)] Exposition combinée = exposition cutanée + exposition par inhalation + exposition orale accidentelle |

![C[C@@H]1CC[C@@H]2[C@]13CC=C([C@H](C3)C2(C)C)C](/content/dam/eccc/images/pded/terpenes-group-4/Table2-1-6.jpg)
![CC1=CC[C@@]2(CCCC([C@]23[C@H]1C3)(C)C)C](/content/dam/eccc/images/pded/terpenes-group-4/Table2-1-7.jpg)
![C[C@@H]1CC[C@@H]2[C@]13CCC(=C)[C@H](C3)C2(C)C](/content/dam/eccc/images/pded/terpenes-group-4/Table2-1-9.jpg)
![CC1=C[C@H]2[C@@H](CC1)C(=C)CCCC2(C)C](/content/dam/eccc/images/pded/terpenes-group-4/Table2-1-10.jpg)
![CC1=C[C@H]2C(=C(CCCC2(C)C)C)CC1](/content/dam/eccc/images/pded/terpenes-group-4/Table2-1-11.jpg)
![CC1=C[C@H]2[C@@H](CC1)C(=CCCC2(C)C)C](/content/dam/eccc/images/pded/terpenes-group-4/Table2-1-12.jpg)
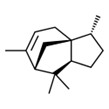
![CC1=CC[C@@]2(CCCC([C@]23[C@H]1C3)(C)C)C](/content/dam/eccc/images/pded/terpenes-group-4/Table2-1-15.jpg)
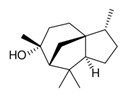
![C[C@@H]1CC[C@@H]2[C@]13CCC(=C)[C@H](C3)C2(C)C](/content/dam/eccc/images/pded/terpenes-group-4/Table2-1-17.jpg)
![CC1=C[C@H]2[C@@H](CC1)C(=C)CCCC2(C)C](/content/dam/eccc/images/pded/terpenes-group-4/Table2-1-18.jpg)
![CC1=C[C@H]2C(=C(CCCC2(C)C)C)CC1](/content/dam/eccc/images/pded/terpenes-group-4/Table2-1-19.jpg)
![CC1=C[C@H]2[C@@H](CC1)C(=CCCC2(C)C)C](/content/dam/eccc/images/pded/terpenes-group-4/Table2-1-20.jpg)
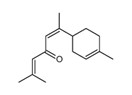
![CC1=CC[C@@]2(CCCC([C@]23[C@H]1C3)(C)C)C](/content/dam/eccc/images/pded/terpenes-group-4/Table2-1-22.jpg)
![C[C@@H]1CC[C@@H]2[C@]13CC=C([C@H](C3)C2(C)C)C](/content/dam/eccc/images/pded/terpenes-group-4/Table2-1-23.jpg)
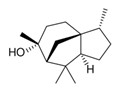
![C[C@]12CC[C@](C[C@H]1C3=CC(=O)[C@@H]4[C@]5(CC[C@@H](C([C@@H]5CC[C@]4([C@@]3(CC2)C)C)(C)C)O)C)(C)C(=O)O](/content/dam/eccc/images/pded/terpenes-group-4/Table2-2-2.jpg)
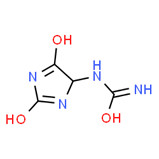
![CC(=C)[C@@H]1CC[C@]2([C@H]1[C@H]3CC[C@@H]4[C@]5(CCC(=O)C([C@@H]5CC[C@]4([C@@]3(CC2)C)C)(C)C)C)C](/content/dam/eccc/images/pded/terpenes-group-4/Table2-2-4.jpg)
![CC(=C)[C@@H]1CC[C@]2([C@H]1[C@H]3CC[C@@H]4[C@]5(CC[C@@H](C([C@@H]5CC[C@]4([C@@]3(CC2)C)C)(C)C)O)C)C](/content/dam/eccc/images/pded/terpenes-group-4/Table2-2-5.jpg)
![C[C@H]1[C@@H]([C@H]([C@H]([C@@H](O1)O[C@@H]2[C@H](O[C@H]([C@@H]([C@H]2O)O)OC[C@@H]3[C@H]([C@@H]([C@H]([C@@H](O3)OC(=O)](/content/dam/eccc/images/pded/terpenes-group-4/Table2-2-7.jpg)
![C[C@]12CC[C@@H]([C@@]([C@@H]1CC[C@@]3([C@@H]2CC=C4[C@]3(CC[C@@]5([C@H]4CC(CC5)(C)C)C(=O)O)C)C)(C)CO)O](/content/dam/eccc/images/pded/terpenes-group-4/Table2-2-8.jpg)
![C[C@H]1[C@@H]([C@H]([C@H]([C@@H](O1)O[C@@H]2[C@H]([C@H](CO[C@H]2O[C@H]3CC[C@]4([C@H]([C@]3(C)CO)](/content/dam/eccc/images/pded/terpenes-group-4/Table2-2-9.jpg)