Chapitre 2 des Normes canadiennes pour la lutte antituberculeuse : La pathogenèse et la transmission de la tuberculose
Sur cette page
- Auteurs et affiliation
- Points clés
- Transmission
- Pathogenèse
- Énoncé de divulgation
- Financement
- Références
Auteurs et affiliations
Richard Long; Unité d'évaluation et de recherche du programme de lutte antituberculeuse, département de médecine, faculté de médecine et de dentisterie de l'Université de l'Alberta, Edmonton, Alberta, Canada
Maziar Divangahi; Meakins-Christie Laboratories, Institut de recherche du Centre universitaire de santé McGill, Montréal, Québec, Canada
Kevin Schwartzman; Centre international de TB McGill, Montréal, Québec, Canada; Département de médecine, Université McGill, Montréal, Québec, Canada
Points clés
- À quelques exceptions près, une infection par Mycobacterium tuberculosis (M. tuberculosis) s'acquiert par inhalation de microgouttelettes (1 à 5 micromètres de diamètre) ne contenant que quelques mycobactéries capables d'atteindre les alvéoles pulmonaires.
- Les facteurs suivants augmentent la probabilité de transmission :
- charge bacillaire (frottis positif) du cas source;
patient - TB cavitaire ou TB pulmonaire siégeant dans la partie supérieure des poumons, comme montré par la radiographie thoracique du cas source;
- maladie laryngée du cas source;
- fréquence et sévérité de la toux chez le cas source;
- durée de l'exposition;
- proximité du cas source;
- espaces surpeuplés et mal ventilés;
- retard dans le diagnostic ou dans la mise en route d'un traitement efficace du cas source.
- charge bacillaire (frottis positif) du cas source;
- La manière la plus efficace de réduire la transmission est de diagnostiquer rapidement la maladie et de traiter les patients atteints d'une TB pulmonaire active le plus rapidement possible.
- Chez certaines personnes, les macrophages alvéolaires éliminent les bacilles par des mécanismes immunitaires innés; chez d'autres, les bacilles peuvent se multiplier et provoquer une infection de TB. Les facteurs liés aux bacilles et les facteurs génétiques liés à l'hôte qui favorisent ou limitent l'acquisition de l'infection ne sont pas bien compris.
- Deux états intermédiaires récemment décrits surviennent entre le moment de l'infection et le développement d'une TB pulmonaire active et symptomatique : la tuberculose incipiens, un état susceptible d'évoluer vers une maladie active, mais ne provoquant pas d'anomalies détectables; et la tuberculose infraclinique, un état de maladie dû à une infection viable par M. tuberculosis ne causant pas de symptômes cliniques liés à la tuberculose, mais pouvant être détecté à l'aide des tests radiologiques ou microbiologiques existants.
1. Transmission
1.1 Introduction
- M. tuberculosis est une bactérie qui se transmet d'un humain à l'autre principalement par la voie aérosol, rarement par d'autres moyens tels que l'ingestion ou l'inoculation percutanée (par exemple, lors d'un accident de laboratoire ou à l'hôpital), ou encore à la suite d'une transplantation d'organe solide ou de cellules souches hématopoïétiquesRéférence 1. L'humain est le réservoir de la bactérie M. tuberculosis. La TB bovine, qui était autrefois causée par l'ingestion de lait fortement contaminé par Mycobacterium bovis ayant ensuite pénétré dans la muqueuse de l'oropharynx ou du tractus gastro-intestinal, est maintenant beaucoup moins fréquente dans le monde et presque complètement éliminée au Canada grâce à la pasteurisation du lait et l'utilisation de tests tuberculiniques sur le bétail.
Les gouttelettes dans les aérosols se déposent extrêmement lentement (0,5 mm par seconde ou moins), ce qui leur permet d'être transportées par les courants d'air, les canalisations ou les cages d'ascenseur à une grande distance de la source d'infection. Les grosses particules se déposent rapidement et peuvent ne pas être inhalées par des contacts ou, si elles le sont, elles sont emprisonnées dans le mucus qui tapisse les voies aériennes supérieures. Seules les microgouttelettes dont la taille se situe entre 1 et 5 micromètres, qui ne contiennent que quelques bacilles, atteignent les espaces aériens terminaux ou alvéoles.Référence 2Référence 3
La probabilité qu'un événement de transmission entraîne la maladie dépendra du nombre de microgouttelettes infectieuses par volume d'air (densité en particules infectieuses) et du temps pendant lequel une personne non infectée a inhalé cet air.
1.2. Déterminants de la transmission liés au patient, au pathogène et à l'environnement
Plusieurs facteurs liés au patient, au pathogène et à l'environnement déterminent s'il y a transmission (voir le Tableau 1).
| Patient | Pathogène | Environnement |
|---|---|---|
|
|
|
| Abréviation: RP = radiographie pulmonaire. | ||
| No réf. | Année de l'étude | Endroit | Contacts | Nombre (n) et pourcentage (%) de contacts infectés selon le statut bactériologique du cas index | % de la population générale positive à la tuberculine DPPTable 2 Note de bas de page a | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Âge | Total | F+C+ | F-C+ | F-C- | |||||||
| N | %+ | N | %+ | N | %+ | ||||||
| 8 | 1949-56 | Angleterre | 0-14 | 545 | 262 | 63 | 126 | 21 | 157 | 18 | 13% |
| 9 | 1950-53 | Angleterre | 0-14 | 823 | 374 | 65 | 228 | 27 | 221 | 18 | 22% |
| 10 | 1963-64 | Pays-Bas | Tous âges confondus | 858Table 2 Note de bas de page b | 391 | 20 | 467 | 1 | S.O. | S.O. | <1% |
| 11 | 1966-71 | Canada (race blanche) | 0-19 | 2406 | 1210 | 38 | 655 | 12 | 541 | 10 | 2% |
| Canada-Autochtones | 0-19 | 1168 | 592 | 45 | 377 | 31 | 199 | 27 | S.O. | ||
| 12 | 1967-69 | Rotterdam | 0-14 | 134 | 40 | 50 | 43 | 5 | 51 | 8 | 1% |
| 13 | 1969 | Etats-Unis | Tous âges confondus | 130 | 88 | 44 | 14 | 21 | 28 | 14 | S.O. |
| 14 | 1971-74 | Etats-Unis | Tous âges confondus | 761 | 504 | 46 | 257 | 28 | S.O. | S.O. | S.O. |
| 15 | 1975-77 | Etats-Unis | Tous âges confondus | 541 | 368 | 40 | 173 | 27 | S.O. | S.O. | S.O. |
Remarques: Abréviations: F = frottis; C = culture; DPP = dérivée de protéines purifiées; S.O. = sans objet. Notes de bas de page
| |||||||||||
1.2.1. Facteurs liés au patient (source)
À quelques rares exceptions près, la transmission nécessite qu'un patient tuberculeux soit capable de générer un aérosol infectieux. C'est pourquoi, dans la plupart des cas, seuls les adolescents ou les adultes souffrant d'une TB pulmonaire de l'adulte, qui se définit comme une maladie siégeant dans la région pulmonaire supérieure, avec ou sans cavitation, mais sans adénopathie discernable sur la radiographie pulmonaire, peuvent transmettre l'infection. Les enfants plus jeunes peuvent parfois être contagieux,Référence 4 mais en général, ils présentent peu de bacilles dans leurs lésions pulmonaires, ne produisent pas d'expectorations et sont par conséquent rarement en mesure de transmettre la maladie.Référence 5 La capacité de transmission des patients atteints de la forme pulmonaire de la maladie peut varier en fonction d'un certain nombre de facteurs, qui sont énumérés dans la section suivante. Ces facteurs influent sur la contagiosité, quel que soit le statut à l'égard du virus de l'immunodéficience humaine (VIH) du patient, même s'il apparaît que les patients tuberculeux co-infectés par le VIH sont moins contagieux que ceux qui ne le sont pas lorsqu'ils présentent une immunosuppression grave.Référence 6
Positivité ou non du frottis d'expectorations
Les patients atteints de tuberculose pulmonaire les plus infectieux sont ceux qui présentent une TB pulmonaire dont le frottis est positif et la culture est positive, suivis de ceux qui présentent une TB pulmonaire dont le frottis est négatif, mais la culture positive. Les patients les moins infectieux sont ceux qui présentent une TB pulmonaire dont le frottis est négatif et la culture négative Référence 7Référence 8Référence 9Référence 10Référence 11Référence 12Référence 13Référence 14Référence 15 (voir le Tableau 2 pour un résumé des études épidémiologiques sur le risque d'infection chez les contacts familiaux [proches] regroupés en fonction du statut bactériologique des cas sources). Un millilitre d'expectorations positives au frottis contient au moins 5 000 bacilles.Référence 16 Le liquide de lavage broncho-alvéolaire positif au frottis est considéré comme aussi infectieux que les expectorations positives.Référence 16 Ceux dont les expectorations provoquées sont positives au frottis sont considérés en pratique comme étant aussi contagieux que ceux dont les expectorations spontanées sont positives au frottis, bien qu'il n'existe encore aucune donnée étayant cette idée. L'utilisation d'outils empruntés à l'épidémiologie moléculaire seuls a permis de calculer que le taux relatif de transmission par les patients ayant un frottis négatif par rapport à ceux ayant un frottis positif se situait entre 0,17 et 0,22, ce qui équivaut approximativement à une probabilité de transmission cinq fois moindre.Référence 17Référence 18Référence 19 Combiner ces outils à des données épidémiologiques, spatio-temporelles et génomiques conventionnelles a permis de déterminer que le taux relatif de transmission entre ces groupes était d'environ 0,10, ce qui équivaut approximativement à une probabilité de transmission 10 fois moindre.Référence 20 Un résultat du frottis d'expectoration élevé implique également un risque relatif de transmission plus élevé.Référence 21 Outre la plus grande contagiosité des cas dont le frottis est positif, le risque de maladie après l'infection est plus élevé chez les personnes infectées par un patient dont le frottis est positif, étant donné la probabilité accrue d'infection répétée, que chez celles infectées par un patient dont le frottis est négatif (voir la section suivante). Une réaction en chaîne par polymérase (PCR) positive est également un facteur de risque de transmission.Référence 21 Il est possible qu'ultérieurement, les résultats semi-quantitatifs obtenus par PCR en temps réel avec le test Xpert MTB/RIF remplacent la microscopie du frottis comme indicateur de l'infectiosité.Référence 22Référence 23
Forme de tuberculose observée à la radiographie pulmonaire standard
Les cas de TB pulmonaire dont la radiographie pulmonaire révèle la formation de cavités sont plus contagieux que les cas de TB pulmonaire sans cavités, une fois les observations bactériologiques prises en compte.Référence 24Référence 25Référence 26 Les cas de TB pulmonaire avec frottis positif et cavités pulmonaires ont des résultats de frottis semi-quantitatifs plus élevés que ceux sans cavitation.Référence 27Référence 28 Les patients atteints de tuberculose pulmonaire aux signes radiologiques pulmonaires « typiques » (c.-à-d. lésion de la partie supérieure des poumons, avec ou sans formation de cavités, en l'absence de signes d'adénopathie intrathoracique) sont plus contagieux que les cas de TB pulmonaire aux signes radiologiques pulmonaires « atypiques » (c.-à-d. toute autre observation).Référence 29
Tuberculose laryngée
Les personnes atteintes d'une tuberculose laryngée sont plus contagieuses que celles atteintes d'une TB pulmonaire.Référence 30 La plupart des cas de TB laryngée présentent aussi une maladie pulmonaire avancée.Référence 31
Symptomatologie
De façon générale, la respiration normale produit un faible nombre de particules infectieuses, tandis qu'une quinte de toux ou le fait de parler normalement pendant cinq minutes en produit un nombre beaucoup plus élevé, et un éternuement est ce qui en produit le plus.Référence 32Référence 33 La probabilité que les contacts familiaux soient infectés augmente en fonction de la fréquence de la toux chez le cas source.Référence 13Référence 34 Lorsqu'on a évalué l'infectiosité des gouttelettes produites par les patients à frottis positif en pulvérisant artificiellement des expectorations et en exposant des cobayes à une dose standard, on a observé qu'il y avait de grandes différences dans l'infectiosité des expectorations aérosolisées, ce qui pourrait peut-être expliquer l'extraordinaire hétérogénéité de la contagiosité chez les patients atteints d'une TB pulmonaire à frottis positif.Référence 35Référence 36Référence 37 Ainsi, même si des patients semblent avoir un nombre équivalent de bacilles dans leurs expectorations, les propriétés physiques et chimiques des expectorations d'un patient, et (ou) les caractéristiques de sa toux ou ses comportements peuvent déterminer le nombre de microgouttelettes produites. Le tabagisme peut augmenter le risque de transmission, vraisemblablement par son effet sur un ou plusieurs des mécanismes susmentionnés.Référence 38 Les allergies ou les infections virales des voies aériennes supérieures peuvent également augmenter, mais ces mécanismes n'ont pas été étudiés de manière approfondie.Référence 39
Diagnostic retardé
Le nombre de contacts et la durée de l'exposition de chaque contact peuvent augmenter à mesure que le délai avant le diagnostic s'allonge. Plus les symptômes durent longtemps chez le cas source, plus le risque de transmission est élevé.Référence 21
Traitement
Un traitement efficace adapté aux résultats de l'épreuve de sensibilité aux antituberculeux réduit rapidement la fréquence de la toux et le nombre de bacilles dans les expectorationsRéférence 13Référence 40 (voir le Chapitre 5 : Le traitement de la tuberculose active et l'Annexe B – Évaluation et recommandations relatives à la fin de l'isolement). Compte tenu de l'ampleur de la pharmacorésistance, l'évaluation de l'efficacité d'un traitement à réduire la contagiosité devrait être fondée sur des observations cliniques, radiographiques et/ou microbiologiques objectives de l'amélioration de l'état du patient, et non seulement sur le temps écoulé depuis la mise en route du traitement.
1.2.2. Facteurs liés au patient (récepteur)
D'une part, les personnes immunocompétentes qui ont été infectées dans le passé bénéficient d'une protection considérable contre la réinfection, estimée à environ 80 % (voir la section suivante sur la pathogenèse). Les personnes immunodéprimées, quant à elles, peuvent être réinfectées même si elles ont déjà été infectées et adéquatement traitées dans le passé. Des études d'observation suggèrent que la vaccination contre le bacille Calmette-Guérin (BCG) dans la petite enfance confère une certaine protection contre l'infection par M. tuberculosis détectée par un test de libération d'interféron gamma (TLIG).Référence 41Référence 42Référence 43Référence 44
1.2.3. Facteurs liés au pathogène
Les données suggèrent qu'une ou plusieurs propriétés de virulence de M. tuberculosis peuvent affecter sa capacité à être transmis.Référence 45 Une souche peut, par exemple, être plus apte qu'une autre à surmonter la résistance innée de l'hôte. Bien qu'il se soit avéré que les souches pharmacorésistantes avaient une virulence réduite dans des modèles animaux Référence 46 les preuves cliniques de leur transmissibilité sont clairesRéférence 47Référence 48Référence 49Référence 50 elles devraient en pratique être considérées comme aussi transmissibles que les souches sensibles aux médicaments. Les souches de la famille
Beijing/W ont été décrites comme hypervirulentes, mais les indices de transmission ne sont pas plus élevés chez les personnes infectées par ces souches que chez celles qui sont infectées par d'autres souches.Référence 51
1.2.4. Facteurs liés à l'environnement
À de rares exceptions près, les expositions à l'extérieur sont peu susceptibles de se conclure par une transmission.Référence 52 Il est entendu que la quasi-totalité de la transmission a lieu à l'intérieur. Voici les facteurs de transmission à l'intérieur.
Circulation et ventilation de l'air
Pour un nombre défini de bacilles tuberculeux expulsés dans l'air, le volume d'air dans lequel les bacilles sont expulsés détermine la probabilité qu'une personne réceptive respirant cet air contracte l'infection. Parmi les facteurs qui contribuent à augmenter la concentration de bacilles viables dans l'air inhalé par le sujet contact figurent le fait d'être exposé dans des espaces confinés, une mauvaise ventilation ou la recirculation de l'air, de même qu'une faible exposition à la lumière naturelle (rayons ultraviolets). La ventilation dilue la concentration des microgouttelettes infectieuses (voir le Chapitre 14 : La prévention et la lutte contre la transmission de la tuberculose dans les milieux de soins de santé).
Proximité du cas source
La proximité du cas source est aussi un déterminant de la transmission. Le surpeuplement est un facteur connexe : si la présence d'un grand nombre de personnes dans une pièce force une personne à être en contact étroit avec un cas de TB contagieuse, son risque d'infection s'en trouvera vraisemblablement accru. Et, bien sûr, le nombre de personnes exposées est augmenté.
Durée de l'exposition
En règle générale, les heures d'exposition à un patient atteint de tuberculose infectieuse sont un facteur prédictif important de l'infection tuberculeuse.Référence 53 La durée de l'exposition associée à la transmission est habituellement prolongée (des jours, des mois, voire même des années), bien que des rapports aient confirmé qu'en de rares occasions, des expositions intérieures rapprochées de quelques minutes seulement peuvent être suffisantes pour infecter un contact.Référence 54
1.3. Mesures visant à prévenir la transmission
La priorité doit être accordée au diagnostic précoce, à l'isolement immédiat et à la fourniture rapide d'un traitement efficace au cas source. Parce que, chez la plupart des patients atteints de TB, les symptômes font leur apparition de façon insidieuse, il faut en général plusieurs semaines ou mois avant que le patient ne consulte un professionnel de la santé et subisse des tests diagnostiques. À ce point, tout retard supplémentaire attribuable au médecin, à l'infirmière ou au système favorise la transmission indue de l'infection à d'autres. Le maintien d'une sensibilisation appropriée à la tuberculose parmi les prestataires de soins de santé est donc essentiel pour réduire la transmission, en leur permettant d'entreprendre un diagnostic et un traitement précoces.Référence 55 Les contrôles administratifs et techniques qui visent à réduire l'exposition dans les établissements de santé et autres lieux de rassemblement complètent, mais ne peuvent remplacer, un diagnostic rapide et un traitement approprié. Des mesures autrefois jugées importantes pour prévenir la transmission de la TB, c'est-à-dire enlever les effets personnels comme les vêtements et la literie, stériliser les vecteurs passifs, porter un couvre-chef et une blouse, faire bouillir la vaisselle, laver les murs) sont superflues, car elles n'ont aucune incidence sur la transmission par voie aérienne. La plupart des bactéries qui se logent sur des objets inanimés meurent rapidement sous l'action du séchage, de la chaleur ou du soleil.Référence 2Référence 3
2. Pathogenèse
La pathogenèse et la transmission de la tuberculose sont liées. M. tuberculosis est presque exclusivement un agent pathogène humain. C'est la manière dont il interagit avec l'hôte humain qui déterminera sa survie. Du point de vue du pathogène, une interaction hôte-pathogène efficace est une relation qui induit la transmission continue du pathogène.Référence 56
2.1. Évolution de l'infection initiale et réponse de l'hôte (description classique)
Au moment où l'infection s'installe, la distribution des microgouttelettes inhalées est déterminée par la ventilation régionale. Comme les microgouttelettes suivent généralement la voie la plus directe vers la périphérie, les parties moyennes et inférieures des poumons, qui reçoivent la majorité de l'air, sont habituellement celles où elles se logent.Référence 57 Chez les hôtes immunocompétents, la théorie veut que les macrophages alvéolaires ingèrent les organismes de M. tuberculosis. Que ces macrophages détruisent ou non les bactéries dépend du degré auquel ils sont activés de manière non spécifique, des facteurs génétiques de l'hôte et des mécanismes de résistance de la bactérie.Référence 58 Si les bacilles sont effectivement éliminés, les résultats resteront négatifs au test cutané à la tuberculine (TCT) et au test de libération d'interféron gamma (TLIG).
Lorsque l'activité microbicide innée des macrophages est insuffisante pour détruire les quelques premiers bacilles présents dans les microgouttelettes, les bacilles se multiplient de façon logarithmique; leur nombre double toutes les 24 heures jusqu'à ce que le macrophage éclate et libère leur progéniture.Référence 59 De nouveaux macrophages attirés vers le site englobent ces bacilles, et le cycle recommence. Les bacilles peuvent se disséminer depuis la lésion initiale vers d'autres régions de l'organisme par le système lymphatique ou par l'appareil circulatoire. Cette dissémination peut, en fait, être essentielle à l'induction de l'immunité cellulaire (voir la section suivante). C'est aussi pendant cette phase que se produit l'ensemencement des apex pulmonaires, qui est si important pour le développement ultérieur de la TB pulmonaire chez l'adulte (infectieuse).Référence 59 Au bout d'une période de 3 à 8 semaines, l'hôte développe une immunité spécifique (immunité à médiation cellulaire [IMC] et hypersensibilité retardée [HR]) contre les bacilles. C'est à ce moment-là que les personnes présentent normalement leurs premiers résultats positifs au TCT et au TLIG. Les lymphocytes spécifiques de M. tuberculosis migrent ensuite vers le site de l'infection, entourant et activant les macrophages localisés sur le site. À mesure que l'infiltration cellulaire se poursuit, le centre de l'amas de cellules, appelé granulome, devient caséeux et nécrotique. La fibrocalcification résiduelle peut être visible ultérieurement à la radiographie au niveau du siège initial de l'infection et peut permettre de constater un granulome calcifié du poumon seul ou accompagné d'un foyer granulomateux calcifié au niveau d'un ganglion lymphatique de drainage, ce qu'on appelle un complexe de Ranke.Référence 60 L'infection et le virage sérologique sont généralement asymptomatiques; si des symptômes se manifestent, ils disparaissent d'eux-mêmes. Chez une faible proportion des cas infectés, un érythème noueux (réponse immunitaire cutanée à une infection tuberculeuse extracutanée) ou une conjonctivite phlycténulaire (réaction d'hypersensibilité) peuvent survenir.
2.2. Évolution précoce vers la maladie (primo-infection tuberculeuse progressive)
Chez une partie des personnes récemment infectées, l'infection ne peut être maîtrisée malgré la stimulation de l'immunité à médiation cellulaire (IMC). Dans ces cas, l'infection évolue vers la maladie en quelques mois. Comme cette évolution précoce vers la maladie est liée à l'âge et à la réponse immunitaire de la personne, la maladie touche principalement les jeunes enfants de 0 à 4 ans et les personnes immunodéprimées.Référence 61Référence 62Référence 63Référence 64 La progression locale dans le poumon, ou la dissémination lymphohématogène entraînant une TB disséminée (miliaire) et une atteinte du système nerveux central peuvent se manifester dès les 2 à 6 mois suivant le début de l'infection chez les nourrissons et les personnes sévèrement immunodéprimées.Référence 61Référence 64 Une adénopathie asymptomatique et non compliquée (hilaire ou médiastinale, sans atteinte des voies aériennes) peut aussi survenir dans les 2 à 6 mois suivant le début de l'infection, mais on ne s'entend pas à savoir si elle constitue une forme de maladie active (voir le Chapitre 9 : La tuberculose de l'enfant).Référence 61Référence 65
Les manifestations de la TB dans les 4 à 12 mois suivant le début de l'infection peuvent comprendre une lymphadénite compliquée (compression des voies aériennes, pneumonie caséeuse expansive, infiltration des structures anatomiques adjacentes), une affection de la plèvre (dans la plupart des cas, un épanchement exsudatif à prédominance lymphocytaire) et une lymphadénite périphérique (généralement au niveau des ganglions lymphatiques cervicaux)Référence 61 Au départ, la TB se manifeste le plus souvent par une adénopathie intrathoracique chez les enfants et les adolescents immunocompétents et par un épanchement pleural unilatéral chez les adultes. Dans le cas des personnes sévèrement immunodéprimées de tous âges (p. ex. à un stade avancé de l'infection par le VIH ou du SIDA), elle peut se manifester par une adénopathie intrathoracique.Référence 66Référence 67 Il arrive que des enfants nouvellement infectés âgés de 10 ans et plus (pubères) développent une TB pulmonaire de l'adulte (voir ci-dessous) ou d'autres formes de TB extrapulmonaire (p. ex. TB ostéo-articulaire) dans les 8 à 24 premiers mois suivant le début de l'infection.Référence 61Référence 68
Pour les besoins de la déclaration de la maladie, la plupart des personnes, mais pas toutes, ayant reçu un diagnostic de TB dans les 18 à 24 mois suivant le début de l'infection sont considérées comme un cas de primo-infection tuberculeuse. Les personnes nouvellement infectées qui ne développent pas de TB durant cette période peuvent présenter trois résultats : elles demeurent infectées par la maladie, mais ne la présenteront jamais, elles peuvent guérir naturellement de l'infection avec le temps ou elles peuvent développer une TB active ultérieurement, après la période de 18 à 24 mois. Le concept de tolérance aux maladies permet de mieux comprendre les interactions hôte-pathogène susmentionnées.
2.3. Tolérance aux maladies
Il est de plus en plus évident que les stratégies de défense de l'hôte contre les maladies infectieuses comprennent la résistance de l'hôte et la tolérance aux maladies. La résistance de l'hôte est la capacité de l'hôte à prévenir l'invasion ou à éliminer l'agent pathogène,Référence 69 tandis que la tolérance aux maladies est définie par la capacité à limiter les dommages tissulaires causés par le pathogène et (ou) la réponse immunitaire. Depuis la découverte de M. tuberculosis il y a plus d'un siècle, des progrès importants ont été réalisés dans la définition des mécanismes de résistance de l'hôte à ce pathogène respiratoire. En revanche, notre compréhension de l'immunité naturelle chez 90 à 95 % des personnes infectées qui ne développent pas la maladie est extrêmement limitée.
L'incapacité du système immunitaire inné et adaptatif à éliminer la bactérie oblige l'hôte à développer une barrière cellulaire, appelée granulome, autour des cellules infectées. Le moment où l'organisme commence à former des granulomes semble être le point où l'immunité de l'hôte « bascule » et passe de la résistance à la tolérance. Des études ont en effet démontré que la communication intercellulaire dans le granulome est organisée et qu'une signalisation pro-inflammatoire se produit au cœur du granulome pour contrôler la croissance de M. tuberculosis, tandis que la signalisation anti-inflammatoire à la périphérie agit pour limiter les dommages tissulaires.Référence 70Référence 71 La compartimentation spatiale de la signalisation pro- et anti-inflammatoire semble donc essentielle dans la fonction du granulome, qui est d'empêcher la dissémination de M. tuberculosis.
2.4. Infection tuberculeuse
Selon le concept classique d'infection tuberculeuse (ITB), les bacilles de M. tuberculosis peuvent survivre pendant des années dans le site de l'infection initiale dans le poumon, les ganglions lymphatiques drainants et dans les petits granulomes ou dans la matière caséeuse solide des foyers ensemencés par voie lymphohématogène. Vraisemblablement, les conditions locales, une immunité à médiation cellulaire intacte ou la présence d'inhibiteurs créent des conditions peu propices à la multiplication. Récemment, la cartographie de la séquence complète du génome de M. tuberculosis a révélé que celui-ci est en mesure de synthétiser des enzymes qui interviennent dans le métabolisme anaérobie.Référence 72 Bien que le bacille meure et s'autolyse rapidement si le milieu est soudainement privé d'oxygène, il peut passer à un état de dormance s'il y a réduction progressive de la tension en oxygène.Référence 73Référence 74 Par conséquent, s'il est vrai que M. tuberculosis se développe bien dans un environnement aérobie, il possède la capacité génétique et biochimique de survivre en milieu anaérobie dans des milieux expérimentalement dépourvus d'oxygène. La formation de granulomes, avec leur environnement dépourvu d'oxygène, est une caractéristique qui définit la TB. C'est à ce stade de l'infection qu'on appelle ITB que la maladie est normalement détectée par un résultat positif au TCT ou au TLIG en l'absence de maladie active (voir le Chapitre 4 : Le diagnostic de l'infection tuberculeuse).
2.5. Réinfection
Les études sophistiquées menées par Ferguson au cours de la première moitié du 20e siècle laissent fortement croire que la maturation des cellules responsables de l'IMC peut prendre jusqu'à 18 mois après le moment où l'infection débute.Référence 75Référence 76 Entretemps, chaque exposition successive et chaque réinfection présente le même risque inhérent de maladie; le risque cumulatif devient donc une fonction du nombre d'infections. Cela pourrait expliquer pourquoi la TB est beaucoup plus courante chez les contacts étroits nouvellement infectés des cas à frottis positif que chez les contacts étroits nouvellement infectés des cas à frottis négatif, le risque d'expositions multiples et de réinfection étant plus élevé chez les premiers que chez les derniers.Référence 11Référence 77Référence 78 Des études plus récentes ont également rapporté un risque de maladie plus élevé en lien avec l'intensité de l'exposition.Référence 79Référence 80
Une méta-analyse de 23 cohortes de l'ère pré antibiotique – comprenant principalement des travailleurs de la santé – estime qu'une réinfection ultérieure (après les 18 premiers mois) d'hôtes immunocompétents comporte un risque beaucoup plus faible de progression vers une TB active, qui est estimé à 21 % du risque de progression d'une infection initiale vers une maladie active.Référence 81 On ne sait toujours pas si une infection antérieure sans développement d'une maladie manifeste est simplement un marqueur pour les personnes moins susceptibles de développer la maladie ou si elle induit réellement une immunité qui parvient mieux à prévenir la progression après une réinfection.
Au Canada, le taux d'exposition répétée est rare dans la plupart des milieux, de sorte que la tuberculose active reflète généralement une infection initiale récente ou lointaine, plutôt qu'une réinfection.Référence 82 Il y a cependant des données claires qui montrent le rôle important de la réinfection dans la morbidité de la tuberculose dans les milieux à forte incidence et à forte transmission. Ce phénomène a été documenté principalement chez les personnes atteintes de VIH qui ne reçoivent pas de traitement antirétroviral, un groupe de personnes chez qui on observe un taux élevé de TB récidivante longtemps après la guérison microbiologique d'un épisode initial de la maladie.Référence 83Référence 84 La prise de l'empreinte ADN a confirmé que les nombreuses récidives sont liées à de nouvelles souches infectantes plutôt qu'à des rechutes tardives. Des preuves solides proviennent également d'essais cliniques menés auprès de personnes vivant avec le VIH dans des environnements à forte transmission. Ces essais ont démontré un taux élevé de TB après la fin du traitement préventif attribuable à la réinfection après le traitement. Référence 85
Une réinfection peut également entraîner une maladie répétée chez les personnes séronégatives qui ont été guéries après un premier épisode de tuberculose, si elles se trouvent dans des milieux où l'incidence et la transmission de TB sont extrêmement élevées.Référence 85 Cela peut être pertinent dans certains milieux canadiens très spécifiques (par exemple, les communautés isolées avec des épidémies importantes). Certaines personnes vivant dans ces milieux et ayant reçu un traitement antérieur documenté contre la tuberculose ont présenté une maladie récurrente par réinfection, ce qui a été montré par le séquençage du génome complet.Référence 86Référence 87 Ces observations peuvent conduire à envisager un retraitement de l'infection tuberculeuse après une nouvelle exposition à des cas sources hautement infectieux, selon ce qui peut être déterminé au cas par cas (voir le Chapitre 6 : Le traitement préventif de la tuberculose chez les adultes et le Chapitre 11 : La recherche des contacts et la gestion des épidémies de tuberculose).
2.6. TB de réactivation
Au Canada, la plupart des cas de TB seraient des « réactivations » (c.-à-d. qu'ils surviennent chez des adolescents ou des adultes). La TB de réactivation se manifeste généralement comme une TB pulmonaire de l'adulte (TB fibrocavitaire dans la partie supérieure des poumons – anciennement appelée TB post-primaire – s'installant dans de petits foyers à la suite d'une dissémination lymphohématogène à distance), mais elle peut aussi prendre la forme d'une TB extrapulmonaire. Tel que mentionné précédemment, il peut arriver à l'occasion que la TB pulmonaire de l'adulte soit la manifestation d'une primo-infection tuberculeuse ou d'une réinfection. Dans tous les groupes de la population, la réactivation de l'ITB menant à une TB de réactivation est beaucoup plus fréquente chez les personnes immunodéprimées.
Les patients atteints d'une TB pulmonaire de l'adulte sont beaucoup plus nombreux à présenter des cavités pulmonaires (qui se forment à la suite de la liquéfaction de la matière caséeuse) qui s'érodent dans les bronches.Référence 88 Dans l'environnement extracellulaire unique des cavités, les défenses de l'hôte sont inefficaces et les bacilles tuberculeux se multiplient en grand nombre. Parce que les cavités s'ouvrent sur les bronches avoisinantes et libèrent leur contenu dans celles-ci, ces mêmes bacilles sont expulsés directement dans l'air extérieur lorsque le patient tousse.Référence 89 Du point de vue de la santé publique et de la survie du microorganisme comme espèce, la TB pulmonaire de l'adulte constitue la plus importante forme de la maladie.
Il est établi que les personnes ayant des antécédents de TB pulmonaire non traitée ou mal traitée ou présentant une cicatrice pulmonaire à risque élevé (anomalie fibronodulaire dans la partie supérieure des poumons) à la radiographie pulmonaire ont une charge bacillaire plus élevée, même si la maladie est « dormante », que les personnes sans ces antécédents ou ces caractéristiques à la radiographie, et qu'elles courent donc un risque accru de TB de réactivation.Référence 90Référence 91 Ce scénario est couramment observé chez les immigrants orientés vers les autorités de santé publique pour une surveillance médicale.
2.7. Tuberculose extrapulmonaire
La pathogenèse de la tuberculose extrapulmonaire a été attribuée à une dissémination lymphohématogène au moment de la primo-infection pulmonaire, à une dissémination ultérieure à partir d'une tuberculose pulmonaire réactivée ou à une dissémination contiguë à partir des organes adjacents. La maladie abdominale peut également résulter d'une infection directe par l'ingestion d'expectorations infectées ou de lait contaminé (M. bovis). La TB extrapulmonaire ou une forme combinée de TB pulmonaire et extrapulmonaire sont plus fréquentes chez les personnes gravement immunodéprimées. Parmi les personnes co-infectées par le VIH et la tuberculose, la prévalence de la tuberculose extrapulmonaire augmente à mesure que le taux de lymphocytes CD4 diminue (voir le Chapitre 7 : La tuberculose extrapulmonaire).Référence 66Référence 67
2.8. Évolution de l'infection initiale et réponse de l'hôte : mettre au point une description plus nuancée
Récemment, Behr, et al. ont exposé une compréhension plus nuancée de l'infection tuberculeuse.Référence 92 Dans une analyse d'études s'étendant sur cinq décennies, ils ont conclu que la majorité des personnes immunoréactives à la tuberculose ont éliminé leur infection tout en conservant une mémoire immunologique de celle-ci.Référence 93 Ces patients ne bénéficieraient par conséquent pas d'un traitement préventif. Malheureusement, il n'existe actuellement aucun test permettant d'identifier les patients qui sont encore l'hôte de bacilles de M. tuberculosis viables et qui bénéficieraient donc d'un traitement préventif (voir aussi le Chapitre 4 : Le diagnostic de l'infection tuberculeuse et le Chapitre 6 : Le traitement préventif contre la tuberculose chez les adultes).
À cette conceptualisation de l'infection s'ajoute une compréhension plus nuancée de la maladie, qui compte maintenant deux états d'infection supplémentaires : la tuberculose incipiens (un état intermédiaire susceptible d'évoluer vers une maladie active, mais qui ne provoque pas d'anomalies détectables) et un état subclinique de TB active causé par la présence de bacilles viables de M. tuberculosis ne causant pas de symptômes cliniques liés à la TB, mais provoquant d'autres anomalies détectables par des tests radiologiques et microbiologiques.Référence 94Référence 95 Ces états nouvellement décrits sont vraisemblablement déterminés par la réponse immunologique de l'hôte et la virulence du pathogène. Ultérieurement, l'analyse des biomarqueurs pourrait permettre le diagnostic précoce et le traitement de ces états intermédiaires. Cette pathogenèse plus nuancée de l'infection et de la maladie est résumée dans la Figure 1.
Figure 1. Compréhension contemporaine de la pathogenèse de l'infection par la tuberculose et de la maladie. Abréviations : MTB = Mycobacterium tuberculosis; TCT = test cutané à la tuberculine; TLIG = test de libération d'interféron gamma.
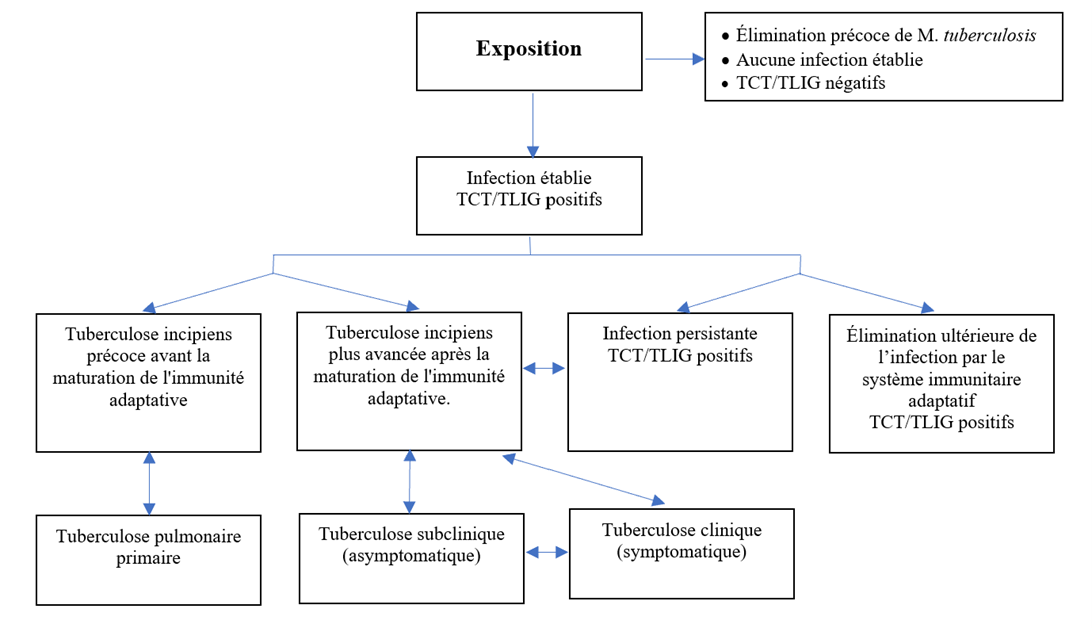
Figure 1 : Texte descriptif
À la suite d'une exposition à une personne atteinte de tuberculose infectieuse, un contact peut soit éliminer rapidement la MTB, auquel cas aucune infection n'est établie et le contact aura un résultat négatif au test cutané à la tuberculine (TCT) ou au test de libération d'interféron gamma (TLIG), soit une infection sera établie et le contact aura un résultat positif au TCT ou au TLIG. Si l'infection est établie, la maladie progressera de l'une des quatre façons suivantes :
- Une tuberculose incipiens précoce avant la maturation de l'immunité adaptative, ce qui peut mener à une tuberculose pulmonaire primaire. Celle-ci peut à son tour revenir à la tuberculose incipiens précoce.
- Une tuberculose incipiens plus avancée après la maturation de l'immunité adaptative, qui peut entraîner une maladie subclinique (asymptomatique), une infection persistante avec résultat positif au TCT ou au TLIG, ou une tuberculose symptomatique clinique. Ces trois stades sont potentiellement bidirectionnels; par conséquent, une personne peut passer d'un stade à l'autre et être atteinte de tuberculose incipiens plus avancée, de tuberculose asymptomatique subclinique et de tuberculose symptomatique clinique.
- Infection persistante avec résultat positif au TCT ou au TLIG, qui peut évoluer vers une tuberculose incipiens plus avancée après la maturation de l'immunité adaptative. Si cela se produit, la personne atteinte d'une infection établie pourrait alors progresser sur la voie décrite précédemment.
- Élimination ultérieure de l'infection par le système immunitaire adaptatif avec un résultat positif au TCT ou au TLIG.
2.9. Facteurs de risque de l'évolution de l'infection vers la maladie
Le risque d'évolution de l'infection par la TB vers la TB active dépend largement de la compétence immunitaire de l'hôte. L'âge et le sexe semblent directement influer sur la réponse immunitaire et sur le risque de maladie : la morbidité est plus élevée chez les jeunes enfants (< 5 ans), particulièrement les nourrissons, les jeunes adultes, particulièrement de sexe féminin, et les personnes âgées, particulièrement de sexe masculin. Selon l'OMS, dans les pays les plus touchés par la TB, la fraction étiologique de la malnutrition dans la TB se situe à 27 %.Référence 96Référence 97 Au Canada, une alimentation inadéquate a été associée à la transmission d'une infection par M. tuberculosis dans une communauté inuite.Référence 97 Dans une étude menée au Pérou, les facteurs biosociaux des ménages contribuaient au risque de transmission de la TB chez les contacts.Référence 98 Le caractère saisonnier de la maladie (son incidence étant plus élevée au printemps et au début de l'été) a été attribué à l'ensoleillement réduit et à une carence en vitamine D durant les mois d'hiver dans certaines études, mais pas dans d'autres.Référence 99Référence 100Référence 101 Les différences ethniques ont été citées comme facteurs intervenant dans la réponse immunitaire de l'hôte, et cette idée a récolté un certain appui.Référence 102 Un nombre croissant de données semblent indiquer que des facteurs génétiques liés à l'hôte jouent un rôle important dans la détermination de la réceptivité à la TB.Référence 103Référence 104Référence 105 Du point de vue clinique, les nombreuses affections connues pour réduire la réponse immunitaire de l'hôte et augmenter le risque d'évolution de l'ITB vers la TB active constituent l'aspect le plus important. Ces affections sont analysées en détail au Chapitre 4 : Le diagnostic de l'infection tuberculeuse.
2.10. Recherche future : l'immunité entraînée
Jusqu'à tout récemment, la quasi-totalité des efforts déployés pour mettre au point un vaccin contre la tuberculose s'est concentrée sur l'immunité à médiation par les lymphocytes T conventionnels. Il n'y a cependant aucune corrélation directe entre l'augmentation de la réponse des lymphocytes T et la protection contre la tuberculose. Il n'est donc pas surprenant que les résultats des essais cliniques portant sur les approches vaccinales s'orientant sur la réponse des lymphocytes T se soient avérés décevants.Référence 106Référence 107 Ces études remettent collectivement en question le dogme actuel selon lequel les lymphocytes T conventionnels sont principalement engagés dans la résistance de l'hôte contre la TB. Elles indiquent plutôt le rôle critique des lymphocytes T dans la tolérance à la maladie et le confinement de l'infection.Référence 108
Plutôt que de se concentrer sur la réponse immunitaire adaptative, les données épidémiologiques montrent que parmi les contacts familiaux proches de patients tuberculeux hautement infectieux, jusqu'à 50 % des individus exposés ne montrent pas de changement dans leur réponse au test cutané à la tuberculine, qui demeure négatif, ce qui suggère que beaucoup de ces individus sont intrinsèquement résistants à l'infection par M. tuberculosis.Référence 109Référence 110 Ces études soutiennent l'idée que la meilleure fenêtre d'opportunité pour éradiquer les bacilles de M. tuberculosis est lors de la phase précoce de l'infection, lorsque les bacilles se trouvent encore dans les voies respiratoires et n'ont pas stimulé l'immunité adaptative et la formation de granulomes. Ces études indiquent que le développement d'un vaccin ciblant l'immunité innée pourrait prévenir la TB.Référence 111 La conception d'un tel vaccin nécessitera cependant une meilleure compréhension de l'immunité innée, surtout de la capacité de mémoire des cellules immunitaires innées. Les organismes simples qui ne possèdent que des défenses immunitaires innées, telles que les plantes et les invertébrés, ont fait preuve de mémoire immunologique (c'est-à-dire que l'exposition primaire à un pathogène a entraîné une immunité plus efficace lorsqu'il a été nécessaire de faire face ultérieurement au même pathogène).Référence 112 De même, les cellules immunitaires innées des vertébrés peuvent générer une réponse de type mémoire (appelée immunité entraînée), qui est plus efficace pour prévenir une infection ultérieure par un large spectre de pathogènes et qui est largement déterminée par des modifications épigénétiques.Référence 113Référence 114Référence 115 L'identification des principaux déterminants de l'immunité entraînée et de leur fonction protectrice conduira par conséquent à de nouvelles cibles et stratégies vaccinales contre M. tuberculosis.
Énoncé de divulgation
Les éditeurs et auteurs des Normes canadiennes pour la lutte antituberculeuse ont déclaré des conflits d'intérêts potentiels au moment de leur nomination et ceux-ci ont été mis à jour tout au long du processus, conformément à la politique de divulgation des conflits d'intérêts de la Société canadienne de thoracologie (SCT). Les déclarations de conflits d'intérêts des membres individuels sont publiées sur le site Web des Normes canadiennes pour la lutte antituberculeuse.
Financement
La 8e édition des Normes canadiennes pour la lutte antituberculeuse est financée conjointement par la SCT et l'Agence de la santé publique du Canada. Elle est éditée par la SCT et publiée par la SCT en collaboration avec l'Association pour la microbiologie médicale et l'infectiologie (AMMI) Canada (en anglais seulement). Il importe cependant de souligner que les recommandations cliniques contenues dans les Normes ont été formulées par la SCT. Les éditeurs et auteurs des Normes canadiennes pour la lutte antituberculeuse sont responsables devant le Comité des lignes directrices canadiennes en santé respiratoire de la SCT et le conseil d'administration de la SCT. Les éditeurs et auteurs des Normes canadiennes pour la lutte antituberculeuse de la SCT sont fonctionnellement et éditorialement indépendants de toute source de financement et n'ont reçu aucun financement direct de sources externes.
La SCT reçoit des subventions sans restriction qui sont combinées à un compte d'exploitation central afin de faciliter les activités d'application des connaissances assemblées de la SCT et de ses panels de directives et de normes. Aucun bailleur de fonds n'a joué un rôle dans la collecte, l'examen, l'analyse ou l'interprétation de la documentation scientifique ou dans la prise de décision concernant les recommandations présentées dans le présent document.
Références
- Référence 1
-
Bumbacea D, Arend SM, Eyuboglu F, et al. The risk of tuberculosis in transplant candidates and recipients: a TBNET consensus statement. Eur Respir J. 2012;40(4):990–1013. doi :10.1183/09031936.00000712.
- Référence 2
-
Allen E. Tuberculosis and other mycobacterial infections of the lung. Dans : Thurlbeck W, Churg A, éditeurs. Pathology of the Lung 2ed. New York: Thieme Medical Publishers; 1995. 229–302.
- Référence 3
-
Iseman M. How is tuberculosis transmitted? Dans : Iseman MD, éditeur. A Clinician's Guide to Tuberculosis. New York, NY: Lippincott Williams and Wilkins; 2000:51–62.
- Référence 4
-
Curtis AB, Ridzon R, Vogel R, et al. Extensive transmission of Mycobacterium tuberculosis from a child. N Engl J Med. 1999;341(20):1491–1495. doi :10.1056/NEJM199911113412002.
- Référence 5
-
Starke JR. Transmission of mycobacterium tuberculosis to and from children and adolescents. Seminars in Pediatric Infectious Diseases. 2001;12(2):115–123. doi :10.1053/spid.2001.22785.
- Référence 6
-
Martinez L, Woldu H, Chen C, et al. Transmission Dynamics in Tuberculosis Patients With Human Immunodeficiency Virus: A Systematic Review and Meta-analysis of 32 Observational Studies. Clin Infect Dis. 2021;73(9):e3446–e3455. doi :10.1093/cid/ciaa1146.
- Référence 7
-
Menzies D. Issues in the Management of Contacts of Patients with Active Pulmonary Tuberculosis. Can J Public Health. 1997;88(3): 197–201. doi :10.1007/BF03403887
- Référence 8
-
Rouillon A, Perdrizet S, Parrot R. Transmission of tubercle bacilli: The effects of chemotherapy. 1976;57(4):275–299. doi :10.1016/S0041-3879(76)80006-2.
- Référence 9
-
Van Zwanenberg D. The influence of the number of bacilli on the development of tuberculous disease in children. Am Rev Respir Dis. 1960;82:31–44. doi :10.1164/arrd.1960.82.1.31.
- Référence 10
-
Shaw JB, Wynn-Williams N. Infectivity of pulmonary tuberculosis in relation to sputum status. Am Rev Tuberc. 1954;69(5):724– doi :10.1164/art.1954.69.5.724.
- Référence 11
-
Gryzbowski S, Barnett GD, Styblo K. Contacts of cases of active pulmonary tuberculosis. Bull Int Union Tuberc. 1975;50(1):90–106.
- Référence 12
-
Van Geuns HA, Meijer J, Styblo K. Results of contact examination of Rotterdam, 1967-1969. Bull Int Union Tuberc. 1975;50(1):107–121.
- Référence 13
-
Loudon RG, Spohn SK. Cough frequency and infectivity in patients with pulmonary tuberculosis. Am Rev Respir Dis. 1969;99(1):109–111. doi :10.1164/arrd.1969.99.1.109.
- Référence 14
-
Rose CE, Zerbe GO, Lantz SO, Bailey WC. Establishing priority during investigation of tuberculosis contacts. Am Rev Respir Dis. 1979;119(4):603–609. doi :10.1164/arrd.1979.119.4.603.
- Référence 15
-
Snider DE, Kelly GD, Cauthen GM, Thompson NJ, Kilburn JO. Infection and disease among contacts of tuberculosis cases with drug-resistant and drug-susceptible bacilli. Am Rev Respir Dis. 1985;132(1):125–132. doi :10.1164/arrd.1985.132.1.125.
- Référence 16
-
Yeager H, Lacy J, Smith LR, LeMaistre CA. Quantitative studies of mycobacterial populations in sputum and saliva. Am Rev Respir Dis. 1967;95(6):998–1004. doi :10.1164/arrd.1967.95.6.998.
- Référence 17
-
Behr MA, Warren SA, Salamon H, et al. Transmission of Mycobacterium tuberculosis from patients smear-negative for acid-fast bacilli. Lancet (Londres, Angleterre). 1999;353(9151):444– 449. doi :10.1016/S0140-6736(98)03406-0.
- Référence 18
-
Hernández-Garduño E, Cook V, Kunimoto D, Elwood RK, Black WA, FitzGerald JM. Transmission of tuberculosis from smear negative patients: a molecular epidemiology study. 2004;59(4):286–290. doi :10.1136/thx.2003.011759.
- Référence 19
-
Tostmann A, Kik SV, Kalisvaart NA, et al. Tuberculosis transmission by patients with smear-negative pulmonary tuberculosis in a large cohort in the Netherlands. Clin Infect Dis: An Official Publication of the Infectious Diseases Society of America. 2008;47(9):1135–1142. doi :10.1086/591974.
- Référence 20
-
Asadi L, Croxen M, Heffernan C, et al. How Much Do Smear-Negative Patients Really Contribute to Tuberculosis Transmissions? Re-Examining an Old Question with New Tools. EClinical Medicine. 2022;43:101250. doi :10.1016/j. eclinm.2021.101250.
- Référence 21
-
Lohmann EM, Koster BFPJ, Le Cessie S, Kamst-van Agterveld MP, van Soolingen D, Arend SM. Grading of a positive sputum smear and the risk of Mycobacterium tuberculosis transmission. Int J Tuberc Lung Dis. 2012;16(11):1477–1484. doi :10.5588/ijtld.12.0129.
- Référence 22
-
Lee HS, Kee SJ, Shin JH, et al. Xpert MTB/RIF Assay as a Substitute for Smear Microscopy in an Intermediate-Burden Setting. Am J Respir Crit Care Med. 2019;199(6):784–794. doi :10.1164/rccm.201804-0654OC.
- Référence 23
-
Van Deun A, Tahseen S, Affolabi D, et al. Sputum smear microscopy in the Xpert®MTB/RIF era. Int J Tuberc Lung Dis: The Official Journal of the International Union against Tuberculosis and Lung Disease. 2019;23(1):12–18. doi :10.5588/ijtld.18.0553.
- Référence 24
-
Catanzaro A. Nosocomial tuberculosis. Am Rev Respir Dis. 1982;125(5):559–562. doi :10.1164/arrd.1982.125.5.559.
- Référence 25
-
Bailey WC, Gerald LB, Kimerling ME, et al. Predictive model to identify positive tuberculosis skin test result during contact investigations. JAMA. 2002;287(8):996–1002. doi :10.1001/jama.287.8.996.
- Référence 26
-
Marks SM, Taylor Z, Qualls NL, Shrestha-Kuwahara RJ, Wilce MA, Nguyen CH. Outcomes of contact investigations of infectious tuberculosis patients. Am J Respir Crit Care Med. 2000;162(6):2033–2038. doi :10.1164/ajrccm.162.6.2004022.
- Référence 27
-
Palaci M, Dietze R, Hadad DJ, et al. Cavitary disease and quantitative sputum bacillary load in cases of pulmonary tuberculosis. J Clin Microbiol. 2007;45(12):4064–4066. doi :10.1128/JCM.01780-07.
- Référence 28
-
Heffernan C, Barrie J, Doroshenko A, et al. Prompt recognition of infectious pulmonary tuberculosis is critical to achieving elimination goals: a retrospective cohort study. BMJ Open Resp Res. 2020;7(1):e000521. doi :10.1136/bmjresp-2019-000521.
- Référence 29
-
Lau A, Barrie J, Winter C, Elamy AH, Tyrrell G, Long R. Chest Radiographic Patterns and the Transmission of Tuberculosis: Implications for Automated Systems. PLoS One. 2016;11(4):e0154032. doi :10.1371/journal.pone.0154032.
- Référence 30
-
Muecke C, Isler M, Menzies D, Allard R, Tannenbaum TN, Brassard P. The use of environmental factors as adjuncts to traditional tuberculosis contact investigation. Int J Tuberc Lung Dis: The Official Journal of the International Union against Tuberculosis and Lung Disease. 2006;10(5):530–535.
- Référence 31
-
Rieder HL. The infectiousness of laryngeal tuberculosis: appropriate public health action based on false premises [Counterpoint]. Int J Tuberc Lung Dis. 2009;13(1):4–5.
- Référence 32
-
Loudon RG, Roberts RM. Singing and the Dissemination of Tuberculosis. Am Rev Respir Dis. 1968;98(2):297–300. doi :10.1164/arrd.1968.98.2.297.
- Référence 33
-
Loudon RG, Roberts RM. Droplet expulsion from the respiratory tract. Am Rev Respir Dis. 1967;95(3):435–442. doi :10.1164/arrd.1967.95.3.435.
- Référence 34
-
Turner RD, Birring SS, Darmalingam M, et al. Daily cough frequency in tuberculosis and association with household infection. Int j Tuberc Lung Dis. 2018;22(8):863–870. doi :10.5588/ijtld.17.0652.
- Référence 35
-
Riley RL, Mills CC, Nyka W, et al. Aerial dissemination of pulmonary tuberculosis. A two-year study of contagion in a tuberculosis ward. Am J Epidemiol. 1995;142(1):3–14. doi :10.1093/oxfordjournals.aje.a117542.
- Référence 36
-
Sultan L, Nyka W, Mills C, O'grady F, Wells W, Riley RL. Tuberculosis disseminators. A study of the variability of aerial infectivity of tuberculous patients. Am Rev Respir Dis. 1960;82:358–369. doi :10.1164/arrd.1960.82.3.358.
- Référence 37
-
Riley RL, Mills CC, O'grady F, Sultan LU, Wittstadt F, Shivpuri DN. Infectiousness of air from a tuberculosis ward. Ultraviolet irradiation of infected air: comparative infectiousness of different patients. Am Rev Respir Dis. 1962;85:511–525. doi :10.1164/arrd.1962.85.4.511.
- Référence 38
-
Lin H-H, Ezzati M, Murray M. Tobacco smoke, indoor air pollution and tuberculosis: a systematic review and meta-analysis. PLoS Med. 2007;4(1):e20. doi :10.1371/journal.pmed.0040020.
- Référence 39
-
Stein RA. Super-spreaders in infectious diseases. Int J Infect Dis. 2011;15(8):e510-3. doi :10.1016/j.ijid.2010.06.020.
- Référence 40
-
Jindani A, Aber VR, Edwards EA, Mitchison DA. The early bactericidal activity of drugs in patients with pulmonary tuberculosis. Am Rev Respir Dis. 1980;121(6):939–949. doi :10.1164/arrd.1980.121.6.939.
- Référence 41
-
Soysal A, Millington KA, Bakir M, et al. Effect of BCG vaccination on risk of Mycobacterium tuberculosis infection in children with household tuberculosis contact: a prospective community-based study. Lancet (Londres, Angleterre). 2005;366(9495):1443–1451. doi :10.1016/S0140-6736(05)67534-4.
- Référence 42
-
Eisenhut M, Paranjothy S, Abubakar I, et al. BCG vaccination reduces risk of infection with Mycobacterium tuberculosis as detected by gamma interferon release assay. Vaccine. 2009;27(44):6116–6120. doi :10.1016/j.vaccine.2009.08.031.
- Référence 43
-
Eriksen J, Chow JY, Mellis V, et al. Protective effect of BCG vaccination in a nursery outbreak in 2009: time to reconsider the vaccination threshold? Thorax. 2010;65(12):1067–1071. doi :10.1136/thx.2010.140186.
- Référence 44
-
Basu Roy R, Sotgiu G, Altet-Gómez N, et al. Identifying predictors of interferon-γ release assay results in pediatric latent tuberculosis: a protective role of bacillus Calmette-Guérin?: a pTB-NET collaborative study. Am J Respir Crit Care Med. 2012;186(4):378–384. doi :10.1164/rccm.201201-0026OC.
- Référence 45
-
Albanna AS, Reed MB, Kotar KV, et al. Reduced transmissibility of East African Indian strains of Mycobacterium tuberculosis. PloS One. 2011;6(9):e25075. doi :10.1371/journal.pone.0025075.
- Référence 46
-
Middlebrook G, Cohn ML. Some observations on the pathogenicity of isoniazid-resistant variants of tubercle bacilli. Science (New York, NY). 1953;118(3063):297–299. doi :10.1126/science.118.3063.297.
- Référence 47
-
Schaaf HS, Marais BJ, Hesseling AC, Gie RP, Beyers N, Donald PR. Childhood drug-resistant tuberculosis in the Western Cape Province of South Africa. Acta Paediatrica (Oslo, Norway: 1992). 2006;95(5):523–528. doi :10.1080/08035250600675741.
- Référence 48
-
Moss AR, Alland D, Telzak E, et al. A city-wide outbreak of a multiple-drug-resistant strain of Mycobacterium tuberculosis in New York. Int J Tuberc Lung Dis: The Official Journal of the International Union against Tuberculosis and Lung Disease. 1997;1(2):115–121.
- Référence 49
-
Drobniewski F, Balabanova Y, Nikolayevsky V, et al. Drug-resistant tuberculosis, clinical virulence, and the dominance of the Beijing strain family in Russia. JAMA. 2005;293(22):2726–2731. doi :10.1001/jama.293.22.2726.
- Référence 50
-
Gandhi NR, Moll A, Sturm AW, et al. Extensively drug-resistant tuberculosis as a cause of death in patients co-infected with tuberculosis and HIV in a rural area of South Africa. Lancet (Londres, Angleterre). 2006;368(9547):1575–1580. doi :10.1016/S0140-6736(06)69573-1.
- Référence 51
-
Langlois-Klassen D, Senthilselvan A, Chui L, et al. Transmission of Mycobacterium tuberculosis Beijing strains in a major immigrant-receiving province of Canada, 1991–2007. Emerg Infect Dis. 2013;19(5):701–711. doi :10.3201/eid1905.121578.
- Référence 52
-
Rea E, Leung T. A cluster of tuberculosis cases linked to smoking: An under-recognized challenge for tuberculosis elimination. Can Commun Dis Rep. 2018;44(3-4):86–90. doi :10.14745/ccdr.v44i34a03.
- Référence 53
-
Reichler MR, Khan A, Yuan Y, Tuberculosis Epidemiologic Studies Consortium Task Order 2 Team, et al. Duration of Exposure Among Close Contacts of Patients With Infectious Tuberculosis and Risk of Latent Tuberculosis Infection. Clin Infect Dis: An Official Publication of the Infectious Diseases Society of America. 2020;71(7):1627–1634. doi :10.1093/cid/ciz1044.
- Référence 54
-
Templeton GL, Illing LA, Young L, Cave D, Stead WW, Bates JH. The risk for transmission of Mycobacterium tuberculosis at the bedside and during autopsy. Ann Intern Med. 1995;122(12):922– doi :10.7326/0003-4819-122-12-199506150-00005.
- Référence 55
-
Heffernan C, Rowe BH, Long R. Engaging frontline providers: an important key to eliminating tuberculosis in Canada, and other high-income countries. Can J Public Health. 2021;112(5):872– doi :10.17269/s41997-021-00556-x.
- Référence 56
-
Wells WF. Airborne Contagion and Air Hygiene an Ecological Study of Droplet Infections. Cambridge : Harvard University Press (pour le Commonwealth Fund), Mass., États-Unis. Londres : Geoffrey Cumberlege, Oxford University Press; 1955.
- Référence 57
-
Murray JF. Bill Dock and the location of pulmonary tuberculosis: how bed rest might have helped consumption. Am J Respir Crit Care Med. 2003;168(9):1029–1033. doi :10.1164/rccm.200307-1016OE.
- Référence 58
-
Woolwine SC, Bishai WR. Overview of the pathogenesis of tuberculosis from a cellular and molecular perspective. Dans : Raviglione M, éditeur. Reichman and Hershfield's Tuberculosis. 3 ed. New York: Informal Healthcare; 2006. 101–116.
- Référence 59
-
Behr MA, Waters WR. Is tuberculosis a lymphatic disease with a pulmonary portal? Lancet Infect Dis. 2014;14(3):250–255. doi :10.1016/S1473-3099(13)70253-6.
- Référence 60
-
Collins J, Ej S. Chest Radiology. Lippincott, Williams et Wilkins;
- Référence 61
-
Perez-Velez CM, Marais BJ. Tuberculosis in children. N Engl J Med. 2012;367(4):348–361. doi :10.1056/NEJMra1008049.
- Référence 62
-
Martinez L, Cords O, Horsburgh CR, et al. The risk of tuberculosis in children after close exposure: a systematic review and individual participant meta-analysis. Lancet (Londres, Angleterre). 2020;395(10228):973–984. doi :10.1016/S0140-6736(20)30166-5.
- Référence 63
-
Gupta RK, Calderwood CJ, Yavlinsky A, et al. Discovery and validation of a personalized risk predictor for incident tuberculosis in low transmission settings. Nat Med. 2020;26(12):1941– doi :10.1038/s41591-020-1076-0.
- Référence 64
-
Daley CL, Small PM, Schecter GF, et al. An outbreak of tuberculosis with accelerated progression among persons infected with the human immunodeficiency virus. An analysis using restriction-fragment-length polymorphisms. N Engl J Med. 1992;326(4):231–235. doi :10.1056/NEJM199201233260404.
- Référence 65
-
Marais BJ, Gie RP, Schaaf HS, et al. The natural history of childhood intra-thoracic tuberculosis: a critical review of literature from the prechemotherapy era. Int J Tuberc Lung Dis: The Official Journal of the International Union against Tuberculosis and Lung Disease. 2004;8(4):392–402.
- Référence 66
-
Post FA, Wood R, Pillay GP. Pulmonary tuberculosis in HIV infection: radiographic appearance is related to CD4+ T-lymphocyte count. Tuber Lung Dis: The Official Journal of the International Union against Tuberculosis and Lung Disease. 1995;76(6):518–521. doi :10.1016/0962-8479(95)90527-8.
- Référence 67
-
Burman WJ, Jones BE. Clinical and radiographic features of HIV-related tuberculosis. Seminars in Respiratory Infections. 2003;18(4):263–271. doi :10.1053/S0882-0546(03)00072-0.
- Référence 68
-
Stead WW, Kerby GR, Schlueter DP, Jordahl CW. The clinical spectrum of primary tuberculosis in adults. Confusion with reinfection in the pathogenesis of chronic tuberculosis. Ann Intern Med. 1968;68(4):731–745. doi :10.7326/0003-4819-68-4-731.
- Référence 69
-
Ayres JS, Schneider DS. Tolerance of Infections. Annu Rev Immunol. 2012;30(1):271–294. doi :10.1146/annurev-immunol-020711-075030.
- Référence 70
-
Cadena AM, Fortune SM, Flynn JL. Heterogeneity in tuberculosis. Nat Rev Immunol. Nov 2017;17(11):691–702. doi :10.1038/nri.2017.69.
- Référence 71
-
Divangahi M. Are tolerance and training required to end TB? Nat Rev Immunol. 2018;18(11):661–663. doi :10.1038/s41577-018-0070-y.
- Référence 72
-
Wilson RJ, Pillay DG, Sturm AW. Mycobacterium tuberculosis is not an obligate aerobe. J Infect. 1999;38(3):197–198. doi :10.1016/S0163-4453(99)90253-0.
- Référence 73
-
Wayne LG, Diaz GA. Autolysis and Secondary Growth of Mycobacterium tuberculosis in Submerged Culture. J Bacteriol. 1967;93(4):1374–1381.
- Référence 74
-
Wayne LG, Lin KY. Glyoxylate metabolism and adaptation of Mycobacterium tuberculosis to survival under anaerobic conditions. Infect Immun. 1982;37(3):1042–1049. doi :10.1128/iai.37.3.1042-1049.1982.
- Référence 75
-
Ferguson RG. Studies in Tuberculosis. Toronto (ON) : University of Toronto Press; 1955.
- Référence 76
-
Long R, Lau A. Ferguson's groundbreaking studies influenced our understanding of tuberculosis reinfection. Where to next? Int J Tuberc Lung Dis. 2016;20(10):1285–1287. doi :10.5588/ijtld.16.0447.
- Référence 77
-
Houk VH, Kent DC, Baker JH, Sorensen K, Hanzel GD. The Byrd Study. In-depth analysis of a micro-outbreak of tuberculosis in a closed environment. Arch Environ Health. 1968;16(1):4–6. doi :10.1080/00039896.1968.10665007.
- Référence 78
-
Houk VN, Baker JH, Sorensen K, Kent DC. The epidemiology of tuberculosis infection in a closed environment. Arch Environ Health. 1968;16(1):26–35. doi :10.1080/00039896.1968.10665011.
- Référence 79
-
Lee RS, Proulx J-F, Menzies D, Behr MA. Progression to tuberculosis disease increases with multiple exposures. Eur Respir J. 2016;48(6):1682–1689. doi :10.1183/13993003.00893-2016.
- Référence 80
-
Acuña-Villaorduña C, Jones-López EC, Fregona G, et al. Intensity of exposure to pulmonary tuberculosis determines risk of tuberculosis infection and disease. Eur Respir J. 2018;51(1):1701578. doi :10.1183/13993003.01578-2017.
- Référence 81
-
Andrews JR, Noubary F, Walensky RP, Cerda R, Losina E, Horsburgh CR. Risk of progression to active tuberculosis following reinfection with Mycobacterium tuberculosis. Clin Infect Dis: An Official Publication of the Infectious Diseases Society of America. 2012;54(6):784–791. doi :10.1093/cid/cir951.
- Référence 82
-
Jasmer RM, Bozeman L, Schwartzman K, et al. Recurrent tuberculosis in the United States and Canada: relapse or reinfection? Am J Respir Crit Care Med. 2004;170(12):1360–1366. doi :10.1164/rccm.200408-1081OC.
- Référence 83
-
Narayanan S, Swaminathan S, Supply P, et al. Impact of HIV Infection on the Recurrence of Tuberculosis in South India. J Infect Dis. 2010;201(5):691–703. doi :10.1086/650528.
- Référence 84
-
Crampin AC, Mwaungulu JN, Mwaungulu FD, et al. Recurrent TB: relapse or reinfection? The effect of HIV in a general population cohort in Malawi. AIDS (Londres, Angleterre). 2010;24(3):417–426. doi :10.1097/QAD.0b013e32832f51cf.
- Référence 85
-
Den Boon S, Matteelli A, Ford N, Getahun H. Continuous isoniazid for the treatment of latent tuberculosis infection in people living with HIV: a systematic review and meta-analysis. AIDS (Londres, Angleterre). 2016;30(5):797–801. doi :10.1097/QAD.0000000000000985.
- Référence 86
-
Lee RS, Radomski N, Proulx J-F, et al. Reemergence and amplification of tuberculosis in the Canadian arctic. J Infect Dis. 2015;211(12):1905–1914. doi :10.1093/infdis/jiv011.
- Référence 87
-
Khan FA, Fox GJ, Lee RS, et al. Housing and tuberculosis in an Inuit village in northern Quebec: a case-control study. CMAJ Open. 2016;4(3):E496–E506. doi :10.9778/cmajo.20160049.
- Référence 88
-
Dannenberg AM, Sugimoto M. Liquefaction of Caseous Foci in Tuberculosis. Am Rev Respir Dis. 1976;113(3):257–259. doi :10.1164/arrd.1976.113.3.257.
- Référence 89
-
Long R, Maycher B, Dhar A, Manfreda J, Hershfield E, Anthonisen N. Pulmonary tuberculosis treated with directly observed therapy: serial changes in lung structure and function. Chest. 1998;113(4):933–943. doi :10.1378/chest.113.4.933.
- Référence 90
-
Chan IHY, Kaushik N, Dobler CC. Post-migration follow-up of migrants identified to be at increased risk of developing tuberculosis at pre-migration screening: a systematic review and meta-analysis. Lancet Infect Dis. 2017;17(7):770–779. doi :10.1016/S1473-3099(17)30194-9.
- Référence 91
-
Long R, Asadi L, Heffernan C, et al. Is there a fundamental flaw in Canada's post-arrival immigrant surveillance system for tuberculosis? PLoS One. 2019;14(3):e0212706. doi :10.1371/journal.pone.0212706.
- Référence 92
-
Behr MA, Kaufmann E, Duffin J, Edelstein PH, Ramakrishnan L. Latent Tuberculosis: Two Centuries of Confusion. Am J Respir Crit Care Med. 2021;204(2):142–148. doi :10.1164/rccm.202011-4239PP.
- Référence 93
-
Behr MA, Edelstein PH, Ramakrishnan L. Revisiting the timetable of tuberculosis. BMJ. 2018;362:k2738. doi :10.1136/bmj.k2738.
- Référence 94
-
Drain PK, Bajema KL, Dowdy D, et al. Incipient and Subclinical Tuberculosis: a Clinical Review of Early Stages and Progression of Infection. Clin Microbiol Rev. 2018;31(4):1–24. doi :10.1128/CMR.00021-18.
- Référence 95
-
Kendall EA, Shrestha S, Dowdy DW. The Epidemiological Importance of Subclinical Tuberculosis. A Critical Reappraisal. Am J Respir Crit Care Med. 2021;203(2):168–174. doi :10.1164/rccm.202006-2394PP.
- Référence 96
-
Lönnroth K, Castro KG, Chakaya JM, et al. Tuberculosis control and elimination 2010-50: cure, care, and social development. Lancet (Londres, Angleterre). 2010;375(9728):1814–1829. doi :10.1016/S0140-6736(10)60483-7.
- Référence 97
-
Fox GJ, Lee RS, Lucas M, et al. Inadequate Diet Is Associated with Acquiring Mycobacterium tuberculosis Infection in an Inuit Community. A Case-Control Study. Ann Am Thorac Soc. 2015;12(8):1153–1162. doi :10.1513/AnnalsATS.201503-156OC.
- Référence 98
-
Saunders MJ, Wingfield T, Datta S, et al. A household-level score to predict the risk of tuberculosis among contacts of patients with tuberculosis: a derivation and external validation prospective cohort study. Lancet Infect Dis. 2020;20(1):110–122. doi :10.1016/S1473-3099(19)30423-2.
- Référence 99
-
Martineau AR, Nhamoyebonde S, Oni T, et al. Reciprocal seasonal variation in vitamin D status and tuberculosis notifications in Cape Town, South Africa. PNAS. 2011;108(47):19013–19017. doi :10.1073/pnas.1111825108.
- Référence 100
-
Fares A. Seasonality of tuberculosis. J Glob Infect Dis. 2011;3(1):46–55. doi :10.4103/0974-777X.77296.
- Référence 101
-
Willis MD, Winston CA, Heilig CM, Cain KP, Walter ND, Mac Kenzie WR. Seasonality of tuberculosis in the United States, 1993–2008. Clin Infect Dis: An Official Publication of the Infectious Diseases Society of America. 2012;54(11):1553–1560. doi :10.1093/cid/cis235.
- Référence 102
-
Stead WW, Senner JW, Reddick WT, Lofgren JP. Racial differences in susceptibility to infection by Mycobacterium tuberculosis. N Engl J Med. 1990;322(7):422–427. doi :10.1056/NEJM199002153220702.
- Référence 103
-
Greenwood CM, Fujiwara TM, Boothroyd LJ, et al. Linkage of tuberculosis to chromosome 2q35 loci, including NRAMP1, in a large aboriginal Canadian family. Am J Hum Genet. 2000;67(2):405–416. doi :10.1086/303012.
- Référence 104
-
Bellamy R. Susceptibility to mycobacterial infections: the importance of host genetics. Genes & Immunity. 2003;4(1):4–11. doi :10.1038/sj.gene.6363915.
- Référence 105
-
Pan H, Yan B-S, Rojas M, et al. Ipr1 gene mediates innate immunity to tuberculosis. Nature. 2005;434(7034):767–772. doi :10.1038/nature03419.
- Référence 106
-
Tameris MD, Hatherill M, Landry BS, et al. Safety and efficacy of MVA85A, a new tuberculosis vaccine, in infants previously vaccinated with BCG: a randomised, placebo-controlled phase 2b trial. Lancet (Londres, Angleterre). 2013;381(9871):1021–1028. doi :10.1016/S0140-6736(13)60177-4.
- Référence 107
-
Nemes E, Geldenhuys H, Rozot V, et al. Prevention of M. tuberculosis Infection with H4:IC31 Vaccine or BCG Revaccination. N Engl J Med. 2018;379(2):138–149. doi :10.1056/NEJMoa1714021.
- Référence 108
-
Divangahi M, Khan N, Kaufmann E. Beyond Killing Mycobacterium tuberculosis: Disease Tolerance. Front Immunol. 2018;9:2976. doi :10.3389/fimmu.2018.02976.
- Référence 109
-
Cobat A, Gallant CJ, Simkin L, et al. Two loci control tuberculin skin test reactivity in an area hyperendemic for tuberculosis. J Exp Med. 2009;206(12):2583–2591. doi :10.1084/jem.20090892.
- Référence 110
-
Morrison J, Pai M, Hopewell PC. Tuberculosis and latent tuberculosis infection in close contacts of people with pulmonary tuberculosis in low-income and middle-income countries: a systematic review and meta-analysis. Lancet Infect Dis. 2008;8(6):359– doi :10.1016/S1473-3099(08)70071-9.
- Référence 111
-
Divangahi M, Behr MA. Cracking the Vaccine Code in Tuberculosis. Am J Respir Crit Care Med. 2018;197(4):427–432. doi :10.1164/rccm.201707-1489PP.
- Référence 112
-
Netea MG, Dominguez-Andres J, Barreiro LB, et al. Defining trained immunity and its role in health and disease. Nat Rev Immunol. 2020;20(6):375–388. doi :10.1038/s41577-020-0285-6.
- Référence 113
-
Divangahi M, Aaby P, Khader SA, et al. Trained immunity, tolerance, priming and differentiation: distinct immunological processes. Nat Immunol. 2021;22(1):2–6. doi :10.1038/s41590-020-00845-6.
- Référence 114
-
Kaufmann E, Sanz J, Dunn JL, et al. BCG Educates Hematopoietic Stem Cells to Generate Protective Innate Immunity against Tuberculosis. Cell. 2018;172(1-2):176–190.e19. doi :10.1016/j.cell.2017.12.031.
- Référence 115
-
Khan N, Downey J, Sanz J, et al. Tuberculosis Reprograms Hematopoietic Stem Cells to Limit Myelopoiesis and Impair Trained Immunity. Cell. 2020;183(3):752–770.e22. doi :10.1016/j.cell.2020.09.062.