L’Observateur des médicaments émergents 2022

Juin 2023
ISSN 2292-3144
No de cat. : H79-5F-PDF
Table des matières
- Sommaire
- Liste de termes
- Introduction
- Méthodologie
- Limites
- Aperçu des médicaments émergents en 2022
- Veille des tendances en 2022
- L’Observateur des médicaments émergents 2022
- Tableau 4. Nouveaux médicaments sélectionnés en 2022
- Tableau 5. Mise à jour sur les médicaments émergents conservés de l’édition 2021 de l’Observateur des médicaments émergents
- Tableau 6. Médicaments émergents de l’édition 2021 de l’Observateur des médicaments émergents ayant reçu une autorisation de mise en marché
- Pleins feux sur le Canada
- Traitements émergents contre la COVID-19
- Annexe A
- Tableau A1. Produits biosimilaires en cours d’essais cliniques de phase III (d’après les données extraites en septembre 2022)
- Tableau A2. Présentations de drogues nouvelles en cours d’examen par Santé Canada (février 2023)
- Tableau A3. Médicaments en cours d’essais de phase II pour des indications ciblées par des médicaments candidats émergents
- Références
Renseignements connexes
Conseil d’examen du prix des médicaments brevetés
Centre Standard Life
Case postale L40
333, avenue Laurier Ouest
Bureau 1400
Ottawa (Ontario) K1P 1C1
Téléphone : 1-877-861-2350
ATS : 613-288-9654
Courriel : PMPRB.Information-Renseignements.CEPMB@pmprb-cepmb.gc.ca
Remerciements
Le présent rapport a été rédigé par le CEPMB dans le cadre de l’initiative du SNIUMP.
Le CEPMB tient à remercier les membres du Comité consultatif du SNIUMP pour leur supervision et leurs conseils avisés au cours de la rédaction du rapport. Veuillez noter que les déclarations et les constatations se rapportant au présent rapport ne reflètent pas nécessairement celles des membres ou de leurs organisations.
Nous remercions sincèrement Patricia Carruthers-Czyzewski, B. Sc. (phm.), M. Sc., Sintera Inc., pour son expertise du domaine pharmaceutique et sa contribution à l’évaluation scientifique.
Nous remercions Allison Carey d’avoir dirigé le projet, ainsi que Tanya Potashnik et Kevin Pothier d’avoir supervisé la rédaction du rapport. Le CEPMB tient également à souligner la contribution de Shirin Paynter, membre de l’équipe rédactionnelle.
Avis de non‑responsabilité
Le SNIUMP est une initiative de recherche indépendante des activités de réglementation du CEPMB. Les priorités de recherche, les données, les déclarations et les opinions présentées ou reproduites dans les rapports du SNIUMP ne reflètent pas la position du CEPMB au sujet des questions réglementaires. Les rapports du SNIUMP ne contiennent pas d’information confidentielle ou protégée en vertu des articles 87 et 88 de la Loi sur les brevets, et la mention d’un médicament dans un rapport du SNIUMP ne revient pas à reconnaître ou à nier que le médicament fait l’objet d’une demande de brevet en vertu des articles 80, 81 ou 82 de la Loi sur les brevets ou encore que son prix est ou n’est pas excessif au sens de l’article 85 de la Loi sur les brevets.
Bien que ces renseignements soient en partie fondés sur des données obtenues avec l’autorisation de GlobalData et à partir de la base de données MIDAS©, propriété exclusive d’IQVIA Solutions Canada Inc. ou de ses sociétés affiliées (« IQVIA »), les déclarations, les résultats, les conclusions, les points de vue et les opinions exprimés dans le présent rapport sont exclusivement ceux du CEPMB et ne peuvent être attribués à GlobalData ou à IQVIA.
Citation suggérée
Conseil d'examen du prix des médicaments brevetés. (2023). L'Observateur des médicaments émergents 2022. Ottawa : CEPMB.
Sommaire
L’Observateur des médicaments émergents (OMÉ) est un rapport d’analyse prospective qui présente une sélection de nouveaux médicaments en cours d’évaluation clinique ou en attente d’homologation qui pourraient avoir une incidence sur la pratique clinique future ou sur les dépenses en médicaments au Canada.
Dans la présente édition, la portée de l’examen visant les médicaments candidats en essais cliniques de phase III ou en attente d’homologation sélectionnés a été élargie et inclut désormais les médicaments en essais de phase II qui ont le même mécanisme d’action ou la même indication. Le fait de disposer de renseignements sur d’autres médicaments en cours d’évaluation (c.-à-d. en essais de phase II) peut aider à avoir une meilleure idée de la place que pourraient occuper ces médicaments candidats dans le traitement. Les médicaments en essais cliniques de phase III ou en attente d’homologation sont sélectionnés pour être ajoutés, en tant que médicaments candidats, à la liste des « nouveaux médicaments » s’ils peuvent répondre à un besoin thérapeutique non comblé, offrir un mécanisme d’action nouveau ou un avantage thérapeutique par rapport aux traitements existants, ou traiter une affection grave. Les médicaments en essais de phase II sont également examinés en vue de déceler d’autres médicaments qui en sont à des phases antérieures du processus et qui présentent la même indication ou le même mécanisme d’action que les médicaments candidats sélectionnés.
Le rapport rassemble des données provenant de deux sources principales : la base de données GlobalData Healthcare, qui permet de relever les médicaments en cours d’évaluation clinique, et les listes des présentations de médicaments et de produits de santé en cours d’examen (PCE) de Santé Canada, qui fournissent de l’information sur les nouveaux médicaments en cours d’examen au Canada.
Faits saillants relatifs aux médicaments émergents en 2022
- En 2022, les médicaments émergents comprenaient plus de 9 000 nouveaux médicaments à différentes étapes de développement clinique, comparativement à un peu moins de 8 500 l’année précédente. Le nombre de médicaments émergents augmente en moyenne de 11 % par année depuis 2018.
- L’oncologie a continué de dominer l’éventail thérapeutique en 2022, les traitements contre le cancer représentant près du tiers (30 %) des médicaments à toutes les phases des essais cliniques. Les traitements contre les maladies infectieuses ont occupé la deuxième place, représentant 15 % des médicaments émergents. Ces résultats s’expliquent par le nombre accru de médicaments pour le traitement de la COVID-19.
- Près du tiers (31 %) des médicaments en cours d’essais cliniques de phase III ou en attente d’homologation avaient une désignation rapide de médicament orphelin approuvée par la Food and Drug Administration (FDA) des États-Unis ou par l’Agence européenne des médicaments (EMA), ce qui concorde avec la tendance à la hausse de la prévalence des médicaments orphelins entrant sur le marché pharmaceutique.
- Les tendances observées en 2022 pour ce qui a trait aux médicaments émergents comprennent un nombre croissant de nouveaux produits de thérapie génique et cellulaire qui sont étendus à des groupes élargis de patients (p. ex. myopathie de Duchenne). Les produits émergents biosimilaires s’étendent également à des domaines thérapeutiques comme l’asthme (omalizumab), la santé osseuse (dénosumab) et l’infarctus du myocarde (ténectéplase).
- Vingt-huit nouveaux médicaments, dont cinq nouveaux produits de thérapie génique et cellulaire, ont été sélectionnés pour être ajoutés à la liste des nouveaux médicaments de l’OMÉ 2022 en raison de leur incidence potentielle sur le système de soins de santé au Canada. Selon les prévisions, neuf des médicaments présentés dans le rapport de cette année devraient générer des revenus annuels mondiaux de plus d’un milliard de dollars américains d’ici 2028, et l’un d’eux a été approuvé par Santé Canada en février 2023.
- Sur les 42 médicaments nouveaux et conservés présentés dans l’édition 2021 de l’OMÉ, 6 ont obtenu une autorisation de mise en marché, 25 ont été maintenus sur la liste car ils répondaient toujours aux critères de sélection, et 11 ont été supprimés car leurs essais cliniques avaient été abandonnés ou ils ne répondaient plus aux critères de sélection.
- En date de septembre 2022, 550 vaccins et traitements étaient en cours d’évaluation clinique à l’échelle mondiale pour la prévention et le traitement de la COVID-19. Santé Canada examine 14 présentations de drogues nouvelles et suppléments à une présentation de drogue nouvelle pour la prévention et le traitement de la COVID-19.
Liste de termes
Les termes suivants et leurs définitions s’appliquent aux fins du présent rapport.
- Autorisation de mise en marché
- Processus d’approbation de la commercialisation d’un médicament dans un pays donné. Au Canada, l’approbation de la commercialisation est accordée à la suite d’une évaluation scientifique approfondie de l’innocuité, de l’efficacité et de la qualité d’un produit, conformément aux exigences de la Loi sur les aliments et drogues et de son RèglementNote de bas de page i.
- Efficacité clinique
- Réponse maximale possible d’un médicament en contexte de recherche médicale et capacité d’avoir un effet thérapeutique suffisant en contexte cliniqueNote de bas de page ii.
- En attente d’homologation
- Un médicament est en attente d’homologation lorsque tous les essais cliniques nécessaires sont terminés et que l’homologation ou l’approbation de l’utilisation du médicament est en cours d’examen par un organisme de réglementationNote de bas de page iii.
- Ingrédient médicinal
- Substance chimique ou biologique responsable de l’effet pharmacologique allégué d’un produit médicamenteux. Parfois appelé molécule, substance active ou ingrédient actifNote de bas de page iv.
- Médicament
- Terme général englobant à la fois le produit médicamenteux final et les ingrédients médicinaux, notamment les substances actives et les produits biologiques fabriqués chimiquement, ainsi que les produits de thérapie génique. Les médicaments sont déclarés par ingrédients médicinaux et peuvent faire référence à un seul ingrédient ou à une combinaison unique d’ingrédients.
- Médicament orphelin
- Médicament utilisé pour traiter une maladie rare. Pour les besoins de la présente étude, les médicaments orphelins sont définis comme ayant une désignation de médicament orphelin accordée par la Food and Drug Administration (FDA) des États-Unis ou par l’Agence européenne des médicaments (EMA) pour l’indication concernée.
- Nouveau médicament
- Ingrédient médicinal dont la mise en marché n’a pas encore été autorisée par un organisme de réglementationNote de bas de page iv.
- Perpétuation des brevets
- Pratique qui consiste à acquérir des brevets supplémentaires pour des modifications mineures apportées à un produit pharmaceutique existant dans le but de prolonger la durée de vie du brevet du produit (p. ex. nouveaux systèmes d’administration, nouvelles posologies, nouvelles utilisations, nouvelles combinaisons ou nouvelles formes)Note de bas de page v.
- Thérapie cellulaire
- La transplantation de cellules humaines pour remplacer ou réparer des tissus ou des cellules endommagés.
- Thérapie génique
- Technique utilisée pour traiter des maladies génétiques, qui consiste à remplacer un gène absent ou défectueux par un gène sain, selon la définition de Santé CanadaNote de bas de page vi.
- Phase I
- Dans cette phase, le médicament expérimental est mis à l’essai pour la première fois auprès d’un petit groupe de personnes. L’objectif est d’examiner l’innocuité du médicament, de déterminer une gamme posologique sûre et de détecter les effets secondaires.
- Phase II
-
Dans cette phase, le médicament est administré à un plus grand groupe de personnes (généralement 100 ou plus) en vue de recueillir des données sur son efficacité dans le traitement d’une maladie ou d’un trouble particulier, de vérifier son innocuité sur un plus grand nombre de personnes et de déterminer la meilleure doseNote de bas de page vii.
- Phase III
-
Dans cette phase, desessais, contrôlés ou non, sont effectués après que des données préliminaires qui permettent de penser que le médicament est efficace ont été obtenues. L’objectif est de recueillir des données supplémentaires afin de confirmer l’efficacité clinique et l’innocuité du médicament dans les conditions d’utilisation proposéesNote de bas de page ii. Les essais de phase III sont habituellement des essais randomisés à double insu menés auprès de plusieurs centaines ou milliers de patients.
Phases des essais cliniques
Introduction
Cette édition de l’Observateur des médicaments émergents (OMÉ) présente une sélection de nouveaux médicaments en cours d’essais cliniques de phase III ou en attente d’homologation qui peuvent avoir une incidence sur la pratique clinique ou les dépenses en médicaments au Canada.
La méthodologie, qui est décrite en détail dans la section suivante, utilise un ensemble précis de critères pour dresser la liste des nouveaux médicaments tirés de la base de données GlobalData Healthcare, ainsi que la liste des médicaments en cours d’examen selon les listes des présentations de médicaments et de produits de santé en cours d’examen (PCE) de Santé Canada. Les nouveaux médicaments indiqués dans le présent rapport sont sélectionnés d’après une revue de la littérature scientifique et les résultats des essais cliniques en vue de déterminer si le médicament peut avoir une incidence sur le système de santé canadien en répondant à un besoin thérapeutique non comblé, en offrant un mécanisme d’action nouveau ou un avantage thérapeutique par rapport aux traitements existants, ou en traitant une affection grave. Les médicaments mentionnés dans les éditions précédentes de l’OMÉ sont également passés en revue et mis à jour dans le présent rapport, qui propose aussi une mise à jour sur les médicaments de l’édition précédente qui ont reçu depuis une autorisation de mise en marché de la Food and Drug Administration (FDA) des États-Unis, de l’Agence européenne des médicaments (EMA) ou de Santé Canada. De même, les nouveaux médicaments figurant dans le présent rapport feront l’objet d’un suivi dans les prochaines éditions de l’OMÉ afin de relever ceux qui réussissent à faire leur entrée sur le marché.
Pour mettre en contexte la sélection des médicaments, l’OMÉ comprend un aperçu du nombre de médicaments à chaque phase des essais cliniques portant sur les médicaments émergents d’année en année (2018-2023) et une ventilation des données par domaine thérapeutique pour chaque phase de développement clinique. La présente édition du rapport met également en lumière certains vaccins et autres médicaments faisant l’objet d’essais cliniques pour le traitement et la prévention de la COVID‑19 dans les marchés mondiaux ainsi qu’au Canada. Les médicaments évalués pour cette partie de l’analyse comprennent de nouveaux traitements ainsi que des traitements commercialisés pour d’autres indications qui ont été repositionnés pour le traitement de la COVID-19.
L’Observateur des médicaments émergents est une publication complémentaire à la Veille des médicaments mis en marché, qui analyse les tendances relatives au lancement sur le marché des médicaments nouvellement approuvés au Canada et à l’étranger. Ensemble, ces deux rapports du CEPMB permettent de surveiller le continuum de commercialisation des médicaments émergents aux dernières étapes de développement et des nouveaux médicaments approuvés, en plus de fournir de l’information sur les médicaments émergents et les pressions changeantes sur les coûts aux décideurs, aux chercheurs, aux patients, aux cliniciens et à d’autres intervenants.
Méthodologie
Aperçu des médicaments émergents
L’aperçu des médicaments émergents en 2022 présente la composition des médicaments qui en sont aux diverses étapes de développement clinique. Aux fins de l’analyse, une liste complète des médicaments émergents a été extraite de la base de données GlobalData Healthcare en septembre 2022. Les médicaments candidats sélectionnés pour le rapport de cette année ont été validés au 30 mars 2023.
Les nouveaux ingrédients médicinaux sont ceux qui n’ont pas été approuvés antérieurement par la FDA des États-Unis, par l’EMA ou par Santé Canada. La répartition des nouveaux médicaments par domaine thérapeutique correspond à l’indication en cours d’évaluation, selon les données de GlobalData. Il convient de préciser qu’un même médicament nouveau peut faire l’objet de plusieurs essais cliniques portant sur des indications distinctes.
L’Observateur des médicaments émergents
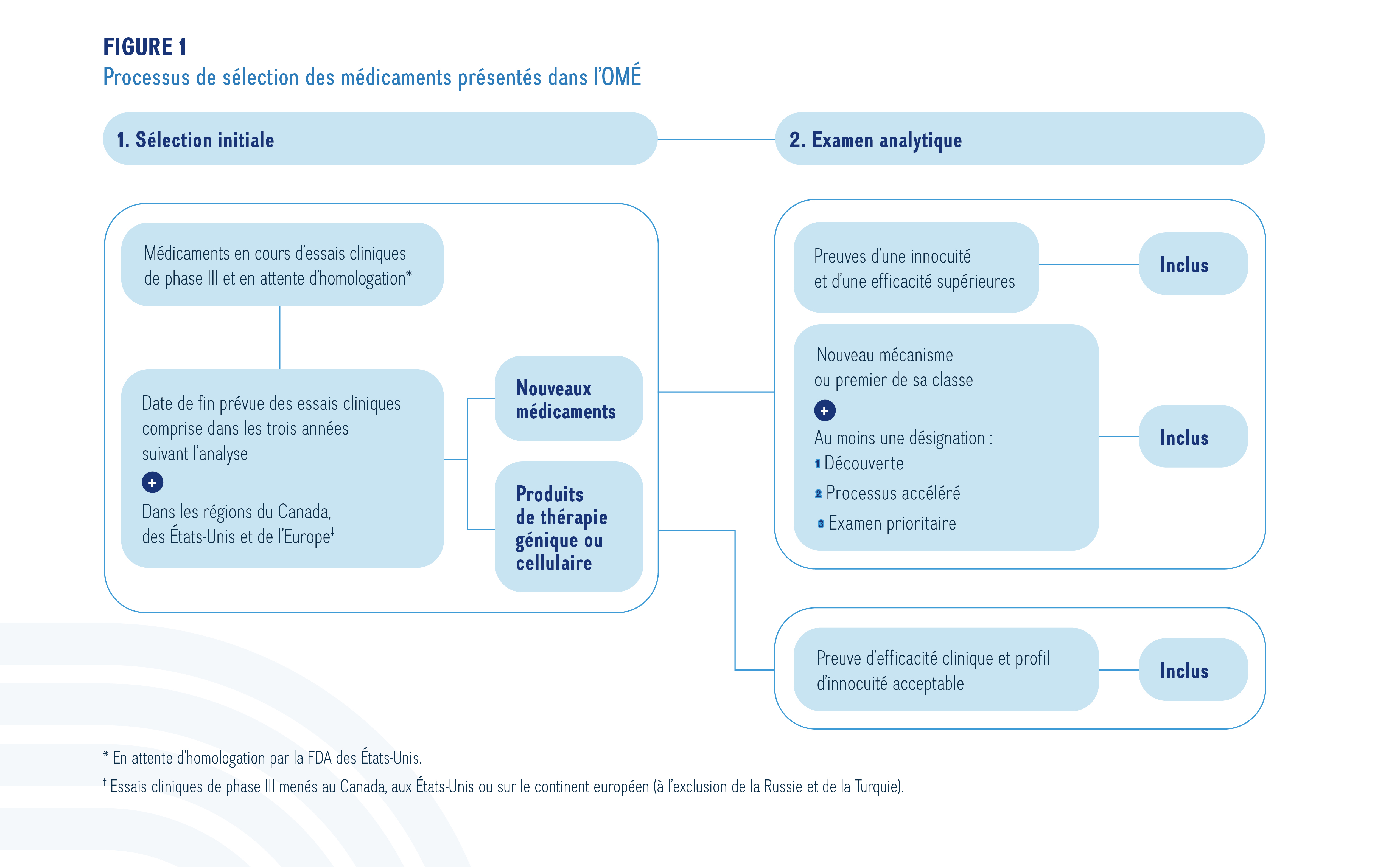
L’OMÉ retient les nouveaux médicaments qui sont en cours d’essais cliniques de phase III ou en attente d’homologation au Canada, aux États-Unis et en Europe. De nombreux médicaments candidats sont premiers de leur classe ou offrent des mécanismes nouveaux pour le traitement dans un domaine thérapeutique précis. Pour cette raison, ce rapport comporte un examen supplémentaire de médicaments qui font l’objet d’essais cliniques de phase II et qui ont la même indication ou le même mécanisme d’action aux étapes précédentes (phase II). La sélection des médicaments émergents repose sur un processus en deux étapes (figure 1). À l’étape de la sélection initiale, les médicaments choisis en sont aux dernières étapes de l’évaluation clinique, tandis qu’à l’étape de l’examen analytique, une évaluation plus rigoureuse de chaque médicament potentiel est effectuée pour déterminer les médicaments qui pourraient avoir une incidence clinique ou budgétaire importante.
* En attente d’homologation par la FDA des États-Unis.
† Essais cliniques de phase III menés au Canada, aux États-Unis ou sur le continent européen (à l’exclusion de la Russie et de la Turquie).
Description de la figure
Cet organigramme décrit la procédure de sélection des nouveaux médicaments inscrits. L’organigramme comprend deux étapes :
1. Sélection initiale
Cette étape comprend d’abord tous les médicaments faisant l’objet d’essais cliniques de phase III ou en attente d’homologation par la Food and Drug Administration des États-Unis. À l’étape suivante, les seuls médicaments retenus sont ceux dont la date de fin prévue des essais cliniques est comprise dans les trois années suivant l’analyse, dans les régions du Canada, des États-Unis et de l’Europe. Pour qu’un médicament satisfasse au critère géographique, des essais cliniques de phase III doivent être menés au Canada, aux États-Unis ou sur le continent européen (à l’exclusion de la Russie et de la Turquie).
2. Examen analytique
L’étape d’examen analytique comprend deux parties : une voie pour les nouveaux médicaments et une autre pour les thérapies géniques.
Les nouveaux médicaments doivent satisfaire au moins l’une des exigences suivantes pour figurer dans la liste :
- Preuves d’une innocuité et d’une efficacité supérieures
- Nouveau mécanisme ou premier agent de sa classe, avec au moins une désignation parmi les suivantes : découverte, traitement accéléré ou évaluation prioritaire
Les thérapies géniques doivent présenter un profil d’innocuité ou d’efficacité clinique prometteur pour figurer dans la liste.
Étape 1. Sélection initiale
On utilise la base de données GlobalData Healthcare pour dresser une liste de médicaments en cours d’essais cliniques de phase III ou en attente d’homologation. Ces médicaments servent de fondement à l’étape de la sélection initiale.
La géographie des médicaments, qui s’entend de la région géographique ou du pays où le médicament est commercialisé ou en développement, se limite au Canada et à d’autres pays ayant des processus de réglementation et d’approbation semblables, soit les États-Unis et le continent européen (à l’exclusion de la Russie et de la Turquie). Seuls les nouveaux ingrédients médicinaux dont l’innocuité et l’efficacité accrues démontrées dans les essais cliniques sont établies par des données adéquates peuvent être considérés pour la sélection.
Les médicaments approuvés ou vendus au Canada, aux États-Unis ou en Europe pour toute autre indication ou dans toute autre concentration ou formulation sont exclus du processus de sélection, tout comme les médicaments dont les essais cliniques sont inactifs, suspendus, retirés ou terminés.
Étape 2. Examen analytique
Critères de sélection
La seconde étape du processus tient compte d’un certain nombre de critères de sélection qui permettent de déterminer la liste finale des médicaments émergents. Ces critères sont exposés en détail dans le tableau 1.
Les étapes précédentes (c.-à-d. phase II) sont également examinées pour déterminer s’il existe d’autres médicaments ayant la même indication ou le même mécanisme d’action que les médicaments candidats en essais cliniques de phase III ou en attente d’homologation sélectionnés. Il est ainsi possible d’obtenir des renseignements supplémentaires sur le nombre de médicaments nouveaux, premiers de leur classe, qui font l’objet d’essais cliniques de phase II et qui pourraient avoir une incidence sur l’importance thérapeutique des médicaments candidats en essais de phase III ou en attente d’homologation sélectionnés.
Tableau 1. Critères de sélection de l’OMÉ
| Critères de sélection |
|---|
| Amélioration de l’innocuité ou de l’efficacité démontrée dans les essais cliniques : médicament qui est associé à une innocuité accrue, à de nouvelles mesures des résultats, à une espérance de vie accrue ou à une meilleure qualité de vie. |
Nouveau mécanisme/premier de sa classe : médicament qui utilise un nouveau mécanisme d’interaction biochimique pour produire un effet médical, ou médicament qui est le premier de sa classe thérapeutique. De plus, le médicament doit correspondre à l’une ou à plusieurs des trois désignations suivantes de la FDA pour le développement et l’examen accélérés :
|
Renseignements descriptifs supplémentaires
Le profil de chaque médicament candidat retenu est fourni, ce qui comprend l’indication et le mécanisme d’action, ainsi qu’un résumé des résultats publiés pertinents provenant des essais cliniques. Les attributs particuliers qui peuvent influer sur l’adoption éventuelle ou le coût de chaque médicament sont également énoncés. Le tableau 2 fournit une description détaillée de ces principaux attributs.
Tableau 2. Principaux attributs des nouveaux médicaments sélectionnés pour l’OMÉ
| Attribut | Pertinence | Source des données |
|---|---|---|
| Essais cliniques de phase III au Canada | Les médicaments mis à l’essai au Canada sont susceptibles d’intéresser les Canadiens. |
GlobalData Healthcare; base de données sur les essais cliniques de Santé Canada; listes des présentations de médicaments et de produits de santé en cours d’examen de Santé Canada; registre des essais cliniques des National Institutes of Health (NIH) |
| Désignation de médicament rare ou orphelin | Les médicaments utilisés dans le traitement de maladies ou de problèmes de santé rares ont généralement des coûts de traitement élevés et peuvent entraîner des dépenses importantes. | GlobalData Healthcare |
| Produit biologique | Ces molécules complexes produites par des organismes vivants devraient avoir des coûts élevés et entraîner ainsi des dépenses importantes. | |
| Traitement d’appoint | Les médicaments conçus pour être utilisés en association avec des médicaments existants peuvent augmenter les coûts de traitement et contribuer à une augmentation des dépenses. | |
| Perpétuation possible | Formes modifiées du même produit afin de prolonger la durée de vie du brevet (p. ex. nouveaux systèmes d’administration, nouvelles posologies, nouvelles utilisations, nouvelles combinaisons ou nouvelles formes). |
Le profil précise également les répercussions possibles sur les coûts, le cas échéant, y compris les revenus mondiaux prévus déclarés par GlobalData.
Les indications et les domaines thérapeutiques des médicaments présentés sont ceux visés par le stade d’essais cliniques de phase III ou d’attente d’homologation. Un même essai clinique peut évaluer plusieurs indications dans le même domaine thérapeutique. Ces médicaments peuvent avoir d’autres indications à divers stades de l’évaluation clinique qui ne sont pas mentionnées dans le présent rapport. La description scientifique et les principaux attributs présentés portent sur l’indication ou les indications précisées pour les médicaments sélectionnés.
Les médicaments mentionnés pour une année donnée sont réévalués à chaque édition de l’OMÉ. Ils peuvent être conservés sur la liste de l’OMÉ s’ils répondent toujours aux critères de sélection. Les médicaments qui font l’objet d’essais cliniques ayant été interrompus ou qui ne répondent plus aux critères de sélection ne sont pas mentionnés dans les éditions suivantes.
Pleins feux sur le Canada
Les listes des PCE de Santé Canada sont évaluées selon une approche modifiée des critères de sélection en vue d’établir une liste de médicaments susceptibles d’avoir une incidence sur la pratique clinique ou sur les dépenses en médicaments au Canada.
Les médicaments inscrits sur les listes des PCE comprennent les présentations de drogues nouvelles contenant des ingrédients médicinaux qui n’ont pas été approuvés au Canada, quelle que soit l’indication, la concentration ou la formulation. Contrairement aux médicaments sélectionnés dans les listes de médicaments émergents, les médicaments inscrits sur les listes des PCE peuvent avoir déjà reçu une autorisation de mise en marché par la FDA des États-Unis ou par l’EMA.
Critères de sélection
Après la sélection initiale, le médicament doit satisfaire à au moins un des trois critères de sélection pour figurer dans le rapport. Ces critères sont présentés dans le tableau 3.
Tableau 3. Critères de sélection pour la liste des médicaments en cours d’examen par Santé Canada
| Critères de sélection |
|---|
| Amélioration de l’innocuité ou de l’efficacité démontrée dans les essais cliniques : médicament qui est associé à une innocuité accrue, à de nouvelles mesures des résultats, à une espérance de vie accrue ou à une meilleure qualité de vie. |
| Nouveau mécanisme/premier de sa classe : médicament qui utilise un nouveau mécanisme d’interaction biochimique pour produire un effet médical, ou médicament qui est le premier de sa classe thérapeutique. |
| Thérapie génique ou cellulaire : technique utilisée pour traiter une maladie génétique, qui consiste à remplacer un gène absent ou défectueux par un gène sain, ou la transplantation de cellules humaines pour remplacer ou réparer des tissus ou des cellules endommagés. |
Renseignements descriptifs supplémentaires
Le profil de chaque médicament en cours d’examen comprend les principaux attributs énoncés au tableau 2, l’indication et le mécanisme d’action, ainsi qu’un résumé des résultats publiés pertinents provenant des essais cliniques. Les attributs particuliers qui peuvent influer sur l’adoption éventuelle ou le coût de chaque médicament sont également énoncés, tout comme les répercussions possibles sur les coûts, le cas échéant, y compris les revenus mondiaux prévus déclarés par GlobalData.
Bien que les désignations de la FDA pour le développement et l’examen accélérés ne constituent pas des critères de sélection pour cette liste, les désignations pertinentes (découverte, processus accéléré et examen prioritaire) sont mentionnées lorsqu’elles sont disponibles. Ces désignations sont décrites au tableau 1.
Les indications et les domaines thérapeutiques correspondent aux renseignements fournis par GlobalData. La description scientifique et les principaux attributs présentés portent sur l’indication précisée pour le médicament en question. Dans le cas des médicaments dont l’examen porte sur plusieurs indications, c’est l’indication principale qui est retenue.
Traitements émergents contre la COVID-19
Les vaccins et les médicaments en cours de développement dans le monde entier qui comportent une indication relative à la COVID-19 ont été extraits pour cette section du rapport, en fonction de l’état d’avancement dans les essais cliniques de phase I, II ou III, ou de l’attente d’homologation. Tous ces médicaments ont été évalués pour la présente analyse, qu’ils soient nouveaux ou existants. Les nouveaux médicaments sont ceux qui n’ont pas encore été commercialisés pour une quelconque indication, tandis que les médicaments existants comprennent les traitements commercialisés antérieurement qui sont en cours d’évaluation pour de nouvelles indications liées à la prévention et au traitement de la COVID-19.
Cette section met également en évidence les médicaments contre la COVID-19 qui ont été approuvés, ainsi que les médicaments qui font actuellement l’objet d’un processus d’examen accéléré par Santé Canada.
Sources de données
La base de données GlobalData Healthcare est la principale source de données pour le repérage des médicaments émergents et des renseignements cliniques correspondants. GlobalData Healthcare permet de suivre les médicaments de leur découverte préclinique jusqu’au lancement sur le marché et aux ventes subséquentes, en passant par les essais cliniques. La base de données est une ressource complète qui répertorie les médicaments à divers stades de développement clinique. Les fonctions de recherche permettent une sélection contrôlée d’attributs particuliers, notamment la phase de développement clinique, le domaine thérapeutique, le type de molécule, l’indication, la géographie du médicament, le mécanisme d’action et les désignations réglementaires.
Les listes des PCE de Santé Canada sont utilisées pour déterminer la sélection présentée des nouveaux médicaments en cours d’examen par Santé Canada. Elles constituent un ensemble de listes accessibles au public énumérant les présentations de produits pharmaceutiques et biologiques qui contiennent de nouveaux ingrédients médicinaux, lesquels n’ont pas encore été approuvés au Canada, et qui ont été acceptées pour examen le 1er avril 2015 ou après cette date.
Étant donné que la sélection se limite aux nouveaux médicaments, d’autres sources d’information sont comparées pour confirmer que les médicaments candidats n’ont jamais été approuvés ou vendus dans le passé. Ces sources comprennent les données de vente enregistrées de la base de données MIDAS© d’IQVIA (tous droits réservés), les dossiers d’approbation réglementaire des National Institutes of Health (NIH), de la FDA des États‑Unis, de l’EMA et de Santé Canada, et des renseignements issus de la base de données sur les essais cliniques de Santé Canada et du site ClinicalTrials.org.
Limites
La présente analyse offre un aperçu des médicaments émergents sur une période donnée. Bien qu’il soit censé être représentatif de la composition des médicaments au cours de l’année complète, l’ensemble des médicaments émergents est assez dynamique, et la part des médicaments dans un domaine thérapeutique particulier peut varier.
L’évaluation se limite aux médicaments en développement destinés à la commercialisation au Canada et dans d’autres pays ayant des processus de réglementation et d’approbation semblables, soit les États-Unis et l’Europe (à l’exclusion de la Russie et de la Turquie). Les médicaments qui n’ont pas encore reçu d’autorisation de mise en marché dans ces pays ont été considérés comme des médicaments candidats potentiels, même s’ils ont été approuvés ailleurs dans le monde.
Certains des médicaments sélectionnés peuvent faire l’objet d’essais cliniques pour d’autres indications; la présente analyse ne fait état que des indications aux derniers stades de développement, c’est-à-dire lors des essais cliniques de phase III ou en attente d’homologation par la FDA des États-Unis, qui répondent aux critères de sélection énoncés dans la méthodologie.
Pour chaque médicament émergent sélectionné, les principaux fabricants et le nom commercial, le cas échéant, sont précisés avec l’indication. Dans certains cas, d’autres fabricants, y compris des filiales, peuvent également participer au développement du médicament avec les principales entreprises, ou d’autres fabricants peuvent mettre au point le même médicament pour d’autres indications.
Bien que le présent rapport tente de répertorier les médicaments émergents les plus importants, la sélection n’est pas exhaustive, et certains médicaments qui ne sont pas inclus dans cette sélection peuvent avoir une incidence importante sur la pratique clinique future ou sur les dépenses en médicaments au Canada.
Sauf indication contraire, les listes présentées rendent compte de la composition des médicaments émergents en date de septembre 2022, et elles ont été validées à la fin mars 2023. En raison de la nature imprévisible et rapide de l’entrée sur le marché des médicaments émergents, certains des médicaments énumérés dans la présente édition peuvent avoir été approuvés ou commercialisés au Canada, aux États-Unis ou en Europe après cette date. Les médicaments émergents qui n’ont pas été inclus dans le rapport en raison du moment où la sélection a eu lieu peuvent actuellement répondre aux critères de sélection; ces médicaments, ainsi que le reste de la liste des médicaments émergents, seront pris en considération dans la prochaine édition du rapport.
Aperçu des médicaments émergents en 2022
Le nombre de produits pharmaceutiques émergents augmente d’année en année. En 2022, plus de 9 000 nouveaux médicaments ont fait l’objet d’une évaluation clinique, ce qui représente une augmentation moyenne de 11 % par année depuis 2018.
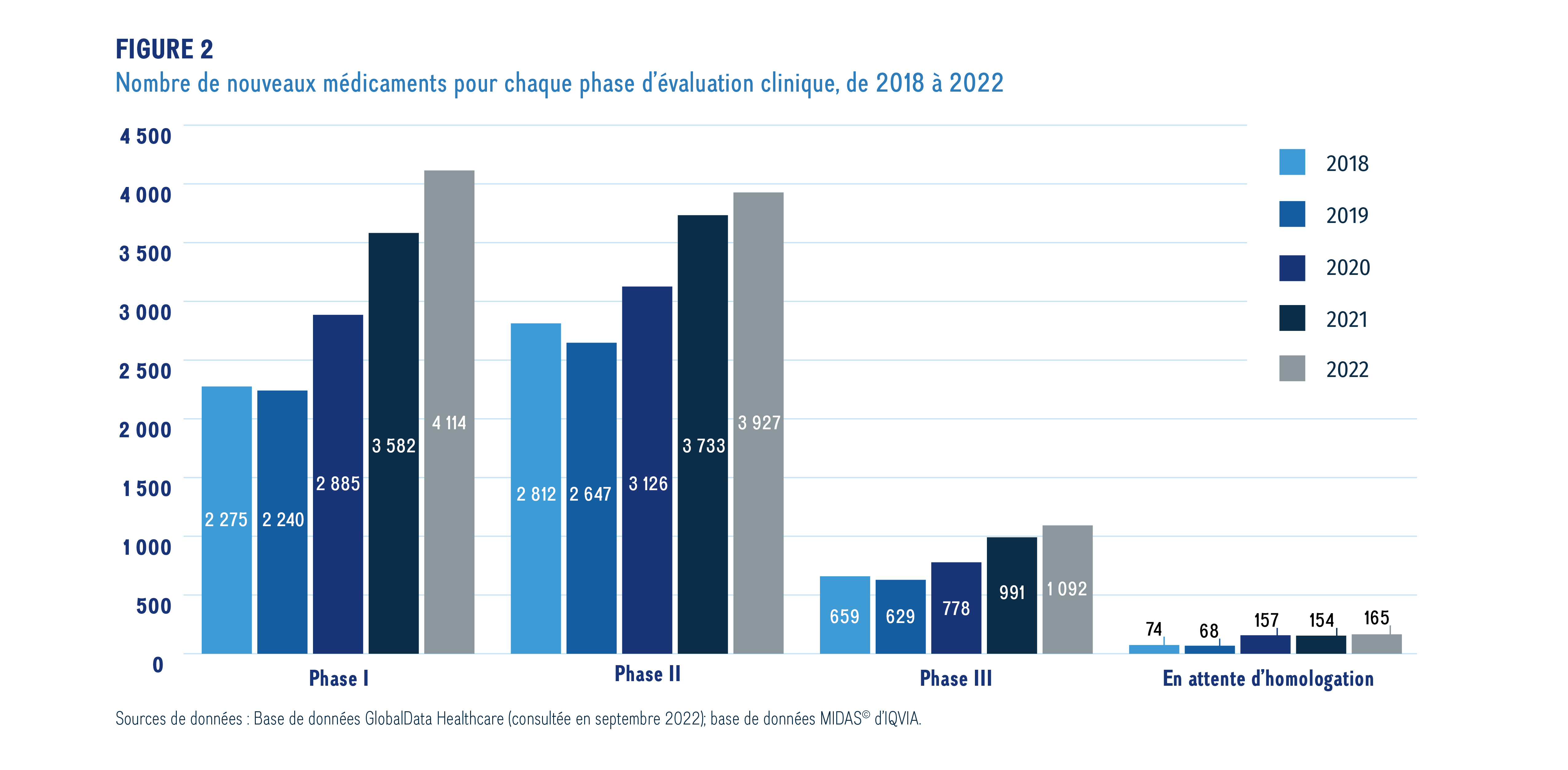
La figure 2 donne un aperçu des médicaments émergents; on y présente le nombre de nouveaux ingrédients médicinaux pour chaque phase de développement clinique au cours des cinq dernières années.
Description de la figure
Figure 2. Nombre de nouveaux médicaments à chaque phase d’évaluation clinique, 2018-2022
Ce graphique à barres donne un aperçu du nombre total de nouveaux médicaments en cours de développement, selon la dernière phase de développement atteinte, de 2018 à 2022. Le nombre de nouveaux médicaments est indiqué pour chaque année et chaque phase.
| Phase I | Phase II | Phase III | Pré-homologation | |
|---|---|---|---|---|
2018 |
2275 |
2812 |
659 |
74 |
2019 |
2240 |
2647 |
629 |
68 |
2020 |
2885 |
3126 |
778 |
157 |
2021 |
3582 |
3733 |
991 |
154 |
2022 |
4114 |
3927 |
1092 |
165 |
Sources de données : Base de données GlobalData Healthcare (consultée en septembre 2022); base de données MIDAS© d’IQVIA.
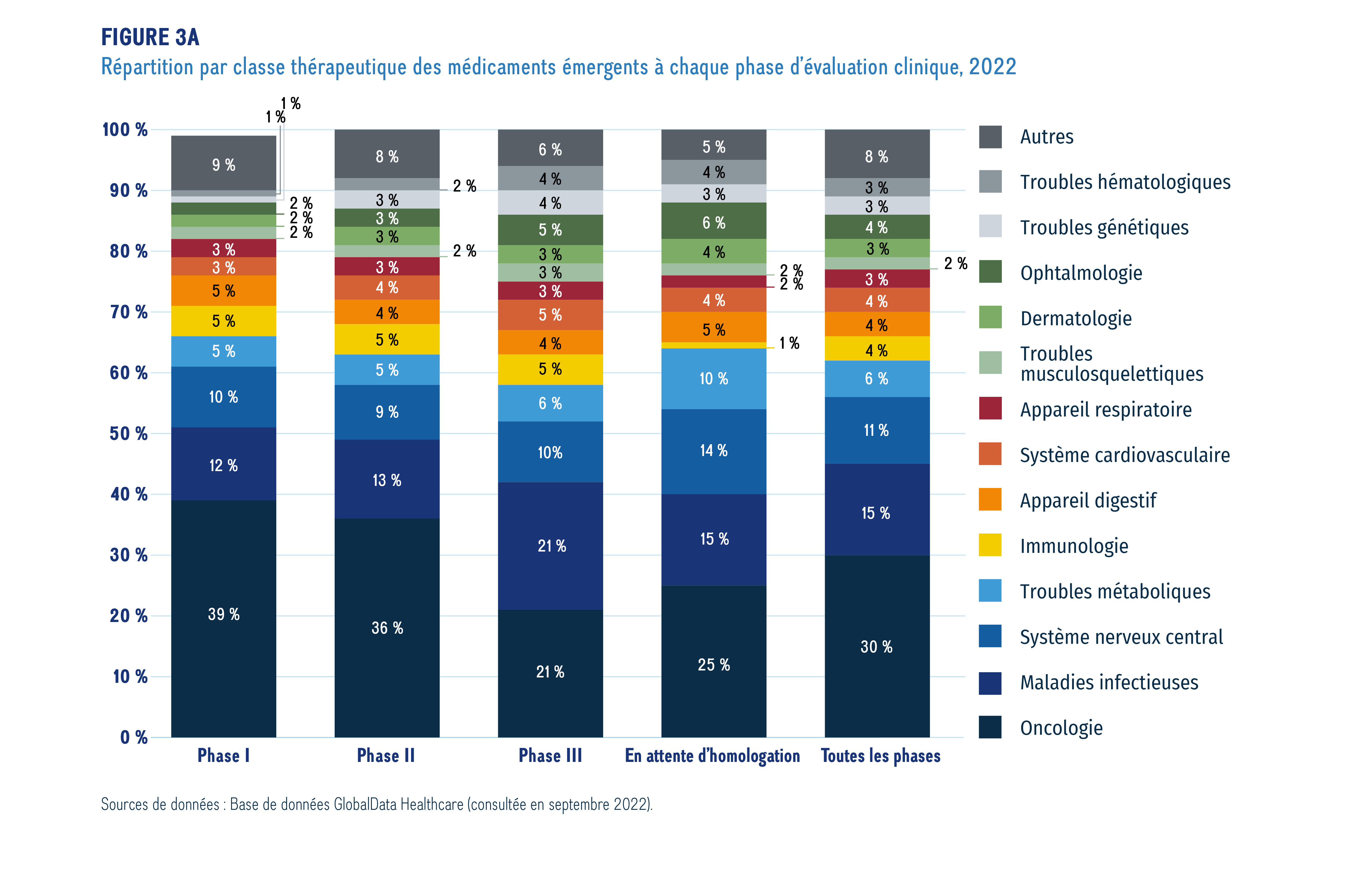
La figure 3a illustre la répartition des nouveaux médicaments par domaine thérapeutique, de la phase I à l’attente d’homologation. Bien que les résultats montrent que les médicaments émergents s’inscrivent dans un large éventail de domaines thérapeutiques en 2022, les traitements contre le cancer dominent la combinaison thérapeutique dans l’ensemble, représentant près du tiers (30 %) des médicaments à toutes les phases d’évaluation clinique. D’autres domaines thérapeutiques importants comprennent les traitements contre les maladies infectieuses (comme la COVID-19) et contre les maladies du système nerveux central.
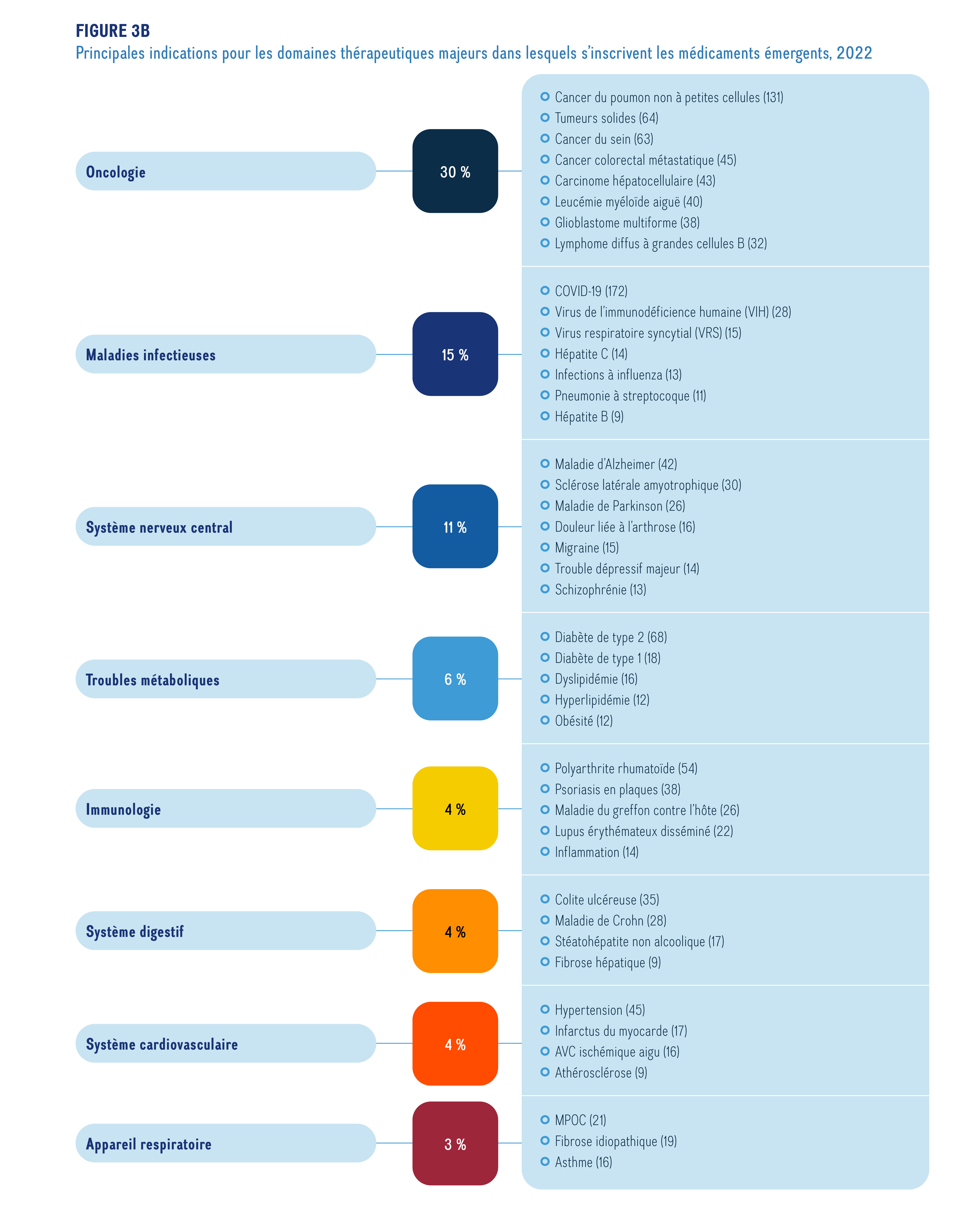
La figure 3b illustre les principales indications et le nombre de médicaments en cours d’essais cliniques de phase II ou de phase III, ou en attente d’homologation dans les domaines thérapeutiques majeurs dans lesquels s’inscrivent les médicaments émergents en 2022.
Description de la figure
Ce graphique à barres empilées illustre la répartition des nouveaux médicaments par domaine thérapeutique, de la phase I à la pré-homologation.
| Domaine thérapeutique | Phase I | Phase II | Phase III | Pré-homologation | Toutes les phases |
|---|---|---|---|---|---|
Oncologie |
39 % |
36 % |
21 % |
25 % |
30 % |
Maladies infectieuses |
12 % |
13 % |
21 % |
15 % |
15 % |
Système nerveux central |
10 % |
9 % |
10 % |
14 % |
11 % |
Troubles métaboliques |
5 % |
5 % |
6 % |
10 % |
6 % |
Immunologie |
5 % |
5 % |
5 % |
1 % |
4 % |
Appareil digestif |
5 % |
4 % |
4 % |
5 % |
4 % |
Système cardiovasculaire |
3 % |
4 % |
5 % |
4 % |
4 % |
Appareil respiratoire |
3 % |
3 % |
3 % |
2 % |
3 % |
Troubles musculosquelettiques |
2 % |
2 % |
3 % |
2 % |
2 % |
Dermatologie |
2 % |
3 % |
3 % |
4 % |
3 % |
Ophtalmologie |
2 % |
3 % |
5 % |
6 % |
4 % |
Troubles génétiques |
1 % |
3 % |
4 % |
3 % |
3 % |
Troubles hématologiques |
1 % |
2 % |
4 % |
4 % |
3 % |
Autres |
9 % |
8 % |
6 % |
5 % |
8 % |
Sources de données : Base de données GlobalData Healthcare (consultée en septembre 2022).
Description de la figure
Ce graphique à barres horizontales illustre les principales indications des médicaments émergents selon le nombre de médicaments, toutes phases de développement confondues.
| Domaine thérapeutique | Toutes les phases | |
|---|---|---|
Oncologie |
30 % |
Cancer du poumon non à petites cellules (131) Tumeur solide (64) Cancer du sein (63) Cancer colorectal métastatique (45) Carcinome hépatocellulaire (43) Leucémie myélocytaire aiguë (40) Glioblastome multiforme (38) Lymphome diffus à grandes cellules B (32) |
Maladies infectieuses |
15 % |
COVID-19 (172) Virus de l’immunodéficience humaine (VIH) (28) Virus respiratoire syncytial (VRS) (15) Hépatite C (14) Infections causées par le virus de l’influenza (13) Pneumonie à streptocoque (11) Hépatite B (9) |
Système nerveux central |
11 % |
Maladie d’Alzheimer (42) Sclérose latérale amyotrophique (30) Maladie de Parkinson (26) Douleur arthrosique (16) Migraine (15) Trouble dépressif majeur (14) Schizophrénie (13) |
Troubles métaboliques |
6 % |
Diabète de type 2 (68) Diabète de type 1 (18) Dyslipidémie (16) Hyperlipidémie (12) Obésité (12) |
Immunologie |
4 % |
Polyarthrite rhumatoïde (54) Psoriasis en plaques (38) Maladie du greffon contre l’hôte (26) Lupus érythémateux disséminé (22) Inflammation (14) |
Appareil digestif |
4 % |
Colite ulcéreuse (35) Maladie de Crohn (28) SHNA (17) Fibrose hépatique (9) |
Système cardiovasculaire |
4 % |
Hypertension (45) Infarctus du myocarde (17) Accident vasculaire cérébral ischémique aigu (16) Athérosclérose (9) |
Appareil respiratoire |
3 % |
MPOC (21) Fibrose pulmonaire idiopathique (19) Asthme (16) |
Les médicaments désignés orphelins par la FDA des États-Unis ou par l’EMA représentent une proportion considérable des médicaments émergents en 2022. La figure 4 illustre les parts des médicaments désignés orphelins à toutes les phases du processus, de 2020 à 2022. Les médicaments désignés orphelins comptent pour une plus grande part des médicaments aux dernières étapes de l’évaluation clinique, représentant 7 % des médicaments émergents faisant l’objet d’essais de phase I contre 31 % des médicaments en attente d’homologation en 2022. Cette tendance est constante depuis 2020.
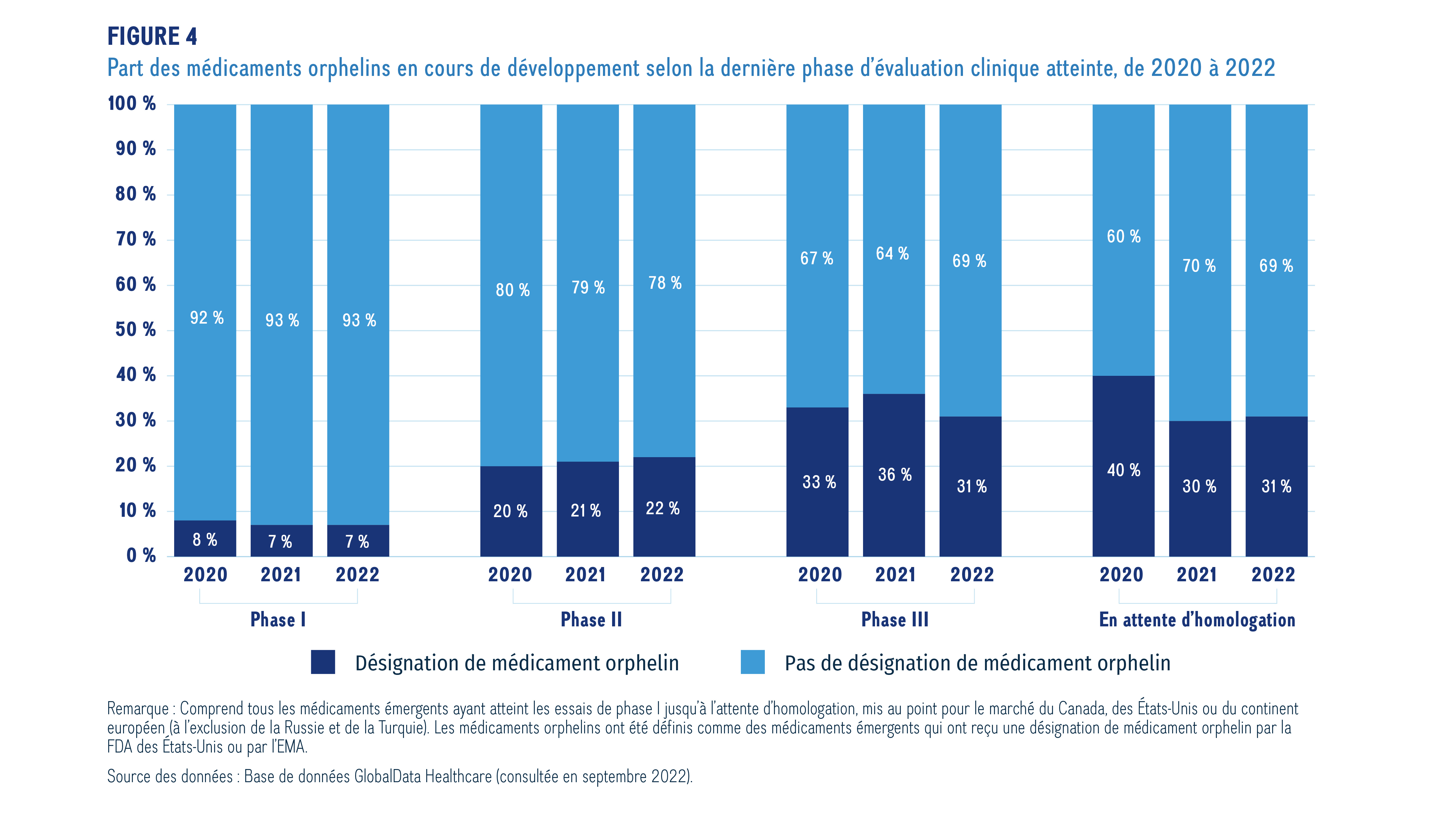
Description de la figure
Ce graphique à barres empilées illustre la part des médicaments orphelins et des médicaments non orphelins émergents, selon la phase de développement, de 2020 à 2022.
| Phase de développement | 2020 | 2021 | 2022 | |
|---|---|---|---|---|
Médicaments orphelins |
Phase I |
8 % |
7 % |
7 % |
Phase II |
20 % |
21 % |
22 % |
|
Phase III |
33 % |
36 % |
31 % |
|
Pré-homologation |
40 % |
30 % |
31 % |
|
Médicaments non orphelins |
Phase I |
92 % |
93 % |
93 % |
Phase II |
80 % |
79 % |
78 % |
|
Phase III |
67 % |
64 % |
69 % |
|
Pré-homologation |
60 % |
70 % |
69 % |
Remarque : Comprend tous les médicaments émergents ayant atteint les essais de phase I jusqu’à l’attente d’homologation, mis au point pour le marché du Canada, des États-Unis ou du continent européen (à l’exclusion de la Russie et de la Turquie). Les médicaments orphelins ont été définis comme des médicaments émergents qui ont reçu une désignation de médicament orphelin par la FDA des États-Unis ou par l’EMA.
Source des données : Base de données GlobalData Healthcare (consultée en septembre 2022).
Veille des tendances en 2022
Le paysage du développement de médicaments évolue depuis quelques années; alors que, auparavant, les efforts étaient axés sur les médicaments vedettes mis au point à l’interne par de grandes entreprises pharmaceutiques, on se concentre maintenant sur les marchés à créneaux et sur la « médecine personnaliséeNote de bas de page ix », qui englobent les médicaments orphelins pour le traitement des maladies rares, les produits de thérapie génique et cellulaire (qui s’étendent à divers domaines thérapeutiques) et les produits biosimilaires émergents (qui sont en pleine croissance).
Médicaments orphelins approuvés
Le nombre de médicaments spécialisés approuvés continue d’augmenter, les médicaments désignés orphelins représentant 58 % (29) des médicaments approuvés en 2020 au CanadaNote de bas de page x. Cette tendance à la hausse se poursuit : en effet, près de la moitié (49 %) des nouveaux médicaments spécialisés sont indiqués pour des maladies orphelines. Lorsqu’on tient compte des médicaments orphelins contre le cancer, les estimations indiquent que 80 % des médicaments spécialisés en développement en 2022 étaient destinés à traiter des maladies orphelinesNote de bas de page xi. Mis à part les médicaments contre le cancer, les nouveaux médicaments anti-inflammatoires, notamment les inhibiteurs du facteur de nécrose tumorale et les antirhumatismaux modificateurs de la maladie (ARMM) synthétiques ciblésNote de bas de page xi, constituent une autre grande classe de médicaments spécialisés émergents.
Produits de thérapie génique et cellulaire
Les produits de thérapie génique et cellulaire émergents connaissent une croissance rapide; en effet, on comptait plus de 600 produits du genre à diverses phases de développement en 2022Note de bas de page xi. Selon les prévisions des analyses de marché de GlobalData, la thérapie génique représentera un marché d’une valeur de 25 milliards de dollars par année d’ici 2034Note de bas de page xii. Parmi les nombreux produits en cours d’évaluation clinique, mentionnons les médicaments destinés à traiter la myopathie de Duchenne (six médicaments en essais de phase III et un médicament en attente d’homologation), l’épidermolyse bulleuse (trois médicaments en phase d’évaluation préclinique, un médicament en essais de phase II et un médicament en attente d’homologation) et la bêta-thalassémie/drépanocytose (dix médicaments en phase d’évaluation préclinique et de découverte)Note de bas de page xiii.
Produits biosimilaires émergents
Les produits biosimilaires peuvent offrir aux patients et aux médecins des options de traitement plus abordables, qui peuvent se traduire par des économies et contribuer à la durabilité de la couverture des médicaments. En date de mars 2023, on comptait 51 produits biosimilaires correspondant à 16 produits de référence novateurs approuvés au Canada. À titre de comparaison, le nombre de produits biosimilaires approuvés par la FDA des États-Unis est de 40, et le nombre de produits biosimilaires approuvés par l’EMA, de 69Note de bas de page xiv. On constate une augmentation des produits biosimilaires émergents à l’échelle mondiale, avec plus de 140 produits faisant l’objet d’essais cliniques de phase III ou en attente d’homologation, notamment dans de nouveaux domaines thérapeutiques comme les hormones de croissance, l’infertilité, la santé osseuse et l’immunosuppression. En date de mars 2023, huit produits biosimilaires étaient à l’étude par Santé Canada; pour deux de ces produits (l’éculizumab et l’ustékinumab), il s’agit de la première présentation d’un produit biosimilaire pour le produit de référence.
L’Observateur des médicaments émergents 2022
Les tableaux ci-après présentent la sélection de nouveaux médicaments candidats pour 2022 (tableau 4), les médicaments conservés des éditions précédentes de l’Observateur des médicaments émergents (tableau 5) et les médicaments figurant dans des éditions précédentes qui ont reçu depuis une autorisation de mise en marché (tableau 6).
Les médicaments en essais cliniques de phase III ou en attente d’homologation sont considérés pour la sélection aux fins d’inclusion dans l’Observateur des médicaments émergents (OMÉ) s’ils sont susceptibles d’avoir une incidence sur la pratique clinique future ou sur les dépenses en médicaments au Canada (p. ex. en répondant à un besoin thérapeutique non comblé, en offrant un mécanisme d’action nouveau ou un avantage thérapeutique par rapport aux traitements existants, ou en traitant une affection grave).
Sélection des nouveaux médicaments candidats
Parmi les 1 257 médicaments émergents en cours d’essais cliniques de phase III ou en attente d’homologation en 2022, 28 nouveaux médicaments ont été retenus pour être ajoutés à la liste des nouveaux médicaments (tableau 4). De nombreux médicaments candidats sont premiers de leur classe ou offrent des mécanismes nouveaux pour le traitement dans des domaines thérapeutiques précis. Le fait de disposer de renseignements sur d’autres médicaments en cours d’évaluation (c.-à-d. en essais de phase II) peut aider à avoir une meilleure idée de la place que pourraient occuper ces médicaments candidats dans le traitement. Les médicaments en essais de phase II ont été examinés en vue de déceler d’autres médicaments émergents qui présentent la même indication ou le même mécanisme d’action que ceux énumérés dans la liste des nouveaux médicaments de 2022. La description de chaque médicament figurant dans la liste des nouveaux médicaments de 2022 comprend un énoncé indiquant s’il existe des médicaments en cours d’essais de phase II qui présentent la même indication ou le même mécanisme d’action. L’annexe A (tableau A3) fournit des renseignements supplémentaires sur les médicaments en cours d’essais de phase II répertoriés pour les indications ciblées par les médicaments candidats. Il est important de souligner que les médicaments en essais de phase II ne passeront pas tous aux essais de phase III. Selon une analyse de l’industrie, ce sont les programmes cliniques de phase II qui connaissent le taux de réussite le plus faible des phases de développement, avec seulement 30,7 % des médicaments candidats en développement passant à la phase III1.
Parmi les nouveaux médicaments présentés dans les rapports précédents, 25 ont été retenus, car ils satisfont toujours aux critères de sélection, et des données récentes continuent d’appuyer d’éventuels bienfaits cliniques prometteurs (tableau 5). Au 30 mars 2023, six des médicaments émergents de 2021 avaient reçu une autorisation de mise en marché aux États-Unis, en Europe ou au Canada (tableau 6), tandis que 11 ont été retirés de la liste parce que les essais cliniques dont ils faisaient l’objet ont été interrompus ou parce qu’ils ne remplissaient plus les critères de sélection.
Sélection des produits biosimilaires
Les produits biosimilaires sont différents des médicaments candidats émergents, car ce sont des produits dont l’efficacité et l’innocuité sont semblables à celles du médicament biologique d’origine. Toutefois, leur entrée sur le marché peut avoir une incidence considérable sur les dépenses en médicaments dans des domaines thérapeutiques précis. Sur les 21 produits biosimilaires en cours d’essais de phase III répertoriés en 2022, 14 (67 %) seraient, s’ils sont approuvés, les premiers produits biosimilaires commercialisés pour le médicament biologique d’origine correspondant. Parmi les exemples, mentionnons le cétuximab (pour le traitement de certains cancers), le dénosumab (pour le traitement de l’ostéoporose postménopausique), l’éculizumab (pour le traitement de l’hémoglobinurie paroxystique nocturne), l’ocrélizumab (pour le traitement de la sclérose en plaques récurrente-rémittente), l’omalizumab (pour le traitement de l’urticaire), le romiplostim (pour le traitement du purpura thrombopénique idiopathique), la ténectéplase (pour le traitement de l’infarctus du myocarde) et l’ustékinumab (pour le traitement du psoriasis en plaques).
L’accès à ces produits biosimilaires pourrait avoir une incidence de taille sur les coûts dans un large éventail de domaines thérapeutiques. Il convient de préciser qu’au 30 mars 2023, un produit biosimilaire de l’éculizumab et un produit biosimilaire de l’ustékinumab étaient en cours d’examen par Santé Canada2. L’annexe A (tableau A1) fournit une liste des produits biosimilaires en essais cliniques de phase III répertoriés et indique s’il existe actuellement un produit biosimilaire pour le médicament biologique d’origine.
Tableau 4. Nouveaux médicaments sélectionnés en 2022
Système cardiovasculaire
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
Abélacimab Anthos Therapeutics Inc
|
Thrombose veineuse profonde (TVP); embolie pulmonaire; fibrillation auriculaire
|
Essais cliniques
Revenus prévus
|
Aprocitentan Idorsia Pharmaceutical Ltd
|
Hypertension réfractaire
|
Essais cliniques
Revenus prévus
|
Étripamil Milestone Pharmaceuticals Inc Canada
|
Tachycardie paroxystique supraventriculaire (TPSV)
|
Essais cliniques
Revenus prévus
|
Obicétrapib NewAmsterdam Pharma BV
|
Dyslipidémie; hypercholestérolémie familiale hétérozygote (HFHe); athérosclérose
|
Essais cliniques
Revenus prévus
|
Sotatercept Acceleron Pharma Inc
|
Hypertension artérielle pulmonaire (HAP) |
Essais cliniques
Revenus prévus
|
Système nerveux central
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
Évobrutinib Merck KGaA
|
Sclérose en plaques récurrente-rémittente (SEP-RR); sclérose en plaques progressive secondaire (SPPS) |
Essais cliniques
Revenus prévus
|
Reldésemtiv Cytokinetics Inc
|
Sclérose latérale amyotrophique (SLA) |
Essais cliniques
Revenus prévus
|
Soticlestat Takeda Pharmaceutical Co Ltd
|
Syndrome de Lennox-Gastaut; syndrome de Dravet (épilepsie myoclonique sévère du nourrisson) |
Essais cliniques
Revenus prévus
|
Ulotaront (SEP-363856) Sunovion Pharmaceuticals Inc
|
Schizophrénie |
Essais cliniques
Revenus prévus
|
Dermatologie
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
Bérémagène géperpavec Krystal Biotech Inc
|
Épidermolyse bulleuse
|
Essais cliniques
Revenus prévus
|
Appareil digestif
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
Resmétirom Madrigal Pharmaceuticals Inc
|
Stéatohépatite non alcoolique (NASH); stéatose hépatique non alcoolique (NAFLD) |
Essais cliniques
Revenus prévus
|
Séladelpar lysine CymaBay Therapeutics Inc
|
Cholangite biliaire primitive (cirrhose biliaire primitive) |
Essais cliniques
Revenus prévus
|
Troubles génétiques
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
Délandistrogène moxéparvovec Sarepta Therapeutics Inc
|
Myopathie de Duchenne
|
Essais cliniques
Revenus prévus
|
REC-2282 Recursion Pharmaceuticals Inc
|
Méningiomes causés par la mutation du gène NF2 (neurofibromatose de type II) |
Essais cliniques
Revenus prévus
|
Immunologie
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
Garadacimab CSL Ltd
|
Angio-œdème héréditaire (AOH) (déficit en inhibiteur de la C1 estérase [C1‑INH]) |
Essais cliniques
Revenus prévus
|
Omidubicel Gamida Cell Ltd
|
Transplantation de cellules souches hématopoïétiques |
Essais cliniques
Revenus prévus
|
Maladies infectieuses
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
Posoleucel AlloVir Inc
|
Infections à herpès virus |
Essais cliniques
Revenus prévus
|
Zoliflodacine Entasis Therapeutics Holdings Inc
|
Gonorrhée urétrale et cervicale non compliquée |
Essais cliniques
Revenus prévus
|
Troubles métaboliques
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
Insuline humaine, voie orale (ORMD-0801) Oramed Pharmaceuticals Inc
|
Diabète de type 2
|
Essais cliniques
Revenus prévus
|
Insuline icodec Novo Nordisk AS
|
Diabète de type 1 (diabète insulino-dépendant); diabète de type 2
|
Essais cliniques
Revenus prévus
|
Oncologie
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
Acétate de rusfertide Protagonist Therapeutics Inc.
| Polycythémie vraie |
Essais cliniques
Revenus prévus
|
Bémarituzumab Amgen Inc
|
Adenocarcinoma of the gastroesophageal junction; Gastric cancer; Bladder cancer; Gastroesophageal (GE) junction carcinomas |
Essais cliniques
Revenus prévus
|
Chlorhydrate d’iberdomide Bristol-Myers Squibb Co
|
Myélome multiple réfractaire; myélome multiple récidivant |
Essais cliniques
Revenus prévus
|
Dichlorhydrate de navitoclax AbbVie Inc
|
Myélofibrose |
Essais cliniques
Revenus prévus
|
Imételstat sodique Geron Corp
|
Syndrome myélodysplasique; myélofibrose secondaire à une thrombocytémie essentielle (MF post‑TE); myélofibrose secondaire à une polycythémie vraie (MF post-PV) |
Essais cliniques
Revenus prévus
|
Rélacorilant Corcept Therapeutics Inc
|
Cancer épithélial de l’ovaire |
Essais cliniques
Revenus prévus
|
Zolbétuximab Astellas Pharma Inc
|
Adénocarcinome de la jonction œsophago-gastrique; cancer de l’estomac
|
Essais cliniques
Revenus prévus
|
Ophtalmologie
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
Lénadogène nolparvovec GenSight Biologics SA
|
Neuropathie optique héréditaire de Leber (atrophie optique de Leber)
|
Essais cliniques
Revenus prévus
|
* Les prévisions consensuelles utilisées pour les données sur les revenus mondiaux ont été recueillies auprès de GlobalData (T4 de 2022) et sont présentées en dollars américains.
Source des données : Base de données GlobalData Healthcare.
Tableau 5. Mise à jour sur les médicaments émergents conservés de l’édition 2021 de l’Observateur des médicaments émergents
Système cardiovasculaire
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
Apabétalone Resverlogix Corp.
|
Coronaropathie (cardiopathie ischémique) |
Essais cliniques
Revenus prévus
|
CSL112 CSL Ltd
|
Syndrome coronarien aigu (SCA) |
Essais cliniques
Revenus prévus
|
Système nerveux central
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
Latozinémab Alector Inc
|
Démence frontotemporale (DFT) |
Essais cliniques
Revenus prévus
|
Midomafetamine (MDMA) Multidisciplinary Association for Psychedelic Studies
|
Trouble de stress post-traumatique (TSPT) |
Essais cliniques
Revenus prévus
|
ND-0612 Mitsubishi Tanabe Pharma Corp
|
Maladie de Parkinson (MP) |
Essais cliniques
Revenus prévus
|
Valiltramiprosate Alzheon Inc
|
Maladie d’Alzheimer (MA) |
Essais cliniques
Revenus prévus
|
Appareil digestif
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
Brazikumab AstraZeneca Plc
|
Maladie de Crohn (entérite régionale) |
Essais cliniques
Revenus prévus
|
RBX-2660 Rebiotix Inc
|
Infections à Clostridium difficile (maladies associées à C. difficile) |
Essais cliniques
Revenus prévus
|
Système génito-urinaire et hormones sexuelles
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
Mésylate de gépotidacine GlaxoSmithKline PLC
|
Cystite; infections urinaires |
Essais cliniques
Revenus prévus
|
Troubles hématologiques
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
Bentracimab PhaseBio Pharmaceuticals Inc
|
Troubles du saignement et de la coagulation |
Essais cliniques
Revenus prévus
|
Danicopan Alexion Pharmaceuticals Inc
|
Hémoglobinurie paroxystique nocturne (HPN) |
Essais cliniques
Revenus prévus
|
Fidanacogène Pfizer Inc
|
Hemophilia B |
Essais cliniques
Revenus prévus
|
Fitusiran Sanofi
|
Hémophilie A; hémophilie B |
Essais cliniques
Revenus prévus
|
Troubles hormonaux
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
Palopegtériparatide (TransCon PTH) Ascendis Pharma AS
|
Hypoparathyroïdie |
Essais cliniques
Revenus prévus
|
Maladies infectieuses
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
V-7 Immunitor Inc
|
Tuberculose (TB) |
Essais cliniques
Revenus prévus
|
Santé des hommes
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
Triflutate de fexapotide Nymox Pharmaceutical Corp
|
Hypertrophie bénigne de la prostate (HBP) |
Essais cliniques
Revenus prévus
|
Troubles métaboliques
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
Birtamimab Prothena Corp Plc
|
Amylose systémique primaire |
Essais cliniques
Revenus prévus
|
Donislecel (Lantidra) CellTrans Inc
|
Diabète de type 1 (DT1; diabète juvénile) |
Essais cliniques
Revenus prévus
|
Pégunigalsidase alfa Chiesi Farmaceutici SpA
|
Maladie de Fabry |
Essais cliniques
Revenus prévus Revenus mondiaux annuels prévus inconnus. |
Oncologie
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
Arfolitixorine Isofol Medical AB
|
Cancer colorectal métastatique |
Essais cliniques
Revenus prévus
|
SGX-301 (HyBryte) Soligenix Inc
|
Lymphome T cutané (LTC) |
Essais cliniques
Revenus prévus
|
Ipatasertib Genentech, Inc
|
Cancer de la prostate métastatique hormono-résistant (résistant à la castration, androgéno-indépendant) |
Essais cliniques
Revenus prévus
|
Motixafortide (BL-8040; Aphexda) BioLineRx Ltd
|
Myélome multiple (maladie de Kahler) |
Essais cliniques
Revenus prévus
|
Ophtalmologie
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
Avacincaptad pégol sodique (Zimura) Iveric Bio Inc
|
Atrophie géographique |
Essais cliniques
Revenus prévus
|
Santé des femmes
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
Fézolinétant Astellas Pharma Inc
|
Symptômes vasomoteurs de la ménopause (bouffées de chaleur) |
Essais cliniques
Revenus prévus
|
* Les prévisions consensuelles utilisées pour les données sur les revenus mondiaux ont été recueillies auprès de GlobalData (T4 de 2022) et sont présentées en dollars américains.
Source des données : Base de données GlobalData Healthcare.
Tableau 6. Médicaments émergents de l’édition 2021 de l’Observateur des médicaments émergents ayant reçu une autorisation de mise en marché
Système nerveux central
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
Lécanemab (Leqembi) Eisai Co Ltd
|
Maladie d’Alzheimer (MA) |
Approbation
Revenus prévus
|
Ublituximab (Briumvi) TG Therapeutics, Inc.; LFB S.A.
|
Sclérose en plaques récurrente-rémittente (SEP-RR) |
Approbation
Revenus prévus
|
Troubles hématologiques
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
Étranacogène dezaparvovec (Hemgenix) CSL Ltd
|
Hémophilie B (déficit en facteur IX) |
Approbation
Revenus prévus
|
Maladies infectieuses
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
Otéséconazole (Vivjoa) Mycovia Pharmaceuticals Inc.
|
Candidose vulvovaginale (CVV) récidivante |
Approbation
Revenus prévus
|
Troubles métaboliques
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
Téplizumab (Tzield) Provention Bio Inc and Sanofi
|
Diabète de type 1 (DT1; diabète juvénile) |
Approbation
Revenus prévus
|
Oncologie
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
Élacestrant (Orserdu) Stemline Therapeutics Inc.
|
Cancer du sein négatif pour le récepteur 2 du facteur de croissance épidermique humain (cancer du sein HER2-); cancer du sein métastatique |
Approbation
Revenus prévus
|
* Les prévisions consensuelles utilisées pour les données sur les revenus mondiaux ont été recueillies auprès de GlobalData (T4 de 2022) et sont présentées en dollars américains.
Source des données : Base de données GlobalData Healthcare.
Pleins feux sur le Canada
Cette section comprend une liste de certains médicaments en cours d’examen par Santé Canada qui pourraient avoir une incidence importante sur la pratique clinique future et sur les dépenses en médicaments. Les médicaments figurant dans cette liste peuvent être nouveaux au Canada, mais avoir été approuvés dans d’autres pays.
Les produits biosimilaires sont inclus dans les listes des PCE de Santé Canada. Bien qu’ils n’offrent pas une innocuité et une efficacité accrues, leur accessibilité pourrait avoir une incidence sur les dépenses en médicaments. En date de septembre 2022, les produits biosimilaires en cours d’examen étaient les suivants : aflibercept, bévacizumab, éculizumab, énoxaparine, pegfilgrastim et trastuzumab. À ce jour, il n’y a pas de produits biosimilaires pour l’aflibercept ou l’éculizumab. Leur accessibilité pourrait avoir une incidence sur les dépenses réservées à l’utilisation de ces traitements dans les budgets de médicaments. L’annexe A (tableau A2) contient la liste des produits biosimilaires faisant actuellement l’objet d’un examen par Santé Canada.
Le tableau 7 présente cinq nouveaux médicaments actuellement inscrits sur les listes des PCE de Santé Canada qui ont un nouveau mécanisme d’action ou dont l’innocuité et l’efficacité ont été améliorées dans le cadre d’essais cliniques. Sur les quatre médicaments figurant dans l’édition 2021, tous ont depuis reçu une autorisation de mise en marché de Santé Canada.
Les listes des PCE constituent un ensemble de documents accessibles au public énumérant les présentations de produits pharmaceutiques et biologiques qui contiennent de nouveaux ingrédients médicinaux et qui ont été acceptés pour examen au Canada.
Tableau 7. Nouveaux médicaments sélectionnés en cours d’examen par Santé Canada, 2022
Système nerveux central
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
Mésylate de masitinib AB Science S.A.
|
Sclérose latérale amyotrophique (SLA) |
Essais cliniques
Revenus prévus
|
Troubles hématologiques
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
Concizumab Novo Nordisk Canada Inc
|
Hémophilie B |
Essais cliniques
Revenus prévus
|
Immunologie
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
Spésolimab Boehringer Ingelheim (Canada) Ltd Ltee
|
Psoriasis pustuleux généralisé (PPG) |
Essais cliniques
Revenus prévus
|
Oncologie
| Médicament (nom commercial) Entreprise |
Indication | Description et principaux attributs |
|---|---|---|
Ciltacabtagène autoleucel (Carvykti) Janssen Inc
|
Myélome multiple en rechute ou réfractaire |
Essais cliniques
Revenus prévus
|
Glofitamab Hoffmann-La Roche Limitée
|
Lymphome diffus à grandes cellules B |
Essais cliniques
Revenus prévus
|
* Les prévisions consensuelles utilisées pour les données sur les revenus mondiaux ont été recueillies auprès de GlobalData (T4 de 2022) et sont présentées en dollars américains.
† Les listes des présentations de médicaments et de produits de santé en cours d ’examen (PCE) de Santé Canada précisent le domaine thérapeutique du médicament en cours d’examen, mais pas l’indication. L’indication présentée au tableau 7 est fondée sur les renseignements sur le médicament issus de la littérature ou des approbations accordées dans d’autres pays. Dans certains cas, lorsque le médicament a fait l’objet d’un examen harmonisé, l’indication a été vérifiée dans le rapport d’examen en vue du remboursement de l’ACMTS.
Source des données : Base de données GlobalData Healthcare.
Traitements émergents contre la COVID-19
Cette section de l’OMÉ comprend un aperçu des médicaments émergents, nouveaux et existants, qui sont en cours d’évaluation clinique pour des indications liées à la prévention et au traitement de la COVID-19. Une analyse des marchés mondiaux fournit de l’information sur les médicaments contre la COVID-19 à toutes les phases des essais cliniques ou en attente d’homologation.
Marchés mondiaux
Le marché des médicaments émergents contre la COVID-19 s’est développé à un rythme sans précédent au cours des trois dernières années. Les données publiées visant à confirmer l’innocuité et l’efficacité des divers traitements contre la COVID-19 évoluent constamment.
En plus de la grande variété de vaccins en cours de mise au point, de nombreux médicaments nouveaux et repositionnés sont actuellement évalués dans le cadre d’essais cliniques pour voir s’ils pourraient être bénéfiques dans le traitement de la COVID-19. Ces médicaments comprennent des antiviraux, des anticorps monoclonaux, des peptides synthétiques et des produits de thérapie cellulaire273.
La figure 5 présente une ventilation des vaccins et des traitements émergents contre la COVID-19 en fonction de la phase d’évaluation clinique. Pour cet aperçu, on a extrait les données sur les médicaments indiqués dans le traitement de la COVID-19 en cours d’essais de phase I, II ou III, ou en attente d’homologation. Ces médicaments ont été regroupés dans trois catégories : les vaccins, qui sont utilisés pour prévenir l’infection causée par le nouveau coronavirus; les traitements (nouveaux médicaments), qui sont de nouveaux médicaments utilisés pour la prévention ou la réduction de certaines des complications associées à la COVID-19 (p. ex. pneumonie, complications respiratoires et hyperinflammation); et les traitements (médicaments existants), qui sont des médicaments déjà commercialisés repositionnés en vue de traiter la COVID-19 ou ses symptômes.
Aperçu
Le marché des médicaments émergents contre la COVID-19 continue de prendre de l’ampleur, de nombreuses études cliniques étant menées sur les médicaments nouveaux et existants. Voici certaines des avancées les plus importantes de 2022 :
- En 2022, plus de 400 nouveaux médicaments ont fait l’objet d’une évaluation clinique en lien avec le traitement et la prévention de la COVID-19. Il s’agit d’une hausse de 10 % par rapport à l’année précédente.
- Les avancées dans la technologie des vaccins ont permis de mettre à jour et d’approuver rapidement des vaccins existants en vue de protéger la population contre les nouvelles souches du virus de la COVID-19.
- Les vaccins bivalents qui ciblent les sous-variants BA.4 et BA.5 d’Omicron ont été approuvés dans de nombreux pays.
- Les vaccins administrés par voie nasale constituent une approche de plus en plus envisagée pour prévenir la COVID-19. En 2022, vingt différents vaccins administrés par voie nasale étaient à différentes phases de développement. Il y a actuellement deux vaccins administrés par voie nasale ou par inhalation qui sont approuvés en Chine et en Inde.
- Les options de traitement émergentes les plus efficaces comprennent les antiviraux par voie orale et les nouveaux anticorps monoclonaux, qui ont donné des résultats positifs dans le cadre d’essais cliniques.
- Les modèles de thérapie à base de cellules souches et les modèles d’organoïdes issus de cellules souches constituent une nouvelle option de traitement et une nouvelle méthode de recherche qui gagnent en importance dans le domaine de la COVID-19. En date de février 2023, on dénombrait 53 produits de thérapie cellulaire à différentes phases d’évaluation clinique.
Sources : Base de données GlobalData Healthcare (février 2023); Santé Canada (février 2023).
La figure 5 présente le nombre d’essais cliniques portant sur des traitements et des vaccins contre la COVID-19 en fonction de la dernière phase de développement atteinte en date de septembre 2022. La majorité des vaccins émergents (97 %) sont de nouveaux médicaments visant à prévenir la COVID-19. Les antiviraux constituent le traitement le plus couramment utilisé pour traiter les symptômes de la COVID-19, représentant 74 % des nouveaux médicaments émergents. Les autres options de traitement comprennent les anticorps monoclonaux, les produits de thérapie cellulaire et les peptides synthétiques, qui représentent un grand pourcentage des médicaments émergents repositionnés.
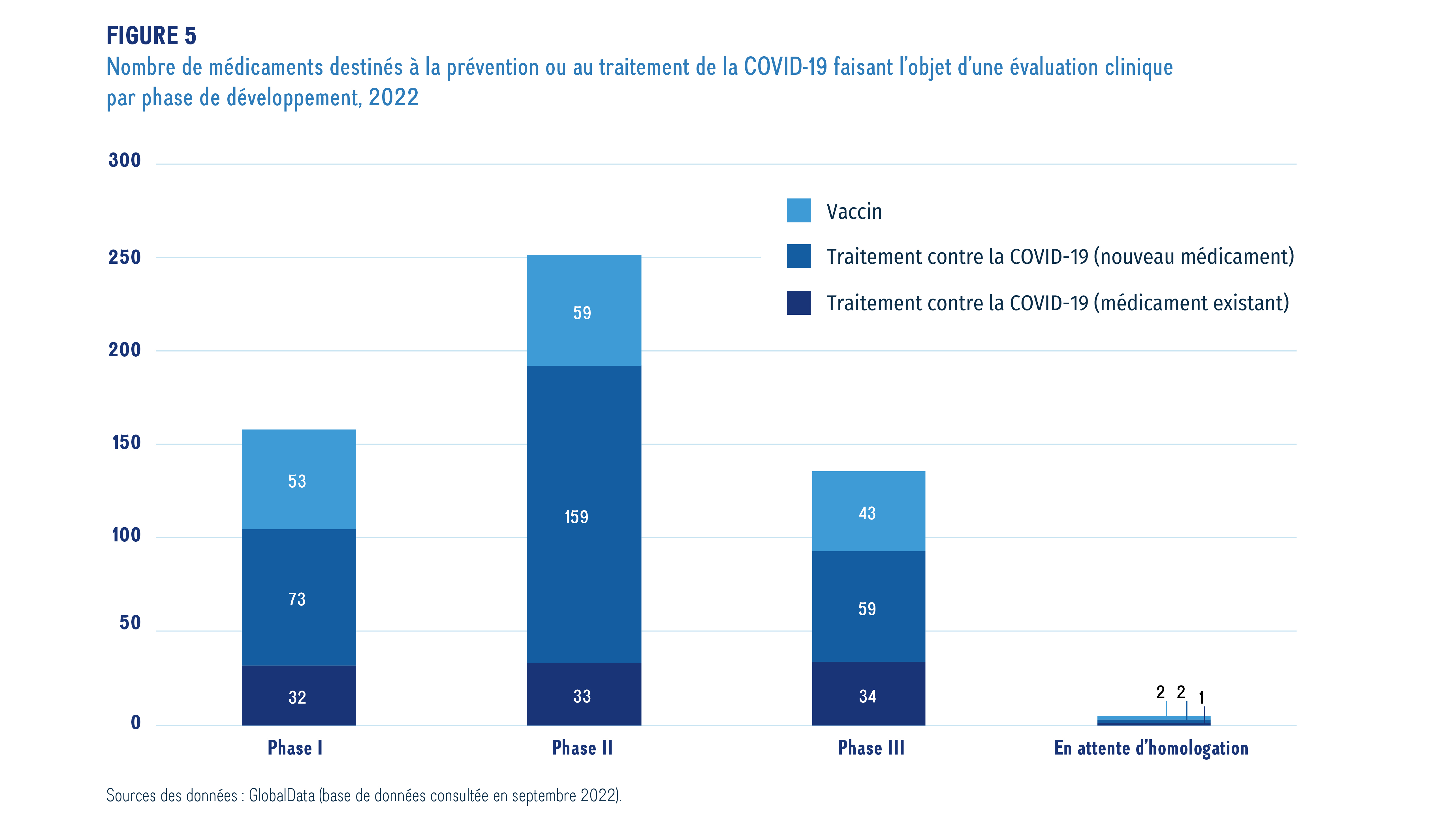
Description de la figure
Ce graphique à barres empilées illustre le nombre de traitements et de vaccins émergents contre la COVID-19 en 2022. Il montre les totaux pour les vaccins et les traitements ainsi que des totaux distincts pour les nouveaux traitements et les traitements repositionnés ou redirigés.
| Phase I | Phase II | Phase III | Pré-homologation | |
|---|---|---|---|---|
Vaccins |
53 |
59 |
43 |
2 |
Nouveaux traitements |
73 |
159 |
59 |
1 |
Traitements repositionnés ou redirigés |
32 |
33 |
34 |
2 |
La figure 6 présente une ventilation des vaccins contre la COVID-19 en fonction de leur mécanisme d’action et de la dernière phase de développement atteinteNote de bas de page xv. Les vaccins sont classés par type selon leur mécanisme d’action (p. ex. les vaccins vivants atténués ciblent le virus entier, mais les vaccins à sous-unités protéiques et les vaccins à vecteurs recombinants ciblent une partie du virus).
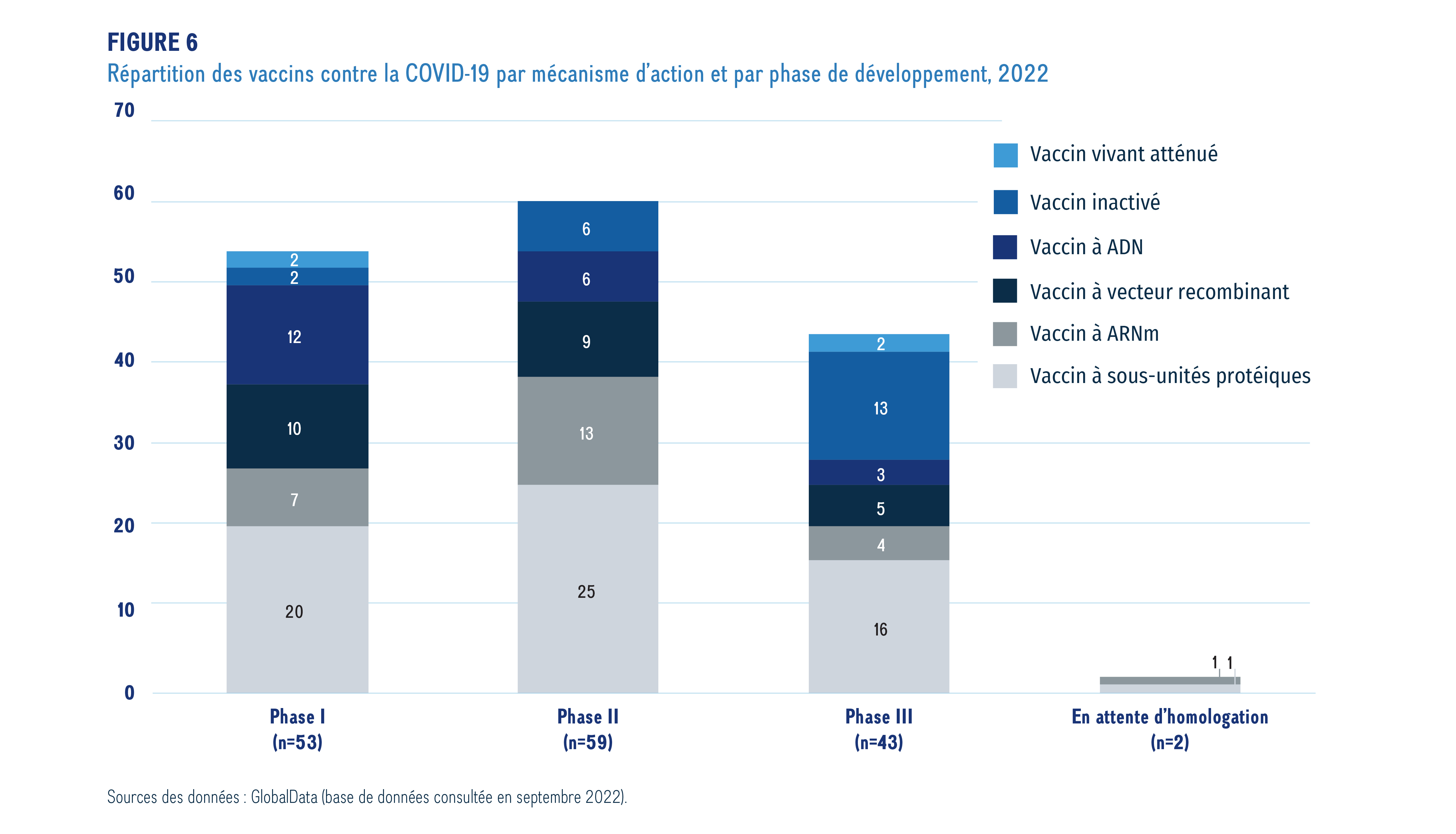
Sources des données : GlobalData (base de données consultée en septembre 2022).
Description de la figure
Ce graphique à barres empilées illustre la répartition des vaccins contre le coronavirus à chacune des phases d’évaluation clinique, par type de vaccin, en date de septembre 2022.
| Vaccins à sous-unités protéiques | Vaccins inactivés | Vaccins à ARNm | Vaccins à vecteur recombinant | Vaccins à ADN | Vaccins vivants atténués | Total | |
|---|---|---|---|---|---|---|---|
Phase I |
20 |
2 |
7 |
10 |
12 |
2 |
53 |
Phase II |
25 |
6 |
13 |
9 |
6 |
0 |
59 |
Phase III |
16 |
13 |
4 |
5 |
3 |
2 |
43 |
Pré-homologation |
1 |
0 |
1 |
0 |
0 |
0 |
2 |
Canada
La COVID-19 continue de toucher les Canadiens, avec environ 182 000 hospitalisations et plus de 52 000 décès en date de mars 2023Note de bas de page xvi. Plus de 85 % des Canadiens ont reçu leur série vaccinale primaire complète (deux doses)Note de bas de page xvii. Les derniers vaccins approuvés par Santé Canada sont les vaccins bivalents qui ciblent deux souches différentes du virus. Les vaccins mis à jour Spikevax de Moderna et Comirnaty de Pfizer-BioNTech ciblent la souche d’origine du SRAS-CoV-2 ainsi que les sous-variants BA.4 et BA.5 d’Omicron, que l’on sait résistants aux versions précédentes des vaccins. Les vaccins sont produits selon les mêmes méthodes que les vaccins précédents contre la COVID-19, sauf qu’ils contiennent deux composants d’ARNm au lieu d’un seul, ce qui leur permet de cibler plus d’une souche du virusNote de bas de page xviii
Santé Canada accorde la priorité à l’examen des présentations de vaccins contre la COVID-19. En date de mars 2023, Santé Canada avait approuvé six vaccins, soit deux vaccins à ARNm (Comirnaty et Spikevax), deux vaccins à vecteurs viraux (Jcovden et Vaxzevria), un vaccin à base de plantes (Covifenz) et un vaccin à protéine (Nuvaxovid). Le tableau 8 présente le nombre de médicaments approuvés par Santé Canada pour la prévention et le traitement de la COVID-19, tandis que le tableau 9 présente le nombre de médicaments contre la COVID-19 à l’étude par Santé Canada en date de mars 2023.
Tableau 8. Traitements et vaccins contre la COVID-19 approuvés par Santé Canada, 2022
| Domaine thérapeutique | Demandeur | Ingrédient médicinal | Résultat de la demande | Date de la décision ou du résultat |
|---|---|---|---|---|
Antiviraux à usage systémique |
Veklury Gilead Sciences Canada Inc. |
Remdésivir (solution pour injection) |
Texte habilitant Règlement sur les aliments et drogues; avis de conformité délivré aux termes de la ligne directrice sur les AC-C |
2020-07-27 |
Indication supplémentaire Règlement sur les aliments et drogues; autorisé |
2022-04-22 |
|||
Antiviraux à usage systémique |
Paxlovid Pfizer Canada ULC |
Nirmatrelvir et ritonavir (comprimés pour administration orale) |
Texte habilitant Règlement sur les aliments et drogues; autorisé avec conditions |
2022-01-17 |
Antisérums et immunoglobulines |
Evusheld AstraZeneca Canada Inc. |
Cilgavimab et tixagévimab (solution pour injection) |
Texte habilitant Règlement sur les aliments et drogues; autorisé avec conditions |
2022-04-14 |
Indication supplémentaire Règlement sur les aliments et drogues; autorisé |
2022-10-18 | |||
Antisérums et immunoglobulines |
Casirivimab et imdévimab Hoffmann-La Roche Ltée |
Casirivimab et imdévimab (solution pour injection) |
Texte habilitant Arrêté d’urgence*; autorisé avec conditions |
2021-06-09 |
Antisérums et immunoglobulines |
Bamlanivimab Eli Lilly Canada Inc. |
Bamlanivimab (solution pour injection) |
Texte habilitant Arrêté d’urgence*; autorisé avec conditions |
2020-11-20 |
Antisérums et immunoglobulines |
Sotrovimab GlaxoSmithKline Inc. |
Sotrovimab (solution pour injection) |
Texte habilitant Arrêté d’urgence*; autorisé avec conditions |
2021-07-30 |
Antisérums et immunoglobulines |
Actemra Hoffmann-La Roche Ltée |
Tocilizumab (solution pour injection) |
Indication supplémentaire Règlement sur les aliments et drogues; autorisé |
2022-10-13 |
Vaccins |
Covifenz Medicago Inc. |
Particules pseudo-virales de la protéine de spicule du SRAS-CoV-2 |
Texte habilitant Règlement sur les aliments et drogues; autorisé avec conditions |
2022-02-24 |
Vaccins |
Nuvaxovid Novavax Inc. |
Protéine de spicule recombinante du SRAS-CoV-2 |
Texte habilitant Dose pour adolescents (12 à 17 ans) Règlement sur les aliments et drogues |
2022-12-06 |
Première dose de rappel Règlement sur les aliments et drogues; autorisé avec conditions |
2022-11-17 |
|||
Règlement sur les aliments et drogues; autorisé avec conditions |
2022-02-17 |
|||
Vaccins |
Vaxzevria AstraZeneca Canada Inc. |
ChAdOx1-S [recombinant] |
Texte habilitant Règlement sur les aliments et drogues; autorisé avec conditions |
2021-11-19 |
| Arrêté d’urgence* |
2021-02-26 | |||
Vaccins |
Comirnaty BioNTech Manufacturing GmbH |
Tozinaméran [vaccin à ARNm, BNT162b2] (suspension pour injection) |
Texte habilitant Règlement sur les aliments et drogues; autorisé avec conditions |
2022-12-09 |
| Dose de rappel du vaccin bivalent (12 ans et plus) Règlement sur les aliments et drogues; autorisé avec conditions |
2022-10-07 |
|||
Indication pédiatrique (6 mois à 5 ans) Règlement sur les aliments et drogues; autorisé avec conditions; |
2022-09-09 |
|||
Première dose de rappel (5 à 11 ans) Règlement sur les aliments et drogues; autorisé avec conditions |
2022-08-19 |
|||
Première dose de rappel (16 et 17 ans) Règlement sur les aliments et drogues; autorisé avec conditions |
2022-06-01 |
|||
Indication pédiatrique (5 à 11 ans) Règlement sur les aliments et drogues |
2021 -11-19 |
|||
Première dose de rappel Règlement sur les aliments et drogues |
2021-11-09 |
|||
Règlement sur les aliments et drogues; autorisé avec conditions |
2021-09-16 |
|||
Indication pédiatrique (12 à 15 ans) Arrêté d’urgence* |
2021-05-05 |
|||
Arrêté d’urgence* |
2020-12-09 |
|||
Vaccins |
Spikevax Moderna TX, Inc. |
Élasoméran |
Texte habilitant Première dose de rappel (12 à 17 ans) Règlement sur les aliments et drogues; autorisé avec conditions |
2023-01-12 |
Dose de rappel du vaccin bivalent (18 ans et plus) Règlement sur les aliments et drogues; autorisé avec conditions |
2022-11-03 |
|||
Dose de rappel du vaccin bivalent (18 ans et plus) Règlement sur les aliments et drogues; autorisé avec conditions |
2022-09-01 |
|||
Indication pédiatrique (6 mois à 5 ans) Règlement sur les aliments et drogues; autorisé avec conditions |
2022-07-14 |
|||
Indication pédiatrique (6 à 11 ans) Règlement sur les aliments et drogues; autorisé avec conditions |
2022-03-17 |
|||
Première dose de rappel Règlement sur les aliments et drogues; autorisé avec conditions |
2021 -11-12 |
|||
Règlement sur les aliments et drogues; autorisé avec conditions |
2021-09-16 |
|||
Indication pédiatrique (12 à 17 ans) Arrêté d’urgence* |
2021-08-27 |
|||
Arrêté d’urgence* |
2020-12-23 |
|||
Vaccins |
Jcovden Janssen Inc. |
AD26.COV2.S [recombinant] |
Texte habilitant Première dose de rappel Règlement sur les aliments et drogues; autorisé avec conditions |
2022-05-11 |
Règlement sur les aliments et drogues; autorisé avec conditions |
2021-11-23 |
|||
Arrêté d’urgence* |
2021-03-05 |
|||
Vaccins |
Covishield Verity Pharmaceuticals Inc./Serum Institute of India (en partenariat avec AstraZeneca Canada Inc.) |
ChAdOx1-S (recombinant) |
Texte habilitant Arrêté d’urgence*; autorisé avec conditions |
2021-02-26 (expiré le 2021-09-16) |
* L’Arrêté d’urgence concernant l’importation, la vente et la publicité de drogues à utiliser relativement à la COVID-19, approuvé le 23 mai 2020, a permis d’offrir une autre voie pour faciliter la tenue d’essais cliniques portant sur des médicaments et des instruments médicaux potentiels pour lutter contre la COVID-19, tout en maintenant des exigences strictes en matière de sécurité des patients et de validité des données d’essais.
Sources des données : Autorisations de médicament et de vaccin contre la COVID-19 : Liste des drogues et vaccins autorisés et des drogues à indication supplémentaire (site consulté en mars 2023) :
https://www.canada.ca/fr/sante-canada/services/medicaments-produits-sante/covid19-industrie/medicaments-vaccins-traitements/autorisations/liste-medicaments.html
Tableau 9. Traitements et vaccins contre la COVID-19 en cours d’examen par Santé Canada, en date de mars 2023
| Domaine thérapeutique | Demandeur | Ingrédient médicinal | Date d’acceptation de la présentation |
|---|---|---|---|
Vaccins |
Pfizer Canada ULC/BioNTech SE |
Tozinaméran |
Février 2022 |
Vaccins – Dose de rappel |
AstraZeneca Canada Inc. |
ChAdOx1-S [recombinant] |
Décembre 2021 |
Vaccins – Dose de rappel |
Janssen Inc. |
Ad26.COV2.S |
Décembre 2021 |
Vaccins – Dose pédiatrique (6 à 11 ans) |
ModernaTX, Inc. |
Élasoméran |
Novembre 2021 |
Vaccins |
Medicago Inc. |
Particules pseudo-virales de coronavirus [CoVLP] |
Août 2021 |
Vaccins |
Novavax Inc. |
NVX-CoV2373 |
Août 2021 |
Vaccins |
Sanofi Pasteur Ltée. |
Protéine de spicule en forme préfusion transmembranaire de la souche delta du SRAS‑CoV-2 [recombinante] |
Juillet 2021 |
Vaccins |
Vaccigen Ltd |
Coronavirus inactivé à virion entier |
Juillet 2021 |
Antisérums et immunoglobulines |
AstraZeneca Canada Inc. |
Cilgavimab, tixagévimab |
Novembre 2021 |
Antisérums et immunoglobulines |
Celltrion HealthCare Co. Ltd |
Regdanvimab |
Mai 2021 |
Antisérums et immunoglobulines |
Eli Lilly Canada Inc. |
Bamlanivimab* |
Juin 2021 |
Antisérums et immunoglobulines |
Hoffmann-La Roche Ltée |
Casirivimab, imdévimab* |
Septembre 2021 |
Antisérums et immunoglobulines |
GlaxoSmithKline Inc. |
Sotrovimab* |
Octobre 2021 |
Antisérums et immunoglobulines |
Eli Lilly Canada Inc. |
Étésévimab |
Septembre 2021 |
Immunosuppresseurs |
Eli Lilly Canada Inc. |
Baricitinib |
Septembre 2021 |
Antiviraux à usage systémique |
Gilead Sciences Canada Inc. |
Remdésivir |
Avril 2021 |
Antiviraux à usage systémique |
Dr. Reddys Laboratories Ltd |
Favipiravir |
Septembre 2021 |
Antiviraux à usage systémique |
Merck Canada Inc. |
Molnupiravir |
Août 2021 |
| Examens annulés | |||
Antisérums et immunoglobulines |
CytoDyn Inc. |
Léronlimab |
Mars 2021 (expiré) |
Préparations contre la goutte |
Pendopharm, division de Pharmascience Inc. |
Colchicine |
Janvier 2021 7 juin 2021 : annulé par le promoteur |
Autres médicaments en relation avec le système nerveux |
Sanotize Research & Development Corp. |
Oxyde nitrique |
Juin 2021 1er septembre 2021 : annulé par le promoteur |
* Le demandeur a déposé une présentation de drogue nouvelle au titre du Règlement sur les aliments et drogues afin que son produit, approuvé en vertu de l’arrêté d’urgence, puisse être autorisé en vertu du Règlement. La vente du produit demeure autorisée au Canada pendant cette période de transition.
Sources des données : Autorisations de médicament et de vaccin contre la COVID-19 : Liste des demandes reçues, Santé Canada (site consulté en mars 2023) : https://www.canada.ca/fr/sante-canada/services/medicaments-produits-sante/covid19-industrie/medicaments-vaccins-traitements/demandes.html
Annexe A
Tableau A1. Produits biosimilaires en cours d’essais cliniques de phase III (d’après les données extraites en septembre 2022)
| Médicament | Produit de référence (fabricant) | Autres produits biosimilaires (O/N) | Fabricants mettant au point le produit biosimilaire | Indication |
|---|---|---|---|---|
Adalimumab
|
Humira (Abbvie Corp.)
|
O |
Enzene Biosciences Ltd |
Spondylarthrite ankylosante |
Wuhan Institute of Biological Products Co Ltd |
Psoriasis en plaques (psoriasis vulgaire) |
|||
Aflibercept
|
Eylea (Bayer Inc.)
|
N |
Amgen Inc. Alteogen Inc. Alvotech SA Celltrion Inc. Formycon AG Hexal AG Johnson & Johnson Sam Chun Dang Pharm Co Ltd Samsung Bioepis Co Ltd |
Dégénérescence maculaire humide (néovasculaire/exsudative) |
Bévacizumab |
Avastin (Hoffmann-La Roche Limitée) |
O |
Aurobindo Pharma Ltd Prestige BioPharma Ltd SinoCelltech Group Ltd
Centrion† |
Cancer du poumon non à petites cellules
S.O. |
Cétuximab |
Erbitux |
N |
Ampo Biotechnology Inc. Cinnagen Co Enzene Biosciences Ltd R-Pharm |
Carcinome épidermoïde de la tête et du cou; cancer de la lèvre; tumeurs malignes solides localement récidivantes ou locorégionales; cancer de la cavité buccale (bouche); tumeur du pharynx; cancer colorectal métastatique |
Darbépoétine alpha |
Aranesp (Amgen Canada Inc.) |
N |
Biocad
|
Anémie associée à la néphropathie chronique (anémie rénale) |
Dénosumab
|
Prolia / Xgeva (Amgen Canada Inc.) |
N |
Mabwell Shanghai Bioscience Co Ltd |
Diabète |
Celltrion Inc. Eden Biologics Inc. Fresenius Kabi SwissBioSim GmbH Gedeon Richter Plc Mabxience Holding SL Samsung Bioepis Co Ltd Sandoz International GmbH Teva Pharmaceutical Industries Ltd |
Ostéoporose postménopausique |
|||
Sandoz International GmbH |
Métastases osseuses; tumeur osseuse à cellules géantes |
|||
Éculizumab |
Soliris (Alexion Pharma GmbH) |
N |
Amgen Inc.† Samsung Bioepis Co Ltd |
Hémoglobinurie paroxystique nocturne |
Énoxaparine |
Lovenox (Sanofi-Aventis Canada Inc.) |
O |
Baxter Corporation† Fresenius Kabi Canada Ltd† |
S.O. |
Étanercept |
Enbrel (Immunex Corporation) |
O |
Mycenax Biotech Inc.
|
Polyarthrite rhumatoïde |
Follitropine alpha |
Gonal-F / Pergoveris (EMD Serono, une division d’EMD Inc., Canada) |
N |
Amega Biotech |
Infertilité féminine |
Golimumab |
Simponi (Janssen Inc.) |
N |
Bio-Thera Solutions Ltd
|
Arthrite psoriasique |
Liraglutide |
Victoza / Saxenda (Novo Nordisk Canada Inc.) |
N |
Shanghai Fosun Pharmaceutical (Group) Co Ltd |
Obésité |
Ocrélizumab
|
Ocrevus (Hoffmann-La Roche Limitée) |
N |
Cinnagen Co |
Sclérose en plaque récurrente-rémittente (SEP-RR) |
Omalizumab |
Xolair (Novartis Pharmaceuticals Canada Inc.)
|
N |
Synermore Biologics Co Ltd |
Asthme allergique |
Celltrion Inc. Synermore Biologics Co Ltd Teva Pharmaceutical Industries Ltd |
Urticaire chronique |
|||
Synermore Biologics Co Ltd |
Polypes nasaux (polypose nasale); rhinosinusite |
|||
Pegfilgrastim |
Neulasta (Amgen Canada Inc.) |
O |
Lupin Pharma Canada Limited† Nora Pharma Inc.† |
Neutropénie fébrile |
Pertuzumab |
Perjeta (Hoffmann-La Roche Limitée) |
N |
Zydus Lifesciences Ltd |
Cancer du sein positif pour le récepteur 2 du facteur de croissance épidermique humain (cancer du sein HER2+) |
Ranibizumab |
Lucentis (Novartis Pharmaceuticals Canada Inc.)
|
O* |
Aurobindo Pharma Ltd Enzene Biosciences Ltd Generium Jecho Biopharmaceuticals Co Ltd Lupin Ltd PharmaResearch BIO Co Ltd |
Dégénérescence maculaire humide (néovasculaire/exsudative) |
Romiplostim |
Nplate (Amgen Canada Inc.) |
N |
Generium
|
Purpura thrombopénique idiopathique (purpura thrombopénique immunologique) |
Ténectéplase |
TNKase (Hoffmann-La Roche Limitée) |
N |
Hetero Drugs Ltd
|
Infarctus du myocarde |
Trastuzumab |
Herceptin (Hoffmann-La Roche Limitée) |
O |
Aprogen Inc. Hetero Drugs Ltd Tanvex BioPharma Inc. Prestige BioPharma Ltd (HC)† |
Cancer du sein positif pour le récepteur 2 du facteur de croissance épidermique humain (cancer du sein HER2+) |
Ustékinumab |
Stelara (Janssen Inc.) |
N |
DM Bio Ltd Samsung Bioepis Co Ltd |
Arthrite psoriasique |
Amgen Inc. Alvotech SA Bio-Thera Solutions Ltd Celltrion Inc. DM Bio Ltd Formycon AG Samsung Bioepis Co Ltd |
Psoriasis en plaques (psoriasis vulgaire) |
|||
DM Bio Ltd |
Maladie de Crohn (entérite régionale); colite ulcéreuse |
|||
JiangSu Qyuns Therapeutics Co Ltd |
Maladie inflammatoire de l’intestin |
* Approuvé mais non commercialisé en date du 5 décembre 2022.
† Produit biosimilaire en cours d’examen par Santé Canada.
Tableau A2. Présentations de drogues nouvelles en cours d’examen par Santé Canada (février 2023)
| Ingrédient médicinal | Domaine thérapeutique | Fabricant | Date d’acceptation de la présentation en vue de l’examen |
|---|---|---|---|
Aflibercept |
Médicaments ophtalmologiques |
BGP Pharma ULC |
Mai 2022 |
Bévacizumab |
Agents antinéoplasiques |
Celltrion HealthCare Co. Ltd |
|
Éculizumab |
Immunosuppresseurs |
Amgen Canada Inc. |
Juillet 2022 |
Énoxaparine sodique |
Antithrombotiques |
Baxter Corporation |
Septembre 2022 |
Pegfilgrastim |
Immunostimulants |
Lupin Pharma Canada Limited |
Mai 2022 |
Pegfilgrastim |
Immunostimulants |
Nora Pharma Inc. |
|
Ranibizumab |
Médicaments ophtalmologiques |
Teva Canada Ltée |
Décembre 2022 |
Trastuzumab |
Agents antinéoplasiques |
Prestige BioPharma Ltd |
Août 2021 |
Tableau A3. Médicaments en cours d’essais de phase II pour des indications ciblées par des médicaments candidats émergents
| Médicament candidat émergent | Indication | Médicaments en cours d’essais de phase II et mécanisme d’action (MA)* |
|---|---|---|
Acétate de rusfertide |
Polycythémie vraie |
À l’heure actuelle, il n’y a pas d’autre médicament en cours d’essais de phase II pour cette indication. |
Abélacimab |
Thrombose veineuse profonde (TVP); embolie pulmonaire |
À l’heure actuelle, il n’y a pas d’autre médicament en cours d’essais de phase II pour cette indication qui a le même MA que l’abélacimab (un inhibiteur mixte du facteur XI et du facteur XIa). |
Aprocitentan et Firibastat |
Hypertension réfractaire |
À l’heure actuelle, il n’y a pas d’autre médicament en cours d’essais de phase II pour cette indication qui a le même MA que l’aprocitentan (un antagoniste mixte des récepteurs de l’endothéline) ou le firibistat (un inhibiteur de l’aminopeptidase A à action centrale). |
Bémarituzumab et Zolbétuximab |
Adénocarcinome de la jonction œsophago-gastrique; cancer de l’estomac; cancer de la vessie; carcinome de la jonction œsophago-gastrique |
À l’heure actuelle, il y a un autre médicament (MAX-4) qui a un MA semblable à celui du bémarituzumab (un inhibiteur du récepteur du facteur de croissance des fibroblastes) et d’autres médicaments (BNT-141, LM-302) qui ont un MA semblable à celui du zolbétuximab (un inhibiteur de la claudine-18) en cours d’essais cliniques de phase II. |
Chlorhydrate d’iberdomide |
Consulter les renseignements à la section « ciltacabtagène ». |
|
Ciltacabtagène autoleucel* et Chlorhydrate d’iberdomide |
Myélome multiple réfractaire; myélome multiple récidivant |
À l’heure actuelle, il y a d’autres médicaments (CFT-7455, mézigdomide) qui ont un MA semblable à celui de l’iberdomide (un activateur du céréblon) et d’autres produits de thérapie génique comme le ciltacabtagène en cours d’essais de phase II pour cette indication. |
Concizumab* |
Hémophilie B |
À l’heure actuelle, il n’y a pas d’autre médicament en cours d’essais de phase II pour cette indication qui a le même MA que le concizumab (un inhibiteur de la voie du facteur tissulaire). |
Dichlorhydrate de navitoclax |
Consulter les renseignements à la section « imételstat ». |
|
Évobrutinib |
Sclérose en plaques récurrente-rémittente (SEP-RR); sclérose en plaques progressive secondaire (SPPS) |
À l’heure actuelle, il n’y a pas d’autre médicament en cours d’essais de phase II pour cette indication qui a le même MA que l’évobrutinib (un immunomodulateur sélectif pénétrant dans le SNC qui bloque de façon irréversible la BTK). |
FCR001 |
Rejet de greffe rénale |
À l’heure actuelle, il y a d’autres produits de thérapie cellulaire comme le produit FCR001 en cours d’essais de phase II pour cette indication. |
Firibastat |
Consulter les renseignements à la section « aprocitentan ». |
|
Garadacimab |
Angio-œdème héréditaire (AOH) (déficit en inhibiteur de la C1 estérase [C1‑INH]) |
À l’heure actuelle, il n’y a pas d’autre médicament en cours d’essais de phase II pour cette indication qui a le même MA que le garadacimab (un anticorps monoclonal d’immunoglobuline G4 qui interfère avec la coagulation par le facteur XIIa). |
Glofitamab |
Lymphomes à cellules B |
À l’heure actuelle, il n’y a pas d’autre médicament en cours d’essais de phase II pour cette indication qui a le même MA que le glofitamab (un anticorps bispécifique anti-CD20-CD3 activant les lymphocytes T). |
Imételstat et Navitoclax
|
Syndrome myélodysplasique; myélofibrose secondaire à une thrombocytémie essentielle (MF post‑TE); myélofibrose secondaire à une polycythémie vraie (MF post-PV) |
À l’heure actuelle, il n’y a pas d’autre médicament en cours d’essais de phase II pour cette indication qui a le même MA que l’imételstat (un inhibiteur de la télomérase) ou le navitoclax (un antagoniste d’une sous-famille de la famille des protéines Bcl-2). |
Masitinib* et Reldésemtiv |
Sclérose latérale amyotrophique (SLA) |
À l’heure actuelle, il n’y a pas d’autre médicament en cours d’essais de phase II pour cette indication qui a le même MA que le masitinib (un inhibiteur sélectif de la tyrosine kinase) ou le reldésemtiv (un activateur de la troponine des muscles squelettiques rapides). |
Obicétrapib
|
Dyslipidémie; hypercholestérolémie familiale hétérozygote (HFHe); athérosclérose |
À l’heure actuelle, il n’y a pas d’autre médicament en cours d’essais de phase II pour cette indication qui a le même MA que l’obicétrapib (un inhibiteur de la CETP). |
Pegcétacoplan* |
Hémoglobinurie paroxystique nocturne |
À l’heure actuelle, il n’y a pas d’autre médicament en cours d’essais de phase II pour cette indication qui a le même MA que le pegcétacoplan (un inhibiteur du fragment C3b et de la protéine C3 du complément). |
REC-2282 |
Neurofibromatose de type II |
Médicaments en cours d’essais de phase II pour cette indication et MA :
À l’heure actuelle, il n’y a pas d’autre médicament en cours d’essais de phase II pour cette indication qui a le même MA que le produit REC-2282 (un pan-inhibiteur des histones désacétylases). |
Rélacorilant |
Cancer épithélial de l’ovaire |
À l’heure actuelle, il n’y a pas d’autre médicament en cours d’essais de phase II pour cette indication qui a le même MA que le rélacorilant (un antagoniste du récepteur des glucocorticoïdes). |
Reldésemtiv |
Consulter les renseignements à la section « masitinib ». |
|
Resmétirom |
Stéatohépatite non alcoolique (NASH); stéatose hépatique non alcoolique (NAFLD) |
À l’heure actuelle, il y a d’autres médicaments (ASC-41, TERN-501, VK-2809) qui ont un MA semblable à celui du resmétirom (un agoniste du récepteur bêta des hormones thyroïdiennes) en cours d’essais de phase II pour cette indication. |
Séladelpar |
Cholangite biliaire primitive (cirrhose biliaire primitive) |
À l’heure actuelle, il n’y a pas d’autre médicament en cours d’essais de phase II pour cette indication qui a le même MA que le séladelpar (un agoniste du PPARd). |
Setmélanotide |
Obésité |
À l’heure actuelle, il n’y a pas d’autre médicament en cours d’essais de phase II pour cette indication qui a le même MA que la setmélanotide (un inhibiteur du récepteur de la mélanocortine-4). |
Sotatercept |
Hypertension artérielle pulmonaire (HAP) |
À l’heure actuelle, il n’y a pas d’autre médicament en cours d’essais de phase II pour cette indication qui a le même MA que le sotatercept (une protéine de fusion ActRIIA-Fc). |
Soticlestat |
Syndrome de Lennox-Gastaut; syndrome de Dravet (épilepsie myoclonique sévère du nourrisson) |
À l’heure actuelle, il n’y a pas d’autre médicament en cours d’essais de phase II pour cette indication qui a le même MA que le soticlestat (un inhibiteur de l’enzyme cholestérol 24-hydroxylase). |
Spésolimab* |
Psoriasis pustuleux généralisé (PPG) |
À l’heure actuelle, il n’y a pas d’autre médicament en cours d’essais de phase II pour cette indication. |
Trémélimumab |
Carcinome hépatocellulaire |
À l’heure actuelle, il y a d’autres médicaments (ADG-126, BMS-986249, ONC-392, PSB-205, zalifrélimab) qui ont un MA semblable à celui du trémélimumab (un inhibiteur de la protéine 4 associée aux lymphocytes T cytotoxiques) en cours d’essais de phase II pour cette indication. |
Ulotaront |
Schizophrénie |
À l’heure actuelle, il y a un autre médicament (ralmitaront) qui a un MA semblable à celui de l’ulotaront (un agoniste du TAAR1) en cours d’essais de phase II pour cette indication. |
Zolbétuximab |
Consulter les renseignements à la section « bémarituzumab ». |
|
Zoliflodacine |
Gonorrhée urétrale et cervicale non compliquée |
À l’heure actuelle, il n’y a pas d’autre médicament en cours d’essais de phase II pour cette indication. |
* En cours d’examen par Santé Canada.
Abréviations : ACE : enzyme de conversion de l’angiotensine; ADN : acide désoxyribonucléique; ASA : acide acétylsalicylique; Bcl-2 : B-cell lymphoma 2; BIR : baculovirus IAP repeat; BTK : tyrosine kinase de Bruton; C/EBP : CCAAT/enhancer binding protein; CETP : protéine de transfert des esters de cholestérol; CREB : protéine de liaison à l’élément de réponse à l’AMPc; DKK1 : Dickkopf related protein 1; DLL4 : delta-like protein 4; GABA : gamma-aminobutyric acid; FAK : focal adhesion kinase; IgG : immunoglobuline de type G; JAK : Janus kinase; KIT : mast/stem cell growth factor receptor; LAG3 : lymphocyte activation gene 3 protein; LOXL2 : lysyl oxidase homolog 2; MA : mécanisme d’action; MAPK : mitogen-activated protein kinase; MCP : membrane cofactor protein; PPAR : récepteur activé par les proliférateurs des peroxysomes; SNC : système nerveux central; STING : stimulator of interferon genes; TAAR1 : récepteur 1 associé aux amines traces.
Sources des données : Base de données GlobalData Healthcare (consultée en septembre 2022).Références
- Clinical Development Success Rates 2006-2015. https://www.bio.org/sites/default/files/legacy/bioorg/docs/Clinical%20Development%20Success%20Rates%202006-2015%20-%20BIO,%20Biomedtracker,%20Amplion%202016.pdf (consulté le 13 janvier 2023).
- Présentations de médicaments et de produits de santé en cours d’examen (PCE). https://www.canada.ca/fr/sante-canada/services/examen-et-approbation-medicaments-et-produit-sante/presentations-cours-examen/presentations-drogues-cours-examen.html
- Anthos Therapeutics Announces that Abelacimab Has Received FDA Fast Track Designation for the Prevention of Stroke and Systemic Embolism in Patients with Atrial Fibrillation. 8 septembre 2022. https://www.globenewswire.com/news-release/2022/09/08/2512472/0/en/Anthos-Therapeutics-Announces-that-Abelacimab-Has-Received-FDA-Fast-Track-Designation-for-the-Prevention-of-Stroke-and-Systemic-Embolism-in-Patients-with-Atrial-Fibrillation.html
- Verhamme P, Yi BA, Segers A, Salter J, Bloomfield D, et al. Abelacimab for Prevention of Venous Thromboembolism. N Engl J Med. 2021 Aug 12;385(7):609-617. doi: 10.1056/NEJMoa2105872. Epub 2021 Jul 19.
- Li T, Liu J, Wu W. Factor XI, a potential target for anticoagulation therapy for venous thromboembolism. Front Cardiovasc Med. 2022 Oct 31;9:975767. doi: 10.3389/fcvm.2022.975767. eCollection 2022.
- Gómez-Outes A, Suárez-Gea ML, Pérez-Cabeza AI, García-Pinilla JM. Pharmacotherapy for stroke prevention in nonvalvular atrial fibrillation: current strategies and future directions. Expert Opin Pharmacother. 2022 Nov 17. doi: 10.1080/14656566.2022.2149323. Publié en ligne avant impression.
- A Multicenter, Randomized, Open-label, Blinded Endpoint Evaluation, Phase 3 Study Comparing the Effect of Abelacimab Relative to Apixaban on Venous Thromboembolism (VTE) Recurrence and Bleeding in Patients With Cancer Associated VTE. NCT05171049 (recruiting). https://clinicaltrials.gov/ct2/show/NCT05171049?term=Abelacimab&draw=2&rank=2
- A Multicenter, Randomized, Open-label, Blinded Endpoint Evaluation, Phase 3 Study Comparing the Effect of Abelacimab vs. Dalteparin on Venous Thromboembolism (VTE) Recurrence and Bleeding in Patients With GI/GU Associated VTE. NCT05171075 (recruiting). https://clinicaltrials.gov/ct2/show/NCT05171075?term=Abelacimab&draw=2&rank=3
- Base de données GlobalData Healthcare (consultée en septembre 2022; liste des médicaments en essais de phase II).
- McCoy EK, Lisenby KM. Aprocitentan (a Dual Endothelin-Receptor Antagonist) for Treatment-Resistant Hypertension. J Cardiovasc Pharmacol. 2021 Jun 1;77(6):699-706. doi: 10.1097/FJC.0000000000001023.
- Schlaich MP, Bellet M, Weber MA, Danaietash P, Bakris GL, et al; PRECISION investigators. Dual endothelin antagonist aprocitentan for resistant hypertension (PRECISION): a multicentre, blinded, randomised, parallel-group, phase 3 trial. Lancet. 2022 Nov 4:S0140-6736(22)02034-7. doi: 10.1016/S0140-6736(22)02034-7. Publié en ligne avant impression.
- Late-Breaking Data from Pivotal Phase 3 PRECISION Study Demonstrates Significant and Sustained Effect of Aprocitentan on Lowering Blood Pressure for Patients with Difficult-to-Control Hypertension. 7 novembre 2022. https://www.jnj.com/late-breaking-data-from-pivotal-phase-3-precision-study-demonstrates-significant-and-sustained-effect-of-aprocitentan-on-lowering-blood-pressure-for-patients-with-difficult-to-control-hypertension#:~:text=Specifically%2C%20after%204%20weeks%2C%20aprocitentan,6.8%2C%20%2D0.8%3B%20p%20%3D
- Höcht C, Allo MA, Polizio AH, Morettón MA, et al. New and developing pharmacotherapies for hypertension. Expert Rev Cardiovasc Ther. 2022 Aug;20(8):647-666. doi: 10.1080/14779072.2022.2105204. Epub 2022 Aug 3.
- Idorsia submits a New Drug Application to the US FDA for aprocitentan for the treatment of patients with difficult-to-control hypertension. 20 décembre 2022. https://www.biospace.com/article/releases/idorsia-submits-a-new-drug-application-to-the-us-fda-for-aprocitentan-for-the-treatment-of-patients-with-difficult-to-control-hypertension/
- Multi-center, Blinded, Randomized Study With Aprocitentan in Subjects With Uncontrolled Blood Pressure and Chronic Kidney Disease Stage 3 or 4. NCT04162366 (Withdrawn [A business decision was made to not initiate this study]). https://clinicaltrials.gov/ct2/show/NCT04162366?term=Aprocitentan&phase=2&draw=2&rank=1
- Multi-center, Blinded, Randomized, Parallel-group, Phase 3 Study With Aprocitentan in Subjects With Resistant Hypertension (RHT). NCT03541174 (completed). https://clinicaltrials.gov/ct2/show/NCT03541174?term=Aprocitentan&phase=2&draw=2&rank=2
- Base de données GlobalData Healthcare (consultée en septembre 2022; liste des médicaments en essais de phase II).
- Weintraub S, Frishman WH. A Novel Calcium Channel Blocker: Etripamil: What is the Future of Intranasal Drug Delivery in the Treatment of Cardiac Arrhythmias? Cardiol Rev. 2021 Sep-Oct 01;29(5):253-258. doi: 10.1097/CRD.0000000000000362.
- An Open Label Extension Study of Etripamil Nasal Spray in Patients With Paroxysmal Supraventricular Tachycardia. NCT04952610 (Enrolling by invitation). https://clinicaltrials.gov/ct2/show/NCT04952610?term=Etripamil&phase=2&draw=2&rank=2
- RAPID: Positive Top-line Results for Etripamil Nasal Spray in Paroxysmal SVT. 17 octobre 2022. https://www.tctmd.com/news/rapid-positive-top-line-results-etripamil-nasal-spray-paroxysmal-svt
- Kashou AH, Noseworthy PA. Etripamil nasal spray: an investigational agent for the rapid termination of paroxysmal supraventricular tachycardia (SVT). Expert Opin Investig Drugs. 2020 Jan;29(1):1-4. doi: 10.1080/13543784.2020.1703180. Epub 2019 Dec 12.
- Multi-Centre, Open-Label, Safety Study of Etripamil Nasal Spray in Spontaneous Episodes of Paroxysmal Supraventricular Tachycardia The NODE-302 Trial (Extension of NODE-301). NCT03635996 (completed). https://clinicaltrials.gov/ct2/show/NCT03635996?term=Etripamil&phase=2&draw=2&rank=4
- The NODE-303 Study: Multi-Centre, Multi-National,Open Label, Safety Study of Etripamil Nasal Spray for Patients With Paroxysmal Supraventricular Tachycardia. NCT04072835 (active, not recruiting). https://clinicaltrials.gov/ct2/show/NCT04072835?term=Etripamil&phase=2&draw=2&rank=1
- Multi-Center, Randomized, Double-Blind, Placebo-Controlled, Efficacy and Safety Study of Etripamil Nasal Spray Self-Administration for the Termination of Spontaneous Episodes of Paroxysmal Supraventricular Tachycardia in Chinese Patients. NCT05410860 (recruiting). https://clinicaltrials.gov/ct2/show/NCT05410860?term=Etripamil&phase=2&draw=2&rank=3
- Multi-Centre, Randomized, Double-Blind, Placebo-Controlled, Efficacy, and Safety Study of Etripamil Nasal Spray for the Termination of Spontaneous Episodes of Paroxysmal Supraventricular Tachycardia. NODE 301 Trial. NCT03464019 (active, not recruiting). https://clinicaltrials.gov/ct2/show/NCT03464019?term=Etripamil&phase=2&draw=2&rank=5
- An Open Label Extension Study of Etripamil Nasal Spray in Patients With Paroxysmal Supraventricular Tachycardia. NCT04952610 (Enrolling by invitation). https://clinicaltrials.gov/ct2/show/NCT04952610?term=Etripamil&phase=2&draw=2&rank=2
- Base de données GlobalData Healthcare (consultée en septembre 2022; liste des médicaments en essais de phase II).
- Nurmohamed NS, Ditmarsch M, Kastelein JJP. Cholesteryl ester transfer protein inhibitors: from high-density lipoprotein cholesterol to low-density lipoprotein cholesterol lowering agents? Cardiovasc Res. 2022 Nov 10;118(14):2919-2931. doi: 10.1093/cvr/cvab350.
- Obicetrapib decreases LDL, increases HDL in phase 2 trial. 2 septembre 2022. https://www.healio.com/news/cardiology/20220909/obicetrapib-decreases-ldl-increases-hdl-in-phase-2-trial
- Obicetrapib decreases LDL, increases HDL in phase 2 trial. 2 septembre 2022. https://www.healio.com/news/cardiology/20220909/obicetrapib-decreases-ldl-increases-hdl-in-phase-2-trial
- A Placebo-Controlled, Double-Blind, Randomized, Phase 3 Study to Evaluate the Effect of 10 mg Obicetrapib in Participants With a History of HeFH Who Are Not Adequately Controlled by Their Lipid Modifying Therapies. NCT05425745 (recruiting). https://clinicaltrials.gov/ct2/show/NCT05425745?term=Obicetrapib&phase=2&draw=2&rank=1
- A Placebo-Controlled, Double-Blind, Randomized Phase 3 Study to Evaluate the Effect of 10mg Obicetrapib in Participants With HeFH and/or ASCVD Who Are Not Adequately Controlled by Their Lipid Modifying Therapies. NCT05142722 (recruiting). https://clinicaltrials.gov/ct2/show/NCT05142722?term=Obicetrapib&phase=2&draw=2&rank=2
- Placebo Controlled, Double Blind, Randomized Cardiovascular Outcome Study to Evaluate the Effect of 10 mg Obicetrapib in Participants With ASCVD Not Adequately Controlled Despite Maximally Tolerated Lipid Modifying Therapies. NCT05202509 (recruiting). https://clinicaltrials.gov/ct2/show/NCT05202509?term=Obicetrapib&phase=2&draw=2&rank=3
- Base de données GlobalData Healthcare (consultée en septembre 2022; liste des médicaments en essais de phase II).
- Rayroux C, Lador F, Soccal PM, Plojoux J, Adler D. Nouveautés en médecine 2021 : Pneumologie. Rev Med Suisse. 2022 Jan 19;18(764-5):64-68. doi: 10.53738/REVMED.2022.18.764-65.64.
- Merck Announces Positive Top-line Results from Pivotal Phase 3 STELLAR Trial Evaluating Sotatercept for the Treatment of Adults with Pulmonary Arterial Hypertension (PAH). 10 octobre 2022. https://www.merck.com/news/merck-announces-positive-top-line-results-from-pivotal-phase-3-stellar-trial-evaluating-sotatercept-for-the-treatment-of-adults-with-pulmonary-arterial-hypertension-pah/
- Hoeper MM, Badesch DB, Ghofrani HA, Gibbs JSR, Gomberg-Maitland M,et al. Phase 3 Trial of Sotatercept for Treatment of Pulmonary Arterial Hypertension. N Engl J Med. 2023 Mar 6. doi: 10.1056/NEJMoa2213558. Publié en ligne avant impression.
- Sotatercept- the breakthrough PAH has been waiting for? 10 novembre 2022. https://www.clinicaltrialsarena.com/comment/sotatercept-breakthrough-pah/
- An Open-label Long-term Follow-up Study to Evaluate the Effects of Sotatercept When Added to Background Pulmonary Arterial Hypertension (PAH) Therapy for the Treatment of PAH. NCT04796337 (recruiting). https://clinicaltrials.gov/ct2/show/NCT04796337?term=Sotatercept&phase=2&draw=2&rank=1
- A Phase 3, Randomized, Double-Blind, Placebo-Controlled Study to Evaluate Sotatercept When Added to Maximum Tolerated Background Therapy in Participants With Pulmonary Arterial Hypertension (PAH) World Health Organization (WHO) Functional Class (FC) III or FC IV at High Risk Mortality. NCT04896008 (recruiting). https://clinicaltrials.gov/ct2/show/NCT04896008?term=Sotatercept&phase=2&draw=2&rank=2
- A Phase 3, Randomized, Double-blind, Placebo-controlled Study to Evaluate Sotatercept When Added to Background Pulmonary Arterial Hypertension (PAH) Therapy in Newly Diagnosed Intermediate- and High-risk PAH Patients. NCT04811092 (recruiting). https://clinicaltrials.gov/ct2/show/NCT04811092?term=Sotatercept&phase=2&draw=2&rank=3
- A Phase 3, Randomized, Double-Blind, Placebo-Controlled Study to Compare the Efficacy and Safety of Sotatercept Versus Placebo When Added to Background Pulmonary Arterial Hypertension (PAH) Therapy for the Treatment of PAH. NCT04576988 (active, not recruiting). https://clinicaltrials.gov/ct2/show/NCT04576988?term=Sotatercept&phase=2&draw=2&rank=4
- Base de données GlobalData Healthcare (consultée en septembre 2022; liste des médicaments en essais de phase II).
- von Hundelshausen P, Siess W. Bleeding by Bruton Tyrosine Kinase-Inhibitors: Dependency on Drug Type and Disease. Cancers (Basel). 2021 Mar 4;13(5):1103. doi: 10.3390/cancers13051103.
- Schneider R, Oh J. Bruton's Tyrosine Kinase Inhibition in Multiple Sclerosis. Curr Neurol Neurosci Rep. 2022 Nov;22(11):721-734. doi: 10.1007/s11910-022-01229-z. Epub 2022 Oct 27.
- Merck KGaA, Darmstadt, Germany Highlights New Data for Evobrutinib, First BTKi to Demonstrate Sustained Clinical Benefit for People with RMS through Three and a Half Years of Treatment. 26 octobre 2022. https://www.emdgroup.com/en/news/evobrutinib-26-10-2022.html
- A Phase III, Multicenter, Randomized, Parallel Group, Double Blind, Double Dummy, Active Controlled Study of Evobrutinib Compared With an Interferon Beta 1a (Avonex®), in Participants With RMS to Evaluate Efficacy and Safety. NCT04032171 (terminated early and comparator changed). https://clinicaltrials.gov/ct2/show/NCT04032171?term=Evobrutinib&phase=2&draw=2&rank=1
- A Phase III, Multicenter, Randomized, Parallel Group, Double Blind, Double Dummy, Active Controlled Study of Evobrutinib Compared With an Interferon Beta 1a (Avonex®), in Participants With Relapsing Multiple Sclerosis to Evaluate Efficacy and Safety. NCT04032158 (terminated early and comparator changed). https://clinicaltrials.gov/ct2/show/NCT04032158?term=Evobrutinib&phase=2&draw=2&rank=2
- A Phase III, Multicenter, Randomized, Parallel Group, Double Blind, Double Dummy, Active Controlled Study of Evobrutinib Compared With Teriflunomide, in Participants With Relapsing Multiple Sclerosis to Evaluate Efficacy and Safety (evolutionRMS 2). NCT04338061 (active, not recruiting). https://clinicaltrials.gov/ct2/show/NCT04338061?term=Evobrutinib&phase=2&draw=2&rank=3
- A Phase III, Multicenter, Randomized, Parallel Group, Double Blind, Double Dummy, Active Controlled Study of Evobrutinib Compared With Teriflunomide, in Participants With Relapsing Multiple Sclerosis to Evaluate Efficacy and Safety (evolutionRMS 1). NCT04338022 (active, not recruiting). https://clinicaltrials.gov/ct2/show/NCT04338022?term=Evobrutinib&phase=2&draw=2&rank=4
- Base de données GlobalData Healthcare (consultée en septembre 2022; liste des médicaments en essais de phase II).
- Phase 3 Trial of Reldesemtiv in ALS Announced. 11 août 2021. https://www.neurologylive.com/view/phase-3-trial-reldesemtiv-als-announced
- Reldesemtiv Earns FDA’s Orphan Drug Designation for ALS Treatment. 19 décembre 2019. https://alsnewstoday.com/news/reldesemtiv-earns-fdas-orphan-drug-designation-for-als-treatment/
- Cytokinetics Updates Phase 3 COURAGE-ALS Trial of Reldesemtiv. 14 décembre 2021. https://alsnewstoday.com/news/moderate-to-fast-progressing-als-courage-als-trial-patients-reldesemtiv-cytokinetics/
- Shefner JM, Andrews JA, Genge A, Jackson C, Lechtzin N, et al. A Phase 2, Double-Blind, Randomized, Dose-Ranging Trial Of Reldesemtiv In Patients With ALS. Amyotroph Lateral Scler Frontotemporal Degener. 2021 May;22(3-4):287-299. doi: 10.1080/21678421.2020.1822410. Epub 2020 Sep 24.
- Cytokinetics Updates Phase 3 COURAGE-ALS Trial of Reldesemtiv. 14 décembre 2021. https://alsnewstoday.com/news/moderate-to-fast-progressing-als-courage-als-trial-patients-reldesemtiv-cytokinetics/
- Shefner JM, Andrews JA, Genge A, Jackson C, Lechtzin N, et al. A Phase 2, Double-Blind, Randomized, Dose-Ranging Trial Of Reldesemtiv In Patients With ALS. Amyotroph Lateral Scler Frontotemporal Degener. 2021 May;22(3-4):287-299. doi: 10.1080/21678421.2020.1822410. Epub 2020 Sep 24.
- Rudnicki SA, Andrews JA, Genge A, Jackson C, Lechtzin N, et al; FORTITUDE-ALS STUDY GROUP. Prescription and acceptance of durable medical equipment in FORTITUDE-ALS, a study of reldesemtiv in ALS: post hoc analyses of a randomized, double-blind, placebo-controlled clinical trial. Amyotroph Lateral Scler Frontotemporal Degener. 2022 May;23(3-4):263-270. doi: 10.1080/21678421.2021.1946083. Epub 2021 Jul 5.
- A Phase 3, Multi-Center, Double-Blind, Randomized, Placebo-Controlled Trial to Evaluate the Efficacy and Safety of Reldesemtiv in Patients With Amyotrophic Lateral Sclerosis (ALS). NCT04944784 (recruiting). https://clinicaltrials.gov/ct2/show/NCT04944784?term=Reldesemtiv&phase=2&draw=2&rank=1
- A Phase 3, Open-Label Extension of COURAGE-ALS (CY 5031). NCT05442775 (recruiting). https://clinicaltrials.gov/ct2/show/NCT05442775?term=Reldesemtiv&phase=2&draw=2&rank=2
- Base de données GlobalData Healthcare (consultée en septembre 2022; liste des médicaments en essais de phase II).
- Soticlestat, A New Potential Treatment for Epilepsy It Inhibits Cholesterol Catabolism. 7 juillet 2022. https://journals.lww.com/neurotodayonline/Fulltext/2022/07070/Soticlestat,_A_New_Potential_Treatment_for.9.aspx
- Nishi T, Metcalf CS, Fujimoto S, Hasegawa S, Miyamoto M, et al. Anticonvulsive properties of soticlestat, a novel cholesterol 24-hydroxylase inhibitor. Epilepsia. 2022 Jun;63(6):1580-1590. doi: 10.1111/epi.17232. Epub 2022 Mar 30.
- Hahn CD, Jiang Y, Villanueva V, Zolnowska M, Arkilo D, et al. A phase 2, randomized, double-blind, placebo-controlled study to evaluate the efficacy and safety of soticlestat as adjunctive therapy in pediatric patients with Dravet syndrome or Lennox-Gastaut syndrome (ELEKTRA). Epilepsia. 2022 Oct;63(10):2671-2683. doi: 10.1111/epi.17367. Epub 2022 Aug 4.
- A Phase 3, Prospective, Open-Label, Multisite, Extension of Phase 3 Studies To Assess the Long-Term Safety and Tolerability of Soticlestat as Adjunctive Therapy in Subjects With Dravet Syndrome or Lennox-Gastaut Syndrome (ENDYMION 2). NCT05163314 (recruiting). https://clinicaltrials.gov/ct2/show/NCT05163314?term=Soticlestat&phase=2&draw=2&rank=1
- A Multicenter, Randomized, Double-Blind, Placebo-Controlled, Parallel Group Study to Evaluate the Efficacy, Safety, and Tolerability of Soticlestat as Adjunctive Therapy in Pediatric and Young Adult Subjects With Dravet Syndrome (DS). NCT04940624 (recruiting). https://clinicaltrials.gov/ct2/show/NCT04940624?term=Soticlestat&phase=2&draw=2&rank=2
- A Multicenter, Randomized, Double-Blind, Placebo-Controlled, Parallel Group Study to Evaluate the Efficacy, Safety, and Tolerability of Soticlestat as Adjunctive Therapy in Pediatric and Adult Subjects With Lennox-Gastaut Syndrome (LGS). NCT04938427 (recruiting). https://clinicaltrials.gov/ct2/show/NCT04938427?term=Soticlestat&phase=2&draw=2&rank=3
- Base de données GlobalData Healthcare (consultée en septembre 2022; liste des médicaments en essais de phase II).
- Koblan KS, Kent J, Hopkins SC, Krystal JH, Cheng H, et al. A Non-D2-Receptor-Binding Drug for the Treatment of Schizophrenia. N Engl J Med. 2020 Apr 16;382(16):1497-1506. doi: 10.1056/NEJMoa1911772.
- Kane JM. A New Treatment Paradigm: Targeting Trace Amine-Associated Receptor 1 (TAAR1) in Schizophrenia. J Clin Psychopharmacol. 2022 Sep-Oct 01;42(5 Suppl 1):S1-S13. doi: 10.1097/JCP.0000000000001596.
- Synan C, Bowen C, Heal DJ, Froger-Colléaux C, Beardsley PM, et al. Ulotaront, a novel TAAR1 agonist with 5-HT1A agonist activity, lacks abuse liability and attenuates cocaine cue-induced relapse in rats. Drug Alcohol Depend. 2022 Feb 1;231:109261. doi: 10.1016/j.drugalcdep.2021.109261. Epub 2021 Dec 31.
- A 52-week, Open-label Study to Evaluate the Long-term Safety and Tolerability of SEP-363856 in Patients With Schizophrenia in Japan. NCT05359081 (recruiting). https://clinicaltrials.gov/ct2/show/NCT05359081?term=SEP-363856&phase=2&draw=2&rank=1
- An 8-Week, Open-Label Study Evaluating the Effectiveness, Safety and Tolerability of SEP-363856 in Subjects With Schizophrenia Switched From Typical or Atypical Antipsychotic Agents. NCT05628103 (not yet recruiting). https://clinicaltrials.gov/ct2/show/NCT05628103?term=SEP-363856&phase=2&draw=2&rank=2
- An Open-label Extension Study to Assess the Safety and Tolerability of SEP-363856 in Subjects With Schizophrenia. NCT04109950 (recruiting). https://clinicaltrials.gov/ct2/show/NCT04109950?term=SEP-363856&phase=2&draw=2&rank=3
- A Randomized, Double-blind, Parallel-group, Placebo-controlled, Fixed-dose, Multicenter Study to Evaluate the Efficacy and Safety of SEP-363856 in Acutely Psychotic Subjects With Schizophrenia. NCT04092686 (recruiting). https://clinicaltrials.gov/ct2/show/NCT04092686?term=SEP-363856&phase=2&draw=2&rank=4
- A Randomized, Double-blind, Parallel-group, Placebo-controlled, Fixed-dose, Multicenter Study to Evaluate the Efficacy and Safety of SEP-363856 in Acutely Psychotic Subjects With Schizophrenia. NCT04072354 (recruiting). https://clinicaltrials.gov/ct2/show/NCT04072354?term=SEP-363856&phase=2&draw=2&rank=5
- A Randomized, Double-blind, Active Comparator-Controlled Study to Evaluate the Long-term Safety and Tolerability of SEP-363856 in Subjects With Schizophrenia. NCT04115319 (active, not recruiting). https://clinicaltrials.gov/ct2/show/NCT04115319?term=SEP-363856&phase=2&draw=2&rank=6
- A Randomized, Double-blind, Parallel-group, Placebo Controlled, Fixed-dose, Multicenter Study to Evaluate the Efficacy and Safety of SEP 363856 in Acutely Psychotic Patients With Schizophrenia, Followed by an Open-label Extension Phase. NCT04825860 (recruiting). https://clinicaltrials.gov/ct2/show/NCT04825860?term=SEP-363856&phase=2&draw=2&rank=8
- Base de données GlobalData Healthcare (consultée en septembre 2022; liste des médicaments en essais de phase II).
- Vyjuvek (Beremagene Geperpavec). Dernière mise à jour : 1er avril 2022. https://epidermolysisbullosanews.com/kb103/
- A Phase III Double Blinded, Placebo-Controlled, Efficacy and Safety Study of Beremagene Geperpavec (B-VEC, Previously "KB103") for the Treatment of Dystrophic Epidermolysis Bullosa (DEB). NCT04491604 (completed). https://clinicaltrials.gov/ct2/show/NCT04491604?term=B-VEC&cond=Dystrophic+Epidermolysis+Bullosa&draw=2&rank=1
- Guide SV, Gonzalez ME, Bağcı IS, Agostini B, Chen H, et al. Trial of Beremagene Geperpavec (B-VEC) for Dystrophic Epidermolysis Bullosa. N Engl J Med. 2022 Dec 15;387(24):2211-2219. doi: 10.1056/NEJMoa2206663.
- Vyjuvek (Beremagene Geperpavec). Dernière mise à jour : 1er avril 2022. https://epidermolysisbullosanews.com/kb103/
- Efficacy of Beremagene Geperpavec in Patients With Dystrophic Epidermolysis Bullosa. 29 décembre 2022. https://www.practiceupdate.com/content/efficacy-of-beremagene-geperpavec-in-patients-with-dystrophic-epidermolysis-bullosa/146343
- Open Label Treatment of Beremagene Geperpavec (B-VEC). NCT04917874 (recruiting). https://clinicaltrials.gov/ct2/show/NCT04917874?term=NCT04917874&draw=2&rank=1
- Fraile JM, Palliyil S, Barelle C, Porter AJ, Kovaleva M. Non-Alcoholic Steatohepatitis (NASH) - A Review of a Crowded Clinical Landscape, Driven by a Complex Disease. Drug Des Devel Ther. 2021 Sep 22;15:3997-4009. doi: 10.2147/DDDT.S315724. eCollection 2021.
- Younossi ZM, Stepanova M, Taub RA, Barbone JM, Harrison SA. Hepatic Fat Reduction Due to Resmetirom in Patients With Nonalcoholic Steatohepatitis Is Associated With Improvement of Quality of Life. Clin Gastroenterol Hepatol. 2022 Jun;20(6):1354-1361.e7. doi: 10.1016/j.cgh.2021.07.039. Epub 2021 Jul 27.
- Positive Topline Phase 3 MAESTRO-NAFLD-1 Data Demonstrate Resmetirom was Safe, Well-Tolerated and Provided Statistically Significant Improvements in Key Measures of Liver and Cardiovascular Health. 31 janvier 2022. https://ir.madrigalpharma.com/news-releases/news-release-details/positive-topline-phase-3-maestro-nafld-1-data-demonstrate
- A 52-Week, Phase 3, Open-Label Extension Study, With a Single-blind Lead-in, to Evaluate Safety and Biomarkers of Resmetirom (MGL-3196) in Patients With Non-alcoholic Fatty Liver Disease (NAFLD), MAESTRO-NAFLD-Open-Label-Extension (MAESTRO-NAFLD-OLE). NCT04951219 (recruiting). https://clinicaltrials.gov/ct2/show/NCT04951219?term=Resmetirom&phase=2&draw=2&rank=1
- A 52-Week, Phase 3 Study to Evaluate Safety and Biomarkers of Resmetirom (MGL-3196) in Patients With Non-alcoholic Fatty Liver Disease (NAFLD) (MAESTRO-NAFLD-1). NCT04197479 (active, not recruiting). https://clinicaltrials.gov/ct2/show/NCT04197479?term=Resmetirom&phase=2&draw=2&rank=2
- A Randomized Double-blind Placebo-controlled Phase 3 Study to Evaluate the Effect of Resmetirom on Liver-related Outcomes in Patients With Well-compensated (Child-Pugh A) Non-alcoholic Steatohepatitis (NASH) Cirrhosis (MAESTRO-NASH OUTCOMES). NCT05500222 (recruiting). https://clinicaltrials.gov/ct2/show/NCT05500222?term=Resmetirom&phase=2&draw=2&rank=3
- A Phase 3, Multinational, Double-Blind, Randomized, Placebo-Controlled Study of MGL-3196 (Resmetirom) in Patients With NASH and Fibrosis to Resolve NASH and Reduce Progression to Cirrhosis and/or Hepatic Decompensation. NCT03900429 (recruiting). https://clinicaltrials.gov/ct2/show/NCT03900429?term=Resmetirom&phase=2&draw=2&rank=4
- Base de données GlobalData Healthcare (consultée en septembre 2022; liste des médicaments en essais de phase II).
- Kremer AE, Mayo MJ, Hirschfield G, Levy C, Bowlus CL, et al. Seladelpar improved measures of pruritus, sleep, and fatigue and decreased serum bile acids in patients with primary biliary cholangitis. Liver Int. 2022 Jan;42(1):112-123. doi: 10.1111/liv.15039. Epub 2021 Aug 26.
- Kremer AE, Mayo MJ, Hirschfield G, Levy C, Bowlus CL, et al. Seladelpar improved measures of pruritus, sleep, and fatigue and decreased serum bile acids in patients with primary biliary cholangitis. Liver Int. 2022 Jan;42(1):112-123. doi: 10.1111/liv.15039. Epub 2021 Aug 26.
- Bowlus CL, Galambos MR, Aspinall RJ, Hirschfield GM, Jones DEJ, et al. A phase II, randomized, open-label, 52-week study of seladelpar in patients with primary biliary cholangitis. J Hepatol. 2022 Aug;77(2):353-364. doi: 10.1016/j.jhep.2022.02.033. Epub 2022 Mar 30.
- Bowlus CL, Galambos MR, Aspinall RJ, Hirschfield GM, Jones DEJ, et al. A phase II, randomized, open-label, 52-week study of seladelpar in patients with primary biliary cholangitis. J Hepatol. 2022 Aug;77(2):353-364. doi: 10.1016/j.jhep.2022.02.033. Epub 2022 Mar 30.
- A 52-week, Placebo-controlled, Randomized, Phase 3 Study to Evaluate the Safety and Efficacy of Seladelpar in Subjects With Primary Biliary Cholangitis (PBC) and an Inadequate Response to or an Intolerance to Ursodeoxycholic Acid (UDCA). NCT03602560 (completed). https://clinicaltrials.gov/ct2/show/NCT03602560?term=Seladelpar&phase=2&draw=2&rank=2
- ASSURE: An Open Label Long-Term Study to Evaluate the Safety and Tolerability of Seladelpar in Subjects With Primary Biliary Cholangitis (PBC). NCT03301506 (recruiting). https://clinicaltrials.gov/ct2/show/NCT03301506?term=Seladelpar&phase=2&draw=2&rank=1
- RESPONSE: A Placebo-controlled, Randomized, Phase 3 Study to Evaluate the Efficacy and Safety of Seladelpar in Patients With Primary Biliary Cholangitis (PBC) and an Inadequate Response to or an Intolerance to Ursodeoxycholic Acid (UDCA). NCT04620733 (active, not recruiting). https://clinicaltrials.gov/ct2/show/NCT04620733?term=Seladelpar&phase=2&draw=2&rank=3
- Base de données GlobalData Healthcare (consultée en septembre 2022; liste des médicaments en essais de phase II).
- As Delandistrogene moxeparvovec moves closer to clinical approval, what is the likelihood that the drug will be approved? 3 janvier 2023. https://www.pharmaceutical-technology.com/data-analysis/delandistrogene-moxeparvovec-what-is-the-likelihood-that-drug-will-be-approved/
- Sarepta Therapeutics Announces That U.S. FDA has Accepted for Filing and Granted Priority Review for the Biologics License Application for SRP-9001, Sarepta’s Gene Therapy for the Treatment of Ambulant Individuals with Duchenne Muscular Dystrophy. 28 novembre 2022. https://investorrelations.sarepta.com/news-releases/news-release-details/sarepta-therapeutics-announces-us-fda-has-accepted-filing-and
- A Phase 3 Multinational, Randomized, Double-Blind, Placebo-Controlled Systemic Gene Delivery Study to Evaluate the Safety and Efficacy of SRP-9001 in Subjects With Duchenne Muscular Dystrophy (EMBARK). NCT05096221 (active not recruiting). https://clinicaltrials.gov/ct2/show/NCT05096221?term=delandistrogene&draw=2&rank=4
- Recursion Announces Initiation of Phase 2/3 Trial for the Treatment of NF2-Mutated Meningiomas at Children's Tumor Foundation NF Conference. 20 juin 2022. https://www.prnewswire.com/news-releases/recursion-announces-initiation-of-phase-23-trial-for-the-treatment-of-nf2-mutated-meningiomas-at-childrens-tumor-foundation-nf-conference-301570906.html
- Recursion Announces Initiation of Phase 2/3 Trial for the Treatment of NF2-Mutated Meningiomas at Children's Tumor Foundation NF Conference. 20 juin 2022. https://www.prnewswire.com/news-releases/recursion-announces-initiation-of-phase-23-trial-for-the-treatment-of-nf2-mutated-meningiomas-at-childrens-tumor-foundation-nf-conference-301570906.html
- Recursion Announces Initiation of Phase 2/3 Trial for the Treatment of NF2-Mutated Meningiomas at Children's Tumor Foundation NF Conference. 20 juin 2022. https://www.prnewswire.com/news-releases/recursion-announces-initiation-of-phase-23-trial-for-the-treatment-of-nf2-mutated-meningiomas-at-childrens-tumor-foundation-nf-conference-301570906.html
- A Parallel-group, Two-staged, Phase 2/3, Randomized, Multicenter Study to Evaluate the Efficacy and Safety of REC-2282 in Participants With Progressive NF2 Mutated Meningiomas. NCT05130866 (recruiting). https://clinicaltrials.gov/ct2/show/NCT05130866?term=REC-2282&draw=2&rank=1
- Base de données GlobalData Healthcare (consultée en septembre 2022; liste des médicaments en essais de phase II).
- Craig TJ, Reshef A, Li HH, Jacobs JS, Bernstein JA, et al. Efficacy and safety of garadacimab, a factor XIIa inhibitor for hereditary angioedema prevention (VANGUARD): a global, multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2023 Feb 28:S0140-6736(23)00350-1. doi: 10.1016/S0140-6736(23)00350-1. Publié en ligne avant impression.
- CSL Announces Positive Top-Line Phase 3 Results for Garadacimab as Preventive Treatment in Patients with Hereditary Angioedema (HAE). 17 août 2022. https://www.csl.com/news/2022/20220817-csl-announces-positive-results-for-garadacimab#:~:text=About%20HAE%20and%20Garadacimab&text=Garadacimab%20is%20a%20novel%20Factor,form%20of%20bradykinin%2Dmediated%20angioedema.
- A Multicenter, Double-blind, Randomized, Placebo-controlled, Parallel-arm Study to Investigate the Efficacy and Safety of Subcutaneous Administration of CSL312 (Garadacimab) in the Prophylactic Treatment of Hereditary Angioedema. NCT04656418 (completed). https://clinicaltrials.gov/ct2/show/NCT04656418?term=Garadacimab&phase=2&draw=2&rank=1
- An Open-label Study to Evaluate the Long-term Safety and Efficacy of CSL312 (Garadacimab) in the Prophylactic Treatment of Hereditary Angioedema. NCT04739059 (active, not recruiting). https://clinicaltrials.gov/ct2/show/NCT04739059?term=Garadacimab&phase=2&draw=2&rank=2
- Base de données GlobalData Healthcare (consultée en septembre 2022; liste des médicaments en essais de phase II).
- Horwitz ME, Stiff PJ, Cutler C, Brunstein C, Hanna R, et al. Omidubicel vs standard myeloablative umbilical cord blood transplantation: results of a phase 3 randomized study. Blood. 2021 Oct 21;138(16):1429-1440. doi: 10.1182/blood.2021011719.
- Horwitz ME, Stiff PJ, Cutler C, Brunstein C, Hanna R, et al. Omidubicel vs standard myeloablative umbilical cord blood transplantation: results of a phase 3 randomized study. Blood. 2021 Oct 21;138(16):1429-1440. doi: 10.1182/blood.2021011719.
- Lin C, Sajeev G, Stiff PJ, Brunstein CG, Cutler C, et al. Health-Related Quality of Life Following Allogeneic Hematopoietic Cell Transplantation with Omidubicel versus Umbilical Cord Blood. Transplant Cell Ther. 2023 Jan;29(1):52.e1-52.e9. doi: 10.1016/j.jtct.2022.09.018. Epub 2022 Sep 28.
- Gamida Cell Provides Regulatory Update on Omidubicel. 21 novembre 2022. https://www.businesswire.com/news/home/20221121005927/en/Gamida-Cell-Provides-Regulatory-Update-on-Omidubicel#:~:text=Omidubicel%20is%20an%20investigational%20stem,or%20any%20other%20health%20authority.
- Horwitz ME, Stiff PJ, Cutler C, Brunstein C, Hanna R, et al. Omidubicel vs standard myeloablative umbilical cord blood transplantation: results of a phase 3 randomized study. Blood. 2021 Oct 21;138(16):1429-1440. doi: 10.1182/blood.2021011719.
- Posoleucel (Viralym-M, ALVR105): A multi-virus specific T cell therapy (VST) targeting five devastating viral pathogens. https://www.allovir.com/products/alvr105
- AlloVir Announces Positive Final Results in Phase 2 Posoleucel Multi-Virus Prevention Study In Oral Presentation at the 64th ASH Annual Meeting and Exposition. 10 décembre 2022. https://www.businesswire.com/news/home/20221210005012/en/AlloVir-Announces-Positive-Final-Results-in-Phase-2-Posoleucel-Multi-Virus-Prevention-Study-In-Oral-Presentation-at-the-64th-ASH-Annual-Meeting-and-Exposition
- Phase 3, Randomized, Double-Blind, Placebo-Controlled Trial, With Cross-Over, of Posoleucel (ALVR105) for the Treatment of Adenovirus Infection in Pediatric and Adult Participants Receiving Standard of Care Following Allogeneic Hematopoietic Cell Transplantation. NCT05179057 (recruiting). https://clinicaltrials.gov/ct2/show/NCT05179057?term=posoleucel&phase=2&draw=2&rank=1
- Phase 2/3, Multicenter, Randomized, Double-Blind, Placebo-Controlled Study to Assess the Safety and Efficacy of ALVR105 (Viralym-M) Compared to Placebo for the Prevention of AdV, BKV, CMV, EBV, HHV-6, and JCV Infection and/or Disease, in High-Risk Patients After Allogeneic Hematopoietic Cell Transplant. NCT05305040 (recruiting). https://clinicaltrials.gov/ct2/show/NCT05305040?term=posoleucel&phase=2&draw=2&rank=3
- Phase 2/3, Multicenter, Randomized, Double-Blind, Placebo-Controlled Study to Assess the Safety and Efficacy of ALVR105 (Viralym-M) Compared to Placebo for the Prevention of AdV, BKV, CMV, EBV, HHV-6, and JCV Infection and/or Disease, in High-Risk Patients After Allogeneic Hematopoietic Cell Transplant. NCT04693637 (active, not recruiting). https://clinicaltrials.gov/ct2/show/NCT04693637?term=posoleucel&phase=2&draw=2&rank=4
- Newman LM, Kankam M, Nakamura A, Conrad T, Mueller J, et al. Thorough QT Study To Evaluate the Effect of Zoliflodacin, a Novel Therapeutic for Gonorrhea, on Cardiac Repolarization in Healthy Adults. Antimicrob Agents Chemother. 2021 Nov 17;65(12):e0129221. doi: 10.1128/AAC.01292-21. Epub 2021 Oct 4.
- Bradford PA, Miller AA, O'Donnell J, Mueller JP. Zoliflodacin: An Oral Spiropyrimidinetrione Antibiotic for the Treatment of Neisseria gonorrheae, Including Multi-Drug-Resistant Isolates. ACS Infect Dis. 2020 Jun 12;6(6):1332-1345. doi: 10.1021/acsinfecdis.0c00021. Epub 2020 May 12.
- A Multi-center, Randomized, Open-label, Non Inferiority Trial to Evaluate the Efficacy and Safety of a Single, Oral Dose of Zoliflodacin Compared to a Combination of a Single Intramuscular Dose of Ceftriaxone and a Single Oral Dose of Azithromycin in the Treatment of Patients With Uncomplicated Gonorrhoea. NCT03959527 (recruiting). https://clinicaltrials.gov/ct2/show/NCT03959527?term=Zoliflodacin&phase=2&draw=2&rank=1
- A Double-Blinded, Placebo-controlled, Phase 3 Study to Evaluate the Efficacy and Safety of ORMD-0801 in Uncontrolled Type 2 DM Subjects on Diet Control Alone, Metformin Monotherapy, or Two or Three Oral Glucose-lowering Agents. NCT04817215 (not yet recruiting). https://clinicaltrials.gov/ct2/show/NCT04817215?term=ORMD-0801&phase=2&draw=2&rank=1
- A Double-Blind, Placebo-controlled, Multi-center Randomized, Phase 3 Study to Evaluate the Efficacy and Safety of ORMD-0801 in T2DM Subjects With Inadequate Glycemic Control on Diet Control Only or on Diet Control and Metformin Monotherapy. NCT04754334 (recruiting). https://clinicaltrials.gov/ct2/show/NCT04754334?term=ORMD-0801&phase=2&draw=2&rank=2
- A Double-Blinded, Placebo-controlled, Double Dummy, Multi-center Randomized, Phase 3 Study to Evaluate the Efficacy and Safety of ORMD-0801 in Subjects With T2DM With Inadequate Glycemic Control on 1, 2 or 3 Oral Glucose-lowering Agents. NCT04606576 (active, not recruiting). https://clinicaltrials.gov/ct2/show/NCT04606576?term=ORMD-0801&phase=2&draw=2&rank=3
- Kjeldsen TB, Hubálek F, Hjørringgaard CU, Tagmose TM, Nishimura E, et al. Molecular Engineering of Insulin Icodec, the First Acylated Insulin Analog for Once-Weekly A dministration in Humans. J Med Chem. 2021 Jul 8;64(13):8942-8950. doi: 10.1021/acs.jmedchem.1c00257. Epub 2021 May 4.
- Rosenstock J, Bajaj HS, Janež A, Silver R, Begtrup K, et al; NN1436-4383 Investigators. Once-Weekly Insulin for Type 2 Diabetes without Previous Insulin Treatment. N Engl J Med. 2020 Nov 26;383(22):2107-2116. doi: 10.1056/NEJMoa2022474. Epub 2020 Sep 22.
- Rosenstock J, Bajaj HS, Janež A, Silver R, Begtrup K, et al; NN1436-4383 Investigators. Once-Weekly Insulin for Type 2 Diabetes without Previous Insulin Treatment. N Engl J Med. 2020 Nov 26;383(22):2107-2116. doi: 10.1056/NEJMoa2022474. Epub 2020 Sep 22.
- A 26-week Trial Comparing the Effect and Safety of Once Weekly Insulin Icodec and Once Daily Insulin Degludec, Both With or Without Non-insulin Anti-diabetic Drugs, in Subjects With Type 2 Diabetes Treated With Basal Insulin. NCT04770532 (completed). https://clinicaltrials.gov/ct2/show/NCT04770532?term=Insulin+icodec&phase=2&draw=2&rank=1
- Effectiveness and Safety of Once Weekly Insulin Icodec Used With DoseGuide Versus Once Daily Basal Insulin Analogues in an Insulin naïve Type 2 Diabetes Population in a Clinical Practice Setting. NCT04760626 (completed). https://clinicaltrials.gov/ct2/show/NCT04760626?term=Insulin+icodec&phase=2&draw=2&rank=5
- A 26-week Trial Comparing the Effect and Safety of Once Weekly Insulin Icodec and Once Daily Insulin Glargine 100 Units/mL, Both in Combination With Bolus Insulin With or Without Non-insulin Anti-diabetic Drugs, in Subjects With Type 2 Diabetes on a Basal-bolus Regimen. NCT04880850 (completed). https://clinicaltrials.gov/ct2/show/NCT04880850?term=Insulin+icodec&phase=2&draw=2&rank=6
- A 26-week Double Blinded, Multiregional, Trial Comparing the Effect and Safety of Once Weekly Insulin Icodec and Once Daily Insulin Degludec 100 Units/mL, Both in Combination With Non-insulin Anti-diabetic Drugs, in Insulin naïve Subjects With Type 2 Diabetes. NCT04795531 (completed). https://clinicaltrials.gov/ct2/show/NCT04795531?term=Insulin+icodec&phase=2&draw=2&rank=7
- A 78-week Trial Comparing the Effect and Safety of Once Weekly Insulin Icodec and Once Daily Insulin Glargine 100 Units/mL, Both in Combination With Non-insulin Anti-diabetic Treatment, in Insulin naïve Subjects With Type 2 Diabetes. NCT04460885 (active, not recruiting). https://clinicaltrials.gov/ct2/show/NCT04460885?term=Insulin+icodec&phase=2&draw=2&rank=2
- Efficacy and Safety of Once Weekly Insulin Icodec Compared to Once Daily Insulin Degludec 100 Units/mL, Both in Combination With Insulin Aspart, in Adults With Type 1 Diabetes. A 26-week, Randomised, Multicentre, Open-label, Active-controlled, Parallel Group, Two Armed, Treat-to-target Trial Investigating the Effect on Glycaemic Control and Safety of Treatment With Once Weekly Insulin Icodec Compared to Once Daily Insulin Degludec, Both in Combination With Insulin Aspart in Adults With Type 1 Diabetes, With a 26-week Extension Investigating Long Term Safety. NCT04848480 (active, not recruiting). https://clinicaltrials.gov/ct2/show/NCT04848480?term=Insulin+icodec&phase=2&draw=2&rank=3
- A 52 Week Study Comparing the Efficacy and Safety of Once Weekly IcoSema and Once Weekly Insulin Icodec, Both Treatment Arms With or Without Oral Anti Diabetic Drugs, in Participants With Type 2 Diabetes Inadequately Controlled With Daily Basal Insulin. NCT05352815 (recruiting). https://clinicaltrials.gov/ct2/show/NCT05352815?term=Insulin+icodec&phase=2&draw=2&rank=4
- A 52 Week Study Comparing the Efficacy and Safety of Once Weekly IcoSema and Daily Insulin Glargine 100 Units/mL Combined With Insulin Aspart, Both Treatment Arms With or Without Oral Anti Diabetic Drugs, in Participants With Type 2 Diabetes Inadequately Controlled With Daily Basal Insulin. COMBINE 3. NCT05013229 (recruiting). https://clinicaltrials.gov/ct2/show/NCT05013229?term=Insulin+icodec&phase=2&draw=2&rank=8
- A 52 Week Study Comparing the Efficacy and Safety of Once Weekly IcoSema and Once Weekly Semaglutide, Both Treatment Arms With or Without Oral Anti Diabetic Drugs, in Participants With Type 2 Diabetes Inadequately Controlled With a GLP 1 Receptor Agonist. COMBINE 2. NCT05259033 (recruiting). https://clinicaltrials.gov/ct2/show/NCT05259033?term=Insulin+icodec&phase=2&draw=2&rank=9
- Rusfertide May Eliminate the Need for Phlebotomies in Polycythemia Vera. 29 septembre 2022. https://www.targetedonc.com/view/rusfertide-may-eliminate-the-need-for-phlebotomies-in-polycythemia-vera
- Protagonist Therapeutics to Present Updated Phase 2 Rusfertide Clinical Results in Polycythemia Vera (PV) at ASCO 2022. 26 mai 2022. https://www.prnewswire.com/news-releases/protagonist-therapeutics-to-present-updated-phase-2-rusfertide-clinical-results-in-polycythemia-vera-pv-at-asco-2022-301556326.html
- Pemmaraju N, Kuykendall A, Kremyanskaya M, Ginzburg Y, Ritchie E, Gotlib J, et al. MPN-469 Rusfertide (PTG-300) Treatment Interruption Reverses Hematological Gains and Upon Reinitiation, Restoration of Clinical Benefit Observed in Patients With Polycythemia Vera. Clin Lymphoma Myeloma Leuk. 2022 Oct;22 Suppl 2:S338-S339. doi: 10.1016/S2152-2650(22)01462-8.
- Protagonist Therapeutics to Present Updated Phase 2 Rusfertide Clinical Results in Polycythemia Vera (PV) at ASCO 2022. 26 mai 2022. https://www.prnewswire.com/news-releases/protagonist-therapeutics-to-present-updated-phase-2-rusfertide-clinical-results-in-polycythemia-vera-pv-at-asco-2022-301556326.html
- Rusfertide Therapy for Polycythemia Vera Leads to Sustained Hematocrit Control. Mi-juillet 2022. https://ashpublications.org/ashclinicalnews/news/6294/rusfertide-therapy-for-polycythemia-vera-leads-to
- A Phase 3 Study of the Hepcidin Mimetic Rusfertide (PTG-300) in Patients With Polycythemia Vera. NCT05210790 (recruiting). https://clinicaltrials.gov/ct2/show/NCT05210790?term=Rusfertide&draw=2&rank=1
- Base de données GlobalData Healthcare (consultée en septembre 2022; liste des médicaments en essais de phase II).
- [Aucun auteur mentionné]. FGFR Inhibitor Stymies Gastric Cancer. Cancer Discov. 2021 Nov 17;11(5):OF3. doi: 10.1158/2159-8290.CD-NB2021-0312. Epub 2021 Feb 11.
- A Phase 1b/3 Study of Bemarituzumab Plus Chemotherapy and Nivolumab Versus Chemotherapy and Nivolumab Alone in Subjects With Previously Untreated Advanced Gastric and Gastroesophageal Junction Cancer With FGFR2b Overexpression. NCT05111626 (recruiting). https://clinicaltrials.gov/ct2/show/NCT05111626?term=Bemarituzumab&phase=2&draw=2&rank=1
- A Randomized, Multi-center, Double-blind, Placebo-controlled Phase 3 Study of Bemarituzumab Plus Chemotherapy Versus Placebo Plus Chemotherapy in Subjects With Previously Untreated Advanced Gastric or Gastroesophageal Junction Cancer With FGFR2b Overexpression. NCT05052801 (recruiting). https://clinicaltrials.gov/ct2/show/NCT05052801?term=Bemarituzumab&phase=2&draw=2&rank=2
- Base de données GlobalData Healthcare (consultée en septembre 2022; liste des médicaments en essais de phase II).
- Lonial S, Popat R, Hulin C, Jagannath S, Oriol A, et al. Iberdomide plus dexamethasone in heavily pretreated late-line relapsed or refractory multiple myeloma (CC-220-MM-001): a multicentre, multicohort, open-label, phase 1/2 trial. Lancet Haematol. 2022 Nov;9(11):e822-e832. doi: 10.1016/S2352-3026(22)00290-3. Epub 2022 Oct 6.
- A Phase 3, Two-Stage, Randomized, Multicenter, Open-label Study Comparing Iberdomide, Daratumumab and Dexamethasone (IberDd) Versus Daratumumab, Bortezomib, and Dexamethasone (DVd) in Subjects With Relapsed or Refractory Multiple Myeloma (RRMM). NCT04975997 (recruiting). https://clinicaltrials.gov/ct2/show/NCT04975997?term=Iberdomide&phase=2&draw=2&rank=1
- GEM21menos65. A Phase III Trial for NDMM Patients Who Are Candidates for ASCT Comparing Extended VRD Plus Early Rescue Intervention vs Isatuximab-VRD vs Isatuximab-V-Iberdomide-D. NCT05558319 (not yet recruiting). https://clinicaltrials.gov/ct2/show/NCT05558319?term=Iberdomide&phase=2&draw=2&rank=2
- Base de données GlobalData Healthcare (consultée en septembre 2022; liste des médicaments en essais de phase II).
- Pandravada S, Sandler S. The Role of Navitoclax in Myelofibrosis. Cureus. 2021 Sep 14;13(9):e17976. doi: 10.7759/cureus.17976. eCollection 2021 Sep.
- Harrison CN, Garcia JS, Somervaille TCP, Foran JM, Verstovsek S, et al. Addition of Navitoclax to Ongoing Ruxolitinib Therapy for Patients With Myelofibrosis With Progression or Suboptimal Response: Phase II Safety and Efficacy. J Clin Oncol. 2022 May 20;40(15):1671-1680. doi: 10.1200/JCO.21.02188. Epub 2022 Feb 18.
- A Randomized, Double-Blind, Placebo-Controlled, Phase 3 Study Of Navitoclax In Combination With Ruxolitinib Versus Ruxolitinib In Subjects With Myelofibrosis (TRANSFORM-1). NCT04472598 (active, not recruiting). https://clinicaltrials.gov/ct2/show/NCT04472598?term=Navitoclax&phase=2&draw=2&rank=1
- A Randomized, Open-Label, Phase 3 Study Evaluating Efficacy and Safety of Navitoclax in Combination With Ruxolitinib Versus Best Available Therapy in Subjects With Relapsed/Refractory Myelofibrosis (TRANSFORM-2). NCT04468984 (recruiting). https://clinicaltrials.gov/ct2/show/NCT04468984?term=Navitoclax&phase=2&draw=2&rank=2
- Base de données GlobalData Healthcare (consultée en septembre 2022; liste des médicaments en essais de phase II).
- Mascarenhas J, Harrison CN, Kiladjian JJ, Komrokji RS, Koschmieder S, et al. Imetelstat in intermediate-2 or high-risk myelofibrosis refractory to JAK inhibitor: IMpactMF phase III study design. Future Oncol. 2022 Jul;18(22):2393-2402. doi: 10.2217/fon-2022-0235. Epub 2022 May 5.
- Steensma DP, Fenaux P, Van Eygen K, Raza A, Santini V, et al. Imetelstat Achieves Meaningful and Durable Transfusion Independence in High Transfusion-Burden Patients With Lower-Risk Myelodysplastic Syndromes in a Phase II Study. J Clin Oncol. 2021 Jan 1;39(1):48-56. doi: 10.1200/JCO.20.01895. Epub 2020 Oct 27.
- A Randomized Open-Label, Phase 3 Study to Evaluate Imetelstat (GRN163L) Versus Best Available Therapy (BAT) in Patients With Intermediate-2 or High-risk Myelofibrosis (MF) Relapsed / Refractory (R/R) to Janus Kinase (JAK) Inhibitor. NCT04576156 (recruiting). https://clinicaltrials.gov/ct2/show/NCT04576156?term=Imetelstat&phase=2&draw=2&rank=1
- A Study to Evaluate Imetelstat (GRN163L) in Transfusion-Dependent Subjects With IPSS Low or Intermediate-1 Risk Myelodysplastic Syndrome (MDS) That is Relapsed/Refractory to Erythropoiesis-Stimulating Agent (ESA) Treatment. NCT02598661 (recruiting). https://clinicaltrials.gov/ct2/show/NCT02598661?term=Imetelstat&phase=2&draw=2&rank=4
- Base de données GlobalData Healthcare (consultée en septembre 2022; liste des médicaments en essais de phase II).
- Corcept Therapeutics to Start Phase 3 Trial of Relacorilant Plus Nab-Paclitaxel in Patients With Platinum-Resistant Ovarian Cancer. 2 juin 2022. https://www.globenewswire.com/en/news-release/2022/06/06/2456669/0/en/Corcept-Therapeutics-to-Start-Phase-3-Trial-of-Relacorilant-Plus-Nab-Paclitaxel-in-Patients-With-Platinum-Resistant-Ovarian-Cancer.html
- Corcept Therapeutics to Start Phase 3 Trial of Relacorilant Plus Nab-Paclitaxel in Patients With Platinum-Resistant Ovarian Cancer. 2 juin 2022. https://www.globenewswire.com/en/news-release/2022/06/06/2456669/0/en/Corcept-Therapeutics-to-Start-Phase-3-Trial-of-Relacorilant-Plus-Nab-Paclitaxel-in-Patients-With-Platinum-Resistant-Ovarian-Cancer.html
- Corcept Therapeutics to Start Phase 3 Trial of Relacorilant Plus Nab-Paclitaxel in Patients With Platinum-Resistant Ovarian Cancer. 2 juin 2022. https://www.globenewswire.com/en/news-release/2022/06/06/2456669/0/en/Corcept-Therapeutics-to-Start-Phase-3-Trial-of-Relacorilant-Plus-Nab-Paclitaxel-in-Patients-With-Platinum-Resistant-Ovarian-Cancer.html
- A Phase 3 Study of Relacorilant in Combination With Nab-Paclitaxel Versus Nab-Paclitaxel Monotherapy in Advanced, Platinum-Resistant, High-Grade Epithelial Ovarian, Primary Peritoneal, or Fallopian-Tube Cancer (ROSELLA). NCT05257408 (recruiting). https://clinicaltrials.gov/ct2/show/NCT05257408?term=Relacorilant&phase=2&draw=2&rank=4
- Base de données GlobalData Healthcare (consultée en septembre 2022; liste des médicaments en essais de phase II).
- Kyuno D, Takasawa A, Takasawa K, Ono Y, Aoyama T, et al. Claudin-18.2 as a therapeutic target in cancers: cumulative findings from basic research and clinical trials. Tissue Barriers. 2022 Jan 2;10(1):1967080. doi: 10.1080/21688370.2021.1967080. Epub 2021 Sep 5.
- Palmieri LJ, Soubeyran I, Pernot S. Adénocarcinome œsogastrique – nouvelles cibles thérapeutiques. Bull Cancer. 2022 Nov 9:S0007-4551(22)00340-X. doi: 10.1016/j.bulcan.2022.08.005. Publié en ligne avant impression.
- Zolbetuximab With mFOLFOX6 Meets Primary Endpoint in SPOTLIGHT Trial. 19 janvier 2023. https://dailynews.ascopubs.org/do/zolbetuximab-mfolfox6-meets-primary-endpoint-spotlight-trial
- A Phase 3, Global, Multi-Center, Double-Blind, Randomized, Efficacy Study of Zolbetuximab (IMAB362) Plus CAPOX Compared With Placebo Plus CAPOX as First-line Treatment of Subjects With Claudin (CLDN) 18.2-Positive, HER2-Negative, Locally Advanced Unresectable or Metastatic Gastric or Gastroesophageal Junction (GEJ) Adenocarcinoma. NCT03653507 (active, not recruiting). https://clinicaltrials.gov/ct2/show/NCT03653507?term=Zolbetuximab&phase=2&draw=2&rank=1
- A Phase 3, Global, Multi-Center, Double-Blind, Randomized, Efficacy Study of Zolbetuximab (IMAB362) Plus mFOLFOX6 Compared With Placebo Plus mFOLFOX6 as First-line Treatment of Subjects With Claudin (CLDN)18.2-Positive, HER2-Negative, Locally Advanced Unresectable or Metastatic Gastric or Gastroesophageal Junction (GEJ) Adenocarcinoma. NCT03504397 (active, not recruiting). https://clinicaltrials.gov/ct2/show/NCT03504397?term=Zolbetuximab&phase=2&draw=2&rank=2
- Base de données GlobalData Healthcare (consultée en septembre 2022; liste des médicaments en essais de phase II).
- Vignal-Clermont C(1)(2), Girmens JF(2)(3), Audo I(2)(3)(4), Said SM(2)(3)(4), Errera MH(2)(3)(5), et al. Safety of Intravitreal Gene Therapy for Treatment of Subjects with Leber Hereditary Optic Neuropathy due to Mutations in the Mitochondrial ND4 Gene: The REVEAL Study.BioDrugs. 2021 Mar;35(2):201-214. doi: 10.1007/s40259(-021)-00468-9. Epub 2021 Feb 10.
- A Randomized, Double-Masked, Sham-Controlled Clinical Trial to Evaluate the Efficacy of a Single Intravitreal Injection of GS010 in Subjects Affected for 6 Months or Less by LHON Due to the G11778A Mutation in the Mitochondrial ND4 Gene. NCT02652767 (completed). https://clinicaltrials.gov/ct2/show/NCT02652767?cond=NCT02652767&draw=2&rank=1
- Randomized, Double-Masked, Sham-Controlled Clinical Trial to Evaluate the Efficacy of a Single Intravitreal Injection of GS010 in Subjects Affected for More Than 6 Months and To 12 Months by LHON Due to the G11778A Mutation in the ND4 Gene. NCT02652780 (completed). https://clinicaltrials.gov/ct2/show/NCT02652780
- Long-term Follow-up of ND4 LHON Subjects Treated With GS010 Ocular Gene Therapy in the RESCUE or REVERSE Phase III Clinical Trials (RESTORE). NCT03406104 (completed). https://clinicaltrials.gov/ct2/show/NCT03406104?term=NCT03406104&draw=2&rank=1
- Carelli V, Newman NJ, Yu-Wai-Man P, Biousse V, Moster ML, et al; the LHON Study Group. Indirect Comparison of Lenadogene Nolparvovec Gene Therapy Versus Natural History in Patients with Leber Hereditary Optic Neuropathy Carrying the m.11778G>A MT-ND4 Mutation.Ophthalmol Ther. 2023 Feb;12(1):401-429. doi: 10.1007/s40123-022-00611-x. Epub 2022 Nov 30.
- Biousse V, Newman NJ, Yu-Wai-Man P, Carelli V, Moster ML, et al; LHON Study Group. Long-Term Follow-Up After Unilateral Intravitreal Gene Therapy for Leber Hereditary Optic Neuropathy: The RESTORE Study. J Neuroophthalmol. 2021 Sep 1;41(3):309-315. doi: 10.1097/WNO.0000000000001367.
- Vignal-ClermoḤ C, Yu-Wai-Man P, Newman NJ, Carelli V, Moster ML, et al; LHON Study Group. Safety of lenadogene nolparvovec gene therapy over 5 years in 189 patients with Leber hereditary optic neuropathy. Am J Ophthalmol. 2022 Dec 7:S0002-9394(22)00464-0. doi: 10.1016/j.ajo.2022.11.026. Publié en ligne avant impression.
- BRIEF—FDA setback for GenSight’s Lumevoq. 19 janvier 2022. https://www.thepharmaletter.com/in-brief/brief-fda-setback-for-gensight-s-lumevoq
- Toth PP, Schwartz GG, Nicholls SJ, Khan A, Szarek M, et al. Reduction in the risk of major adverse cardiovascular events with the BET protein inhibitor apabetalone in patients with recent acute coronary syndrome, type 2 diabetes, and moderate to high likelihood of non-alcoholic fatty liver disease. Am J Prev Cardiol. 2022 Aug 8;11:100372. doi: 10.1016/j.ajpc.2022.100372. eCollection 2022 Sep.
- A Phase 3, Multicenter, Double-blind, Randomized, Placebo-controlled, Parallel-group Study to Investigate the Efficacy and Safety of CSL112 in Subjects With Acute Coronary Syndrome. NCT03473223 (active, not recruiting). https://clinicaltrials.gov/ct2/show/NCT03473223?term=NCT03473223&draw=2&rank=1
- https://www.dicardiology.com/content/memorialcare-heart-and-vascular-institute-participating-global-study-csl112-patients-acute. 8 mars 2022.
- A Phase 3, Multicenter, Randomized, Double Blind, Placebo Controlled Study to Evaluate the Efficacy and Safety of AL001 in Individuals at Risk for or With Frontotemporal Dementia Due to Heterozygous Mutations in the Progranulin Gene. NCT04374136 (recruiting). https://clinicaltrials.gov/ct2/show/NCT04374136?term=AL001&phase=2&draw=2&rank=1
- Smith KW, Sicignano DJ, Hernandez AV, White CM. MDMA-Assisted Psychotherapy for Treatment of Posttraumatic Stress Disorder: A Systematic Review With Meta-Analysis. J Clin Pharmacol. 2022 Apr;62(4):463-471. doi: 10.1002/jcph.1995. Epub 2021 Nov 28.
- A Randomized, Double-Blind, Placebo-Controlled, Multi-Site Phase 3 Study of the Efficacy and Safety of Manualized MDMA-Assisted Psychotherapy for the Treatment of Posttraumatic Stress Disorder of Moderate or Greater Severity. NCT04077437 (completed). https://clinicaltrials.gov/ct2/show/NCT04077437?term=NCT04077437&draw=2&rank=1
- A Multi-Site Open-Label Safety Extension Study of Manualized MDMA-Assisted Psychotherapy for the Treatment of Participants With Posttraumatic Stress Disorder. NCT04714359 (enrolling by invitation). https://clinicaltrials.gov/ct2/show/NCT04714359?term=NCT04714359&draw=2&rank=1
- A Multicenter, Randomized, Active-controlled, Double-blind, Double-dummy, Parallel Group Clinical Trial, Investigating the Efficacy, Safety, and Tolerability of Continuous Subcutaneous ND0612 Infusion in Comparison to Oral IR-LD/CD in Subjects With Parkinson's Disease Experiencing Motor Fluctuations (BouNDless). NCT04006210 (recruiting). https://clinicaltrials.gov/ct2/show/NCT04006210?term=NCT04006210&draw=2&rank=1
- A Phase 3, Multicenter, Randomized, Double-blind, Placebo-controlled Study of the Efficacy, Safety and Biomarker Effects of ALZ-801 in Subjects With Early Alzheimer's Disease and APOE4/4 Genotype.NCT04770220 (active, not recruiting). https://clinicaltrials.gov/ct2/show/NCT04770220?term=NCT04770220&draw=2&rank=1
- An Open-label, Long-term Extension Study of Brazikumab in Participants With Moderately to Severely Active Crohn's Disease (INTREPID OLE). NCT03961815 (enrolling by invitation). https://clinicaltrials.gov/ct2/show/NCT03961815?term=NCT03961815&draw=2&rank=1
- A 52-Week, Multicenter, Randomized, Double-blind, Placebo and Active-Controlled, Operationally Seamless Phase 2b/3, Parallel-group Study to Assess the Efficacy and Safety of Brazikumab in Participants With Moderately to Severely Active Crohn's Disease (INTREPID Lead-In). NCT03759288 (recruiting). https://clinicaltrials.gov/ct2/show/NCT03759288?term=NCT03759288&draw=2&rank=1
- A Phase 3 Prospective, Randomized, Double-blinded, Placebo-controlled Clinical Study to Evaluate the Efficacy and Safety of RBX2660 (Microbiota Suspension) for the Prevention of Clostridium Difficile InfectionNCT03244644 (completed). https://clinicaltrials.gov/ct2/show/NCT03244644?term=NCT03244644&draw=2&rank=1
- Khanna S, Assi M, Lee C, Yoho D, Louie T, et al. Efficacy and Safety of RBX2660 in PUNCH CD3, a Phase III, Randomized, Double-Blind, Placebo-Controlled Trial with a Bayesian Primary Analysis for the Prevention of Recurrent Clostridioides difficile Infection. Drugs. 2022 Oct 26:1-12. doi: 10.1007/s40265-022-01797-x. Publié en ligne avant impression.
- Ferring and Rebiotix Present Landmark Phase 3 Data Demonstrating Superior Efficacy of Investigational RBX2660 Versus Placebo to Reduce Recurrence of C. difficile Infection. 21 mai 2021. https://www.rebiotix.com/efficacy-rbx2660-vs-placebo-reduce-recurrence-c-difficile-infection/
- A Phase 3 Open-Label Clinical Study to Evaluate the Safety and Tolerability of Rebiotix RBX2660 (Microbiota Suspension) in Subjects With Recurrent Clostridium Difficile Infection. NCT03931941 (active, not recruiting). https://clinicaltrials.gov/ct2/show/NCT03931941?term=NCT03931941&draw=2&rank=1
- A Phase III, Randomized, Multicenter, Parallel-Group, Double-Blind, Double-Dummy Study in Adolescent and Adult Female Participants Comparing the Efficacy and Safety of Gepotidacin to Nitrofurantoin in the Treatment of Uncomplicated Urinary Tract Infection (Acute Cystitis). NCT04020341 (active, not recruiting). https://clinicaltrials.gov/ct2/show/NCT04020341?term=NCT04020341&draw=2&rank=1.
- A Phase III, Randomized, Multicenter, Parallel-Group, Double-Blind, Double-Dummy Study in Adolescent and Adult Female Participants Comparing the Efficacy and Safety of Gepotidacin to Nitrofurantoin in the Treatment of Uncomplicated Urinary Tract Infection (Acute Cystitis). NCT04187144 (active, not recruiting). https://clinicaltrials.gov/ct2/show/NCT04187144?term=NCT04187144&draw=2&rank=1.
- EAGLE-2 and EAGLE-3 phase III trials for gepotidacin stopped early for efficacy following pre-planned interim analysis by Independent Data Monitoring Committee Issued: London UK. 3 novembre 2022. https://www.gsk.com/en-gb/media/press-releases/gsk-announces-phase-iii-trials-for-gepotidacin/
- New antibiotic appears to be effective against urinary tract infections, drug company says. 3 novembre 2022. https://www.cnn.com/2022/11/03/health/new-uti-antibiotic-gepotidacin/index.html
- GSK to submit drug application for new antibiotic to US FDA. 4 novembre 2022. https://www.pmlive.com/pharma_news/gsk_to_submit_drug_application_for_new_antibiotic_to_us_fda_1480238
- Bhatt DL, Pollack, Jr. CV, Mazer D, Angiolillo DJ, Steg G, et al; for the REVERSE-IT Investigators. Bentracimab for Ticagrelor Reversal in Patients Undergoing Urgent Surgery. NEJM Evid 2021; 1 (3) DOI:https://doi.org/10.1056/EVIDoa2100047. https://evidence.nejm.org/doi/full/10.1056/EVIDoa2100047
- PhaseBio Announces Successful Pre-BLA Meeting with U.S. FDA for Bentracimab. 16 mai 2022. https://www.businesswire.com/news/home/20220516005342/en/PhaseBio-Announces-Successful-Pre-BLA-Meeting-with-U.S.-FDA-for-Bentracimab
- Danicopan (ALXN2040) add-on to Ultomiris or Soliris met primary endpoint in ALPHA Phase III trial for patients with paroxysmal nocturnal haemoglobinuria who experience clinically significant extravascular haemolysis. 16 septembre 2022. https://www.astrazeneca.com/media-centre/press-releases/2022/danicopan-phase-iii-trial-met-primary-endpoint.html
- A Phase 3 Study of Danicopan (ALXN2040) as Add-on Therapy to a C5 Inhibitor (Eculizumab or Ravulizumab) in Patients With Paroxysmal Nocturnal Hemoglobinuria Who Have Clinically Evident Extravascular Hemolysis (EVH). NCT04469465 (active, not recruiting). https://clinicaltrials.gov/ct2/show/NCT04469465?term=NCT04469465&draw=2&rank=1.
- Gene Therapy for Hemophilia Is on the Brink of FDA Approval. 17 novembre 2022. https://www.managedhealthcareexecutive.com/view/gene-therapy-for-hemophilia-is-on-the-brink-of-fda-approval
- Une prophylaxie par fitusiran a réduit de 61% les saignements chez les personnes atteintes d’hémophilie A ou B, avec ou sans inhibiteurs, comparativement à une prophylaxie antérieure par facteur de remplacement ou par agent court-circuitant. 10 juillet 2022. https://www.sanofi.com/fr/media-room/communiques-de-presse/2022/2022-07-10-13-45-00-2476896
- Une prophylaxie par fitusiran a réduit de 61% les saignements chez les personnes atteintes d’hémophilie A ou B, avec ou sans inhibiteurs, comparativement à une prophylaxie antérieure par facteur de remplacement ou par agent court-circuitant. 10 juillet 2022. https://www.sanofi.com/fr/media-room/communiques-de-presse/2022/2022-07-10-13-45-00-2476896
- An Open-label, Long-term Safety and Efficacy Study of Fitusiran in Patients With Hemophilia A or B, With or Without Inhibitory Antibodies to Factor VIII or IX. NCT03754790 (active, not recruiting). https://clinicaltrials.gov/ct2/show/NCT03754790?term=Fitusiran&phase=2&draw=2&rank=2
- Khan AA, Rubin MR, Schwarz P, Vokes T, Shoback DM, et al. Efficacy and Safety of Parathyroid Hormone Replacement With TransCon PTH in Hypoparathyroidism: 26-Week Results From the Phase 3 PaTHway Trial. J Bone Miner Res. 2022 Oct 21. doi: 10.1002/jbmr.4726. Publié en ligne avant impression.
- TransCon PTH Gets Priority Review for Hypoparathyroidism. 2 novembre 2022. https://www.empr.com/home/news/drugs-in-the-pipeline/transcon-pth-gets-priority-review-for-hypoparathyroidism/
- Tuberculosis Pipeline Landscape Analysis of 38+ Companies by DelveInsight. 4 mai 2022. https://www.globenewswire.com/en/news-release/2022/05/04/2436001/0/en/Tuberculosis-Pipeline-Landscape-Analysis-of-38-Companies-by-DelveInsight.html
- Nymox Announces Submission of New Drug Application (NDA) to the FDA for Fexapotide Triflutate. 3 mars 2022. https://www.drugs.com/nda/fexapotide_triflutate_220303.html
- Prothena to Present Data on Survival Benefit Observed in Completed Phase 3 Study of Drug Candidate Birtamimab in Patients with Mayo Stage IV AL Amyloidosis at the ASH 2022 Meeting. 3 novembre 2022. https://www.businesswire.com/news/home/20221103005351/en/Prothena-to-Present-Data-on-Survival-Benefit-Observed-in-Completed-Phase-3-Study-of-Drug-Candidate-Birtamimab-in-Patients-with-Mayo-Stage-IV-AL-Amyloidosis-at-the-ASH-2022-Meeting
- A Phase 3, Randomized, Multicenter, Double-Blind, Placebo-Controlled, Efficacy and Safety Study of Birtamimab Plus Standard of Care vs. Placebo Plus Standard of Care in Mayo Stage IV Subjects With Light Chain (AL) Amyloidosis. NCT04973137 (recruiting). https://clinicaltrials.gov/ct2/show/NCT04973137?term=NCT04973137&draw=2&rank=1.
- CellTrans’ Lantidra™ (donislecel) approaches a decision from the FDA. 15 juin 2021. https://www.primetherapeutics.com/news/celltrans-lantidra-donislecel-approaches-a-decision-from-the-fda/
- FDA Meeting Likely to Lead to New Request for PRX-102 Approval. 22 octobre 2021. https://fabrydiseasenews.com/news/new-fda-approval-request-prx-102-likely-protalix-reports/
- Protalix Resubmits To FDA The BLA For Pegunigalsidase Alfa For Treatment Of Fabry Disease. 14 novembre 2022. https://www.nasdaq.com/articles/protalix-resubmits-to-fda-the-bla-for-pegunigalsidase-alfa-for-treatment-of-fabry-disease
- Protalix BioTherapeutics and Chiesi Global Rare Diseases Announce the Submission of a Marketing Authorization Application to the European Medicines Agency for PRX-102 for the Treatment of Fabry Disease. 24 février 2022. https://www.prnewswire.com/il/news-releases/protalix-biotherapeutics-and-chiesi-global-rare-diseases-announce-the-submission-of-a-marketing-authorization-application-to-the-european-medicines-agency-for-prx-102-for-the-treatment-of-fabry-disease-301491083.html
- A Randomized, Multicenter, Parallel-group, Phase III Study to Compare the Efficacy of Arfolitixorin Versus Leucovorin in Combination With 5 Fluorouracil, Oxaliplatin, and Bevacizumab in Patients With Advanced Colorectal Cancer. NCT03750786 (active, not recruiting). https://clinicaltrials.gov/ct2/show/NCT03750786?term=NCT03750786&draw=2&rank=1.
- A Phase 3 Multicenter, Randomized, Double-Blind, Placebo Controlled Study to Determine the Efficacy of Topical SGX301 (Synthetic Hypericin) and Fluorescent Bulb-Light Irradiation for the Treatment of Cutaneous T-Cell Lymphoma. NCT02448381 (completed). https://clinicaltrials.gov/ct2/show/NCT02448381?term=NCT02448381&draw=2&rank=1.
- Kim EJ, Mangold AR, DeSimone JA, Wong HK, Seminario-Vidal L, et al. Efficacy and Safety of Topical Hypericin Photodynamic Therapy for Early-Stage Cutaneous T-Cell Lymphoma (Mycosis Fungoides): The FLASH Phase 3 Randomized Clinical Trial. JAMA Dermatol. 2022 Sep 1;158(9):1031-1039. doi: 10.1001/jamadermatol.2022.2749.
- FDA Declines to File New Drug Application for SGX301 in T-Cell Lymphoma. 20 février 2023. https://www.cancernetwork.com/view/fda-declines-to-file-new-drug-application-for-sgx301-in-t-cell-lymphoma
- A Phase III, Randomized, Double-Blind, Placebo-Controlled, Multicenter Trial Testing Ipatasertib Plus Abiraterone Plus Prednisone/Prednisolone, Relative to Placebo Plus Abiraterone Plus Prednisone/Prednisolone in Adult Male Patients With Asymptomatic or Mildly Symptomatic, Previously Untreated, Metastatic Castrate-Resistant Prostate Cancer. NCT03072238 (active, but not recruiting). https://clinicaltrials.gov/ct2/show/NCT03072238?term=NCT03072238&draw=2&rank=1
- BioLineRx Announces U.S. FDA Acceptance of New Drug Application for Aphexda (motixafortide) in Stem Cell Mobilization. Novembre 2022. https://www.drugs.com/nda/aphexda_221110.html
- BioLineRx Announces U.S. FDA Acceptance of New Drug Application for Aphexda (motixafortide) in Stem Cell Mobilization. Novembre 2022. https://www.drugs.com/nda/aphexda_221110.html
- A Phase 3 Multicenter, Randomized, Double Masked, Sham- Controlled Clinical Trial to Assess the Safety and Efficacy of Intravitreal Administration of Zimura (Complement C5 Inhibitor) in Patients With Geographic Atrophy Secondary to Age-Related Macular Degeneration. NCT04435366 (active, not recruiting). https://clinicaltrials.gov/ct2/show/NCT04435366?term=NCT04435366&draw=2&rank=1.
- FDA accepts NDA for avacincaptad pegol for the treatment of geographic atrophy. 17 février 2023. https://www.modernretina.com/view/fda-approves-nda-for-avacincaptad-pegol-for-the-treatment-of-geographic-atrophy
- U.S. FDA Accepts Astellas' New Drug Application for Fezolinetant. 18 août 2022. https://www.prnewswire.com/news-releases/us-fda-accepts-astellas-new-drug-application-for-fezolinetant-301608116.html
- Astellas Announces Topline 12-week Results from Phase 3 Study of Fezolinetant for the Nonhormonal Treatment of Vasomotor Symptoms in Women in Asia. 15 mars 2022. https://www.astellas.com/en/news/25421
- Astellas has menopause accelerated approval ambition thwarted by FDA at last minute. 20 février 2023. https://www.fiercebiotech.com/biotech/astellas-after-using-prv-has-menopause-accelerated-approval-ambition-thwarted-fda-last
- Leqembi (lecanemab-irmb). Lettre d’approbation de la FDA. https://www.accessdata.fda.gov/drugsatfda_docs/appletter/2023/761269Orig1s000ltr.pdf
- Briumvi (ublituximab-xiiy). Lettre d’approbation de la FDA. https://www.accessdata.fda.gov/drugsatfda_docs/appletter/2023/761238Orig1s000ltr.pdf
- FDA Approves First Gene Therapy to Treat Adults with Hemophilia B. 22 novembre 2022. https://www.fda.gov/news-events/press-announcements/fda-approves-first-gene-therapy-treat-adults-hemophilia-b
- Vivjoa (oteseconazole). Lettre d’approbation de la FDA. https://www.accessdata.fda.gov/drugsatfda_docs/appletter/2022/215888Orig1s000ltr.pdf
- Tzield (teplizumab-mzwv) injection. Lettre d’approbation de la FDA. https://www.accessdata.fda.gov/drugsatfda_docs/appletter/2022/761183Orig1s000ltr.pdf
- Orserdu (elacestrant). Lettre d’approbation de la FDA. https://www.accessdata.fda.gov/drugsatfda_docs/appletter/2023/217639Orig1s000correctedltr.pdf
- Mora JS(1), Bradley WG(2), Chaverri D(3), Hernández-Barral M(3), Mascias J(3), et al. Long-term survival analysis of masitinib in amyotrophic lateral sclerosis. Ther Adv Neurol Disord. 2021 Jul 19;14:17562864211030365. doi: 10.1177/17562864211030365. eCollection 2021.
- AB Science annonce aujourd’hui avoir déposé une demande d’autorisation de mise sur le marché conditionnelle auprès de l’Agence européenne des médicaments (EMA) pour Alsitek (masitinib) dans le traitement de la sclérose latérale amyotrophique (SLA). 24 août 2022. https://www.ab-science.com/fr/ab-science-annonce-avoir-depose-une-demande-dautorisation-de-mise-sur-le-marche-conditionnelle-aupres-de-lema-pour-le-masitinib-dans-le-traitement-de-la-sla/
- Alsitek (masitinib). European Medicines Agency. https://www.ema.europa.eu/en/medicines/human/EPAR/alsitek
- Base de données GlobalData Healthcare (consultée en septembre 2022; liste des médicaments en essais de phase II).
- Pasca S. Concizumab as a Subcutaneous Prophylactic Treatment Option for Patients with Hemophilia A or B: A Review of the Evidence and Patient's Perspectives. J Blood Med. 2022 Apr;16(13):191-199. doi: 10.2147/JBM.S242219. eCollection 2022.
- Novo Nordisk A/S: Phase 3 data for concizumab show 86% reduction in treated bleeds in haemophilia A or B with inhibitors. 10 juillet 2022. https://www.globenewswire.com/news-release/2022/07/10/2476898/0/en/Novo-Nordisk-A-S-Phase-3-data-for-concizumab-show-86-reduction-in-treated-bleeds-in-haemophilia-A-or-B-with-inhibitors.html
- Jiménez-Yuste V, Angchaisuksiri P, Castaman G, et al. Concizumab prophylaxis in patients with haemophilia A or B with inhibitors: Efficacy and safety results from the 32-week primary analysis of the phase 3 explorer7 trial. ISTH 2022 abstracts. Abstract number: LB 01.2. https://abstracts.isth.org/?advanced=1&title=Concizumab+prophylaxis+in+patients+with+haemophilia+A+or+B+with+inhibitors&theauthor=&affiliation=&meetingid=&s
- Novo Nordisk A/S: Phase 3 data for concizumab show 86% reduction in treated bleeds in haemophilia A or B with inhibitors. 10 juillet 2022. https://www.globenewswire.com/news-release/2022/07/10/2476898/0/en/Novo-Nordisk-A-S-Phase-3-data-for-concizumab-show-86-reduction-in-treated-bleeds-in-haemophilia-A-or-B-with-inhibitors.html
- Base de données GlobalData Healthcare (consultée en septembre 2022; liste des médicaments en essais de phase II).
- Trial of Spesolimab for Generalized Pustular Psoriasis. 22 décembre 2021. https://www.mountsinai.org/about/newsroom/2021/trial-of-spesolimab-for-generalized-pustular-psoriasis
- FDA approves the first treatment option for generalized pustular psoriasis flares in adults. 1er septembre 2022. https://www.boehringer-ingelheim.us/press-release/fda-approves-first-treatment-option-generalized-pustular-psoriasis-flares-adults
- Menter A, Van Voorhees AS, Hsu S. Pustular Psoriasis: A Narrative Review of Recent Developments in Pathophysiology and Therapeutic Options. Dermatol Ther (Heidelb). 2021 Dec;11(6):1917-1929. doi: 10.1007/s13555-021-00612-x. Epub 2021 Oct 9.
- Maçães CO, Lé AM, Torres T. Generalized pustular psoriasis: the new era of treatment with IL-36 receptor inhibitors. J Dermatolog Treat. 2022 Nov;33(7):2911-2918. doi: 10.1080/09546634.2022.2089335. Epub 2022 Jun 21.
- FDA approves the first treatment option for generalized pustular psoriasis flares in adults. 1er septembre 2022. https://www.boehringer-ingelheim.us/press-release/fda-approves-first-treatment-option-generalized-pustular-psoriasis-flares-adults
- Spevigo (spesolimab-sbzo) intravenous injection. Lettre d’approbation de la FDA. https://www.accessdata.fda.gov/drugsatfda_docs/appletter/2022/761244Orig1s000ltr.pdf
- Spevigo (spesolimab). European Medicines Agency. https://www.ema.europa.eu/en/medicines/human/summaries-opinion/spevigo
- Base de données GlobalData Healthcare (consultée en septembre 2022; liste des médicaments en essais de phase II).
- Chekol Abebe E, Yibeltal Shiferaw M, Tadele Admasu F, Asmamaw Dejenie T. Ciltacabtagene autoleucel: The second anti-BCMA CAR T-cell therapeutic armamentarium of relapsed or refractory multiple myeloma. Front Immunol. 2022 Sep 2;13:991092. doi: 10.3389/fimmu.2022.991092. eCollection 2022.
- Carvykti. European Medicines Agency. https://www.ema.europa.eu/en/medicines/human/EPAR/carvykti
- Chekol Abebe E, Yibeltal Shiferaw M, Tadele Admasu F, Asmamaw Dejenie T. Ciltacabtagene autoleucel: The second anti-BCMA CAR T-cell therapeutic armamentarium of relapsed or refractory multiple myeloma. Front Immunol. 2022 Sep 2;13:991092. doi: 10.3389/fimmu.2022.991092. eCollection 2022.
- Weisel K, Martin T, Krishnan A, Jagannath S, Londhe A, et al. Comparative Efficacy of Ciltacabtagene Autoleucel in CARTITUDE-1 vs Physician's Choice of Therapy in the Long-Term Follow-Up of POLLUX, CASTOR, and EQUULEUS Clinical Trials for the Treatment of Patients with Relapsed or Refractory Multiple Myeloma. Clin Drug Investig. 2022 Jan;42(1):29-41. doi: 10.1007/s40261-021-01100-y. Epub 2021 Nov 25.
- FDA approves ciltacabtagene autoleucel for relapsed or refractory multiple myeloma. 28 février 2022. https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-ciltacabtagene-autoleucel-relapsed-or-refractory-multiple-myeloma
- Carvykti. European Medicines Agency. https://www.ema.europa.eu/en/medicines/human/EPAR/carvykti
- Base de données GlobalData Healthcare (consultée en septembre 2022; liste des médicaments en essais de phase II).
- Minson A, Dickinson M. Glofitamab CD20-TCB bispecific antibody. Leuk Lymphoma. 2021 Dec;62(13):3098-3108. doi: 10.1080/10428194.2021.1953016. Epub 2021 Jul 15.
- Fixed-Duration Glofitamab Elicits Early, Durable Complete Remissions in Relapsed/Refractory LBCL. 2 septembre 2022. https://www.onclive.com/view/fixed-duration-glofitamab-elicits-early-durable-complete-remissions-in-relapsed-refractory-lbcl
- New Pivotal Data Demonstrate Clinical Benefit of Genentech’s Glofitamab, a Potential First-in-Class Bispecific Antibody for People with Aggressive Lymphoma. 26 mai 2022. https://www.gene.com/media/press-releases/14954/2022-05-26/new-pivotal-data-demonstrate-clinical-be
- Minson A, Dickinson M. Glofitamab CD20-TCB bispecific antibody. Leuk Lymphoma. 2021 Dec;62(13):3098-3108. doi: 10.1080/10428194.2021.1953016. Epub 2021 Jul 15.
- Base de données GlobalData Healthcare (consultée en septembre 2022; liste des médicaments en attente d’homologation).
- Base de données GlobalData Healthcare (consultée en septembre 2022; liste des médicaments en essais de phase II).
- Samaddar A, Grover M, Nag VL. 2020. Pathophysiology and Potential Therapeutic Candidates for COVID-19: A Poorly Understood Arena. Front Pharmacol. 11:585888. doi: 10.3389/fphar.2020.585888.