Lignes directrices sur l'évaluation de l'innocuité des aliments nouveaux
Direction des aliments
Direction générale des produits de santé et des aliments
Santé Canada
Juin, 2006
Mis à jour juillet 2022
- 1. Introduction
- 2. Procédure de préavis
- 3. Autres considérations de nature réglementaire
- 3.1 Impact environnemental
- 3.2 Végétaux à caractères nouveaux et aliments nouveaux du bétail
- 3.3 Coordination des décisions réglementaires concernant les aliments nouveaux et les aliments nouveaux du bétail et dérivés des végétaux à caractères nouveaux
- 3.4 Nouveaux renseignements
- 3.5 Surveillance après la mise en marché
- 4. Exigences en matière de renseignements concernant l'évaluation de l'innocuité
- 4.1 Aliments nouveaux dérivés de végétaux
- 4.1.1 Substance sans antécédents d'innocuité comme aliment
- 4.1.2 Procédé nouveau
- 4.1.3 Modifications génétiques
- 4.1.3.1 Caractérisation de la lignée dérivée
- 4.1.3.2 Considérations relatives aux modifications génétiques
- 4.1.3.3 Historique de l'organisme (hôte et donneur)
- 4.1.3.4 Exposition alimentaire
- 4.1.3.5 Examens nutritionnels
- 4.1.3.6 Examens toxicologiques
- 4.1.3.7 Examens relatifs à l'allergénicité
- 4.1.3.8 Examens chimiques
- 4.2 Nouveaux aliments dérivés de micro-organismes
- 4.2.1 Substance sans antécédents d'innocuité comme aliment
- 4.2.2 Procédé nouveau
- 4.2.3 Modifications génétiques
- 4.2.3.1 Caractérisation de la souche dérivée
- 4.2.3.2 Considérations relatives aux modifications génétiques
- 4.2.3.3 Historique de l'organisme
- 4.2.3.4 Exposition alimentaire
- 4.2.3.5 Examens nutritionnels
- 4.2.3.6 Examens toxicologiques
- 4.2.3.7 Examens relatifs à l'allergénicité
- 4.2.3.8 Examens chimiques
- 4.1 Aliments nouveaux dérivés de végétaux
- Annexe 1 : Orientations règlementaires de Santé Canada sur l'interprétation de la nouveauté envers les produits de sélections végétales
- 1. Introduction
- 2. Contexte
- 3. Aliments dérivés de produits de sélection végétale qui ne sont pas des aliments nouveaux
- 4. Répercussions sur la salubrité des aliments et la nutrition
- 4.1 Effets sur les allergènes, les toxines et les antinutriments
- 4.2 Répercussions sur la composition des nutriments clés et sur le métabolisme
- 4.3 Changements intentionnels dans l'utilisation alimentaire du végétal
- 4.4 Produits alimentaires dérivés de plantes contenant de l'ADN étranger dans le végétal final
- 5. Liste des méthodes classiques de sélection végétale
- Annexe 2 : Orientations règlementaires de Santé Canada sur l'évaluation préalable à la mise en marché des aliments dérivés de retransformants
Ce document remplace les Lignes directrices sur l'évaluation de l'innocuité des aliments nouveaux (Volumes I et II) originellement publiées en septembre de 1994.
1. Introduction
1.1 Contexte
La mondialisation de l'approvisionnement alimentaire, la demande pour un accroissement mondial des sources de nourriture et les progrès rapides dans le domaine de la science et des technologies de l'alimentation ont entraîné l'introduction d'aliments qui n'étaient pas offerts auparavant sur le marché canadien. Les aliments entiers et les ingrédients alimentaires nouveaux peuvent être introduits au Canada par l'importation de nouveaux produits, l'introduction d'une nouvelle espèce comme source de nourriture, l'utilisation de nouvelles techniques de transformation ou des changements dans la constitution génétique des micro-organismes, des végétaux et des animaux desquels les aliments sont dérivés.
Les progrès réalisés dans le domaine de la technologie des transports et la diminution des coûts associés au transport ont accru la diversité des aliments et des produits alimentaires importés au Canada. Les habitudes alimentaires changeantes des consommateurs, dictées par une exposition à différentes traditions culturelles et ethniques et par des préoccupations liées à la nutrition et à la santé, ont également eu pour conséquence la diversification de notre approvisionnement alimentaire. De plus, l'accroissement de la population mondiale continue d'entraîner l'introduction de nouvelles sources mondiales de nourriture. Il existe des aliments non traditionnels au Canada qui sont consommés à grande échelle dans d'autres parties du monde. Dans les cas où ces aliments entraînent des effets indésirables, ceux-ci sont associés à la consommation de ces aliments ou aux méthodes traditionnelles utilisées pour les apprêter avant de les consommer. Il est nécessaire d'évaluer l'innocuité des aliments dérivés de sources n'ayant jamais été utilisées pour la consommation humaine, puisqu'ils peuvent contenir des toxines, des contaminants et des facteurs antinutritionnels. Les conclusions tirées de ces évaluations permettent de prendre des mesures adéquates de gestion du risque.
On continue de mettre au point de nouvelles techniques de conservation et de transformation des aliments en vue d'accroître la durée de conservation des aliments et des produits alimentaires, de réduire l'énergie nécessaire à leur traitement, ainsi qu'à bien d'autres fins. Étant donné que le processus de transformation peut modifier les caractéristiques d'un aliment, y compris les caractéristiques nutritionnelles et toute caractéristique toxicologique, il est essentiel d'étudier les répercussions des nouvelles techniques de transformation sur la santé de l'homme.
Les modifications génétiques visant à améliorer les caractéristiques des micro-organismes, des végétaux et des animaux, sur les plans de la culture, de la production, de la transformation et de la valeur nutritive peuvent se faire à l'aide de techniques traditionnelles de sélection ou de technologies nouvelles de génie génétique, dont l'application n'entraînerait pas de réduction ni d'augmentation du risque intrinsèque associé à la consommation de l'organisme en tant qu'aliment. Toutefois, le large éventail de modifications que permettent ces techniques de manipulation génétique, de même que le risque d'introduction de composés toxiques, d'effets secondaires et de changements inattendus dans les caractéristiques nutritionnelles et toxicologiques des aliments, pourrait soulever des inquiétudes en ce qui concerne l'innocuité.
La responsabilité fédérale en ce qui concerne la réglementation des aliments vendus au Canada, y compris les aliments nouveaux, est partagée entre Santé Canada (SC) et l'Agence canadienne d'inspection des aliments (ACIA). Santé Canada est responsable de l'établissement de normes et de politiques régissant l'innocuité et la qualité nutritionnelle des aliments et d'élaborer des politiques d'étiquetage qui tiennent compte de la santé et de la nutrition. L'ACIA élabore des normes visant la publicité sur les aliments ainsi que le conditionnement et l'étiquetage de ceux-ci et assume toutes les fonctions liées à l'inspection et à l'application des règlements. L'ACIA est également responsable de la réglementation des semences, des produits biologiques vétérinaires, des engrais et des aliments du bétail. Plus précisément, l'ACIA est responsable des règlements et des lignes directrices qui visent la culture de végétaux à caractères nouveaux et les aliments du bétail ainsi que des évaluations de l'innocuité connexes, alors que Santé Canada est responsable de la réglementation et des lignes directrices touchant les aliments nouveaux de même que des évaluations d'innocuité concernant les aliments nouveaux.
Le mécanisme selon lequel Santé Canada contrôle la vente d'aliments nouveaux au Canada est l'avis avant la vente obligatoire, conformément au Titre 28 de l'article B du Règlement sur les aliments et drogues (voir figure 1). Les fabricants ou les importateurs sont tenus, en vertu de ce Règlement, de soumettre toute information à Santé Canada concernant le produit en question, de façon que l'on puisse déterminer l'innocuité du produit avant sa vente.
Les critères d'innocuité servant à l'évaluation d'aliments nouveaux, décrits brièvement dans le présent document, ont été dérivés de principes scientifiques internationalement reconnus, élaborés par l'Organisation de coopération et de développement économiques (OCDE), par l'Organisation des Nations Unies pour l'alimentation et l'agriculture (FAO), par l'Organisation mondiale de la Santé (OMS) et par la Commission du Codex Alimentarius. Ces lignes directrices offrent la souplesse et la rigueur requises permettant de confirmer le besoin d'émettre un avis et de procéder à une évaluation de l'innocuité concernant l'éventail de produits alimentaires en développement. Cette souplesse est essentielle à l'évaluation au cas par cas des aliments et des produits alimentaires nouveaux, de même qu'à la mise à l'étude des éventuels progrès scientifiques.
1.2 Objectif
Ces lignes directrices visent à aider le demandeur dans la préparation d'un préavis de vente visant les aliments nouveaux et à s'assurer que les renseignements suffisent pour permettre une évaluation de l'innocuité. Les évaluations de l'innocuité des aliments nouveaux sont menées par la Direction des aliments, Direction générale des produits de santé et des aliments, de Santé Canada. La Direction des aliments est l'autorité fédérale en matière de santé chargée d'établir des politiques et des normes et de fournir des conseils et des renseignements sur l'innocuité et la valeur nutritionnelle des aliments.
Ces lignes directrices n'ont pas pour objet de déterminer explicitement toutes les données qui peuvent être requises au cours d'une évaluation de l'innocuité. Des données additionnelles peuvent être relevées, au cas par cas, pendant le processus d'évaluation de l'innocuité.
1.3 Portée
Ce document traite de tous les aliments nouveaux, qu'il s'agisse d'aliments entiers, de produits alimentaires ou d'ingrédients alimentaires, d'origine végétale ou microbienne. Les critères d'évaluation de l'innocuité des aliments nouveaux dérivés d'animaux sont présentement en cours d'élaboration. Les fabricants et les importateurs d'aliments nouveaux dérivés de source animale doivent consulter la Direction des aliments pour discuter des renseignements qui conviennent à l'évaluation de l'innocuité d'un produit en particulier.
Le Titre B.28.001 du Règlement sur les aliments et drogues donne une définition des termes « aliments nouveaux », « changement majeur » et « modifié génétiquement ». Veuillez consulter la figure 1.
Figure 1. Titre 28 de la Partie B du Règlement sur les aliments et drogues
Aliments nouveaux
Interprétation
B.28.001. Les définitions qui suivent s'appliquent au présent titre.
« modifier génétiquement » Manipuler intentionnellement les caractères héréditaires d'un végétal, d'un animal ou d'un micro-organisme. (genetically modify)
« changement majeur » Changement apporté à un aliment à la suite duquel, selon l'expérience du fabricant ou la théorie généralement admise dans le domaine des sciences de la nutrition et de l'alimentation, les propriétés de celui-ci se situent en dehors des variations naturelles acceptables de l'aliment en ce qui a trait à l'un ou l'autre des éléments suivants :
- la composition, la structure, la qualité nutritive ou les effets physiologiques généralement reconnus de l'aliment;
- la manière dont l'aliment est métabolisé par le corps humain;
- l'innocuité générale, microbiologique ou chimique de l'aliment. (major change)
« aliment nouveau » signifie, selon le cas,- substance, y compris un micro-organisme, qui ne présente pas d'antécédents d'innocuité comme aliment;
- aliment qui a été fabriqué, préparé, conservé ou emballé au moyen d'un procédé qui :
- n'a pas été appliqué auparavant à l'aliment,
- fait subir à l'aliment un changement majeur;
- aliment dérivé d'un végétal, d'un animal ou d'un micro-organisme qui, ayant été modifié génétiquement, selon le cas :
- présente des caractères qui n'avaient pas été observés auparavant,
- ne présente plus des caractères qui avaient été observés auparavant,
- présente un ou plusieurs caractères qui ne se trouvent plus dans les limites prévues pour ce végétal, cet animal ou ce micro-organisme. (novel food)
Avis avant la vente
B.28.002. (1) Il est interdit de vendre ou d'annoncer en vue de la vente un aliment nouveau à moins que le fabricant ou l'importateur
- n'ait donné au Directeur un avis écrit de son intention de vendre l'aliment nouveau ou de l'annoncer en vue de la vente;
- n'ait reçu du Directeur l'avis visé à l'alinéa B.28.003(1)(a) ou au paragraphe B.28.003(2), selon le cas.
(2) L'avis visé à l'alinéa (1)a) est signé par le fabricant ou l'importateur, ou une personne autorisée à signer en son nom, et contient les renseignements suivants
- le nom commun sous lequel l'aliment nouveau sera vendu;
- les nom et adresse du principal établissement du fabricant et, si l'adresse est à l'étranger, les nom et adresse du principal établissement de l'importateur;
- la description de l'aliment nouveau, accompagnée :
- des renseignements sur son élaboration,
- des renseignements détaillés sur son mode de fabrication, de préparation, de conservation, d'emballage et d'emmagasinage,
- de la description du changement majeur, le cas échéant,
- des renseignements sur son utilisation proposée et son mode de préparation,
- le cas échéant, des renseignements sur l'historique de son utilisation comme aliment dans un pays autre que le Canada,
- de renseignements permettant d'établir son innocuité;
- des renseignements sur les niveaux de consommation estimatifs chez les consommateurs de l'aliment nouveau;
- le texte des étiquettes qui seront utilisées avec l'aliment nouveau;
- les nom et titre du signataire de l'avis et la date de la signature.
B.28.003. (1) Dans les 45 cinq jours suivant la réception de l'avis visé à l'alinéa B.28.002(1)a), le Directeur examine les renseignements contenus dans l'avis et :
- si les renseignements établissent l'innocuité de l'aliment nouveau, il avise par écrit le fabricant ou l'importateur que ces renseignements sont suffisants;
- si d'autres renseignements sont nécessaires sur le plan scientifique afin d'évaluer l'innocuité de l'aliment nouveau, il demande par écrit au fabricant ou à l'importateur de les lui fournir.
(2) Dans les 90 jours suivant la réception des renseignements additionnels visés à l'alinéa (1)b), le Directeur les évalue et, s'ils établissent l'innocuité de l'aliment nouveau, il avise par écrit le fabricant ou l'importateur que ces renseignements sont suffisants.
2. Procédure de préavis
2.1 Soumission d'un préavis de vente visant les aliments nouveaux
Le Titre 28 de la section B du Règlement sur les aliments et drogues exige d'un fabricant ou d'un importateur qu'il avise par écrit la Direction des aliments de son intention de vendre ou de faire la publicité en vue de vendre un aliment nouveau. Il est important de prendre note que, conformément au paragraphe B.28.002(1), il est interdit de vendre ou d'annoncer en vue de la vente un aliment nouveau à moins que le fabricant ou l'importateur :
- n'ait donné au Directeur un avis écrit de son intention de vendre l'aliment nouveau ou de l'annoncer en vue de la vente;
- n'ait reçu une lettre d'attestation de non objection à la vente de l'aliment nouveau au Canada, conformément à l'alinéa B.28.002(1)b).
On recommande aux fabricants et aux importateurs de consulter la Direction des aliments s'ils ne sont pas certains qu'un produit est un aliment nouveau, ou s'ils désirent discuter des exigences en matière de données spécifiques à un aliment nouveau. Cette façon de faire permettra de déterminer si un avis est nécessaire et, le cas échéant, la façon d'utiliser les présentes lignes directrices pour élaborer un ensemble de données en vue de l'évaluation de l'innocuité.
Pour plus d'informations concernant les demandes de consultation préalable à une soumission auprès de la Direction des aliments, veuillez consulter les Directives concernant les consultations préparatoires - Demandes d'autorisation obligatoires avant la mise en marché à l'intention de la Direction des aliments.
L'avis doit comprendre les renseignements mentionnés au paragraphe B.28.002 (2), comme l'indique la figure 1 et tel qu'il est indiqué de nouveau ci-dessous :
L'avis visé à l'alinéa (1)a) est signé par le fabricant ou l'importateur, ou une personne autorisée à signer en son nom, et contient les renseignements suivants
- le nom commun sous lequel l'aliment nouveau sera vendu;
- les nom et adresse du principal établissement du fabricant et, si l'adresse est à l'étranger, les nom et adresse du principal établissement de l'importateur;
- la description de l'aliment nouveau, accompagnée :
- des renseignements sur son élaboration,
- des renseignements détaillés sur son mode de fabrication, de préparation, de conservation, d'emballage et d'emmagasinage,
- de la description du changement majeur, le cas échéant,
- des renseignements sur son utilisation proposée et son mode de préparation,
- le cas échéant, des renseignements sur l'historique de son utilisation comme aliment dans un pays autre que le Canada,
- de renseignements permettant d'établir son innocuité;
- les renseignements sur les niveaux estimés de consommation chez les consommateurs de l'aliment nouveau;
- le texte qui sera imprimé sur les étiquettes accompagnant l'aliment nouveau;
- les nom et titre du signataire de l'avis et de la date de la signature.
L'avis doit être envoyé par voie électronique au moyen du Formulaire d'application pour la préparation des demandes à soumettre à la Direction des aliments (formulaire de demande en ligne). Il est recommandé que l'avis fournisse les renseignements dans l'ordre des paragraphes a) à f) du paragraphe B.28.002 (2). Dès réception de l'avis, un numéro de cas est attribué et l'ensemble de données est vérifié dans les 10 jours civils. Sur vérification satisfaisante de la notification, un accusé de réception portant le numéro de cas sera envoyé au demandeur. Ce numéro doit être employé dans toute la correspondance ultérieure.
Le Titre B.28.003 prévoit deux étapes d'avis et d'examen. Il y a d'abord une période de 45 jours où les avis sont examinés afin de déterminer si les renseignements fournis permettent de conclure que les aliments sont sûrs et d'informer les demandeurs dans l'éventualité où d'autres renseignements seraient nécessaires pour assurer une évaluation adéquate du produit. L'avis sera examiné et le demandeur sera informé par écrit qu'il n'y a aucune objection à la vente de l'aliment nouveau aux fins de consommation ou que des données scientifiques supplémentaires doivent être soumises afin d'évaluer l'innocuité de l'aliment nouveau. Si d'autres renseignements sont nécessaires, une période de 90 jours, suivant réception des renseignements demandés, est prévue au paragraphe B.28.003 (2) pour évaluer les renseignements (voir la section 2.2 ci-dessous).
2.2 Soumission d'un ensemble de données en vue de l'évaluation de l'innocuité
Si l'on juge que l'information fournie dans le préavis de vente visant les aliments nouveaux ne suffit pas pour évaluer l'innocuité de l'aliment nouveau, des données supplémentaires corroborant l'innocuité de l'aliment seront requises. Le type de renseignements nécessaires pour procéder à l'évaluation de l'innocuité d'un aliment nouveau dépend d'un grand nombre de facteurs, comme la nature de l'aliment, les méthodes de transformation utilisées et l'usage auquel l'aliment est destiné. Les démarches adoptées pour évaluer l'innocuité d'un aliment nouveau sont exposées dans ces lignes directrices. Cependant, le type d'études que l'on juge pertinentes au moment de démontrer l'innocuité d'un aliment nouveau varie selon l'évolution des connaissances et des progrès scientifiques. Les présentes lignes directrices doivent être utilisées parallèlement à l'information fournie dans la littérature scientifique et obtenue grâce aux efforts de recherche et de développement déployés par le fabricant.
Puisque les aliments nouveaux consistent en une gamme de produits diversifiés, ce ne sont pas toutes les données présentées dans ce document qui conviendront à toutes les demandes de mise en marché. Les demandeurs devraient tenir compte des nouvelles caractéristiques du produit pour lequel ils présentent une demande au moment d'examiner les critères de ces lignes directrices. Il est recommandé de consulter la Direction des aliments pendant la phase de développement du produit afin de déterminer les données spécifiques requises pour démontrer l'innocuité du produit. Les renseignements permettant de déterminer l'innocuité d'un aliment nouveau peuvent consister en des données expérimentales ou en des fondements scientifiques solides.
Pour accroître l'efficacité du processus d'examen, les demandeurs doivent préparer leurs ensembles de données en vue de l'évaluation de l'innocuité en utilisant les en-têtes suivants, au besoin :
- Antécédent d'utilisation
- Exposition alimentaire
- Détails du procédé nouveau
- Historique de l'organisme
- Caractérisation de la lignée/souche dérivée
- Considérations liées à la modification génétique
- Examens nutritionnels
- Examens toxicologiques
- Examens relatifs à l'allergénicité
- Examens chimiques
- Examens microbiologiques
Il est important de consulter les lignes directrices pour déterminer ce qu'il faut inclure sous chaque en-tête. Les détails relatifs au procédé et aux échéanciers de l'examen et de l'avis au demandeur sont donnés à la section 2.5.
2.3 Moment de présentation de la demande
L'avis écrit doit être soumis le plus tôt possible avant la période où le fabricant a l'intention de commercialiser son produit. La Direction des aliments est dans l'obligation de statuer, à l'intérieur d'un délai de 45 jours de la réception de l'avis, sur l'innocuité de l'aliment nouveau ou sur la nécessité de présenter des renseignements supplémentaires pour l'évaluation.
2.4 Comment soumettre une demande
La Section des aliments nouveaux a été mise sur pied au sein de la Direction des aliments pour coordonner l'évaluation de l'innocuité des aliments nouveaux prévus pour la consommation humaine au Canada. Les avis et les dossiers d'évaluation de l'innocuité doivent être transmis par voie électronique au moyen du formulaire de demande en ligne.
Les renseignements supplémentaires demandés (p. ex., les réponses aux demandes d'informations ou aux lacunes) doivent être transmis par voie électronique au moyen du Formulaire pour soumettre des documents additionnels à Santé Canada (formulaire pour soumettre des documents additionnels).
2.5 Procédure opérationnelle standard
En tant que bureau de coordination, la Section des aliments nouveaux de la Direction des aliments est responsable de communiquer avec les demandeurs, de recevoir les préavis visant les aliments nouveaux et les soumissions de renseignements supplémentaires demandés aux fins d'évaluation, et d'amorcer le processus d'examen présenté plus en détail à la figure 2. Cette méthode offre donc un guichet unique pour l'examen des demandes. La Section des aliments nouveaux remet les documents liés aux demandes au bureau de la Direction des aliments concerné, à savoir le Bureau d'innocuité des produits chimiques en ce qui concerne l'évaluation des examens chimiques et toxicologiques, le Bureau des sciences de la nutrition en ce qui a trait aux examens nutritionnels et le Bureau des dangers microbiens en ce qui touche les aspects liés aux micro-organismes et à la biologie moléculaire. Dans certains cas, lorsque l'ACIA ne procède pas à l'examen des effets environnementaux en vertu de la Loi relative aux aliments du bétail ou de la Loi sur les semences, l'Unité d'évaluation environnementale, Direction générale de la santé environnementale et de la sécurité des consommateurs de Santé Canada, se verra assignée par la Direction des aliments la responsabilité de mener une évaluation environnementale des aliments nouveaux, conformément à la Loi canadienne sur la protection de l'environnement, 1999 (LCPE) (voir la section 3.1 de ces lignes directrices pour obtenir d'autres renseignements).
Pendant l'évaluation, une analyse approfondie des données soumises et des protocoles utilisés est réalisée en vue d'obtenir les données nécessaires pour assurer la validité des résultats. Si un évaluateur détermine que les données ne suffisent pas, que la demande n'est pas claire ou qu'elle est incomplète, d'autres renseignements, des précisions ou des tests seront demandés afin d'évaluer l'innocuité de l'aliment nouveau. De plus, les évaluateurs tiennent compte des données publiées au Canada ou à l'échelle internationale se rapportant au produit en question.
En vertu du Règlement, un préavis de vente visant les aliments nouveaux doit comprendre des renseignements spécifiques décrits au paragraphe B.28.002(2), y compris des détails concernant tout changement important au sujet de l'aliment, les renseignements relatifs à ses utilisations prévues et les directives concernant sa préparation, de même que le texte affiché sur toutes les étiquettes à utiliser en lien avec l'aliment nouveau. Les demandeurs qui désirent faire la promotion d'une caractéristique de l'aliment nouveau sur une étiquette ou dans une publicité doivent savoir que de telles représentations ou allégations doivent faire l'objet d'un autre examen, distinct de l'évaluation de l'innocuité de l'aliment nouveau. Bien que l'alinéa B.28.002(2) exige des fabricants, au moment de déposer un préavis de vente visant les aliments nouveaux, qu'ils informent la Direction des aliments des utilisations prévues du produit et des détails relatifs aux changements importants, le cas échéant, et qu'ils fournissent le texte qui apparaîtra sur toutes les étiquettes à utiliser en lien avec l'aliment nouveau, cela ne constitue pas une demande d'examen ni l'approbation d'une demande. Actuellement le Règlement sur les aliments et drogues permet seulement certaines allégations liées à la santé et à la nutrition concernant les aliments, c'est-à-dire celles mentionnées au Titre B.01.311 (allégations relatives au rôle biologique), les tableaux suivant le Titre B.01.513 (allégations relatives à la teneur en éléments nutritifs) et le Titre B.01.603 (allégations relatives à la santé).
Si un demandeur envisage une allégation, quelle qu'elle soit, on recommande de le mentionner avant, ou au moment de présenter le préavis de vente visant les aliments nouveaux. Le demandeur doit savoir que les allégations relatives à la santé qui ne figurent pas actuellement dans le tableau du Titre B.01.603 nécessitent que des données pertinentes soient fournies en vue de l'examen et que le Règlement soit modifié pour en permettre l'utilisation. Cet intérêt pour une allégation sera transmis au bureau concerné, aux fins d'étude. Pour obtenir d'autres renseignements importants sur les questions réglementaires touchant les allégations relatives à la santé et les aliments nouveaux, le demandeur doit également consulter les sections portant sur les effets nutritionnels non intentionnels, sous l'intitulé Examens nutritionnels de la section des présentes lignes directrices portant sur le type d'aliment nouveau qui le concerne (voir la figure 3).
Le Titre B.28.003 prévoit deux étapes pour le préavis de vente et d'évaluation. Une période de 45 jours permettant d'évaluer les préavis de vente et une autre période de 90 jours si d'autres renseignements s'avèrent nécessaires pour évaluer l'aliment nouveau. La période de 45 jours permet à la Direction des aliments de revoir les renseignements soumis et de déterminer si ces renseignements permettent de conclure que l'aliment est propre à la consommation humaine. Pendant cette période, la Direction peut informer le demandeur que d'autres renseignements sont nécessaires pour examiner le produit de manière adéquate. Si l'on informe le demandeur que des données supplémentaires sont nécessaires, la Direction des aliments doit conclure l'examen des données soumises dans les 90 jours suivant réception de ces renseignements, à condition d'avoir obtenu un ensemble de données complet qui comprend toute l'information nécessaire pour en arriver à une conclusion.
Au terme de l'évaluation de l'innocuité, si et seulement si il n'y a aucune autre préoccupation non résolue concernant tout aspect de l'évaluation de l'innocuité et si l'on a conclu qu'il n'existe aucun risque pour la santé associé à la consommation de l'aliment nouveau en question, un document proposant que l'aliment puisse être vendu est élaboré. Cette proposition, qui contient un résumé des examens scientifiques menés par les bureaux concernés de la Direction des aliments, est présentée au Comité des décisions sur les aliments aux fins d'examen. Ce comité est présidé par le directeur général de la Direction des aliments et est composé de hauts dirigeants de la Direction des aliments et de représentants de l'Agence canadienne d'inspection des aliments. Si la proposition de décision sur les aliments est jugée acceptable par le comité, le demandeur est avisé par écrit que, selon l'évaluation des données soumises, Santé Canada ne s'oppose pas à la vente de l'aliment nouveau pour l'alimentation humaine au Canada, tel que présenté dans l'avis.
Dans l'éventualité où les examens scientifiques menés par les bureaux mènent à une conclusion voulant que le produit ne puisse pas être considéré comme étant sûr pour la consommation en tant qu'aliment, cette conclusion doit également être présentée devant le Comité des décisions sur les aliments. De plus, lorsque les entreprises ne sont pas en mesure de fournir les données requises pour prouver l'innocuité d'un produit, elles peuvent choisir de retirer leur demande.
À la lumière de l'intérêt généralisé pour les aliments nouveaux et, particulièrement, ceux produits à l'aide de techniques liées à la biotechnologie, la Direction des aliments est d'avis que des mécanismes visant à informer le public de tels nouveaux produits sont nécessaires. L'un de ces mécanismes suppose le recours à un document portant sur une décision relative à un aliment nouveau. Pour demeurer transparent, tout en respectant la nature confidentielle des renseignements présentés dans une demande, un document sommaire général est élaboré, décrivant le produit et résumant les renseignements recueillis permettant d'en démontrer l'innocuité. Ce résumé est préparé conformément aux sections pertinentes des présentes lignes directrices (c.-à-d. Développement et production, Renseignements sur le produit, Exposition alimentaire, Examens nutritionnels et Examens toxicologiques). Le fabricant ou l'importateur a l'occasion de revoir ce document et de le commenter. Le document portant sur la décision relative à l'aliment nouveau est ensuite affiché sur la page portant sur les aliments nouveaux du site Web de Santé Canada concernant tous les produits pour lesquels Santé Canada a émis une lettre d'acceptation quant à l'utilisation de l'aliment au Canada.
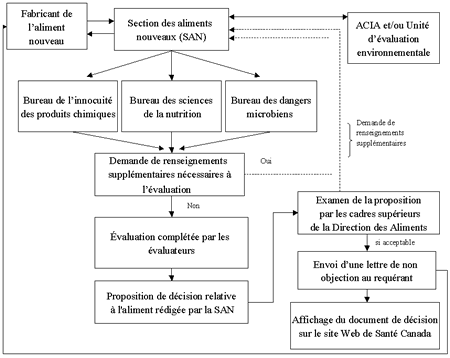
Figure 2 - Équivalent textuel
En tant que bureau de coordination, la Section des aliments nouveaux de la Direction des aliments est responsable de communiquer avec les demandeurs, de recevoir les préavis visant les aliments nouveaux et les documents liés aux demandes, et d'amorcer le processus d'examen.
La Section des aliments nouveaux remet les documents liés aux demandes au bureau de la Direction des aliments concerné, à savoir le Bureau d'innocuité des produits chimiques, le Bureau des sciences de la nutrition et le Bureau des dangers microbiens qui procéderont à leur évaluation respective de l'aliment nouveau.
Des évaluateurs examineront les documents liés à la demande visant l'aliment nouveau et détermineront si oui ou non le produit est considéré comme nouveau en vertu de l'article B.28.001 du Règlement sur les aliments nouveaux. Si l'aliment est considéré comme nouveau, on procédera alors à une évaluation de son innocuité comme indiqué dans les Lignes directrices sur l'évaluation de l'innocuité des aliments nouveaux. Les évaluateurs pourront demander des renseignements additionnels si les données pertinentes n'ont pas été incluses dans les documents originaux accompagnant le préavis ou la demande.
Tout aliment nouveau doit aussi faire l'objet d'une évaluation environnementale. Si l'aliment nouveau est dérivé d'une plante génétiquement modifiée, l'Agence canadienne d'inspection des aliments se chargera de l'évaluation environnementale. Dans le cas de tous les autres aliments nouveaux, l'évaluation environnementale est effectuée par l'Unité d'évaluation environnementale de Santé Canada, si l'aliment nouveau est une substance nouvelle.
Une fois que l'évaluation de l'innocuité est effectuée, si et seulement si tous les membres de l'équipe d'évaluation s'accordent pour dire qu'aucun risque pour la santé n'est associé à la consommation du produit alimentaire nouveau à l'étude, un projet de proposition sera présenté au Comité des décisions sur les aliments. Si la proposition est acceptée par le Comité, le directeur général avise le demandeur par écrit que, sur la base de l'évaluation des documents présentés, Santé Canada ne s'oppose pas à la vente du produit alimentaire nouveau pour l'alimentation humaine au Canada, comme indiqué dans la lettre. Santé Canada publiera aussi un résumé de l'évaluation de l'innocuité et de la décision du comité sur le site Web de Santé Canada.
3. Autres considérations de nature réglementaire
3.1 Impact environnemental
Santé Canada est chargé de l'évaluation de l'innocuité des aliments nouveaux en vertu de la Loi sur les aliments et drogues et son Règlement. Cependant, la Loi et son Règlement ne prévoient pas actuellement l'évaluation de l'impact environnemental ni de l'évaluation de certains aspects touchant les effets indirects sur la santé humaine que pourrait avoir la fabrication ou l'importation d'un produit réglementé, comme un aliment nouveau.
Santé Canada est présentement à élaborer un cadre réglementaire d'évaluation environnementale concernant les produits régis en vertu de la Loi sur les aliments et drogues et son Règlement. Jusqu'à ce que ce cadre soit élaboré, les renseignements concernant les effets éventuels d'un aliment nouveau sur l'environnement et la santé humaine s'avèrent nécessaires, conformément au Règlement sur les renseignements concernant les substances nouvelles, en vertu de la Loi canadienne sur la protection de l'environnement (LCPE).
Le demandeur est tenu de s'assurer que l'aliment nouveau répond à toutes les exigences réglementaires qui s'appliquent, y compris celles visées à la LCPE. Un guide sur la déclaration de substances nouvelles pour les produits réglementés en vertu de la Loi sur les aliments et drogues est affiché sur le site Web de Santé Canada; il est également possible de l'obtenir sur demande au 1-888-492-1104. Si l'évaluation environnementale est jugée nécessaire, le demandeur est alors tenu de préparer une trousse d'information conforme aux exigences de la LCPE, qui sera examinée par l'Unité d'évaluation environnementale de la Direction générale de la santé environnementale et de la sécurité des consommateurs (DGSESC) (voir la figure 2).
Les substances qui ne figurent pas sur la Liste intérieure des substances (LIS) ou qui sont des substances déjà réglementées en vertu d'autres lois fédérales énumérées à l'annexe III de la LCPE, comme la Loi sur les semences et la Loi relative aux aliments du bétail, sont exemptées de l'exigence d'avis en vertu de la LCPE. Par exemple, si un aliment nouveau est dérivé d'un végétal pour lequel une application a été soumise à l'ACIA en vue d'une dissémination environnementale non confinée ou pour nourrir le bétail, cela doit être énoncé dans le préavis de vente visant les aliments nouveaux à Santé Canada car ces lois prévoient déjà des exigences en matière d'évaluation environnementale équivalentes à celles de la LCPE.
3.2 Végétaux à caractères nouveaux et aliments nouveaux du bétail
L'ACIA s'occupe de la réglementation des végétaux à caractères nouveaux qui seront cultivés au Canada. En vertu de la Loi sur les semences, les nouvelles variétés d'une espèce cultivée qui possèdent un caractère nouveau (c.-à-d., une nouvelle caractéristique) seront visées à la directive de réglementation Dir 94-08 (Directives relatives à l'évaluation des végétaux dotés de caractères nouveaux). Il est possible d'obtenir d'autres renseignements sur la réglementation des végétaux à caractères nouveaux (VCN) auprès du Bureau de la biosécurité végétale, au 613-225-2342, ou sur leur site Web.
En application de la Loi relative aux aliments du bétail, la Section des aliments du bétail de l'ACIA administre un programme national des aliments du bétail pour s'assurer que tous les aliments du bétail, y compris les aliments nouveaux du bétail, fabriqués, vendus ou importés au Canada sont sûrs, efficaces et correctement étiquetés. Les aliments nouveaux du bétail se composent d'organismes, ou d'éléments de produits qui en dérivent, qui n'ont pas été évalués ni approuvés pour utilisation comme aliments du bétail au Canada. Les aliments nouveaux de bétail peuvent provenir de végétaux, y compris de VCN pouvant être utilisés comme aliments du bétail, doivent être évalués par la Section des aliments du bétail avant d'être utilisés comme tels. On trouvera plus d'information sur la réglementation d'aliments nouveaux du bétail. Veuillez consulter les Directives relatives à évaluation de l'innocuité des aliments nouveaux du bétail d'origine végétale pour d'autres renseignements concernant la demande de mise en marché d'un aliment nouveau du bétail.
Les aliments de bétail constituent des débouchés pour les sous-produits et les résidus de l'industrie de transformation des aliments. Les sous-produits d'aliments dérivés de micro-organismes nouveaux doivent être évalués par la Section des aliments du bétail avant d'être intégrés à des produits alimentaires pour le bétail. On peut se procurer la version préliminaire des Directives relatives à l'évaluation de la salubrité des aliments nouveaux de bétail : produits microbiens auprès de la Section des aliments de bétail de l'ACIA.
Avant d'introduire un nouveau végétal sur le marché canadien, il est nécessaire de se demander si celui-ci serait classé comme un produit nouveau en vertu des dispositions réglementaires de la Loi relative aux aliments du bétail, de la Loi sur les aliments et drogues et de la Loi sur les semences. Afin de favoriser l'harmonisation, de réduire les délais inutiles et les décisions conflictuelles, l'ACIA et Santé Canada ont élaboré un processus officiel permettant de déterminer le caractère nouveau des nouvelles variétés de plantes, des aliments ou des aliments du bétail dérivés de ces plantes, tel que défini dans les dispositions réglementaires de ces lois.
Lorsqu'un demandeur communique avec la Section des aliments du bétail (ACIA), la Section des aliments nouveaux (Santé Canada), ou le Bureau de la biosécurité végétale (ACIA) pour obtenir un avis quant au caractère nouveau d'un végétal ainsi que des produits alimentaires et des aliments du bétail qui en sont dérivés, une rencontre est organisée entre les trois groupes afin d'étudier la situation, de façon à analyser les facteurs qui contribuent à son statut et qui permettent de guider une surveillance réglementaire appropriée. Lorsqu'une variété de végétaux est considérée comme un végétal à caractères nouveaux (VCN), les produits alimentaires et les aliments du bétail qui en sont dérivés sont généralement classés parmi les aliments nouveaux. Par ailleurs, dans certains cas, il est possible qu'une variété végétale ne soit pas considérée comme un VCN, mais que les caractéristiques des aliments du bétail et des produits alimentaires qui en sont dérivés amènent la Section des aliments du bétail et la Section des aliments nouveaux à conclure que ceux-ci sont nouveaux. Dans d'autres cas, un végétal est considéré comme un VCN par le Bureau de la biosécurité végétale s'il est nouveau dans l'environnement canadien, mais les aliments du bétail et les produits alimentaires qui en sont dérivés ne seraient pas considérés comme nouveaux puisqu'ils ont déjà des antécédents d'innocuité comme aliment sur le marché. En vue de répondre à une demande d'avis sur un produit nouveau de la part d'un demandeur, d'autres renseignements peuvent être exigés par les autorités administratives afin qu'elles puissent en arriver à une décision.
3.3 Coordination des décisions réglementaires concernant les aliments nouveaux et les aliments nouveaux du bétail et dérivés des végétaux à caractères nouveaux
Santé Canada et l'ACIA mènent des consultations interministérielles afin de coordonner leurs méthodes d'approbation de façon à éviter que des produits alimentaires non approuvés ne soient introduits sur le marché canadien. Cette approche se traduira en un processus officiel visant à assurer l'harmonisation de la prise de décisions relatives à l'utilisation de végétaux à caractères nouveaux comme aliments et aliments du bétail.
Si les produits sont exclusivement destinés à être utilisés comme aliments, aliments du bétail ou produits de l'agriculture moléculaire (utilisation des végétaux pour fabriquer des produits industriels ou thérapeutiques), les autorités administratives devront se consulter pour évaluer tout risque éventuel que pourrait causer la distribution de ces produits dans une filière à laquelle ils ne sont pas destinés. À cet égard, il sera donc essentiel de mettre en place un système de préservation de l'identité, ou un autre système visant le même objectif, afin de réduire au minimum la possibilité de causer de tels risques.
Veuillez prendre note qu'une fois les évaluations de l'innocuité terminées, Santé Canada et l'ACIA avisent par écrit le demandeur (deux lettres distinctes) quant à leur décision respective.
3.4 Nouveaux renseignements
Si la Direction des aliments établit qu'il n'y a pas d'objection à la vente d'un aliment nouveau destiné à la consommation humaine, celui-ci pourra être introduit sur le marché comme tout produit alimentaire habituel. Il sera alors soumis aux mêmes exigences réglementaires s'appliquant à tous les autres aliments vendus au Canada. L'entreprise demeurera toutefois responsable de veiller à ce que ses produits respectent tous les règlements et les lois qui s'y appliquent.
Vu la rapidité des progrès technologiques, on s'attend à découvrir à l'occasion de nouvelles données sur les produits approuvés. Toute information découverte après la mise en marché, et pouvant avoir des répercussions sur la santé et la sécurité, devra être transmise à Santé Canada aux fins d'examen, question de maintenir la sécurité et à l'innocuité des aliments nouveaux offerts sur le marché canadien. La vente d'un aliment qui pourrait nuire à la santé des consommateurs enfreint les dispositions de la Loi sur les aliments et drogues.
3.5 Surveillance après la mise en marché
Les aliments nouveaux ne peuvent pas être vendus s'il existe une preuve indiquant qu'ils ne conviennent pas à une consommation sûre. La surveillance après la mise en marché peut s'avérer une mesure appropriée de gestion du risque dans des cas particuliers. Une fois l'évaluation de l'innocuité terminée, c'est pendant la période d'évaluation des risques qu'il faut étudier au cas par cas la nécessité et l'utilité d'une surveillance après la mise en marché, et c'est pendant la période de gestion des risques que la possibilité de mise en œuvre d'une telle initiative de surveillance doit être envisagée.
4. Exigences en matière de renseignements concernant l'évaluation de l'innocuité
La méthode d'évaluation de l'innocuité des aliments nouveaux est basée sur l'évaluation de ces aliments en fonction des contreparties classiques ayant des antécédents d'innocuité comme aliment. Cette démarche permet d'examiner à la fois les effets intentionnels et non intentionnels involontaires. L'objectif consiste à relever les risques nouveaux ou modifiés par rapport à la contrepartie classique. Si un risque nouveau ou modifié, sur les plans nutritionnel ou de l'innocuité des aliments, est relevé au moment de l'évaluation de l'innocuité, il sera évalué dans le but de déterminer sa pertinence pour la santé de l'homme. S'il n'existe pas d'équivalent reconnu permettant d'établir une comparaison, il faudra évaluer l'innocuité d'un aliment nouveau à partir des données tirées directement de l'historique ou des résultats d'expériences réalisées concernant cet aliment.
L'évaluation de l'innocuité des aliments nouveaux suit un processus progressif permettant d'aborder les facteurs pertinents, dont :
- Antécédent d'utilisation
- Exposition alimentaire
- Détails du processus nouveau (le cas échéant)
- Historique de l'organisme
- Caractérisation de la lignée/souche dérivée (le cas échéant)
- Examens des modifications génétiques (le cas échéant)
- Examens nutritionnels
- Examens toxicologiques
- Examens relatifs à l'allergénicité
- Examens chimiques
La quantité d'information requise pour l'évaluation va fluctuer énormément d'un cas à l'autre, étant donné le large éventail d'aliments potentiellement nouveaux et les nombreuses raisons pour lesquelles un aliment peut être considéré comme nouveau. Par conséquent, dans le but d'orienter les demandeurs, ce document soulignera les divers types de renseignements habituellement requis concernant certaines formes particulières d'aliments nouveaux. Toute l'information décrite peut ne pas s'appliquer à tous les cas. Les explications et les interprétations présentées dans ce document risquent de changer, au fur et à mesure que l'on développera d'autres connaissances et que l'on acquerra de l'expérience en ce qui concerne l'évaluation des données et des renseignements fournis dans les demandes de mise en marché d'aliments nouveaux.
Les expériences destinées à produire des données pour démontrer l'innocuité d'un aliment nouveau devront être conçues et menées en conformité avec des concepts et des principes scientifiques valables et, le cas échéant, en faisant usage de bonnes pratiques de laboratoire. Les autorités administratives doivent pouvoir accéder, sur demande, aux données primaires. Les données devront être obtenues grâce à des méthodes scientifiques valables et analysées selon des techniques statistiques pertinentes, selon le cas. La sensibilité de l'ensemble des méthodes analytiques doit être documentée et les références à ces méthodes doivent être fournies.
L'arbre de décision de la figure 3 vise à aider les demandeurs à réfléchir sur la question de savoir si leur produit est en réalité un aliment, s'il est possible qu'il soit autre chose qu'un aliment nouveau et, s'il s'agit d'un aliment nouveau, de déterminer quelles sections des lignes directrices conviennent le mieux aux diverses catégories d'aliments nouveaux (modification génétique, procédé nouveau et antécédents d'innocuité comme aliment) et de déterminer s'il s'agit d'un végétal, d'un micro-organisme ou s'il s'agit d'un animal (ce dernier est en cours d'élaboration). On encourage les demandeurs à consulter la Section des aliments nouveaux pour préciser les exigences à respecter en matière d'information concernant un aliment nouveau particulier, avant de présenter un avis ou une demande.
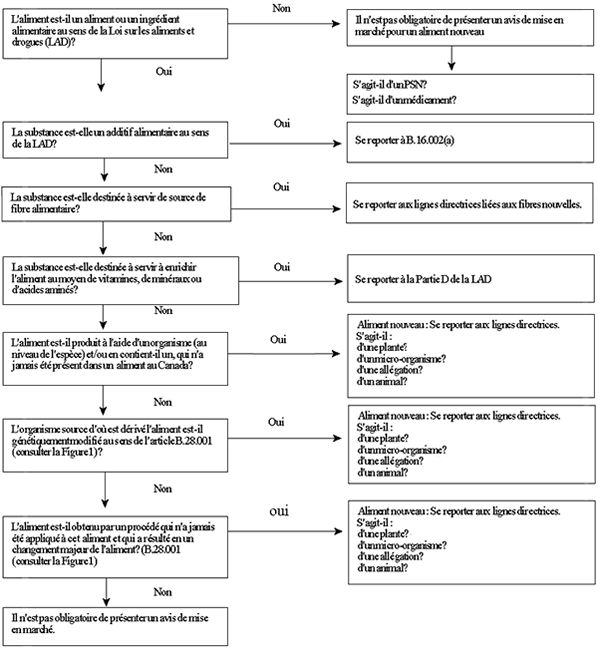
Figure 3 - Équivalent textuel
Lorsqu'un demandeur souhaite vendre un produit qui, selon lui, est régi en vertu de la Loi sur les aliments et drogues, il a la possibilité de répondre à la série de questions ci-dessous, ce qui lui permet de confirmer son hypothèse ou de déterminer le règlement en vertu duquel le produit en question est régi (s'il y a lieu).
La première question est la suivante : ce produit est-il un aliment ou un ingrédient alimentaire au sens de la Loi sur les aliments et drogues (LAD)? Si la réponse est non, un avis de mise en marché pour un aliment nouveau n'est pas requis en vertu de la partie B du Règlement sur les aliments et drogues. Cependant, un demandeur pourrait ensuite se demander si le produit est un médicament et s'il lui faut dès lors se reporter à la partie C du Règlement sur les aliments et drogues intitulée Drogues. Si le produit n'est pas un médicament, le demandeur pourrait alors se demander si son produit en est un de santé naturel et par conséquent, s'il est régi par le Règlement sur les produits de santé naturels.
Si la réponse est non, la troisième question à laquelle il doit répondre est la suivante : cet aliment ou cet ingrédient alimentaire tient-il lieu de source de fibres alimentaires? Si la réponse est oui, le demandeur doit se reporter aux lignes directrices sur les fibres nouvelles.
Si la réponse est non, la quatrième question à laquelle il doit répondre est la suivante : l'aliment ou l'ingrédient alimentaire est-il destiné à enrichir les aliments au moyen de vitamines, de minéraux ou d'acides aminés? Si la réponse est oui, le demandeur doit se reporter à la partie D du Règlement sur les aliments et drogues intitulé Vitamines, minéraux et acides aminés.
Si la réponse est non, la cinquième question à laquelle il doit répondre est la suivante : cet aliment ou cet ingrédient alimentaire est-il produit au moyen d'un organisme (sur le plan de l'espèce) n'ayant jamais été utilisé dans un aliment au Canada et/ou en contient-il? Si la réponse est oui, le demandeur doit se reporter aux Lignes directrices sur l'évaluation de l'innocuité des aliments nouveaux, et plus particulièrement aux sections 4.1.1 et 4.2.1 traitant respectivement des plantes et des microorganismes sans antécédents d'innocuité comme aliment.
Si la réponse est non, la sixième question à laquelle il doit répondre est la suivante : la source de l'organisme duquel l'aliment ou l'ingrédient alimentaire est dérivé est-elle modifiée génétiquement comme défini à l'article B.28.001 du Règlement sur les aliments et drogues? Si la réponse est oui, le demandeur doit se reporter aux Lignes directrices sur l'évaluation de l'innocuité des aliments nouveaux, et plus particulièrement aux sections 4.1.3 et 4.2.3 traitant respectivement des plantes et des microorganismes modifiés génétiquement.
Si la réponse est non, la septième question à laquelle il doit répondre est la suivante : l'aliment ou l'ingrédient alimentaire est-il le résultat d'un procédé qui n'a jamais été appliqué et qui a produit un changement majeur à celui-ci? Pour connaître la définition complète de l'expression changement majeur, il convient de consulter l'article B.28.001 du Règlement sur les aliments et drogues. Si la réponse est oui, le demandeur doit se reporter aux Lignes directrices sur l'évaluation de l'innocuité des aliments nouveaux, et plus particulièrement aux sections 4.1.2 et 4.2.2 traitant respectivement des procédés nouveaux appliqués à des plantes et à des microorganismes.
Enfin, si le demandeur a déterminé que son produit est un aliment ou un ingrédient alimentaire comme défini dans la Loi sur les aliments et drogues, mais a répondu non aux six autres questions, un avis de mise en marché d'un aliment nouveau n'est pas requis pour la vente de l'aliment ou de l'ingrédient alimentaire au Canada.
4.1 Aliments nouveaux dérivés de végétaux
Les végétaux peuvent être consommés comme aliments ou utilisés dans le but de produire des matières qui sont utilisés dans les aliments ou dans la transformation des aliments. Les aliments nouveaux peuvent être dérivés de végétaux qui n'ont pas d'antécédents d'innocuité comme aliment au Canada en tant que source de nourriture, peuvent être fabriqués à partir de nouveaux processus appliqués à des matières végétales, ou peuvent être produits à partir de végétaux génétiquement modifiés selon une variété de techniques.
On recommande d'inclure les renseignements suivants afin d'évaluer l'acceptabilité des aliments dérivés de végétaux qui sont nouveaux pour l'une ou plusieurs des raisons susmentionnées. Prendre note que tous les renseignements présentés ci-dessous ne s'appliquent pas nécessairement à tous les cas.
4.1.1 Substance sans antécédents d'innocuité comme aliment
- 4.1.1.1 Antécédent d'utilisation
- 4.1.1.2 Exposition alimentaire
- 4.1.1.3 Examens nutritionnels
- 4.1.1.4 Examens toxicologiques
- 4.1.1.5 Examens relatifs à l'allergénicité
- 4.1.1.6 Examens chimiques
4.1.2 Procédé nouveau
- 4.1.2.1 Détails du procédé nouveau
- 4.1.2.2 Exposition alimentaire
- 4.1.2.3 Historique de l'organisme
- 4.1.2.4 Examens nutritionnels
- 4.1.2.5 Examens toxicologiques
- 4.1.2.6 Examens relatifs à l'allergénicité
- 4.1.2.7 Examens chimiques
4.1.3 Modifications génétiques
- 4.1.3.1 Caractérisation de la souche dérivée
- 4.1.3.2 Considérations relatives aux modifications génétiques
- 4.1.3.3 Historique de l'organisme (hôte et donneur)
- 4.1.3.4 Exposition alimentaire
- 4.1.3.5 Examens nutritionnels
- 4.1.3.6 Examens toxicologiques
- 4.1.3.7 Examens relatifs à l'allergénicité
- 4.1.3.8 Examens chimiques
4.1.1 Substance sans antécédents d'innocuité comme aliment
L'évaluation de l'innocuité des aliments nouveaux de cette catégorie suit un processus progressif d'examen des facteurs pertinents, dont :
- 4.1.1.1 Antécédent d'utilisation
- 4.1.1.2 Exposition alimentaire
- 4.1.1.3 Examens nutritionnels
- 4.1.1.4 Examens toxicologiques
- 4.1.1.5 Examens relatifs à l'allergénicité
- 4.1.1.6 Examens chimiques
4.1.1.1 Antécédent d'utilisation
On peut considérer qu'une substance a un antécédent d'innocuité comme aliment lorsque, depuis bon nombre de générations, elle fait partie continue du régime d'une population humaine vaste et génétiquement diverse, où cette substance est consommée selon des méthodes et des niveaux auxquels on s'attend au Canada. Le fait qu'un produit a un antécédent d'utilisation dans le sens de cette définition, dans un territoire ayant un système alimentaire semblable, accroîtrait le niveau de confiance des preuves présentées. Les renseignements suivants seraient nécessaires pour appuyer l'allégation selon laquelle un produit a un antécédent d'innocuité comme aliment :
- Des preuves historiques indiquant une consommation continue et fréquente par une section transversale de la population pendant plusieurs générations. Ces preuves peuvent être tirées de diverses sources, y compris, sans toutefois s'y limiter, des articles scientifiques et des brevets, des publications non scientifiques ainsi que des livres, des livres de recettes, des ouvrages sur l'histoire de la culture de l'alimentation, des affidavits d'au moins deux autorités indépendantes et reconnues comprenant des récits bien documentés de la manière dont on utilise l'aliment en question et une explication de la façon dont ils ont pris connaissance de cet historique. Une utilisation limitée ou une exposition à court terme ne suffirait pas pour démontrer un antécédent d'innocuité comme aliment.
- Une déclaration de tout effet nocif éventuel lié à l'aliment en question, documenté dans son pays d'origine ou dans un pays où l'aliment est consommé en grande quantité.
- Une description des méthodes traditionnelles de traitement et de préparation commerciale et personnelle en vue de la consommation.
- Une description des méthodes de culture de l'aliment en question ou, s'il est à l'état sauvage, des méthodes de récolte.
- La quantité de l'aliment que les Canadiens consommeraient probablement, y compris les portions types et la fréquence prévue de consommation, selon des niveaux de consommation moyens et extrêmement élevés.
- Une analyse de la composition de l'aliment sur des échantillons choisis au hasard et statistiquement valides. Cette analyse devrait comprendre des données immédiates ainsi qu'un profil des acides aminés et des acides gras, sa composition en minéraux, en oligo-éléments et en vitamines ainsi que tout nutriment, facteur antinutritionnel et produit phytochimique bioactif soulevant un intérêt particulier concernant le produit en question. Cette analyse devrait particulièrement porter sur la présence, dans l'aliment, de composés qui pourraient avoir des retombées sur la santé des groupes de la population canadienne (comme les produits éventuellement toxiques ou allergènes, ou encore des niveaux particulièrement élevés de nutriments dans la source de nourriture ou le produit alimentaire final).
- Les effets sur le métabolisme et le système gastro-intestinal des humains.
Cette soumission doit contenir des données fiables et de qualité, ainsi que des sources de référence. L'évidence anecdotique aura moins de poids que les données scientifiques. L'information sur l'historique de l'exposition des humains est spécialement importante lorsqu'il s'agit d'un aliment nouveau qu'il faut préparer ou cuire de manière traditionnelle. Cette information doit être présentée aux consommateurs de façon uniforme.
4.1.1.2 Exposition alimentaire
Le rôle de l'évaluation de l'exposition alimentaire concernant les substances sans antécédent d'innocuité comme aliment consiste à estimer :
- la quantité de l'aliment qui risque d'être consommée et la fréquence de consommation, ainsi que le rôle que cet aliment pourrait jouer dans l'alimentation (p. ex., une source importante de protéines, un condiment, etc.);
- l'impact possible de cet aliment sur l'apport alimentaire des nutriments, en combinant le résultat des recherches réalisées au point a) aux renseignements sur la composition des nutriments que contient l'aliment;
- s'il est possible que des facteurs antinutritionnels, des toxines, des contaminants ou des substances nouvelles se trouvent dans l'aliment, l'exposition potentielle à ces substances.
L'introduction d'aliments sans antécédent d'innocuité comme aliment peut provoquer des conséquences nutritionnelles, toxicologiques ou allergènes qui pourraient avoir une incidence sur la salubrité des aliments; une évaluation de l'exposition aux composantes de cet aliment ayant d'importantes conséquences sur la santé doit être envisagée. En ce qui concerne ces aliments, l'évaluation de l'exposition alimentaire comporte des défis particuliers, puisque l'aliment ne constitue pas simplement un aliment existant auquel on a apporté des changements; il n'existe aucune expérience préalable de son rôle dans l'approvisionnement alimentaire sur laquelle il est possible de fonder des conclusions sur le plan de l'exposition. La méthode requise pour prévoir des modèles de consommation possibles nécessiterait probablement l'utilisation de données sur l'apport de produits de composition nutritionnelle semblable qui jouent un rôle similaire dans l'alimentation et qui sont consommés de manière routinière par les Canadiens. L'incidence de la sapidité des aliments et la façon dont on fera la promotion de ces aliments devront être évaluées. Une simulation d'exposition pourrait ensuite être effectuée en fonction des bases de données actuelles sur l'apport alimentaire, en utilisant de préférence des données obtenues chez des sujets canadiens, dans lesquelles l'aliment nouveau a été intégré en le substituant par un aliment ou par des aliments qui pourraient le remplacer dans l'alimentation. Ces estimations de l'apport alimentaire peuvent ensuite être utilisées pour calculer l'exposition alimentaire possible à des composantes spécifiques de l'aliment nouveau qui ferait l'objet de l'évaluation de l'innocuité.
Les résultats de l'évaluation de l'exposition doivent décrire les changements prévus de la distribution des microconstituants dans l'apport alimentaire en utilisant des mesures comme la moyenne, la variabilité et les percentiles (supérieur et inférieur) de l'apport. L'impact différentiel sur les sous-groupes de la population (p. ex., les enfants, les nourrissons, les personnes âgées, les groupes ethniques, les populations sensibles) doit être évalué, de même que l'impact sur la population dans son ensemble.
Bien que l'introduction d'un aliment complètement nouveau puisse changer les modèles de consommation alimentaire et, par conséquent, avoir une incidence plus large sur la nutrition et sur l'exposition aux autres composantes de l'alimentation qui peuvent être directement attribuées à l'aliment en soi, ces types de changement peuvent être impossibles à prévoir, et la nécessité de telles projections ou de suivi après la mise en marché, ou leur faisabilité, devra être évaluée au cas par cas. Des sondages périodiques sur la nutrition, réalisés auprès de la population, conviendraient probablement mieux pour définir les tendances alimentaires qui pourraient découler des aliments nouvellement introduits, des aliments devenus plus accessibles ou plus populaires, de même que de nombreux autres facteurs qui ont une incidence sur les régimes alimentaires au Canada et qui pourraient avoir un impact bénéfique ou nocif sur la santé (voir la section 3.4).
4.1.1.3 Examens nutritionnels
Observations générales
L'introduction d'un aliment nouveau dans l'approvisionnement alimentaire canadien est nécessite que l'on détermine la qualité nutritionnelle de l'aliment et les implications de ses caractéristiques nutritionnelles pour l'ensemble de la population ou pour des sous-groupes particuliers. Ces sous-groupes de la population peuvent être plus vulnérables pour différentes raisons, par exemple, les jeunes enfants, les femmes enceintes et les mères qui allaitent, les personnes ayant des caractéristiques métaboliques particulières, les adolescents et d'autres personnes qui peuvent consommer de grandes quantités d'aliments, ou les personnes âgées qui ne consomment que de petites quantités d'aliments. Une évaluation nutritionnelle, comprenant un examen des effets intentionnels et inattendus, est nécessaire dans le but de s'assurer que l'état nutritionnel des consommateurs ne risque pas d'être menacé par :
- la substitution d'aliments ou d'ingrédients alimentaires qui ont une valeur nutritionnelle considérable, par des variétés moins nutritives de ces aliments ou d'aliments semblables;
- l'ingestion excessive de nutriments ou d'autres substances bioactives du fait que l'aliment nouveau en contient des niveaux exceptionnellement élevés;
- des niveaux récents ou accrus de facteurs antinutritionnels qui pourraient affecter de façon négative la valeur nutritionnelle de l'aliment ou du régime alimentaire.
Qu'est-ce que la qualité nutritionnelle?
La qualité nutritionnelle, telle qu'appliquée aux aliments, est liée à la présence de nutriments essentiels et de substances énergétiques (en quantité et qualité adéquates) ainsi qu'à d'autres aspects des aliments traditionnellement considérés comme faisant partie de la science de la nutrition. Ces aspects comprennent les rôles nutritionnels des acides aminés non essentiels, des types spécifiques d'acides gras et d'hydrates de carbone, des fibres alimentaires, du cholestérol, des substances lipotropes, et d'autres composants d'aliments spécifiques (p. ex., le lait maternel), de la biodisponibilité et des interactions entre les nutriments et les autres nutriments, les additifs alimentaires et les substances toxiques naturelles. Ils incluent également les excès de nutriments et les effets (à la fois positifs et négatifs) de la transformation des aliments sur les nutriments et sur les propriétés organoleptiques des aliments. On a plus récemment démontré qu'une gamme étendue de substances « bioactives » trouvées principalement dans les végétaux avait peut-être un rôle à jouer dans l'amélioration ou la protection de la santé de l'homme. Ces rôles sont également compris dans la définition au sens large de la qualité nutritionnelle.
Aliments sans antécédent d'innocuité comme aliment
La principale préoccupation à l'égard des aliments sans antécédent d'innocuité comme aliment consisterait à vérifier s'il est possible que la consommation de ces aliments ait un effet nocif sur la santé nutritionnelle du consommateur. L'information sur la composition et la qualité nutritionnelles est principalement nécessaire pour déterminer de quelle manière les aliments peuvent être utilisés dans le régime alimentaire, pour déterminer les renseignements sur la composition de base de l'aliment à utiliser dans les banques de données sur la composition des aliments, et pour permettre la validation des allégations concernant la valeur nutritive et des déclarations de quantité.
Lignes directrices sur la production de données pour l'évaluation nutritionnelle
- Fonction des données à être soumises
- Les renseignements fournis sur un aliment sans antécédent d'innocuité comme aliment doivent être suffisants, sur le plan de la qualité comme de la quantité, pour déterminer son rôle dans le régime alimentaire et définir la composition nutritionnelle moyenne de l'aliment.
- Toutes les études visant à évaluer la qualité nutritionnelle doivent porter sur l'aliment tel qu'on prévoit l'utiliser pour la consommation humaine.
- Lorsque les données publiées sur la composition nutritionnelle d'un aliment nouveau ne sont pas suffisantes, le demandeur peut devoir obtenir des données analytiques. Dans ce cas, une hypothèse claire doit être formulée et accompagnée d'une méthodologie appropriée, afin d'obtenir des données sur la composition nutritionnelle qui permettront ce qui suit :
- Examiner toutes les sources importantes de variation possible dans la qualité nutritionnelle, par exemple la région géographique, la saison, le type et la fertilité du sol, la quantité de lumière du soleil, la température, la gestion des cultures, etc., au moment de concevoir l'étude, afin de veiller à ce que l'on maîtrise bien ces éléments.
- Exposer la plante nouvelle, au moment de la culture, aux conditions prévues pour la production commerciale.
- Repérer des parcelles d'expérimentation en plusieurs endroits où il est prévu de cultiver ou de récolter la plante. Idéalement, il faudrait que les conditions de culture de la plante, en vue de la cueillette de données, représentent différents lieux géographiques où la plante peut être cultivée ainsi que différentes années; il est préférable de ne pas s'appuyer sur des données provenant de plusieurs répétitions obtenues dans un champ donné au cours d'une seule année. S'assurer que l'échantillonnage se fait à l'étape opportune de maturité de la culture en question.
- Établir un plan d'échantillonnage avant le début de l'étude, fondé sur un calcul permettant d'utiliser au moins une ou plusieurs composantes, afin d'indiquer le nombre d'échantillons requis. Cela pourrait être fondé sur les analytes les plus importants ou les analytes que l'on prévoit être plus variables et nécessiter plus d'échantillons. Il faut fournir des détails concernant la puissance et la taille prévues de la méthodologie choisie pour le test statistique proposé ainsi que des vérifications d'hypothèses.
- S'assurer que les analyses pertinentes sont effectuées sur toutes les parties de la plante qui pourront être utilisées comme aliment au Canada. Il faut fournir des données sur la composition de l'aliment cru, c.-à-d. la partie comestible de la plante à l'état brut, ainsi sur la composition de l'aliment préparé en vue de la consommation humaine, selon les moyens recommandés ou prévus, afin d'examiner les effets, le cas échéant, de la transformation, de l'entreposage et de la cuisson.
- Établir les critères de sélection des nutriments analysés et justifier l'exclusion des analyses de tout nutriment et de toute autre substance figurant dans la section « Composition des nutriments » ci-dessous.
- S'assurer que les analyses de chaque composant, nutritif et non nutritif, sont effectuées sur tous les échantillons, par le même laboratoire, selon des méthodes d'analyse approuvées et validées à l'échelle internationale, et selon des procédures de conservation des échantillons et de préparation uniformes et appropriées, et ce, tout au long des analyses. Les échantillons utilisés dans le cadre de cette étude sont analysés dans un délai acceptable suivant la date de cueillette.
- Utiliser des méthodes statistiques pertinentes et uniformes, choisies à l'avance selon la conception de l'étude à analyser, et présenter les résultats.
-
Composition des nutriments
Les composants des aliments nouveaux présentés ci-dessous devraient être analysés dans le contexte des lignes directrices de l'étude susmentionnée. Même si les nutriments ne sont pas tous analysés, le demandeur devrait fournir les critères de sélection des nutriments analysés et indiquer les raisons pour lesquels certains nutriments ou d'autres substances figurant dans la liste suivante ont été exclus de l'analyse.
- la composition immédiate (p. ex., les cendres, l'humidité, les protéines, le gras, les fibres, les hydrates de carbone);
- le contenu en protéine vraie, en matière azotée non protéinée (p. ex., les acides nucléiques et les aminoglycosides), le profil en acides aminés - la quantité d'acides aminés inhabituels devrait être déterminée si on suspecte leur présence (p. ex., les acides aminés d'origine bactérienne);
- le profil complet des acides gras exprimé en tant que pourcentage total des acides gras, les composants non saponifiables, et les stérols - la liste des acides gras doit être regroupée selon les catégories monoinsaturé, polyinsaturé et saturé;
- la composition de la fraction des hydrates de carbone (p.ex., les sucres, les amidons, les chitines, les tanins, les polysaccharides non amylacés et les lignines);
- la composition des micronutriments (p. ex., l'analyse des vitamines et des minéraux importants);
- la présence de facteurs antinutritionnels naturels ou adventifs (p. ex., les phytates, les inhibiteurs de la trypsine, etc.);
- les métabolites secondaires prévisibles, les substances physiologiques actives (bioactives) et les autres substances décelées.
-
Biodisponibilité des nutriments / Présence de facteurs antinutritionnels
Dans les situations où un aliment qui n'a pas d'antécédents comme aliment peut devenir un important composant du régime alimentaire canadien, ou un fournisseur important de nutriments, des études sur les animaux devraient être effectuées afin d'évaluer le niveau de la valeur nutritionnelle. Ceci se rapporte en particulier à l'évaluation de la qualité des protéines, à la possibilité de facteurs antinutritionnels inconnus et à la question relative à la biodisponibilité des nutriments.
Le cas échéant, des renseignements devraient être fournis afin de décrire les conditions de transformation qui seraient utilisées dans la production de l'aliment nouveau et les effets de la transformation sur la concentration de nutriments et la biodisponibilité de ceux-ci.
- Renseignements à inclure dans la demande :
- le nom de la plante y compris les noms latin et usuel;
- une description complète du concept expérimental, des conditions expérimentales et de la façon dont les sources de variation des concentrations de nutriments ont été contrôlées;
- une description complète de la cueillette et de la préparation des échantillons;
- une présentation ou une description des méthodes statistiques et d'analyse qui ont été utilisées afin d'obtenir des données sur les composants nutritionnels et non nutritionnels;
- les nutriments et les données relatives exprimées sous forme de moyenne ± l'écart-type et sous forme d'étendue;
- les résultats de l'analyse statistique;
- les données brutes de tous les composants analysés, depuis tous les emplacements utilisés pour cultiver la plante;
- les données publiées, si elles sont accessibles;
- l'utilisation prévue au Canada de l'organisme en tant qu'aliment, par exemple le(s) type(s) d'ingrédients, le produit final possible, le niveau d'utilisation s'il est différent de celui des produits actuels qu'il remplacerait, les habitudes reconnues d'utilisation ainsi que la consommation de l'aliment et de ses dérivés;
- toute utilisation non prévue, envisageable.
- Processus de prise de décision
- Tous les aspects de la qualité nutritionnelle seront évalués et fondés sur les principes, les normes et les lignes directrices nutritionnelles de pointe visant à répondre aux besoins nutritionnels de l'homme. Les fondements de l'évaluation comprennent : les recommandations concernant l'apport nutritionnel, le rôle de l'aliment dans le régime alimentaire de la population et l'incidence du régime et de la nutrition sur la réduction des risques de développer une maladie liée au régime et sur la promotion de la santé.
- La première phase de l'évaluation nutritionnelle sera fondée sur les données relatives à la composition nutritionnelle et sur une évaluation des effets intentionnels et non intentionnels sur la composition nutritionnelle. Si l'on découvre des composants, des concentrations de nutriments ou des substances nutritives inhabituels ou inattendus, l'aliment peut alors être soumis à des analyses plus approfondies.
- Il n'est pas nécessaire qu'un aliment nouveau sans antécédent d'innocuité comme aliment satisfasse des critères spécifiques de qualité nutritionnelle. La principale préoccupation consiste à documenter la composition de l'aliment afin d'évaluer les allégations et de déterminer le rôle qu'il peut jouer dans le régime alimentaire.
4.1.1.4 Examens toxicologiques
Des tests toxicologiques sont nécessaires en ce qui concerne les substances pour lesquelles l'innocuité demeure inconnue et qui pourraient être introduites dans l'approvisionnement alimentaire. Dans le cas des aliments qui n'ont pas d'antécédent d'innocuité comme aliment, il est parfois difficile de cerner les composants qui sont nouveaux à la consommation humaine sans contrepartie classique.
Lorsqu'il n'est pas possible de cerner les composants nouveaux d'un aliment, il faut adopter une approche au cas par cas afin de déterminer les tests toxicologiques pertinents à mener sur chaque aliment. On étudiera aussi l'historique de l'organisme dont dérive l'aliment, en tant que source de toxines ou de facteurs antinutritionnels, et l'on effectuera une analyse chimique afin de déterminer le test toxicologique à administrer. À partir de ces conclusions, on pourra mener des analyses conventionnelles de toxicité, y compris des analyses de toxicité chronique, de toxicité développementale, de génotoxicité et d'action carcinogène, sur le produit alimentaire final ou sur ses composants, le cas échéant.
Soulignons qu'il est très difficile de mener des études sur les aliments entiers, car on risque de nuire à l'équilibre nutritionnel en incorporant l'aliment dans le régime en concentrations élevées. De plus, les études toxicologiques sur des aliments nouveaux servent à déterminer si la consommation ordinaire de l'aliment est sûre selon des modèles de consommation prévus, au lieu de dériver une limite quantitative comme une dose quotidienne acceptable, comme on le fait pour les produits chimiques simples tels les additifs alimentaires.
4.1.1.5 Examens relatifs à l'allergénicité
L'examen principal de l'évaluation de l'allergénicité d'un aliment nouveau a trait à la prévention d'une exposition inattendue et inévitable des personnes sensibles aux allergènes alimentaires. Dans le cas des aliments sans antécédents d'innocuité comme aliment, il est possible qu'une ou plusieurs protéines qui s'y trouvent puissent réagir avec des allergènes alimentaires reconnus ou conduisant à la création d'une nouvelle forme d'hypersensibilité. Soulignons cependant que la grande majorité des protéines consommées dans le régime alimentaire ne sont pas allergènes.
Pour le moment, on ne connaît pas de test qui puisse mesurer directement le potentiel allergène d'une protéine ou d'un aliment entier. Comme les stratégies existantes d'évaluation du potentiel allergène des protéines ont été élaborées en vue de l'évaluation de protéines individuelles bien définies (section 4.1.3.7), on ne peut pas les appliquer aisément à tout constituant protéique d'un aliment entier. Le constituant protéique des aliments qui n'ont pas d'antécédents d'innocuité comme aliment ne peut pas être caractérisé de manière à permettre l'application de ces stratégies d'évaluation.
Une stratégie préliminaire pour évaluer le potentiel allergène des aliments qui n'ont pas d'antécédents d'innocuité comme aliment serait d'examiner si les végétaux de la même famille taxonomique qui font ordinairement partie du régime alimentaire provoquent des réactions allergènes. Le lien entre une famille particulière de végétaux et des réactions allergènes n'empêcherait pas nécessairement l'introduction d'un aliment nouveau issu d'une espèce connexe sur le marché, mais il faudrait envisager des mesures de gestion du risque telles que la surveillance après la mise en marché et l'étiquetage pour l'identification de l'article alimentaire lorsque celle-ci n'est pas évidente. Les protéines issues d'une source allergène ne doivent pas être ajoutées aux aliments lorsque la préservation de l'identité ne peut être assurée.
4.1.1.6 Examens chimiques
Il faut signaler les contaminants chimiques trouvés dans un aliment qui n'a pas d'antécédents d'innocuité comme aliment, de même que la concentration de ces contaminants. Les niveaux de concentration et les types de contaminants éventuels seraient spécifiques à l'aliment nouveau. Il serait donc nécessaire de déterminer les niveaux de concentration et l'étendue des contaminants présents dans l'aliment. Dans la mesure du possible, on devrait comparer les niveaux de contaminants chimiques de l'aliment nouveau à ceux que l'on trouve habituellement dans des aliments semblables. Les métaux (p.ex., l'arsenic, le cadmium, le mercure et le plomb), les contaminants organiques, y compris les polluants organiques persistants, ou POP (p. ex., le DDT, l'aldrine, la dieldrine, etc.) et les contaminants naturels, y compris les mycotoxines (p. ex., l'aflatoxine, la vomitoxine, l'ochratoxine, la zéaralénone, etc.) sont des exemples de contaminants potentiels.
Tout additif alimentaire présent dans le produit alimentaire final (p. ex., les antiagglomérants, les solvants de support, les diluants solides, les colorants, les agents de conservation) ou les adjuvants de fabrication utilisés pendant la fabrication de l'aliment (p. ex., les adjuvants de précipitation et de filtration, etc.) doivent être définis et leur niveau spécifié.
Dans le cas des aliments nouveaux dont l'utilisation est prévue en tant qu'ingrédient dans d'autres aliments, les spécifications quant à l'identité et à la pureté doivent être fournies, et accompagnées d'un exemple d'étiquette et du mode d'emploi.
4.1.2 Procédé nouveau
Certains procédés appliqués aux aliments et aux ingrédients alimentaires peuvent entraîner la création d'aliments qui seraient considérés comme nouveaux par rapport à leurs contreparties traditionnelles. L'application de procédés nouveaux qui occasionnent des changements majeurs dans un aliment exige que Santé Canada soit avisé. Le terme « changement majeur » est défini au Titre 28 du Règlement comme un changement apporté à un aliment à la suite duquel, selon l'expérience du fabricant ou la théorie généralement admise dans le domaine des sciences de la nutrition et de l'alimentation, les propriétés de celui-ci se situent en dehors des variations naturelles acceptables de l'aliment en ce qui a trait à l'un ou l'autre des éléments suivants : la composition, la structure, la qualité nutritive ou les effets physiologiques généralement reconnus de l'aliment; la manière dont l'aliment est métabolisé par le corps humain; l'innocuité générale, microbiologique ou chimique de l'aliment. Voici quelques exemples de procédés nouveaux : de nouvelles techniques de traitement thermique, de nouvelles technologies d'emballage et l'utilisation de rayons ultraviolets afin de réduire la charge microbienne du produit.
L' évaluation de l'innocuité des aliments nouveaux de cette catégorie suit un processus progressif d'examen des facteurs pertinents, dont :
- 4.1.2.1 Détails du procédé nouveau
- 4.1.2.2 Exposition alimentaire
- 4.1.2.3 Historique de l'organisme
- 4.1.2.4 Examens nutritionnels
- 4.1.2.5 Examens toxicologiques
- 4.1.2.6 Examens relatifs à l'allergénicité
- 4.1.2.7 Examens chimiques
4.1.2.1 Détails du procédé nouveau
Alors que l'évaluation de l'innocuité est axée sur le produit alimentaire, un examen du procédé ou de la préparation du produit peut orienter cette évaluation. Toute technique de transformation ou de préparation nouvelle servant à produire un aliment nouveau devrait être décrite avec suffisamment de détails puisque de telles techniques peuvent soulever des préoccupations de nature microbiologique, toxicologique, allergène ou nutritionnelle.
4.1.2.2 Exposition alimentaire
Le rôle de l'évaluation de l'exposition alimentaire concernant les substances sans antécédent d'innocuité comme aliment consiste à estimer :
- la quantité de l'aliment qui risque d'être consommée et la fréquence de consommation, ainsi que le rôle que cet aliment pourrait jouer dans l'alimentation, s'ils diffèrent du rôle de l'aliment non transformé ou de l'aliment transformé par des méthodes conventionnelles;
- l'impact possible de cet aliment sur l'apport nutritionnel, en combinant le résultat des recherches réalisées au point a) aux renseignements sur les changements, le cas échéant, dans la composition nutritionnelle de l'aliment, à la suite du procédé nouveau;
- si l'on observe des modifications quant à la concentration ou à la nature des substances bioactives, des facteurs antinutritionnels, des contaminants ou des toxines, ou s'il existe des substances nouvelles produites dans l'aliment, l'exposition possible à ces substances.
Dans les cas où la composition nutritionnelle de l'aliment a été modifiée, intentionnellement ou involontairement, par l'application du procédé nouveau, l'ampleur de ce changement doit être évaluée en fonction de la valeur nutritionnelle attendue de l'aliment non transformé et en fonction des changements qui découlent d'une transformation conventionnelle de ce même aliment; il faut également déterminer si cela peut avoir une incidence considérable sur l'apport global en nutriments des consommateurs. La décision de procéder à une évaluation complète de l'exposition peut dépendre de la mesure dans laquelle un changement s'est produit et du degré selon lequel l'approvisionnement alimentaire pourrait s'en trouver affecté. Une évaluation de l'exposition pourrait être effectuée par l'élaboration de modèles de l'apport nutritionnel, grâce à des bases de données actuelles sur l'apport alimentaire, de préférence des données obtenues auprès de sujets canadiens, dans lesquelles l'aliment nouveau a été intégré, selon sa composition nutritionnelle modifiée, et remplace un autre aliment transformé dans le même objectif par des moyens conventionnels. Par exemple, si le nouveau procédé venait remplacer la pasteurisation, il faudrait donc remplacer par l'aliment nouveau les aliments transformés par pasteurisation dans la base de données.
Les résultats de l'évaluation de l'exposition doivent décrire les changements prévus de la distribution des nutriments dans l'apport alimentaire en utilisant des mesures comme la moyenne, la variabilité et les percentiles (supérieur et inférieur) de l'apport. L'impact différentiel sur les sous-groupes de la population (p. ex., les enfants, les nourrissons, les personnes âgées, les groupes ethniques, les populations sensibles) doit être évalué, de même que l'impact sur la population dans son ensemble.
Lorsque l'on observe une modification intentionnelle sur le plan nutritionnel ou de la santé, l'impact du modèle de publicité doit également être envisagé, dans la mesure du possible, puisque cela pourrait modifier le niveau actuel de consommation d'un produit équivalent, non nouveau.
Lorsque l'on observe des changements dans les concentrations de substances bioactives, de facteurs antinutritionnels, de contaminants ou de toxines, ou si des substances nouvelles sont produites en tant que sous-produits de réaction dans l'aliment, à la suite du procédé, des estimations de l'apport nutritionnel concernant cet aliment seraient donc utilisées pour calculer l'exposition alimentaire possible à ces composants spécifiques de l'aliment nouveau, et celui-ci ferait l'objet d'une évaluation de l'innocuité.
Les procédés nouveaux appliqués aux aliments afin de réduire les pertes occasionnées par l'activité microbienne peuvent également accroître l'accessibilité aux aliments exotiques sur le marché canadien, par exemple, les fruits qui poussent dans les régions tropicales. Ce plus grand accès peut soulever des problèmes de nature nutritionnelle, toxicologique ou allergène pouvant avoir une incidence sur l'innocuité et, par conséquent, les estimations de l'exposition à des composants de l'aliment dont l'impact sur la santé est important devrait être prises en compte dans des cas semblables. L'estimation des possibilités qu'une telle hausse se produise, et les répercussions qui s'ensuivraient, doivent être prises en compte s'il existe des motifs raisonnables sur lesquels on peut s'appuyer pour avancer de telles prévisions quantifiables. Bien que de telles augmentations puissent changer les modèles de consommation alimentaire et, par conséquent, avoir une incidence plus large sur la nutrition et sur l'exposition aux autres composantes de l'alimentation qui peuvent être directement attribuées à l'aliment en soi, ces types de changement peuvent être impossibles à prévoir, et la nécessité de telles projections ou de suivi après la mise en marché, ou leur faisabilité, devra être évaluée au cas par cas. Des sondages périodiques sur la nutrition, réalisés auprès de la population, conviendraient probablement mieux pour définir les tendances alimentaires qui pourraient découler des aliments nouvellement introduits, des aliments devenus plus accessibles ou plus populaires, de même que de nombreux autres facteurs qui ont une incidence sur les régimes alimentaires au Canada et qui pourraient avoir un impact bénéfique ou nocif sur la santé (voir la section 3.4).
4.1.2.3 Historique de l'organisme
L'historique d'un organisme peut fournir des renseignements importants dans l'évaluation d'un aliment nouveau. Il peut exister des antécédents de production de toxines par certaines souches, espèces ou génériques et il serait important, dans ces situations, d'examiner la variété particulière de l'organisme utilisée dans le développement de l'aliment nouveau afin de vérifier la possibilité de produire de telles toxines, à la fois dans des conditions utilisées au cours de la fabrication et aussi dans des conditions extrêmes.
4.1.2.4 Examens nutritionnels
I Effets nutritionnels non intentionnels
Observations générales
L'introduction d'un aliment nouveau dans l'approvisionnement alimentaire canadien est nécessite que l'on détermine la qualité nutritionnelle de l'aliment et les implications de ses caractéristiques nutritionnelles pour l'ensemble de la population ou pour des sous-groupes particuliers. Ces sous-groupes de la population peuvent être plus vulnérables pour différentes raisons, par exemple, les jeunes enfants, les femmes enceintes et les mères qui allaitent, les personnes ayant des caractéristiques métaboliques particulières, les adolescents et d'autres personnes qui peuvent consommer de grandes quantités d'aliments, ou les personnes âgées qui ne consomment que de petites quantités d'aliments. Une évaluation nutritionnelle, comprenant un examen des effets intentionnels et inattendus, est nécessaire dans le but de s'assurer que l'état nutritionnel des consommateurs ne risque pas d'être menacé par :
- la substitution d'aliments ou d'ingrédients alimentaires qui ont une valeur nutritionnelle considérable, par des variétés moins nutritives de ces aliments ou d'aliments semblables;
- l'ingestion excessive de nutriments ou d'autres substances bioactives du fait que l'aliment nouveau en contient des niveaux exceptionnellement élevés;
- des niveaux récents ou accrus de facteurs antinutritionnels qui pourraient affecter de façon négative la valeur nutritionnelle de l'aliment ou du régime alimentaire.
Qu'est-ce que la qualité nutritionnelle?
La qualité nutritionnelle, telle qu'appliquée aux aliments, est liée à la présence de nutriments essentiels et de substances énergétiques (en quantité et qualité adéquates) ainsi qu'à d'autres aspects des aliments traditionnellement considérés comme faisant partie de la science de la nutrition. Ces aspects comprennent les rôles nutritionnels des acides aminés non essentiels, des types spécifiques d'acides gras et d'hydrates de carbone, des fibres alimentaires, du cholestérol, des substances lipotropes, et d'autres composants d'aliments spécifiques (p. ex., le lait maternel), de la biodisponibilité et des interactions entre les nutriments et les autres nutriments, les additifs alimentaires et les substances toxiques naturelles. Ils incluent également les excès de nutriments et les effets (à la fois positifs et négatifs) de la transformation des aliments sur les nutriments et sur les propriétés organoleptiques des aliments. On a plus récemment démontré qu'une gamme étendue de substances « bioactives » trouvées principalement dans les végétaux avait peut-être un rôle à jouer dans l'amélioration ou la protection de la santé de l'homme. Ces rôles sont également compris dans la définition au sens large de la qualité nutritionnelle.
Application d'un procédé nouveau à des végétaux
Le développement d'aliments nouveaux ou d'ingrédients alimentaires nouveaux par la mise en œuvre d'un procédé nouveau peut provoquer des changements inattendus dans la composition des produits alimentaires qui peuvent à leur tour avoir un impact sur la valeur nutritionnelle de l'aliment et sur l'état nutritionnel des personnes le consommant.
Des effets nutritionnels inattendus peuvent surgir, que le nouveau procédé soit prévu pour des motifs nutritionnels, microbiologiques ou autres. L'évaluation des effets intentionnels sur la qualité nutritionnelle d'un aliment est présentée dans la partie II de cette section.
Une étape importante dans l'évaluation nutritionnelle et de l'innocuité de ce type d'aliment nouveau consiste en une comparaison entre sa composition et celle de ses équivalents pertinents. Afin de déterminer s'il existe des différences dans la qualité nutritionnelle de l'aliment nouveau par rapport à ses équivalents pertinents, les composants majeurs de l'aliment doivent être analysés, p. ex., les macronutriments et leurs parties constituantes ainsi que les micronutriments individuels et les autres substances bioactives sélectionnées selon des critères valides. Il faut justifier, de manière raisonnable, l'exclusion de certains nutriments des analyses. Également, des circonstances peuvent justifier une évaluation du « rendement » nutritionnel de l'aliment nouveau, dans sa forme prêt-à-manger, soit à l'état brut ou transformé par des méthodes traditionnelles/conventionnelles utilisées pour faire de cet aliment un produit prêt-à-manger. Le but serait d'offrir une occasion d'identifier les changements majeurs qui pourraient ne pas être avoir été décelés par l'analyse compositionnelle, mais qui peuvent affecter, par exemple, la stabilité ou la biodisponibilité des nutriments dans l'aliment ou la sensibilité des facteurs antinutritionnel à des procédés de transformation qui, normalement, les détruisent. Un essai de rendement pourrait supposer une nouvelle analyse d'une substance après la cuisson ou il pourrait nécessiter un essai de biodisponibilité sur un animal.
Lignes directrices sur la production de données pour l'évaluation nutritionnelle
- Fonction des données à être soumises
- Les renseignements fournis sur un aliment nouveau doivent être suffisants, sur le plan de la qualité comme de la quantité, pour permettre une évaluation afin de savoir si un effet inattendu important sur la qualité nutritionnelle de l'aliment est survenu en raison de la mise en œuvre du procédé nouveau sur l'aliment, par rapport à l'aliment traité à l'aide de procédés commerciaux usuels. Les renseignements devraient également permettre une évaluation de l'importance nutritionnelle de tout changement qui a été décelé.
- Des données devraient être fournies sur l'aliment à l'état de produit final (p. ex., transformé à l'aide de la nouvelle méthode). Des données peuvent aussi être requises sur l'aliment préparé selon des moyens conventionnels pour la consommation humaine, afin d'examiner les effets d'une transformation supplémentaire, de l'entreposage et de la cuisson. Par exemple, dans les cas où la cuisson détruit normalement les facteurs antinutritionnels, des données pourraient être recueillies concernant les concentrations de facteurs antinutritionnels après la cuisson.
- Des données sur l'aliment nouveau devraient être comparées, à tout le moins, aux données relatives à deux équivalents pertinents, l'aliment non transformé et l'aliment transformé par un procédé équivalent actuellement utilisé (consulter la section b ci-dessous). Il est recommandé que la méthodologie comprenne une représentation des différents cultivars offerts sur le marché canadien; ces cultivars devraient être soumis à des processus d'essai et de contrôle. Ceci permettrait une évaluation à l'égard des variations normales probables entre les différents cultivars. Les données documentaires (si elles sont accessibles) sont également valables pour évaluer la pertinence nutritionnelle de tout effet inattendu.
- Lorsque les données publiées sur la composition nutritionnelle d'un aliment nouveau ne sont pas suffisantes, le demandeur peut devoir obtenir des données analytiques. Dans ce cas, une hypothèse claire doit être formulée et accompagnée d'une méthodologie appropriée, afin d'obtenir des données sur la composition nutritionnelle qui permettront ce qui suit :
- Examiner toutes les sources éventuelles de variation dans la qualité nutritionnelle, par exemple les conditions d'application (dose, durée, température), la surface ou le volume de l'aliment végétal, le cultivar, la consistance des niveaux de nutriments dans la matière de base, etc., au moment de concevoir l'étude, afin de veiller à ce que l'on maîtrise bien ces éléments.
- Inclure dans la même étude l'aliment nouveau qui fait l'objet de l'avis ainsi que les équivalents pertinents, c'est-à-dire le même aliment à l'état brut avant sa transformation et le même aliment soumis à un procédé équivalant actuellement utilisé. Un tel procédé en serait un qui n'est pas nouveau qui est actuellement utilisé commercialement afin d'obtenir le même effet que le procédé nouveau (le cas échéant). En l'absence d'un procédé équivalant actuellement utilisé, l'équivalent consisterait tout simplement en l'aliment à l'état brut avant sa transformation.
- Appliquer le procédé nouveau (essai) et le procédé équivalent actuellement utilisé (contrôle) à une sélection de cultivars commerciaux actuellement offerts sur le marché.
- Établir un plan d'échantillonnage avant le début de l'étude, fondé sur un calcul permettant d'utiliser au moins une ou plusieurs composantes, afin d'indiquer le nombre d'échantillons requis. Cela pourrait être fondé sur les analytes les plus importants ou les analytes que l'on prévoit être plus variables et nécessiter plus d'échantillons. Il faut fournir des détails concernant la puissance et la taille prévues de la méthodologie choisie pour le test statistique proposé ainsi que des vérifications d'hypothèses.
- S'assurer que la transformation est effectuée à l'étape de maturité requise pour l'aliment végétal et que l'échantillonnage est mené à l'étape pertinente de la transformation de l'aliment végétal (c.-à-d. le produit final).
- S'assurer que les analyses appropriées sont effectuées sur toutes les parties de la plante qui peuvent être utilisées comme aliments au Canada.
- Établir les critères de sélection des nutriments analysés et la justifier l'exclusion des analyses de tout nutriment et de toute autre substance figurant dans la section « Composition des nutriments » ci-dessous.
- Veiller à ce que les échantillons utilisés dans le cadre de cette étude soient analysés dans un délai acceptable suivant la date de cueillette.
- S'assurer que les analyses de chaque composant, nutritif et non nutritif, sont effectuées sur tous les échantillons, par le même laboratoire, selon des méthodes d'analyse approuvées et validées à l'échelle internationale, et selon des procédures de conservation des échantillons et de préparation uniformes et appropriées, et ce, tout au long des analyses.
- Utiliser des méthodes statistiques pertinentes et uniformes, choisies à l'avance selon la méthodologie, afin de comparer les concentrations de chaque nutriment dans l'aliment nouveau par rapport au groupe contrôle.
-
Composition des nutriments
Les composants des aliments nouveaux présentés ci-dessous devraient être analysés dans le contexte des lignes directrices de l'étude susmentionnée. Même si les nutriments ne sont pas tous analysés, le demandeur devrait fournir les critères de sélection des nutriments analysés et indiquer les raisons pour lesquels certains nutriments ou d'autres substances figurant dans la liste suivante ont été exclus de l'analyse.
- la composition immédiate (p. ex., les cendres, l'humidité, les protéines, le gras, les fibres, les hydrates de carbone);
- le contenu en protéine vraie, en matière azotée non protéinée (p. ex., les acides nucléiques et les aminoglycosides), le profil en acides aminés - la quantité d'acides aminés inhabituels devrait être déterminée si on suspecte leur présence (p. ex., les acides aminés d'origine bactérienne);
- profil complet des acides gras exprimé en tant que pourcentage total des acides gras, les composants non saponifiables, et les stérols - la liste des acides gras doit être regroupée selon les catégories monoinsaturé, polyinsaturé et saturé;
- la composition de la fraction des hydrates de carbone (p.ex., les sucres, les amidons, les chitines, les tanins, les polysaccharides non amylacés et les lignines);
- la composition des micronutriments (p. ex., l'analyse des vitamines et des minéraux importants);
- la présence de facteurs antinutritionnels naturels ou adventifs (p. ex., les phytates, les inhibiteurs de la trypsine, etc.);
- les métabolites secondaires prévisibles, les substances physiologiques actives (bioactives) et les autres substances décelées.
-
« Rendement » nutritionnel d'un aliment végétal nouveau
Il faut tenir compte du besoin éventuel de renseignements comme ceux présentés ci-dessous concernant l'aliment nouveau :
- La réaction des facteurs antinutritionnels connus à des procédés normalement prévus pour neutraliser leur activité, mesurée par une analyse compositionnelle.
- La stabilité à l'entreposage en ce qui concerne la dégradation des nutriments.
- Le rendement du produit relativement aux avantages prévus (autre que des avantages directs pour la santé) c.-à-d. l'amélioration de la stabilité d'une huile pour la cuisson après la modification du profil des acides gras.
-
Biodisponibilité des nutriments / Présence de facteurs antinutritionnels nouveaux ou modifiés
Dans les situations où un aliment nouveau peut devenir un important composant du régime alimentaire canadien, ou un fournisseur important de nutriments, des études sur les animaux devraient être effectuées afin d'évaluer le niveau de la valeur nutritionnelle. Ceci se rapporte en particulier à l'évaluation de la qualité des protéines, à la possibilité de facteurs antinutritionnels inconnus et à la question relative à la biodisponibilité des nutriments.
Le cas échéant, des renseignements devraient être fournis afin de décrire les conditions de transformation qui seraient utilisées dans la production de l'aliment nouveau et les effets de la transformation sur la concentration de nutriments et la biodisponibilité de ceux-ci.
- Renseignements à inclure dans la demande :
- une description complète du procédé nouveau, de l'objectif de ce procédé et des aliments auxquels il pourrait s'appliquer ainsi que des aliments auxquels il sera appliqué (aux fins de la demande);
- les aliments auxquels le processus d'essai et de contrôle a été appliqué dans le cadre de l'étude, et le nom et la source de tous les cultivars commerciaux (c.-à-d. l'endroit où ils ont été achetés et cultivés) qui ont été représentés dans cette étude;
- un4e description complète du concept expérimental, des conditions expérimentales et de la façon dont les sources de variation des concentrations de nutriments ont été contrôlées;
- une description complète de la cueillette et de la préparation des échantillons;
- une présentation ou une description des méthodes statistiques et d'analyse qui ont été utilisées afin d'obtenir des données sur les composants nutritionnels et non nutritionnels;
- les nutriments et les données relatives exprimées sous forme de moyenne ± l'écart-type et sous forme d'étendue;
- les résultats de l'analyse statistique;
- les données brutes de tous les composants analysés;
- les données publiées, si elles sont accessibles;
- l'utilisation prévue au Canada de l'organisme en tant qu'aliment, par exemple le(s) type(s) d'ingrédients, le produit final possible, le niveau d'utilisation s'il est différent de celui des produits actuels qu'il remplacerait, les habitudes reconnues d'utilisation ainsi que la consommation de l'aliment et de ses dérivés;
- toute utilisation non prévue, envisageable.
- Processus de prise de décision
- Des méthodes statistiques modernes appropriées doivent être appliquées aux données afin de démontrer qu'aucun changement important ne découle de l'intervention. Selon le CodexNote de bas de page 3, « la signification statistique de toutes différences observées devrait être évaluée dans le contexte de l'écart de variations naturelles pour ce paramètre afin de déterminer sa signification biologique ». Si la composition de l'aliment nouveau est jugée ne pas être équivalente, sur le plan nutritionnel, à celui de ses équivalents, c.-à-d. que des différences significatives (statistiques et biologiques) existent dans les données sur les nutriments, des données nutritionnelles supplémentaires peuvent être requises, au cas par cas.
- Tous les aspects de la qualité nutritionnelle seront évalués et fondés sur les principes, les normes et les lignes directrices nutritionnelles de pointe visant à répondre aux besoins nutritionnels de l'homme. Les fondements de l'évaluation comprennent : les recommandations concernant l'apport nutritionnel, le rôle de l'aliment dans le régime alimentaire de la population et l'incidence du régime et de la nutrition sur la réduction des risques de développer une maladie liée au régime et sur la promotion de la santé.
- La détection d'un changement majeur causé par un effet nutritionnel non intentionel n'empêchera pas nécessairement la mise en marché d'un produit. Cependant, ces changements peuvent nécessiter l'application de limites sur l'utilisation de l'aliment dans des produits alimentaires ou une exigence d'étiquetage qui va plus loin que les dispositions de base. Consultez aussi la partie II concernant l'évaluation de l'innocuité des niveaux élevés de nutriments ou de substances bioactives.
- La première phase de l'évaluation nutritionnelle sera fondée sur les données relatives à la composition nutritionnelle et sur une évaluation des effets intentionnels et inattendus sur la composition nutritionnelle. Si l'on découvre des composants, des concentrations de nutriments ou des substances nutritives inhabituels ou inattendus, l'aliment peut alors être soumis à des analyses plus approfondies.
- L'innocuité relative à une hausse importante de la concentration de nutriments ou d'autres composants bioactifs nécessiterait une évaluation homologue à celle de l'innocuité relative à un changement nutritionnel prévu. Consultez la partie II ci-dessous pour obtenir plus de détails.
II Modifications nutritionnelles intentionnelles
Le terme « modifications nutritionnelles intentionnelles » englobe tous les changements ou les caractéristiques introduits intentionnellement en vue d'améliorer la qualité nutritionnelle ou le profil de l'aliment en ce qui touche la santé, y compris, sans toutefois s'y limiter, les nutriments essentiels, les phytochimiques bioactifs bénéfiques, les quantités et la nature des substances énergétiques, la biodisponibilité accrue des nutriments et la réduction des concentrations de facteurs antinutritionnels.
L'évaluation des changements nutritionnels intentionnels exige que l'on suive des étapes semblables à celles utilisées pour l'ajout d'un nutriment vitaminique ou minéral à un aliment, pour l'évaluation d'aliments auxquels une allégation en matière de santé est reliée, ou les deux. Par exemple, un tel changement soulèverait des questions ayant trait au groupe cible prévu, au niveau de concentration prévu du nutriment ciblé ou d'une autre substance dans l'aliment, au changement prévu dans le niveau d'exposition au nutriment ciblé ou à une autre substance pour tous les groupes (âge et sexe) et aux niveaux extrêmes supérieur et inférieur de consommation de l'aliment, de même qu'à l'innocuité de ce niveau d'exposition.
L'ajout direct de nutriments vitaminiques et minéraux aux aliments continuera d'être réglementé en vertu de la partie D du Règlement sur les aliments et drogues et des sections pertinentes de la partie B de ce même Règlement. Cependant, les aliments dont le contenu nutritionnel est augmenté intentionnellement à la suite d'autres types de transformation, y compris l'utilisation d'engrais spéciaux pour accroître le contenu nutritionnel d'un légume ou d'une céréale, seraient considérés comme des aliments nouveaux. L'évaluation des nouveaux niveaux de concentration proposés de vitamines ou de minéraux tiendra compte des limites réglementaires liées à l'ajout de vitamines et de minéraux.
Un aliment nouveau auquel on a intégré un avantage sanitaire ou nutritionnel entrerait dans la catégorie non officielle « d'aliment fonctionnel ». L'alinéa B.28.002(2) exige des fabricants, au moment de déposer un préavis de vente visant les aliments nouveaux, qu'ils informent la Santé Canada des utilisations prévues du produit et des détails relatifs aux changements importants, le cas échéant, et qu'ils fournissent le texte qui apparaîtra sur toutes les étiquettes à utiliser en lien avec l'aliment nouveau. On s'attend donc à ce que le fabricant ou l'importateur informe Santé Canada de la nature de l'avantage sanitaire ou nutritionnel prévu et des allégations relatives à la santé souhaitées qu'il envisage concernant ces produits. Puisqu'il existe différents types d'allégations relatives à la santé, y compris les allégations relatives au rôle biologique concernant les nutriments et les allégations sur la réduction des risques de maladie liée au régime alimentaire, on encourage les fabricants ou les importateurs à ne pas s'abstenir de divulguer les allégations souhaitées puisque les répercussions sur la réglementation peuvent varier.
Les fabricants et les importateurs doivent prendre note que l'évaluation de toute allégation sanitaire ou nutritionnelle consiste en une étape distincte de celle de l'évaluation de l'innocuité, bien que l'information relative à l'utilisation prévue puisse fournir des renseignements importants dans le cadre de l'évaluation de l'innocuité et avoir une incidence sur des considérations clés comme l'exposition alimentaire. L'évaluation de l'allégation risque de se faire une fois que sera prise la décision concernant l'innocuité du produit et son utilisation appropriée en tant qu'aliment.
Dans certains cas, ces produits seront évalués conformément aux critères exposés concernant l'autorisation spécifique des allégations santé liées aux aliments. À ce stade, les règlements concernant l'autorisation spécifique des allégations santé liées aux aliments n'ont pas encore été promulgués. Les futurs demandeurs devraient se référer au cadre de réglementation proposé concernant l'autorisation spécifique des allégations santé liées aux aliments qui a été publié au mois de novembre 2001, et le Document d'orientation provisoire sur les normes relatives aux éléments probants qui a été publié en février 2002.
Dans ces documents, on porte une attention particulière à la preuve en appui de l'allégation, de même qu'à l'innocuité des produits et aux considérations relatives à la qualité des produits.
L'innocuité d'un produit de ce type d'aliment nouveau est contrôlée par la mise en œuvre de règlements sur les aliments nouveaux. L'évaluation de l'innocuité d'un produit fabriqué à l'aide d'un procédé nouveau dans le but d'obtenir une modification nutritionnelle intentionnelle devrait être la même que pour les autres aliments nouveaux. En ce qui a trait à l'évaluation nutritionnelle et de l'innocuité de la modification nutritionnelle intentionnelle en soi, les exigences en matière de données sont décrites ci-dessous. Il est important de prendre note que si une modification de l'aliment fait en sorte que celui-ci n'est pas sûr pour une consommation à satiété, un amendement au Règlement peut s'avérer nécessaire afin de préciser les niveaux de consommation permis pour cet aliment ou cet ingrédient; la période d'approbation de ce produit serait donc considérablement prolongée.
L'assurance de la qualité du produit vise à assurer la constance du niveau de substances biologiques actives dans l'aliment nouveau en ce qui touche l'apport de bénéfices allégués et la conformité aux procédures acceptables dans tous les aspects des essais de produit. Les détails relatifs à l'assurance de la qualité sont présentés dans le Document d'orientation provisoire sur les normes relatives aux éléments probants, mentionné ci-dessous.
Par souci d'assurance de la qualité, il est important de s'assurer jusqu'à quel point les effets nutritionnels intentionnels d'un procédé nouveau demeurent stables en tenant compte de l'entreposage, des transformations supplémentaires et de la cuisson.
La révision des effets nutritionnels non-intentionnels dans un aliment fabriqué à l'aide d'un procédé nouveau dans le but d'obtenir un effet nutritionnel intentionnel suivrait les mêmes étapes qu'en ce qui concerne les autres aliments nouveaux.
Évaluation nutritionnelle de niveaux accrus intentionnels ou non-intentionnels d'un nutriment ou d'une substance bioactive
- L'augmentation des concentrations d'un nutriment ou d'une autre substance bioactive intrinsèque dans un aliment doit être évaluée pour en vérifier l'innocuité.
- Les données nécessaires à cette fin comprennent :
- la concentration du nutriment ou d'une autre substance ciblé et prévu dans l'aliment;
- le groupe ciblé prévu, le cas échéant, ou le ou les groupes qui risquent le plus d'ingérer une grande quantité de l'aliment;
- le niveau prévu d'exposition à la substance par la consommation de l'aliment par le groupe ciblé, par des sous-groupes vulnérables et à l'extrémité supérieure ou inférieure d'ingestion de l'aliment dans tous les groupes (âge et sexe), selon les données canadiennes récentes sur la consommation d'aliments, dans la mesure du possible;
- la façon dont le niveau prévu d'exposition au nutriment ou à une autre substance ciblé diffère des niveaux actuels d'exposition de toutes les sources;
- toute utilisation possible de ce produit comme remplaçant d'aliments existants;
- des données en appui de l'innocuité du niveau prévu d'exposition.
- l'acceptabilité de nouvelles concentrations d'une vitamine ou d'un minéral sera évaluée en fonction des concentrations permises concernant l'ajout direct, en vertu du Règlement sur les aliments et drogues.
4.1.2.5 Examens toxicologiques
Il est absolument nécessaire d'effectuer des tests toxicologiques sur les substances dont on ne connaît pas l'innocuité et qui sont introduites dans l'approvisionnement alimentaire. En appliquant des procédés nouveaux à des aliments, on risque, intentionnellement ou non, de générer des substances nouvelles dans l'aliment final. Vu l'immense variété de produits pouvant être générés par l'application de procédés nouveaux, les tests toxicologiques devraient être réalisés au cas par cas.
Pour déceler les substances nouvelles apparaissant dans un aliment auquel on a appliqué un procédé nouveau, on utilise un élément de comparaison, comme un aliment non transformé ou transformé à l'aide de méthodes traditionnelles. Une analyse chimique peut fournir des renseignements sur toute substance nouvellement formée. De plus, l'information sur la nature, la durée et l'intensité d'un traitement ainsi que sur la composition chimique de l'aliment peuvent servir à prévoir les types de modifications qu'ont subies les composants alimentaires. À partir de ces conclusions, on devra peut-être mener sur le produit alimentaire final ou ses composantes, le cas échéant, des études conventionnelles sur la toxicité, dont une bioanalyse du métabolisme, la toxicocinétique, la toxicité chronique/carcinogénicité, l'impact sur les fonctions reproductrices et la tératogénicité.
Toute modification intentionnelle à la composition d'aliments par l'ajout de composant alimentaires à des niveaux dépassant les limites acceptées de variation naturelle (p. ex., les aliments dits « fonctionnels ») pourrait entraîner une exposition pour laquelle il n'existe aucun antécédent d'innocuité. En ajoutant dans les aliments des substances traditionnellement consommées dans l'alimentation à des doses supérieures aux doses normales, on augmente la quantité consommée de cette substance par rapport au régime ordinaire. Dans de tels cas, l'aspect nouveau de l'aliment est le niveau d'exposition à cette substance plutôt que la substance elle-même. Il faudra donc effectuer des tests toxicologiques sur la composante plus concentrée afin de déterminer la limite maximale de tolérance à cette substance. Les types d'études choisis devraient reposer sur la connaissance qu'on a du rôle que joue la composante en question dans la physiologie humaine. Il faudrait présenter des preuves tirées d'études sur les animaux et in vitro, tel que mentionné dans le paragraphe précédent, pour déterminer l'innocuité. Les études effectuées sur des animaux de laboratoire ne seront pas très utiles si le modèle d'animal utilisé (p. ex., le rat) présente une différence marquée par rapport à l'homme quant à ses voies métaboliques et ses conditions chroniques, qui sont à la base de l'effet fonctionnel étudié. Il sera donc nécessaire de s'appuyer davantage sur la réaction des humains à des doses plus élevées de ces composantes alimentaires. Il est possible qu'il existe déjà des études épidémiologiques concernant des substances qui font normalement partie d'aliments et qui pourraient comporter des renseignements importants sur les effets à long terme.
4.1.2.6 Examens relatifs à l'allergénicité
L'examen principal de l'évaluation de l'allergénicité d'un aliment nouveau a trait à la prévention d'une exposition inattendue et inévitable des personnes sensibles aux allergènes alimentaires. Lorsque l'application d'un procédé nouveau sur un aliment génère une protéine nouvelle ou modifie le contenu protéinique d'un aliment qui contient des protéines allergènes, il faudrait évaluer le potentiel allergène de l'aliment nouveau.
Protéines nouvelles
Pour le moment, on ne connaît pas de test qui puisse mesurer directement le potentiel allergène d'une protéine ou d'un aliment entier. Si l'application d'un procédé nouveau à un aliment génère une protéine nouvelle qu'on peut isoler et caractériser, on peut utiliser la stratégie d'évaluation conçue pour les aliments produits par la technique de l'ADN recombinant décrite à la section 4.1.3.7 pour en évaluer l'allergénicité potentielle. Cette stratégie comprend démarche s'appuyant sur la valeur de la preuve fondée sur l'évaluation de l'homologie de la séquence des amino-acides sur des allergènes alimentaires connus. Elle détermine aussi la mesure dans laquelle ses propriétés, surtout la résistance à la digestion dans les voies gastro-intestinales des mammifères, sont analogues à celles d'allergènes alimentaires connus.
Altération du contenu allergène endogène
Si l'application d'un procédé nouveau à un aliment qui contient des protéines allergènes en altère le contenu protéinique, il faudrait évaluer le potentiel d'accroissement du contenu allergène. Bien qu'on ne connaisse pas avec certitude les effets qu'aurait cet accroissement sur la santé, il faudrait les considérer comme indésirables. Les techniques servant à évaluer la possibilité d'effets sur l'expression allergène endogène sont les suivantes : une comparaison quantitative de la composition protéinique de la partie comestible de l'organisme modifié ou, lorsque l'on dispose d'échantillons de sérum sanguin d'un nombre suffisant de personnes allergiques à l'aliment en question la réactivité immunologique comparative de la partie comestible de l'organisme modifié à l'aide de techniques de buvardage.
4.1.2.7 Examens chimiques
Il faut signaler les contaminants chimiques lorsqu'on en découvre, de même que la concentration de ces contaminants. Ces contaminants peuvent se trouver naturellement présents dans l'aliment avant l'application du procédé nouveau ou encore, ils peuvent être introduits à la suite de l'application du procédé nouveau. Il serait donc nécessaire de comparer les niveaux de contaminants chimiques de l'aliment nouveau à ceux que l'on trouve dans le produit alimentaire d'origine. Les métaux (p.ex., l'arsenic, le cadmium, le mercure et le plomb), les contaminants organiques, y compris les polluants organiques persistants, ou POP (p. ex., le DDT, l'aldrine, la dieldrine, etc.) et les contaminants naturels, y compris les mycotoxines (p. ex., l'aflatoxine, la vomitoxine, l'ochratoxine, la zéaralénone, etc.) sont des exemples de contaminants potentiels. Les substances qui pourraient être introduites à la suite de l'application du procédé nouveau comprennent les résidus de solvants d'extraction, les auxiliaires technologiques, les lubrifiants pour les machines, etc.
Tout additif alimentaire présent dans le produit alimentaire final (p. ex., les antiagglomérants, les solvants de support, les diluants solides, les colorants, les agents de conservation) ou les adjuvants de fabrication utilisés pendant la fabrication de l'aliment (p. ex., les adjuvants de précipitation et de filtration, etc.) doivent être définis et leur niveau spécifié.
Dans le cas des aliments nouveaux dont l'utilisation est prévue en tant qu'ingrédient dans d'autres aliments, les spécifications quant à l'identité et à la pureté doivent être fournies, et accompagnées d'un exemple d'étiquette et du mode d'emploi.
4.1.3 Modifications génétiques
Les végétaux peuvent être consommés en tant qu'aliments ou servir à produire des matières utilisées dans les aliments ou dans la transformation d'aliments. Étant donné l'éventail de façons dont on peut modifier les végétaux et l'ampleur des modifications pouvant être apportées, il est impossible d'établir une norme d'évaluation de l'innocuité. Les méthodes de modification génétique ainsi que la portée de celle-ci déterminent, en partie, le type et la quantité de renseignements nécessaires pour procéder à une évaluation.
L'étape du développement d'une nouvelle variété au cours de laquelle les données sont générées est cruciale à l'évaluation de l'innocuité. On s'attend à ce que, dans le cas de nombreux « végétaux nouveaux », le produit final soit issu de rétrocroisements répétitifs entre la plante modifiée et la variété hôte. Certaines données obtenues aux premières étapes seraient acceptables pour une évaluation du produit final. Il s'agirait précisément de renseignements sur la méthode de modification, sur la stabilité du végétal transformé et sur la biologie moléculaire. Il faudrait générer les données détaillées sur la caractérisation chimique et toxicologique à partir de souches génétiquement stables et transformées qui sont représentatives du produit alimentaire final.
Il est important de retenir que ce ne sont pas tous les renseignements requis ci-dessous qui conviendront dans tous les cas. On encourage les demandeurs à consulter la Direction des aliments dès les premières étapes du développement du produit, dans le but de conclure un accord sur les renseignements qui seront pertinents pour l'évaluation de l'innocuité du produit. On recommande de présenter les renseignements suivants aux fins de l'évaluation de l'acceptabilité des plantes génétiquement modifiées et de leurs produits destinés à être utilisés dans ou comme un aliment. Dès que l'on juge qu'une plante génétiquement modifiée est acceptable, le développement d'autres variétés à l'aide de techniques de reproduction traditionnelles ne produirait pas de variétés qui nécessiteraient un avis de mise en marché, à moins que le changement majeur ne survienne dans la plante.
Dans la mesure du possible, le produit final ne devrait contenir aucun marqueur de transformation qui soulève des préoccupations relatives à l'innocuité. Si des marqueurs spécifiques sont présents dans le produit final, ils seront évalués afin d'en déterminer l'innocuité.
L'évaluation de l'innocuité des aliments nouveaux de cette catégorie suit un processus progressif d'examen des facteurs pertinents, dont :
- 4.1.3.1 Caractérisation de la souche dérivée
- 4.1.3.2 Considérations liées à la modification génétique
- 4.1.3.3 Historique de l'organisme
- 4.1.3.4 Exposition alimentaire
- 4.1.3.5 Examens nutritionnels
- 4.1.3.6 Examens toxicologiques
- 4.1.3.7 Examens relatifs à l'allergénicité
- 4.1.3.8 Examens chimiques
4.1.3.1 Caractérisation de la lignée dérivée
Lorsqu'un végétal a été modifié par des techniques d'amélioration génétique traditionnelles, par sélection ou par mutagenèse, ou encore par la technologie d'ADN recombinant, il faut définir le lien entre la variété dérivée et les variétés parentes. La démarche utilisée pour procéder à l'évaluation de l'innocuité repose sur le principe selon lequel il faut évaluer l'innocuité d'un produit nouveau en le comparant à un équivalent ayant un antécédent d'innocuité comme aliment, en tenant compte des effets intentionnels et non intentionnels. Il est particulièrement important, pour une évaluation de l'innocuité, de déterminer si la modification pourrait, de manière non intentionnelle, développer ou accroître la toxicité ou les effets allergènes de la nouvelle variété, ou encore en réduire la qualité nutritionnelle.
4.1.3.2 Considérations liées à la modification génétique
Modification génétique par des techniques traditionnelles
De nombreuses méthodes de modification de l'acide nucléique non recombinant demeurent relativement mal définies et peu précises en termes d'insertion, d'élimination et de réarrangement du matériel génétique. On les utilise généralement pour transférer des traits multigéniques. En sélectionnant les souches, ou en appliquant des techniques conventionnelles de sélection, on peut influencer la capacité de production des toxines d'un organisme ainsi que certains facteurs nutritionnels souhaitables comme les concentrations de vitamines ou la proportion d'acides gras non saturés.
Bien sûr, il arrive qu'on ne dispose pas de renseignements précis sur les différences génétiques d'un organisme nouveau, comme un végétal dérivé par mutagenèse ou par des méthodes traditionnelles de sélection. Il est possible que le sélectionneur connaisse le trait sélectionné ainsi que sa source qui, le cas échéant doit être fournie. Outre l'examen des nutriments clés (les macronutriments et les micronutriments), des facteurs antinutritionnels et des substances toxiques, la caractérisation agronomique devra démontrer l'innocuité de tout aliment nouveau dérivé par mutagenèse ou par des techniques traditionnelles de sélection. Le nombre de nutriments, de substances toxiques et de facteurs antinutritionnels clés nécessaire à l'analyse à l'évaluation sera déterminé au cas par cas et sera associé à l'organisme faisant l'objet de l'étude. La détermination des nutriments et les substances toxiques qui sont jugés importants dans l'établissement de l'innocuité de l'aliment nouveau dépend aussi de la quantité éventuelle consommée de l'aliment au Canada (examens de l'exposition alimentaire).
On reconnaît que les principales cultures alimentaires ont de longs antécédents d'innocuité comme aliment et que l'introduction de nouvelles variétés d'une culture existante n'a que rarement produit des effets indésirables sur les humains. Les nouvelles variétés d'aliments, obtenues par croisement éloigné entre des variétés de cultures traditionnelles et des types sauvages ou exotiques, pourraient soulever des préoccupations de nature nutritionnelles ou toxicologiques. Dans le cas de croisements dont on connaît bien les variétés parentales, il est possible que les toxines soient connues et que l'on puisse établir des normes concernant les niveaux de toxines. Toutefois, dans le cas de croisements avec des végétaux sauvages ou avec des variétés sauvages de cultures, il pourrait s'avérer nécessaire de mener des analyses plus approfondies des toxines se trouvant dans les parties comestibles du végétal ainsi que des études sur son utilisation dans le régime alimentaire. Soulignons que la portée des rétrocroisements devrait être entièrement décrite, car ce procédé risque d'éliminer un pourcentage important du matériel génétique des parents donneurs parmi les descendants choisis à des fins alimentaires.
Les plantes développées de façon traditionnelle requièrent une évaluation multidisciplinaire puisque certains détails relatifs à la modification peuvent être en grande partie inconnus. L'expérience dans l'évaluation de l'innocuité des aliments nouveaux étant en plein développement, il se pourrait que l'on puisse mieux préciser les exigences en matière de données concernant des groupes particuliers de produits ou d'écarter la possibilité d'évaluation plus approfondie de certains produits.
Les méthodes de sélection conventionnelles peuvent donner une culture vivrière qui nécessite un avis avant la vente si les caractéristiques sélectionnées ne s'inscrivent pas dans le spectre agronomique, nutritionnel et compositionnel de cette espèce. Un aliment dérivé d'une espèce pourrait également être considéré comme nouveau s'il présente des variations importantes dans sa composition, par rapport à son homologue non modifié.
Les plantes issues de la mutagénèse et de la sélection traditionnelle peuvent donner une culture vivrière qui nécessite un avis avant la vente si les caractéristiques sélectionnées ne s'inscrivent pas dans le spectre agronomique, nutritionnel et compositionnel de cette espèce. Par exemple, un aliment dérivé d'une culture vivrière pourrait être considéré comme nouveau s'il présente des variations importantes dans sa composition comparativement à son homologue modifié de manière traditionnelle. L'objectif de la sélection est de modifier les caractéristiques héréditaires d'un organisme afin d'y introduire de nouvelles caractéristiques ou d'améliorer les caractéristiques existantes. Santé Canada ne désire pas revoir l'ensemble des nouvelles variétés de plantes en cours d'élaboration, mais seulement celles qui sont véritablement nouvelles et qui pourraient constituer un risque pour la santé.
Modification génétique par des techniques modernes
Lorsqu'une plante a été modifiée à l'aide de techniques génétiques modernes, comme les techniques d'ADN recombinant, l'évaluation de l'innocuité portera sur les données de caractérisation détaillées d'un organisme nouveau au niveau moléculaire. Les exigences suivantes sont tirées de lignes directrices portant sur l'évaluation de l'innocuité, acceptées par la Commission du Codex Alimentarius 2003Note de bas de page 4. En plus des exigences présentées dans les sections précédentes, les domaines suivants devraient être examinés pour ces types de produits :
i) Description de la (des) modification(s) génétique(s)
Des détails de toutes les méthodes et manipulations exécutées dans la modification d'un organisme doivent être indiqués afin de permettre l'identification de tout le matériel génétique pouvant être inséré, supprimé, muté ou réarrangé dans le génome hôte. Ainsi, les renseignements nécessaires à l'analyse des données en appui de la caractérisation de l'organisme modifié seront accessibles.
La description du processus de modification devrait comprendre :
- l'information sur la (les) méthode(s) de modification utilisée(s), c.-à-d. la transformation fondée sur Agrobacterium ou la transformation directe par des méthodes telles que le bombardement de particules, l'électroporation, etc.;
- la description et la caractérisation de tous les matériaux génétiques pouvant être livrés, le cas échéant, y compris la source, l'identité et la fonction prévue dans l'organisme;
- les détails des manipulations ou des modifications effectuées sur le matériel génétique introduit, intermédiaire et récepteur (p. ex., changement qui affecte la séquence d'acides aminés du produit d'expression).
Des renseignements devraient être fournis concernant l'ADN ajouté, inséré, supprimé ou modifié, y compris :
- la caractérisation de toutes les composantes génétiques y compris les gènes marqueurs, les éléments de réglementation ou autres éléments affectant la fonction de l'ADN;
- la taille et l'identité;
- la situation et l'orientation de la séquence dans le vecteur final/gène hybride;
- la fonction dans l'organisme.
Un diagramme sommaire exposant les caractéristiques principales du gène hybride final devrait être fourni. Des cartes de restrictions et des données sur la séquence du matériel génétique introduit ou modifié et des régions adjacentes peuvent être requises en fonction de la nature de la modification génétique.
ii) Caractérisation des modifications génétiques
En vue de fournir une vision claire de l'impact sur la composition et l'innocuité des aliments dérivés d'organismes génétiquement modifiés, une caractérisation complète moléculaire et biochimique de l'organisme devrait être effectuée.
Des renseignements devraient être fournis sur les insertions d'ADN dans le génome et doivent comprendre :
- la caractérisation et la description de tous les matériaux génétiques insérés;
- le nombre de points d'insertion;
- les données permettant de démontrer si des copies entières ou partielles ont été insérées dans le génome;
- des données permettant de démontrer si l'arrangement du matériel génétique utilisé pour l'insertion a été conservé ou si des réarrangements importants sont survenus à la suite de l'intégration);
- l'organisation du matériel génétique inséré à chaque site d'insertion, y compris le numéro de copie et, le cas échéant, la séquence de données du matériel inséré et des régions environnantes (les renseignements sur la séquence peuvent être informatifs dans certains cas, p. ex., pour caractériser complètement une insertion d'ADN partielle ou réorganisée);
- l'identification de tout cadre de lecture ouvert à l'intérieur de l'ADN créé par l'insertion avec l'ADN génomique avoisinant de la plante, si le matériel génétique inséré est tronqué;
- lorsque des modifications qui comportent des suppressions, des réarrangements ou une mutagénèse in vitro dirigée, les données de la séquence de la région avant et après la modification devraient être fournies.
Des renseignements devraient être fournis concernant toutes les substances exprimées de l'organisme modifié et comprendre :
- le produit génétique (c.-à-d. une protéine ou un ARN non traduit);
- la fonction du produit génétique;
- la description phénotypique de la(les) nouvelle(s) souche(s);
- le niveau et le lieu d'expression du(des) produit(s) du gène et les niveaux de ses métabolites;
- afin de démontrer si des modifications délibérées effectuées sur la séquence en acides aminés de la protéine exprimée entraînent des changements dans sa modification post-traduction ou affectent les sites cruciaux pour sa structure ou sa fonction;
- lorsque des manipulations génétiques altèrent la régulation de gènes endogènes, la caractérisation et le niveau d'expression de gène devraient être comparés avec ceux de son hôte non modifié;
- afin d'indiquer s'il existe toute preuve qui suggère qu'un ou plusieurs gènes endogéniques dans la plante hôte ait été affectés par le processus de modification;
- afin de confirmer l'identité de la forme d'expression de toutes protéines hybrides nouvelles;
- afin de démontrer que l'effet intentionné de la modification a été atteint et que tous les traits exprimés sont bien exprimés et transmis d'une manière qui est stable à travers plusieurs générations compatibles avec les lois de l'hérédité. Il pourrait être nécessaire d'examiner l'hérédité de l'ADN lui-même ou l'expression de l'ARN correspondant si les caractéristiques phénotypiques ne peuvent pas être mesurées directement;
- afin de démontrer que la(les) souche(s) nouvellement exprimée(s) sont exprimées tel que prévu dans les tissus pertinents d'une manière et à des niveaux qui sont compatibles avec les séquences réglementaires associées qui dirigent l'expression du gène correspondant.
Hybrides sélectionnés de manière conventionnelle dérivés du croisement entre des lignées végétales modifiées génétiquement déjà approuvées
Conformément à la définition de « aliment nouveau » du Titre 28 du Règlement sur les aliments et drogues, la descendance dérivée de la sélection conventionnelle de végétaux génétiquement modifiés approuvés (l'un des deux parents, ou les deux parents, ont été modifiés génétiquement) ne serait pas considérée comme un aliment nouveau, à moins qu'une certaine forme de nouveauté ait été introduite dans cette descendance à la suite du croisement, nécessitant alors un avis avant la vente, en vertu du Titre 28. Par exemple, un avis pourrait être nécessaire si des modifications étaient observées dans la descendance à la suite d'un changement dans les caractéristiques existantes de la plante faisant en sorte que ses caractéristiques tombent en deçà du spectre accepté ou introduisant de nouvelles caractéristiques jamais observées chez cette plante (p. ex., un changement important a été observé dans les niveaux d'expression des caractéristiques lorsque empilé). De plus, l'utilisation d'espèces sauvages (croisement interspécifique) n'ayant pas d'antécédent d'innocuité comme aliment dans le développement d'une nouvelle lignée végétale peut également nécessiter un avis à Santé Canada.
4.1.3.3 Historique de l'organisme
L'historique d'un organisme donneur et celui d'un hôte peuvent fournir des renseignements importants dans l'évaluation d'un aliment nouveau. Il peut exister des antécédents de production de toxines par certaines souches, espèces ou génériques et il serait important, dans ces situations, d'examiner la variété particulière de l'organisme utilisée dans le développement de l'aliment nouveau afin de vérifier la possibilité de produire de telles toxines, à la fois dans des conditions utilisées au cours de la fabrication et aussi dans des conditions extrêmes.
4.1.3.4 Exposition alimentaire
Le rôle de l'évaluation de l'exposition alimentaire concernant les substances sans antécédent d'innocuité comme aliment consiste à estimer :
- la quantité de l'aliment qui risque d'être consommée et la fréquence de consommation, ainsi que le rôle que cet aliment pourrait jouer dans l'alimentation, s'il diffère du rôle de l'aliment non modifié;
- l'impact possible de cet aliment sur l'apport nutritionnel, en combinant le résultat des recherches réalisées au point a) aux renseignements sur les changements, le cas échéant, dans la composition nutritionnelle de l'aliment, à la suite de la modification génétique;
- si l'on observe des modifications quant à la concentration ou à la nature des substances bioactives, des facteurs antinutritionnels, des contaminants ou des toxines;
- l'exposition possible à des produits d'expression génétiques découlant d'une modification génétique.
Dans les cas où la composition nutritionnelle de l'aliment a été modifiée, intentionnellement ou involontairement, par l'application d'une modification génétique, l'ampleur de ce changement doit être évaluée en fonction de la valeur nutritionnelle attendue de l'aliment non transformé et en fonction des changements qui découlent d'une transformation conventionnelle de ce même aliment; il faut également déterminer si cela peut avoir une incidence considérable sur l'apport global en nutriments des consommateurs. La décision de procéder à une évaluation complète de l'exposition peut dépendre de la mesure dans laquelle un changement s'est produit et du degré selon lequel l'approvisionnement alimentaire pourrait s'en trouver affecté. Une évaluation de l'exposition pourrait être effectuée par l'élaboration de modèles de l'apport nutritionnel, grâce à des bases de données actuelles sur l'apport alimentaire, de préférence des données obtenues auprès de sujets canadiens, dans lesquelles l'aliment nouveau a été intégré, selon sa composition nutritionnelle modifiée, et remplace un autre aliment non transformé.
Les résultats de l'évaluation de l'exposition doivent décrire les changements prévus de la distribution des nutriments dans l'apport alimentaire en utilisant des mesures comme la moyenne, la variabilité et les percentiles (supérieur et inférieur) de l'apport. L'impact différentiel sur les sous-groupes de la population (p. ex., les enfants, les nourrissons, les personnes âgées, les groupes ethniques, les populations sensibles) doit être évalué, de même que l'impact sur la population dans son ensemble.
Lorsque l'on observe une modification intentionnelle sur le plan nutritionnel ou de la santé, l'impact du modèle de publicité doit également être envisagé, dans la mesure du possible, puisque cela pourrait modifier le niveau actuel de consommation d'un produit équivalent, non nouveau.
Lorsque l'on observe des changements dans les concentrations de substances bioactives, de facteurs antinutritionnels, de contaminants ou de toxines, ou si des substances nouvelles sont produites en tant que sous-produits de réaction dans l'aliment, à la suite du procédé, des estimations de l'apport nutritionnel concernant cet aliment seraient donc utilisées pour calculer l'exposition alimentaire possible à ces composants spécifiques de l'aliment nouveau, et celui-ci ferait l'objet d'une évaluation de l'innocuité.
Lorsque des denrées servant à l'alimentation subissent une modification génétique afin de transformer les caractéristiques agronomiques, l'exposition alimentaire à l'aliment ou aux ingrédients de l'aliment dérivés de la culture n'en sera pas altérée. Cependant, si des cultures vivrières provoquent l'introduction d'une protéine nouvelle ou des métabolites nouveaux à l'approvisionnement alimentaire, le contenu de ces substances dans l'aliment devrait être déterminé et examiné parallèlement aux données toxicologiques en tant que partie de l'évaluation de l'innocuité. Les effets des procédures typiques de la transformation des aliments sur les composants nouveaux devraient être examinés en dérivant l'estimation de l'exposition. Lorsque des substances sont comprises dans les données d'innocuité existantes (c.-à-d. les produits chimiques agricoles permis), la documentation de l'accroissement anticipé de l'exposition à ces substances devrait être fournie.
Une modification génétique des cultures ayant pour but de transformer les caractéristiques agronomiques telles que la résistance aux maladies peut aussi favoriser la disponibilité d'aliments exotiques sur le marché canadien. L'estimation des possibilités qu'une telle hausse se produise, et les répercussions qui s'ensuivraient, doivent être prises en compte s'il existe des motifs raisonnables sur lesquels on peut s'appuyer pour avancer de telles prévisions quantifiables. Bien que de telles augmentations puissent changer les modèles de consommation alimentaire et, par conséquent, avoir une incidence plus large sur la nutrition et sur l'exposition aux autres composantes de l'alimentation qui peuvent être directement attribuées à l'aliment en soi, ces types de changement peuvent être impossibles à prévoir, et la nécessité de telles projections ou de suivi après la mise en marché, ou leur faisabilité, devra être évaluée au cas par cas. Des sondages périodiques sur la nutrition, réalisés auprès de la population, conviendraient probablement mieux pour définir les tendances alimentaires qui pourraient découler des aliments nouvellement introduits, des aliments devenus plus accessibles ou plus populaires, de même que de nombreux autres facteurs qui ont une incidence sur les régimes alimentaires au Canada et qui pourraient avoir un impact bénéfique ou nocif sur la santé (voir la section 3.4).
4.1.3.5 Examens nutritionnels
I Effets nutritionnels non intentionnels
Observations générales
L'introduction d'un aliment nouveau dans l'approvisionnement alimentaire canadien est nécessite que l'on détermine la qualité nutritionnelle de l'aliment et les implications de ses caractéristiques nutritionnelles pour l'ensemble de la population ou pour des sous-groupes particuliers. Ces sous-groupes de la population peuvent être plus vulnérables pour différentes raisons, par exemple, les jeunes enfants, les femmes enceintes et les mères qui allaitent, les personnes ayant des caractéristiques métaboliques particulières, les adolescents et d'autres personnes qui peuvent consommer de grandes quantités d'aliments, ou les personnes âgées qui ne consomment que de petites quantités d'aliments. Une évaluation nutritionnelle, comprenant un examen des effets intentionnels et non intentionnels, est nécessaire dans le but de s'assurer que l'état nutritionnel des consommateurs ne risque pas d'être menacé par :
- la substitution d'aliments ou d'ingrédients alimentaires qui ont une valeur nutritionnelle considérable, par des variétés moins nutritives de ces aliments ou d'aliments semblables;
- l'ingestion excessive de nutriments ou d'autres substances bioactives du fait que l'aliment nouveau en contient des niveaux exceptionnellement élevés;
- les niveaux récents ou accrus de facteurs antinutritionnels qui pourraient affecter de façon négative la valeur nutritionnelle de l'aliment ou du régime alimentaire.
Qu'est-ce que la qualité nutritionnelle?
La qualité nutritionnelle, telle qu'appliquée aux aliments, est liée à la présence de nutriments essentiels et de substances énergétiques (en quantité et qualité adéquates) ainsi qu'à d'autres aspects des aliments traditionnellement considérés comme faisant partie de la science de la nutrition. Ces aspects comprennent les rôles nutritionnels des acides aminés non essentiels, des types spécifiques d'acides gras et d'hydrates de carbone, des fibres alimentaires, du cholestérol, des substances lipotropes, et d'autres composants d'aliments spécifiques (p. ex., le lait maternel), de la biodisponibilité et des interactions entre les nutriments et les autres nutriments, les additifs alimentaires et les substances toxiques naturelles. Ils incluent également les excès de nutriments et les effets (à la fois positifs et négatifs) de la transformation des aliments sur les nutriments et sur les propriétés organoleptiques des aliments. On a plus récemment démontré qu'une gamme étendue de substances « bioactives » trouvées principalement dans les végétaux avait peut-être un rôle à jouer dans l'amélioration ou la protection de la santé de l'homme. Ces rôles sont également compris dans la définition au sens large de la qualité nutritionnelle.
Aliments provenant de plantes modifiées génétiquement
Le développement d'aliments nouveaux ou d'ingrédients alimentaires nouveaux par une modification génétique, que ce soit par reproduction traditionnelle, par mutagénèse ou par la technologie de l'ADN recombinant peut provoquer des changements non-intentionnels dans la composition du produit alimentaire qui peut à son tour avoir un impact sur la valeur nutritive de l'aliment et la situation nutritionnelle des personnes qui le consomment. Bien que des modifications génétiques plus complexes ou hiérarchisées sont expérimentées par des techniques d'ADN recombinant, entre autres l'introduction à la fois de souches nutritionnelles améliorées et de souches agronomiques dans le même organisme, celles-ci peuvent accroître la possibilité d'effets non intentionnels en comparaison à des modifications plus simples. En outre, d'autres méthodes de modifications génétiques pourraient aussi occasionner des changements multiples.
Des effets nutritionnels inattendus peuvent surgir, que le nouveau procédé soit prévu pour des motifs nutritionnels, microbiologiques ou autres. Une évaluation des effets intentionnels sur la qualité nutritive d'un aliment est examinée dans la partie II de cette section.
Une étape importante dans l'évaluation nutritionnelle et de l'innocuité de l'aliment modifié consiste en une comparaison entre sa composition et celle de ses contreparties pertinentes. Afin de déterminer s'il existe des différences dans la qualité nutritionnelle de l'aliment nouveau par rapport à ses contreparties pertinentes, les composants majeurs de l'aliment doivent être analysés, p. ex., les macronutriments et leurs parties constituantes ainsi que les micronutriments individuels et les autres substances bioactives sélectionnées selon des critères valides. Il faut justifier, de manière raisonnable, l'exclusion de certains nutriments des analyses. Également, des circonstances peuvent justifier une évaluation du « rendement » nutritionnel de l'aliment nouveau, dans sa forme prêt-à-manger, soit à l'état brut ou transformé par des méthodes traditionnelles/conventionnelles utilisées pour faire de cet aliment un produit prêt-à-manger. Le but serait d'offrir une occasion d'identifier les changements majeurs qui pourraient ne pas être avoir été décelés par l'analyse compositionnelle, mais qui peuvent affecter, par exemple, la stabilité ou la biodisponibilité des nutriments dans l'aliment ou la sensibilité des facteurs antinutritionnel à des procédés de transformation qui, normalement, les détruisent. Un essai de rendement pourrait supposer une nouvelle analyse d'une substance après la cuisson ou il pourrait nécessiter un essai de biodisponibilité sur un animal.
Lignes directrices sur la production de données pour l'évaluation nutritionnelle
- Fonction des données à être soumises
- Les renseignements fournis sur un aliment nouveau doivent être suffisants, sur le plan de la qualité comme de la quantité, pour permettre une évaluation à savoir si une modification génétique non-intentionnelle d'importance affectant la qualité nutritionnelle de l'aliment est survenue en raison de l'introduction de la souche nouvelle. Les renseignements devraient également permettre une évaluation de l'importance nutritionnelle de tout changement qui a été décelé.
- Des données devraient être fournies sur l'aliment cru, en d'autres mots, la partie comestible de la plante non transformée. Des données peuvent aussi être requises sur l'aliment transformé selon des moyens conventionnels pour la consommation humaine, afin d'examiner les effets de la transformation, de l'entreposage ou de la cuisson, selon le cas, sur cet aliment. Cela pourrait servir par exemple à évaluer l'efficacité de la cuisson pour détruire les facteurs antinutritionnels, dans les cas où l'on aurait décelé la présence de facteurs antinutritionnels normalement détruits par la cuisson.
- Des données sur l'aliment nouveau devraient être comparées, à tout le moins, aux données relatives à la variété parente isogénique et non transgénique, à l'équivalent le plus pertinent, dans la mesure du possible, ou à un cultivar parent non transgénique. Puisqu'une ou plusieurs différences pourraient apparaître, il est recommandé que la méthodologie comprenne des cultures des mêmes espèces d'une variété de cultivars normaux qui existent dans la production commerciale pour les mêmes buts et qui sont cultivés dans les mêmes régions géographiques, ainsi que celles que l'on trouve généralement sur le marché canadien. Ceci permettrait une évaluation à l'égard des variations normales. Les données documentaires (si elles sont accessibles) sont également valables pour évaluer la pertinence nutritionnelle de tout effet non intentionnel.
- Une hypothèse claire doit être formulée et accompagnée d'une méthodologie appropriée, afin d'obtenir des données sur la composition nutritionnelle qui permettront ce qui suit :
- Examiner toutes les sources importantes de variation possible dans la qualité nutritionnelle, par exemple la région géographique, la saison, le type et la fertilité du sol, la quantité de lumière du soleil, la température, la gestion des cultures, etc., au moment de concevoir l'étude, afin de veiller à ce que l'on maîtrise bien ces éléments.
- Soumettre la plante modifiée aux conditions prévues lors de la production commerciale, c.-à-d. une plante qui est rendue tolérante aux stress environnementaux ou autres (les insectes, le sel, la sécheresse, les herbicides, etc.) devrait être cultivée dans ces conditions, afin de recueillir des données. Les plantes contrôles devraient également être cultivées dans des conditions qui leur conviennent.
- Inclure dans la même étude l'aliment nouveau qui fait l'objet de l'avis ainsi que la contrepartie pertinente, c'est-à-dire le cultivar isogénique parent, et une sélection des cultivars commerciaux offerts actuellement sur le marché. En l'absence d'un cultivar isogénique proche parent, le cultivar non transgénique le plus étroitement relié peut être choisi.
- Repérer des parcelles d'expérimentation en plusieurs endroits où il est prévu de cultiver ou de récolter la plante. Idéalement, il faudrait que les conditions de culture de la plante, en vue de la cueillette de données, représentent différents lieux géographiques où la plante peut être cultivée ainsi que différentes années; il est préférable de ne pas s'appuyer sur des données provenant de plusieurs répétitions obtenues dans un champ donné au cours d'une seule année.>
- Établir un plan d'échantillonnage avant le début de l'étude, fondé sur un calcul permettant d'utiliser au moins une ou plusieurs composantes, afin d'indiquer le nombre d'échantillons requis. Cela pourrait être fondé sur les analytes les plus importants ou les analytes que l'on prévoit être plus variables et nécessiter plus d'échantillons. Il faut fournir des détails concernant la puissance et la taille prévues de la méthodologie choisie pour le test statistique proposé ainsi que des vérifications d'hypothèses.
- S'assurer que l'échantillonnage se fait à l'étape opportune de maturité de la culture en question.
- S'assurer que les analyses pertinentes sont effectuées sur toutes les parties de la plante qui pourront être utilisées comme aliment au Canada. Par exemple, si les utilisations prévues d'un maïs nouveau comprennent l'huile et la farine, il faudrait analyser des échantillons d'huile de maïs et la semoule de maïs pour y détecter les nutriments adéquats.
- Établir les critères de sélection des nutriments analysés et la justifier l'exclusion des analyses de tout nutriment et de toute autre substance figurant dans la section « Composition des nutriments » ci-dessous.
- Veiller à ce que les échantillons utilisés dans le cadre de cette étude soient analysés dans un délai acceptable suivant la date de cueillette.
- S'assurer que les analyses de chaque composant, nutritif et non nutritif, sont effectuées sur tous les échantillons, par le même laboratoire, selon des méthodes d'analyse approuvées et validées à l'échelle internationale, et selon des procédures de conservation des échantillons et de préparation uniformes et appropriées, et ce, tout au long des analyses.
- Utiliser des méthodes statistiques pertinentes et uniformes, choisies à l'avance selon la méthodologie, afin de comparer les concentrations de chaque nutriment contenu dans l'aliment nouveau par rapport au groupe contrôle.
-
Composition des nutriments
Dans le contexte des lignes directrices d'étude susmentionnées, la liste générique des composantes des aliments nouveaux qui suit doit être analysée. Les caractéristiques spécifiques des cultures individuelles et de leurs produits varient. Les documents de consensus portant sur les considérations liées à la composition des nouvelles variétés de diverses cultures, élaborés par le Groupe d'étude sur la sécurité des nouveaux aliments destinés à la consommation humaine et animale de l'Organisation de coopération et de développement économiques (OCDE)Note de bas de page 5, sont disponibles et peuvent être consultés pour obtenir d'autres conseils en ce qui concerne les cultures particulières. Ces documents proposent des nutriments, des facteurs antinutritionnels et des substances toxiques clés associés aux cultures qui doivent être analysées et fournir des données sur la composition type des cultures et de leurs principaux produits dérivés. Comme il ne s'agit que de lignes directrices, on recommande de consulter Santé Canada en ce qui concerne les composants à inclure dans une évaluation. Même si ceux-ci ne sont pas tous analysés dans le contexte des lignes directrices de l'étude ci-dessus. Le demandeur devrait fournir les critères utilisés afin de sélectionner les nutriments analysés et la justification de l'exclusion de l'analyse de certains nutriments et d'autres substances énumérés ci-dessous :
- la composition immédiate (p. ex., les cendres, l'humidité, les protéines, le gras, les fibres, les hydrates de carbone);
- o le contenu en protéine vraie, en matière azotée non protéinée (p. ex., les acides nucléiques et les aminoglycosides), le profil en acides aminés - la quantité d'acides aminés inhabituels devrait être déterminée si on suspecte leur présence (p. ex., les acides aminés d'origine bactérienne);
- le profil complet des acides gras exprimé en tant que pourcentage total des acides gras, les composants non saponifiables, et les stérols - la liste des acides gras doit être regroupée selon les catégories monoinsaturé, polyinsaturé et saturé;
- la composition de la fraction des hydrates de carbone (p.ex., les sucres, les amidons, les chitines, les tanins, les polysaccharides non amylacés et les lignines);
- la composition des micronutriments (p. ex., l'analyse des vitamines et des minéraux importants);
- la présence de facteurs antinutritionnels naturels ou adventifs (p. ex., les phytates, les inhibiteurs de la trypsine, etc.);
- les métabolites secondaires prévisibles, les substances physiologiques actives (bioactives) et les autres substances décelées.
- « Rendement » nutritionnel de la plante modifiée
Il faut tenir compte du besoin éventuel de renseignements comme ceux présentés ci-dessous concernant la plante modifiée :- La réaction des facteurs antinutritionnels connus à des procédés normalement prévus pour neutraliser leur activité, mesurée par une analyse compositionnelle.
- La stabilité à l'entreposage en ce qui concerne la dégradation des nutriments.
- Le rendement du produit relativement aux avantages prévus (autre que des avantages directs pour la santé) c.-à-d. l'amélioration de la stabilité d'une huile pour la cuisson après la modification du profil des acides gras.
- Biodisponibilité des nutriments / Présence de facteurs anti-nutritionnels nouveaux ou modifiés
Dans les situations où un aliment d'une source génétiquement modifiée peut devenir un important composant du régime alimentaire canadien, ou un fournisseur important de nutriments, des études sur les animaux devraient être effectuées afin d'évaluer le niveau de la valeur nutritionnelle. Ceci se rapporte en particulier à l'évaluation de la qualité des protéines, à la possibilité de facteurs antinutritionnels inconnus et à la question relative à la biodisponibilité des nutriments.
Le cas échéant, des renseignements devraient être fournis afin de décrire les conditions de transformation qui seraient utilisées dans la production de l'aliment nouveau et les effets de la transformation sur la concentration de nutriments et la biodisponibilité de ceux-ci. - Renseignements à inclure dans la demande :
- le nom de tous les cultivars qui ont été représentés dans l'étude;
- une description complète du concept expérimental, des conditions expérimentales et de la façon dont les sources de variation des concentrations de nutriments ont été contrôlées;
- une description complète de la cueillette et de la préparation des échantillons;
- une présentation ou une description des méthodes statistiques et d'analyse qui ont été utilisées afin d'obtenir des données sur les composants nutritionnels et non nutritionnels;
- les nutriments et les données relatives exprimées sous forme de moyenne ± l'écart-type et sous forme d'étendue;
- les résultats de l'analyse statistique;
- les données brutes de tous les composants analysés, depuis tous les emplacements utilisés pour cultiver la plante;
- les données publiées, si elles sont accessibles;
- l'utilisation prévue au Canada de l'organisme en tant qu'aliment, par exemple le(s) type(s) d'ingrédients, le produit final possible, le niveau d'utilisation s'il est différent de celui des produits actuels qu'il remplacerait, les habitudes reconnues d'utilisation ainsi que la consommation de l'aliment et de ses dérivés;
- toute utilisation non prévue, envisageable.
- Processus de prise de décision
- Des méthodes statistiques modernes appropriées doivent être appliquées aux données afin de démontrer qu'aucun changement important ne découle de l'intervention. Selon le CodexNote de bas de page 6, « la signification statistique de toutes différences observées devrait être évaluée dans le contexte de l'écart de variations naturelles pour ce paramètre afin de déterminer sa signification biologique ». Si la composition de l'aliment nouveau est jugée ne pas être équivalente, sur le plan nutritionnel, à celui de ses contreparties, c.-à-d. que des différences significatives (statistiques et biologiques) existent dans les données sur les nutriments, des données nutritionnelles supplémentaires peuvent être requises, au cas par cas.
- Tous les aspects de la qualité nutritionnelle seront évalués et fondés sur les principes, les normes et les lignes directrices nutritionnelles de pointe visant à répondre aux besoins nutritionnels de l'homme. Les fondements de l'évaluation comprennent : les recommandations concernant l'apport nutritionnel, le rôle de l'aliment dans le régime alimentaire de la population et l'incidence du régime et de la nutrition sur la réduction des risques de développer une maladie liée au régime et sur la promotion de la santé.
- La détection d'un changement majeur causé par un effet nutritionnel non intentionnel peut ne pas empêcher la mise en marché du produit. Cependant, ces changements peuvent nécessiter l'application de limites sur l'utilisation de l'aliment dans des produits alimentaires ou une exigence d'étiquetage qui va plus loin que les dispositions de base. Consultez aussi la partie II concernant l'évaluation de l'innocuité des niveaux élevés de nutriments ou de substances bioactives.
- La première phase de l'évaluation nutritionnelle sera fondée sur les données relatives à la composition nutritionnelle et sur une évaluation des effets intentionnels et inattendus sur la composition nutritionnelle. Si l'on découvre des composants, des concentrations de nutriments ou des substances nutritives inhabituels ou inattendus, l'aliment peut alors être soumis à des analyses plus approfondies.
- L'innocuité relative à une hausse importante de la concentration de nutriments ou d'autres composants bioactifs nécessiterait une évaluation homologue à celle de l'innocuité relative à un changement nutritionnel prévu. Consultez la partie II ci-dessous pour obtenir plus de détails.
II Modifications nutritionnelles intentionnelles
Le terme « modifications nutritionnelles intentionnelles » englobe tous les changements ou les caractéristiques introduits intentionnellement en vue d'améliorer la qualité nutritionnelle ou le profil de l'aliment en ce qui touche la santé, y compris, sans toutefois s'y limiter, les nutriments essentiels, les phytochimiques bioactifs bénéfiques pour la santé, les quantités et la nature des substances énergétiques, la biodisponibilité accrue des nutriments et la réduction des concentrations de facteurs antinutritionnels.
L'évaluation des changements nutritionnels intentionnels exige que l'on suive des étapes semblables à celles utilisées pour l'ajout d'un nutriment vitaminique ou minéral à un aliment, pour l'évaluation d'aliments auxquels une allégation en matière de santé est reliée, ou les deux. Par exemple, un tel changement soulèverait des questions ayant trait au groupe cible prévu, au niveau de concentration prévu du nutriment ciblé ou d'une autre substance dans l'aliment, au changement prévu dans le niveau d'exposition au nutriment ciblé ou à une autre substance pour tous les groupes (âge et sexe) et aux niveaux extrêmes supérieur et inférieur de consommation de l'aliment, de même qu'à l'innocuité de ce niveau d'exposition.
Un aliment nouveau auquel on a intégré un avantage sanitaire ou nutritionnel entrerait dans la catégorie non officielle « d'aliment fonctionnel ». On s'attend à ce que les manufacturiers souhaitent faire des allégations santé pour ces produits. Ces produits seraient donc évalués selon les critères établis pour les aliments avec des allégations santé spécifiques. Ceci inclut de porter une attention particulière aux preuves apportées pour supporter ces allégations de même qu'aux questions concernant l'innocuité et la qualité du produit.
L'innocuité du produit de ce type d'aliment nouveau doit être contrôlée par l'application des règlements concernant l'aliment nouveau. L'évaluation de l'innocuité d'un aliment nouveau modifié génétiquement dans le but d'y apporter une modification nutritionnelle intentionnelle devrait être la même que celle utilisée pour les autres aliments modifiés génétiquement. Les exigences concernant les données requises pour l'évaluation sûre et nutritionnelle des modifications nutritionnelles intentionnelles sont décrites ci-dessous.
L'assurance de la qualité du produit vise à assurer la constance du niveau de substances biologiques actives dans l'aliment nouveau en ce qui touche l'apport de bénéfices allégués et la conformité aux procédures acceptables dans tous les aspects des essais de produit. Les détails relatifs à l'assurance de la qualité sont présentés dans le Document d'orientation provisoire sur les normes relatives aux éléments probants, mentionné ci-dessous.
À ce stade, les règlements concernant l'autorisation spécifique des allégations santé liées aux aliments n'ont pas encore été promulgués. Les futurs demandeurs devraient se référer au cadre de réglementation proposé concernant l'autorisation spécifique des allégations santé liées aux aliments qui a été publié au mois de novembre 2001, et le Document d'orientation provisoire sur les normes relatives aux éléments probants qui a été publié en février 2002.
L'ajout d'une substance par une modification génétique diffère de l'ajout d'une substance en l'appliquant ou en la mélangeant à un aliment après qu'il ait été récolté. La décision de continuer ou de cesser l'ajout prendrait place à différentes étapes de la production. Ceci pourrait avoir un effet sur la possibilité de gérer la substance ou la caractéristique « ajoutés » dans l'apport nutritif, si on jugeait par la suite qu'il est nécessaire d'effectuer un contrôle. En raison de ce besoin potentiel, de tels produits devraient être soumis à des procédures de suivi d'identité pour assurer la possibilité de les surveiller et de les contrôler. Pour promouvoir un produit qui a été altéré dans l'intention d'avantager le consommateur, les manufacturiers eux-mêmes seraient requis dans tous les cas de faire un suivi de l'identité, ce qui ne devrait pas avoir comme conséquence d'ajouter un autre fardeau important sur leurs épaules.
Il est important d'établir jusqu'à quelle limite l'élément nutritif modifié (si l'intention était de modifier délibérément le niveau d'un élément nutritif) est biodisponible et demeure stable durant la culture, dans le temps, lors du traitement, de l'entreposage et de la cuisson.
La révision des effets nutritionnels non intentionnels dans un aliment modifié dans le but d'obtenir un effet nutritionnel intentionnel suivrait les mêmes étapes qu'en ce qui concerne les autres aliments nouveaux.
Évaluation nutritionnelle de l'augmentation prévue ou inattendue des concentrations d'un nutriment ou d'une substance bioactive
- L'augmentation des concentrations d'un nutriment ou d'une autre substance bioactive intrinsèque (y compris un micro-organisme) dans un aliment doit être évaluée pour en vérifier l'innocuité.
- Les données nécessaires à cette fin comprennent :
- la concentration du nutriment ou d'une autre substance ciblé et prévu dans l'aliment;
- le groupe ciblé prévu, le cas échéant, ou le ou les groupes qui risquent le plus d'ingérer une grande quantité de l'aliment;
- le niveau prévu d'exposition à la substance par la consommation de l'aliment par le groupe ciblé, par des sous-groupes vulnérables et à l'extrémité supérieure ou inférieure d'ingestion de l'aliment dans tous les groupes (âge et sexe), selon les données canadiennes récentes sur la consommation d'aliments, dans la mesure du possible;
- la façon dont le niveau prévu d'exposition au nutriment ou à une autre substance ciblé diffère des niveaux actuels d'exposition de toutes les sources;
- toute utilisation possible de ce produit comme remplaçant d'aliments existants;
- des données en appui de l'innocuité du niveau prévu d'exposition.
4.1.3.6 Examens toxicologiques
Il est absolument nécessaire d'effectuer des tests toxicologiques sur les substances dont on ne connaît pas l'innocuité et qui sont introduites dans l'approvisionnement alimentaire. De nouvelles substances peuvent être introduites dans l'apport nutritif par des technologies de l'ADN recombinant ou peuvent être générées par l'application de nouveaux processus aux aliments ou [autres processus de modification de l'ADN]. L'introduction de nouvelles substances peut être intentionnelle ou non intentionnelle.
Les techniques de modifications génétiques peuvent causer la création de nouvelles substances par l'organisme ou la modification intentionnelle ou non intentionnelle de substances déjà produites par l'organisme ou son expression.
Substances nouvelles
Les techniques d'acide nucléique in vitro permettent la production d'ADN qui peuvent causer la synthèse de nouvelles substances dans les plantes. Ceci inclut le produit d'expression de la protéine et d'autres substances qui peuvent être générées à la suite de l'activité enzymique du produit d'expression de la protéine. Les nouvelles substances peuvent être des composantes conventionnelles d'aliments des plantes telles que les protéines, les gras, les hydrates de carbone ou les vitamines qui sont nouvelles dans le contexte de cette plante dont l'ADN est recombinant.
L'introduction de cette caractéristique ne devrait pas être reliée à aucune caractéristique des organismes donneurs qui pourraient être nuisibles à la santé humaine. On devrait fournir l'information pour assurer que le codage des gènes des toxines ou des éléments non nutritifs connus présents dans l'organisme des donneurs ne soit pas transféré à des plantes à l'ADN recombinant qui n'expriment pas normalement ces caractéristiques toxiques ou non nutritives. Cette assurance est particulièrement importante dans les cas où des plantes à l'ADN recombinant ne sont pas traitées de la même manière qu'une plante donneuse parce que les techniques de traitement traditionnelles associées aux organismes donneurs peuvent désactiver les éléments antinutritionnels ou toxiques.
Des études toxicologiques ne sont pas considérées comme nécessaires lorsque la substance, ou une substance étroitement reliée ont été consommées de façon sûre dans les aliments, à des rations équivalentes, ou lorsque la nouvelle substance n'est pas présente dans les aliments. Autrement, l'utilisation d'études toxicologiques conventionnelles sur la nouvelle substance sera nécessaire. Ceci peut requérir l'isolement de la nouvelle substance de la plante à l'ADN recombinant ou la production de la substance à partir d'une source alternative et dans ce cas, le matériel devrait être biochimiquement et fonctionnellement équivalent à celui produit dans la plante à l'ADN recombinant.
Pour les protéines, l'évaluation de la toxicité potentielle devrait se centrer sur la similarité de la séquence en acide aminé, entre la protéine, des toxines et d'autres éléments non nutritifs connus (p. ex., les inhibiteurs de protéase, les lectines), de même que sur la stabilité lorsqu'il s'agit de chauffer ou de traiter et de la dégradation dans les systèmes représentatifs appropriés de modèles gastriques et intestinaux. Puisque les protéines qui sont des enzymes ne se sont jamais révélées être des substances cancérigènes qui agissent directement, des mutagènes, des tératogènes ou des produits toxiques reproductifs (Pariza et Foster 1983) il n'est généralement pas nécessaire de soumettre ces protéines à des essais pour des critères d'évaluation toxicologiques lorsque l'exposition apparaît par la voie orale. Les toxines agissent par des mécanismes pénétrant après l'administration d'une simple dose à des doses de nanogramme à milligramme par kilogramme du poids corporel (pc). Ainsi, les études de la toxicité aiguë pénétrant par voie orale qui utilisent des doses gramme/kg pc de la nouvelle protéine sont appropriées pour évaluer la toxicité potentielle des protéines. Un résultat négatif en utilisant l'écart en gramme/kg du poids corporel avec la preuve que la protéine est digérée en de petits peptides et en acides aminés fournira l'assurance que la protéine n'est pas une toxine et qu'elle est assimilée aux éléments nutritifs comme le sont la vaste majorité des protéines diététiques.
Différents types d'études in vivo ou in vitro seraient nécessaires pour évaluer la toxicité des substances introduites autres que les protéines. Les types d'études sont déterminés sur la base du cas par cas et dépendent de la source originale des substances introduites et de leurs fonctions. De telles études peuvent inclure des essais de métabolismes, de toxicocinétique, de toxicité/carcicogénicité chroniques, d'impact sur la fonction reproductive et de tératogénicité.
Effets non intentionnels
Les techniques utilisées dans la modification génétique des plantes ou des micro-organismes ont le potentiel de produire des effets non intentionnels sur le génome de l'organisme modifié qui pourraient se manifester par une altération du niveau de toxines ou d'éléments non nutritifs normalement produits par cet organisme. L'altération génétique intentionnelle peut également influencer le comportement de l'organisme quant à l'accumulation de contaminants, de pesticides ou autres substances provenant de l'environnement qui n'était pas anticipée.
L'analyse compositionnelle est la méthode actuellement utilisée pour détecter les changements non intentionnels au génome qui sont causés par l'accumulation de substances toxiques d'origine endogène et exogène. En raison de l'influence du stress environnemental sur la production des composantes endogènes telles que les toxines et les éléments non nutritifs, il serait nécessaire de collecter des données d'un grand nombre de sites d'essais. Des technologies nouvelles, plus sensibles, qui permettent de déterminer les altérations à l'expression du génome des organismes sont présentement en voie de développement.
4.1.3.7 Examens relatifs à l'allergénicité
L'examen principal de l'évaluation de l'allergénicité d'un aliment nouveau a trait à la prévention d'une exposition inattendue et inévitable des personnes sensibles aux allergènes alimentaires. Ceci inclut l'évaluation du potentiel d'aliments contenant de nouvelles protéines à interagir avec des allergènes alimentaires connus ou à mener au développement d'une hypersensibilité de novo. De plus, la possibilité d'accroître le potentiel allergénique à des aliments contenant des allergènes causé par une modification génétique devrait être évaluée. Les exigences suivantes proviennent de la directive du Codex sur la conduite d'évaluation de l'innocuité des aliments dérivés de plantes à ADN recombinant.
Section 1 - Introduction
Toutes les nouvelles protéines d'expression dans les plantes à ADN recombinant qui pourraient être présentes dans l'aliment final et qui sont nouvelles dans le contexte de cet aliment doivent être évaluées à l'égard de leur potentiel à causer des réactions allergiques. Ceci devrait inclure de vérifier si une nouvelle protéine d'expression en est une à laquelle certaines personnes pourraient déjà être sensibles et si une nouvelle protéine nouvellement introduite dans l'apport alimentaire est susceptible de produire des réactions allergiques chez certaines personnes.
Pour le moment, on ne connaît pas de test qui puisse mesurer directement le potentiel allergène d'une nouvelle protéine d'expression chez les humains. Selon les meilleures informations scientifiques actuellement disponibles, l'approche recommandée qui est utilisée tient compte de la prépondérance de la preuve dérivée des divers types d'informations et des données d'une manière intégrée, par étapes logiques et au cas par cas.
Section 2 - Stratégie d'évaluationNote de bas de page 7
Les étapes initiales d'évaluation de l'allergénicité possible de nouvelles protéines d'expression supposent que l'on détermine ce qui suit : l'allergénicité de la source de la protéine introduite; la similitude entre la séquence d'acide aminé de la protéine et des allergènes connus ainsi que certaines propriétés physico-chimiques, incluant, mais ne se limitant pas à sa prédisposition à la dégradation enzymatique.
Les gènes dérivés de sources allergéniques connues devraient être considérés comme étant aptes à encoder pour un allergène à moins qu'une preuve scientifique ne démontre le contraire.
La détermination des caractéristiques physico-chimiques et d'homologie de la séquence d'acide aminé exigera l'isolement de la nouvelle protéine d'expression de l'organisme à ADN recombinant, ou la synthèse de production de la substance d'une source alternative, dans lequel cas le matériel devrait apparaître comme étant fonctionnellement et biochimiquement équivalent à celui produit dans l'organisme à ADN recombinant.
Les protéines alimentaires qui ne sont pas allergènes et qui sont altérées par des techniques de genèse doivent être évaluées seulement pour la probabilité que leur protéine mutagénisée est un allergène de novo.
L'exposition absolue à la nouvelle protéine d'exposition et aux effets du traitement alimentaire approprié contribuera à tirer des conclusions générales au sujet des risques potentiels pour la santé humaine. À cet égard, la nature du produit alimentaire prévu pour la consommation devrait être examinée lorsqu'on détermine les types de traitements qui seraient appliqués et de ses effets sur la présence de la protéine dans le produit alimentaire final.
Section 3 - évaluation initiale
Section 3.1 - Source de la protéine
En tant que partie intégrante des données visant à supporter l'innocuité des aliments dérivés d'organismes à ADN recombinant, l'information devrait décrire tous les rapports d'allergénicité associés aux organismes donneurs. Les sources allergéniques de gènes seraient définies comme étant celles des organismes pour lesquelles des preuves raisonnables d'allergie par IgE se servant de la voie orale, respiratoire ou de contact sont disponibles. Des outils spécifiques ou des données pertinentes qui permettent la confirmation de l'allergénicité sont disponibles pour les protéines provenant de certaines sources allergéniques. Ceci inclut ce qui suit : la disponibilité de sérums à des fins de dépistage; des types, de la gravité et de la fréquence documentés des réactions allergéniques ainsi que des caractéristiques structurales et des séquences d'acide aminé (lorsqu'elles sont disponibles) de protéines allergéniques connues de cette source.
Section 3.2 - Homologie du gène d'acide aminé
Les comparaisons d'homologies de gènes d'acide aminé devraient être utilisées pour évaluer jusqu'à quel point la structure d'une protéine d'expression est similaire aux allergènes connus afin de déterminer si une protéine a un pouvoir allergisant ou d'inter- réactivité. Les similitudes structurales globales peuvent être prédites en utilisant les recherches d'homologie séquentielles qui comparent la structure des nouvelles protéines d'expression avec tous les allergènes connus et devraient être menées en utilisant divers algorithmes tels que FASTA or BLASTP. Des stratégies telles que des recherches par étapes logiques de segments d'acide aminé identiques contiguës peuvent également être adoptés afin de déterminer les séquences qui peuvent représenter des épitopes linéaires. L'ampleur de la recherche sur l'acide aminé contiguë devrait reposer sur une logique scientifique justifiée afin de minimiser la possibilité d'obtenir de faux résultats négatifs ou positifsNote de bas de page 8. Des recherches validées et des processus d'évaluation devraient être utilisés afin de produire des résultats biologiques significatifs. L'inter-réactivité IgE entre la nouvelle protéine d'expression et un allergène connu devrait être considérée comme une possibilité lorsqu'il y a plus de 35 % d'identité dans un segment de 80 ou plus d'acide aminé (FAO/OMS 2001).
Les recherches d'homologie séquentielle ont certaines limites. En particulier, les comparaisons sont limitées aux allergènes connus dans les bases de données disponibles et dans la littérature scientifique. Il existe également des limites quant à l'habilité de telles comparaisons à détecter des épitopes de fixation d'IgE non contiguës.
Un résultat d'homologie séquentielle négatif indique que la nouvelle protéine d'expression n'est pas un allergène connu et a peu de chance d'interagir avec des allergènes connus. Un résultat indiquant l'absence d'homologie séquentielle importante devrait être considéré avec les autres données exposées en vertu de cette stratégie en évaluant l'allergénicité des nouvelles protéines d'expression. Ceci n'écarte pas le fait que d'autres études ont été considérées comme nécessaires (voir également la section 6). Un résultat d'homologie séquentielle positif indique que le taux de probabilité de la nouvelle protéine d'expression d'être allergénique est très élevé. Si le produit ne doit pas être pris davantage en considération, il devrait être évalué en utilisant le sérum de personnes sensibles à la source allergénique identifiée (voir section sur le criblage d'un sérum spécifique).
Section 3.3 - Résistance aux pepsines
La résistance à la digestion des pepsines a été observée dans plusieurs allergies alimentaires; ainsi, il existe une corrélation entre la résistance à la digestion des pepsines et l'allergénicitéNote de bas de page 9. La résistance d'une protéine à la dégradation en la présence de pepsine dans des conditions appropriées indique qu'une analyse subséquente devrait être menée pour déterminer la probabilité que la nouvelle protéine d'expression soit allergénique. L'établissement d'un protocole consistant et bien validé de dégradation des pepsines pourrait améliorer l'utilité de cette méthode.
Même si le protocole de résistance à la pepsine est fortement recommandé, il est reconnu qu'il existe d'autres protocoles de vive sensibilité aux enzymes. Des protocoles alternatifs peuvent être utilisés lorsqu'une justification adéquate est fournie.
Section 4 - Criblage des sérums spécifiques
Dans le cas des protéines qui proviennent d'une source connue pour être allergène ou pour avoir une homologie séquentielle avec un allergène connu, on doit faire des essais immunologiques. Le sérum sanguin des personnes atteintes d'une allergie à une source de la protéine validée cliniquement peuvent être utilisés pour vérifier le pouvoir liant de l'IgE de la protéine dans des essais in vitro. Un enjeu critique des essais concernera la disponibilité de sérum d'un nombre suffisant de personnesNote de bas de page 10. De plus, la qualité des sérums et de la procédure des essais doivent être normalisés pour obtenir un résultat d'essai valide.
Dans le cas d'une nouvelle protéine d'expression dérivée d'une source allergénique connue, un résultat négatif lors d'un immuno-essai in vitro peut ne pas être considéré comme suffisant, mais devrait inciter à réaliser des essais additionnels, telle que l'utilisation possible du test cutané et des protocoles ex vivo.
La classification d'une nouvelle protéine d'expression en tant qu'allergène par le biais des essais immunologiques laisse entendre que le développement futur du produit pour la commercialisation doit être découragé, à moins que des mesures adéquates de gestion des risques et de la communication des risques peuvent être assurés par le marketing et la distribution du produit, puisque la protection de la ségrégation et de l'identité de la nouvelle source de cet allergène peuvent être difficiles, voire impossibles à mettre en application.
Section 5 - Secteur nécessitant davantage de développement
L'aboutissement de l'évaluation des données discutée ci-dessus mène à une conclusion, à savoir la probabilité que la protéine soit un allergène alimentaire. Les techniques de criblage du sérum ciblé (p. ex., l'évaluation de la liaison au IgE dans le cas de sérum de personnes ayant des réactions allergiques validées cliniquement à une grande catégorie d'aliments reliés) et l'utilisation de modèles d'animaux, une fois développées et validées, pourraient améliorer le poids de la preuve utilisée pour tirer cette conclusion. Pour permettre le criblage du sérum, il faudrait prendre des mesures pour mettre sur pieds une banque internationale de sérums. Alors que la connaissance et la technologie scientifiques évoluent, d'autres méthodes telles que l'examen des nouvelles protéines d'expression pour les cellules T des épitopes et les motifs structuraux associés aux allergènes, pourraient également être utiles.
Effets non intentionnels sur les allergènes endogènes
Les techniques de modifications génétiques ont le potentiel de produire des effets non intentionnels sur le génome qui pourraient mener à une augmentation de l'expression des allergènes endogènes. Bien qu'on ne connaisse pas avec certitude les effets qu'aurait cet accroissement sur la santé, il faudrait les considérer comme indésirables. Les techniques servant à évaluer la possibilité d'effets sur l'expression allergène endogène sont les suivantes : une comparaison quantitative de la composition protéinique de la partie comestible de l'organisme modifié ou, lorsque l'on dispose d'échantillons de sérum sanguin d'un nombre suffisant de personnes allergiques à l'aliment en question, la réactivité immunologique comparative de la partie comestible de l'organisme modifié à l'aide de techniques de buvardage.
4.1.3.8 Examens chimiques
Il faut signaler la présence de contaminants chimiques, de même que la concentration de ces contaminants. Les niveaux de concentration et les types de contaminants éventuels seraient spécifiques à l'aliment à modifier et, aussi, au type de processus utilisé pour procéder à la modification génétique. À cet égard, les contaminants pourraient être présents naturellement dans les aliments avant la modification génétique, ou pourraient avoir été introduits, ou leur concentration avoir été modifiée, dans les aliments dérivés de la culture modifiée par rapport à la souche parentale non modifiée, selon des conditions de croissance équivalentes, conséquemment à une modification génétique. Dans ce dernier cas, il serait nécessaire de fournir une comparaison de la concentration de contaminants chimiques dans les aliments modifiés génétiquement avec les concentrations généralement observées dans les aliments d'origine. Les métaux (p. ex., l'arsenic, le cadmium, le mercure et le plomb), les contaminants organiques, y compris les polluants organiques persistants, ou POP (p. ex., le DDT, l'aldrine, la dieldrine, etc.) et les contaminants naturels, y compris les mycotoxines (p. ex., l'aflatoxine, la vomitoxine, l'ochratoxine, la zéaralénone, etc.) sont des exemples de contaminants potentiels.
Tout additif alimentaire présent dans le produit alimentaire final (p. ex., les antiagglomérants, les solvants de support, les diluants solides, les colorants, les agents de conservation) ou les adjuvants de fabrication utilisés pendant la fabrication de l'aliment (p. ex., les adjuvants de précipitation et de filtration, etc.) doivent être définis et leur niveau spécifié.
Dans le cas des aliments nouveaux dont l'utilisation est prévue en tant qu'ingrédient dans d'autres aliments, les spécifications quant à l'identité et à la pureté doivent être fournies, et accompagnées d'un exemple d'étiquette et du mode d'emploi.
4.2 Nouveaux aliments dérivés de micro-organismes
Les micro-organismes constituent une composante importante des aliments depuis des millénaires. Ils peuvent être consommés comme inoculant dans le lait fermenté, la viande ou les légumes ou leurs métabolites peuvent être utilisés dans les aliments et le traitement des aliments. Plus récemment, les micro-organismes ont également été consommés directement en tant qu'aliments sous la forme de protéines unicellulaires. Les nouveaux aliments ou les ingrédients peuvent être dérivés de micro-organismes qui ne sont pas traditionnellement utilisés en tant que source alimentaire au Canada, manufacturés selon de nouveaux processus impliquant des micro-organismes ou être produits par des micro-organismes qui ont été modifiés génétiquement selon une variété de techniques.
Il est recommandé que les informations suivantes soient incluses dans l'évaluation de l'acceptabilité de nouveaux micro-organismes et leurs produits qui sont prévus pour être utilisés dans ou en tant qu'aliments. Il est important de noter que les exigences d'information indiquées ci-dessous peuvent ne pas être toutes appropriées dans tous les cas.
4.2.1 Substance sans antécédents d'innocuité comme aliment
- 4.2.1.1 Antécédent d'utilisation
- 4.2.1.2 Exposition alimentaire
- 4.2.1.3 Examens nutritionnels
- 4.2.1.4 Examens toxicologiques
- 4.2.1.5 Examens relatifs à l'allergénicité
- 4.2.1.6 Examens chimiques
4.2.2 Procédé nouveau
- 4.2.2.1 Détails du procédé nouveau
- 4.2.2.2 Exposition alimentaire
- 4.2.2.3 Historique de l'organisme
- 4.2.2.4 Examens nutritionnels
- 4.2.2.5 Examens toxicologiques
- 4.2.2.6 Examens relatifs à l'allergénicité
- 4.2.2.7 Examens chimiques
4.2.3 Modifications génétiques
- 4.2.3.1 Caractérisation de la souche dérivée
- 4.2.3.2 Considérations relatives aux modifications génétiques
- 4.2.3.3 Historique de l'organisme (hôte et donneur(s))
- 4.2.3.4 Exposition alimentaire
- 4.2.3.5 Examens nutritionnels
- 4.2.3.6 Examens toxicologiques
- 4.2.3.7 Examens relatifs à l'allergénicité
- 4.2.3.8 Examens chimiques
4.2.1 Substance sans antécédents d'innocuité comme aliment
L'évaluation de l'innocuité des aliments nouveaux de cette catégorie suit un processus progressif d'examen des facteurs pertinents, dont :
- 4.2.1.1 Antécédent d'utilisation
- 4.2.1.2 Exposition alimentaire
- 4.2.1.3 Examens nutritionnels
- 4.2.1.4 Examens toxicologiques
- 4.2.1.5 Examens relatifs à l'allergénicité
- 4.2.1.6 Examens chimiques
- 4.2.1.7 Examens microbiologiques
4.2.1.1 Antécédent d'utilisation
On peut considérer qu'une substance a un antécédent d'innocuité comme aliment lorsque, depuis bon nombre de générations, elle fait partie continue du régime d'une population humaine vaste et génétiquement diverse, où cette substance est consommée selon des méthodes et des niveaux auxquels on s'attend au Canada. Le fait qu'un produit a un antécédent d'utilisation dans le sens de cette définition, dans un territoire ayant un système alimentaire semblable, accroîtrait le niveau de confiance des preuves présentées. Les renseignements suivants seraient nécessaires pour appuyer l'allégation selon laquelle un produit a un antécédent d'innocuité comme aliment :
- Des preuves historiques indiquant une consommation continue et fréquente par une section transversale de la population pendant plusieurs générations. Ces preuves peuvent être tirées de diverses sources, y compris, sans toutefois s'y limiter, des articles scientifiques et des brevets, des publications non scientifiques ainsi que des livres, des livres de recettes, des ouvrages sur l'histoire de la culture de l'alimentation, des affidavits d'au moins deux autorités indépendantes et reconnues comprenant des récits bien documentés de la manière dont on utilise l'aliment en question et une explication de la façon dont ils ont pris connaissance de cet historique. Une utilisation limitée ou une exposition à court terme ne suffirait pas pour démontrer un antécédent d'innocuité comme aliment.
- Une déclaration de tout effet nocif éventuel lié à l'aliment en question, documenté dans son pays d'origine ou dans un pays où l'aliment est consommé en grande quantité.
- Une description des méthodes traditionnelles de traitement et de préparation commerciale et personnelle en vue de la consommation.
- Une description des méthodes de culture de l'aliment en question ou, s'il est à l'état sauvage, des méthodes de récolte.
- La quantité de l'aliment que les Canadiens consommeraient probablement, y compris les portions types et la fréquence prévue de consommation, selon des niveaux de consommation moyens et extrêmement élevés.
- Une analyse de la composition de l'aliment sur des échantillons choisis au hasard et statistiquement valides. Cette analyse devrait comprendre des données immédiates ainsi qu'un profil des acides aminés et des acides gras, sa composition en minéraux, en oligo-éléments et en vitamines ainsi que tout nutriment, facteur antinutritionnel et produit phytochimique bioactif soulevant un intérêt particulier concernant le produit en question. Cette analyse devrait particulièrement porter sur la présence, dans l'aliment, de composés qui pourraient avoir des retombées sur la santé des groupes de la population canadienne (comme les produits éventuellement toxiques ou allergènes, ou encore des niveaux particulièrement élevés de nutriments dans la source de nourriture ou le produit alimentaire final).
- Les effets sur le métabolisme et le système gastro-intestinal des humains.
Cette soumission doit contenir des données fiables et de qualité, ainsi que des sources de référence. L'évidence anecdotique aura moins de poids que les données scientifiques. L'information sur l'historique de l'exposition des humains est spécialement importante lorsqu'il s'agit d'un aliment nouveau qu'il faut préparer ou cuire de manière traditionnelle. Cette information doit être présentée aux consommateurs de façon uniforme.
4.2.1.2 Exposition alimentaire
Le rôle de l'évaluation de l'exposition alimentaire concernant les substances sans antécédent d'innocuité comme aliment consiste à estimer :
- la quantité de l'aliment qui risque d'être consommée et la fréquence de consommation, ainsi que le rôle que cet aliment pourrait jouer dans l'alimentation, s'il diffère du rôle de l'aliment non modifié;
- l'impact possible de cet aliment sur l'apport nutritionnel, en combinant le résultat des recherches réalisées au point a) aux renseignements sur les changements, le cas échéant, dans la composition nutritionnelle de l'aliment;
- s'il est possible que des facteurs antinutritionnels, des toxines, des contaminants ou des substances nouvelles se trouvent dans l'aliment, l'exposition potentielle à ces substances.
L'introduction d'aliments sans antécédent d'innocuité comme aliment peut provoquer des conséquences nutritionnelles, toxicologiques ou allergènes qui pourraient avoir une incidence sur la salubrité des aliments; une évaluation de l'exposition aux composantes de cet aliment ayant d'importantes conséquences sur la santé doit être envisagée. En ce qui concerne ces aliments, l'évaluation de l'exposition alimentaire comporte des défis particuliers, puisque l'aliment ne constitue pas simplement un aliment existant auquel on a apporté des changements; il n'existe aucune expérience préalable de son rôle dans l'approvisionnement alimentaire sur laquelle il est possible de fonder des conclusions sur le plan de l'exposition. La méthode requise pour prévoir des modèles de consommation possibles nécessiterait probablement l'utilisation de données sur l'apport de produits de composition nutritionnelle semblable qui jouent un rôle similaire dans l'alimentation et qui sont consommés de manière routinière par les Canadiens. L'incidence de la sapidité des aliments et la façon dont on fera la promotion de ces aliments devront être évaluées. Une simulation d'exposition pourrait ensuite être effectuée en fonction des bases de données actuelles sur l'apport alimentaire, en utilisant de préférence des données obtenues chez des sujets canadiens, dans lesquelles l'aliment nouveau a été intégré en le substituant par un aliment ou par des aliments qui pourraient le remplacer dans l'alimentation. Ces estimations de l'apport alimentaire peuvent ensuite être utilisées pour calculer l'exposition alimentaire possible à des composantes spécifiques de l'aliment nouveau qui ferait l'objet de l'évaluation de l'innocuité.
Les résultats de l'évaluation de l'exposition doivent décrire les changements prévus de la distribution des microconstituants dans l'apport alimentaire en utilisant des mesures comme la moyenne, la variabilité et les percentiles (supérieur et inférieur) de l'apport. L'impact différentiel sur les sous-groupes de la population (p. ex., les enfants, les nourrissons, les personnes âgées, les groupes ethniques, les populations sensibles) doit être évalué, de même que l'impact sur la population dans son ensemble.
Bien que l'introduction d'un aliment complètement nouveau puisse changer les modèles de consommation alimentaire et, par conséquent, avoir une incidence plus large sur la nutrition et sur l'exposition aux autres composantes de l'alimentation qui peuvent être directement attribuées à l'aliment en soi, ces types de changement peuvent être impossibles à prévoir, et la nécessité de telles projections ou de suivi après la mise en marché, ou leur faisabilité, devra être évaluée au cas par cas. Des sondages périodiques sur la nutrition, réalisés auprès de la population, conviendraient probablement mieux pour définir les tendances alimentaires qui pourraient découler des aliments nouvellement introduits, des aliments devenus plus accessibles ou plus populaires, de même que de nombreux autres facteurs qui ont une incidence sur les régimes alimentaires au Canada et qui pourraient avoir un impact bénéfique ou nocif sur la santé (voir la section 3.4).
4.2.1.3 Examens nutritionnels
Observations générales
L'introduction d'un aliment nouveau dans l'approvisionnement alimentaire canadien est nécessite que l'on détermine la qualité nutritionnelle de l'aliment et les implications de ses caractéristiques nutritionnelles pour l'ensemble de la population ou pour des sous-groupes particuliers. Ces sous-groupes de la population peuvent être plus vulnérables pour différentes raisons, par exemple, les jeunes enfants, les femmes enceintes et les mères qui allaitent, les personnes ayant des caractéristiques métaboliques particulières, les adolescents et d'autres personnes qui peuvent consommer de grandes quantités d'aliments, ou les personnes âgées qui ne consomment que de petites quantités d'aliments. Une évaluation nutritionnelle, comprenant un examen des effets intentionnels et inattendus, est nécessaire dans le but de s'assurer que l'état nutritionnel des consommateurs ne risque pas d'être menacé par :
- la substitution d'aliments ou d'ingrédients alimentaires qui ont une valeur nutritionnelle considérable, par des variétés moins nutritives de ces aliments ou d'aliments semblables;
- l'ingestion excessive de nutriments ou d'autres substances bioactives du fait que l'aliment nouveau en contient des niveaux exceptionnellement élevés;
- des niveaux récents ou accrus de facteurs antinutritionnels qui pourraient affecter de façon négative la valeur nutritionnelle de l'aliment ou du régime alimentaire.
Qu'est-ce que la qualité nutritionnelle?
La qualité nutritionnelle, telle qu'appliquée aux aliments, est liée à la présence de nutriments essentiels et de substances énergétiques (en quantité et qualité adéquates) ainsi qu'à d'autres aspects des aliments traditionnellement considérés comme faisant partie de la science de la nutrition. Ces aspects comprennent les rôles nutritionnels des acides aminés non essentiels, des types spécifiques d'acides gras et d'hydrates de carbone, des fibres alimentaires, du cholestérol, des substances lipotropes, et d'autres composants d'aliments spécifiques (p. ex., le lait maternel), de la biodisponibilité et des interactions entre les nutriments et les autres nutriments, les additifs alimentaires et les substances toxiques naturelles. Ils incluent également les excès de nutriments et les effets (à la fois positifs et négatifs) de la transformation des aliments sur les nutriments et sur les propriétés organoleptiques des aliments. On a plus récemment démontré qu'une gamme étendue de substances « bioactives » trouvées principalement dans les végétaux avait peut-être un rôle à jouer dans l'amélioration ou la protection de la santé de l'homme. Ces rôles sont également compris dans la définition au sens large de la qualité nutritionnelle.
Aliments sans antécédents d'innocuité comme aliment
La principale préoccupation à l'égard des aliments sans antécédent d'innocuité comme aliment consisterait à vérifier s'il est possible que la consommation de ces aliments ait un effet nocif sur la santé nutritionnelle du consommateur. L'information sur la composition et la qualité nutritionnelles est principalement nécessaire pour déterminer de quelle manière les aliments peuvent être utilisés dans le régime alimentaire, pour déterminer les renseignements sur la composition de base de l'aliment à utiliser dans les banques de données sur la composition des aliments, et pour permettre la validation des allégations concernant la valeur nutritive et des déclarations de quantité.
Lignes directrices sur la production de données pour l'évaluation nutritionnelle
- Fonction des données à être soumises
- Les renseignements fournis sur un aliment sans antécédent d'innocuité comme aliment doivent être suffisants, sur le plan de la qualité comme de la quantité, pour déterminer son rôle dans le régime alimentaire et définir la composition nutritionnelle moyenne de l'aliment.
- Toutes les études visant à évaluer la qualité nutritionnelle doivent porter sur l'aliment tel qu'on prévoit l'utiliser pour la consommation humaine.
- Lorsque les données publiées sur la composition nutritionnelle d'un aliment nouveau ne sont pas suffisantes, le demandeur peut devoir obtenir des données analytiques. Dans ce cas, une hypothèse claire doit être formulée et accompagnée d'une méthodologie appropriée, afin d'obtenir des données sur la composition nutritionnelle qui permettront ce qui suit :
- Examiner toutes les sources importantes de variation possible dans la qualité nutritionnelle, par exemple la composition du milieu de croissance, les conditions de fermentation (température, pH, étape de croissance), etc., au moment d'élaborer le concept expérimental et les méthodologies d'échantillonnage.
- Exposer le nouveau micro-organisme ou l'aliment qui le contient aux conditions prévues pour la production commerciale.
- Établir un plan d'échantillonnage avant le début de l'étude, fondé sur un calcul permettant d'utiliser au moins une ou plusieurs composantes, afin d'indiquer le nombre d'échantillons requis. Cela pourrait être fondé sur les analytes les plus importants ou les analytes que l'on prévoit être plus variables et nécessiter plus d'échantillons. Il faut fournir des détails concernant la puissance et la taille prévues de la méthodologie choisie pour le test statistique proposé ainsi que des vérifications d'hypothèses.
- S'assurer que l'échantillonnage est effectué au cours des étapes de production appropriées.
- S'assurer que toutes les analyses appropriées sont faites sur tous les produits contenant les micro-organismes et devant être utilisés en tant qu'aliments au Canada.
- Établir les critères de sélection des nutriments analysés et la justifier l'exclusion des analyses de tout nutriment et de toute autre substance figurant dans la section « Composition des nutriments » ci-dessous.
- Veiller à ce que les échantillons utilisés dans le cadre de cette étude soient analysés dans un délai acceptable suivant la date de cueillette.
- S'assurer que les analyses de chaque composant, nutritif et non nutritif, sont effectuées sur tous les échantillons, par le même laboratoire, selon des méthodes d'analyse approuvées et validées à l'échelle internationale, et selon des procédures de conservation des échantillons et de préparation uniformes et appropriées, et ce, tout au long des analyses.
- Utiliser des méthodes statistiques pertinentes et uniformes, choisies à l'avance selon la conception de l'étude à analyser, et présenter les résultats.
-
Composition des nutriments
Les composants des aliments nouveaux présentés ci-dessous devraient être analysés dans le contexte des lignes directrices de l'étude susmentionnée. Même si les nutriments ne sont pas tous analysés, le demandeur devrait fournir les critères de sélection des nutriments analysés et indiquer les raisons pour lesquels certains nutriments ou d'autres substances figurant dans la liste suivante ont été exclus de l'analyse.
- la composition immédiate (p. ex., les cendres, l'humidité, les protéines, le gras, les fibres, les hydrates de carbone);
- le contenu en protéine vraie, en matière azotée non protéinée (p. ex., les acides nucléiques et les aminoglycosides), le profil en acides aminés - la quantité d'acides aminés inhabituels devrait être déterminée si on suspecte leur présence (p. ex., les acides aminés d'origine bactérienne);
- le profil complet des acides gras exprimé en tant que pourcentage total des acides gras, les composants non saponifiables, et les stérols - la liste des acides gras doit être regroupée selon les catégories monoinsaturé, polyinsaturé et saturé;
- la composition de la fraction des hydrates de carbone (p.ex., les sucres, les amidons, les chitines, les tanins, les polysaccharides non amylacés et les lignines);
- la composition des micronutriments (p. ex., l'analyse des vitamines et des minéraux importants);
- la présence de facteurs antinutritionnels naturels ou adventifs (p. ex., les phytates, les inhibiteurs de la trypsine, etc.);
- les métabolites secondaires prévisibles, les substances physiologiques actives (bioactives) et les autres substances décelées.
-
Biodisponibilité des nutriments / Présence de facteurs antinutritionnels
Dans les situations où un micro-organisme, ou l'aliment nouveau qui le contient, peut devenir un important composant du régime alimentaire canadien, ou un fournisseur important de nutriments, des études sur les animaux devraient être effectuées afin d'évaluer le niveau de la valeur nutritionnelle. Ceci se rapporte en particulier à l'évaluation de la qualité des protéines, à la possibilité de facteurs antinutritionnels inconnus et à la question relative à la biodisponibilité des nutriments.
Le cas échéant, des renseignements devraient être fournis afin de décrire les conditions de transformation qui seraient utilisées dans la production de l'aliment nouveau et les effets de la transformation sur la concentration de nutriments et la biodisponibilité de ceux-ci.
- Renseignements à inclure dans la demande :
- le nom du micro-organisme y compris les noms latin et usuel;
- une description complète du concept expérimental, des conditions expérimentales et de la façon dont les sources de variation des concentrations de nutriments ont été contrôlées;
- une description complète de la cueillette et de la préparation des échantillons;
- une présentation ou une description des méthodes statistiques et d'analyse qui ont été utilisées afin d'obtenir des données sur les composants nutritionnels et non nutritionnels;
- les nutriments et les données relatives exprimées sous forme de moyenne ± l'écart-type et sous forme d'étendue;
- les résultats de l'analyse statistique;
- les données brutes de tous les composants analysés;
- les données publiées, si elles sont accessibles;
- l'utilisation prévue au Canada du micro-organisme en tant qu'aliment, par exemple le(s) type(s) d'ingrédients, le produit final possible, le niveau d'utilisation s'il est différent de celui des produits actuels qu'il remplacerait, les habitudes reconnues d'utilisation ainsi que la consommation de l'aliment et de ses dérivés;
- toute utilisation non prévue, envisageable.
- Processus de prise de décision
- Tous les aspects de la qualité nutritionnelle seront évalués et fondés sur les principes, les normes et les lignes directrices nutritionnelles de pointe visant à répondre aux besoins nutritionnels de l'homme. Les fondements de l'évaluation comprennent : les recommandations concernant l'apport nutritionnel, le rôle de l'aliment dans le régime alimentaire de la population et l'incidence du régime et de la nutrition sur la réduction des risques de développer une maladie liée au régime et sur la promotion de la santé.
- La première phase de l'évaluation nutritionnelle sera fondée sur les données relatives à la composition nutritionnelle et sur une évaluation des effets intentionnels et non intentionnels sur la composition nutritionnelle. Si l'on découvre des composants, des concentrations de nutriments ou des substances nutritives inhabituels ou inattendus, l'aliment peut alors être soumis à des analyses plus approfondies.
- Il n'est pas nécessaire qu'un aliment nouveau sans antécédent d'innocuité comme aliment satisfasse des critères spécifiques de qualité nutritionnelle. La principale préoccupation consiste à documenter la composition de l'aliment afin d'évaluer les allégations et de déterminer le rôle qu'il peut jouer dans le régime alimentaire.
4.2.1.4 Examens toxicologiques
Des tests toxicologiques sont nécessaires en ce qui concerne les substances pour lesquelles l'innocuité demeure inconnue et qui pourraient être introduites dans l'approvisionnement alimentaire. Dans le cas des aliments qui n'ont pas d'antécédent d'innocuité comme aliment, il est parfois difficile de cerner les composants qui sont nouveaux à la consommation humaine sans contrepartie classique.
Lorsqu'il n'est pas possible de cerner les composants nouveaux d'un aliment, il faut adopter une approche au cas par cas afin de déterminer les tests toxicologiques pertinents à mener sur chaque aliment. On étudiera aussi l'historique de l'organisme dont dérive l'aliment, en tant que source de toxines ou de facteurs antinutritionnels, et l'on effectuera une analyse chimique afin de déterminer le test toxicologique à administrer. À partir de ces conclusions, on pourra mener des analyses conventionnelles de toxicité, y compris des analyses de toxicité chronique, de toxicité développementale, de génotoxicité et d'action carcinogène, sur le produit alimentaire final ou sur ses composants, le cas échéant.
Soulignons qu'il est très difficile de mener des études sur les aliments entiers, car on risque de nuire à l'équilibre nutritionnel en incorporant l'aliment dans le régime en concentrations élevées. De plus, les études toxicologiques sur des aliments nouveaux servent à déterminer si la consommation ordinaire de l'aliment est sûre selon des modèles de consommation prévus, au lieu de dériver une limite quantitative comme une dose quotidienne acceptable, comme on le fait pour les produits chimiques simples tels les additifs alimentaires.
4.2.1.5 Examens relatifs à l'allergénicité
L'examen principal de l'évaluation de l'allergénicité d'un aliment nouveau a trait à la prévention d'une exposition inattendue et inévitable des personnes sensibles aux allergènes alimentaires. Dans le cas des aliments sans antécédents d'innocuité comme aliment, il est possible qu'une ou plusieurs protéines qui s'y trouvent puissent réagir avec des allergènes alimentaires reconnus ou conduisent à la création d'une nouvelle forme d'hypersensibilité. Soulignons cependant que la grande majorité des protéines consommées dans le régime alimentaire ne sont pas allergènes.
Pour le moment, on ne connaît pas de test qui puisse mesurer directement le potentiel allergène d'une protéine ou d'un aliment entier. Comme les stratégies existantes d'évaluation du potentiel allergène des protéines ont été élaborées en vue de l'évaluation de protéines individuelles bien définies (section 4.1.3.7), on ne peut pas les appliquer aisément à tout constituant protéique d'un aliment entier. Le constituant protéique des aliments qui n'ont pas d'antécédents d'innocuité comme aliment ne peut pas être caractérisé de manière à permettre l'application de ces stratégies d'évaluation.
Une stratégie préliminaire pour évaluer le potentiel allergène des aliments qui n'ont pas d'antécédents d'innocuité comme aliment serait d'examiner si les végétaux de la même famille taxonomique qui font ordinairement partie du régime alimentaire provoquent des réactions allergènes. Le lien entre une famille particulière de végétaux et des réactions allergènes n'empêcherait pas nécessairement l'introduction d'un aliment nouveau issu d'une espèce connexe sur le marché, mais il faudrait envisager des mesures de gestion du risque telles que la surveillance après la mise en marché et l'étiquetage pour l'identification de l'article alimentaire lorsque celle-ci n'est pas évidente. Les protéines issues d'une source allergène ne doivent pas être ajoutées aux aliments lorsque la préservation de l'identité ne peut être assurée.
4.2.1.6 Examens chimiques
Une caractérisation chimique complète des microconstituants pouvant être toxiques, contenus dans l'aliment nouveau, doit être présentée. L'identification et les niveaux de contaminants chimiques introduits par inadvertance doivent également être signalés. La contamination éventuelle par des résidus de contaminants inorganiques, organiques ou naturels pourrait se produire, par exemple, dans le cas de produits chimiques utilisés dans la fermentation, ou produits par celle-ci ou dans l'extraction ou la purification servant à produire l'aliment voulu, dérivé des micro-organismes.
Tout additif alimentaire présent dans le produit alimentaire final (p. ex., les antiagglomérants, les solvants de support, les diluants solides, les colorants, les agents de conservation) ou les adjuvants de fabrication utilisés pendant la fabrication de l'aliment (p. ex., les adjuvants de précipitation et de filtration, etc.) doivent être définis et leur niveau spécifié.
Dans le cas des aliments nouveaux dont l'utilisation est prévue en tant qu'ingrédient dans d'autres aliments, les spécifications quant à l'identité et à la pureté doivent être fournies, et accompagnées d'un exemple d'étiquette et du mode d'emploi.
4.2.1.7 Examens microbiologiques
Dans le cas des micro-organismes nouveaux, les requérants devraient satisfaire aux critères suivants :
-
Identification de la souche
Une identification précise de la souche fournira de l'information importante en vue de l'évaluation de l'innocuité des micro-organismes et de leurs produits. Une souche microbienne devrait porter la bonne désignation taxonomique respectant les codes de nomenclature internationaux et les sources taxonomiques standard. La désignation taxonomique devrait être fournie au point de distinguer le micro-organisme des espèces pathogènes. Si l'identification n'est pas adéquate, il faudra demander des données supplémentaires pour veiller à l'innocuité du micro-organisme.
De façon générale, les méthodes suivies pour identifier un organisme devraient être similaires à celles suivies actuellement en taxonomie microbienne. Toute désignation taxonomique devrait s'accompagner d'une liste des tests qui ont servi à la désignation, avec les résultats et toute autre information ayant servi à la désignation. Il faudrait fournir une brève description du type de tests utilisés, ou des sources de référence.
-
Pathogénicité
Il faut examiner les risques qu'un micro-organisme viable contenu dans un aliment pourrait causer à la santé des humains. Les effets indésirables pourraient comprendre, sans toutefois s'y limiter, une infection, une maladie, des réactions immunitaires indésirables et de la toxicose. Bien que l'information tirée d'un examen de la littérature scientifique suffirait à satisfaire à cette exigence, les requérants devraient chercher diverses sources d'information sur les effets que le micro-organisme pourrait avoir sur la santé des humains (dans des bases de données, auprès d'autorités de réglementation, etc.). Ils devraient ainsi fournir de l'information qui donnerait un aperçu complet et approfondi de tout rôle que le micro-organisme pourrait jouer en cas de réaction indésirable, ou sur le manque de documentation sur les effets indésirables que le micro-organisme pourrait avoir sur la santé. Dans certains cas, il faudrait exiger plus de tests pour déterminer le potentiel pathogène de l'organisme.
-
Production antimocrobienne
Il faudrait fournir de l'information sur la production des composés antimicrobiens par un micro-organisme ou par ses parents proches. Cela s'applique aux antibiotiques traditionnels et à d'autres antimicrobiens, comme les bactériocines. On examinera l'importance qu'ont ces composés par rapport à des antimicrobiens cliniquement importants.
-
Résistance aux antimicrobiens
La présence de facteurs de résistance, particulièrement de résistance aux antibiotiques importants sur le plan clinique, doit être abordée. Cela s'avère particulièrement important si le micro-organisme vivant est présent dans l'aliment et peut survivre, voire même coloniser le tube digestif (p. ex., nouvelle culture de yogourt/souche probiotique utilisée dans le yogourt). Dans ce cas, les données sur la sensibilité du micro-organisme à divers antibiotiques doivent être fournies.
-
Production et données techniques
Les données techniques garantissant l'innocuité de microbes et les données démontrant le respect de ces données techniques devraient être fournies pour plusieurs lots de production. Il faut signaler toute identification de contaminants microbiens, et leurs niveaux. On s'attendrait à ce qu'une fermentation-aliment produise une culture pure, exempte de toute contamination microbiologique avant d'effectuer les transformations. Toutefois, si l'on utilise les technologies traditionnelles, les contaminants microbiens pourraient être présents dans la culture. Il faut les identifier afin de démontrer qu'ils ne présentent aucun problème d'innocuité. Il faudrait fournir des certificats d'analyse des organismes indicateurs afin de démontrer l'innocuité microbienne. Il faudrait fournir de la documentation sur le contrôle de la qualité du procédé de fabrication, avec une description du procédé de fabrication et des mesures de contrôle appliquées pour garantir la qualité et prévenir toute contamination microbienne.
4.2.2 Procédé nouveau
Certains procédés appliqués aux aliments et aux ingrédients alimentaires peuvent entraîner la création d'aliments qui seraient considérés comme nouveaux par rapport à leurs contreparties classiques. L'application de procédés nouveaux qui occasionnent des changements majeurs dans un aliment exige que Santé Canada soit avisé. Le terme « changement majeur » est défini au Titre 28 du Règlement comme un changement apporté à un aliment à la suite duquel, selon l'expérience du fabricant ou la théorie généralement admise dans le domaine des sciences de la nutrition et de l'alimentation, les propriétés de celui-ci se situent en dehors des variations naturelles acceptables de l'aliment en ce qui a trait à l'un ou l'autre des éléments suivants : la composition, la structure, la qualité nutritive ou les effets physiologiques généralement reconnus de l'aliment; la manière dont l'aliment est métabolisé par le corps humain; l'innocuité générale, microbiologique ou chimique de l'aliment. Voici quelques exemples de procédés nouveaux : de nouvelles techniques de traitement thermique, de nouvelles technologies d'emballage et l'utilisation de rayons ultraviolets afin de réduire la charge microbienne du produit.
L'évaluation de l'innocuité des aliments nouveaux de cette catégorie suit un processus progressif d'examen des facteurs pertinents, dont :
- 4.2.2.1 Détails du procédé nouveau
- 4.2.2.2 Exposition alimentaire
- 4.2.2.3 Historique de l'organisme
- 4.2.2.4 Examens nutritionnels
- 4.2.2.5 Examens toxicologiques
- 4.2.2.6 Examens relatifs à l'allergénicité
- 4.2.2.7 Examens chimiques
4.2.2.1 Détails du procédé nouveau
Alors que l'évaluation de l'innocuité est axée sur le produit alimentaire, un examen du procédé ou de la préparation du produit peut orienter cette évaluation. Toute technique de transformation ou de préparation nouvelle servant à produire un aliment nouveau devrait être décrite avec suffisamment de détails puisque de telles techniques peuvent soulever des préoccupations de nature microbiologique, toxicologique, allergène ou nutritionnelle.
4.2.2.2 Exposition alimentaire
Le rôle de l'évaluation de l'exposition alimentaire concernant les substances sans antécédent d'innocuité comme aliment consiste à estimer :
- la quantité de l'aliment qui risque d'être consommée et la fréquence de consommation, ainsi que le rôle que cet aliment pourrait jouer dans l'alimentation, s'il diffère du rôle de l'aliment non transformé ou de l'aliment transformé par des méthodes conventionnelles;
- l'impact possible de cet aliment sur l'apport nutritionnel, en combinant le résultat des recherches réalisées au point a) aux renseignements sur les changements, le cas échéant, dans la composition nutritionnelle de l'aliment, à la suite du procédé nouveau;
- si l'on observe des modifications quant à la concentration ou à la nature des substances bioactives, des facteurs antinutritionnels, des contaminants ou des toxines, ou s'il existe des substances nouvelles produites dans l'aliment, l'exposition possible à ces substances.
Dans les cas où la composition nutritionnelle de l'aliment a été modifiée, intentionnellement ou involontairement, par l'application du procédé nouveau, l'ampleur de ce changement doit être évaluée en fonction de la valeur nutritionnelle attendue de l'aliment non transformé et en fonction des changements qui découlent d'une transformation conventionnelle de ce même aliment; il faut également déterminer si cela peut avoir une incidence considérable sur l'apport global en nutriments des consommateurs. La décision de procéder à une évaluation complète de l'exposition peut dépendre de la mesure dans laquelle un changement s'est produit et du degré selon lequel l'approvisionnement alimentaire pourrait s'en trouver affecté. Une évaluation de l'exposition pourrait être effectuée par l'élaboration de modèles de l'apport nutritionnel, grâce à des bases de données actuelles sur l'apport alimentaire, de préférence des données obtenues auprès de sujets canadiens, dans lesquelles l'aliment nouveau a été intégré, selon sa composition nutritionnelle modifiée, et remplace un autre aliment transformé dans le même objectif par des moyens conventionnels. Par exemple, si le nouveau procédé venait remplacer la pasteurisation, il faudrait donc remplacer par l'aliment nouveau les aliments transformés par pasteurisation dans la base de données.
Les résultats de l'évaluation de l'exposition doivent décrire les changements prévus de la distribution des nutriments dans l'apport alimentaire en utilisant des mesures comme la moyenne, la variabilité et les percentiles (supérieur et inférieur) de l'apport. L'impact différentiel sur les sous-groupes de la population (p. ex., les enfants, les nourrissons, les personnes âgées, les groupes ethniques, les populations sensibles) doit être évalué, de même que l'impact sur la population dans son ensemble.
Lorsque l'on observe une modification intentionnelle sur le plan nutritionnel ou de la santé, l'impact du modèle de publicité doit également être envisagé, dans la mesure du possible, puisque cela pourrait modifier le niveau actuel de consommation d'un produit équivalent, non nouveau.
Lorsque l'on observe des changements dans les concentrations de substances bioactives, de facteurs antinutritionnels, de contaminants ou de toxines, ou si des substances nouvelles sont produites en tant que sous-produits de réaction dans l'aliment, à la suite du procédé, des estimations de l'apport nutritionnel concernant cet aliment seraient donc utilisées pour calculer l'exposition alimentaire possible à ces composants spécifiques de l'aliment nouveau, et celui-ci ferait l'objet d'une évaluation de l'innocuité.
Les procédés nouveaux appliqués aux aliments afin de réduire les pertes occasionnées par l'activité microbienne peuvent également accroître l'accessibilité aux aliments exotiques sur le marché canadien, par exemple, les fruits qui poussent dans les régions tropicales. Ce plus grand accès peut soulever des problèmes de nature nutritionnelle, toxicologique ou allergène pouvant avoir une incidence sur l'innocuité et, par conséquent, les estimations de l'exposition à des composants de l'aliment dont l'impact sur la santé est important devrait être prises en compte dans des cas semblables. L'estimation des possibilités qu'une telle hausse se produise, et les répercussions qui s'ensuivraient, doivent être prises en compte s'il existe des motifs raisonnables sur lesquels on peut s'appuyer pour avancer de telles prévisions quantifiables. Bien que de telles augmentations puissent changer les modèles de consommation alimentaire et, par conséquent, avoir une incidence plus large sur la nutrition et sur l'exposition aux autres composantes de l'alimentation, ces types de changement peuvent être impossibles à prévoir, et la nécessité de telles projections ou de suivi après la mise en marché, ou leur faisabilité, devra être évaluée au cas par cas. Des sondages périodiques sur la nutrition, réalisés auprès de la population, conviendraient probablement mieux pour définir les tendances alimentaires qui pourraient découler des aliments nouvellement introduits, des aliments devenus plus accessibles ou plus populaires, de même que de nombreux autres facteurs qui ont une incidence sur les régimes alimentaires au Canada et qui pourraient avoir un impact bénéfique ou nocif sur la santé (voir la section 3.4).
4.2.2.3 Historique de l'organisme
L'historique d'un organisme peut fournir des renseignements importants dans l'évaluation d'un aliment nouveau. Il peut exister des antécédents de production de toxines par certaines souches, espèces ou génériques et il serait important, dans ces situations, d'examiner la variété particulière de l'organisme utilisée dans le développement de l'aliment nouveau afin de vérifier la possibilité de produire de telles toxines, à la fois dans des conditions utilisées au cours de la fabrication et aussi dans des conditions extrêmes.
4.2.2.4 Examens nutritionnels
I Effets nutritionnels non intentionnels
Observations générales
L'introduction d'un aliment nouveau dans l'approvisionnement alimentaire canadien est nécessite que l'on détermine la qualité nutritionnelle de l'aliment et les implications de ses caractéristiques nutritionnelles pour l'ensemble de la population ou pour des sous-groupes particuliers. Ces sous-groupes de la population peuvent être plus vulnérables pour différentes raisons, par exemple, les jeunes enfants, les femmes enceintes et les mères qui allaitent, les personnes ayant des caractéristiques métaboliques particulières, les adolescents et d'autres personnes qui peuvent consommer de grandes quantités d'aliments, ou les personnes âgées qui ne consomment que de petites quantités d'aliments. Une évaluation nutritionnelle, comprenant un examen des effets intentionnels et non intentionnels, est nécessaire dans le but de s'assurer que l'état nutritionnel des consommateurs ne risque pas d'être menacé par :
- la substitution d'aliments ou d'ingrédients alimentaires qui ont une valeur nutritionnelle considérable, par des variétés moins nutritives de ces aliments ou d'aliments semblables;
- l'ingestion excessive de nutriments ou d'autres substances bioactives du fait que l'aliment nouveau en contient des niveaux exceptionnellement élevés;
- des niveaux récents ou accrus de facteurs antinutritionnels qui pourraient affecter de façon négative la valeur nutritionnelle de l'aliment ou du régime alimentaire.
Qu'est-ce que la qualité nutritionnelle?
La qualité nutritionnelle, telle qu'appliquée aux aliments, est liée à la présence de nutriments essentiels et de substances énergétiques (en quantité et qualité adéquates) ainsi qu'à d'autres aspects des aliments traditionnellement considérés comme faisant partie de la science de la nutrition. Ces aspects comprennent les rôles nutritionnels des acides aminés non essentiels, des types spécifiques d'acides gras et d'hydrates de carbone, des fibres alimentaires, du cholestérol, des substances lipotropes, et d'autres composants d'aliments spécifiques (p. ex., le lait maternel), de la biodisponibilité et des interactions entre les nutriments et les autres nutriments, les additifs alimentaires et les substances toxiques naturelles. Ils incluent également les excès de nutriments et les effets (à la fois positifs et négatifs) de la transformation des aliments sur les nutriments et sur les propriétés organoleptiques des aliments. On a plus récemment démontré qu'une gamme étendue de substances « bioactives » trouvées principalement dans les végétaux avait peut-être un rôle à jouer dans l'amélioration ou la protection de la santé de l'homme. Ces rôles sont également compris dans la définition au sens large de la qualité nutritionnelle.
Application d'un procédé nouveau aux micro-organismes
Les micro-organismes constituent une composante mineure des aliments dans la diète canadienne. L'utilisation d'une protéine à cellule unique est rare. Ainsi, il est très improbable qu'un changement dans les micro-organismes qui sont actuellement présents dans les aliments puisse avoir un impact direct sur la qualité nutritionnelle des aliments et des diètes. Il existe toutefois deux façons par lesquelles un micro-organisme dans un aliment pourrait avoir un impact sur la qualité nutritionnelle de l'aliment ou de la diète et, par ricochet, sur la santé des consommateurs. L'une de ces façons est que les micro-organismes peuvent avoir un impact indirect important sur la qualité nutritionnelle des aliments dans lesquels ils se trouvent. Par exemple, l'utilisation de la levure pour faire lever le pain réduit le contenu en phytates qui rendent les minéraux plus disponibles pour l'absorption intestinale. La levure produit également des vitamines B en quantité suffisante pour affecter de façon significative le contenu de certaines des vitamines B, par exemple le folate, dans le pain. L'autre façon par laquelle un micro-organisme dans un aliment peut avoir un impact sur la santé est potentiellement en tant que « probiotique ». On croit que les probiotiques peuvent proliférer et altérer la population de bactéries dans le gros intestin et, en conséquence, avoir des effets bénéfiques variés sur la santé de l'intestin et de la personne.
Le développement de nouvelles formes de micro-organismes par la mise en œuvre d'un procédé nouveau, peut provoquer des changements intentionnels ou non intentionnels dans la composition des produits alimentaires qui peuvent à leur tour avoir un impact sur la valeur nutritionnelle de l'aliment et sur l'état nutritionnel des personnes le consommant.
Des effets nutritionnels non intentionnels peuvent surgir, que le nouveau procédé soit prévu pour des motifs nutritionnels, fonctionnels ou autres. L'évaluation d'un micro-organisme qui a été produit en utilisant un nouveau processus prévu pour affecter la qualité nutritionnelle du micro-organisme ou de l'aliment auquel il appartient fait l'objet d'une discussion dans la Partie II de cette section. Par conséquent, la discussion sur les aspects probiotiques des micro-organismes se limite à cette section.
Une étape importante dans l'évaluation nutritionnelle et dans l'évaluation de l'innocuité de ce type d'aliment nouveau est la comparaison de sa composition avec ses contreparties appropriées. Dans le cas d'un nouveau micro-organisme (c.-à-d le micro-organisme qui a été produit en utilisant un nouveau processus), ceci pourrait s'appliquer au micro-organisme lui-même dans l'éventualité où il constitue une portion importante de la masse alimentaire mais ceci s'appliquera plus probablement à l'aliment contenant le nouveau micro-organisme. Pour déterminer s'il y a des différences dans la qualité nutritionnelle de l'aliment contenant le nouveau micro-organisme comparé à ses contreparties appropriées, le micro-organisme devrait d'abord être soumis à des essais de laboratoire portant sur les produits métaboliques du micro-organisme dans un milieu contrôlé. Une fois qu'ils se trouvent dans la phase d'essais de production de l'aliment, les constituants majeurs de l'aliment contenant le micro-organisme doivent être analysés, c.-à-d les macroéléments nutritifs et leurs parties composantes, de même que les microéléments nutritifs isolés sélectionnés sur la base de critères validés. Si un élément nutritif (dans la liste ci-dessous) est exclu des analyses, ceci devrait être justifié par des raisons acceptables.
De même, certaines circonstances peuvent justifier une évaluation de la « performance » nutritionnelle d'un aliment nouveau dans sa forme prête à manger, de même que s'il est cru ou traité par des méthodes traditionnelles/conventionnelle utilisées pour en faire un produit prêt à manger. Le but serait d'offrir une occasion d'identifier les changements majeurs qui pourraient ne pas être avoir été décelés par l'analyse compositionnelle, mais qui peuvent affecter, par exemple, la stabilité ou la biodisponibilité des nutriments dans l'aliment ou la sensibilité des facteurs antinutritionnel à des procédés de transformation qui, normalement, les détruisent. Un essai de rendement pourrait supposer une nouvelle analyse d'une substance après la cuisson ou il pourrait nécessiter un essai de biodisponibilité sur un animal.
Lignes directrices sur la production de données pour l'évaluation nutritionnelle
- Fonction des données à être soumises
- Les renseignements fournis sur un aliment nouveau doivent être suffisants, sur le plan de la qualité comme de la quantité, afin de savoir si un effet non intentionel important sur la qualité nutritionnelle de l'aliment est survenu en raison de la mise en œuvre du procédé nouveau sur l'aliment. Les renseignements devraient également permettre une évaluation de l'importance nutritionnelle de tout changement qui a été décelé.
- Des données concernant l'aliment nouveau dérivé d'un micro-organisme ou en contenant un devraient être fournies avant d'effectuer d'autres transformations. Des données peuvent aussi être requises sur l'aliment préparé selon des moyens conventionnels pour la consommation humaine, afin d'examiner les effets d'une transformation supplémentaire, de l'entreposage et de la cuisson. Par exemple, dans les cas où la cuisson détruit normalement les facteurs antinutritionnels, des données pourraient être recueillies concernant les concentrations de facteurs antinutritionnels après la cuisson.
- Les données concernant l'aliment nouveau dérivé d'un micro-organisme ou en contenant un devraient être comparées, à tout le moins, aux données relatives à l'équivalent le plus pertinent (voir section b, ci-dessous). Les données documentaires (si elles sont accessibles) sont également valables pour évaluer la pertinence nutritionnelle de tout effet non intentionel.
- Lorsque les données publiées sur la composition nutritionnelle d'un aliment nouveau ne sont pas suffisantes, le demandeur peut devoir obtenir des données analytiques. Dans ce cas, une hypothèse claire doit être formulée et accompagnée d'une méthodologie appropriée, afin d'obtenir des données sur la composition nutritionnelle qui permettront ce qui suit :
- Examiner toutes les sources importantes de variation possible dans la qualité nutritionnelle, par exemple la composition du milieu de croissance, les conditions de production, les conditions de traitement etc., au moment de concevoir l'étude, afin de veiller à ce que l'on maîtrise bien ces éléments.
- Exposer le nouveau micro-organisme ou l'aliment qui le contient aux conditions prévues pour la production commerciale.
- o Inclure dans la même étude le nouveau micro-organisme qui fait l'objet de l'avis ainsi que les équivalents pertinents, c'est-à-dire lorsque la composante du micro-organisme a été préparée en utilisant un procédé commercial équivalent (p. ex., un procédé qui n'est pas nouveau et qui est actuellement utilisé pour produire le même effet ou un effet similaire).
- Établir un plan d'échantillonnage avant le début de l'étude, fondé sur un calcul permettant d'utiliser au moins une ou plusieurs composantes, afin d'indiquer le nombre d'échantillons requis. Cela pourrait être fondé sur les analytes les plus importants ou les analytes que l'on prévoit être plus variables et nécessiter plus d'échantillons. Il faut fournir des détails concernant la puissance et la taille prévues de la méthodologie choisie pour le test statistique proposé ainsi que des vérifications d'hypothèses.
- Veiller à ce que toutes les analyses appropriées soient faites sur tous les produits contenant les micro-organismes et devant être utilisés en tant qu'aliments au Canada.
- Établir les critères de sélection des nutriments analysés et la justifier l'exclusion des analyses de tout nutriment et de toute autre substance figurant dans la section « Composition des nutriments » ci-dessous.
- Veiller à ce que les échantillons utilisés dans le cadre de cette étude soient analysés dans un délai acceptable suivant la date de cueillette.
- S'assurer que les analyses de chaque composant, nutritif et non nutritif, sont effectuées sur tous les échantillons, par le même laboratoire, selon des méthodes d'analyse approuvées et validées à l'échelle internationale, et selon des procédures de conservation des échantillons et de préparation uniformes et appropriées, et ce, tout au long des analyses.
- Utiliser des méthodes statistiques pertinentes et uniformes, choisies à l'avance selon la méthodologie, afin de comparer les concentrations de chaque nutriment contenu dans l'aliment par rapport au groupe contrôle.
-
Composition des nutriments
Les composants des aliments nouveaux présentés ci-dessous devraient être analysés dans le contexte des lignes directrices de l'étude susmentionnée. Même si les nutriments ne sont pas tous analysés, le demandeur devrait fournir les critères de sélection des nutriments analysés et indiquer les raisons pour lesquels certains nutriments ou d'autres substances figurant dans la liste suivante ont été exclus de l'analyse :
- la composition immédiate (p. ex., les cendres, l'humidité, les protéines, le gras, les fibres, les hydrates de carbone);
- le contenu en protéine vraie, en matière azotée non protéinée (p. ex., les acides nucléiques et les aminoglycosides), le profil en acides aminés - la quantité d'acides aminés inhabituels devrait être déterminée si on suspecte leur présence (p. ex., les acides aminés d'origine bactérienne);
- le profil complet des acides gras exprimé en tant que pourcentage total des acides gras, les composants non saponifiables, et les stérols - la liste des acides gras doit être regroupée selon les catégories monoinsaturé, polyinsaturé et saturé;
- la composition de la fraction des hydrates de carbone (p.ex., les sucres, les amidons, les chitines, les tanins, les polysaccharides non amylacés et les lignines);
- la composition des micronutriments (p. ex., l'analyse des vitamines et des minéraux importants);
- la présence de facteurs antinutritionnels naturels ou adventifs (p. ex., les phytates, les inhibiteurs de la trypsine, etc.);
- les métabolites secondaires prévisibles, les substances physiologiques actives (bioactives) et les autres substances décelées.
- « Rendement » nutritionnel du nouveau micro-organisme
Il faut tenir compte du besoin éventuel de renseignements comme ceux présentés ci-dessous concernant l'aliment nouveau :- La réaction des facteurs antinutritionnels connus à des procédés normalement prévus pour neutraliser leur activité, mesurée par une analyse compositionnelle.
- La stabilité à l'entreposage en ce qui concerne la dégradation des nutriments.
- Le rendement du produit relativement aux avantages prévus (autre que des avantages directs pour la santé) c.-à-d. l'amélioration de la stabilité d'une huile pour la cuisson après la modification du profil des acides gras.
- Biodisponibilité des nutriments / Présence de facteurs antinutritionnels nouveaux ou modifiés
Dans les situations où un aliment nouveau peut devenir un important composant du régime alimentaire canadien, ou un fournisseur important de nutriments, des études sur les animaux devraient être effectuées afin d'évaluer le niveau de la valeur nutritionnelle. Ceci se rapporte en particulier à l'évaluation de la qualité des protéines, à la possibilité de facteurs antinutritionnels inconnus et à la question relative à la biodisponibilité des nutriments.
Le cas échéant, des renseignements devraient être fournis afin de décrire les conditions de transformation qui seraient utilisées dans la production de l'aliment nouveau et les effets de la transformation sur la concentration de nutriments et la biodisponibilité de ceux-ci. - Renseignements à inclure dans la demande :
- une description complète du procédé nouveau, de l'objectif de ce procédé et des micro-organismes auxquels il pourrait s'appliquer ainsi que des micro-organismes auxquels il s'appliquera (aux fins de la demande);
- les micro-organismes auxquels le processus de contrôle et d'essai a été appliqué dans le cadre de l'étude, et le nom et la source de toutes les souches qui étaient représentées dans l'étude;
- une description complète du concept expérimental, des conditions expérimentales et de la façon dont les sources de variation des concentrations de nutriments ont été contrôlées;
- une description complète de la cueillette et de la préparation des échantillons;
- une présentation ou une description des méthodes statistiques et d'analyse qui ont été utilisées afin d'obtenir des données sur les composants nutritionnels et non nutritionnels;
- les données concernant les éléments nutritifs et les données qui leur sont reliées pour les souches d'essais, de contrôle et commerciales (exprimées en termes de moyenne ± l'écart type et en termes d'étendue);
- les résultats de l'analyse statistique;
- les données brutes de tous les composants analysés;
- les données publiées, si elles sont accessibles;
- l'utilisation prévue au Canada du nouveau micro-organisme en tant qu'aliment, par exemple le(s) type(s) d'ingrédients, le produit final possible, le niveau d'utilisation s'il est différent de celui des produits actuels qu'il remplacerait, les habitudes reconnues d'utilisation ainsi que la consommation de l'aliment et de ses dérivés;
- toute utilisation non prévue, envisageable.
- Processus de prise de décision
- Des méthodes statistiques modernes appropriées doivent être appliquées aux données afin de démontrer qu'aucun changement important ne découle de l'intervention. Selon le CodexNote de bas de page 11, « la signification statistique de toutes différences observées devrait être évaluée dans le contexte de l'écart de variations naturelles pour ce paramètre afin de déterminer sa signification biologique ». Si la composition de l'aliment nouveau est jugée ne pas être équivalente, sur le plan nutritionnel, à celui de ses équivalents, c.-à-d. que des différences significatives (statistiques et biologiques) existent dans les données sur les nutriments, des données nutritionnelles supplémentaires peuvent être requises, au cas par cas.
- Tous les aspects de la qualité nutritionnelle seront évalués et fondés sur les principes, les normes et les lignes directrices nutritionnelles de pointe visant à répondre aux besoins nutritionnels de l'homme. Les fondements de l'évaluation comprennent : les recommandations concernant l'apport nutritionnel, le rôle de l'aliment dans le régime alimentaire de la population et l'incidence du régime et de la nutrition sur la réduction des risques de développer une maladie liée au régime et sur la promotion de la santé.
- La détection d'un changement majeur causé par un effet nutritionnel non intentionnel n'empêchera pas nécessairement la mise en marché du produit. Cependant, ces changements peuvent nécessiter l'application de limites sur l'utilisation de l'aliment dans des produits alimentaires ou une exigence d'étiquetage qui va plus loin que les dispositions de base. Consultez aussi la partie II concernant l'évaluation de l'innocuité des niveaux élevés de nutriments ou de substances bioactives.
- La première phase de l'évaluation nutritionnelle sera fondée sur les données relatives à la composition nutritionnelle et sur une évaluation des effets intentionnels et non intentionnels sur la composition nutritionnelle. Si l'on découvre des composants, des concentrations de nutriments ou des substances nutritives inhabituels ou non intentionnels, l'aliment peut alors être soumis à des analyses plus approfondies.
- L'innocuité relative à une hausse importante de la concentration de nutriments ou d'autres composants bioactifs nécessiterait une évaluation homologue à celle de l'innocuité relative à un changement nutritionnel prévu. Consultez la partie II ci-dessous pour obtenir plus de détails.
II Modifications nutritionnelles intentionnelles
Le terme « modifications nutritionnelles intentionnelles » englobe tous les changements ou les caractéristiques introduits intentionnellement en vue d'améliorer la qualité nutritionnelle ou le profil de l'aliment en ce qui touche la santé, y compris, sans toutefois s'y limiter, les nutriments essentiels, les phytochimiques bioactifs bénéfiques, les quantités et la nature des substances énergétiques, à la biodisponibilité accrue des nutriments, à une fonction probiotique améliorée et à la réduction des concentrations de facteurs antinutritionnels.
L'évaluation des changements nutritionnels intentionnels exige que l'on suive des étapes semblables à celles utilisées pour l'ajout d'un nutriment vitaminique ou minéral à un aliment, pour l'évaluation d'aliments auxquels une allégation en matière de santé est reliée, ou les deux. Par exemple, un tel changement soulèverait des questions ayant trait au groupe cible prévu, au niveau de concentration prévu du nutriment ciblé ou d'une autre substance dans l'aliment, au changement prévu dans le niveau d'exposition au nutriment ciblé ou à une autre substance pour tous les groupes (âge et sexe) et aux niveaux extrêmes supérieur et inférieur de consommation de l'aliment, de même qu'à l'innocuité de ce niveau d'exposition.
Un aliment nouveau auquel on a intégré un avantage sanitaire ou nutritionnel entrerait dans la catégorie non officielle « d'aliment fonctionnel ». On s'attend à ce que les manufacturiers souhaitent faire des allégations santé pour ces produits. Ces produits seraient donc évalués selon les critères établis pour les aliments avec des allégations santé spécifiques. Ceci inclut de porter une attention particulière aux preuves apportées pour supporter ces allégations de même qu'aux questions concernant la sécurité et la qualité du produit.
L'innocuité d'un produit de ce type d'aliment nouveau est contrôlée par la mise en œuvre de règlements sur les aliments nouveaux. L'évaluation de l'innocuité d'un micro-organisme ou d'un aliment contenant un micro-organisme, là où le micro-organisme était soumis à un procédé nouveau dans le but d'obtenir une modification nutritionnelle, intentionnelle devrait être la même que pour les autres aliments nouveaux. En ce qui a trait à l'évaluation nutritionnelle et de l'innocuité de la modification nutritionnelle intentionnelle en soi, les exigences en matière de données sont décrites ci-dessous.
À ce stade, les règlements concernant l'autorisation spécifique des allégations santé liées aux aliments n'ont pas encore été promulgués. Les futurs demandeurs devraient se référer au cadre de réglementation proposé concernant l'autorisation spécifique des allégations santé liées aux aliments qui a été publié au mois de novembre 2001, et le Document d'orientation provisoire sur les normes relatives aux éléments probants qui a été publié en février 2002.
Il est important de s'assurer jusqu'à quel point les effets nutritionnels intentionnels d'un procédé nouveau demeurent stables en ce qui concerne la culture, le temps, la transformation supplémentaire, l'entreposage et de la cuisson.
La révision des effets nutritionnels non-intentionnels dans un nouveau micro-organisme ou dans un aliment contenant un nouveau micro-organisme, c.-à-d là où un nouveau procédé a été appliqué au micro-organisme dans le but d'obtenir un effet nutritionnel intentionnel suivrait les mêmes étapes qu'en ce qui concerne les autres aliments nouveaux.
Évaluation nutritionnelle de l'augmentation prévue ou non intentionnelle d'un nutriment ou d'une substance bioactive
- L'augmentation des concentrations d'un nutriment ou d'une autre substance intrinsèque bioactive (y compris un micro-organisme) dans un aliment doit être évaluée pour en vérifier l'innocuité.
- Les données nécessaires à cette fin comprennent :
- la concentration du nutriment ou d'une autre substance ciblé et prévu dans l'aliment;
- le groupe ciblé prévu, le cas échéant, ou le ou les groupes qui risquent le plus d'ingérer une grande quantité de l'aliment;
- le niveau prévu d'exposition à la substance par la consommation de l'aliment par le groupe ciblé, par des sous-groupes vulnérables et à l'extrémité supérieure ou inférieure d'ingestion de l'aliment dans tous les groupes (âge et sexe), selon les données canadiennes récentes sur la consommation d'aliments, dans la mesure du possible;
- la façon dont le niveau prévu d'exposition au nutriment ou à une autre substance ciblé diffère des niveaux actuels d'exposition de toutes les sources;
- des données en appui de l'innocuité du niveau prévu d'exposition
4.2.2.5 Examens toxicologiques
Il est absolument nécessaire d'effectuer des tests toxicologiques sur les substances dont on ne connaît pas l'innocuité et qui sont introduites dans l'approvisionnement alimentaire. En appliquant des procédés nouveaux à des aliments, on risque, intentionnellement ou non, de générer des substances nouvelles dans l'aliment final. Vu l'immense variété de produits pouvant être générés par l'application de procédés nouveaux, les tests toxicologiques devraient être réalisés au cas par cas.
Pour déceler les substances nouvelles apparaissant dans un aliment auquel on a appliqué un procédé nouveau, on utilise un élément de comparaison, comme un aliment non transformé ou transformé à l'aide de méthodes traditionnelles. Une analyse chimique peut fournir des renseignements sur toute substance nouvellement formée. De plus, l'information sur la nature, la durée et l'intensité d'un traitement ainsi que sur la composition chimique de l'aliment peuvent servir à prévoir les types de modifications qu'ont subies les composants alimentaires. À partir de ces conclusions, on devra peut-être mener sur le produit alimentaire final ou ses composantes, le cas échéant, des études conventionnelles sur la toxicité, dont une bioanalyse du métabolisme, la toxicocinétique, la toxicité chronique/carcinogénicité, l'impact sur les fonctions reproductrices et la tératogénicité.
Toute modification intentionnelle à la composition d'aliments par l'ajout de composant alimentaires à des niveaux dépassant les limites acceptées de variation naturelle (p. ex., les aliments dits « fonctionnels ») pourrait entraîner une exposition pour laquelle il n'existe aucun antécédent d'innocuité. En ajoutant dans les aliments des substances traditionnellement consommées dans l'alimentation à des doses supérieures aux doses normales, on augmente la quantité consommée de cette substance par rapport au régime ordinaire. Dans de tels cas, l'aspect nouveau de l'aliment est le niveau d'exposition à cette substance plutôt que la substance elle-même. Il faudrait présenter des preuves tirées d'études sur les animaux et in vitro, tel que mentionné dans le paragraphe précédent, pour déterminer l'innocuité. Les études effectuées sur des animaux de laboratoire ne seront pas très utiles si le modèle d'animal utilisé (p. ex., le rat) présente une différence marquée par rapport à l'homme quant à ses voies métaboliques et ses conditions chroniques, qui sont à la base de l'effet fonctionnel étudié. Il sera donc nécessaire de s'appuyer davantage sur la réaction des humains à des doses plus élevées de ces composantes alimentaires. Il est possible qu'il existe déjà des études épidémiologiques concernant des substances qui font normalement partie d'aliments et qui pourraient comporter des renseignements importants sur les effets à long terme.
4.2.2.6 Examens relatifs à l'allergénicité
L'examen principal de l'évaluation de l'allergénicité d'un aliment nouveau a trait à la prévention d'une exposition inattendue et inévitable des personnes sensibles aux allergènes alimentaires. Lorsque l'application d'un procédé nouveau sur un aliment génère une protéine nouvelle ou modifie le contenu protéinique d'un aliment qui contient des protéines allergènes, il faudrait évaluer le potentiel allergène de l'aliment nouveau.
Protéines nouvelles
Pour le moment, on ne connaît pas de test qui puisse mesurer directement le potentiel allergène d'une protéine ou d'un aliment entier. Si l'application d'un procédé nouveau à un aliment génère une protéine nouvelle qu'on peut isoler et caractériser, on peut utiliser la stratégie d'évaluation conçue pour les aliments produits par la technique de l'ADN recombinant décrite à la section 4.1.3.7 pour en évaluer l'allergénicité potentielle. Cette stratégie comprend démarche s'appuyant sur la valeur de la preuve fondée sur l'évaluation de l'homologie de la séquence des amino-acides sur des allergènes alimentaires connus. Elle détermine aussi la mesure dans laquelle ses propriétés, surtout la résistance à la digestion dans les voies gastro-intestinales des mammifères, sont analogues à celles d'allergènes alimentaires connus.
Altération du contenu allergène endogène
Si l'application d'un procédé nouveau à un aliment qui contient des protéines allergènes en altère le contenu protéinique, il faudrait évaluer le potentiel d'accroissement du contenu allergène. Bien qu'on ne connaisse pas avec certitude les effets qu'aurait cet accroissement sur la santé, il faudrait les considérer comme indésirables. Les techniques servant à évaluer la possibilité d'effets sur l'expression allergène endogène sont les suivantes : une comparaison quantitative de la composition protéinique de la partie comestible de l'organisme modifié ou, lorsque l'on dispose d'échantillons de sérum sanguin d'un nombre suffisant de personnes allergiques à l'aliment en question, la réactivité immunologique comparative de la partie comestible de l'organisme modifié à l'aide de techniques de buvardage.
4.2.2.7 Examens chimiques
Il faut signaler les contaminants chimiques trouvés dans un aliment qui n'a pas d'antécédents d'innocuité comme aliment, de même que la concentration de ces contaminants. Les niveaux de concentration et les types de contaminants éventuels seraient spécifiques à l'aliment nouveau. Il serait donc nécessaire de déterminer les niveaux de concentration et l'étendue des contaminants présents dans l'aliment. Dans la mesure du possible, on devrait comparer les niveaux de contaminants chimiques de l'aliment nouveau à ceux que l'on trouve habituellement dans des aliments semblables. Les métaux (p.ex., l'arsenic, le cadmium, le mercure et le plomb), les contaminants organiques, y compris les polluants organiques persistants, ou POP (p. ex., le DDT, l'aldrine, la dieldrine, etc.) et les contaminants naturels, y compris les mycotoxines (p. ex., l'aflatoxine, la vomitoxine, l'ochratoxine, la zéaralénone, etc.) sont des exemples de contaminants potentiels.
Tout additif alimentaire présent dans le produit alimentaire final (p. ex., les antiagglomérants, les solvants de support, les diluants solides, les colorants, les agents de conservation) ou les adjuvants de fabrication utilisés pendant la fabrication de l'aliment (p. ex., les adjuvants de précipitation et de filtration, etc.) doivent être définis et leur niveau spécifié.
Dans le cas des aliments nouveaux dont l'utilisation est prévue en tant qu'ingrédient dans d'autres aliments, les spécifications quant à l'identité et à la pureté doivent être fournies, et accompagnées d'un exemple d'étiquette et du mode d'emploi.
4.2.3 Modification génétique
Les micro-organismes dont il est question dans cette section sont ceux développés par des technologies d'acides nucléiques recombinant et par d'autres méthodes d'introduction de l'ADN comme la fusion de protoplaste, la microinjection, la bio-balistique et l'électroporation. Les micro-organismes développés par élimination, réarrangement ou suppression de l'ADN d'origine devraient également être considérés. De plus, ces micro-organismes qui ont subi une modification génétique par des techniques de sélection traditionnelles (mutations spontanées, pressions sélectives) et par une mutagénèse provoquée intentionnellement (c.-à-d. par l'application de techniques telles que le traitement chimique et les radiations aux rayons ultraviolets) ayant comme conséquence d'altérer le phénotype ou la composition, doivent également être inclus.
Les données qui doivent être soumises doivent être ncluses à celles mentionnées ici, sans toutefois s'y limiter. Les micro-organismes modifiés peuvent plus particulièrement retenir l'attention lorsqu'un parent ou un vecteur est issu d'une espèce connue pour produire des composés toxiques. Dans la mesure du possible, le produit final ne devrait contenir aucun marqueur de transformation qui soulève des préoccupations relatives à l'innocuité. Si des marqueurs spécifiques sont présents dans le produit final, ils seront évalués afin d'en déterminer l'innocuité.
L'évaluation de l'innocuité des aliments nouveaux de cette catégorie suit un processus progressif d'examen des facteurs pertinents, dont :
- 4.2.3.1 Caractérisation de la souche dérivée
- 4.2.3.2 Considérations liées à la modification génétique
- 4.2.3.3 Historique de l'organisme (hôte et donneur(s))
- 4.2.3.4 Exposition alimentaire
- 4.2.3.5 Examens nutritionnels
- 4.2.3.6 Examens toxicologiques
- 4.2.3.7 Examens relatifs à l'allergénicité
- 4.2.3.8 Examens chimiques
4.2.3.1 Caractérisation de la souche dérivée
Lorsqu'un végétal a été modifié par des techniques d'amélioration génétique traditionnelles, par sélection ou par mutagenèse, ou encore par la technologie d'ADN recombinant, il faut définir le lien entre la variété dérivée et les variétés parentes. La démarche utilisée pour procéder à l'évaluation de l'innocuité repose sur le principe selon lequel il faut évaluer l'innocuité d'un produit nouveau en le comparant à un équivalent ayant un antécédent d'innocuité comme aliment, en tenant compte des effets intentionnels et non intentionnels. Il est particulièrement important, pour une évaluation de l'innocuité, de déterminer si la modification pourrait, de manière non intentionnelle, développer ou accroître la pathogénicité, la toxicité ou l'allergénicité d'un organisme.
4.2.3.2 Considérations liées à la modification génétique
Modifications génétiques par des techniques traditionnelles
De nombreuses méthodes de modification de l'acide nucléique non recombinant demeurent relativement mal définies et peu précises en termes d'insertion, d'élimination et de réarrangement du matériel génétique. En sélectionnant les souches ou en appliquant des techniques de mutagenèse, on peut influencer la capacité de production des toxines d'un organisme ainsi que l'expression des composés antimicrobiens ou d'autres substances non présentes dans l'aliment.
En ce qui a trait aux micro-organismes dérivés de techniques classiques de sélection et de mutagénèse, l'information devrait être fournie pour caractériser pleinement la nouvelle souche qui permet une comparaison avec le(s) organisme(s) parent(s). La caractérisation inclura des détails sur les méthodes utilisées pour modifier l'organisme et des comparaisons phénotypiques et génotypiques des parents et des donneurs, si cela est approprié. Les caractéristiques, nouvelles ou altérées, acquis et exprimés, devraient être décrits. Une comparaison de l'activité biologique, des caractéristiques physiologiques et de croissance du nouveau micro-organisme avec le parent, exception faite de la modification intentionnelle, devrait être faite. Dans tous les cas, le degré d'exposition au micro-organisme modifié ou à ses produits constituera un facteur important pour déterminer la quantité de données requises pour une évaluation de sécurité (examens de l'exposition alimentaire).
Les micro-organismes modifiés de façon traditionnelle requièrent une évaluation multidisciplinaire puisque certains détails relatifs à la modification peuvent être en grande partie inconnus. L'expérience dans l'évaluation de l'innocuité des aliments nouveaux étant en plein développement, il se pourrait que l'on puisse mieux préciser les exigences en matière de données concernant des groupes particuliers de produits ou d'écarter la possibilité d'évaluation plus approfondie de certains produits.
Modifications génétiques par des techniques modernes
Dans les cas où un micro-organisme a été modifié à l'aide de techniques génétiques modernes, comme les techniques d'ADN recombinant, l'évaluation de l'innocuité portera sur les données de caractérisation détaillées d'un organisme nouveau au niveau moléculaire. Les exigences suivantes sont tirées de lignes directrices portant sur l'évaluation de l'innocuité, acceptées par la Commission du Codex Alimentarius 2003Note de bas de page 12. En plus des exigences présentées dans les sections précédentes, les domaines suivants devraient être examinés pour ces types de produits :
i) Description de la (des) modification(s) génétique(s)
Des détails de toutes les méthodes et manipulations exécutées dans la modification d'un organisme doivent être indiqués afin de permettre l'identification de tout le matériel génétique pouvant être inséré, supprimé, muté ou réarrangé dans le génome hôte. Ainsi, les renseignements nécessaires à l'analyse des données en appui de la caractérisation de l'organisme modifié seront accessibles.
La description du processus de modification devrait comprendre :
- l'information sur la (les) méthode(s) de modification utilisée(s), c.-à-d. la conjugaison, l'électroporation, etc.;
- la description et la caractérisation de tous les matériaux génétiques pouvant être livrés, le cas échéant, y compris la source, l'identité et la fonction prévue dans l'organisme et la copie du nombre de plasmides;
- les détails des manipulations ou des modifications effectuées sur le matériel génétique introduit, intermédiaire et récepteur.
Des renseignements devraient être fournis concernant l'ADN ajouté, inséré, supprimé ou modifié, y compris :
- la caractérisation de toutes les composantes génétiques y compris les gènes marqueurs, les éléments de réglementation ou autres éléments affectant la fonction de l'ADN;
- la taille et l'identité;
- la situation et l'orientation de la séquence dans le vecteur final/gène hybride;
- la fonction dans l'organisme.
Un diagramme sommaire exposant les caractéristiques principales du gène hybride final devrait être fourni. Des cartes de restrictions et des données sur la séquence du matériel génétique introduit ou modifié et des régions adjacentes peuvent être requises en fonction de la nature de la modification génétique.
ii) Caractérisation de la (des) modification(s) génétique(s)
En vue de fournir une vision claire de l'impact sur la composition et l'innocuité des aliments dérivés d'organismes génétiquement modifiés, une caractérisation complète moléculaire et biochimique de l'organisme devrait être effectuée
Des renseignements devraient être fournis sur les insertions d'ADN dans le génome et doivent comprendre :
- la caractérisation et la description de tous les matériaux génétiques insérés, éliminés ou autrement modifiés;
- le nombre de points d'insertion;
- les données permettant de démontrer si des copies entières ou partielles ont été insérées dans le génome;
- des données permettant de démontrer si l'arrangement du matériel génétique utilisé pour l'insertion a été conservé ou si des réarrangements importants sont survenus à la suite de l'intégration;
- l'organisation du matériel génétique inséré à chaque site d'insertion, y compris le numéro de copie et, le cas échéant, la séquence de données du matériel inséré et des régions environnantes;
- l'identification de tout cadre de lecture ouvert à l'intérieur de l'ADN créé par l'insertion avec l'ADN génomique avoisinant de la plante, si le matériel génétique inséré est tronqué;
- lorsque des modifications qui comportent des suppressions, des réarrangements ou une mutagénèse in vitro dirigée, les données de la séquence de la région avant et après la modification devraient être fournies.
Des renseignements devraient être fournis concernant toutes les substances exprimées de l'organisme modifié et comprendre :
- le produit génétique (p. ex., une protéine ou un ARN non traduit);
- la fonction du produit génétique;
- la description phénotypique du (des) nouvelle(s) caractéristique(s);
- le niveau et le lieu d'expression du(des) produit(s) du gène et les niveaux de ses métabolites;
- afin de démontrer si des modifications délibérées effectuées sur la séquence en acides aminés de la protéine exprimée entraînent des changements dans sa modification post-traduction ou affectent les sites cruciaux pour sa structure ou sa fonction;
- lorsque les manipulations génétiques sont effectuées pour altérer la régulation des gènes endogènes, les caractéristiques et les niveaux des gènes d'expression devraient être comparés avec ceux de l'hôte non modifié;
- pour indiquer s'il y a des preuves suggérant que l'un des nombreux gènes endogènes du micro-organisme hôte a été affecté par le processus de modification;
- pour confirmer l'identité et les schèmes d'expression de toutes les nouvelles protéines chimères;
- pour démontrer que l'effet intentionnel de la modification a été atteint et que toutes les caractéristiques exprimées sont exprimés et transmis d'une manière qui est stable à travers plusieurs générations en accord avec les lois de la transmission génétique. Il peut être nécessaire d'examiner la transmission génétique de l'ADN lui-même ou de l'expression de l'ARN correspondant si les caractéristiques phénotypiques ne peuvent pas être mesurées directement;
- afin de démontrer que la(les) souche(s) nouvellement exprimée(s) est exprimée comme prévu dans les tissus pertinents d'une manière et à des niveaux qui sont compatibles avec les séquences réglementaires associées qui dirigent l'expression du gène correspondant.
iii) Considérations particulières dans le cas où un micro-organisme à ADN recombinant viable est présent dans l'aliment
On reconnaît que la transmission horizontale de gènes peut s'avérer problématique si le micro-organisme modifié est revivifiable et présent dans l'aliment. Par conséquent, une considération particulière doit être supportée concernant la possibilité que le micro-organisme colonise l'intestin et transmette du matériel génétique au reste de la flore intestinale. En raison de ces préoccupations, les exigences suivantes doivent être satisfaites :
Évaluation de la viabilité et de la rémanence des micro-organismes dans le tractus gastro-intestinal humain :
Dans certains aliments produits à l'aide de micro-organismes à ADN recombinant, l'ingestion de ces micro-organismes et leur rémanence doivent avoir une incidence sur le tractus intestinal humain. La nécessité de tests plus approfondis sur ces micro-organismes doit s'appuyer sur la présence de leur équivalent conventionnel dans les aliments, et sur la nature des effets voulus ou non des modifications génétiques. Si la transformation du produit alimentaire final permet d'éliminer les micro-organismes revivifiables (par traitement thermique dans la cuisson du pain par exemple), ou si des accumulations de produits finaux toxiques pour le micro-organisme (comme l'alcool ou les acides) éliminent sa nature revivifiable, la viabilité et la rémanence des micro-organismes dans le système alimentaire n'ont donc pas besoin d'être examinées.
Quant aux applications où les micro-organismes à ADN recombinant utilisé dans la production demeurent revivifiables dans le produit alimentaire final (p. ex., les organismes dans certains produits laitiers), il est recommandé de démontrer la viabilité (ou temps de rémanence) du micro-organisme seul, et à l'intérieur de la matrice alimentaire qui lui correspond dans le système digestif et l'incidence sur la microflore intestinale dans les systèmes appropriés. La nature des effets voulus ou non de la modification génétique et l'ampleur des différences par rapport à l'équivalent conventionnel permettront de déterminer la portée de ces tests.
Antibiorésistance et transfert génétique :
De façon générale, les souches traditionnelles de micro-organismes élaborées aux fins de transformation des aliments n'ont pas été évaluées quant à leur résistance aux antibiotiques. De nombreux micro-organismes utilisés dans la production d'aliments possèdent une résistance intrinsèque à des antibiotiques particuliers. De telles propriétés ne doivent pas exclure ces souches des examens en tant que précepteurs dans la construction de micro-organismes à ADN recombinant. Cependant, les souches pour lesquelles l'antibiorésistance est codée par élément génétiquement transmissible ne doivent pas être utilisées si ces souches ou ces éléments génétiques sont présents dans l'aliment final. Toute indication de la présence de plasmines, de transposons ou d'intégrons contenant de tels gènes résistants devrait être étudiées attentivement.
Des technologies de remplacement, dont on a démontré la sûreté, ne dépendant pas de gènes marqueurs résistants aux antibiotiques dans des micro-organismes revivifiables présents dans les aliments doivent être utilisées aux fins de sélection dans les micro-organismes à ADN recombinant. De façon générale, l'utilisation d'un marqueur résistant aux antibiotiques pour développer des souches intermédiaires ne devrait poser aucun risque important qui viendrait exclure l'utilisation des souches finales dans la production alimentaire, à condition que les gènes marqueurs résistants aux antibiotiques aient été retirés du produit final.
La transmission de plasmides et de gènes entre la microflore intestinale rémanente et les micro-organismes à ADN recombinant ingérés peut se produire. La possibilité et les conséquences de la transmission génétique, des micro-organismes à ADN recombinant et des produits alimentaires développés à l'aide de micro-organismes à ADN recombinant, en micro-organismes intestinaux ou aux cellules humaines doivent également être considérées. Il est peu probable que l'ADN transmis survive en l'absence d'une pression de sélection. Néanmoins, la possibilité de tels événements ne peut pas être complètement écartée.
Afin de réduire au minimum la possibilité de transmission génétique, les étapes suivantes doivent être envisagées :
- l'intégration chromosomique du matériel génétique inséré serait préférable à la localisation dans un plasmide;
- dans les cas où le micro-organisme à ADN recombinant demeurera revivifiable dans le tractus gastro-intestinal, il faut éviter dans le construit génétique les gènes qui pourraient entraîner un avantage sur le plan de la sélection pour les organismes récepteurs auxquels le matériel génétique est transmis involontairement;
- les séquences intermédiaires à l'intégration dans d'autres génomes doivent être évitées au moment de créer le matériel génétique introduit.
4.2.3.3 Historique de l'organisme
L'historique d'un organisme donneur et celui d'un hôte peuvent fournir des renseignements importants dans l'évaluation d'un aliment nouveau. Il peut exister des antécédents de production de toxines par certaines souches, espèces ou génériques et il serait important, dans ces situations, d'examiner la variété particulière de l'organisme utilisée dans le développement de l'aliment nouveau afin de vérifier la possibilité de produire de telles toxines, à la fois dans des conditions utilisées au cours de la fabrication et aussi dans des conditions extrêmes.
L'information détaillée suivante devrait être fournie :
- la désignation taxonomique du micro-organisme au niveau des espèces et, là où cela est applicable, pour inclure les sous-espèces et les souches, accompagnée de données techniques justifiant cette désignation;
- les autres noms (synonymes, nom commun, nombre de souches, numéro d'acquisition de la collection de culture) associés aux micro-organismes;
- l'origine (environnemental/clinique/isolat de l'aliment, collection de culture) du micro-organisme;origine (environnemental/clinique/isolat de l'aliment, collection de culture) du micro-organisme;
- le développement de la souche et l'historique de l'amélioration du micro-organisme;
- la pathogénicité du genre et de l'espèce;
- les preuves se rapportant au potentiel de production de tout composé toxique et antibiotique;
- de longs antécédents d'innocuité, particulièrement dans les aliments, du micro-organisme à l'étude et des souches étroitement reliées.
4.2.3.4 Exposition alimentaire
En menant des évaluations sur l'exposition dans le régime des nouveaux aliments produits par modification génétique, les principales questions auxquelles il faut trouver des réponses lors de l'évaluation de l'innocuité sont les suivantes : le potentiel d'altération du contenu des éléments nutritifs et le potentiel d'introduction de nouvelles substances dans l'apport alimentaire.
Dans les cas où la composition des éléments nutritifs des aliments a été modifiée, même intentionnellement par des modifications génétiques, les changements à la consommation des éléments nutritifs devraient être déterminés pour l'aliment lui-même et en tenant compte du fait que l'aliment est une source d'éléments nutritifs dans la diète globale. Il faudrait examiner la variation des schèmes de diète dans les sous-groupes de la population (p. ex., enfants, nouveaux-nés, personnes âgées, groupes ethniques) de même que le potentiel de changement dans l'utilisation ou l'exposition à l'aliment par rapport à l'aliment traditionnel qui lui est relié).
Dans le cas des aliments produits à partir de micro-organismes modifiés génétiquement qui ont comme conséquence d'introduire une nouvelle protéine ou de nouveaux métabolites dans l'apport alimentaire, il faudrait déterminer et examiner leur contenu en fonction de leurs données toxicologiques lors de l'évaluation toxicologique. Les effets des processus typiques de traitement des aliments sur le ou les nouveau(x) composant(s) devraient être examinés en dérivant l'exposition estimée.
4.2.3.5 Examens nutritionnels
I Effets nutritionnels non intentionnels
Observations générales
L'introduction d'un aliment nouveau dans l'approvisionnement alimentaire canadien est nécessite que l'on détermine la qualité nutritionnelle de l'aliment et les implications de ses caractéristiques nutritionnelles pour l'ensemble de la population ou pour des sous-groupes particuliers. Ces sous-groupes de la population peuvent être plus vulnérables pour différentes raisons, par exemple, les jeunes enfants, les femmes enceintes et les mères qui allaitent, les personnes ayant des caractéristiques métaboliques particulières, les adolescents et d'autres personnes qui peuvent consommer de grandes quantités d'aliments, ou les personnes âgées qui ne consomment que de petites quantités d'aliments. Une évaluation nutritionnelle, comprenant un examen des effets intentionnels et non intentionnels, est nécessaire dans le but de s'assurer que l'état nutritionnel des consommateurs ne risque pas d'être menacé par :
- la substitution d'aliments ou d'ingrédients alimentaires qui ont une valeur nutritionnelle considérable, par des variétés moins nutritives de ces aliments ou d'aliments semblables;
- l'ingestion excessive de nutriments ou d'autres substances bioactives du fait que l'aliment nouveau en contient des niveaux exceptionnellement élevés;
- des niveaux récents ou accrus de facteurs antinutritionnels qui pourraient affecter de façon négative la valeur nutritionnelle de l'aliment ou du régime alimentaire.
Qu'est-ce que la qualité nutritionnelle?
La qualité nutritionnelle, telle qu'appliquée aux aliments, est liée à la présence de nutriments essentiels et de substances énergétiques (en quantité et qualité adéquates) ainsi qu'à d'autres aspects des aliments traditionnellement considérés comme faisant partie de la science de la nutrition. Ces aspects comprennent les rôles nutritionnels des acides aminés non essentiels, des types spécifiques d'acides gras et d'hydrates de carbone, des fibres alimentaires, du cholestérol, des substances lipotropes, et d'autres composants d'aliments spécifiques (p. ex., le lait maternel), de la biodisponibilité et des interactions entre les nutriments et les autres nutriments, les additifs alimentaires et les substances toxiques naturelles. Ils incluent également les excès de nutriments et les effets (à la fois positifs et négatifs) de la transformation des aliments sur les nutriments et sur les propriétés organoleptiques des aliments. On a plus récemment démontré qu'une gamme étendue de substances « bioactives » trouvées principalement dans les végétaux avait peut-être un rôle à jouer dans l'amélioration ou la protection de la santé de l'homme. Ces rôles sont également compris dans la définition au sens large de la qualité nutritionnelle.
Micro-organismes modifiés génétiquement
Les micro-organismes constituent une composante mineure quantitative des aliments dans la diète canadienne. L'utilisation d'une protéine en tant qu'ingrédient d'un aliment est rare. Ainsi, il est très improbable qu'un changement dans les micro-organismes qui sont actuellement présents dans les aliments pourrait avoir un impact direct sur la qualité nutritionnelle des aliments et des diètes. Il existe toutefois deux façons par lesquelles un micro-organisme dans un aliment pourrait avoir un impact sur la qualité nutritionnelle de l'aliment ou de la diète et, par ricochet, sur la santé des consommateurs.
L'une de ces façons est que les micro-organismes peuvent avoir un impact indirect important sur la qualité nutritionnelle des aliments dans lesquels ils se trouvent. Par exemple, l'utilisation de la levure pour faire lever le pain réduit le contenu en phytates qui rendent les minéraux plus disponibles pour l'absorption intestinale. La levure produit également des vitamines B en quantité suffisante pour affecter de façon significative le contenu de certaines des vitamines B, par exemple le folate, dans le pain. L'autre façon par laquelle un micro-organisme présent dans un aliment peut avoir un impact sur la santé est potentiellement en tant que « probiotique ». On croit que les probiotiques peuvent proliférer et altérer la population de bactéries dans le gros intestin et, en conséquence, avoir des effets bénéfiques variés sur la santé de l'intestin et de la personne.
Ainsi le développement de nouvelles formes de micro-organismes utilisés dans les aliments par le biais de la modification génétique, même par des méthodes de sélection, des techniques d'ADN recombinant et de mutagénèse, pourrait causer des changements intentionnels ou non intentionnels dans la composition des aliments qui pourraient, par ricochet, avoir un impact sur la valeur nutritionnelle de l'aliment et le statut nutritionnel des personnes qui le consomment. Alors que des modifications génétiques en strates ou plus complexes sont expérimentées par des techniques d'ADNr, par exemple pour introduire simultanément des caractéristiques nutritionnelles et fonctionnels dans le même organisme, ceux-ci pourraient accroître le potentiel d'effets non intentionnels en comparaison avec des modifications plus simples. Par la même pratique, d'autres méthodes de modifications génétiques pourraient également introduire des changements multiples.
Des effets nutritionnels non intentionnels peuvent se produire même si la modification des micro-organismes est prévue pour des raisons nutritionnelles, fonctionnelles ou autres. L'évaluation de la modification d'un micro-organisme prévu pour affecter la qualité nutritionnelle du micro-organisme ou de l'aliment auquel il appartient fait l'objet d'une discussion dans la Partie II de cette section. Ainsi, la discussion sur les aspects probiotiques des micro-organismes est limitée à cette partie.
Une étape importante dans l'évaluation nutritionnelle et dans l'évaluation de la sécurité de cet aliment modifié est la comparaison de sa composition avec ses contreparties appropriées. Dans le cas d'un micro-organisme modifié, ceci pourrait s'appliquer au micro-organisme lui-même dans l'éventualité où il constitue une portion importante de la masse alimentaire mais ceci s'appliquera plus probablement à l'aliment contenant le micro-organisme modifié. Pour déterminer s'il y a des différences dans la qualité nutritionnelle de l'aliment contenant le micro-organisme modifié comparé à ses contreparties appropriées, le micro-organisme devrait d'abord être soumis à des essais de laboratoire portant sur les produits métaboliques du micro-organisme dans un milieu contrôlé. Une fois qu'ils se trouvent dans la phase d'essai de production de l'aliment, les constituants majeurs de l'aliment contenant le micro-organisme doivent être analysés, c.-à-d les macroéléments nutritifs et leurs parties composantes, de même que les microéléments nutritifs isolés sélectionnés sur la base de critères validés. Si un élément nutritif (dans la liste ci-dessous) est exclu des analyses, ceci devrait être justifié par des raisons acceptables.
De même, certaines circonstances peuvent justifier une évaluation de la « performance » nutritionnelle d'un aliment nouveau dans sa forme prête à manger, de même que s'il est cru ou traité par des méthodes traditionnelles/conventionnelle utilisées pour en faire un produit prêt à manger. Le but serait d'offrir une occasion d'identifier les changements majeurs qui pourraient ne pas être avoir été décelés par l'analyse compositionnelle, mais qui peuvent affecter, par exemple, la stabilité ou la biodisponibilité des nutriments dans l'aliment ou la sensibilité des facteurs antinutritionnel à des procédés de transformation qui, normalement, les détruisent. Un essai de rendement pourrait supposer une nouvelle analyse d'une substance après la cuisson ou il pourrait nécessiter un essai de biodisponibilité sur un animal.
Lignes directrices sur la production de données pour l'évaluation nutritionnelle
- Fonction des données à être soumises
- Les renseignements fournis sur un micro-organisme nouveau ou sur un aliment qui en contient un doivent être suffisants, sur le plan de la qualité comme de la quantité, pour permettre une évaluation afin de savoir si une modification génétique non intentionnelle importante affecte la qualité nutritionnelle de l'aliment créé à la suite de l'introduction d'une nouvelle caractéristique. Les renseignements devraient également permettre une évaluation de l'importance nutritionnelle de tout changement qui a été décelé.
- Des données sur l'aliment nouveau devraient être comparées, à tout le moins, aux données relatives à la souche parente non transgénique, isogénique, c'est-à-dire l'équivalent le plus pertinent, si elles sont accessibles, ou sinon une souche non transgénique qui lui est étroitement reliée. Puisqu'une ou plusieurs différences significatives pourraient survenir, la méthodologie devrait inclure les souches de la même espèce allant des souches standards qui sont utilisées dans la production commerciale aux mêmes fins et, possiblement, à des souches de production typiques au Canada. Ceci permettrait une évaluation à l'égard des variations normales. Les données documentaires (si elles sont accessibles) sont également valables pour évaluer la pertinence nutritionnelle de tout effet non intentionnel.
- Des données sur l'aliment nouveau devraient être comparées, à tout le moins, aux données relatives à la souche parente non transgénique, isogénique, c'est-à-dire l'équivalent le plus pertinent, si elles sont accessibles, ou sinon une souche non transgénique qui lui est étroitement reliée. Puisque une ou plusieurs différences significatives pourraient survenir, la méthodologie devrait inclure les souches de la même espèce allant des souches standards qui sont utilisées dans la production commerciale aux mêmes fins et, possiblement, à des souches de production typiques au Canada. Ceci permettrait une évaluation à l'égard des variations normales. Les données documentaires (si elles sont accessibles) sont également valables pour évaluer la pertinence nutritionnelle de tout effet non intentionnel.
- Une hypothèse claire doit être formulée et accompagnée d'une méthodologie appropriée, afin d'obtenir des données sur la composition nutritionnelle qui permettront ce qui suit :
- Examiner toutes les sources importantes de variation possible dans la qualité nutritionnelle, par exemple la composition du milieu de croissance, les conditions de production et de transformation, etc., au moment de concevoir l'étude, afin de veiller à ce que l'on maîtrise bien ces éléments.
- Exposer le micro-organisme modifié ou l'aliment qui le contient aux conditions prévues pour la production commerciale.
- Inclure dans la même étude le nouveau micro-organisme qui fait l'objet de l'avis ainsi que les équivalents pertinents, c'est-à-dire la souche parente non transgénique, isogénique la plus proche, si elle est accessible, et une sélection de souches commerciales offertes actuellement sur le marché. En l'absence d'une souche parente isogénique proche, il est possible de choisir la souche non transgénique reliée la plus proche.
- Établir un plan d'échantillonnage avant le début de l'étude, fondé sur un calcul permettant d'utiliser au moins une ou plusieurs composantes, afin d'indiquer le nombre d'échantillons requis. Cela pourrait être fondé sur les analytes les plus importants ou les analytes que l'on prévoit être plus variables et nécessiter plus d'échantillons. Il faut fournir des détails concernant la puissance et la taille prévues de la méthodologie choisie pour le test statistique proposé ainsi que des vérifications d'hypothèses.
- S'assurer que l'échantillonnage est effectué aux étapes appropriées de l'incubation.
- S'assurer que toutes les analyses appropriées sont faites sur tous les produits contenant les micro-organismes et devant être utilisés en tant qu'aliments au Canada.
- Établir les critères de sélection des nutriments analysés et la justifier l'exclusion des analyses de tout nutriment et de toute autre substance figurant dans la section « Composition des nutriments » ci-dessous.
- S'assurer que les analyses de chaque composant, nutritif et non nutritif, sont effectuées sur tous les échantillons, par le même laboratoire, selon des méthodes d'analyse approuvées et validées à l'échelle internationale, et selon des procédures de conservation des échantillons et de préparation uniformes et appropriées, et ce, tout au long des analyses.
- Veiller à ce que les échantillons utilisés dans le cadre de cette étude soient analysés dans un délai acceptable suivant la date de cueillette.
- Utiliser des méthodes statistiques pertinentes et uniformes, choisies à l'avance selon la méthodologie, afin de comparer les concentration de chaque nutriment contenu dans l'aliment nouveau par rapport au groupe contrôle.
-
Composition des nutriments
Les composants des aliments nouveaux présentés ci-dessous devraient être analysés dans le contexte des lignes directrices de l'étude susmentionnée. Même si les nutriments ne sont pas tous analysés, le demandeur devrait fournir les critères de sélection des nutriments analysés et indiquer les raisons pour lesquelles certains nutriments ou d'autres substances figurant dans la liste suivante ont été exclus de l'analyse.
- la composition immédiate (p. ex., les cendres, l'humidité, les protéines, le gras, les fibres, les hydrates de carbone);
- o le contenu en protéine vraie, en matière azotée non protéinée (p. ex., les acides nucléiques et les aminoglycosides), le profil en acides aminés - la quantité d'acides aminés inhabituels devrait être déterminée si on suspecte leur présence (p. ex., les acides aminés d'origine bactérienne);
- le profil complet des acides gras exprimé en tant que pourcentage total des acides gras, les composants non saponifiables, et les stérols - la liste des acides gras doit être regroupée selon les catégories monoinsaturé, polyinsaturé et saturé;
- la composition de la fraction des hydrates de carbone (p.ex., les sucres, les amidons, les chitines, les tanins, les polysaccharides non amylacés et les lignines);
- la composition des micronutriments (p. ex., l'analyse des vitamines et des minéraux importants);
- la présence de facteurs antinutritionnels naturels ou adventifs (p. ex., les phytates, les inhibiteurs de la trypsine, etc.);
- les métabolites secondaires prévisibles, les substances physiologiques actives (bioactives) et les autres substances décelées.
-
« Rendement » nutritionnel du micro-organisme modifié
Il faut tenir compte du besoin éventuel de renseignements comme ceux présentés ci-dessous concernant l'aliment nouveau :
- La réaction des facteurs antinutritionnels connus à des procédés normalement prévus pour neutraliser leur activité, mesurée par une analyse compositionnelle.
- La stabilité à l'entreposage en ce qui concerne la dégradation des nutriments.
- Le rendement du produit relativement aux avantages prévus (autre que des avantages directs pour la santé) c.-à-d. l'amélioration de la stabilité d'une huile pour la cuisson après la modification du profil des acides gras.
-
Biodisponibilité nutriments / Présence de facteurs antinutritionnels nouveaux ou modifiés
Dans les situations où un aliment provenant d'une source modifiée génétiquement peut devenir un important composant du régime alimentaire canadien, ou un fournisseur important de nutriments, des études sur les animaux devraient être effectuées afin d'évaluer le niveau de la valeur nutritionnelle. Ceci se rapporte en particulier à l'évaluation de la qualité des protéines, à la possibilité de facteurs antinutritionnels inconnus et à la question relative à la biodisponibilité des nutriments.
Le cas échéant, des renseignements devraient être fournis afin de décrire les conditions de transformation qui seraient utilisées dans la production de l'aliment nouveau et les effets de la transformation sur la concentration de nutriments et la biodisponibilité de ceux-ci.
- Renseignements à inclure dans la demande :
- le nom de toutes les souches qui ont été présentées dans l'étude.
- une description complète de la conception expérimentale, des conditions expérimentales et de la façon dont les sources de variation des concentrations de nutriments ont été contrôlées.
- une description complète de la cueillette et de la préparation des échantillons;
- une présentation ou une description des méthodes statistiques et d'analyse qui ont été utilisées afin d'obtenir des données sur les composants nutritionnels et non nutritionnels;
- les données concernant les éléments nutritifs et les données qui leur sont reliées en ce qui concerne les souches d'essais, de contrôle et commerciales (exprimées en termes de moyenne ± l'écart type et en termes d'étendue).
- les résultats de l'analyse statistique;
- les données brutes de tous les composants analysés;
- les données publiées, si elles sont accessibles;
- l'utilisation prévue au Canada du micro-organisme en tant qu'aliment, par exemple le(s) type(s) d'ingrédients, le produit final possible, le niveau d'utilisation s'il est différent de celui des produits actuels qu'il remplacerait, les habitudes reconnues d'utilisation ainsi que la consommation de l'aliment et de ses dérivés;
- toute utilisation non prévue, envisageable.
- Processus de prise de décision
- Des méthodes statistiques modernes appropriées doivent être appliquées aux données afin de démontrer qu'aucun changement important ne découle de l'intervention. Selon le CodexNote de bas de page 13, « la signification statistique de toutes différences observées devrait être évaluée dans le contexte de l'écart de variations naturelles pour ce paramètre afin de déterminer sa signification biologique ». Si la composition de l'aliment nouveau est jugée ne pas être équivalente, sur le plan nutritionnel, à celui de ses contreparties, c.-à-d. que des différences significatives (statistiques et biologiques) existent dans les données sur les nutriments, des données nutritionnelles supplémentaires peuvent être requises, au cas par cas.
- Tous les aspects de la qualité nutritionnelle seront évalués et fondés sur les principes, les normes et les lignes directrices nutritionnelles de pointe visant à répondre aux besoins nutritionnels de l'homme. Les fondements de l'évaluation comprennent : les recommandations concernant l'apport nutritionnel, le rôle de l'aliment dans le régime alimentaire de la population et l'incidence du régime et de la nutrition sur la réduction des risques de développer une maladie liée au régime et sur la promotion de la santé.
- La détection d'un changement majeur causé par un effet nutritionnel non intentionnel peut ne pas empêcher la mise en marché du produit. Cependant, ces changements peuvent nécessiter l'application de limites sur l'utilisation de l'aliment dans des produits alimentaires ou une exigence d'étiquetage qui va plus loin que les dispositions de base. Consultez aussi la partie II concernant l'évaluation de l'innocuité des niveaux élevés de nutriments ou de substances bioactives.
- La première phase de l'évaluation nutritionnelle sera fondée sur les données relatives à la composition nutritionnelle et sur une évaluation des effets intentionnels et non intentionnels sur la composition nutritionnelle. Si l'on découvre des composants, des concentrations de nutriments ou des substances nutritives inhabituels ou non intentionnels, l'aliment peut alors être soumis à des analyses plus approfondies.
- L'innocuité relative à une hausse importante de la concentration de nutriments ou d'autres composants bioactifs nécessiterait une évaluation homologue à celle de l'innocuité relative à un changement nutritionnel prévu. Consultez la partie II ci-dessous pour obtenir plus de détails.
II Modifications nutritionnelles intentionnelles
Le terme « modifications nutritionnelles intentionnelles » englobe tous les changements ou les caractéristiques introduits intentionnellement en vue d'améliorer la qualité nutritionnelle ou le profil de l'aliment en ce qui touche la santé, y compris, sans toutefois s'y limiter, les nutriments essentiels, les phytochimiques bioactifs bénéfiques, les quantités et la nature des substances énergétiques, la biodisponibilité accrue des nutriments et la réduction des concentrations de facteurs antinutritionnels.
L'évaluation des changements nutritionnels intentionnels exige que l'on suive des étapes semblables à celles utilisées pour l'ajout d'un nutriment vitaminique ou minéral à un aliment, pour l'évaluation d'aliments auxquels une allégation en matière de santé est reliée, ou les deux. Par exemple, un tel changement soulèverait des questions ayant trait au groupe cible prévu, au niveau de concentration prévu du nutriment ciblé ou d'une autre substance dans l'aliment, au changement prévu dans le niveau d'exposition au nutriment ciblé ou à une autre substance pour tous les groupes (âge et sexe) et aux niveaux extrêmes supérieur et inférieur de consommation de l'aliment, de même qu'à l'innocuité de ce niveau d'exposition.
Un aliment nouveau auquel on a intégré un avantage sanitaire ou nutritionnel entrerait dans la catégorie non officielle « d'aliment fonctionnel ». On s'attend à ce que les manufacturiers souhaitent faire des allégations santé pour ces produits. Ces produits seraient donc évalués selon les critères établis pour les aliments avec des allégations santé spécifiques. Ceci inclut de porter une attention particulière aux preuves apportées pour supporter ces allégations de même qu'aux questions concernant l'innocuité et la qualité du produit.
L'innocuité d'un produit de ce type d'aliment nouveau est contrôlée par la mise en œuvre de règlements sur les aliments nouveaux. L'évaluation de l'innocuité d'un aliment nouveau modifié génétiquement dans le but d'obtenir une modification nutritionnelle intentionnelle devrait être la même que pour les autres aliments modifiés génétiquement. En ce qui a trait à l'évaluation nutritionnelle et de l'innocuité de la modification nutritionnelle intentionnelle en soi, les exigences en matière de données sont décrites ci-dessous.
À ce stade, les règlements concernant l'autorisation spécifique des allégations santé liées aux aliments n'ont pas encore été promulgués. Les futurs demandeurs devraient se référer au cadre de réglementation proposé concernant l'autorisation spécifique des allégations santé liées aux aliments, qui a été publié au mois de novembre 2001, et au Document d'orientation provisoire sur les normes relatives aux éléments probant qui a été publié en février 2002.
L'ajout d'une substance par des modifications génétiques est différent de l'ajout par l'application ou le mélange de cette substance à l'aliment après qu'il ait été recollé. La décision de continuer ou de cesser l'ajout prendrait place à différentes étapes de la production. Ceci pourrait avoir un effet sur la capacité de gérer la présence de la substance « ajoutée » ou de la caractéristique dans l'apport alimentaire si on considérait plus tard la nécessité de le contrôler. En raison de ce besoin potentiel, de tels produits devraient être soumis à une surveillance après sa mise en marché pour assurer la capacité de surveiller et de contrôler les produits. Pour promouvoir un produit qui a été altéré avec l'intention d'en faire profiter le consommateur, les manufacturiers eux-mêmes seraient requis de le surveiller après sa mise en marché, dans tous les cas, et ceci ne devrait donc pas ajouter un fardeau additionnel important.
Il est important d'établir jusqu'à quel point l'élément nutritif ou une autre substance ciblée dont les niveaux ont été changés (si l'intention était de modifier de façon délibérée le niveau d'un élément nutritif) est biodisponible et demeure stable durant la culture, dans le temps, lors du traitement, de l'entreposage et de la cuisson.
La révision des effets nutritionnels non intentionnels dans un aliment modifié dans le but d'obtenir un effet nutritionnel intentionnel suivrait les mêmes étapes qu'en ce qui concerne les autres aliments nouveaux.
Évaluation nutritionnelle de l'augmentation prévue ou inattendue des concentrations d'un nutriment ou d'une substance bioactive
L'augmentation des concentrations d'un nutriment ou d'une autre substance bioactive intrinsèque ( y compris un micro-organisme) dans un aliment doit être évaluée pour en vérifier l'innocuité.
Les données nécessaires à cette fin comprennent :
- la concentration du nutriment ou d'une autre substance ciblé et prévu dans l'aliment;
- le niveau prévu d'exposition à la substance par la consommation de l'aliment par le groupe ciblé, par des sous-groupes vulnérables et à l'extrémité supérieure ou inférieure d'ingestion de l'aliment dans tous les groupes (âge et sexe), selon les données canadiennes récentes sur la consommation d'aliments, dans la mesure du possible;
- le groupe ciblé prévu, le cas échéant, ou le ou les groupes qui risquent le plus d'ingérer une grande quantité de l'aliment;
- la façon dont le niveau prévu d'exposition au nutriment ou à une autre substance ciblé diffère des niveaux actuels d'exposition de toutes les sources;
- des données en appui de l'innocuité du niveau prévu d'exposition.
4.2.3.6 Examens toxicologiques
Il est absolument nécessaire d'effectuer des tests toxicologiques sur les substances dont on ne connaît pas l'innocuité et qui sont introduites dans l'approvisionnement alimentaire. De nouvelles substances peuvent être introduites dans l'apport nutritif par des technologies de l'ADN recombinant ou peuvent être générées par l'application de nouveaux processus aux aliments ou [autres processus de modification de l'ADN]. L'introduction de nouvelles substances peut être intentionnelle ou non intentionnelle.
Les techniques de modifications génétiques peuvent causer la création de nouvelles substances par l'organisme ou la modification intentionnelle ou non intentionnelle de substances déjà produites par l'organisme ou son expression.
Substances nouvelles
Les techniques d'acide nucléique in vitro permettent la production d'ADN pouvant causer la synthèse de nouvelles substances dans le micro-organisme. Ceci inclut le produit d'expression de la protéine et d'autres substances qui peuvent être générées à la suite de l'activité enzymique du produit d'expression de la protéine. Les nouvelles substances peuvent être des composantes conventionnelles des micro-organismes.
L'introduction de cette caractéristique ne devrait pas être reliée à aucune caractéristique des organismes donneurs qui pourraient être nuisible à la santé humaine. On devrait fournir l'information pour assurer que le codage des gènes des toxines ou des éléments non nutritifs connus présents dans l'organisme des donneurs ne soit pas transféré à d'autres organismes recombinants.
Des études toxicologiques ne sont pas considérées comme nécessaires lorsque la substance, ou une substance étroitement reliée, a été consommée de façon sûre dans les aliments, à des rations équivalentes, ou lorsque la nouvelle substance n'est pas présente dans les aliments. Autrement, l'utilisation d'études toxicologiques conventionnelles sur la nouvelle substance sera nécessaire. Ceci peut requérir l'isolement de la nouvelle substance du micro-organisme recombinant.
Pour les protéines, l'évaluation de la toxicité potentielle devrait se centrer sur la similarité des gènes d'acide aminé, entre la protéine et les toxines de protéines et les éléments non nutritifs connus (p. ex., les inhibiteurs de protéase, les lectines), de même que sur la stabilité lorsqu'il s'agit de chauffer ou de traiter et de la dégradation dans les systèmes représentatifs appropriés de modèles gastriques et intestinaux. Puisque les protéines qui sont des enzymes ne se sont jamais révélées être des substances cancérigènes qui agissent directement, des mutagènes, des tératogènes ou des produits toxiques reproductifs (Pariza et Foster 1983), il n'est généralement pas nécessaire de soumettre ces protéines à des essais pour des critères d'évaluation toxicologiques lorsque l'exposition apparaît par la voie orale. Les toxines de protéines agissent par des mécanismes pénétrant après l'administration d'une simple dose à des doses de nanogramme à milligramme par kilogramme du poids corporel (pc). Ainsi, les études de la toxicité aiguë pénétrant par voie orale qui utilisent des doses gramme/kg pc de la nouvelle protéine sont appropriées pour évaluer la toxicité potentielle des protéines. Un résultat négatif en utilisant l'écart en gramme/kg du poids corporel avec la preuve que la protéine est digérée en de petits peptides et en acides aminés fournira l'assurance que la protéine n'est pas une toxine et qu'elle est assimilée aux éléments nutritifs comme le sont la vaste majorité des protéines alimentaires.
Différents types d'études in vivo ou in vitro seraient nécessaires pour évaluer la toxicité des substances introduites autres que les protéines. Les types d'études sont déterminés sur la base du cas par cas et dépendent de la source originale des substances introduites et de leurs fonctions. De telles études peuvent inclure des essais de métabolismes, de toxicocinétique, de toxicité/carcicogénicité chroniques, d'impact sur la fonction reproductive et de tératogénicité.
Effets non intentionnels
Les techniques utilisées dans la modification génétique des plantes ou des micro-organismes ont le potentiel de produire des effets non intentionnels sur le génome de l'organisme modifié qui pourraient se manifester par une altération du niveau de toxines ou d'éléments non nutritifs normalement produits par cet organisme. L'altération génétique intentionnelle peut également influencer le comportement de l'organisme quant à l'accumulation de contaminants, de pesticides ou autres substances provenant de l'environnement qui n'était pas anticipée.
L'analyse compositionnelle est la méthode actuellement utilisée pour détecter les changements non intentionnels au génome qui sont causés par l'accumulation de substances toxiques d'origine endogène et exogène. En raison de l'influence du stress environnemental sur la production des composantes endogènes telles que les toxines et les éléments non nutritifs, il serait nécessaire de collecter des données d'un grand nombre de sites d'essais. Des technologies nouvelles, plus sensibles, qui permettent de déterminer les altérations à l'expression du génome des organismes sont présentement en voie de développement.
4.2.3.7 Examens relatifs à l'allergénicité
L'examen principal de l'évaluation de l'allergénicité d'un aliment nouveau a trait à la prévention d'une exposition inattendue et inévitable des personnes sensibles aux allergènes alimentaires. Ceci inclut l'évaluation du potentiel d'aliments contenant de nouvelles protéines à interréagir avec des allergènes alimentaires connus ou à mener au développement d'une hypersensibilité de novo. De plus, la possibilité d'accroître le potentiel allergénique à des aliments contenant des allergènes causé par une modification génétique devrait être évaluée.
Section 1 - Introduction
Toutes les nouvelles protéines d'expression dans les micro-organismes à ADN recombinant qui pourraient être présentes dans l'aliment final et sont nouvelles dans le contexte de cet aliment doivent être évaluées à l'égard de leur potentiel à causer des réactions allergiques. Ceci devrait inclure de vérifier si une nouvelle protéine d'expression en est une à laquelle certaines personnes pourraient déjà être sensibles et si une nouvelle protéine nouvellement introduite dans l'apport alimentaire est susceptible de produire des réactions allergiques chez certaines personnes.
Pour le moment, on ne connaît pas de test qui puisse mesurer directement le potentiel allergène d'une nouvelle protéine d'expression chez les humains. Selon les meilleures informations scientifiques actuellement disponibles, l'approche recommandée tient compte de la prépondérance de la preuve dérivée des divers types d'informations et des données d'une manière intégrée, par étapes logiques et au cas par cas.
Section 2 - Stratégie d'évaluationNote de bas de page 14
Les étapes initiales d'évaluation de l'allergénicité possible des nouvelles protéines d'expression suppose que l'on détermine ce qui suit : l'allergénicité de la source de la protéine introduite; la similitude entre la séquence d'acide aminé de la protéine et des allergènes connus; et certaines propriétés physico-chimiques, incluant mais ne se limitant pas à sa prédisposition à la dégradation enzymatique.
Les gènes dérivés des sources allergéniques connues devraient être considérés comme étant aptes à encoder un allergène à moins qu'une preuve scientifique ne démontre le contraire.
La détermination des caractéristiques physico-chimiques et d'homologie du gène de la séquence d'acide aminé exigera l'isolement de la nouvelle protéine d'expression de l'organisme à ADN recombinant, ou la production de la substance d'une source alternative, dans lequel cas le matériel devrait apparaître comme étant fonctionnellement et biochimiquement équivalent à celui produit dans l'organisme à ADN recombinant.
Les protéines alimentaires qui ne sont pas allergènes et qui sont altérées par des techniques de mutagénèse doivent être évaluées seulement pour évaluer la probabilité que leur protéine mutagénisée soit un allergène de novo.
L'exposition absolue à la nouvelle protéine d'expression et aux effets du traitement alimentaire approprié contribuera à tirer des conclusions générales au sujet des risques potentiels pour la santé humaine. À cet égard, la nature du produit alimentaire prévu pour la consommation devrait être examinée lors de la détermination des types de traitements qui seraient appliqués et de ses effets sur la présence de la protéine dans le produit alimentaire final.
Section 3 - évaluation initiale
Section 3.1 - Source de la protéine
En tant que partie intégrante des données visant à supporter l'innocuité des aliments dérivés d'organismes à ADN recombinant, l'information devrait décrire tous les rapports d'allergénicité associés aux organismes donneurs. Les sources allergéniques de gènes seraient définies comme étant celles des organismes pour lesquelles des preuves raisonnables d'allergie par IgE se servant de la voie orale, respiratoire ou de contact sont disponibles. Des outils spécifiques ou des données pertinentes qui permettent la confirmation de l'allergénicité sont disponibles pour les protéines provenant de certaines sources allergéniques. Ceci inclut ce qui suit : la disponibilité de sérums à des fins de criblage; des types, de la gravité et de la fréquence documentés des réactions allergéniques; ainsi que des caractéristiques structurales et des séquences d'acide aminé (lorsqu'ils sont disponibles) de protéines allergéniques connues de cette source.
Section 3.2 - Homologie de la séquence d'acide aminé
Les comparaisons d'homologie de séquence d'acide aminé devraient être utilisées pour évaluer jusqu'à quel point la structure d'une protéine d'expression est similaire aux allergènes connus afin de déterminer si une protéine a un pouvoir allergisant ou d'inter- réactivité. Les similitudes structurales globales peuvent être prédites en utilisant les recherches sur l'homologie des séquences qui comparent la structure des nouvelles protéines d'expression avec tous les allergènes connus et devraient être menées en utilisant divers algorithmes tels que FASTA or BLASTP. Des stratégies telles que des recherches par étapes logiques de segments d'acide aminé identiques contiguës peuvent également être adoptées afin de déterminer les séquences qui peuvent représenter des épitopes linéaires. L'ampleur de la recherche sur l'acide aminé contiguë devrait reposer sur une logique scientifique justifiée afin de minimiser la possibilité d'obtenir de faux résultatsvent représenter des épitopes linéaires. L'ampleur de la recherche sur l'acide aminé contiguë devrait reposer sur une logique scientifique justifiée afin de minimiser la possibilité d'obtenir de faux résultats négatifs ou positifsNote de bas de page 15. Des recherches validées et des processus d'évaluation devraient être utilisés afin de produire des résultats biologiques significatifs.
L'inter-réactivité IgE entre la nouvelle protéine d'expression et un allergène connu devrait être considérée comme une possibilité lorsqu'il y a plus de 35 % d'identité dans un segment de 80 ou plus d'acide aminé (FAO/OMS 2001).
Les recherches en homologie des séquences ont certaines limites. En particulier, les comparaisons sont limitées aux séquences d'allergènes connus dans les bases de données publiques disponibles et dans la littérature scientifique. Il existe également des limites quant à l'habilité de telles comparaisons à détecter des épitopes de fixation d'IgE non contiguës.
Un résultat d'homologie de séquence négative indique que la nouvelle protéine d'expression n'est pas un allergène connu et a peu de chance d'interagir avec des allergènes connus. Un résultat indiquant l'absence d'homologie d'une séquence importante devrait être considéré avec les autres données exposées en vertu de cette stratégie en évaluant l'allergénicité des nouvelles protéines d'expression. Ceci n'écarte pas que d'autres études ont été considérées nécessaires (voir également la section 6). Un résultat d'homologie de séquence positive indique qu'il existe une grande probabilité que la nouvelle protéine d'expression soit allergénique. S'il n'y a pas besoin d'examiner le produit plus avant, il devrait être évalué en utilisant le sérum de personnes sensibles à la source allergénique identifiée (voir section sur le criblage d'un sérum spécifique).
Section 3.3 - Résistance aux pepsines
La résistance à la digestion des pepsines a été observée dans plusieurs allergies alimentaires; ainsi, il existe une corrélation entre la résistance à la digestion des pepsines et l'allergénicitéNote de bas de page 16. La résistance d'une protéine à la dégradation en la présence de pepsine dans des conditions appropriées indique qu'une analyse subséquente devrait être menée pour déterminer la probabilité que la nouvelle protéine d'expression soit allergénique. L'établissement d'un protocole consistant et bien validé de dégradation des pepsines pourrait améliorer l'utilité de cette méthode.
Même si le protocole de résistance à la pepsine est fortement recommandé, il est reconnu qu'il existe d'autres protocoles de vive sensibilité aux enzymes. Des protocoles alternatifs peuvent être utilisés lorsqu'une justification adéquate est fournie.
Section 4 - Criblage des sérums spécifiques
Dans le cas des protéines qui proviennent d'une source connue pour être allergénique ou d'avoir une homologie de séquence avec un allergène connu, il est requis de faire des essais immunologiques. Les sérums des personnes atteintes d'une allergie à une source de la protéine validée cliniquement peuvent être utilisés pour vérifier le pouvoir liant de l'IgE de la protéine dans des essais in vitro. Un enjeu critique des essais concernera la disponibilité de sérum humain d'un nombre suffisant de personnesNote de bas de page 17. De plus, la qualité des sérums et de la procédure des essais doit être normalisée pour obtenir un résultat d'essai valide.
Dans le cas d'une nouvelle protéine d'expression dérivée d'une source allergénique connue, un résultat négatif lors d'immuno-essais in vitro peut ne pas être considéré comme suffisant, mais devrait inciter à tenir des essais additionnels, tels que l'utilisation possible du test cutané et des protocoles ex vivo.
L'identification d'une nouvelle protéine d'expression en tant qu'allergène par le biais d'essais immunologiques suggère que le développement futur du produit pour la commercialisation doit être découragé, à moins que des mesures adéquates de gestion des risques et de la communication des risques puissent être assurées par le marketing et la distribution du produit, puisque la protection de la ségrégation et la préservation de l'identité de la nouvelle source de cet allergène peuvent être difficiles, voire impossibles à mettre en application.
Section 5 - Secteurs nécessitant davantage de développement
La fin de l'évaluation des données discutée ci-dessus mène à une conclusion, à savoir la probabilité que la protéine soit un allergène alimentaire. Les techniques de criblage du sérum ciblé (p. ex., l'évaluation de la liaison aux IgE dans le cas de sérum de personnes ayant des réactions allergiques validées cliniquement à une grande catégorie d'aliments reliés) et l'utilisation de modèles d'animaux, une fois développées et validées, pourraient améliorer le poids de la preuve utilisée pour tirer cette conclusion. Pour permettre le criblage du sérum, il faudrait prendre des mesures pour mettre sur pied une banque internationale de sérums. Alors que la connaissance et la technologie scientifiques évoluent, d'autres méthodes, telles que l'examen des nouvelles protéines d'expression pour les cellules T des épitopes et les motifs structuraux associés aux allergènes endogènes, pourraient également être utiles.
Effets non intentionnels sur les allergènes endogènes
Les techniques de modification génétique ont le potentiel de produire des effets non intentionnels sur le génome qui pourraient mener à une augmentation de l'expression des allergènes endogènes. Bien qu'on ne connaisse pas avec certitude les effets qu'aurait cet accroissement sur la santé, il faudrait les considérer comme indésirables. Les techniques servant à évaluer la possibilité d'effets sur l'expression allergène endogène sont les suivantes : une comparaison quantitative de la composition protéinique de la partie comestible de l'organisme modifié ou, lorsque l'on dispose d'échantillons de sérum sanguin d'un nombre suffisant de personnes allergiques à l'aliment en question, la réactivité immunologique comparative de la partie comestible de l'organisme modifié à l'aide de techniques de buvardage.
4.2.3.8 Examens chimiques
Une caractérisation chimique complète des microconstituants pouvant être toxiques, contenus dans l'aliment nouveau, doit être présentée. L'identification et les niveaux de contaminants chimiques introduits par inadvertance doivent également être signalés. La contamination éventuelle par des résidus de contaminants inorganiques, organiques ou naturels pourrait se produire, par exemple, dans le cas de produits chimiques utilisés dans la fermentation, ou produits par celle-ci ou dans l'extraction ou la purification servant à produire l'aliment voulu, dérivé des micro-organismes. À cet égard, il serait nécessaire de comparer le niveau de concentration des contaminants de l'aliment nouveau à ceux observés généralement dans le produit alimentaire non modifié.
Tout additif alimentaire présent dans le produit alimentaire final (p. ex., les antiagglomérants, les solvants de support, les diluants solides, les colorants, les agents de conservation) ou les adjuvants de fabrication utilisés pendant la fabrication de l'aliment (p. ex., les adjuvants de précipitation et de filtration, etc.) doivent être définis et leur niveau spécifié.
Dans le cas des aliments nouveaux dont l'utilisation est prévue en tant qu'ingrédient dans d'autres aliments, les spécifications quant à l'identité et à la pureté doivent être fournies, et accompagnées d'un exemple d'étiquette et du mode d'emploi.
Annexe 1 : Orientations règlementaires de Santé Canada sur l'interprétation de la nouveauté envers les produits de sélections végétales
1. Introduction
Les Règlements sur les aliments nouveaux du Canada (Titre 28, partie B du Règlement sur les aliments et drogues ou RAD) a été publié en 1999. Ce règlement exige que le fabricant dépose un préavis avant la mise en marché et que l'organisme de règlementation détermine si les renseignements contenus dans ce préavis établissent que l'aliment est salubre avant sa mise en marché. La portée de ces exigences est préétablie par la définition « aliment nouveau » énoncée dans ledit règlement. Lorsqu'un aliment est « nouveau », le règlement exige un avis préalable à la mise en marché et une approbation règlementaire avant sa mise en marché.
Pour faciliter l'interprétation des Règlements sur les aliments nouveaux, Santé Canada a publié les Lignes directrices sur l'évaluation de l'innocuité des aliments nouveaux. Ces lignes directrices décrivent les renseignements qui doivent être inclus dans un avis préalable à la mise en marché et la façon dont les organismes de règlementation évaluent l'innocuité des nouveaux aliments avant leur mise en marché. Ce document d'orientation a été mis à jour en 2006.
Depuis lors, les progrès technologiques ont permis de créer de nouveaux outils de modification génétique qui permettent de développer de nouvelles variétés de plantes (p. ex., technologies d'éditions géniques). Conséquemment, les développeurs de plantesNote de bas de page 18 ont exprimé la nécessité que les Règlements sur les aliments nouveaux soit plus clair, plus prévisible et plus transparent en ce qui a trait aux produits de sélections végétales, y compris ceux mis au point à l'aide de ces nouveaux outils de modifications.
Ces nouvelles orientations règlementaires tiennent compte des objectifs de santé et de sécurité énoncés dans la règlementation et mettent à profit l'expérience de l'organisme de règlementation puisque ce domaine scientifique a évolué depuis la publication du règlement. Ces nouvelles orientations interprètent les Règlements sur les aliments nouveaux d'une manière qui tient compte des connaissances scientifiques actuelles et du régime et de l'objectif sous-jacents de ces règles (c.-à-d., exiger une évaluation préalable à la mise en marché des aliments nouveaux qui peuvent poser un risque potentiel pour le consommateur) d'une manière qui reflète une meilleure compréhension des technologies de sélection végétale et les avantages de s'aligner sur nos partenaires internationaux en matière de règlementation.
2. Contexte
2.1 Élaboration des Règlements sur les aliments nouveaux
Une nouvelle règlementation a été élaborée en 1999 afin de dissiper l'incertitude relative à la salubrité des végétaux développés au moyen de la biotechnologie d'édition génique (c.-à-d., les technologies de l'ADN recombinant [ADNr]). Cependant, contrairement à la plupart des juridictions qui ont élaboré des lois fondées sur un processus spécifique de modification génétique, les Règlements sur les aliments nouveaux du Canada a été rédigé d'une manière qui pourrait être interprétée comme pouvant généralement définir plusieurs aliments dérivés de plantes génétiquement modifiées, y compris certains produits issus de la sélection conventionnelle, comme étant « nouveaux » afin d'exiger un avis et une évaluation préalable de leur l'innocuité avant leur mise en marché. À ce jour, ces règles ont été interprétées d'une manière qui ne tient pas compte de la question de savoir si les méthodes de sélections utilisées pour mettre au point le végétal sont bien caractérisées comme étant sécuritaires afin de déterminer si ces exigences d'évaluation préalable à la mise en marché s'appliquent à un aliment.
2.2 Pratiques de sélection végétale qui appuient la salubrité des aliments
Les développeurs de plantes analysent et étudient rigoureusement leurs nouvelles variétés végétales en ce qui a trait à la salubrité des aliments pendant le processus de sélection avant la commercialisation et tout au long de la durée de vie commerciale des variétés végétales incluant celle mise au point au moyen de la biotechnologie. La caractérisation approfondie du produit limite le risque que les plantes puissent avoir des effets indésirables sur la salubrité des aliments liés à une caractéristique intentionnellement mise au point. Ces caractérisations donnent également l'assurance que tous les effets des nouvelles caractéristiques en lien avec la salubrité des aliments sont bien compris. Ces principes de caractérisation ont toujours fait partie des pratiques de sélection végétale, quelles que soient les méthodes utilisées pour développer une nouvelle variété végétale. Au fil du temps, les avancées technologiques ont donné aux développeurs de nouveaux outils analytiques pour caractériser plus précisément leurs produits. Cette orientation règlementaire ne modifie pas la responsabilité des développeurs d'analyser ou de caractériser leur produit, ni leur responsabilité de garantir que leurs produits soient sécuritaires pour une utilisation alimentaire.
Les considérations suivantes représentent la compréhension de Santé Canada des pratiques et des compétences bien établies et universellement appliquées des développeurs de plantes en ce qui a trait à la caractérisation complète d'un nouveau produit de sélection végétale, quelles que soient les méthodes utilisées pour son élaboration et sa sélection.
- Les développeurs de plantes sont des experts de leur variété végétale et de l'espèce végétale en ce qui concerne son utilisation dans les aliments et la salubrité des aliments connexes. Cela signifie que :
- Les développeurs de plantes connaissent la gamme typique d'analytes importants qui composent les nutriments, les antinutriments, les allergènes et les toxines de la variété végétale qu'ils développent ou qu'ils ont développée;
- Les développeurs de plantes connaissent les caractéristiques prévues de leur nouvelle variété végétale et la façon dont elle peut influencer l'exposition des Canadiens aux nutriments, aux antinutriments, aux allergènes et aux toxines des aliments dérivés du végétal;
- Les développeurs de plantes sont conscients des utilisations finales prévues de leurs produits et de la façon dont ces utilisations finales influencent l'exposition des Canadiens aux nutriments, aux antinutriments, aux allergènes et aux toxines des aliments dérivés du végétal.
- Il est bien établi que les développeurs de plantes sont à jour sur leurs connaissances de la façon dont les caractéristiques prévues peuvent influer sur l'expression d'autres caractéristiques et en quoi cela peut avoir une incidence sur la salubrité des aliments. Par exemple, comment les changements dans une voie métabolique pourraient influer sur la biodisponibilité des nutriments ou mener à l'accumulation d'autres métabolites qui peuvent avoir des propriétés allergéniques, toxiques ou anti-nutritionnelles.
- Il est bien établi que les développeurs de plantes étudient s'il existe des risques possibles pour la salubrité des aliments liés aux nouvelles caractéristiques qu'ils ont introduits ou qu'ils prévoient introduire dans la plante. En ce sens, les développeurs de plantes envisagent des hypothèses de risque impliquant la modification des niveaux de nutriments, d'antinutriments, d'allergènes et de toxines.
- Il est bien établi que tout au long du processus de développement d'une plante, les végétaux ayant des caractéristiques qui peuvent avoir une incidence négative sur la salubrité des aliments sont consignés et éliminés.
- Il est bien établi qu'après la commercialisation, les développeurs de plantes observent attentivement les caractéristiques de leurs variétés végétales qui peuvent avoir une incidence négative sur la salubrité des aliments pour en établir le lien avec la variété végétale avec laquelle ils travaillent. Tous les végétaux qui présentent des caractéristiques pouvant avoir une incidence négative sur la salubrité des aliments sont consignés et éliminés.
Une combinaison de connaissances provenant des développeurs de plantes, de raisonnement scientifique et de données générées pendant le développement de la variété végétale, ainsi que la surveillance des variétés après commercialisation (ce qui est constamment d'une grande qualité et d'une rigueur suffisante) étayent que ces produits sont salubres et ne correspondent pas en tant que tels à l'interprétation d'un « aliment nouveau » au sens de l'article B.28.001(c) du RAD. Santé Canada reconnait que les composantes d'une plante soumise à l'analyse sont très spécifiques et ciblées. Par conséquent, la détermination des analyses à effectuer est fondée sur de multiples considérations propres à la plante. Les pratiques bien établies des développeurs de plantes assurent constamment l'innocuité de ces produits.
3. Aliments dérivés de produits de sélection végétale qui ne sont pas des aliments nouveaux
En tenant compte de ces conclusions, Santé Canada est d'avis que les cinq catégories d'aliments suivantes ne constitueraient aucun ajout à notre corpus de connaissances sur leur innocuité si elles étaient évaluées individuellement comme des aliments nouveaux conformément aux articles B.28.002-B.28.003 du RAD parce que leur innocuité est déjà bien caractérisée de façon constante :
- Aliments dérivés de végétaux possédant des modifications génétiques qui n'altèrent pas une protéine endogène de sorte qu'elle introduise ou augmente la similarité avec un allergène ou une toxine connu et pertinent pour la santé humaine;
- Aliments dérivés de végétaux avec des modifications génétiques qui n'augmentent pas les niveaux d'un allergène endogène connu, d'une toxine endogène connue ou d'un antinutriment endogène connu au-delà des intervalles documentés observés pour ces analytes retrouvés dans ces espèces végétales;
- Aliments dérivés de végétaux avec des modifications génétiques qui n'ont pas d'effet sur la composition nutritionnelle et/ou le métabolisme clé;
- Aliments dérivés de végétaux possédant des modifications génétiques qui ne modifient pas intentionnellement l'utilisation alimentaire du végétal; et
- Aliments dérivés de végétaux avec des modifications génétiques qui ne sont pas le résultat de la présence d'ADN étranger Note de bas de page 19 dans le produit végétal finalNote de bas de page 20.
Le Ministère interprète les Règlements sur les aliments nouveaux afin de classer les aliments dérivés de plantes répondant à l'ensemble de ce cinq (5) catégories comme ceux dont les caractéristiques n'atteignent pas le seuil de nouveauté requis pour qu'ils répondent à la définition « aliment nouveau » énoncée à l'article B.28.001(c) du RAD. La définition interprétée de façon restrictive tient compte des objectifs de précaution en matière d'innocuité qui sous-tendent ces règlements d'évaluation préalable de l'innocuité avant la mise en marché.
4. Répercussions sur la salubrité des aliments et la nutrition
Bien que la plupart des caractéristiques introduites ou modifiées dans les végétaux soient réputées ne pas avoir d'effet sur la salubrité des aliments, certaines caractéristiques pourraient poser un problème de salubrité et ces aliments seraient considérés comme des « aliments nouveaux ». Ils nécessiteraient donc une évaluation préalable à leur mise en marché.
Les caractéristiques qui sont considérées par Santé Canada comme présentant des préoccupations potentielles en matière de salubrité ou de nutrition et qui justifient qu'un aliment dérivé d'un végétal soit classé comme nouveau sont présentées ci-dessous:
4.1 Effets sur les allergènes, les toxines et les antinutriments
L'expression d'une protéine endogène altérée qui démontre maintenant une similarité significativeNote de bas de page 21 avec un allergène ou une toxine connu et pertinent pour la santé humaine; l'expression accrue d'un allergène ou d'une toxine endogène ou l'expression accrue d'un antinutriment endogène sont toutes considérées comme des éléments déclencheurs pour qu'un aliment soit considéré comme un « aliment nouveau ». Qui est assujetti à un avis et à une évaluation préalable de son innocuité avant sa mise en marché.
4.2 Répercussions sur la composition des nutriments clés et sur le métabolisme
Aux fins de la présente orientation règlementaire, Santé Canada se concentrera sur les nutriments indiqués par les valeurs de l'Apports nutritionnels de référence (ANREF) en tant qu'éléments nutritifs associés à un apport adéquat et/ou ayant des effets nocifs établis sur la santé (appelés nutriments clésNote de bas de page 22). Des modifications dans l'un de ces nutriments clés peuvent être dues à la manipulation directe de ce nutriment ou de son métabolisme, ou indirectement par manipulation d'autres nutriments ou voies métaboliques. Lorsqu'une caractéristique est connue pour influencer une voie métabolique liée à la composition nutritionnelle, les éléments nutritifs essentiels de cette plante doivent être mesurés et comparés à leurs intervalles documentésNote de bas de page 23.
Compte tenu de la variabilité de la composition nutritionnelle attribuable à divers facteurs, Santé Canada est d'avis que l'utilisation des intervalles documentés demeure une approche utile pour cibler les produits qui nécessitent une évaluation préalable avant leur mise en marché. Par conséquent, Santé Canada se concentrera sur les nutriments clés identifiés comme étant potentiellement préoccupants en raison de l'existence d'une prévalence d'inadéquation élevée (p. ex., plus de 10 % de la population a des apports habituels qui sont inférieurs au besoin moyen estimatif [BME]) ou d'une prévalence élevée des apports qui dépassent l'apport maximal tolérable (AMT) dans la population canadienne.
Lorsqu'un nutriment clé est présent dans un végétal à un niveau en dehors de l'intervalle documenté, l'impact potentiel sur l'apport alimentaire des Canadien(ne)s à l'égard de ce nutriment clé devrait être considéré. Si la consommation de cette plante est susceptible d'entrainer une augmentation ou une diminution globale de l'apport alimentaire de ce nutriment clé par les Canadien(ne)s, le produit doit faire l'objet d'une notification et une évaluation préalable à la mise en marché en tant qu'aliment nouveau.
De plus, les développeurs doivent tenir compte de la biodisponibilité des nutriments ou de la façon dont l'aliment est métabolisé dans l'organisme. Si une caractéristique d'une plante fait en sorte qu'un nutriment clé devient plus ou moins disponible lors de la consommation de l'aliment dérivé de la plante et est susceptible d'entrainer un apport alimentaire global plus ou moins élevé de ce nutriment clé chez les Canadien(ne)s, le produit doit faire l'objet d'une notification et une évaluation préalable à la mise en marché en tant qu'aliment nouveau.
4.3 Changements intentionnels dans l'utilisation alimentaire du végétal
Dans certains cas, les nouvelles variétés végétales peuvent présenter des caractéristiques modifiées ou nouvelles qui modifient l'utilisation proposée des aliments qui en sont dérivés. Le développeur de plantes pourrait introduire ou altérer une caractéristique qui fera en sorte que les consommateurs mangeront désormais une partie de la plante qui n'était pas précédemment consumée comme aliment, ou qu'une plante n'ayant pas d'utilisation comme aliment ne soit modifiée de sorte qu'elle soit désormais consommée comme aliment. Similairement, une ou plusieurs composantes des tissues parties comestibles peuvent être altérées de sorte que les consommateurs soient destinés à consumer une quantité plus ou moins grande de l'aliment d'origine végétaleNote de bas de page 24. Les variétés végétales qui ont des caractéristiques modifiées ou nouvelles qui entrainent tout changement mentionné ci-dessus dans l'utilisation alimentaire continuent d'être considérées comme des « aliments nouveaux » qui nécessitent un avis et une évaluation préalable à leur mise en marché.
4.4 Produits alimentaires dérivés de plantes contenant de l'ADN étranger dans le végétal final
Les aliments dérivés de plantes qui ont été génétiquement modifiées et qui contiennent de l'ADN étranger dans le produit végétal final doivent faire l'objet d'un avis et d'une évaluation préalable à leur mise en marché comme des aliments nouveaux.
Ce qui est particulièrement important pour les plantes dérivées de l'édition génique, le mécanisme d'édition génique d'encodage de l'ADN (p. ex., les protéines CRISPR Cas et les ARN guides connexes) est considéré comme de l'ADN étranger s'il est présent dans le produit final. La plupart des développeurs de plantes retireront cet ADN lors de la sélection végétale subséquente. Cependant, dans le cas où une plante issue de l'édition génique contient toujours le mécanisme d'encodage de l'ADN dans son génome, les aliments dérivés d'une telle plante nécessiteront un avis et une évaluation préalable à leur mise en marché comme des aliments nouveaux.
5. Liste des méthodes classiques de sélection végétale
Techniques pour surmonter les obstacles à la reproduction
- Rapprochement des croisements
- Pollinisation par l'utilisation de l'âge sous-optimal ou supra-optimal de la stigmatisation, ou des conditions sous-optimales
- Pollinisation facilitée par les produits chimiques
- Pollinisation à l'aide de traitements par mélange de pollen
- Pollinisation par le traitement ou la manipulation du style
- Pollinisation in vitro
- Culture in vitro d'ovaires excisés
- Culture in vitro d'ovules excisés
- Culture in vitro d'embryons excisés (sauvetage d'embryons)
- Fécondation in vitro
Techniques de manipulation des chromosomes et du génome
- Haplométhode
- Doublement du génome, polyploïdisation
- Production de lignées d'addition ou de substitution
- Translocation chromosomique
- Manipulation de l'appariement chromosomique dans la méiose
- Mutagenèse (par mutagène chimique ou rayonnement ionisant)
- Fusion cellulaire (c.-à-d., hybridation somatique)
- Transfert partiel du génome
Autres techniques de sélection végétale
- Greffes interspécifiques
- Production de variétés hybrides
- Culture de tissus in vitro
- Expression de genre chez les espèces monospécifiques ou dioïques
- Apomixie
- Sélection à l'aide de marqueurs moléculaires
- Ciblage de lésions locales dans les génomes
- Tri cellulaire
* On trouvera des descriptions détaillées et des exemples des techniques énumérées dans l'œuvre de van de Wiel et coll., 2010. Traditional plant breeding methods. Wageningen UR Plant Breeding, Wageningen. Report 338.
** Ce tableau représente une liste de méthodes qui ont été, au minimum, étudiées comme outils potentiels pour la sélection végétale. La majorité de ces méthodes ont été adoptées par les développeurs de végétaux et sont utilisées dans les programmes de sélection actuels.
Annexe 2 : Orientations règlementaires de Santé Canada sur l'évaluation préalable à la mise en marché des aliments dérivés de retransformants
1. Introduction
Depuis l'adoption des Règlements sur les aliments nouveaux en 1999, Santé Canada a évalué l'innocuité des aliments dérivés de plus de 140 variétés de plantes génétiquement modifiéesNote de bas de page 25 (GM). Dans tous les cas, Santé Canada a constaté que les aliments dérivés de ces variétés de plantes génétiquement modifiées étaient sans danger pour fins alimentaires. Par conséquent, Santé Canada a évalué certaines caractéristiques à plusieurs reprises et a déterminé que celles-ci ne constituaient pas un problème d'innocuité des aliments. Cette vaste expérience a permis aux organismes de règlementation de se familiariser avec ces caractéristiques.
De plus, les organismes de règlementation canadiens ont examiné la littérature scientifique sur les types de changements génétiques pouvant se produire après l'insertion de l'ADN dans le génome d'une plante (collectivement appelés les effets d'insertion) (Schnell et coll., 2015). Cet examen a permis de conclure que les changements génétiques involontaires qui peuvent résulter de l'insertion de l'ADN dans le génome d'une plante ne sont pas différents de ceux qui peuvent se produire chez les plantes sélectionnées de manière conventionnelle ou comme le résultat d'interactions plantes-environnement. Ces effets imprévus sont pris en compte dans les pratiques utilisées par les développeurs de plantesNote de bas de page 26. Les développeurs produisent des milliers de plantes contenant le même ADN inséré et, par analyse, choisissent la plante idéale (c.-à-d., aucun effet inattendu observé).
En outre, les développeurs sélectionnent souvent plusieurs générations de la plante idéale pour s'assurer que, à l'exception de l'ADN inséré, le génome de la plante soit aussi similaire que possible à son équivalent non modifié. Par conséquent, le potentiel d'effets indésirables d'intérêt est lié à ce qui est codé et exprimé à partir de l'ADN inséré. Dans les cas où une nouvelle variété de plantes qui a été développée par l'insertion d'une séquence d'ADN identique à une autre plante génétiquement modifiée préalablement évaluée, les effets indésirables potentiels qui pourraient se produire sont soit contrôlés par des pratiques de sélection ou ont été pris en compte dans le cadre de l'évaluation de la plante génétiquement modifiée précédente.
Dans ce contexte, Santé Canada a mis au point une approche à plusieurs niveaux pour les exigences en matière d'information pour les évaluations préalables à la mise en marché pour les aliments nouveaux dérivés de plantes GM qui ont été transformés avec une séquence d'ADN identique à ceux des plantes GM déjà évaluées. Ces aliments sont référés comme étant retransformants. Même si les changements génétiques spécifiques au sein du génome du retransformant ne nécessite pas d'être identique aux changements génétiques effectués dans la plante précédemment génétiquement modifiée, ces changements génétiques doivent aboutir au même mécanisme(s) d'actionNote de bas de page 27 et à la même caractéristique pour qu'ils soient considérés comme étant retransformants. Les exigences en matière d'information sont échelonnées de manière à prendre en considération les connaissances préalables en fonction du niveau de risque associé à ces produits alimentaires d'origine végétale tout en maintenant la sécurité des Canadiens et Canadiennes. De plus, l'évaluation de leur innocuité préalable à la mise en marché des retransformants sera effectuée selon une norme de service accéléré. Les sections suivantes décrivent les exigences en matière d'information et la norme de service pour l'évaluation d'innocuité préalable à la mise en marché des retransformants.
Santé Canada continuera d'effectuer des évaluations d'innocuité préalable à la mise en marché en appliquant une norme de service standard (c.-à-d., 410 jours calendaires) pour les produits qui sont nouveaux et qui sont différents de tout aliment nouveau préalablement évalué.
2. Évaluation d'innocuité préalable à la mise en marché avec une norme de service accélérée pour les aliments nouveaux dérivés de retransformants
Les produits qui font l'objet d'un processus d'évaluation d'innocuité préalable à la mise en marché avec une norme de service accélérée seront publiés sur la Liste des évaluations d'innocuité achevées pour les nouveaux aliments. De plus, les produits alimentaires en question qui ont été déclarés à Santé Canada ne seront autorisés à la vente que lorsqu'une confirmation écrite sera fournie par Santé Canada.
2.1 Exigences en matière d'information pour les aliments nouveaux dérivés de retransformants
Les exigences en matière de données pour l'évaluation d'innocuité préalable à la mise en marché d'un retransformant vont comme suit :
- Une description sommaire du produit qui démontre que ce dernier rencontre la définition d'un retransformant. Cela inclurait une description de la caractéristique(s) et du mode(s) d'action du produit par lequel il est atteint.
- Une caractérisation moléculaire complète du retransformant comme décrit dans les Lignes directrices sur l'évaluation de l'innocuité des aliments nouveaux. Ces données peuvent inclurent mais ne sont pas limitées à :
- Une carte de l'insert prévu qui est comparée avec l'insert prévu utilisée pour développer la plante génétiquement modifiée précédemment évaluée
- Données de séquençage démontrant la caractérisation complète de l'insert
- Un raisonnement scientifique ou des données abordant le comment la caractéristique(s) entre le retransformant et la plante génétiquement modifiée précédemment évaluée est identique
- Un raisonnement scientifique ou des données abordant le comment le mode(s) d'action entre le retransformant et la plante génétiquement modifiée précédemment évaluée est identique
Le but de ces données est de démontrer que le retransformant possède des changements génétiques qui aboutissent au même caractéristique(s) obtenue au travers du même mécanisme(s) d'action que la plante génétiquement modifiée évaluée précédemment;
- Un raisonnement scientifique supportant que la composition nutritionnelle du retransformant est équivalent à une plante génétiquement modifiée évaluée précédemment.
- Un raisonnement scientifique supportant que les données concernant l'innocuité toxicologique et allergénique de la plante génétiquement modifiée précédemment évaluée sont applicables au retransformant.
- Si la caractéristique(s) du retransformant implique un changement intentionnel dans l'absorption de substances chimiques par la plante, une analyse chimique du produit est requise.
- Lorsque applicable, adressez toutes différences concernant l'exposition alimentation estimée entre le retransformant et la plante génétiquement modifiée évaluée précédemment ainsi que leurs pertinences envers la santé humaine.
2.2 Norme de service pour les évaluations préalables à la mise en marché d'aliments nouveaux dérivés de retransformants
L'évaluation d'innocuité préalable à la mise en marché d'aliments nouveaux dérivés de retransformants sera effectuée dans les 120 jours calendrier suivant la réception de la soumission complète par Santé Canada.
Si Santé Canada a besoin de précisions ou de renseignements supplémentaires durant l'évaluation d'innocuité préalable à la mise en marché avec une norme de service accélérée, la demande en sera faite au requérant. Un délai supplémentaire de 45 jours calendrier sera ajouté à la norme de service pour permettre au requérant de répondre à la demande. Si les renseignements fournis par le requérant sont insuffisants pour mener à bien l'évaluation ou que le délai de réponse dépasse 45 jours, la soumission sera fermée sans préjudice à pouvoir présenter une nouvelle soumission.
2.3 Résultats
Comme pour tous les aliments nouveaux qui font l'objet d'une évaluation de leur innocuité préalable à la mise en marché, le résultat positif de l'évaluation d'innocuité préalable à la mise en marché d'un retransformant par une norme de service accélérée comprendra l'émission d'une lettre de non-objection au requérant. De plus, des documents techniques et sommaires décrivant la plante évaluée seront publiés dans le cadre de la liste d'Évaluations d'innocuité achevées pour les aliments nouveaux, y compris les aliments génétiquement modifiés (GM) par Santé Canada.
Si Santé Canada détermine qu'un produit ne rencontre pas la définition d'un retransformant, cette conclusion sera communiquée au requérant aussi tôt que possible au cours du processus, et la demande sera fermée. Une nouvelle demande pour l'évaluation préalable à la mise en marché du produit avec une norme de service standard (c.-à-d., 410 jours calendaires) pourra être soumise sans préjudice.
3. Référence
SCHNELL, J., STEELE, M., BEAN, J., NEUSPIEL, M., GIRARD, C., DORMANN, N., PEARSON, C., SAVOIE, A., BOURBONNIÈRE, L., and MACDONALD, P., 2015. A comparative analysis of insertional effects in genetically engineered plants: considerations for pre-market assessments. Transgenic research, 24(1), pp. 1-17.
Notes de bas de page
- Note de bas de page 1
-
Avant d'amorcer ce processus, les fabricants ou les importateurs peuvent demander une consultation préalable à l'obtention de l'avis, afin de les aider à préparer un document complet.
- Note de bas de page 2
-
ACIA = Agence canadienne d'inspection des aliments. L'Unité d'évaluation environnementale fait partie de la Direction générale de la santé environnementale et de la sécurité des consommateurs de Santé Canada.
- Note de bas de page 3
-
Commission FAO/OMS du Codex Alimentarius, Programme mixte FAO/OMS sur les normes alimentaires; Groupe de travail intergouvernemental spécial du Codex sur les aliments dérivés de la biotechnologie, 3e session : Yokohama (Japon) 4-8 mars 2002: Examen du projet de directives régissant la conduite de l'évaluation de l'innocuité des aliments dérivés de plantes à ADN recombiné, étape 4; page 13.
- Note de bas de page 4
-
Codex Alimentarius. Directive régissant la conduite de l'évaluation de la sécurité sanitaire des aliments dérivés de plantes à ADN recombinant. Accessible à l'adresse (Aliments dérivés des biotechnologies).
- Note de bas de page 5
- Note de bas de page 6
-
Commission FAO/OMS du Codex Alimentarius, Programme mixte FAO/OMS sur les normes alimentaires; Groupe de travail intergouvernemental spécial du Codex sur les aliments dérivés de la biotechnologie, 3e session : Yokohama (Japon) 4-8 mars 2002: Examen du projet de directives régissant la conduite de l'évaluation de l'innocuité des aliments dérivés de plantes à ADN recombinant, étape 4 page 13.
- Note de bas de page 7
-
Cette stratégie d'évaluation ne peut pas s'appliquer pour évaluer si de nouvelles protéines d'expression peuvent induire des éléments sensibles au gluten ou d'autres entéropathies. De plus, la stratégie ne peut pas s'appliquer à l'évaluation d'aliments où les gènes sont calculés à la baisse à des fins hypoallergéniques.
- Note de bas de page 8
-
Il est reconnu que la consultation FAO/OMS 2001 a suggéré de faire passer les recherches de segments d'acide aminé de 8 à 6. Plus la séquence de peptides utilisée dans la comparaison par étapes logiques est petite, plus la probabilité d'identifier de faux positifs est élevée et inversement, plus la séquence de peptides utilisée est grande, plus grande est la probabilité d'identifier de faux négatifs, réduisant ainsi l'utilité de la comparaison.
- Note de bas de page 9
-
La méthode exposée dans le U.S. Pharmacopoeia (1995) a été utilisée pour établir la corrélation (Astwood et al. 1996).
- Note de bas de page 10
-
Selon le Rapport conjoint du Forum mondial des responsables sur l'allergénicité des aliments dérivés de la biotechnologie de la FAO/OMS (22 au 25 janvier 2001, Rome, Italie) un minimum de 8 sérums pertinents est requis pour avoir une certitude à 99 p. cent que la nouvelle protéine n'est pas allergène dans le cas d'un allergène majeur. De même, un minimum de 24 sérums pertinents est requis pour obtenir le même degré de certitude dans le cas d'un allergène mineur. Il est reconnu que ces quantités de sérum pourraient ne pas être disponibles aux fins des essais.
- Note de bas de page 11
-
Commission FAO/OMS du Codex Alimentarius, Programme mixte FAO/OMS sur les normes alimentaires; Groupe de travail intergouvernemental spécial du Codex sur les aliments dérivés de la biotechnologie, 3e session : Yokohama (Japon) 4-8 mars 2002: Examen du projet de directives régissant la conduite de l'évaluation de l'innocuité des aliments dérivés de plantes à ADN recombinant, étape 4; page 13.
- Note de bas de page 12
-
Codex Alimentarius. Directive régissant la conduite de l'évaluation de la sécurité sanitaire des aliments produits à l'aide de microorganismes à ADN recombinant.
- Note de bas de page 13
-
Commission FAO/OMS du Codex Alimentarius, Programme mixte FAO/OMS sur les normes alimentaires; Groupe de travail intergouvernemental spécial du Codex sur les aliments dérivés de la biotechnologie, 3e session : Yokohama (Japon) 4-8 mars 2002: Examen du projet de directives régissant la conduite de l'évaluation de l'innocuité des aliments dérivés de plantes à ADN recombinant, étape 4 page 13.
- Note de bas de page 14
-
Cette stratégie d'évaluation ne peut pas s'appliquer pour évaluer si de nouvelles protéines d'expression peuvent induire des éléments sensibles au gluten ou d'autres entéropathies. De plus, la stratégie ne peut pas s'appliquer à l'évaluation d'aliments où les gènes sont calculés à la baisse à des fins hypoallergéniques.
- Note de bas de page 15
-
Il est reconnu que la consultation FAO/OMS 2001 a suggéré de faire passer les recherches de segments d'acide aminé de 8 à 6. Plus la séquence de peptides utilisée dans la comparaison par étapes logiques est petite, plus la probabilité d'identifier de faux positifs est élevée et inversement, plus la séquence de peptides utilisée est grande, plus grande est la probabilité d'identifier de faux négatifs, réduisant ainsi l'utilité de la comparaison.
- Note de bas de page 16
-
La méthode exposée dans le U.S. Pharmacopoeia (1995) a été utilisée pour établir la corrélation (Astwood et al.1996).
- Note de bas de page 17
-
Selon le Rapport conjoint du Forum mondial des responsables sur l'allergénicité des aliments dérivés de la biotechnologie de la FAO/OMS (22 au 25 janvier 2001, Rome, Italie) un minimum de 8 sérums pertinents est requis pour avoir une certitude à 99 % que la nouvelle protéine n'est pas allergène dans le cas d'un allergène majeur. De même, un minimum de 24 sérums pertinents est requis pour obtenir le même degré de certitude dans le cas d'un allergène mineur. Il est reconnu que ces quantités de sérum pourraient ne pas être disponibles aux fins des essais.
- Note de bas de page 18
-
Aux fins de la présente orientation règlementaire, le terme « développeur » est utilisé comme un terme qui englobe toutes les parties impliquées dans le développement d'une nouvelle variété végétale de sa conception à sa commercialisation.
- Note de bas de page 19
-
Le terme « ADN étranger », dans le contexte de cette orientation règlementaire, désigne de l'ADN issu originalement de sources génétiques ne provenant pas de l'espèce végétale et ne pouvant pas être introduit au sein de l'espèce végétale au moyen des méthodes conventionnelles de sélection végétale tel que défini dans 5. Liste des méthodes classiques de sélection végétale.
- Note de bas de page 20
-
Le produit végétal final fait référence à la variété végétale destinée à la commercialisation et à l'utilisation alimentaire.
- Note de bas de page 21
-
Une similarité significative est généralement supérieure à 35 % de l'identité globale de la séquence entre les séquences d'acides aminés, ou égale à 100 % de l'identité de la séquence sur 8 résidus d'acides aminés consécutifs avec la séquence d'un allergène connu.
- Note de bas de page 22
-
Les nutriments essentiels sont tous les nutriments figurant dans les Apports nutritionnels de référence (ANREF) qui ont une valeur de référence fondée sur les nutriments associés à un apport suffisant (c.-à-d., un Besoin moyen estimatif [BME], un Apport nutritionnel recommandé [ANR] ou un Apport suffisant [AS]) et/ou à des effets néfastes avérés sur la santé (c.-à-d., Apport maximal tolérable [AMT]). Les quatre valeurs de référence sont directement associées à la santé des consommateurs.
- Note de bas de page 23
-
Aux fins de la présente orientation règlementaire, les intervalles documentés renvoient aux intervalles documentés dans les documents Consensus Documents on Compositional Considerations for New Varieties (en anglais seulement) de l'Organisation de coopération et de développement économiques (OCDE) et les autres bases de données sur la composition des cultures (p. ex., la base de données sur la composition des cultures de l'Agriculture and Food Systems Institute) ainsi que la littérature scientifique et les variétés commercialisées. Les intervalles documentés de la littérature publiée et l'expérience des développeurs sont également des sources d'information acceptables lorsqu'elles renvoient à des variétés commercialisées.
- Note de bas de page 24
-
Par exemple, un développeur réduit intentionnellement l'allergénicité d'une plante avec l'intention que ses tissues comestibles puissent désormais être consommés par des individus sensibles (c.-à-d., consommation supérieure). De manière similaire, un développeur pourrait augmenter intentionnellement la concentration d'un nutriment important de la plante de manière à ce que les consommateurs puissent obtenir la quantité recommandée de ce nutriment tout en consumant moins de calories en tout et partout (c.-à-d. une consommation moindre).
- Note de bas de page 25
-
Comme définie à la section B.28.001 du RAD, ''modifier génétiquement'' veut dire de manipuler intentionnellement les caractères héréditaires d'un végétal, d'un animal ou d'un microorganisme.
- Note de bas de page 26
-
Dans le cadre de cette orientation réglementaire, le terme ''développeur'' est utilisé comme un terme qui englobe toutes les parties impliquées dans le développement d'une nouvelle variété végétale de sa conception à sa commercialisation.
- Note de bas de page 27
-
Dans le cadre de cette orientation, ''mécanisme d'action'' est défini comme étant les interactions biochimiques spécifiques au travers desquelles une caractéristique spécifique s'opère.