InfoVigilance sur les produits de santé: juin 2025
Télécharger en format PDF
(569 Ko, 11 pages)
Direction générale des produits de santé et des aliments
Direction des produits de santé commercialisés
Équipe de rédaction de l'InfoVigilance sur les produits de santé
ISSN: 2368-8033
Cat.: H167-1F-PDF
Pub.: 250001
Contenu
- Récapitulatif mensuel des renseignements sur l'innocuité des produits de santé
- Nouveaux renseignements sur l'innocuité des produits de santé
- Portée
- Pour signaler des effets indésirables
- Liens utiles
- Contactez-nous
Récapitulatif mensuel des renseignements sur l'innocuité des produits de santé
Voici une liste des avis concernant les produits de santé, des rappels de médicaments de type I , ainsi que des résumés de l'examen de l'innocuité ou de la sûreté publiés en mai 2025 par Santé Canada.
Agents de contraste à base de gadolinium
Cet examen de l’innocuité a évalué le risque d’effets indésirables graves, notamment convulsions, encéphalopathie, coma et décès, en cas d’utilisation intrathécale et hors indication des agents de contraste à base de gadolinium (Dotarem [gadotérate de méglumine], Gadovist 1.0 [gadobutrol], Magnevist [gadopentétate de diméglumine], MultiHance [gadobénate de diméglumine], Omniscan [gadodiamide], Primovist [gadoxétate disodique] et ProHance [gadotéridol]) (ACBG). L'examen de Santé Canada a permis d'établir un lien possible. Santé Canada travaille avec les fabricants pour mettre à jour les monographies de produits canadiennes pour tous les ACBG afin d’y inclure le risque d’effets indésirables graves, notamment convulsions, encéphalopathie, coma et décès, avec une utilisation intrathécale hors indication.
Ézétimibe 10 mg de Sivem
La société Sivem Pharmaceuticals ULC a procédé au rappel d'un lot de comprimés d'ézétimibe 10 mg, car certains flacons pourraient également contenir des comprimés de périndopril 4 mg. La prise de périndopril alors que le médicament prescrit est l'ézétimibe peut présenter des risques graves pour la santé.
JAMP-pregabalin 50 mg
JAMP Pharma Corp. a procédé au rappel d’un lot de gélules de JAMP-pregabalin, car certains flacons étiquetés comme contenant des gélules de 50 mg pourraient contenir des gélules de 150 mg. Cela pourrait entraîner l’administration d’une dose beaucoup plus élevée que celle prescrite, ce qui pourrait causer une surdose et présenter des risques graves pour la santé, voire la mort.
Produits de santé non homologués
Santé Canada a avisé les Canadiens que divers produits de santé non autorisés qui pourraient poser un risque grave pour la santé ont été vendus dans des points de vente au détail au Canada ou en ligne.
- Avis: Faux Viagra saisi au dépanneur Queen St. Variety à Toronto
- Avis: Faux Viagra saisi au Pacific Fresh Food Market à Pickering, en Ontario
- Avis: Produits non homologués pour améliorer la performance sexuelle
Seasonique (comprimés de levonorgestrel et d’éthinylestradiol, et comprimés d’éthinylestradiol)
Teva Canada Ltd. a procédé au rappel d’un lot de contraceptifs oraux Seasonique sur ordonnance après avoir reçu une plainte signalant que 2 comprimés manquaient dans un emballage, ce qui pourrait augmenter le risque de grossesse.
- Avis: Seasonique (comprimés de levonorgestrel et d’éthinylestradiol, et comprimés d’éthinylestradiol)
- Rappel type 1: Seasonique (comprimés de levonorgestrel et d’éthinylestradiol, et comprimés d’éthinylestradiol)
Stivarga (régorafénib)
Cet examen de l’innocuité a évalué le risque de microangiopathie thrombotique (MAT) liée à l’utilisation de Stivarga (régorafénib). Santé Canada a permis d'établir un lien possible. Santé Canada travaillera avec le fabricant pour mettre à jour la monographie de produit canadienne afin d’y inclure le risque de MAT.
Nouveaux renseignements sur l'innocuité des produits de santé
Les sujets suivants ont été inclus dans le but d'accroître la sensibilisation et d’encourager la déclaration d'effets indésirables.
Résumé sur l’innocuité des produits de santé
Les systèmes de déclaration après la mise en marché aident à cerner et à analyser de nouvelles informations sur l’innocuité des produits de santé, de sorte que les mesures appropriées soient prises pour réduire au minimum les risques pour la santé humaine. Les effets indésirables (EI) soupçonnés d’être associés à l’utilisation de produits de santé peuvent être signalés au Programme Canada Vigilance (PCV) de Santé Canada qui a la responsabilité de surveiller l’innocuité des produits de santé au Canada. Les détenteurs d’une autorisation de mise en marché et les hôpitaux doivent transmettre les déclarations d’EI au PCV. Le PCV reçoit aussi des déclarations soumises de façon volontaire de la part des membres de la collectivité (consommateurs, patients et professionnels de la santé ne pratiquant pas dans les hôpitaux).
Le présent rapport résume les renseignements sur les cas d’EI survenus au pays pour les produits pharmaceutiques, les produits de santé naturels, les médicaments biologiques, les produits radiopharmaceutiques, les désinfectants, et les agents d’assainissement aux propriétés désinfectantes reçus par le PCV en 2024. Les données présentées reflètent les opinions et observations du déclarant et ne reflètent aucune évaluation de Santé Canada concernant l’association entre le produit de santé et la ou les réactions.
Pour obtenir de plus amples renseignements, veuillez contacter la direction des produits de santé commercialisés.
Données sur les EI de 2024
- 202 008 déclarations d’EI au Canada ont été reçues par le PCV du 1er janvier au 31 décembre 2024. Ces déclarations représentent 76 638 cas survenus au pays.Note de bas de page 1
- 78% des cas ont été jugés graves
- 26% ont nécessité une hospitalisation
- 3% décrivaient un état présentant un danger de mort
- 8% signalaient un décès
- 13 problèmes d’innocuité potentiels ont été identifiés à partir de déclarations d’EI pour les produits de santé au cours de cette période, et pour 2 d‘entre eux, des examens sont en cours pour déterminer s’ils représentent des signaux d’innocuité.
- Les déclarations d’EI reçues en 2024 ont également contribué à la validation et à l’évaluation des signaux d’innocuité provenant d’autres sources (p. ex., de nouvelles informations sur l’innocuité provenant d’agences réglementaires étrangères et de détenteurs d’une autorisation de mise en marché, ainsi que de la littérature médicale et scientifique).
Figure 1: Répartition des cas d’EI par source de déclaration
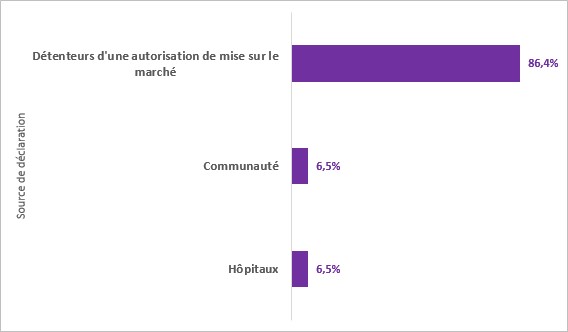
Figure 1 - Équivalent textuel
| Source de déclaration | Pourcentage |
|---|---|
| Détenteurs d'une autorisation de mise sur le marché | 86,4% |
| Communauté | 6,5% |
| Hôpitaux | 6,5% |
Figure 2: Répartition des cas d’EI par type de produit

Figure 2 - Équivalent textuel
| Type de produit | Pourcentage |
|---|---|
| Produits pharmaceutiques | 57,6% |
| Produits biologiques | 40,0% |
| Produits de santé naturels | 1,4% |
| Produits radiopharmaceutiques | 0,8% |
| Autres | 0,2% |
Répartition des cas d’EI par type de déclarant
- 18% provenant d’un médecin
- 7% provenant d’un pharmacien
- 46% provenant d’autres professionnels de la santé
- 29% provenant d’un consommateur / autre
Répartition des cas d’EI selon le sexe
- 57% de sexe féminin
- 39% de sexe masculin
- 4% de sexe inconnu
Figure 3: Répartition des cas d’EI par groupe d’âge

Figure 3 - Équivalent textuel
| Groupe d’âge | Nombres de cas d’effets indésirables graves | Nombres de cas d’effets indésirables non graves |
|---|---|---|
| Inconnu | 8 139 | 2 332 |
| Ainé (65 ans ou plus) | 20 260 | 3 427 |
| Adulte (19 – 64 ans) | 28 774 | 10 279 |
| Adolescent (12 – 18 ans) | 1 592 | 339 |
| Enfant (2-11 ans) | 1 031 | 163 |
| Nourrisson (moins de 24 mois) | 268 | 34 |
| Groupe anatomique, thérapeutique et chimique (ATC) | % de déclarations |
|---|---|
| Immunosuppresseurs | 47% |
| Antinéoplasiques | 15% |
| Médicaments pour les maladies obstructives des voies respiratoires | 4% |
| Psycholeptiques | 4% |
| Analgésiques | 4% |
| Classe par système et par organe | % de déclarations |
|---|---|
| Troubles généraux et anomalies au site d’administration | 52% |
| Lésions, intoxication et complications d’interventions | 30% |
| Infections and infestations | 24% |
| Affections gastro-intestinales | 22% |
| Affections du système nerveux | 16% |
Résumé sur l’innocuité des vaccins
Santé Canada et l'Agence de la santé publique du Canada (ASPC) partagent la responsabilité de la surveillance de l'innocuité des vaccins au Canada. Les détenteurs d'une autorisation de mise en marché sont tenus de déclarer les effets secondaires suivant l'immunisation (ESSI) considérés graves au Programme Canada Vigilance (PCV) de Santé Canada. Le PCV reçoit également des déclarations volontaires des professionnels de la santé et des consommateurs. Même si les hôpitaux doivent déclarer les effets indésirables graves d'un médicament documentés dans leur établissement, ils ne sont pas tenus de le faire dans le cas d'un vaccin s'ils ont transmis une déclaration d'ESSI à leur bureau local de santé publique. Ces déclarations sont transmises par les autorités de santé publique provinciales et territoriales au Système canadien de surveillance des effets secondaires suivant l'immunisation de l'ASPC.
Pour obtenir de plus amples renseignements, veuillez contacter la Direction des produits de santé commercialisés.
Données sur les ESSI de 2024
- 900 déclarations d’ESSI ont été reçues par le PCV du 1er janvier au 31 décembre 2024, pour tous les vaccins commercialisés au Canada.
- 74% des déclarations ont été jugées graves
- 14% ont nécessité une hospitalisation
- 4% décrivaient un état présentant un danger de mort
- 3% signalaient un décèsNote de bas de page 2
- Aucun nouveau signal d’innocuité (problèmes potentiels d’innocuité) n’a été identifié pour des vaccins pendant cette période.Note de bas de page 3
Répartition des déclarations par type de déclarant
- 9% provenant d’un médecin
- 17% provenant d’un pharmacien
- 21% provenant d’autres professionnels de la santé
- 53% provenant d’un consommateur / autre
Répartition des déclarations selon le sexe
- 62% de sexe féminin
- 30% de sexe masculin
- 8% de sexe inconnu
Figure 4: Répartition des déclarations par groupe d’âge

Figure 4 - Équivalent textuel
| Groupe d’âge | Nombre de déclarations d'effets graves | Nombre de déclarations d'effets non graves |
|---|---|---|
| Inconnu | 127 | 2 |
| Ainé (65 ans ou plus) | 228 | 63 |
| Adulte (19 – 64 ans) | 283 | 163 |
| Adolescent (12 – 18 ans) | 16 | 3 |
| Enfant (2-11 ans) | 6 | 2 |
| Nourrisson (28 jours - 23 mois) | 7 | 0 |
Figure 5: Dix types de vaccins soupçonnés les plus fréquemment associés aux ESSI

Figure 5 - Équivalent textuel
| Type de vaccin | Nombre de déclarations d'effets graves | Nombre de déclarations d'effets non graves | |
|---|---|---|---|
| COVID-19 | COVID | 350 | 30 |
| Zona | VZ | 130 | 135 |
| Influenza | INF | 42 | 11 |
| Virus respiratoire syncytial | VRS | 34 | 7 |
| Influenza/COVID-19 | INF/COVID | 37 | 2 |
| Pneumocoque | PNEU | 21 | 6 |
| Hépatite A et Hépatite B | HAHB | 3 | 10 |
| Diphtérie (réduite), Coqueluche acellulaire et Tétanos | dcaT | 1 | 9 |
| Virus du papillome humain | VPH | 8 | 1 |
| Hépatite B | HB | 2 | 5 |
Constatations clés
- Vaccins contre la COVID-19: les ESSI les plus fréquemment signalés était la COVID-19 (138), l’inefficacité médicamenteuse (101), l’échange de produits vaccinaux (46), la fatigue (38), la douleur (36) et les céphalées (36). La plupart des événements liés à la COVID-19 ont été signalés en même temps que l’inefficacité médicamenteuse.
- Vaccins contre le zona: les ESSI les plus fréquemment signalés étaient le zona (81), l’échec de la vaccination (57), la fièvre (29), la douleur (24), le malaise (22) et un schéma d'administration du produit inapproprié (22). La plupart des événements de zona ont été signalés en même temps que l’échec de la vaccination.
- Vaccins contre l’influenza: les 5 ESSI les plus fréquemment signalés étaient les céphalées (23), la fatigue (19), les sensations vertigineuses (17), la dyspnée (17) et le malaise (16).
Veuillez noter qu’en raison des mises à jour des renseignements reçus par le Programme Canada Vigilance, le nombre de déclarations des effets indésirables peut varier selon les dates de consultation.
Mises à jour de monographies de produits
Les mises à jour suivantes concernant l'innocuité, qui ont récemment été apportées aux monographies de produits canadiennes, ont été incluses afin d'en accroître la sensibilisation. Une liste complète des mises à jour de l'étiquetage pour les produits pharmaceutiques se trouve sur la page L'innocuité des monographies de produits pour les médicaments innovateurs de Santé Canada. Les monographies de produits canadiennes sont disponibles dans la Base de données sur les produits pharmaceutiques de Santé Canada.
Amphétamines
Les sections Mises en garde et précautions, Surdosage, et Renseignements destinés aux patients des monographies de produits canadiennes pour toutes les amphétamines au Canada ont été ou seront mises à jour avec des informations au sujet des risques d’allongement de l’intervalle QTc, de cardiomyopathie de Takotsubo et de syndrome d’encéphalopathie postérieure réversible (SEPR).
Messages clés à l’intention des professionnels de la santé:Référence a
L'allongement de l’intervalle QTc:
- Le traitement par les amphétamines a été associé à un allongement de l’intervalle QTc chez certains patients.
- Il convient d’utiliser les amphétamines avec prudence chez les patients qui présentent un allongement confirmé de l’intervalle QTc ou un syndrome du QT long congénital, qui prennent des médicaments affectant l’intervalle QTc ou qui présentent une maladie cardiaque préexistante ou des anomalies des électrolytes sanguins.
- À titre de rappel, les amphétamines sont contre-indiquées chez les patients atteints d’une maladie cardiovasculaire symptomatique ainsi que chez les patients souffrant d’hypertension modérée à grave.
Surdosage:
- Une cardiomyopathie de Takotsubo peut survenir lors d’une surdose d’amphétamines.
- Des cas de SEPR associés à une surdose d’amphétamines ont été signalés. Parmi les symptômes révélateurs d’un SEPR, on compte des céphalées, une altération de l’état mental, des crises d’épilepsie et des troubles visuels. Le diagnostic doit être confirmé à l’aide d’un examen radiologique (p. ex., une IRM). Si un SEPR est soupçonné ou diagnostiqué, les mesures appropriées doivent être prises. Les symptômes du SEPR sont généralement réversibles, mais ils peuvent évoluer et donner lieu à un accident vasculaire cérébral ischémique ou à une hémorragie cérébrale. Un diagnostic et un traitement tardifs peuvent entraîner des séquelles neurologiques permanentes.
Portée
Cette publication mensuelle s’adresse principalement aux professionnels de la santé et contient des informations sur les produits pharmaceutiques, biologiques, les matériels médicaux et les produits de santé naturels. Elle fournit un résumé des informations clés concernant l’innocuité des produits de santé qui ont été publiés au cours du mois précédent par Santé Canada, ainsi qu’une sélection de nouveaux renseignements en matière d’innocuité sur les produits de santé, pour en accroître la sensibilisation. Les nouvelles informations contenues dans ce numéro ne sont pas exhaustives, mais représentent plutôt une sélection de problèmes d’innocuité cliniquement pertinents, justifiant une dissémination améliorée.
Pour signaler des effets indésirables
Programme Canada Vigilance
Téléphone : 1-866-234-2345
Télécopieur ou courrier : formulaire disponible sur MedEffet Canada
Des renseignements sur la marche à suivre pour déclarer un effet indésirable à Santé Canada sont publiés à la page Déclaration des effets indésirables ou des incidents liés aux matériels médicaux .
Liens utiles
- MedEffetMC Canada
- Base de données sur les rappels et les avis de sécurité
- Nouveaux examens de l'innocuité ou de la sûreté et de l’efficacité
- Base de données en ligne des effets indésirables de Canada Vigilance
- Base de données sur les produits pharmaceutiques
- Liste des instruments médicaux homologués
- Base de données des produits de santé naturels homologués
- Portail des médicaments et des produits de santé
- Pénuries de médicaments Canada
- Pénuries d'instruments médicaux
- Portail des vaccins et traitements pour la COVID-19
Contactez-nous
Vos commentaires sont importants pour nous. Dites-nous ce que vous pensez en nous contactant à: infowatch-infovigilance@hc-sc.gc.ca
Équipe de rédaction de l’InfoVigilance sur les produits de santé
Direction des produits de santé commercialisés
Santé Canada
Indice de l’adresse 1906C
Ottawa (ON) K1A 0K9
Référence
- Référence a
-
Adderall XR (sels mixtes d’amphétamine) [monographie de produit]. Toronto (Ont.): Takeda Canada Inc.; 2025.
Notes de bas de page
- Note de bas de page 1
-
Un cas comprend toutes les informations décrivant le ou les EI subis par un patient à un moment donné et soupçonné d’être lié à l’utilisation d'un ou de plusieurs produits de santé. Un cas peut comprendre une déclaration initiale d’EI et éventuellement plusieurs déclarations de suivi fournissant des informations supplémentaires. Des cas en double peuvent exister si une déclaration d’EI concernant le même événement a été reçue de différents déclarants.
- Note de bas de page 2
-
Les informations fournies dans ces déclarations d’ESSI n’étaient pas suffisamment détaillées pour évaluer l’association causale entre l’évènement signalé et le vaccin.
- Note de bas de page 3
-
Les évènements graves signalés étaient soit déjà répertoriés dans les monographies de produits du vaccin concerné, soit jugés peu susceptibles d’être liés à la vaccination en raison de la présence de problèmes de santé sous-jacents et/ou de médicaments concomitants qui auraient pu contribuer aux évènements.
