Données sur les effets indésirables du cannabis : Rapport annuel de 2018-2019

Télécharger le format de rechange
(Format PDF, 830 Ko, 24 pages)
Organisation : Santé Canada
Date publiée : Décembre 2022
Cat. : H131-1F-PDF
ISBN : 2817-0563
Pub. : 220648
Effets indésirables associés au cannabis signalés à Santé Canada entre le 17 octobre 2018 et le 31 décembre 2019
Contenu
- Points forts
- 1.0 Introduction
- 2.0 Cas d'effets indésirables associés au cannabis
- 3.0 Évaluation clinique des cas graves et importants sur le plan médical
- 4.0 Avis aux lecteurs
- 5.0 Signaler un effet indésirable impliquant un produit de cannabis
- 6.0 Nous joindre
Points forts
- Il s'agit du premier rapport annuel concernant les rapports d'effets indésirables associés aux produits de cannabis légaux qui ont été soumis au Programme Canada Vigilance et analysés par la Direction générale des substances contrôlées et du cannabis de Santé Canada.
- Le présent rapport a pour but de présenter un survol des données recueillies par Santé Canada sur les rapports d'effets indésirables au cours de la première année depuis l'entrée en vigueur de la Loi sur le cannabis et à ses règlements, couvrant la période de déclaration du 17 octobre 2018 au 31 décembre 2019.
- Entre le 17 octobre 2018 et le 31 décembre 2019, un total de 219 rapports d'effets indésirables associés au cannabis en tant que substance (y compris les cas de polyconsommation de substances) ont été signalés à la base de données de Canada Vigilance de Santé Canada. Parmi ceux-ci, 151 cas d'effets indésirables étaient associés à des produits de cannabis légaux qui étaient utilisés à des fins médicales ou non médicales.
- Des 151 cas d'effets indésirables associés à des produits de cannabis légaux, 77 ont été signalés comme graves, l'hospitalisation étant la raison la plus fréquemment citée pour justifier le niveau de gravité. Onze autres cas non graves ont été jugés importants sur le plan médical et ont fait l'objet d'un examen plus approfondi.
- Aucune tendance n'a été observée dans le nombre ou la gravité des cas d'un mois à l'autre ou sur une base cumulative au cours de la période de référence. La majorité des cas provenaient de consommateurs (76 %) et ont été soumis à Santé Canada par des titulaires de licence pour le cannabis (62 %) alors que presque un quart des cas (24 %) ont été signalés par des professionnels de la santé.
- La majorité des cas concernaient des jeunes adultes ou des adultes d'âge moyen (25 % étaient âgés de 18 à 44 ans et 24 % étaient âgés de 45 à 64 ans); toutefois, les cas concernent aussi fréquemment des adultes âgés (28 % avaient 65 ans et plus). Les cas concernent plus fréquemment des femmes que les hommes (55 % et 39 %, respectivement, alors que 6 % des cas n'avaient pas déclaré le sexe de la personne impliquée).
- La plupart des cas concernaient des produits du cannabis à des fins médicales autodéclarées (87 %) et impliquaient souvent des produits à base d'huile de cannabis consommés par voie orale (64 %).
- Les événements médicaux les plus souvent signalés étaient les maux de tête (n = 23), les nausées (n = 19), les hallucination (n = 15), les vertiges (n = 13), l'anxiété (n = 12), la dyspnée (n = 11) et les malaises (n = 9). Parmi les autres événements d'intérêt, figuraient les interactions médicamenteuses (n = 8) et les problèmes de qualité des produits suspectés (n = 8).
- Un nouveau risque important a été identifié au cours de cette période, soit l'interaction entre les produits à base d'huile de cannabis à prédominance de cannabidiol (CBD) ingérés par voie orale et la warfarine, un anticoagulant, entraînant un risque potentiel accru de saignement. Ce signal a été évalué dans une série complète de cas et a été publié dans le bulletin d'information de Santé Canada InfoVigilance en octobre 2020.
- Les autres cas étaient associés à des risques connus ou déjà identifiés (c'est-à-dire caractérisés dans le document de Santé Canada Renseignements destinés aux professionnels de la santé). Notamment, des réactions d'hypersensibilité ou d'allergie (par exemple, réactions d'hypersensibilité localisées ou systémiques telles que le prurit, l'urticaire, l'œdème; anaphylaxie), des réactions psychiatriques (par exemple, panique, anxiété, hallucination), des réactions neurologiques (par exemple, maux de tête, vertiges) et des réactions gastro-intestinales (par exemple, nausées, vomissements).
- Parmi les risques potentiels importants observés au cours de cette période qui nécessiteront de nouvelles preuves et qui continueront à être surveillés, figuraient les interactions entre le cannabis et les médicaments, les modifications des taux de glucose sanguin, les modifications des paramètres hématologiques et l'élévation des taux d'enzymes hépatiques.
- Les effets indésirables impliquant les extraits de cannabis inhalés (par exemple, produits de vapotage), en particulier, ceux qui sont soupçonnés d'être liés à des maladies pulmonaires associées au vapotage (MPAV) ou à d'autres problèmes respiratoires graves, continuent d'être surveillés en priorité, ainsi que les cas qui concernent des populations spéciales (par exemple, les personnes âgées et les populations pédiatriques).
1.0 Introduction
Ce rapport décrit les résultats des rapports de cas nationaux d'effets indésirables associés aux produits du cannabis soumis au Programme Canada Vigilance de Santé Canada et analysés par le Bureau de la science et de la surveillance du cannabis de la Direction générale des substances contrôlées et du cannabis. Ces travaux s'inscrivent dans le cadre de la vigilance sur le cannabis mis en place depuis l'entrée en vigueur du Règlement sur le cannabis (17 octobre 2018).
Ce rapport résume tous les effets indésirables signalés à Santé Canada entre le 17 octobre 2018 et le 31 décembre 2019, associés à un produit du cannabis tel que défini dans la Loi sur le cannabis et à ses règlements, destiné à la consommation humaine :
Produit du cannabis : Désigne le cannabis d'une seule des catégories visées à l'annexe 4 de la Loi – ou de tout accessoire contenant de ce cannabis, une fois emballé et étiqueté pour la vente au détail aux consommateurs. Ce terme ne comprend pas :
- le cannabis destiné à un animal
- un accessoire de cannabis qui contient du cannabis destiné à un animal
- les produits de santé contenant du cannabis ou à utiliser avec du cannabis
Comme l'énonce l'article 248 du Règlement sur le cannabis, les titulaires de licence qui vendent ou distribuent des produits du cannabis doivent fournir à Santé Canada, dans les quinze jours suivant la date à laquelle ils ont eu connaissance d'une réaction indésirable grave au produit de cannabis, un rapport détaillé faisant état des données qu'ils ont en leur possession concernant l'utilisation du produit du cannabis par l'individu touché. En vertu du Règlement :
- un effet indésirable est défini comme « une réaction nocive et non voulue à un produit du cannabis »
- un effet indésirable grave est défini comme étant une « réaction nocive et non voulue à un produit du cannabis qui nécessite ou prolonge une hospitalisation, entraîne une malformation congénitale, une invalidité ou une incapacité persistante ou importante, met la vie en danger ou entraîne la mort»
Les consommateurs, les patients, les professionnels de la santé, les cliniques de cannabis médical et les autres déclarants, comme les détaillants autorisés par les provinces et les territoires, soumettent volontairement à Santé Canada les rapports d'effets indésirables impliquant des produits de cannabis. Des rapports d'effets indésirables peuvent également être reçus par les détenteurs d'une autorisation de mise sur le marché de produits de santé autorisés qui déclarent des effets indésirables associés à d'autres produits de santé suspects (comme des médicaments sur ordonnance ou en vente libre, ou des produits de santé naturels) dans lesquels le cannabis est également suspecté. Les effets indésirables du cannabis peuvent concerner le cannabis qui est: (i) un produit du cannabis transformé par un titulaire de licence fédérale, (ii) cultivé à domicileNote de bas de page 1, (iii) non défini (cannabis en tant que substance sans précision), ou (iv) de source illégale.
Aux fins du présent rapport, les déclarations de cas impliquant un produit de cannabis légal (c'est-à-dire identifiable par la marque du produit ou le titulaire de licence) sont classées en fonction de l'utilisation prévue des produits de cannabis comme décrit dans le rapport de cas :
- Utilisation de cannabis à des fins médicales : Comprend des rapports de cas dans lesquels il est indiqué que le consommateur détient un document d'autorisation médicale; ou, des rapports de cas dans lesquels un but médical ou thérapeutique est déclaré pour la consommation du cannabis, sans la mention d'un document d'autorisation médicale. Cette définition correspond à la définition de l'utilisation médicale qui figure dans l'Enquête canadienne sur le cannabis. Cette définition a une portée plus large que la définition réglementaire de l'utilisation du cannabis à des fins médicales dans le Règlement sur le cannabis, c'est-à-dire un document médical rempli par un professionnel de la santé (médecin, infirmière praticienne) et autorisant l'utilisation du cannabis à des fins médicales.
- Utilisation de cannabis à des fins non médicales : Si le rapport de cas ne mentionne aucune raison d'utilisation ou d'indication thérapeutique, ne fournit que des détails minimaux ou indique qu'une utilisation prévue à des fins non médicales, le rapport de cas est classé dans la catégorie « cannabis utilisé à des fins non médicales ».
Les rapports de cas sur les effets indésirables sont recueillis et conservés dans la base de données de Canada Vigilance. La majorité des effets indésirables sont signalés spontanément à Santé Canada (type de rapport =spontané) par des consommateurs, des patients, des professionnels de la santé ou des titulaires de licence (appelés « détenteurs d'une autorisation de mise sur le marché » dans la base de données Canada Vigilance). Toutefois, ils peuvent également provenir d'études (type de rapport=étude), notamment d'études observationnelles dans le monde réel, d'études humaines portant sur le cannabis qui ne répondent pas à la définition d'un essai clinique, ou d'autres systèmes organisés de collecte de données (par exemple, des enquêtes auprès de patients ou de prestataires de soins de santé).
Conformément au Cadre de vigilance du cannabis, Santé Canada mène des activités de surveillance, de détection et d'évaluation en temps réel et des activités connexes pour les cas d'effets indésirables impliquant des produits du cannabis. Santé Canada surveille également les cas impliquant le cannabis en tant que substance pour des questions plus larges d'importance pour la santé publique, comme les MPAV, les cas impliquant des populations pédiatriques et d'autres problèmes d'innocuité émergents potentiels.
Il est à noter que ce rapport ne couvre pas les effets indésirables associés aux produits de santé, y compris les médicaments contenant du cannabis, qui sont régis par la Loi sur les aliments et drogues et à ses règlements. Un résumé des effets indésirables associés à d'autres produits de santé et instruments médicaux reçus par Canada Vigilance en 2019 est décrit dans le rapport suivant : Effets indésirables, incidents liés aux instruments médicaux et rappels de produits de santé au Canada : rapport sommaire 2019.
Le présent rapport a pour but de fournir une analyse descriptive des types d'effets indésirables concernant les produits du cannabis en vertu de la Loi sur le cannabis et du Règlement sur le cannabis, soumis à Santé Canada entre le 17 octobre 2018 et le 31 décembre 2019. Cette période de référence correspond à la première année de légalisation et de réglementation et à la période de transition vers la deuxième année de réglementation (avec des modifications au Règlement sur le cannabis), soit du 17 octobre 2019 au 31 décembre 2019Note de bas de page 2. Pendant cette période, seules les premières catégories de produits du cannabis (cannabis séché, cannabis frais et huile de cannabis) étaient en vente aux Canadiens par l'intermédiaire des détaillants autorisés par les provinces et territoires, ou directement auprès des titulaires de licence à des fins médicales. Ainsi, aucune observation ne peut être faite sur les nouvelles classes de produits du cannabis (extraits, comestibles ou topiques) au cours de cette période de déclaration, car ces produits n'étaient pas encore vendus par les titulaires de licence ou les détaillants autorisés.
1.1 Considérations
Certaines mises en garde doivent être prises en compte lors de l'interprétation des données sur les effets indésirables figurant dans ce rapport :
- Les effets indésirables sont généralement déclarés spontanément à Santé Canada et ne peuvent être utilisés pour déterminer l'incidence ou la prévalence des effets indésirables du cannabis dans la population générale.
- Les effets indésirables graves sont davantage représentés dans cet ensemble de données car les titulaires de licence sont obligés de les déclarer à Santé Canada en vertu du Règlement sur le cannabis. La déclaration des effets indésirables non graves par les titulaires de licence à Santé Canada sous forme de rapports de cas individuels est volontaire;Note de bas de page 3 par conséquent, ces cas sont probablement sous-déclarés et sous-représentés dans cet ensemble de données.
- Les déclarations des effets indésirables, qu'ils soient graves ou non graves, associées aux produits du cannabis par les déclarant volontaires, tels que les consommateurs, les professionnels de la santé, les cliniques de cannabis médical et les détaillants étant volontaire, sont probablement sous-déclarées.
- Les personnes qui subissent des effets indésirables graves ou qui utilisent des produits à base de cannabis à des fins médicales peuvent être plus motivées à les signaler ou à consulter un médecin.
- Plusieurs facteurs peuvent influencer le nombre de cas déclarés à Santé Canada, notamment : les antécédents médicaux du consommateur/patient, la raison de la consommation de cannabis, la durée de commercialisation d'un produit, la couverture médiatique, la connaissance de la possibilité de signaler les cas et la méthode de signalement (systèmes de déclaration spontanés ou systèmes de collecte de données organisés).
- Ce rapport comprend de l'information sur le cannabis à des fins médicales et non médicales, toutefois, le nombre de cas pourrait ne pas correspondre directement à ce qui est présenté dans le présent rapport sommaire annuel en raison des différentes dates d'extraction de la base de données de Canada Vigilance.
2.0 Cas d'effets indésirables associés au cannabis
2.1 Cas d'effets indésirables associés au cannabis en tant que substance
Entre le 17 octobre 2018 et le 31 décembre 2019, un total de 219 rapports d'effets indésirables ont été déclarés à Santé Canada concernant le cannabis en tant que substance.
La majorité de ces cas impliquaient des produits de cannabis légal (68 %, n = 151), et la plupart ont été classés comme des utilisations à des fins médicales autodéclarées (88 %, n = 132) par rapport à des utilisations à des fins non médicales (13 %, n = 19). Les autres cas impliquaient du cannabis de nature indéterminée ou illégale (par exemple, décrit comme de la « marijuana » sans autre précision; souvent co-suspecté dans un cas où de multiples autres substances étaient également suspectées).
Les autres parties du présent rapport annuel sont basées sur des rapports de cas impliquant des produits du cannabis utilisés à des fins médicales et non médicales et provenant du marché légal.
2.2 Cas d'effets indésirables associés à des produits du cannabis légaux à des fins médicales ou non médicales
Figure 1: Cas par mois et par gravité
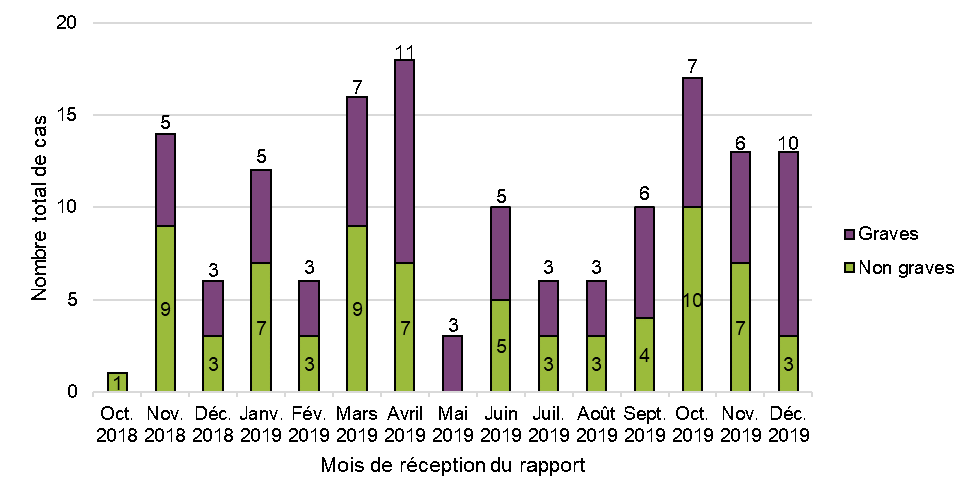
Figure 1 - Équivalent textuel
| Mois de réception du rapport | Nombre total de cas par gravité | ||
|---|---|---|---|
| Non grave | Grave | Total général | |
| Oct. 2018 | 1 | 0 | 1 |
| Nov. 2018 | 9 | 5 | 14 |
| Déc. 2018 | 3 | 3 | 6 |
| Janv. 2019 | 7 | 5 | 12 |
| Fév. 2019 | 3 | 3 | 6 |
| Mars 2019 | 9 | 7 | 16 |
| Avril 2019 | 7 | 11 | 18 |
| Mai 2019 | 0 | 3 | 3 |
| Juin 2019 | 5 | 5 | 10 |
| Juil. 2019 | 3 | 3 | 6 |
| Août 2019 | 3 | 3 | 6 |
| Sept. 2019 | 4 | 6 | 10 |
| Oct. 2019 | 10 | 7 | 17 |
| Nov. 2019 | 7 | 6 | 13 |
| Déc. 2019 | 3 | 10 | 13 |
| Total général | 74 | 77 | 151 |
Mises en garde :
- Les cas sont présentés selon la date initiale de réception par le Programme Canada Vigilance. La date réelle de l'effet indésirable pourrait être d'un mois différent de celui où le cas a été reçu (délai entre l'événement et la déclaration).
- La gravité est fondée sur la déclaration initiale et peut être modifiée si des renseignements supplémentaires sont soumis à Santé Canada.
Dans l'ensemble, aucune tendance temporelle n'a été observée dans le nombre total de cas d'effets indésirables liés à des produits du cannabis légaux, y compris le nombre de cas graves et non graves sur une base cumulative (n = 77 cas graves, n = 74 cas non graves), ou d'un mois à l'autre. Les nombres de cas (graves et non graves combinés) les plus élevés ont été signalés en avril 2019 (n = 18), en octobre 2019 (n = 17) et en mars 2019 (n = 16), tandis que les nombres les plus faibles de cas ont été signalés en mai (n = 3) 2019 [à l'exception d'octobre 2018, mois incomplet]. Le nombre le plus élevé de cas graves a été signalé en avril (n = 11) et en décembre (n = 10) 2019.
Il convient de noter que les titulaires de licence ne sont pas tenus de soumettre à Santé Canada les effets indésirables non graves sous forme de rapports de cas individuels. Ainsi, il se peut que d'autres effets indésirables non graves n'aient pas été déclarés à Santé Canada. Toutefois, comme le recommande le Guide sur la déclaration des effets indésirables du cannabis de Santé Canada, les rapports de cas important sur le plan médical, ainsi que tout groupe de cas d'intérêts, quelle que soit leur gravité, sont toujours encouragés à être soumis à Santé Canada. Tous les effets indésirables, y compris ceux qui sont graves et non graves, doivent être inclus dans le rapport de synthèse annuel que les titulaires de licences doivent préparer et tenir à jour sur une base annuelle (année civile).
Figure 2: Cas graves par la raison de gravité
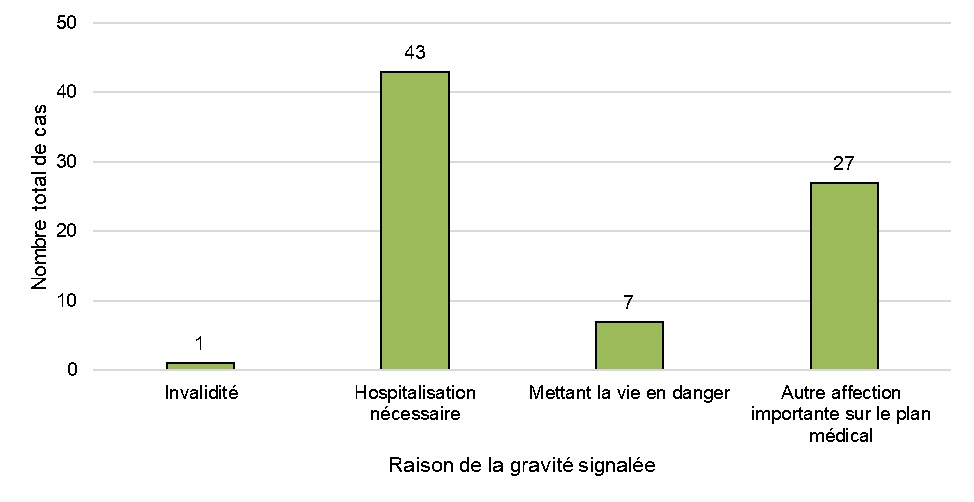
Figure 2 - Équivalent textuel
| Raison de la gravité signalée | Nombre total de cas |
|---|---|
| Invalidité | 1 |
| Hospitalisation nécessaire | 43 |
| Mettant la vie en danger | 7 |
| Autre affection importante sur le plan médical | 27 |
| Total général | 78 |
Mises en garde :
- Chaque cas grave peut avoir plus d'une raison de gravité, le déclarant pouvant en choisir plusieurs.
Parmi les 77 cas signalés comme graves à Santé Canada, un total de 78 réponses pour la gravité ont été citées par les déclarants [Figure 2]. La raison de gravité la plus fréquemment citée est l'hospitalisation nécessaire (55 %, n = 43), suivie par une autre affection importante sur le plan médical (35 %, n = 27). Cette dernière catégorie peut impliquer une visite aux urgences, une visite en consultation externe chez un médecin ou un professionnel de la santé, ou nécessiter une intervention médicale pour prévenir l'une des conséquences énumérées dans la définition de « grave » du Règlement sur le cannabis. Aucun cas de décès n'a été signalé en lien avec des produits du cannabis à des fins médicales ou non médicales au Canada, cependant, sept cas ont fait état d'« événements mettant la vie en danger », et un cas d'invalidité.
Onze autres cas signalés comme non graves ont été considérés comme des affections importantes sur le plan médical par Santé Canada et ont fait l'objet d'un examen plus approfondi.
Figure 3: Cas par type de déclarant initial et par source de déclaration
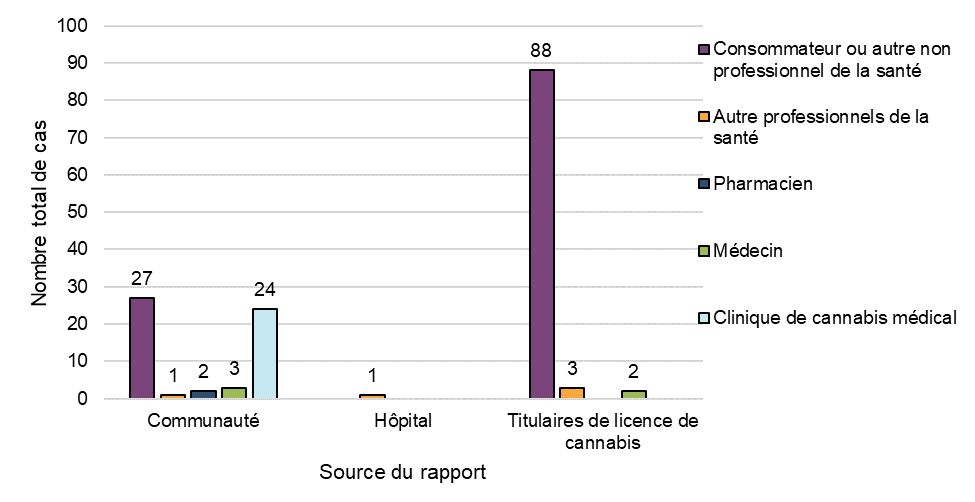
Figure 3 - Équivalent textuel
| Source du rapport | Type de déclarant initial | |||||
|---|---|---|---|---|---|---|
| Consommateur ou autre non professionnel de la santé | Autre professionnel de la santé | Pharmacien | Médecin | Clinique de cannabis médical | Total général | |
| Communauté | 27 | 1 | 2 | 3 | 24 | 57 |
| Hôpital | 0 | 1 | 0 | 0 | 0 | 1 |
| Titulaires de licence de cannabis | 88 | 3 | 0 | 2 | 0 | 93 |
| Total général | 115 | 5 | 2 | 5 | 24 | 151 |
Mises en garde :
- La source de la déclaration indique l'endroit d'où le rapport a été soumis à Santé Canada (communauté, hôpital ou titulaire de licence de cannabis [soit, « détenteur d'une autorisation de mise sur le marché » dans la base de données de Canada Vigilance]).
- Dans cette figure, chaque source de déclaration a été subdivisée en fonction du type de déclarant initial (consommateur, professionnels de la santé [médecins, pharmaciens ou autres], cliniques de cannabis médical).
- Les rapports provenant de sources de professionnels de la santé sont considérés comme « médicalement confirmés » selon les directives internationalesNote de bas de page 4; ils sont donc distincts des rapports des consommateurs.
- Les rapports des cliniques de cannabis médical sont considérés comme « médicalement confirmés » car ils relèvent d'une pratique médicale et d'une surveillance médicale par les cliniques, où les patients utilisent du cannabis à des fins médicales et peuvent subir un effet indésirable.
La majorité des cas d'effets indésirables concernant des produits du cannabis utilisés à des fins médicales ou non médicales ont été signalés à Santé Canada par les titulaires de licence (62 %, n = 93), suivis des rapports de la communauté (38 %, n = 57; rapports soumis directement à Santé Canada par des déclarants volontaires). Un seul cas provenait d'un hôpital.
La plupart des cas d'effets indésirables ont été initialement signalés par des patients ou des consommateurs (76 %, n = 115), tandis que 24 % (n = 36) ont été signalés par des professionnels de la santé, majoritairement des cliniques de cannabis médical (n = 24). D'après les observations de la Figure 3, les professionnels de la santé semblent plus susceptibles de déclarer les effets indésirables directement à Santé Canada, tandis que les consommateurs semblent avoir plus tendance à les déclarer directement aux titulaires de licence sur le marché.
2.3 Données démographiques
Figure 4: Cas par groupe d'âge
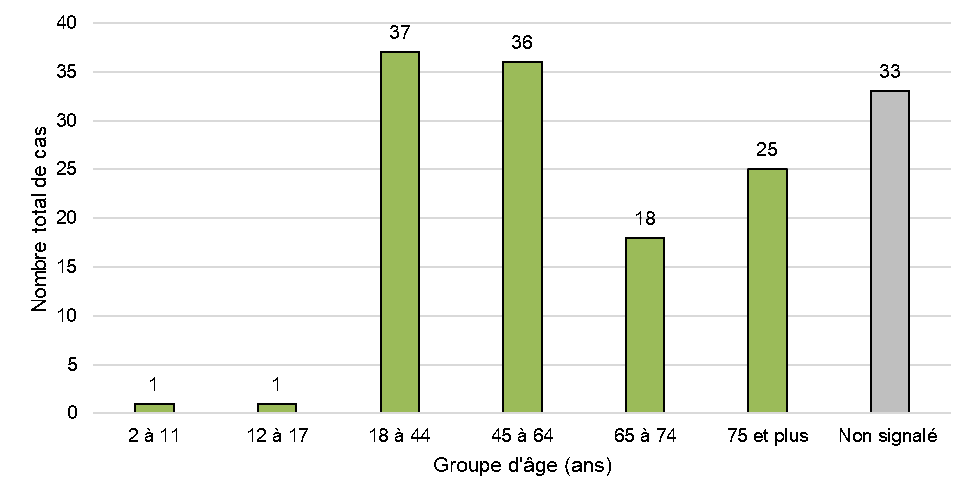
Figure 4 - Équivalent textuel
| Groupe d'âge (ans) | Nombre total de cas |
|---|---|
| 2 à 11 | 1 |
| 12 à 17 | 1 |
| 18 à 44 | 37 |
| 45 à 64 | 36 |
| 65 à 74 | 18 |
| 75 et plus | 25 |
| Non signalé | 33 |
| Total général | 151 |
Mises en garde :
- Lorsque seule l'année de naissance est indiquée, sans la mention de la date de survenue de la réaction, la date à laquelle le rapport a été soumis est utilisée pour calculer l'âge.
- Lorsque seule l'année de naissance est indiquée, sans la mention de la date de survenue de la réaction, la date à laquelle le rapport a été soumis est utilisée pour calculer l'âge.
- Les cas pour lesquels l'âge a été calculé ont été classés selon les groupes d'âge de la base de données Vigilyze de l'Organisation mondiale de la santé (Vigibase).
La majorité des cas d'effets indésirables concernaient des adultes jeunes ou d'âge moyen, soit 25 % (18 à 44 ans; n = 37) et 24 % (45 à 64 ans; n = 36) du nombre total de cas pour les 18 à 44 ans et les 45 à 64 ans, respectivement. Cependant, un grand nombre de cas concernaient également des adultes plus âgés (65 à 74 ans : 12 %; 75 ans et plus : 17 %). Il est à noter que dans une grande partie des cas (22 %, n = 33), l'âge n'a pas été indiqué. Les cas impliquant des patients en pédiatrie (moins de 18 ans; n = 2) ne concernaient que des produits de cannabis utilisés à des fins médicales.
Figure 5: Cas par sexe
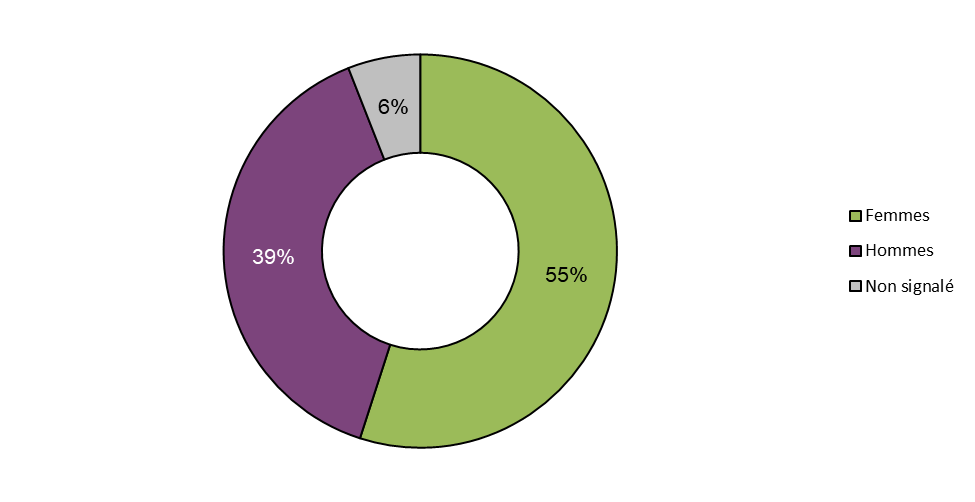
Figure 5 - Équivalent textuel
| Sexe | Nombre total de cas | Pourcentage (%) du total |
|---|---|---|
| Femmes | 83 | 55 |
| Hommes | 59 | 39 |
| Non déclaré | 9 | 6 |
| Total général | 151 | 100 |
Un peu plus de la moitié des cas concernaient des femmes (55 % des femmes, n = 83; 39 % des hommes; n = 59); cependant, dans 6 % des cas (n = 9), le sexe n'était pas déclaré.
2.4 Produits de cannabis suspects
Dans l'ensemble, pour la majorité des cas d'effets indésirables, le cannabis a été signalé comme seul produit suspect, ce qui signifie qu'aucun autre produit n'a été signalé comme co-suspect (96 %, n = 145). Les autres produits peuvent comprendre des médicaments sur ordonnance ou en vente libre, des produits de santé naturels ou d'autres types de produits de santé réglementés par la Loi sur les aliments et drogues. Toutefois, un ou plusieurs produits suspects du cannabis peuvent avoir joué un rôle dans un même cas. En fait, 26 cas mentionnaient l'usage de plusieurs produits du cannabis (de deux à sept produits), la majorité impliquant jusqu'à deux produits du cannabis (85 %, n = 22). Il convient de noter que tous les produits du cannabis suspects sont considérés comme tels par le déclarant et que le rôle d'autres produits ou facteurs ne peut pas toujours être exclu. Ces considérations font partie de l'évaluation clinique dans la partie du résumé clinique du présent rapport.
Les produits à base d'huile de cannabis ont également été plus fréquemment signalés dans les cas graves (83 %; n = 64), tandis que les produits à base de cannabis séché ont été plus fréquemment signalés dans les cas non graves (57 %; n = 42).
Figure 6: Cas par voie d'administration
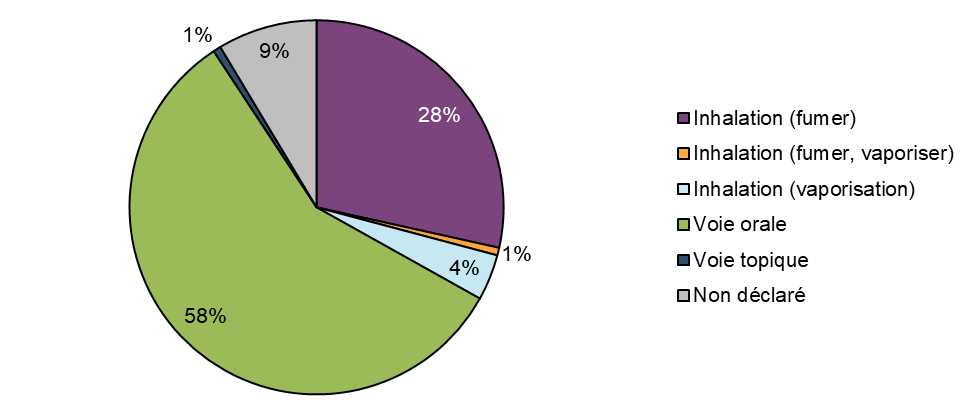
Figure 6 - Équivalent textuel
| Voie d'administration | Nombre total de cas | Proportion (en %) du total |
|---|---|---|
| Inhalation (fumer) | 43 | 28 |
| Inhalation (fumer, vaporiser) | 1 | 1 |
| Inhalation (vaporisation) | 6 | 4 |
| Voie orale | 87 | 58 |
| Voie topique | 1 | 1 |
| Non déclaré | 13 | 9 |
| Total général | 151 | 100 |
Mises en garde :
- Cette figure décrit la voie d'administration des produits de cannabis suspects associés aux cas, qui est codée séparément de la forme posologique (c'est-à-dire qu'un produit à base d'huile de cannabis peut être ingéré, appliqué localement sur la peau, etc.)
- L'administration par voie orale fait référence à la consommation de cannabis par la bouche et peut comprendre l'ingestion, l'administration buccale, l'administration sublinguale, etc., ce qui signifie que l'absorption peut se produire dans le tractus gastro-intestinal ainsi que directement dans la circulation sanguine à travers les tissus des muqueuses buccales.
- L'inhalation fait référence à la consommation de cannabis par les voies respiratoires sous forme de fumée ou par vaporisation.
- Les cas peuvent être associés à plus d'un produit de cannabis suspect; par conséquent, plusieurs voies d'administration peuvent être indiquées pour un seul cas.
Les produits de cannabis suspects impliqués dans les rapports de cas ont été le plus souvent consommés par voie orale (58 %, n = 87). L'inhalation de cannabis séché en fumant constituait la deuxième voie d'administration la plus courante parmi les cas (28 %, n = 43). Un petit nombre de cas concernait la vaporisation de cannabis séché (4 %, n = 6). Il est à noter que les extraits de cannabis, y compris ceux destinés à l'inhalation, n'étaient pas pris en compte dans ces données, n'étant pas offerts légalement sur le marché au cours de la période de déclaration (se terminant le 31 décembre 2019).
Presque tous les cas d'effets indésirables étaient associés à des produits du cannabis utilisés à des fins médicales (87 %, n = 132), par rapport à une utilisation à des fins non médicales (13 %, n = 19). Un peu plus de la moitié des cas où des produits du cannabis ont été utilisés à des fins médicales étaient graves (53 %, n = 70 graves; 47 %, n = 62 non graves). En revanche, la plupart des cas où des produits du cannabis ont été utilisés à des fins non médicales ont été signalés comme non graves (37 %, n = 7 graves; 63 %, n = 12 graves).
Figure 7: Cas par classe de produits et par raison d'utilisation
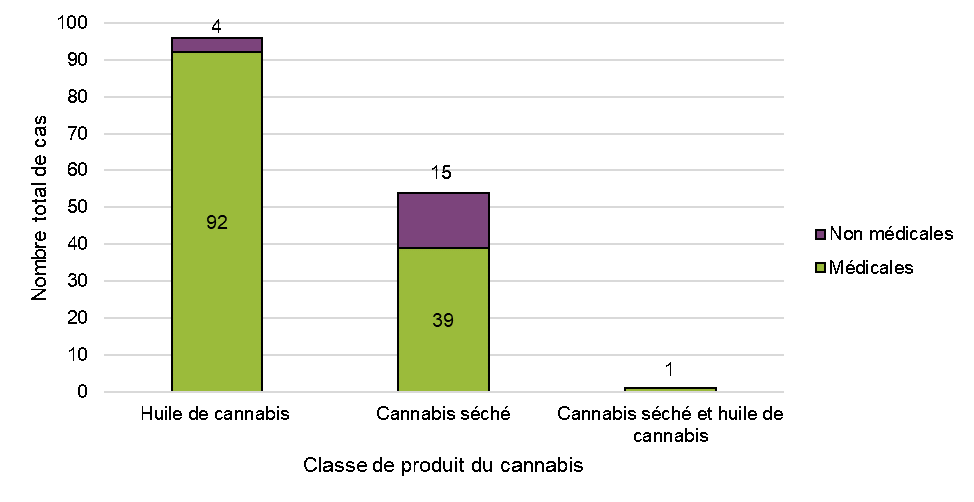
Figure 7 - Équivalent textuel
| Classe de produit du cannabis | Raisons de la consommation | ||
|---|---|---|---|
| Médicales | Non médicales | Total général | |
| Huile de cannabis | 92 | 4 | 96 |
| Cannabis séché | 39 | 15 | 54 |
| Cannabis séché et huile de cannabis | 1 | 0 | 1 |
| Total général | 132 | 19 | 151 |
L'huile de cannabis était la classe de produits suspects la plus fréquemment signalée dans l'ensemble des cas d'effets indésirables (64 %, n = 96), suivie du cannabis séché (36 %, n = 54). Aucun cas associé au cannabis frais n'a été signalé. Un seul concernait à la fois le cannabis séché et l'huile de cannabis; les autres cas se rapportaient soit à un ou plusieurs produits suspects à base d'huile de cannabis, soit à des produits de cannabis séché.
Comme indiqué ci-dessus, les cas concernant des produits à base d'huile de cannabis ont été presque exclusivement signalés comme des utilisations à des fins médicales. Les produits suspects à base d'huile de cannabis et l'utilisation à des fins médicales ont souvent coexisté dans des cas graves suggérant une interaction potentielle entre ces facteurs.
Il convient de noter que la plupart des produits à base d'huile de cannabis dans les cas d'effets indésirables étaient « à prédominance de CBD » ou « à concentration supérieure de CBD », alors que les produits à base de cannabis séché étaient généralement « à prédominance de THC »Note de bas de page 5. De plus, les adultes plus âgés et les personnes âgées (65 ans et plus) étaient fréquemment impliqués dans des cas d'effets indésirables où des produits à base d'huile de cannabis étaient concernés, contrairement aux cas de jeunes adultes chez qui le cannabis séché et les produits à base d'huile de cannabis étaient tous deux impliqués de manière comparable (données non présentées).
Figure 8: Répartition des événements médicaux individuels par classe de système organique
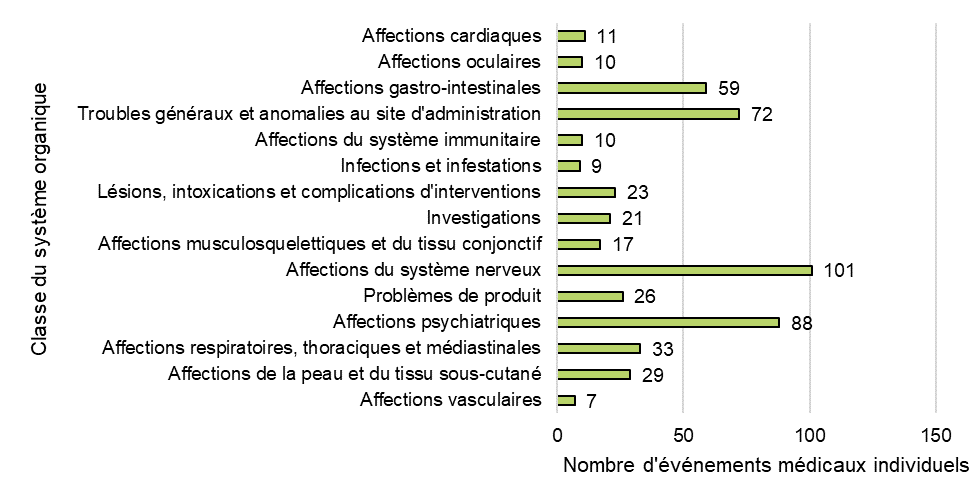
Figure 8 - Équivalent textuel
| Classe de système organique | Nombre d'événements médicaux individuels |
|---|---|
| Affections cardiaques | 11 |
| Affections oculaires | 10 |
| Affections gastro-intestinales | 59 |
| Troubles généraux et anomalies au site d'administration | 72 |
| Affections du système immunitaire | 10 |
| Infections et infestations | 9 |
| Lésions, intoxications et complications liées aux procédures | 23 |
| Investigations | 21 |
| Affections musculo-squelettiques et du tissu conjonctif | 17 |
| Affections du système nerveux | 101 |
| Problèmes de produits | 26 |
| Affections psychiatriques | 88 |
| Affections respiratoires, thoraciques et médiastinales | 33 |
| Affections de la peau et du tissu sous-cutané | 29 |
| Affections vasculaires | 7 |
Mises en garde :
- Cette figure porte sur les 15 principales classes de systèmes organiques signalées dans tous les cas d'effets indésirables.
- Chaque cas peut décrire un ou plusieurs événements médicaux individuels, indiquant des signes, des symptômes, des maladies, des diagnostics, des enquêtes et des procédures.
- Les événements sont codés selon le Dictionnaire médical des affaires réglementaires (MedDRA) (en anglais), qui fournit une terminologie médicale normalisée en regroupements hiérarchiques. Le groupe du niveau le plus élevé est la classe de système organique (System Organ Class [SOC]).
- Un cas d'effet indésirable peut être représenté dans plusieurs SOC et est influencé par la façon dont les événements individuels (signes, symptômes, observations ou diagnostics) sont signalés.
Au total, 541 événements médicaux individuels (représentant 243 types uniques de catégories d'événements médicaux individuels) ont été signalés dans 151 cas d'effets indésirables. Lorsqu'elles sont regroupées par SOC, les catégories les plus fréquentes sont les suivantes :
- Affections du système nerveux (19 %, n = 101)
- Affections psychiatriques (16 %, n = 88)
- Troubles généraux et anomalies au site d'administration (13 %, n = 72)
- Affections gastro-intestinales (11 %, n = 59)
Figure 9: Fréquence des événements médicaux individuels
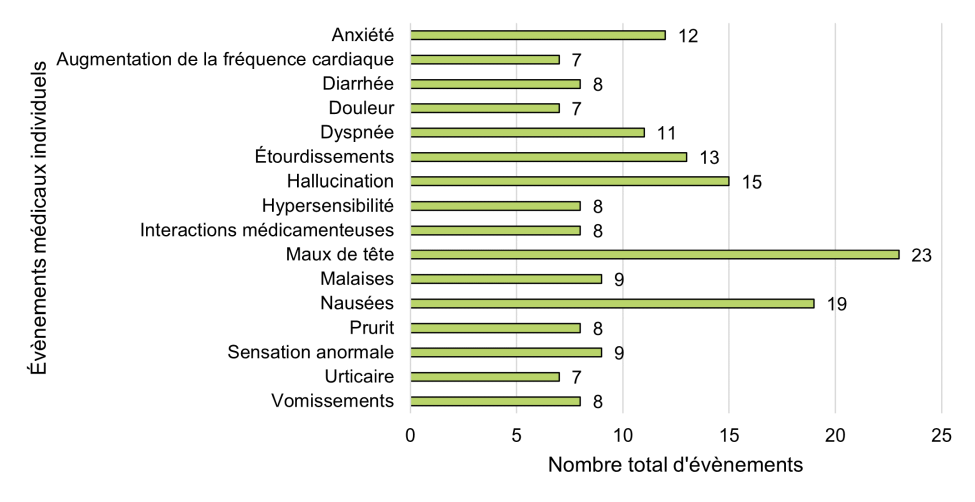
Figure 9 - Équivalent textuel
| Évènements médicaux individuels | Nombre total d'événements |
|---|---|
| Anxiété | 12 |
| Augmentation de la fréquence cardiaque | 8 |
| Diarrhée | 13 |
| Douleur | 8 |
| Dyspnée | 11 |
| Étourdissements | 9 |
| Hallucination | 15 |
| Hypersensibilité | 23 |
| Interactions médicamenteuses | 7 |
| Maux de tête | 8 |
| Malaises | 9 |
| Nausées | 19 |
| Prurit | 7 |
| Sensation anormale | 8 |
| Urticaire | 7 |
| Vomissements | 8 |
Mises en garde :
- Cette figure porte sur les 15 principaux événements médicaux signalés parmi tous les effets indésirables. Plus de 15 événements sont observés dans cette figure, car plusieurs événements ont été comptés un nombre égal de fois. D'autres événements médicaux individuels ont été rapportés, mais n'apparaissent pas dans cette figure.
- Les événements médicaux individuels sont codés en utilisant la terminologie MedDRA basée sur le compte rendu du rapport de cas.
- Chaque cas pouvant avoir plusieurs événements médicaux individuels rapportés, le nombre d'événements médicaux individuels dépasse le nombre total de cas uniques.
- Plusieurs types d'hallucinations ont été combinés pour créer une catégorie générale d'hallucinations. Il s'agissait d'hallucinations auditives, d'hallucinations visuelles, d'hallucinations mixtes, d'hallucinations hypnagogiques et de pseudo-hallucinations.
Comme le montre la figure 9, les événements médicaux individuels les plus fréquemment signalés dans le groupe de 2018 et 2019 étaient les suivants :
- Maux de tête (n = 23)
- Nausées (n = 19)
- Hallucination (n = 15)
- Étourdissements (n = 13)
- Anxiété (n = 12)
Parmi les autres événements d'intérêt, citons les interactions médicamenteuses (n = 8) et les problèmes liés à la qualité des produits suspectés (n = 8).
Figure 10: Fréquence des événements médicaux individuels selon la dominance du cannabinoïde
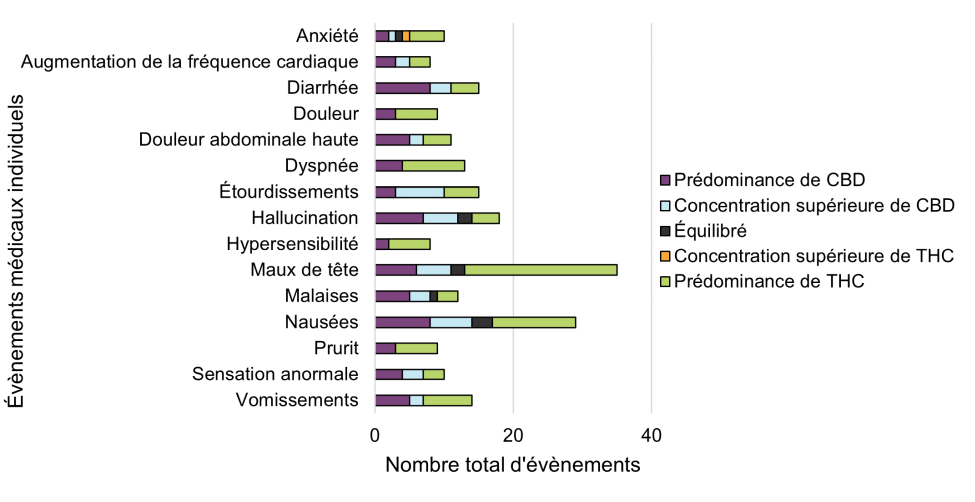
Figure 10 - Équivalent textuel
| Événement médical individuel | Dominance du cannabinoïde | |||||
|---|---|---|---|---|---|---|
| Prédominance de CDB | Concentration supérieure de CBD | Équilibré | Concentration supérieure de THC | Prédominance de THC | Total général (hors cas non classés) | |
| Anxiété | 5 | 2 | 0 | 0 | 4 | 11 |
| Augmentation de la fréquence cardiaque | 2 | 1 | 1 | 1 | 5 | 10 |
| Diarrhée | 8 | 3 | 0 | 0 | 4 | 15 |
| Douleur | 3 | 7 | 0 | 0 | 5 | 15 |
| Douleur abdominale haute | 4 | 0 | 0 | 0 | 9 | 13 |
| Dyspnée | 4 | 3 | 0 | 0 | 3 | 10 |
| Étourdissements | 7 | 5 | 2 | 0 | 4 | 18 |
| Hallucination | 6 | 5 | 2 | 0 | 22 | 35 |
| Hypersensibilité | 3 | 2 | 0 | 0 | 3 | 8 |
| Maux de tête | 2 | 0 | 0 | 0 | 6 | 8 |
| Malaises | 5 | 3 | 1 | 0 | 3 | 12 |
| Nausées | 8 | 6 | 3 | 0 | 12 | 29 |
| Prurit | 3 | 0 | 0 | 0 | 6 | 9 |
| Sensation anormale | 3 | 0 | 0 | 0 | 6 | 9 |
| Vomissements | 5 | 2 | 0 | 0 | 7 | 14 |
Mises en garde :
- Cette figure porte sur les 15 principaux événements médicaux après stratification par dominance de cannabinoïdes. Cette figure exclut les cas n'ayant pas suffisamment d'informations pour l'attribution d'une dominance de cannabinoïde (c'est-à-dire non classés); par conséquent, les 15 premiers événements de cette figure peuvent différer de ceux observés dans la figure 9. D'autres événements médicaux individuels ont été signalés pendant la période de déclaration, mais ne font pas partie de cette figure.
- Cette figure a été créée manuellement par Santé Canada en classant chaque produit de cannabis suspect selon la dominance du cannabinoïde sur la base des détails disponibles sur le produit et en attribuant tous les événements médicaux individuels dans un cas à tous les produits de cannabis suspects signalés et leur dominance du cannabinoïde (pondérés de manière égale pour tous les événements). Par conséquent, cette façon de faire peut surestimer la corrélation entre la dominance du cannabinoïde et les événements médicaux individuels, et ne reflète pas la causalité.
Les données suivantes sont préliminaires, de nombreux événements ayant été signalés pour plus d'un type de produit du cannabis, et toute conclusion peut être limitée, certains événements médicaux semblent être plus fréquemment signalés avec des produits à prédominance de THC ou à concentration supérieure de THC, tandis que d'autres sont plus fréquemment signalés avec des produits à prédominance de CBD ou à concentration supérieure de CBD. Par exemple, les maux de tête et la dyspnée ont été plus fréquemment observés en rapport avec les produits à prédominance de THC, tandis que les étourdissements et la diarrhée ont été plus fréquemment signalés pour les produits à prédominance ou à concentration supérieure de CBD.
Il est important de noter qu'il s'agit uniquement d'événements médicaux rapportés et que d'autres facteurs peuvent contribuer à ces événements, notamment : l'âge et l'état de santé des patients (y compris les problèmes de santé préexistants et l'utilisation de médicaments concomitants); l'exposition antérieure au cannabis (par exemple, les consommateurs qui consomment du cannabis pour la première fois); le dosage; la voie d'administration; et la connaissance des effets du cannabis et des cannabinoïdes.
Figure 11: Raison principale de la déclaration (à l'échelle du cas)
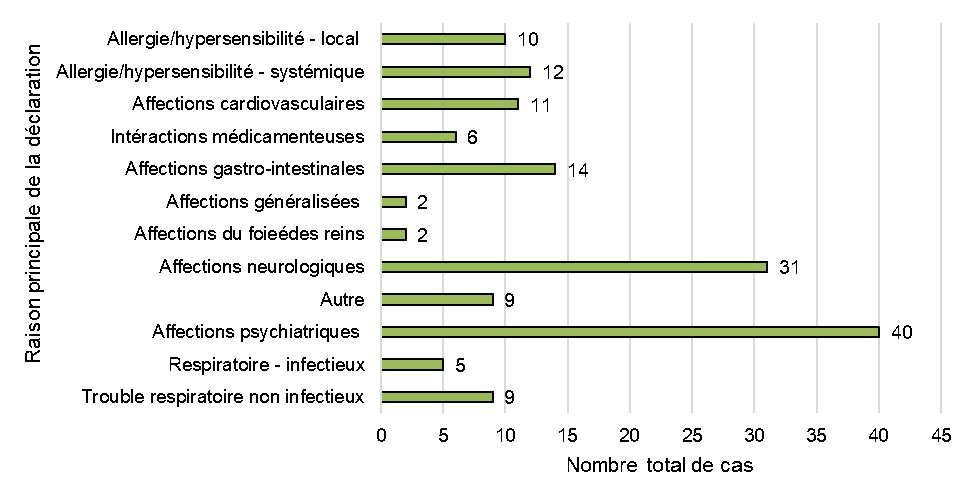
Figure 11 - Équivalent textuel
| Raison principale de la déclaration | Nombre total de cas |
|---|---|
| Allergie/hypersensibilité – local | 10 |
| Allergie/hypersensibilité – systémique | 12 |
| Affections cardiovasculaires | 11 |
| Interactions médicamenteuses | 6 |
| Affections gastro-intestinales | 14 |
| Affections généralisées | 2 |
| Affections du foie/des reins | 2 |
| Affections neurologiques | 31 |
| Autre | 9 |
| Affections psychiatriques | 40 |
| Respiratoire – infectieux (respiratoire, autre) | 5 |
| Troubles respiratoires non infectieux (irritation, etc.) | 9 |
| Total général | 151 |
Mises en garde :
- Cette figure a été créée manuellement en attribuant une raison principale (type d'événement médical) au cas en fonction des détails généraux du cas (y compris le compte rendu textuel), plutôt qu'en fonction de la fréquence de l'événement médical individuel extrait de tous les rapports de cas (tous les événements).
- Dans le cas où il y avait plusieurs raisons, l'événement le plus grave était sélectionné.
Comme décrit ci-dessus, la répartition des événements médicaux individuels par SOC est utile pour la présentation générale des données; cependant, elle n'est pas toujours suffisante pour représenter les conditions cliniques ou les événements qui peuvent avoir une incidence sur plusieurs systèmes (c'est-à-dire qui touchent à plusieurs SOC), ce qui est important pour la surveillance continue et la détection de nouveaux signaux d'innocuité. À ce titre, Santé Canada a aussi procédé à un examen manuel des détails des cas afin d'attribuer à chacun d'eux une raison principale de déclaration. Cela permet à Santé Canada de cibler et de mettre en évidence les cas présentant un intérêt sur le plan clinique qui peuvent toucher à plusieurs SOCNote de bas de page 6, ou qui peuvent s'inscrire dans des catégories généralisées de SOC peut-être moins précisesNote de bas de page 7, afin de faciliter la surveillance des signaux et la détermination des cas pour une évaluation plus approfondie. Selon cette méthodologie, les affections psychiatriques, neurologiques (système nerveux) et gastro-intestinales étaient la raison principale la plus fréquente de déclaration des cas, ce qui correspond aux SOC (selon la fréquence des événements médicaux individuels, décrits ci-dessus). Cependant, d'autres effets indésirables présentant un intérêt ont été déterminés, notamment les allergies ou l'hypersensibilité (systémiques et localisées) et les affections respiratoires (infectieuses et non infectieuses).
3.0 Évaluation clinique des cas graves et importants sur le plan médical
3.1 Résumé des effets indésirables graves et importants sur le plan médical
- Santé Canada a examiné tous les cas d'effets indésirables signalés comme graves, ainsi que ceux qui n'étaient pas graves, mais qui ont été jugés importants sur le plan médical (n = 88).
| Causalité attribuée | Nombre de cases |
|---|---|
| Certain | 0 |
| Probable | 12 |
| Possible | 61 |
| Improbable | 5 |
| Non évaluable | 10 |
| Total général | 88 |
- Dans l'ensemble, la causalité attribuer à la majorité des cas était « possible » (69 %, n = 61), ce qui signifie qu'il y avait une possibilité raisonnable que le produit du cannabis ait contribué à l'effet indésirable, mais que d'autres facteurs contributifs ne pouvaient être exclus (par exemple, médicaments concomitants, comorbidités, etc.).
- Dans 12 cas, la causalité a été qualifiée de « probable » (14 %), ce qui signifie qu'il y avait suffisamment de renseignements permettant de juger que le produit du cannabis avait probablement contribué à l'effet indésirable et que la contribution d'autres facteurs était considérée comme peu probable.
- Dix cas ont été jugés « non évaluables » (11 %), ce qui signifie que les renseignements disponibles étaient insuffisants ou contradictoires pour établir un lien de causalité.
- Dans cinq cas, la causalité a été qualifiée d'« improbable » (6 %), ce qui signifie que les facteurs en cause ont rendu la relation causale improbable ou qu'une autre cause claire a été déterminée.
- Parmi les 12 cas pour lesquels la causalité était « probable », il s'agissait de produits de cannabis séché utilisés par inhalation et de produits d'huile de cannabis utilisés par voie orale. Ces produits contenaient des concentrations variables de cannabinoïdes et d'autres ingrédients (par exemple des terpènes, des entraîneurs) et étaient tous utilisés à des fins médicales.
- Parmi les cas « probables », il y avait différentes raisons principales de déclaration, notamment : affections psychiatriques (n = 4); allergies ou hypersensibilités (systémiques et locales [n = 3]); affections du système nerveux (n = 2); interactions médicamenteuses (n = 2); et troubles hépatiques ou rénaux (n = 1).
3.2 Risques importants identifiés au cours de la période de déclaration
- Au cours de cette période de référence, un « nouveau » risque importantNote de bas de page 8 a été identifié par Santé Canada, celui d'un risque accru de saignement (augmentation du rapport international normalisé [RIN]) associé à une interaction entre les produits à base d'huile de cannabis « à prédominance de CBD » consommés par voie orale et la warfarine, un médicament anticoagulant. Ce signal a été considéré comme nouveau et n'avait pas été bien caractérisé auparavant; c'est pourquoi une évaluation approfondie (série de cas) qui comprenait un examen des rapports de cas d'effets indésirables, du pays et de l'étranger, ainsi que des données tirées de la littérature publiée (rapports de cas et littérature scientifique), a été réalisée.
- Il a été conclu qu'il existe un risque accru d'événements hémorragiques (augmentation du RIN) avec les produits du cannabis utilisés en combinaison avec la warfarine, probablement en raison d'une interaction pharmacocinétique, en particulier avec les produits du cannabis à prédominance de CBD consommés par voie orale. Il existe également un petit nombre de rapports de cas publiés d'interaction entre la warfarine et le cannabis inhalé (généralement à prédominance de THC) ainsi que les produits comestibles à base de cannabis; toutefois, les détails des produits faisaient souvent défaut. Les produits du cannabis ne sont pas des cannabinoïdes isolés purs; par conséquent, même avec des produits à prédominance de CBD ou de THC, les deux cannabinoïdes sont présents en concentrations variables et peuvent avoir un effet; la contribution d'autres cannabinoïdes est inconnue pour le moment. Un résumé de ce signal a été publié sous forme d'article dans le bulletin d'information de Santé Canada d'octobre 2020 InfoVigilance.
- D'autres cas graves ou importants sur le plan médical ayant une causalité « probable » ont été considérés comme des effets sur la santé qui ont déjà identifiés et, par exemple, décrits dans le document de Santé Canada Renseignements destinés aux professionnels de la santé. Notamment :
- l'hypersensibilité ou les réactions allergiques (par exemple les réactions d'hypersensibilité localisées ou systémiques telles que le prurit, l'urticaire, l'œdème, l'anaphylaxie)
- les réactions psychiatriques (par exemple, anxiété, hallucination)
- les réactions neurologiques (par exemple, maux de tête, étourdissements)
- les réactions gastro-intestinales (par exemple, nausées, vomissements, douleurs à l'estomac)
3.3 Risques potentiels importants pendant la période de déclaration
Les « risques potentiels importantsFootnote 9 » observés dans les données sur les effets indésirables des produits du cannabis au cours de la période de référence et qui continuent d'être surveillés sont les suivants :
- altérations des paramètres hématologiques (par exemple, diminution du taux d'hémoglobine, saignement incontrôlé sans médicament anticoagulant)
- altérations des paramètres de la glycémie
- altérations des paramètres du foie ou des reins (par exemple, augmentation des enzymes hépatiques)
- cannabis – interaction médicamenteuse avec le topiramate
- cannabis – interaction médicamenteuse avec le clobazam
3.4 Informations manquantes pendant la période de déclaration
Cette section met en évidence les risques potentiels identifiés sur une base préliminaire avec des informations disponibles limitées, et qui continuent à être surveillés.
- cannabis – interactions médicamenteuses avec des relaxants musculaires non précisés; cannabis et médicaments antidépresseurs non précisés
- cannabis (à prédominance de CBD) et possible endormissement soudain
- altérations des paramètres du système immunitaire; réactions cutanées graves liées au système immunitaire
4.0 Avis aux lecteurs
Les rapports d'effets indésirables associés au cannabis soumis à Santé Canada sont reçus et saisis dans la base de données de Canada Vigilance. La Direction des produits de santé commercialisés (DPSC) de la Direction générale des produits de santé et des aliments (DGPSA) recueille, surveille et analyse les effets indésirables soumis à la base de données de Canada Vigilance, entre autres activités, code et héberge les déclarations d'effets indésirables du cannabis. La Direction générale des substances contrôlées et du cannabis (DGSCC) est responsable de la surveillance, de la détection, de la hiérarchisation, de l'évaluation et de la préparation de rapports cumulatifs sur les effets indésirables associés au cannabis (pharmacovigilance).
Les déclarations volontaires du public peuvent être transmises par le biais du formulaire de déclaration en ligne, en composant le numéro sans frais ou en remplissant le formulaire à imprimer à transmettre par télécopie électronique ou par courrier à Santé Canada. Les rapports obligatoires sont soumis par les titulaires de licence afin de respecter leurs obligations réglementaires de déclaration des effets indésirables graves en vertu du Règlement sur le cannabis et sont soumis par télécopieur ou par courrier, à moins que l'entreprise ne soit enregistrée pour soumettre des rapports électroniques directement à la base de données de Canada Vigilance (un format particulier doit être respecté). Les plaintes relatives au cannabis et/ou les problèmes de qualité des produits peuvent également être transmis à l'aide du Formulaire de déclaration relative au cannabis de Santé Canada. Les incidents impliquant des accessoires de cannabis (par exemple, un problème ou une défaillance mécanique, physique ou électrique d'un accessoire de cannabis et les blessures associées) peuvent être signalés au moyen du Rapport d'incident concernant un produit de consommation - Formulaire à l'intention des consommateurs, disponible auprès de la Direction générale de la santé environnementale et de la sécurité des consommateurs.
Tous les cas d'effets indésirables liés au cannabis sont codés de la manière suivante :
- Les rapports de cas sont traduits en données électroniques dans la base de données de Canada Vigilance. Tous les événements médicaux individuels sont codés à l'aide du MedDRA, qui est élaboré, géré et mis à jour par la Conférence internationale sur l'harmonisation (ICH) pour fournir un ensemble international de termes médicaux normalisés en ce qui concerne les symptômes, les signes, les maladies, les syndromes et les diagnostics.
- Les rapports de cas concernant le cannabis en tant que substance dont le rôle est suspecté sont codés comme « cannabis sativa » pour ce qui est du principe actif, indépendamment du statut du produit de cannabis (légal, illégal, non précisé, indéterminé).
- Les rapports de cas concernant un produit de cannabis légal dans un rôle suspect (déterminé soit par le nom du produit, soit par le titulaire de licence) sont classés en fonction de l'utilisation prévue : produit de cannabis utilisé à des fins médicales (« cannabis médical ») ou utilisé à des fins non médicales (« cannabis non médical »), sur la base des renseignements contenus dans le rapport. Utilisation de cannabis à des fins médicales : Comprend les rapports dans lesquels il est indiqué que le consommateur détient un document d'autorisation médicale; ou, un but ou une indication médicale ou thérapeutique déclaré, sans mention d'un document d'autorisation médicale. Si le rapport ne mentionne pas de raison d'utilisation, ne donne que des détails minimaux ou si l'utilisation prévue est à des fins non médicales, le rapport est classé dans la catégorie « cannabis non médical ».
- Les rapports de cas sont codés comme aussi graves que la déclaration l'indique si au moins un critère de gravité est sélectionné : décès, danger pour la vie, admission à l'hôpital, séjour prolongé à l'hôpital, invalidité ou anomalie congénitale; grave – d'autres affections médicales importantes peuvent également être sélectionnées par le déclarant.
- Selon les lignes directrices internationales de pharmacovigilance (lignes directrices de l'ICHFootnote 10), les affections importantes sur le plan médical peuvent également être considérées comme graves dans certaines circonstances et sont donc une option à choisir lors de la déclaration d'effets indésirables à Santé Canada, et tout cas d'effets indésirables défini comme tel est examiné de manière approfondie. Toutefois, ces cas ne s'inscrivent techniquement pas dans la définition réglementaire d'un effet indésirable grave en vertu du Règlement sur le cannabis.
- La dominance des cannabinoïdes est une valeur attribuée par Santé Canada à chaque produit de cannabis suspect dans tous les cas, sur la base des renseignements disponibles. Dans le cas où les concentrations sont manquantes, en utilisant le nom du produit, les concentrations de cannabinoïdes sont vérifiées en fonction des renseignements en ligne sur le site Web du titulaire de licence, les sites Web des magasins provinciaux, ou d'autres ressources accessibles. Dans le cas où un produit ne peut être déterminé (par exemple, huile de cannabis inconnue par le titulaire de la licence) et que les concentrations de cannabinoïdes ne sont pas rapportées, la dominance des cannabinoïdes est alors attribuée comme « non évaluable ».
Les critères utilisés pour attribuer la dominance des cannabinoïdes sont les suivants :
- « Prédominance de THC » : rapport THC : CDB supérieur à 1,5:1
- « THC en concentration supérieure » : rapport THC : CDB entre 1,5:1 et 1,2:1
- « Équilibré » : rapport THC : CBD entre 1,2:1 et 1:1,2
- « CBD en concentration supérieure » : rapport THC : CDB comprit entre 1:1,2 et 1:1,5
- « Prédominance de CBD » : rapport THC : CBD supérieur à 1:1,5
Santé Canada effectue une surveillance systématique, une détection, une évaluation et des activités connexes pour toutes les déclarations d'effets indésirables, ce qui comprend :
- Examen de tous les nouveaux rapports de cas de cannabis pour vérifier qu'ils sont correctement codés selon le MedDRA, qu'ils sont classés comme cannabis à des fins médicales ou non médicales (classes légales) et que les noms des produits sont exacts.
- Les cas de non-conformité suspectée (c'est-à-dire présence visible de moisissure, goût métallique, odeur inhabituelle, etc.) sont transmis à la Direction de la conformité pour vérification.
- Les rapports non graves sont examinés par Santé Canada et ceux qui sont considérés comme des événements importants sur le plan médical sont inclus pour une évaluation plus approfondie (évaluation de la causalité).
- Tous les cas graves et importants sur le plan médical font l'objet d'une enquête et d'une évaluation plus approfondies :
- un suivi est effectué pour obtenir des renseignements supplémentaires sur les détails du produit ou les détails cliniques des cas afin de faciliter l'évaluation ;
- une évaluation superficielle de la causalité est effectuée pour tous les cas graves et importants sur le plan médical de routine ;
- tous les cas de décès ou mettant la vie en danger sont considérés comme des rapports prioritaires et font l'objet d'une évaluation individuelle complète de la causalité ;
- l'évaluation de la causalité est principalement fondée sur le système de causalité de l'Organisation mondiale de la Santé (Centre de surveillance d'Uppsala de l'Organisation mondiale de la Santé)
- Tous les cas concernant des effets indésirables nouveaux ou inattendus présentant un intérêt font l'objet d'une évaluation préliminaire afin de déterminer s'ils doivent faire l'objet d'une évaluation plus approfondie (hiérarchisation des signaux).
- Une évaluation de la série de cas (évaluation des signaux) est effectuée dans la situation d'un groupe de cas ou de cas connexes présentant de nouveaux effets indésirables d'intérêt. Ces évaluations complètes comprennent la détermination de la plausibilité biologique sur la base de la littérature publiée ainsi que des données nationales et internationales sur les effets indésirables (VigiBase de l'OMS).
5.0 Signaler un effet indésirable impliquant un produit de cannabis
Les titulaires de licence doivent déclarer les effets indésirables graves, conformément au Règlement sur le cannabis, impliquant un produit de cannabis et sont encouragés à signaler volontairement les effets indésirables non graves impliquant un produit de cannabis. Vous trouverez de plus amples informations dans le Document d'orientation relatif à la déclaration des effets indésirables à l'intention des titulaires de licence.
Les consommateurs et les professionnels de la santé sont encouragés à signaler toutes les effets indésirables liées à un produit de cannabis directement à la DGSCC. Les consommateurs et les professionnels de la santé peuvent également envoyer un rapport au titulaire de licence du produit de cannabis.
Déclarer un effet indésirable à Santé Canada
6.0 Nous joindre
Tout commentaire ou toute question sur ce rapport, y compris toute demande concernant les données utilisées à l'appui de ce rapport, doit être adressé à cannabis_oss-cannabis_bss@hc-sc.gc.ca.
Notes de bas de page
- Note de bas de page 1
-
En vertu de la Loi sur le cannabis et ses règlements, les adultes sont autorisés à cultiver légalement jusqu'à quatre plantes de cannabis au maximum. Cela s'ajoute aux plantes qui peuvent être autorisées pour une production personnelle et désignée à des fins médicales. Toutefois, les règles entourant la culture à domicile à des fins non médicales peuvent varier en fonction des règles et règlements de chaque province ou territoire.
- Note de bas de page 2
-
Période prolongée jusqu'à la fin de l'année civile pour les besoins de ce rapport de la phase 1.
- Note de bas de page 3
-
Conformément à l'article 248 du Règlement sur le cannabis, tous les effets indésirables, y compris les effets indésirables non graves, doivent être consignés dans un rapport de synthèse annuel par le titulaire de licence, dont Santé Canada peut demander la communication à tout moment.
- Note de bas de page 4
-
Organisation mondiale de la Santé (2012). Safety monitoring of medicinal products. Reporting system for the general public. Disponible ici : https://www.who.int/publications/i/item/9789241503198 (en anglais seulement)
- Note de bas de page 5
-
Les catégories à prédominance de CBD, à concentration supérieure de CBD, à prédominance de THC, à concentration supérieure de THC et équilibrée ont été attribuées manuellement par Santé Canada. Veuillez vous référer à l'annexe 1 : Avis aux lecteurs pour plus de détails
- Note de bas de page 6
-
Par exemple, les allergies ou réactions d'hypersensibilité comprennent généralement plusieurs SOC, y compris la SOC des affections de la peau et du tissu sous-cutané, la SOC des affections du système immunitaire, et peuvent en toucher d'autres comme la SOC des affections cardiaques, la SOC des investigations et la SOC des affections gastro-intestinales en cas d'anaphylaxie.
- Note de bas de page 7
-
Par exemple, l'interaction médicamenteuse est classée dans la SOC « troubles généraux et anomalies au site d'administration ».
- Note de bas de page 8
-
Risque pour lequel il existe des données probantes suffisantes pour démontrer un lien.
- Note de bas de page 9
-
Risque pour lequel on soupçonne un lien, sans qu'il y ait confirmation sur la base de renseignements actuels, et qui nécessite une surveillance continue.
- Note de bas de page 10
-
https://www.ema.europa.eu/en/documents/scientific-guideline/international-conference-harmonisation-technical-requirements-registration-pharmaceuticals-human-use_en-12.pdf (en anglais seulement)