Faits saillants sur les produits de santé 2021 : Médicaments à usage vétérinaire
Sur cette page
- Message de la directrice générale
- Études expérimentales
- Nouveaux médicaments à usage vétérinaire autorisés
- Le Programme de distribution de médicaments d’urgence
- Vigilance après la mise en marché
- Réponse à la résistance antimicrobienne liée à l’utilisation d’antimicrobiens chez les animaux
- Établir des partenariats
- Améliorer notre approche réglementaire
Message de la directrice générale
L’un des rôles de Santé Canada est de réglementer les médicaments à usage vétérinaire qui jouent un rôle important dans la protection de la santé humaine et animale. Nous évaluons et surveillons l’innocuité, la qualité et l’efficacité des médicaments à usage vétérinaire. Ce faisant, nous travaillons à protéger les animaux et l’approvisionnement alimentaire du Canada.
Cette année, nous avons continué de faire progresser les travaux sur plusieurs priorités clés. Une de ces priorités est la mise en œuvre d’un projet pilote portant sur les produits de santé vétérinaires qui peuvent être utilisés dans la nourriture des animaux de ferme. En partenariat avec l’Agence canadienne d’inspection des aliments, cette initiative offre des outils supplémentaires pour maintenir la santé et le bien-être des animaux et pourrait contribuer à réduire le besoin d’utiliser régulièrement des antimicrobiens.
Nous avons également continué notre suivi et notre analyse des données de ventes d’antimicrobiens vétérinaires afin de mieux appuyer les efforts de surveillance. Cette année marque la troisième année de rapport sur les ventes, avec ses principaux résultats qui dressent un portrait complet des antimicrobiens disponibles pour usage vétérinaire, divisés par espèce, province ou territoire. Ces rapports annuels jouent un rôle clé dans notre programme de surveillance de la résistance aux antimicrobiens et dans nos efforts de bonne gestion.

Directrice générale,
Médicaments vétérinaires
Études expérimentales
Nous examinons des présentations pour permettre aux promoteurs et aux chercheurs de mener des études sur les médicaments à usage vétérinaire au Canada. Les essais de nouveaux médicaments vétérinaires (appelés drogues nouvelles de recherche et études expérimentales) appuient l’accès à de nouveaux médicaments à usage vétérinaire dans l’avenir. En 2021, nous avons autorisé 125 études expérimentales appuyant les essais cliniques ou les activités de recherche.
Nouveaux médicaments à usage vétérinaire autorisés
Lorsqu’un fabricant décide de commercialiser un médicament vétérinaire au Canada, il dépose auprès de Santé Canada, une présentation qui contient des renseignements scientifiques détaillés sur l’innocuité, l’efficacité et la qualité du médicament. Ces présentations sont examinées par nos scientifiques afin d’évaluer les avantages et les risques pour la santé humaine et animale. Nos scientifiques s’assurent également de faire en sorte que les étiquettes des médicaments vétérinaires comportent un mode d’emploi et des mises en garde clairs.
En 2021, nous avons autorisé six médicaments pour les animaux domestiques ou élevés pour la consommation. Cela a permis à nos intervenants d’avoir un meilleur accès aux nouveaux produits et nouvelles thérapies innovants qui maintiennent et améliorent la santé des animaux. Nous avons également autorisé 13 nouveaux médicaments génériques pour offrir des options plus rentables en matière de prévention et de traitement.
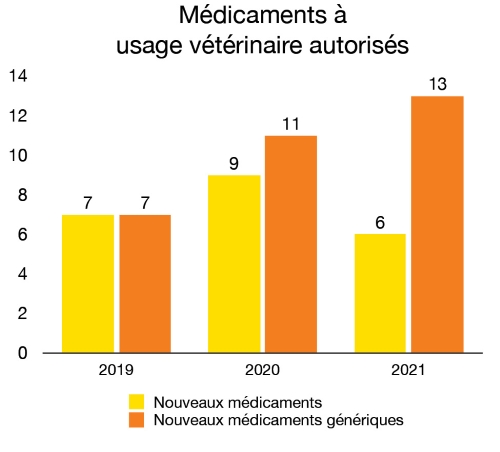
Figure 9 - Équivalent textuel
| Année | Nouveaux médicaments autorisés | Nouveaux médicaments génériques autorisés |
|---|---|---|
| 2019 | 7 | 7 |
| 2020 | 9 | 11 |
| 2021 | 6 | 13 |
Nous avons autorisé les deux premiers produits contenant des anticorps monoclonaux comme médicaments vétérinaires. Les deux produits, Librela et Solensia (Zoetis), sont indiqués pour le traitement de la douleur causée par l’arthrose chez les chiens et les chats respectivement. Les méthodes pour réduire la douleur autres que les anti-inflammatoires non stéroïdiens (AINS) intéressent les propriétaires d’animaux de compagnie vieillissants puisque ceux-ci peuvent être sensibles aux effets des AINS sur les reins, le foie et le système gastro-intestinal.
Afin de permettre aux promoteurs d’envoyer facilement et en toute sécurité leurs présentations de médicaments à usage vétérinaire, toutes les présentations se font électroniquement soit par l’entremise du processus d’inscription réglementaire, soit par le biais de nouveaux outils comme le Secure File Transfer Protocol. De plus, la Base de données sur les produits pharmaceutiques, qui contient des renseignements spécifiques pour les produits désinfectants, les médicaments à usage vétérinaire et à usage humain autorisés pour utilisation au Canada, a été mise à jour afin de permettre la recherche de produits par espèce. Cette mise à jour est particulièrement utile pour les professionnels de la santé vétérinaire et les producteurs qui désirent savoir quels médicaments sont disponibles pour traiter des animaux précis.
Le Programme de distribution de médicaments d’urgence
Les vétérinaires peuvent, par l’entremise de notre Programme de distribution de médicaments d’urgence (DMU), demander l’accès à des médicaments à usage vétérinaire, qui ne sont pas disponibles au Canada, pour répondre à des situations d’urgence. Les vétérinaires peuvent demander l’accès à des médicaments pour traiter des patients (un animal ou un groupe d’animaux) souffrant de conditions médicales graves ou mettant leur vie en danger. L’accès à ces médicaments n’est envisagé que lorsque les thérapies conventionnelles ont échoué, ne sont pas adéquates ou disponibles. En 2021, 333 demandes ont été autorisées dans le cadre du Programme de distribution de médicaments d’urgence.
Santé Canada a continué de mettre en œuvre les changements apportés au Règlement sur les aliments et drogues en octobre 2020 qui ont pour but de réduire au minimum le fardeau associé à l’accès à des médicaments vétérinaires non autorisés. Il s’agissait notamment de travailler à simplifier ce processus pour les vétérinaires. De plus, nous avons travaillé avec les fabricants pour permettre l’importation et le stockage précoces dans les installations canadiennes. Ce processus, également appelé « prépositionnement », facilite la distribution immédiate d’un médicament une fois autorisé, le rendant ainsi disponible dès que possible.
Vigilance après la mise en marché
Après avoir autorisé un médicament pour la vente au Canada, nous continuons de surveiller et d’évaluer les réactions indésirables soupçonnés des médicaments à usage vétérinaire. Ceci permet d’améliorer l’accès à l’information destiné aux propriétaires d’animaux, aux professionnels de la santé vétérinaire et aux fabricants de médicaments. Le formulaire de déclaration des effets indésirables a été mis à jour en incluant des renseignements plus clairs et plus complets dans le but d’améliorer sa facilité d’utilisation. Un nouveau formulaire de déclaration de réactions indésirables, plus accessible et facile à remplir en format PDF, a été créé et mis à la disposition du public le 15 juillet 2021. Ceci devrait faciliter la déclaration des réactions indésirables.
Réponse à la résistance antimicrobienne liée à l’utilisation d’antimicrobiens chez les animaux
La résistance antimicrobienne est une menace croissante pour la santé publique au Canada et dans le monde. La surutilisation et le mauvais usage des médicaments antimicrobiens permettent aux germes pathogènes comme les bactéries et les champignons d’évoluer et de devenir résistants aux antimicrobiens.
L’utilisation des médicaments antimicrobiens chez les animaux peut contribuer au développement et à la propagation de bactéries résistantes aux antimicrobiens chez les humains. L’approche « Une seule santé » reconnaît l’interconnexion entre la santé des humains, des animaux et de leur environnement commun, ainsi que la nécessité d’une collaboration entre les secteurs pour améliorer la santé pour tous. En 2021, Santé Canada a continué de mettre l’accent sur ses initiatives relatives à la résistance aux antimicrobiens des médicaments vétérinaires, afin de réduire l'utilisation systématique des antimicrobiens et de promouvoir leur utilisation responsable lorsqu'ils sont nécessaires.
Par exemple, en août 2021, en collaboration avec l’Agence de la santé publique du Canada, nous avons publié le Rapport sur les points saillants des ventes d’antimicrobiens vétérinaires de 2019. Ce rapport est le deuxième sur les ventes qui appuie nos programmes de surveillance et de bonne gestion des antimicrobiens. Ce rapport annuel fournit un tableau complet des antimicrobiens disponibles en 2019 pour usage vétérinaire, divisés par espèce et par province ou territoire.
En gardant les animaux en santé, nous pouvons réduire la nécessité de recourir aux médicaments, incluant les antimicrobiens. Au cours de la dernière année, en partenariat avec l’Agence canadienne d’inspection des aliments, nous avons mis en œuvre un projet pilote portant sur les produits de santé vétérinaire qui peuvent être mélangés à l’alimentation des animaux de ferme. En 2021, 12 produits ont été notifiés à travers l’application Web sur les produits de santé vétérinaire qui sont autorisés pour utilisation dans l’alimentation des animaux de ferme à titre de projet pilote provisoire. Cette initiative permet l’accès à des outils supplémentaires pour maintenir la santé et le bien-être des animaux.
Nous avons également fait d’importantes mises à jour en ligne de la Liste C, qui énumère les substances autorisées pour la fabrication des produits de santé animale. En 2021, 97 nouvelles substances ont été ajoutées et 106 modifications ont été apportées aux listes actuelles, y compris les substances utilisées pour un certain nombre d’espèces comme les poissons à nageoires et les bovins laitiers. En décembre 2021, la Liste C comprenait un total de 781 substances actives, dont près de 300 pour les animaux destinés à l’alimentation. L’augmentation du nombre de substances crée davantage de possibilités pour l’industrie de commercialiser un plus large éventail de produits à l’appui de la santé animale. En 2021, un total de 496 produits de santé vétérinaires a été notifié par l’entremise du programme de notification des produits de santé animale.
Établir des partenariats
En 2021, Santé Canada a continué de travailler en étroite collaboration avec les intervenants nationaux et les organismes de réglementation à travers le monde sur les questions liées aux médicaments à usage vétérinaire. Ces efforts sont pour appuyer un accès élargi aux options de traitement pour les animaux au Canada tout en réduisant le fardeau réglementaire pour l’industrie.
Nous avons poursuivi nos examens des médicaments vétérinaires simultanés en partenariat avec le Center for Veterinary Medicine de la Food and Drug Administration des États-Unis, ainsi qu’en collaboration avec l’Australie et la Nouvelle-Zélande.
En janvier 2021, le Canada et le Royaume-Uni ont également publié une nouvelle ligne directrice sur les processus d’examen simultané des présentations de médicaments vétérinaires pour favoriser la coopération en matière de réglementation. Cette collaboration crée des occasions pour les fabricants d’accéder simultanément à deux marchés importants, ce qui aide à élargir les options de traitement pour les animaux et à appuyer les producteurs alimentaires en matière de compétitivité à l’échelle mondiale.
Pleins feux sur… L’examen simultané avec le Royaume-Uni
En se basant sur d’autres succès de collaboration internationale en matière de médicaments vétérinaires, Santé Canada a fait progresser le processus d’examen simultané des présentations avec le Royaume-Uni. En 2021, Santé Canada a commencé son premier examen simultané avec le Royaume-Uni. La Ligne directrice relative au processus d’examen simultané des présentations de médicaments vétérinaires avec le Royaume-Uni a également été publiée et elle décrit le processus d’examen simultané des médicaments vétérinaires.
Améliorer notre approche réglementaire
Innovation réglementaire
Attribution agile des homologations de médicaments
En 2021, nous avons publié un avis d’intention dans la Gazette du Canada informant les intervenants des plans de modifications du Règlement sur les aliments et drogues. Ces modifications prévues donneraient au ministre de la Santé la possibilité d’imposer des conditions aux autorisations de médicaments pour favoriser la surveillance des produits au moment de l’autorisation et après la mise en marché. Les modifications proposées créeraient également une voie alternative pour les présentations en continu. Cette voie pourrait faciliter l’accès en temps opportun aux médicaments vétérinaires qui traitent les maladies infectieuses nouvelles et émergentes importantes, ainsi que pour le traitement, la prévention ou le diagnostic de maladies ou de conditions médicales graves ou gravement débilitantes.
Pleins feux sur… Le rôle de Santé Canada dans la salubrité des aliments
L’évaluation de l’innocuité des médicaments vétérinaires utilisés chez les animaux destinés à l’alimentation des humains contribue à garantir que les aliments dérivés d’animaux traités par ces médicaments sont sans danger pour les humains. Les promoteurs de produits doivent fournir à Santé Canada les données scientifiques ou les renseignements pertinents nécessaires pour démontrer que les résidus du médicament pour usage vétérinaire dans les tissus comestibles des animaux traités sont sans danger pour la consommation humaine. Santé Canada établit des normes de salubrité des aliments sous la forme de limites maximales de résidus. Celles-ci correspondent à des niveaux de résidus qui pourraient demeurer sans danger dans le tissu ou le produit alimentaire dérivé d’un animal qui a été traité avec un médicament à usage vétérinaire. En 2021, Santé Canada a mené une consultation pour établir des limites maximales de résidus pour 6 nouveaux médicaments et elles seront ajoutées à la Liste des limites maximales de résidus de drogues pour usage vétérinaire dans les aliments au début de 2022.