Faits saillants sur les produits de santé 2021 : Instruments médicaux
Sur cette page
- Message des directeurs généraux
- Essais expérimentaux (essais cliniques)
- Nouveaux instruments médicaux autorisés
- Programme d’accès spécial
- Vigilance après la mise en marché
- Transparence du processus décisionnel
- Établir des partenariats
- Améliorer notre approche réglementaire
Message des directeurs généraux
L’un des rôles de Santé Canada est de réglementer les instruments médicaux qui peuvent aider les Canadiens à maintenir et à améliorer leur santé. Les instruments médicaux sont utilisés pour le traitement, le diagnostic ou la prévention de maladies ou bien répondre à un besoin de santé physique. Au Canada, les instruments médicaux sont classés en quatre groupes, selon le niveau de risque associé à leur utilisation. Ces groupes sont appelés des « classes » et sont numérotés de I à IV. Les instruments de classe I sont considérés comme des instruments à faible risque. Il peut s’agir, par exemple, d’un fauteuil roulant. Les instruments de classe IV sont ceux qui présentent le plus grand risque, par exemple, un défibrillateur.
En 2021, Santé Canada a continué à accorder la priorité à sa réponse à la pandémie de COVID-19, tout en faisant progresser les priorités clés non liées à la COVID. Nous avons notamment fait des efforts pour augmenter le nombre d’instruments d’autodépistage de la COVID-19 disponibles sur le marché canadien. Le rythme auquel le variant Omicron s’est répandu à travers le monde a renforcé l’importance de ces instruments, qui aident à ralentir la transmission en permettant aux individus de déterminer rapidement s’ils sont infectés. Plus de 115 instruments de dépistage de la COVID-19 sont maintenant disponibles au Canada, et, il y en a d’autres en cours d’élaboration.
Nous avons également effectué une analyse active des nouveaux produits liés à la COVID-19. Ceci a permis de rechercher et d’encourager les présentations de technologies innovantes et importantes qui autrement n’auraient peut-être pas été déposées au Canada.
En s’appuyant sur les progrès réalisés dans le cadre du Plan d’action sur les instruments médicaux, Santé Canada fait progresser les changements réglementaires dans le cadre de l’initiative d’attribution agile des homologations. Un avis d’intention a été publié en 2021. Dans celui-ci, nous décrivons nos plans de modifier le Règlement sur les aliments et drogues et le Règlement sur les instruments médicaux afin de promouvoir une plus grande agilité réglementaire. La capacité accrue d’utiliser les conditions liées aux homologations d’instruments médicaux favorisera une surveillance appropriée de ces instruments tout au long de leur cycle de vie.
Bien que nous avançons dans notre réponse à la COVID-19 et que nous faisons progresser d’autres priorités clés, nous continuerons de mettre la santé et la sécurité des personnes au Canada en avant-plan en appuyant l’innovation et l’amélioration des solutions réglementaires.

Directeur général,
Instruments médicaux

Directrice générale,
Produits de santé commercialisés
Essais expérimentaux (essais cliniques)
Les essais cliniques sont menés par les promoteurs (fabricants ou importateurs) pour recueillir des renseignements sur l’innocuité et l’efficacité d’un instrument médical chez l’être humain. Les promoteurs d’essais expérimentaux (essais cliniques) soumettent leurs demandes. Santé Canada les examine avant que les essais soient menés au Canada. De nouveaux essais cliniques signifient que les personnes vivant au Canada pourraient avoir accès à des instruments plus innovants. En 2021, 140 nouvelles demandes d’autorisation d’essais expérimentaux pour des instruments médicaux ont été autorisés.
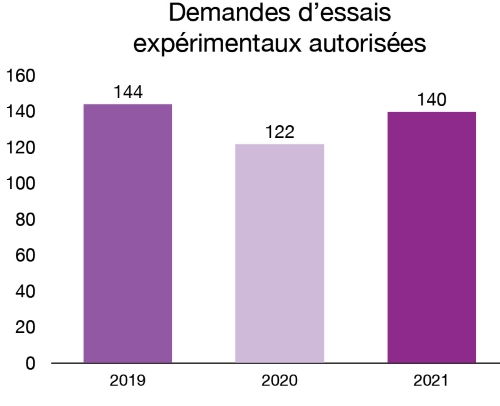
Figure 4 - Équivalent textuel
| Année | Demandes d’essais expérimentaux autorisées |
|---|---|
| 2019 | 144 |
| 2020 | 122 |
| 2021 | 140 |
Nous avons permis la mise à l’essai de nouveaux instruments médicaux liés à la COVID-19, y compris des trousse d’instruments de dépistage, des instruments de surveillance physiologique et des instruments liés à la thérapie respiratoire.
Nous avons également autorisé des essais expérimentaux pour de nouveaux instruments utilisés lors de certaines interventions chirurgicales de nature cardiovasculaire, ainsi que pour un appareil d’imagerie par résonance magnétique au point de service qui sera employé pour les régions éloignées. Cet appareil permet aux professionnels de la santé d’effectuer l’imagerie là où se trouvent les patients, au lieu d’exiger qu’ils se rendent dans de grands centres hospitaliers ou cliniques.
Nouveaux instruments médicaux autorisés
Dans le cadre de sa mission d’aider les Canadiens à maintenir et à améliorer leur santé, Santé Canada évalue les instruments médicaux avant et après leur arrivée sur le marché canadien. Santé Canada s’investit tout au long du cycle de vie d’un instrument médical. Ce cycle comprend les essais expérimentaux et une fois que l’instrument est vendu au Canada.
En 2021, nous avons homologué 272 nouveaux instruments médicaux de classe III et 45 nouveaux instruments médicaux de classe IV. Ces nouveaux instruments offrent aux patients et aux professionnels de la santé des nouvelles options innovantes pour le traitement, la prévention et le diagnostic de divers problèmes de santé. Par exemple, en 2021, nous avons homologué le premier implant médical fabriqué au Canada avec une imprimante 3D. La technologie utilisée permet de fabriquer une prothèse de mâchoire personnalisée et adaptée à l’anatomie de chaque patient. Veuillez consulter l’annexe pour obtenir la liste et la description des nouveaux instruments médicaux de classe IV autorisés en 2021.
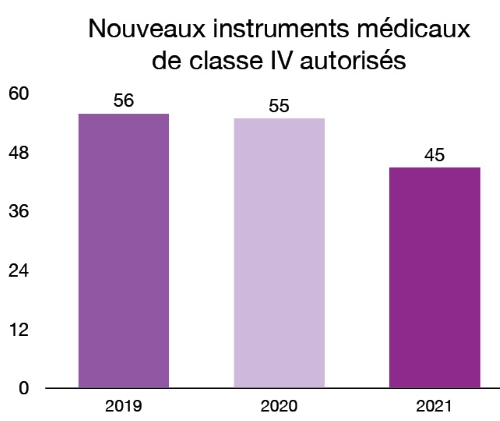
Figure 5 - Équivalent textuel
| Année | Nouveaux instruments médicaux de classe IV autorisés |
|---|---|
| 2019 | 56 |
| 2020 | 55 |
| 2021 | 45 |
En 2021, nous avons accordé la priorité à l’examen des demandes d’autorisation d’essais expérimentaux pour des instruments médicaux en lien avec la santé publique. Nous avons autorisé 55 instruments de dépistage liés à la COVID-19. Il s’agissait entre autres d‘instruments destinés aux populations asymptomatiques, du premier instrument d’auto dépistage rapide pour utilisation à domicile et des instruments de nature multiplex qui peuvent être utilisés pour diagnostiquer simultanément d’autres virus et celui de la COVID-19.
De plus, à la suite d’un examen et d’une recommandation de Santé Canada, nous avons autorisé la vente de dix ventilateurs et élargi l’usage prévu pour certains holters glycémiques afin d’inclure les femmes enceintes. Les holters glycémiques permettent aux fournisseurs de soins de santé de consulter à distance les données de glucose des patients et de faciliter des visites de cliniques virtuelles. Ils ont aidé à réduire la nécessité de visites en personne pour les femmes enceintes qui ont été identifiées comme présentant un risque plus élevé de complications liées à la COVID-19.
Programme d’accès spécial
Grâce au programme d’accès spécial, nous accordons aux professionnels de la santé l’accès à des instruments personnalisés et à des instruments médicaux non homologués pour une utilisation d’urgence ou lorsque les thérapies conventionnelles ont échoué, ne sont pas adéquates ou disponibles. En 2021, nous avons autorisé 3 121 demandes d’accès à des d’instruments médicaux dans le cadre de ce programme.
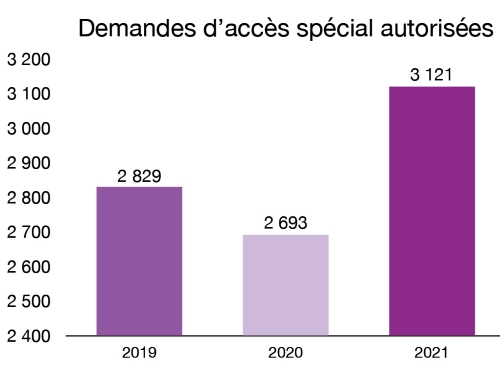
Figure 6 - Équivalent textuel
| Année | Demandes d’accès spécial autorisées |
|---|---|
| 2019 | 2829 |
| 2020 | 2693 |
| 2021 | 3121 |
Vigilance après la mise en marché
Une fois qu’un instrument médical est autorisé et disponible pour la vente au Canada, nous continuons de surveiller son utilisation dans la population canadienne. Nous évaluons les problèmes potentiels d’innocuité et d’efficacité, et nous prenons des mesures au besoin. Ces mesures peuvent comprendre de transmettre de nouveaux renseignements relatifs à l’innocuité aux personnes au Canada et aux professionnels de la santé, de demander la modification d’étiquettes, ou de confirmer notre compréhension actuelle de l’instrument en recommandant des mesures de conformité. À titre d’exemple, nous avons mis en œuvre des changements complets à l’étiquetage pour les implants mammaires semblables à ceux exigés par la Food and Drug Administration des États-Unis.
En 2021, nous avons reçu 39 601 rapports d’incidents liés aux instruments médicaux et nous avons entrepris cinq actions liées aux instruments médicaux. Ces actions ont suivi l’entrée en vigueur, en décembre 2019, du règlement exigeant que les hôpitaux déclarent les effets indésirables graves liés aux médicaments et les instruments médicaux. Depuis l’entrée en vigueur du règlement, nous avons constaté une augmentation du nombre de rapports d’incidents relatifs aux instruments médicaux reçus. Nous en avons reçu près de 1 200 en 2021 seulement. Ces rapports aident Santé Canada à prendre des mesures par rapport aux produits qui peuvent présenter un risque pour la santé et la sécurité des personnes au Canada.
En 2021, nous avons continué de surveiller l’innocuité et l’efficacité des instruments médicaux liés à la COVID-19 et nous avons pris des mesures au besoin pour protéger les personnes au Canada. Ces actions incluaient la prise de mesures proactives pour identifier les incidents liés à la COVID-19 et la collaboration avec les partenaires gouvernementaux pour surveiller les détaillants et les publicités qui font des déclarations fausses, trompeuses ou illégales liées à la COVID-19. Nous avons travaillé en étroite collaboration avec des partenaires nationaux et internationaux et nous avons publié des communications sur les risques potentiels liés à l’innocuité et l’efficacité des instruments. Il s’agit, par exemple, d’un avis sur les limites et les pratiques exemplaires afin d’assurer des lectures exactes lors de l’utilisation des thermomètres infrarouges sans contact.
Les nouvelles dispositions réglementaires relatives à la surveillance et à la gestion des risques des instruments médicaux après leur mise en marché sont entrées en vigueur en 2021. Elles appuient davantage une approche de cycle de vie de la réglementation des instruments médicaux en renforçant les pouvoirs de surveillance après la mise en marché. Nous avons publié des lignes directrices pour informer les fabricants de comment se conformer aux nouvelles dispositions réglementaires relatives à la notification des risques survenus à l’étranger, aux analyses liées à un sujet de préoccupation et aux rapports de synthèse pour les instruments médicaux homologués. Ensemble, ces mesures contribueront à réduire les risques associés aux instruments médicaux et à améliorer leur innocuité, leur efficacité et leur qualité.
Transparence du processus décisionnel
En 2021, nous avons continué nos efforts d’ouverture et de transparence en augmentant la quantité d’informations réglementaires sur la santé et l’innocuité qui sont mises à la disposition des personnes au Canada.
Nous avons publié 2 100 pages de renseignements cliniques au sujet de 13 instruments médicaux sur notre portail de renseignements cliniques. Ces informations cliniques sont fournies par les promoteurs lorsqu’ils demandent l’autorisation de vendre un instrument médical au Canada.
Nous avons également publié des résumés de nos examens de l’innocuité décrivant les problèmes potentiels d’innocuité pour les amalgames dentaires et les lentilles cornéennes en 2021. Ces résumés complètent d’autres informations relatives à l’innocuité pour aider les personnes au Canada à prendre des décisions éclairées par rapport aux instruments médicaux.
Le Programme Canada Vigilance recueille des données sur les effets indésirables soupçonnés des médicaments et sur les incidents liés aux instruments médicaux. Pour les instruments médicaux, les données sur les incidents et les rappels sont rendues publiques par l’entremise de la Base de données sur les incidents liés aux matériaux médicaux et sont mises à jour sur une base trimestrielle.
Établir des partenariats
Nous avons continué de collaborer avec nos partenaires internationaux, ainsi qu’avec l’Organisation mondiale de la Santé, afin d’harmoniser les stratégies de réglementation et de communication et les directives sur la gestion des instruments médicaux. En 2021, nous avons participé à des discussions sur des questions d’innocuité et de qualité en lien avec plusieurs instruments médicaux relatifs à la COVID-19, y compris des respirateurs, des tests sérologiques et d’anticorps, des ventilateurs retraités et décontaminés, des masques et des écouvillons imprimés à l’aide d’imprimante 3D.
Dans le cadre de l’International Medical Device Regulators Forum – en anglais (IMDRF), Santé Canada a contribué à la rédaction des lignes directrices portant sur les expressions et les définitions des instruments médicaux adaptatifs basés sur l’apprentissage. Elle a également travaillé sur le processus de reconnaissance des organismes d’évaluation de la conformité qui effectuent des examens réglementaires. Les deux rapports ont été publiés en 2021. Nous poursuivons également notre travail avec le Adverse Events Working Group de l’IMDRF afin d’harmoniser les codes des patients et des appareils pour les rapports d’incidents liés aux instruments médicaux.
Dans le cadre du Conseil de coopération en matière de réglementation, Santé Canada a continué de travailler avec la Food and Drug Administration des États-Unis afin de mettre sur pied un programme d’examen unique des instruments médicaux. Ce programme vise à améliorer l’accès des patients aux instruments médicaux, à soutenir l’innovation et à renforcer l’élaboration de normes. À travers cette initiative, nous avons terminé un premier examen dans le cadre d’une validation de principe préalable au projet pilote pour l’instrument médical Affinity NT Oxygenator. Nous commencerons un deuxième examen simultané d’un cathéter angioplastique coronarienne transluminale percutanée en 2022.
Dans le cadre de notre réponse réglementaire à la COVID-19, nous avons travaillé en étroite collaboration avec des entreprises canadiennes de ventilateurs, l’Agence de la santé publique du Canada, Services publics et Approvisionnement Canada, Innovation, Sciences et Développement économique Canada et le Conseil national de recherches Canada, afin de fournir des conseils sur les exigences en matière de ventilateurs et le processus de demande. En plus, Santé Canada a travaillé avec les promoteurs en fournissant des conseils sur le processus d’autorisation des arrêtés d’urgence de Santé Canada. De plus, nous avons transmis les exigences de Santé Canada sur l’innocuité et l’efficacité à soumettre pour une autorisation d’arrêté d’urgence relativement aux ventilateurs.
Améliorer notre approche réglementaire
En 2021, nous avons veillé à ce que les personnes au Canada continuent de bénéficier de l’accès aux instruments médicaux nécessaires liés à la COVID-19 en préservant bon nombre des mesures flexibles clés utilisées dans le cadre de notre intervention réglementaire agile face à la pandémie.
En mars 2021, le ministre de la Santé a approuvé un deuxième arrêté d’urgence qui conservait la voie accélérée et les mesures réglementaires flexibles concernant l’importation et la vente d’instruments médicaux liés à la COVID-19. De plus, en mai 2021, le ministre de la Santé a approuvé un deuxième arrêté d’urgence qui conservait certaines mesures flexibles en matière d’essais cliniques d’instruments médicaux et de drogues en lien avec la COVID-19. Les connaissances tirées de ces mesures d’urgence ont renforcé l’importance d’être un organisme de réglementation agile. Nous continuerons d’utiliser ces connaissances recueillies au fur et à mesure que nous ferons progresser nos plans d’innovation réglementaire.
Innovation réglementaire
Modernisation de la réglementation portant sur les essais cliniques
En mai 2021, nous avons publié un document de consultation décrivant nos plans de moderniser la réglementation canadienne portant sur les essais cliniques dans le but d’améliorer l’accès à de nouvelles thérapies, tout en continuant d’assurer la sécurité des patients. Cette démarche a été menée en consultant des intervenants tout au long du printemps et de l’été. Le nouveau cadre contribuera à promouvoir les essais cliniques au Canada en créant un environnement qui appuie l’innovation sécuritaire. Les changements réglementaires proposés permettraient aux chercheurs indépendants et aux professionnels de la santé de mener des essais cliniques sur des instruments médicaux.
Voie pour les produits thérapeutiques de pointe
Tel que mentionné dans la section sur les médicaments pour usage humain, certains produits sont tellement innovants ou complexes qu’ils ont besoin d’une approche réglementaire différente. Nous les appelons « produits thérapeutiques de pointe ». En 2021, nous avons mis sur pied un groupe de référence externe pour aider à orienter les premières réflexions sur la démarche d’établir une voie réglementaire personnalisée pour les instruments médicaux adaptatifs basés sur l’apprentissage. Le but de ce groupe est de réunir des experts dans la matière afin de leur permettre de fournir leurs perceptions et de formuler des conseils fondés sur des données probantes en gérant, tout de même, efficacement les risques, les avantages et les incertitudes qui y sont liés. Nous continuerons de tenir compte des idées et des commentaires des intervenants à mesure que cette initiative avancera.
Attribution agile des homologations d’instruments médicaux
En 2021, nous avons publié un avis d’intention dans la Gazette du Canada informant les intervenants des plans d’améliorer le Règlement sur les instruments médicaux. Les modifications proposées contribueraient à une homologation plus adaptative pour les instruments médicaux et elles fourniraient à Santé Canada des outils réglementaires agiles pour protéger la santé et la sécurité des personnes au Canada. Les modifications prévues élargiraient la portée des conditions imposées au besoin lors de l’examen des présentations d’instruments médicaux afin d’aider à gérer les incertitudes liées aux avantages ou aux risques de l’instrument. Cette démarche s’appuierait sur notre expérience de l’utilisation des conditions dans le cadre de notre réponse à la COVID-19.
Plan d’action sur les instruments médicaux
En mai 2021, Santé Canada a publié un rapport d’étape du Plan d’action sur les instruments médicaux, qui décrit les activités menées pour améliorer l’innocuité et l’efficacité des instruments médicaux, y compris :
- consulter les comités consultatifs scientifiques de Santé Canada en ce qui concerne les produits de santé destinés aux femmes, les technologies de santé numériques et les instruments médicaux utilisés pour la santé cardiovasculaire;
- organiser quatre webinaires pour fournir de l’information sur le renforcement de la réglementation finalisée concernant la surveillance après la mise en marché des instruments médicaux.
De plus, d’autres règlements liés à la surveillance après la mise en marché sont entrés en vigueur en décembre 2021 et ils permettront à Santé Canada de mieux surveiller les instruments médicaux en utilisant des rapports de synthèse annuels ou biannuels préparés par le fabricant.
Pleins feux sur… L’innovation – instruments médicaux adaptatifs basés sur l’apprentissage
Les instruments médicaux adaptatifs basés sur l’apprentissage sont des outils hautement sophistiqués qui s’appuient sur l’intelligence artificielle pour apprendre et s’améliorer au fil du temps. Ils sont utilisés particulièrement en imagerie médicale. À l’heure actuelle, Santé Canada dispose de protocoles bien établis pour la surveillance des appareils dits traditionnels qui emploient des algorithmes statiques. Ces instruments médicaux dotés d’algorithmes adaptatifs ont le potentiel de révolutionner les soins de santé. En créant un processus sur mesure de produit thérapeutique de pointe pour permettre leur utilisation, les patients pourraient avoir accès à ces produits complexes et uniques dans leur genre.