Faits saillants sur les produits de santé 2021 : Médicaments à usage humain
Sur cette page
- Message des directeurs généraux
- Essais cliniques
- Nouveaux médicaments à usage humain autorisés
- Programme d’accès spécial
- Vigilance après la mise en marché
- Transparence du processus décisionnel
- Établir des partenariats
- Lutter contre la résistance aux antimicrobiens
- Améliorer notre approche réglementaire
Message des directeurs généraux
L’un des rôles de Santé Canada est de réglementer les médicaments qui peuvent aider les personnes au Canada à maintenir et à améliorer leur santé. Cette section portera sur les médicaments, y compris les médicaments sur ordonnance, les vaccins, le sang et le plasma destinés à l’usage humain. Santé Canada évalue les médicaments avant qu’ils atteignent le marché canadien et continue de surveiller les données probantes du monde réel après leur mise en marché. Nous intervenons tout au long du cycle de vie des médicaments à usage humain, c’est-à-dire des essais cliniques jusqu’à leur utilisation au Canada.
La pandémie de COVID-19 a créé un besoin urgent d’accès à des vaccins et des traitements sûrs, efficaces et de grande qualité. À la fin de l’année 2021, quatre vaccins contre la COVID-19 ont été autorisés pour utilisation au Canada. Notre travail sur les vaccins comprenait également des examens spécialisés pour assurer l’innocuité et l’efficacité des doses de rappel et une formulation pédiatrique pour les enfants de cinq à 12 ans. En 2021, nous avons également autorisé deux nouveaux traitements, ce qui nous a amené à quatre traitements contre la COVID-19 autorisés au total, incluant les présentations reçues en 2022. Nous avons accéléré l’examen de ces produits tout en maintenant nos normes scientifiques rigoureuses grâce à des outils réglementaires agiles, comme des présentations en continu, ainsi que la mobilisation et l’augmentation des ressources humaines au sein de Santé Canada.
Nous avons continué d’examiner les produits non liés à la COVID-19 afin d’assurer leur innocuité, leur efficacité et leur qualité, et ce, tout en faisant face à la pandémie. Nous avons continué de nous focaliser sur les populations issues de la diversité et les populations vulnérables comme les enfants. À titre d’exemple, en 2021, nous avons travaillé à améliorer l’accès aux traitements pour les maladies rares en approuvant dix nouveaux médicaments pour les maladies rares. Nous avons fait progresser la mise en œuvre du Plan d’action sur les médicaments pédiatriques afin d’accroître davantage l’accès aux médicaments pour les populations pédiatriques au Canada. Santé Canada a également appuyé l’accès à des traitements qui ne sont pas disponibles au Canada par l’entremise de notre Programme d’accès spécial.
Notre planification de la gestion des risques après la mise en marché commence à l’étape qui précède la mise en marché. Nous examinons les plans de gestion des risques qui contribuent à s’assurer que des mesures appropriées d’atténuation des risques et des incertitudes connus et potentiels sont en place. Ces plans de gestion des risques sont mis à jour au fur et à mesure que de nouveaux renseignements sur l’innocuité sont disponibles. Nous avons également amélioré nos activités de surveillance et d’évaluation des nouveaux enjeux en matière d’innocuité, y compris pour les produits liés à la COVID-19, tout en collaborant et en partageant de l’information avec nos partenaires au Canada et dans le monde.
En 2021, nous avons continué de voir les avantages de la déclaration obligatoire des effets indésirables graves des médicaments par les hôpitaux, qui a été mise en œuvre en 2019. Depuis l’entrée en vigueur de cette réglementation, le nombre de rapports d’effets indésirables graves soumis par les hôpitaux a augmenté de façon significative, avec 4 500 rapports uniquement en 2021. Ces rapports enrichissent nos connaissances après la mise en marché afin de réduire l’incertitude associée aux avantages et aux risques réels des produits thérapeutiques.

Directeur général,
Produits
thérapeutiques

Directrice générale,
Médicaments biologiques et
radiopharmaceutiques

Directrice générale,
Produits de santé
commercialisés
Essais cliniques
Les essais cliniques sont menés par les promoteurs (fabricants ou chercheurs) pour recueillir des renseignements sur l’innocuité et l’efficacité d’un médicament chez l’être humain. Les promoteurs d’essais cliniques doivent soumettre leurs demandes pour mener un essai clinique sur un médicament au Canada. Santé Canada examine ces demandes pour s’assurer que les essais sont bien conçus et que les participants ne sont pas exposés à un risque excessif.
En 2021, nous avons autorisé l’utilisation de médicaments expérimentaux dans 1 158 nouvelles demandes d’essais cliniques pour des médicaments. De ce nombre, 32 visaient des produits liés à la COVID (13 vaccins et 19 médicaments).
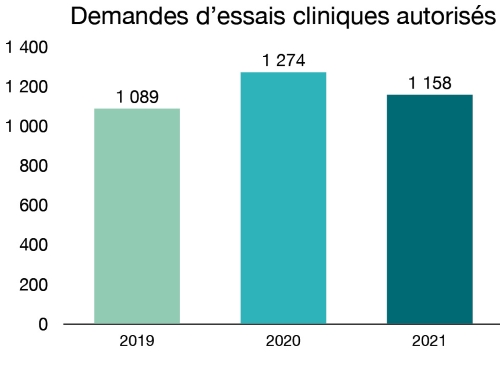
Figure 1 - Équivalent textuel
| Année | Année Nouveaux médicaments autorisés |
|---|---|
| 2019 | 1089 |
| 2020 | 1274 |
| 2021 | 1158 |
Les essais ont varié grandement quant au type, à la taille et au but. Par exemple, nous avons autorisé l’utilisation de produits expérimentaux dans le cadre d’un essai de phase II/III conçu pour évaluer rapidement plusieurs nouveaux produits susceptibles d’être des thérapies efficaces pour les patients atteints de la COVID-19 non hospitalisés.
Nous avons autorisé l’étude MOSAIC (en anglais), dirigée par le Canadian Immunization Research Network, qui examine l’innocuité et la réponse immunitaire lorsque l’on utilise différentes marques de vaccins contre la COVID-19 autorisés à différents intervalles de temps chez les adultes.
De plus, en mars 2021, le vaccin contre la COVID-19 à particules pseudo-virales de Medicago est passé à la phase III des essais cliniques. Ce vaccin était le premier vaccin fabriqué au Canada dans un essai de phase III. Il est également unique puisqu’il intègre une protéine d’origine végétale.
En novembre 2021, Santé Canada a autorisé l’utilisation du médicament expérimental ION582 en essai clinique ouvert à un stade précoce. Cet essai a été conçu pour évaluer l’innocuité et la tolérabilité des doses croissantes de ce médicament chez les patients atteints du syndrome d’Angelman. Le syndrome d’Angelman est un trouble génétique incurable qui entraîne un retard de développement, des troubles moteurs, des problèmes de langage oral, une déficience intellectuelle et des crises. Les traitements actuels sont axés sur la gestion des problèmes de santé, de sommeil et de développement.
En 2021, nous avons déployé des efforts considérables pour continuer à fournir des conseils réglementaires améliorés pour les essais cliniques et les examens de médicaments. Ces efforts incluent des lignes directrices sur la gestion des essais cliniques pendant la pandémie et la publication d’une liste des essais cliniques autorisés pour les médicaments et les vaccins liés à la COVID-19. Nous avons également continué de collaborer avec les Instituts de recherche en santé du Canada, l’Association canadienne des comités d’éthique de la recherche, ainsi que les intervenants provinciaux, pour échanger de l’information sur les essais cliniques et la COVID-19.
Nouveaux médicaments à usage humain autorisés
Lorsqu’une entreprise décide qu’elle souhaite commercialiser un médicament au Canada, elle soumet une présentation auprès de Santé Canada. Une présentation d’un nouveau médicament contient des renseignements scientifiques détaillés sur l’innocuité, la qualité et l’efficacité du médicament. Nos scientifiques et nos médecins hygiénistes effectuent un examen approfondi des renseignements soumis. Ils peuvent également faire appel à des comités consultatifs ou à des consultants externes dans le cadre de leur examen. Les évaluateurs examinent les données sur l’innocuité, l’efficacité et la qualité afin d’évaluer les avantages et les risques potentiels du médicament sur la santé humaine. Ils étudient également l’information qui sera fournie aux professionnels de la santé et aux consommateurs au sujet du médicament.
En 2021, nous avons autorisé 78 nouveaux médicaments dans le but d’offrir aux patients plus d’options pour le traitement, la prévention et le diagnostic de divers problèmes de santé. Parmi ces médicaments :
- trente-sept étaient des médicaments pour le traitement des maladies rares;
- huit étaient de nouveaux médicaments avec des indications pédiatriques.
Quarante-trois (43) des nouveaux médicaments autorisés en 2021 contenaient des ingrédients médicinaux qui, soit n’avaient jamais été autorisés pour la vente au Canada ou soit ils avaient ce que nous appelons des « nouvelles substances actives ». Trente-sept pour cent (37 %) d’entre eux, incluant ceux qui ciblent des besoins particuliers en soins de santé, ont été autorisés dans le cadre d’un processus accéléré.
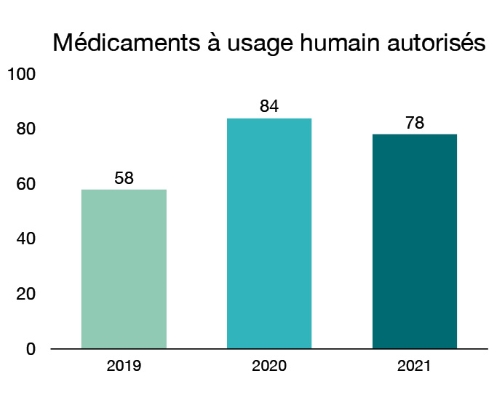
Figure 2 - Équivalent textuel
| Année | Année Nouveaux médicaments autorisés |
|---|---|
| 2019 | 58 |
| 2020 | 84 |
| 2021 | 78 |
Un des exemples est Trikafta, une thérapie innovatrice autorisée par Santé Canada en juin 2021 à la suite d’un examen prioritaire. Trikafta est indiqué pour tous les patients atteints de la fibrose kystique âgés de 12 ans et plus ayant la mutation génétique la plus courante. Ainsi, ces patients, y compris les adolescents, ont dorénavant accès à un traitement efficace.
Rukobia est un autre exemple. Il s’agit d’un médicament pour les patients atteints du VIH multirésistant. Il s’agit d’un sous-ensemble rare de la population séropositive qui autrement n’auraient pas d’options de traitement. Compte tenu de l’importance de ce nouveau traitement, la présentation de ce médicament a obtenu le statut d’examen prioritaire et a été autorisée en octobre 2021.
En 2021, nous avons également autorisé 147 nouveaux médicaments génériques. Les médicaments génériques contiennent les mêmes ingrédients médicinaux que le médicament de marque et ils sont considérés comme bioéquivalents au médicament de marque. Ces produits offrent un plus grand choix et des options abordables pour les personnes au Canada. Nous avons aussi autorisés 11 nouveaux produits biosimilaires. Il s’agit de médicaments biologiques très semblables à des médicaments déjà autorisés pour la vente au Canada.
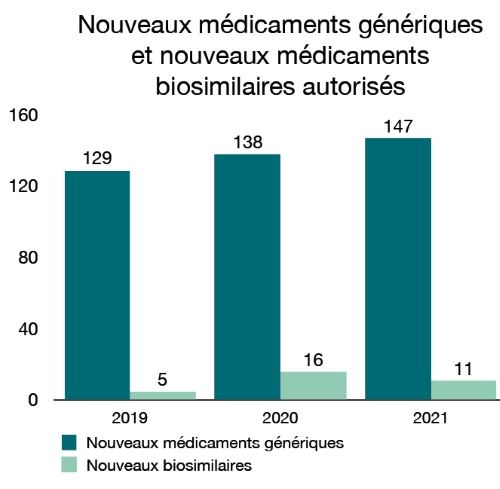
Figure 3 - Équivalent textuel
| Année | Année Nouveaux médicaments autorisés | Nouveaux médicaments biosimilaires autorisés |
|---|---|---|
| 2019 | 129 | 5 |
| 2020 | 138 | 16 |
| 2021 | 147 | 11 |
De surcroît, en 2021, nous avons continué d’accorder la priorité à l’examen et à l’autorisation des lots de médicaments dans le but de maintenir l’accès des personnes au Canada à leurs médicaments biologiques ou à des traitements de remplacement équivalents. Le programme d’autorisation de mise en circulation des lots de médicaments de Santé Canada est un système de surveillance en temps réel pour vérifier la qualité des médicaments. Ceci est fait par l’examen et l’analyse des médicaments biologiques que nous réglementons. Le programme inclue à la fois les étapes avant et celles après la mise en marché des médicaments biologiques. Afin d’assurer une surveillance adéquate, l’autorisation de mise en circulation est fondée sur le degré de risque du produit.
Afin d’assurer la sécurité du sang et des composants sanguins destinés aux personnes au Canada, Santé Canada effectue la surveillance réglementaire du système d’approvisionnement. En vertu du Règlement sur le sang, les établissements canadiens qui recueillent du sang, des composants sanguins ou du plasma sont tenus de soumettre des présentations pour toute modification à Santé Canada. Ces présentations doivent contenir des données scientifiques provenant d’études qui appuient l’innocuité de tout changement. Avant d’accorder une autorisation, Santé Canada tient compte des risques et des avantages. En 2021, nous avons autorisés 23 présentations relatives aux produits sanguins et plasmatiques à usage humain.
Nous continuons d‘avancer les travaux sur les technologies de réduction des agents pathogènes dans les plaquettes. Nous avons, par exemple, autorisé la présentation de la Société canadienne du sang portant sur l’utilisation de la technologie d’inactivation des agents pathogènes Intercept pour les plaquettes ayant une durée de conservation de 5 jours. Cette technologie est utilisée pour inactiver de nombreux agents pathogènes et, donc, de réduire le risque d’infections transmises par transfusion en plus de servir comme alternative aux essais de stérilité.
Programme d’accès spécial
Grâce à notre Programme d’accès spécial, nous favorisons l’accès à une vaste gamme de médicaments non disponibles à la vente au Canada pour lutter contre des maladies graves comme la fibrose kystique, les formes rares d’épilepsie, les infections complexes, les cancers, la sclérose latérale amyotrophique, les maladies cardiovasculaires, l’hémophilie et d’autres troubles sanguins. En 2021, nous avons autorisé 12 456 demandes d’accès spécial aux médicaments et nous avons ajouté 140 nouveaux médicaments au programme. Ces médicaments sont soit au stade de développement ou soit autorisés dans d’autres pays.
En 2020, nous avions finalisé les modifications apportées au Règlement sur les aliments et drogues afin de moderniser le Programme d’accès spécial. Ces changements ont amélioré les processus pour les professionnels de la santé et ils ont réduit le fardeau administratif pour les demandes d’accès à des médicaments dont la vente n’est pas encore autorisée au Canada.
Les travaux se sont poursuivis dans le but de réduire activement la nécessité de recourir au Programme d’accès spécial. Pour ce faire, nous avons travaillé avec nos partenaires réglementaires pour autoriser les médicaments nécessaires pour les personnes au Canada. Dans le cadre de ces travaux, nous avons encouragé l’échange d’information, des examens parallèles, et l’industrie à soumettre des demandes de médicaments au Canada. À titre d’exemple, 35 médicaments mis en circulation dans le cadre du programme ne nécessiteront plus un accès spécial en 2021. Il s’agit notamment du Ranexa (ranolazine) pour traiter les douleurs thoraciques cardiaques, de l’EVRYSDI (risdiplam) pour traiter l’atrophie musculaire spinale et de l’Effient (prasugrel) pour prévenir la formation de caillots de sang. Les professionnels de la santé ont demandé ces médicaments, en moyenne, plus de 50 fois par année par l’entremise du Programme d’accès spécial, mais ils peuvent maintenant être prescrits directement.
Vigilance après la mise en marché
Après avoir autorisé la vente d’un médicament au Canada, nous continuons de surveiller et d’évaluer les rapports d’effets indésirables soupçonnés. Les effets indésirables sont des effets secondaires qui peuvent être associés à la prise d’un médicament.
Nous évaluons les problèmes potentiels d’innocuité et d’efficacité, et nous prenons des mesures au besoin. Dans le cadre du Programme Canada Vigilance, Santé Canada recueille des renseignements sur l’innocuité d’un produit auprès de diverses sources incluant les effets indésirables soupçonnés qui nous sont signalés après l’autorisation de la vente d’un médicament. Santé Canada évalue ces données provenant de diverses sources pour capter toute question au sujet de l’innocuité qui sera, ensuite, examinée de plus près. Une question au sujet de l’innocuité peut être définie comme un renseignement sur un effet indésirable, nouveau ou connu, possiblement associé à un médicament. Ces enquêtes sont appelées des évaluations des questions au sujet de l’innocuité et elles peuvent donner lieu à des recommandations de mesures à prendre par l’entreprise, par Santé Canada ou par les deux. Ces mesures réglementaires peuvent inclure la transmission de nouveaux renseignements relatifs à l’innocuité du médicament aux personnes et aux professionnels de la santé au Canada ou des modifications aux étiquettes. Dans les situations les plus graves, nous pouvons retirer un médicament du marché.
Santé Canada cherche continuellement des moyens d’augmenter ses connaissances après la mise en marché d’un produit afin de réduire l’incertitude associée aux avantages et aux risques réels des produits thérapeutiques. En 2021, Santé Canada a reçu plus de 1,1 million de rapports d’effets indésirables soupçonnés pour les médicaments à usage humain. Ceux-ci comprenaient les rapports soumis par les hôpitaux canadiens qui doivent obligatoirement être déclarés suite à une réglementation entrée en vigueur en décembre 2019. Ces rapports aident Santé Canada à investiguer les risques potentiels de certains médicaments pour la santé et la sécurité des personnes au Canada.
En 2021, nous avons étudié 12 questions au sujet de l’innocuité et ensuite, pris neuf mesures réglementaires découlant des évaluations des vaccins et des traitements contre la COVID-19. Nous avons également effectué 14 évaluations des questions au sujet de l’innocuité et réalisé dix mesures réglementaires découlant de ces évaluations pour les médicaments pharmaceutiques et biologiques non liés à la COVID-19. De plus, nous avons effectué quatre analyses d’incident médicamenteux et pris trois mesures réglementaires découlant de ces analyses.
Par ailleurs, Santé Canada utilise des plans de gestion des risques pour appuyer l’évaluation continue de l’information qui pourrait changer le profil avantages-risques d’un médicament. La décision d’autoriser un médicament est fondée sur son profil avantages-risques et les renseignements disponibles au moment de l’approbation. Les connaissances relatives au profil d’innocuité d’un médicament peuvent changer au fil du temps en raison de l’utilisation du médicament par un grand nombre de patients différents. Les plans de gestion des risques décrivent les activités à entreprendre à la suite d’une autorisation de mise en marché pour identifier, caractériser, prévenir ou réduire les risques liés aux médicaments dès qu’ils sont utilisés. En 2021, nous avons examiné 413 plans de gestion des risques pour des médicaments, dont 35 pour des traitements et vaccins contre la COVID-19.
De plus, en 2021, nous avons publié un nombre accru de communications des risques liés aux produits de santé. Nous avons mis l’accent sur les questions concernant la disponibilité et les risques des vaccins et des traitements contre la COVID-19. Les communications sur les risques liés aux produits de santé sont conçues pour transmettre clairement et efficacement aux professionnels de la santé des nouveaux renseignements cliniquement importants des produits de santé commercialisés. Entre le 1er janvier 2021 et le 31 décembre 2021, une meilleure collaboration avec les intervenants a également contribué à rendre possible la publication de 33 communications sur les risques liés aux produits de santé dont 21 étaient au sujet des vaccins et des traitements liés à la COVID-19.
Enfin, Santé Canada a continué d’identifier un grand nombre d’incidents de publicité, dont ceux en lien avec la COVID-19. De janvier à décembre 2021, nous avons agi en lien avec 1 100 publicités fausses ou trompeuses incluant 530 liées à la COVID-19.
Transparence du processus décisionnel
En 2021, nous avons poursuivi nos efforts d’ouverture et de transparence en augmentant la quantité d’informations réglementaires sur la santé et la sécurité qui étaient mises à la disposition des personnes au Canada. Nous avons publié 147 sommaires des décisions réglementaires et 48 sommaire des motifs de décision. Ceux-ci expliquent les décisions de Santé Canada pour certains médicaments voulant une autorisation de mise en marché.
Pour appuyer nos efforts de transparence et répondre à la forte demande de données scientifiques fiables, nous publions des renseignements sur la réglementation et les produits sur le site Web de Santé Canada et sur le portail des vaccins et traitements pour la COVID-19. Santé Canada poursuit également sa collaboration avec l’Agence de la santé publique du Canada afin de fournir des mises à jour hebdomadaires sur les effets secondaires signalés après la vaccination contre la COVID-19 au Canada.
Établir des partenariats
Au cours des dernières années, Santé Canada a intensifié ses efforts de collaboration avec les organismes de réglementation d’autres pays. Nous travaillons à améliorer l’harmonisation de la réglementation, la coopération scientifique et d’entreprendre plus d’examens collaboratifs. Le but est d‘améliorer nos processus d’approbation et d’apporter plus rapidement les médicaments nécessaires aux personnes au Canada.
Notre coopération internationale en ce qui a trait aux médicaments s’est poursuivie en 2021 dans les dossiers liés à la COVID-19 et nos activités principales. Nous avons effectué 17 examens de médicaments en collaboration avec d’autres organismes de réglementation.
Par exemple, en tant que membre fondateur du Consortium Access, nous avons travaillé avec l’Australie, Singapour, la Suisse et, depuis l’année dernière, le Royaume-Uni, pour mettre des produits de santé sur le marché plus rapidement. Grâce à Access, nous avons terminé les examens de plusieurs nouveaux médicaments en utilisant un modèle de partage de travail avec des pays avec une population combinée de 150 millions de personnes. Kesimpta est l’un de ces produits et il s’agit d’un traitement pour la sclérose en plaques récurrente. Il a été autorisé dans le cadre du partage de travail avec l’Australie et la Suisse par l’entremise d’Access. Nous avons également bénéficié du partenariat Access par rapport au contrôle et à la surveillance de l’innocuité des vaccins et des traitements contre la COVID-19.
Nous avons également collaboré avec la Food and Drug Administration des États-Unis et d’autres partenaires dans le cadre du projet Orbis, afin de fournir aux patients un accès amélioré et rapide à des traitements prometteurs contre le cancer. Par l’entremise d’Orbis, les médicaments contre le cancer ont été autorisés en moyenne 109 jours avant la norme de service habituelle de 300 jours.
Santé Canada a participé à l’initiative OPEN de l’Agence européenne des médicaments de concert avec l’Union européenne, l’Australie, le Japon, la Suisse et l’Organisation mondiale de la Santé. L’initiative a permis d’accroître la collaboration internationale dans l’évaluation des vaccins et des traitements contre la COVID-19, ainsi que la surveillance continue de l’innocuité des vaccins. Nous collaborons également avec l’Agence européenne des médicaments pour la publication d’informations cliniques sur les médicaments.
Nous avons continué d’être un membre actif de l'International Council for Harmonization of Technical Requirements for Pharmaceuticals for Human Use – en anglais (ICH). Nous avons agi à la fois comme vice-président de l’Assemblée et comme président du Comité financier de l’ICH. Nous avons poursuivi notre travail avec les organismes de réglementation et l’industrie à l’échelle mondiale afin d’élaborer des lignes directrices techniques harmonisées à l’échelle internationale. Celles-ci sont pour veiller à ce que des médicaments sûrs, efficaces et de grandes qualités soient élaborés, homologués et conservés de la manière la plus efficace possible sur le plan des ressources tout en respectant nos normes élevées.
Nous avons également poursuivi notre participation à l’International Pharmaceutical Regulators Programme – en anglais (IPRP). L’IPRP vise à créer un forum pour les membres et les observateurs de la réglementation dans lequel il est possible d’échanger des informations sur des questions d’intérêt mutuel et de favoriser la coopération et de promouvoir la convergence des approches réglementaires pour les médicaments pharmaceutiques à usage humain. À travers son Comité de gestion et divers groupes de travail, l’IPRP facilite les discussions sur les questions de réglementation mondiales et les technologies émergentes.
Santé Canada est également membre du comité exécutif de l’International Coalition of Medicines Regulatory Authorities – en anglais (ICMRA) et joue un rôle essentiel dans l’établissement de ses orientations stratégiques. L’ICMRA réunit 37 organismes de réglementation de partout dans le monde. Pour faire face à la pandémie de COVID-19, l’ICMRA a décidé d’établir une démarche mondiale visant à harmoniser les approches des organismes de réglementation par rapport aux traitements et les vaccins contre la COVID-19. Santé Canada a dirigé et contribué à ces travaux.
En collaboration avec les membres de l’ICMRA, Santé Canada a travaillé avec d’autres partenaires internationaux pour publier des énoncés sur le diagnostic, les produits thérapeutiques, les essais cliniques et la confiance à l’égard des vaccins liés à la COVID-19. Ces énoncés fournissent des renseignements importants sur la COVID-19 au grand public.
Au Canada, nous avons également amélioré notre collaboration avec les partenaires du système de santé. Par exemple, dans le cadre de l’initiative d’améliorer l’examen réglementaire des médicaments et des instruments nous avons travaillé avec les organismes d’évaluation des technologies de la santé afin de réduire le temps entre nos approbations et leurs recommandations de remboursement. Nous espérons contribuer à accélérer l’accès des patients aux médicaments. En 2021, nous avons réalisé 20 examens harmonisés avec l’Agence canadienne des médicaments et des technologies de la santé (ACMTS) et l’Institut national d’excellence en santé et en services sociaux (INESSS). Cette collaboration a réduit le temps global nécessaire à Santé Canada, à l’ACMTS et à l’INESSS d’émettre leurs examens et recommandations permettant, ainsi, d’accélérer l’accès aux médicaments pour les personnes au Canada.
Les nitrosamines sont des composés qui peuvent se former dans certains médicaments pendant le processus de fabrication. Ces dernières années, on en a trouvé dans un nombre croissant de médicaments. Certaines nitrosamines peuvent augmenter le risque de cancer si des humains y sont exposés pour de longues périodes.
En réponse à ce défi important, Santé Canada a joué un rôle de chef de file à l’échelle internationale en présidant le Nitrosamines International Strategic Group et le Nitrosamines International Technical Working Group. Le but est de coordonner les activités des différents organismes de réglementation et de faciliter l’échange rapide d’information sur la gestion des nitrosamines dans les produits pharmaceutiques. Ces groupes sont des forums où les organismes de réglementation, notamment ceux de l’Union européenne, des États-Unis, du Japon, de l’Australie, de Singapour et de la Suisse, peuvent échanger des renseignements sur les nouvelles questions portant sur les risques, s’entendre sur des limites acceptables pour des nitrosamines spécifiques, élaborer des positions techniques et réglementaires et répondre aux préoccupations nouvelles et émergentes.
Santé Canada continuera de travailler avec l’industrie et les partenaires pour mieux comprendre ce phénomène et déterminer comment le prévenir à l’avenir. Plus important encore, nous continuerons de communiquer avec les personnes au Canada au sujet des médicaments touchés afin qu’ils puissent prendre des décisions éclairées.
Lutter contre la résistance aux antimicrobiens
Les antimicrobiens, tels que les antibiotiques et les antifongiques, sont essentiels aux soins de santé modernes. Cependant, l’utilisation généralisée de ces produits a entraîné une augmentation des niveaux de résistance aux antimicrobiens. Les antimicrobiens couramment utilisés perdent de leur efficacité à mesure que les agents pathogènes qu’ils ciblent (bactéries, virus, champignons et parasites) y deviennent résistants.
La résistance aux antimicrobiens est un défi mondial et une menace croissante pour la santé publique, le système de soins de santé et la sécurité sanitaire. Lorsqu’il y aura moins d’antimicrobiens efficaces disponibles, il sera plus difficile de protéger les personnes au Canada contre les maladies infectieuses courantes. En 2021, nous avons continué de prendre des mesures importantes pour favoriser la mise au point de nouveaux produits thérapeutiques innovants pour lutter contre la résistance aux antimicrobiens (RAM).
Par exemple, en mars 2021, nous avons publié la première mise à jour de la Liste des agents pathogènes d’intérêt de Santé Canada à la suite d’une consultation publique. La liste contient des agents pathogènes bactériens et fongiques qui peuvent causer des infections graves et potentiellement mortelles dans la population au Canada et pour lesquelles les options de traitement sont ou pourraient être limitées, voire inexistantes.
En octobre 2021, en collaboration avec l’Agence de la santé publique du Canada et les Instituts de recherche en santé du Canada, Santé Canada a organisé une séance d’échanges intitulée « Meilleurs Cerveaux » qui a réuni des décideurs, des experts en la matière et des intervenants de l’industrie afin de discuter des défis du modèle commercial des antimicrobiens et les incitatifs potentiels pour améliorer l’accès et promouvoir l’innovation au Canada.
Chaque année, Santé Canada se joint à l’Organisation mondiale de la santé, aux agences sanitaires internationales et à d’autres autorités nationales pour soutenir la Semaine mondiale de la sensibilisation aux antimicrobiens. En 2021, conjointement avec l’Agence de la santé publique du Canada, nous avons organisé un webinaire « Un monde, une santé » au cours duquel ont eu lieu des présentations sur des approches et des produits novateurs pour lutter contre la RAM chez les humains et la RAM d’origine alimentaire ainsi que la RAM liée aux animaux destinés à l’alimentation. Des experts de Santé Canada, d’autres ministères et groupes d’intervenants ont effectué des présentations dans le cadre de cet évènement.
Ces efforts, qui comprennent la collaboration au sein du gouvernement, avec différents groupes d’intervenants et avec des partenaires nationaux et internationaux, sont des étapes importantes pour faire progresser ce dossier.
Améliorer notre approche réglementaire
En 2021, nous nous sommes efforcés de veiller à ce que les personnes au Canada continuent de bénéficier de l’accès aux vaccins et aux traitements contre la COVID-19 nécessaires tout en gardant certaines mesures flexibles clés mises à profit dans le cadre de notre intervention réglementaire agile face à la pandémie. Ces mesures comprenaient un accès élargi aux essais cliniques pour les produits de santé liés à la COVID-19, l’utilisation de conditions pour mieux gérer les produits tout au long de leur cycle de vie, ainsi que l‘examen continue de présentations. Celles-ci nous ont permis d’examiner les preuves et les renseignements sur un produit dès qu’ils étaient disponibles.
En mars 2021, un arrêté d’urgence relatif au Règlement sur les aliments et drogues a été publié dans la Partie II de la Gazette du Canada. Cet arrêté a permis de maintenir en place certaines de ces mesures flexibles clés pour les vaccins et les traitements contre la COVID-19. De plus, en mai 2021, le ministre de la Santé a approuvé un deuxième arrêté d’urgence qui portait sur des mesures flexibles en matière d’essais cliniques liés aux médicaments et aux instruments médicaux contre la COVID-19. Les connaissances recueillies par l’utilisation de ces arrêtés d’urgence ont renforcé l’importance d’être un organisme de réglementation agile. Nous continuerons d’utiliser ces connaissances recueillies au fur et à mesure que nous ferons progresser nos plans d’innovation réglementaire.
Innovation réglementaire
Modernisation de la réglementation entourant les essais cliniques
Au cours de la dernière décennie, nous avons observé un changement dans l’orientation des essais cliniques. De plus en plus, les essais visent à trouver un traitement contre une maladie grave, mortelle ou rare pour laquelle il existe un besoin pour un traitement. La complexité opérationnelle et les coûts associés aux essais cliniques ont également augmenté de façon spectaculaire. Pour ces raisons, la conception des essais cliniques évolue rapidement. Ces changements se produisent en parallèle avec le développement accru de produits de santé personnalisés, de thérapies géniques et de produits destinés au traitement de maladies rares. Chacun de ces produits possèdent ses propres défis en ce qui concerne la conduite des essais cliniques. Une conception et des exigences appropriées en matière d’essais cliniques sont donc essentielles pour appuyer l’ajout de nouvelles thérapies sûres et efficaces sur le marché canadien.
En conséquence, Santé Canada s’est dotée d’une vision pour la modernisation du cadre réglementaire des essais cliniques au Canada. Le nouveau cadre répondra mieux à ces changements et contribuera à promouvoir les essais cliniques au Canada en créant un environnement qui appuie l’innovation sécuritaire. En mai 2021, nous avons publié un document de consultation décrivant nos plans de moderniser la réglementation canadienne sur les essais cliniques afin d’améliorer l’accès à de nouvelles thérapies, tout en continuant d’assurer la sécurité des patients. Cette démarche a été combinée avec des consultations auprès des intervenants tout au long du printemps et de l’été.
Attribution agile des homologations de médicaments
Auparavant, un ensemble commun de réglementation fonctionnait bien pour la plupart des produits. Cependant, à mesure que le marché a évolué et qu’il comprend maintenant un nombre beaucoup plus grand de médicaments, y compris des thérapies plus complexes et personnalisées, notre système de réglementation doit également évoluer. Afin de continuer à progresser, nous avons publié un avis d’intention dans la Gazette du Canada informant les intervenants des plans de modification du Règlement sur les aliments et drogues. Ces modifications prévues donneraient au ministre de la Santé la possibilité d’accepter des présentations en continu dans certaines circonstances, d’imposer des conditions aux autorisations de médicaments au besoin et d’exiger des plans de gestion des risques. Ces outils réglementaires ont été mis à profit dans le cadre de notre réponse à la COVID-19 et nous pouvons maintenant nous y appuyer pour mieux soutenir la surveillance d’un plus grand nombre de produits.
Processus pour les produits thérapeutiques innovants
Certains produits sont tellement innovants ou complexes qu’ils ont besoin d’une approche réglementaire différente. Nous les appelons des « produits thérapeutiques innovants ». En 2021, nous avons mis sur pied un groupe de référence externe pour aider à orienter les premières réflexions sur la démarche d’établir une voie réglementaire personnalisée pour la bactériothérapie fécale. Le but de ce groupe de référence externe est de réunir des experts dans la matière afin de fournir des conseils fondés sur des données probantes pour résoudre les questions de réglementation et permettre un accès sécuritaire aux patients. Nous continuerons de tenir compte des idées et des commentaires des intervenants à mesure que cette initiative avancera.
La bactériothérapie fécale (BF) implique le transfert de bactéries d’un donneur en bonne santé dans l’intestin d’un patient malade afin de promouvoir une flore bactérienne saine pour aider à lutter contre la résistance antimicrobienne, comme lors du traitement des infections récurrentes à C. difficile. Santé Canada supervise actuellement la BF avec une politique provisoire et se limite aux formes connues (c.-à-d. fraîches ou congelées) utilisées pour le traitement des patients souffrant d’infections récurrentes à C. difficile qui ne sont pas réceptifs aux traitements conventionnels. En créant un processus de produits thérapeutiques de pointe pour la BF, une surveillance adéquate sera possible dans le cadre d’un processus qui a force de loi et qui inclue des outils d’application de la loi. De plus, un tel processus ouvrira aux chercheurs et aux innovateurs un chemin vers la mise en marché.