Le soin des objets métalliques
Robert L. Barclay, Carole Dignard et Lyndsie Selwyn
Le soin des objets métalliques fait partie de la ressource Web Lignes directrices relatives à la conservation préventive des collections. Cette section présente les principaux aspects dont il faut tenir compte pour prendre soin des objets métalliques dans les collections patrimoniales, en fonction des principes de la conservation préventive et de la gestion des risques.
Table des matières
- Comprendre la nature des métaux et ce qu'est la corrosion
- Causes de la corrosion des métaux et stratégies de conservation préventive
- Stratégies de protection contre la corrosion : l'approche à niveaux multiples
- Stratégies visant l'ensemble de la collection
- Stratégies pour obtenir une protection accrue
- Autres agents de détérioration
- Exemples de pratiques de conservation préventive
- Argent terni : le traitement est clair
- Mesures de soin préventif pour la collection d'argent Birks au Musée des beaux-arts du Canada
- Introduction
- Conditions ambiantes au Musée des beaux-arts du Canada
- Mise en place d'un milieu idéal pour la préservation des objets en argent
- Voûte de mise en réserve des objets en argent sous faible humidité relative
- Armoires de rangement des objets en argent
- Vitrines d'exposition des objets en argent dans les galeries du Musée des beaux-arts du Canada
- Rangement au sec des objets en fer corrodés
- Utilisation d'un milieu anoxique pour préserver la croix de Ferryland
- Produits de corrosion blancs poudreux dans la réserve
- Bibliographie
- Glossaire
Liste des abréviations et des symboles
Abréviations
- COV
- composé organique volatil
- CVC
- chauffage, ventilation et climatisation
- HR
- humidité relative
- ICC
- Institut canadien de conservation
- MBAC
- Musée des beaux-arts du Canada
- MDF
- panneau de fibres à densité moyenne
- MERV
- minimum efficiency reporting value (valeur de référence d'efficacité minimale de filtration)
- format de document portable
- PEBD
- polyéthylène basse densité
- ppb
- partie par milliard
- PTE
- poly(téréphtalate d'éthylène)
- UV
- ultraviolet
Symboles
- cm
- centimètre
- e-
- électron
- Fe
- fer
- Fe2+
- ion ferreux
- H2O
- eau
- mm
- millimètre
- O2
- oxygène (gazeux)
- OH-
- ion hydroxyde
- po
- pouce
Comprendre la nature des métaux et ce qu'est la corrosion
Les collections muséales renferment une variété de métaux, d'alliages métalliques et de finis métalliques. Les métaux, dans leur ensemble, possèdent des propriétés communes et uniques. L'une de ces propriétés est que, en général, les métaux sont sujets à la corrosion (exception faite de l'or et des autres métaux nobles). Chaque type de métal possède son propre degré de vulnérabilité à la corrosion.
À noter que le sujet des métaux qui se trouvent à l'extérieur est traité plus en détail à la section Le soin des objets exposés à l'extérieur.
Comprendre la nature des objets métalliques
Propriétés des métaux
Les métaux ont en commun de nombreuses propriétés utiles, à savoir leur robustesse, leur aspect souvent lustré, leurs bonnes propriétés de conduction de la chaleur et de l'électricité et le fait que l'on puisse les fondre et les mouler. Dans un métal pur, les atomes sont tous de la même dimension et, donc, sous l'effet d'une force, ils glissent librement les uns au-dessus des autres. C'est pourquoi les métaux relativement purs sont mous, malléables et ductiles, ce qui fait qu'ils peuvent facilement être façonnés par pliage, martelage et extrusion (figure 1).

© Gouvernement du Canada, Institut canadien de conservation. ICC 87306-0001
Figure 1. Vase en cuivre finement façonné et martelé.
Dans les alliages, c'est-à-dire les mélanges de deux ou de plusieurs éléments dont au moins un est un métal, la taille comparative des atomes donne une mesure du caractère malléable ou ductile du métal. Par exemple, les atomes de zinc et de cuivre ont à peu près les mêmes dimensions, de sorte que leur alliage, le laiton, est relativement mou et facile à travailler. En revanche, l'atome d'étain est beaucoup plus gros que celui de cuivre, de sorte que leur alliage, le bronze, est plus difficile à travailler (figure 2). La facilité de travailler un métal varie aussi en fonction de la présence d'impuretés.

© Gouvernement du Canada, Institut canadien de conservation. ICC 97899-0011
Figure 2. Un sextant du milieu du XIXe siècle fait de bronze et de laiton provenant du parc historique du fort William et fabriqué par R. H. Cogswell, un fabricant d'instruments de navigation bien connu d'Halifax, en Nouvelle-Écosse. Le bâti de l'instrument est fait de bronze (85 % de cuivre, 10 % d'étain, 4 % de plomb et 1 % de zinc), un matériau habituellement plus dur et plus robuste que le laiton, ce qui explique pourquoi on l'utilise dans presque toute la partie structurale de l'instrument. Les composants plus petits sont faits de laiton (71 % de cuivre, 27 % de zinc et des traces de plomb, d'étain et de nickel). Les pièces décoratives sont souvent faites en laiton, car cet alliage permet de mouler de fins détails.
Structure granulaire des métaux
Sur le plan microscopique, les métaux présentent une structure granulaire, chaque grain étant composé d'un agencement structuré d'atomes. Les grains ressemblent à des cristaux, comme ceux que l'on voit dans le sel de table, sauf qu'ils peuvent être déformés sous l'effet d'une force. La taille des grains dépend de nombreux facteurs, notamment la vitesse de refroidissement du métal; s'il s'agit d'un alliage, la taille dépend aussi de ses éléments constitutifs. Le fleurage caractéristique de la couche de zinc sur l'acier galvanisé (acier plaqué de zinc), facilement visible à l'œil nu, par exemple sur les conduites de chauffage, montre clairement la structure granulaire du zinc (figures 3a et 3b). L'orientation des atomes varie d'un grain à l'autre, de sorte qu'à la lisière des grains, là où ils se touchent les uns les autres, on observe une discontinuité dans le réseau cristallin d'atomes. Le métal est plus vulnérable à la corrosion à ces endroits, car les atomes sont chimiquement plus actifs.
Pendant le travail du métal, les grains se déforment, ce qui en provoque le durcissement. Un chauffage contrôlé amènera les grains à revenir à une forme plus uniforme, ce qui ramollira le métal; ce processus s'appelle le recuit.

© Gouvernement du Canada, Institut canadien de conservation. ICC 125773-0038
Figure 3a. Cuve en acier galvanisé.

© Gouvernement du Canada, Institut canadien de conservation. ICC 125773-0039
Figure 3b. Vue rapprochée de la cuve de la figure 3a, qui montre le fleurage caractéristique de l'acier galvanisé.
Variété des métaux
Il est important de savoir et d'être en mesure de reconnaître de quel métal un objet métallique est fait pour avoir une idée de sa prédisposition à la corrosion et pour mieux cibler les mesures de conservation préventive qui devraient être mises en œuvre.
Il existe un large éventail d'éléments métalliques. Les métaux les plus couramment rencontrés dans les collections muséales sont l'aluminium, le cuivre, l'or, le fer, le plomb, le nickel, l'argent, l'étain et le zinc.
Une vaste gamme d'alliages ont été produits à partir de ces métaux à diverses fins. La plupart des métaux qui se trouvent dans les collections sont des alliages; les objets faits d'un métal pur sont rares. Parmi les principaux alliages se trouvant dans les collections, on trouve le laiton (cuivre et zinc), le bronze (cuivre et étain), l'acier (fer plus carbone, manganèse, nickel, chrome, etc.), l'argent sterling (argent et cuivre) et l'argentan, aussi appelé « argent allemand » (cuivre, nickel et zinc). L'aluminium est habituellement allié avec d'autres métaux (par exemple, cuivre, manganèse, magnésium, mais de nombreuses autres combinaisons sont possibles), tandis que l'or est souvent allié avec l'argent, le platine ou le cuivre. La figure 4 montre la couleur, la teinte et la brillance d'une variété de métaux et d'alliages courants.

© Gouvernement du Canada, Institut canadien de conservation. ICC 120260-0069
Figure 4. Exemples de divers métaux. De gauche à droite, première rangée : nickel (1); étain (2); aluminium (3); zinc (4); argent sterling (5). Deuxième rangée : laiton (6); fer étamé (7); acier galvanisé (8); plomb (9); cuivre (10). Troisième rangée : acier (11); fer nickelé (12); fer chromé (13).
Métaux plaqués
Les objets métalliques plaqués étant assez courants, surtout dans le cas des objets contemporains, ils se trouvent aussi dans les collections. Un métal plaqué consiste en un métal de base (l'âme) sur lequel une fine couche d'un autre métal a été déposée. Le processus se fait souvent à l'aide d'un courant électrique, et s'appelle « électrodéposition » ou « électroplastie » (aussi appelé « galvanoplastie », breveté en 1840). C'est ainsi que, souvent, on argente le cuivre ou les alliages de cuivre et de nickel (figures 5a et 5b), c'est-à-dire que l'on applique une couche d'argent à leur surface par électrodéposition. Les objets plaqués argent ont le même éclat mais sont moins coûteux que ceux faits entièrement d'argent sterling (alliage contenant 92,5 % d'argent et 7,5 % de cuivre). On trouve de nombreux objets plaqués argent, dont les couverts, les plats de service, les bijoux, les objets liturgiques, les chandeliers et les trophées.

© Gouvernement du Canada, Institut canadien de conservation. ICC 97196-0006
Figure 5a. Fourchette plaquée argent. L'estampille à l'arrière de la partie la plus mince de la poignée est présentée à la figure 5b.

© Gouvernement du Canada, Institut canadien de conservation. ICC 97196-0006
Figure 5b. Les lettres E.P.N.S. estampillées, signifiant « electroplated nickel silver », indiquent qu'il s'agit d'une couche d'argent électrodéposée sur une base d'argentan, un alliage riche en cuivre contenant aussi du nickel et du zinc, mais pas d'argent.
Le fer et l'acier sont eux aussi fréquemment plaqués, habituellement d'une couche de zinc, d'étain, de nickel ou de chrome. Par exemple, on trouve, parmi divers objets courants, les boîtes de conserve en acier étamé (aussi appelé « fer-blanc »), les pièces automobiles chromées ou encore, les récipients en acier galvanisé (acier plaqué de zinc) (figure 3a). La couche de métal en surface protège le métal sous-jacent contre la corrosion, et ce, tant qu'elle demeure continue.
Finition du métal
Diverses techniques chimiques et physiques permettent de donner aux métaux un fini ou une patine; il importe de départager ces finis originaux des autres couches possibles à la surface. L'acier peut, par exemple, être fini à la chaleur (figure 6). Des couleurs ou des marbrures attrayantes peuvent être produites pendant le chauffage; leur présence à la surface d'un métal révèle ainsi de l'information au sujet de la technique de fabrication (par exemple, trempe au jaspé). Des patines artificielles sont souvent créées sur le fer, le bronze (figure 7) et d'autres métaux au moyen de produits chimiques. Les processus de corrosion naturelle produisent également, au fil du temps, une patine qui est souvent prisée et recherchée. D'un point de vue chimique, une patine est une couche de corrosion; toutefois, le terme est souvent utilisé pour désigner expressément une couche ayant un cachet esthétique qui rehausse l'apparence de l'objet métallique et qu'il ne faudrait pas enlever.

Carabine à percussion, MCG 20000201-001, Musée canadien de la guerre
Figure 6. Vue rapprochée d'un mousquet illustrant l'acier trempé sur la platine.
© Gouvernement du Canada, Institut canadien de conservation. ICC 122863-0090
Figure 7. Buste en bronze patiné du compositeur et pianiste Béla Bartók, par le sculpteur hongrois Pál Pátzay, présenté au Centre national des arts, à Ottawa.
En outre, les objets métalliques peuvent être recouverts de laques qui constituent une caractéristique importante de leur apparence originale. Ces laques peuvent être transparentes ou colorées. De tels finis laqués sont courants sur les instruments scientifiques (figures 8a, 8b et 8c).

© S. Michalski
Figure 8a. Microscope en laiton laqué en bon état avec quelques marques de corrosion. Vue d'ensemble du microscope dans son boîtier.

© S. Michalski
Figure 8b. Vue rapprochée de la corrosion sur la jante du miroir, là où l'utilisateur posait ses doigts pour effectuer des ajustements fréquents.

© S. Michalski
Figure 8c. Vue rapprochée d'un endroit sur la base où la corrosion s'est formée après qu'un utilisateur a laissé tomber du solvant sur la laque.
Les finis, les patines et les laques sont souvent des couches superficielles extrêmement minces et peuvent être endommagées même par une très faible abrasion ou un nettoyage chimique très léger. Reconnaître et préserver les finis originaux est un aspect important du soin des objets métalliques.
Comprendre ce qu'est la corrosion
Pourquoi les métaux se corrodent-ils?
La présence de produits de corrosion sur les métaux (figures 9a, 9b et 9c) se remarque au quotidien. Un produit de corrosion est un composé habituellement formé par la réaction d'un métal (ou d'un alliage) avec une matière non métallique. Exception faite des métaux nobles, comme l'or et le platine, la plupart des métaux sont intrinsèquement instables et présentent une forte tendance à la corrosion.

© Gouvernement du Canada, Institut canadien de conservation. ICC 123557-0062
Figure 9a. Pièce d'un cent canadienne de 1980 présentant de fortes marques de corrosion vertes, brunes et noires.

© Gouvernement du Canada, Institut canadien de conservation. ICC 123557-0062
Figure 9b. Pièce d'un cent canadienne de 1973 dont la surface est recouverte d'une patine brune (ternissure).

© Gouvernement du Canada, Institut canadien de conservation. ICC 123557-0062
Figure 9c. Pièce d'un cent canadienne de 2008 ne présentant aucune ternissure ou presque.
Les ingrédients nécessaires à la corrosion sont :
- le métal;
- l'eau (un électrolyte);
- l'oxygène.
Lorsque ces ingrédients sont réunis, ils forment une cellule électrochimique qui permet le déplacement libre des électrons et des ions (figure 10). Par exemple, pour le fer, la réaction à l'anode est :
Fe → Fe2++ 2e-
et la réaction à la cathode est :
½ O2 (gaz) + H2O + 2e- → 2OH-
En présence d'un électrolyte (habituellement de l'eau), les électrons se déplacent dans le métal (de la zone anodique à la zone cathodique). Les ions métalliques (dans l'exemple de la figure 10, ce sont les ions de fer Fe2+ ) demeurent en solution ou bien réagissent avec les espèces environnantes et se précipitent, formant ainsi des produits de corrosion.

© Gouvernement du Canada, Institut canadien de conservation. ICC 87306-0139
Figure 10. Illustration du processus de corrosion sur une pièce de fer recouverte d'une mince pellicule d'eau. C'est sur le site anodique que l'« action » se passe, c'est-à-dire là où le fer est oxydé et forme les ions de fer (ici, Fe2+) qui, du moins initialement, se dissolvent dans l'électrolyte. Simultanément, sur le site cathodique, les molécules d'eau se combinent avec l'oxygène gazeux (O2) et les électrons qui sont transférés depuis le site anodique pour former des ions hydroxydes (OH-).
La présence de sels dissous dans l'eau peut accélérer grandement la corrosion. Les sels de chlorure, notamment, sont des plus destructifs et, malheureusement, ils sont également omniprésents. On les trouve, par exemple, dans les traces de doigts laissées sur le métal manipulé directement avec les mains. Ces sels sont très solubles et il est très difficile, voire impossible, d'assurer la stabilité des métaux en leur présence. Le cuivre peut se combiner avec les ions de chlorure pour former des produits de corrosion qui sont instables en présence d'humidité. Dans le cas du fer contaminé par des sels de chlorure, toute humidité provoquera de la corrosion, qui se poursuivra jusqu'à ce que le métal soit consumé.
Les polluants, la poussière (qui peut contenir des sels) et d'autres contaminants peuvent également causer la corrosion ou y contribuer. Les composés de soufre, par exemple, causent le ternissement de l'argent (pour en savoir davantage, consulter Comprendre comment ternissent les objets en argent). La plupart des polluants proviennent de sources extérieures, mais certains peuvent provenir de l'intérieur des bâtiments (par exemple, des acides organiques, comme l'acide acétique, sont dégagés par le bois et ses produits dérivés, ainsi que par de nombreuses peintures au latex, à l'huile ou aux résines alkydes).
Les métaux les plus sujets à la corrosion
Certains métaux sont plus sujets à la corrosion que d'autres. Le tableau 1 présente une série galvanique, c'est-à-dire une liste de métaux présentés par ordre de réactivité ou de potentiel de corrosion.
Plus noble 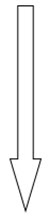 Moins noble |
Platine Acier inoxydable 304, passif Argent Nickel Plomb Alliages de cuivre-nickel Bronzes d'étain Brasure plomb-étain (50/50) Étain Cuivre Laitons jaune et rouge Acier inoxydable 304, actif Acier doux, fer de fonte Alliages d'aluminium Zinc |
|---|
Plus un métal est noble dans cette série, moins il est sujet à la corrosion. (L'or ne figure habituellement pas dans une série galvanique; son rang dans la série serait près de celui du platine.) Si deux métaux directement en contact (par exemple, un alliage, un métal plaqué ou deux composants métalliques soudés ou joints) se trouvent tous deux exposés à un environnement humide, cela produit un effet galvanique (corrosion galvanique ou bimétallique) dans lequel le métal le moins noble dans la série se corrodera plus rapidement que s'il n'était pas en contact avec le métal plus noble. Par exemple, si un rivet en aluminium sert à fixer une pièce de cuivre et que l'air est suffisamment humide pour jouer le rôle d'un électrolyte, l'aluminium se corrodera au point de contact du cuivre. Le fer plaqué, comme le fer étamé ou fer-blanc, est un autre bon exemple : il est stable s'il est en bon état, mais sujet à la corrosion si des rayures ou des bosselures exposent le fer sous-jacent, car la corrosion galvanique peut alors survenir s'il y a suffisamment d'humidité (figures 11a et 11b).

© Gouvernement du Canada, Institut canadien de conservation. ICC 123557-0141
Figure 11a. Boîte à musique en fer-blanc peint. Aux deux coins de la base, l'abrasion de la peinture et de la couche étamée (couche d'étain) a exposé le fer sous-jacent à l'air ambiant. Le fer, en présence d'humidité, a alors rouillé.

© Gouvernement du Canada, Institut canadien de conservation. ICC 123557-0141
Figure 11b. Vue rapprochée de la figure 11a, montrant les dommages causés par l'abrasion et la rouille dans le coin gauche inférieur de la boîte à musique.
Surfaces stables et corrosion active
Comment reconnaître la différence entre une surface stable et une surface attaquée par la corrosion active?
- Surfaces stables : Si une couche de corrosion uniforme et compacte s'est formée à la surface d'un métal, elle protégera souvent le métal sous-jacent contre la formation de corrosion supplémentaire en créant une barrière qui empêchera de nouvelles réactions chimiques. C'est ainsi que se forme une couche de passivation stable. Les surfaces stables sur les objets métalliques sont habituellement adhérentes et l'épaisseur n'augmente pas (ou de façon très minime) au fil du temps. Ces couches sont habituellement plus épaisses et moins uniformes sur les objets provenant de fouilles archéologiques. La majeure partie des objets muséologiques constitués de métal ont une surface stable s'ils sont conservés à des taux modérés d'humidité relative (HR) (45 % à 50 %).
- Corrosion active : L'expression « corrosion active » désigne habituellement une corrosion fraîche ou nouvelle sur un objet. On reconnaît la corrosion active par la présence, notamment, de fissures ou d'effritement dans la couche superficielle de l'objet ou par la présence de poudre ou d'écailles provenant de cette couche autour de l'objet (figure 12). Ces dommages ou pertes physiques de matière peuvent être dus à la formation d'une couche récente de corrosion sous la surface, à l'interface du métal : l'accroissement en volume à cet endroit provoque des tensions contre les autres couches en surface (couches de corrosion plus anciennes, peinture, métal plaqué), causant des fissures ou de l'écaillage. Ces dommages surviennent aussi lorsque des sels contaminent le métal : en présence d'humidité, les sels s'hydratent et augmentent en volume, ce qui rompt la cohésion des couches en surface et provoque des pertes. L'efflorescence et la déliquescence sont aussi des signes indicateurs de la présence de sels stimulant la corrosion. La corrosion active a un aspect caractéristique pour chaque métal et alliage, comme il est décrit ci-dessous.

© Gouvernement du Canada, Institut canadien de conservation. ICC 125773-0070
Figure 12. Les produits de corrosion qui s'écaillent de la surface du clou inférieur indiquent que le métal est instable et que la corrosion est active. Le clou du dessus est stable.
Reconnaître les divers types de corrosion sur les métaux communs
Il est utile d'apprendre à distinguer un métal d'un autre en l'examinant, car la couche de corrosion en surface a souvent un aspect distinctif permettant l'identification du métal. Pour chacun des métaux communs ci-dessous, on présente la couleur typique du produit de corrosion, ainsi que les caractéristiques visuelles de sa corrosion stable et de sa corrosion active.
Aluminium
Couleur typique du produit de corrosion : blanc
Surface stable : Couche d'oxyde stable et très mince qui empêche toute autre détérioration. La plupart des objets en aluminium conservés à l'intérieur dans les collections muséales devraient être stables.
Corrosion active : Les sels et les acides contenus dans la saleté peuvent s'accumuler sur les surfaces d'aluminium. Ces contaminants se trouvent surtout sur les objets qui ont été exposés à l'extérieur. En présence d'eau (pluie, inondation, etc.), ces contaminants pénètrent la couche d'oxyde d'aluminium et provoquent des piqûres en surface (figure 13). Le chlorure dans le sel ordinaire (chlorure de sodium) attaque rapidement la couche d'oxyde d'aluminium, ce qui donne un produit de corrosion poudreux blanc. Cependant, il est rare que de la corrosion active se manifeste lorsque l'aluminium se trouve à l'intérieur.

© Gouvernement du Canada, Institut canadien de conservation. ICC 123557-0011
Figure 13. Vue rapprochée de la corrosion sur une cuillère en aluminium, probablement provoquée par la présence de sels. Les zones corrodées sont blanches et poudreuses, par opposition à la surface lisse de l'aluminium.
Cuivre et alliages de cuivre (bronze et laiton)
Couleurs typiques des produits de corrosion : rouge, brun, noir, bleu, vert
Surfaces stables : Pour le cuivre et les alliages de cuivre (dont les plus courants sont le bronze et le laiton), les couches de corrosion stables, ou patines, sont très diversifiées et peuvent être d'origine naturelle ou artificielle. Les patines stables sur ces métaux sont habituellement uniformes, adhérentes et lisses, et peuvent avoir une teinte dorée (figure 14), rouge, brune (figure 15), noire, verte (figures 7 et 16) ou bleue.

© Gouvernement du Canada, Institut canadien de conservation. ICC 85802-0008
Figure 14. Le chandelier en laiton poli de gauche est d'un jaune pâle, tandis que le chandelier terni de droite est plus foncé. L'exposition à de l'humidité et des polluants, comme le sulfure d'hydrogène, présents dans l'air cause la lente formation de cette mince couche de corrosion stable, aussi appelée « patine ».

© Gouvernement du Canada, Institut canadien de conservation. ICC 125773-0040
Figure 15. Exemple de patine brune stable qui s'est formée naturellement sur cette pièce d'un cent commémorative du centenaire de 1967, ayant passé entre de nombreuses mains. La ternissure peut éventuellement devenir assez foncée.

© Gouvernement du Canada, Institut canadien de conservation. ICC 68548-0012
Figure 16. Une patine stable d'un noir verdâtre sur une cloche en alliage de cuivre (probablement du bronze), datant d'environ 1648 et probablement d'origine française, se trouvant actuellement dans la collection du lieu historique national du Poste-de-Sainte-Marie-au-pays-des-Hurons.
Corrosion active : Des taches de corrosion verte, petites ou étendues, peuvent apparaître sur une patine stable. De telles taches localisées présentes sur des objets muséaux sont souvent le résultat de la contamination causée par un mauvais astiquage (utilisation de produits trop forts à base d'ammoniac ou d'acide, résidus de produit d'entretien, etc.; figure 17). De nombreux polluants et contaminants réagissent avec le cuivre pour former des produits de corrosion verts, mais on les retrouve surtout dans un environnement extérieur pollué plutôt qu'à l'intérieur d'un musée (figure 18).

© Gouvernement du Canada, Institut canadien de conservation. ICC 129955-0008
Figure 17. La couleur brune sur le gros de la surface de cet objet en cuivre est la patine d'origine naturelle. Les produits de corrosion verts sont vraisemblablement attribuables à des résidus de produit d'entretien difficiles à déloger des creux du motif floral; les taches noires sur la patine sont probablement dus à des dépôts localisés de contaminants (par exemple, des résidus de polissage, des sels ou des poussières).

© Gouvernement du Canada, Institut canadien de conservation. ICC 125773-0041
Figure 18. Broche à l'effigie de la feuille d'érable. La feuille verte est faite d'un morceau de cuivre corrodé provenant de la toiture des édifices du Parlement du Canada entre 1918 et 1996.
La corrosion verte peut également se développer lorsque le cuivre ou ses alliages sont en contact avec certains produits végétaux et animaux naturels, comme la cire d'abeille, la lanoline et l'huile de lin. Les acides présents dans les matières grasses, les huiles et les cires attaqueront le cuivre, ce qui donnera des produits de corrosion verts cireux (produits de saponification ou « savons de cuivre », par exemple stéréates). On trouve souvent ce type de corrosion sur les objets en cuir ayant des composants métalliques à base de cuivre (par exemple, des courroies, des sacs et des bottes en cuir munis de rivets, d'attaches ou de perles décoratives en laiton) (figures 19 et 20). Cette corrosion survient non seulement parce que le cuir contient des matières grasses ou des huiles qui y ont été incorporées pendant le processus de fabrication, mais aussi parce que, souvent, au cours de l'utilisation de l'objet, le cuir peut avoir été ciré ou enduit de produits huileux (lubrifiants, produits d'entretien ou « nourriture pour cuir »). Des taches vertes de corrosion peuvent aussi se former, par exemple, sur un chandelier en laiton autour des gouttes de cire qui s'y déposent.

© Gouvernement du Canada, Institut canadien de conservation ICC 124883-0027
Figure 19. Vue rapprochée d'un bouton-pression sur des bottes de cuir de tannage végétal. Les produits de corrosion verts sont communs lorsque des éléments en cuivre ou en alliage de cuivre sont en contact avec le cuir.

© Gouvernement du Canada, Institut canadien de conservation. ICC 100641-0004
Figure 20. Vue rapprochée d'une ceinture de cuir provenant des Plaines du Nord, décorée avec des perles de verre turquoise, bleues et rouges, ainsi qu'avec des perles en laiton à l'intérieur du motif à chevrons. Le laiton est recouvert de produits de corrosion verts cireux, causés par la réaction avec des huiles provenant probablement d'un produit d'entretien.
Une forme spéciale de corrosion active, appelée « maladie du bronze », se voit habituellement sur les objets d'origine archéologique. Elle est due à la présence de sels de chlorure, provenant du milieu dans lequel l'objet était enfoui, qui réagissent avec le cuivre pour former le produit de corrosion « chlorure de cuivre (I) ». Cette « maladie » est caractérisée par l'apparition d'une poudre vert pâle sous forme de taches sur la surface (figure 21) lorsque le chlorure de cuivre (I) réagit avec l'humidité et l'air. Cette forme de corrosion active peut survenir lorsque l'humidité est supérieure à 55 %. Les objets atteints de la maladie du bronze doivent être entreposés à une HR moindre, habituellement en deçà de 42 % (Rimmer et coll., 2013).

© Gouvernement du Canada, Institut canadien de conservation. ICC 125773-0064
Figure 21. Exemple de « maladie du bronze » sur une lame archéologique en alliage de cuivre qui se manifeste sous forme de taches poudreuses vertes.
Or
Couleurs typiques des produits de corrosion : aucunes
Surface stable : L'or pur ne se corrode pas. Cependant, les alliages d'or peuvent se corroder. En présence de gaz soufrés, les composantes argent et cuivre des alliages d'or deviendront foncées en se ternissant.
De nombreux objets en or, comme les plats de service ou les objets religieux, sont plutôt plaqués or et non fait tout entier en or. Ils peuvent être en argent partiellement doré, c'est-à-dire que seule une partie de la surface est dorée, et il peut arriver que la ternissure présente sur l'argent déborde sur la dorure.
Corrosion active : aucune (L'or et les alliages d'or sont stables.)
Fer et acier
Couleurs typiques des produits de corrosion : noir, rouge, orange, jaune, brun
Surfaces stables : Les produits de corrosion stables sont compacts, adhérents et de diverses couleurs, allant du bleu-noir au rouge-brun. Les objets muséaux en fer et en acier, surtout ceux qui ont été à l'extérieur ou conservés dans un milieu non contrôlé, sont souvent recouverts d'une couche stable de rouille rouge-brun (figures 22 et 23).

© Gouvernement du Canada, Institut canadien de conservation. ICC 98217-0005
Figure 22. Couche stable et uniforme de rouille rouge-brun sur la poignée d'une épée en acier.

© Gouvernement du Canada, Institut canadien de conservation. ICC 85802-0012
Figure 23. La rouille stable est souvent de couleur rouge-brun. Elle adhère habituellement bien au métal et est causée par l'exposition à l'humidité à un certain moment pendant la durée de vie de l'objet. Cette photographie présente un véhicule ancien dont bon nombre des composants en acier sont rouillés. Cette rouille demeurera stable tant que l'HR demeurera faible.
Corrosion active : Il y a corrosion active du fer lorsque la rouille progresse ou s’intensifie. Elle est caractérisée par l’apparition d’une corrosion de couleur orange vif (formation instantanée de rouille lorsque l’HR est élevée) ou par l’apparition d’écailles qui se délogent d’une surface, la laissant ainsi parsemée de piqûres et de petites dépressions comportant des taches orangées au centre. Cette corrosion est provoquée par la présence d’une humidité élevée ou de sels hygroscopiques (contenant surtout du chlore) qui ont absorbé l’humidité de l’air.

© Gouvernement du Canada, Institut canadien de conservation. ICC 124716-0044
Figure 24. La lame de ce couteau présente des signes de corrosion orange active, des piqûres sur la surface et de l'effritement.
Une forme particulière de corrosion active s'attaque surtout au fer archéologique n'ayant pas été traité après la fouille. Elle est causée par la présence d'ions de chlorure dans le site d'enfouissement, qui contaminent le métal. Cette forme de corrosion est caractérisée par un suintement : des gouttelettes jaunes, brunes ou orangées apparaissent à la surface du métal lorsque l'HR dépasse 55 % environ. Dans des conditions plus sèches, cette corrosion active prend la forme de cloques vitreuses orange-brun (figure 25). Un autre produit de corrosion du fer contenant du chlore, appelé « akaganéite », peut également être présent. Les objets sujets à ce type de corrosion active doivent être conservés dans un lieu ayant une faible HR, habituellement moins de 20 % (Rimmer et coll., 2013).

© Gouvernement du Canada, Institut canadien de conservation. ICC 87306-0007
Figure 25. Vue rapprochée d'un morceau de fer contaminé par des chlorures et présentant des cloques qui se sont formées après le suintement.
Plomb
Couleur typique du produit de corrosion : blanc
Surface stable : Le plomb acquiert une patine gris foncé stable, non pulvérulente.
Corrosion active : Le plomb est très sujet à la corrosion en présence des vapeurs d'acide organique (par exemple, acide acétique) qu'émettent les vitrines d'exposition ou les armoires de rangement en bois (particulièrement en chêne). Ces gaz nocifs peuvent aussi être émis par le papier et le carton de piètre qualité et par de nombreux types de peintures fraîchement appliquées. La corrosion se présente sous forme d'une poudre blanche faiblement adhérente (figure 26). La poudre peut avoir un aspect uniforme en surface ou peut également former un réseau de piqûres blanches.

© Gouvernement du Canada, Institut canadien de conservation. ICC 129955-0009
Figure 26. Cet objet en fonte est un pique-allumette : il a la forme d'un pic-bois articulé qui, en pivotant, saisit dans son bec une allumette parmi celles rangées dans la base. La queue de l'oiseau, en plomb, est maintenant totalement couverte de produits de corrosion blancs dus à un long séjour dans une vitrine d'exposition en chêne. (Pique-allumette provenant de la collection du Musée du Séminaire de Sherbrooke.)
Remarque : Le plomb et ses produits de corrosion sont toxiques. Il faut prendre des mesures de sécurité appropriées pour ne pas y être exposé. En particulier, les produits de corrosion blancs du plomb sont poudreux et peuvent être facilement délogés ou se retrouver en suspension dans l'air, ce qui présente alors un risque plus grand de contact et d'inhalation (Selwyn, 2005).
Nickel
Couleur typique du produit de corrosion : vert
Surface stable : Le nickel résiste à la corrosion et demeure brillant longtemps dans les conditions normales présentes dans un musée. Le brillant s'estompe graduellement au fil du temps, lorsque la couche d'oxyde de nickel s'épaissit, particulièrement si l'HR est élevée.
Corrosion active : Lorsque le nickel est exposé à l'extérieur à des polluants tels que des gaz soufrés, des oxydes d'azote ou des ions chlorure, sa surface brillante devient matte (on parle alors de voilage), car elle réagit avec les polluants et forme une mince couche de produits de corrosion verts.
Argent
Couleur typique du produit de corrosion : noir
Surface stable : La ternissure, une couche de corrosion superficielle stable composée de sulfure d'argent, se développe sur l'argent lorsqu'il est exposé à des gaz soufrés. Au début, quand la couche est mince, elle peut être de couleur or, bleue ou pourpre. De légères différences d'épaisseur donnent lieu à des couleurs iridescentes. À mesure que le ternissement se poursuit, la couche devient dense, noire, compacte et adhérente (figure 27).

© Gouvernement du Canada, Institut canadien de conservation. ICC 120260-0051
Figure 27. Ternissure sur une tasse en argent présentant une palette de couleurs.
Corrosion active : Dans de rares cas, des efflorescences de sulfure d'argent noir peuvent se former sur l'argent. Elles se formeront surtout en présence de concentrations élevées de gaz soufrés et si l'air circule peu.
Étain et alliages d'étain
Couleurs typiques des produits de corrosion : blanc, noir (la patine semble habituellement grise en raison d'un mélange de produits de corrosion blancs et noirs)
Surface stable : On trouve surtout, dans les collections, de l'étain sous forme de couche de placage (par exemple, le fer étamé) ou d'alliages, car ce métal, à l'état pur, est habituellement trop mou pour qu'il soit possible d'en faire des objets. Depuis l'Antiquité jusqu'à il y a quelques siècles, un alliage plomb-étain (aussi appelé « pewter ancien » ou « potin ») était couramment utilisé dans la confection de divers objets; cet alliage a généralement une patine gris mat (figure 28). Par contre, l'étain (le métal pur), les surfaces étamées ainsi que les alliages d'étain modernes sans plomb demeurent brillants longtemps, mais deviennent graduellement mat au fil du temps, à mesure qu'une couche d'oxyde se forme en surface (figure 29). Il est à noter qu'en français, les alliages modernes d'étain sont simplement appelés « étain ».

© Gouvernement du Canada, Institut canadien de conservation. ICC 85802-0011
Figure 28. Chope en alliage plomb-étain. La surface a progressivement foncé au fil du temps pour former une patine gris mat.

© Gouvernement du Canada, Institut canadien de conservation. ICC 125773-0035
Figure 29. Boîte à bijoux en étain, c'est-à-dire un alliage d'étain qui ne contient pas de plomb; il demeure stable.
Corrosion active : L'étain et ses alliages ne sont pas sujets à la corrosion active.
Remarque : Les objets en fer étamé, comme les boîtes de conserve, certaines pièces de vaisselle et divers ustensiles de cuisine sont aussi appelés « objets en fer-blanc » ou « objets en tôle ». Ils présentent souvent des problèmes de corrosion associés à la formation de la rouille du fer sous-jacent, qui surviennent habituellement à la suite de dommages à la couche d'étain (figures 30a et 30b). Consulter Métaux plaqués pour en savoir davantage sur ce type de corrosion.

© Gouvernement du Canada, Institut canadien de conservation. ICC 125773-0001
Figure 30a. Lanterne en fer-blanc.

© Gouvernement du Canada, Institut canadien de conservation. ICC 125773-0002
Figure 30b. Vue rapprochée de la lanterne de la figure 30a, montrant la patine gris foncé sur la surface étamée, ainsi que les endroits où l'étain a disparu et où le fer sous-jacent est en train de rouiller.
Zinc
Couleur typique du produit de corrosion : blanc (figure 31)

© Gouvernement du Canada, Institut canadien de conservation. ICC 89037-0227
Figure 31. Bidon d'essence en acier galvanisé (c'est-à-dire en acier plaqué de zinc), datant d'environ 1930, présentant des endroits où le zingage est en train de se corroder. Le bidon provient des fouilles sur le site archéologique Krüger, sur l'île Axel Heiberg, au Nunavut.
Surface stable : La surface d'un objet en zinc demeure brillante longtemps (figure 3a) et perd son lustre lentement, au fur et à mesure que se forme une couche relativement adhérente de produits de corrosion de zinc.
Corrosion active : Les surfaces de zinc se corrodent et forment des produits de corrosion blancs lorsqu'elles sont exposées à l’eau ou à des taux élevés d’humidité. Le taux de corrosion du zinc s’accélère lorsque les polluants augmentent l’acidité ou l’alcalinité de l'eau ou que les sels augmentent la conductivité de l’eau. Ces composés sont souvent présents ou adsorbés dans les particules de poussière. On peut voir ce type de corrosion sur les objets en zinc qui se trouvent dans des milieux archéologiques humides, surtout si ces derniers sont exposés à l’eau salée (figure 31).
Métaux plaqués
Surfaces stables : Les surfaces des métaux plaqués qui sont stables, particulièrement celles plaquées or, argent, nickel ou chrome, préservent souvent leur aspect métallique brillant d'origine lorsqu'elles sont conservées dans des conditions ambiantes appropriées, bien qu'un dépôt de saletés diverses puisse en obscurcir le lustre. Tant que la couche de placage demeure continue, le métal sous-jacent est protégé de la corrosion.
Corrosion active : Le métal sous-jacent peut se mettre à corroder activement s'il est exposé à l'air et à l'humidité. Cela peut se produire si la couche de placage est défaillante et poreuse ou si elle est physiquement endommagée (par exemple, abrasion, rayures, bosselures).
La corrosion active sur les métaux plaqués se manifeste de différentes façons, selon la nature du métal sous-jacent, de la couche métallique de placage et du type de corrosion. Habituellement, la couche de placage se soulève parce que les produits de corrosion du métal sous-jacent prennent de l'expansion (figure 32). Les produits de corrosion du métal sous-jacent peuvent également parvenir à la surface par l'intermédiaire de microfissures ou de pores, et ainsi percer la couche de surface. Des piqûres se manifestent aussi sur les objets plaqués lorsque la couche métallique de placage est perforée, et ces piqûres s'étalent pour former des taches au fur et à mesure que le métal sous-jacent se corrode. Toute corrosion active sur les métaux plaqués s'accompagne d'un accroissement du volume, ce qui entraîne le délogement de produits de corrosion, qui se retrouvent dispersés sous forme de poudre tout autour de l'objet, ou la formation de boursouflures plus ou moins uniformes à la surface.

© Gouvernement du Canada, Institut canadien de conservation. ICC 73174-0002
Figure 32. Vue rapprochée d'un cadre de vélo motorisé montrant comment la couche de nickelage (plaquée nickel) s'écaille sur l'acier.
Causes de la corrosion des métaux et stratégies de conservation préventive
Les objets métalliques doivent avant tout être protégés de l'eau et de l'HR élevée, de même que des polluants et des contaminants. Ces agents de détérioration peuvent souvent être contrôlés ensemble. Les interventions en conservation préventive visent surtout, d'une part, à maintenir les objets dans un milieu le plus sec possible afin d'empêcher l'amorce de corrosion et, d'autre part, à garder l'air libre de polluants et la surface des métaux exempte de contaminants. En déterminant les cas prioritaires, il est possible de mettre en œuvre un programme de préservation multiniveau, allant de mesures globales de conservation préventive à des microenvironnements propres à des objets en particulier. Les autres agents de détérioration qui menacent les objets métalliques sont aussi présentés.
Eau et humidité relative
L'eau liquide et l'HR ambiante élevée présentent des risques sérieux pour presque tous les objets métalliques : toute exposition à l'un ou l'autre risque alors d'entraîner de la corrosion.
Eau
Lorsque l'eau liquide entre en contact avec des objets métalliques (par exemple, dans le cas d'une inondation), il y aura un certain degré de corrosion. L'immersion dans l'eau peut mener à la corrosion, et celle-ci sera particulièrement rapide ou intense si l'eau est bien oxygénée ou si des sels sont présents. Une exposition brève peut donner lieu à une corrosion rapide de la surface; par exemple, lorsque des objets en fer ou en acier sont momentanément mouillés, cela peut entraîner la formation instantanée de rouille (figure 33).
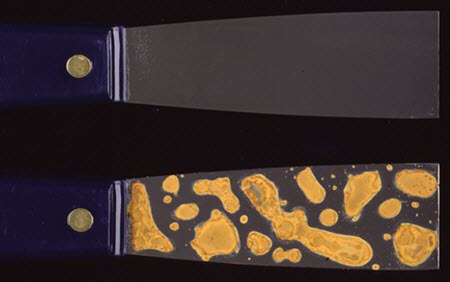
© Gouvernement du Canada, Institut canadien de conservation. ICC 87306-0026
Figure 33. Au haut : couteau à mastiquer avec lame en acier. L'acier qui n'est pas corrodé a typiquement une teinte argentée-grise, comme ici. L'acier est souvent utilisé dans la fabrication d'outils et de machines. Au bas : marques de corrosion typiques de la formation instantanée de rouille (très rapide) sur un couteau à mastiquer semblable. Cette rouille de surface survient rapidement à la suite d'une exposition à une humidité élevée (par exemple, dans le cas d'une inondation) ou d'un bref mouillage. La rouille qui se forme est de couleur orange vif et les taches indiquent les endroits où l'eau s'est accumulée sur l'acier.
Humidité relative élevée
Dans le milieu ambiant, il y a toujours un certain degré d'humidité dans l'air, ce qui peut provoquer la corrosion. Plus l'HR est élevée, plus le risque est grand.
Lorsque l'HR est supérieure à 65 %, la plupart des surfaces métalliques propres adsorbent superficiellement assez d'eau de l'air ambiant pour approcher le point d'eau libre, créant ainsi un électrolyte qui rend possible le processus de corrosion (figure 34). En général, au-delà d'un taux d'HR de 65 %, toute corrosion du métal s'accélère grandement.

© Gouvernement du Canada, Institut canadien de conservation. ICC 129955-0010
Figure 34. Vue rapprochée d'une ancienne voiture hippomobile. Il y a une mince couche de moisissure sur les sièges en cuir et des pièces en fer très rouillées : c'est habituellement ce que l'on trouve sur les objets conservés dans un hangar qui est sec la majeure partie de l'année, mais humide au printemps et à l'automne.

© Gouvernement du Canada, Institut canadien de conservation. ICC 129955-0001
Figure 35. Cet objet composite, un couteau inuit (« ulu »), fait de fer et muni d'une poignée en bois, a été conservé pendant des années à des taux modérés d'HR (environ 50 % +/- 5 %). Le métal est demeuré relativement stable, et ce taux d'HR est sécuritaire pour la poignée en bois.
Puisque le processus de corrosion des métaux nécessite de l'eau (de l'humidité), il est avantageux de diminuer le taux d'HR pour ralentir, voire arrêter la corrosion. En règle générale :
- les environnements secs (30 % d'HR ou moins) sont l'idéal pour les métaux;
- à des taux modérés d'HR (40 % à 55 %), la majorité des métaux ne présentent pas de problèmes immédiats. Cela s'explique par le fait que, sur la plupart des métaux, la surface est déjà recouverte d'une mince couche d'oxydation (couche de passivation) stable. Les taux modérés d'HR sont également recommandés pour les objets composites (objets ayant des composants métalliques et des composants organiques; figure 35). Dans ce dernier cas, il faut éviter les taux d'HR trop faibles pour empêcher que les composants organiques ne s'assèchent, ce qui peut conduire à des dommages physiques (fissures, fendillement, soulèvements, gauchissement, déformations, etc).
Polluants et contaminants
Polluants gazeux
Le tableau 2 présente un résumé des polluants gazeux les plus nocifs pour les métaux, les plages de concentrations moyennes à l'extérieur et à l'intérieur, ainsi que leurs sources usuelles (adapté de Tétreault, 2003, p. 8; 26; 32; 103-109).
| Polluant : seuil* d'apparition de la corrosion (μg m-3) (métal) | Concentrations extérieures moyennes (μgm-3) et sources extérieures communes | Concentrations intérieures moyennes (μgm-3) et sources intérieures communes |
|---|---|---|
Sulfure d'hydrogène (H2 S) : 0,1 (argent); 1 (cuivre) |
0,01 à 10 Sources : combustion de carburant et de charbon, industries du pétrole, usines de pâtes et papiers (procédés Kraft), gaz d'échappement des véhicules, volcans, marais, océan, certaines eaux naturelles |
Dans une pièce : 0,03 à 40 (en présence de personnes) Sources : visiteurs et personnel, certains aliments (œufs, mayonnaise), soudage à l'arc, caoutchouc, colles animales, certaines pâtes à modeler, certaines peintures, pyrite dans les spécimens minérologiques, bactéries sulfatoréductrices dans les objets archéologiques |
Sulfure de carbonyle (COS) : 30 (cuivre); 500 (argent) |
0,7 à 1 Sources : combustion du charbon, littoral océanique, sols, zones humides, oxydation du bisulfure de carbonyle (CS2) (sources de CS2 : matière organique en décomposition dans les océans, les sols et les marais, croissance fongique) |
Dans une pièce : 0,3 à 0,5 Émissions de la laine dans une pièce sans éclairage : 0,03 Émissions de la laine à la lumière solaire : 1 Sources : laine en cours de dégradation, produits d'étanchéité à base de polysulfures en cours de dégradation |
Dioxyde de soufre (SO2) : 50 (cuivre) |
0,1 à 100 Sources : combustion de carburants fossiles contenant des impuretés soufrées, usines de pâtes et papiers, raffineries de pétrole |
Dans une pièce : 0,1 à 50 Sources : caoutchoucs vulcanisés, matériaux contenant du soufre en cours de dégradation (fibres protéiques, certaines teintures, pyrite dans les collections de minéraux) |
Acide acétique (CH3 COOH) : 400 (plomb); 1 000 (cuivre); 20 000 (zinc) |
0,3 à 30 Source : dégradation de la matière organique |
Dans une pièce : 40 à 100 Caisse en bois : 80 à 3 000 Coffre en chêne : 300 à 7 000 Peinture-émulsion ou peinture époxyde à deux composants après cinq semaines de séchage : 3 000 à 20 000 Peinture à l'huile après cinq semaines de séchage : 20 000 à 70 000 Silicone de type acide, durci pendant trois jours, une semaine, quatre semaines : 14 000, 1 000, 100 Films d'acétate de cellulose en cours de dégradation : 900 à 100 000 Sources : bois et produits dérivés, peintures alkydes, peintures à l'huile, de nombreuses peintures-émulsions, produits d'étanchéité à la silicone de type acide, produits de nettoyage écologiques (à base de vinaigre), acétate de cellulose en cours de dégradation (« syndrome du vinaigre »), matières organiques en cours de dégradation, adhésifs de revêtement de sol, linoléum, métabolisme humain, contamination microbiologique des filtres de climatisation |
Acide formique (HCOOH) : 200 (plomb); 8 000 (cuivre) |
0,1 à 20 Source : dégradation de la matière organique |
Dans une pièce : 0,1 à 30 Caisse en bois : 2 à 2 000 Sources : bois et produits dérivés, peintures à l'huile, dégradation de la matière organique |
Ozone (O3) |
2 à 400 Source : smog photochimique |
Dans une pièce : 0,1 à 100 Pièce avec photocopieurs ou générateurs d'ozone : 4 à 600 Sources : épurateur d'air électronique, arcs électroniques, systèmes à électrofiltre, imprimantes laser, photocopieurs, sources de lumière ultraviolette (UV), éclairs, dispositif électrique pour tuer les insectes |
Dioxyde d'azote (NO2) : 50 (cuivre) |
2 à 100 Sources : composés d'oxydation de l'azote (NO) (sources de NO : engrais agricoles, combustion de carburant par les véhicules et les centrales thermiques, appareils de chauffage au gaz, éclairs, smog photochimique) |
Dans une pièce : 2 à 90 Émissions par les films de nitrate de cellulose : 4 000 Source : nitrate de cellulose en cours de dégradation (plastique ou film) |
Ammoniac (NH3) |
0,7 à 20 Sources : poussière de béton, industries d'engrais, industries de processus inorganiques, activités bactériennes souterraines, matières fécales des animaux |
Dans une pièce : 0,6 à 60 Immeuble recevant de 400 à 3 000 visiteurs/jour : 10 à 30 Sources : produits de nettoyage ménagers (par exemple, nettoyants liquides pour fenêtres), poussière de béton, peintures et adhésifs en émulsion, produits d'étanchéité à la silicone de type alcalin, visiteurs |
*Ces estimations se fondent sur des données pour des métaux propres se trouvant à un taux d'HR de 50 % à 60 % et à une température de 20 °C à 30 °C. |
||
Les gaz soufrés (H2 S, COS et SO2) réagissent avec les métaux en général, mais ils réagissent tout particulièrement avec l'argent, le cuivre et les alliages de cuivre, provoquant ainsi le ternissement de ces métaux (figure 36). Le sulfure d'hydrogène (H 2 S) est vraiment un problème parce qu'il réagit avec l'argent et le cuivre à de très faibles concentrations. L'argent exposé à une concentration d'à peine 0,1 μg m-3 (1 ppb) ternira habituellement en moins d'un an; il s'agit d'une concentration courante à l'intérieur d'un bâtiment (consulter le tableau 2), qui est bien au-dessous du seuil de détection olfactive (Tétreault, 2003). Le sulfure de carbonyle et le dioxyde de soufre peuvent également provoquer la corrosion, particulièrement pour le cuivre et ses alliages. Les gaz soufrés sont émis par des sources venant de l'extérieur comme de l'intérieur d'un bâtiment; à l'intérieur, les visiteurs et le personnel représentent l'une des sources les plus importantes. Le métal fraîchement poli est plus sujet au ternissement qu'un métal déjà recouvert d'une couche de ternissure.

© Gouvernement du Canada, Institut canadien de conservation. ICC 121590-0011
Figure 36. Objet en argent présentant une légère ternissure (teinte légèrement noirâtre avec reflets jaunâtres) due à l'exposition au soufre atmosphérique.
L'acide acétique et l'acide formique sont des polluants corrosifs qui peuvent réagir avec certains métaux, le plomb étant de loin le plus sensible. Le plomb se corrode s'il est exposé à une concentration d'à peine 400 μg m-3 d'acide acétique ou à 200 μg m-3 d'acide formique (Tétreault, 2003). Ces niveaux d'émissions sont largement atteints à proximité de certains matériaux, comme le bois et ses dérivés, les peintures et revêtements à l'huile ou à base d'alkyde et de nombreux produits d'étanchéité (tableau 2). Dans le contexte muséal, du plomb conservé dans une vitrine d'exposition ou une armoire de rangement en bois en est un exemple phare : il se recouvrira d'une couche de corrosion poudreuse blanche (figure 37). Les alliages plomb-étain ne sont pas aussi vulnérables à ces composés volatils acides que le plomb pur. Certains auteurs mentionnent que le formaldéhyde peut potentiellement poser un risque pour le plomb, le zinc, le cuivre et les alliages de cuivre; cependant, les risques sont négligeables dans les musées où les conditions ambiantes sont normales (Tétreault, 2003).

© Gouvernement du Canada, Institut canadien de conservation. ICC 87306-0059
Figure 37. Une corrosion poudreuse et blanche apparaît à la surface de certains médaillons et jetons en plomb et en alliage plomb-étain, dans un tiroir de rangement. La vitesse de corrosion dépend de la nature de l'alliage et de la stabilité de la patine. La corrosion est provoquée par les produits qui dégagent des acides organiques et qui se trouvent à proximité. Le plomb est particulièrement sujet à ce type de corrosion.
Remarque : Les produits de corrosion poudreux blancs sur le plomb sont toxiques. En présence de tels produits, il faut porter un équipement de protection individuelle (gants de nitrile, masque), ensacher l'objet de plomb afin d'empêcher l'étalement de ces produits et consulter un restaurateur afin de savoir comment procéder de façon sécuritaire pour enlever la corrosion et se débarrasser de ces produits toxiques.
L'ozone et les composés d'oxyde d'azote contribuent à la corrosion; par exemple, ils accroissent la vitesse de ternissement de l'argent (Rimmer et coll., p. 14). Par ailleurs, les composés d'oxyde d'azote (NOx) peuvent également provoquer des réactions de corrosion avec divers métaux, particulièrement le fer (figure 56b). L'ammoniac, qui peut se trouver dans l'air à l'intérieur d'un bâtiment en raison de l'utilisation de produits de nettoyage ménagers (par exemple, nettoyants liquides pour fenêtres) ou qui peut émaner de la poussière de béton, est aussi corrosif pour les métaux.
Poussières, traces de doigts, sels, acides gras, résidus de produits à polir
La poussière qui se dépose sur les objets métalliques peut contenir des sels et des particules hygroscopiques qui provoquent une corrosion localisée. En outre, la poussière peut obscurcir les détails décoratifs et agir comme abrasif sur une surface polie en cas de frottement.
Les traces de doigts et la transpiration (ou la sueur) des mains contiennent des sels, des huiles, de l'humidité, etc., qui sont facilement transférés sur des surfaces de métal et peuvent entraîner une corrosion notable, surtout sur les surfaces de métal polies (figure 38). Le chlorure de sodium (le sel) provenant des traces de doigts réagit avec l'argent pour former du chlorure d'argent, qui est sensible à la lumière et peut s'obscurcir au fil du temps, ce qui entraîne des traces de doigts très visibles et défigurantes sur les pièces polies.

© Gouvernement du Canada, Institut canadien de conservation. ICC 128594-0011
Figure 38a. Vue d'ensemble d'une épée et de son fourreau en laiton.

Gouvernement du Canada, Institut canadien de conservation. ICC 128594-0017
Figure 38b. Vue rapprochée de traces de doigts ayant corrodé la surface du fourreau en laiton. Des traces de ce genre sont presque impossibles à enlever sans polissage.
Un problème important pour les métaux dans les lieux maritimes est dû à la présence de sels (principalement des chlorures) dans l'air (sel marin en aérosol).
Les acides gras peuvent corroder les métaux. Les matériaux contenant des huiles, des graisses et des cires qui sont en contact avec des métaux à base de cuivre provoqueront le développement de produits de corrosion verts (produits de saponification du cuivre; figures 19 et 20).
La présence d'une corrosion caractéristique de couleur vert pâle, causée par la réaction entre le métal et les résidus de produits de polissage (figure 39), est un problème commun que l'on peut observer sur les objets de musée en cuivre et en alliages de cuivre.

© Gouvernement du Canada, Institut canadien de conservation. ICC 85802-0009
Figure 39. Les résidus de produit de polissage abrasif peuvent rester dans les creux ou les zones gravées à la suite d'un rinçage inadéquat. Ici, les résidus apparaissent vert pâle parce que des produits de corrosion verts ont taché le produit de polissage blanc.
Effets combinés des polluants, des contaminants et de l'humidité relative
L'HR joue un grand rôle dans le degré de corrosion que peuvent provoquer les polluants et les contaminants. Dans le cas de l'argent, pour une concentration donnée de polluants, le ternissement diminuera par un facteur de trois lorsque l'HR est abaissée de 75 % à 15 % (Rimmer et coll., 2013). Il est estimé que l'effet est davantage prononcé pour d'autres métaux : de manière approximative, lorsque l'HR est diminuée de 10 %, la dose minimale requise pour qu'un polluant provoque de la corrosion peut jusqu'à doubler (Tétreault, 2003). En d'autres mots, plus l'HR est élevée, plus la concentration seuil d'un polluant provoquant la corrosion d'un métal est basse.
L'effet nocif du sel, des huiles et des particules de métal dépend aussi grandement de l'HR :
- Les sels sont hygroscopiques et provoquent activement la corrosion, même à des taux faibles à modérés d'HR (Rimmer et coll., 2013) :
- Le fer et ses alliages contaminés par le sel peuvent souffrir de la corrosion active (figures 40a et 40b) à un taux d'HR aussi faible que 20 %, voire 12 % dans certains cas. Aux taux d'HR compris entre 20 % et 30 %, la vitesse de corrosion augmente progressivement. À des taux d'HR supérieurs à 30 %, la vitesse de corrosion augmente brusquement et à des taux d'HR de 50 % ou plus, la corrosion est très rapide.
- Le cuivre et ses alliages contaminés par le sel présentent un risque faible de corrosion uniquement si le taux d'HR est inférieur à 42 %. Aux taux compris entre 42 % et 68 %, le risque est présent et probablement de modéré à élevé, tandis qu'au-dessus de 68 %, il est très élevé.
- Dans de nombreux cas, la corrosion commence lorsqu'une particule (poussière) se dépose sur la surface d'un métal.
- Les particules de métal qui se déposent sur la surface d'un métal présentent des problèmes additionnels, car elles peuvent amorcer de nouveaux processus de corrosion.
- Les résidus huileux ont tendance à absorber les polluants atmosphériques, ils accroissent donc l'effet global de ces derniers (Tétreault, 2003, p. 28).

© Gouvernement du Canada, Institut canadien de conservation. ICC 129955-0011
Figure 40a. Cette tête de hache très corrodée est un exemple type de corrosion active sur un objet archéologique en fer contaminé par le sel.

© Gouvernement du Canada, Institut canadien de conservation. ICC 129955-0012
Figure 40b. La tête de hache de la figure 40a, de laquelle on a enlevé les couches fracturées, révélant ainsi les produits de corrosion de couleur vive près de la surface du métal.
Stratégies de protection contre la corrosion : l'approche à niveaux multiples
Les métaux sont sensibles à l'HR et aux polluants en général, mais à divers degrés : certains métaux courent un plus grand risque d'être endommagés dans des conditions intérieures normales. C'est pourquoi il est possible d'optimiser les résultats de la préservation en adoptant une approche à niveaux multiples. Certaines stratégies, comme la régulation du climat à des taux modérés d'HR (en évitant l'humidité excessive) et la filtration, devraient être appliquées pour assurer une protection globale de base pour l'ensemble de la collection. Par ailleurs, pour protéger les objets métalliques les plus vulnérables, on peut recourir à des mesures accrues et localisées, comme les microenvironnements, et appliquer ces mesures en priorité aux objets qui en profiteront le plus.
Avant de mettre en place l'approche de préservation à niveaux multiples, il faut déterminer les objets métalliques qui courent le plus grand risque dans la collection. Il n'est pas rentable d'assurer une protection maximale à tous les objets métalliques dans la collection, et il n'est pas conseillé non plus de supposer que tous les métaux requièrent les mêmes soins de base.
Stratégies visant l'ensemble de la collection
Protection contre l'eau liquide
- Éviter toutes les sources d'eau potentielles : l'eau peut provenir de canalisations percées, de la fonte de la glace, de fuites dues à des pluies intenses et au vent, d'inondations et de la condensation.
- Ne pas ranger les objets directement sur le plancher (figure 41). Dans le cas des objets lourds, on peut recourir à un appareil de levage et à des palettes spécialement construites.
- Recouvrir les étagères de rangement d'une bâche antipoussière étanche à l'eau (par exemple, des feuilles de plastique en polyéthylène ou des feuilles de non-tissé de polyéthylène [Tyvek]). Dans la mesure du possible, draper la bâche légèrement en pente. De cette façon, en cas d'infiltration d'eau, l'eau provenant du plafond ne s'accumulera pas sur la bâche, mais s'écoulera plutôt vers les extrémités de l'étagère.
- Enfermer les petits objets métalliques dans des sacs de qualité archives ou des boîtes résistantes à l'eau (consulter Contenants de protection).
- Éviter de mettre en réserve ou d'exposer des objets métalliques dans des endroits où il y a un risque de fuite d'eau (par exemple, près des tuyaux d'eau).

© Gouvernement du Canada, Institut canadien de conservation. ICC 125773-0185
Figure 41. La mise en réserve des objets sur des tablettes de métal robustes. Éviter de les laisser simplement sur le sol.
Maintenir un taux d'humidité relative modéré et éviter les taux élevés
Dans le cas des métaux, la priorité est de ne pas les exposer à des taux d'humidité trop élevés (HR > 65 %). Une plage modérée d'HR (40 % à 55 %), qui est normalement recommandée pour les objets faits de matières organiques (comme le bois, les textiles, les peintures) ou pour les objets composites, sera adéquate pour minimiser les risques de corrosion pour la majeure partie des métaux de la collection, mais non pour tous les objets : certains métaux requerront des conditions plus sèches. L'élimination de tous les risques d'HR élevée dans la collection aura des bénéfices sur toute la collection et améliorera l'efficacité des mesures localisées qui devront être mises en place pour les objets métalliques plus sensibles, car il sera alors possible d'établir des microenvironnements stables et efficaces à faible HR pendant de plus longues périodes (Rimmer et coll., 2013).
Pour assurer le contrôle du climat à l'intérieur de l'immeuble, un système mécanique actif (par exemple, le système CVC de l'immeuble) peut être utilisé si l'institution en possède un. Des moyens passifs peuvent aussi être utilisés; par exemple, améliorer l'enveloppe de l'immeuble, c'est-à-dire faire des réparations qui réduisent les risques de pénétration d'eau et qui améliorent l'isolation et l'étanchéité à l'air.
La température influence grandement l'HR. Dans les maisons historiques, si les murs ne sont pas bien isolés, par temps froid, des poches d'air froid peuvent se créer aux alentours de ces murs, ce qui refroidira l'air ambiant et provoquera un excès d'humidité, exposant ainsi les objets métalliques dans les environs à de plus grands risques de corrosion. En outre, la diminution rapide de la température extérieure peut causer une augmentation de l'HR à l'intérieur, ce qui favorise la corrosion.
Voici quelques stratégies de base de régulation de l'HR :
- Maintenir les objets à l'écart des zones froides de la pièce (par exemple, loin des murs extérieurs fenêtrés), car celles-ci provoqueront des poches d'air localisées et humides qui accroîtront les risques de corrosion des objets métalliques.
- Améliorer l'isolation de l'immeuble afin d'éliminer les gradients de température et les points froids.
- Assurer la circulation de l'air, car cela empêchera la concentration locale de poches d'humidité élevée pour, à tout le moins, ralentir la vitesse de corrosion.
- Surveiller les conditions ambiantes pour repérer les endroits froids ou humides. Dans les réserves et les salles d'exposition, installer des appareils de mesure continue de l'HR et de la température (enregistreurs de données, thermohygrographes, bandes indicatrices d'HR, etc.).
Pour connaître davantage de stratégies, consulter Agent de détérioration : humidité relative inadéquate.
Filtration
Consulter Agent de détérioration : polluants afin de connaître les objectifs de qualité de l'air recommandés pour les musées et les collections d'archives (tableau 2 pour les polluants gazeux et le tableau 6 pour les poussières et les particules). Ces objectifs sont de nature générale. Des mesures de protection supplémentaires (contenants de protection, etc.) sont requises pour les objets métalliques les plus sensibles aux polluants (par exemple, l'argent, le plomb), comme il est indiqué ci-dessous dans la section Stratégies pour obtenir une protection accrue.
Les stratégies de filtration des poussières et des gaz corrosifs dépendront du contexte. Si l'immeuble est déjà pourvu d'un système CVC, il peut s'avérer possible d'y ajouter un filtre à poussière plus efficace ainsi qu'une unité de filtration des gaz. À cette fin, il faudra plus d'énergie pour faire fonctionner le système, puisque l'air rencontrera une résistance accrue. Il existe une grande variété de filtres antipoussières, parmi lesquels il faudra choisir ceux qui correspondent à la taille des particules à capturer. Pour les locaux à bureaux, il est souvent recommandé d'utiliser des filtres antipoussières ayant une cote MERV (Minimum Efficiency Reporting Value [valeur de référence d'efficacité minimale de filtration]) de 10. Pour les musées, il est recommandé de choisir des filtres ayant une cote MERV supérieure, c'est-à-dire jusqu'à une valeur de 16, ce qui est similaire aux filtres HEPA utilisés dans les salles blanches, notamment en chirurgie ou en haute technologie. Par ailleurs, il existe différents types de sorbants qui peuvent filtrer des polluants gazeux spécifiques. Les sorbants actifs multiples (mélangés) sont les plus souvent utilisés dans les musées, car ils peuvent piéger toute une gamme de composés. Cependant, si un gaz précis est la source principale des dommages à la collection, il est possible de sélectionner un sorbant en particulier, optimisé pour le piéger.
Pour certains des gaz principaux, il faudrait installer des détecteurs sensibles jusqu'à l'échelle des ppb en amont et en aval du système de filtration. Il est aussi possible de mesurer la corrosivité de l'air en plaçant des coupons de métal dans la pièce pendant un certain nombre de semaines, puis en les faisant analyser (certaines compagnies qui fabriquent des filtres offrent des services techniques de ce type). Cela permet de vérifier la performance du système de filtration et d'établir à quel moment il faudra changer les filtres. Il est également possible de déterminer la fréquence de remplacement des filtres en envoyant le support filtrant (la matière filtrante), après quelques mois d'utilisation, à une entreprise spécialisée qui en mesurera le degré d'épuisement. S'il n'est pas possible d'effectuer de tels essais, il est suggéré de remplacer les filtres à gaz chaque année.
Si l'immeuble n'est pas pourvu d'un système CVC (ce qui peut être le cas, par exemple, des immeubles anciens et des maisons historiques), il est toujours possible d'utiliser des unités de filtration portables pour les particules ou les gaz/particules dans les pièces où les objets risquent de se corroder.
Protection contre les poussières
Pour protéger les objets métalliques contre les dépôts de poussière, utiliser autant que possible des contenants de protection (consulter Contenants de protection) ainsi que des housses et des bâches antipoussières. Les bâches antipoussières peuvent recouvrir les étagères ou être installées comme des rideaux sur les côtés, ou encore, des housses peuvent recouvrir les objets individuellement ou des groupes d'objets sur des étagères. Pour protéger les objets métalliques surdimensionnés, des pare-poussière devront être utilisés. Il faut également minimiser les sources de poussière à l'intérieur du musée (par exemple, en plaçant des tapis aux entrées afin de réduire la saleté apportée de l'extérieur; toutefois, on évitera d'utiliser des tapis ailleurs, car ils dégagent des fibres dans l'air). Consulter Agent de détérioration : polluants pour connaître davantage de stratégies de protection contre les poussières.
Gants
Il faut éviter de toucher les surfaces de métal avec les mains nues. Les traces de doigts sur le métal sont un problème courant lorsque les visiteurs peuvent toucher les objets exposés ou que le personnel n'observe pas les bonnes procédures de manipulation (figure 42).
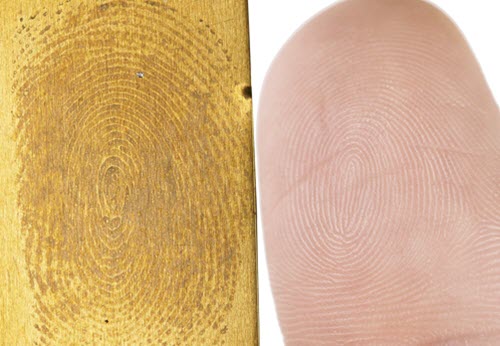
© Gouvernement du Canada, Institut canadien de conservation. ICC 120260-0065
Figure 42. Si l'on touche des surfaces de métal avec les mains nues, cela peut laisser des traces de doigts corrodées à la surface du laiton, comme la marque de cette empreinte de pouce.
Il est recommandé de porter des gants de plastique propres appropriés (par exemple, gants de nitrile) pour manipuler les objets (Rimmer et coll., 2013). Les gants qui conviennent le mieux pour manipuler les métaux, surtout les métaux polis, sont les gants de nitrile exempts d'agents accélérants chimiques (par exemple, gants de nitrile sans N-DEX). Des gants de coton propres peuvent aussi être utilisés, mais il faut noter que les sels de chlorure peuvent traverser les gants de coton au cours d'une seule utilisation. De plus, les gants de coton neufs contiennent du chlorure résiduel provenant de leur traitement; il faut donc les laver avant de les utiliser.
Produits sécuritaires pour la mise en réserve et l'exposition
Il faudra éviter d'utiliser des produits qui dégagent des substances volatiles nocives à proximité des objets métalliques, en particulier :
- le bois et ses dérivés, à moins qu'ils ne soient scellés (description ci-dessous) : ils émettent de l'acide formique, de l'acide acétique, des aldéhydes et des péroxides;
- les revêtements et peintures au latex (émulsion) fraîchement appliqués (description ci-dessous) : ils émettent de l'acide acétique et de l'ammoniaque;
- les revêtements et peintures alkydes ou à base d'huile : ils émettent de l'acide formique, de l'acide acétique et des péroxides;
- les agents d'étanchéité (joints d'étanchéité, produits en caoutchouc) et les adhésifs à la silicone : ceux de type acide émettent de l'acide acétique, et ceux de type alcalin, de l'ammoniac;
- les joints d'étanchéité en caoutchouc et tout produit en caoutchouc : ils émettent des gaz sulfurés.
Pour la fabrication de supports et de boîtes ainsi que la construction d'armoires et de vitrines d'exposition, utiliser des produits connus comme étant sécuritaires (par exemple, du carton à passe-partout sans acide, des panneaux de plastique en acrylique ou en polyéthylène, des produits d'étanchéité sans silicone, du métal, du verre). Porter une attention particulière au choix des matériaux utilisés pour les structures closes qui contiendront des objets métalliques. Examiner avec soin les produits (tissu, feutre, adhésif, peinture, joint d'étanchéité) qui seront utilisés à l'intérieur des vitrines d'exposition et d'autres types de contenants de protection pour s'assurer qu'ils sont sécuritaires. Noter, en particulier, ce qui suit :
- Bois et produits dérivés : éviter de les utiliser s'ils doivent couvrir de vastes surfaces; utiliser plutôt des produits sécuritaires, comme des panneaux de contreplaqué revêtu de densité moyenne ou de haute densité (ce sont des panneaux dont la surface du bois est revêtue d'une couche étanche de papier imprégné d'une résine stable); ou étanchéifier les surfaces de bois au moyen d'un film barrière d'aluminium plastifié (Marvelseal; figure 43) ou de tout autre film barrière convenable. Les peintures, vernis et autres revêtements de ce genre ne forment pas, généralement, des couches étanches efficaces contre les gaz nocifs émis par le bois (de plus, la plupart des peintures et des vernis sont eux-mêmes des sources d'émissions nocives, comme cela est traité ci-dessous).
- Peintures, vernis et autres revêtements semblables : en règle générale, garder les objets métalliques loin de l'environnement des salles, des meubles ou des décors peints ou vernis, surtout si l'application est fraîche ou récente. S'il faut utiliser une peinture, un vernis ou un revêtement sur une surface à l'intérieur d'une pièce qui abritera des objets métalliques, choisir un produit au latex (c'est-à-dire à émulsion), car c'est le produit le moins nocif pour les métaux. Il faut quand même prévoir une période d'aération avant de remettre les objets métalliques dans le même environnement, car même les produits au latex dégageront des taux élevés de gaz nocifs, mais juste pendant un certain temps. Si le produit est appliqué à l'intérieur d'un espace clos, comme une vitrine d'exposition ou un autre type de contenant de protection, il faut laisser aérer pendant au moins quatre semaines avant d'y installer un objet métallique. Si le produit est appliqué sur des surfaces exposées à l'air libre d'une pièce bien ventilée, prévoir au moins quatre jours d'aération.
- Utiliser un matériau intercalaire, comme une pellicule de polyester (Melinex), afin d'éviter le contact direct entre les objets métalliques et les produits qui dégagent des gaz nocifs, notamment le bois, les dérivés du bois et toute surface peinte ou vernie, incluant les surfaces peintes ou vernies au latex.
- Éviter de ranger un objet dans son étui d'origine (par exemple, l'étui d'un instrument de musique ou d'une médaille) s'il est fait de bois, de carton, de mousse ou de cuir, à moins d'avoir déterminé qu'il n'est pas acide et ne dégage pas de gaz nocifs.

© Gouvernement du Canada, Institut canadien de conservation. ICC 124491-0028
Figure 43. Un film barrière d'aluminium plastifié (Marvelseal) est appliqué sur une surface en bois au moyen d'un fer. Les gaz ne peuvent traverser la couche en aluminium du Marvelseal. Ainsi, si toutes les surfaces sont recouvertes et thermoscellées, les émissions nocives provenant du bois et des produits du bois seront entièrement bloquées.
Consulter le Bulletin technique 32 Produits utilisés en conservation préventive afin d'en savoir davantage sur les produits sécuritaires pour la mise en réserve et l'exposition. Consulter également le Bulletin technique 21 Revêtements pour l'exposition et la mise en réserve dans les musées pour en savoir davantage sur les peintures, les vernis et autres revêtements semblables utilisés dans un contexte muséal.
Contact ou proximité avec d'autres objets muséaux
Certains objets de musée dégagent des gaz nocifs ou produisent des sous-produits nocifs, notamment :
- le nitrate de cellulose (par exemple, l'ivoire d'imitation);
- l'acétate de cellulose en cours de dégradation (« syndrome du vinaigre »);
- les spécimens minéraux de pyrite (ces spécimens peuvent se dégrader et produire de l'acide sulfurique);
- le caoutchouc;
- la laine en cours de dégradation;
- les objets en bois, particulièrement si la superficie en bois est importante;
- les objets peints, particulièrement si la superficie peinte est importante.
S'assurer que les objets en métal ne sont ni en contact direct avec ces objets, ni placés tout près de ceux-ci s'ils se trouvent ensemble dans un espace clos. D'ailleurs, cette consigne est, en général, tout autant bénéfique pour les autres types d'objets parce que les produits de corrosion à la surface des objets métalliques pourraient les tacher.
Stratégies pour obtenir une protection accrue
Objets qui nécessitent une protection accrue
Dans le cadre de la protection d'une collection d'objets métalliques contre la corrosion, l'approche à niveaux multiples consiste à repérer les objets métalliques dans la collection qui sont instables ou le plus à risque afin de leur assurer une protection accrue sur mesure. Les objets qui manifestent une corrosion active (comme il est décrit à la section Surfaces stables et corrosion active) requièrent des mesures plus poussées. Les signes habituels de corrosion active comprennent les fissures, l'écaillage et la présence de produits de corrosion en poudre autour de l'objet (figures 44a, 44b et 45).

© Musée des sciences et de la technologie du Canada. ICC 125760-0012
Figure 44a. Une aile d'hydroptère retirée d'une embarcation Baddeck de 1956 et faite d'un alliage de cuivre, probablement de monel (alliage de cuivre et de nickel). Les produits de corrosion verts sont tombés sur la palette de bois, ce qui est un signe de corrosion active indiquant clairement que les mesures de conservation préventive mises en œuvre dans la pièce sont insuffisantes pour cet objet.

© Musée des sciences et de la technologie du Canada. ICC 125760-0018
Figure 44b. Vue rapprochée de la figure 44a montrant la surface piquée et les taches de corrosion d'un vert intense. L'analyse effectuée à l'ICC a indiqué la présence de cuivre, de nickel et de chlorures dans les produits de corrosion.
Les objets métalliques qui, généralement, requièrent une protection accrue ainsi que les stratégies de conservation préventive qui s'appliquent à chacun sont présentés ci-dessous. Les moyens de mise en œuvre de ces stratégies sont décrits dans la section Microenvironnements.
- Fer et alliages contaminés par les chlorures (par exemple, objets marins et archéologiques, machinerie industrielle contaminée par des dépôts de sel de voirie ou des poussières provenant de l'extérieur) : conserver les objets dans un milieu aussi sec que possible (HR de 0 % à 10 %) en utilisant un dessiccatif dans des contenants de protection bien étanches faits de matériaux à faible perméabilité à l'humidité. En cas de corrosion active (comme l'objet à la figure 45), la stratégie la plus efficace consiste souvent à placer l'objet dans un milieu anoxique (dans lequel on emploie des films barrières spécialisés et un désoxygénant [absorbant d'oxygène] en combinaison avec un dessiccatif).
- Alliages de cuivre contaminés par les chlorures (par exemple, objets d'origine archéologique ou marine) : utiliser des contenants de protection (comme des boîtes ou des sacs) étanches à l'air comportant un dessiccatif afin de maintenir une HR aussi faible que possible. Le risque de corrosion diminue significativement si l'HR reste inférieure au seuil de 42 % (Rimmer et coll., 2013). L'utilisation d'un milieu anoxique et d'un dessiccatif constitue également une méthode efficace.
- Argent, particulièrement s'il est poli :porter des gants pour manipuler l'objet, s'assurer qu'il n'y a aucun dépôt de poussière ou de contaminants sur sa surface et placer l'objet propre dans un sac ou un autre type de contenant de protection étanche à l'air. Inclure un matériau efficace pour retirer les gaz soufrés (par exemple, tissu prévenant le ternissement [comme le Pacific Silvercloth]; figure 46), ainsi qu'un dessiccatif pour créer un environnement sec. S'assurer que les produits utilisés pour la fabrication du contenant de protection et les objets à proximité ne contiennent pas de matières qui dégagent du soufre (comme le caoutchouc ou certaines peintures). Éviter de polir trop souvent. Si la ternissure réapparaît, c'est un signe qu'il faut accroître le niveau de protection (utilisation d'un contenant de protection plus épais [par exemple, doubler l'ensachement] ou plus étanche, installation de filtres expressément à cet endroit, utilisation d'une plus grande quantité de matériau dessiccatif, utilisation d'un sorbant plus efficace contre les gaz soufrés, etc.).
- Cuivre et alliages polis : utiliser les mêmes stratégies accrues que pour l'argent, décrites ci-dessus.
- Plomb (y compris l'alliage plomb-étain et la brasure au plomb) : éviter de le mettre en contact direct ou dans un espace clos avec des matières qui dégagent des gaz acides organiques (bois et dérivés du bois, carton acide, peintures, produits d'étanchéité, etc.), ou encore à proximité de telles matières. Protéger les objets en plomb des gaz acides organiques normalement présents dans l'air ambiant en les plaçant dans des contenants de protection étanches à l'air, faits de matériaux sécuritaires (par exemple, carton à passe-partout sans acide, métal, verre, plastiques sécuritaires, bois étanchéifié avec un film barrière [Marvelseal]). Au besoin, accroître la protection en utilisant du charbon activé à l'intérieur de ces contenants. S'il est impossible d'éviter l'utilisation de peintures dans la salle où se trouvent des objets en plomb, employer une peinture au latex, ventiler la salle bien au-delà du minimum de quatre jours (dans la mesure du possible, pendant plusieurs semaines) et prévoir pour les objets en plomb des contenants de protection munis de charbon activé.
- Métaux exposés aux polluants ou à la poussière : si les polluants ou la poussière dans certaines pièces ou certains endroits sont à des niveaux élevés et qu'on ne peut ni éliminer leur source, ni en réduire suffisamment le niveau au moyen de la ventilation ou d'autres mesures à l'échelle de l'immeuble ou de la pièce, utiliser alors des contenants de protection étanches pour créer un microenvironnement pouvant garder les métaux à risque à l'abri. Pour accroître la protection, il est possible d'insérer des dessiccatifs et des sorbants dans les contenants. Si un objet est sale ou empoussiéré, il faut déterminer s'il est possible ou sécuritaire de le nettoyer et, au besoin, consulter un restaurateur pour obtenir des directives à cet effet.
- Articles précieux pour lesquels une corrosion minime ou progressant à un taux faible est jugée inacceptable : assurer une protection optimale contre l'HR, la poussière et les polluants en utilisant des contenants de protection étanches à l'air ainsi qu'un dessiccatif et un sorbant pouvant protéger le métal en cause (par exemple, un tissu prévenant le termissement pour l'argent, du charbon activé pour les autres métaux).
- Objets composites avec un composant métallique soumis à une corrosion active : si cela est pertinent et possible, séparer le métal du reste de l'objet (par exemple, une épée métallique peut probablement être retirée de son fourreau fait de matières organiques) et placer le métal dans un endroit où l'HR est plus faible et appropriée. Une autre option consiste à ranger tout l'objet dans un milieu anoxique étanchéifié, tout en maintenant l'HR à une valeur ambiante normale (autour de 40 % à 50 %, car une HR plus basse pourrait endommager les matières organiques). Le désoxygénant, qui retire l'oxygène, devrait faire cesser la plupart des réactions de corrosion et, souvent, même celles du fer ou de l'acier contaminé par le sel. Sinon, le gel de silice conditionné peut être utilisé pour réduire l'HR à une valeur qui offre le meilleur compromis pour protéger tant les composants métalliques de l'objet que les composants organiques.

© Gouvernement du Canada, Institut canadien de conservation. ICC 129955-0013
Figure 45. Un morceau de ce boulet est tombé au cours d'une manipulation, ce qui a révélé une corrosion orange active due à la présence de sels de chlorure. La contamination par les chlorures, prévalente chez les objets provenant d'un environnement marin, cause une forme très destructive de corrosion. La mise en réserve et l'exposition dans un environnement très sec (par exemple, sous 20 %) ralentira la réaction. Un traitement chimique est nécessaire pour stabiliser davantage l'objet.

© Gouvernement du Canada, Institut canadien de conservation. ICC 125773-0069
Figure 46. Protéger un objet en argent en l'enveloppant dans du papier de soie sans acide et ensuite dans un tissu pouvant prévenir le ternissement (par exemple, du Pacific Silvercloth), puis le sceller dans un sac à fermeture à glissière.
Il est nécessaire de documenter l'état des objets métalliques dans la collection et de les surveiller sur une base régulière. En particulier, il faut documenter l'étendue de la corrosion présente et surveiller les nouvelles occurrences de corrosion. Les photographies peuvent être très utiles, car elles permettent de déterminer si les stratégies de préservation adoptées contre la corrosion sont efficaces. Si des problèmes sont relevés, corriger la situation ou accroître le niveau de protection expressément pour les objets qui en ont besoin. Assurer la formation du personnel pour qu'il reconnaisse ces problèmes et établir un mécanisme qui permet de les documenter et de les régler promptement.
Microenvironnements
L'utilisation de microenvironnements représente la solution la plus courante pour protéger les objets métalliques à risque de corrosion. Un microenvironnement consiste en un espace isolé étanchement du reste de la salle, à l'intérieur duquel sont maintenues des conditions ambiantes distinctes qui favorisent la conservation de l'objet métallique contenu dans cet espace. Un microenvironnement requiert l'utilisation d'un contenant de protection (contenant fait d'un matériau barrière assemblé au moyen de joints étanches) dans lequel on place un ou plusieurs produits spécialisés (par exemple, un dessiccatif pour abaisser l'HR, un sorbant pour retenir certains polluants gazeux ou encore un désoxygénant pour créer des conditions anoxiques et ainsi faire cesser l'oxydation). Les composants nécessaires pour créer un microenvironnement sont décrits plus en détail ci-après.
Contenants de protection
Un contenant de protection est tout type d'enceinte ou de structure physique qui enferme complètement un objet et l'isole du reste de la salle (par exemple, sacs, boîtes, armoires de rangement ou vitrines d'exposition; figures 47, 48 et 49). Les contenants de protection les plus efficaces sont ceux faits de matériaux étanches (matériaux barrières) assemblés à l'aide de joints également étanches. Les objets métalliques placés dans des contenants de protection sont à l'abri de plusieurs menaces, dont les suivantes :
- Les forces physiques : les contenants de protection munis de rembourrage, autant ceux conçus pour un seul objet que ceux qui sont assortis de cloisons séparatrices afin d'y loger plusieurs objets, offrent l'avantage d'empêcher les objets de se toucher ou de se heurter accidentellement pendant la manipulation. Cela évite ainsi les dommages physiques, comme des fêlures et des rayures, ainsi que l'apparition de taches de corrosion galvanique.
- La poussière, la saleté, les traces de doigts et les sels en aérosol : les contenants de protection sont efficaces pour protéger contre tous ces contaminants; toutefois, la poussière et les aérosols parviendront à pénétrer à moins d'assurer l'étanchéité des joints.
- Les polluants gazeux : les contenants de protection, même de simples sacs de polyéthylène refermables (figure 48), peuvent également être utilisés avantageusement contre les polluants gazeux. Dans les endroits où l'air extérieur est pollué, on peut utiliser la règle empirique de « 100, 10, 1 » pour estimer les avantages qu'offrent une ou deux enveloppes protectrices. Par exemple, s'il y a 200 ppb de dioxyde d'azote à l'extérieur, la concentration à l'intérieur d'une pièce dans un bâtiment sera habituellement de 20 ppb, alors que la concentration à l'intérieur d'un contenant de protection étanche (vitrine d'exposition étanche, sac fermé) sera de 2 ppb. Un contenant assure une protection seulement s'il ne comporte aucune source interne de polluant (par exemple, aucun produit dégageant des gaz nocifs n'est utilisé dans sa fabrication et aucun objet dégageant des gaz nocifs n'y est rangé avec l'objet métallique [consulter Produits sécuritaires pour la mise en réserve et l'exposition). On peut accroître la protection contre les polluants en utilisant des sorbants (décrits dans la section Sorbants pour retenir les polluants).
- L'humidité relative : utilisé seul, un contenant de protection permet de parer contre les conditions défavorables d'HR ambiante, mais seulement jusqu'à un certain point. En fonction du matériau dont est fait le contenant, il peut protéger l'objet dans une certaine mesure contre les pointes élevées d'HR et les fluctuations à court terme. Cependant, pour obtenir les conditions de faible HR dont ont besoin les métaux sensibles, il faut ajouter un dessiccatif (consulter Dessiccatifs). Les matériaux étanches à l'air offrant une faible perméabilité à l'humidité devraient être utilisés afin d'optimiser le rendement.

© Gouvernement du Canada, Institut canadien de conservation. ICC 125773-0187
Figure 47. Exemple de bon système de rangement pour les métaux. Une armoire métallique revêtue d'une peinture-émail cuite est stable et ne dégage aucun gaz nocif. On a ensaché les objets pour éviter qu'ils se trouvent en contact les uns avec les autres, car cela risquerait d'entraîner la corrosion galvanique, des fêlures ou des rayures. Les objets reposent sur une doublure en mousse servant de matelassure.

© Gouvernement du Canada, Institut canadien de conservation. ICC 125773-0067
Figure 48. De simples sacs de plastique à fermeture à glissière constituent un moyen facile et économique de réduire les risques de corrosion due à des sources externes de polluants. De plus, ils assurent une protection contre les traces de doigts, la poussière et les autres contaminants. On doit comprimer le sac avant de le fermer pour en expulser l'air.

Artefacts en exposition : Coup de patins – La passion canadienne pour le patinage, 2006 Musée canadien d'histoire, IMG2009-0363-0017-Dm (détail)
Figure 49. Les vitrines servent souvent à protéger les objets en argent contre les conditions ambiantes (pollution, poussière, humidité) pendant une exposition. Un bac caché sous le présentoir de la vitrine est rempli de gel de silice conditionné pour réduire le taux d'HR à l'intérieur de la vitrine. On peut aussi inclure du charbon activé ou d'autres types de sorbants qui retiennent les composés soufrés gazeux.
L'efficacité avec laquelle un contenant assure une protection contre l'humidité et les polluants dépend du type de matériau barrière utilisé (plus précisément, du coefficient de perméabilité du matériau à la vapeur d'eau ou aux polluants qu'il doit contrer), de l'épaisseur de ce matériau ainsi que de l'étanchéité des joints de l'assemblage. On peut accroître la protection en multipliant le nombre de couches; par exemple, on peut emballer les objets dans plusieurs couches de papier de soie sans acide et les placer dans un contenant qu'on emboîte ensuite dans un autre (double sac de plastique ou sac de plastique dans une boîte ou vice versa); ou encore, on peut ranger les objets dans des sacs ou des boîtes closes et les placer à l'intérieur d'armoires fermées. L'ajout de couches accroît l'effet de blindage, particulièrement contre la poussière et les polluants externes.
Les désavantages des contenants de protection sont ceux du coût, du temps requis pour en munir tous les objets d'une grande collection et, si des dessiccatifs et des sorbants sont utilisés, de l'accès restreint aux objets (un environnement étanche est requis pour préserver les conditions ambiantes voulues à l'intérieur du contenant).
Matériaux barrières
Il est important que tout matériau dont est fait le contenant de protection ne dégage aucun gaz corrosif (consulter Produits sécuritaires pour la mise en réserve et l'exposition). Voici quelques options de matériaux couramment utilisées offrant un certain niveau de propriétés barrières :
- Sacs de polyéthylène : les sacs de polyéthylène étanches sont une option économique pour assurer la protection contre la poussière et les polluants, de façon générale, et peuvent atténuer jusqu'à un certain degré les effets des fluctuations importantes et soudaines de l'HR ou encore les conditions humides à court terme. Un des avantages du polyéthylène est qu'il est thermosoudable, ce qui permet de créer un joint étanche à l'air. Cependant, pour maintenir des conditions de faible HR au moyen de dessiccatifs, les sacs de polyéthylène ne sont pas efficaces, car le polyéthylène (dans ce cas, le polyéthylène basse densité [PEBD]) offre une faible étanchéité à la vapeur d'eau à long terme, et la plupart des sacs sont faits d'une couche de plastique relativement mince comparativement à l'épaisseur des parois d'une boîte de plastique munie d'un couvercle parfaitement jointif (par exemple, munie de joints d'étanchéité). Pour une meilleure performance, utiliser des feuilles ou des sacs de polyéthylène plus épais (sacs pour congélateur) ou doubler le nombre de couches. Certaines feuilles et certains sacs de polyéthylène en vente dans le commerce ont une durée de vie limitée, car le plastique devient cassant et se déchire après 5 à 10 ans. Cependant, les sacs de PEBD de qualité alimentaire sont probablement plus stables que d'autres types de sacs. Il est à noter que, puisque les agents antiadhérents et les agents de glissance à l'intérieur du sac (qui empêchent les deux côtés du sac de coller ensemble) peuvent rayer l'argent, il faut d'abord envelopper les objets en argent dans du papier de soie sans acide (figure 50).

© Gouvernement du Canada, Institut canadien de conservation. ICC 125773-0068
Figure 50. Envelopper un objet en argent dans du papier de soie avant de le ranger et de le sceller à l'intérieur d'un sac de polyéthylène.
- Sacs faits de feuilles de polyester transparent [poly(téréphtalate d'éthylène) (PTE), Melinex, Mylar] : une feuille de PTE est 100 fois moins perméable aux gaz de sulfure d'hydrogène (H2S) qu'une feuille de PEBD (Tétreault, 2003, p. 135). Ce plastique sous forme de sac ou d'emballage est donc utile pour protéger les objets en argent mis en réserve (figure 51). Ce plastique présente toutefois le désavantage de ne pas être thermosoudable.

Photo Musée canadien de l'histoire, Rebecca Latourelle, IMG2018-0026-0001-Dm
Figure 51. Objets en argent enveloppés dans du polyester (Mélinex, anciennement connu sous le nom de Mylar). Certains sont d'abord recouverts d'un papier de soie, puis d'un tissu de couleur brune pouvant prévenir le ternissement à l'intérieur de l'emballage de plastique.
- Films barrières stratifiés à faible perméabilité : ces films barrières stratifiés sont conçus pour être presque complètement imperméables aux gaz, à la vapeur d'eau et à l'oxygène, et ils sont thermosoudables, ce qui permet d'en créer des sacs dont les joints sont étanches. Les films de métal plastifié (comportant habituellement une feuille d'aluminium entre deux couches de plastique, par exemple le Marvelseal) sont généralement le film barrière le plus efficace, mais ils ont le désavantage de ne pas être transparents. Certains films plastiques stratifiés spécialisés (par exemple, les films Escal) sont transparents et presque aussi efficaces, mais ils sont également coûteux. Des sacs faits de ces types de films offrent la meilleure protection possible pour contrer l'infiltration de la vapeur d'eau, de l'oxygène et des polluants.
- Boîtes munies de joints d'étanchéité : ces boîtes sont en vente dans le commerce (comme les boîtes pour aliments Lock & Lock) et peuvent être faites entièrement de plastique polyéthylène assez épais (elles seront alors d'un aspect laiteux) ou en verre transparent avec un couvercle en plastique. Leur couvercle est muni d'une garniture de joint d'étanchéité sur le pourtour et de volets de fixation sur chaque côté permettant de fixer le couvercle à la boîte, ce qui créé un joint relativement bien étanche (figure 52).
- Boîtes de polystyrène : celles-ci ont l'avantage d'être tout à fait transparentes, mais elles ne se ferment pas de façon assez étanche pour assurer une faible HR sur une longue période.
- Vitrage des vitrines d'exposition (figure 49) : pour que la vitrine d'exposition puisse maintenir son propre microenvironnement, il faut utiliser du verre, car les feuilles d'acrylique (Plexiglas, Acrylite) ne sont pas suffisamment imperméables à la vapeur d'eau pour maintenir des conditions de faible HR sur une longue période.
- Bois et produits dérivés du bois : ils sont perméables à la vapeur d'eau, sauf s'ils sont étanchéifiés. Leur étanchéisation assurera également un milieu intérieur ne dégageant aucune émission. Parmi les choix qui satisfont aux critères de la conservation des objets de musée, il est possible d'utiliser des produits de bois correctement étanchéifiés au préalable, comme des panneaux de contreplaqué revêtu de densité élevée ou moyenne, ou des produits du bois qui ont été thermoscellés d'un film métallique plastifié (Marvelseal).
Étanchéité à l'air et qualité des joints d'étanchéité
Un contenant de protection peut maintenir un microenvironnement seulement si ses joints d'étanchéité sont étanches à l'air : ils empêchent ainsi l'infiltration d'air provenant du milieu extérieur. Dans le cas des emballages souples, comme les sacs de polyéthylène ou en Escal, ils doivent être bien scellés de sorte que, quand ils sont légèrement pressés, il est possible de sentir la résistance de l'air qui y est emprisonné. En règle générale, la meilleure étanchéité est obtenue par thermoscellage. Les fermetures à glissière ou celles qui consistent à rabattre une partie du sac et à utiliser du ruban adhésif ne sont pas aussi étanches. Les boîtes avec couvercles verrouillables ou joints de compression peuvent également assurer une assez bonne étanchéité à l'air. Dans le cas des vitrines d'exposition et des armoires de rangement, pour réduire autant que possible les infiltrations d'air, il faut s'assurer de minimiser les trous et les fentes (s'il y en a, ils devraient être si minuscules qu'ils sont difficilement visibles à l'œil nu), et voir à ce que tous les joints et les garnitures d'étanchéité soient très bien ajustés de sorte qu'on ne puisse faire passer une feuille de papier d'épaisseur normale à travers les joints. En règle générale, la construction d'une vitrine d'exposition bien étanche doit intégrer des éléments conceptuels particuliers afin que ses joints d'étanchéité puissent maintenir un taux d'un échange d'air par jour, performance typiquement nécessaire pour établir un microenvironnement de faible HR [Tétreault, 2003, p. 48]). Consulter la vaste documentation sur la conception de vitrines d'exposition étanches à l'air pouvant protéger les objets métalliques lorsqu'ils sont exposés, par exemple Rimmer et coll., 2013.
La température doit demeurer constante afin de ne pas faire varier l'HR à l'intérieur d'un contenant de protection étanche à l'air. Il faut, dans la mesure du possible, retirer l'air en excès (par exemple, en comprimant un sac souple) et ne pas placer le contenant de protection près d'une source de froid, car les températures froides causeront une augmentation de l'HR à l'intérieur du contenant de protection, ce qui est à éviter pour la sauvegarde des métaux. Garder le contenant à au moins 10 cm d'un plancher ou d'un mur extérieur (froid), ou en assurer l'isolation (Tétreault, 2003).
Dessiccatifs
La meilleure façon d'assurer un milieu sec (30 % ou moins), qui est l'idéal pour les métaux, consiste à utiliser des dessiccatifs. Ceux-ci, comme le gel de silice déshydraté ou d'autres produits similaires (Desi Pak, ProSorb), sont des produits qui absorbent l'humidité dans l'air ambiant et qui, lorsqu'ils sont ajoutés à l'intérieur d'un contenant de protection suffisamment étanche, y créent un milieu à faible HR (figure 52).

© Gouvernement du Canada, Institut canadien de conservation. ICC 126258-0001
Figure 52. Pour freiner la corrosion, ces objets ferreux sont enveloppés dans des sacs à fermeture à glissière, puis placés à l'intérieur d'une boîte de plastique aux joints étanches, dans laquelle il y a du gel de silice déshydraté au fond. Une poche remplie de gel de silice déshydraté et une carte hygrométrique sont placées sur le dessus.
Points à considérer lorsqu'on utilise des dessiccatifs :
- Étudier les différences entre les divers produits; certains produits offrent un meilleur rendement que d'autres dans une plage d'HR donnée ou sont plus simples et plus commodes à utiliser (par exemple, les dessiccatifs en sachets, comme Desi Pak).
- La qualité du contenant de protection (matériau barrière et joints d'étanchéité) joue un rôle au moins aussi important que celui du dessiccatif pour maintenir l'HR à une valeur faible à l'intérieur du contenant.
- Utiliser suffisamment de dessiccatif pour le volume d'air enfermé. Utiliser au minimum la quantité recommandée par le fabricant et envisager de l'augmenter (par exemple, la doubler, la tripler ou même la quadrupler) pour réduire la fréquence d'entretien. Parce qu'un sac est souple, comme contenant de protection, il a l'avantage de permettre d'évacuer la majeure partie de l'air emprisonné, ce qui réduira la quantité de dessiccatif requise pour le volume d'air en cause. Cependant, il faut aussi considérer la perméabilité à la vapeur d'eau du matériau dont est fait le sac (utiliser des sacs Escal; les sacs de plastique polyéthylène, même épais et doubles, sont habituellement trop perméables pour être utilisés avec des dessiccatifs).
- S'assurer que le dessiccatif est correctement conditionné au préalable (suivre les instructions du fabricant) et qu'il est reconditionné périodiquement afin de préserver le milieu à faible HR dans la plage acceptable. D'habitude, si le gel de silice est chauffé à environ 100 ºC pendant 8 à 10 heures, l'eau qu'il a adsorbée s'élimine totalement : il est alors déshydraté et prêt à être utilisé pour créer une HR de près de 0 % à l'intérieur d'un contenant de protection étanche. Comme aucun contenant n'est parfaitement étanche, l'HR augmentera au fil du temps. Il faut déterminer la plage d'HR acceptable pour l'objet (par exemple, entre 0 % et 30 % d'HR) et prévoir un mécanisme de détection pour déterminer à quel moment le seuil supérieur est atteint, ce qui indique aussi à quel moment le dessiccatif doit être déshydraté à nouveau. Pour prolonger la période pendant laquelle le contenant de protection demeure performant et réduire la fréquence d'entretien du dessiccatif, il est tout indiqué d'investir dans des matériaux de grande qualité qui assureront une bonne étanchéité du contenant et, aussi, d'utiliser aussi plus de dessiccatif dans le volume d'air que la quantité minimale requise.
- S'assurer qu'il y a une circulation d'air suffisante entre le dessiccatif et l'air autour de l'objet. L'utilisation de dessiccatif dans une vitrine d'exposition nécessite de porter une attention particulière à certains aspects de la conception de cette dernière. Normalement, le présentoir où reposent les objets dans la vitrine est pourvu de trous ou de fentes (masqués par un tissu) qui permettent une circulation d'air suffisante à partir d'un bac inférieur rempli de dessiccatif. Il faut veiller à ce qu'il y ait un accès direct au bac de dessiccatif se trouvant dans le socle de la vitrine.
- Surveiller l'HR à l'intérieur du contenant de protection à l'aide d'un détecteur posé près de l'objet. Cela est nécessaire pour s'assurer que le dessiccatif réussit à atteindre et à maintenir le niveau d'HR recherché. Dans le cas des objets dans la réserve, des cartes hygrométriques (indicatrices de l'HR) dans les contenants transparents conviennent très bien à cette fin (figure 52).
- Éviter les dessiccatifs qui contiennent du chlorure de lithium, ce qui peut provoquer la corrosion des métaux par contact direct. Les anciens gels de silice qui contiennent l'indicateur bleu avec chlorure de cobalt devront aussi être évités, car le cobalt peut être cancérogène (consulter Conserve O Gram 2/15 Cobalt Indicating Silica Gel Health and Safety Update [format PDF, 224 Ko; en anglais seulement]). Parmi les autres produits utilisables, on trouve le dessiccatif Sorbead Orange.
Des exemples d'utilisation de contenants de protection étanches et de dessiccatifs sont présentés dans les sections Mesures de soin préventif pour la collection d'argent Birks au Musée des beaux-arts du Canada et Le soin des collections archéologiques – Rangement au sec des objets en fer corrodés.
Environnements anoxiques
Un milieu anoxique, dans lequel l'oxygène est retiré du voisinage de l'objet, est très efficace pour freiner la corrosion et, dans les cas de corrosion extrême (par exemple, l'attaque de chlore sur le fer), c'est la solution la plus efficace. Des produits spécialisés sont toutefois requis, comme il est mentionné ci-dessous :
- On peut utiliser des films barrières à faible perméabilité à l'oxygène, comme le film métallique plastifié Marvelseal ou le film barrière transparent Escal, pour renfermer des objets métalliques, ainsi qu'un désoxygénant, comme les produits RP (figure 53). Ces substances ont été fabriquées expressément à cette fin. Un exemple de leur utilisation est décrit à la section Utilisation d'un milieu anoxique pour préserver la croix de Ferryland. On peut ajouter un détecteur d'oxygène (par exemple, AGELESS-EYE; figure 54) pour savoir à quel moment le désoxygénant doit être changé. Cependant, la durée de vie du produit AGELESS-EYE est brève (par exemple, habituellement six mois).
- Le produit AGELESS Z est un autre désoxygénant utilisé dans le domaine de la conservation. Il n'est pas efficace dans des conditions très sèches et, par conséquent, il ne convient pas à la création de microenvironnments secs pour le fer archéologique contaminé par le chlorure.
- Certains désoxygénants sont offerts avec ou sans dessiccatif; par exemple, les sachets de RP-A (jaunes) contiennent un dessiccatif, tandis que les sachets de RP-K (verts) n'en contiennent pas (ils sont souvent dits « neutres en humidité »). Pour freiner la corrosion du métal, il est plus efficace d'éliminer l'eau et l'oxygène à l'intérieur du contenant de protection au moyen du produit RP-A. Cependant, dans le cas des matériaux composites, l'utilisation du produit RP-K est préférable pour les composants organiques, car il conservera l'HR dans le contenant de protection aux niveaux ambiants.

© Gouvernement du Canada, Institut canadien de conservation. ICC 123028-0045
Figure 53. Un ciseau inuit en cuivre provenant d'un site archéologique dans le nord du Canada est conservé dans un sac Escal scellé; un sachet de RP-A (désoxygénant et dessiccatif) est aussi inclus.

© Gouvernement du Canada, Institut canadien de conservation. ICC 122641-0003
Figure 54. Trois échantillons du détecteur d'oxygène AGELESS-EYE (capsule bleue) dans leur emballage de plastique
Cela dit, l'emballage scellé des objets en vue de les préserver en milieu anoxique présente un désavantage : l'impossibilité d'accéder physiquement à un objet. Chaque fois que le sac est ouvert, l'objet est exposé à l'oxygène, il n'est plus protégé contre la corrosion et le milieu anoxique est perdu. Il faut donc utiliser une nouvelle quantité de désoxygénant avant de sceller le sac de nouveau.
Sorbants pour retenir les polluants
L'utilisation, dans les contenants de protection, de sorbants (produits absorbants ou adsorbants qui piègent les polluants) accroît le niveau de protection contre les polluants gazeux. La quantité de sorbants requise varie selon le type de sorbants et la situation. Au fil du temps, les sorbants s'épuisent et doivent être changés ou régénérés, selon le taux d'émission de la source interne de pollution ou le taux d'infiltration des polluants externes. Pour être efficace à réduire le niveau de polluants, le sorbant doit couvrir une grande surface à l'intérieur de la vitrine d'exposition, de l'armoire de rangement ou de tout type de contenant de protection. Consulter les instructions du fabricant ou Tétreault (2003) pour en savoir davantage. Ces produits se présentent habituellement sous deux formes : ceux en grains ou en granules et ceux où l'agent effectuant la sorption est incorporé à un tissu.
Grains et granules
- Catalyseur à base d'oxyde de zinc : très bon rendement de sorption pour les composés soufrés, comme le sulfure d'hydrogène et le sulfure de carbonyle. Cependant, il ne peut être régénéré.
- Charbon activé : c'est probablement le sorbant le plus utilisé dans les musées. Son rendement de sorption est bon pour l'acide acétique, le sulfure d'hydrogène, le dioxyde de soufre et le dioxyde d'azote, mais il est moyen pour l'acide formique et l'ozone. En utilisant 500 g de charbon activé dans la plage de 6 à 14 mesh (par exemple, charbon activé de Fisher Scientific ou charbon activé granulaire de Fisher [charbon de bois de noix de coco]) par mètre cube, on peut réduire la concentration de polluants à l'intérieur du contenant de protection d'un facteur de 10 par rapport à la concentration dans la pièce, pourvu que le contenant soit bien étanche (à l'air) et qu'il ne contienne pas de produits qui émettent des gaz nocifs à l'intérieur. Cette quantité devrait être bonne pour une année. Pour régénérer le charbon activé, il faut le chauffer à environ 120 ºC pendant à peu près 12 heures. Il est souvent pratique de l'utiliser dans des sachets de forme allongée, car ceux-ci offrent une grande surface en contact avec l'air ambiant, ce qui maximise la rétention de polluants. Les sachets devraient être faits d'un tissu qui supporte le chauffage, ce qui permet de chauffer tout le sachet pour régénérer le charbon.
- Alumine activée imprégnée de permanganate de potassium : ce produit offre un très bon rendement de sorption pour le sulfure d'hydrogène, un bon rendement pour le dioxyde de soufre, l'acide acétique et l'ozone et un rendement moyen pour le dioxyde d'azote. Il ne peut pas être régénéré. Sa couleur va du rose au brun lorsqu'il est épuisé.
Remarque : Les produits de charbon activé et d'alumine activée peuvent également avoir été imprégnés d'autres composants actifs, comme du carbonate de potassium, de l'hydroxyde de potassium ou du bicarbonate de sodium, de façon à améliorer la sorption finale de ces produits ou à accroître leur efficacité de piégeage de divers types de polluants.
Tissus
- Tissus imprégnés de charbon activé : ils sont pratiques, car ils sont prêts à utiliser comme tissus de revêtement et d'emballage (nul besoin de former des sachets pour y insérer les granules de charbon activé). Toutefois, leur rendement est plus limité. Leur rendement est bon pour l'acide acétique et l'ozone, mais moyen pour le dioxyde de soufre et médiocre pour le sulfure d'hydrogène et le dioxyde d'azote.
- Tissus pour prévenir le ternissement (par exemple, le Pacific Silvercloth) : c'est une bonne solution pour l'argent, puisque ce produit est conçu pour le protéger contre le ternissement. De minuscules particules d'argent sont noyées dans le tissu et sont très réactives aux polluants qui produisent la ternissure. Ce tissu est très efficace lorsqu'on l'utilise pour emballer entièrement un objet en argent, puisque les particules d'argent dans le tissu sont les premières à réagir avec tout composé soufré gazeux provenant de l'extérieur. La pratique la plus sécuritaire consiste à emballer d'abord l'objet dans un papier de soie sans acide, puis dans une double couche de Silvercloth. On place ensuite le tout dans un contenant de protection étanche (boîte, vitrine d'exposition, etc.) (figures 55a, 55b et 55c).
© Gouvernement du Canada, Institut canadien de conservation. ICC 125773-0195
Figure 55a. Envelopper tout d'abord chaque objet en argent dans du papier de soie sans acide.

© Gouvernement du Canada, Institut canadien de conservation. ICC 125773-0188
Figure 55b. Une fois complètement enveloppés de papier, les objets sont ensuite emballés dans du Pacific Silvercloth et placés dans une boîte de plastique pouvant être fermée de façon étanche.

© Gouvernement du Canada, Institut canadien de conservation. ICC 125773-0192
Figure 55c. On scelle la boîte. Il y aurait lieu d'apposer une étiquette de façon à savoir ce qui se trouve à l'intérieur de la boîte avant de la ranger.
Systèmes mécaniques actifs
Les systèmes mécaniques pouvant déshumidifier jusqu'à des taux très bas (jusqu'au dessèchement de l'air) sont une solution plus coûteuse que les solutions dites passives (des microenvironnements avec dessiccatifs). Ces systèmes mécaniques sont dits actifs parce qu'ils ont besoin d'une source d'énergie constante pour fonctionner et maintenir l'HR requise. Cela a toutefois pour désavantage qu'ils deviennent inactifs s'il y a panne de courant. Il en existe qui sont conçus pour les vitrines d'exposition (par exemple, les modules de régulation de l'HR de l'ICC), d'autres, pour une pièce entière (par exemple, une voûte). Il est possible de les régler de façon à créer n'importe quelles conditions ambiantes requises (par exemple, pour les métaux, le réglage est habituellement une HR restant sous le seuil des 30 %). Si l'on utilise ces systèmes, il faut prévoir l'espace nécessaire pour les insérer à l'intérieur de la pièce ou du socle de la vitrine d'exposition et concevoir une façon de cacher le raccordement des fils électriques. L'unité de déshumidification devrait comporter un drainage automatique (au besoin) afin de réduire la fréquence d'entretien. L'endroit bénéficiant d'une régulation du climat au moyen du système mécanique (par exemple, une vitrine d'exposition, une voûte, une pièce) devrait être étanche à l'air pour réduire les fuites. La description d'une voûte ayant un système mécanique actif à faible HR figure dans la section Mesures de soin préventif pour la collection d'argent Birks au Musée des beaux-arts du Canada.
Films barrières intercalaires
Si les éléments métalliques qui font partie d'un objet composite se corrodent, le contact direct du métal avec des produits de corrosion peut être nocif pour les autres composants de l'objet. Parfois, la combinaison de matériaux dans l'objet est la cause inhérente de corrosion (figures 56a et 56b). Il n'est pas toujours possible de retirer l'élément métallique qui provoque la corrosion en raison de la façon dont l'objet est conçu ou parce que son retrait modifierait l'intégrité originale de l'ensemble de l'objet. Une mesure simple et efficace, qui au moins protège les composants organiques, consiste à insérer un film barrière intercalaire isolant afin d'empêcher que la corrosion ne tache les matériaux avec lesquels elle est en contact. Les ions métalliques transférés sur des matériaux organiques peuvent de plus accélérer leur dégradation (catalyse de la réaction de l'oxydation de la cellulose et de matériaux protéiniques).

© Gouvernement du Canada, Institut canadien de conservation. ICC 97196-0017

© Gouvernement du Canada, Institut canadien de conservation. ICC 97196-0016
Figures 56a et 56b. Vues avant et arrière d'un bouton en nitrate de cellulose. L'arrière en acier (figure 56b) est en voie de se corroder en raison de la présence des gaz d'oxyde d'azote corrosifs émis par le nitrate de cellulose. Dans ce cas, retirer le métal du reste du bouton n'est pas une option. Si ce bouton se trouvait sur un costume, les produits de corrosion tacheraient et dégraderaient le tissu. Une solution simple consiste à intercaler un film barrière entre le bouton et le tissu.
Dans le cas du cuivre ou de ses alliages faisant partie d'un objet composite, pour prévenir la corrosion du métal en contact direct avec des matériaux contenant des gras, des huiles ou des cires (par exemple, le cuir), il faudra insérer un film barrière entre le métal et ces matériaux. Il doit être possible de retirer entièrement ce film, au besoin. Par exemple, on peut intercaler un film de polyester transparent (Melinex) (figures 57a et 57b). Consulter un restaurateur professionnel pour obtenir des conseils sur le nettoyage.

© Gouvernement du Canada, Institut canadien de conservation. ICC 124883-0014
Figure 57a. Vue rapprochée d'une botte de cuir ayant appartenu à l'ancien gouverneur général Georges Vanier (collection du Musée Royal 22e Régiment, Québec). Les produits cireux verts sur le cuir près de l'éperon sont des produits de corrosion provoqués par le contact du métal avec le cuir.

© Gouvernement du Canada, Institut canadien de conservation. ICC 124883-0019
Figure 57b. Après le nettoyage des surfaces, un film de polyester transparent (Melinex) a été glissé sur l'éperon à l'aide d'une petite sangle et intercalé entre le cuir et le métal afin d'empêcher le contact direct et la réapparition de la corrosion.
Revêtements
Les revêtements organiques sur les métaux (huiles, cires, vernis, laques, etc.) ne sont pas imperméables à l'oxygène et à la vapeur d'eau; ce n'est qu'une question de temps avant que ces gaz traversent l'enduit et amorcent la corrosion (figure 58). C'est pourquoi il faut réappliquer de façon régulière les revêtements, car la couche protectrice finit par être inefficace (particulièrement à l'extérieur). L'application d'un revêtement est, somme toute, un remède insuffisant, et il y aurait lieu de s'attaquer plutôt au problème réel de l'objet, qui est le milieu inhospitalier (un taux d'HR élevé), et de trouver une solution permanente. En règle générale, les revêtements ne sont pas recommandés, puisqu'il est difficile de les appliquer de façon uniforme (s'il y a de petites imperfections, cela peut provoquer la corrosion ou des piqûres) et de les enlever lorsque cela devient nécessaire.

© Gouvernement du Canada, Institut canadien de conservation. ICC 129955-0014
Figure 58. La surface de ce moteur à vapeur jouet montre l'évolution d'une laque au fil du temps : sur les zones foncées, la laque d'origine est devenue inefficace et une patine s'est formée. Les zones d'un jaune doré brillant sont encore intactes parce que, à ces endroits, la couche de laque d'origine est plus épaisse.
Cependant, l'application de revêtements protecteurs sur des objets vulnérables peut, dans certains cas, avoir de nets avantages. C'est une solution envisageable, par exemple, pour les objets métalliques exposés à l'air libre ou qui sont destinés à être manipulés par les visiteurs. Trois types de revêtements sont possibles :
- Les laques et les vernis : l'application d'une laque ou d'un vernis peut être appropriée dans certaines conditions. Parmi la variété de produits offerts, on trouve ceux à base de nitrate de cellulose (par exemple, Frigiline et Agateen, qui ont été utilisés sur l'argent) et les résines acryliques thermoplastiques (par exemple, le Paraloid B-72, utilisé à l'occasion sur le fer ou le cuivre). Le feuil protecteur d'une laque ou d'un vernis peut commencer à perdre son intégrité et donner lieu à une corrosion localisée, ce qui produit une surface inégale et peu attrayante (figures 56a et 56b). Dans un examen de l'utilisation de laques à base de nitrate de cellulose sur une collection d'objets en argent, présentée à l'air libre dans un cadre historique, il a été constaté que la laque pouvait être efficace pendant 25 à 30 ans, mais qu'elle pouvait aussi cesser de l'être après 10 à 15 ans, particulièrement si la forme des objets (que la laque doit épouser parfaitement et uniformément) est complexe. Par conséquent, il est recommandé de réévaluer l'efficacité des laques et des vernis tous les 5 à 10 ans (Pouliot et coll., 2014). Pour obtenir d'autres conseils au sujet des vernis et des laques, consulter la Note de l'ICC 9/3 Nettoyage, polissage et cirage des objets de laiton et de cuivre et la Note de l'ICC 9/7 Le soin de l'argent.
- Cire : lorsqu'une certaine couche protectrice est requise, de la cire peut être appliquée. Il suffit d'appliquer doucement une pâte de cire microcristalline et de la réchauffer à l'air chaud pour en favoriser l'étalement uniforme. Cependant, un enduit de cire n'est pas toujours désirable du point de vue esthétique sur les métaux très polis. De plus, la cire appliquée sur des surfaces poreuses et rugueuses de métaux archéologiques est extrêmement difficile à enlever. Pour obtenir des conseils sur le nettoyage et le cirage, consulter :
- Note de l'ICC 9/3 Nettoyage, polissage et cirage des objets de laiton et de cuivre
- Note de l'ICC 9/6 Le soin et le nettoyage du fer
- Note de l'ICC 9/7 Le soin de l'argent
- Conserve O Gram 10/2 Caring for Argent and Copper Alloy Objects (format PDF, 450 Ko; en anglais seulement)
- Huile légère : les métaux ferreux nus, particulièrement ceux qui sont manipulés fréquemment, peuvent profiter d'un enduit d'huile légère à mécanisme. On devrait appliquer l'huile avec parcimonie, puis frotter l'objet au moyen d'un tissu doux afin de répartir uniformément la couche d'huile à sa surface et d'en retirer l'excès. Cette procédure est décrite en détail dans la Note de l'ICC 9/6 Le soin et le nettoyage du fer.
Polissage
Le polissage des métaux est une procédure courante pour nettoyer les objets personnels, mais les techniques de polissage que l'on emploie chez soi ou dans le commerce ne peuvent être appliquées dans un contexte muséal, car cela risquerait de provoquer d'importants dommages. Il faut bien comprendre ce qui suit :
- Une surface ternie est stable et n'a pas besoin d'être polie. En outre, la ternissure offre une certaine protection, ce qui réduit le taux de ternissement global du métal. En comparaison, une surface polie est plus réactive qu'une surface ternie et plus susceptible de ternir de nouveau.
- Le polissage est abrasif de nature : une partie de la surface d'origine est toujours supprimée. L'abrasion sera plus prononcée avec un polissage fréquent ou vigoureux, ou si des composés abrasifs durs sont utilisés. En particulier, le polissage des objets métalliques plaqués cause facilement des dommages : la couche de placage étant très mince, elle risque d'être enlevée (figure 59).
- Les pâtes à polir et d'autres produits semblables peuvent être difficiles à éliminer complètement de la surface du métal, car ils peuvent se loger dans les entailles du motif ou sous les rivets.
- Les composés de polissage sont souvent acides ou alcalins. Si des résidus restent sur le métal, ils vont corroder la surface (comme on peut le voir sur les figures 17 et 39).

© Gouvernement du Canada, Institut canadien de conservation. ICC 120260-0318
Figure 59. Vue rapprochée illustrant la perte d'une partie de la couche d'argent sur un plateau en cuivre plaqué argent, causée par le nettoyage répété au moyen d'un agent de polissage abrasif. Il ne reste que très peu d'argent sur les zones du motif en relief : la couleur rosâtre est celle du cuivre sous-jacent.
Voici trois lignes directrices de base concernant le polissage :
- En règle générale, il faut éviter de polir les objets; le polissage ne devrait être effectué que dans de rares circonstances.
- Pour polir les objets, utiliser seulement les méthodes et les produits appropriés. Enlever d'abord la poussière, la souillure et la graisse afin de faciliter le polissage et d'empêcher que des particules de poussière dures n'agissent comme agent abrasif. Utiliser l'agent de polissage le moins abrasif pour ce travail, comme une pâte de carbonate de calcium précipitée et de l'eau (consulter Argent terni : le traitement est clair). Laver ensuite soigneusement tous les résidus de polissage.
- La prévention est primordiale. Il faut prévenir la ternissure en réduisant les polluants dans le milieu où se trouvent les objets, ce qui minimise le besoin de les polir. Si aucune mesure de préservation n'est prise, la surface de métal se ternira de nouveau peu après avoir été polie.
Pour en savoir davantage sur le polissage, consulter la Note de l'ICC 9/7 Le soin de l'argent et Conserve O Gram 10/2 Caring for Argent and Copper Alloy Objects (format PDF, 450 Ko; en anglais seulement).
Pour connaître les stratégies de préservation en présence d'eau et d'HR, consulter Agent de détérioration : eau et Agent de détérioration : humidité relative inadéquate.
Pour connaître les stratégies de préservation en présence de polluants, consulter Agent de détérioration : polluants.
Autres agents de détérioration
Les agents suivants constituent des risques pour tous les objets d'une collection, y compris les objets métalliques. Consulter la page Agents de détérioration pour connaître une gamme plus vaste de stratégies applicables à chaque agent.
Forces physiques
Si des forces excessives sont appliquées, elles peuvent endommager les métaux, causer des bosselures, des déformations, voire le bris de composants (figure 60). Les rayures et l'abrasion sont d'autres formes courantes de dommages physiques (consulter, entre autres, Polissage). Les métaux mous (or, argent, plomb, cuivre) sont particulièrement vulnérables aux bosselures, aux rayures et à l'abrasion. Les métaux archéologiques sont souvent cassants en raison de la détérioration qu'ils ont subie pendant leur durée d'enfouissement, et ils sont donc sujets aux fissures et aux fractures.
Il existe plusieurs stratégies de prévention des dommages physiques, entre autres, les suivantes :
- Déterminer les objets métalliques qui sont les plus susceptibles d'être endommagés par des forces physiques et prendre des mesures préventives.
- Utiliser des boîtes et du rembourrage, au besoin, en fonction de la fragilité des objets.
- Si plusieurs objets sont mis ensemble dans une boîte, sur un plateau ou dans un tiroir, séparer les objets les uns des autres au moyen de rembourrage pour éviter qu'ils soient en contact. Cela éliminera les risques de fêlure et de rayure pendant les déplacements ou lorsque le tiroir est ouvert. On peut aussi les placer dans des nids sculptés sur mesure (figure 61) ou les immobiliser contre une surface matelassée au moyen de ruban en tissu sergé.
- Fabriquer des socles ou des bases pour les objets qui sont instables, déséquilibrés ou lourds du haut (objets dont le centre de gravité est élevé).
- Manipuler avec soin les objets dans leurs boîtes et leurs bacs de rangement en employant les techniques et l'équipement appropriés.

© Gouvernement du Canada, Institut canadien de conservation. ICC 121590-0001
Figure 60. Bol décoratif en argent. Une des pièces de feuillage ornemental qui était soudée au pourtour du bol s'en est détachée.

© Gouvernement du Canada, Institut canadien de conservation. ICC 82540-0008
Figure 61. Des clous archéologiques fragiles et minces sont insérés dans un rembourrage en mousse et mis en réserve individuellement dans des boîtes de polystyrène.
Vol et vandalisme
Les métaux précieux et les objets de valeur (bijoux, pièces de monnaie, pièces de collection) courent le risque d'être volés (figure 62) et requièrent donc des mesures de protection plus poussées en ce sens.
Dissociation
Les petites pièces métalliques, y compris les éléments fonctionnels, comme les vis, les boulons et les écrous, peuvent parfois devenir lâches ou être mal fixés à un objet. Lorsque l'objet est manipulé ou déplacé, ces pièces peuvent devenir encore plus lâches et se détacher de l'objet. Consulter le Bulletin technique de l'ICC 17 Fixations filetées d'objets métalliques, qui décrit comment empêcher la dissociation des objets et s'assurer que les petites pièces métalliques sur les objets demeurent bien préservées.

© Gouvernement du Canada, Institut canadien de conservation. ICC 97889-0004
Figure 62. Contrefaçon historique d'une pièce de monnaie espagnole de 1861 (20 reales). La pièce n'est pas faite d'or pur, mais plutôt d'un cœur en platine plaqué or.
Incendie
Les alliages à faible point de fusion, comme l'alliage plomb-étain ou les brasures de plomb-étain, sont particulièrement à risque en cas d'incendie.
Température inadéquate
Les températures élevées accroissent la vitesse des réactions chimiques, y compris les réactions de corrosion (si d'autres facteurs favorisant la corrosion sont également présents, telle une HR élevée). Par exemple, pour une même HR, le fer se corrodera deux fois plus rapidement à 29 °C qu'à 18 °C.
Comme cela a été mentionné dans la section Maintenir un taux d'humidité relative modéré et éviter les taux élevés, la température influe grandement sur l'HR; il faut donc la maintenir stable afin de maintenir l'HR à des taux appropriés. Consulter Agent de détérioration : température inadéquate pour en savoir davantage sur la façon dont la température influe sur l'HR.
Exemples de pratiques de conservation préventive
Argent terni : le traitement est clair
Lyndsie Selwyn
(Version révisée du texte publié dans le Bulletin de l'ICC, 23 juin 1999)
C'est assurément un problème courant : de vieux amis viennent dîner, et c'est l'occasion d'utiliser pour la première fois depuis des années les chandeliers en argent qu'ils nous ont donnés comme cadeau de mariage. Après les avoir longuement cherchés dans la maison, la joie de la découverte se transforme rapidement en consternation quand on les déballe pour voir qu'ils sont si… ternis! L'exposition aux gaz soufrés a laissé une mince pellicule de sulfure d'argent à la surface, et le résultat est un fini terne et mat (figure 63). Pour restaurer l'éclat original de l'argent, il faut donc enlever le film de sulfure.

© Gouvernement du Canada, Institut canadien de conservation. ICC 72776-0001
Figure 63. Les chandeliers reçus en cadeau de mariage par l'auteure (zinc plaqué argent avec saillies en or), avant et après le polissage.
Au tournant du siècle, une femme au foyer industrieuse avait publié la recette suivante de produit de polissage (Hiscox, 1907) : « Le meilleur produit de polissage pour l'argent, c'est-à-dire un produit qui, tout en nettoyant, ne provoque pas l'abrasion trop rapide de la surface, est la craie lévigée [...]. Les produits de polissage de métal habituels, comme la [...] pierre ponce finement broyée [...], rayent si rapidement la surface que, après quelques nettoyages, on a traversé la couche argentée d'épaisseur ordinaire. »
L'opinion émise en 1907 est encore valable aujourd'hui. La seule modification est que la craie devrait être précipitée à partir d'une solution, plutôt que d'être lévigée (broyée en une fine poudre). Cela est dû au fait que la précipitation donne un meilleur contrôle de la granulométrie que le broyage, ce qui évite d'avoir de grosses particules qui laissent derrière elles des rayures visibles pendant le polissage (les petites particules laissent également des rayures, mais si elles sont suffisamment petites, ces rayures sont invisibles à l'œil nu). On continue encore de nos jours à utiliser de la craie, car c'est un matériau tendre (dureté d'environ 3 sur l'échelle de Mohs). Les produits abrasifs plus durs, comme la pierre ponce (dureté d'environ 6 sur l'échelle de Mohs), retirent une mince couche de matériau à chaque passage et provoquent ainsi plus de dommages : si des polis faits d'abrasifs durs (comme les produits à polir le métal « tout usage ») sont employés sur un objet plaqué argent, ils élimineront rapidement toute la couche d'argent, révélant ainsi le métal de base sous-jacent. S'ils sont utilisés sur de l'argent sterling, ces produits peuvent tout simplement effacer les gravures délicates. On peut retenir de cette histoire que le conseil a tout simplement été poli au fil du temps!
Mesures de soin préventif pour la collection d'argent Birks au Musée des beaux-arts du Canada
Doris E. Couture-Rigert
Restauratrice en chef
Restauration et recherche technique, Musée des beaux-arts du Canada
Introduction
Le Musée des beaux-arts du Canada (MBAC) a commencé à collectionner l'argent dès 1960, et il avait déjà acquis un nombre modeste d'objets lorsqu'il a reçu, en 1979, un cadeau massif de la part de la Collection Henry Birks d'orfèvrerie canadienne, consistant en plus de 7 000 pièces. Depuis, le MBAC a continué d'accroître activement sa collection d'objets en argent en faisant l'acquisition d'objets importants, choisis avec soin afin de compléter et d'équilibrer sa collection historique existante et d'accroître son fonds d'objets du XXe siècle. Bien que le MBAC ait fait l'acquisition d'importantes pièces américaines et européennes, il est surtout connu pour son impressionnante collection d'orfèvrerie canadienne, la plus importante au Canada, dont la donation Birks forme encore un volet important.
La donation Birks comprenait un certain nombre d'armoires en bois, bien construites, dans lesquelles la collection était rangée au siège social de Birks, à Montréal. Cependant, ces armoires en bois étaient loin de constituer le milieu idéal dans lequel ranger ou présenter des objets en argent, ce qui était devenu manifeste en raison du besoin récurrent de nettoyer les pièces d'argent. C'était en fait devenu un grave problème d'entretien, vu le nombre d'objets que comporte la collection. Par conséquent, il a fallu mettre en œuvre rapidement des mesures de conservation préventive afin de réduire le ternissement. Et, lorsqu'il a été décidé de planifier la construction d'un nouvel immeuble qui abriterait le MBAC et ses collections, la fabrication de nouvelles armoires dans une voûte de mise en réserve sous HR contrôlée, ainsi que de nouvelles vitrines d'exposition, a été jugée hautement prioritaire. Ces spécifications techniques ont été élaborées et réalisées en 1988 lorsque la collection a déménagé dans l'actuel immeuble du Musée, qui orne la promenade Sussex à Ottawa (figure 64).

Photo © Musée des beaux-arts du Canada
Figure 64. Le Musée des beaux-arts du Canada à Ottawa, en Ontario, héberge la collection d'orfèvrerie Birks.
Conditions ambiantes au Musée des beaux-arts du Canada
Afin d'assurer un milieu en grande partie exempt de contaminants dans les vastes espaces du Musée et dans ses voûtes de mise en réserve, le MBAC est pourvu d'un système complexe de traitement de l'air. L'air qui pénètre dans l'immeuble est d'abord préfiltré avant de circuler par un bloc additionnel de filtres de type accordéon, qui filtrent les particules, et de type à charbon activé, qui filtrent les gaz. L'air qui circule dans le système de filtration est un mélange d'air extérieur et d'air intérieur recyclé, et la proportion d'air renouvelé dépend de la température extérieure et de la densité de la foule de visiteurs. Afin de déterminer la proportion optimale, des capteurs de mesure de dioxyde de carbone et de point de rosée sont placés en des endroits stratégiques dans toutes les galeries. Une centrale de filtration de l'eau par osmose inverse, qui comprend un sous-système de traitement aux UV afin de tuer les microorganismes, contrôle l'humidification et la déshumidification de l'immeuble et assure une HR de 50 ± 3 %, en été, et de 44 ± 3 %, en hiver. La transition se fait progressivement sur une période de 60 jours à l'automne et une transition inverse a lieu au printemps. La température est maintenue à 21 ± 2 °C pendant toute l'année. Le système actuel a été mis à jour en 2011 et il est maintenant entièrement automatisé et contrôlé numériquement. Des essais de qualité de l'air intérieur sont effectués périodiquement pour évaluer et contrôler le rendement des systèmes, et pour garantir que les contaminants particulaires et gazeux dans l'air qui pénètre dans le musée et les voûtes de mise en réserve se situent à l'intérieur des taux admissibles.
Mise en place d'un milieu idéal pour la préservation des objets en argent
Bien que le milieu décrit ci-dessus convienne à la plupart des types d'œuvres d'art, l'argent requiert quelques mesures supplémentaires. Le métal est, en général, plus stable à une faible HR, et l'argent, en particulier, requiert des mesures plus intenses de réduction de la pollution et des poussières, en plus d'une faible HR ambiante à une température stable si l'on veut éliminer ou réduire de manière appréciable le ternissement (la formation d'une couche de sulfure d'argent). Cela est particulièrement important pour l'argent, car à la différence des autres métaux, l'apparence habituellement souhaitée est une surface brillante (sans ternissure). Si rien n'est fait pour empêcher le ternissement, le retrait répété de couches minces de sulfure d'argent, en plus d'être un travail d'entretien coûteux, se traduira par une perte de surface au fil du temps, ce qui se manifestera sous la forme d'une perte de la netteté de tout le travail décoratif en surface.
Par conséquent, il a été nécessaire d'instaurer d'autres mesures de prévention afin de protéger la collection d'argent du MBAC dans le milieu ambiant du Musée, tant dans la salle d'exposition que dans la réserve, grâce à l'utilisation de microclimats.
Voûte de mise en réserve des objets en argent sous faible humidité relative
Pour planifier la mise en place d'une voûte de mise en réserve d'objets d'art sous conditions contrôlées, il faut tenir compte de deux approches : soit que la voûte constitue en elle-même un microclimat ou que les armoires fournissent les conditions microclimatiques voulues à l'intérieur du milieu ambiant de la pièce. Selon l'utilisation de la collection, un système ou l'autre peut être choisi. Comme il est souvent nécessaire d'avoir accès à la collection d'argent du MBAC aux fins d'étude, d'installations d'exposition à l'interne, d'expositions itinérantes et de prêts, la solution la plus rationnelle était de conditionner la pièce elle-même. Ainsi, nul besoin de retirer à la presse les objets d'art de leurs armoires, car aucune perte d'air sec à l'intérieur des armoires n'est à craindre, puisque les armoires et la pièce partagent le même air ambiant conditionné. En outre, avec cette approche, les objets peuvent être laissés sur une table, plusieurs jours même dans certains cas, ce qui permet aux conservateurs et aux chercheurs de les étudier, tout en les maintenant dans leur environnement idéal.
Par conséquent, la voûte de mise en réserve de l'argent et des métaux a été spécialement construite selon les spécifications techniques suivantes :
- Les murs peints ainsi que les revêtements de plafond et de plancher devaient être exempts de toute source de contaminants. Pour ce faire, il fallait choisir des matériaux appropriés et prévoir suffisamment de temps pour leur dégazement.
- Toutes les portes d'accès à la voûte devaient être munies de joints d'étanchéité stables ne dégageant aucun gaz nocif et pouvant maintenir un microclimat étanche.
- La voûte devait comporter des circuits séparés d'air d'amenée et de retour, conçus pour assurer :
- une HR de 35 % ± 3 %;
- une température de 21 ± 2 °C (la même qu'ailleurs dans l'immeuble).
- Les polluants atmosphériques gazeux et particulaires devaient être réduits ou éliminés à l'aide de filtres antipoussières et de charbon activé.
Remarque : Au moment de choisir le point de réglage de l'HR pour une voûte de mise en réserve d'objets métalliques, il faut tenir compte des matériaux secondaires qui peuvent être entreposés dans cette pièce. Bon nombre d'objets en argent religieux ou séculiers sont pourvus de boutons, de poignées et d'autres éléments décoratifs en matériaux hygroscopiques, comme l'ivoire et le bois. Une HR de 35 % a été choisie pour assurer la préservation de ces matériaux, tout en offrant un milieu assez sec pour le métal, et elle s'est avérée à la fois sécuritaire et efficace pour préserver la collection d'argent du MBAC.
Armoires de rangement des objets en argent
Les armoires de rangement des objets en argent utilisées dans la voûte ont été construites sur mesure en acier thermolaqué d'une peinture de type polyester non réactive, exempte de solvant et qui ne dégage aucun gaz nocif. De grandes portes en verre, au cadrage minimal, ont été choisies afin d'offrir une vue optimale du contenu des armoires (figure 65). Pour permettre un accès sur toute la largeur de l'armoire, les portes s'ouvrent sur 180° et reposent à plat contre les armoires adjacentes (figure 66). Comme la pièce est maintenue à une HR de 35 %, les armoires sont pourvues d'orifices de ventilation permettant un échange d'air passif; l'air peut ainsi circuler librement entre la pièce et les armoires (figure 67). Les portes en verre ne sont pas munies de joints d'étanchéité, mais sont pourvues d'aimants qui les maintiennent en place avant d'être verrouillées.

Photo © Musée des beaux-arts du Canada
Figure 65. Vue intérieure de la voûte de mise en réserve des objets en argent du MBAC montrant une rangée d'armoires.

Photo © Musée des beaux-arts du Canada
Figure 66. Armoire de rangement des objets en argent dont la porte est entièrement ouverte et dont deux tiroirs sont entrouverts.

Photo © Musée des beaux-arts du Canada
Figure 67. Trous de ventilation à l'arrière de chaque armoire.
Les armoires sont relativement peu profondes (56 cm) afin d'éviter d'avoir de trop nombreuses rangées d'objets par étagère. Ainsi, il est plus facile de voir et de localiser les objets individuellement, ce qui rend leur retrait plus facile et donc plus sécuritaire.
Afin de réduire davantage le risque de formation de ternissure (c'est-à-dire de sulfure d'argent), l'intérieur de chaque tiroir et de chaque armoire est revêtu d'une couche de tissu Pacific Silvercloth pouvant prévenir le ternissement (figure 68), cousu sur des feuilles blanches de mousse de polyéthylène réticulé à alvéoles fermées de 3 mm d'épaisseur (Nalgene).

Photo © Musée des beaux-arts du Canada
Figure 68. Doublure en Pacific Silvercloth.
Vitrines d'exposition des objets en argent dans les galeries du Musée des beaux-arts du Canada
Deux types de vitrines d'exposition spéciales ont été conçus afin de permettre la présentation sécuritaire des objets en argent : le type standard et le type motorisé (comportant un mécanisme motorisé qui soulève le couvercle en Plexiglas). Les deux types de vitrines (standard et motorisé) constituent des contenants de protection sécuritaires, stables et exempts de poussière dans lesquels le microclimat voulu peut facilement être obtenu et maintenu (figure 69).

Photo © Musée des beaux-arts du Canada
Figure 69. Vitrine d'exposition des objets en argent du MBAC.
Les vitrines d'exposition des objets en argent du MBAC sont conçues selon les spécifications techniques suivantes :
- Corps principal : panneaux de fibres à densité moyenne (MDF)
- Couvercle en Plexiglas (acrylique) : feuilles de Plexiglas de 1/4 po avec coupe d'onglet et joints fusionnés le long des côtés afin de réduire la visibilité des joints
- Vitrine de type motorisé : mécanisme motorisé permettant de soulever le couvercle en Plexiglas, plus compartiment en Plexiglas dans la base pour recevoir les agents de conditionnement de l'air (figure 70)
- Vitrine de type standard : soulèvement manuel du couvercle en Plexiglas; les agents de conditionnement de l'air sont placés sous le présentoir ou sous des blocs-présentoirs (blocs servant à exposer les objets à diverses hauteurs dans la vitrine)
- Joint d'étanchéité à rendement élevé : situé entre la base et le couvercle en Plexiglas pour permettre l'établissement d'un microclimat
- Fini des surfaces extérieures : peinture en aérosol époxy à deux composantes pour la durabilité
- Fini des surfaces intérieures, y compris le présentoir et les blocs-présentoirs : peinture latex de qualité intérieure (à base d'eau), avec liant acrylique ou acrylique/uréthane
- Circulation d'air : le présentoir et les blocs-présentoirs peints sont soulevés de la surface où ils reposent à l'aide d'intercalaires de 3 mm afin de permettre la circulation d'air; la version avec recouvrement en tissu est pourvue de côtés perforés
Au moment de choisir le type de peinture selon sa composition, une peinture à faible teneur en composés organiques volatils (COV) (par exemple, 10 g/l) est recommandée pour protéger la santé humaine. Cependant, cela ne veut pas dire que les peintures à faible teneur en COV conviennent dans un contexte de préservation des œuvres d'art. En effet, de nombreux additifs dans la peinture sont la source et la cause de la détérioration, du ternissement et de la corrosion des matériaux. Par conséquent, avant de choisir une peinture, il est recommandé de consulter sa fiche signalétique sous la section 5 « Produits de décomposition dangereux » (pour en savoir davantage, consulter La FTSS : Guide de base de l'usager – Version canadienne SIMDUT). S'il est indiqué que la peinture contient des composés qui ternissent l'argent, comme le sulfure d'hydrogène, le dioxyde de soufre ou le sulfure de carbonyle, cette peinture est alors à éviter. Les mêmes critères s'appliquent au choix des panneaux MDF, car certains panneaux de ce type contiennent un adhésif soufré qui peut dégager des composés soufrés nocifs.
Les peintures-émulsions acryliques et les peintures en aérosol à la résine époxy bi-composante prennent environ quatre jours pour sécher, et il s'écoulera de trois à quatre semaines supplémentaires avant que la plupart des COV s'évaporent. Par conséquent, avant d'installer toute œuvre d'art, et particulièrement des objets en argent, il faut respecter les temps d'attente minimale suivants pour permettre le dégazement de ces composés :
- Pour les surfaces se trouvant dans des espaces ouverts et bien ventilés, y compris les murs, les socles et les plateformes d'exposition : 7 jours pour le plomb, 5 jours pour l'argent et 4 jours pour tous les autres métaux ou matériaux. Une feuille de Mylar (Melinex) est intercalée entre l'objet et la surface d'exposition, sauf si la peinture a pu dégazer pendant au moins 3 semaines.
- Dans le cas des contenants de protection fermés, comme les vitrines d'exposition : 28 jours pour le plomb, 21 jours pour l'argent et tous les autres métaux ou matériaux.
Le présentoir et les blocs-présentoirs recouverts de tissu requièrent les travaux préparatoires suivants :
- Le panneau MDF est d'abord scellé au moyen de trois couches de gomme-laque de couleur blonde ou peint au moyen d'une peinture-émulsion acrylique, puis le tout doit dégazer pendant trois semaines.
- Tous les tissus utilisés à cette fin sont testés pour déceler la présence de soufre au moyen d'un réactif d'azoture de sodium (Daniels et Ward, 1982; Thickett et Lee, 2004) ou du test à l'acétate de plomb (Tétreault, 2004). Chaque nouveau lot de tissu, même si c'est le même tissu provenant du même fabricant, doit être testé avant d'être utilisé.
Afin de créer un milieu de faible HR pour les objets en argent, on utilise le dessiccatif Desi Pak, très efficace et économique, car il adsorbe plus la vapeur d'eau que le gel de silice standard.
À l'opposé des sorbants chimiquement synthétiques, le Desi Pak contient de la bentonite, un produit de météorisation de la cendre volcanique consistant essentiellement en montmorillonite, une argile qui existe à l'état naturel. Vendu sous diverses formes et tailles, c'est le sachet en non-tissé de polyéthylène (Tyvek) comportant huit unités qui s'est avéré le plus approprié pour nos vitrines d'exposition, car il s'insère aisément dans les compartiments en Plexiglas perforés, pour la vitrine motorisée (figures 70 et 71), et également sous le présentoir et les blocs-présentoirs des vitrines standards lorsque l'espace est limité. La quantité de Desi Pak requise variera en fonction du taux de fuite d'air d'une vitrine donnée et du niveau d'HR recherché. Cependant, comme règle approximative, si la vitrine est bien étanche, un à deux sachets de huit unités de Desi Pak sont suffisants pour déshydrater un mètre cube d'air dans un espace clos. L'utilisation de petits thermomètres et hygrostats numériques à l'intérieur de la vitrine d'exposition permet un contrôle facile.

Photo © Musée des beaux-arts du Canada
Figure 70. Des agents de contrôle sont placés dans un compartiment derrière la porte dévoilée d'une vitrine d'exposition d'objets en argent.
Afin d'adsorber les gaz qui provoquent la ternissure, du charbon activé est ajouté dans chaque vitrine d'exposition (environ 500 g ou 12 cartouches par mètre cube), en plus du dessiccatif (figure 71). Les objets en argent sont ainsi maintenus dans un milieu sec et exempt de pollution pendant qu'ils sont exposés.

Photo © Musée des beaux-arts du Canada
Figure 71. Agents de contrôle utilisés dans les vitrines d'exposition des objets en argent du MBAC (dessiccatif [Desi Pak] et charbon activé [sous forme de cartouche]).
Ces vitrines d'exposition très performantes sont toujours utilisées dans les salles d'exposition d'art européen. Cependant, depuis le mois de juin 2017, à la suite d'une reconception complète, introduisant une nouvelle esthétique et une reconfiguration des salles d'art canadien et autochtone, l'orfèvrerie est maintenant présentée dans trois nouveaux styles de vitrines de pointe faites sur mesure : sur socle, murales ou en encart (figure 72). La construction en acier thermolaqué et en verre antireflet (GroGlass Artglass AR Protect) créé un environnement sans polluant tout en permettant une visibilité supérieure. Selon le style de la vitrine, les agents de conditionnement de l'air (dessiccatif et charbon activé) sont insérés dans des compartiments qui se trouvent soit le long des bords de la vitrine (figure 73), soit sous son présentoir. Le dessiccatif sous forme de Desi Pak est utilisé dans la même proportion que par le passé dans les anciennes vitrines. Cependant, les cartouches de charbon activé anciennement employées ont été remplacées par du charbon activé (charbon vierge) en granules de 4 mm ensachées sur mesure dans du Reemay (un non-tissé de polyester) (figure 74). La quantité recommandée, basée sur un taux de 0,3 échange d'air aux 24 heures, est de 500 g de charbon activé par mètre cube de volume d'exposition, avec nécessité de remplacement prévue aux trois ans. Le choix de passer au charbon activé en granules a été motivé surtout par le rapport coût-efficacité de ce produit, puisque certaines nouvelles vitrines, étant très grandes, nécessitent une grande quantité de produit pour conditionner un volume d'exposition de 8 mètres cubes.

Photo © Musée des beaux-arts du Canada
Figure 72. Le nouveau type de vitrine en encart au Musée des beaux-arts du Canada.

Photo © Musée des beaux-arts du Canada (MBAC)
Figure 73. Un compartiment le long d'un des côtés de la vitrine sert à y mettre les agents de contrôle.

Photo © Musée des beaux-arts du Canada
Figure 74. Sacs en Reemay (un non-tissé de polyester) cousus sur mesure et remplis de charbon activé (charbon vierge) en granules de 4 mm.
On sait d'expérience que les doublures en Pacific Silvercloth utilisées dans la réserve et les agents de conditionnement de l'air (dessiccatifs et charbon activé) utilisés dans les vitrines de types standard et motorisé bien conçues et étanches performent à plein rendement pendant une dizaine d'années, puis doivent être remplacés. De concert avec le système de filtration d'air et de régulation de l'HR de l'immeuble, cette approche permet d'assurer un milieu qui facilite le soin préventif des objets en argent. Ainsi, au cours des 25 dernières années, le besoin de nettoyer l'orfèvrerie de la collection du MBAC a presque disparu, et les besoins en entretien sont passés de très élevés à très bas. On continue de recueillir les statistiques sur la performance avec les nouvelles vitrines d'exposition, et l'on s'attend à obtenir des résultats similaires.
Rangement au sec des objets en fer corrodés
Pour savoir comment créer un microenvironnement sec comme solution de mise en réserve pour les objets en fer corrodés, consulter Le soin des collections archéologiques – Rangement au sec des objets en fer corrodés.
Utilisation d'un milieu anoxique pour préserver la croix de Ferryland
Un micromilieu anoxique a été utilisé pour freiner le processus de détérioration d'un objet archéologique métallique appelé « la croix de Ferryland ». Pour en savoir davantage, consulter Le soin des collections archéologiques – Préserver la croix de Ferryland en milieu anoxique.
Produits de corrosion blancs poudreux dans la réserve
Le plomb se corrode en présence d'acide acétique. Consulter Agent de détérioration : polluants – Vignette 1 pour en savoir davantage sur les sources d'acide acétique et la façon d'empêcher l'exposition du plomb à ce polluant nocif.
Bibliographie
Ankersmit, B., M. Griesser-Stermscheg, L. Selwyn et S. Sutherland. Comment reconnaître les métaux et leurs produits de corrosion, Ottawa, (Ontario), Institut canadien de conservation, s. d.
Barclay, R. L. Le soin des objets en zinc, version révisée, Notes de l'ICC 9/9, Ottawa (Ontario), Institut canadien de conservation, 2007.
Barclay, R. L., et C. Hett. Nettoyage, polissage et cirage des objets de laiton et de cuivre, version révisée, Notes de l'ICC 9/3, Ottawa (Ontario), Institut canadien de conservation, 2007.
Chilton, J. P. Principles of Metallic Corrosion, London (Royaume-Uni), Chemical Society, 1973.
Daniels, V., et S. Ward. « A Rapid Test for the Detection of Substances Which Will Tarnish Silver », Studies in Conservation, vol. 27, no 2 (1982), p. 58-60.
Drayman-Weisser, T. « Metal Objects », Caring for Your Collections (sous la direction de H. Whelchel), New York (New York), Harry N. Abrams, 1992, p. 108-121.
Hiscox, G. (directeur de publication). Henley's Twentieth Century Book of Recipies, Formulas and Processes, New York (New York), The Norman W. Henley Publishing Company, 1907.
Logan, J., et L. Selwyn. Comment reconnaître la corrosion active, version révisée, Notes de l'ICC 9/1, Ottawa (Ontario), Institut canadien de conservation, 2007.
Logan, J., et L. Selwyn. Mise en réserve des métaux, version révisée, Notes de l'ICC 9/2, Ottawa (Ontario) Institut canadien de conservation, 2007.
Logan, J. and L. Selwyn. Le soin et le nettoyage du fer, version révisée, Notes de l'ICC 9/6, Ottawa (Ontario) Institut canadien de conservation, 2007.
Logan, J., R. L. Barclay, C. Newton et L. Selwyn. « The Ferryland Cross Revisited », Bulletin de l'ICC 36 (automne 2005), p. 8-9.
Logan, J., R. L. Barclay, P. Bloskie, C. Newton et L. Selwyn. « Saving the Ferryland Cross: 3D Scanning, Replication, and Anoxic Storage », dans The Conservation of Archaeological Materials: Current Trends and Future Directions (sous la direction de E. Williams et C. Peachey), BAR International Series 2116, Oxford (Royaume-Uni), Archaeopress, 2010, p. 127-134.
Logan, J, L. Selwyn, C. Cook et T. Grant. Le traitement à l'acide tannique pour les artefacts en fer rouillé, publié antérieurement sous le titre Le traitement du fer à l'acide tannique, version révisée, Notes de l'ICC 9/5, Ottawa (Ontario), Institut canadien de conservation, 2013.
National Park Service. Caring for Silver and Copper Alloy Objects (format PDF, 250 Ko) (en anglais seulement), Conserve O Gram 10/2, Washington (D.C.), National Park Service, 1999.
National Park Service. Caring for Historic Longarms: Storage and Handling Requirements (en anglais seulement), Conserve O Gram 10/1, Washington (D.C.), National Park Service, 1999.
National Park Service. Preparing Historic Motorized Vehicles for Storage or Exhibit (format PDF, 514 Ko) (en anglais seulement), Conserve O Gram 10/3, Washington (D.C.), National Park Service, 1999.
National Park Service. Using Silica Gel in Microenvironnements (format PDF, 478 Ko) (en anglais seulement), Conserve O Gram 1/8, Washington (D.C.), National Park Service, 1999.
National Park Service. Cobalt Indicating Silica Gel Health and Safety Update (format PDF, 224 Ko) (en anglais seulement), Conserve O Gram 2/15, Washington (D.C.), National Park Service, 2005.
National Park Service. Creating A Microclimate Box for Metal Storage (format PDF, 321 Ko) (en anglais seulement), Conserve O Gram 4/16, Washington (D.C.), National Park Service, 2011.
Pouliot, B., C. Matsen, J. Mass, W. Donnelly, K. Andrews et M. Bearden. « Three Decades Later: A Status Report on the Silver Lacquering Program at Winterthur » (en anglais seulement), Objects Specialty Group Postprints, vol. 20, Washington (D.C.), American Institute for Conservation, 2013.
Prytulak, G. Élimination mécanique de la rouille sur les surfaces usinées, version révisée, Notes de l'ICC 9/8, Ottawa (Ontario), Institut canadien de conservation, 2007.
Rimmer, M., D. Thickett, D. Watkinson et H. Ganiaris. Guidelines for the Storage and Display of Archaeological Metalwork (en anglais seulement), Swindon (Royaume-Uni), English Heritage, 2013.
Schweitzer, P. A. Metallic Materials: Physical, Mechanical, and Corrosion Properties, New York (New York), Marcel Dekker, 2003.
Selwyn, L. Metals and Corrosion: A Handbook for the Conservation Profession, Ottawa (Ontario), Institut canadien de conservation, 2004.
Selwyn, L. « Health and Safety Concerns Relating to Lead and Lead Compounds in Conservation », Journal de l'Association canadienne pour la conservation et la restauration 30 (2005), p. 18-37.
Selwyn, L. Le soin de l'argent, version révisée, Notes de l'ICC 9/7, Ottawa (Ontario), Institut canadien de conservation, 2007.
Selwyn, L. La présence de plomb dans les collections muséales et les édifices patrimoniaux, Notes de l'ICC 1/8, Ottawa (Ontario), Institut canadien de conservation, 2010.
Selwyn, L. Comprendre comment ternissent les objets en argent, 2016.
Stone, T. Le soin des pièces de monnaie et des médailles, version révisée, Notes de l'ICC 9/4, Ottawa (Ontario), Institut canadien de conservation, 2007.
Tétreault, J. « Display Materials: The Good, The Bad and The Ugly », dans Exhibitions and Conservation: Preprints of the Conference Held at the Royal College of Physician's, Edinburgh, April 21–22, 1994, Edinburgh (Royaume-Uni), Scottish Society for Conservation and Restoration, 1994, p. 79-87.
Tétreault, J. Polluants dans les musées et les archives : évaluation des risques, stratégies de contrôle et gestion de la préservation, Ottawa (Ontario), Institut canadien de conservation, 2003.
Tétreault, J. Produits utilisés en conservation préventive, Bulletin technique de l'ICC 32, Ottawa (Ontario), Institut canadien de conservation, 2017.
Thickett, D., et L. R. Lee. « The Azide Test – For Sulphur-Containing Materials », dans The Selection of Materials for the Storage or Display of Museum Objects, édition révisée, British Museum Occasional Paper Number 111, London (Royaume-Uni), British Museum, 2004, p. 16-17.
Weintraub, S. « Demystifying Silica Gel », dans Objects Specialty Group Postprints (sous la direction de V. Greene), vol. 9, Washington (D.C.), Objects Specialty Group of the American Institute for Conservation, 2002, p. 169-194.
Glossaire
- Alliage :
- Produit métallique comportant au moins deux éléments et dont au moins un des éléments est un métal (par exemple, le laiton, le bronze, l'alliage plomb-étain, l'acier).
- Alliage plomb-étain (aussi appelé « pewter ancien » ou « potin ») :
- Alliage d'étain (typiquement 80 % à 90 % massique d'étain) et de plomb, utilisé couramment au Moyen Âge. L'étain moderne consiste en un alliage d'étain et d'antimoine (« pewter moderne »).
- Anode :
- Électrode d'une cellule électrochimique sur laquelle surviennent des demi-réactions d'oxydation qui provoquent la perte d'électrons et leur déplacement à travers le circuit extérieur. La corrosion se produit habituellement à l'anode, là où les ions métalliques sont libérés dans la solution. Comparer à : « cathode ».
- Bronze :
- Alliage de cuivre contenant différentes concentrations d'étain et qui peut contenir d'autres métaux (par exemple, le zinc, le plomb). Dans les alliages de bronze modernes, l'étain peut être remplacé par d'autres éléments, comme l'aluminium ou le silicium.
- Cathode :
- Électrode d'une cellule électrochimique sur laquelle surviennent des demi-réactions de réduction. Les électrons circulent vers la cathode dans le circuit extérieur. Comparer à : « anode ».
- Cellule électrochimique :
- Montage de deux électrodes (anode et cathode) liées par un courant électrique et plongées dans un électrolyte; l'anode et la cathode peuvent être de différents métaux ou des points différents sur une même surface métallique.
- Contenant de protection :
- Tout type de structure physique ou d'enceinte qui enferme complètement un objet et l'isole du reste de la salle (par exemple, un sac de plastique, une boîte, une armoire de rangement ou une vitrine d'exposition). Un contenant de protection est le plus efficace, du point de vue fonctionnel, quand il est fait de matériaux étanches (matériaux barrières) et qu'il est assemblé à l'aide de joints étanches.
- Corrosion active :
- Corrosion récente ou qui progresse; elle se présente souvent sous forme d'effritement, de fissuration ou d'écaillures.
- Corrosion galvanique :
- Corrosion accélérée d'un métal mis en contact électrique avec un métal plus noble (ou un conducteur non métallique) dans un électrolyte.
- Corrosion :
- Réaction électrochimique entre un métal et le milieu qui cause la détérioration du métal. La réaction fait intervenir un échange d'électrons du métal à une autre espèce pendant des réactions simultanées d'oxydation et de réduction.
- Couche de passivation :
- Mince couche protectrice de corrosion (d'oxydation) sur une surface de métal qui réduit la vitesse de corrosion du métal.
- Désoxygénant :
- Substance qui absorbe ou retire l'oxygène de l'air ambiant. (Synonyme : absorbant d'oxygène)
- Dessiccatif :
- Substance qui réduit l'HR en retirant l'humidité de l'air ambiant. Le gel de silice déshydraté est un dessiccatif couramment utilisé. (Synonymes : desséchant, déshydratant, absorbeur d'humidité)
- Électrodéposition :
- Couche métallique qui se forme sur une surface conductrice lorsqu'elle devient la cathode d'une cellule d'électrolyse.
- Électrolyte :
- Conducteur ionique contenant des ions positifs et des ions négatifs (cations et anions) qui se déplacent dans un champ électrique (par exemple, une solution aqueuse contenant des sels dissous).
- État actif :
- Se dit d'un métal qui réagit avec son milieu (c'est-à-dire qui se corrode librement) en raison de son instabilité thermodynamique; les produits de corrosion sont solubles. Comparer à : « état passif ».
- État passif :
- État dans lequel un métal en instabilité thermodynamique présente une faible vitesse de corrosion parce que la surface du métal a réagi avec le milieu pour former une couche protectrice de corrosion (une couche de passivation). Comparer à : « état actif ».
- Finition :
- Procédé (par exemple, bleuissage à la flamme, patine artificielle, gravure mécanique, électrodéposition, application de peinture ou de laque) qui intervient aux dernières étapes de la fabrication d'un objet, à titre de décoration ou de protection supplémentaire.
- Galvanisation :
- Processus par lequel on protège de l'acier ou du fer de la corrosion en le couvrant d'une mince couche de zinc, soit par immersion dans un bain de zinc en fusion, soit par électrodéposition.
- Grain :
- Cristal individuel d'un métal polycristallin. Chaque grain renferme des atomes ordonnés selon une forme géométrique régulière.
- Laiton :
- Alliage de cuivre contenant différentes concentrations de zinc et parfois d'autres métaux, comme l'étain ou le plomb.
- Métal noble :
- Métal peu susceptible de corrosion (par exemple, l'or et le platine). Consulter « série galvanique ».
- Métal plaqué :
- Métal revêtu d'une fine couche d'un autre métal (d'habitude plus noble) déposée par processus électrolytique (électrodéposition) ou chimique. Cette couche protège le métal sous-jacent (l'âme) de la corrosion.
- Microenvironnement :
- Un environnement distinct et étanche au sein de l'environnement plus vaste d'une salle, à l'intérieur duquel sont créées et maintenues des conditions ambiantes qui favorisent la préservation des objets contenus dans cet espace. Pour créer un microenvironnement, on utilise habituellement un contenant de protection (c'est-à-dire un contenant fait d'un matériau barrière assemblé au moyen de bons joints d'étanchéité), dans lequel on inclut un ou plusieurs produits spécialisés (dessiccatif, sorbant, etc.).
- Milieu anoxique :
- Milieu présentant une plus faible concentration en oxygène que l'air ambiant normal.
- Oxydation :
- Réaction chimique dans laquelle les éléments présents perdent des électrons. Si un métal ou un ion métallique est oxydé, l'état d'oxydation augmente. Comparer à : « réduction ».
- Patine :
- Couche de corrosion à la surface d'un métal. Il peut s'agir d'une patine naturelle qui résulte d'une exposition prolongée aux intempéries, à la pollution, etc., ou d'une patine artificielle obtenue par l'application de divers produits chimiques.
- Recuit :
- Traitement à chaud d'un métal pour en changer les propriétés physiques (par exemple, la chauffe peut « adoucir » un métal en neutralisant les contraintes internes causées par l'écrouissage).
- Réduction :
- Réaction chimique pendant laquelle les éléments présents acquièrent des électrons. Si un ion métallique est réduit, l'état d'oxydation l'est également. Comparer à : « oxydation ».
- Série galvanique :
- Liste de métaux, d'alliages et de matériaux conducteurs ordonnés selon leur potentiel d'électrode dans un milieu humide particulier (par exemple, l'eau de mer). L'ordre de la série va des métaux les moins sujets à la corrosion (par exemple, des métaux nobles, comme le platine) à ceux qui le sont le plus (par exemple, des métaux actifs, comme le zinc et l'aluminium).
- Sorbant :
- Matériau qui assure une fonction de sorption, c'est-à-dire d'adsorption ou d'absorption. Les sorbants peuvent extraire certains composés dans l'air ambiant et les retenir par un processus d'affinité ou de réaction. Le charbon activé est un type courant de sorbant.
- Système CVC :
- Système de chauffage, de ventilation et de climatisation.
- Ternissement :
- Processus par lequel se forme la ternissure.
- Ternissure :
- Fine couche de corrosion qui se développe à la surface d'un métal et qui en altère l'éclat. On emploie le plus souvent ce terme pour décrire ce type de couche qui se forme sur l'argent ou le cuivre en raison de la réaction avec le soufre.
© Gouvernement du Canada, Institut canadien de conservation, 2020
Publié par :
Institut canadien de conservation
Ministère du Patrimoine canadien
1030, chemin Innes
Ottawa (Ontario) K1B 4S7
Canada
No de catalogue : CH57-4/6-7-2020F-PDF
ISBN 978-0-660-35197-1