Évaluation du Programme des médicaments vétérinaires de 1999 à 2012
Rapport préparé par
la Direction de l'évaluation
Santé Canada et Agence de la santé publique du Canada
Septembre 2013
Liste des sigles
- AAC
- Agriculture et Agroalimentaire Canada
- AAP
- Architecture des activités de programme
- AC
- Avis de conformité
- ACIA
- Agence canadienne d'inspection des aliments
- ACMV
- Association canadienne des médecins vétérinaires
- ADI
- Avis d'insuffisance
- AMDUCA
- Animal Medicinal Drug Use Clarification Act
- ANC
- Avis de non-conformité
- ARLA
- Agence de réglementation de la lutte antiparasitaire
- ASFC
- Agence des services frontaliers du Canada
- ASPC
- Agence de la santé publique du Canada
- AV
- Antibiotique à usage vétérinaire
- BPCO
- Bronchopneumopathie chronique obstructive
- BPF
- Bonnes pratiques de fabrication
- BRP
- Bureau des régions et des programmes
- CCCRPSV
- Comité consultatif canadien sur la réglementation des produits de santé vétérinaires
- CCE
- Comité consultatif d'experts
- CCPBV
- Centre canadien des produits biologiques vétérinaires
- CCR
- Conseil de coopération en matière de réglementation
- CCRVDF
- Comité du Codex sur les résidus de médicaments vétérinaires dans les aliments
- CEDS
- Comité d'évaluation des dossiers scientifiques
- CGRR
- Cadre de gestion et de responsabilisation axé sur les résultats
- CMR
- Cadre de mesure du rendement
- DAA
- Division des aliments pour animaux
- DCEE
- Demande de certificat d'études expérimentales
- DDMU
- Demande de distribution de médicaments d'urgence
- DEC
- Division de l'évaluation clinique (DMV)
- DECF
- Division de l'évaluation chimique et de la fabrication (DMV)
- DGPSA
- Direction générale des produits de santé et des aliments (Santé Canada)
- DIH
- Division de l'innocuité pour les humains (DMV)
- DIN
- Numéro d'identification du médicament
- DMU
- Distribution de médicaments d'urgence
- DMV
- Direction des médicaments vétérinaires (DGPSA)
- DPT
- Direction des produits thérapeutiques (DGPSA)
- EIM
- Événement indésirable médicamenteux
- EIR
- Étude d'impact de la réglementation
- ERS
- Évaluation des risques pour la santé
- FDA
- Food and Drug Administration
- FISA
- Fédération internationale pour la santé animale
- GCE
- Groupe consultatif d'experts
- GPR
- Gestion des présentations réglementaires
- ICDPE
- Institut canadien du droit et de la politique de l'environnement
- ICSA
- Institut canadien de la santé animale
- IPA
- Ingrédient pharmaceutique actif
- IRSC
- Instituts de recherche en santé du Canada
- IUP
- Importation pour usage personnel
- LAMR
- Limite administrative maximale de résidus
- LEPP
- Licence d'établissement de produits pharmaceutiques
- LMR
- Limite maximale de résidus
- MAECI
- Ministère des Affaires étrangères et du Commerce international
- MDO
- Modification à déclaration obligatoire
- MPO
- Ministère des Pêches et des Océans
- NARMS
- National Antimicrobial Resistance Monitoring System
- OMCL
- Laboratoires officiels de contrôle des médicaments
- OMS
- Organisation mondiale de la Santé
- PADN
- Présentation abrégée de drogue nouvelle
- PASPAC
- Plan d'action pour assurer la sécurité des produits alimentaires et de consommation
- PCSIN
- Programme canadien de surveillance des infections nosocomiales
- PDN
- Présentation de drogue nouvelle
- PDNR
- Présentation de drogue nouvelle de recherche
- PE
- Protocole d'entente
- PICRA
- Programme intégré canadien de surveillance de la résistance aux antimicrobiens
- PMV
- Programme des médicaments vétérinaires
- PNSRC
- Programme national de surveillance des résidus chimiques
- PPIL
- Programme de permis d'importation limitée
- PVSFR
- Produit vétérinaire de santé à faible risque
- RAM
- Résistance aux antimicrobiens
- RAQ
- Résumé analytique de la question
- RIM
- Réaction indésirable à un médicament
- RMR
- Rapport ministériel sur le rendement
- RNSM
- Recueil des notices sur les substances médicatrices
- RPPV
- Rapport périodique de pharmacovigilance
- RVCP
- Relation vétérinaire-client-patient
- SARM
- Staphylococcus aureus résistant à la méthicilline
- SCT
- Secrétariat du Conseil du Trésor
- SGII
- Système de gestion de l'information sur les intervenants
- SPADN
- Supplément à une présentation abrégée de drogue nouvelle
- SPDN
- Supplément à une présentation de drogue nouvelle
- SSPD
- Système de suivi des présentations de drogues
- UE
- Union européenne
- UMDDE
- Utilisation de médicaments en dérogation des directives de l'étiquette
- ULEM
- Usage limité pour espèces mineures
- VICH
- Coopération internationale pour l'harmonisation des exigences techniques pour l'enregistrement des médicaments vétérinaires
Table des matières
Sommaire
Le Programme des médicaments vétérinaires (PMV) est administré par la Direction des médicaments vétérinaires (DMV), Direction générale des produits de santé et des aliments, Santé Canada. Le PMV est responsable « de l'évaluation et [du] contrôle de l'innocuité, de la qualité et de l'efficacité des médicaments vétérinaires administrés aux animaux destinés à l'alimentation et aux animaux de compagnie, ainsi que [de] la promotion de leur utilisation prudente et [de] l'établissement de normes pour une telle utilisation » (Santé Canada, 2010a). Les activités du PMV sont les suivantes : réaliser des travaux de recherche et de surveillance sur les tendances en santé; élaborer des politiques et des règlements; communiquer avec les partenaires et les intervenants; réaliser un examen préalable à la mise en marché et une surveillance post-commercialisation des médicaments vétérinaires; surveiller la conformité à la réglementation et faire observer la réglementation. Les principaux participants au programme sont les suivants : la DMV; l'Inspectorat de la DGPSA; les bureaux régionaux du Bureau des régions et des programmes (BRP); l'Agence canadienne d'inspection des aliments (ACIA).
L'évaluation du PMV fait partie du Plan quinquennal d'évaluation de Santé Canada. À l'aide de la Politique sur l'évaluation en vigueur du Secrétariat du Conseil du Trésor (SCT, 2009), les évaluateurs ont examiné la pertinence et le rendement (efficacité, efficience et économie) des activités de Santé Canada relevant du PMV. La période visée par l'évaluation s'étend de 1999 à 2012. Elle a été établie d'après le Plan d'évaluation stratégique de la Direction générale des produits de santé et des aliments (2006), qui présente l'historique du PMV en matière de financement et les obligations connexes en matière de production de rapports. Cependant, l'évaluation porte surtout sur les dernières années de cette période. Les résultats de l'évaluation guideront la mise en œuvre des activités courantes et futures du PMV.
La collecte de données pour l'évaluation s'est déroulée de février 2012 à août 2013; elle repose sur plusieurs sources de données, notamment une revue de la littérature, un examen des documents, un examen des données administratives, une analyse comparative des questions importantes, des enquêtes auprès de représentants de l'industrie et d'utilisateurs finaux des médicaments vétérinaires ainsi que des entrevues avec des informateurs clés.
Constatations
Pertinence
Les risques possibles pour la santé humaine liés à l'utilisation de médicaments vétérinaires administrés aux animaux destinés à l'alimentation et aux animaux de compagnie, comme les risques découlant de la présence possible de résidus de médicaments vétérinaires dans les aliments, les risques associés à la résistance aux antimicrobiens (RAM) et l'exposition directe aux médicaments vétérinaires, donnent à penser que Santé Canada doit poursuivre ses activités de réglementation de ces produits afin de protéger la santé de la population canadienne. Ce rôle correspond aux rôles et responsabilités du gouvernement fédéral et de Santé Canada, qui sont décrits dans les lois et règlements fédéraux, et cadre directement avec le résultat stratégique de Santé Canada « les Canadiens sont informés et protégés des risques pour la santé que présentent les aliments, les produits, les substances et les environnements ». De plus, les activités du PMV s'harmonisent parfaitement aux priorités fédérales de renforcer la salubrité des aliments et la sécurité des produits de consommation, conformément à ce qui a été exprimé dans les récents discours du Trône, le Plan d'action pour assurer la sécurité des produits alimentaires et de consommation (PASPAC) et l'accord Cultivons l'avenir. Dans le cadre de l'initiative de modernisation de la réglementation de la DGPSA, le PMV travaille actuellement à un nouveau cadre de réglementation des médicaments vétérinaires.
Rendement - Mise en œuvre du programme
Au Canada, le pouvoir de réglementation des médicaments vétérinaires est un champ de compétence partagé entre Santé Canada, l'ACIA, les provinces et les territoires; Santé Canada et l'ACIA sont responsables de l'exécution des activités précédant et suivant la mise en marché considérées comme faisant partie du PMV. Au cours de la période visée par l'évaluation, aucune structure de gouvernance ni aucun mécanisme de coordination officiel n'a été mis en place pour le PMV ni pour le volet de Santé Canada. Toutefois, Santé Canada dispose d'un éventail de structures et de mécanismes officiels et non officiels mis en place avec ses partenaires (p. ex. protocoles d'entente, groupes de travail et comités, etc.) pour régir différents aspects du programme. Dans l'ensemble, l'approche existante pour la gouvernance du programme semble fonctionner raisonnablement bien. Même si des changements ont été apportés récemment à la structure de gouvernance de la DGPSA, en vertu desquels les médicaments vétérinaires ont été conçus comme faisant partie du grand Programme des médicaments, il est toujours important, tant du point de vue de la reddition de comptes que de la gestion du programme, que Santé Canada maintienne sa capacité de faire rapport à la fois sur les extrants et sur les résultats obtenus par ses activités de réglementation relatives aux médicaments vétérinaires.
Recommandation 1
Santé Canada devrait développer et renforcer sa capacité de faire rapport sur les résultats de ses activités de réglementation se rapportant au PMV.
Au cours de la période visée par l'évaluation, Santé Canada a réalisé des progrès considérables en ce qui concerne la mise en œuvre de ses activités prévues; ce faisant, il a dû prendre des mesures à l'égard de plusieurs nouveaux problèmes et défis. L'une de ses plus grandes réalisations a été de réussir à éliminer un important arriéré de travail lié aux présentations de médicaments vétérinaires et de réduire considérablement le délai moyen de la prise de décisions. Les données les plus récentes dont on dispose indiquent que, en 2011-2012, 89 % des décisions réglementaires s'appliquant à des médicaments vétérinaires ont été prises selon les normes de service - et la cible de rendement avait été fixée à 90 % des décisions. De plus, Santé Canada a entrepris plusieurs autres initiatives pour améliorer l'efficacité du processus d'examen, notamment les suivants : lancement d'un projet pilote avec la Food and Drug Administration des États-Unis (FDA des É.-U.) sur l'examen parallèle des sections techniques des présentations de médicaments destinés aux animaux de compagnie; adoption d'un programme pilote de déclaration provisoire pour les produits vétérinaires de santé à faible risque (PVSFR); simplification de l'examen des présentations de médicaments génériques; mise en place d'un processus d'approbation spécialisé pour les médicaments à usage limité pour espèces mineures (ULEM); amélioration du processus d'échange de renseignements avec ses homologues internationaux, notamment en trouvant des moyens d'accroître l'utilisation des examens et des données provenant de l'étranger.
En ce qui a trait aux communications et aux consultations avec les intervenants, les informateurs clés externes ont souligné que la DMV avait fait des efforts concertés, surtout au cours des dernières années, pour améliorer ses activités de communication et de consultation avec les intervenants; en règle générale, ils estiment que ces mêmes activités se sont améliorées considérablement. Cela dit, certaines données probantes démontrent que, alors que Santé Canada a été particulièrement efficace pour communiquer avec l'industrie et plutôt efficace pour communiquer avec les vétérinaires, il n'a pas réussi à joindre les éleveurs d'animaux de ferme. Étant donné les répercussions de l'utilisation de médicaments vétérinaires sur la santé humaine et la salubrité des aliments, il est important que les éleveurs comprennent les risques liés à l'utilisation de ces produits. On pourrait mettre en œuvre une stratégie de communication à l'aide d'intermédiaires, comme les associations provinciales de vétérinaires et les éleveurs, pour s'assurer que les communications de Santé Canada au sujet des risques permettent de joindre les utilisateurs finaux de médicaments vétérinaires.
Dans le domaine de l'élaboration de règlements et de politiques, même si Santé Canada a présenté un certain nombre d'initiatives pour s'attaquer au problème complexe de la résistance aux antimicrobiens (RAM), il n'a pas encore entièrement mis en œuvre l'ensemble des recommandations formulées en 2002 par le Comité consultatif d'experts sur l'utilisation d'antimicrobiens chez les animaux et les conséquences pour la résistance et la santé humaine. Jusqu'à maintenant, son approche va également à l'encontre des recommandations de 2011 de l'Organisation mondiale de la Santé (OMS), notamment celles de mettre fin à l'utilisation non thérapeutique d'antimicrobiens et d'exiger des ordonnances pour tous les antimicrobiens utilisés pour lutter contre les maladies chez les animaux destinés à l'alimentation. Des informateurs clés de Santé Canada ont signalé que le Ministère travaille actuellement à un certain nombre d'initiatives pour s'attaquer à la RAM et collabore avec l'Agence de la santé publique du Canada (ASPC), l'ACIA, Agriculture et Agroalimentaire Canada (AAC) et les responsables provinciaux et territoriaux pour élaborer une approche plus coordonnée en matière de RAM.
Santé Canada a été très critiqué par les intervenants pour son incapacité à restreindre l'utilisation continue de médicaments non approuvés, qui serait l'un des principaux facteurs contribuant à la RAM. Deux éléments de l'actuel cadre de réglementation des médicaments vétérinaires rendent cette pratique possible. Premièrement, à l'heure actuelle, rien n'interdit l'importation de médicaments non homologués à des fins d'utilisation chez des animaux. Cette lacune a permis à des éleveurs d'obtenir des produits vétérinaires à coût moindre ou des produits non offerts au Canada pour les utiliser dans leurs activités d'élevage. L'autre élément se rapporte aux politiques actuelles sur les ingrédients pharmaceutiques actifs (IPA), qui font actuellement l'objet d'une faible surveillance de la part de Santé Canada. À titre comparatif, d'autres administrations, comme l'UE et les États-Unis, interdisent l'importation et l'utilisation de médicaments vétérinaires non homologués et limitent l'importation de produits chimiques en vrac et d'IPA aux titulaires de licences d'établissement.
Récemment, Santé Canada a amorcé un processus touchant l'importation pour usage personnel (IUP) ainsi que l'importation et l'utilisation directe d'IPA en tenant, en mars 2013, des consultations auprès des intervenants au sujet d'une approche proposée en matière de réglementation de l'IUP et des IPA.
Recommandation 2
Santé Canada devrait continuer de prendre des mesures pour lutter contre l'importation et l'utilisation de médicaments vétérinaires et d'IPA non homologués.
Les activités de pharmacovigilance de Santé Canada relatives aux médicaments vétérinaires comprennent la surveillance des déclarations de réactions indésirables à des médicaments (RIM), la détection des signaux, l'évaluation du lien de causalité et les mesures postérieures à la mise en marché, comme la modification des étiquettes et les rappels de médicaments. Les intervenants qui ont pris part à cette évaluation ont ciblé un certain nombre de lacunes possibles dans l'approche de Santé Canada concernant les déclarations de réactions indésirables à des médicaments et à la surveillance post-commercialisation, notamment : la sous-déclaration des réactions indésirables à des médicaments de la part des utilisateurs finaux; un niveau de connaissance et de compréhension insuffisant des exigences de Santé Canada concernant la déclaration des réactions indésirables à des médicaments de la part des fabricants étrangers; l'absence d'exigences concernant la déclaration des réactions indésirables à des médicaments pour les produits importés non approuvés, y compris les IPA; le manque d'attention accordée à l'efficacité du produit dans les déclarations de réactions indésirables à des médicaments, une information importante dans le contexte de la RAM selon les informateurs clés; le manque de surveillance des produits de santé naturels vétérinaires (PSNV) après la mise en marché. De plus, au Canada l'information sur le nombre et les types de réactions indésirables aux médicaments vétérinaires n'est pas rendue publique, contrairement à ce qui se fait aux États-Unis et dans l'UE.
Les activités de conformité et d'application de la loi touchant les médicaments vétérinaires sont exécutées par Santé Canada et l'ACIA; elles portent sur ce qui suit : sensibilisation, consultation et information; surveillance de la conformité au moyen d'inspections relatives aux bonnes pratiques de fabrication (BPF) et d'inspections de conformité aux limites maximales de résidus (LMR); vérifications et enquêtes sur la conformité; application d'un éventail de mesures volontaires ou réglementaires de conformité et d'application de la loi à l'égard des cas de non-conformité. L'approche actuelle de Santé Canada concernant les inspections relatives aux BPF des établissements de médicaments vétérinaires est perçue comme étant problématique par l'industrie des produits de santé animale, qui estime que le Ministère applique des lignes directrices inadéquates découlant d'une perspective axée sur la santé humaine pour les inspections relatives aux BPF, notamment des lignes directrices qui ne sont pas appliquées aux États-Unis ou dans l'UE. Cependant, Santé Canada a publié des lignes directrices précises décrivant la façon dont les exigences sur les BPF peuvent s'appliquer différemment dans le cas des médicaments vétérinaires. De plus, lors de consultations menées récemment sur un nouveau cadre de réglementation des médicaments vétérinaires, il a proposé d'établir des exigences sur les BPF des médicaments vétérinaires qui seraient admissibles selon un processus d'« homologation » proposé; ces exigences seraient semblables à celles prescrites dans le Règlement sur les produits naturels.
Rendement - Atteinte des résultats
Au cours de la période visée par l'évaluation, Santé Canada a entrepris de nombreuses activités qui devraient, en théorie, contribuer aux résultats attendus du PMV. Cependant, dans la plupart des cas, les données administratives appuyant les conclusions quant à la mesure dans laquelle les résultats ont été atteints sont limitées. Bien que l'évaluation visait à combler ces lacunes à l'aide d'enquêtes menées auprès de l'industrie et d'utilisateurs finaux, l'enquête auprès de ces derniers a obtenu un faible taux de réponse et a eu une portée limitée en raison du petit échantillon utilisé. Compte tenu de ces facteurs, les données permettant de tirer des conclusions définitives sont limitées quant à l'atteinte des résultats.
Dans l'immédiat, on s'attend à ce que le PMV entraîne une hausse du niveau de connaissance et de compréhension chez les utilisateurs finaux quant aux risques et aux avantages liés aux médicaments vétérinaires ainsi qu'une meilleure connaissance et compréhension du cadre réglementaire de Santé Canada s'appliquant aux médicaments vétérinaires au sein de l'industrie. Bien qu'il semble évident que Santé Canada a amélioré ses activités de communication et de consultation auprès des intervenants au cours des dernières années, peu de données probantes démontrent que ces activités ont produit l'effet souhaité, notamment chez les utilisateurs finaux.
Les activités du PMV visent également à accroître le niveau d'innocuité et d'efficacité des médicaments vétérinaires. Le PMV contribue à l'innocuité des produits en établissant des LMR et des limites administratives maximales de résidus (LAMR) pour les médicaments vétérinaires, et il avait établi 269 LMR pour 88 substances pharmacologiquement actives en date de mai 2012. De plus, des améliorations apportées récemment au processus d'examen des présentations pourraient, en théorie, mener à la présence de médicaments plus sûrs et efficaces sur le marché. Toutefois, rien ne prouve que les nouveaux médicaments sont effectivement plus sûrs et plus efficaces que les produits existants.
Dans l'immédiat, les activités du PMV visent une plus grande conformité de l'industrie au cadre de réglementation des médicaments vétérinaires de Santé Canada. Des données probantes donnent à penser que la conformité de l'industrie aux LMR établies et aux exigences relatives aux BPF est généralement élevée, mais en raison de la décision prise en 2007-2008 de combiner les rapports d'inspection des BPF des médicaments pour usage vétérinaire et pour usage humain, il est difficile de cibler des tendances claires au niveau de la conformité aux BPF au sein de l'industrie des médicaments vétérinaires. Il est important pour Santé Canada, en tant qu'organisme chargé de la réglementation des médicaments vétérinaires, de surveiller la conformité au sein de l'industrie des médicaments vétérinaires et de faire rapport à ce sujet. Une telle approche concorde sans doute davantage avec la décision prise récemment par le Ministère de reconnaître le caractère unique des médicaments vétérinaires par l'établissement d'un nouveau cadre de réglementation des médicaments vétérinaires et concorde également davantage avec l'approche adoptée par la FDA, qui sépare les rapports de conformité par type de produits. Il faudrait aussi mettre davantage l'accent sur la présentation des résultats en matière de conformité (au lieu des activités et des extrants) si l'on souhaite mieux comprendre le degré de conformité de l'industrie.
Recommandation 3
Santé Canada devrait travailler à améliorer les rapports sur la conformité de l'industrie aux exigences réglementaires s'appliquant aux médicaments vétérinaires. Le Ministère devrait également mettre davantage l'accent sur les résultats en matière de conformité dans les rapports sur le rendement, plutôt que sur les activités et les extrants.
À moyen terme, les activités du PMV devraient amener les intervenants externes à faire preuve de prudence lorsqu'ils utilisent des médicaments vétérinaires. Des données probantes tirées de la littérature indiquent qu'il existe des pratiques dangereuses dans le milieu agricole canadien, dont l'utilisation d'agents antimicrobiens, l'IUP ainsi que l'importation et l'utilisation directe d'IPA, même si l'ampleur du problème continue de susciter des discussions. L'incidence du PMV sur le comportement des utilisateurs finaux devrait faire l'objet de recherches dans l'avenir.
On s'attend également à ce que les activités du PMV entraînent, à moyen terme, une plus grande utilisation par Santé Canada des données scientifiques et de l'analyse risques-avantages en vue d'éclairer la prise de décisions. L'utilisation de données scientifiques et de l'analyse risques-avantages est officiellement intégrée au processus décisionnel de Santé Canada; en général, le Ministère semble utiliser les données scientifiques et l'analyse risques-avantages sur une base régulière pour éclairer la prise de décisions. Toutefois, le Ministère n'a pas encore mis en œuvre de réformes réglementaires pour s'attaquer à l'importation et à l'utilisation de médicaments non approuvés. Cette situation semble s'expliquer, du moins en partie, par des préoccupations concernant l'incidence économique possible de telles réformes sur les éleveurs.
À moyen terme, on s'attend à ce que les activités du PMV entraînent une intervention rapide à l'égard des risques ciblés. En raison de l'absence de normes de rendement et de renseignements sur le temps pris par Santé Canada pour intervenir à l'égard de ces risques, il n'y a pas suffisamment de données probantes pour appuyer les conclusions générales concernant ce résultat. Toutefois, on compte quelques exemples de problèmes de longue date auxquels Santé Canada ne s'est pas encore attaqué en modifiant ses politiques et ses règlements - notamment l'importation et l'utilisation de médicaments vétérinaires non approuvés qui se poursuivent.
Les activités du PMV devraient aussi mener, à moyen terme, à une plus grande harmonisation internationale des cadres de réglementation des médicaments vétérinaires et, ultimement, à une amélioration de la santé humaine et de la salubrité de l'approvisionnement alimentaire. Les données probantes recueillies dans le cadre de l'évaluation donnent à penser que Santé Canada a joué un rôle actif à l'échelle internationale. Santé Canada participe à la Coopération internationale pour l'harmonisation des exigences techniques pour l'enregistrement des médicaments vétérinaires (VICH) et à la Commission du Codex Alimentarius et a conclu plusieurs ententes d'échange de renseignements et de coopération en matière de réglementation avec des homologues internationaux. Même si les initiatives d'harmonisation réglementaire comme celles-ci peuvent contribuer à une amélioration de la santé humaine et de la salubrité de l'approvisionnement alimentaire, en l'absence de données probantes concrètes, les avantages pour la santé et la sécurité rattachés à une plus grande harmonisation sont davantage théoriques que réels.
À long terme, les activités du PMV devraient contribuer à une diminution des risques pour la santé et des effets indésirables associés à l'utilisation des médicaments vétérinaires, à une hausse de la salubrité de l'approvisionnement alimentaire au Canada ainsi qu'à une plus grande confiance du public à l'égard des médicaments vétérinaires, du système de réglementation connexe et de l'approvisionnement alimentaire. Il semble donc raisonnable de penser que les activités du PMV, telles que l'approbation en temps opportun de médicaments sûrs et efficaces, l'interdiction de la vente de certains produits pour l'utilisation chez les animaux destinés à l'alimentation pour lesquels aucune limite de résidus n'est jugée sûre, la gestion des résidus de médicaments dans les aliments, les initiatives visant à exercer une influence sur l'utilisation d'agents antimicrobiens chez les animaux destinés à l'alimentation et les activités de surveillance et de conformité après la mise en marché, devraient, en théorie, contribuer à la salubrité de l'approvisionnement alimentaire et à la réduction des risques pour la santé. La lutte contre l'importation et l'utilisation de médicaments vétérinaires non approuvés contribuerait encore davantage à la réduction des risques et à la salubrité des aliments.
Quant à la confiance du public à l'égard des médicaments vétérinaires, du système de réglementation connexe et de l'approvisionnement alimentaire, des sondages d'opinion menés récemment semblent indiquer que, à l'heure actuelle, la population canadienne fait plutôt confiance au système d'assurance de la salubrité des aliments du Canada, qu'elle approuve de façon générale les normes et règlements canadiens dans le domaine de la salubrité des aliments et qu'elle croit que le gouvernement du Canada peut contribuer grandement à accroître la confiance de la population à l'endroit du système d'assurance de la salubrité des aliments en soi. Toutefois, il n'existe aucune donnée sur l'opinion publique portant précisément sur les médicaments vétérinaires.
Rendement - Efficience et économie
En raison de changements apportés à l'approche de la DGPSA en matière de production de rapports financiers au cours de la période visée par l'évaluation, il a été difficile de comparer et d'analyser cette information au fil du temps. De plus, la DGPSA a commencé récemment à inclure les médicaments vétérinaires dans les rapports financiers du grand Programme des médicaments. La DGPSA est en mesure d'isoler les activités liées aux médicaments vétérinaires de la DMV de ses activités touchant la salubrité des aliments pour la production de rapports. Cependant, le PMV ne comporte pas uniquement les activités de la DMV, mais comprend aussi les activités d'autres partenaires du programme, comme l'Inspectorat, le Bureau des régions et des programmes (BRP) et la Direction de la gestion des ressources et des opérations (DGRO). Il se peut que l'approche actuelle de la DGPSA s'appliquant à la production de rapports financiers ne permette pas d'obtenir le coût total du PMV. Par ailleurs, aucun rapport fondé sur les activités, un type de rapport important pour analyser l'efficience et l'économie du programme, n'a été produit depuis 2008-2009. Tant du point de vue de la gestion du programme que de celui de son évaluation, il est important de définir le coût total des activités touchant les médicaments vétérinaires de la Direction générale et d'analyser les inducteurs de coût.
En raison des lacunes majeures que présentaient les données existantes sur les finances et les ressources humaines, l'évaluation n'a pas permis d'établir la mesure dans laquelle les ressources du programme ont été utilisées conformément à ce qui était prévu, ni de déterminer si les extrants du programme ont été produits de manière efficace ou si les résultats attendus ont été obtenus de manière économique. Cela dit, des données probantes démontrent des gains d'efficience opérationnelle au cours des dernières années. Le PMV a éliminé un important arriéré de travail lié aux présentations de drogue nouvelle dans les dernières années, a réduit considérablement le délai moyen nécessaire pour décider si une drogue nouvelle doit être approuvée et a entrepris d'autres initiatives pour améliorer l'efficacité de l'examen préalable à la mise en marché. Puisque bon nombre de ces initiatives sont relativement récentes, leur incidence sur l'efficience et l'économie du programme n'a pas encore été établie. Le recours accru aux présentations électroniques, l'acceptation des présentations successives, l'acceptation des ensembles de données de l'étranger et l'utilisation des examens étrangers pourraient mener à d'autres gains d'efficience.
| Recommandations | Réponse | Activités principales | Réalisations attendues | Direction responsable | Échéance |
|---|---|---|---|---|---|
| 1. Santé Canada devrait développer et renforcer sa capacité de faire rapport sur les résultats de ses activités de réglementation se rapportant au PMV. | D'accord | Renforcer le processus intégré de planification opérationnelle et de production de rapports à la DGPSA au niveau des programmes et à celui des sous-programmes conformément à l'actuelle AAP (2013-2014). |
|
DGRO |
|
| 2. Santé Canada devrait continuer de prendre des mesures pour lutter contre l'importation et l'utilisation de médicaments vétérinaires et d'IPA non homologués. | D'accord | La DGPSA mènera des consultations pour étudier les options et les approches internationales sur la question de l'IUP et des IPA afin de répondre aux préoccupations touchant la salubrité des aliments et la santé publique. Dans le nouveau cadre proposé de réglementation des médicaments vétérinaires, la question de l'IUP et des IPA est traitée au niveau réglementaire et sera appuyée par l'apport de modifications à la politique et au programme. |
|
DMV |
|
| 3. Santé Canada devrait travailler à améliorer les rapports sur la conformité de l'industrie aux exigences réglementaires s'appliquant aux médicaments vétérinaires. Le Ministère devrait également mettre davantage l'accent sur les résultats en matière de conformité dans les rapports sur le rendement, plutôt que sur les activités et les extrants. | D'accord | Santé Canada utilise les taux de conformité globaux (c.-à-d. les pourcentages de conformité) de l'industrie comme indicateur de rendement fondé sur des résultats pour mesurer et évaluer les résultats des extrants de l'Inspectorat (c.-à-d. objectifs en matière d'inspection et nombre de dossiers d'incident ouverts et fermés) par rapport aux objectifs du programme. La mesure du rendement fait l'objet d'un rapport mensuel. Les résultats sont également présentés dans le tableau de bord de Santé Canada et utilisés dans le Rapport ministériel sur le rendement, le Rapport sur les plans et les priorités et le Cadre de mesure du rendement (CMR). Depuis la période visée par l'évaluation, Santé Canada a mis au point un rapport sommaire des inspections annuelles, destiné à une publication externe. Le rapport décrit en détail les taux de conformité globaux de l'industrie par programme et présente les observations communes mentionnées pour les établissements non conformes. Il renferme également des exemples précis d'observations formulées au regard de la Loi sur les aliments et drogues et de son règlement d'application et établit des liens entre les inspections réalisées par activité (p. ex. fabricant, importateur et distributeur), les observations présentées et la catégorie de risque connexe. Le rapport est publié en vue de contribuer à l'atteinte de nombreux résultats en matière de rendement présentés dans le CMR, y compris les résultats « connaissance et compréhension accrues au sein de l'industrie du cadre de réglementation de Santé Canada » et « conformité accrue de l'industrie aux exigences réglementaires de Santé Canada ». |
Préparation du premier rapport sommaire des inspections annuelles en vue de sa publication. | Inspectorat | Mars 2014 |
|
|||||
1. Introduction
Le Programme des médicaments vétérinaires (PMV) est administré par la Direction des médicaments vétérinaires (DMV), qui fait partie de la Direction générale des produits de santé et des aliments (DGPSA) de Santé Canada. Le PMV est chargé d'évaluer et de surveiller l'innocuité, la qualité et l'efficacité des médicaments vétérinaires administrés aux animaux destinés à l'alimentation et aux animaux de compagnie, d'encourager leur utilisation prudente et d'établir des normes à cet égard (Santé Canada, 2010a). Les activités du PMV sont les suivantes : réaliser des travaux de recherche et de surveillance sur les tendances en santé; élaborer des politiques et des règlements; communiquer avec les partenaires et les intervenants; réaliser l'examen préalable à la mise en marché et la surveillance post-commercialisation des médicaments vétérinaires; surveiller la conformité à la réglementation et faire observer la réglementation. Les principaux participants au programme sont les suivants : la DMV; l'Inspectorat de la DGPSA; les bureaux régionaux du Bureau des régions et des programmes (BRP); l'Agence canadienne d'inspection des aliments (ACIA).
L'évaluation du PMV fait partie du Plan quinquennal d'évaluation de Santé Canada. À l'aide de l'actuelle Politique sur l'évaluation du Conseil du Trésor (SCT, 2009), les évaluateurs ont examiné la pertinence et le rendement (efficacité, efficience et économie) des activités de Santé Canada relevant du PMV menées durant la période de 1999 à 2012Note de bas de page 1. Cette période a été établie d'après le Plan d'évaluation stratégique de la Direction générale des produits de santé et des aliments (2006), qui définissait l'historique du PMV en matière de financement et les obligations connexes en matière de production de rapports. Cependant, l'évaluation porte surtout sur les dernières années de cette période. Les résultats de l'évaluation guideront la mise en œuvre des activités courantes et futures du PMV.
Prairie Research Associates Inc., une société indépendante d'experts-conseils en évaluation, a réalisé l'évaluation pour le compte de Santé Canada. La collecte de données s'est déroulée de février 2012 à août 2013 et repose sur plusieurs sources de données, dont une revue de la littérature, un examen des documents, un examen des données administratives, une analyse comparative des questions importantes, des enquêtes auprès de représentants de l'industrie et d'utilisateurs finaux des médicaments vétérinaires ainsi que des entrevues avec des informateurs clés. Les constatations issues de l'évaluation ainsi que les conclusions et les recommandations formulées par les évaluateurs sont exposées dans le présent rapport.
1.1 Structure du rapport
Le rapport compte plusieurs sections. La section 2 présente le profil détaillé du PMV, la section 3, la méthodologie adoptée pour l'évaluation, et la section 4, les constatations issues de l'évaluation. La section 5 présente les conclusions et les recommandations formulées par les évaluateurs. Trois annexes sont jointes au rapport principal. L'annexe A contient la matrice d'évaluation, l'annexe B, la liste des références bibliographiques, et l'annexe C, des tableaux de données supplémentaires.
2. Profil du PMV
Le PMV assume la responsabilité suivante : évaluer et surveiller l'innocuité, la qualité et l'efficacité des médicaments vétérinaires administrés aux animaux destinés à l'alimentation et aux animaux de compagnie, encourager leur utilisation prudente et établir des normes à cet égard (Santé Canada, 2010a). La présente section décrit les rôles et les responsabilités des partenaires du PMV, les activités du programme et les résultats attendus.
2.1 Rôles et responsabilités des partenaires du PMV
Le PMV compte quatre participants clés au programme : la DMV, l'Inspectorat, les bureaux régionaux du BRP et l'ACIA.
2.1.1 DMV
La DMV, établie en octobre 2001, est la principale organisation responsable de l'évaluation et de la surveillance de l'innocuité, de la qualité et de l'efficacité des médicaments vétérinaires, de la promotion de leur utilisation prudente et de l'établissement de normes relatives à cette même utilisation. La DMV se compose de cinq divisions et du Bureau du directeur général, qui est responsable de la planification et de l'administration ainsi que des opérations financières de la DMV (Santé Canada, 2010b). Les rôles et les responsabilités des cinq divisions de la DMV sont résumés ci-dessous.
Division de l'innocuité pour les humains (DIH)
- Établir si les médicaments vétérinaires présentent un risque pour la santé humaine à l'aide des méthodes suivantes :
- évaluation de la pharmacologie ou de la toxicologie du médicament pour calculer la dose quotidienne admissible et établir s'il s'agit d'un produit toxique ou carcinogène pour les humains;
- (pour les médicaments antimicrobiens) évaluation de l'innocuité microbiologique du médicament pour calculer la dose quotidienne admissible microbiologique du médicament s'il est ingéré par un humain à partir de sources alimentaires et pour évaluer l'incidence de l'utilisation du médicament chez les animaux sur la santé humaine;
- calcul de la LMR du médicament et du délai d'attente connexe (s'il y a lieu).
- Établir des normes nationales sur les résidus de médicaments vétérinaires qui peuvent demeurer dans les aliments d'origine animale (p. ex. en fixant des LMR).
- Produire des évaluations des risques pour la santé (ERS) et des recommandations connexes (sur demande, si des inspections révèlent des violations en matière de résidus de médicaments alors qu'aucune LMR ou ni aucun seuil de tolérance n'a été établi).
- Élaborer des politiques et des règlements sur l'innocuité pour les humains des médicaments vétérinaires.
- Encourager l'utilisation prudente des médicaments vétérinaires, plus précisément pour ce qui est des médicaments antimicrobiens et de leur incidence sur la résistance aux antimicrobiens.
Division de l'évaluation chimique et de la fabrication (DECF)
- Réaliser des évaluations préalables à la mise en marché des processus de production complets de médicaments vétérinaires afin de s'assurer que les médicaments sont conformes aux normes de qualité acceptables.
- Surveiller les processus de production des médicaments vétérinaires pour s'assurer de leur conformité aux normes de qualité et de fabrication acceptables.
- Réaliser des ERS et transmettre des recommandations connexes si certains aspects de la qualité d'un médicament vétérinaire peuvent avoir une incidence sur la sécurité des humains ou des animaux.
- Évaluer les modifications apportées aux processus de production de médicaments vétérinaires après la mise en marché.
- Élaborer des politiques et des documents d'orientation sur la qualité des médicaments vétérinaires.
Division de l'évaluation clinique (DEC)
- Réaliser des évaluations préalables à la mise en marché de médicaments vétérinaires pour vérifier leur innocuité et leur efficacité.
- Vérifier les étiquettes des médicaments vétérinaires en ce qui a trait à la clarté, à la concision et au caractère adéquat du mode d'emploi.
- Surveiller les médicaments vétérinaires qui se trouvent sur le marché au moyen d'activités de surveillance post-commercialisation (aussi appelées activités de pharmacovigilance).
- Encourager une utilisation prudente des médicaments vétérinaires qui sont sur le marché.
- Superviser le programme de distribution de médicaments d'urgence (DMU), qui permet aux fabricants de vendre de petites quantités de médicaments nouveaux, qui ne sont pas approuvés au Canada, à des vétérinaires praticiens dans des circonstances particulières.
- En collaboration avec la DIH et la DECF, évaluer les propositions d'essais cliniques.
Division de la gestion des présentations et du savoir (DGPS)
- Gérer les présentations de médicaments vétérinaires et élaborer des politiques connexes.
- S'assurer que les présentations concernent des médicaments vétérinaires et qu'elles relèvent du mandat de la DMV.
- Vérifier l'exhaustivité et la qualité des présentations; demander des précisions aux promoteurs au besoin.
- Distribuer les présentations aux divisions concernées à des fins d'examen et compiler leurs recommandations respectives.
- Formuler la position de la DMV sur le médicament vétérinaire et informer le promoteur de la décision.
- Entreprendre un processus de réexamen avec le promoteur (au besoin).
Division des politiques, de la réglementation et des affaires internationales (DPRAI)
- Élaborer des politiques, des lignes directrices et des règlements sur les questions liées à l'examen des présentations de médicaments vétérinaires ou à la protection de l'approvisionnement alimentaire canadien et de la santé humaine et animale.
- Planifier et coordonner les activités internationales de la DMV, notamment en prenant part à des activités bilatérales avec d'autres organismes de réglementation et en participant à la Commission du Codex Alimentarius et à la VICH.
- Favoriser et maintenir la participation des intervenants aux activités de la DMV.
2.1.2 Inspectorat et BRP
L'Inspectorat et les bureaux régionaux du BRP sont responsables de l'exécution du programme de l'Inspectorat. Le principal rôle de l'Inspectorat consiste à « exécuter un programme national de conformité et d'application de la loi pour tous les produits visés par le mandat de la Direction générale, à l'exception des produits alimentaires [ainsi que des aliments médicamentés destinés au bétail et des produits biologiques vétérinaires] qui relèvent de l'Agence canadienne d'inspection des aliments » (Santé Canada, 2011a). En ce qui a trait aux médicaments vétérinaires, les responsabilités de l'Inspectorat comprennent ce qui suit :
- délivrer des licences d'établissement de médicaments vétérinaires et mener des inspections pour s'assurer de la conformité aux BPF;
- mener des vérifications de la conformité et des enquêtes si un cas éventuel de non-conformité est établi ou porté à l'attention de l'Inspectorat;
- encourager la conformité chez les parties réglementées ou la faire respecter par celles-ci en utilisant diverses approches volontaires ou réglementaires; bien que l'on parvienne normalement à la conformité par la coopération entre l'Inspectorat et la partie réglementée, l'Inspectorat peut faire appel à des options d'application de la loi non volontaires au besoin (Inspectorat, 2005a);
- effectuer des rappels, lesquels se définissent comme suit : retrait d'un produit non conforme par l'entreprise en vue d'en empêcher la vente ou l'utilisation, ou encore de corriger un tel produit, qui peut représenter un risque pour la santé des consommateurs ou qui ne respecte pas la loi administrée par la DGPSA (Inspectorat, 2005a); en règle générale, les rappels se font sur une base volontaire par la partie réglementée;
- fournir des services d'analyse chimique, physique et microbiologique par l'intermédiaire du Programme de laboratoire pour soutenir les activités d'inspection et d'enquête;
- examiner les envois personnels et commerciaux de médicaments vétérinaires à la frontière pour s'assurer qu'ils sont conformes à la réglementation canadienne;
- demander que la DMV réalise des ERS lorsque des risques possibles pour la santé ont été relevés dans le cadre des activités de conformité;
- recommander que Santé Canada informe le public de risques imminents pour la santé en diffusant une mise en garde ou un avis public;
- réaliser des activités de promotion de la conformité avec des intervenants de l'industrie.
En présence de cas de non-conformité, l'Inspectorat adopte une approche axée sur le risque pour collaborer avec la partie réglementée de manière à s'assurer que des mesures appropriées ont été prises, comme une cessation de la vente du produit, un rappel ou des documents de communication publique. L'Inspectorat peut également prendre des mesures coercitives, comme la saisie du produit, des alertes à l'importation ou des enquêtes criminelles, suivant le cas.
Le BRP est le secteur opérationnel de Santé Canada dans les régions. Il fournit des services à la population canadienne dans chaque province et territoire. Il assume notamment les responsabilités suivantes : activités de promotion de la conformité; application des lois et des règlements au moyen d'inspections, d'enquêtes, d'actions en justice et d'évaluations de la conformité suivant des normes relatives à la fabrication, à l'emballage, à l'étiquetage, à l'analyse, à l'importation, à la distribution et à la vente en gros de produits de santé destinés aux consommateurs, y compris les médicaments vétérinaires.
2.1.3 ACIA
Même si l'évaluation du PMV ne porte pas sur les activités de l'ACIA en tant que telles, l'ACIA, tout comme Santé Canada, joue un rôle important dans la réglementation des médicaments vétérinaires.
Les responsabilités de l'ACIA comprennent la surveillance du respect des LMR s'appliquant aux substances chimiques contenues dans les produits alimentaires, notamment celles que contiennent les médicaments vétérinaires. Ces LMR sont fixées par la DMV en vertu de la Loi sur les aliments et drogues et de son règlement d'application (ACIA, 2012). Les nouveaux médicaments vétérinaires approuvés par la DMV sont visés par les activités de surveillance de l'ACIA, et l'Agence a le pouvoir de faire appliquer la loi en cas d'infraction. La DMV joue un rôle consultatif auprès de l'ACIA en présence de violations; elle fournit à l'Agence des évaluations des risques (Santé Canada, 2011b).
L'ACIA est également responsable de la réglementation des produits biologiques vétérinaires, comme le précisent la Loi sur la santé des animaux et son règlement d'application. À cet égard, les rôles et les responsabilités de l'Agence comprennent ce qui suit : délivrer des licences aux fabricants de produits biologiques vétérinaires; délivrer des licences pour des produits biologiques vétérinaires; délivrer des permis d'importation; établir des délais d'attente; approuver le libellé de l'étiquette pour différents états pathologiques; délivrer des certificats d'exportation; collaborer avec l'Agence des services frontaliers du Canada (ASFC) pour les inspections à la frontière; réaliser des activités de pharmacovigilance. Le Centre canadien des produits biologiques vétérinaires (CCPBV) a la responsabilité de réglementer la fabrication et l'importation des produits biologiques vétérinaires.
Finalement, l'ACIA réglemente les aliments pour animaux en vertu de la Loi relative aux aliments du bétail. En collaboration avec la DMV, la Division des aliments pour animaux (DAA) de l'ACIA tient à jour le Recueil des notices sur les substances médicatrices (RNSM), qui présente la liste des substances médicatrices destinées à la vente libre qui ont été approuvées par Santé Canada à des fins d'utilisation dans les aliments médicamentés destinés au bétail. L'ACIA doit également s'assurer que les médicaments vétérinaires sont utilisés dans les aliments pour animaux d'élevage suivant le mode d'emploi approuvé et que les aliments non médicamentés ne contiennent pas de résidus de médicaments dangereux. Si les produits posent un risque inacceptable pour la santé des animaux ou pour l'élevage ou s'ils peuvent entraîner des risques pour la santé humaine en raison de la présence de résidus dans les aliments, on procède alors à des rappels de produits et à d'autres mesures de contrôle de produit.
En raison du chevauchement des définitions des termes « drogue », contenu dans la Loi sur les aliments et drogues, et « aliments pour animaux de ferme », contenu dans la Loi relative aux aliments du bétail, la DMV et l'ACIA collaborent actuellement pour établir les usages homologués de chacun des produits. La DAA de l'ACIA est responsable de ces activités.
2.2 Modèle logique
| Intrants | Financement | Ressources humaines | Installations, infrastructures | Lois, règlements, politiques | Science et technologie | Données de recherche |
|---|---|---|---|---|---|---|
| Activités (A) |
(1) Effectuer la recherche et assurer la surveillance | (2) Élaborer des politiques et des règlements fondés sur la science | (3) Communiquer avec les partenaires et les intervenants et les faire participer | (4) Effectuer des activités préalables à la mise en marché et établir des normes | (5) Effectuer la surveillance post-commercialisation et les activités de suivi | (6) Donner des conseils et du soutien et mener des activités d'application de la loi |
| Extrants (B) |
|
|
|
|
|
|
| Groupes cibles (C) |
|
|
|
|
|
|
| Résultats immédiats (D) |
Connaissances et compréhension accrues des intervenants externes quant aux risques et aux avantages des médicaments vétérinaires | Connaissances et compréhension accrues de l'industrie quant au cadre de réglementation des médicaments vétérinaires de Santé Canada | Innocuité et efficacité accrues des médicaments vétérinaires | Conformité accrue de l'industrie aux exigences réglementaires de Santé Canada relatives aux médicaments vétérinaires | ||
| Résultats intermédiaires (E) | Adoption de comportements sûrs par les intervenants externes par rapport à l'usage des médicaments vétérinaires | Recours accru de Santé Canada aux données scientifiques et aux analyses risques-avantages pour éclairer la prise de décisions | Mesures réglementaires prises au moment opportun quand des risques sont cernés | Harmonisation à l'échelle internationale des cadres de réglementation pour les médicaments vétérinaires, contribuant à améliorer la santé des Canadiens et à accroître la salubrité de l'approvisionnement alimentaire au Canada | ||
| Résultats à long terme (F) | Atténuation des risques pour la santé et des effets indésirables associés à l'usage des médicaments vétérinaires | Contribution du Programme à l'assurance de la salubrité de l'approvisionnement alimentaire au Canada | Confiance accrue du public à l'égard des médicaments vétérinaires, du système de réglementation et de l'approvisionnement alimentaire | Système de réglementation durable, économique, réceptif et fondé sur des données scientifiques pour les médicaments vétérinaires au Canada | ||
| Résultat final | Amélioration de la santé et du bien-être des Canadiens | |||||
Description du modèle logique (Tableau 1)
Le PMV comporte six activités principales qui sont mises en œuvre par Santé Canada et l'ACIA même si, tel qu'il a été indiqué précédemment, l'évaluation est axée sur les activités de Santé Canada.
Fournir du soutien et réaliser des activités de recherche et de surveillance. La DMV finance et soutient des activités de recherche et de surveillance menées avec des partenaires internes et externes. Ces activités visent à renforcer le processus d'élaboration de politiques et de règlements rigoureux pour, à terme, améliorer la santé humaine et animale et la sécurité de l'approvisionnement alimentaire. Par exemple, ces activités comprennent la recherche sur les méthodes de détection des résidus de médicaments, la surveillance des résidus et la surveillance de la résistance aux antimicrobiens. Ces activités devraient générer les produits suivants : rapports, méthodologies (p. ex. détection améliorée des résidus) et données (p. ex. tendances relatives aux résidus et à la résistance aux antimicrobiens). Les groupes cibles de ces activités sont les suivants : organismes de réglementation fédéraux (p. ex. ACIA et ASPC) et intervenants internationaux.
Élaborer des politiques et des règlements fondés sur la science. Cette activité comprend l'élaboration et la mise en œuvre de différents types de lois, de règlements, de politiques, de documents d'orientation et de protocoles d'entente (PE) sur le maintien et l'amélioration du cadre de réglementation des médicaments vétérinaires. Ces activités devraient générer les produits suivants : politiques, règlements et documents d'orientation, et protocoles d'entente pour la coopération nationale et internationale. Les groupes cibles pour ces activités sont les suivants : industrie, organismes de réglementation et partenaires fédéraux, provinciaux, territoriaux et internationaux, utilisateurs finaux, comités consultatifs, associations professionnelles, et universitaires.
Communiquer avec les partenaires et les intervenants et les faire participer. Par cette activité, le PMV communique au moyen de différentes méthodes avec les partenaires et les intervenants, notamment le grand public, l'industrie, des professionnels de la santé, des universitaires, des chercheurs, etc. Cette activité compte également des consultations avec des intervenants sur des questions touchant les médicaments vétérinaires (comme des consultations avec l'industrie sur des ébauches de document d'orientation). Ces activités devraient générer les produits suivants : documents, activités et réunions d'information pour les intervenants, consultations, avis (p. ex. avis publics et communications aux professionnels de la santé), réponses aux demandes de renseignements et correspondance. Les groupes cibles pour ces activités sont les suivants : industrie, organismes de réglementation et partenaires fédéraux, provinciaux, territoriaux et internationaux, utilisateurs finaux, comités consultatifs, associations professionnelles, et universitaires.
Effectuer des activités préalables à la mise en marché et établir des normes. Cette activité comprend l'examen préalable à la mise en marché des présentations de médicaments vétérinaires soumises par l'industrie afin de déterminer si les produits sont sûrs et efficaces et si l'étiquette est claire et concise. De plus, les médicaments utilisés chez les animaux destinés à l'alimentation sont évalués pour vérifier les risques qu'ils pourraient présenter pour la santé humaine. Cette activité comprend aussi l'établissement de périodes d'attente et de LMR. Ces activités devraient générer les produits suivants : limites administratives maximales de résidus et limites maximales de résidus, évaluations des risques, normes, autorisations et plans de gestion des risques. Les groupes cibles pour ces activités sont les suivants : organismes de réglementation fédéraux, promoteurs et demandeurs, organismes de réglementation internationaux, industrie, associations professionnelles et utilisateurs finaux.
Effectuer la surveillance post-commercialisation et les activités de suivi. Dans le cadre de cette activité, le PMV vérifie l'innocuité, l'efficacité et la qualité des médicaments vétérinaires sur le marché en recueillant et en analysant de l'information sur des problèmes ou des préoccupations qui ont été signalés ou des déclarations de réactions indésirables à des médicaments et en demandant des rapports périodiques de pharmacovigilance (RPPV). Cette activité comprend aussi différents types de travaux de surveillance des résidus et de la contamination. Les données de surveillance sont analysées et utilisées pour produire et publier de l'information sur les dangers des médicaments vétérinaires et pour recommander des mesures correctives. Cette activité comprend aussi la collaboration avec l'ASPC pour le suivi des tendances relatives à la résistance aux antimicrobiens dans le cadre du Programme intégré canadien de surveillance de la résistance aux antimicrobiens (PICRA). Ces activités devraient générer les produits suivants : étiquettes à jour, évaluations des mises à jour périodiques des résumés, évaluations des risques, plans de gestion des risques, décisions relatives à la gestion des risques et rapports sur les effets indésirables des médicaments. Les groupes cibles pour ces activités sont les suivants : organismes de réglementation internationaux et fédéraux, promoteurs et demandeurs, détenteurs d'une autorisation de mise sur le marché, utilisateurs finaux, associations professionnelles et universitaires.
Donner des conseils et du soutien et mener des activités de conformité et d'application de la loi. Cette activité vise à faire observer la Loi sur les aliments et drogues et son règlement d'application et à surveiller la conformité à ceux-ci par un certain nombre d'activités : vérifications de la conformité, inspections, délivrance de licences d'établissement, intégrité des frontières et soutien en laboratoire. En cas de non-conformité, diverses options d'application de la loi peuvent être mises en œuvre, notamment l'arrêt des ventes ou le rappel d'un produit, la saisie de produits, des perquisitions et des poursuites. Finalement, cette activité comprend la surveillance et le contrôle des résidus de médicaments vétérinaires contenus dans des produits alimentaires canadiens et importés, activités qui sont réalisées par l'ACIA. Ces activités devraient générer les produits suivants : évaluations des risques pour la santé, évaluations des dangers pour la santé, décisions sur le statut des médicaments, rapports et recommandations réglementaires, permis d'établissement, accords de reconnaissance mutuelle, rapports de conformité et de vérification, rapports d'inspection, analyses de laboratoire et rappels. Les groupes cibles pour ces activités sont les suivants : partenaires et intervenants de réglementation fédéraux, provinciaux, territoriaux et internationaux, industrie, public et utilisateurs finaux, ainsi que promoteurs et demandeurs.
L'ensemble des activités et des produits devrait donner lieu aux résultats suivants :
À court terme, les activités du PMV devraient accroître le niveau de connaissance et de compréhension des risques et des avantages liés aux médicaments vétérinaires chez les intervenants externes, accroître le niveau de connaissance et de compréhension du cadre de réglementation des médicaments vétérinaires de Santé Canada au sein de l'industrie ainsi que renforcer le niveau d'innocuité et d'efficacité des médicaments vétérinaires et le niveau de conformité de l'industrie au cadre de réglementation.
La réalisation de ces résultats immédiats devrait mener à plusieurs résultats intermédiaires : adoption de comportements sûrs à l'égard des médicaments vétérinaires par les intervenants externes; utilisation accrue des données scientifiques et de l'analyse risques-avantages par Santé Canada pour éclairer la prise de décisions; intervention réglementaire rapide à l'égard des risques cernés. De plus, l'harmonisation internationale des cadres de réglementation des médicaments vétérinaires devrait contribuer à améliorer la santé de la population canadienne et à accroître la salubrité de l'approvisionnement alimentaire au Canada.
À long terme, Santé Canada veut réduire les risques pour la santé et les effets indésirables associés à l'utilisation des médicaments vétérinaires, à accroître la confiance du public à l'égard des médicaments vétérinaires, du système de réglementation connexe et de l'approvisionnement alimentaire, à contribuer à la salubrité de l'approvisionnement alimentaire et à mettre en place un système de réglementation des médicaments vétérinaires au Canada qui soit durable, rentable, adapté et fondé sur des données scientifiques.
Ces résultats devraient contribuer à l'atteinte de l'objectif principal de Santé Canada, soit d'améliorer la santé et le bien-être des Canadiens.
3. Méthodologie
La présente section du rapport décrit en détail la méthode d'évaluation. Elle présente une liste des éléments et des questions d'évaluation, une description du modèle de l'évaluation, des méthodes de collecte de données et de l'approche utilisée pour analyser les données et un exposé sur les limites de la méthode ainsi que des stratégies d'atténuation.
3.1 Questions d'évaluation
L'évaluation vise à répondre à dix grandes questions et à un certain nombre de questions secondaires. L'annexe A contient une matrice d'évaluation détaillée qui relie chaque question à un ensemble d'indicateurs, de sources de données et de méthodes de collecte. Les questions et la matrice d'évaluation sont conformes à la Politique sur l'évaluation du Conseil du Trésor du Canada.
3.2 Modèle de l'évaluation et méthodes de collecte de données
Le modèle de l'évaluation a été élaboré à partir des constatations issues d'une évaluation de l'évaluabilité, qui constituait la première étape de l'évaluation. L'évaluation de l'évaluabilité comportait un examen préliminaire, une évaluation des données administratives et des documents existants ainsi que 14 entrevues préliminaires auprès d'intervenants clés du programme, y compris des représentants de la DMV, de l'Inspectorat et de l'ACIA. Le modèle et la matrice d'évaluation (Annexe A) ont été élaborés d'après l'évaluation de l'évaluabilité.
Plusieurs méthodes de collecte de données ont été utilisées pour l'évaluation.
Revue de la littérature. La revue de la littérature a permis de répondre aux questions d'évaluation touchant la pertinence du programme, les résultats à long terme et les autres approches. Des publications évaluées par des pairs (c.-à-d. milieu scientifique et universitaire) et de la documentation parallèle ont été prises en compte dans la revue. Des recherches en ligne ont permis de cibler la documentation pertinente.
Examen des documents. L'examen des documents a permis de répondre aux questions d'évaluation, dans la mesure où des documents pertinents existaient. Les documents examinés comprenaient des documents gouvernementaux, surtout des documents produits par Santé Canada et l'ACIA, se rapportant à la planification, à la gestion et aux activités courantes du PMV. Plusieurs centaines de documents ont été examinés dans le cadre de l'examen.
Examen des données administratives. L'examen des données administratives a permis de répondre aux questions se rapportant aux résultats du programme. Des données produites par la DMV, l'Inspectorat et l'ACIA ont été examinées. Bien que théoriquement il s'agissait de deux exercices distincts, dans la pratique l'examen des documents et l'examen des données administratives ont constitué deux volets d'une même tâche, car la majorité des données administratives se retrouvaient dans les documents du programme.
Analyse comparative des principales questions touchant la réglementation des médicaments vétérinaires. L'analyse des questions importantes a permis d'élargir la revue de la littérature et l'examen des documents dans le but d'examiner un certain nombre de sujets importants relatifs à la réglementation des médicaments vétérinaires qui sont ressortis à l'étape de la revue de la littérature et de l'examen des documents. Elle avait pour objectifs de décrire les mesures prises par le Canada à l'égard des questions cernées, d'examiner la façon dont les intervenants nationaux et internationaux ont perçu ces mesures et d décrire comment d'autres administrations, notamment les États-Unis et l'Union européenne (UE), ont traité ces questions.
Enquête auprès de représentants de l'industrie. L'enquête bilingue menée auprès de représentants de l'industrie était fondée sur une méthode Web et portait sur les questions d'évaluation se rapportant aux résultats. Elle visait les fabricants de médicaments vétérinaires ainsi que les consultants de l'industrie. Un échantillon d'enquête possible a été fourni par l'Institut canadien de la santé animale (ICSA), la principale association de l'industrie des médicaments vétérinaires au Canada. Au total, l'ICSA a donné 30 noms. Les noms fournis en double et ceux des personnes-ressources représentant une même organisation ont été supprimés, tout comme ceux des personnes qui avaient déjà participé à une entrevue en tant qu'informateurs clés. Une fois les données épurées, l'échantillon final comprenait 20 représentants de l'industrie, chacun étant d'une organisation différente. L'enquête a été menée à bien auprès de 10 répondants, ce qui donne un taux d'achèvement de 50 %.
Enquête auprès d'utilisateurs finaux de médicaments vétérinaires. L'enquête bilingue menée auprès d'utilisateurs finaux était fondée sur une méthode Web et visait des vétérinaires, des technologues en santé animale et des représentants d'associations d'éleveurs, dont certains sont peut-être eux-mêmes des éleveurs. L'échantillon a été constitué à partir d'une liste fournie par Santé Canada, qui comprenait le nom d'intervenants de la DMV se trouvant dans la base de données du Système de gestion de l'information sur les intervenants (SGII) de Santé Canada; cette liste comportait principalement des représentants d'associations d'éleveurs. Un petit nombre de noms supplémentaires, surtout des vétérinaires, a été fourni par le PMV pour donner suite à une demande formulée par les évaluateurs. L'échantillon final de 275 personnes comprenait 215 représentants d'associations d'éleveurs et 60 vétérinaires et technologues en santé animale. Le taux de réponse à l'enquête a été de 12 % (32 adresses valides sur 267 ) et le taux d'achèvement a été de 8 % (21 adresses valides sur 267).
Entrevues avec des informateurs clés externes. Les entrevues avec des informateurs clés ont permis de répondre à toutes les questions d'évaluation. Au total, 36 informateurs clés externes ont été interviewés. Il s'agissait de représentants de secteurs de Santé Canada qui ne participent pas à la prestation du PMV et d'autres ministères fédéraux (n = 10); de représentants d'associations médicales vétérinaires provinciales et d'autres organismes de réglementation provinciaux (n = 11); de représentants d'associations d'éleveurs (n = 4); d'universitaires et de chercheurs (n = 4); de représentants de l'industrie (n = 3); de représentants d'associations de consommateurs (n = 1); d'autres intervenants externes (n = 3). Les informateurs clés ont été désignés par les évaluateurs à l'aide d'un échantillonnage dirigé - c'est-à-dire que les informateurs clés ont été sélectionnés pour leurs connaissances particulières, leur expertise ou leur participation au PMV et pour le point de vue unique que chacun pourrait apporter à l'évaluation.
Tous les informateurs clés ont reçu une invitation par courriel à participer à l'évaluation de la part de Santé Canada et ont obtenu une copie du guide d'entrevue à l'avance afin qu'ils puissent préparer leurs réponses. Les entrevues ont été menées dans la langue officielle choisie par l'informateur clé et ont été enregistrées sur support numérique avec la permission des informateurs clés. Ces derniers ont eu la possibilité d'examiner et de modifier les notes pour en assurer l'exactitude et ont reçu l'assurance que leurs réponses seraient traitées en toute confidentialité.
Entrevues avec des informateurs clés internes. En plus des entrevues préliminaires menées auprès de 14 représentants du PMV au début du projet, une deuxième série d'entrevues a été réalisée auprès de neuf représentants de Santé Canada une fois que les autres activités de collecte de données eurent été terminées. Cette série d'entrevues avait pour objectif de donner au personnel du programme l'occasion de réagir à certaines constatations préliminaires de l'évaluation et de fournir des renseignements additionnels, notamment d'autres données ou documents, au besoin. Comme dans le cas des entrevues auprès d'informateurs externes, les entrevues menées à l'interne ont été enregistrées (avec la permission des informateurs), et les notes consignées ont été remises aux personnes interviewées à des fins d'examen.
3.3 Méthode d'analyse des données
Trois rapports techniques ont été produits durant l'étude; ces rapports résument les constatations de la revue de la littérature, de l'examen des documents, de l'examen des données administratives, de l'analyse des questions importantes, des enquêtes et des entrevues externes. Le personnel du programme a examiné et commenté les deux premiers rapports techniques et a étudié le troisième rapport technique. De plus, au cours de la deuxième série d'entrevues, les personnes interviewées à l'interne à Santé Canada ont eu l'occasion de réagir aux constatations préliminaires en formulant d'autres interprétations ou en fournissant des données additionnelles. Ce processus a non seulement permis d'ajouter des nuances à l'interprétation des données, mais a également aidé à valider les constatations issues de l'évaluation.
Le rapport sur l'examen des documents, l'examen des données, la revue de la littérature, l'analyse des questions importantes et le rapport final ont également été passés en revue par un expert scientifique en pharmacologie vétérinaire engagé à forfait pour faire partie de l'équipe de recherche. Il était essentiel d'obtenir l'apport de cet expert pour s'assurer que des données scientifiques pertinentes étaient présentées avec exactitude et de manière équilibrée.
Pour la préparation du rapport final, des données provenant de toutes les sources ont été intégrées ou validées par triangulation afin d'obtenir des constatations pour l'ensemble de l'évaluation. La triangulation désigne un processus permettant de comparer les réponses aux questions de recherche obtenues par différentes méthodes de collecte de données. Lorsque des méthodes différentes donnent des résultats semblables, la validité de ces constatations est considérée comme étant supérieure, ce qui justifie que l'on fasse davantage confiance à ces résultats.
3.4 Limites de la méthodologie et stratégies d'atténuation
Il faut souligner plusieurs limites méthodologiques importantes, qui sont surtout rattachées aux enquêtes. Même si les enquêtes visaient à combler les lacunes statistiques dont il a été question précédemment, la façon de calculer les échantillons de l'enquête a restreint la mesure dans laquelle il était possible d'atteindre cet objectif. Plus précisément, les lignes directrices et directives du Secrétariat du Conseil du Trésor du Canada concernant la recherche sur l'opinion publique et les enquêtes ont amené les évaluateurs à interroger uniquement des personnes-ressources connues pour avoir été en contact avec le Ministère pour des motifs liés au PMV. Dans le cas de l'enquête auprès de l'industrie, l'échantillon de personnes-ressources de l'industrie a été fourni par l'ICSA et devait inclure la plupart des fabricants canadiens de médicaments vétérinaires, sinon tous. Même si l'enquête menée auprès de l'industrie a obtenu un bon taux de réponse (50 %), elle ne comprenait pas de fabricants installés à l'extérieur du Canada qui sont assujettis à la réglementation canadienne pour la commercialisation de leurs produits au pays.
Quant à l'enquête auprès des utilisateurs finaux, les responsables de l'évaluation ont dû utiliser des listes d'intervenants tenues par Santé Canada au lieu de se fonder sur d'autres sources externes potentiellement plus complètes. Cette façon de faire pour établir l'échantillon a entraîné deux conséquences importantes :
- Ce sont surtout des représentants d'associations d'éleveurs qui ont répondu à l'enquête auprès des utilisateurs finaux, soit le groupe comptant le plus grand nombre d'intervenants sur les listes d'intervenants internes de Santé Canada. On ignore combien de ces représentants étaient eux-mêmes des éleveurs (soit des utilisateurs finaux). Il se peut que les personnes qui n'étaient pas des éleveurs aient eu l'impression que l'enquête ne s'adressait pas à elles, et que de ce fait, elles n'aient pas participé à l'enquête. Cela pourrait expliquer en partie le faible taux de réponse obtenu à cette enquête. Quoi qu'il en soit, l'enquête auprès d'utilisateurs finaux n'a permis de joindre qu'une faible proportion de tous les éleveurs au Canada.
- L'utilisation de listes d'intervenants de Santé Canada signifie également que les vétérinaires étaient relativement peu représentés dans l'échantillon. Celui-ci comptait 60 vétérinaires et technologues en santé animale sur une possibilité de plusieurs milliers de personnesNote de bas de page 2. Il s'agit d'une lacune très importante si l'on tient compte du fait que les vétérinaires forment l'un des plus importants groupes d'utilisateurs finaux du PMV.
Même si certains résultats des enquêtes auprès de représentants de l'industrie et d'utilisateurs finaux sont inclus dans le présent rapport, il ne faut pas oublier que les résultats ne sont pas statistiquement significatifs et qu'ils ne représentent pas le point de vue de tous les fabricants et utilisateurs finaux de médicaments vétérinaires. Afin d'atténuer les limites des enquêtes, les évaluateurs se sont beaucoup appuyés sur des données plus objectives provenant de la revue de la littérature, de l'examen des documents et de l'examen des données administratives.
Bien qu'il ne s'agisse pas d'une limite méthodologique en soi, il est également important de reconnaître le rôle précis des entrevues qualitatives auprès d'informateurs clés dans le cadre de l'évaluation. Tel qu'il a été indiqué précédemment, les informateurs clés externes ont été sélectionnés pour leurs connaissances particulières, leur expertise ou leur participation au PMV et pour le point de vue unique que chacun apporterait à l'évaluation. En raison de leurs connaissances spécialisées et de leurs expériences, la plupart des informateurs clés n'ont pas été en mesure de répondre à toutes les questions de l'entrevue; ils se sont plutôt concentrés sur les sujets qu'ils connaissaient le mieux. Ainsi, dans le cadre de l'évaluation, le rôle des entrevues avec des informateurs clés n'a pas été de quantifier la mesure dans laquelle diverses opinions étaient répandues chez les intervenants du PMV (ce qui était l'objectif des enquêtes). Elles ont plutôt servi à cibler les principales questions et préoccupations soulevées par les intervenants clés du programme. Dans un contexte où les informateurs clés sont choisis pour leurs connaissances et leur expertise, il faut reconnaître qu'il n'est pas nécessaire qu'un point de vue soit partagé par tous les informateurs clés pour être valide.
Finalement, même si certaines données sur les ressources financières et humaines ont été fournies pour l'évaluation, les données existantes ont limité l'analyse de l'efficience et de l'économie du programme.
4. Constatations
La présente section du rapport comprend les constatations issues de l'évaluation, qui sont classées par question d'évaluation.
4.1 Pertinence
4.1.1 Nécessité de poursuivre le PMV
Les risques possibles pour la santé humaine liés à l'utilisation de médicaments vétérinaires administrés aux animaux destinés à l'alimentation et aux animaux de compagnie donnent à penser que les activités de réglementation doivent se poursuivre dans ce secteur afin de protéger la santé de la population canadienne.
On utilise actuellement un large éventail de produits de santé en médecine vétérinaire, notamment, mais pas exclusivement, des agents antimicrobiens, des analgésiques, des agents anti-inflammatoires, des agents anesthésiques, des agents antiparasitaires, des vaccins et des produits de santé naturels. Les répercussions possibles pour la santé humaine de l'utilisation de médicaments vétérinaires administrés aux animaux destinés à l'alimentation et aux animaux de compagnie semblent indiquer que des mesures réglementaires dans ce secteur sont toujours nécessaires.
Résidus de médicaments vétérinaires dans les aliments
L'une des principales voies d'exposition humaine aux résidus de médicaments vétérinaires est l'approvisionnement alimentaire, surtout la consommation de tissus ou de sous-produits animaux contenant des résidus. Des publications scientifiques indiquent que ces résidus pourraient présenter divers risques pour la santé humaine; toutefois, il faut également noter que, dans certains cas, l'incertitude scientifique est encore grande quant à l'incidence sur la santé humaine.
De nombreuses études donnent à penser que les agents antimicrobiens résiduels peuvent contribuer à la création de bactéries résistantes dans le tractus gastro-intestinal, ce qui entraîne des perturbations dans la microflore de la barrière intestinale et rend la digestion des éléments nutritifs plus difficile et le tractus intestinal plus vulnérable à la maladie (Doyle, 2006, p. 2; Tollefson et Miller, 2000, p. 249). La VICH (2004) n'a recensé aucune déclaration d'effets sur la santé humaine découlant de changements dans la proportion de bactéries résistantes aux antimicrobiens dans la flore intestinale humaine, mais signale que, étant donné les limites de l'état actuel des connaissances sur l'écologie microbienne, il ne faut pas écarter la possibilité que de tels effets néfastes sur la santé existent.
Bien qu'elles soient rares, des réactions allergiques ou anaphylactiques à des résidus de médicaments vétérinaires sont également possibles. Par exemple, les auteurs Raison-Peyron, Messaad, Bousquet et Demoly (2001) font état de 20 cas d'anaphylaxie associés à des résidus de pénicilline soupçonnés dans le bœuf et le porc. Ces réactions ont tendance à survenir chez des individus ayant déjà une sensibilité à ces mêmes médicaments. Doyle (2006) souligne que, bien que cela soit peu courant, il y a eu des déclarations de réactions allergiques chez des humains résultant de la présence de résidus de médicaments vétérinaires dans de la viande. Le document d'orientation GL33 (2002) de la VICH recommande de faire enquête sur certaines classes de médicaments, comme les antibiotiques bêta-lactamines, puisque ces médicaments peuvent causer des réactions allergiques chez les individus sensibles.
D'autres types d'effets sur la santé humaine peuvent également découler de l'exposition à des résidus de médicaments vétérinaires. Par exemple, Barbosa et ses collaborateurs (2005) font référence à quatre cas recensés au Portugal d'intoxication alimentaire sévère (touchant 50 personnes) causée par l'ingestion de viande et de foie contenant des résidus de clenbutérol. Les auteurs citent également des études menées dans d'autres administrations faisant un lien entre une intoxication alimentaire et l'ingestion de foie et de viande contenant des résidus de clenbutérol. En voici un autre exemple : l'agent antimicrobien chloramphénicol peut causer une anémie aplastique (myélosuppression) chez les humains (Turnipseed et Andersen, 2008, p. 316).
Par ailleurs, des données probantes démontrent que, à plus long terme, la présence de résidus de médicaments dans les aliments peut avoir des effets cancérogènes, génésiques ou tératogènes. Par exemple, des données scientifiques indiquent que la leucobase du vert malachite pourrait être un agent cancérigène génotoxique; ainsi, son usage délibéré chez les animaux destinés à l'alimentation est interdit au Canada (ACIA, 2006a). Voici un autre cas : on sait que la furazolidone et ses métabolites causent le cancer chez les animaux et que le diéthylstilbestrol peut avoir des effets génésiques ou tératogènes. En effet, en raison des effets nocifs de plusieurs substances sur la santé humaine, leur vente à des fins d'utilisation chez les animaux destinés à l'alimentation est interdite en vertu du Règlement sur les aliments et drogues; il s'agit notamment des substances suivantes : chloramphénicol ou ses sels ou dérivés; composés de 5-nitrofurane; clenbutérol ou ses sels ou dérivés; composés de 5-nitroimidazole; diéthylstilbestrol ou d'autres composés de stilbène (GC, 2012a, art. c.01.610.1).
Selon les résultats de programmes nationaux de surveillance des résidus mis en œuvre au Canada, aux États-Unis et dans l'UE, même si les tests de dépistage de résidus de médicaments sont parfois positifs pour certains aliments, il est rare que le taux de ces mêmes résidus dépasse les seuils de tolérance fixés (ACIA, 2008a, 2011a; Autorité européenne de sécurité des aliments, 2010; département de l'Agriculture des États-Unis, 2011, p. 40, 65-66).
Résistance aux antimicrobiens (RAM)
L'utilisation d'agents antimicrobiens en médecine a permis de traiter des maladies qui ont déjà été des causes importantes de morbidité et de mortalité chez les humains. Toutefois, la RAM est généralement reconnue comme étant une menace sérieuse pour la santé publique puisqu'elle nuit à l'efficacité de ces agents pour ce qui est de traiter un large éventail de maladies présentes chez les humains. De nombreuses études ont démontré que les infections résistantes aux antimicrobiens entraînent une hausse du taux d'hospitalisation, une aggravation des maladies, une augmentation des coûts rattachés aux soins de santé et une hausse de la mortalité. Pour obtenir un résumé des conclusions de certaines de ces études, consulter l'annexe C.
Les agents antimicrobiens sont utilisés dans les activités d'élevage au Canada pour traiter et prévenir les maladies et pour stimuler la croissance (Rosengren, Gow et Weese, 2009, p. 25-27; Sarmah, Meyer et Boxall, 2006). Cependant, l'utilisation d'agents antimicrobiens à des fins de stimulation de la croissance et de prophylaxie (soit la prévention des maladies) chez les animaux est actuellement controverséeNote de bas de page 3. Récemment, l'Institut canadien du droit et de la politique de l'environnement (ICDPE) a recommandé que le Canada interdise ou limite l'utilisation d'antibiotiques à ces fins (Holtz, 2009, p. 6). Dans le même ordre d'idées, une analyse exhaustive de la littérature portant sur la relation entre l'élevage industriel d'animaux destinés à l'alimentation et la RAM a mené à la conclusion que [traduction] « l'utilisation d'agents antimicrobiens à des fins non thérapeutiques en agriculture est un facteur qui contribue grandement à l'émergence de la résistance aux antimicrobiens à l'échelle mondiale » et ses auteurs ont soutenu qu'« une politique prudente en matière de santé publique est donc un signe qu'il faudrait mettre fin aux utilisations non thérapeutiques des antimicrobiens dans l'élevage d'animaux destinés à l'alimentation » (Silbergeld, Graham et Price, 2008, p. 162). Pour des raisons semblables, dans sa série de politiques énoncée en 2011 pour lutter contre la RAM, l'OMS recommande de cesser les usages non thérapeutiques d'agents antimicrobiens (comme l'utilisation d'agents antimicrobiens pour stimuler la croissance), de limiter ou d'éliminer l'utilisation, chez les animaux destinés à l'alimentation, d'agents antimicrobiens perçus comme étant essentiels dans la médecine humaine (surtout les fluoroquinolones et les céphalosporines de troisième et de quatrième générations) et d'obliger des ordonnances pour tous les agents antimicrobiens utilisés pour lutter contre des maladies chez les animaux destinés à l'alimentation (OMS, 2011).
En revanche, il est important de reconnaître que l'enjeu scientifique que constituent les risques réels pour la santé humaine découlant de l'utilisation d'agents antimicrobiens chez les animaux destinés à l'alimentation n'est toujours pas résoluNote de bas de page 4. Bien que la littérature canadienne et d'ailleurs ne cesse de signaler que des bactéries résistantes aux antimicrobiens se retrouvent dans l'approvisionnement alimentaire destiné aux humains par l'intermédiaire des produits alimentaires d'origine animale (voir l'annexe C pour obtenir des exemples), il n'a pas été possible de quantifier clairement les effets de ce phénomène sur la santé humaine.
Un certain nombre d'études portant sur l'incidence de l'interdiction danoise (imposée en 2000) d'utiliser des antibiotiques à des fins de prévention des maladies et de stimulation de la croissance dans les activités de production de porcs, de volaille et de bovins ont fait ressortir que l'interdiction n'avait eu aucune incidence sur la santé humaine, mais qu'il y avait eu des conséquences économiques. Par exemple, Hurd (2012) a découvert que, alors que le coût économique de l'interdiction était élevé, la santé publique ne s'est pas améliorée. Au cours des 10 années qui se sont écoulées depuis l'entrée en vigueur de l'interdiction, les taux de salmonelle et de campylobactériose n'ont pas diminué, le Staphylococcus aureus résistant à la méthicilline (SARM) a augmenté de façon constante et les niveaux de résistance de certaines infections humaines importantes ont connu une hausse. De plus, l'utilisation d'antibiotiques à des fins thérapeutiques a augmenté pendant la période à l'étude. Les auteurs de celle-ci ont conclu qu'il serait préférable d'évaluer les risques que présente chaque antibiotique dans le contexte de son utilisation réelle plutôt que d'imposer une interdiction générale.
En outre, Bender (2011) a découvert que, malgré une baisse générale de la quantité d'antibiotiques utilisés dans la production de porcs du Danemark, l'utilisation d'antibiotiques à des fins thérapeutiques a augmenté, les coûts de production ont augmenté et la politique a eu des répercussions négatives sur la santé des porcs sevrés. L'étude a également fait ressortir que le nombre d'isolats humains résistant aux antibiotiques les plus importants du point de vue médical a continué d'augmenter chez les Danois qui ne voyagent pas. Tout comme Hurd, Bender a conclu qu'il n'est probablement pas nécessaire d'interdire complètement les stimulateurs de croissance antimicrobiens et qu'une telle interdiction pourrait entraîner d'autres problèmes. Palmer et ses collaborateurs (2011) indiquent que, malgré l'interdiction danoise d'utiliser des stimulateurs de croissance antibiotiques en agriculture, aucune diminution visible de la RAM n'a été constatée (p. 5).
Par ailleurs, des scientifiques danois signalent que l'utilisation totale d'antibiotiques par kilogramme de porc a diminué de plus de 50 % de 1992 à 2007, alors que la production totale de porcs au Danemark a augmenté de 43 % et que le nombre moyen de porcs produits par truie a augmenté, passant de 21 à 25 (Aarestrup et Wegener, 2009). Toutefois, depuis 1999, l'utilisation d'agents antimicrobiens chez le porc a augmenté en partie en raison de l'émergence et de la propagation de nouvelles maladies infectieuses. La mortalité chez le porcelet sevré a augmenté de 1993 à 2003, mais depuis 2009, elle est revenue aux niveaux antérieurs à l'interdiction; la mortalité chez le porc de finition a augmenté lentement de 1993 à 2007. Les auteurs concluent que [traduction] « l'abandon de l'utilisation d'antibiotiques à des fins non thérapeutiques n'a pas eu d'incidence négative sur la productivité à long terme de l'industrie du porc au Danemark ».
Pour ce qui est du contexte canadien, certains intervenants ayant participé aux consultations sur l'élaboration d'une stratégie de gestion des risques touchant la RAM au Canada ont souligné que le fait d'interdire les stimulateurs de croissance pourrait entraîner une diminution de la qualité de la viande, une plus grande utilisation d'agents antimicrobiens à des fins thérapeutiques, une hausse des coûts pour les producteurs et les consommateurs ou des conséquences pour le marché (DMV, 2003a, p. 7-8). L'expérience danoise donne à penser que l'utilisation accrue d'agents antimicrobiens à des fins thérapeutiques constitue une possibilité réelle.
Exposition directe à des médicaments vétérinaires (sécurité des personnes qui les manipulent)
L'exposition directe à certains médicaments vétérinaires peut également nuire à la santé humaine bien que ce risque soit moins important. Par exemple, en 2003 et en 2004, la DMV a diffusé un avis aux hôpitaux et aux vétérinaires pour les avertir que l'auto-injection accidentelle chez des humains de l'antibiotique Micotil® avait été associée à des décès chez les humains (Santé Canada, 2003a, 2004a). Citons un autre exemple : le clenbutérol peut servir à traiter les cas de maladie pulmonaire obstructive chronique (MPOC) chez les chevaux (Lust, Barthold, Malesker et Wichman, 2011), mais sa vente est actuellement interdite au Canada à des fins d'administration chez les animaux destinés à l'alimentation, tel qu'il a été indiqué précédemment (DMV, 2009a). En plus de la menace d'exposition par l'intermédiaire de résidus de médicaments vétérinaires (voir plus haut), on a signalé des effets néfastes sur le cœur ou le système nerveux central chez des personnes qui s'étaient exposées délibérément au clenbutérolNote de bas de page 5
(Lust et coll., 2011, p. 202).
Comme l'indique l'exposé qui précède, même si les médicaments vétérinaires sont importants pour protéger la santé animale et humaine, dans certaines circonstances, ces produits peuvent avoir l'effet contraire. Étant donné l'incidence possible de l'utilisation de médicaments vétérinaires sur la santé humaine ainsi que les incertitudes scientifiques qui existent toujours, surtout au niveau de la RAM, les résultats de la revue de la littérature donnent à penser qu'il est toujours nécessaire de prendre des mesures réglementaires dans ce secteur.
4.1.2 Conformité aux priorités du gouvernement fédéral
Le PMV est parfaitement conforme aux priorités du gouvernement fédéral visant à protéger la population canadienne contre les aliments et les produits de consommation dangereux.
L'évaluation a démontré que le PMV était conforme aux priorités du gouvernement du Canada. Même s'il n'était pas précisé dans les récents discours du Trône (2006-2011) et budgets fédéraux que les médicaments vétérinaires constituaient une priorité, le discours présenté le 16 octobre 2007 stipulait que le gouvernement fédéral, « à l'instar des parents, se préoccupe de la sûreté des produits de consommation et des aliments » en promettant « des mesures sur la sûreté des aliments et des produits, afin que les familles puissent avoir confiance en la qualité et la sûreté des biens qu'elles achètent » (GC, 2007). Parallèlement, dans le discours du Trône du 3 mars 2010, le gouvernement s'est engagé à « présenter de nouveau des projets de loi visant à protéger les familles canadiennes contre les aliments, les médicaments et les produits de consommation qui posent un risque » (GC, 2010) et à renforcer le système canadien d'assurance de la salubrité des aliments. Par conséquent, même si aucun discours n'a traité précisément des médicaments vétérinaires et que l'on ne peut savoir exactement à quelles lois le gouvernement fédéral faisait référence dans son discours de 2010, le PMV suit étroitement les priorités fédérales définies dans les récents discours du Trône.
Pour donner suite aux intentions énoncées dans le discours de 2007, le gouvernement fédéral a mis en place le PASPAC en 2008. Le PASPAC est une initiative horizontale quinquennale de 489,4 M$ entre Santé Canada, l'ASPC, l'ACIA et les IRSC, dont l'objectif est « de protéger la santé et la sécurité de la population canadienne en garantissant la sécurité des produits de santé et de consommation et des aliments » (Santé Canada, 2008a, p. 5) par la mise en place d'un système de sécurité moderne qui intègre des volets de prévention active, de surveillance ciblée et d'intervention rapide à l'égard des risques ciblés liés aux aliments, aux produits de santé ou aux produits de consommation (2008a, p. 1).
Il est question des médicaments vétérinaires dans l'une des 11 stratégies du volet Produits de santé du PASPAC, soit la Stratégie no 10 : Initiatives sur l'intégrité à la frontière fondée sur les risques. La Stratégie no 10 prévoit l'établissement d'un programme national visant à accroître la coordination et la collaboration entre Santé Canada et l'ASFC dans le but de protéger la population canadienne contre l'utilisation ou la consommation de produits de santé importés non conformes. On ignore pourquoi le volet des médicaments vétérinaires n'a pas été financé dans les dix autres stratégies du PASPC puisque du moins quelques-unes de ces stratégies concernent les médicaments vétérinairesNote de bas de page 6.
Même si, pendant les entrevues, aucune question précise n'a été posée sur la priorité relative accordée par Santé Canada aux médicaments vétérinaires par rapport à d'autres produits de santé, quelques informateurs clés ont souligné la tendance, à Santé Canada, de donner la priorité aux médicaments à usage humain plutôt qu'aux médicaments vétérinaires. Ils ont fait remarquer qu'il arrive souvent que l'on ne discute pas des modifications réglementaires touchant des médicaments vétérinaires tant que des modifications comparables n'ont pas été apportées du côté de l'usage chez les humains et que, par conséquent, il se peut que l'on ignore des problèmes et défis propres aux médicaments vétérinaires. Une certaine crédibilité peut être accordée à ces perceptions compte tenu de l'exclusion des médicaments vétérinaires de la plupart des stratégies du PASPAC ainsi que des modifications réglementaires apportées récemment par Santé Canada visant à rendre les BPF et les licences d'établissement obligatoires pour les IPA utilisés dans les médicaments pour usage humain au Canada; ces exigences entreront en vigueur à l'automne 2013 (Santé Canada, 2013). Cette réglementation ne vise pas les IPA utilisés exclusivement dans les médicaments pour usage vétérinaire.
Les médicaments vétérinaires visés par l'accord Cultivons l'avenir du gouvernement fédéral. En vertu de cet accord, il sera possible de renforcer la sécurité du système alimentaire grâce à trois initiatives connexes, dont l'établissement, la reconnaissance et la mise en œuvre de systèmes d'assurance de la salubrité des aliments (AAC, 2008, p. 28). Dans le cadre de Cultivons l'avenir, on s'attend à ce que l'Initiative sur les médicaments vétérinaires contribue à rendre le secteur agricole canadien compétitif et novateur notamment en renforçant la capacité scientifique qui permet d'examiner les présentations de médicaments vétérinaires et en simplifiant le processus d'approbation des médicaments vétérinaires génériques (AAC, 2008, p. 14). Puisque l'approbation des présentations de médicaments vétérinaires fait partie des principales activités opérationnelles du PMV, la présence d'une initiative touchant l'approbation de médicaments vétérinaires dans Cultivons l'avenir donne à penser que le PMV cadre fortement avec les priorités actuelles du gouvernement fédéral.
Finalement, le PMV va dans le même sens que l'actuelle Architecture des activités de programme (AAP) de Santé Canada et, plus précisément, des résultats stratégiques « les Canadiens sont informés et protégés des risques pour la santé que présentent les aliments, les produits, les substances et les environnements et sont sensibilités aux bienfaits d'une saine alimentation », et de ce fait, « les aliments que les Canadiens consomment et les produits qu'ils utilisent présentent le moins de risque possible et les dangers pour la santé sont traités adéquatement » (Santé Canada, 2012a, p. 25).
4.1.3 Harmonisation avec les rôles et les responsabilités du gouvernement fédéral
Le PMV cadre avec les rôles et les responsabilités du gouvernement fédéral qui sont énoncés dans les lois et règlements fédéraux.
L'évaluation a aussi démontré que le PMV allait dans le même sens que les rôles et les responsabilités du gouvernement fédéral. Les aspects du PMV liés à la santé humaine cadrent étroitement avec les responsabilités de Santé Canada relevant de la Loi sur le ministère de la Santé de 1996. En vertu de cette loi, les fonctions du ministre s'étendent « à tous les domaines de compétence du Parlement liés à la promotion et au maintien de la santé de la population ne ressortissant pas de droit à d'autres ministères ou organismes fédéraux » (GC, 1996, art. 4(1)). Les rôles que le Ministère (maintenant Santé Canada) est tenu d'assumer comprennent ce qui suit : promouvoir le bien-être physique, mental et social de la population canadienne; protéger la population contre les risques pour la santé; mener des travaux d'enquête et de recherche en santé publique, notamment par la surveillance des maladies; établir des normes de sécurité pour les produits de consommation; recueillir et distribuer des renseignements sur la santé (GC, 1996, art. 4(2)).
Le rôle de Santé Canada se rapportant à l'exécution du PMV est également décrit dans la Loi sur les aliments et drogues et son règlement d'application. Les médicaments vétérinaires sont inclus dans la définition de drogue contenue dans la Loi, soit « substances ou mélanges de substances fabriqués, vendus ou présentés comme pouvant servir :
- au diagnostic, au traitement, à l'atténuation ou à la prévention d'une maladie, d'un désordre, d'un état physique anormal ou de leurs symptômes, chez l'être humain ou les animaux;
- à la restauration, à la correction ou à la modification des fonctions organiques chez l'être humain ou les animaux;
- à la désinfection des locaux dans lesquels les aliments sont fabriqués, préparés ou conservés. » (GC, 1985, art. 2)
La Loi jette les bases juridiques du rôle de Santé Canada en matière de réglementation des médicaments, qui concerne ce qui suit : l'étiquetage et l'emballage; la taille, les dimensions et les spécifications; les normes s'appliquant à la composition et à la pureté; les conditions de vente; l'utilisation de n'importe quelle substance comme ingrédient (1985, art. 30). De plus, la Loi autorise Santé Canada à établir et à appliquer des règlements relativement à l'objet de la Loi; le fait de contrevenir à la réglementation constitue une infraction punissable (1985, art. 30-36), conformément aux aspects conformité et application de la loi du PMV.
Santé Canada partage la responsabilité législative et réglementaire des médicaments vétérinaires avec l'ACIA, les provinces et les territoires. L'ACIA est responsable, en vertu de la Loi sur les aliments et drogues, de l'application de la réglementation touchant les médicaments vétérinaires et est également responsable de l'application et de l'administration de la Loi relative aux aliments du bétail et de son règlement d'application ainsi que de la Loi sur la santé des animaux et de son règlement d'application. L'ACIA est responsable de la réglementation des aliments pour animaux d'élevage en vertu de la première loi et de la réglementation des produits biologiques vétérinaires en vertu de la deuxième loi.
Finalement, l'utilisation des médicaments vétérinaires est du ressort des provinces et des territoires. Par conséquent, bien que Santé Canada soit responsable de l'évaluation de l'innocuité et de l'efficacité des nouveaux médicaments vétérinaires, il n'a aucun pouvoir de réglementation quant à l'utilisation de médicaments vétérinaires ou à la pratique de la médecine ou de la pharmacie vétérinaire. Toutefois, il peut exercer une influence indirecte par d'autres moyens, comme l'étiquetage de produits ainsi que la préparation et la diffusion de renseignements sur les risques.
4.2 Gouvernance du programme
Par le passé, aucune entité n'avait à elle seule officiellement le pouvoir de diriger le PMV. Toutefois, on a mis en place un éventail de structures et de mécanismes officiels et non officiels pour régir certains aspects des activités du PMV. À la suite des changements apportés récemment à la structure de gouvernance de la DGPSA, le PMV fait désormais partie du grand Programme des médicaments, qui comprend également les médicaments pour usage humain.
Le PMV comprend toutes les activités entreprises par la DMV ainsi que les activités pertinentes réalisées par l'Inspectorat ou le BRP et l'ACIA. D'après l'examen des documents, rien n'indique que, par le passé, une seule organisation a géré ou coordonné les activités entreprises par ces groupes ou assumait l'entière responsabilité du PMV. Cette situation pourrait s'expliquer par le fait que, par le passé, les activités de Santé Canada et de l'ACIA touchant les médicaments vétérinaires n'avaient pas été conçues comme un « programme ».
Dans la nouvelle structure de gouvernance de la DGPSA, qui a été mise en œuvre en 2012-2013, les médicaments vétérinaires ont été envisagés comme faisant partie du Programme des médicaments de la DGPSA (DGPSA, 2012a). Le Programme des médicaments comprend également les médicaments pour usage humain et est régi par un sous-comité du Comité exécutif du Programme. Il existe des sous-comités semblables qui s'occupent des programmes touchant les produits biologiques, les instruments médicaux, les produits de santé naturels, la salubrité des aliments et la nutrition ainsi que la politique et la promotion de la nutrition.
Même si rien ne démontre clairement que l'absence d'un organisme de coordination axé sur les médicaments vétérinaires a eu des conséquences préjudiciables sur la réalisation des activités de Santé Canada touchant les médicaments vétérinaires, cela ne signifie pas qu'il ne serait pas avantageux d'améliorer la coordination entre les partenaires du programme. En l'absence d'un organisme de coordination responsable des activités touchant les médicaments vétérinaires, un éventail de structures et de mécanismes officiels et non officiels ont été mis en place pour régir différents aspects des activités du PMV.
Collaboration entre les partenaires de Santé Canada
Au sein de Santé Canada, les documents du programme démontrent que la DMV et l'Inspectorat collaborent de différentes façons pour ce qui est de la conformité au cadre de réglementation des médicaments vétérinaires et à l'application de celui-ci. Voici quelques exemples : échange de renseignements sur les réactions indésirables, vérifications de la conformité et plaintes; collaboration pour élaborer et diffuser des produits de communication; discussions sur des questions touchant la conformité et l'application de la loi, de nouvelles méthodes d'inspection et des projets de modifications législatives et réglementaires. À la demande l'inspectorat, la DMV réalise des ERS au cas par cas et transmet à l'Inspectorat des recommandations de mesures réglementaires.
Collaboration entre Santé Canada et l'ACIA
Santé Canada et l'ACIA collaborent également à la mise en œuvre des activités du PMV de différentes façons. Dans l'ensemble, les personnes interviewées représentant la DMV et l'ACIA ont convenu que leurs organisations entretiennent depuis longtemps une relation positive. On a signalé que, alors que Santé Canada et l'ACIA ont déjà eu un comité de gestion mixte qui s'est réuni sur une base mensuelle pendant des années pour discuter de questions touchant les médicaments vétérinaires, les deux organisations ne se réunissent désormais que si des questions ou des besoins particuliers surviennent. Cela dit, l'ACIA et Santé Canada participent tous deux aux réunions ordinaires du Comité consultatif canadien sur la réglementation des produits de santé vétérinaires (CCCRPSV); ce comité a été formé au début de 2008 par les deux organisations en association avec l'ICSA, la principale association de l'industrie canadienne des médicaments vétérinaires (DMV, 2009b, p. 1).
Dans le domaine des produits biologiques vétérinaires, la DMV et le CCPBV de l'ACIA ont établi un protocole d'entente qui précise la répartition des responsabilités entre les deux organismes, ainsi que les produits qui sont considérés comme des produits biologiques vétérinaires et ceux qui sont des médicaments vétérinaires (ACIA et Santé Canada, s.d.). Le PE stipule que, si un produit entraîne une réaction immunitaire précise relativement à une maladie infectieuse, il s'agit d'un produit biologique qui relève alors du pouvoir de l'ACIA. À l'inverse, si un produit stimule une réaction immunitaire relativement à une maladie non infectieuse, ce produit relève alors généralement du mandat de Santé Canada. Des informateurs clés de Santé Canada ont souligné que, puisque les technologies vétérinaires sont de plus en plus complexes et sophistiquées, la ligne s'estompe entre les responsabilités de Santé Canada et celles de l'ACIA; ainsi, il faut souvent que les deux organismes se consultent pour établir qui détient le pouvoir réglementaire ou pour déterminer si un examen doit se faire conjointement. Les informateurs ont fait savoir qu'un groupe de travail se consacrant à la classification des médicaments et des produits biologiques vétérinaires a été formé récemment et qu'une liste de critères de classification est en cours d'élaboration. De plus, on envisage de mettre à jour et de réviser le PE.
Par ailleurs, des informateurs clés de Santé Canada ont mentionné que, depuis l'adoption d'exigences de déclaration des effets indésirables à la fois pour les produits biologiques et pour d'autres médicaments vétérinaires, Santé Canada et l'ACIA ont commencé récemment à collaborer à la création d'une base de données commune qui permettrait aux entreprises de soumettre les déclarations de réactions indésirables par voie électronique; selon le produit, l'information serait transmise soit à Santé Canada, soit à l'ACIA. Cette initiative vise à éliminer toute confusion possible de la part des vétérinaires et d'autres personnes qui déclarent des réactions indésirables et qui ne savent peut-être pas quelle est l'organisation responsable des différentes catégories de produits.
Dans le domaine des aliments pour animaux d'élevage, la DMV et la Division des aliments pour animaux de l'ACIA travaillent également en collaboration, en raison de chevauchements dans les définitions des termes « drogue » dans la Loi sur les aliments et drogues et du terme « aliments pour animaux de ferme » dans la Loi relative aux aliments du bétail, afin d'établir les usages homologués de chacun des produits que l'on trouve sur le terrain (Santé Canada, 2011b, p. 17-18). Cette entente ne semble pas avoir été officialisée au moyen d'un PE ou d'un accord semblable, comme celui qui a été établi pour faire la distinction entre les médicaments et les produits biologiques vétérinaires. Toutefois, un groupe de travail DMV-ACIA travaille actuellement à un document d'orientation pour aider l'industrie à faire la différence entre un médicament et un aliment pour animaux d'élevage (2011b, p. 18). La DMV et l'ACIA collaborent également au projet conjoint Santé Canada-ACIA de classement des risques associés au transfert involontaire de résidus de médicaments, dont le but est de classer les risques que présentent les médicaments à base d'aliments pour les espèces non ciblées. Les objectifs du projet sont les suivants : réviser le guide de séquencement des médicaments de l'ACIA pour permettre les combinaisons médicaments-espèces jugées à faible risque; déterminer si d'autres contrôles sont nécessaires ou non en vertu du Règlement sur les aliments médicamentés pour le bétail (Santé Canada, s.d.).
La DMV et la Direction de la salubrité des aliments et de la protection des consommateurs de l'ACIA travaillent en collaboration au dossier des résidus de médicaments vétérinaires contenus dans les aliments. Alors que la DMV est responsable de l'établissement des LMR, l'ACIA surveille la conformité aux LMR établies au moyen de son programme d'inspection et prend les mesures de gestion des risques qui conviennent. De plus, des représentants de Santé Canada ont indiqué que la DMV assure la liaison avec la Direction des sciences de la salubrité des aliments sur les questions touchant la méthodologie utilisée pour les résidus de médicaments vétérinaires et donne des conseils, au besoin, à certains secteurs de programme au sein de l'ACIA (p. ex. poissons et fruits de mer, viande rouge, œufs et miel).
Finalement, l'ACIA peut soumettre des demandes d'ERS à la DMVNote de bas de page 7 ou peut communiquer avec la DMV ou l'Inspectorat au sujet de questions précises, comme l'utilisation de médicaments non approuvés ou interdits, qui sont soulevées au cours de ses activités d'inspectionNote de bas de page 8.
Quelques informateurs clés externes ont reconnu qu'il y a davantage de consultation et de collaboration entre la DMV, le CCPBV et la DAA. Ces répondants ont souligné la nécessité d'adopter une approche unifiée pour régler les questions touchant la salubrité des aliments et ont appuyé la poursuite de la collaboration entre Santé Canada et l'ACIA à cet égard.
Collaboration avec d'autres ministères et organismes fédéraux
En plus de collaborer avec des partenaires du PMV, Santé Canada collabore avec d'autres ministères et organismes fédéraux à des activités relatives aux médicaments vétérinaires.
Dans le cadre du PASPAC, l'Inspectorat travaille avec l'ASFC à la mise en œuvre des activités du PASPAC touchant les produits de santé, y compris les médicaments vétérinaires, par l'intermédiaire du Programme d'intégrité des frontières (Santé Canada, 2008a, p. 7, 2011b, p. 4). Des informateurs clés de Santé Canada ont indiqué que des discussions avaient également eu lieu avec l'ASFC concernant le suivi des médicaments vétérinaires entrant au Canada en vertu de la disposition sur l'IUP de la Loi sur les aliments et drogues; toutefois, ils ont également souligné que ces discussions n'avaient pas mené à un accord de collaborationNote de bas de page 9.
La DMV a établi un PE avec le Laboratoire de lutte contre les zoonoses d'origine alimentaire de l'ASPC pour administrer le PICRA et pour renforcer l'échange de renseignements visant à obtenir des données de surveillance sur la RAM qui sont nécessaires pour l'évaluation des risques, la gestion des risques et l'élaboration de politiques sur la RAM (DMV et ASPC, 2005). La DMV contribue au PICRA en réalisant des évaluations avant et après la mise en marché et en fournissant un soutien technique et financier (Santé Canada, 2011b, p. 4). L'ACIA assume également des responsabilités dans le cadre du PICRA, dont l'échantillonnage de produits et la fourniture de cultures à l'ASPC pour réaliser des épreuves de sensibilité.
Plus récemment, des informateurs clés de Santé Canada ont signalé que Santé Canada avait commencé à travailler avec l'ASPC (l'organisme fédéral responsable de la RAM), l'ACIA, AAC ainsi que les provinces et les territoires à l'élaboration d'une approche mieux coordonnée en matière de RAM. Selon les informateurs clés, une équipe interministérielle chargée des politiques scientifiques sur la RAM d'origine alimentaire a été mise sur pied dans les six derniers mois. L'équipe a pour mandat d'assurer un leadership dans le cadre d'initiatives FPT sur la gestion des risques de RAM d'origine alimentaire et d'élaborer des approches stratégiques coordonnées concernant l'émergence et la propagation de la RAM d'origine alimentaire associée à l'utilisation de médicaments antimicrobiens chez d,autres espèces que les humains.
Santé Canada collabore également avec AAC à la mise en œuvre de l'Initiative sur les médicaments vétérinaires, qui est l'un des volets de l'accord Cultivons l'avenir. Cette collaboration a été officialisée dans un PE convenu entre les deux ministères (AAC et Santé Canada, 2009). Sachant que l'on estimait que le cadre de réglementation en vigueur avait besoin d'être amélioré pour encourager l'innovation en agriculture ainsi que la compétitivité du secteur de l'élevage, on a inclus dans le PE l'engagement de tenir compte de ces préoccupations à l'aide de plans favorisant l'harmonisation des exigences techniques pour l'approbation des médicaments vétérinaires et d'un processus plus rapide et transparent afin d'accroître la compétitivité du secteur en améliorant la disponibilité de médicaments plus récents et plus efficaces offerts aux éleveurs canadiens (AAC et Santé Canada, 2009, p. 3).
Des informateurs clés de Santé Canada ont indiqué que la DMV a conclu un PE avec l'Agence de réglementation de la lutte antiparasitaire (ARLA), dont le but est de faire une distinction entre les pesticides et les médicaments vétérinaires. Ils ont ajouté que les deux organisations échangent des pratiques exemplaires sur des sujets tels que l'examen parallèle et l'harmonisation internationale. Par ailleurs, des informateurs clés ont mentionné que la DMV étudie une approche mise en œuvre par l'ARLA pour composer avec les situations où le secteur privé manque de moyens financiers pour soumettre les pesticides nécessaires à l'approbation réglementaire. Pour régler le problème, l'ARLA a créé le Centre de lutte antiparasitaire, qui relève d'AAC, afin de recueillir les données nécessaires à la préparation des présentations. Des informateurs clés de Santé Canada ont indiqué que la DMV étudie actuellement la possibilité d'adopter une approche semblable pour régler des problèmes comparables liés à des médicaments à usage limité pour espèces mineures (ULEM)Note de bas de page 10.
Finalement, des représentants de Santé Canada ont signalé que la DMV travaille avec Pêches et Océans Canada au dossier de l'aquaculture et avec le Ministère des Affaires étrangères et du Commerce international (MAECI) quand surviennent des différends commerciaux touchant des résidus de médicaments vétérinaires.
4.2.1 Mesure du rendement
La modification du modèle logique et de la stratégie de mesure du rendement actuels du PMV permettra d'assurer la concordance avec le mandat de Santé Canada, les cadres et les outils de la Direction générale et les objectifs de la modernisation de la réglementation et de soutenir les futures évaluations du PMV. Malgré l'intégration du PMV au grand Programme des médicaments, il est important que Santé Canada soit toujours en mesure de produire des rapports distincts sur les activités et les résultats touchant les médicaments vétérinaires.
Des stratégies de mesure du rendement ont été élaborées pour le PASPAC (Santé Canada, 2008a) et pour l'Initiative sur les médicaments vétérinaires dans le cadre de l'accord Cultivons l'avenir (AAC et Santé Canada, 2009); un processus connexe de production de rapports sur le rendement a également été mis en place. À ce jour, trois rapports annuels sur le rendement ont été produits sur le PASPAC, et un rapport a été produit sur l'Initiative sur les médicaments vétérinaires (Santé Canada, 2010c, 2010d, 2011c; DMV, 2009c). Toutefois, dans le cas des rapports sur le PASPAC (Santé Canada, 2010c, 2010d, 2011c), on ne fait que mentionner les médicaments vétérinaires au passage.
Par ailleurs, certaines données sur le rendement se retrouvent dans des rapports de la DMV et de l'Inspectorat, mais ces données portent surtout sur les activités et les extrants; par conséquent, elles ont une valeur limitée lorsqu'il s'agit d'évaluer la mesure dans laquelle des résultats ont été atteints. En revanche, il est évident qu'au moins une partie de ces données sur le rendement sont utilisées pour éclairer la prise de décisions. Par exemple, la question de l'exécution rapide de l'examen préliminaire et de l'examen des présentations de médicaments vétérinaires a été au cœur des préoccupations de la DMV pendant la période visée par l'évaluation, tandis que le rendement opérationnel en matière de réglementation (comme l'état d'avancement des examens de présentations de médicaments) faisait déjà l'objet d'un suivi en 2002-2003 (DMV, 2003b, p. 4-6). Des informateurs clés de la DMV ont signalé que l'information sur le rendement est utilisée comme suit pour éclairer le processus décisionnel.
- L'état d'avancement des présentations de médicaments est utilisé dans les réunions mensuelles du forum de gestion de la charge de travail dans le but de gérer la charge de travail rattachée aux présentations de médicaments.
- Les données de pharmacovigilance et les données du PICRA sont utilisées par les examinateurs de médicaments quand ils étudient les présentations de médicaments.
- Dans le cadre d'une réunion semestrielle, un comité de gestion spécial évalue le rendement et examine des mesures pour l'exercice à venir.
Plus récemment, des rapports sur certaines activités et certains extrants liés aux médicaments vétérinaires ont été inclus dans les rapports intégrés de type tableau de bord de la DGPSA. Ces rapports ont été présentés à la suite de la mise en œuvre d'un nouveau cadre de recouvrement des coûts pour les médicaments à usage humain et les instruments médicaux en avril 2011. Les rapports servent à éclairer les décisions touchant les priorités et l'attribution des ressources. Par exemple, le rapport intégré de type tableau de bord de juillet 2013 comptait des données sur le nombre de présentations de médicaments vétérinaires, les déclarations de réactions indésirables et les RPPV reçus ainsi que des données sur le rendement du processus d'examen des présentations de médicaments vétérinaires. On ignore l'incidence qu'aura la nouvelle structure de gouvernance de la DGPSA sur la mesure du rendement relativement aux médicaments vétérinaires. Tel qu'il a été mentionné précédemment, dans la nouvelle structure, les médicaments vétérinaires ont été envisagés comme faisant partie du grand Programme des médicaments. Toutefois, les questions qui concernent les médicaments vétérinaires sont uniques à maints égards; elles nécessitent donc une approche distincte en matière de réglementation. Les travaux qui sont en cours à Santé Canada pour élaborer un cadre de réglementation distinct pour les médicaments vétérinaires reconnaissent le caractère unique de ces produits. Quoi qu'il en soit, du point de vue de la reddition de comptes, il est important que Santé Canada soit toujours en mesure de faire rapport à la fois sur les extrants et sur les résultats obtenus dans le cadre de ses activités de réglementation liées aux médicaments vétérinaires.
4.3 Mise en œuvre du programme
L'évaluation a fait ressortir que le PMV avait réalisé des progrès pendant la période visée par l'évaluation pour ce qui est de la mise en œuvre de ses activités prévues et qu'il avait dû, pendant le processus, composer avec plusieurs nouveaux problèmes et défis. Néanmoins, il reste encore un certain nombre de problèmes et de défis majeurs. Les progrès du PMV sont décrits ci-après par rapport à ses six grands secteurs d'activité : recherche et surveillance; élaboration de règlements et de politiques; activités préalables à la mise en marché et établissement de normes; surveillance post-commercialisation; conformité et application de la loi; communications et mobilisation des intervenants.
4.3.1 Recherche et surveillance
Bien que le PMV ait mené certaines activités de recherche et de surveillance, ces activités sont relativement limitées par comparaison avec le travail qu'il a accompli dans d'autres secteurs.
Selon le modèle logique du PMV, cette activité comprend la recherche et la surveillance visant à renforcer le processus d'élaboration de politiques et de règlements solides. En voici quelques exemples : recherche sur les méthodes de détection des résidus de médicaments; surveillance des résidus; surveillance de la RAM. Selon Santé Canada, la recherche sur la surveillance des résidus est menée par l'ACIA, tout comme la plupart des travaux de recherche sur les méthodes de détection des résidus. La recherche sur la surveillance de la RAM a été lancée par Santé Canada, mais est maintenant sous la direction de l'ASPC, qui reçoit le soutien de Santé Canada.
Pendant la période visée par l'évaluation, Santé Canada a réalisé plusieurs activités de recherche et de surveillance, notamment en contribuant financièrement à la création et au maintien du PICRA (de 2002 à aujourd'hui), en analysant les résultats du PICRA et en examinant les rapports de ce programme (de 2003 à 2011), en finançant des activités de recherche à la Direction des aliments sur les résidus de médicaments vétérinaires (de 2003 à 2006) et en travaillant en collaboration avec des organisations de recherche à des projets de recherche sur l'encéphalopathie spongiforme transmissible/encéphalopathie bovine spongiforme (EST/EBS). Ces activités semblent relativement restreintes par comparaison avec le travail entrepris par Santé Canada dans d'autres secteurs d'activité importants décrits précédemment. Cependant, si l'on ne comprend pas le niveau de financement accordé à cette activité par rapport à d'autres, il est difficile d'évaluer les efforts de Santé Canada dans ce domaineNote de bas de page 11.
4.3.2 Élaboration de règlements et de politiques
Le PMV a pris des mesures pour résoudre plusieurs questions interdépendantes en élaborant des règlements et des politiques. Il a notamment élaboré une politique pour l'utilisation de médicaments en dérogation des directives de l'étiquette (UMDDE), mis en place des initiatives pour accroître l'accès aux médicaments à ULEM, pris des mesures pour s'attaquer à la RAM et adopté un processus de demande simplifié pour les produits de santé naturels vétérinaires. Le PMV se penche depuis peu sur certains aspects du cadre de réglementation qui permettent l'importation et l'utilisation de médicaments vétérinaires non approuvés et sur les politiques actuelles qui permettent l'importation d'IPA, qui sont très peu réglementés par Santé Canada.
L'élaboration de règlements et de politiques est une activité importante du PMV. Pendant la majeure partie de la période visée par l'évaluation, cette activité s'est déroulée dans un contexte de modernisation à plus échelle de la réglementation des produits de santé entreprise par la DGPSA. Les plans de la Direction générale en matière de renouvellement de la réglementation ont été définis dans le Plan de renouveau de 2007 (DGPSA, 2007a) et, plus récemment, dans la Feuille de route de la réglementation des aliments et des produits de santé, publiée en mai 2012 (DGPSA, 2012b). Voici les objectifs généraux du processus de renouvellement de la réglementation, tels qu'ils sont énoncés dans ces documents de planification stratégique :
- adopter une approche de réglementation fondée sur le « cycle de vie du produit », soit une approche de réglementation des produits de santé qui comprend toutes les étapes de l'élaboration du produit;
- mettre en œuvre des interventions réglementaires qui sont proportionnelles au risque;
- renforcer la surveillance post-commercialisation, la conformité et l'application de la loi;
- tirer des leçons des homologues internationaux et collaborer avec ceux-ci;
- accroître la transparence et l'ouverture;
- fonder la réglementation sur des données scientifiques;
- garantir la durabilité du cadre de réglementation.
En ce qui a trait aux médicaments vétérinaires, la Feuille de route de la réglementation définit le projet d'un nouveau cadre de réglementation distinct pour les médicaments vétérinaires visant surtout à assurer la salubrité de l'approvisionnement alimentaire en se fondant sur le principe suivant : « le niveau de contrôle exercé sur divers produits doit être proportionnel au niveau des préjudices auxquels ils sont associés » (DGPSA, 2012b, p. 19). En janvier et en mars 2013, dans le cadre de cette initiative de modernisation, Santé Canada a mené des consultations auprès d'intervenants dans le but de décrire, à des fins de discussion et d'analyse, les approches possibles envisagées par le Ministère. Les consultations portaient sur toutes les étapes du cycle de vie du produit - y compris l'examen avant la mise en marché, la surveillance et le suivi après la mise en marché ainsi que la conformité et l'application de la loi - et sur des questions précises comme la surveillance de l'importation, l'accès aux médicaments vétérinaires à ULEM dans des circonstances exceptionnelles, l'évaluation environnementale pour les médicaments vétérinaires, etc.
Tenant compte de ce contexte, l'exposé qui suit traite de plusieurs problèmes majeurs interdépendants touchant les règlements et les politiques sur lesquels Santé Canada a dû se pencher pendant la période visée par l'évaluation. Dans l'ensemble, il est évident que le PMV a pris des mesures pour résoudre certains de ces problèmes, mais, malgré des progrès considérables dans de nombreux secteurs, il reste encore un certain nombre de problèmes et de défis non réglés. Des informateurs clés de Santé Canada ont indiqué que l'on s'attend à ce que la réforme réglementaire règle quelques-uns de ces problèmes puisqu'elle comblera certaines lacunes du cadre actuel. Cela dit, ils ont également souligné que la réforme réglementaire comporte de nombreux défis, notamment la complexité des questions en cause, les champs de compétence et responsabilités partagés et les répercussions économiques possibles de la réforme réglementaire pour le secteur canadien de l'agriculture.
Utilisation de médicaments non approuvés
L'utilisation de médicaments vétérinaires qui n'ont pas été approuvés par Santé Canada a constitué un problème majeur pour le PMV pendant la période visée par l'évaluation. L'utilisation de tels médicaments découle de deux caractéristiques de l'actuel cadre de réglementation des médicaments vétérinaires.
- Règlements actuels permettant l'importation de médicaments non approuvés à des fins d'utilisation chez des animaux. À l'heure actuelle, rien n'interdit l'importation de médicaments non approuvés à des fins d'utilisation chez des animaux. De plus, la Politique canadienne d'importation et d'exportation des produits de santé en application de la Loi sur les aliments et drogues et de ses règlements (POL-0060) stipule qu'un individu rentrant d'un séjour à l'étranger peut apporter avec lui une seule unité de traitement ou une provision de 90 jours d'un produit de santé pour son usage personnel, pour l'usage d'une autre personne ou « pour l'usage d'un animal dont il est responsable et avec lequel il voyage » (Inspectorat, 2010a, p. 5). Initialement conçue pour assurer la continuité des soins chez les humains, la disposition sur l'IUP a été utilisée par les éleveurs pour se procurer des produits vétérinaires moins coûteux ou des produits qui ne sont pas disponibles au Canada, à partir des États-Unis ou d'autres pays, à des fins d'utilisation dans leurs activités d'élevage (Handa et Webster, 2009; GT sur l'IUP, 2008).
- Politiques actuelles sur les IPA. En vertu de la réglementation actuelle, il est possible de vendre ou d'importer légalement des IPA en tant que matières premières à des fins de modification ultérieure. Les IPA ne sont pas visés par la réglementation sur l'étiquetage ni par les exigences touchant le numéro d'identification du médicament (DIN); ils ne doivent pas non plus être utilisés comme médicament sous une forme posologique (Inspectorat, 2007a). Néanmoins, les IPA en vrac sont importés, fabriqués, vendus et présentés comme pouvant servir de médicaments vétérinaires sous une forme posologique, ce que Santé Canada a indiqué dans sa Politique concernant l'importation ou la vente d'ingrédients pharmaceutiques actifs à usage vétérinaire (POL-0018) : « une telle utilisation des IPA échappe aux instruments de contrôle du système réglementaire canadien et peut avoir une incidence sur l'innocuité des aliments destinés aux Canadiens, la disponibilité de médicaments à usage vétérinaire de grande qualité au Canada ou nos exportations de produits alimentaires » (Inspectorat, 2007a).
Les représentants de l'industrie des produits de santé pour animaux sont fortement d'accord avec les interdictions relatives à l'IUP et aux IPA; ils estiment que les médicaments non homologués représentent actuellement environ 20 % du marché canadien total de la santé animale (ICSA, 2007, p. 11). Dans un rapport produit récemment, l'ICSA soutient qu'il n'est pas logique que les organismes de réglementation imposent aux entreprises de santé animale responsables des normes strictes alors qu'aucune norme ne s'applique aux IUP et aux IPA non approuvés (p. 11). Dans ce même rapport, l'ICSA recommande que Santé Canada harmonise son approche sur l'importation et l'utilisation de médicaments vétérinaires non homologués avec celles d'autres administrations, ce qui demanderait d'interdire l'importation et l'utilisation de médicaments non homologués et de limiter l'importation de produits chimiques en vrac et d'IPA aux détenteurs de licences d'établissement (p. 11)Note de bas de page 12.
Plus récemment, l'enquête sur l'étalonnage mondial pour le Canada réalisée par la Fédération internationale pour la santé animale (FISA) en 2011 a fait ressortir une profonde déception au sein de l'industrie canadienne des produits de santé animale concernant l'incapacité des responsables de la réglementation de contrer le marché croissant des produits non approuvés en freinant l'IUP, l'importation d'IPA et le mélange d'IPA (BioBridge Ltd, 2012, p. 4). Les recommandations de grande portée formulées par les auteurs du rapport comprennent celle de trouver « en priorité » des solutions aux problèmes persistants des produits non approuvés, de l'IUP et de l'utilisation abusive d'IPA.
Par ailleurs, les représentants des éleveurs ont soutenu que, en interdisant l'IUP, on nuirait à la compétitivité des éleveurs canadiens en faisant monter les coûts des activités d'élevage; ils ont plutôt suggéré que l'on s'attaque à la différence de prix entre les médicaments vendus aux États-Unis et ceux vendus au Canada (Comité permanent de l'agriculture et de l'agroalimentaire, 2008, p. 10).
Il ne fait aucun doute que l'on retrouve des opinions bien arrêtées dans les deux camps chez ceux qui ont un intérêt économique pour la question. Les experts en la matière craignent que l'IUP, y compris l'importation d'IPA antimicrobiens, puisse contribuer à une hausse de la RAM chez les animaux destinés à l'alimentation. Pour cette raison, le Comité consultatif d'experts sur l'utilisation d'antimicrobiens chez les animaux et les conséquences pour la résistance et la santé humaine (2002) a recommandé, il y a dix ans, de réglementer ce secteur pour freiner l'IUP d'agents antimicrobiens et d'IPA antimicrobiens au Canada. Plus récemment, les participants à une conférence sur la gestion des antimicrobiens tenue au Canada à la fin de 2011 ont conclu qu'il faudrait s'occuper en priorité de régler les questions réglementaires entourant l'IUP pour promouvoir la gestion des antimicrobiens dans les activités d'élevage d'animaux destinés à l'alimentation (Prescott, Szkotnicki, McClure, Reid-Smith et Léger, 2012, p. 19).
Santé Canada a reconnu les répercussions possibles sur la santé publique qui sont liées à l'utilisation de médicaments non approuvés et a envisagé des approches de réglementation pour s'attaquer à cette problématique.
- Santé Canada a tenu des consultations auprès des intervenants sur un projet de modification réglementaire visant à interdire l'importation de médicaments non approuvés à des fins d'utilisation chez des animaux destinés à l'alimentation du 2 novembre 2004 au 1er janvier 2005 (Santé Canada, 2005a). Un document de synthèse préparé par Santé Canada pour répondre aux préoccupations soulevées par des intervenants indiquait que la DMV participait à l'initiative du Ministère intitulée Renouveau législatif en matière de protection de la santé, qui comprend un examen complet de l'IUP de médicaments vétérinaires. Pour répondre aux préoccupations exprimées quant aux coûts possibles d'une interdiction de l'IUP pour les éleveurs canadiens de bétail, la DMV a mentionné que lorsqu'on tient compte des risques pour la santé humaine, la sécurité publique et la santé animale, l'avantage sur le plan des coûts n'est pas une raison suffisante pour permettre l'importation de médicaments vétérinaires non approuvés.
- Dans un résumé analytique de la question (RAQ) préparé en 2005 dans le cadre des initiatives générales de renouveau législatif de Santé Canada, la DMV a une fois de plus fait observer que l'importation ou l'utilisation inadéquate de produits de santé vétérinaires par les éleveurs pouvait éventuellement menacer la santé publique, ce qui justifiait que l'on limite ces pratiques (DMV, 2005a, p. 5-6). Toutefois, nonobstant le fait que des consultations avaient déjà alors été menées auprès d'intervenants concernant un projet de modification réglementaire visant à interdire l'IUP, aucune des modifications réglementaires proposées dans le RAQ n'avait en réalité pour but d'interdire cette pratique.
- En 2007, le Canada a créé le Groupe de travail sur l'IUP pour examiner la question de l'importation de médicaments vétérinaires à des fins personnelles et pour formuler des recommandations qui permettraient de remédier à la situation. Dans son rapport final, le GT a recommandé de mettre à l'essai un programme de permis d'importation limitée (PPIL), qui aurait demandé d'abroger les dispositions actuelles sur l'IUP et de permettre aux éleveurs d'importer certains produits vétérinaires admissibles après avoir soumis une demande à la DMV (GT sur l'IUP, 2008). Toutefois, au-delà de l'accord sur la nécessité d'appliquer une réforme réglementaire dans le domaine des médicaments et des produits biologiques vétérinaires, les membres du GT sur l'IUP ne sont pas vraiment parvenus à un consensus quant à la marche à suivreNote de bas de page 13.
Des représentants de la DMV ont mentionné dans le cadre des entrevues que le nouveau cadre de réglementation des médicaments vétérinaires traitera entre autres de l'IUP et des IPA. Il s'agit de quelques-uns des sujets abordés dans les consultations menées auprès des intervenants en mars 2013. Pendant ces consultations, la DMV a présenté à des fins de consultation une structure de réglementation flexible permettant d'accéder à des produits vétérinaires non approuvés qui comprendrait les éléments définis (voir ci-dessous).
Éléments proposés pour du nouveau cadre de réglementation des IPA et de l'IUP
IPA
- Limiter l'importation d'IPA aux titulaires de licences d'établissement
- Considérer l'importation d'IPA à des fins de vente aux fabriques d'aliments, aux détaillants, aux agriculteurs ou à d'autres utilisateurs finaux comme de la vente de médicaments sous forme posologique, qui serait donc assujettie au Règlement sur les aliments et drogues en ce qui a trait à l'autorisation de mise en marché, aux BPF, à la délivrance de licences d'établissement et aux exigences relatives à l'étiquetage.
- Rendre les BPF obligatoires pour les IPA à usage vétérinaire par l'adoption des directives ICH Q7 concernant les BPF pour les IPA à usage humain.
IUP
- Établir des critères d'admissibilité pour les produits destinés à l'IUP qui satisfont aux critères de salubrité des aliments, notamment :
- uniquement les médicaments en vente libre;
- uniquement les préparations sous une forme posologique finale;
- aucun médicament antimicrobien de catégorie I, II ou III jugé important sur le plan médical;
- produit approuvé par un organisme de réglementation étranger reconnu;
- le produit ne peut être importé au Canada qu'à partir du pays de l'organisme de réglementation étranger reconnu;
- le produit doit contenir exactement le même ingrédient actif que celui contenu dans un produit canadien approuvé possédant un DIN en vigueur;
- des LMR canadiennes doivent déjà avoir été établies pour le produit ou aucune LMR n'est requise pour les espèces à l'étude;
- le médicament ne fait pas l'objet d'une réévaluation dans le pays étranger où il est approuvé;
- le médicament n'est pas protégé par un brevet et ne fait pas l'objet de mesures de protection des données.
- Exiger une demande de permis d'importation pour les médicaments qui satisfont aux critères d'admissibilité.
Source : (DMV, 2013a).
Tel qu'il a été indiqué précédemment, à l'automne 2013, un règlement rendant les BPF et les licences d'établissement (LE) obligatoires pour les IPA au Canada et imposant des exigences de traçabilité entrera en vigueur. Toutefois, ces modifications réglementaires s'appliquent seulement aux médicaments pour usage humain; les IPA utilisés uniquement dans des médicaments à usage vétérinaire ne sont pas visés par le règlement (GC, 2012b). En vertu des changements proposés par la DMV en mars 2013, les BPF deviendraient obligatoires pour tous les IPA à usage vétérinaire. Toutefois, des représentants de la DMV ont insisté sur le fait que toute modification réglementaire sera tributaire de la rétroaction obtenue des intervenants quant à l'approche qu'elle propose.
Utilisation de médicaments en dérogation des directives de l'étiquette (UMDDE)
L'utilisation de médicaments non approuvés soulève une autre question, soit l'UMDDE, que Santé Canada définit comme suit : « utilisation effective ou prévue, chez un animal, d'une façon non conforme aux directives de l'étiquette ou de la notice d'accompagnement, d'un médicament homologué par Santé Canada » (DMV, 2011a). L'UMDDE peut convenir lorsque les fabricants de médicaments vétérinaires sont peu motivés à produire des médicaments pour certains problèmes de santé chez certaines espèces ou si l'on s'attend à ce que les produits existants ne donnent pas de résultats efficaces (Santé Canada, 2011d). Bien que cette situation ne soit pas idéale, dans bien des cas, des professionnels de la médecine vétérinaire peuvent faire des inférences raisonnables sur l'efficacité et l'innocuité du médicament à partir de l'expérience acquise dans d'autres milieux; ils peuvent aussi opter pour cette façon de faire s'il n'existe aucune autre solution de rechange (Rollin, 2002, p. 749).
Cependant, l'UMDDE soulève des préoccupations en matière de santé publique. En plus des préoccupations relatives à la santé animale (comme les effets néfastes pour la santé), on s'inquiète de la présence de résidus non réglementaires de médicaments dans des produits alimentaires d'origine animale et du risque qu'une RAM se développe et se propage (Comité consultatif sur l'UMDDE, 2004; Gehring, Baynes et Riviere, 2006; province du Manitoba, 2008). Les résidus de cette nature sont perçus comme étant inquiétants dans le contexte de l'UMDDE parce que les utilisations que l'on fait réellement d'un certain médicament peuvent différer des utilisations dont les risques connexes ont été évalués par les autorités dans le cadre du processus d'approbation. De plus, la surveillance des résidus de médicaments est rendue plus difficile en raison de l'absence de LMR et de limite administrative maximale de résidus (LAMR) pour les médicaments utilisés en dérogation des directives de l'étiquette (Comité consultatif sur l'UMDDE, 2004, p. 20; Gehring et coll., 2006, p. 8). L'UMDDE peut également contribuer à l'émergence de pathogènes résistants aux antimicrobiens pouvant causer des maladies chez les humains, par exemple par l'utilisation d'agents antimicrobiens jugés très importants sur le plan médical, mais dont l'utilisation n'est pas approuvée chez les animaux destinés à l'alimentation (Comité consultatif sur l'utilisation d'antimicrobiens chez les animaux et les conséquences pour la résistance et la santé humaine, 2002, p. XII).
Même si l'utilisation de médicaments vétérinaires, y compris l'UMDDE, relève de l'exercice de la médecine vétérinaire - un champ de compétence provincial - les répercussions possibles sur la santé publique de l'UMDDE ont incité Santé Canada à envisager une surveillance réglementaire plus stricte dans ce secteur. Par exemple, dans son RAQ de 2005, la DMV a suggéré des modifications réglementaires exigeant que l'UMDDE se fasse sous la supervision d'un vétérinaire autorisé si l'on s'attend à ce que cette utilisation présente un risque pour la santé publique (DMV, 2005a, p. 19). Tel qu'il a été indiqué, les modifications réglementaires qui avaient alors été proposées n'ont pas été mises en œuvre. Plus récemment, en collaboration avec un comité consultatif formé à cette fin, Santé Canada a publié une politique sur l'UMDDE chez les animaux destinés à l'alimentation (Santé Canada, 2008b). Une telle politique avait d'abord été recommandée par le Comité consultatif d'experts sur l'utilisation d'antimicrobiens chez les animaux et les conséquences pour la résistance et la santé humaine (2002, p. XII).
On peut résumer la politique sur l'UMDDE comme suit.
- L'UMDDE est reconnue comme un outil important pour la pratique de la médecine vétérinaire dans le cadre d'une relation vétérinaire-client-patient valable (RVCP).
- L'UMDDE chez les animaux destinés à l'alimentation est habituellement réservée au vétérinaire agréé.
- L'UMDDE n'est pas recommandée lorsqu'il s'agit de médicaments de haute importance pour la santé humaine inscrits sur la liste des antimicrobiens de catégorie I.
- L'UMDDE ne doit pas enfreindre la Loi sur les aliments et drogues et son règlement d'application en ce qui concerne les substances interdites, les aliments médicamentés pour les animaux et les résidus non réglementaires.
On ignore si l'initiative de modernisation de la réglementation de Santé Canada mènera à des modifications réglementaires touchant l'UMDDE, comme la modification proposée en 2005 qui aurait exigé que l'UMDDE se fasse sous la supervision d'un vétérinaire autorisé si l'on s'attendait à ce que cette utilisation présente un risque pour la santé publique. À l'opposé de la loi canadienne, la Animal Medicinal Drug Use Clarification Act (AMDUCA) des États-Unis, adoptée en 1994, prévoit que l'UMDDE :
- doit être mise en œuvre par un vétérinaire ou dans le contexte d'une RVCP valable;
- n'est acceptable que s'il n'existe aucun nouveau médicament vétérinaire approuvé efficace dont l'étiquette mentionne l'usage donné et qui contient le même ingrédient actif dans la dose, la forme et la concentration requises;
- se limite à une utilisation thérapeutique (c'est-à-dire que l'utilisation en dérogation des directives de l'étiquette à des fins d'augmentation de la production est interdite);
- ne doit pas produire des résidus qui présentent un risque pour la santé publique ou qui dépassent les niveaux, concentrations ou seuils sûrs;
- n'est pas autorisée dans les aliments pour animauxNote de bas de page 14 (CVM, 2011b).
Dans l'UE, la loi limite l'UMDDE aux produits pour lesquels des LMR provisoires ou non ont été établies ou pour lesquels aucune LMR n'est nécessaire, précise un processus décisionnel pour l'UMDDE qui permet l'utilisation de médicaments pour usage humain chez des espèces animales seulement dans de rares circonstances et édicte clairement que l'UMDDE doit être exceptionnelle et mise en œuvre uniquement pour éviter des souffrances inacceptables chez les animaux destinés à l'alimentation et les animaux de compagnie (Alexander, 2005; Commission européenne, 2001, art. 10-11; Gehring et coll., 2006).
Médicaments à usage limité pour espèces mineures (ULEM)
La question de la non-disponibilité relative des médicaments à usage limité pour espèces mineures a également été examinée par le PMV pendant la période visée par l'évaluation. Selon une définition pratique préparée par la DMV, « usage limité » fait référence à une utilisation à petite échelle (restreinte ou rare) de médicaments chez des animaux, tandis qu'« espèce mineure » fait référence à des animaux autres que les bovins, les porcs, les poules, les dindes, les chiens, les chats et les chevaux (AAC et Santé Canada, 2009, p. 9; Adewoye, 2005, p. 3), y compris, par exemple, les poissons, les moutons, les chèvres, les abeilles et les animaux de zoo.
La rareté des médicaments à ULEM s'explique en partie par le fait que les marchés de ces produits sont trop petits pour permettre au fabricant du médicament de récupérer les coûts fixes rattachés à la mise au point, à l'approbation et à la vente du médicament. Bref, il se peut que le rendement des investissements soit insuffisant du point de vue du fabricant pour justifier de mettre des médicaments à ULEM sur le marché au Canada ou ailleurs (Caswell, 2011, p. 4). Puisque les fabricants de médicaments ne sont pas tenus de répondre aux besoins des consommateurs, peu de médicaments à ULEM sont commercialisésNote de bas de page 15 (DMV, 2005a, p. 8).
L'inaccessibilité des médicaments à ULEM peut entraîner des souffrances potentiellement évitables chez les animaux (Menzies, 2012) ainsi qu'une plus grande dépendance à l'UMDDE qui, tel qu'il a déjà été expliqué, peut nuire à la santé humaine et animale (DMV, 2005a, p. 24). La hausse de l'UMDDE peut contribuer à entretenir un cercle vicieux dans lequel les fabricants de médicaments hésitent à présenter de nouveaux médicaments à ULEM au Canada puisque la demande dans leur marché cible est déjà comblée par l'utilisation en dérogation des directives de l'étiquette d'autres produits (Caswell, 2011, p. 4).
Dans le RAQ de 2005 qui a été préparé dans le cadre des initiatives générales de renouveau législatif de Santé Canada, la DMV a recommandé que l'on se penche sur des questions touchant les médicaments à ULEM; elle demandait ainsi qu'on lui donne le pouvoir d'accorder un accès contrôlé aux médicaments vétérinaires et que l'on permette aux fabricants de vendre ces médicaments en imposant des exigences moins strictes en matière de présentation de données, selon le niveau de risque que ces médicaments présentent pour la santé humaine et animale (DMV, 2005a, p. 24). Voici des exemples d'exigences pour les projets de règlements : fournir à Santé Canada l'autorisation législative d'étudier des données et des examens (ou des parties de ceux-ci) provenant d'autres administrations; encourager les examens adaptés à l'utilisateur; faire en sorte que les approbations de mise en marché soient conditionnelles à un engagement de la part du fabricant de produire le médicament et de surveiller son innocuité et son efficacité (DMV, 2005a, p. 25).
Tel qu'il a déjà été mentionné dans la présente section, les modifications proposées en 2005 n'ont pas été mises en œuvre. Toutefois, l'examen de la disponibilité des médicaments à ULEM faisait partie des trois éléments visés par l'Initiative sur les médicaments vétérinaires dans le cadre de Cultivons l'avenir. L'Initiative visait à contribuer à accroître la disponibilité et à simplifier l'approbation des médicaments à ULEM afin que le processus de soumission de présentations au Canada soit plus rentable pour les sociétés pharmaceutiques (AAC et Santé Canada, 2009, p. 24). Pour y parvenir, il fallait : examiner les approches relatives aux médicaments à ULEM adoptées dans d'autres administrations et élaborer une politique fondée sur les conclusions de l'examen; dresser une liste des médicaments à ULEM prioritaires en collaboration avec l'industrie; réaliser un projet pilote d'approbation des médicaments à ULEM avec le secteur des petits ruminants; simplifier le processus d'examen des présentations de médicaments à ULEM; produire des documents de politique et des documents d'orientation et établir des LMR pour les médicaments à ULEM (AAC et Santé Canada, 2009, p. 24).
On ne sait pas avec certitude si Santé Canada a produit la liste des groupes prioritaires de médicaments à ULEM ou établi des LMR pour les médicaments à ULEM, mais on sait qu'il a entrepris un certain nombre d'initiatives concernant ces médicaments, dont les suivantes :
- former un comité consultatif sur les médicaments à ULEM en 2005;
- rédiger un énoncé de politique sur les médicaments à ULEM et mener des consultations à ce sujet; la publication était prévue pour la fin de l'exercice 2011-2012 (DGPSA, 2011b, p. 6), mais le document ne semble pas avoir été publié à ce jour;
- mettre en œuvre un processus d'approbation spécialisé pour les médicaments à ULEM.
Les caractéristiques du processus d'approbation spécialisé sont les suivantes : consultations préalables auprès des promoteurs de médicaments afin qu'ils soient informés des exigences réglementaires s'appliquant aux médicaments à ULEM; amélioration de l'efficacité réglementaire au moyen de la collaboration internationale, y compris l'acceptation de l'information d'autres administrations, des barèmes tarifaires flexibles et un possible classement par ordre de priorité (Caswell, 2011, p. 3-4; Mehrotra, 2011). Au début du premier trimestre de l'exercice 2010-2011, la première présentation de médicament à ULEM (soit des implants progestatifs pour brebis) a été soumise, et un avis de conformité (AC) a été délivré (DGPSA, 2010a, p. 9, 2011b, p. 3). Il s'agit de la seule présentation de médicament à ULEM reçue par Santé Canada à ce jour; par conséquent, la DMV n'a pas atteint sa cible définie dans Cultivons l'avenir, qui était de cinq présentations de médicaments à ULEM au 31 mars 2013 (AAC, 2013).
Des informateurs clés de la DMV ont signalé que, dans le cadre de l'actuelle initiative de modernisation de la réglementation, la Direction cherche des moyens possibles d'encourager la soumission de présentations de médicaments à ULEM en vue de faciliter l'accès aux médicaments vétérinaires à ULEM approuvés. Lors des consultations menées auprès des intervenants en mars 2013, la DMV a décrit l'approche proposée pour soumettre une demande concernant les médicaments à ULEM, approche qui prévoyait les éléments suivants : des réunions préalables à la présentation entre Santé Canada et le promoteur pour discuter de la nécessité d'avoir accès au produit et de l'éventuelle marche à suivre; la définition des exigences relatives aux données probantes et des exemptions possibles à ces mêmes exigences (comme l'utilisation d'autres voies pour obtenir des données probantes); l'approbation conditionnelle selon laquelle une autorisation de mise en marché est accordée à la condition que des données supplémentaires soient recueillies et soumises à Santé Canada au fur et à mesure (DMV, 2013b). La DMV a également proposé que, étant donné que la plupart des demandes concernant des médicaments à ULEM se rapporteraient à l'élargissement du profil d'emploi figurant sur l'étiquette (p. ex. ajouter des espèces et des directives à une étiquette existante), des groupes d'éleveurs ou d'autres tierces parties pourraient amorcer le processus de demande, à la condition que le promoteur du médicament soit d'accord pour modifier l'étiquette si la tierce partie fournit des données satisfaisantes à l'appui de l'élargissement (DMV, 2013b).
L'approche proposée par la DMV est semblable à celle adoptée aux États-Unis en vertu de la Minor Use and Minor Species Animal Health Act, selon laquelle un processus d'approbation conditionnelle permet aux promoteurs de médicaments de commercialiser des médicaments pendant une période maximale de cinq ans alors qu'ils recueillent les données nécessaires sur leur efficacité (quoiqu'ils doivent déjà avoir démontré que le médicament est sûr); par ailleurs, les promoteurs de médicaments désignés peuvent demander des subventions pour réaliser des essais sur l'innocuité et l'efficacité et profiter de droits de commercialisation exclusifs pendant sept ans quand ils obtiennent une approbation ou une approbation conditionnelle (CVM, 2012a). Des représentants de la DMV ont fait remarquer que la Direction tente actuellement d'obtenir des commentaires sur l'approche proposée de la part des intervenants et que la marche à suivre dépendra des commentaires obtenus.
Finalement, dans le contexte des médicaments à ULEM, il convient également de noter que Santé Canada a amorcé certains travaux touchant l'aquaculture et le cheval en tant qu'animal destiné à l'alimentation, mais, dans les deux cas, l'évaluation n'a pas permis de déterminer l'état d'avancement actuel de ses travaux dans ces secteurs. En ce qui a trait à l'aquaculture, la DMV a formé un groupe consultatif d'experts (GCE) sur l'aquaculture en 2006 et mené des consultations sur un projet de document de politique sur l'aquaculture (DMV, 2007a). Dans ce document, la DMV a signalé qu'elle entreprenait les activités suivantes en collaboration avec le GCE afin de s'attaquer au manque relatif de médicaments autorisés à des fins d'utilisation chez les espèces animales aquatiques :
- recenser les médicaments qui sont jugés essentiels pour la production des espèces aquatiques;
- examiner des initiatives de partenariat avec des gouvernements provinciaux, des membres de l'industrie de l'aquaculture et des universitaires;
- élaborer des documents de politique et d'orientation, notamment en définissant les exigences relatives aux données pour les médicaments vétérinaires qui seront utilisés chez les espèces animales aquatiques;
- travailler de concert avec l'industrie pour recueillir des données pertinentes afin d'établir des LMR provisoires et des délais d'attente pour les médicaments utilisés en aquaculture qui n'ont pas encore été autorisés par Santé Canada;
- examiner les pratiques exemplaires d'autres organismes de réglementation.
En 2007-2008, le GCE sur l'aquaculture avait apparemment été intégré au Comité consultatif sur les médicaments à ULEM. Lors des entrevues menées avec des intervenants externes, ceux-ci ont avancé que l'absence d'un programme spécialisé sur les médicaments à ULEM pour l'aquaculture constitue une lacune majeure, tandis que les informateurs clés de la DMV ont souligné que la question des médicaments à ULEM n'est pas propre à l'aquaculture et que, par conséquent, il n'est pas nécessaire d'établir une politique ou un programme sur les médicaments à ULEM distinct pour l'aquaculture.
En ce qui a trait au cheval en tant qu'animal destiné à l'alimentation, les rapports sur le rendement de la DMV semblent indiquer que la DMV a amorcé un projet sur le cheval en tant qu'animal destiné à l'alimentation et lancé un appel de mises en candidature pour former un comité consultatif sur le sujet. Le rapport sur le rendement de Cultivons l'avenir de 2008-2009 indique que la DMV travaillait alors à la rédaction d'un document de travail sur une approche canadienne sur l'utilisation du cheval en tant qu'animal destiné à l'alimentation (DMV, 2009c); l'évaluation n'a pas permis de déterminer si ce travail avait été mené à bien.
Néanmoins, la DMV a travaillé avec l'ACIA et d'autres intervenants à l'élaboration et au lancement d'un plan d'action pour examiner les exigences de l'UE annoncées en 2009 concernant l'importation de viande de cheval (DGPSA, 2010b), dont les exigences suivantes de déterminer les chevaux destinés à la production alimentaire, de mettre en place un système de suivi et de s'assurer que les délais d'attente sont respectés pour les produits médicaux vétérinaires pouvant être utilisés chez des chevaux qui risquent d'être abattus pour en faire des produits alimentaires. En réponse à une demande de l'ACIA, la DMV a fourni de l'information sur les substances non autorisées et les médicaments essentiels chez les chevaux et a fixé un délai d'attente provisoire relativement à l'utilisation de médicaments vétérinaires chez les chevaux destinés à l'alimentation (DGPSA, 2010c). Le Manuel des méthodes de l'hygiène des viandes de l'ACIA a été mis à jour en conséquence (ACIA, 2011b). On ignore quels sont les autres travaux touchant les politiques et les règlements qui sont entrepris par Santé Canada dans le dossier du cheval en tant qu'animal destiné à l'alimentation.
Résistance aux antimicrobiens (RAM)
Tel qu'il a été expliqué à la section 4.1, on constate un consensus général dans la littérature selon lequel la RAM constitue une menace sérieuse pour la santé publique. Le rôle de la médecine vétérinaire concernant la prolifération des pathogènes résistants auxquels les humains sont exposés fait actuellement l'objet d'un débat, mais l'utilisation d'agents antimicrobiens chez les animaux destinés à l'alimentation et les animaux de compagnie contribue effectivement à la RAM. Certaines pratiques, comme l'IUP ainsi que l'importation et l'utilisation d'IPA, et d'autres facteurs, tels que l'utilisation d'agents antimicrobiens comme stimulateurs de croissance et l'UMDDE, pourraient également contribuer à la RAM.
Santé Canada reconnaît depuis au moins dix ans que la RAM, en ce qui a trait à l'utilisation des médicaments vétérinaires, est très préoccupante. En 2002, le Comité consultatif d'experts sur l'utilisation d'antimicrobiens chez les animaux et les conséquences pour la résistance et la santé humaine, mandaté par Santé Canada, a produit un rapport contenant 38 recommandations à l'intention des gouvernements FPT ainsi que d'autres partenaires et intervenants afin de s'attaquer au problème de la RAM. Voici quelques-unes des recommandations du Comité destinées à Santé Canada :
- s'assurer que la réglementation des agents antimicrobiens (dont l'homologation, la vente, la distribution, l'utilisation et la conformité à la réglementation) tient compte de l'incidence sur la santé humaine de la RAM;
- élaborer des méthodes et des critères pour l'évaluation des effets des médicaments à usage vétérinaire sur la santé humaine et animale, en ce qui a trait à la RAM;
- rendre disponibles uniquement sur ordonnance tous les antimicrobiens utilisés pour le traitement de maladies et la lutte contre celles-ci;
- mettre fin à l'importation directe d'IPA antimicrobiens;
- cesser l'importation, la vente et l'utilisation des antimicrobiens qui n'ont pas été évalués et homologués par Santé Canada;
- élaborer une politique concernant les utilisations en dérogation des directives de l'étiquette qui interdirait, entre autres, de telles utilisations pour certains médicaments d'importance critique pour la santé humaine.
Même si aucune modification n'a été apportée aux politiques et aux règlements relativement à l'IUP ou aux IPA, Santé Canada s'est penché sur bon nombre des recommandations du Comité touchant la RAM. À ce jour, le Ministère a :
- intégré l'étude de la RAM dans l'examen préalable à la mise en marché des antimicrobiens;
- établi une classification des antimicrobiens en fonction de leur importance pour la médecine humaine;
- depuis 2002, exigé que tous les nouveaux antimicrobiens soient délivrés sur ordonnance seulement;
- imposé des restrictions sur les étiquettes relativement à l'UMDDE d'antimicrobiens qui sont très importants sur le plan médical (fluoroquinolones et céphalosporines de troisième génération);
- exigé que des stratégies de gestion des risques de RAM figurent sur les étiquettes des produits;
- réévalué l'efficacité des stimulateurs de croissance antimicrobiens existants;
- dirigé le Groupe intergouvernemental spécial du Codex sur la RAM; joué un rôle majeur dans l'élaboration des Lignes directrices pour l'analyse des risques liés à la résistance aux antimicrobiens d'origine alimentaire;
- élaboré une politique sur l'UMDDE.
Contrairement au Canada, les États-Unis ont limité l'utilisation de certains agents antimicrobiens à l'échelle nationale, tandis que l'UE a éliminé graduellement l'utilisation des additifs alimentaires antibiotiques comme stimulateurs de croissance. À ce jour, les mesures prises par le Canada en matière de RAM peuvent sembler non conformes aux recommandations de l'OMS formulées en 2011, qui, tel qu'il a déjà été mentionné, demandaient notamment : que l'on mette fin à l'utilisation non thérapeutique d'agents antimicrobiens, telle que l'utilisation d'antimicrobiens comme stimulateurs de croissance; que l'on limite ou élimine l'utilisation, chez les animaux destinés à l'alimentation, d'antimicrobiens jugés essentiels en médecine humaine; que tous les antimicrobiens utilisés pour contrôler les maladies chez les animaux destinés à l'alimentation soient délivrés uniquement sur ordonnance.
Parmi les informateurs clés externes qui ont commenté la question de la RAM, bon nombre ont repris les recommandations du Comité consultatif d'experts sur l'utilisation d'antimicrobiens chez les animaux et les conséquences pour la résistance et la santé humaine, qui pressaient Santé Canada de prendre d'autres mesures concernant la RAM en s'attaquant à la question de l'IUP et des IPA, en rendant obligatoire la délivrance sur ordonnance de tous les antimicrobiens ainsi qu'en améliorant la surveillance de la RAM et de l'utilisation des antimicrobiens. Le PICRA est perçu comme un progrès important sur le plan de la surveillance.
Des représentants de la DMV ont indiqué que Santé Canada prend actuellement un certain nombre de mesures supplémentaires pour s'attaquer à la RAM, notamment examiner les produits en vente libre qui appartiennent à la catégorie des antimicrobiens importants sur le plan médical afin de déterminer s'ils doivent devenir des médicaments sur ordonnance; travailler avec l'industrie des médicaments et des aliments pour animaux d'élevage pour éliminer progressivement l'utilisation de stimulateurs de croissance antimicrobiens pour des raisons non thérapeutiques; travailler avec l'ASPC, l'ACIA, AAC et les autorités provinciales et territoriales en vue d'élaborer une approche mieux coordonnée en matière de RAM. Comme cela a déjà été indiqué, la question de l'IUP et des IPA est déjà abordée dans les initiatives actuelles de renouvellement de la réglementation de la Direction, qui devraient mener à la mise en place d'un cadre de réglementation distinct pour les médicaments vétérinaires.
Produits de santé naturels vétérinaires (PSNV)
Selon ce qui est indiqué dans le Plan de renouveau, l'un des principes directeurs de l'initiative de modernisation de la réglementation de la DGPSA concernait la mise en place d'interventions proportionnelles au risque. À cette fin, Santé Canada a établi le Comité consultatif d'experts sur les produits de santé naturels vétérinaires (CCE-PSNV) en 2008 ayant pour mandat d'orienter le processus d'élaboration de politiques et de programmes sur ces produits(CCE-PSNV, s.d.; DMV, 2011b). Le CCE-PSNV a établi la définition pratique suivante d'un PSNV : « substance ou mélange de substances administré à travers les muqueuses ou appliqué localement et qui est fabriqué, vendu ou présenté comme pouvant servir :
- au diagnostic, au traitement, à l'atténuation ou à la prévention d'une maladie, d'un désordre, d'un trouble, d'un état physique anormal ou de leurs symptômes chez l'animal;
- au rétablissement, à la correction ou à la modification des fonctions organiques chez l'animal;
- d'article pouvant modifier la structure ou la fonction de l'organisme l'animal » (CCE-PSNV, 2010)Note de bas de page 16.
De plus, le CCE-PSNV définit les « produits présumés sans danger » comme étant des PSNV qui ne sont pas susceptibles d'avoir une incidence négative sur la santé des animaux ni sur la salubrité de l'approvisionnement alimentaire et qui ne présentent pas de risque particulier pour les humains (p. ex. exposition en milieu de travail) ou l'environnement (CCE-PSNV, 2010)Note de bas de page 17. Cela dit, Santé Canada souligne sur son site Web qu'il ne faut jamais présumer que les produits naturels sont toujours sûrs (DMV, 2006a).
En 2010, le Comité a publié un rapport qui comprenait les recommandations suivantes :
- mettre en place un processus « accéléré » pour les produits peu susceptibles de nuire à la santé animale ou humaine et qui ne compromettront pas la salubrité de l'approvisionnement alimentaire (soit les produits à faible risque ou « présumés sûrs »);
- examiner d'abord la question de la santé humaine et animale avant de tenir compte d'autres facteurs au moment de réglementer les PSNV et classer ces produits d'après leur risque possible pour la santé;
- établir et appliquer des normes de sécurité pour tous les PSNV afin de faciliter leur autorisation de mise en marché en imposant des normes plus strictes aux produits qui présentent plus de risques;
- mener des examens préalables à la mise en marché pour les produits qui ne peuvent être présumés sûrs et investir dans la surveillance des PSNV après la mise en marché;
- inspecter les dossiers et les installations des entreprises et prendre des mesures de conformité et d'application de la loi au besoin (CCE-PSNV, 2010).
Le Comité a consacré une bonne partie de ses efforts à la formulation de recommandations précises sur l'accélération du processus d'approbation de mise en marché pour les PSNV « présumés sûrs ». Le Canada a donné suite à ces recommandations en concevant et en mettant en œuvre le Programme pilote de déclaration provisoire pour les produits vétérinaires de santé à faible risque (PVSFR), qui a entamé ses activités au début de 2012 (Santé Canada, 2012b). Il s'agit d'un programme volontaire pour les PVSFR administrés aux chiens, aux chats et aux chevaux non destinés à l'alimentation qui demande l'approbation des numéros de déclaration pour les entreprises qui importent ou fabriquent des produits visés; les produits inscrits ne reçoivent pas d'autorisation de mise en marché officielle, mais habituellement Santé Canada ne prend pas de mesures pour empêcher l'importation, la fabrication ou la vente de tels produits. Le programme est administré par une tierce partie, soit North American Compendiums.
Le but énoncé de ce programme temporaire est d'« évaluer l'efficacité d'une approche simplifiée pour superviser les PVSFR en vue d'éclairer l'élaboration d'un nouveau cadre relatif aux médicaments vétérinaires » en plus de « [sensibiliser] les membres de l'industrie sur d'importantes questions telles que le contrôle de la qualité et les bonnes pratiques de fabrication », qui risquent de se retrouver dans de futures mesures réglementaires visant les PVSFR (Santé Canada, 2012b). Un processus d'inscription simplifié pour les produits médicinaux vétérinaires homéopathiques semble également être en place dans l'UE à la fois pour les animaux de compagnie et pour les animaux destinés à l'alimentation, à la condition notamment que ces produits soient vendus à des concentrations suffisamment faibles et qu'il n'y ait pas d'indications précises sur l'étiquette (ECHAMP, 2012).
Dans de récentes consultations menées auprès des intervenants en vue de guider le processus d'élaboration d'un cadre de réglementation distinct pour les médicaments vétérinaires, Santé Canada a proposé un modèle d'inscription des produits qui s'appliquerait aux médicaments vétérinaires admissibles, en fonction des exigences du programme de déclaration provisoire des PVSFR (DMV, 2013c).
On ignore si l'actuel programme canadien compte un volet de surveillance post-commercialisation, comme le recommandait le CCE-PSNV en 2010. L'absence de surveillance des PSNV après la mise en marché a été mentionnée par certains informateurs clés comme étant une faiblesse de l'actuelle approche de Santé Canada en matière de pharmacovigilance vétérinaire, qui est décrite plus en détail à la section 4.3.
4.3.3 Activités préalables à la mise en marché et établissement de normes
Le PMV a éliminé un important arriéré de travail lié aux présentations de médicaments vétérinaires et a réduit considérablement le délai moyen de la prise de décisions. Il a également mis en place d'autres éléments pour améliorer l'efficacité du processus d'examen, notamment : un examen parallèle avec la FDA des É.-U. pour les sections techniques des présentations visant les animaux de compagnie; un processus simplifié pour les présentations de PSNV et de médicaments génériques à faible risque; un processus d'approbation spécialisé pour les médicaments à ULEM; un échange accru de renseignements avec ses homologues internationaux.
Au cours de la période visée par l'évaluation, dans le cadre de cette activité, le PMV a mis l'accent sur l'élaboration de politiques, de processus et d'outils pour faciliter le processus d'examen des présentations ainsi que sur la poursuite de l'établissement de LMR et de l'adoption de normes internationales. Les activités préalables à la mise en marché et l'établissement des LMR sont examinés ci-après, tandis que la question de l'adoption de normes internationales est traitée à la section 4.4.7.
Examen des présentations
Dans le cadre du PMV, l'une des principales activités de Santé Canada menées avant la mise en marché consiste à examiner les présentations de médicaments vétérinaires et à accorder des autorisations de mise en marché pour des produits jugés sûrs et efficaces. Pendant la période visée par l'évaluation, l'une des grandes préoccupations de la DMV, et d'autres directions de la DGPSA, concernait les délais d'examen des présentations de produits alors que le volume des présentations est à la hausse et que les présentations sont de plus en plus complexes. Les données probantes recueillies dans le cadre de l'évaluation donnent à penser que la DMV a réussi à réduire le délai nécessaire pour examiner les présentations pendant la période visée par l'évaluation.
Il existe plusieurs types de présentation de médicament vétérinaire au CanadaNote de bas de page 18.
- Présentation de drogue nouvelle (PDN)/présentation abrégée de drogue nouvelle (PADN).Ce processus comprend l'approbation de nouveaux médicaments vétérinaires et des médicaments vétérinaires génériques, respectivement.
- Demande de numéro d'identification du médicament (DIN).Ce processus s'applique aux médicaments du Titre 1, soit habituellement les médicaments qui sont sur le marché depuis de nombreuses années et qui ne sont donc pas nouveaux.
- PDN/PADN administrative.Ce processus s'applique lorsqu'il y a changements dans les données administratives du médicament, comme le nom de la marque.
- Supplément à une PDN (SPDN)/supplément à une PADN (SPADN).Ce processus est nécessaire en cas de changements majeurs apportés à la fabrication ou de modifications apportées au mode d'emploi (étiquetage) dans le cas de médicaments préalablement approuvés.
- Modification à déclaration obligatoire (MDO).Ce processus est nécessaire en cas de modifications mineures apportées au procédé de fabrication ou de modifications apportées au profil d'événements indésirables ou au mode d'emploiNote de bas de page 19.
- Présentation de drogue nouvelle de recherche (PDNR) ou demande de certificat d'études expérimentales (DCEE). L'approbation d'une PDNR permet aux fabricants de fournir une drogue nouvelle à des chercheurs qualifiés afin qu'ils en évaluent l'innocuité et l'efficacité, tandis que la délivrance d'un certificat d'études expérimentales permet aux fabricants de vendre à un chercheur qualifié un médicament non approuvé à des fins d'études chez des animaux.
- Demande de distribution de médicaments d'urgence (DDMU). Une autorisation de DMU peut être délivrée pour autoriser la vente d'une quantité restreinte d'un médicament dont la vente n'est actuellement pas approuvée au Canada à un vétérinaire dans un contexte d'urgence.
L'examen des présentations est un processus complexe qui commence par un examen préliminaire pour déterminer si la présentation est conforme au modèle accepté et si elle contient suffisamment de renseignements à l'appui. Suit un examen détaillé visant à évaluer l'innocuité et l'efficacité chez l'animal, la salubrité des aliments destinés aux humains (dans le cas des médicaments administrés à des animaux destinés à l'alimentation) ainsi que la qualité relative à la chimie et à la fabrication. Si la présentation est jugée conforme au Règlement sur les aliments et drogues, la DMV délivre un avis de conformité (AC) au promoteur. Un DIN est attribué après la délivrance d'un AC.
La DMV a mis en œuvre plusieurs initiatives pour améliorer l'efficacité du processus d'examen. Elle a commencé la mise en œuvre de la Gestion des présentations réglementaires (GPR) en juillet 2005 (Santé Canada, 2005b), dont l'objectif était d'accélérer le traitement des présentations de médicaments vétérinaires et d'harmoniser les activités de la DMV avec la Politique sur les normes de service pour les frais d'utilisation du Conseil du Trésor (Boulay, 2005, p. 7)Note de bas de page 20. La GPR précise des cibles en jours pour plusieurs catégories de présentations (voir l'annexe B pour obtenir des précisions).
Les données disponibles donnent à penser que, depuis l'adoption des cibles de la GPR, la DMV a réussi à éliminer un important arriéré de travail lié aux présentations de drogues nouvelles ainsi qu'à réduire considérablement le délai moyen nécessaire pour décider si une drogue nouvelle doit être approuvée. La figure 1 ci-après montre une baisse importante de la charge de travail et de l'arriéré associés aux présentations de drogues nouvelles du T4 de l'exercice 2006-2007 au T4 de l'exercice 2007-2008, puis une baisse moins rapide mais observable au cours de l'exercice 2008-2009. Du T4 de l'exercice 2008-2009 au T3 de l'exercice 2010-2011, la charge de travail est restée stable à un niveau relativement bas, et l'arriéré de travail était négligeable.
Figure 1 - Charge de travail et arriéré de travail pour les présentations de drogues nouvelles du T4 de 2006-2007 au T3 de 2010-2011
La figure 1 montre les tendances relatives au nombre de présentations reçues et au nombre de présentations dont le traitement accuse un retard, et ce, pour la période du quatrième trimestre de 2006-2007 au deuxième trimestre de 2013 2014. Dans l'ensemble, on note une tendance à la baisse du nombre de présentations reçues et du nombre de présentations en souffrance. De façon plus particulière, la charge de travail a atteint un sommet au premier trimestre de 2007-2008, avec 80 présentations, puis a lentement diminué au cours des six années suivantes pour s'établir à 18 présentations au troisième trimestre de 2012-2013. On note une tendance semblable dans le nombre de présentations dont le traitement accuse un retard, lequel est passé de 50 au troisième trimestre de 2007-2008 à 6 en 2012 2013. La baisse des présentations a principalement été enregistrée entre le quatrième trimestre de 2006-2007 et le deuxième trimestre de 2008-2009, alors que leur nombre est passé de 75 à 33. On note un changement important dans l'arriéré du traitement des présentations entre le troisième et le quatrième trimestres de 2008-2009, alors que le nombre de présentations en souffrance est passé de 18 à 2.
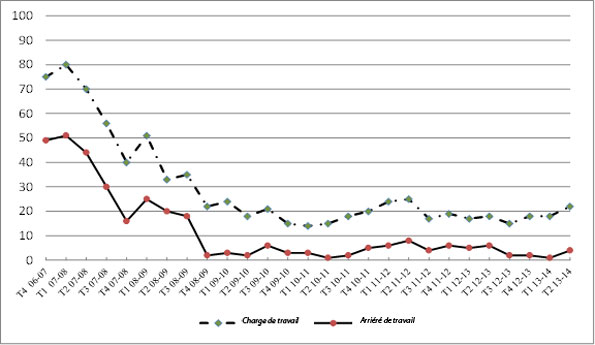
Source : DGPSA (2011a, p. 2)
De la même façon, le délai requis pour réaliser l'examen préliminaire et l'examen des présentations de drogues nouvelles a également diminué dans les dernières années. Comme le montre la figure 2 ci-après, alors que le délai total moyen pour prendre une décision relativement à une présentation de drogue nouvelle a diminué considérablement entre la deuxième moitié de l'exercice 2005-2006 et la première moitié de l'exercice 2006-2007, il a également diminué presque continuellement depuis cette date. Le délai total moyen pour prendre une décision au T1 et au T2 de l'exercice 2010-2011 était de 434 jours par comparaison avec 602 jours dans la deuxième moitié de l'exercice 2009-2010 (DGPSA, 2011a, p. 1) et beaucoup plus de 2 000 jours pendant la première moitié de l'exercice 2006-2007. Toutefois, en 2011-2012, le délai total moyen est monté à 657 jours; il s'agissait évidemment d'une conséquence de la montée en flèche du nombre de présentations soumises au cours de l'exercice précédent. Par contre, la DMV s'attendait à atteindre sa cible de 600 jours pour l'examen d'une présentation d'ici mars 2013 (AAC, 2013).
Figure 2 - Délai total moyen (en jours) pour une décision concernant une présentation de drogue nouvelle, du T1 de 2005-2006 au T1 de 2010-2011
La figure 2 montre les tendances relatives au nombre moyen de jours nécessaires pour arriver à une décision finale pour les présentations de drogue nouvelle. Dans l'ensemble, le temps moyen nécessaire a diminué de la première moitié de 2005-2006 à la première moitié de 2013-2014. Pour la première moitié de 2006-2007, on note une moyenne de 2237 jours, soit le nombre le plus élevé enregistré pour cette période, suivi d'une baisse relativement graduelle pour atteindre 551 jours. Cet écart représente une diminution de 75 %.
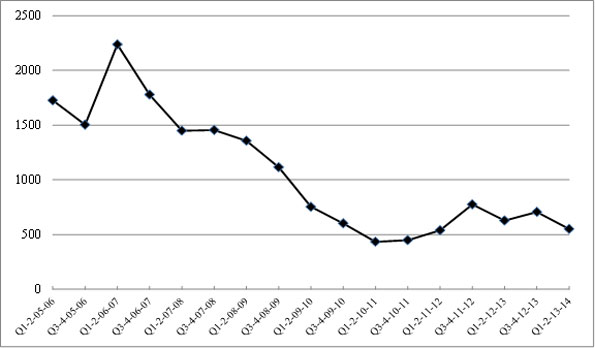
Source : DGPSA (2011a, p. 3)
Pour ce qui est de la proportion de présentations de médicaments vétérinaires atteignant les cibles de rendement, les rapports sur le rendement existants indiquent que le rendement semble avoir diminué quelque peu en 2009-2010 et en 2010-2011 alors qu'on atteignait constamment les cibles de la GPR en 2008-2009 (voir l'annexe B pour obtenir des données détaillées). D'autres facteurs ont pu contribuer à ces résultats, notamment le plus grand nombre de présentations et la complexité croissante de celles-ci (DGPSA, 2011b, p. 3), les ressources limitées (DGPSA, 2010c, p. 3) ainsi qu'un changement dans la façon d'évaluer le rendementNote de bas de page 21.
Selon le RMR 2011-2012 de Santé Canada, au cours de l'exercice 2011-2012, 89 % des décisions réglementaires concernant des médicaments pharmaceutiques vétérinaires ont été prises en respectant les normes de service (Santé Canada, 2011f).
En plus de mettre en place des normes de service pour l'examen des présentations et pour le suivi du rendement du processus d'examen, la DMV a également entrepris de nombreuses initiatives visant à améliorer l'efficacité du processus d'examen des présentations :
- élaboration et mise en œuvre de différents documents d'orientation à l'intention de l'industrie, y compris des directives sur la gestion des décisions réglementaires, les présentations de drogues nouvelles, les présentations de médicaments génériques, le règlement des différends, les modifications apportées après avoir reçu un AC concernant la qualité, l'innocuité et l'efficacité, l'examen des présentations de médicaments par ordre de priorité ainsi que, plus récemment, les présentations électroniques;
- fourniture d'information aux fabricants en délivrant des avis de mise à jour pour les présentations dépassant les cibles de rendement et migration de toutes les présentations actives vers le Système de suivi des présentations de drogues (SSPD) de la DGPSA pour permettre aux fabricants de suivre l'état d'avancement de leur présentation pendant le processus d'examen;
- en réponse à la réduction naturelle de ses effectifs responsables des activités de réglementation avant la mise en marché au milieu des années 2000 (DMV, 2006b), établissement d'un partenariat avec l'ACMV pour dresser une liste de vétérinaires du secteur privé souhaitant réaliser des examens sur une base contractuelle (DMV, 2007c) et prise de dispositions pour recevoir des services d'évaluation en toxicologie de la Direction des aliments de la DGPSA (DGPSA, 2010a);
- réalisation d'un projet pilote avec le Centre for Veterinary Medicine (CVM) de la FDA des É.-U. portant sur l'examen parallèle des sections techniques des présentations visant les animaux de compagnie et annonce de la première approbation simultanée d'une présentation de médicament vétérinaire relevant du processus d'examen parallèle le 14 décembre 2012Note de bas de page 22 (GC, 2012c);
- entrée en vigueur du Programme pilote de déclaration provisoire volontaire pour les PVSFR en 2012;
- simplification de l'examen des présentations de médicaments génériques en publiant des directives harmonisées à l'échelle internationale en avril 2010 (DMV, 2010a) et réduire le nombre de jours requis pour la première et la deuxième étape de l'examen des présentations de médicaments génériques; ces activités ont été financées en partie par Cultivons l'avenir;
- mise en place d'un processus d'approbation spécialisé pour les médicaments à ULEM;
- collaboration avec des homologues étrangers pour échanger de l'information et accroître l'utilisation de données ou d'examens d'autres pays (voir la section 4.7.7 pour obtenir des précisions).
Des documents récents de la DMV indiquent que le Canada accepte désormais les présentations de drogues nouvelles suivant le modèle de présentation américain; deux présentations ont fait l'objet d'un examen parallèle au début de 2012 (DGPSA, 2011b, p. 2, 6). Le modèle de présentation américain suit un processus d'examen progressif ou continu, dans le cadre duquel des sections d'une présentation sont reçues et examinées par l'organisme à mesure qu'elles sont produites par le promoteur, ce qui est différent du processus actuel qui prévoit que l'information est transmise d'un seul coup à l'organisme une fois toutes les données produites par le promoteur (DGPSA, 2010c, p. 11).
Les médicaments vétérinaires sont également visés par le Projet pilote sur l'utilisation des examens étrangers de Santé Canada, qui a été lancé en octobre 2011 et qui doit se terminer en mars 2013Note de bas de page 23. Ce projet pilote constituait la réponse de Santé Canada au rapport de 2011 du vérificateur général sur la réglementation des médicaments pharmaceutiques, qui mentionnait que Santé Canada ne respectait pas ses normes de service touchant l'examen des présentations et qui recommandait notamment que le Ministère prenne dûment compte de l'utilisation de données réglementaires étrangères dans le processus d'examen (BVG, 2011, p. 15-16).
Finalement, dans le cadre des consultations auprès des intervenants tenues au début de 2013, la DMV a présenté un projet de modèle de demande de médicament vétérinaire prévoyant un processus qui fournirait des voies pour adapter les exigences relatives aux données justificatives aux circonstances particulières associées au médicament (DMV, 2013d, p. 1). Plus précisément, la DMV a proposé deux types de voie pour les données probantes - une voie complète et une voie de rechange -, cette dernière permettant des « dérogations » à l'ensemble des exigences relatives aux données quand, par exemple, un autre organisme de réglementation de confiance a démontré que l'utilisation d'un produit est sûre ou a approuvé un produit (2013d, p. 4).
L'enquête de 2011 de la FISA a fait ressortir que l'industrie canadienne des produits de santé animale est satisfaite des améliorations apportées par la DMV au cours des dernières années concernant la gestion des présentations de produits, dont la mise en place de normes de rendement, l'amélioration du délai d'examen, la diminution de l'arriéré de travail, la simplification du processus d'approbation des produits à faible risque ainsi que l'amélioration des communications et des relations de coopération tant avec l'industrie qu'avec des organismes de réglementation étrangers (BioBridge Ltd, 2012, p. 3).
Chez les intervenants ayant participé à la présente évaluation, les points de vue étaient partagés quant à l'examen des présentations. Même si presque tous les répondants à l'enquête menée auprès de l'industrie estiment que les activités préalables à la mise en marché de Santé Canada sont efficaces pour garantir l'innocuité des médicaments vétérinaires, seulement 3 des 10 répondants étaient d'accord pour dire que les examens sont réalisés rapidement (nonobstant l'importante diminution du délai d'examen qui a été obtenu) et que Santé Canada fournit rapidement à l'industrie des renseignements lui permettant de savoir si les examens respectent les normes de service établies.
Les informateurs clés externes qui ont pu commenter l'examen des présentations s'entendaient généralement pour dire que des améliorations avaient été apportées quant à la rapidité d'exécution du processus. Voici quelques-unes des suggestions formulées pour accroître encore plus l'efficacité : utilisation à plus grande échelle des présentations électroniques et des présentations continues ou échelonnées; acceptation des ensembles de données de l'étranger et utilisation des examens étrangers; réalisation d'examens conjoints sur une base plus fréquente.Quelques intervenants externes ont dit craindre que les récentes compressions de personnel et réductions de fonds à Santé Canada compromettent l'efficacité ou la rapidité du processus d'examen préalable à la mise en marché.
Établissement de LMR
L'établissement de LMR sur une base continue fait partie des principales activités d'établissement de normes du PMV. Tel qu'il est expliqué à la section 4.1, dans des concentrations excessives, les résidus de médicaments vétérinaires peuvent nuire à la santé humaine; de nombreuses administrations, dont le Canada, ont donc pris des mesures pour gérer l'exposition humaine à ces résidus. Pour ce faire, il existe un outil commun : les LMR. Le Canada définit ce concept comme suit : « concentration de résidus qui peut demeurer dans les tissus ou les produits alimentaires provenant d'un animal destiné à l'alimentation et à qui l'on a administré des médicaments vétérinaires. Cette limite représente la quantité de résidus qui, croit-on, peut être consommée quotidiennement par un être humain tout au long de sa vie sans que cela n'ait d'effets indésirables sur sa santé » (DMV, 2003c).
La limite administrative maximale de résidus (LAMR) est identique à la LMR (c'est-à-dire qu'elle est obtenue à l'aide du même processus scientifique), sauf que le processus réglementaire relatif à la publication des données est toujours en cours. Autrement dit, la limite de résidus a été définie, mais elle n'a pas encore été intégrée au Règlement sur les aliments et drogues (DMV, 2003c). L'adoption de LAMR au Canada devait résoudre la question des longs délais (jusqu'à deux ans) entre la délivrance d'une approbation pour de nouveaux médicaments vétérinaires et la publication de LMR, que l'on décrivait comme entraînant des difficultés et des délais coûteux pour le producteur sans contribuer à une amélioration de la santé publique (DMV, 2003d).
En mai 2012, la DMV avait établi 269 LMR pour 88 substances pharmacologiquement actives, soit 155 LMR et 114 LAMR (DMV, 2012). Le processus d'établissement de certaines de ces LMR a été mis en œuvre à l'aide de fonds obtenus du volet sur les médicaments vétérinaires de Cultivons l'avenir, dont l'un des objectifs était d'harmoniser davantage les exigences techniques, y compris les LMR, s'appliquant à l'approbation conjointe de médicaments vétérinaires par les États-Unis et le Canada (AAC et Santé Canada, 2009, p. 5)Note de bas de page 24.
Ainsi, dans le cadre de Cultivons l'avenir, la DMV a dressé une liste d'agents pharmacologiques approuvés prioritaires pour lesquels les États-Unis ont établi une LMR et le Canada doit en établir une, l'objectif étant d'établir trois LMR canadiennes par année. À ce jour, la DMV a fixé des LMR canadiennes pour 25 agents pharmacologiques dotés de LMR américaines, soit davantage que la cible de trois par année (AAC, 2013). Toujours dans le cadre de Cultivons l'avenir, la DMV a produit une étude comparative préliminaire en 2009, où sont comparés les processus canadien et américain relatifs aux LMR, et un plan d'action était prévu pour mars 2010 (DGPSA, 2010d). Ni l'étude comparative ni le plan d'action n'étaient prêts au moment de la présente évaluation.
4.3.4 Surveillance post-commercialisation
Les activités de surveillance post-commercialisation du PMV comprennent la surveillance des déclarations de réactions indésirables à des médicaments, la détection des signaux, l'évaluation de la causalité et les mesures prises après la mise en marché. Voici quelques unes des lacunes perçues : sous-déclaration des réactions indésirables par les utilisateurs finaux; absence d'exigences pour la déclaration des réactions indésirables causées par des produits importés non approuvés; manque de surveillance des produits de santé naturels vétérinaires.
L'amélioration de la surveillance post-commercialisation, aussi appelée pharmacovigilance, est l'un des principaux thèmes visés par l'initiative de modernisation de la réglementation de la DGPSA. Dans ce secteur, les activités du PMV comprennent la collecte et l'évaluation sur une base continue des données sur l'innocuité après la mise en marché et des déclarations de réactions indésirables à des médicaments faites au Canada et à l'étranger ainsi que la collaboration nationale et internationale en matière de surveillance post-commercialisation. Cela dit, d'après les données probantes recueillies dans le cadre de l'évaluation, il est difficile de dire avec précision quelles sont les améliorations à la surveillance post-commercialisation qui étaient prévues et qui ont été apportées par Santé Canada au cours de la période visée par l'évaluationNote de bas de page 25.
Sur son site Web, Santé Canada définit la pharmacovigilance comme suit dans le contexte des médicaments vétérinaires : « surveillance après la mise en marché ou déclaration des réactions indésirables aux médicaments (RIM), afin de faire le suivi de l'innocuité et de l'efficacité des médicaments à usage vétérinaire » (DMV, 2004a). En vertu du Règlement sur les aliments et drogues, les fabricants sont tenus de déclarer à Santé Canada, dans les 15 jours, toute réaction indésirable soupçonnée survenue au Canada et toute réaction indésirable grave et inattendue survenue à l'extérieur du pays (GC, 2012a, art. C.01.017). Les vétérinaires et les techniciens sont vivement encouragés à déclarer de telles réactions, mais ne sont pas obligés de le faire (DMV, 2011c). Une modification apportée récemment à la réglementation oblige les fabricants à aviser Santé Canada si le profil risques-avantages d'un médicament change considérablement, permet à Santé Canada de demander aux fabricants de fournir des rapports sommaires ou des études de cas sur l'innocuité et l'efficacité d'un médicament et exige des fabricants qu'ils conservent différents documents sur l'innocuité et l'efficacité pendant 25 ans (GC, 2012a, art. C.01.018).
Des informateurs clés de la DMV ont indiqué que plus de 98 % de toutes les déclarations reçues par la DMV concernent des réactions chez des animaux même si les déclarations de réactions indésirables à des médicaments vétérinaires comprennent à la fois les réactions chez des animaux et celles chez des humains »Note de bas de page 26.
Au sein de la DMV, l'Unité de la pharmacovigilance gère une base de données contenant les dossiers de réactions indésirables soupçonnées, conformément aux lignes directrices établies par la VICH (DMV, 2004a). Des informateurs clés de la DMV ont indiqué que l'une des lacunes de l'actuelle base de données était l'impossibilité d'effectuer la détection de signaux; les requêtes précises doivent être formulées à partir de l'information obtenue d'autres sources, comme l'examen préalable à la mise en marché, les RPPV demandés aux fabricants ou les homologues internationaux de la DMV. Des informateurs clés de la DMV ont signalé que la Direction envisage de mettre à niveau son système afin qu'il soit doté de fonctions automatisées de surveillance et de détection des signaux, comme les systèmes utilisés par l'industrie et d'autres organismes de réglementation étrangers.
Des informateurs clés de la DMV ont indiqué que chaque déclaration de réaction indésirable effectuée au pays fait l'objet d'une évaluation de la causalité; d'après le nombre de rapports, leur similitude et l'ampleur de la réaction, la DMV peut envisager d'autres mesures comme l'ajout de nouveaux avertissements, de contre-indications ou de renseignements sur l'innocuité pour les humains sur les étiquettes, le rappel d'un lot précis de médicaments ou le retrait du médicament du marché (DMV, 2004a). Selon le cas, les mesures visant à résoudre des problèmes de sécurité après la mise en marché sont prises en collaboration avec l'Inspectorat (comme des rappels).
Le Canada a adopté deux lignes directrices de la VICH portant précisément sur la pharmacovigilance vétérinaire, soit Management of Adverse Event Reports (AERs) (Gestion des rapports d'événements indésirables - GL 24) et Management of Periodic Summary Update Reports (Gestion des rapports de mise à jour périodiques- GL 29) (DMV, 2011d). La DMV a également conclu des ententes avec des homologues du secteur de la réglementation d'autres administrations, notamment des ententes pour l'échange de données de pharmacovigilance (Santé Canada et Agence européenne des médicaments, 2009; Santé Canada, 2003b, 2006).
Chez les informateurs clés externes et les répondants qui ont pris part à la présente évaluation, les points de vue étaient partagés quant à la pertinence de l'approche de Santé Canada à l'égard des activités de déclaration des RIM et de surveillance post-commercialisation concernant les médicaments vétérinaires. Voici quelques domaines où l'on perçoit des lacunes :
- sous-déclaration des RIM de la part des utilisateurs finaux, notamment les éleveurs et les vétérinaires;
- manque de connaissance et de compréhension des exigences de Santé Canada en matière de déclaration des RIM chez les fabricants étrangers;
- absence d'exigences en matière de déclaration des RIM à des produits importés non approuvés, y compris les IPA;
- manque d'attention accordée à l'efficacité des produits dans les déclrations de RIM (une information jugée importante par les informateurs clés dans le contexte de la RAM);
- absence de surveillance post-commercialisation des PSNV;
- ressources inadéquates pour la surveillance post-commercialisation des médicaments vétérinaires.
De plus, la littérature contient des critiques formulées par certains intervenants relativement à l'absence, au Canada, de données de pharmacovigilance mises à la disposition du public concernant les médicaments vétérinaires. Par exemple, Woodward (2009) a constaté que, même si le programme canadien de pharmacovigilance vétérinaire est à de nombreux égards comparable aux systèmes d'autres pays, contrairement à ce qui se passe dans ces pays, on compte étonnamment peu de données de pharmacovigilance mises à la disposition du public au Canada (p. 147). En effet, les renseignements sur le nombre et le type de réaction indésirable à un médicament ne sont pas accessibles au public au Canada, contrairement à ce qui se fait aux États-Unis, en Australie et dans l'UE (APVMA, 2012; CVM, 2012b; CVMP, 2012). Il faut également noter que l'UE et les États-Unis disposent tous deux d'un système de déclaration électronique des réactions indésirables aux médicaments vétérinaires qui encourage la déclaration et facilite l'analyse, alors que le Canada ne possède pas un tel système.
4.3.5 Conformité et application de la loi
Les activités de conformité et d'application de la loi comprennent ce qui suit : sensibilisation, consultation et information; surveillance de la conformité par des inspections des BPF et des inspections de la conformité aux LMR; mesures volontaires et réglementaires de conformité et d'application de la loi à la suite de cas de non-conformité. L'approche du PMV concernant les inspections relatives aux BPF des médicaments vétérinaires est perçue comme étant problématique par l'industrie des produits de santé animale, qui estime qu'il ne faut pas appliquer aux médicaments vétérinaires des normes qui conviennent aux médicaments pour usage humain.
Comme dans le cas de la surveillance post-commercialisation, même si l'amélioration de la conformité et de l'application de la loi est l'un des principaux thèmes de l'initiative de modernisation de la réglementation de la DGPSA et que cette activité s'applique probablement aux médicaments vétérinaires, l'évaluation n'a pas permis de trouver un grand nombre de données démontrant l'existence de projets d'amélioration dans ce secteur portant précisément sur les médicaments vétérinaires. Cette activité se rapportait plutôt à l'exécution continue et permanente de tâches précises par l'Inspectorat, tâches que celui-ci exécute également pour d'autres produits de santé réglementés par Santé CanadaNote de bas de page 27. Toutefois, certains des travaux du PMV touchant l'élaboration de politiques et de règlements, surtout sur l'IUP et les IPA, se rapportent à la conformité et à l'application de la loi.
L'une des principales tâches de l'Inspectorat consiste à réaliser des inspections des BPF et à délivrer des licences d'établissement de produits pharmaceutiques (LEPP). Les LEPP sont obligatoires pour « toute personne au Canada qui mène l'une ou l'autre des six activités requérant une licence relativement aux médicaments sous forme posologique » (Inspectorat, 2012). Voici les six activités requérant une licence : fabrication, emballage/étiquetage, analyse, importation, distribution et vente en gros. Pour obtenir une LEPP, l'établissement doit passer avec succès une inspection menée par l'Inspectorat qui vérifie la conformité à la partie C, titres 2 à 4 du Règlement sur les aliments et drogues, portant sur les BPF. Cette partie comporte des exigences sur les locaux, l'équipement, le personnel, l'hygiène, l'analyse des matières premières, la fabrication, le contrôle de la qualité, l'analyse du matériel d'emballage, l'analyse du produit fini, la tenue des dossiers, la conservation des échantillons, la manipulation des produits stériles et la stabilité du produit (GC, 2012a).
Par conséquent, les inspections des BPF, dans le cadre desquelles l'Inspectorat évalue si les médicaments sont toujours produits et contrôlés conformément aux normes de qualité qui s'appliquent à l'utilisation prévue, selon l'autorisation de mise en marché (Inspectorat, 2007b, p. 6), constituent le fondement des LEPP. Les établissements installés au pays qui sont visés par une inspection des BPF sont classés comme suit : conforme, non conforme ou conforme avec modalités et conditionsNote de bas de page 28. Les inspections sont menées suivant des cycles de 24 mois pour les fabricants, les emballeurs/étiqueteurs et les laboratoires d'essai et de 36 mois pour les importateurs, les distributeurs et les grossistes.
L'approche actuelle de Santé Canada à l'égard des inspections des BPF des établissements de médicaments vétérinaires est perçue comme étant problématique par bon nombre de personnes de l'industrie des produits de santé animale. Par exemple, 30 % des répondants à l'enquête de 2011 de la FISA ont signalé des problèmes concernant les inspections des BPF découlant de la rigidité de l'unité des BPF de Santé Canada et de l'application de lignes directrices inadéquates qui proviennent du secteur de la santé humaine, dont certaines lignes directrices qui ne sont pas appliquées aux États-Unis ni en Europe pour les produits de santé animale (BioBridge Ltd, 2012, p. 15). De façon plus générale, l'enquête a révélé que l'industrie canadienne estime que l'influence du cadre de réglementation des produits de santé destinés aux humains est le plus important facteur pouvant avoir une incidence négative sur l'industrie canadienne. Des informateurs clés de l'industrie ayant participé à la présente évaluation ont fait part de réflexions semblables.
Dans ce contexte, il est important de noter que Santé Canada a pris des mesures pour reconnaître le caractère unique des médicaments vétérinaires dans les inspections des BPF, notamment en publiant des lignes directrices précises décrivant la façon dont les exigences relatives aux BPF pourraient être appliquées différemment dans le cas des médicaments vétérinaires (DGPSA, 2011c)Note de bas de page 29. Des informateurs clés de Santé Canada ont également indiqué que l'actuelle initiative de réforme de la réglementation comporte une évaluation complète de toutes les activités de réglementation actuellement en place, l'objectif étant de moderniser le cadre à la lumière d'une approche fondée sur le risque et de créer un cadre de réglementation distinct pour les médicaments vétérinaires. Au cours de consultations menées récemment auprès d'intervenants visant à guider le processus d'élaboration d'un cadre de réglementation distinct pour les médicaments vétérinaires, Santé Canada a proposé que l'on mette en place des exigences relatives aux BPF s'appliquant aux médicaments vétérinaires admissibles selon le processus d'homologation proposé qui seraient comparables à ce qui est prescrit dans le Règlement sur les produits de santé naturels (DMV, 2013e). Selon le document de consultation, les exigences relatives aux BPF actuelles s'appliquant aux médicaments vétérinaires ne changeraient pas.
Même si la plupart des informateurs clés externes ne pouvaient dire si les activités de conformité et d'application de la loi de Santé Canada sont adéquates pour garantir la conformité de l'industrie au cadre de réglementation des médicaments vétérinaires, les informateurs représentant l'industrie ont fait part de certaines préoccupations. La grande préoccupation tourne autour de ce que les informateurs clés perçoivent comme étant l'application inadéquate aux médicaments vétérinaires de normes de BPF établies pour des produits destinés à un usage humain, une préoccupation également soulevée par les répondants à l'enquête de la FISA, tel qu'il a été indiqué précédemment. Certains informateurs clés de l'industrie ont également fait part de préoccupations quant aux ressources insuffisantes consacrées aux activités de conformité et au défaut d'application de la loi au niveau des utilisateurs finaux. Même s'ils reconnaissaient que Santé Canada n'a pas compétence en ce qui a trait à l'utilisation de médicaments vétérinaires par les vétérinaires et les éleveurs, des informateurs ont souligné que la mise en œuvre d'une réforme réglementaire s'attaquant aux problèmes liés à l'IUP et aux IPA permettrait en quelque sorte de se pencher sur les préoccupations relatives à l'utilisation de médicaments non approuvés par des utilisateurs finaux.
Finalement, même si l'ACIA n'est pas visée par l'évaluation du PMV, il est important de noter qu'elle a quand même une responsabilité à assumer en matière de surveillance de la conformité des médicaments vétérinaires par l'entremise de plusieurs programmes. Les données de l'Inspectorat et de l'ACIA sur la conformité et l'application de la loi sont présentées à la section 4.3.3.
4.3.6 Communication et mobilisation des intervenants
La DMV a déployé des efforts concertés au cours des dernières années pour améliorer ses activités de communication et de consultation auprès des intervenants, et les intervenants s'entendent en général pour dire que les communications et les consultations se sont améliorées considérablement.
Dans le cadre de son initiative de modernisation de la réglementation, la DGPSA poursuivait deux objectifs généraux ou primordiaux aux plans des communications et de la mobilisation des intervenants, soit fournir aux Canadiens plus d'information sur les produits de santé, y compris des renseignements plus à jour et accessibles, et faire en sorte que les consommateurs et d'autres intervenants puissent apporter une plus grande contribution au système de réglementation. Au cours de la période visée par l'évaluation, le PMV a entrepris un certain nombre d'activités de communication et de mobilisation des intervenants, dont voici certains des objectifs généraux :
- afficher des renseignements à l'intention des utilisateurs finaux de médicaments vétérinaires et le grand public sur son site Web, y compris notamment :
- des mises en garde et des avertissements touchant des médicaments vétérinaires;
- des fiches de renseignements, des questions et réponses ainsi que des documents semblables sur des sujets comme la RAM, les LMR, l'UMDDE, l'IUP, la préparation, l'utilisation prudente de médicaments vétérinaires dans les aliments pour animaux d'élevage, les stimulateurs de croissance hormonaux et les PSNV;
- de l'information permettant de déterminer comment et quand il faut déclarer des RIM;
- afficher de l'information à l'intention de l'industrie sur les processus de demande et d'examen relatifs aux médicaments vétérinaires, ainsi que des politiques et des documents d'orientation connexes;
- délivrer des avis de mise à jour aux fabricants concernant les présentations qui dépassent les cibles de rendement et permettre aux fabricants de suivre l'état d'avancement de leurs présentations pendant le processus d'examen par l'intermédiaire du SSPD;
- tenir des réunions et des consultations sur une base régulière avec des intervenants, y compris des réunions avec l'ICSA, le Comité des intervenants de la DMV et le CCCRPSV (voir l'annexe C pour en savoir plus) et transmettre de l'information sur ses activités aux intervenants au moyen de communiqués;
- établir des comités consultatifs, des CCE et des GCE pour orienter les processus d'élaboration de règlements et de politiques portant sur différentes questions (voir la section 4.4.5 et l'annexe C pour obtenir des précisions sur ces comités);
- mener des consultations auprès du public et des intervenants au sujet de lignes directrices provisoires, de projets de politiques et de modifications que l'on propose d'apporter au Règlement sur les aliments et drogues, notamment des consultations sur ce qui suit :
- LMR proposées pour l'amprolium, la bacitracine, la cloxacilline, le dichlorvos, l'érythromycine, la gamithromycine, le méloxicam, la novobiocine, la pénicilline G et le toltrazuril (DMV, 2011e);
- ébauches de politiques et de documents d'orientation sur la RAM, l'UMDDE, l'IUP, les PSNV, les médicaments à ULEM, les PDN, etc.;
- adoption de lignes directrices précises de la VICH, de modifications réglementaires proposées et d'autres éléments, comme un projet de politique sur l'aquaculture (DMV, 2007a) et une définition provisoire du terme PSNV (DMV, 2007d, 2008a, s.d.).
De nombreux informateurs clés externes ont fait observer que la DMV semble avoir fait des efforts concertés au cours des dernières années pour améliorer ses activités de communication et de consultation auprès des intervenants, et la plupart d'entre eux affirment que les communications et les consultations se sont grandement améliorées. Cette question est traitée plus en détail à la section 4.4.1.
4.4 Atteinte des résultats
Cette section présente les constatations des évaluateurs concernant les questions d'évaluation relatives aux résultats. Globalement, tel qu'il a été expliqué à la section 3.4, alors que Santé Canada a mené de nombreuses activités qui auraient dû, théoriquement, produire les résultats escomptés, il existe relativement peu de données à l'appui d'une conclusion définitive concernant la mesure dans laquelle les résultats escomptés ont été atteints. Il faut donc considérer les constatations issues de l'évaluation liées aux résultats du programme comme des données de référence.
4.4.1 Sensibilisation et compréhension
Bien que les activités de communication et de consultation de Santé Canada se soient améliorées au cours des dernières années, il est possible d'améliorer davantage les communications et les consultations avec les intervenants, en particulier avec les utilisateurs finaux de médicaments vétérinaires comme les vétérinaires ou les éleveurs.
À court terme, on s'attend à ce que les activités de communication et de mobilisation des intervenants de Santé Canada permettent aux intervenants externes d'avoir une meilleure connaissance et une meilleure compréhension des risques et des avantages liés aux médicaments vétérinaires et du cadre réglementaire qui les régit. Bien que l'information existante ne permette pas de déterminer si la sensibilisation s'est accrue, les activités de communication et de consultation de Santé Canada se sont améliorées de façon manifeste au cours des dernières années. Cela dit, il est possible d'améliorer davantage les communications et les consultations avec les intervenants, en particulier avec les utilisateurs finaux de médicaments vétérinairesNote de bas de page 30.
Avis des intervenants à propos des communications et des consultations de Santé Canada
Parmi les informateurs clés externes qui ont bien voulu faire des commentaires à ce sujet, nombreux ont été ceux qui ont indiqué que les communications de Santé Canada s'étaient manifestement améliorées ces dernières années. De manière générale, ils pensent que Santé Canada communique bien avec l'industrie et les vétérinaires, mais moins bien avec les éleveurs, qui ne se considèrent peut-être pas comme l'un des groupes de clients de Santé Canada. De plus, on a laissé entendre que Santé Canada s'en remet aux vétérinaires pour communiquer l'information aux éleveurs et que la plupart des vétérinaires reçoivent ces renseignements indirectement par l'intermédiaire de l'ACMV ou des associations provinciales de médecins vétérinaires. Les informateurs clés de Santé Canada ont reconnu que certains groupes d'intervenants recevaient peut-être l'information indirectement par l'entremise de leur association, mais ils ont souligné qu'il s'agissait d'un moyen efficace de diffusion de l'information compte tenu du manque de ressources du programme.
Bien que les communications de Santé Canada avec les intervenants se soient améliorées, les informateurs clés externes ont constaté que de nombreux intervenants se procuraient l'information sur les médicaments vétérinaires auprès d'autres sources que Santé Canada (gouvernements provinciaux, associations provinciales de médecins vétérinaires et sociétés pharmaceutiques). De la même façon, même si certains des répondants à l'enquête menée auprès des utilisateurs finaux de médicaments considèrent que Santé Canada est leur plus importante source d'information en ce qui concerne l'innocuité et l'efficacité des médicaments vétérinaires, pour la plupart d'entre eux, ce sont les autres sources qui sont plus importantes. Parmi ces sources figurent les vétérinaires, les publications scientifiques et la Global Food Animal Residue Avoidance Database (gFARAD), qui, entre autres services, fournit une estimation concernant les délais d'attente pour l'utilisation de médicaments en dérogation des directives de l'étiquette (Dowling, Doucet, Fortier et Clark, 2004). Il est notoire que la version canadienne (CgFARAD) est une importante ressource pour le contrôle des résidus des médicaments vétérinaires (ACMV, 2010; Prescott et coll., 2012; Szkotnicki, 2008).
Quelques-uns des informateurs clés externes attribuent la réussite que Santé Canada a connue en matière de communication ces dernières années aux efforts que les associations provinciales de médecins vétérinaires et d'autres organisations ont faits pour diffuser l'information de Santé Canada à leurs membres. Ils pensent que Santé Canada devrait redoubler d'efforts pour mieux communiquer avec les organismes de réglementation provinciaux et les associations de médecins vétérinaires afin d'améliorer encore plus la diffusion de l'information.
En ce qui concerne les consultations, les informateurs clés externes qui ont fourni des commentaires à ce sujet croient pareillement que, au cours des quatre ou cinq dernières années, Santé Canada a consulté davantage les intervenants pour l'élaboration des politiques et de la réglementation. Santé Canada a créé divers comités consultatifs multilatéraux d'intervenants et d'experts, et il rencontre régulièrement l'ICSA et le CCCRPSV. Cela dit, les préoccupations suivantes ont été citées à propos du processus de consultation de Santé Canada :
- l'absence de transparence à l'égard de la considération que Santé Canada accorde à l'information reçue pendant les consultations;
- l'absence de consultations pour certaines décisions ou l'organisation de consultations a posteriori (c'est-à-dire alors que les décisions ont déjà été prises);
- la réticence de Santé Canada à consulter les intervenants sur des problèmes liés aux médicaments vétérinaires si le problème n'a pas déjà été examiné pour des médicaments à usage humain;
- le manque de temps pour examiner les changements proposés aux politiques ou à la réglementation et pour faire des commentaires à ce sujet;
- la lassitude à l'égard des consultations (on peut se sentir submerger par les demandes fréquentes de commentaires);
- l'absence de représentants des utilisateurs finaux de médicaments vétérinaires dans certaines consultations et l'absence de communication avec les utilisateurs finaux de médicaments concernant la possibilité de faire des commentaires;
- la complexité du processus de consultation, y compris par l'intermédiaire de comités consultatifs, ce qui peut dissuader les gens d'y participer.
Les informateurs clés ont fait les suggestions suivantes pour améliorer la consultation : séparer, s'il y a lieu, les discussions sur les médicaments vétérinaires des discussions sur les médicaments à usage humain; faire appel aux intervenants plus tôt dans le processus; demander aux associations de médecins vétérinaires et aux autres associations de transmettre les demandes de commentaires à leurs membres et de leur demander de répondre; organiser des consultations ciblées sur des dossiers précis au moyen de réunions en personne avec enregistrement des décisions et des mesures à prendre; faire le point sur les activités et les décisions après les consultations.
De même, les résultats des enquêtes réalisées auprès des utilisateurs finaux de médicaments et de l'industrie révèlent des opinions partagées sur les consultations de Santé Canada au cours des dix dernières années, l'industrie étant apparemment plus satisfaite du processus que les utilisateurs finaux de médicaments. La majorité des répondants à l'enquête menée auprès de l'industrie conviennent que Santé Canada a consulté le secteur des médicaments vétérinaires comme il convient et que les mécanismes actuels de consultation offrent au secteur un moyen efficace de faire connaître au Ministère ses inquiétudes et ses intérêts, même si un nombre moindre de répondants trouvent que Santé Canada tient compte de ces inquiétudes et de ces intérêts dans la préparation de ses politiques et de la réglementation. Globalement toutefois, ces constatations correspondent à celles de l'enquête de la FISA de 2011. Dans celle-ci, le secteur canadien des produits de santé animale avait généralement estimé qu'au cours des cinq dernières années l'attitude de Santé Canada à l'égard d'une consultation positive et coopérative et sa capacité de régler les problèmes s'étaient considérablement améliorées (BioBridge Ltd, 2012, p. 3).
Presque tous les membres du secteur ayant répondu à l'enquête ont convenu que les réunions préalables aux présentations sont un moyen efficace de veiller à ce que les présentations de produits satisfassent aux exigences de Santé Canada, sentiment que partagent la plupart des informateurs clés de l'industrie. Néanmoins, quelques-uns des informateurs clés se sont plaints que ces réunions s'accompagnent habituellement d'un long processus qui peut coûter des milliers de dollars aux promoteurs. Par conséquent, certains promoteurs ont proposé une solution de rechange, demandant désormais la tenue de réunions annuelles sur les produits en voie de commercialisation pour informer Santé Canada des activités de développement de produits en cours et pour donner suite aux préoccupations naissantes.
Contrairement aux répondants à l'enquête effectuée auprès de l'industrie, seule une minorité de répondants à l'enquête menée auprès des utilisateurs finaux de médicaments ont convenu que Santé Canada avait consulté les utilisateurs finaux de médicaments vétérinaires comme il convient, que les mécanismes de consultation existants constituaient un moyen efficace de faire connaître au Ministère leurs inquiétudes et leurs intérêts et que Santé Canada avait tenu compte de leurs inquiétudes et de leurs intérêts dans la préparation de ses politiques et de la réglementation.
Incidence des communications et des consultations sur la sensibilisation et la compréhension des utilisateurs finaux de médicaments
Tel qu'il a été indiqué précédemment, on s'attend à ce que les activités de communication et de consultation de Santé Canada permettent aux intervenants externes de mieux connaître et comprendre les risques et les avantages des médicaments vétérinaires. Au moins la moitié des utilisateurs finaux de médicaments interrogés ont indiqué qu'ils comprenaient bien :
- les mesures de gestion du risque visant à réduire la résistance aux antimicrobiens associée à l'emploi d'agents antimicrobiens pour les animaux destinés à l'alimentation;
- les risques possibles pour la santé humaine que présente la RAM attribuable à l'emploi d'agents antimicrobiens pour les animaux destinés à l'alimentation;
- la politique de Santé Canada sur l'utilisation de médicaments en dérogation des directives de l'étiquette (UMDDE);
- l'emploi prudent des médicaments vétérinaires dans les aliments pour animaux d'élevage.
Parmi les domaines pour lesquels la compréhension n'est pas aussi bonne figurent les risques possibles pour la santé humaine que présente l'emploi des stimulateurs de croissance hormonaux pour les animaux destinés à l'alimentation, la façon et le moment de déclarer des RIM et les risques possibles pour la santé humaine que présente l'UMDDE pour les animaux destinés à l'alimentation.
Par ailleurs, alors que de nombreux utilisateurs finaux de médicaments disent savoir que Santé Canada diffuse des renseignements sur les risques et la sécurité, ceux qui ont réellement utilisé ces renseignements sont moins nombreux. Le plus souvent, les utilisateurs finaux de médicaments ont utilisé la politique sur l'UMDDE et l'information sur les LMR pour les animaux destinés à l'alimentation, alors que seulement quelques-uns se sont servis de l'information sur les risques possibles pour la santé animale et humaine que présente l'emploi des médicaments non homologués et des stimulateurs de croissance hormonaux. Néanmoins, ceux qui se sont servis de l'information préparée par Santé Canada ont généralement trouvé qu'elle était à jour, accessible, compréhensible, de haute qualité et utile. Globalement, un tiers des utilisateurs finaux de médicaments ont convenu que Santé Canada a eu une influence sur leur compréhension des risques pour la santé animale et humaine.
L'enquête a révélé que des utilisateurs finaux de médicaments n'étaient pas certains de ce qu'il fallait faire pour déclarer les RIM, la déclaration étant volontaire pour ce groupe d'intervenants. Bien que la plupart des utilisateurs finaux de médicaments sachent, grâce à l'information diffusée par Santé Canada, comment et quand déclarer les RIM, ceux qui se sont servis de cette information sont beaucoup moins nombreux, et seulement 18 % (3/21) ont déjà déclaré une réaction indésirable à un médicament à la DMV. Moins de la moitié des utilisateurs finaux de médicaments ont reconnu que Santé Canada a clairement précisé quelle information les utilisateurs finaux de médicaments devraient déclarer, indiqué à quel service du Ministère les utilisateurs finaux de médicaments devaient transmettre les déclarations de RIM et défini quels types de RIM les utilisateurs finaux de médicaments sont invités à déclarer.
Les informateurs clés externes qui pouvaient faire des commentaires sur le sujet avaient des opinions partagées sur la mesure dans laquelle les vétérinaires et les autres utilisateurs finaux de médicaments déclarent les RIM. Certains sont d'avis que les vétérinaires sont très conscients de la nécessité de les déclarer alors que d'autres pensent que, en général, les vétérinaires ne déclarent pas tous les RIM, car, toujours selon les informateurs clés, ils sont plus susceptibles de déclarer les réactions indésirables aux fabricants de médicaments qu'à Santé Canada. Les informateurs clés externes ont indiqué plusieurs facteurs qui pourraient expliquer pourquoi les vétérinaires ne déclarent pas toutes les RIM, à savoir :
- manque de connaissances quant aux réactions qui devraient être signalées et à l'endroit où elles devraient l'être;
- difficulté à déterminer si la réaction observée est attribuable au médicament ou à un autre facteur;
- réticence à déclarer des réactions qui pourraient avoir été causées par une administration incorrecte du médicament;
- crainte que les données sur les réactions indésirables puissent entraîner des restrictions non justifiées de l'utilisation du produit.
Les informateurs clés externes pensent que les éleveurs sont peu susceptibles de déclarer les RIM à Santé Canada. Selon eux, un grand nombre d'éleveurs ne savent probablement pas qu'il faut les déclarer, et, s'ils le savent, il est plus probable qu'ils préviendront leur vétérinaire que Santé Canada.
Malheureusement, en raison des limites liées à l'échantillon et à un faible taux de réponse, il n'a pas été possible de confirmer ou de réfuter ces observations à l'aide de l'enquête menée auprès des utilisateurs finaux de médicaments. Cependant, Santé Canada reconnaît depuis longtemps que le fait que les utilisateurs finaux de médicaments ne déclarent pas tous les RIM est un problème général qui touche tous les produits de santé que le Ministère réglemente.
Incidence des communications et des consultations sur la sensibilisation et la compréhension de l'industrie
Pour l'industrie, les activités de communication de Santé Canada devraient permettre d'avoir une meilleure connaissance et une meilleure compréhension du cadre réglementaire régissant les médicaments vétérinaires. Selon l'enquête menée auprès de l'industrie, alors que la plupart des répondants indiquent bien comprendre les exigences de Santé Canada en matière de présentations pour les médicaments vétérinaires, ils sont moins nombreux à bien comprendre les exigences concernant les BPF, les licences d'établissement et les déclarations obligatoires des réactions indésirables; un seul a indiqué qu'il comprenait très bien les activités de Santé Canada visant la conformité.
Tous les répondants de l'industrie connaissaient l'information offerte par Santé Canada sur ses exigences pour la présentation de produits, les BPF, les licences d'établissement et les déclarations obligatoires des réactions indésirables, et la majorité d'entre eux l'avaient utilisée. À l'exception d'une personne, tous les répondants de l'industrie avaient aussi connaissance de l'information sur le processus électronique de présentation, mais seulement trois d'entre eux s'étaient servis de l'information. Moins nombreux étaient ceux qui connaissaient l'information sur les activités de Santé Canada en matière de vérification de la conformité à la réglementation et qui l'avaient utilisée. Dans l'ensemble, les répondants de l'industrie considèrent que l'information préparée par Santé Canada est à jour, accessible, compréhensible, de haute qualité et utile.
Même si les informateurs clés externes ont indiqué que les fabricants de médicaments prennent très au sérieux les exigences de Santé Canada sur la déclaration des RIM, qu'ils comprenaient bien ces exigences, et qu'ils les suivent à la lettre, l'enquête menée auprès de l'industrie a révélé une incertitude chez les répondants de l'industrie dans ce domaine. Presque tous les répondants de l'industrie conviennent que Santé Canada a clairement défini les délais applicables à la déclaration obligatoire des RIM; ils sont moins nombreux à admettre que Santé Canada a bien indiqué à quel service du Ministère les rapports doivent être transmis et a clairement précisé l'information à donner. La moitié des répondants disent que Santé Canada a clairement défini les RIM qui doivent être signalées. Dans les cas où des RIM devraient être signalées, environ la moitié des répondants ont indiqué que leur entreprise était à même de fournir l'information demandée et de remplir le rapport dans les délais demandés.
4.4.2 Innocuité et efficacité des médicaments vétérinaires
Bien que de toute évidence il existe des processus visant à ce que les médicaments mis en marché ne soient pas dangereux et soient efficaces, aucun élément concret n'indique que l'innocuité et l'efficacité des médicaments vétérinaires se soient améliorées au Canada pendant la période visée par l'évaluation.
À court terme, les activités de Santé Canada avant la mise en marché devraient aboutir à l'amélioration de l'innocuité et de l'efficacité des médicaments vétérinaires sur le marché canadien. Bien que de toute évidence il existe des processus visant à ce que les médicaments mis en marché ne soient pas dangereux et soient efficaces, aucun élément concret n'indique que l'innocuité et l'efficacité des médicaments vétérinaires se soient améliorées au Canada pendant la période visée par l'évaluation.
On s'attend à ce qu'un processus d'examen rigoureux engendre l'amélioration de l'innocuité et de l'efficacité. Tel qu'il a été expliqué à la section 4.3.3, les exigences en matière d'information pour les examens préalables à la mise en marché des nouveaux médicaments vétérinaires sont complexes et détaillées, et tous les répondants à l'enquête menée auprès de l'industrie ont convenu que tous les examens que Santé Canada fait préalablement à la mise en marché pour les présentations de médicaments vétérinaires sont rigoureux. En outre, les répondants à l'enquête menée auprès de l'industrie ont généralement admis que Santé Canada disposait de bons processus préalables à la mise en marché pour garantir à la fois l'innocuité et l'efficacité des médicaments vétérinaires, même si les utilisateurs finaux de médicaments n'ont pas été aussi catégoriques. Les informateurs clés externes qui pouvaient faire des commentaires sur le processus d'examen des présentations ont généralement convenu que Santé Canada considérait comme il le fallait le type et la qualité de l'information dans les examens préalables à la mise en marché. Leurs suggestions pour les améliorations, comme une utilisation plus fréquente des examens et des données venant de l'étranger et une utilisation plus intensive des méthodes fondées sur les risques, portaient principalement sur l'accroissement de l'efficacité des processus.
En fait, l'amélioration dans le domaine de l'innocuité et de l'efficacité est étroitement liée dans les documents des programmes et de la DGPSA à un processus d'approbation plus efficace. L'accélération du processus d'examen des présentations de médicaments vétérinaires devrait faciliter l'accès aux nouveaux médicaments vétérinaires, qui sont censés avoir des qualités souhaitables permettant d'améliorer les résultats de la pharmacothérapie vétérinaire. Au cours des dernières années, tel qu'il a été expliqué à la section 4.3.3, la DMV a fait de gros progrès en ce qui concerne l'efficacité et la rapidité avec lesquelles les présentations sont examinéesNote de bas de page 31.
Bien que ces améliorations étayent la conclusion selon laquelle l'accès rapide aux nouveaux médicaments vétérinaires s'est amélioré, il n'en découle pas une amélioration de l'innocuité et de l'efficacité. Par ailleurs, il n'est pas nécessairement évident que l'amélioration de l'innocuité et de l'efficacité des médicaments vétérinaires relève du mandat de Santé Canada tel qu'il est actuellement défini. On pourrait soutenir, en effet, que ce mandat se limite à veiller à ce que les produits dont la vente est approuvée au Canada sont sûrs et efficaces.
4.4.3. Conformité de l'industrie avec les exigences
En général, l'industrie respecte très bien les LMR et se conforme aussi très bien aux exigences relatives aux BPF. Cependant, en raison du passage à des rapports combinant les inspections visant les médicaments vétérinaires et celles visant les médicaments à usage humain, il est difficile de discerner clairement les tendances en ce qui concerne la conformité aux BPF dans le secteur des médicaments vétérinaires en particulier. En tant qu'organisme de réglementation des médicaments vétérinaires, Santé Canada devrait pouvoir continuer à produire des rapports séparés sur la manière dont l'industrie des médicaments vétérinaires respecte la réglementation. Si l'on accordait une plus grande place aux résultats en matière de conformité dans les rapports, on saurait mieux si l'industrie se conforme aux exigences.
À court terme, on s'attend à ce que les activités de Santé Canada poussent l'industrie à mieux respecter les exigences réglementaires applicables aux médicaments vétérinaires. Dans deux domaines - le respect des LMR et la conformité avec les exigences relatives aux BPF - il existe des données indiquant que le niveau de conformité de l'industrie est généralement élevé. Toutefois, rien ne prouve qu'il y ait une conformité accrue avec les exigences réglementaires de Santé Canada.
Par exemple, les données du Programme national de surveillance des résidus chimiques (PNSRC) de l'ACIA montrent qu'au cours d'une période de trois ans, de 2005-2006 à 2007-2008, environ 99 % des échantillons analysés (œufs, produits laitiers, miel et viande) étaient conformes aux LMR (ACIA, 2006b, 2008a, 2011c)Note de bas de page 32. Néanmoins, les données d'autres programmes de surveillance de la conformité de l'ACIA indiquent des niveaux de conformité quelque peu inférieursNote de bas de page 33 :
- De 1995-1996 à 2006-2007, dans le cadre de la Vérification des garanties des substances médicatrices, l'ACIA a découvert que les taux de conformité étaient en moyenne de 58 % pour les fabriques d'aliments à la ferme et de 78 % pour les meuneries commerciales; autrement dit, en moyenne 42 % et 22 %, respectivement, des échantillons d'aliments médicamentés analysés pendant cette période contenaient des ingrédients médicamentés dont la teneur dépassait les teneurs garanties (ACIA, s.d.-a).
- De 1991-1992 à 2006-2007, dans le cadre du programme d'inspection de la contamination par des résidus de médicaments, l'ACIA a découvert qu'environ 20 %, en moyenne, des aliments non médicamentés fabriqués dans des meuneries commerciales et dans des fabriques d'aliments à la ferme avaient été contaminés involontairement par des résidus de médicaments (ACIA, s.d.-b)Note de bas de page 34.
Comme l'ACIA l'a constaté, lorsque des médicaments sont administrés à des teneurs supérieures à la teneur voulue, ils peuvent devenir toxiques pour les animaux d'élevage ou produire des niveaux inacceptables de résidus dans les produits animaux. En revanche, lorsque des médicaments sont administrés à des teneurs inférieures à la teneur voulue, ils peuvent devenir inefficaces et contribuer au développement d'une RAM (ACIA, s.d.-a). Pareillement, une contamination involontaire peut entraîner des niveaux inacceptables de résidus de médicaments dans les aliments (ACIA, s.d.-b).
Selon certaines indications, le niveau de conformité de l'industrie avec les exigences relatives aux BPF est généralement élevé.Le nombre des inspections nationales des BPF entreprises par l'Inspectorat de 2003-2004 à 2010-2011 et les résultats de ces inspections sont indiqués dans le tableau 2 ci-après. Il est difficile de discerner des tendances concernant la conformité aux BPF en raison de changements apportés à la méthode de préparation des rapports et un manque de clarté concernant les données qui y sont présentées. Toutefois, il est possible de dire que la majorité des fabricants nationaux de médicaments vétérinaires étaient résolus à se conformer aux exigences relatives aux BPFde 2003-2004 à 2006-2007.
Les informateurs clés de Santé Canada ont signalé que, en règle générale, le taux de conformité résultant des inspections de médicaments pharmaceutiques (médicaments à usage humain et médicaments vétérinaires) était de l'ordre de 90 % à 95 % au fil des ans. Ils ont aussi indiqué que la conformité à la réglementation dans le secteur des médicaments vétérinaires était similaire à celle du secteur des médicaments à usage humain. Toutefois, depuis le passage à des rapports combinant les inspections des BPF des médicaments vétérinaires et à celles des médicaments à usage humain en 2007-2008, il est difficile de juger du niveau de conformité aux BPF dans le secteur des médicaments vétérinaires en particulier.
| Année financière | Nombre d'inspectionsNote de bas de page ** | Conformes | Conformes avec conditions | Non conformes | Taux de conformité (%)Note de bas de page ** |
|---|---|---|---|---|---|
| 2003-2004 | 30 | 22 | S.O. | 7 | 76 % |
| 2004-2005 | 40 | 37 | S.O. | 3 | 93 % |
| 2005-2006 | 43 | 39 | 1 | 5 | 91 % |
| 2006-2007 | 40 | 34 | 7 | 3 | 85 % |
| 2007-2008 | S.O. | S.O. | S.O. | S.O. | S.O. |
| 2008-2009 | Note de bas de page * 21 | Note de bas de page ˆ 20 | 1 | 95 % | |
| 2009-2010 | Note de bas de page * 31 | S.O. | S.O. | S.O. | S.O. |
| 2010-2011 | 27 | S.O. | S.O. | S.O. | S.O. |
Sources : Inspectorat (2004, 2005b, 2006, 2007c, 2008, 2009b, 2010b, 2010c). Données pour 2010-2011 fournies par Santé Canada. |
|||||
La méthode de regroupement employée par Santé Canada pour les rapports sur la conformité diffère de la méthode employée par la FDA aux États-Unis. Cette dernière sépare les rapports de conformité; elle en produit un pour chaque centre chargé de la réglementation d'une catégorie de produits. Ainsi, la FDA communique les données sur la conformité séparément pour le centre de médecine vétérinaire (médicaments vétérinaires), le centre chargé de l'évaluation des médicaments et de la recherche (médicaments à usage humain), le centre chargé de l'évaluation des produits biologiques et de la recherche (produits biologiques), et ainsi de suite (FDA, 2013). Par ailleurs, en vertu du plan de travail sur les bonnes pratiques de fabrication, mesure du Conseil de coopération Canada- États-Unis en matière de réglementation, Santé Canada et la FDA visent à « améliorer la collaboration en matière de conformité et d'application par une confiance réciproque accrue dans les rapports d'inspection fondée sur les bonnes pratiques de fabrication (BPF) », pour adopter en définitive « un cadre de travail continu » qui pourrait comprendre, entre autres éléments, une « base de données commune sur les BPF servant de dépôt commun pour favoriser le partage uniformisé des rapports d'inspection fondée sur les BPF », un « échange systématique de rapports/données d'inspection pour réduire le nombre d'inspections faisant double emploi » et des « inspections conjointes entreprises de firmes choisies » (Groupe de travail sur les produits d'hygiène personnelle et les produits pharmaceutiques du Conseil de coopération en matière de réglementation, 2012). Il semble que pour atteindre ces objectifs il faudra une méthode commune pour l'établissement des rapports sur la conformité.
Les données existantes sur la conformité liées aux médicaments vétérinaires indiquent ce qui suit.
- Relativement peu de rappels de médicaments vétérinaires concernent des dangers de type I, la catégorie la plus élevée attribuée par Santé CanadaNote de bas de page 35. Les données concernant les rappels de médicaments vétérinaires effectués de 2003-2004 à 2010-2011 indiquent que des 57 rappels décidés :
- 8,7 % concernaient des dangers de type I, c'est-à-dire qu'en cas d'utilisation du produit rappelé ou d'exposition à ce produit, la probabilité qu'il entraîne des effets néfastes importants pour la santé, voire la mort, était relativement élevée.
- 43,8 % concernaient des dangers de type II, c'est-à-dire que l'utilisation du produit rappelé ou l'exposition à ce produit peut entraîner des effets nocifs temporaires sur la santé ou que la probabilité d'effets nocifs graves est faible.
- 42,0 % concernaient des dangers de type III, c'est-à-dire que l'utilisation du produit rappelé ou l'exposition à ce produit n'est pas censée avoir des conséquences indésirables pour la santé.
- De 2003-2004 à 2006-2007, il n'y a eu que sept mesures de conformité (autres que des rappels) liées à des médicaments vétérinaires; toutes ces mesures ont été prises volontairement par la partie réglementée. Il n'y a pas eu de cas répertoriés où Santé Canada aurait pris des mesures d'application de la loi, telles que des saisies ou des poursuites.
- Dans le cadre du Programme de l'intégrité des frontières, l'ASFC renvoie les cargaisons qui pourraient contenir des produits de santé non conformes à l'Inspectorat, qui les inspecte et détermine s'ils sont admissibles. Bien que l'on n'ait pas les données de 2007-2008 à 2008-2009, les données de 2004-2005 à 2006-2007, de 2009-2010 et de 2010-2011 montrent que pendant ces années, l'Inspectorat a recommandé le refus de 17 % à 43 % des cargaisons. En 2009-2010 et en 2010-2011, 3 % (n=9) des cargaisons inspectées contenaient des produits de contrefaçon et leur admission a été refusée pour cette raison.
On trouvera des renseignements détaillés sur le nombre de mesures de vérification de la conformité, de rappels et de recommandations relatives aux frontières à l'annexe C. Toutefois, ces mesures sont de faibles indicateurs de la conformité de l'industrie, étant donné que de nombreux facteurs pourraient influer sur les tendances dans ces domaines et qu'il est difficile de tenir compte de tous les facteurs qui pourraient y contribuer. Par conséquent, il est possible d'interpréter les tendances observées soit comme un signe de la réussite, soit comme un signe de l'échec de la méthode de Santé Canada en matière de réglementation. Par exemple, une augmentation au fil du temps du nombre annuel de rappels peut être interprétée soit comme le signe qu'il y a un plus grand nombre de produits dangereux sur le marché (c'est-à-dire une baisse de la conformité), soit comme une sensibilisation accrue de l'industrie à l'obligation de retirer du marché les produits dangereux (c'est-à-dire une augmentation de la conformité). Pour ces raisons, les données sur les mesures de vérification de la conformité, les rappels, les recommandations relatives aux frontières et les indicateurs similaires des activités de l'Inspectorat ou de ce qu'il produit ne devraient pas servir à tirer des conclusions sur la conformité.
4.4.4 Adoption de comportements sûrs
Des données probantes indiquent que le secteur agricole canadien se livre à des pratiques dangereuses, y compris l'emploi d'agents antimicrobiens, l'importation pour approvisionnement personnel ainsi que l'importation directe et l'utilisation d'ingrédients pharmaceutiques actifs, bien que l'ampleur du problème fasse encore l'objet d'un débat. Les effets du PMV sur le comportement des utilisateurs finaux de médicaments sont un domaine qui pourra faire l'objet de recherches à l'avenir.
À moyen terme, on s'attend à ce que les activités du PMV aboutissent à l'adoption de comportements sûrs par les intervenants externes en ce qui concerne l'emploi des médicaments vétérinaires. En raison de l'absence de données sur l'usage des médicaments vétérinaires, il est difficile de tirer des conclusions sur la mesure dans laquelle ce résultat a été atteint. Les données probantes dont on dispose sont inégales.
La revue de la littérature a permis de trouver des données probantes indiquant que des pratiques dangereuses sont employées dans l'agriculture canadienne, en particulier l'usage d'agents antimicrobiens. Par exemple, on a signalé dans un rapport publié récemment dans un bulletin de surveillance du PICRA une nouvelle tendance (prévalence >10 %) de Campylobacter résistante à la ciprofloxacine dans la viande de poulets vendus au détail en Colombie-Britannique et en Saskatchewan (PICRA, 2011, p. 1). La ciprofloxacine est une fluoroquinolone antimicrobienne, un agent de catégorie I de très grande importance pour la médecine humaine (ASPC, 2011, p. 96). Selon le bulletin, on peut déduire de ces constatations qu'il y a utilisation d'enrofloxacine en dérogation des directives de l'étiquette chez des troupeaux de poulets reproducteurs à griller pour traiter les infections à Salmonella (PICRA, 2011, p. 2).
Pareillement, bien que le PICRA signale, au moyen de données fournies par l'ICSA sur le volume d'agents antimicrobiens distribué par ses membres au CanadaNote de bas de page 36, une réduction importante de l'utilisation des fluoroquinolones (de très grande importance pour la médecine humaine), des lincosamides (de grande importance pour la médecine humaine) et des tétracyclines (de moyenne importance pour la médecine humaine) de 2006 à 2008, pendant la même période, l'utilisation des aminoglucosides (de très grande à grande importance), ainsi que des triméthoprimes et des sulfamides (tous les deux de grande à moyenne importance) a beaucoup augmenté (ASPC, 2009, p. 64-65, 2010, p. 67-68, 2011, p. 82-83).
Ces données comportent de nombreuses limites, y compris les changements dans la manière de regrouper les différents agents antimicrobiens, la période relativement courte pour laquelle il existe des données et le fait que l'utilisation ne correspond pas forcément à la distribution (ASPC, 2011, p. 82). Et, fait sans doute le plus important, ces données ne contiennent pas d'indications sur l'importation pour usage personnel (IUP) ou sur les ingrédients pharmaceutiques actifs (IPA) employés dans les préparations. L'ICSA estime qu'environ le tiers des médicaments vétérinaires utilisés au Canada sont importés (Handa et Webster, 2009, p. 914). Handa et Webster (2009) signalent aussi que de grosses quantités d'agents antimicrobiens sont importées d'outre-mer et qu'il se peut qu'ils soient employés sans la surveillance d'un vétérinaire dans certaines fermes industrielles (p. 915-916).
D'un autre côté, des données probantes indiquent également que l'emploi dangereux d'agents antimicrobiens dans l'élevage au Canada est relativement limité. Par exemple, Gow et Waldner (2009) ont déterminé que l'utilisation de médicaments chez 203 troupeaux de bovins de l'Ouest canadien pendant la saison du vêlage était essentiellement thérapeutique et que relativement peu d'animaux recevaient des traitements avec des médicaments antimicrobiens. Les agents antimicrobiens les plus communément employés dans ces troupeaux étaient des antibiotiques d'importance moyenne pour la médecine humaine, bien qu'on ait aussi observé une utilisation de médicaments en dérogation des directives de l'étiquette limitée pour des fluoroquinolones et des céphalosporines. Une autre étude de l'emploi d'agents antimicrobiens dans 24 élevages de bovins en Ontario a permis de déterminer que moins d'un pour cent des agents antimicrobiens que les participants utilisaient étaient des agents de grande importance pour la médecine humaine, alors que 78 % des antibiotiques employés étaient des agents de faible importance pour la médecine humaine (Carson, Reid-Smith, Irwin, Martin, et McEwen, 2008, p. 115). En bref, bien que d'évidence des agents antimicrobiens soient utilisés de manière dangereuse dans l'élevage au Canada, l'ampleur du phénomène est discutable.
Les intervenants qui ont participé à la présente évaluation avaient des opinions partagées concernant la question suivante : Dans quelle mesure les utilisateurs finaux de médicaments ont-ils adopté des comportements sûrs en raison des activités de Santé Canada? Certains des informateurs clés externes sont d'avis que les vétérinaires et les éleveurs emploient les médicaments vétérinaires d'une manière plus sûre, soulignant que la sensibilisation à l'égard de problèmes comme la RAM et les délais d'attente s'était accrue, que certains vétérinaires parlent de la bonne utilisation des antibiotiques avec leurs collègues, et que les éleveurs mettent en œuvre des systèmes de surveillance dans les exploitations agricoles. De plus, on a constaté que les associations de l'industrie utilisent la classification dont se sert la DMV pour les médicaments antimicrobiens afin de préparer des documents d'orientation pour les vétérinaires.
Cependant, d'autres croient que l'utilisation des médicaments vétérinaires n'a pas changé et qu'il y a toujours des pratiques dangereuses. Comme exemples, les informateurs clés externes ont cité l'IUP et l'utilisation directe d'IPA, ainsi que l'utilisation de produits antimicrobiens en vente libre sans surveillance vétérinaire. De plus, des craintes ont été exprimées en ce qui concerne une nouvelle pratique de « groupage » que l'on voit dans certaines provinces où les fabricants de médicaments vendent des « lots » de médicaments vétérinaires aux éleveurs à prix réduit. Cette pratique pourrait entraîner une utilisation inappropriée ou inutile de médicaments vétérinairesNote de bas de page 37.
On a constaté une répartition semblable chez les utilisateurs finaux de médicaments qui ont été interrogés, un tiers indiquant que les politiques de Santé Canada et les communications sur les risques du Ministère avaient influé sur la manière dont ils exerçaient la médecine vétérinaire ou sur leur utilisation des médicaments vétérinaires, ou les deux. Le reste des personnes interrogées avaient une opinion neutre, étaient en désaccord ou ne savaient pas.
4.4.5 Utilisation de données scientifiques et d'analyses risques-avantages
De manière générale, Santé Canada semble se servir régulièrement de données scientifiques et d'analyses risques-avantages pour éclairer la prise de décisions. Récemment, le Ministère a commencé à mettre en œuvre des réformes réglementaires pour s'attaquer à l'importation pour approvisionnement personnel et à l'utilisation d'ingrédients pharmaceutiques actifs.
À moyen terme, les responsables du PMV pensent que Santé Canada fera une utilisation accrue des données scientifiques et d'analyses risques-avantages pour prendre des décisions éclairées. De manière générale, Santé Canada semble se servir régulièrement de données scientifiques et d'analyses risques-avantages pour éclairer la prise de décisions. Récemment, le Ministère a commencé à mettre en œuvre des réformes réglementaires pour s'attaquer à l'importation pour approvisionnement personnel et à l'utilisation d'ingrédients pharmaceutiques actifs.
L'utilisation de données scientifiques et d'analyses risques-avantages est officiellement intégrée dans le processus décisionnel de Santé Canada. Le Cadre décisionnel de Santé Canada pour la détermination, l'évaluation et la gestion du risque pour la santé fournit une méthode pour la prise de décision dans laquelle l'analyse du risque et les activités de gestion sont des éléments essentiels (Santé Canada, 2001a). On présume que le cadre sert à guider le processus décisionnel du PMV, bien qu'il n'ait pas été possible au cours de l'évaluation d'établir s'il est utilisé régulièrement en pratique.
Santé Canada a créé un certain nombre de groupes consultatifs composés d'experts et de scientifiques qui le conseillent pour la préparation de la réglementation et des politiques dans divers domaines (pour voir un aperçu de ces groupes et de leurs activités, consulter l'annexe C). D'après la liste des membres de ces groupes, on y retrouve des personnes qui ont fait de longues études et suivi beaucoup de formation sur les sujets étudiés. La composition est relativement bien équilibrée, car les groupes comprennent des universitaires, des représentants de l'ACMV et de l'ICSA, ainsi que des représentants des groupes de producteurs, des associations de consommateurs, des provinces et du gouvernement fédéral. Il semble qu'il ait eu moins d'universitaires dans le CCE-PSNV et le Groupe de travail sur l'IUP que dans les autres groupes (Santé Canada, 2009; Groupe de travail sur l'IUP, 2008)Note de bas de page 38.
Santé Canada s'est servi des recommandations de plusieurs groupes consultatifs d'experts pour guider la préparation des politiques et de la réglementation. Par exemple :
- Le CCE sur l'évaluation des risques de résistance aux antimicrobiens a donné des conseils pour la préparation d'un document de catégorisation des risques antimicrobiens.
- Le CCE-PSNV a préparé une définition des produits de santé naturels vétérinaires; on s'est servi de ses recommandations pour mettre sur pied le Programme pilote de déclaration provisoire pour les produits vétérinaires de santé à faible risque (PVSFR).
- Les recommandations du comité consultatif sur l'UMDDE ont été utilisées pour créer la politique sur l'utilisation de médicaments en dérogation des directives de l'étiquette.
Néanmoins, dans certains cas, Santé Canada n'a pas suivi, ou n'a pas suivi complètement, les recommandations faites par les comités consultatifs d'experts ou de scientifiques. Par exemple, Santé Canada n'a pas entièrement donné suite à plusieurs des recommandations faites en 2002 par le Comité consultatif d'experts sur l'utilisation d'antimicrobiens pour les animaux et les conséquences pour la résistance et la santé humaine, y compris faire en sorte que tous les agents antimicrobiens employés pour le traitement et le contrôle des maladies ne soient vendus que sur ordonnance et changer les politiques sur l'usage des agents antimicrobiens pour stimuler la croissance. Par ailleurs, dans son combat contre l'IUP, Santé Canada n'a pas arrêté l'importation directe d'IPA antimicrobiens, ni l'importation des agents antimicrobiens qui non pas été évalués et homologués par de Santé Canada. Lors d'une conférence organisée récemment sur la gérance des agents antimicrobiens, des intervenants des milieux scientifiques et de l'industrie ont critiqué Santé Canada parce que le Ministère ne s'est pas encore attaqué à l'IUP et aux IPA (Prescott et coll., 2012). Tel qu'il a déjà été souligné, les informateurs clés de Santé Canada ont indiqué que le Ministère continue de travailler sur les mesures qu'il prendra à l'égard la RAM et que, en raison de leur complexité, les questions de l'IUP et de l'utilisation d'IPA seront traitées dans un nouveau cadre de réglementation des médicaments vétérinaires (voir la section 4.3.2).
Comme cela a déjà été souligné, les exigences de Santé Canada en matière d'information pour l'examen préalable à la mise en marché des nouveaux médicaments vétérinaires semblent être complexes et détaillées, et elles comprennent la prise en compte des données post-commercialisation d'autres pays. Étant donné que Santé Canada est en train d'adopter une méthode davantage axée sur les risques pour la réglementation, il a commencé à mettre en œuvre des moyens pour simplifier les exigences en matière de données pour les produits à risques moins élevés (voir l'exposé de la section 4.3.3). En ce qui concerne la surveillance post-commercialisation, les informateurs clés de Santé Canada ont signalé que les réactions indésirables des médicaments et les signaux liés à l'innocuité font l'objet d'une surveillance et qu'ils servent à éclairer la prise de décisions.
Les évaluateurs n'ont pas reçu de données de surveillance post-commercialisation ou de renseignements sur les mesures prises par Santé Canada à la suite des signaux relevés qu'ils avaient demandés. Cependant, parmi les sources accessibles au public, on a trouvé plusieurs exemples de décisions prises par Santé Canada en réaction aux données sur l'innocuité recueillies après la mise en marché.
- Après avoir analysé minutieusement les rapports sur les réactions indésirables qui auraient été causées au Canada par ProHeart®6, médicament injectable à libération prolongée approuvé pour protéger les chiens de la dirofilariose, Santé Canada a recommandé que le fabricant du produit modifie l'étiquette pour tenir compte des préoccupations relativement à l'innocuité et prévienne les vétérinaires de ces modifications (DMV, 2006c).
- Après avoir eu connaissance des risques pour la santé humaine liés à l'injection accidentelle du médicament vétérinaire Micotil® (antibiotique vétérinaire macrolide), la DMV a collaboré avec le fabricant du médicament pour modifier la notice du médicament et elle a publié des avis destinés à la fois aux vétérinaires et aux hôpitaux donnant des consignes pour une manipulation sûre du médicament et des recommandations pour le traitement des effets cardiaques chez l'humain en cas d'injection accidentelle (Santé Canada, 2003a, 2004a).
De plus, les représentants de Santé Canada ont indiqué qu'en 2005 la DMV avait inclus des restrictions concernant l'UMDDE sur toutes les étiquettes de ceftiofur après que le PICRA eut signalé avoir des données de surveillance de la RAM indiquant une résistance accrue des isolats de Salmonella, résistance découverte dans des poulets vendus au détail pour lesquels, on le présume, le médicament aurait été utilisé en dérogation des directives de l'étiquette.
Il existe de nombreux cas documentés d'ERS préparées par la DMV à la suite de la découverte de risques particuliers pour la santé humaineNote de bas de page 39.
- Dans un texte sur le vert de malachite affichée sur le site Web de l'ACIA, on mentionne que la leucobase du vert de malachite, un métabolite du vert de malachite, serait cancérigène. Dans une ERS qu'il a effectuée, Santé Canada a déterminé que « le risque que pourrait comporter la consommation de poisson dont les concentrations de résidus de vert de malachite ou de leucobase du vert de malachite atteignent au plus 1,0 partie par milliard (partie x 109) est faible, même si l'on en consomme quotidiennement tous les jours de sa vie » (ACIA, 2006a).
- Dans une FAQ concernant la menace que représente le chloramphénicol dans le miel importé de la Chine, on indique que, après que des traces de ce produit ont été trouvées dans du miel analysé pour détecter des résidus de médicaments, Santé Canada a fourni les résultats d'une ERS indiquant que le miel présentait un risque faible mais grave pour la santé. Il a donc été recommandé que les produits retenus ne soient pas vendus au Canada, que les produits qui pourraient être concernés soient rappelés et que les risques pour la santé soient communiqués aux consommateurs (DMV, 2004b).
- Dans une ERS demandée par l'ACIA pour du bétail destiné à l'abattage que l'on avait nourri avec un mélange de substances médicatrices, dont certaines n'étaient pas homologuées pour le bétail, la DMV a indiqué qu'il existait de nombreuses incertitudes liées à la combinaison des divers médicaments approuvés aux niveaux recommandés et à des niveaux plus élevés, ainsi qu'à la présence de médicaments non approuvés dans la ration alimentaire du bétail (DMV, 2007e). Par conséquent, il était impossible de prévoir quels pourraient être les risques pour la santé humaine en cas de consommation de la viande de ce bétail. Par précaution, la DMV a recommandé que le bétail en question ne soit pas abattu à des fins de consommation humaine pendant 50 jours.
Environ la moitié des utilisateurs finaux de médicaments et un peu plus d'un tiers des répondants de l'industrie ont convenu que les politiques et la réglementation de Santé Canada sont fondées sur les meilleures données scientifiques existantes et une analyse des risques convenable.
4.4.6 Intervention rapide du système de règlementation à l'égard des risques cernés
Bien qu'il n'y ait pas suffisamment de données probantes appuyant des conclusions générales concernant la mesure dans laquelle le PMV réagit rapidement aux risques cernés, il existe quelques exemples de problèmes de longue date pour lesquels Santé Canada n'a encore rien fait par voie de modifications aux politiques ou à la réglementation.
À moyen terme, on s'attend à ce que les activités du PMV mènent à une intervention réglementaire rapide à l'égard des risques cernés. Bien qu'il n'y ait pas suffisamment de données probantes pour soutenir des conclusions générales en ce qui concerne ce résultat, il existe quelques exemples de problèmes de longue date pour lesquels Santé Canada n'a encore rien fait par voie de modifications aux politiques ou à la réglementation.
La méthode la plus systématique pour répondre à la question consisterait à calculer le temps qu'il a fallu à Santé Canada pour réagir par voie de politiques ou de réglementation à partir du moment où il a découvert les risques en question. Bien que l'on ait décrit ci-dessus plusieurs exemples de l'intervention de Santé Canada après avoir découvert des risques particuliers (p. ex. les effets néfastes pour la santé des animaux causés par l'utilisation de ProHeart®6, et la présence de résidus de chloramphénicol dans du miel importé de la Chine), il n'y avait pas suffisamment d'information dans les documents fournis pour déterminer le temps qui s'est écoulé entre la découverte des risques et l'intervention. Même si l'on était en possession de cette information pour ces cas-là, il ne s'agirait que d'exemples, et cela ne serait pas nécessairement indicatif de la rapidité d'intervention globale du PMV. Ce qui complique d'autant plus l'analyse de la rapidité d'intervention de Santé Canada, c'est qu'il est difficile de déterminer avec exactitude le moment où les risques ont été découverts et quand le Ministère est jugé avoir réagi, et qu'il n'y a pas de normes de rendement auxquelles l'intervention de Santé Canada peut être comparéeNote de bas de page 40. Pour ces raisons, on ne peut pas évaluer la rapidité d'intervention globale de Santé Canada en présence de risques.
Cela dit, il est clair que Santé Canada n'a pas modifié la réglementation pour remédier à deux problèmes qui ont été reconnus au moins depuis dix ans pour les risques qu'ils présentent pour la santé humaine et animale et envers la sûreté de l'approvisionnement alimentaire, à savoir la pratique courante d'importer des médicaments vétérinaires non approuvés pour usage personnel et l'utilisation directe d'IPA. Tel qu'il a été expliqué à la section 4.3.2, il est évident que cela n'est pas dû au fait que Santé Canada n'aurait pas reconnu ces risques ou tenté de changer la réglementation, au moins en ce qui concerne l'IUP. Par conséquent, d'autres facteurs pourraient expliquer l'absence de progrès dans ce domaine. Selon les informateurs clés de Santé Canada, un nouveau cadre de réglementation des médicaments vétérinaires, qui se trouve actuellement à l'étape de la consultation publique, va permettre de remédier à l'IUP et à l'utilisation d'IPA.
Une minorité de répondants aux enquêtes menées auprès de l'industrie et des utilisateurs finaux de médicaments sont d'avis que Santé Canada est intervenu rapidement à l'égard des risques cernés au cours des dix dernières années.
4.4.7 Harmonisation internationale
Les responsables du PMV s'efforcent d'obtenir une plus grande harmonisation internationale et ils ont fait des progrès dans certains domaines. Cependant, rien ne permet de soutenir des conclusions concernant les effets de cette harmonisation sur la santé humaine ou la salubrité des aliments.
À moyen terme, on s'attend à ce que les activités du PMV permettent une meilleure harmonisation internationale des exigences réglementaires pour les médicaments vétérinaires. En définitive, une meilleure harmonisation devrait contribuer à l'amélioration de la santé des Canadiens et la salubrité accrue de l'approvisionnement alimentaire. L'évaluation a permis de trouver des données probantes indiquant que les responsables du PMV se sont efforcés d'obtenir une plus grande harmonisation internationale et qu'ils ont fait des progrès dans certains domaines. Cependant, rien ne permet de soutenir des conclusions concernant les effets de cette harmonisation sur la santé humaine ou la salubrité des aliments.
La Direction des produits thérapeutiques (DPT) de Santé Canada, qui joue un rôle semblable à celui de la DMV en ce qui concerne les produits pharmaceutiques et les instruments médicaux destinés aux humains, définit l'harmonisation comme étant « l'élaboration, l'adoption et la mise en œuvre de normes techniques internationales relativement à la mise au point, à l'homologation et au contrôle des produits pharmaceutiques et des matériels médicaux » ainsi que « la convergence des pratiques et des processus réglementaires » (DPT, 2004, p. 9-10). En gardant cette définition à l'esprit, voici certaines des activités d'harmonisation internationale du PMV :
- participer à la Coopération internationale pour l'harmonisation des exigences techniques s'appliquant à l'enregistrement des produits médicaux vétérinaires (VICH) en prenant part à diverses réunions de la VICH, ainsi qu'à des groupes de travail; adoption de 37 normes de la VICH jusqu'à présent (Santé Canada, 2003c);
- participer à la Commission du Codex Alimentarius, qui « met au point des normes alimentaires, des lignes directrices et des codes d'usages visant à protéger la santé des consommateurs et à assurer des pratiques loyales dans le commerce des aliments » (Commission du Codex Alimentarius, 2012); parmi les contributions de la DMV au Codex Alimentarius figurent :
- participer aux réunions du Comité du Codex sur les résidus de médicaments vétérinaires dans les aliments (CCRVDF) et du Groupe intergouvernemental spécial du Codex sur la résistance aux antimicrobiens;
- rédiger des documents indiquant la position du Canada au CCRVDF et diriger un groupe de travail électronique du CCRVDF sur l'extrapolation des LMR dans les espèces et les tissus;
- diriger les contributions de la délégation canadienne au Groupe intergouvernemental spécial du Codex sur la résistance aux antimicrobiens, qui a créé et révisé les lignes directrices du Codex pour l'analyse des risques liés à la résistance aux antimicrobiens d'origine alimentaire;
- signer des protocoles d'entente (PE) et des accords semblables sur l'échange d'information et la coopération en matière de réglementation avec les organismes de réglementation des médicaments vétérinaires d'autres pays, y compris l'Australie, la Suisse, la Nouvelle-Zélande, le Royaume-Uni et la France; il existe également des PE sur l'échange d'information avec la FDA des États-Unis et l'Agence européenne des médicaments pour les produits thérapeutiques en général.
- établir des PE avec divers organisations et organismes internationaux pour entreprendre des activités de recherche, y compris le Friedrich-Loeffler Institute et l'institut des nouvelles maladies infectieuses en Allemagne et le Prion Research Group en Australie.
- organiser un projet pilote avec la FDA des États-Unis sur l'examen parallèle des parties techniques des présentations de médicaments pour les animaux de compagnie; la première approbation simultanée d'une demande de médicament vétérinaire dans le cadre du processus d'examen parallèle a été annoncée le 14 décembre 2012.
- s'efforcer de créer une liste de priorité pour les médicaments à ULEM destinés aux petits ruminants qui sont approuvés en Australie et aux États-Unis, et établir des protocoles pour échanger des rapports d'examen pour les médicaments ayant déjà fait l'objet d'un examen dans ces pays.
- participer à des activités internationales comme les réunions et les épreuves de compétence de la Pharmaceutical Inspection Convention, du Pharmaceutical Inspection Co-operation Scheme et des Laboratoires officiels de contrôle des médicaments.
Les mesures d'harmonisation de la réglementation comme celles-ci pourraient contribuer à l'amélioration de la santé humaine et de la salubrité de l'approvisionnement alimentaire, mais en l'absence d'éléments concrets, les bienfaits de l'harmonisation pour la santé et la sécurité sont plus théoriques que réels. Dans ce contexte, il importe de souligner que la dernière mesure d'harmonisation de la réglementation du plan d'action pour le Canada, le CCR - dans le cadre duquel Santé Canada et la FDA des États-Unis ont réalisé récemment le premier examen parallèle d'un médicament vétérinaire - ne garantit pas explicitement que les mesures prises par le CCR concernant les produits de santé favoriseront la santé publique. Au lieu de cela, selon le plan d'action, ces mesures permettront de « réduire le dédoublement inutile des coûts pour les fabricants [...] de simplifier davantage le processus décisionnel en matière de réglementation, de limiter les délais requis pour la mise en marché des produits de santé et de soins personnels et, par le fait même, d'offrir un plus grand choix aux consommateurs sans compromettre l'innocuité, l'efficacité et la qualité des produits » (GC, 2011, p. 25).
4.4.8 Résultats à long terme
Il semble raisonnable de présumer que les activités du PMV ont contribué à réduire les risques pour la santé et les effets néfastes liés à l'emploi des médicaments vétérinaires, à améliorer la salubrité de l'approvisionnement alimentaire et à donner au public une plus grande confiance dans les médicaments vétérinaires, le système de réglementation connexe et l'approvisionnement alimentaire.
À long terme, on s'attend à ce que les activités du PMV contribuent à réduire les risques pour la santé et les effets néfastes liés à l'emploi des médicaments vétérinaires, à améliorer la salubrité de l'approvisionnement alimentaire au Canada et à donner au public une plus grande confiance dans les médicaments vétérinaires, le système de réglementation connexe et l'approvisionnement alimentaire. Il semble raisonnable de présumer que les activités du PMV ont eu une incidence dans ces domaines, même s'il est important de savoir qu'un grand nombre d'autres facteurs peuvent aussi influer sur ces résultats.
Les activités du PMV, comme l'approbation rapide de médicaments sûrs et efficaces, les interdictions de vente de certains produits employés pour les animaux destinés à l'alimentation pour lesquels aucun niveau de résidus n'est considéré sans danger, la gestion des résidus de médicaments dans les aliments, les mesures visant à influer sur l'usage d'agents antimicrobiens pour les animaux destinés à l'alimentation, la surveillance post-commercialisation et les activités relatives à la conformité, devraient théoriquement contribuer à la salubrité de l'approvisionnement alimentaire et réduire les risques pour la santé. Par exemple, l'interdiction d'utiliser certaines substances chez les animaux destinés à l'alimentation a sans aucun doute permis d'éviter des effets néfastes pour la santé humaine qui seraient survenus s'il n'y avait pas eu d'interdiction.
Cela dit, il existe des lacunes en matière de politique et de règlementation qui, si elles étaient comblées, contribueraient davantage à la réduction des risques et à la salubrité alimentaire. Plus précisément, l'utilisation directe d'IPA et l'importation de médicaments non homologués pour approvisionnement personnel peuvent présenter des risques plus graves pour la santé humaine et la salubrité alimentaire que les risques associés aux médicaments vétérinaires homologués. Récemment, Santé Canada a entamé le processus visant à résoudre les questions de l'IUP ainsi que de l'importation et de l'utilisation directe d'IPA en organisant des consultations avec les intervenants concernant une proposition de méthode de réglementation pour l'IUP et les IPA.
En ce qui concerne la confiance du public, selon plusieurs sondages d'opinion réalisés récemment, les Canadiens ont plutôt confiance dans le système de salubrité des aliments canadien : environ neuf personnes sur dix ont dit que le système leur inspire une confiance modérée ou élevée (CRA, 2012; Decima Research, 2010, p. 19-20; EKOS Research Associates Inc., 2010, p. 3; Léger Marketing, 2011, p. 15). Il s'agit d'une comparaison favorable avec les groupes de discussion réalisés à la fin 2007, dans lesquels les participants décrivaient leur confiance dans l'approvisionnement alimentaire comme étant « modérée et précaire » (Les Études de marché Créatec, 2007, p. 2). Selon le résumé d'une enquête récente sur l'opinion publique affiché sur le site Web de l'ACIA, la confiance des consommateurs a augmenté graduellement au cours des dernières années (ACIA, 2011d); les Canadiens approuveraient en général les normes et la réglementation canadiennes dans le domaine de la salubrité des aliments, et la confiance dans le gouvernement du Canada peut contribuer de manière importante à la confiance qu'ils ont dans le système de salubrité des aliments en soi.
En définitive, Santé Canada espère avoir un système de réglementation durable, rentable, adaptable et fondé sur des données scientifiques pour les médicaments vétérinaires au Canada. En raison du peu de renseignements en matière de finances et de ressources humaines, il est difficile de tirer des conclusions concernant la durabilité et la rentabilité du système, même si des données probantes indiquent que le PMV est devenu opérationnellement plus efficace ces dernières années et que diverses mesures ont été prises pour le rendre encore plus efficace (voir la section 4.5 pour obtenir des précisions à ce sujet). En ce qui a trait à l'adaptabilité et au fondement scientifique du système de réglementation, Santé Canada a fait des progrès évidents dans la manière de s'attaquer aux nouveaux problèmes et difficultés pendant la période visée par l'évaluation. Ainsi, il semble que le Ministère fonde un grand nombre de ses décisions relatives aux politiques et à la réglementation sur des données scientifiques et sur une analyse du risque. D'un autre côté, des améliorations sont encore possibles concernant certains problèmes de longue date (p. ex. l'IUP et les IPA).
4.4.9 Conséquences imprévues
Les évaluateurs ont trouvé peu de conséquences imprévues. Cependant, l'importation pour approvisionnement personnel et l'importation et l'utilisation directe d'ingrédients pharmaceutiques actifs entraînent l'emploi de médicaments vétérinaires non homologués au Canada.
Les évaluateurs ont trouvé peu de conséquences imprévues des activités de réglementation de Santé Canada relativement aux médicaments vétérinaires. Fait peut-être plus important, l'IUP ainsi que l'importation et l'utilisation directe d'IPA entraînent de fait l'emploi de médicaments vétérinaires non homologués au Canada. Certains des informateurs clés sont d'avis que ces pratiques existent parce que, si l'on compare le Canada à d'autres pays, la durée de l'examen des présentations de médicaments est plus longue, il est plus difficile de se procurer ces médicaments vétérinaires et leur coût est plus élevé. Ils ont suggéré qu'en s'attaquant à ces causes on pourrait réduire la fréquence d'utilisation de produits non homologuésNote de bas de page 41. Toutefois, comme cela a déjà été mentionné dans le présent rapport, les changements à la réglementation qui permettraient de remédier à l'IUP et d'interdire l'utilisation directe d'IPA sont largement soutenus.
4.5 Efficience et économie
En raison des changements apportés à la méthode de production de rapports financiers de la DGPSA pendant la période visée par l'évaluation, il est difficile de comparer et d'analyser ces renseignements au fil du temps. Il n'y a pas suffisamment d'information sur les finances et les ressources humaines pour effectuer une analyse de l'efficience et de l'économie. L'inclusion récente des médicaments vétérinaires dans les rapports financiers du grand Programme des médicaments compliquera l'analyse de l'efficience et de l'économie dans l'avenir; en outre, la DGPSA pourrait avoir des difficultés à comprendre l'affectation et l'utilisation des ressources pour les deux programmes.
En raison des changements apportés à la méthode de production de rapports financiers de la DGPSA pendant la période visée par l'évaluation, il est difficile de comparer et d'analyser ces renseignements au fil du temps. De plus, tel qu'il est expliqué ci-dessous, il n'y a pas suffisamment d'information sur les finances et les ressources humaines pour effectuer une analyse de l'efficience et de l'économie. Par conséquent, il n'a pas été possible lors de l'évaluation de déterminer la mesure dans laquelle les ressources du programme sont employées comme prévu, si les extrants du programme ont été produits avec efficience, ou si les résultats escomptés ont été produits économiquement.
Jusqu'à l'année financière 2007-2008, les rapports financiers étaient fondés sur la précédente AAP de Santé Canada. Dans la présente AAP, les activités liées aux médicaments vétérinaires sont classées dans l'activité de programme « Produits de santé et aliments ». Les sous-activités de programme étaient les suivantes :
- évaluation réglementaire avant la mise en marché et amélioration du processus;
- information, éducation et sensibilisation sur les produits de santé, les aliments et la nutrition;
- surveillance de l'innocuité et de l'efficacité thérapeutique et gestion du risque;
- transparence, responsabilité à l'égard du public, et relations avec les intervenants.
Dans la présente AAP, les rapports financiers étaient liés à ces quatre sous-activités de programme et à des sous-sous-activités qui représentent, à un niveau plus détaillé, les activités fonctionnelles exécutées par le personnel de Santé Canada dans le cadre des sous-activités. Cependant, il n'est pas possible d'associer cette information à ce qui, depuis 2008-2009, est considéré comme le PMV.
En 2007-2008, l'AAP de Santé Canada a été restructurée. Dans la nouvelle AAP, l'activité de programme pertinente est « Produits de santé », et les sous-activités de programme sont les suivantes :
- produits pharmaceutiques à usage humain;
- produits biologiques et radiopharmaceutiques;
- instruments médicaux;
- médicaments vétérinaires.
Les rapports financiers étaient liés à ces quatre sous-activités de programme de 2008-2009 à 2010-2011. Toutefois, en 2008-2009, la plupart des services internes de la DGPSA ont été affectés au PMV et Santé Canada n'a pas publié de renseignements financiers séparément pour le PMV. Au lieu de cela, les activités liées aux médicaments vétérinaires ont été intégrées au grand Programme des médicaments, qui comprend aussi les médicaments humains. Par la suite, on a mis en œuvre les modifications correspondantes à la structure de gouvernance du programme en 2012-2013 (comme cela est décrit dans la section 4.2). À partir de 2011-2012, dans la nouvelle structure de l'AAP, les activités liées aux médicaments vétérinaires ont été éliminées comme sous-activité de programme. Les activités du Programme des médicaments vétérinaires sont analysées dans deux sous-activités de programme de l'AAP, à savoir « Médicaments pharmaceutiques » et « Salubrité des aliments et nutrition ».
En raison de ces changements, il est difficile de dresser un tableau financier exact de ce qui est désormais considéré comme faisant partie du PMV sur toute la période visée par l'évaluation. Pour cette raison, on a indiqué dans le tableau 3 les dépenses totales du PMV seulement pour une période de deux ans, allant de 2009-2010 à 2010-2011. En 2011-2012, il n'y a pas eu de rapport sur les dépenses totales pour le PMV. Au lieu de cela, il y a eu un rapport sur les dépenses de la DMV; il était difficile d'établir quelle proportion de ces dépenses était précisément attribuable au PMV. De plus, il n'y avait pas d'information sur les dépenses des autres partenaires du PMV (l'Inspectorat, le BRP, la DGRO).
Selon les renseignements financiers plus récents fournis par la DGPSA (2013-2014), cette dernière a une capacité limitée lorsqu'il s'agit de produire des rapports financiers séparés pour les activités de la DMV liées à la salubrité des aliments et pour les activités liées aux médicaments vétérinaires (cela se limite aux salaires et aux dépenses de fonctionnement diverses). Cependant, l'information sur les dépenses liées aux médicaments vétérinaires des autres partenaires du PMV (comme l'Inspectorat, le BRP et la DGRO) n'a pas été fournie. Sans cette information, la DGPSA n'a pas une idée complète ou exacte des coûts totaux du PMV.
| Direction | 2009-2010 | 2010-2011 | ||||
|---|---|---|---|---|---|---|
| Sans revenus | Avec revenus | Revenus | Sans revenus | Avec revenus | Revenus | |
| Médicaments vétérinaires | 7 702 792 | 7 162 488 | 540 304 | 6 735 700 | 6 084 826 | 650 874 |
| Produits thérapeutiques | 4 080 | 4 080 | 0 | 4 030 | 4 030 | 0 |
| Inspectorat de la DGPSA | 24 298 | 24 298 | 0 | 3 511 | 3 511 | 0 |
| Produits de santé commercialisés | 3 870 | 3 870 | 0 | 24 | 24 | 0 |
| Sous-ministre adjoint | 726 000 | 726 000 | 0 | 840 000 | 840 000 | 0 |
| Produits biologiques et thérapies génétiques | 0 | 0 | 0 | 0 | 0 | 0 |
| Aliments | 0 | 0 | 0 | 0 | 0 | 0 |
| Secrétariat aux litiges sur les produits de santé et les aliments | 0 | 0 | 0 | 0 | 0 | 0 |
| Produits de santé naturels | 0 | 0 | 0 | 0 | 0 | 0 |
| Bureau de la politique et des programmes alimentaires | 0 | 0 | 0 | 0 | 0 | 0 |
| Bureau de la participation des consommateurs et du public | 0 | 0 | 0 | 0 | 0 | 0 |
| Politiques, planification et affaires internationales | 0 | 0 | 0 | 0 | 0 | 0 |
| Fonds d'obligations de la DGPSA | 0 | 0 | 0 | 0 | 0 | 0 |
| Région de la Colombie-Britannique, de l'Alberta, du Nunavut, des Territoires du Nord-Ouest | 315 | 315 | 0 | 0 | 0 | 0 |
| Région de l'Ontario | 2 574 | 2 574 | 0 | 57 223 | 57 223 | 0 |
| Région du Québec | 308 | 308 | 0 | 0 | 0 | 0 |
| Région de l'Atlantique | 0 | 0 | 0 | 0 | 0 | 0 |
| Région du Manitoba et de la Saskatchewan | 0 | 0 | 0 | 0 | 0 | 0 |
| Total pour le PMV | 8 464 236 | 7 923 932 | 540 304 | 7 640 488 | 6 989 614 | 650 874 |
Remarques
- Les chiffres ne comprennent pas ceux du BRP, mais ils comprennent ceux des régimes d'avantages sociaux des employés (RASE).
- Étant donné que les frais généraux n'ont pas de code au niveau des sous-programmes, les dépenses totales du PMV ne comprennent pas les frais généraux. Source : DGPSA
Étant donné que la majorité des dépenses du PMV est attribuée à la DMVNote de bas de page 42, on a pensé que l'on pourrait se servir des dépenses de la DMV en 2011-2012 pour estimer la taille du PMV cette année-là. Les résultats de l'analyse sont présentés dans le tableau 4. Les chiffres semblent indiquer que les dépenses de la DMV étaient de 1,3 million de dollars (revenus compris) en 2011-2012, ce qui représente une forte baisse par rapport à l'année financière précédente, lorsque les dépenses de la DMV (revenus compris) étaient d'environ 6,1 millions de dollars. Il n'y a pas d'explication claire pour cet écart; il pourrait s'agir d'une erreur ou d'un revirement dans la manière dont la DGPSA produit ses rapports financiers. On a constaté, néanmoins, que malgré des variations d'une année à l'autre, les revenus de la DMV ont baissé de 2009-2010 à 2011-2012.
Bref, les renseignements financiers dont on dispose ne permettent pas de dresser un tableau exact des dépenses totales du PMV au fil du temps.
Pareillement, il existe peu de renseignements sur les budgets du PMV. Par exemple, en 2010-2011 et 2011-2012, les rapports financiers au niveau des sous-activités de programme ne comprenaient pas les montants budgétaires. Ces derniers n'étaient indiqués qu'au niveau du programme (c.-à-d. Produits de santé et Salubrité des aliments et nutrition)Note de bas de page 43. Cela, combiné avec les changements de méthode pour le compte rendu des dépenses décrits ci-dessus, rend difficile la comparaison des montants budgétaires avec les dépenses réelles pour le PMV au fil du temps.
Selon les Services financiers de la DGPSA, à partir de 2013-2014, des codes seront attribués aux sous-programmes et aux programmes de l'AAP dans les budgets. Cependant, étant donné les récents changements à la structure de gouvernance de la DGPSA, on peut supposer que les rapports sur les dépenses prévues et les dépenses réelles pour les médicaments vétérinaires continueront d'être inclus dans les rapports financiers du grand Programme des médicaments. Bien que, tel qu'il a déjà été souligné, la DGPSA ne puisse pas vraiment isoler les coûts associés aux activités liées aux médicaments vétérinaires de la DMV de ceux des activités liées aux produits pharmaceutiques et des activités liées à la salubrité des aliments, il est important de savoir que le PMV n'est pas composé uniquement des activités de la DMV. Il est difficile de dire si la méthode utilisée actuellement par la DGPSA pour ses rapports financiers lui permet de dresser un tableau complet et exact du coût total du PMV.
| Programme | 2009-2010 | 2010-2011 | 2011-2012 | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Sans revenus | Avec revenus | Revenus | Sans revenus | Avec revenus | Revenus | Sans revenus | Avec revenus | Revenus | |
| Médicaments vétérinaires | 7 702 792 | 7 162 488 | 540 304 | 6 735 700 | 6 084 826 | 650 874 | 0 | 0 | 0 |
| Instruments médicaux | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Produits biologiques et radiopharmaceutiques | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Produits pharmaceutiques | 0 | 0 | 0 | 0 | 0 | 0 | 1 978 833 | 1 340 146 | 638 687 |
| Total partiel - Produits de santé | 7 702 792 | 7 162 488 | 540 304 | 6 735 700 | 6 084 826 | 650 874 | 1 978 833 | 1 340 146 | 638 687 |
| Frais généraux pour les produits de santé | 1 107 193 | 1 107 193 | 0 | 989 325 | 989 325 | 0 | 1 064 | 1 064 | 0 |
| Total - Produits de santé | 8 809 985 | 8 269 681 | 540 304 | 7 725 024 | 7 074 150 | 650 874 | 1 979 897 | 1 341 210 | 638 687 |
| Salubrité des aliments et nutrition | 0 | 0 | 0 | 73 333 | 73 333 | 0 | 4 889 859 | 4 889 834 | 25 |
| Total - Produits de santé et Salubrité des aliments et nutrition | 8 809 985 | 8 269 681 | 540 304 | 7 798 358 | 7 147 484 | 650 874 | 6 869 756 | 6 231 044 | 638 712 |
Remarque : Les chiffres ne comprennent pas ceux du BRP, mais ils comprennent ceux des RASE.
Source : DGPSA
Plusieurs autres lacunes en ce qui concerne les données limitent leur utilité pour l'analyse de l'efficience et de l'économie. Par exemple, il n'y a pas de renseignements sur le nombre d'équivalents temps plein (ETP) affectés au PMV pendant la période visée par l'évaluation. Les renseignements dont on dispose indiquent qu'entre 2000 et 2008 le nombre d'ETP à la DMV est passé de 16,52 à 70,38, mais on ne sait pas combien de ces ETP ont été affectés au PMV. Par ailleurs, on ignore combien d'ETP ont été affectés au PMV dans les autres directions de la DGPSA (comme l'Inspectorat). On n'a pas obtenu de renseignements plus récents.
Considération encore plus importante peut-être, il n'y a pas eu depuis 2008-2009 de rapports selon les activités fonctionnelles, prévues dans le cadre de l'ancienne AAP. Parmi les activités fonctionnelles (appelées également secteurs fonctionnels) figurent l'examen préliminaire, l'évaluation des produits, les nouvelles présentations, le contrôle et la surveillance ainsi que l'éducation et la sensibilisation. Ces rapports sont importants pour analyser l'efficience et l'économie parce qu'ils indiquent le temps passé par le personnel des programmes pour exécuter les diverses tâches ou activités. À ce titre, l'information est importante pour évaluer :
- l'efficience de la répartition des ressources, qui met l'accent sur la relation entre les ressources et les résultats;
- l'efficience opérationnelle, qui met l'accent sur la relation entre les ressources et les extrants;
- l'économie, qui met l'accent sur l'optimisation (y compris la réduction au minimum) de l'utilisation des ressources.
En bref, en raison des limites considérables au niveau des données, il n'a pas été possible d'évaluer la mesure dans laquelle les ressources du programme sont employées comme prévu, si les extrants du programme ont été produits efficacement, ou si les résultats escomptés ont été produits économiquement. Cela dit, des données probantes indiquent que l'efficacité des opérations s'est améliorée ces dernières années. Tel qu'il est expliqué à la section 4.3.3, le PMV a réussi à éliminer un arriéré important de présentations de drogues nouvelles ces dernières années et à réduire de manière draconienne le temps moyen nécessaire pour décider s'il faut ou non approuver de nouveaux médicaments. De plus, on a pris diverses autres mesures pour améliorer l'efficacité du processus d'examen préalable à la mise en marché, notamment l'introduction d'un processus spécial d'approbation pour les médicaments à ULEM et le Programme pilote de déclaration provisoire (PPDP) volontaire pour les produits vétérinaires de santé à faible risque (PVSFR), la simplification de l'examen des présentations de médicaments génériques et la mise à l'essai d'un projet d'examen parallèle avec la FDA des États-Unis. Étant donné qu'un grand nombre de ces changements sont plutôt récents, leur incidence sur l'efficience et l'économie du programme n'a pas encor été établie. De plus, s'il n'est pas possible de lier clairement les ressources financières et humaines à ces activités, il sera impossible de déterminer leur effet dans ces domaines.
Utiliser plus souvent les présentations électroniques, accepter les présentations ouvertes, accepter les dossiers de données remis par un organisme de réglementation étranger et se servir des examens étrangers devraient permettre d'obtenir des gains d'efficacité supplémentaires.
5. Conclusions et recommandations
La section qui suit présente un résumé des principales constatations issues de l'évaluation, ainsi que les conclusions et les recommandations formulées par les évaluateurs.
Pertinence
Les risques possibles pour la santé humaine liés à l'utilisation de médicaments vétérinaires chez les animaux destinés à l'alimentation et chez les animaux de compagnie découlant de la présence possible de résidus de médicaments vétérinaires dans les aliments, les risques associés à la RAM et l'exposition directe aux médicaments vétérinaires donnent à penser que Santé Canada doit poursuivre ses activités de réglementation de ces produits afin de protéger la santé de la population canadienne. Ce rôle correspond aux rôles et responsabilités du gouvernement fédéral et de Santé Canada, qui sont décrits dans les lois et règlements fédéraux, et cadre directement avec le résultat stratégique de Santé Canada « les Canadiens sont informés et protégés des risques pour la santé que présentent les aliments, les produits, les substances et les environnements ». De plus, les activités du PMV s'harmonisent parfaitement aux priorités fédérales de renforcer la salubrité des aliments et la sécurité des produits de consommation, conformément à ce qui a été exprimé dans les récents discours du Trône, le PASPAC et l'accord Cultivons l'avenir. Dans le cadre de l'initiative de modernisation de la réglementation de la DGPSA, le PMV travaille actuellement à un nouveau cadre de réglementation des médicaments vétérinaires.
Rendement - Mise en œuvre du programme
Au Canada, le pouvoir de réglementation des médicaments vétérinaires est un champ de compétence partagé entre Santé Canada, l'ACIA, les provinces et les territoires; Santé Canada et l'ACIA sont responsables de l'exécution des activités précédant et suivant la mise en marché considérées comme faisant partie du PMV. Au cours de la période visée par l'évaluation, aucune structure de gouvernance ni aucun mécanisme de coordination officiel n'a été mis en place pour le PMV ni pour le volet de Santé Canada. Toutefois, Santé Canada dispose d'un éventail de structures et de mécanismes officiels et non officiels mis en place avec ses partenaires (p. ex. protocoles d'entente, groupes de travail et comités, etc.) pour régir différents aspects du programme.
Dans l'ensemble, l'approche existante pour la gouvernance du programme semble fonctionner raisonnablement bien. Toutefois, il pourrait être avantageux de revoir et de simplifier le modèle logique et le cadre de mesure du rendement existants pour le PMV de sorte que les résultats escomptés soient parfaitement conformes au mandat de Santé Canada, aux cadres de travail et aux outils de la Direction générale ainsi qu'aux objectifs de modernisation de la réglementation. Le modèle logique et le cadre de travail pourraient mettre à profit ceux qui ont été préparés à des fins d'évaluation et ils pourraient être employés de façon continue comme outils de gestion du programme. Malgré les récentes modifications à la structure de gouvernance de la DGPSA, dans le cadre desquelles les médicaments vétérinaires font partie du grand Programme des médicaments, il est important du point de vue de l'évaluation et de la gestion du programme que Santé Canada conserve la capacité de produire des rapports à la fois sur les extrants et sur les résultats obtenus par ses activités de réglementation relatives aux médicaments vétérinaires.
Recommandation 1
Santé Canada devrait développer et renforcer sa capacité de faire rapport sur les résultats de ses activités de réglementation se rapportant au PMV.
Au cours de la période visée par l'évaluation, Santé Canada a réalisé des progrès considérables en ce qui concerne la mise en œuvre de ses activités prévues; ce faisant, il a dû prendre des mesures à l'égard de plusieurs nouveaux problèmes et défis. L'une de ses plus grandes réalisations a été de réussir à éliminer un important arriéré de travail lié aux présentations de médicaments vétérinaires et de réduire considérablement le délai moyen de la prise de décisions. Les données les plus récentes dont on dispose indiquent que, en 2011-2012, 89 % des décisions réglementaires s'appliquant à des médicaments vétérinaires ont été prises selon les normes de service - et la cible de rendement avait été fixée à 90 % des décisions. De plus, Santé Canada a entrepris plusieurs autres initiatives pour améliorer l'efficacité du processus d'examen, notamment les suivants : lancement d'un projet pilote avec la FDA des É.-U. sur l'examen parallèle des sections techniques des présentations de médicaments destinés aux animaux de compagnie; adoption d'un programme pilote de déclaration provisoire pour les PVSFR; simplification de l'examen des présentations de médicaments génériques; mise en place d'un processus d'approbation spécialisé pour les médicaments à usage limité pour espèces mineures (ULEM); amélioration du processus d'échange de renseignements avec ses homologues internationaux, notamment en trouvant des moyens d'accroître l'utilisation des examens et des données provenant de l'étranger.
En ce qui a trait aux communications et aux consultations avec les intervenants, les informateurs clés externes ont souligné que la DMV avait fait des efforts concertés, surtout au cours des dernières années, pour améliorer ses activités de communication et de consultation avec les intervenants; en règle générale, ils estiment que ces mêmes activités se sont améliorées considérablement. Cela dit, certaines données probantes démontrent que, alors que Santé Canada a été particulièrement efficace pour communiquer avec l'industrie et plutôt efficace pour communiquer avec les vétérinaires, il n'a pas réussi à joindre les éleveurs. Étant donné les répercussions de l'utilisation de médicaments vétérinaires sur la santé humaine et la salubrité des aliments, il est important que les éleveurs comprennent les risques liés à l'utilisation de ces produits. On pourrait mettre en œuvre une stratégie de communication à l'aide d'intermédiaires, comme les associations provinciales de vétérinaires et les éleveurs, pour s'assurer que les communications de Santé Canada au sujet des risques permettent de joindre les utilisateurs finaux de médicaments vétérinaires.
Dans le domaine de l'élaboration de règlements et de politiques, même si Santé Canada a présenté un certain nombre d'initiatives pour s'attaquer au problème complexe de la RAM, il n'a pas encore entièrement mis en œuvre l'ensemble des recommandations formulées en 2002 par le Comité consultatif d'experts sur l'utilisation d'antimicrobiens chez les animaux et les conséquences pour la résistance et la santé humaine. Jusqu'à maintenant, son approche va également à l'encontre des recommandations de 2011 de l'OMS, notamment celles de mettre fin à l'utilisation non thérapeutique d'antimicrobiens et d'exiger des ordonnances pour tous les antimicrobiens utilisés pour lutter contre les maladies chez les animaux destinés à l'alimentation. Des informateurs clés de Santé Canada ont signalé que le Ministère travaille actuellement à un certain nombre d'initiatives pour s'attaquer à la RAM et collabore avec l'ASPC, l'ACIA, AAC et les responsables provinciaux et territoriaux pour élaborer une approche plus coordonnée en matière de RAM.
Santé Canada a été très critiqué par les intervenants pour son incapacité à restreindre l'utilisation continue de médicaments non approuvés, qui serait l'un des principaux facteurs contribuant à la RAM. Deux éléments de l'actuel cadre de réglementation des médicaments vétérinaires rendent cette pratique possible. Premièrement, à l'heure actuelle, rien n'interdit l'importation de médicaments non homologués à des fins d'utilisation chez des animaux. Cette lacune a permis à des éleveurs d'obtenir des produits vétérinaires à coût moindre ou des produits non offerts au Canada pour les utiliser dans leurs activités d'élevage. L'autre élément se rapporte aux politiques actuelles sur les ingrédients pharmaceutiques actifs (IPA), qui font actuellement l'objet d'une faible surveillance de la part de Santé Canada. À titre comparatif, d'autres administrations, comme l'UE et les États-Unis, interdisent l'importation et l'utilisation de médicaments vétérinaires non homologués et limitent l'importation de produits chimiques en vrac et d'IPA aux titulaires de licences d'établissement.
Récemment, Santé Canada a amorcé un processus touchant l'IUP ainsi que l'importation et l'utilisation directe d'IPA en tenant, en mars 2013, des consultations auprès des intervenants au sujet d'une approche proposée en matière de réglementation de l'IUP et d'IPA.
Recommandation 2
Santé Canada devrait continuer de prendre des mesures pour lutter contre l'importation et l'utilisation de médicaments vétérinaires et d'IPA non homologués.
Les activités de pharmacovigilance de Santé Canada relatives aux médicaments vétérinaires comprennent la surveillance des déclarations de réactions indésirables à un médicament, la détection des signaux, l'évaluation du lien de causalité et les mesures postérieures à la mise en marché, comme la modification des étiquettes et les rappels de médicaments. Les intervenants qui ont pris part à cette évaluation ont ciblé un certain nombre de lacunes possibles dans l'approche de Santé Canada concernant les déclarations de réactions indésirables à des médicaments et à la surveillance post-commercialisation, notamment : la sous-déclaration des réactions indésirables à des médicaments de la part des utilisateurs finaux; un niveau de connaissance et de compréhension insuffisant des exigences de Santé Canada concernant la déclaration des réactions indésirables à des médicaments de la part des fabricants étrangers; l'absence d'exigences concernant la déclaration des réactions indésirables à des médicaments pour les produits importés non approuvés, y compris les IPA; le manque d'attention accordée à l'efficacité du produit dans les déclarations de réactions indésirables à des médicaments, une information importante dans le contexte de la RAM selon les informateurs clés; le manque de surveillance des PSNV après la mise en marché. De plus, au Canada l'information sur le nombre et les types de réactions indésirables aux médicaments vétérinaires n'est pas rendue publique, contrairement à ce qui se fait aux États-Unis et dans l'UE.
Les activités de conformité et d'application de la loi touchant les médicaments vétérinaires sont exécutées par Santé Canada et l'ACIA; elles portent sur ce qui suit : sensibilisation, consultation et information; surveillance de la conformité au moyen d'inspections relatives aux BPF et d'inspections de conformité aux LMR; vérifications et enquêtes sur la conformité; application d'un éventail de mesures volontaires ou réglementaires de conformité et d'application de la loi à l'égard des cas de non-conformité. L'approche actuelle de Santé Canada concernant les inspections relatives aux BPF des établissements de médicaments vétérinaires est perçue comme étant problématique par l'industrie des produits de santé animale, qui estime que le Ministère applique des lignes directrices inadéquates découlant d'une perspective axée sur la santé humaine pour les inspections relatives aux BPF, notamment des lignes directrices qui ne sont pas appliquées aux États-Unis ou dans l'UE. Cependant, Santé Canada a publié des lignes directrices précises décrivant la façon dont les exigences sur les BPF peuvent s'appliquer différemment dans le cas des médicaments vétérinaires. De plus, lors de consultations menées récemment sur un nouveau cadre de réglementation des médicaments vétérinaires, il a proposé d'établir des exigences sur les BPF des médicaments vétérinaires qui seraient admissibles selon un processus d'« homologation » proposé; ces exigences seraient semblables à celles prescrites dans le Règlement sur les produits naturels.
Rendement - Atteinte des résultats
Au cours de la période visée par l'évaluation, Santé Canada a entrepris de nombreuses activités qui devraient, en théorie, contribuer aux résultats attendus du PMV. Cependant, dans la plupart des cas, les données administratives appuyant les conclusions quant à la mesure dans laquelle les résultats ont été atteints sont limitées. Bien que l'évaluation visait à combler ces lacunes à l'aide d'enquêtes menées auprès de l'industrie et d'utilisateurs finaux, l'enquête auprès de ces derniers a obtenu un faible taux de réponse et a eu une portée limitée en raison du petit échantillon utilisé. Compte tenu de ces facteurs, les données permettant de tirer des conclusions définitives sont limitées quant à l'atteinte des résultats.
Dans l'immédiat, on s'attend à ce que le PMV entraîne une hausse du niveau de connaissance et de compréhension chez les utilisateurs finaux quant aux risques et aux avantages liés aux médicaments vétérinaires ainsi qu'une meilleure connaissance et compréhension du cadre réglementaire de Santé Canada s'appliquant aux médicaments vétérinaires au sein de l'industrie. Bien qu'il semble évident que Santé Canada a amélioré ses activités de communication et de consultation auprès des intervenants au cours des dernières années, peu de données probantes démontrent que ces activités ont produit l'effet souhaité, notamment chez les utilisateurs finaux.
Les activités du PMV visent également à accroître le niveau d'innocuité et d'efficacité des médicaments vétérinaires. Le PMV contribue à l'innocuité des produits en établissant des LMR et des LAMR pour les médicaments vétérinaires, et il avait établi 269 LMR pour 88 substances pharmacologiquement actives en date de mai 2012. De plus, des améliorations apportées récemment au processus d'examen des présentations pourraient, en théorie, mener à la présence de médicaments plus sûrs et efficaces sur le marché. Toutefois, rien ne prouve que les nouveaux médicaments soient effectivement plus sûrs et plus efficaces que les produits existants.
Dans l'immédiat, les activités du PMV visent une plus grande conformité de l'industrie au cadre de réglementation des médicaments vétérinaires de Santé Canada. Des données probantes donnent à penser que la conformité de l'industrie aux LMR établies et aux exigences relatives aux BPF est généralement élevée, mais en raison de la décision prise en 2007-2008 de combiner les rapports d'inspection des BPF des médicaments pour usage vétérinaire et pour usage humain, il est difficile de cibler des tendances claires au niveau de la conformité aux BPF au sein de l'industrie des médicaments vétérinaires. Il est important pour Santé Canada, en tant qu'organisme chargé de la réglementation des médicaments vétérinaires, de surveiller la conformité au sein de l'industrie des médicaments vétérinaires et de faire rapport à ce sujet. Une telle approche concorde sans doute davantage avec la décision prise récemment par le Ministère de reconnaître le caractère unique des médicaments vétérinaires par l'établissement d'un nouveau cadre de réglementation des médicaments vétérinaires et concorde également davantage avec l'approche adoptée par la FDA, qui sépare les rapports de conformité par type de produits. Il faudrait aussi mettre davantage l'accent sur la présentation des résultats en matière de conformité (au lieu des activités et des extrants) si l'on souhaite mieux comprendre le degré de conformité de l'industrie.
Recommandation 3
Santé Canada devrait travailler à améliorer les rapports sur la conformité de l'industrie au cadre règlementaire s'appliquant aux médicaments vétérinaires. Il faudrait que les données sur la conformité des médicaments vétérinaires et sur les activités d'application de la loi soient séparées des données sur les activités liées aux médicaments humains. Le Ministère devrait également mettre davantage l'accent sur les résultats en matière de conformité dans les rapports sur le rendement, plutôt que sur les activités et les extrants.
À moyen terme, les activités du PMV devraient amener les intervenants externes à faire preuve de prudence lorsqu'ils utilisent des médicaments vétérinaires. Des données probantes tirées de la littérature indiquent qu'il existe des pratiques dangereuses dans le milieu agricole canadien, dont l'utilisation d'agents antimicrobiens, l'IUP ainsi que l'importation et l'utilisation directe d'IPA, même si l'ampleur du problème continue de susciter des discussions. L'incidence du PMV sur le comportement des utilisateurs finaux devrait faire l'objet de recherches dans l'avenir.
On s'attend également à ce que les activités du PMV entraînent, à moyen terme, une plus grande utilisation par Santé Canada des données scientifiques et de l'analyse risques-avantages en vue d'éclairer la prise de décisions. L'utilisation de données scientifiques et de l'analyse risques avantages est officiellement intégrée au processus décisionnel de Santé Canada; en général, le Ministère semble utiliser les données scientifiques et l'analyse risques-avantages sur une base régulière pour éclairer la prise de décisions. Toutefois, le Ministère n'a pas encore mis en œuvre de réformes réglementaires pour s'attaquer à l'importation et à l'utilisation de médicaments non approuvés. Cette situation semble s'expliquer, du moins en partie, par des préoccupations concernant l'incidence économique possible de telles réformes sur les éleveurs.
À moyen terme, on s'attend à ce que les activités du PMV entraînent une intervention rapide à l'égard des risques ciblés. En raison de l'absence de normes de rendement et de renseignements sur le temps pris par Santé Canada pour intervenir à l'égard de ces risques, il n'y a pas suffisamment de données probantes pour appuyer les conclusions générales concernant ce résultat. Toutefois, on compte quelques exemples de problèmes de longue date auxquels Santé Canada ne s'est pas encore attaqué en modifiant ses politiques et ses règlements - notamment l'importation et l'utilisation de médicaments vétérinaires non approuvés qui se poursuivent.
Les activités du PMV devraient aussi mener, à moyen terme, à une plus grande harmonisation internationale des cadres de réglementation des médicaments vétérinaires et, ultimement, à une amélioration de la santé humaine et de la salubrité de l'approvisionnement alimentaire. Les données probantes recueillies dans le cadre de l'évaluation donnent à penser que Santé Canada a joué un rôle actif à l'échelle internationale. Santé Canada participe à la VICH et à la Commission du Codex Alimentarius et a conclu plusieurs ententes d'échange de renseignements et de coopération en matière de réglementation avec des homologues internationaux. Même si les initiatives d'harmonisation réglementaire comme celles-ci peuvent contribuer à une amélioration de la santé humaine et de la salubrité de l'approvisionnement alimentaire, en l'absence de données probantes concrètes, les avantages pour la santé et la sécurité rattachés à une plus grande harmonisation sont davantage théoriques que réels.
À long terme, les activités du PMV devraient contribuer à une diminution des risques pour la santé et des réactions indésirables associés à l'utilisation des médicaments vétérinaires, à une hausse de la salubrité de l'approvisionnement alimentaire au Canada ainsi qu'à une plus grande confiance du public à l'égard des médicaments vétérinaires, du système de réglementation connexe et de l'approvisionnement alimentaire. Il semble donc raisonnable de penser que les activités du PMV, telles que l'approbation en temps opportun de médicaments sûrs et efficaces, l'interdiction de la vente de certains produits pour l'utilisation chez les animaux destinés à l'alimentation pour lesquels aucune limite de résidus n'est jugée sûre, la gestion des résidus de médicaments dans les aliments, les initiatives visant à exercer une influence sur l'utilisation d'agents antimicrobiens chez les animaux destinés à l'alimentation et les activités de surveillance et de conformité après la mise en marché, devraient, en théorie, contribuer à la salubrité de l'approvisionnement alimentaire et à la réduction des risques pour la santé. La lutte contre l'importation et l'utilisation de médicaments vétérinaires non approuvés contribuerait encore davantage à la réduction des risques et à la salubrité des aliments.
Quant à la confiance du public à l'égard des médicaments vétérinaires, du système de réglementation connexe et de l'approvisionnement alimentaire, des sondages d'opinion menés récemment semblent indiquer que, à l'heure actuelle, la population canadienne fait plutôt confiance au système d'assurance de la salubrité des aliments du Canada, qu'elle approuve de façon générale les normes et règlements canadiens dans le domaine de la salubrité des aliments et qu'elle croit que le gouvernement du Canada peut contribuer grandement à accroître la confiance de la population à l'endroit du système d'assurance de la salubrité des aliments en soi. Toutefois, il n'existe aucune donnée sur l'opinion publique portant précisément sur les médicaments vétérinaires.
Rendement - Efficience et économie
En raison de changements apportés à l'approche de la DGPSA en matière de production de rapports financiers au cours de la période visée par l'évaluation, il a été difficile de comparer et d'analyser cette information au fil du temps. De plus, la DGPSA a commencé récemment à inclure les médicaments vétérinaires dans les rapports financiers du grand Programme des médicaments. La DGPSA est en mesure d'isoler les activités liées aux médicaments vétérinaires de la DMV de ses activités touchant la salubrité des aliments pour la production de rapports. Cependant, le PMV ne comporte pas uniquement les activités de la DMV, mais comprend aussi les activités d'autres partenaires du programme, comme l'Inspectorat, le Bureau des régions et des programmes (BRP) et la Direction de la gestion des ressources et des opérations (DGRO). Il se peut que l'approche actuelle de la DGPSA s'appliquant à la production de rapports financiers ne permette pas d'obtenir le coût total du PMV. Par ailleurs, aucun rapport fondé sur les activités, un type de rapport important pour analyser l'efficience et l'économie du programme, n'a été produit depuis 2008-2009. Tant du point de vue de la gestion du programme que de celui de son évaluation, il est important de définir le coût total des activités touchant les médicaments vétérinaires de la Direction générale et d'analyser les inducteurs de coût.
En raison des lacunes majeures que présentaient les données existantes sur les finances et les ressources humaines, l'évaluation n'a pas permis d'établir la mesure dans laquelle les ressources du programme ont été utilisées conformément à ce qui était prévu, ni de déterminer si les extrants du programme ont été produits de manière efficace ou si les résultats attendus ont été obtenus de manière économique. Cela dit, des données probantes démontrent des gains d'efficience opérationnelle au cours des dernières années. Le PMV a éliminé un important arriéré de travail lié aux présentations de drogue nouvelle dans les dernières années, a réduit considérablement le délai moyen nécessaire pour décider si une drogue nouvelle doit être approuvée et a entrepris d'autres initiatives pour améliorer l'efficacité de l'examen préalable à la mise en marché. Puisque bon nombre de ces initiatives sont relativement récentes, leur incidence sur l'efficience et l'économie du programme n'a pas encore été établie. Le recours accru aux présentations électroniques, l'acceptation des présentations successives, l'acceptation des ensembles de données de l'étranger et l'utilisation des examens étrangers pourraient mener à d'autres gains d'efficience.
Annexe A Grille d'évaluation
| Problèmes et questions | Indicateurs | Sources de données |
|---|---|---|
| SECTION 1 : PERTINENCE | ||
| Dossier n° 1 : Nécessité de maintenir le programme | ||
| 1. Le PMV est-il toujours nécessaire? | Les raisons justifiant la poursuite du programme ont été recensées et consignées. | Examen des documents
|
| Éléments démontrant les problèmes actuels ou nouveaux en matière de santé humaine et de salubrité des aliments liés aux MV | Revue de la littérature | |
| Évaluation par des experts/intervenants du besoin actuel | Entrevues avec les informateurs clés (internes et externes) | |
| Dossier n° 2 : Harmonisation avec les priorités du gouvernement | ||
| 2. Le PMV concorde-t-il avec les priorités du gouvernement du Canada? | Mesure dans laquelle les objectifs du programme concordent avec les priorités du gouvernement fédéral | Examen des documents
|
| Mesure dans laquelle les objectifs du programme sont liés aux résultats et aux priorités stratégiques de la DGPSA de Santé Canada | Examen des documents
|
|
| Dossier n° 3 : Harmonisation avec les rôles et les responsabilités du gouvernement fédéral | ||
| 3. Le PMV concorde-t-il avec les rôles et les responsabilités du gouvernement fédéral? | Mesure dans laquelle les objectifs du programme concordent avec le cadre législatif du gouvernement fédéral | Examen des documents
|
| Mesure dans laquelle les objectifs du programme concordent avec le cadre législatif de Santé Canada | Examen des documents
|
|
| SECTION 2 : RENDEMENT (EFFICACITÉ, EFFICIENCE ET ÉCONOMIE) | ||
| Dossier n° 4 : Atteinte des résultats escomptés | ||
| 4. Est-ce la structure de gouvernance du programme susceptible d'appuyer l'atteinte des résultats escomptés? | ||
| a) Y a-t-il une structure de gouvernance établie permettant de coordonner l'exécution du PMV? |
|
Examen des documents
Entrevues avec les informateurs clés (internes et externes, c.-à-d. d'autres ministères fédéraux) |
|
Examen des documents
Entrevues avec les informateurs clés (internes et externes) |
|
|
Examen des documents
Entrevues avec les informateurs clés (internes et externes, c.-à-d. d'autres ministères fédéraux) |
|
| b) Un cadre de mesure du rendement a-t-il été conçu et mis en place? |
|
Examen des documents
|
|
Examen des documents
Entrevues avec les informateurs clés (internes) |
|
| c) Le cadre de mesure du rendement est-il utilisé pour appuyer les processus décisionnels? |
|
Examen des documents
Entrevues avec les informateurs clés (internes) |
| 5. Dans quelle mesure le PMV a-t-il été mis en œuvre comme prévu? | ||
| a) Le programme a-t-il permis de donner suite convenablement aux défis, aux problèmes émergents et à l'évolution des priorités? |
|
Examen des documents
Entrevues avec les informateurs clés (internes et externes) |
| b) Les activités ont-elles été mises en œuvre comme prévu? |
|
Examen des documents
|
|
|
Pour la mise en œuvre réelle
Principaux problèmes |
|
| c) Les activités ont-elles produit les extrants escomptés? |
|
Examen des documents
|
Pour les extrants réels
Principaux problèmes |
||
| d) Les exigences ou engagements à l'égard des organismes centraux (Bureau du vérificateur général, Directive du Cabinet sur la rationalisation de la réglementation, Politique sur la consultation du public, Politique en matière d'analyse comparative entre les sexes) ont-ils été respectés? |
|
Examen des documents (selon la disponibilité des documents pertinents) |
| 6. Dans quelle mesure les résultats escomptés ont-ils été atteints? | ||
| Résultats immédiats | ||
| a) Dans quelle mesure les intervenants externes connaissent-ils et comprennent-ils davantage les risques et les avantages liés aux médicaments vétérinaires? |
|
Examen des documents
|
|
Entrevues avec les informateurs clés (externes) |
|
| b) Dans quelle mesure l'industrie connaît-elle et comprend-elle davantage le cadre de réglementation des médicaments vétérinaires de Santé Canada? |
|
Examen des documents
|
|
Entrevues avec les informateurs clés (externes) |
|
| c) Dans quelle mesure les médicaments vétérinaires sont-ils plus sûrs et plus efficaces? |
|
Examen des données administratives
|
|
Examen des données administratives
|
|
|
Examen des données administratives
|
|
|
Revue de la littérature
Entrevues avec les informateurs clés (internes et externes) |
|
| d) Dans quelle mesure l'industrie respecte-t-elle davantage les exigences réglementaires de Santé Canada sur les médicaments vétérinaires? |
|
Examen des données administratives
|
|
Examen des données administratives
|
|
|
Examen des données administratives
Examen des documents
|
|
|
Examen administratif
|
|
|
Examen des documents
|
|
|
Enquête auprès de l'industrie |
|
Résultats à moyen terme |
||
| e) Dans quelle mesure les intervenants externes adoptent-ils des comportements sûrs relativement aux médicaments vétérinaires? |
|
Entrevues avec les informateurs clés (externes) |
|
Entrevues avec les informateurs clés (externes, en particulier les représentants des associations de vétérinaires des provinces pour obtenir des renseignements sur l'usage) |
|
| f) Dans quelle mesure Santé Canada emploie-t-il plus les données scientifiques et l'analyse risques-avantages pour éclairer la prise de décision? |
|
Examen des documents
|
|
Examen des documents
|
|
|
Examen des documents
|
|
|
Examen des documents (s'ils existent) |
|
|
Examen des documents (s'ils existent) |
|
|
Examen des données administratives - données du CED :
Entrevues avec les informateurs clés (internes) |
|
|
Examen des documents (ERS, si elles existent) |
|
|
Examen des documents (s'ils existent) |
|
|
Entrevues avec les informateurs clés (externes et internes) |
|
| g) Dans quelle mesure le système réglementaire permet-il d'intervenir rapidement à l'égard des risques cernés? |
|
Examen des documents (si l'information existe) |
|
Entrevues avec les informateurs clés (externes et internes) |
|
| h) Dans quelle mesure l'harmonisation internationale des cadres réglementaires pour les médicaments vétérinaires a-t-elle contribué à améliorer la santé des Canadiens et à accroître la salubrité de l'approvisionnement alimentaire du Canada? |
|
Revue de la littérature
Principaux problèmes |
|
Revue de la littérature |
|
Résultats à long terme |
||
| i) Dans quelle mesure les risques pour la santé et les réactions indésirables associés à l'emploi des médicaments vétérinaires ont-ils été réduits? |
|
Examen des documents et examen des données administratives
|
|
Entrevues avec les informateurs clés (internes et externes) |
|
| j) Dans quelle mesure le PMV a-t-il contribué à la salubrité de l'approvisionnement alimentaire du Canada? |
|
Entrevues avec les informateurs clés (internes et externes) |
| k) Dans quelle mesure le public a-t-il une plus grande confiance dans les médicaments vétérinaires, le système qui les réglemente et l'approvisionnement alimentaire? |
|
Examen des documents
Entrevues avec les informateurs clés (externes) |
| l) Dans quelle mesure le système de réglementation des médicaments vétérinaires du Canada est-il durable, rentable, opportun et fondé sur la science? |
|
Toutes les sources de données |
| m) Les activités du programme ont-elles entraîné des conséquences inattendues, positives ou négatives? |
|
Entrevues avec les informateurs clés (internes et externes) |
| Dossier n° 5 : Efficacité et économie | ||
| 7. Les ressources du programme ont-elles été utilisées comme prévu?Quelles ont été les raisons des écarts (dépenses supérieures ou inférieures par rapport aux dépenses prévues)? |
|
Examen des données administratives
Entrevues avec les informateurs clés (internes) |
| 8. Y a-t-il des méthodes plus rentables permettant d'obtenir les extrants du programme? |
|
Entrevues avec les informateurs clés (internes) |
| 9. Existe-t-il d'autres moyens de parvenir aux mêmes résultats à moindre coût? |
|
Revue de la littérature |
Annexe B Bibliographie
aac. Cultivons l'avenir : Accord-cadre fédéral-provincial-territorial sur une politique agricole, agroalimentaire et des produits agro-industriels, 2008.
aac. Rapport : Évaluation du Plan d'action en matière de réglementation pour l'agriculture dans le cadre de Cultivons l'avenir - allégations santé, aliments et ingrédients nouveaux; enrichissement des aliments; et médicaments vétérinaires, 2013 (rapport préliminaire).
aac et Santé Canada. MOU between AAFC & HC pertaining to the Growing Forward Regulatory Action Plan, 2009.
Aarestrup, f.m. et h. Wegener. (2009). Testimony of Dr. Frank Moeller Aarestrup and Dr. Henrik Wegener for the US House of Representatives Committee on Rules. Hearing on H.R. 1549, the Preservation of Antibiotics for Medical Treatment Act of 2009 (consulté le 11 avril 2013).
ACIA. Vert malachite - Questions et réponses, 2006a (consulté le 7 mars 2012). Sur Internet : http://www.inspection.gc.ca/francais/fssa/concen/specif/malachite/questf.shtml.
ACIA. Rapport annuel 2005-2006 du PNSRC sur les aliments d'origine végétale et animale, 2006b. Sur Internet : http://epe.lac-bac.gc.ca/100/206/301/cfia-acia/2011-09-21/www.inspection.gc.ca/francais/fssa/ microchem/resid/2005-2006/annuf.shtml.
ACIA. Health Risk Assessment Request, 2007a.
ACIA. Ionophore residues in eggs, 2007b.
ACIA. (2008a). Programme national de surveillance des résidus chimiques - Rapport - 2007-2008 Rapport annuel - Aliments d'origine animale et végétale, 2008a.
ACIA. Agence canadienne d'inspection des aliments - Questions et réponses - Limites fonctionnelles de résidus, 2008b (consulté le 16 février 2012).
ACIA. Health Risk Assessment Request, 2008c.
ACIA. Programme national de surveillance des résidus chimiques (PNSRC), 2011a (consulté le 9 février 2012). Sur Internet : http://www.inspection.gc.ca/francais/fssa/microchem/ncrmpf.shtml.
ACIA. Manuel des méthodes de l'hygiène des viandes, 2011b (consulté le 10 avril 2013).
ACIA. Salubrité des aliments : La confiance de la population canadienne en hausse, 2011d (consulté le 10 avril 2012).
ACIA. Rapport annuel 2006-2007 du PNSRC- Aliments d'origine animale et végétale - résumé, 2011e (consulté le 21 mars 2012).
ACIA. Résidus chimiques dans les aliments, 2012 (consulté le 15 mars 2012).
ACIA. Inspection de surveillance - Teneur garantie en substances médicamenteuses dans les aliments du bétail fabriqués dans des établissements commerciaux et à la ferme. Rapport de conformité des échantillons analysés : Période 1995-1996 - 2006-2007, s.d. -a
ACIA. Inspection de surveillance - Résidus de médicaments dans les aliments du bétail fabriqués dans des établissements commerciaux et à la ferme. Rapport de conformité des échantillons analysés : Période 1991-1992 - 2006-2007, s.d. -b
ACIA et Santé Canada. MOU concerning regulatory control of veterinary biologics and veterinary drugs, s.d.
ACMV. Utilisation des médicaments en dérogation des directives de l'étiquette (UMDDE), 2010 (consulté le 9 février 2012). Sur Internet : http://veterinairesaucanada.net/ShowText.aspx?ResourceID=1951.
ACMV. « Rapport annuel 2010 de l'Association canadienne des médecins vétérinaires », La revue vétérinaire canadienne, vol. 52, no 7, (2011), p.723-747.
ACMV. Public bulletin : Veterinary pharmacovigilance 2011 (no du document EMA/CVMP/PhVWP/987984/2011), European Medicines Agency, 2012. Sur Internet : http://www.ema.europa.eu/docs/en_GB/document_library/Other/2012/03/WC500123684.pdf.
Adewoye, L. A Veterinary Drugs Directorate Perspective on minor uses/minor species (MUMS). Ottawa (Ont.), 2005.
agri. Comité permanent de l'agriculture et d'agroalimentaire - AGRI (39-2) - Témoignages - no 023, 2008. Sur Internet : http://www.parl.gc.ca/HousePublications/ Publication.aspx?DocId=3372475&Mode=2&Parl=39&Ses=2&Language=F.
Alexander, I. (2005). Extra-label drug use (ELDU) : Perspectives of Canada, the United States and other jurisdictions (présenté à la 6e réunion du Comité des intervenants de la DMV).
apvma. (Rapport de l'APVMA). Site Web de l'Australian Pesticides and Veterinary Medicines Authority, 2012 (consulté le 9 avril 2012). Sur Internet : http://www.apvma.gov.au/publications/reports/index.php.
ASPC. Programme intégré canadien de surveillance de la résistance aux antimicrobiens (PICRA), 2006, 2009.
ASPC. Programme intégré canadien de surveillance de la résistance aux antimicrobiens (PICRA), 2007, 2010.
ASPC. Programme intégré canadien de surveillance de la résistance aux antimicrobiens (PICRA), 2008 (Rapport final), 2011.
Barbosa, J., C. Cruz, J. Martins, J. Manuel Silva, C. Neves, C. Alves, M. I. Noronha Da Silveira. « Food poisoning by clenbuterol in Portugal », Food Additives and Contaminants, vol. 22, no 6 (2005), p. 563-566 (doi:10.1080/02652030500135102).
Bender, J. Impact of the Danish Policy Banning Antimicrobial Growth Promoter Use in Danish Pork Production, 2011.
BioBridge Ltd. IFAH Benchmarking Survey Final Report : Canada, 2012 (consulté le 6 décembre 2012). Sur Internet : http://www.cahi-icsa.ca/uploads/UserFiles/files/IFAH%20Benchmarking%20Survey%20-%20Final%20Report%202011.pdf.
Birnbaum, D., E. Jandciu, et L. Twells. Antimicrobial resistance: A deadly burden no country can afford to ignore. CCRA, 2002. Sur Internet : http://www.designit.ca/ccar/english/word/FinalReport2.doc.
Boulay, L. Veterinary Drugs Directorate Submission Review update, 2005 (présenté à la 6e réunion du Comité des intervenants).
BVG. Rapport du vérificateur général du Canada : Chapitre 4 - La réglementation des médicaments, 2011.
Carson, C. A., R. Reid-Smith, R. J. Irwin, W. S. Martin, et S. A. McEwen. « Antimicrobial use on 24 beef farms in Ontario », Canadian Journal of Veterinary Research, vol. 72, no2 (2008), p. 109.
Caswell, B. Antimicrobial Stewardship Conference, vol. 8, no 9 (2011), p. 3-4.
CCE-PSNV. (2010). Rapport et recommandations du Comité consultatif d'experts sur les produits de santé naturels vétérinaires.
CCE-PSNV. Cadre de références - Comité consultatif d'experts sur les produits de santé naturels vétérinaires, s.d.
CCRA. The Pan-Canadian Stakeholder Consultations on Antimicrobial Resistance, 2009. Sur Internet : http://www.designit.ca/ccar/english/pdfs/CCAR-Pan-CanadianAMR.pdf.
CEDS. Cadre de fonctionnement - Comité d'évaluation des dossiers scientifiques (CEDS), 2004. Faire affaire avec la DMV.
Center for Veterinary Medicine. Minor Use/Minor Species, 2012a (site Internet de la US Food andDrug Administration) (consulté le 27 mars 2012). Sur Internet : http://www.fda.gov/AnimalVeterinary/DevelopmentApprovalProcess/MinorUseMinorSpecies/default.htm.
Center for Veterinary Medicine. Product Safety Information - Adverse Drug Experience (ADE) Reports, 2012b, (site Internet de la US Food andDrug Administration) (consulté le 9 avril 2012). Sur Internet : http://www.fda.gov/AnimalVeterinary/SafetyHealth/ProductSafetyInformation/ucm055369.htm.
Comité consultatif sur l'UMDDE. Utilisation de médicaments en dérogation des directives de l'étiquette (UMDDE) chez les animaux : Développer une compréhension commune (Document de détermination des enjeux), 2004. Sur Internet http://www.collectionscanada.gc.ca/archivesweb/20061215000050/http://hc-sc.gc.ca/dhp-mps/alt_formats/hpfb-dgpsa/pdf/pubs/eldu-umdde_issue-enjeux_final_10-12-2004_f.pdf.
Comité consultatif sur l'utilisation d'antimicrobiens chez les animaux et les conséquences pour la résistance et la santé humaine. L'utilisation au Canada d'antimicrobiens chez les animaux destinés à l'alimentation : les conséquences pour la résistance et la santé humaine, 2002.
Comité consultatif sur la résistance aux antimicrobiens. Ébauche du cadre de référence - Comité consultatif d'experts sur l'évaluation des risques de résistance aux antimicrobiens, 2004.
Commission du Codex Alimentarius. CODEX Alimentarius : Accueil, 2012 (consulté le 18 décembre 2012). Sur Internet : http://www.codexalimentarius.org/codex-home/fr/.
Commission européenne. Directive 2001/82/EC du Parlement européen et du Conseil du 6 novembre 2001 instituant un code communautaire relatif aux médicaments vétérinaires (CONSOLIDATION), 2001 (consulté le 2 janvier 2013). Sur Internet : http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=CONSLEG:2001L0082:20090807:FR:PDF.
Comyn, G. « Extra-label Drug Use in Veterinary Medicine », FDA Veterinarian Newsletter, vol.18, no 2 (2003). Sur Internet : http://www.fda.gov/AnimalVeterinary/NewsEvents/FDAVeterinarianNewsletter/ucm100268.htm.
CRA. Salubrité des aliments : sensibilisation, attitudes et comportements des Canadiens (2011‐12) : CRA. Sommaire, 2012 (consulté le 3 janvier 2013). Sur Internet : http://epe.lac-bac.gc.ca/100/200/301/pwgsc-tpsgc/por-ef/canadian_food_inspection_agency/2012/029-11/sommaire.pdf.
CVM. Animal Medicinal Drug Use Clarification Act of 1994 (AMDUCA), 2011b (consulté le 2 janvier 2013). Sur Internet : http://www.fda.gov/AnimalVeterinary/GuidanceComplianceEnforcement/ActsRulesRegulations/ucm085377.htm.
CVM. Import & Exports > Importing - Veterinary Drugs, 2011a (consulté le 2 janvier 2013). Sur Internet : http://www.fda.gov/AnimalVeterinary/Products/ImportExports/ucm050077.htm.
Decima Research. Food safety: Canadians' awareness, attitudes, and behaviours (rapport final no 088-09), 2010, Agence canadienne d'inspection des aliments. Sur Internet : http://epe.lac-bac.gc.ca/100/200/301/pwgsc-tpsgc/por-ef/canadian_food_inspection_agency/2010/088-09/report.pdf.
DGPSA. Health Products and Food Branch's Strategic Evaluation Plan. Program Evaluation and Audit Coordination Office,2006.
DGPSA. Plan de renouveau II : Moderniser l'approche de la réglementation des produits de santé et des aliments au Canada, 2007a (consulté le 11 décembre 2012). Sur Internet : http://www.collectionscanada.gc.ca/ archivesweb/20071214051519//ahc-asc/alt_formats/hpfb-dgpsa/pdf/hpfb-dgpsa/blueprint-plan_ll_f.pdf.
DGPSA. DGPSA - Rapport sur le rendement en matière de participation du public - 2005-2007, 2007b.
DGPSA. HPFB Quarterly Program Review: Food and Nutrition Program, FY 2010-11 Q1 (VDD-Specific), 2010a.
DGPSA. VDD dashboard reporting, FY 2009-10 Q3 (includes all HPFB Directorates), 2010b.
DGPSA. HPFB Quarterly Program Review: Food and Nutrition Program, FY 2009-10 Q4 (VDD-Specific), 2010c.
DGPSA. HPFB Quarterly Program Review: Food and Nutrition Program, FY 2010-11 Q2 (VDD-Specific), 2010d.
DGPSA. HPFB Quarterly Program Review: Food and Nutrition Program - VDD, 2010-11 Q3 - Appendix #1 : Q3 Performance Report, 2011a.
DGPSA. HPFB Food Safety (VDD input), 2010-11 review, 2011-2012 priority setting, 2011b.
DGSPA. Document d'orientation :Annexe 4 à l'édition actuelle des Lignes directrices sur les Bonnes pratiques de fabrication (BPF), 2011c.
DGSPA. Examen de mi-exercice des programmes, 2012-2013, 2012a.
DGSPA. Feuille de route de la réglementation pour les produits de santé et aliments, 2012b (consulté le 11 décembre 2012).
DMV. Rapport de la consultation d'intervenants sur l'élaboration d'une stratégie de gestion des risques liés à la résistance aux antimicrobiens associés à l'utilisation d'agents antimicrobiens chez les animaux, 2003a.
DMV. Communiqué aux intervenants, vol. 3, no 1, 2003b.
DMV. Réglementation intelligente - se libérer des ornières : Limites administratives maximales de résidus, 2003d (consulté le 3 janvier 2013).
DMV. Operational plan for Veterinary Drugs Directorate (FY 2003-04, Q3-Q4), 2003e.
DMV. PVI : Pharmacovigilance, 2004a (consulté le 21 mars 2012). Sur Internet : /dhp-mps/vet/advers-react-neg/adr-rim_fyi-pvi-fra.php.
DMV. Le chloramphénicol dans le miel, 2004b (consulté le 21 mars 2012). Sur Internet : /dhp-mps/vet/faq/faq_chloramphenicol_honey-miel-fra.php.
DMV. Draft section B13-veterinary drug issues - analysis summary, 2005a.
DMV. Compte rendu de la septième réunion du Comité des intervenants de la Direction des médicaments vétérinaires, 2005b.
DMV. Foire aux questions : produits de santé naturels vétérinaires (PSNV),2006a (consulté le 19 mars 2012).
DMV. VDD dashboard reporting: FY 2006-07 Q2 (Regulatory Operational Performance), 2006b.
DMV. Questions et réponses : ProHeart® 6 - Produit injectable contre la dirofilariose, 2006c (consulté le 21 mars 2012).
DMV. 9e réunion du comité des intervenants de la DMV - Rapport sommaire, 2006d.
DMV. VDD dashboard reporting, FY 2006-07 Q4, 2006e.
DMV. VDD dashboard reporting, FY 2006-07 Q1 (Transparency), 2006f.
DMV. Communiqué aux intervenants, vol. 6, no 2, 2006g.
DMV. Consultation - Document de travail sur un énoncé de politique sur l'aquaculture, 2007a (consulté le 11 avril 2012).
DMV. Ligne directrice à l'intention de l'industrie sur la préparation des présentations de drogues nouvelles vétérinaires, 2007b.
DMV. VDD dashboard reporting, FY 2007-08 Q1 & Q2 (Transparency), 2007c.
DMV. Consultation de la Direction des médicaments vétérinaires avec les intervenants sur l'ébauche de définition d'un produit de santé naturel, 2007d (consulté le 11 avril 2012).
DMV. Health Risk Assessment for cattle intended for slaughter that have been fed a mixture of medicating ingredients, some of which are not approved for cattle, 2007e.
DMV. Bulletin sur la résistance aux antimicrobiens (RAM) - hiver 2007, 2007f.
VDD. Potential risk to human health from consumption of milk and meat derived from cattle and sheep treated with copper sulphate which is contaminated with dioxins, 2007g.
DMV. Ionophore residues in eggs, 2007h.
DMV. Health risk assessment associated with antibiotic residues in ethanol by-products derived from fuel ethanol production and intended for livestock feeds, 2007i.
DMV. Consultation - Summary report on the draft definition of a Veterinary Natural Health Product (vNHP), 2008a.
DMV. VDD Target status, FY 2008-09 Q1, 2008b.
DMV. VDD Performance Summary, FY 2008-09 Q2, 2008c.
DMV. VDD dashboard reporting, FY 2008-09 Q1 (International and National), 2008d.
DMV. VDD dashboard reporting, FY 2008-09 Q1 (MUMS), 2008e.
DMV. VDD dashboard reporting, FY 2007-08 Q4 (International and National), 2008f.
DMV. Questions et réponses concernant la Politique de Santé Canada sur l'utilisation des médicaments en dérogation des directives de l'étiquette (UMDDE) chez les animaux destinés à l'alimentation, 2009a (consulté le 10 avril 2012).
DMV. VDD dashboard reporting, FY 2008-09 Q4 (Regulatory Operational Performance), 2009b.
DMV. Report on VDD-AAFC Growing Forward Regulatory Action Plan, 2008-2009, 2009c.
DMV. VDD Performance Summary, FY 2008-09 Q4, 2009d.
DMV. VDD quarterly reporting - executive summary, FY 2009-10 Q1, 2009e.
DMV. VDD Performance Summary, FY 2008-09 Q3, 2009f.
DMV. VDD quarterly reporting - executive summary, FY 2009-10 Q2, 2009g.
DMV. VDD dashboard reporting, FY 2008-09 Q4 (MUMS), 2009h.
DMV. VDD dashboard reporting, FY 2009-10 Q2, 2009i.
DMV. Utilisation de médicaments en dérogation des directives de l'étiquette (UMDDE), 2009j (consulté le 17 février 2012).
DMV. Health risk associated with the potential residues of erythromycin in distillers' grain ethanol by-products derived from fuel ethanol production and intended for livestock feeds, 2009k.
DMV. Ligne directrice à l'intention de l'industrie - Préparation des présentations abrégées de drogues nouvelles vétérinaires - Médicaments, 2010a.
DMV. VDD Submission Review Performance Measures, FY 2010-11 Q1, 2010b.
DMV. VDD Performance Report, FY 2009-10 Q3, 2010c.
DMV. VDD Submission Review Performance Measures, FY 2010-11 Q2, 2010d.
DMV. VDD update, ADM key commitments dashboard, FY 2010-11, 2010e.
DMV. Utilisation de médicaments en dérogation des directives de l'étiquette - Médicaments vétérinaires - Santé Canada, 2011a (consulté le 11 décembre 2012).
DMV. Comité consultatif d'experts sur les produits de santé naturels vétérinaires, 2011b.
DMV. Réactions indésirables aux médicaments (RIM) (pharmacovigilance), 2011c (consulté le 21 mars 2012).
DMV. Lignes directrices du VICH adoptées au Canada, 2011d (consulté le 21 mars 2012). Sur Internet : /dhp-mps/vet/legislation/guide-ld/vich/guide-ligne-fra.php.
DMV. Consultation - Limites maximales de résidus (LMR) proposées pour l'amprolium, la bacitracine, la cloxacilline, le dichlorvos, l'érythromycine, la gamithromycine, le méloxicam, la novobiocine, la pénicilline G et le toltrazuril, 2011e (consulté le 14 février 2012).
DMV. VDD Submission Review Performance Measures, FY 2010-11 Q3, 2011f.
DMV. VDD Submission Review Performance Measures, FY 2010-11 Q4, 2011g.
DMV. Limites maximales de résidus (LMR) établies par le Canada, 2012 (consulté le 3 janvier 2013).
DMV.Document utilisé pour les discussions techniques sur la modernisation des règlements des médicaments vétérinaires - Sujet G : Surveillance de l'importation pour usage personnel de médicaments vétérinaires et de l'importation d'ingrédients pharmaceutiques actifs, 2013a.
DMV.Document utilisé pour les discussions techniques sur la modernisation des règlements des médicaments vétérinaires- Sujet K : Approche relative aux produits pour usage mineur, espèces mineures (UMEM), 2013b.
DMV.Document utilisé pour les discussions techniques sur la modernisation des règlements des médicaments vétérinaires - Sujet C : Demande d'enregistrement, 2013c.
DMV.Document utilisé pour les discussions techniques sur la modernisation des règlements des médicaments vétérinaires - Sujet B : Demande d'autorisation de mise en marché - Processus de présentation des données probantes, 2013d.
DMV. Document utilisé pour les discussions techniques sur la modernisation des règlements des médicaments vétérinaires- Sujet F : Exigences en matière de bonnes pratiques de fabrication et de licences d'établissement pour les médicaments vétérinaires, 2013e.
DMV. Rapport sommaire de consultation sur l'ébauche de définition de produits de santé naturels vétérinaires, s.d.
DMV et ASPC. Memorandum of understanding between Veterinary Drugs Directorate Health Products and Food Branch and the Laboratory for Foodborne Zoonoses, 2005.
Dowling, P., M. Doucet, S. Fortier, et C. Clark. « CgFARAD - the Canadian Food Animal Residue Avoidance Database », Large Animal Veterinary Rounds, vol. 4, no 1, (2004). Sur Internet : http://www.larounds.ca/crus/laveng_0104.pdf.
Doyle, M. E. Veterinary Drug Residues in Processed Meats -- Potential Health Risk, mars 2006.
DPT. Direction des produits thérapeutiques, Rapport d'étape sur la transformation opérationnelle, 2004.
ECHAMP. Veterinary homeopathic medicinal products. Website of the European Coalition on Homeopathic and Anthroposophic Medicinal Products, 2012 (consulté le 15 mai 2012). Sur Internet : http://www.echamp.eu/regulation/veterinary-homeopathic-medicinal-products.html.
EKOS Research Associates Inc. Survey of Canadians' knowledge & behaviour related to food safety (no du rapport final : 070-09), Santé Canada, 2010. Sur Internet : http://epe.lac-bac.gc.ca/100/200/301/pwgsc-tpsgc/por-ef/health/2010/070-09/report.pdf.
Enne, V. I., C. Cassar, K. Sprigings, M. J. Woodward, et P. M. Bennett. « A high prevalence of antimicrobial resistant Escherichia coli isolated from pigs and a low prevalence of antimicrobial resistant E. coli from cattle and sheep in Great Britain at slaughter », FEMS microbiology letters, vol. 278, no 2 (2008), p. 193-199.
European Food Safety Authority. « Report for 2008 on the results from the monitoring of veterinary medicinal product residues and other substances in food of animal origin in the member states », EFSA Journal, vol. 8, no 4, (2010), p. 1559.
FDA. Inspections, Compliance, Enforcement, and Criminal Investigations: Inspections Database, 2013 (consulté le 27 juin 2013). Sur Internet : http://www.fda.gov/iceci/enforcementactions/ucm222557.htm.
GC. Loi sur les aliments et drogues, L.R.C. ch. F-27, 1985.
GC. Loi sur le ministère de la Santé, L.C. ch. 8, 1996.
GC. Discours du Trône ouvrant la première session de la trente-neuvième législature du Canada, 2007. Sur Internet : http://www.parl.gc.ca/ParlInfo/Documents/ThroneSpeech/39-1-f.html.
GC. Discours du Trône ouvrant la troisième session de la quarantième législature du Canada, 2010. Sur Internet : http://www.parl.gc.ca/Parlinfo/Documents/ThroneSpeech/40-3-f.html.
GC. Plan d'action conjoint du Conseil de coopération en matière de réglementation | Plan d'action économique du Canada, 2011 (consulté le 18 décembre 2012). Sur Internet : http://actionplan.gc.ca/fr/page/ rcc-ccr/plan-daction-conjoint-du-conseil-de-cooperation.
GC. Règlement sur les aliments et drogues, C.R.C., ch.870, 2012a.. Sur Internet : http://laws.justice.gc.ca/PDF/ C.R.C.,_c._870.pdf
GC. Règlement modifiant le Règlement sur les aliments et drogues (1475 - bonnes pratiques de fabrication), 2012b (consulté le 11 décembre 2012).
GC. Santé Canada et la Food and Drug Administration des États-Unis effectuent le premier examen conjoint d'un médicament vétérinaire : Feu vert à un produit antipuces dans le cadre d'un projet du Conseil de coopération en matière de réglementation | Plan d'action économique du Canada, 2012c (consulté le 17 décembre 2012).
Gehring, R., R. E Baynes, et J. E. Riviere. « Application of risk assessment and management principles to the extralabel use of drugs in food-producing animals », Journal of Veterinary Pharmacology and Therapeutics, vol. 29, no 1 (2006), p. 5-14 (doi:10.1111/j.1365-2885.2006.00707.x).
Goetghebeur, M., P. A. Landry, D. Han, et C.Vicente. « Methicillin-resistant Staphylococcus aureus: a public health issue with economic consequences », The Canadian Journal of Infectious Diseases & Medical Microbiology, vol. 18, no 1, (2007), p. 27.
Gow, S. P., et C. L. Waldner. « Antimicrobial drug use and reason for treatment in 203 western Canadian cow-calf herds during calving season ». Preventive Veterinary Medicine, vol. 90, nos 1 et 2 (2009), p. 55-65. (doi:10.1016/j.prevetmed.2009.03.010)
Groupe de travail sur l'IUP. Rapport final du Groupe de travail sur l'importation pour usage personnel de médicaments vétérinaires, 2008.
Handa, A., et P. Webster. « Industry-led committee urges delay in closing loophole allowing import of unapproved antibiotics for animals », Canadian Medical Association Journal, vol. 80, no 9, (2009), p. 914-916. (doi:DOI:10.1503/cmaj.090525)
Helms, M., P. Vastrup, P. Gerner-Smidt, et K. Mølbak. « Excess mortality associated with antimicrobial drug-resistant Salmonella Typhimurium », Emerging Infectious Diseases, vol. 8, no 5 (2002), p. 490.
Holtz, S. Reducing and phasing out the use of antibiotics and hormone growth promoters in Canadian agriculture. Canadian Institute for Environmental Law and Policy, 2009. Sur Internet : http://www.cielap.org/pdf/AHGPs.pdf.
Hurd, H. S. « Danish experience offers lessons for U.S. antibiotic use », Beef Issues Quarterly, vol. 3, no 4, (2012) (consulté le 19 décembre 2012). http://www.beefissuesquarterly.com/ danishexperienceofferslessonsforu.s.antibioticuse.aspx.
ICSA. Moving to competitive veterinary pharmaceutical regulatory programs in Canada: Recommendations further to the Canadian Animal Health Institute - International Federation of Animal Health Survey, 2007.
ICSA. Site Web de l'Institut canadien de la santé animale (ICSA), 2012 (consulté le 17 février 2012). Sur Internet : http://www.cahi-icsa.ca/.
Inspectorat. A5.1 Drug Compliance Verification and Investigations (2003-2004), year-end project report, 2004.
Inspectorat. (POL-0001) Politique de conformité et d'application, 2005a.
Inspectorat. A5.1 Drug Compliance Verification and Investigations (2004-2005), year-end project report, 2005b.
Inspectorat. A5.1 Drug Compliance Verification and Investigations (2005-2006), year-end project report, 2006.
Inspectorat. Politique concernant l'importation ou la vente d'ingrédients pharmaceutiques actifs à usage vétérinaire (POL-0018), 2007a (consulté le 11 décembre 2012).
Inspectorat. Inspectorate gap analysis, 2007b.
Inspectorat. A5.1 Drug Compliance Verification and Investigations (2006-2007), year-end project report, 2007c.
Inspectorat. Inspectorate performance indicators (2007-2008), 2008.
Inspectorat. Inspectorate performance indicators (2008-2009), 2009.
Inspectorat. Politique d'importation et d'exportation des produits de santé en vertu de la Loi sur les aliments et drogues et de ses Règlements (POL-0060), 2010a (consulté le 11 décembre 2012).
Inspectorat. Inspectorate performance indicators (2009-2010), 2010b.
Inspectorat. A5.2 VD GMP inspection reporting - National cumulative and consolidated (2009-2010), 2010c.
Inspectorat. B1.5 Region Border Integrity Unit - Report FY 2009/10 YTD, 2010d.
Inspectorat. B1.5 Region Border Integrity Unit - Report FY 2010/11 YTD, 2011.
Inspectorat. Document d'orientation sur les licences d'établissement et le prix à payer pour les licences d'établissement (GUI-0002), 2012 (consulté le 3 janvier 2013).
Léger Marketing. Food safety: Canadians' awareness, attitudes and behaviours (Public Opinion Research Study No. 048-10), Agence canadienne d'inspection des aliments, 2011. Sur Internet : http://epe.lac-bac.gc.ca/100/200/301/pwgsc-tpsgc/por-ef/canadian_food_inspection_agency/2011/048-10/report.pdf.
Les Études de Marché Créatec. Canadians' perceptions of the safety of Canada's food supply (rapport final no. 226-07). Agence canadienne d'inspection des aliments, 2007. Sur Internet : http://epe.lac-bac.gc.ca/100/200/301/pwgsc-tpsgc/por-ef/canadian_food_inspection_agency/2007/226-07/report.pdf.
Little, C. L., J. F. Richardson, R. J. Owen, E. de Pinna, et E. J. Threlfall. « Campylobacter and Salmonella in raw red meats in the United Kingdom: Prevalence, characterization and antimicrobial resistance pattern, 2003-2005 », Food Microbiology, vol. 25 (2008), p. 538-543.
Lust, E. B., C. Barthold, M. A. Malesker, et T. O. Wichman. « Human health hazards of veterinary medications: information for emergency departments », The Journal of Emergency Medicine, vol. 40, no 2 (2011), p. 198-207 (doi:10.1016/j.jemermed.2009.09.026).
Martin, L. J., M. Fyfe, K. Dore, J. A. Buxton, F. Pollari, B. Henry. Multi-provincial Salmonella Typhimurium case-control study steering committee, « Increased burden of illness associated with antimicrobial-resistant Salmonella enterica serotype Typhimurium infections », The Journal of Infectious Diseases, vol. 189, no 3, (2004), p.377-384.
Mathew, R. Own-use importation (OUI) of veterinary drugs: Task Force report update, 2009.
Mehrotra, M. Drug Approval Process for Minor Species in Canada. (Présenté dans le cadre de la conférence sur la gestion des antimicrobiens en agriculture et en médecine vétérinaire au Canada), 2011.
Menzies, P. I. Growth of small ruminant industries & challenges. (Présenté dans le cadre du forum du MAAARO sur la santé animale), Guelph (Ont.), 2012.
NARMS. National Antimicrobial Resistance Monitoring System (NARMS): 2009 retail meat report. 2009. Sur Internet : http://www.fda.gov/downloads/AnimalVeterinary/SafetyHealth/AntimicrobialResistance/NationalAntimicrobialResistanceMonitoringSystem/UCM257587.pdf.
OMS. Réduire l'utilisation des antimicrobiens chez les animaux destinés à la consommation humaine, 2011.
Palmer, M., S. Sahdev, L. Johnson, J. Adickes, R. Andreatta, C. Chan, A. Zucker. Scientific analysis of The Preservation of Antibiotics for Medical Treatment Act of 2011 (Final Report). Université Columbia, School of International and Public Affairs, 2011. Sur Internet : http://mpaenvironment.ei.columbia.edu/sitefiles/file/Summer%2011%20reports/Preservation%20of%20Antibiotics_%20Final%20Report.pdf.
Prescott, J. F. « Advisory Committee reports to Health Canada on "Antimicrobials in food animals in Canada: Impact on resistance and animal health." » The Canadian Veterinary Journal, vol. 43, no 11 (2002), p. 836.
Prescott, J. F., J. Szkotnicki, J. T. McClure, R. J.Reid-Smith, et D. F. Léger. Antimicrobial Stewardship in Canadian Agriculture and Veterinary Medicine: How is Canada doing and what still needs to be done? (compte rendu de conférence), 2012. Sur Internet : http://www.antimicrobialcanada.com/pdfs/Conference-Report-Final-Draft.pdf.
Province of Manitoba. Extra label drug use in animals (Fact Sheet), 2008. Sur Internet : http://www.gov.mb.ca/agriculture/foodsafety/chiefvo/pdf/cfs03s00a.pdf.
Raison-Peyron, N., D. Messaad, J. Bousquet, et P. Demoly. « Anaphylaxis to beef in penicillin-allergic patient », Allergy, vol. 56, no 8 (2001), p.796-797.
Regulatory Cooperation Council Personal Care Products and Pharmaceuticals Working Group. Good Manufacturing Practices Work Plan, 2012.
Rollin, B. E. « An ethicist's commentary on extra-label drug use », The Canadian Veterinary Journal, vol. 43, no 10 (2002), p. 749-750.
Rosengren, L. B., S. P. Gow, et J. S. Weese. L'utilisation des antimicrobiens et la résistance chez les porcs et les poulets : une revue de la science, des politiques et des pratiques de contrôle - Bilan de l'élevage à l'abattage, Centre de collaboration nationale des maladies infectieuses, 2009.
Santé Canada. Cadre décisionnel de Santé Canada pour la détermination, l'évaluation et la gestion des risques pour la santé, 2001a.
Santé Canada. Cadre de fonctionnement - Comité consultatif sur la résistance aux antimicrobiens - Médicaments vétérinaires, 2001b (consulté le 16 février 2012). https://web.archive.org/web/ 20070813194243//dhp-mps/consultation/vet/com/antimicrob/archive/terms-cadre/index_f.html.
Santé Canada. Avis aux hôpitaux : Micotil (tilmicosine), 2003a(consulté le 19 mars 2012).
Santé Canada. Protocole d'entente entre la Food and Drug Administration du département de la Santé et des Services sociaux des États-Unis d'Amérique et la Direction générale des produits de santé et des aliments de Santé Canada du Canada au sujet de la diffusion et de l'échange de renseignements sur les produits thérapeutiques, 2003b (consulté le 22 février 2012). Sur Internet : https://web.archive.org/web/20130530043000//ahc-asc/intactiv/agree-accord/us-eu-sharing-diffusion-fra.php.
Santé Canada. Lignes directrices du VICH adoptées au Canada - Médicaments vétérinaires, 2003c (consulté le 1er mars 2012).
Santé Canada. Micotil - Réactions indésirables aux médicaments - Médicaments vétérinaires, 2004a (consulté le 3 avril 2012). Sur Internet : https://web.archive.org/web/20130530050640//dhp-mps/vet/advers-react-neg/pharma_let_vet-fra.php.
Santé Canada. Réunions - Comité consultatif sur la résistance aux antimicrobiens, 2004b (consulté le 16 février 2012).
Santé Canada. Modification réglementaire proposée visant à interdire l'importation de médicaments non homologués pour utilisation chez les animaux destinés à l'alimentation : commentaires reçus et réponses formulées par Santé Canada suite à la consultation auprès des intervenants tenue du 2 novembre 2004 au 21 janvier 2005, 2005a.
Santé Canada. Foire aux Questions - Gestion des présentations réglementaires, 2005b (consulté le 1er mars 2012). Sur Internet : http://www.collectionscanada.gc.ca/archivesweb/20060225113522//dhp-mps/legislation/vet/pol/mors-gspr_faq_f.html.
Santé Canada. Protocole d'entente sur les produits thérapeutiques entre la Direction générale des produits de santé et des aliments de Santé Canada et le Département fédéral de l'intérieur, au nom du Conseil fédéral de la Confédération suisse, 2006.
Santé Canada. Cadre de gestion et de responsabilisation axé sur les résultats (CGRR) interministériel du Plan d'action pour assurer la sécurité des produits alimentaires et de consommation (PASPAC, 2008a.
Santé Canada. Politique sur l'utilisation des médicaments en dérogation des directives de l'étiquette chez les animaux destinés à l'alimentation, 2008b.
Santé Canada. Composition du Comité consultatif d'experts sur les produits de santé naturel vétérinaires, 2009 (consulté le 21 mars 2012).
Santé Canada. Rapport sur les plans et les priorités - 2009-2010, 2010a.
Santé Canada. Divisions de la Direction des médicaments vétérinaires, 2010b (consulté le 22 février 2012).
Santé Canada. Plan d'action pour assurer la sécurité des produits alimentaires, Premier rapport annuel (2008-2009), 2010c.
Santé Canada. Food and Consumer Safety Action Plan, 2nd Annual Report (FY 2009-2010, 2010d.
Santé Canada. Direction générale des produits de santé et des aliments (DGPSA) - Comités consultatifs. 2010e.
Santé Canada. Bureau du Directeur général - Inspectorat de la Direction générale des produits de santé et des aliments, 2011a (consulté le 22 février 2012).
Santé Canada. Cadre d'évaluation sommative du Programme des médicaments vétérinaires, 2011b.
Santé Canada. Food and Consumer Safety Action Plan, 3rd Annual Report (FY 2010-2011), 2011c.
Santé Canada. Utilisation de médicaments en dérogation des directives de l'étiquette, 2011d (consulté le 17 février 2012).
Santé Canada. Rapport ministériel sur le rendement de Santé Canada, 2011-12, 2011e (consulté le 6 décembre 2012). Sur Internet : Activité de programme 2.1 : Produits de santé .
Santé Canada. Compte rendu des délibérations : Réunion du Comité consultatif d'experts sur les produits de santé naturels vétérinaires (24 mai 2011), 2011f (consulté le 24 février 2012).
Santé Canada. Rapport sur les plans et les priorités - 2011-2012, 2012a.
Santé Canada. Programme pilote de déclaration provisoire pour les produits vétérinaires de santé à faible risque (PVSFR), Santé Canada, 2012b (consulté le 17 décembre 2012).
Santé Canada. Le gouvernement Harper renforce l'innocuité des médicaments à l'aide de nouvelles normes - Les bonnes pratiques de fabrication s'appliquent maintenant à tous les ingrédients pharmaceutiques actifs, Communiqué de presse, 2013 (consulté le 10 mai 2013).
Santé Canada. Risk Profiling of Feed Medications: Health Canada-CFIA Project, s.d.
Santé Canada et l'Agence européenne des médicaments. Plan de mise en oeuvre de la collaboration en matière de réglementation des produits médicinaux, 2009.
Sarmah, A. K., M. T. Meyer, et A. Boxall. « A global perspective on the use, sales, exposure pathways, occurrence, fate and effects of veterinary antibiotics (VAs) in the environment », Chemosphere, vol. 65, no 5, (2006), p. 725-759.
SCT. Politique sur l'évaluation, 2009. Sur Internet : http://www.tbs-sct.gc.ca/pol/doc-fra.aspx?section=text &id=15024.
Sheridan, J., I. Blair, et D. McDowell. The incidence and antibiotic resistance profiles of Salmonella spp. on Irish retail meat products, 1998.
Silbergeld, E. K., J. Graham, et L. B. Price. « Industrial food animal production, antimicrobial resistance, and human health », Annu. Rev. Public Health, vol. 29 (2008), p. 151-169.
Szkotnicki, J. « Extra-label drug use in food-producing animals in Canada » The Canadian Veterinary Journal, vol. 49, no 12, (2008), p.1161.
Tollefson, L., et M. A. Miller. « Antibiotic use in food animals: controlling the human health impact », Journal of AOAC international, vol. 83, no 2, (2000), p.245-254.
Turnipseed, S., et W. Andersen. « Veterinary Drug Residues », Comprehensive Analytical Chemistry, vol. 51, (2008), p. 307-338. Sur Internet : http://linkinghub.elsevier.com/retrieve/pii/S0166526X0800010X.
US Department of Agriculture. United States National Residue Program - 2009 residue sample result, (mai 2011).
VDD. Potential risk to human health from consumption of milk and meat derived from cattle and sheep treated with copper sulphate which is contaminated with dioxins, 2007g.
VICH. GL33 - Studies to evaluate the safety of residues of veterinary drugs in human food: General approach to testing, 2002.
VICH. GL36 - Studies to evaluate the safety of residues of veterinary drugs in human food: General approach to establish a microbiological ADI, 2004.
Woodward, K. « Veterinary adverse drug event reporting in the United States, Australia and Canada », Veterinary Pharmacovigilance: Adverse Reactions to Veterinary Medicinal Products, John Wiley and Sons, (2009), p 119-149.
Annexe C Tableaux de données supplémentaires
| Étude, auteur(s) et année | Constatations |
|---|---|
| Martin et coll. (2004) | En examinant les données de 440 cas d'intoxication par la Salmonella enterica recensés au Canada de décembre 1999 à novembre 2000, les auteurs ont découvert que les malades dont les infections étaient résistantes à l'ampicilline, au chloramphénicol, à la kanamycine, à la streptomycine, au sulphaméthoxazole et à la tétracycline, tendaient à être hospitalisés plus fréquemment que les malades dont les infections n'étaient pas résistantes à ces médicaments. |
| Helms, Vastrup, Gerner-Smidt et Mølbak (2002) | En se servant d'une méthode faisant appel à un groupe témoin, les auteurs ont découvert que, alors que des malades danois infectés par des souches de Salmonella typhimurium sensibles au traitement avec des antibiotiques étaient 2,3 fois plus à risque que la population générale de mourir dans les deux années suivantes, les malades infectés par des souches résistantes à l'ampicilline, au chloramphénicol, à la streptomycine, au sulphonamide et à la tétracycline étaient 4,8 fois plus à risque de mourir; lorsqu'il y a résistance à la quinolone, la probabilité de décès est 10,3 fois plus grande par rapport à la population générale. |
| Birnbaum, Jandciu et Twells (2002) | Les auteurs estiment que les infections résistantes aux médicaments ont provoqué un accroissement du coût des soins de santé compris entre 14,2 et 25,5 millions de dollars par an au Canada en raison de l'augmentation des coûts d'hospitalisation. De plus, ils estiment que le dépistage permettant de détecter les porteurs d'organismes résistants ferait augmenter les coûts annuels de 10,3 millions de dollars, alors que la mise en quarantaine des porteurs coûterait 15,9 millions de dollars de plus. Si le niveau de résistance aux médicaments au Canada devait augmenter pour atteindre les niveaux existants actuellement aux États-Unis, Birnbaum et coll. (2002) sont d'avis que les coûts annuels d'hospitalisation seuls augmenteraient d'un montant compris entre 103,9 et 187,1 millions de dollars. |
| Goetghebeur, Landry, Han et Vicente (2007) | Les auteurs citent des résultats provenant du Programme canadien de surveillance des infections nosocomiales (PCSIN) suggérant que les cas de staphylocoque doré résistant à la méthicilline (SARM) ont été multipliés par dix dans les hôpitaux canadiens entre 1995 et 2004 (p. 27). Ils estiment que pour chaque malade infecté par le SARM le coût moyen (principalement attribuable aux frais d'hospitalisation) est de 12 216 dollars (dollars de 2005), ce qui entraînerait des coûts totaux directs pour les soins de santé au Canada de 82 millions de dollars en 2004. En se fondant sur les augmentations historiques des coûts attribuables au SARM, ils prévoient que cela coûtera 129 millions de dollars au système de santé en 2010 (Goetghebeur et coll., 2007, p. 31). Les auteurs indiquent que ces chiffres sont probablement les chiffres minimaux, car ils ne tiennent pas compte des cas de SARM d'origine communautaire (SARM-OC), des coûts de gestion d'une épidémie, ou des coûts indirects (p. 31-32). |
| Étude, auteur(s) et année | Constatations |
|---|---|
| ASPC (2011) | Dans le rapport du PICRA de 2008, on indique que l'on a trouvé des E. coli résistant à la ciprofloxacine dans du poulet et du porc vendus au détail. Dans un bulletin de surveillance récent du PICRA, on signale une augmentation considérable des cas où l'on a trouvé des campylobactéries résistant à la ciprofloxacine dans du poulet en Colombie-Britannique et en Saskatchewan. La ciprofloxacine est une fluoroquinolone antimicrobienne, considérée comme très importante pour la médecine humaine (ASPC, 2011, p. 92). |
| NARMS (2009) | On a trouvé récemment des bactéries résistant aux médicaments dans du poulet, de la dinde hachée, du bœuf haché et des côtelettes de porc vendus au détail par l'intermédiaire du National Antimicrobial Resistance Monitoring System (NARMS) américain. |
| Enne, Cassar, Sprigings, Woodward et Bennett (2008); Little, Richardson, Owen, de Pinna et Threlfall (2008); Sheridan, Blair et McDowell (1998) | Ces auteurs ont signalé des cas où l'on a trouvé des bactéries résistant aux antimicrobiens dans de la viande vendue au détail et dans de la viande venant d'abattoirs au Royaume-Uni. |
| Élément | Description |
|---|---|
| Volume principal | Comprend entre autres, une lettre d'accompagnement et une table des matières, un formulaire d'attestation de demande rempli, des lettres d'autorisation, un formulaire de présentation du médicament et un formulaire concernant les frais de présentation, des formulaires concernant les ingrédients d'origine animale, la version provisoire des étiquettes ainsi que des formulaires et documents concernant le brevet. |
| Section sur la fabrication et le contrôle de la qualité | Comprend des renseignements détaillés sur la substance médicamenteuse et le produit pharmaceutique (ce ne sont pas des synonymes), comme la nomenclature, la structure chimique, les propriétés physicochimiques, la méthode de fabrication, l'élucidation et la confirmation de la structure, les impuretés, les normes de référence, la description de l'emballage et la stabilité. |
| Section sur l'innocuité pour les animaux | Il s'agit des renseignements concernant les études sur l'animal en laboratoire et les études cibles sur l'innocuité du produit pour les animaux. Dans chaque cas, il faut donner une vaste gamme de renseignements; par exemple, le contenu de la présentation lié aux études sur l'animal en laboratoire comprend des études sur la toxicité aiguë, sous-chronique et chronique, des études sur l'irritation ainsi que des études sur la reproduction et sur la tératogénicité. |
| Section sur l'efficacité du produit | Il s'agit des résultats des études de microbiologie, des études faites en laboratoire, de l'efficacité du modèle animal, et des études de pharmacologie clinique, ainsi que de la détermination des doses et les études de confirmation. |
| Section pour l'innocuité pour les humains | La section est divisée en trois sous-sections examinant respectivement la toxicité chez l'animal étudiée en laboratoire, la sécurité microbiologique et les résidus. La section a pour but de répondre à des questions telles que l'incidence de nouveaux agents antimicrobiens sur la microflore intestinale humaine et la médecine humaine, ainsi que les incidences possibles résultant de l'ingestion par des consommateurs de résidus de médicaments vétérinaires et le temps nécessaire pour que les résidus de médicaments contenus dans les tissus ou produits animaux atteignent un niveau inférieur à la LMR. |
| Section sur les incidences pour l'environnement | Correspond au Règlement sur les renseignements concernant les substances nouvelles de la Loi canadienne sur la protection de l'environnement |
Source : (DMV, 2007b)
| Catégorie de présentation | Cible en jours | ||||
|---|---|---|---|---|---|
| Examen préliminaire 1 | Examen préliminaire 2 | Examen 1 | Examen 2 | Total | |
| Présentation de drogue nouvelle | 45 | 45 | 300 | 150 | 540 |
| Présentation abrégée de drogue nouvelle | 45 | 45 | 300 | 150 | 540 |
| Supplément à une présentation de drogue nouvelle | 45 | 45 | 240 | 120 | 450 |
| Supplément à la présentation abrégée de drogue nouvelle | 45 | 45 | 240 | 120 | 450 |
| Présentation administrative de drogue nouvelle | 14 | 14 | 90 | 45 | 163 |
| Présentation administrative abrégée de drogue nouvelle | 14 | 14 | 90 | 45 | 163 |
| Présentation de modification à déclaration obligatoire | S.O. | S.O. | 90 | S.O. | 90 |
| Présentation de drogue nouvelle de recherche | S.O. | S.O. | 60 | S.O. | 60 |
| Demande de certificat d'études expérimentales | S.O. | S.O. | 60 | S.O. | 60 |
| Demande de numéro d'identification du médicament | S.O. | S.O. | 120 | S.O. | 120 |
| Demande de distribution d'une drogue pour traitement d'urgenceNote de bas de page * | S.O. | S.O. | S.O. | S.O. | S.O. |
|
|||||
Source : DGPSA (2010c)
| Type de soumission, de despitage et de l'examen |
2008-2009 | 2009-2010 | 2010-2011 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| T1 | T2 | T3 | T4 | T1 | T2 | T3 | T4 | T1 | T2 | T3 | T4 | |||
| PDN | Examen préliminaire | 1 | O | O | O | O | N | O | N | O | N | N | N | O |
| 2 | O | O | O | O | PR | PR | O | O | O | O | O | N | ||
| Examen | 1 | PR | PR | PR | PR | N | N | N | N | N | N | O | N | |
| 2 | PR | PR | PR | PR | PR | PR | N | N | O | N | N | O | ||
| PADN | Examen préliminaire | 1 | S.O. | N | O | O | O | O | S.O. | O | N | N | N | O |
| 2 | O | O | S.O. | S.O. | PR | PR | S.O. | S.O. | O | S.O. | S.O. | S.O. | ||
| Examen | 1 | PR | PR | PR | PR | O | N | O | O | N | O | S.O. | N | |
| 2 | PR | PR | PR | PR | PR | PR | S.O. | S.O. | S.O. | N | S.O. | S.O. | ||
| SPDN | Examen préliminaire | 1 | O | O | O | O | O | O | O | S.O. | O | O | N | N |
| 2 | O | O | O | S.O. | PR | PR | S.O. | O | S.O. | S.O. | S.O. | S.O. | ||
| Examen | 1 | PR | PR | PR | PR | O | N | O | N | N | N | N | N | |
| 2 | PR | PR | PR | PR | PR | PR | N | S.O. | O | S.O. | S.O. | S.O. | ||
| SPADN | Examen préliminaire | 1 | S.O. | S.O. | S.O. | O | S.O. | S.O. | O | S.O. | S.O. | O | O | N |
| 2 | S.O. | S.O. | S.O. | S.O. | PR | PR | S.O. | S.O. | S.O. | S.O. | S.O. | S.O. | ||
| Examen | 1 | PR | PR | PR | PR | S.O. | S.O. | O | O | O | S.O. | S.O. | N | |
| 2 | PR | PR | PR | PR | PR | PR | S.O. | S.O. | S.O. | S.O. | S.O. | S.O. | ||
| PADN | Examen préliminaire | 1 | N | O | S.O. | O | PR | PR | N | O | O | N | O | O |
| 2 | S.O. | S.O. | S.O. | O | PR | PR | O | O | S.O. | S.O. | S.O. | S.O. | ||
| Examen | 1 | PR | PR | PR | PR | PR | PR | N | N | N | N | O | N | |
| 2 | PR | PR | PR | PR | PR | PR | O | N | N | S.O. | S.O. | S.O. | ||
| PAADN | Examen préliminaire | 1 | S.O. | S.O. | S.O. | S.O. | PR | PR | S.O. | S.O. | S.O. | S.O. | S.O. | S.O. |
| 2 | S.O. | S.O. | S.O. | S.O. | PR | PR | S.O. | S.O. | S.O. | S.O. | S.O. | S.O. | ||
| Examen | 1 | PR | PR | PR | PR | PR | PR | S.O. | S.O. | S.O. | S.O. | S.O. | S.O. | |
| 2 | PR | PR | PR | PR | PR | PR | S.O. | S.O. | S.O. | S.O. | S.O. | S.O. | ||
| MDO (examen 1) | PR | PR | PR | PR | PR | PR | N | N | N | N | N | N | ||
| PDNR (examen 1) | S.O. | S.O. | S.O. | S.O. | PR | PR | S.O. | S.O. | O | S.O. | N | S.O. | ||
| DCEE (examen 1) | O | O | O | O | PR | PR | O | O | O | O | N | O | ||
| DIN (examen 1) | N | N | O | O | PR | PR | N | N | O | N | N | N | ||
| DDMU (examen 1) | O | O | O | O | PR | PR | O | O | O | O | O | O | ||
| Nombre de cibles atteintes | 7/9 | 8/10 | 8/8 | 10/10 | 4/6 | 3/6 | 10/18 | 10/17 | 11/19 | 6/16 | 6/15 | 6/16 | ||
| % de cibles atteintes | 77,8 | 80,0 | 100,0 | 100,0 | 66,7 | 50,0 | 55,6 | 58,8 | 57,9 | 37,5 | 40,0 | 37,5 | ||
NOTA : Les cases O indiquent que les cibles ont été atteintes, alors que les cases N indiquent que les cibles n'ont pas été atteintes. Les cases PR indiquent les trimestres où l'on n'a pas recueilli de données.
Adapté de : DGPSA (2010c); (2008b, 2008c, 2009d, 2009e, 2009f, 2009g, 2010b, 2010c, 2010d, 2011f, 2011g)
| Opionion de l'industrie | n=10 | |||
|---|---|---|---|---|
| D'accord | Opinion neutre | Pas d'accord | Ne sait pas | |
| Santé Canada a consulté convenablement l'industrie des médicaments vétérinaires au cours des 10 dernières années. | 7 | 1 | 2 | - |
| Les mécanismes de consultation que Santé Canada utilise actuellement constituent un moyen efficace permettant à l'industrie des médicaments vétérinaires d'exprimer ses préoccupations et intérêts à Santé Canada. | 6 | 3 | 1 | - |
| Au cours des 10 dernières années, Santé Canada a tenu compte des préoccupations et des intérêts de l'industrie des médicaments vétérinaires pour préparer ses politiques et règlements. | 3 | 3 | 4 | - |
| Les réunions préalables aux présentations sont un mécanisme efficace pour s'assurer que les présentations de produits satisfont aux exigences de Santé Canada | 9 | 1 | - | - |
| Mon organisation sait que la Direction des médicaments vétérinaires a un processus en place pour le règlement des différends pendant la présentation des produits. | 5 | 2 | 3 | - |
| Opinion des utilisateurs finaux | n=21 | |||
|---|---|---|---|---|
| D'accord | Opinion neutre | Pas d'accord | Ne sait pas | |
| Santé Canada a consulté convenablement les utilisateurs finaux de médicaments vétérinaires au cours des 10 dernières années. | 5 | 5 | 5 | 6 |
| Les mécanismes de consultation que Santé Canada utilise actuellement constituent un moyen efficace permettant aux utilisateurs finaux de médicaments vétérinaires d'exprimer leurs préoccupations et intérêts à Santé Canada. | 6 | 3 | 7 | 5 |
| Au cours des 10 dernières années, Santé Canada a tenu compte des préoccupations et des intérêts des utilisateurs finaux de médicaments vétérinaires pour préparer ses politiques et règlements. | 2 | 7 | 5 | 7 |
| Notation des utilisateurs finaux | n=21 | ||
|---|---|---|---|
| Élevé | Moyen | Faible | |
| Mesures de gestion du risque visant la résistance aux antimicrobiens attribuable à l'emploi d'agents antimicrobiens pour les animaux destinés à l'alimentation | 14 | 4 | 3 |
| Risques pour la santé humaine que présente la résistance aux antimicrobiens attribuable à l'emploi d'agents antimicrobiens pour les animaux destinés à l'alimentation | 13 | 7 | 1 |
| Politique de Santé Canada sur l'utilisation de médicaments en dérogation des directives de l'étiquette | 13 | 5 | 3 |
| Emploi prudent des médicaments vétérinaires dans les aliments pour animaux d'élevage | 12 | 6 | 3 |
| LMR pour les animaux destinés à l'alimentation | 10 | 7 | 4 |
| Risques pour la santé humaine que présente l'utilisation de médicaments en dérogation des directives de l'étiquette pour les animaux destinés à l'alimentation | 9 | 6 | 6 |
| Risques pour la santé des animaux et la santé humaine que présente l'emploi de médicaments non homologués, y compris l'utilisation en préparation et l'utilisation directe d'IPA | 8 | 9 | 4 |
| Risques pour la santé humaine que présente l'emploi de stimulateurs de croissance hormonaux pour les animaux destinés à l'alimentation | 5 | 11 | 5 |
| Comment et quand déclarer les RIM | 4 | 12 | 5 |
| Type d'information | n=21 | |
|---|---|---|
| Connaît l'information | Utilise l'information | |
| Information sur les LMR pour les animaux destinés à l'alimentation | 19 | 10 |
| Politique de Santé Canada sur l'utilisation de médicaments en dérogation des directives de l'étiquette | 17 | 11 |
| Information sur les risques pour la santé humaine que présente la résistance aux antimicrobiens attribuable à l'emploi d'agents antimicrobiens pour les animaux destinés à l'alimentation | 16 | 7 |
| Mesures de gestion du risque visant la résistance aux antimicrobiens attribuable à l'emploi d'agents antimicrobiens pour les animaux destinés à l'alimentation | 15 | 9 |
| Information sur l'emploi prudent des médicaments vétérinaires dans les aliments pour animaux d'élevage | 15 | 6 |
| Information sur comment et quand déclarer les RIM | 15 | 4 |
| Information sur les risques pour la santé humaine que présente l'utilisation de médicaments en dérogation des directives de l'étiquette pour les animaux destinés à l'alimentation | 14 | 6 |
| Information sur les RIM, les mises en garde et les rappels liés à des médicaments vétérinaires particuliers | 14 | 3 |
| Information sur les risques pour la santé des animaux et la santé humaine que présente l'emploi de médicaments non homologués, y compris l'utilisation en préparation et l'utilisation directe d'IPA | 12 | 2 |
| Information sur les risques pour la santé humaine que présente l'emploi de stimulateurs de croissance hormonaux pour les animaux destinés à l'alimentation | 10 | 1 |
| Des utilisateurs finaux de compréhension niveau | n=21 | |||
|---|---|---|---|---|
| D'accord | Opinion neutre | Pas d'accord | Ne sait pas | |
| Dans l'ensemble, Santé Canada m'a aidé à comprendre les risques que les médicaments vétérinaires présentent pour la santé des animaux. | 7 | 8 | 4 | 2 |
| Dans l'ensemble, Santé Canada m'a aidé à comprendre les risques que les médicaments vétérinaires présentent pour la santé humaine. | 7 | 5 | 7 | 2 |
| Règlements, politiques et activités de Santé Canada | n=10 | ||
|---|---|---|---|
| Élevé | Moyen | Faible | |
| Exigences de Santé Canada concernant la présentation de médicaments vétérinaires | 7 | 2 | 1 |
| Exigences de Santé Canada concernant les BPF pour les fabricants de médicaments vétérinaires | 5 | 5 | - |
| Exigences de Santé Canada concernant la délivrance de licences d'établissement pour les fabricants de médicaments vétérinaires | 5 | 4 | 1 |
| Exigences de Santé Canada concernant l'obligation de déclarer les RIM pour les médicaments vétérinaires | 5 | 2 | 3 |
| Activités d'application de la règlementation de Santé Canada, y compris les inspections et la vérification de la conformité ainsi que les mesures d'application de la loi prises pour s'attaquer aux risques recensés (c.-à-d. la non-conformité) | 1 | 6 | 3 |
| Type d'information | (n=10) | |
|---|---|---|
| Connaît l'information | Utilise l'information | |
| Information sur les exigences de Santé Canada relatives aux présentations pour les fabricants de médicaments vétérinaires demandant qu'un nouveau produit soit homologué pour la vente au Canada | 10 | 9 |
| Information sur les exigences de Santé Canada concernant les BPF pour les fabricants de médicaments vétérinaires | 10 | 9 |
| Information sur les exigences concernant la délivrance de licences d'établissement pour les fabricants de médicaments vétérinaires | 10 | 8 |
| Information sur les exigences de Santé Canada concernant l'obligation de déclarer les RIM pour les médicaments vétérinaires | 10 | 8 |
| Information sur le processus de présentation électronique pour les médicaments vétérinaires | 9 | 3 |
| Information sur les activités d'application de la règlementation de Santé Canada, y compris les inspections et la vérification de la conformité et les mesures d'application de la loi prises pour s'attaquer aux risques recensés | 7 | 6 |
| Industrie de compréhension niveau | (n=10) | |||
|---|---|---|---|---|
| D'accord | Opinion neutre | Pas d'accord | Ne sait pas | |
| Santé Canada a clairement indiqué les délais dans lesquels il faut déclarer les RIM. | 8 | - | 1 | 1 |
| Santé Canada a clairement indiqué l'information que les fabricants doivent donner/que les utilisateurs finaux de médicaments devraient donner. | 6 | 2 | 2 | - |
| Santé Canada a clairement indiqué à quel service du Ministère les fabricants doivent déclarer les RIM/les utilisateurs finaux de médicaments devraient déclarer les RIM. | 6 | 2 | 2 | - |
| Santé Canada a clairement indiqué à quel service du Ministère les fabricants doivent déclarer les RIM/les utilisateurs finaux de médicaments devraient déclarer les RIM. | 5 | 2 | 3 | - |
| Si l'on devait déclarer des RIM, ma société pourrait donner toute l'information demandée par Santé Canada.Note de bas de page * | 6 | 1 | 1 | - |
| Si l'on devait déclarer des RIM, ma société pourrait remplir le rapport obligatoire sur les RIM dans les délais exigés.Note de bas de page * | 5 | 2 | 1 | - |
|
||||
| Des utilisateurs finaux de compréhension niveau | n=21 | |||
|---|---|---|---|---|
| D'accord | Opinion neutre | Pas d'accord | Ne sait pas | |
| Santé Canada a clairement indiqué l'information qu'il recommande aux utilisateurs finaux de médicaments de donner. | 7 | 4 | 1 | 9 |
| Santé Canada a clairement indiqué à quel service du Ministère les utilisateurs finaux de médicaments devraient déclarer les RIM. | 5 | 5 | 1 | 10 |
| Santé Canada a clairement défini quels RIM on recommande aux utilisateurs finaux de médicaments de déclarer. | 8 | 2 | 2 | 9 |
| Des utilisateurs finaux d'accord de niveau | n=21 | |||
|---|---|---|---|---|
| D'accord | Opinion neutre | Pas d'accord | Ne sait pas | |
| Dans l'ensemble, Santé Canada m'a aidé à comprendre les risques que les médicaments vétérinaires présentent pour la santé des animaux. | 7 | 8 | 4 | 2 |
| Dans l'ensemble, Santé Canada m'a aidé à comprendre les risques que les médicaments vétérinaires présentent pour la santé humaine. | 7 | 5 | 7 | 2 |
| Les politiques de Santé Canada et ses communications sur les risques ont influé sur la manière dont j'exerce la médecine vétérinaire et j'utilise les médicaments vétérinaires. | 7 | 6 | 4 | 4 |
| Accord de niveau | Industrie (n=10) | Utilisateurs (n=21) | ||||||
|---|---|---|---|---|---|---|---|---|
| D'accord | Opinion neutre | Pas d'accord | Ne sait pas | D'accord | Opinion neutre | Pas d'accord | Ne sait pas | |
| Les politiques et les règlements de Santé Canada sur les médicaments vétérinaires sont fondés sur les meilleures données scientifiques existantes. | 4 | 4 | 2 | - | 11 | 3 | 1 | 6 |
| Les politiques et les règlements de Santé Canada sur les médicaments vétérinaires sont fondés sur une bonne analyse du risque. | 3 | 3 | 4 | - | 11 | 3 | 1 | 6 |
| Accord de niveau | Industrie (n=10) | Utilisateurs (n=21) | ||||||
|---|---|---|---|---|---|---|---|---|
| D'accord | Opinion neutre | Pas d'accord | Ne sait pas | D'accord | Opinion neutre | Pas d'accord | Ne sait pas | |
| Dans l'ensemble, au cours des 10 dernières années, Santé Canada a réagi rapidement lorsque l'on a découvert que des médicaments vétérinaires présentaient des risques. | 2 | 2 | 4 | 2 | 4 | 6 | 2 | 9 |
| Année financière | Saisies | Poursuites judiciaires | Dispositions volontairesNote de bas de page * | Détentions volontairesNote de bas de page ˆ | Toutes mesures comprises |
|---|---|---|---|---|---|
| 2003-2004 | 0 | 0 | 1 | 2 | 3 |
| 2004-2005 | 0 | 0 | 0 | 1 | 1 |
| 2005-2006 | 0 | 0 | 0 | 3 | 3 |
| 2006-2007 | 0 | 0 | 0 | 0 | 0 |
| Total | 0 | 0 | 1 | 6 | 7 |
Sources : Inspectorat (2004, 2005b, 2006, 2007c, 2008, 2009b, 2010b)
|
|||||
| Année financière | Type I | Type II | Type III | Sans catégorie | Total |
|---|---|---|---|---|---|
| 2003-2004 | 0 | 5 | 5 | 0 | 10 |
| 2004-2005 | 0 | 5 | 7 | 0 | 12 |
| 2005-2006 | 1 | 3 | 4 | 0 | 8 |
| 2006-2007 | 1 | 0 | 2 | 0 | 3 |
| 2007-2008 | 0 | 0 | 0 | 0 | 0 |
| 2008-2009 | 0 | 1 | 2 | 0 | 3 |
| 2009-2010 | 2 | 11 | 0 | 0 | 13 |
| 2010-2011 | 1 | 0 | 4 | 3 | 8 |
| Total | 5 | 25 | 24 | 3 | 57 |
Sources : Inspectorat (2004, 2005b, 2006, 2007c, 2008, 2009b, 2010b). Données de 2010-2011 fournies par Santé Canada
| Année financière | Trimestre | Refus | Libération | Total | ||
|---|---|---|---|---|---|---|
| Contrefaçon (soupçonnée) | Tous les autres | Total | ||||
| 2003-2004 | Total | Note de bas de page * 59 | 59 | S.O. | S.O. | |
| 2004-2005 | Total | Note de bas de page * 68 | 68 | 96 | 164 | |
| 2005-2006 | Total | Note de bas de page * 33 | 33 | 167 | 200 | |
| 2006-2007 | Total | Note de bas de page * 59 | 59 | 77 | 136 | |
| 2007-2008 | Total | S.O. | S.O. | S.O. | S.O. | S.O. |
| 2008-2009 | Total | S.O. | S.O. | S.O. | S.O. | S.O. |
| 2009-2010 | T1 | 0 | 2 | 2 | 0 | 2 |
| T2 | 6 | 2 | 8 | 9 | 17 | |
| T3 | 0 | 12 | 12 | 31 | 43 | |
| T4 | 3 | 5 | 8 | 37 | 45 | |
| Total | 9 | 21 | 30 | 77 | 107 | |
| 2010-2011 | T1 | 0 | 22 | 22 | 38 | 60 |
| T2 | 0 | 16 | 16 | 27 | 43 | |
| T3 | 0 | 18 | 18 | 39 | 57 | |
| T4 | 0 | 12 | 12 | 27 | 39 | |
| Total | 0 | 68 | 68 | 131 | 199 | |
| De 2009-2010 à 2010-2011 | 9 | 89 | 98 | 208 | 306 | |
Sources : Inspectorat (2004, 2005b, 2006, 2007c, 2010d, 2011) Note de bas de page * Le rapport existant n'indique pas les raisons des refus. |
||||||
| Source | Paramètre | Produits laitiers | OEufs | Miel | Viande | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2005-2006 | 2006-2007 | 2007-2008 | 2005-2006 | 2006-2007 | 2007-2008 | 2005-2006 | 2006-2007 | 2007-2008 | 2005-2006Note de bas de page * | 2006-2007 | 2007-2008 | ||
| Produits canadiens | Nombre de tests effectués | 3 167 | 1 906 | 2 493 | 6 239 | 4 945 | 5 457 | 1 318 | 1 318 | 1 857 | S.O. | S.O. | 65 995 |
| Nombre de résidus détectés | 12 | 12 | 9 | 63 | 158 | 136 | 42 | 44 | 50 | S.O. | S.O. | 1 132 | |
| % de résultats positifs | 0,38 % | 0,63 % | 0,31 % | 1,01 % | 3,20 % | 2,49 % | 3,19 % | 3,34 % | 2,69 % | S.O. | S.O. | 1,72 % | |
| Nombre d'infractions constatées | 12 | 3 | 8 | 63 | 155 | 25 | 42 | 6 | 1 | S.O. | S.O. | 335 | |
| % de conformité | 99,62 % | 99,84 % | 99,73 % | 98,99 % | 96,87 % | 99,54 % | 96,81 % | 99,54 % | 99,95 % | 99,69 % | S.O. | 99,49 % | |
| Produits importés | Nombre de tests effectués | 2 114 | 1 533 | 1 415 | 4 949 | 3 496 | 3 421 | 141 | 335 | 636 | S.O. | S.O. | 2 893 |
| Nombre de résidus détectés | 8 | 24 | 28 | 27 | 33 | 33 | 2 | 10 | 30 | S.O. | S.O. | 7 | |
| % de résultats positifs | 0,38 % | 1,57 % | 1,98 % | 0,55 % | 0,94 % | 0,96 % | 1,42 % | 2,99 % | 4,72 % | S.O. | S.O. | 0,24 % | |
| Nombre d'infractions constatées | 8 | 3 | 22 | 27 | 33 | 14 | 2 | 9 | 5 | S.O. | S.O. | 1 | |
| % de conformité | 99,62 % | 99,80 % | 98,45 % | 99,45 % | 99,06 % | 99,59 % | 98,58 % | 97,31 % | 99,21 % | 99,95 % | S.O. | 99,97 % | |
| Total | Nombre de tests effectués | 5 281 | 3 439 | 4 358 | 11 188 | 8 441 | 8 878 | 1 459 | 1 653 | 2 493 | S.O. | S.O. | 68 888 |
| Nombre de résidus détectés | 20 | 36 | 37 | 90 | 191 | 169 | 44 | 54 | 80 | S.O. | S.O. | 1 139 | |
| % de résultats positifs | 0,38 % | 1,05 % | 0,85 % | 0,80 % | 2,26 % | 1,90 % | 3,02 % | 3,27 % | 3,21 % | S.O. | S.O. | 1,65 % | |
| Nombre d'infractions constatées | 20 | 6 | 30 | 90 | 188 | 39 | 44 | 15 | 6 | S.O. | S.O. | 336 | |
| % de conformité | 99,62 % | 99,83 % | 99,31 % | 99,20 % | 97,77 % | 99,56 % | 96,98 % | 99,09 % | 99,76 % | S.O. | S.O. | 99,51 % | |
|
|||||||||||||
| Année financière | Vérification de la teneur garantie en substances médicamenteuses | Inspection de la contamination par des résidus de médicaments | ||
|---|---|---|---|---|
| % d'échantillons conformes (établissement commercial) |
% d'échantillons conformes (exploitation agricole) |
% d'échantillons conformes (établissement commercial) |
% d'échantillons conformes (exploitation agricole) |
|
| 1991-1992 | - | - | 72,6 | 72,7 |
| 1992-1993 | - | - | 71,5 | 70,6 |
| 1993-1994 | - | - | 81,6 | 76,7 |
| 1994-1995 | - | - | 81,8 | 83,3 |
| 1995-1996 | 76,2 | 51,9 | 76,4 | 78,8 |
| 1996-1997 | 77,3 | 52,9 | 83,8 | 82,1 |
| 1997-1998 | 77,7 | 53,8 | 83,1 | 85,9 |
| 1998-1999 | 74,8 | 59,4 | 84,2 | 77,8 |
| 1999-2000 | 80,6 | 60,2 | 82,7 | 87,5 |
| 2000-2001 | 80,0 | 62,0 | 84,4 | 86,4 |
| 2001-2002 | 79,0 | 41,9 | 85,3 | 83,6 |
| 2002-2003 | 77,3 | 62,2 | 86,2 | 86,3 |
| 2003-2004 | 79,9 | 56,8 | 90,3 | 79,0 |
| 2004-2005 | 79,8 | 66,1 | 92,6 | 87,2 |
| 2005-2006 | 78,2 | 61,1 | 92,5 | 90,1 |
| 2006-2007 | 85,8 | 58,2 | 82,8 | 88,7 |
| Moyenne | 78,2 | 58,2 | 81,9 | 80,8 |
Sources : ACIA (s.d.-a, s.d.-b)
| Titre | Description | Composition | Activités consignées |
|---|---|---|---|
| ICSA | L'ICSA est une association sectorielle représentant les entreprises qui « mettent au point, fabriquent et distribuent des produits de santé animale tels que les produits pharmaceutiques et biologiques, les additifs alimentaires et les pesticides pour animaux au Canada » (ICSA, 2012). Sa mission est « d'encourager la mise à disposition rapide de produits de santé animale sûrs et efficaces qui contribuent à la santé et au bien-être des animaux et à une production alimentaire saine et complète, lesquelles jouent un rôle important sur la santé et le bien-être de la population en général ». (ICSA, 2012) | On n'a pas trouvé de liste des membres. | L'ICSA a eu des consultations fréquentes avec la DMV sur divers dossiers intéressant ses membres. Selon les documents, l'association demeure active dans ce rôle. |
| Comité des intervenants de la DMV | Le mandant du Comité des intervenants de la DMV n'est pas officiellement défini dans les documents à notre disposition; dans l'un des documents, on indique que son but est de fournir un forum pour obtenir l'avis des intervenants sur les principaux dossiers qui relèvent de la Direction des médicaments vétérinaires (DGPSA, 2007b, p. 37). | La composition du comité lors de la dernière réunion des intervenants ayant fait l'objet d'un procès-verbal en novembre 2006 est donnée dans le compte rendu de la réunion (DMV, 2006d). Le comité était alors composé d'universitaires et de représentants des groupes d'éleveurs, des associations de vétérinaires et d'autres groupes d'intérêt (p. ex. la Society for Environmentally Responsible Livestock Operation en Alberta, le Réseau canadien de l'environnement) (DMV, 2006d, p. 1). | Il existe neuf procès-verbaux des réunions du Comité des intervenants de la DMV qui ont eu lieu entre 2002 et 2006, ainsi que 17 communiqués; il n'y a aucune indication de l'activité du comité depuis cette date. Le CCCRPSV, qui avait été formé en tant que sous-comité du Comité des intervenants, semble être toujours actif. |
| CCCRPSV | Formé en tant que sous-comité du comité consultatif des intervenants de la DMV (DMV, 2008d, p. 8), le CCCRPSV se réunit selon les besoins (Santé Canada, 2010e, p. 7). | On n'a pas trouvé de liste des membres, mais, selon Santé Canada, le CCCRPSV est composé de 17 membres (Santé Canada, 2010e, p. 7). | L'examen des rapports de rendement de la DMV indique : que le CCCRPSV a été créé par la DMV et l'ACIA en collaboration avec l'ICSA au début de 2008 (DMV, 2009b, p. 1); que le CCCRPSV a eu sa troisième réunion le 26 juin 2008 (DMV, 2008d, p. 8). Une proposition de méthode pour l'examen parallèle a été présentée à une réunion du CCCRPSV en avril 2010, ce qui laisse penser que le comité est encore actif (DGPSA, 2010d, p. 10) |
| Regroupement des catégories d'antimicrobiens et importance en médecine humaine (échelle de 1 à 4, 1 étant le plus important) | Poids total des ingrédients actifs (kg) | Écart (%), 2006-2008 |
Écart (%), 2007-2008 |
|||
|---|---|---|---|---|---|---|
| 2006 | 2007 | 2008 | ||||
| Aminoglucosides | Note de bas de page * 1-2 | 5 121,60 | 4 302,20 | 5 816,88 | 13,58 % | 35,21 % |
| Amphénicols | 3 | S.O. | S.O. | 3 242,03 | S.O. | S.O. |
| Bêta-lactamines (2006 et 2007) | 2 | 58 538,00 | 52 594,00 | S.O. | S.O. | S.O. |
| Bêta-lactamines (2008) | 2 | S.O. | S.O. | 109 152,97 | S.O. | S.O. |
| Cephalosporines | 1-2 | 702,00 | 850,00 | S.O. | S.O. | S.O. |
| Fluoroquinolones | 1 | 591,00 | 443,10 | 411,44 | -30,38 % | -7,15 % |
| Ionophores, anticoccidiens et arsenicaux (2006 et 2007) | 4 | 455 753,00 | 445 952,00 | S.O. | S.O. | S.O. |
| Ionophores, anticoccidiens et arsenicaux, et nitroimidazoles (2008) | Note de bas de page ˆ 4 | S.O. | S.O. | 472 384,36 | S.O. | S.O. |
| Lincosamides | 2 | 67 825,30 | 55 872,30 | 41 222,12 | -39,22 % | -26,22 % |
| Macrolides et pleuromutilines (2006 et 2007) | Note de bas de page ** 2-3 | 136 496,50 | 118 724,80 | S.O. | S.O. | S.O. |
| Macrolides, pleuromutilines et bacitracines (2008) | Note de bas de page ** 2-3 | S.O. | S.O. | 210 868,75 | S.O. | S.O. |
| Tétracyclines | 3 | 847 280,60 | 753 168,40 | 680 601,15 | -19,67 % | -9,63 % |
| Triméthoprime et sulfonamides | Note de bas de page ˆˆ 2-3 | 50 789,00 | 38 961,00 | 59 165,54 | 16,49 % | 51,86 % |
| Autres antimicrobiens (2006 et 2007) | Divers | 143 029,00 | 146 879,80 | S.O. | S.O. | S.O. |
| Autres antimicrobiens (2008) | Divers | S.O. | S.O. | 32 706,00 | S.O. | S.O. |
| Total | S.O. | 1 766 126,00 | 1 617 747,60 | 1 615 571,23 | -8,52 % | -0,13 % |
Source : ASPC (2011, p. 83, 96) |
||||||
| Titre | Description | Composition | Activités consignées |
|---|---|---|---|
| Création du Comité consultatif d'experts sur l'utilisation d'antimicrobiens chez les animaux et les conséquences pour la résistance et la santé humaine | Le but du comité est « fournir des informations pouvant être utiles pour réduire la résistance potentielle ainsi que les effets sur la santé et la sécurité humaines découlant de l'utilisation d'agents antimicrobiens chez les animaux » (Santé Canada, 2001b). | La composition du comité est indiquée dans le rapport final du comité (Comité consultatif sur l'utilisation d'antimicrobiens chez les animaux et les conséquences pour la résistance et la santé humaine, 2002, p. 187). |
|
| Le Comité consultatif sur les ULEM | On a peu d'information sur le mandat ou la composition du comité. | On n'a pas trouvé de liste des membres. Selon les documents à notre disposition, le comité a été créé pour « conseiller la DMV de façon régulière et opportune dans ses activités d'élaboration de politiques sur les ULEM » (DMV, 2005b, p. 5). Il devait comprendre des représentants des éleveurs, des vétérinaires, des fabricants de médicaments ainsi que des groupes de consommateurs ou s'intéressant à la salubrité des aliments. |
|
| Comité consultatif d'experts sur l'évaluation des risques de résistance aux antimicrobiens | Créé en 2005 (DMV, 2007f), le rôle du comité était de « passer en revue des informations scientifiques et de fournir des conseils d'experts sur l'évaluation des risques et des effets bénéfiques de l'utilisation d'agents antimicrobiens chez les humains et les non humains » (Comité consultatif d'experts sur l'évaluation des risques de résistance aux antimicrobiens, 2004). Selon Santé Canada, le comité se réunit de deux à trois fois par an (Santé Canada, 2010e). |
Les critères de sélection des membres sont donnés dans le mandat provisoire (Comité consultatif d'experts sur l'évaluation des risques de résistance aux antimicrobiens, 2004), mais on n'a pas pu obtenir une liste des membres. |
|
| Comité consultatif d'experts sur les produits de santé naturels vétérinaires (CCE-PSNV) | Le comité fait des recommandations à la DGPSA pour la préparation de règlements régissant les produits de santé naturels vétérinaires (CCE-PSNV, s.d.; DMV, 2011b). Selon Santé Canada, le CCE-PSNV se réunit de deux à trois fois par an (Santé Canada, 2010e, p. 7). |
La liste des membres du comité se trouve sur le site Web de Santé Canada (Santé Canada, 2009). |
|
| Comité consultatif sur le cheval en tant qu'animal destiné à l'alimentation | On a peu d'information sur le comité. | On n'a pas trouvé de liste de membres. |
|
| Groupe de travail sur l'importation pour usage personnel (IUP) | Santé Canada a créé le Groupe de travail sur l'IUP en décembre 2006. Le rapport définitif du groupe de travail a été publié à des fins de commentaires en décembre 2008, la période de commentaires se prolongeant jusqu'en mars 2009 (Mathew, 2009). | La composition du comité est indiquée dans le rapport définitif (qui se trouve sur le site Web de Santé Canada); en période d'activité, le comité était composé de représentants des éleveurs, de groupes de consommateurs, des associations de vétérinaires, des provinces et du gouvernement fédéral, y compris de la DMV, de l'Inspectorat, d'AAC, du MAECI et de l'ACIA (Groupe de travail sur l'IUP, 2008). |
|
| Comité consultatif sur l'utilisation de médicaments en dérogation des directives de l'étiquette de la DMV | Le mandat du Comité consultatif sur l'utilisation de médicaments en dérogation des directives de l'étiquette n'est pas indiqué officiellement dans les documents à notre disposition. | Dans un document de détermination des enjeux de 2004, on donne la liste des membres du comité, lequel comprend des représentants de l'industrie, des universitaires, des vétérinaires, des représentants des provinces et du gouvernement fédéral (Comité consultatif sur l'utilisation de médicaments en dérogation des directives de l'étiquette, 2004, p.32) |
|
| Comité d'évaluation des dossiers scientifiques (CEDS) de la DMV | Le mandat du CEDS est de veiller à ce que les médicaments vétérinaires se trouvant sur le marché canadien ne présentent pas de risque pour la santé des Canadiens et à ce qu'ils soient sûrs et efficaces pour les animaux. (CEDS, 2004, p. 2). Le CEDS est présidé par le DG de la DMV et il relève de celui-ci. Il a l'appui d'un secrétariat (2004, p. 3). À l'origine, il devait se réunir de manière régulière toutes les semaines (2004, p. 4). | Les renseignements sur les membres du comité se trouvent dans le mandat, mais il semblerait qu'il n'existe pas de liste des membres. |
|
| Groupe consultatif d'experts sur l'aquaculture | Le Groupe consultatif d'experts sur l'aquaculture est composé d'experts en toxicologie et de vétérinaires spécialisés dans l'étude des poissons et dans l'aquaculture venant des provinces et du gouvernement fédéral (DMV, 2007a). L'objectif du groupe est d'explorer les principaux problèmes liés aux médicaments vétérinaires dans le contexte de l'aquaculture et « de fournir des conseils au sujet de mécanismes possibles de protection de la sécurité des aliments, de la santé publique et de l'industrie en croissance » (DMV, 2007a). | On n'a pas trouvé de liste de membres. |
|
| Date de la demande de l'ACIA | Date de l'ERS | Sujet de l'ERS | Conclusions et recommandations de la DMV |
|---|---|---|---|
| 30 janvier 2007 | 9 février 2007 | Évaluation des risques pour la santé présentés par du bétail destiné à l'abattage qui a été nourri avec un mélange de substances médicamenteuses, dont certaines ne sont pas homologuées pour le bétail | Il y avait de nombreuses incertitudes relativement au mélange de divers médicaments homologués à des niveaux recommandés et à des niveaux supérieurs, ainsi que la présence de médicaments non homologués dans l'alimentation des animaux. Par conséquent, il était impossible de prévoir les risques que présenterait pour la santé humaine la consommation de ce bétail. La DMV a donc recommandé que le bétail en question (à la fois les bovins de finition et les bovins en croissance) ne soit pas abattu à des fins de consommation humaine pendant 50 jours. |
| Inconnue | 17 avril 2007 | Risque pour la santé humaine en cas de consommation de lait et de viande provenant de bovins et d'ovins qui ont été traités avec du sulfate de cuivre contaminé par des dioxines | Il a été conclu que les niveaux de dioxines en question ne présentaient pas de risque important pour la santé humaine en cas de consommation de lait ou de viande provenant de ces animaux. Les recommandations suivantes ont été faites : l'ACIA devrait informer le fabricant et les importateurs que Santé Canada ne recommande pas l'emploi d'un sulfate de cuivre sans DIN; il faudrait inviter le fabricant du sulfate de cuivre à communiquer avec la DMV pour connaître les exigences à remplir afin d'obtenir une autorisation de mise en marché. |
| Février 2007 | Avril 2007 | Risque pour la santé humaine en cas de consommation d'œufs canadiens et importés dans lesquels on a trouvé des résidus d'ionophore pendant les années financières de 2004 à 2007 | Il a été conclu que le risque pour la santé que présentait la consommation d'œufs contaminés par des résidus d'ionophore n'est pas considéré comme important sauf pour la salinomycine. Les recommandations suivantes ont été faites : l'ACIA doit prendre les mesures qui conviennent pour éliminer la contamination croisée dans les usines de fabrication des aliments pour les animaux afin de minimiser le transfert de médicaments entre les lots d'aliments destinés à différentes espèces, veiller à ce qu'il n'y ait pas d'utilisation délibérée de produits non homologués, et envisager d'améliorer la méthode employée pour détecter ces ionophores dans les aliments pour animaux. |
| 24 août 2007 | 13 septembre 2007 | Risques pour la santé humaine et la santé des animaux présentés par des résidus d'antibiotiques dans des sous-produits de l'éthanol (dérivés de la production d'éthanol-carburant) destinés aux aliments pour animaux d'élevage | Il a été conclu que les niveaux de résidus dans les aliments constitués de sous-produits de l'éthanol, s'ils se retrouvent dans les tissus mangeables des animaux destinés à la consommation, seraient très faibles et peu susceptibles de causer des effets indésirables graves pour la santé des personnes et des animaux destinés à la consommation. On a exprimé des préoccupations pour la salubrité en ce qui concerne les chevaux nourris avec des sous-produits de l'éthanol contenant du monensin et les tilapias nourris avec des sous-produits de l'éthanol contenant de la tylosine. On a souligné que pour mieux évaluer la situation il fallait des renseignements particuliers sur les niveaux de monensin à utiliser dans la production de l'éthanol. Il a été recommandé que le taux maximal d'ajout de sous-produits venant des drêches de distillerie contenant de la tylosine dans l'alimentation des tilapias ne dépasse pas les 30 % en termes de matière sèche. |
| 2 janvier 2008 | 26 janvier 2009 | Risques pour la santé présentés par des résidus potentiels d'érythromycine dans des sous-produits d'éthanol venant de drêches de distillerie, dérivés de la production d'éthanol-carburant et destinés aux aliments pour animaux d'élevage | Il a été conclu que les niveaux de résidus d'érythromycine attribuables aux sous-produits de l'éthanol présents dans les aliments, s'ils se retrouvent dans les tissus mangeables des animaux destinés à la consommation, devraient être très faibles et qu'il est improbable qu'ils causent des effets indésirables pour la santé des personnes ou des animaux. |
Références bibliographiques utilisées pour les tableaux de données supplémentaires
ACIA. Rapport annuel 2005-2006 du PNSRC - Aliments d'origine animale et végétale, 2006. Sur Internet : http://epe.lac-bac.gc.ca/100/206/301/cfia-acia/2011-09-21/www.inspection.gc.ca/francais/fssa/microchem/resid/2006-2007/annuappf.shtml.
ACIA. Health Risk Assessment Request, 2007a.
ACIA. Ionophore residues in eggs, 2007b.
ACIA. Rapport annuel 2007-2008 du PNSRC - Aliments d'origine animale et végétale, 2008a.
ACIA. Health Risk Assessment Request, 2008b.
ACIA. Rapport annuel 2006-2007 du PNSRC - Aliments d'origine animale et végétale, 2011 (consulté le 21 mars 2012). Sur Internet : http://epe.lac-bac.gc.ca/100/206/301/cfia-acia/2011-09-21/www.inspection.gc.ca/francais/fssa/microchem/resid/2005-2006/annue.shtml
ACIA. Inspection de surveillance - Résidus de médicaments dans les aliments du bétail fabriqués dans des établissements commerciaux et à la ferme. Rapport de conformité des échantillons analysés : Période 1991-1992 - 2006-2007, s.d.
ACIA. Inspection de surveillance - Teneur garantie en substance médicamenteuse dans les aliments du bétail fabriqués dans des établissements commerciaux et à la ferme. Rapport de conformité des échantillons analysés : Période 1995-1996 - 2006-2007, s.d.
Alexander, I. Extra-label drug use (ELDU): Perspectives of Canada, the United States and other jurisdictions. Presented at the 6th VDD Stakeholder Committee Meeting, 2005.
ASPC. Programme intégré canadien de surveillance de la résistance aux antimicrobiens (PICRA), 2008 (rapport final), 2011. Sur Internet : http://www.phac-aspc.gc.ca/cipars-picra/2008/pdf/cipars-picra-2008-fra.pdf.
Birnbaum, D., E. Jandciu, et L. Twells. Antimicrobial resistance: A deadly burden no country can afford to ignore, CCAR, 2002. Sur Internet : http://www.designit.ca/ccar/english/word/FinalReport2.doc.
CCE-PSNV. Cadre de références -Comité consultatif d'experts sur les produits de santé naturels vétérinaires, s.d.
CEDS. Mandat du Comité d'évaluation des dossiers scientifiques (CEDS) de la Direction des médicaments vétérinaires,2004.
Comité consultatif d'experts sur l'évaluation des risques de résistance aux antimicrobiens. Ébauche du cadre de référence - Comité consultatif d'experts sur l'évaluation des risques de résistance aux antimicrobiens, 2004.
Comité consultatif sur l'UMDDE. Utilisation de médicaments en dérogation des directives de l'étiquette (UMDDE) chez les animaux : Développer une compréhension commune (Document de détermination des enjeux), 2004. Sur Internet : http://www.collectionscanada.gc.ca/archivesweb/20061215000050/http://hc-sc.gc.ca/dhp-mps/alt_formats/hpfb-dgpsa/pdf/pubs/eldu-umdde_issue-enjeux_final_10-12-2004_f.pdf.
Comité consultatif sur l'utilisation d'antimicrobiens chez les animaux et les conséquences pour la résistance et la santé humaine. L'utilisation au Canada d'antimicrobiens chez les animaux destinés à l'alimentation : les conséquences pour la résistance et la santé humaine, 2002.
DGPSA. DGPSA - Rapport sur le rendement en matière de participation du public - 2005-2007, 2007.
DGPSA. HPFB Quarterly Program Review: Food and Nutrition Program, FY 2009-10 Q4 (VDD-Specific), 2010a.
DGPSA. HPFB Quarterly Program Review: Food and Nutrition Program, FY 2010-11 Q2 (VDD-Specific), 2010b.
DMV. Plan opérationnel de la Direction des médicaments vétérinaires, 2003-2004, T3-T4, 2003.
DMV. Compte rendu de la septième réunion du Comité des intervenants de la Direction des médicaments vétérinaires, 2005.
DMV. Compte rendu de la 9e réunion du comité des intervenants de la DMV, 2006a.
DMV. Rapport du tableau de bord de la DMV, 2006-2007, T4, 2006b.
DMV. Rapport du tableau de bord de la DMV, 2006-2007, T1 (Transparence), 2006c.
DMV. Communiqué aux intervenants, vol. 6, no 2, 2006d.
DMV. Ligne directrice à l'intention de l'industrie sur la préparation des présentations de drogues nouvelles vétérinaires, 2007a.
DMV. Bulletin sur la résistance aux antimicrobiens - hiver 2007, 2007b.
DMV. Consultation - Document de travail sur un énoncé de politique sur l'aquaculture, 2007c (consulté le 11 avril 2012).
DMV. Health Risk Assessment for cattle intended for slaughter that have been fed a mixture of medicating ingredients, some of which are not approved for cattle, 2007d.
DMV. Potential risk to human health from consumption of milk and meat derived from cattle and sheep treated with copper sulphate which is contaminated with dioxins, 2007e.
DMV. Ionophore residues in eggs, 2007f.
DMV. Health risk assessment associated with antibiotic residues in ethanol by-products derived from fuel ethanol production and intended for livestock feeds, 2007g.
DMV. VDD Target status, FY 2008-09 Q1, 2008a.
DMV. VDD Performance Summary, FY 2008-09 Q2, 2008b.
DMV. VDD dashboard reporting, FY 2008-09 Q1 (International and National), 2008c.
DMV. VDD dashboard reporting, FY 2008-09 Q1 (MUMS), 2008d.
DMV. VDD dashboard reporting, FY 2007-08 Q4 (International and National), 2008e.
DMV. VDD Performance Summary, FY 2008-09 Q4, 2009a.
DMV. VDD quarterly reporting - executive summary, FY 2009-10 Q1, 2009b.
DMV. VDD Performance Summary, FY 2008-09 Q3, 2009c.
DMV. VDD quarterly reporting - executive summary, FY 2009-10 Q2, 2009d.
DMV. VDD dashboard reporting, FY 2008-09 Q4 (Regulatory Operational Performance), 2009e.
DMV. VDD dashboard reporting, FY 2008-09 Q4 (MUMS), 2009f.
DMV. VDD dashboard reporting, FY 2009-10 Q2, 2009g.
DMV. Utilisation de médicaments en dérogation des directives de l'étiquette, 2009h, (consulté le 17 février 2012).
DMV. Health risk associated with the potential residues of erythromycin in distillers' grain ethanol by-products derived from fuel ethanol production and intended for livestock feeds, 2009i.
DMV. VDD Submission Review Performance Measures, FY 2010-11 Q1, 2010a.
DMV. VDD Performance Report, FY 2009-10 Q3, 2010b.
DMV. VDD Submission Review Performance Measures, FY 2010-11 Q2, 2010c.
DMV. VDD update, ADM key commitments dashboard, FY 2010-11, 2010d.
DMV. VDD Submission Review Performance Measures, FY 2010-11 Q3, 2011a.
DMV. VDD Submission Review Performance Measures, FY 2010-11 Q4, 2011b.
DMV. Comité consultatif d'experts sur les produits de santé naturels, 2011c.
Enne, V. I., C. Cassar, K. Sprigings, M. J. Woodward, et P. M. Bennett. « A high prevalence of antimicrobial resistant Escherichia coli isolated from pigs and a low prevalence of antimicrobial resistant E. coli from cattle and sheep in Great Britain at slaughter », FEMS microbiology letters, vol. 278, no 2 (2008), p. 193-199.
Goetghebeur, M., P. A. Landry, D. Han, et C. Vicente. « Methicillin-resistant Staphylococcus aureus: a public health issue with economic consequences », The Canadian Journal of Infectious Diseases & Medical Microbiology, vol. 18, no 1 (2007), p. 27.
Groupe de travail sur l'IUP. Rapport final du Groupe de travail sur l'importation pour usage personnel de médicaments vétérinaires, 2008. Sur Internet : Consultations.
Helms, M., P. Vastrup, P. Gerner-Smidt, et K. Mølbak « Excess mortality associated with antimicrobial drug-resistant Salmonella Typhimurium », Emerging Infectious Diseases , vol. 8, no 5 (2002), p. 490.
ICSA. Site Internet de l'Institut canadien de la santé animale (ICSA), 2012 (consulté le 17 février 2012). Sur Internet : http://www.cahi-icsa.ca/francais/default.aspx.
Inspectorat. A5.1 Drug Compliance Verification and Investigations (2003-2004), year-end project report, 2004.
Inspectorat. A5.1 Drug Compliance Verification and Investigations (2004-2005), year-end project report, 2005a.
Inspectorat. (POL-0001) Politique de conformité et d'application, 2005b.
Inspectorat. A5.1 Drug Compliance Verification and Investigations (2005-2006), year-end project report, 2006.
Inspectorat. A5.1 Drug Compliance Verification and Investigations (2006-2007), year-end project report, 2007.
Inspectorat. Inspectorate performance indicators (2007-2008), 2008.
Inspectorat. Inspectorate performance indicators (2008-2009), 2009.
Inspectorat. Inspectorate performance indicators (2009-2010), 2010a.
Inspectorat. B1.5 Region Border Integrity Unit - Report FY 2009/10 YTD (Excel Spreadsheet), 2010b.
Inspectorat. B1.5 Region Border Integrity Unit - Report FY 2010/11 YTD (Excel Spreadsheet), 2011.
Little, C. L., J. F. Richardson, R. J. Owen, E. de Pinna, et E. J. Threlfall. « Campylobacter and Salmonella in raw red meats in the United Kingdom: Prevalence, characterization and antimicrobial resistance pattern, 2003-2005 », Food Microbiology, vol. 25, (2008), p.538-543.
Martin, L. J., M. Fyfe, K. Dore, J. A. Buxton, F. Pollari, B. Henry. « Increased burden of illness associated with antimicrobial-resistant Salmonella enterica serotype Typhimurium infections », Multi-provincial Salmonella Typhimurium case-control study steering committee, The Journal of Infectious Diseases, vol. 189, no 3, (2004), p. 377-384.
Mathew, R. Own-use importation (OUI) of veterinary drugs: Task Force report update, 2009.
NARMS. National Antimicrobial Resistance Monitoring System (NARMS): 2009 retail meat report, 2009. Sur Internet : National Antimicrobial Resistance Monitoring System
Prescott, J. F. « Advisory Committee reports to Health Canada on "Antimicrobials in food animals in Canada: Impact on resistance and animal health." », The Canadian Veterinary Journal, vol. 43, no 11, (2002), p.836.
Santé Canada. Mandat du Comité consultatif sur la résistance aux antimicrobiens - Médicaments vétérinaires, 2001 (consulté le 16 février 2012).
Santé Canada. Réunions - Comité consultatif sur la résistance aux antimicrobiens, 2004, (consulté le 16 février 2012).
Santé Canada. Composition du Comité consultatif d'experts sur les produits de santé naturels vétérinaires, 2009, (consulté le 21 mars 2012).
Santé Canada. Direction générale des produits de santé et des aliments (DGPSA) - Comités consultatifs, 2010.
Santé Canada. Compte rendu des délibérations : Réunion du Comité consultatif d'experts sur les produits de santé naturels vétérinaires (24 mai 2011), 2011a, (consulté le 24 février 2012).
Santé Canada. Cadre de l'évaluation sommative du Programme des médicaments vétérinaires, 2011b.
Santé Canada. Utilisation de médicaments en dérogation des directives de l'étiquette (UMDDE), 2011c, (consulté le 17 février 2012).
Sheridan, J., I. Blair, et D. McDowell. The incidence and antibiotic resistance profiles of Salmonella spp. on Irish retail meat products, 1998.
Détails de la page
- Date de modification :