Guide pour démontrer que la valeur nutritive est adéquate – Préparations pour prématurés et fortifiants pour lait humain
Document d’orientation à l’intention des fabricants de préparations pour nourrissons et de fortifiants pour lait humain
2021
Table des matières
- 1.0 Introduction
- 2.0 Valeur nutritive adéquate des préparations pour prématurés ou des fortifiants pour lait humain
- 3.0 Termes-clés utilisés dans l'évaluation des préparations pour prématurés ou des fortifiants pour lait humain
- 3.1 Termes-clés utilisés dans la Loi sur les aliments et drogues (LAD) et le Règlement sur les aliments et drogues (RAD), et à l'échelle internationale
- 3.2 Autres termes utilisés dans la recherche et la pratique cliniques sur les nourrissons prématurés
- 3.3 Autres termes liés à la recherche et à la pratique cliniques, à utiliser dans les essais cliniques chez des nourrissons prématurés
- 4.0 Études cliniques requises pour appuyer l'évaluation préalable à la mise en marché des préparations pour prématurés ou des fortifiants pour lait humain
- 5.0 Autres études requises pour les préparations pour prématurés et fortifiants pour lait humain
- 6.0 Circonstances justifiant la conduite d'essais cliniques et d'autres essais
- 6.1 Nouvelle préparation pour prématurés ou nouveau fortifiant pour lait humain
- 6.2 Changements majeurs apportés à une préparation pour prématurés ou à un fortifiant pour lait humain déjà approuvé
- 6.2.1 Teneur énergétique
- 6.2.2 Augmentation de la teneur en protéines
- 6.2.3 Traitement des protéines
- 6.2.4 Modification du mélange de protéines, de lipides ou de glucides
- 6.2.5 Modification de la teneur ou de la source en vitamines ou minéraux
- 6.2.6 Nouvelle combinaison de sources de macronutriments
- 6.3 Ingrédient alimentaire nouveau et nouvel ingrédient d'aliment pour bébés (NIAB)
- 7.0 Surveillance après la mise en marché
- 8.0 Consultations préalables à la demande d'approbation
- 9.0 Acronymes
- 10.0 Références
- Appendice 1. Modèle de comparaison du profil nutritionnel d'une préparation pour nourrissons prématurés ou d'un fortifiant pour lait humain (tel que consommé) avec les recommandations nutritionnelles pour prématurés pour 100 kcal
- Appendice 2. Composition du lait maternel pour prématurés
1.0 Introduction
Au Canada, la réglementation des préparations pour nourrissons et des fortifiants pour lait humain est régie par la Loi sur les aliments et drogues (LAD) titre 25 du Règlement sur les aliments et drogues (RAD). Les fabricants doivent présenter une demande préalable à la mise en marché avant de vendre ou d'annoncer toute nouvelle préparation pour nourrissons, tout fortifiant pour lait humain ou tout produit ayant subi un changement majeur. La demande préalable à la mise en marché doit contenir des renseignements détaillés sur la composition, la fabrication, l'emballage et l'étiquetage de la préparation pour nourrissons ou du fortifiant pour lait humain, ainsi que des données probantes permettant d'établir que la préparation pour nourrissons nouvelle ou modifiée ou le fortifiant pour lait humain nouveau ou modifié est sûr et a une valeur nutritive suffisante pour favoriser une croissance et un développement acceptables chez les nourrissons prématurés auxquels ces produits sont destinés, s'ils sont consommés conformément au mode d'emploi.
Le présent document fournit aux fabricants de préparations pour nourrissons et de fortifiants pour lait humain des directives supplémentaires sur les données probantes exigées pour démontrer que la valeur nutritive de ces produits est adéquate, selon les articles B.25.046 et B.25.048 et l'alinéa B.25.011 (j) du titre 25 du RAD. D'autres lignes directrices de Santé Canada, notamment les documents Guide pour la préparation des demandes préalables à la mise en marché de préparations pour nourrissons et de fortifiants pour lait humain et Bonnes pratiques de fabrication des préparations pour nourrissons, devraient être consultées conjointement avec le présent document.
Les nourrissons prématurés forment un sous-groupe particulier, diversifié et unique. L'hétérogénéité de leurs besoins nutritionnels, leur état clinique sous-jacent à la naissance et l'immaturité de leurs organes requièrent l'adoption d'une approche individualisée en matière d'alimentation, de supplémentation et de prise en charge clinique. Les préparations pour nourrissons et les fortifiants pour lait humain destinés aux nourrissons prématurés sont deux produits alimentaires distincts, dont l'objectif commun est de fournir les éléments nutritifs requis pour favoriser un taux de croissance et une composition du gain pondéral qui se rapprochent de ceux observés chez un fœtus normal du même âge post-menstruel. Il est important de souligner que pour démontrer que le fortifiant pour lait humain est adéquat, il est toujours évalué en association avec celle du lait humain pour prématurés, car le fortifiant pour lait humain n'est pas, en soi, un aliment complet sur le plan nutritionnel. En pratique clinique, si la mère ne produit pas de lait ou n'en produit pas en quantités suffisantes, le lait provenant de donneuses (mères de nourrissons nés à terme) peut être utilisé en association avec un fortifiant pour lait humain. Il est toutefois recommandé d'utiliser le lait de la mère du nourrisson prématuré (1).
Dans le présent document, « lait humain enrichi » désigne le mélange composé de fortifiant pour lait humain et de lait humain pour prématurés, qui est utilisé pour démontrer que la valeur nutritive du fortifiant pour lait humain est adéquate en comparaison avec les recommandations internationales (voir l'appendice 1).
La présente ligne directrice décrit le type de données probantes exigées par Santé Canada avant la vente ou la mise en marché :
- d'une nouvelle préparation pour prématurés ou d'un nouveau fortifiant pour lait humain;
- d'une préparation pour prématurés ou d'un fortifiant pour lait humain qui a subi un changement majeur;
- d'une préparation pour prématurés ou d'un fortifiant pour lait humain auxquels un nouvel ingrédient ou un aliment nouveau a été ajouté.
Le présent document précise les circonstances dans lesquelles des essais cliniques ou d'autres types d'essais doivent être menés, les données probantes (cliniques, biochimiques, sur des animaux, etc.) devant accompagner la demande d'évaluation préalable à la mise en marché de la préparation pour nourrissons ou du fortifiant pour lait humain, ainsi que les types d'essais recommandés selon les circonstances.
2.0 Valeur nutritive adéquate des préparations pour prématurés ou des fortifiants pour lait humain
Afin d'évaluer que la valeur nutritive des préparations pour nourrissons prématurés ou des fortifiants pour lait humain est adéquate, les unités de soins intensifs néonatals doivent prévoir notamment la mesure de paramètres anthropométriques et biochimiques cliniques valides, faciles à obtenir et peu coûteux.
La valeur nutritive des préparations pour nourrissons prématurés ou des fortifiants pour lait humain est établie lorsque ces produits satisfont aux objectifs nutritionnels fixés pour les nourrissons prématurés et qu'ils procurent les éléments nutritifs permettant de reproduire le taux de croissance et la composition du gain pondéral d'un fœtus normal du même âge post-menstruel, tout en maintenant des concentrations normales d'éléments nutritifs dans le sang et autres tissus. La valeur nutritive est également considérée adéquate lorsque les produits réduisent le degré de retard de croissance extra-utérin ou postnatal qui survient habituellement au moment de la sortie de l'hôpital. Des experts en la matière ont récemment conclu qu'un taux de gain pondéral de 15 à 20 g/kg par jour était un objectif raisonnable pour les nourrissons dont l'âge gestationnel se situe entre 23 et 36 semaines, mais pas au-delà (2). Ils ont aussi conclu qu'une augmentation de 1 cm/semaine du périmètre crânien entre 24 et 33 semaines d'âge gestationnel, et de 1 cm/semaine de la taille entre 24 et 32 semaines (2), correspond bien aux courbes de croissance pour prématurés de Fenton (2013)(3) et d'Olsen (2010)(4).
Pour offrir une valeur nutritive adéquate, la préparation pour nourrissons prématurés doit satisfaire aux exigences de composition énoncées dans le RAD. Elle doit aussi satisfaire aux deux critères de qualité suivants:
- fournit un régime alimentaire qui favorise la croissance physique des nourrissons prématurés, et
- procure un apport en protéines d'une valeur biologique suffisante.
L'évaluation du fortifiant pour lait humain est réalisée sur la composition du fortifiant lorsqu'il est mélangé avec du lait humain pour prématurés (et non sur le fortifiant seul). Santé Canada a établi un tableau des besoins nutritifs (voir les appendices 1 et 2) des nourrissons prématurés, en se basant sur les plus récentes recommandations d'experts internationaux (5,6,7,8,9). Le profil nutritionnel du lait humain enrichi doit se situer dans les plages nutritionnelles recommandées par ces experts internationaux.
3.0 Termes-clés utilisés dans l'évaluation des préparations pour prématurés ou des fortifiants pour lait humain
3.1 Termes-clés utilisés dans la Loi sur les aliments et drogues (LAD) et le Règlement sur les aliments et drogues (RAD), et à l'échelle internationale
Essai clinique
Expérience visant à comparer les effets de deux ou plusieurs interventions en matière de soins de santé.
L’expression « essai clinique » est un terme générique qui désigne des essais sur les soins de santé menés selon différentes méthodologies, notamment les essais non contrôlés, les essais contrôlés et les essais contrôlés randomisés (10). Un essai clinique est une étude de recherche au cours de laquelle des participants ou des groupes de participants sont affectés à une ou à plusieurs interventions liées à la santé, puis sont suivis durant une certaine période pour évaluer les effets de ces interventions sur la santé. L’essai clinique est conçu de manière à répondre à une question précise. Les participants qui reçoivent l’intervention forment le groupe expérimental. Les autres servent de témoins. Les effets et l’importance clinique de l’intervention sur un résultat lié à la santé sont évalués en comparant les deux groupes. Il incombe aux comités d’examen des établissements de veiller à ce que ces études soient éthiques et sûres. Lorsque l’essai porte sur des nourrissons prématurés ou de faible poids à la naissance (FPN), les représentants légaux de ces bébés doivent donner leur consentement éclairé pour que ceux-ci puissent y participer.
Les fabricants sont invités à consulter le document de Santé Canada intitulé « Protocole d'essai clinique sur la croissance et la tolérance – Nourrissons nés à terme en bonne santé », pour de plus amples renseignements sur le protocole d'essai clinique s'appliquant aux préparations pour prématurés ou aux fortifiants pour lait humain.
Données probantes
Renseignements pertinents recueillis dans le cadre de recherches scientifiques de haute qualité visant à répondre à une question bien définie. Les données probantes doivent être factuelles, sans biais, équilibrées, valables (elles mesurent ce qu'elles sont censées mesurer), reproductibles et précises. L'étude clinique sur la croissance et la tolérance associées aux préparations pour prématurés ou aux fortifiants pour lait humain doit être accompagnée d'un rapport complet dans lequel les données brutes sont représentées sur des courbes de croissance acceptables (3). L'étude doit aussi comprendre une évaluation équilibrée des avantages et des inconvénients, et mettre l'accent sur les limites de l'étude et sa généralisabilité. Les données probantes provenant d'études individuelles forment l'ensemble de la preuve. Les données probantes doivent être suffisamment convaincantes et solides pour appuyer la décision d'autoriser une nouvelle préparation pour prématurés ou d'un nouveau fortifiant pour lait humain, ou d'un produit ayant subi un changement majeur.
Les données probantes établissant l'innocuité et la valeur nutritive adéquate de la préparation pour prématurés ou du fortifiant pour lait humain peuvent comprendre des données obtenues auprès des nourrissons, des modèles animaux ou d'autres sources et peuvent inclure, sans toutefois s'y limiter, les données suivantes:
- Essais cliniques évaluant la croissance et la tolérance associées aux préparations pour prématurés ou au fortifiant pour lait humain (études sur des nourrissons);
- Mesures d'indices biochimiques, tels que mesure des taux de sérum-albumine, d'azote uréique sanguin (AUS), de calcium, de phosphore et de phosphatase alcaline sérique, des électrolytes sériques, des gaz sanguins et du pH, etc. (la nécessité de réaliser ces tests dépend de la nature de la préparation pour nourrissons et devrait être déterminée au cas par cas);
- Études sur des animaux évaluant la qualité des protéines, notamment le coefficient d'efficacité protéique (CEP), qui est utilisé pour déterminer si la teneur en protéines biodisponibles est suffisante;
- Antécédents d'innocuité dans d'autres pays (données probantes complémentaires);
- Avis d'experts indépendants (par exemple, affirmations GRAS (généralement reconnu comme sûr) des États-Unis);
- Indicateurs de qualité (par exemple, aminogramme comme preuve de la composition en protéines ou profil des acides gras comme preuve de la qualité des lipides);
- Revue de la littérature scientifique sur le nouvel ingrédient ou l'aliment nouveau devant être ajouté à la préparation pour nourrissons prématurés ou au fortifiant pour lait humain.
Les données probantes doivent satisfaire aux exigences suivantes:
- Bonnes pratiques de fabrication, en conformité avec la LAD et RAD, ainsi qu'avec la Loi sur la salubrité des aliments au Canada et le Règlement sur la salubrité des aliments au Canada, pour s'assurer que la préparation pour prématurés ou le fortifiant pour lait humain contient tous les éléments nutritifs et autres ingrédients requis, et ce, en quantités appropriées, et que la préparation pour prématurés ou le fortifiant pour lait humain n'est pas contaminé par des micro-organismes ou d'autres substances;
- Mesures de contrôle de la qualité visant à garantir que la préparation pour prématurés ou le fortifiant pour lait humain renferme les types et les quantités d'éléments nutritifs requis pour favoriser la croissance physique du nourrisson pendant toute la durée de conservation du produit;
- Limites minimales et maximales fixées pour certains éléments nutritifs au tableau II du titre 25 du RAD et les recommandations nutritionnelles d'experts internationaux pour les nourrissons prématurés;
- Lignes directrices publiées d'organismes faisant autorité, notamment l'American Academy of Pediatrics/Committee on Nutrition (2020), Tsang RC (2005) (7), la European Society for Paediatric Gastroenterology, Hepatology and Nutrition (9), Klein CJ (2002)(5), Koletzko B (2014)(6) et l'OMS (8,11,12).
Fortifiant pour lait humain (article B.25.001 du RAD)
Désigne un aliment :
- dont la composition comprend une vitamine, un minéral nutritif ou un acide aminé ajouté,
- qui est étiqueté ou annoncé comme devant être ajouté au lait humain pour en augmenter la valeur nutritive afin de satisfaire aux besoins alimentaires particuliers d'un bébé qui manifeste un état physique ou physiologique particulier en raison d'une maladie, d'un désordre ou d'un état physique anormal.
Succédané de lait humain (article B.25.001 du RAD)
Désigne tout aliment étiqueté ou annoncé :
- comme un remplacement partiel ou total du lait humain et destiné à être consommé par des bébés, ou
- comme pouvant être utilisé comme ingrédient d'un aliment visé à l'alinéa a).
Aliments pour bébés (article B.25.001 du RAD)
Désigne un aliment étiqueté ou annoncé comme pouvant être consommé par des bébés.
Changement majeur dans le cas d'un succédané de lait humain (article B.25.001 du RAD)
Signifie, en ce qui concerne un fortifiant pour lait humain ou un succédané de lait humain, tout changement apporté à un ingrédient ou à la quantité d'un ingrédient ou toute modification au traitement ou à l'emballage du fortifiant pour lait humain ou du succédané de lait humain, si l'expérience du fabricant ou la théorie généralement acceptée prévoit que ce changement aurait un effet indésirable sur les niveaux ou la disponibilité des éléments nutritifs ou sur l'innocuité microbiologique ou chimique du fortifiant pour lait humain ou du succédané de lait humain.
Voici quelques exemples de changements majeurs dans le cas d'une préparation pour prématurés ou d'un fortifiant pour lait humain :
- changement important apporté au traitement ou à l'emballage de la préparation pour prématurés ou du fortifiant pour lait humain, ou modification de l'installation de fabrication ou ajout d'une nouvelle installation
- ajout d'une nouvelle source de macronutriments (protéines, lipides ou glucides)
- changement important de la teneur en protéines, en lipides ou en glucides
- ajout d'un nouvel ingrédient ou d'un aliment nouveau
- modification de la quantité ou des sources de vitamines ou de minéraux qui, selon l'expérience du fabricant ou la théorie généralement acceptée, aurait un effet indésirable sur :
- les niveaux ou la disponibilité des éléments nutritifs, ou
- l'innocuité microbiologique ou chimique
Succédané de lait humain nouveau (préparations pour nourrissons) (article B.25.001 du RAD)
Désigne un succédané de lait humain :
- soit qui est fabriqué pour la première fois,
- soit qui est vendu au Canada pour la première fois,
- soit qu'une personne fabrique pour la première fois.
Nouvel ingrédient d'aliment pour bébés (NIAB)
Désigne une substance alimentaire (par exemple, nutritive, microbiologique) qui :
- n'est pas un aliment nouveau,
- est utilisée pour la première fois au Canada dans une préparation pour nourrissons ou un fortifiant pour lait humain
Aliment nouveau (article B.28.001 du RAD)
Selon le cas :
- substance, y compris un micro-organisme, qui ne présente pas d'antécédents d'innocuité comme aliment;
- aliment qui a été fabriqué, préparé, conservé ou emballé au moyen d'un procédé qui :
- n'a pas été appliqué auparavant à l'aliment,
- fait subir à l'aliment un changement majeur;
- aliment dérivé d'un végétal, d'un animal ou d'un micro-organisme qui, ayant été modifié génétiquement, selon le cas :
- présente des caractères qui n'avaient pas été observés auparavant,
- ne présente plus des caractères qui avaient été observés auparavant,
- présente un ou plusieurs caractères qui ne se trouvent plus dans les limites prévues pour ce végétal, cet animal ou ce micro-organisme.
- Notification préalable à la mise en marché (articles B.25.046 et B.25.048 du RAD)
Le fabricant d'une nouvelle préparation pour nourrissons, ou d'une préparation qui a subi un changement majeur quant à sa composition, à sa fabrication, à son emballage ou à sa transformation, doit aviser Santé Canada de son intention de vendre ou d'annoncer pour la vente la préparation pour nourrissons nouvelle ou modifiée.
Cette notification doit être signifiée au moins 90 jours avant la vente ou l'annonce pour la vente (veuillez consulter le Guide pour la préparation des demandes préalables à la mise en marché de préparations pour nourrissons et de fortifiants pour lait humain de Santé Canada).
- Nourrisson prématuré
Désigne un bébé vivant dont la naissance survient avant la fin de la 37Remarque e semaine de grossesse. Il existe différentes sous-catégories de naissances prématurées, établies selon l'âge gestationnel (13); veuillez consulter le tableau 1 ci-après.
Catégories |
Groupe |
Définition |
|---|---|---|
Âge gestationnel(13) |
Prématurité extrême/microprématurité |
< 28 semaines |
Grande prématurité |
28 à < 32 semaines |
|
Prématurité moyenne à tardive |
32 à < 37 semaines |
|
Poids à la naissance(14) |
Faible poids à la naissance |
< 2500 g |
Très faible poids à la naissance |
< 1500 g |
|
Poids extrêmement faible à la naissance |
< 1000 g |
|
Poids selon l'âge(14) |
Petit pour l'âge gestationnel (PAG) |
Poids à la naissance < 10Remarque e percentile selon les courbes de croissance des prématurés |
Approprié pour l'âge gestationnel (AAG) |
Poids à la naissance ≥ 10Remarque e et ≤ 90Remarque e percentile selon les courbes de croissance des prématurés |
|
Grand pour l'âge gestationnel (GAG) |
Poids à la naissance > 90Remarque e percentile selon les courbes de croissance des prématurés |
- Préparation pour nourrissons prématurés
Désigne un aliment présenté comme un remplacement partiel ou total du lait humain pour prématurés et qui est destiné à être consommé par des bébés prématurés, des bébés de FPN, des bébés de très faible poids à la naissance (TFPN) ou des bébés de poids extrêmement faible à la naissance.
Les préparations pour nourrissons prématurés sont enrichies en calories (environ 80 kcal/100 mL contre 67 kcal/100 mL pour les préparations pour nourrissons à terme), en protéines et en minéraux, pour aider le nourrisson à atteindre des taux d'accrétion des éléments nutritifs qui se rapprochent des taux intra-utérins. Les calories proviennent des protéines, des lipides et des glucides. Les deux derniers macronutriments sont utilisés pour accroître la densité énergétique. L'équilibre entre l'énergie et les protéines – le macronutriment limitant – est essentiel pour déterminer le type de croissance. Les préparations pour prématurés ont habituellement des teneurs en protéines, en sodium, en calcium, en phosphore, en zinc, en cuivre et en vitamines plus élevées que le lait humain non enrichi ou les préparations standards pour nourrissons.
- Évaluation quantitative et qualitative des protéines
La teneur en protéines des préparations pour prématurés et des fortifiants pour lait humain, et la qualité de ces protéines, doivent être conformes ou adaptées à l'usage prévu de ces produits. La qualité des protéines doit être mesurée à l'aide des méthodes existantes d'évaluation du CEP (Association of Official Analytical Chemists ou Méthode FO-1 de Santé Canada). Le CEP est actuellement la meilleure méthode pour démontrer la qualité des protéines dans les préparations pour nourrissons qui sont destinées à de jeunes bébés (moins de six mois) et les fortifiants pour lait humain. À l'heure actuelle, les méthodes basées sur l'indice chimique corrigé de la digestibilité des protéines (PDCAAS) et l'indice de digestibilité des acides aminés essentiels (DIAAS) ne sont pas suffisamment développées pour servir à l'évaluation de produits destinés à de jeunes nourrissons, en particulier les préparations à base de végétaux qui contiennent habituellement des facteurs antinutritionnels. Le profil des acides aminés essentiels et conditionnellement essentiels doit également être conforme aux besoins en acides aminés recommandés par le LSRO (2002) pour les nourrissons prématurés et les bébés de faibles poids à la naissance (5).
3.2 Autres termes utilisés dans la recherche et la pratique cliniques sur les nourrissons prématurés
- Âge chronologique
Âge du nourrisson calculé en semaines à partir de la date de naissance, sans correction pour la prématurité (11) (voir la figure 1).
- Âge corrigé [semaines ou mois] (c.-à-d. corrigé en fonction de la prématurité)
Désigne l'âge chronologique, duquel est soustrait le nombre de semaines avant terme (avant 40 semaines de gestation); cette expression ne doit être utilisée que pour les enfants de moins de trois ans qui sont nés avant terme (15) (voir la figure 1).
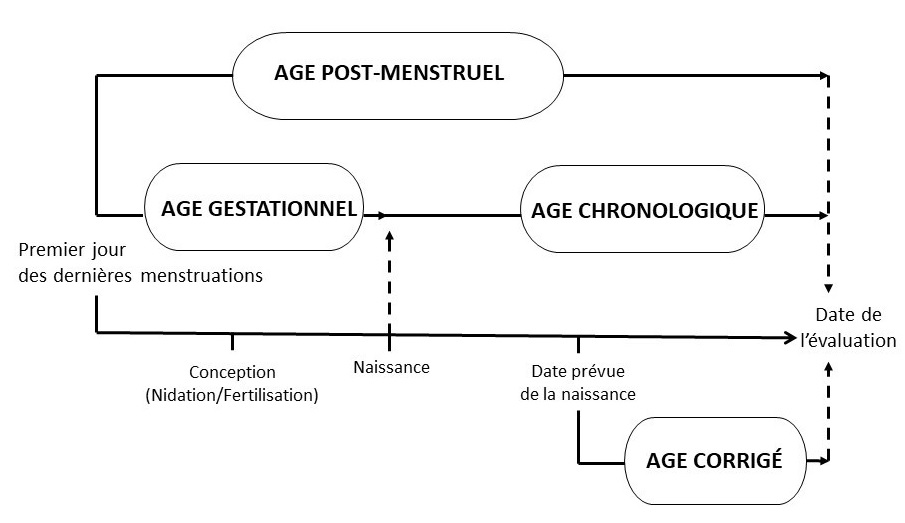
Figure 1 - Équivalent textuel
Chronologie montrant la relation entre l'âge post menstruel, l'âge gestationnel, l'âge chronologique et l'âge corrigé, tel que défini à la section 2.0.
- Âge gestationnel
En obstétrique, âge du fœtus, calculé à partir de la date présumée du début des dernières menstruations normales (13) (voir la figure 1 ci-dessus).
- Âge post-menstruel (APM)
Indique le temps écoulé entre le premier jour des dernières menstruations et la naissance (âge gestationnel), plus le temps écoulé après la naissance (âge chronologique), en jours et semaines. Il s'agit du terme privilégié pour décrire l'âge d'un nourrisson prématuré durant la période périnatale et l'hospitalisation. Après la période périnatale, « âge corrigé » est le terme privilégié (voir la figure 1 ci-dessus) [19].
- Charge potentielle rénale en solutés (CPRS) des préparations pour nourrissons
Correspond à la somme de l'azote (exprimé en mmol d'urée, par exemple, mg d'azote divisé par 28), du sodium, du potassium, du chlorure et du phosphore de source alimentaire. La CPRS détermine la charge rénale en solutés et, donc, la concentration osmolaire de l'urine.
CPRS (mosmol) = N/28 + Na + Cl + K + P
La CPRS minimale pour les préparations pour prématurés devrait être fixée à 22 mOsm/100 kcal jusqu'à un maximum de 32 mOsm/100 kcal pour une préparation pour nourrissons contenant 81 kcal/100 mL (5).
- Faible poids à la naissance (FPN)
Poids inférieur à 2 500 g (jusqu'à 2 499 g inclusivement), quel que soit l'âge gestationnel (11).
- Osmolalité
Concentration d'osmoles de soluté par kg de solvant, exprimée en mOsm/kg. L'osmolalité maximale recommandée par l'American Academy of Pediatrics (1976) est de 450 mOsm/kg d'eau pour les préparations pour nourrissons ou le lait humain enrichi, afin de réduire au minimum le risque d'entérocolite nécrosante néonatale (ENN).
- Osmolarité
Concentration d'osmoles de soluté par litre de solvant, exprimée en mOsm/L; l'osmolarité maximale recommandée par l'American Academy of Pediatrics est de 400 mOsm/L (AAP, 1976).
- Petit pour l'âge gestationnel
Désigne un fœtus ou un nourrisson qui est plus petit ou moins développé que la normale, selon le sexe et l'âge gestationnel du bébé, ou un nourrisson dont le poids à la naissance est inférieur au 10e percentile sur les courbes de croissance utilisées pour les prématurés (17).
- Prématurité tardive
Nourrissons nés entre 34 et 37 semaines de gestation (13).
- Retard de croissance intra-utérin (RCIU)
Incapacité de maintenir les taux de croissance intra-utérine prévus; le retard peut être dû à une insuffisance placentaire, une infection, une malnutrition, etc. (l'enfant peut ou non naître prématurément). Cela décrit un fœtus qui n'a pas atteint son potentiel de croissance à cause de facteurs génétiques ou environnementaux (16).
- Retard de croissance postnatal et retard de croissance postnatal sévère
Poids à la sortie de l'hôpital inférieur aux 10e percentiles et au 3e percentiles sur les courbes de croissance et selon l'âge post-menstruel, respectivement (15).
- Retard de croissance postnatal
Diminution du poids entre la naissance et la sortie de l'hôpital, supérieure à −2 scores Z selon les courbes de croissance pour prématurés de Fenton (17).
3.3 Autres termes liés à la recherche et à la pratique cliniques, à utiliser dans les essais cliniques chez des nourrissons prématurés
- Alimentation entérale
Administration de tout aliment directement dans le tractus gastro-intestinal; cela comprend le gavage intragastrique, l'alimentation à la tasse ou au biberon et l'allaitement maternel (11).
- Alimentation orale
Administration de tout aliment dans la cavité buccale; cela comprend l'alimentation à la tasse, à la cuillère, à la seringue ou au biberon, l'expression directe et l'allaitement maternel, mais exclut le gavage par sonde gastrique (11).
- Croissance de rattrapage
Toute amélioration du centile ou du score Z. Un rattrapage précoce se définit comme une croissance rapide durant la première enfance des petits nouveau-nés, alors qu'un rattrapage tardif se définit comme une amélioration de la croissance entre l'âge d'un an et l'âge adulte (11).
- Effet secondaire
Événement indésirable pour lequel il existe tout au moins une possibilité raisonnable qu'il y ait un lien de causalité entre l'intervention et l'événement (21).
- Événement indésirable
Résultat indésirable qui survient pendant ou après l'administration d'un médicament ou une autre intervention mais qui n'est pas nécessairement causé par le médicament ou l'intervention (19).
- Événement indésirable grave (dans le contexte d'un essai clinique)
Événement qui, de l'avis du chercheur ou du promoteur, cause l'un des résultats suivants : décès, événement indésirable mettant la vie en danger, hospitalisation nouvelle ou prolongée, incapacité persistante ou importante, ou perturbation importante de la capacité de mener les fonctions normales de la vie (20).
- Lait humain enrichi
Désigne le mélange constitué d'un fortifiant pour lait humain et de lait humain pour prématurés.
- Lait humain enrichi contrôlé
Désigne le mélange constitué d'un fortifiant pour lait humain autorisé au Canada ou ailleurs et de lait humain.
- Lait humain enrichi expérimental
Désigne le mélange constitué d'un fortifiant pour lait humain nouveau ou modifié et de lait humain.
- Période de croissance stable
Période qui commence lorsque le prématuré est stable sur le plan métabolique et clinique et qu'il prend du poids, et qui prend fin lorsque le prématuré atteint l'âge post-menstruel de 37 semaines (11) ou qu'il obtient son congé de l'hôpital.
- Période de transition
Période comprise entre la naissance et 7 jours, durant laquelle les nourrissons sont susceptibles d'être cliniquement et métaboliquement instables et de perdre du poids (11).
- Taux recommandé de gain pondéral
Un objectif allant jusqu'à 20 g/kg/jour pourrait être indiqué pour les nourrissons dont l'âge post-menstruel se situe entre 23 et 36 semaines (2).
4.0 Études cliniques requises pour appuyer l'évaluation préalable à la mise en marché des préparations pour prématurés ou des fortifiants pour lait humain
En général, les études cliniques visent à évaluer les aspects suivants:
- croissance et tolérance : innocuité de la préparation pour nourrissons ou du lait humain enrichi et capacité de ces produits de favoriser la croissance physique;
- biodisponibilité de certains éléments nutritifs et minéraux osseux (déterminés au cas par cas);
- bilan métabolique et biochimie du sang.
Les types suivants d'études cliniques sont expressément exigés pour déterminer l'innocuité et la valeur nutritive des préparations pour prématurés ou des fortifiants pour lait humain.
4.1 Étude clinique de croissance et de tolérance
L'étude clinique de croissance et de tolérance mesure et évalue les paramètres suivants :
- Taux de gain pondéral mesuré sur une période minimale de 28 jours ou jusqu'à la sortie de l'hôpital, exprimé en g/kg/jour, chez des nourrissons prématurés ou de FPN ou de TFPN, qui affichent une croissance cliniquement et métaboliquement stable et qui reçoivent la préparation pour nourrissons expérimentale ou le lait humain enrichi expérimental, comparé au taux observé chez des nourrissons recevant une préparation pour prématurés témoin ou un fortifiant pour lait humain témoin (ajouté au lait humain aux fins de l'étude) qui est vendu au Canada et dont l'innocuité a été confirmée et la valeur nutritive a été déterminée come adéquate par des essais.
- Taux d'augmentation de la taille, exprimée en cm/semaine, et du périmètre crânien, exprimé en cm/semaine.
- Données sur l'apport alimentaire : volume moyen de l'apport quotidien de préparation pour nourrissons ou de lait humain enrichi, de calories, de protéines et de suppléments modulaires.
- Données sur la tolérance : volonté du nourrisson de consommer la préparation pour nourrissons ou le lait humain enrichi et tolérance au produit (avec le minimum de symptômes gastro-intestinaux, respiratoires et dermatologiques.
- Incidence d'événements indésirables et d'événements indésirables graves, tels que mortalité, acidose métabolique, septicémie, ENN, consignés et évalués quotidiennement par des professionnels de la santé.
Pour plus de détails sur les paramètres précités, veuillez consulter le document de Santé Canada intitulé Protocole d'essai clinique sur la croissance et la tolérance – Nourrissons prématurés.
4.2 Études sur la biodisponibilité des éléments nutritifs
4.2.1 Indices sériques de la valeur protéique adéquate des préparations pour prématurés ou du lait humain enrichi
Des marqueurs biochimiques doivent compléter l'évaluation anthropométrique. À titre d'exemple, les taux de préalbumine, d'AUS et de protéines fixant le rétinol (PFR) sont utilisés pour évaluer le bilan protéique. Un faible taux d'AUS est corrélé à un apport insuffisant en protéines, alors qu'un taux élevé peut indiquer un apport approprié en acides aminés, un faible apport énergétique par rapport à l'apport en protéines ou encore une intolérance aux acides aminés. Les taux de préalbumine et de PFR sont de bons marqueurs du bilan protéique actuel, en raison de la courte demi-vie de ces substances; ces taux peuvent toutefois être influencés par des facteurs autres que l'apport en protéines (11).
4.2.2 Indices sériques de l'état nutritionnel en fer aux fins des études de recherche
Une supplémentation en fer est recommandée pour les nourrissons prématurés, afin de leur fournir un apport en fer suffisant pour favoriser leur croissance et développement sans accroître le risque de surcharge en fer. Une carence en fer au début de la vie a des effets négatifs sur la croissance et le fonctionnement de nombreux organes. Une carence en fer a des effets dévastateurs permanents sur le cerveau en développement. Les nourrissons prématurés sont privés de l'importante accrétion de fer qui se produit durant le troisième trimestre de la grossesse et leurs réserves de fer à la naissance sont moins importantes que chez les nourrissons nés à terme (23).
De nombreux facteurs non liés à l'alimentation contribuent à une carence en fer chez les prématurés. Le taux de ferritine sérique est couramment utilisé pour personnaliser la supplémentation en fer chez les prématurés en croissance; il convient toutefois de rappeler que des processus inflammatoires peuvent augmenter les taux de ferritine sérique. L'évaluation de la protéine C-réactive est habituellement combinée à la mesure de la ferritine sérique pour déterminer si le taux de ferritine constitue un indicateur fiable. L'hémoglobine, le fer sérique et la capacité totale de fixation du fer sont d'autres paramètres du bilan ferrique qui sont souvent utilisés en pratique clinique.
4.2.3 Bilan métabolique et biochimie du sang
En raison de l'immaturité de leurs organes, les prématurés présentent un risque accru de déséquilibre acido-basique. Le bilan métabolique peut être évalué en mesurant les gaz artériels sanguins, le pH sanguin, le pH urinaire, les marqueurs métaboliques protéiques, les électrolytes sériques et la biochimie du sang, au début, au milieu et à la fin de l'étude.
4.2.4 Évaluation de la minéralisation osseuse
L'évaluation de la minéralisation osseuse par la mesure des taux sériques de calcium, de phosphate et de phosphatase alcaline est couramment utilisée. Les données probantes sont insuffisantes pour déterminer si, pris individuellement, ces paramètres sont des indicateurs biochimiques valables de la maladie métabolique de l'os (MMO); la combinaison d'un taux élevé de phosphatase alcaline et d'un faible taux de phosphate constitue le meilleur indicateur biochimique de la MMO (22).
4.3 Consignation des réactions indésirables
Des renseignements précis et clairs sur les événements indésirables et les effets secondaires observés durant
l'étude, ou durant une période de suivi prédéterminée, doivent être soigneusement consignés et déclarés, que ces événements ou effets soient ou non immédiatement associés au traitement à l'étude (21).
5.0 Autres études requises pour les préparations pour prématurés et fortifiants pour lait humain
En plus des études cliniques et des analyses en laboratoire, des études sur des animaux peuvent être nécessaires pour évaluer l'innocuité d'ingrédients destinés à des préparations pour prématurés ou à des fortifiants pour lait humain. Cela pourrait comprendre la mesure du CEP qui évalue la qualité des protéines et peut servir à évaluer les interactions indésirables entre des éléments nutritifs.
Avant que de nouvelles préparations hypoallergéniques soient testées chez des humains, des essais précliniques exhaustifs doivent être menés sur des modèles animaux évaluant l'allergénicité. Ces essais doivent évaluer la toxicité et le bilan azoté et permettre de prévoir si des réactions indésirables seront observées chez des nourrissons allergiques aux protéines du lait de vache. Les demandeurs sont invités à demander une consultation préalable à la demande d'approbation, conformément à la section 10 du présent document.
6.0 Circonstances justifiant la conduite d'essais cliniques et d'autres essais
Les essais recommandés pour l'évaluation d'une nouvelle préparation pour prématurés ou d'un nouveau fortifiant pour lait humain, ou d'une préparation pour prématurés ou d'un fortifiant pour lait qui a préalablement été approuvé mais qui a subi un changement majeur, sont énoncés ci-après. Remarque : Les exigences relatives à la demande d'approbation varient selon le cas.
6.1 Nouvelle préparation pour prématurés ou nouveau fortifiant pour lait humain
La nouvelle préparation pour prématurés ou le nouveau fortifiant pour lait humain peut contenir une variété d'ingrédients, et être soumis à différentes méthodes de traitement ou différentes interactions matricielles – tous ces facteurs pourraient avoir une incidence sur la teneur en éléments nutritifs ainsi que sur l'absorption, la biodisponibilité et la valeur adéquate de ces éléments nutritifs. Il est donc essentiel de démontrer la non-infériorité ou l'équivalence (ou supériorité) de la nouvelle préparation pour prématurés ou du nouveau fortifiant pour lait humain, par rapport à une préparation pour prématurés ou à un fortifiant pour lait humain dont la valeur nutritive et l'innocuité ont été bien établies (consulter le document de Santé Canada intitulé Protocole d'essai clinique sur la croissance et la tolérance – Nourrissons prématurés).
Études et données requises :
- Étude clinique de croissance et de tolérance;
- Études sur la biodisponibilité des éléments nutritifs, pourraient être demandées au cas par cas;
- Déclaration rigoureuse des événements indésirables pour l'évaluation de l'innocuité clinique.
6.2 Changements majeurs apportés à une préparation pour prématurés ou à un fortifiant pour lait humain déjà approuvé
L'étendue de l'évaluation ou de l'essai clinique requis, lorsqu'une modification précise est apportée à une préparation pour prématurés ou à un fortifiant pour lait humain existant, est déterminée au cas par cas. Par exemple, l'augmentation de la teneur en protéines d'une préparation pour nourrissons ou d'un fortifiant pour lait humain existant, ou l'ajout dans ces produits d'un nouvel ingrédient qui n'a jamais été utilisé dans une préparation pour prématurés ou un fortifiant pour lait humain au Canada, sont considérés comme des cas où des essais cliniques seraient exigés.
6.2.1 Teneur énergétique
Les préparations pour prématurés sont spécialement conçues pour les nourrissons prématurés ou de FPN. Elles sont enrichies en calories (environ 80 kcal/100 mL) pour favoriser des taux d'accrétion des éléments nutritifs et des taux de croissance comparables aux taux intra-utérins.
Les préparations pour nourrissons prématurés ou fortifiants pour lait humain contenant plus de 80 kcal/100 mL doivent faire l'objet d'une étude clinique de croissance et de tolérance. Les préparations pour nourrissons prématurés ou le lait humain enrichi offrant une haute densité énergétique peuvent entraîner une augmentation des charges en solutés de l'urine dans des conditions de stress accru, par exemple en présence de fièvre ou de diarrhée infectieuse. Par conséquent, la charge potentielle rénale en solutés de la préparation pour nourrissons prématurés ou du lait humain enrichi doit être indiquée dans la notification préalable à la mise en marché. On sait également que le fortifiant pour lait humain peut entraîner une augmentation de l'osmolalité; la notification préalable à la mise en marché doit donc préciser l'osmolalité du lait humain enrichi final.
Études et données requises:
- Étude de croissance et de tolérance;
- Bilan métabolique;
- Charge potentielle rénale en solutés associée aux préparations pour prématurés et au lait humain enrichi mélangé dans différentes proportions avec le fortifiant pour lait humain;
- Osmolalité du lait humain enrichi, mélangé dans différentes proportions avec le fortifiant pour lait humain;
- Marqueurs de l'état d'hydratation, de l'osmolalité de l'urine et de la densité de l'urine.
6.2.1.1 Nouvelle source d'énergie
L'introduction d'une nouvelle source de protéines, de lipides ou de glucides dans une préparation pour prématurés ou un fortifiant pour lait humain nécessitera habituellement une étude de croissance et de tolérance.
6.2.1.2 Nouvelle source de protéines
La détermination du CEP est requise pour toute nouvelle source de protéines. Par exemple, une nouvelle protéine de lait animal dont on propose l'utilisation dans une préparation pour prématurés ou un fortifiant pour lait humain.
Études et données requises:
- Étude de croissance et de tolérance;
- Détermination du CEP de toute nouvelle protéine utilisée dans une préparation pour prématurés ou un fortifiant pour lait humain;
- Aminogramme de la préparation pour nourrissons prématurés finie ou du lait humain enrichi fini;
- Analyses biochimiques : albumine sérique, AUS et PFR.
6.2.1.3 Nouvelle source de lipides
Les études et données suivantes seraient exigées pour l'utilisation d'une nouvelle source de lipides, par exemple des graisses animales, des huiles végétales ou une source d'acides gras polyinsaturés à longue chaîne :
- Étude de croissance et de tolérance;
- La mesure des taux sériques de calcium, de phosphore et de phosphatase alcaline pourrait être demandée;
- Profil des acides gras de la préparation pour nourrissons prématurés finie ou du lait humain enrichi fini;
6.2.1.4 Nouvelle source de glucides
L'utilisation d'une nouvelle source de glucides (par exemple, monosaccharides, disaccharides, polysaccharides ou fibres alimentaires) nécessiterait une étude de croissance et de tolérance.
6.2.2 Augmentation de la teneur en protéines
Études et données requises :
- Étude de croissance et de tolérance;
- Analyses biochimiques et bilan métabolique du nourrisson prématuré; par exemple, sérum-albumine, AUS, PFR, calcium, phosphore, phosphatase alcaline sérique, électrolytes sériques, gaz sanguins et pH (les tests exigés seraient déterminés au cas par cas, en fonction de la nature de la préparation);
- Dans le cas de fortifiant pour lait humain, l'utilisation de lait humain provenant de banques, plutôt que du propre lait de la mère du prématuré, devrait être prise en compte lors de l'évaluation de la teneur en protéines du produit final.
Remarque : Le domaine de la nutrition clinique et de la croissance optimale des nourrissons prématurés et des bébés de faible poids à la naissance continue d'évoluer et de progresser. Par conséquent, si l'objectif de l'étude est de démontrer la supériorité d'une nouvelle préparation pour nourrissons ou d'un nouveau fortifiant pour lait humain à l'étude, qui a une teneur plus élevée en protéines qu'une préparation pour nourrissons ou un fortifiant pour lait humain témoin du commerce, il est recommandé d'utiliser une méthodologie avec une marge de supériorité prédéfinie (ICH E9).
6.2.3 Traitement des protéines
Tout changement dans le traitement des protéines (requiert ce qui suit) :
- Étude de croissance et de tolérance;
- Aminogramme de la préparation pour nourrissons prématurés finie ou du lait humain enrichi fini;
- Détermination du CEP de la préparation pour nourrissons prématurés finie, du fortifiant pour lait humain fini ou du lait humain enrichi fini.
Renseignements complémentaires requis pour certaines sources de protéines (par exemple, préparations à base de protéines partiellement hydrolysées, de protéines fortement hydrolysées et d'acides aminés) :
- Détails sur le processus d'hydrolyse;
- Enzymes utilisées;
- Contenu de la préparation d'enzymes.
6.2.4 Modification du mélange de protéines, de lipides ou de glucides
Les fabricants sont invités à communiquer avec Santé Canada pour discuter des essais recommandés lorsque des changements sont apportés aux mélanges de protéines, lipides ou glucides (voir la section 9.0 pour connaître la marche à suivre pour organiser une consultation).
6.2.5 Modification de la teneur ou de la source en vitamines ou minéraux
Pour connaître les sources de calcium, de phosphore et d'autres minéraux et vitamines approuvées par le Codex, veuillez consulter la liste du Codex Alimentarius des sources acceptables de vitamines et de minéraux pour les aliments à usage diététique spécial.
Lorsque d'autres changements sont apportés à la teneur ou à la source des vitamines ou minéraux (par exemple, augmentation de la teneur en vitamine A, en vitamine D ou en sodium), les études et données suivantes sont exigées:
- Étude de croissance et de tolérance
- Taux sériques de vitamines et de minéraux
6.2.6 Nouvelle combinaison de sources de macronutriments
Dans le cas de nouvelles combinaisons de sources de macronutriments, qui ont été utilisées ou étudiées séparément dans diverses préparations pour prématurés ou divers fortifiants pour lait humain actuellement commercialisés (qu'ils soient fabriqués ou non par le même fabricant), mais qui n'ont pas été utilisées ou étudiées ensemble dans la même préparation pour nourrissons prématurés ou le même fortifiant pour lait humain, les études et données suivantes sont exigées :
- Étude de croissance et de tolérance
- Biochimie du sang
6.3 Ingrédient alimentaire nouveau et nouvel ingrédient d'aliment pour bébés (NIAB)
Une préparation pour prématurés ou un fortifiant pour lait humain, qui contient un aliment nouveau qui a été approuvé ou un NIAB dont l'utilisation a été autorisée, doit faire l'objet d'essais cliniques et éventuellement d'autres tests supplémentaires. Le produit doit faire l'objet des mêmes essais qu'une nouvelle préparation pour prématurés ou qu'un nouveau fortifiant pour lait humain (y compris une étude de croissance et de tolérance), à moins que ces tests n'aient déjà été réalisés sur des nourrissons prématurés et que les données n'aient déjà été présentées dans le cadre de l'évaluation de l'aliment nouveau ou du nouvel ingrédient d'aliment pour bébés.
Pour obtenir de plus amples renseignements sur le processus d'approbation d'un aliment nouveau ou d'un NIAB, le fabricant est invité à consulter le document de Santé Canada intitulé « Guide pour la préparation des demandes préalables à la mise en marché de préparations pour nourrissons et de fortifiants pour lait
humain ».
7.0 Surveillance après la mise en marché
Un plan de surveillance après la mise en marché peut être exigé pour appuyer l'innocuité à long terme (24).
La surveillance après la mise en marché consiste en :
- un volet de surveillance, qui prévoit des mesures pour surveiller les effets indésirables après la mise en marché du produit;
- un volet de suivi, qui met l'accent sur les effets retardés ou à long terme qui pourraient se produire après la période d'utilisation maximale du produit. La durée du suivi doit être déterminée au cas par cas;
- un rapport écrit semestriel ou annuel du comité médical et scientifique du demandeur, résumant les résultats de sa revue de la littérature, notamment ceux portant sur l'innocuité et le suivi à long terme de tout nouvel ingrédient ajouté (par exemple, lutéine)
8.0 Consultations préalables à la demande d'approbation
Les fabricants sont invités à communiquer avec l'Unité de la gestion des demandes et de l'information de la Direction des aliments de Santé Canada (smiu-ugdi@hc-sc.gc.ca) pour demander la tenue d'une consultation préalable à la demande d'approbation afin de mieux se renseigner sur le processus de notification avant la mise en marché et sur les exigences à satisfaire pour établir la valeur nutritive adéquate.
9.0 Acronymes
- AUS
- azote uréique du sang
- CEP
- coefficient d'efficacité protéique
- CPRS
- charge potentielle rénale en solutés
- DIAAS
- indice de digestibilité des acides aminés essentiels
- ENN
- entérocolite nécrosante néonatale
- FPN
- faible poids à la naissance
- GRAS
- généralement reconnu comme sûr
- MMO
- maladie métabolique de l'os
- NIAB
- nouvel ingrédient d'aliment pour bébés
- PDCAAS
- indice chimique corrigé de la digestibilité des protéines
- PFR
- protéines fixant le rétinol
- RAD
- Règlement sur les aliments et drogues
- TFPN
- très faible poids à la naissance
10.0 Références
- Moro GE, Arslanoglu S, Bertino E, Corvaglia L, Montirosso R, Picaud JC, Polberger S, Schanler RJ, Steel C, van Goudoever J, Ziegler E. (2015). Human milk in feeding premature infants: consensus statement. Journal of Pediatric Gastroenterology and Nutrition, 61(1), S16-S19.
- Fenton TR, Anderson D, Groh-Wargo S, Hoyos A, Ehrenkranz RA, Senterre T. (2018). An attempt to standardize the calculation of growth velocity of preterm infants—evaluation of practical bedside methods. Journal of Pediatrics, 196,77-83.
- Fenton T and Kim J. (2013). A systematic review and meta-analysis to revise the Fenton growth chart for preterm infants. BMC Pediatrics. 13(1), 1-13.
- Olsen IE, Groveman SA, Lawson ML, Clark RH, Zemel BS. (2010). New intrauterine growth curves based United States data. Pediatrics, 125(2), e214-24.
- Klein CJ. (2002). Nutrient requirements for preterm infant formulas (LSRO). Journal of Nutrition, 132(6 Suppl 1), 1395S-577S.
- Koletzko B, Poindexter B, Uauy R (eds). (2014). Nutritional Care of Preterm Infants: Scientific Basis and Practical Guidelines. World Review of Nutrition and Dietetics, 110.
- Tsang RC, Uauy R, Koletzko B, Zlotkin S. (2005). Nutrition of the preterm infant, Scientific basic and practical guidelines. Digital Educational Publishing, Inc., Cincinnati, OH, USA.
- Tudehope D, Fewtrell M, Kashyap S, Udaeta E. (2013). Nutritional Needs of the Micropreterm Infant. Journal of Pediatrics. 162 (3 Suppl): S72–S80.
- Agostoni C, Buonocore G, Carnielli VP, De Curtis M, Darmaun D, Decsi T, Domellöf M, Embleton ND, Fusch C, Genzel-Boroviczeny O, Goulet O, Kalhan SC, Kolacek S, Koletzko B, Lapillonne A, Mihatsch W, Moreno L, Neu J, Poindexter B, Puntis J, Putet G, Rigo J, Riskin A, Salle B, Sauer P, Shamir R, Szajewska H, Thureen P, Turck D, van Goudoever JB, Ziegler EE; ESPGHAN Committee on Nutrition. (2010). Enteral nutrient supply for preterm infants: commentary from the European Society of Paediatric Gastroenterology, Hepatology and Nutrition Committee on Nutrition. Journal of Pediatric Gastroenterology and Nutrition, 50(1), 85-91.
- Cochrane Collaboration. (2019). Glossary of Cochrane terms. [En ligne, anglais seulement]. Accès: https://epoc.cochrane.org/sites/epoc.cochrane.org/files/public/uploads/SURE-Guides-v2.1/Collectedfiles/source/glossary.html
- World Health Organization (WHO). (2006). Optimal feeding of low-birth-weight infants. [En ligne, anglais seulement]. Accès: https://apps.who.int/iris/bitstream/handle/10665/43602/9789241595094_eng.pdf;jsessionid=80736F92F581729831081B1CA71D704B?sequence=1
- World Health Organization (WHO). (2011). Guidelines on optimal feeding of low-birth-weight infants in low- and middle-income countries. [En ligne, anglais seulement]. Accès: Guidelines on optimal feeding of low birth-weight infants in low- and middle-income countries (who.int)
- World Health Organization (WHO). (2018). Naissances prématurées: Principal repère. [En ligne]. Accès: https://www.who.int/fr/news-room/fact-sheets/detail/preterm-birth
- Groh-Wargo S, Thompson M, Cox H (eds). (2000). Nutritional Care for High-Risk Newborns. Precept Press, Inc., Chicago, IL.
- American Academy of Pediatrics, Committee on Fetus and Newborn. (2004). Age terminology during the perinatal period. Pediatrics, 114 (5), 1362-1364.
- Smitten J. (2011). Approach to the child with IUGR/SGA. [En ligne, anglais seulement]. Accès: https://learn.pediatrics.ubc.ca/body-systems/neonate/approach-to-the-child-with-iugrsga/
- Horbar J, Ehrenkranz RA, Badger GJ, Edwards EM, Morrow KA, Soll RF, Buzas JS, Bertino E, Gagliardi L, Bellù R. (2015). Weight Growth Velocity and Postnatal Growth Failure in Infants 501 to 1500 Grams: 2000-2013. Pediatrics, 136(1), e84-e92.
- Lee SM, Kim N, Namgung R, Park M, Park K, Jeon J. (2018). Prediction of Postnatal Growth Failure among Very Low Birth Weight Infants. Scientific Reports, 8(3729).
- Altman DG, Schulz KF, Moher D, Egger M, Davidoff F, Elbourne PC, GØtzsche PC, Lang T for the CONSORT Group. (2001). The revised CONSORT statement for reporting randomized trials: explanation and elaboration. Annals of Internal Medicine, 134(8), 663-694.
- International Conference on Harmonisation (ICH) of Technical Requirements for Registration of Pharmaceuticals for Human Use. (2016). ICH harmonised tripartite guideline for good clinical practice E6 (R2). [En ligne, anglais seulement]. Accès: https://ich.org/page/efficacy-guidelines
- Ioannidis JPA, Evans SJW, Gøtzsche PC, O'Neill RT, Altman DG, Schulz K, Moher D for the CONSORT group. (2004). Better reporting of harms in randomized trials: an extension of the CONSORT statement. Annals of Internal Medicine, 141(10), 781-8.
- Pereira-da-Silva L, Virella D, Fusch C. (2019). Nutritional assessment in preterm infants: a practical approach in the NICU. Nutrients, 11(9), 1999.
- McCarthy EK, Dempsey EM, Kiely ME. (2019). Iron supplementation in preterm and low-birth-weight infants: a systematic review of intervention studies. Nutrition Reviews, 77(12), 865-877.
- Institute of Medicine (US) Committee on the Evaluation of the Addition of Ingredients New to Infant Formula. (2004). Infant formula: evaluating the safety of new ingredients. Washington (DC). National Academies Press.
Appendice 1. Modèle des besoins nutritifs pour les préparations pour prématurés ou pour les fortifiants avec du lait humain (tel que consommé) par 100 kcal
NOTE: Une valeur unique représente une recommandation minimale. Une valeur entre crochets a été rapportée comme la valeur calculée dans la citation indiquée.
- MACRONUTRIMENTS
Éléments nutritifs (unité) |
Exigences du RAD |
Recommandations des experts internationaux |
Profil nutritionnel |
Spécification |
||||||
|---|---|---|---|---|---|---|---|---|---|---|
Nom de l'élément nutritif |
Unité |
ESPGHAN (2010)Référence 1 |
Tsang, et. al. (2005)Référence 2 >1000 g P.C. |
LSRO (2002)Référence 3 |
OMSRéférence 4 >1000 g P.C. (stabilisation à terme)Remarque a |
Koletzko, et. al. (2014)Référence 5 |
Min |
Max |
||
Protéines |
g |
1,8 – 4 |
3,2 – 4,1Remarque b |
2,6 – 3,8 |
2,5 – 3,6 |
[2,5 – 3,0] |
3,2 – 4,1 |
|||
Lipides |
g |
3,3 – 6 |
4,4 – 6,0 |
4,1 – 6,5 |
4,4 – 5,7 |
[3,8 – 5,7] |
4,4 – 6,0 |
|||
- AL |
g |
0,5 |
0,350 – 1,400 |
0,462 – 1,309 |
[0,350 – 1,425]Remarque c |
AP |
0,350 – 1,400 |
|||
- AAL |
g |
AP |
>0,050 |
AP (1 – 4 E% par kg/jour) |
0,077 – 0,228 (1,75 – 4% des acids gras totaux) |
AP |
0.050 |
|||
- AL:AAL |
- |
AP |
5 – 15 |
5 – 15 |
6 – 16 |
AP |
AP |
|||
- AA |
g |
AP |
0,016 – 0,039 |
0,022 |
[0 – 0,034] Remarque d |
AP |
0,032 – 0,041 |
|||
- ADH |
g |
AP |
0,011 – 0,027 |
0,016 |
[0 – 0,020]Remarque e |
AP |
0,050 – 0,055 |
|||
Glucides |
g |
AP |
10,5 – 12 |
5,4 – 15.5 |
9,6 – 12.5 |
[6,3 – 12.9] |
10,5 – 12 |
|||
- VITAMINES ET MINÉRAUX
Éléments nutritifs (unité) |
Exigences du RAD |
Recommandations des experts internationaux |
Profil nutritionnel |
Spécification |
||||||
|---|---|---|---|---|---|---|---|---|---|---|
Nom de l'élément nutritif |
Unité |
ESPGHAN (2010)Référence 1 |
Tsang, et. al. (2005)Référence 2 >1000 g P.C. |
LSRO (2002)Référence 3 |
OMSRéférence 4 >1000 g P.C. (stabilisation à terme)Remarque a |
Koletzko, et. al. (2014)Référence 5 |
Min |
Max |
||
Vitamine A |
UI |
250 – 500 |
1200 – 2467 |
538 – 1364 |
680 – 1267 |
583 – 1250 |
1217 – 3333 |
|||
mcg RE |
-- |
[360 – 740] |
[162 – 410] |
[204 – 380] |
[175 – 375] |
[365 – 1000] |
||||
Vitamine D |
UI |
40 – 100 |
800 – 1000Remarque f par jour |
115 – 364 |
75 – 270 |
[400 – 800]Remarque f par jour |
100 – 350 provenant seulement du lait |
|||
Vitamine E |
UI |
0.6 |
[3,0 – 15] |
4,6 – 10,9 |
[3,0 – 12] |
[5,0 – 10,0] |
[3,0 – 15] |
|||
mg a-TE |
-- |
2 – 10 |
[3,1 – 7,3] |
2 – 8 Remarque g |
[3,4 – 6,7] |
2 – 10 |
||||
Vitamine K |
mcg |
8 |
4 – 25 |
6,2 – 9,1 |
4 – 25 |
[6.7 – 8.3] |
4 – 25 |
|||
Vitamine C |
mg |
8 |
10 – 42 |
13,8 – 21,8 |
8,3 – 37 |
[5 – 8] |
18 – 50 |
|||
Thiamine |
mcg |
40 |
125 – 275 |
138 – 218 |
30 – 250 |
[33 – 42] |
127 – 273 |
|||
Riboflavine |
mcg |
60 |
180 – 365 |
192 – 327 |
80 – 620 |
[300 – 383] |
181 – 364 |
|||
Vitamine B6 |
mcg |
35 |
41 – 273 |
115 – 191 |
30 – 250 |
[15]Remarque h |
45 – 273 |
|||
Vitamine B12 |
mcg |
0,15 |
0,08 – 0,7 |
0,23 – 0,27 |
0,08 – 0,7 |
[0,15]Remarque f |
0,09 – 0,73 |
|||
Niacine |
mcg |
250 |
345 – 5000 |
2800 – 4400 |
550 – 5000 |
[720] |
900 – 5000 |
|||
Acide pantothénique |
mcg |
300 |
300 – 1900 |
900 – 1500 |
300 – 1900 |
[667 – 1083] |
450 – 1900 |
|||
Acide folique |
mcg |
4 |
32 – 90 |
19 – 45 |
30 – 45 |
[50]Remarque f |
32 – 91 |
|||
Biotine |
mcg |
2 |
1,5 – 15 |
2,8 – 5,5 |
1,0 – 37 |
[1,3] |
1.5 – 15 |
|||
Choline |
mg |
12 |
7 – 50 |
11,1 – 25,5 |
7 – 23 |
AP |
7,3 – 50 |
|||
Inositol |
mg |
AP |
4 – 48 |
25 – 74 |
4 – 44 |
AP |
4 – 48 |
|||
Taurine |
mg |
AP |
AP |
3,5 – 8,2 |
5 – 12 |
AP |
AP |
|||
Carnitine |
mg |
AP |
AP |
2,2 – 2,6 |
2 – 5,9 |
AP |
AP |
|||
Calcium (Ca) |
mg |
50 |
110 – 130 |
77 – 200 |
123 – 185 |
[134 – 200] |
109 – 182 |
|||
Phosphore(P) |
mg |
25 |
55 – 80 |
46 – 127 |
82 – 109 |
[65 – 98] |
55 – 127 |
|||
Ca:P |
-- |
1,2 – 2 |
AP |
AP |
1,7 – 2,0:1 |
AP |
AP |
|||
Magnésium |
mg |
6 |
7,5 – 13,6 |
AP |
6,8 – 17 |
[4,1 – 8,1] |
7,5 – 13.6 |
|||
Sodium |
mg |
20 – 60 |
63 – 105 |
53 – 105 |
39 – 63 |
[48 – 77] |
63 – 105 |
|||
Potassium |
mg |
80 – 200 |
60 – 120 |
60 – 106 |
60 – 160 |
[81 – 114] |
71 – 177 |
|||
Chlorure |
mg |
55 – 150 |
95 – 161 |
82 – 226 |
60 – 160 |
[74 – 118] |
95 – 161 |
|||
Fer |
mg |
0.15 |
1,8 – 2,7 |
1,538 – 3,636 |
1,7 – 3,0 |
[1.7 – 2.5] |
1,8 – 2,7 |
|||
Zinc |
mg |
0.5 |
1,0 – 1,8 |
0,769 – 2,727 |
1,1 – 1,5 |
[0,42 – 0,67] |
1,3 – 2,3 |
|||
Cuivre |
mcg |
60 |
90 – 120 |
92 – 136 |
100 – 250 |
[58 – 101] |
90 – 210 |
|||
Manganèse |
mcg |
5 |
6,3 – 25 |
0,5 – 6,8 |
6,3 – 25 |
[0,5 – 0,9] |
0,9 – 13,6 |
|||
Iode |
mcg |
5 |
10 – 50 |
7,7 – 54,5 |
6 – 35 |
[26 – 53] |
9 – 50 |
|||
Sélénium |
mcg |
AP |
4,5 – 9 |
1,0 – 4,1 |
1,8 – 5,0 |
[2,6 – 3,9] |
4,5 – 9 | |||
Chrome |
mcg |
AP |
0,027 – 1,12 |
0,08 – 2,05 |
AP |
0,04 – 0,08 |
0,027 – 2,045 |
|||
Molybdène |
mcg |
AP |
0,27 – 4,5 |
0,23 – 0,27 |
AP |
0,16 – 0,32 |
0,27 – 4,5 |
|||
Fluorure |
mcg |
AP |
1,4 – 55 |
NS |
0 – 25 |
AP |
1,4 – 55 |
|||
- NUCLÉOTIDES
Éléments nutritifs (unité) |
Exigences du RAD |
Recommandations des experts internationaux |
Profil nutritionnel |
Spécification |
||||||
|---|---|---|---|---|---|---|---|---|---|---|
Nom de l'élément nutritif |
Unité |
ESPGHAN (2010)Référence 1 |
Tsang, et. al. (2005)Référence 2 >1000 g P.C. |
LSRO (2002)Référence 3 |
OMSRéférence 4 >1000 g P.C. (stabilisation à terme)Remarque a |
Koletzko, et. al. (2014)Référence 5 |
Min |
Max |
||
Nucléotides totaux |
mg |
AP |
AP |
AP |
AP |
AP |
AP |
|||
AMP |
mg |
AP |
AP |
0,27 – 0,73 |
AP |
AP |
AP |
|||
CMP |
mg |
AP |
AP |
1,6 – 3,7 |
AP |
AP |
AP |
|||
GMP |
mg |
AP |
AP |
0,03 – 0,54 |
AP |
AP |
AP |
|||
UMP |
mg |
AP |
AP |
0,69 – 0,9 |
AP |
AP |
AP |
|||
Abréviations
- AAL
- acide alpha-linolénique;
- AGPI
- acides gras polyinsaturés
- AL
- acide linoléique
- AMP
- adénosine monophosphate
- AP
- aucune précision
- Ca:P
- calcium/phosphore
- CMP
- cytosine monophosphate
- Eα-T
- équivalents α-tocophérol
- ER
- équivalents rétinol
- GMP
- guanosine monophosphate
- LSRO
- Life Sciences Research Office
- Max
- maximum
- mg
- milligramme
- mcg
- microgramme
- Min
- minimum
- OMS
- Organisation mondiale de la Santé
- UMP
- uridine monophosphate
Références
- Référence 1
-
Agostoni C, Buonocore G, Carnielli VP, De Curtis M, Darmaun D, Decsi T, et al. Enteral nutrient supply for preterm infants: commentary from the European Society of Paediatric Gastroenterology, Hepatology, and Nutrition Committee on Nutrition. J Pediatr Gastroenterol Nutr. 2010:50. 85-91.
- Référence 2
-
Tsang RC, Uauy R, Koletzko B, Zlotkin S. Nutrition of the preterm infant, Scientific basic and practical guidelines. Cincinnati, OH: Digital Educational Publishing Inc. 2005.
- Référence 3
-
Klein CJ. Nutrient requirements for preterm infant formulas. J Nutr 2002;132:1395S-577S.
- Référence 4
-
Tudehope D. et al. Nutritional Needs of the Micropreterm Infant March 2013, Volume 162, Issue 3, Supplement, Pages S72–S80
- Référence 5
-
Koletzko B, Poindexter B, Uauy R. Nutritional Care of Preterm Infants: Scientific Basis and Practical Guidelines. Karger, 2014:99-120
Remarques
- Remarque a
-
Calculé sur la base de la moyenne des recommandations énergétiques maximales et minimales pour la population indiquée; 120 kcal/kg/j pour une stabilisation à terme.
- Remarque b
-
3,6 – 4,1 g / 100 kcal pour les nourrissons dont le poids corporel est inférieur à 1 kg; 3,2-3,6 g/100 kcal pour les nourrissons dont le poids corporel se situe entre 1 et 1,8 kg.
- Remarque c
-
Acides gras totaux : 8% (minimum) and 25% (maximum)
- Remarque d
-
La recommandation minimale pour l'AA n'a pas été établie. Maximum : 0,6 % des acides gras totaux, avec la condition supplémentaire que le ratio AA:ADH se situe dans la plage 1,5-2,0:1.
- Remarque e
-
La recommandation minimale pour l'ADH n'a pas été établie. Maximum : 0,35 % des acides gras totaux, avec la condition supplémentaire que le ratio AA:ADH se situe dans la plage 1,5-2,0:1.
- Remarque f
-
Recommandation donnée par jour, indépendamment du poids corporel et de l'apport énergétique.
- Remarque g
-
Le ratio vitamine E:AGPI (mg d'Eα-T par g d'AGPI) devrait être supérieur à 1,5 mg/g.
- Remarque h
-
Recommandation par gramme de protéines consommé.
Appendice 2. Composition du lait maternel pour prématurés
Note : Ces données peuvent être utilisées pour remplir le modèle ci-dessus, ainsi que pour normaliser l'approche.
Éléments nutritifs |
Unités |
Lait humain pour prématurés (par 100 kcal) |
Lait humain pour prématurés (par 100 mL) |
|---|---|---|---|
MACRONUTRIMENTS |
|||
Protéines Référence 1Remarque a |
g |
2,1 |
1,5 |
Lipides tRéférence 1Remarque a |
g |
4,9 |
3,5 |
- Acide linoléique Référence 2 |
g |
0,72 |
0,48 |
- Acide alpha-linolénique Référence 2 |
g |
0,045 |
0,03 |
- AL:AAL |
-- |
16:1 |
16:1 |
- Acide arachidonique (AA)Référence 2 |
g |
0,029 |
0,017 |
- Acide docosahexaénoïque (ADH) Référence 2 |
g |
0,017 |
0,011 |
Glucides Référence 2 |
g |
10,9 |
7,3 |
VITAMINES ET MINÉRAUX |
|||
Vitamine A Référence 2 |
IU |
72 |
48 |
Vitamine D Référence 2 |
IU |
12 |
8 |
Vitamine E Référence 2 |
IU |
0,59 |
0,39 |
Vitamine K Référence 2 |
mcg |
3 |
2 |
Vitamine C Référence 2 |
mg |
6,6 |
4,4 |
Thiamine Référence 2 |
mcg |
13,35 |
8,9 |
Riboflavine Référence 2 |
mcg |
40,5 |
27 |
Vitamine B6 Référence 2 |
mcg |
9,3 |
6,2 |
Vitamine B12 Référence 2 |
mcg |
0,03 |
0,02 |
Niacine Référence 2 |
mcg |
315 |
210 |
Acide pantothénique Référence 2 |
mcg |
345 |
230 |
Acide folique Référence 2 |
mcg |
4,65 |
3,1 |
Biotine Référence 2 |
mcg |
0,81 |
0,54 |
Choline Référence 3 |
mg |
23,7 |
15,8 |
Inositol Référence 4 |
mg |
29,1 |
19,4 |
VITAMINES ET MINÉRAUX (suite) |
|||
Taurine Référence 2 |
mg |
6 |
4 |
Carnitine Référence 2 |
mg |
1,05 |
0,7 |
CalciumRéférence 1Remarque a |
mg |
35 |
25 |
PhosphoreRéférence 1Remarque a |
mg |
21 |
15 |
Ca:P |
mg-mg |
1.67: 1 |
1,67: 1 |
Magnésium Référence 2 |
mg |
4,95 |
3,3 |
Sodium Référence 2 |
mg |
42 |
28 |
Potassium Référence 2 |
mg |
75 |
50 |
Chlorure Référence 2 |
mg |
87 |
58 |
Fer Référence 2 |
mg |
0,135 |
0,09 |
Zinc Référence 2 |
mg |
0,56 |
0,37 |
Cuivre Référence 2 |
mcg |
57 |
38 |
Manganèse Référence 2 |
mcg |
0,54 |
0,36 |
Iode Référence 2 |
mcg |
26,7 |
17,8 |
Sélénium Référence 2 |
mcg |
3,6 |
2,4 |
Chrome Référence 5Remarque b |
mcg |
0,038 |
0,025 |
Molybdène Référence 5 |
mcg |
0,3 |
0,2 |
Fluorure Remarque c |
mcg |
NS |
NS |
NUCLÉOTIDES |
|||
Nucléotides totaux |
mg |
NS |
NS |
AMP |
mg |
NS |
NS |
CMP |
mg |
NS |
NS |
GMP |
mg |
NS |
NS |
UMP |
mg |
NS |
NS |
Abréviations
- AA
- acide arachidonique
- AAL
- acide alpha-linolénique;
- ADH
- acide docosahexaénoïque
- AL
- acide linoléique
- AMP
- adénosine monophosphate
- Ca:P
- rapport calcium/phosphore
- CMP
- cytosine monophosphate
- g
- gramme
- GMP
- guanosine monophosphate
- mcg
- microgramme
- mg
- milligramme
- NS
- non spécifié
- OMS
- Organisation mondiale de la Santé
- PC
- poids corporel
- UMP
- uridine monophosphate
Références
- Référence 1
-
Gidrewicz, D.A., et T.R. Fenton. « A systematic review and meta-analysis of the nutrient content of preterm and term breast milk », BMC Pediatrics, vol. 14, p. 216, 30 août 2014.
- Référence 2
-
Koletzko, B., B. Poindexter et R. Uauy. Nutritional Care of Preterm Infants: scientific basis and practical guidelines, Bâle (Suisse), Karger AG, 2014.
- Référence 3
-
Maas, C., A.R. Franz, A. Shunova, M. Mathes, C. Bleeker, C.F. Poets, E. Schleicher et W. Bernhard. « Choline and polyunsaturated fatty acids in preterm infants' maternal milk », European Journal of Nutrition, vol. 56, no 4, p. 1733-1742, juin 2017.
- Référence 4
-
Moles, L., S. Manzano, L. Fernández, A. Montilla, N. Corzo, S. Ares, J.M. Rodríguez et I. Espinosa-Martos. « Bacteriological, biochemical, and immunological properties of colostrum and mature milk from mothers of extremely preterm infants », Journal of Pediatric Gastroenterology and Nutrition, vol. 60, no 1, p. 120-126, janvier 2015.
- Référence 5
-
Klein, C.J. « Nutrient requirements for preterm infant formulas », Journal of Nutrition, vol. 132, no 6, suppl. 1, p. 1395S-1577S, juin 2002.
Remarques
Pour la référence 1, 71 kcal/100 mL; pour les autres, ~67 kcal/100 mL
- Remarque a
-
Les valeurs relatives aux protéines, aux lipides, au calcium et au phosphore sont basées sur les données de la semaine 2 (méta-analyse); toutes les autres valeurs sont basées sur les données obtenues durant les semaines 1 à 4
- Remarque b
-
Les valeurs pour le chrome sont basées sur le lait humain pour nourrissons né à terme (valeurs utilisées par le LSRO, 2002)
- Remarque c
-
Non Spécifié en raison des fortes fluctuations (dues vraisemblablement à la variation des taux de fluorure dans l'eau)