Module 4 : Examen et communication par Santé Canada des résultats sur l’innocuité

Télécharger le format de rechange
(Format PowerPoint, 3,3 Mo, 33 pages)
Organisation : Santé Canada
Publiée : 2019-12-13
Module 4 - Résultats d'apprentissage
La fin du module 4 vous permettra de :
- Présenter une vue d'ensemble de la vigilance des produits de santé au Canada
- Déterminer les étapes de la déclaration des effets indésirables (EI) et des problèmes relatifs aux instruments médicaux (PIM)
- Décrire les activités de surveillance des produits après leur mise en marché ; elles comprennent, entre autres, la détection des signaux d'innocuité, leur priorisation et leur évaluation, l'examen de l'innocuité et l'atténuation des risques.
- Décrire la communication des risques par Santé Canada
- Prendre acte des diverses ressources fournies par Santé Canada pour diffuser les données et les résultats relatifs aux EI et aux PIM
- Comprendre les principes de Santé Canada en matière de sécurité et de mise en commun des données de déclaration des EI et des PIM
Module 4 - Sujets abordés
- Vigilance sur les produits de santé
- Gestion des déclarations d'EI et de PIM par Santé Canada
- Mise en commun de l'information provenant des déclarations d'EI et de PIM
- Bases de données en ligne sur les EI et les PIM
- Examens de l'innocuité de Santé Canada
- Rappels et avis de sécurité de Santé Canada
- InfoVigilance sur les produits de santé
- Registre des médicaments et des produits de santé (RMPS)
- Sécurité des données et mise en commun à partir des déclarations d'EI et de PIM
- Éléments essentiels à retenir
- Abréviations
- Ressources
Modèle théorique de la déclaration par les hôpitaux des RIM graves et des IIM
Le module 4 décrit l'analyse de Santé Canada et ses constatations relatives à l'innocuité.
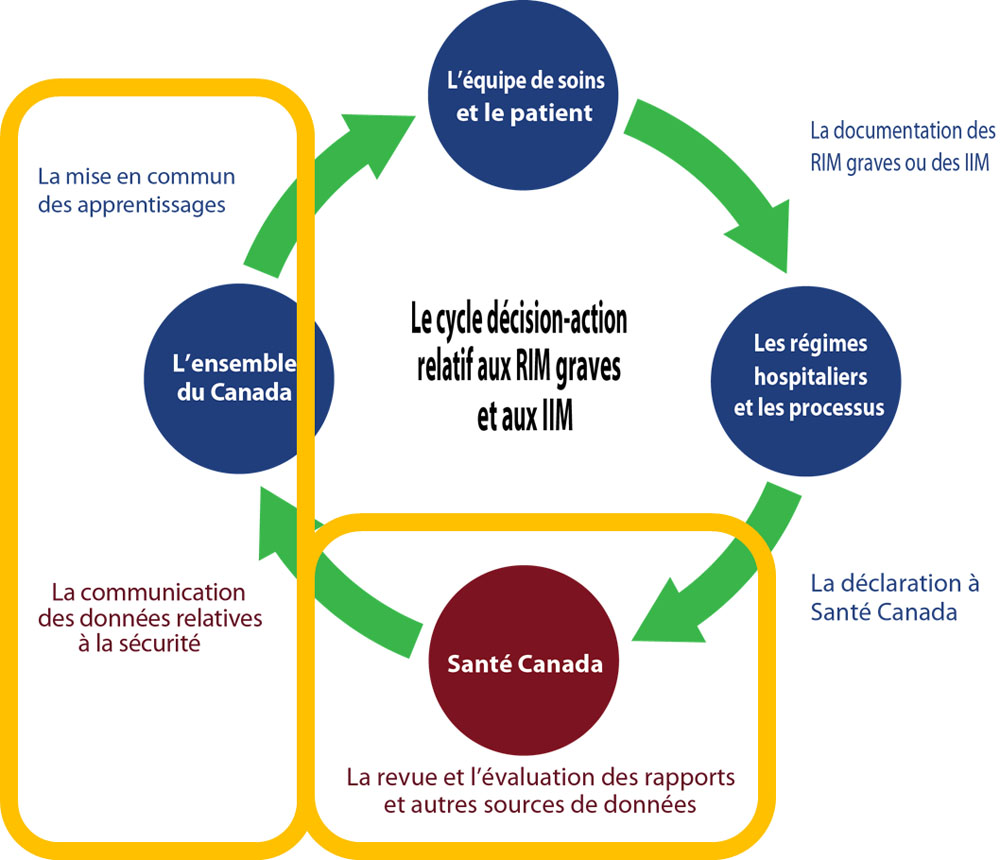
Source : Le cycle décision-action lié aux RIM graves et aux IIM. ISMP Canada, Organisation des normes en santé (HSO), ICSP; 2019
Équivalent textuel
Un diagramme circulaire illustre le cycle décision-action relatif aux RIM graves et aux IIM soumis par les hôpitaux. En résumé, le graphique illustre la documentation des RIM graves ou des IIM par l'équipe soignante et des patients. Signaler un RIM grave ou un IIM à Santé Canada est soutenu par les systèmes et les processus hospitaliers. Santé Canada examine et évalue les rapports et autres sources de données. Santé Canada communique les conclusions de sécurité à tous les canadiens, incluant les hôpitaux à qui l'on apprend à partager les connaissances. Ceci conclue le cycle de décision-action.
Le diagramme superpose deux formes rectangulaires jaune autour de parties spécifiques du cycle décision-action.
Le premier rectangle jaune est placé autour :
- Révision et évaluation des rapports et autres sources de données par Santé Canada.
Le deuxième rectangle jaune est placé autour :
- Connaissances acquises par tous les canadiens (incluant les hôpitaux) des conclusions de sécurité que Santé Canada leur communique et partage.
Vigilance sur les produits de santé
- Santé Canada puise ses connaissances sur l'innocuité des produits après leur mise en marché à partir de plusieurs sources. Ces données, indispensables à l'efficacité de leur utilisation clinique, proviennent notamment des déclarations de réactions indésirables à un médicament (RIM graves) et des incidents liés aux instruments médicaux (IIM).
- En plus des déclarations de RIM graves et d'IIM, diverses autres sources de données concourent à la surveillance de l'innocuité des produits thérapeutiques, notamment :
- La déclaration obligatoire des parties réglementées ;
- Les rapports volontaires des professionnels de la santé et des consommateurs ;
- Des données étrangères, comme l'évaluation par le fabricant des données mondiales sur la sécurité ;
- L'échange d'informations avec les organismes de réglementation étrangers ;
- La littérature médicale ;
- L'information générée par le Réseau sur l'innocuité et l'efficacité des médicaments (RIEM).
- Ce module reflète la vaste portée des activités de surveillance des produits de Santé Canada qui vont au-delà de la déclaration obligatoire par les hôpitaux (des RIM graves et des IIM) ; cette diversité se reflète dans la terminologie de déclaration des EI et des PIM.
Cycle de vie de la vigilance sur les produits de santé de Santé Canada
- SOUMISSION à l'autorisation de mise sur le marché
- Soumission du produit (produits pharmaceutiques, produits de santé naturel, produits biologiques et biosimilaires, produits radiopharmaceutiques, produits désinfectants et les produits d'hygiène comportant des allégations de propriétés de désinfection, et instruments médicaux) par le détenteur d'une autorisation de mise en marché (DAMM)
- Examen avant la mise en marché
- Examen des soumissions de produit pour en évaluer l'innocuité, l'efficacité et la qualité
- Revue des plans de gestion des risques avec le DAMM pour atténuer les risques possibles (le cas échéant)
- Évaluation du nom du produit et de l'étiquette (selon la classe d'instrument médical)
- Surveillance après la mise en marché
- Surveillance de l'innocuité et de l'efficacité des produits de santé en déterminant et en évaluant les possibles signaux d'innocuité par l'entremise de multiples sources, y compris la déclaration spontanée des effets indésirables aux produits de santé et des problèmes liés aux instruments médicaux, la revue de littérature, les rapports de synthèse annuels (RSA) sur l'innocuité, le RIEM, la liaison avec les autres autorités réglementaires, etc.
- Atténuation des risques
- Observation continue
- Modifications des étiquettes
- Communication des risques
- Rappel des produits
- Activités éducatives
- Retrait du marché
- Autre
- Conformité et respect de la réglementation
- Suivi de la qualité des déclarations des effets indésirables/problèmes liés aux instruments médicaux par l'encouragement de la conformité et du respect de la réglementation (p. ex., inspections)
- Application des règlements
La déclaration des EI est essentielle à la surveillance après la mise en marché
- De nombreux problèmes d'innocuité ne sont décelés QU'APRÈS l'approbation de la mise en marché en raison de l'utilisation du produit de santé par de plus grandes populations.
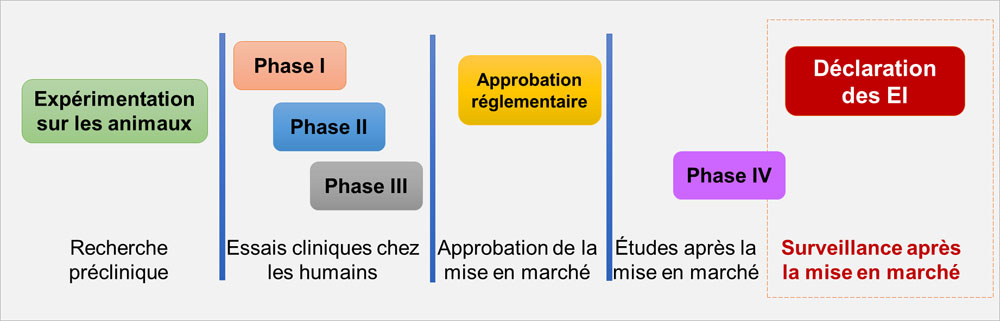
Équivalent textuel
Ce diagramme illustre la circulation des médicaments à travers cinq étapes.
Étape 1 : Recherche préclinique
- Tests sur des animaux
Étape 2 : Essais cliniques chez l'être humain.
- Phase Un
- Phase Deux
- Phase Trois
Étape 3 : Approbation du marché
- Approbation règlementaire
Étape 4 : Études post-commercialisation
- Phase Quatre
Étape 5 : Surveillance post-commercialisation
- Signalement
La déclaration des PIM est essentielle à la surveillance après la mise en marché
- De nombreux problèmes liés aux instruments médicaux ne sont détectés QU'APRÈS l'approbation de leur mise en marché en raison de l'utilisation par de plus grandes populations.

Équivalent textuel
Ce diagramme illustre la circulation des instruments médicaux à travers cinq étapes.
Étape 1 : Recherche
- Invention et prototypage d'appareils, qui se décompose en :
- Développement
- Validation
- Conception
- Mise à l'essais
- Refonte
Étape 2 : Essais expérimentaux
- Études et collectes de données
- Analyse de données
- Refonte
Étape 3 : Approbation du marché
- Approbation règlementaire
Étape 4 : Lancement de l'instrument
Étape 5 : Surveillance post-commercialisation
- Signalement d'IIM
| Portée limitée des essais cliniques/essais expérimentaux | La surveillance après la mise en marché détecte les problèmes émergents d'innocuité |
|---|---|
| Environnement hautement contrôlé | Utilisation en situation réelle |
| Nombre restreint de patients | Population variée et nombreuse |
| Essai clinique de courte durée | Utilisation à long terme |
| Patients triés sur le volet | Utilisation non indiquée sur l'étiquette par différents groupes de patients |
| Sélection des cas et des maladies | Patients avec de multiples comorbidités |
| Non-détection possible des incidents rares | Possibilité de détection d'incidents rares |
Gestion des déclarations d'EI et de PIM par Santé Canada
Étapes de la gestion des déclarations d'EI et de PIM
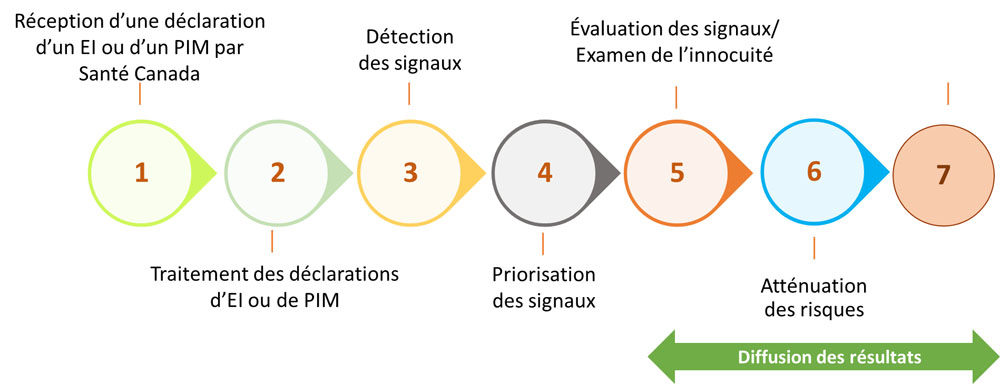
Équivalent textuel
Le diagramme montre les sept étapes de rapports de gestion des RIM et d'IIM.
- Rapport de RIM ou d'IIM reçu par Santé Canada
- Traitement du rapport de RIM ou d'IIM
- Détection de signaux
- Hiérarchisation des signaux
- Évaluation des signaux/Examen de sécurité
- Atténuation des risques
- Communication possible des risques
Une flèche verte nommée « Diffusion des résultats » est placée sous les étapes cinq à sept.
Détection et évaluation des signaux
- Les signaux relatifs à l'innocuité (indications préliminaires de problèmes d'innocuité liés aux produits) sont détectés par l'analyse des données, y compris l'examen des déclarations d'EI et de PIM.
- Les signaux potentiels sont examinés par un comité interne composé de scientifiques, de pharmaciens et de médecins pour déterminer si une évaluation des signaux sera effectuée.
- L'évaluation de toutes les sources de données s'avère nécessaire pour examiner les possibles mesures d'atténuation des risques.
- Les considérations relatives au risque tiennent compte de la validité des preuves, du caractère gérable du risque, de la diffusion de l'information et des objectifs de communication.
- Une fois l'évaluation des signaux terminée, des recommandations sont formulées. Elles peuvent comprendre la modification des étiquettes (notamment l'indication), le rappel ou le retrait d'un produit du marché et la communication des risques aux intervenants.
La Loi visant à protéger les Canadiens contre les drogues dangereuses (Loi de Vanessa) améliore la capacité de Santé Canada à recueillir des renseignements sur l'innocuité des produits après leur mise en marché et à intervenir rapidement au moyen de mesures appropriées lorsqu'un risque grave pour la santé est mis en évidence.Note de bas de page 1
Communication des risques
Public visé : les professionnels de la santé et les hôpitaux
- Communication des risques liés aux produits de santé
- Communication ad hoc relative aux enjeux d'innocuité
- Large diffusion (affichage sur le Web, fil RSS, avis électronique MedEffetMD)
- Diffusion ciblée par le détenteur d'une autorisation de mise en marché ou par Santé Canada (télécopieur, courriel, poste)
- InfoVigilance sur les produits de santé
- Publication mensuelle de sensibilisation aux problèmes d'innocuité et de promotion de leur déclaration
- Chaque numéro propose un récapitulatif mensuel des avis sur les produits de santé, des résumés des examens d'innocuité et une sélection croissante de nouveaux renseignements sur l'innocuité des produits de santé.
- Large diffusion (affichage sur le Web, Twitter, fil RSS, avis électronique MedEffetMD)
Public cible : grand public
- Avis de rappel
- Rédigé et distribué par l'industrie ; un « extrait » de l'information est publié par Santé Canada
- Publication à intervalles réguliers dans la base de données des rappels et des avis de sécurité de Santé Canada
- Avis public
- Rédigé par Santé Canada en cas de problèmes urgents à risque élevé
- Large diffusion (Newswire, Twitter, fil RSS, avis électronique MedEffetMD)
- Diffusion ciblée aux intervenants au besoin
- Mise à jour
- Rédigée par Santé Canada en cas de problèmes moins urgents ne comportant pas de risques élevés (p. ex. mise à jour de l'étiquetage)
- Large diffusion (Newswire, Twitter, fil RSS, avis électronique MedEffetMD)
- Alerte de produit étranger (APE)
- Santé Canada communique au besoin des renseignements sur les produits non autorisés en provenance d'autres pays qui peuvent avoir été introduits au pays par des voyageurs ou achetés en ligne.
Mise en commun de l'information provenant des déclarations d'EI et de PIM
Mise en commun de l'information avec les partenaires du système de santé
- Outre la diffusion en ligne des données sur les EI et les PIM et la publication d'un rapport annuel sur les tendances, Santé Canada fait aussi paraître des communications sur les risques à l'intention des prestataires de soins de santé dans le cadre de divers forums.
- Santé Canada s'efforce d'améliorer continuellement ses analyses de données sur les EI et les PIM pour que les partenaires du système de santé aient accès en temps opportun aux informations indispensables.
- Analyse des données :
- Investir dans la technologie de l'information pour favoriser l'analyse ponctuelle des données sur les EI et les PIM et simplifier la détection de nouveaux signaux d'innocuité
- Investir dans l'optimisation des bases de données existantes consultables sur les EI/PIM
- Mise en commun de l'information avec les partenaires par l'entremise :
- Du rapport annuel de Santé Canada sur les EI et les PIM
- Des activités de sensibilisation et d'éducation à la déclaration et à la surveillance après la mise en marché
- Analyse des données :
Exemples de mise en commun de l'information sur l'innocuité liée aux EI et aux PIM
Santé Canada diffuse les résultats aux prestataires de soins de santé et au public pour les alerter et les éduquer sur les risques pour la santé associés aux produits de santé.
De multiples sources d'information sur l'innocuité fournissent des renseignements à jour sur les EI et les PIM :
- Base de données en ligne des effets indésirables
- Base de données sur les incidents liés aux matériels médicaux
- Rapport des tendances annuelles dans les déclarations de cas d'EI et de PIM
- Examens de l'innocuité de Santé Canada
- Rappels et avis de sécurité de Santé Canada
- InfoVigilance sur les produits de santé
- Registre des médicaments et des produits de santé (RMPS)
Base de données en ligne des effets indésirables
Base de données en ligne des effets indésirables de Canada Vigilance
- Base de données consultable fondée sur les déclarations d'EI après la mise en marché de produits depuis 1965
- Les effets indésirables soupçonnés à des produits de santé y sont consignés
- Les fichiers peuvent être exportés et sauvegardés dans différents formats
Il est possible de consulter et d'effectuer une recherche à partir de plusieurs champs de la base de données des déclarations d'EI :
- Date de réception de la déclaration, gravité et source
- Information du patient (sexe, âge, résultats)
- Produit de santé suspect soit par marque de commerce ou par ingrédient actif
- Effet indésirable soit par terme ou par système et organe
Source : Base de données en ligne des effets indésirables de Canada Vigilance
Base de données en ligne sur les instruments médicaux
Base de données sur les incidents liés aux instruments médicaux
- Base de données consultable fondée sur les déclarations de PIM après la mise en marché de produits depuis 1980
- Elle comprend les instruments approuvés pour le marché canadien
- Extrait complet téléchargeable
On peut consulter et effectuer des recherches parmi les déclarations de PIM en saisissant du texte de forme libre. Voici les données retournées :
- Identifiant de l'incident
- Date de réception
- Nom de l'instrument
- Type d'instrument
- Nom de l'entreprise
- Gravité du danger
- Description
- Types de codes attribués
Source : Matériel médical
Rapport annuel des tendances
Le rapport annuel sur les tendances fournit une analyse descriptive des déclarations de cas d'effets indésirables à des produits de santé et de problèmes relatifs aux instruments médicaux à Santé Canada entre 2008 et 2017.
Examens de l'innocuité de Santé Canada
Santé Canada publie régulièrement des résumés de l'examen des signaux après la mise en marché des produits.
Chaque résumé de l'examen de l'innocuité présente :
- Ce qui a été évalué
- Ce qui a été trouvé
- Quelles mesures ont été prises par Santé Canada
Ces résumés facilitent la prise de décision des Canadiens et des Canadiennes à l'égard de leur médication et du choix des instruments médicaux.
Source : Examens de l'innocuité
Rappels et avis de sécurité
La base de données des rappels et des avis de sécurité centralise l'accès aux rappels et aux avis de sécurité des organismes suivants :
- Santé Canada
- Agence canadienne d'inspection des aliments
- Transport Canada
Source : Rappels et avis de sécurité
InfoVigilance sur les produits de santé
- Une publication mensuelle s'adressant principalement aux prestataires de soins de santé
- Source de renseignements cliniques pertinents axés sur l'innocuité pour les :
- Produits pharmaceutiques ;
- Produits biologiques ;
- Instruments médicaux ;
- Produits de santé naturels.
- Chaque publication comprend :
- Un récapitulatif mensuel des avis sur les produits de santé
- Des résumés des examens d'innocuité
- De nouveaux renseignements sur l'innocuité des produits de santé
- Des mises à jour des monographies de produit.
ABONNEZ-VOUS :
InfoVigilance sur les produits de santé
Registre des médicaments et des produits de santé (RMPS)
Le RMPS fournit des renseignements sur l'innocuité des produits de santé offerts au Canada.
Ce registre permet au public :
- D'accéder à des résumés des décisions réglementaires en langage clair et simple :
- Résumé de l'examen de l'innocuité
- Sommaire des motifs de décision
- Sommaire des décisions réglementaires
- De rechercher des informations sur les EI et les PIM
- De rechercher les effets indésirables signalés, les problèmes d'instruments médicaux et les rapports sommaires d'information sur l'innocuité
- De déclarer les effets indésirables des produits de santé
Source : Registre des médicaments et des produits de santé
Portail de publication par Santé Canada des données après la mise en marché
MedEffet Canada facilite l'accès des professionnels de la santé et des consommateurs aux informations sur l'innocuité (avis, alertes, rappels, etc.) qui sont rapportées par Santé Canada à la suite des activités de surveillance et d'évaluation des produits après leur mise en marché.
Ce portail permet d'accéder à des ressources supplémentaires traitant des produits de santé.
Source : MedEffet Canada
Sécurité des données et mise en commun à partir des déclarations d'EI et de PIM
Utilisation des données recueillies - sécurité et confidentialité
Santé Canada :
- Conserve les déclarations d'EI et de PIM dans une base de données confidentielle.Note de bas de page 2
- Suit des protocoles pour que les renseignements identificatoires des patients et du déclarant soient protégés en vertu de la Loi fédérale sur la protection des renseignements personnels.
- S'assure que les déclarations d'EI et de PIM sont dépersonnalisées avant l'échange des informations.
- Envoie les données sur les EI à l'Organisation mondiale de la Santé (OMS) (base de données mondiale de pharmacovigilance) (en anglais seulement).
- S'engage à ce que les données soient utilisées et transmises de façon responsable sur le plan scientifique et social.
Collaboration internationale
- Soutient la surveillance et la détection des nouveaux problèmes d'innocuité causés par les produits de santé
- Facilite la détection des signaux d'innocuité en raison d'un plus grand ensemble de données
- Améliore la sécurité des patients grâce à la communication cohérente des risques liés aux produits de santé
- Les organismes de réglementation suivants collaborent : FDA des États-Unis, EMA de l'UE, MHRA du Royaume-Uni, TGA de l'Australie, PMDA du Japon.
- Fait avancer les normes et les systèmes de pharmacovigilance et promouvoit l'apprentissage en la matière à l'échelle mondiale par l'entremise d'organisations, comme l'IMDRF, le CIH, l'ISoP et l'ICMRA
Éléments essentiels à retenir
- Les déclarations d'EI et de PIM sont essentielles, car de nombreux problèmes d'innocuité sont détectés après la mise en marché des produits.
- Les étapes de gestion des déclarations d'EI et de PIM :
- Réception d'une déclaration d'EI ou de PIM par Santé Canada ;
- Traitement des déclarations d'EI ou de PIM ;
- Détection des signaux ;
- Priorisation des signaux ;
- Évaluation des signaux/examen de l'innocuité ;
- Atténuation des risques ;
- Possible communication des risques.
- Santé Canada s'est dotée de multiples mécanismes pour communiquer les leçons tirées des déclarations d'EI et de PIM, comme le Registre des médicaments et des produits de santé (bases de données consultables en ligne, examens sommaires de l'innocuité et accès aux rapports) et MedEffet Canada.
Abréviations
- RIM :
- Réaction indésirable à un médicament
- EI :
- Effet indésirable
- RMPS :
- Registre des médicaments et des produits de santé
- RIEM :
- Réseau sur l'innocuité et l'efficacité des médicaments
- EMA :
- Agence européenne des médicaments
- UE :
- Union européenne
- FDA :
- Secrétariat américain aux produits alimentaires et pharmaceutiques
- CIH :
- Conférence internationale sur l'harmonisation des exigences techniques relatives à l'homologation des produits pharmaceutiques à usage humain
- ICMRA :
- International Coalition of Medicines Regulatory Authorities (Coalition internationale des autorités de réglementation pharmaceutique)
- IMDRF :
- International Medical Device Regulators Forum (Forum international des organismes de réglementation des matériels médicaux)
- ISoP :
- International Society of Pharmacovigilance (Société internationale de pharmacovigilance)
- DAMM :
- détenteur d'une autorisation de mise en marché
- IIM :
- incident lié aux instruments médicaux
- PIM :
- problème relatif aux instruments médicaux (peu importe le type, pas nécessairement un incident)
- MHRA :
- Medicines and Healthcare Products Regulatory Agency (Agence de réglementation des médicaments et des produits de santé)
- PMDA :
- Pharmaceuticals and Medical Devices Agency (Agence des produits pharmaceutiques et des dispositifs médicaux)
- REI :
- résumé de l'examen de l'innocuité
- TGA :
- Therapeutic Goods Administration (un bureau du Département de la Santé et du Troisième Âge du Gouvernement australien)
- RU :
- Royaume-Uni
- É.-U. :
- États-Unis
- OMS :
- Organisation mondiale de la santé
Ressources
- Tendances annuelles dans les déclarations de cas d'effets indésirables des produits de santé et des incidents liés aux matériels médicaux
- Base de données en ligne des effets indésirables de Canada Vigilance
- Registre des médicaments et des produits de santé (RMPS)
- Déclaration obligatoire des réactions indésirables graves à un médicament et des incidents liés aux instruments médicaux par les hôpitaux : document d'orientation
- Examens de l'innocuité de Santé Canada
- Rappels et avis de sécurité de Santé Canada
- InfoVigilance sur les produits de santé
- MedEffet Canada
- Base de données sur les incidents liés aux matériels médicaux
- Lignes directrices sur la divulgation au public de renseignements tirés des déclarations d’effets indésirables et d’incidents liés aux instruments médicaux
- Loi visant à protéger les Canadiens contre les drogues dangereuses (Loi de Vanessa)
- Base de données mondiale de pharmacovigilance de l'Organisation mondiale de la Santé (OMS) (en anglais seulement)
- Règlement modifiant le Règlement sur les aliments et drogues
- Règlement modifiant le Règlement sur les instruments médicaux
- La Loi sur la protection des renseignements personnels
Pour de plus amples renseignements, veuillez communiquer avec le Programme Canada Vigilance :
Courriel : hc.canada.vigilance.sc@canada.ca
Téléphone : 1 866 234-2345
Remerciements
- Tous les documents ont été élaborés par les parties collaboratrices suivantes : Santé Canada, l'Institut pour l'utilisation sécuritaire des médicaments du Canada (ISMP Canada), l'Organisation des normes en santé (HSO) et l'Institut canadien pour la sécurité des patients (ICSP).
- Toute personne souhaitant les utiliser doit citer Santé Canada comme le propriétaire et la source des documents : Formation à l'appui de la déclaration obligatoire, Santé Canada, 2019.
- Note de bas de page 1
-
Loi visant à protéger les Canadiens contre les drogues dangereuses (Loi de Vanessa) Modifications à la Loi sur les aliments et drogues (projet de Loi C-17)
- Note de bas de page 2
-
Effets secondaires déclarés – Avertissement