Archivée - InfoVigilance sur les produits de santé – juillet 2018

Télécharger le format de rechange
(Format PDF, 436 Ko, 6 pages)
Direction générale des produits de santé et des aliments
Direction des produits de santé commercialisés
Équipe de rédaction de l'InfoVigilance sur les produits de santé
ISSN 2368-8033
No cat 170364
Contenu
- Produits de santé mentionnés dans ce numéro
- Récapitulatif mensuel
- Nouveaux renseignements
- Portée
- Liens utiles
- Des suggestions?
- Droit d'auteur
Produits de santé mentionnés dans ce numéro
Produits pharmaceutiques et biologiques
Blincyto (blinatumomab)
Clozapine
Demulen 30
Écrans solaires
Imbruvica (ibrutinib)
Médicaments contenant du dolutégravir (Tivicay, Triumeq et Juluca)
Mésylate d'imatinib (Gleevec et génériques)
Matériels médicaux
Bandelettes de test pour détecter le fentanyl
Produits de santé naturels
Jamp-Glucose 50 et Jamp-Glucose 75
Autres
Produits de santé non autorisés
Récapitulatif mensuel des renseignements sur l'innocuité des produits de santé
Voici une liste des avis concernant les produits de santé, des rappels de type I, ainsi que des résumés de l’examen de l'innocuité ou de la sûreté publiés en juin 2018 par Santé Canada.
Bandelettes de test pour détecter le fentanyl
Santé Canada a rappelé aux Canadiens les limites potentielles des bandelettes de test du fentanyl lorsqu'utilisées pour détecter le fentanyl ou d'autres substances mortelles dans les drogues de rue avant leur consommation. Aucune bandelette de test du fentanyl n'est spécialement conçue pour vérifier les drogues de rue avant leur consommation. Une étude préliminaire faite par le Ministère d'une trousse de test du fentanyl indiquait que des résultats faux négatifs étaient possibles. Santé Canada a effectué des évaluations supplémentaires de la même trousse d'analyse du fentanyl et a constaté que même si le produit détectait du fentanyl chaque fois, il n'était pas fiable pour détecter certains analogues du fentanyl, y compris le carfentanil. Santé Canada collabore avec les entreprises pour inclure des mises en garde sur l'emballage de ces produits afin de mieux informer les consommateurs des risques de résultats non fiables lorsqu'ils utilisent les bandelettes de test de fentanyl pour vérifier les drogues de rue qu'ils prévoient consommer.
Mise à jour – Bandelettes de test pour détecter le fentanyl
Blincyto (blinatumomab)
Une nouvelle option pour la préparation de Blincyto a été autorisée récemment en sacs de solution pour perfusion sur 7 jours contenant de l’alcool benzylique. Cette option convient aux patients qui pèsent 22 kg ou plus. Elle n’est toutefois pas recommandée pour les patients de moins de 22 kg. Des effets indésirables graves et des décès (y compris le « syndrome de respiration haletante ») peuvent se produire chez les enfants, plus particulièrement chez les nouveau-nés et les nourrissons ayant reçu la solution pour perfusion Blincyto contenant de l’alcool benzylique comme agent de conservation. Pour préparer les sacs de solution pour perfusion Blincyto destinée aux nouveau-nés, aux nourrissons et aux patients pesant moins de 22 kg, il est recommandé aux professionnels de la santé d’utiliser uniquement une solution saline exempte d’agent de conservation. La monographie de produit canadienne du produit a fait l’objet d'une mise à jour pour tenir compte de ces nouveaux renseignements en matière d’innocuité.
Communication des risques aux professionnels de la santé – Blincyto (blinatumomab)
Clozapine
Ce résumé de l’examen de l'innocuité actualisé, initialement publié en mars 2018, a évalué le risque d'agranulocytose associée à la clozapine. L'examen de Santé Canada a conclu que les mesures de surveillance actuelles pour détecter l'agranulocytose sont acceptables, mais que le risque devrait continuer de faire l'objet d'une surveillance. Santé Canada a rappelé aux professionnels de la santé de suivre les recommandations concernant le passage d'un patient d'une marque de clozapine à une autre, tel qu'indiqué dans la monographie canadienne actuelle du produit, et dans une communication des risques émise précédemment.
Résumé de l'examen de l'innocuité – Clozapine
Demulen 30
La société Pfizer Canada Inc. a reçu des plaintes concernant des emballages de Demulen 30 qui comprenaient des comprimés brisés ou ébréchés. Santé Canada a rappelé aux femmes de vérifier leurs emballages de contraceptifs oraux et de signaler les problèmes qu’elles constatent.
Écrans solaires
Santé Canada a reçu un nombre plus élevé que prévu de déclarations de réactions cutanées potentiellement associées à des écrans solaires Banana Boat l’été dernier. En réponse à ces déclarations, Santé Canada a testé des écrans solaires de plusieurs marques différentes et a publié un résumé des résultats. Les tests effectués par Santé Canada n’ont révélé aucun problème important en ce qui concerne la qualité des produits. Bien que les réactions observées ne soient pas dues à des problèmes liés à la qualité des produits, d’autres facteurs qui auraient pu contribuer aux réactions signalées sont actuellement examinés. Santé Canada s’affaire à effectuer un examen scientifique et clinique approfondi de l’innocuité des écrans solaires et de leur risque à causer des réactions cutanées. Un résumé de l’examen de l’innocuité sera publié lorsque disponible. Santé Canada a aussi rappelé aux Canadiens de se protéger et de protéger leur famille du soleil en fournissant des conseils de sécurité sur les écrans solaires.
Mise à jour – Écrans solaires (résultats des tests)
Mise à jour – Écrans solaires (conseils de sécurité)
Jamp-Glucose 50 et Jamp-Glucose 75
Six lots de Jamp-Glucose 50 et de Jamp-Glucose 75 ont été rappelés car ils contiennent moins de glucose que la quantité déclarée sur les étiquettes, ce qui pourrait potentiellement conduire à des faux négatifs. Il est recommandé aux professionnels de la santé de cesser immédiatement l'utilisation des lots concernés et de les retourner à leur point d’achat. De plus, les professionnels de la santé devraient contacter les patients qui ont obtenu un résultat négatif lors d’un test de dépistage du diabète ou d’un test d’hyperglycémie orale provoquée et considérer répéter le test ou utiliser une méthode alternative de diagnostic du diabète.
Communication des risques aux professionnels de la santé – Jamp-Glucose 50 et Jamp-Glucose 75
Médicaments contenant du dolutégravir (Tivicay, Triumeq et Juluca)
De graves cas d’anomalies du tube neural chez des nourrissons nés de mères exposées au dolutégravir au moment de la conception ont été décelés dans le cadre de l’étude observationnelle actuellement menée au Botswana. Au cours de la même étude, aucun nourrisson né d’une mère ayant amorcé un traitement par le dolutégravir durant sa grossesse n’a présenté d’anomalies du tube neural. Les professionnels de la santé sont invités à éviter de prescrire du dolutégravir aux femmes en âge de procréer qui tentent de devenir enceintes, à moins qu’aucune autre option thérapeutique adéquate ne soit disponible. Les risques et bienfaits du traitement par le dolutégravir devraient être considérés lorsqu’il est prescrit aux femmes en âge de procréer.
Communication des risques aux professionnels de la santé – Médicaments contenant du dolutégravir (Tivicay, Triumeq et Juluca)
Mise à jour – Médicaments contenant du dolutégravir (Tivicay, Triumeq et Juluca)
Mésylate d'imatinib (Gleevec et génériques)
Cet examen de l'innocuité a évalué le risque de tendinopathies associées au mésylate d'imatinib (Gleevec et génériques). L'examen des renseignements disponibles mené par Santé Canada n'a pas permis d'établir de lien. Santé Canada encourage la déclaration de tout effet indésirable associé à l'utilisation de ce médicament.
Résumé de l’examen de l’innocuité – Mésylate d'imatinib (Gleevec et génériques)
Produits de santé non autorisés
Santé Canda a avisé les Canadiens que divers produits de santé non autorisés qui pourraient poser un risque grave pour la santé ont été vendus dans des points de vente au détail au Canada ou en ligne.
Nouveaux renseignements sur l’innocuité des produits de santé
Les sujets suivants ont été sélectionnés dans le but d’accroître la sensibilisation et, dans certains cas, encourager la déclaration d’effets indésirables similaires.
Mise à jour de monographie de produit
Les mises à jour suivantes concernant l'innocuité, qui ont récemment été apportées aux monographies de produit canadiennes, ont été sélectionnées afin d'en accroître la sensibilisation. Une liste complète des mises à jour de l'étiquetage se trouve sur la page L'innocuité des monographies de produits pour les médicaments innovateurs de Santé Canada. Les monographies de produit canadiennes sont disponibles dans la Base de données sur les produits pharmaceutiques de Santé Canada.
Imbruvica (ibrutinib)
Le risque de tachyarythmie ventriculaire a été ajoutée aux sections Mises en garde et précautions et Effets indésirables rapportés après la commercialisation du produit de la monographie de produit canadienne pour Imbruvica.
Messages clés pour les professionnels de la santéFootnote 1:
- Des événements de tachyarythmies ventriculaires y compris certains évènements ayant entraîné la mort ont été signalés chez des patients traités par Imbruvica, particulièrement chez les patients ayant des facteurs de risque cardiaque, de l’hypertension, des infections aiguës et un antécédent d’arythmie cardiaque.
- Les professionnels de la santé devraient faire un suivi clinique périodique chez tous les patients prenant Imbruvica afin de déceler une arythmie cardiaque. En cas d’apparition de symptômes d’arythmie tel que des palpitations, de l’étourdissement, syncope, de la douleur thoracique ou la survenue d’une dyspnée, les patients devraient faire l’objet d’une évaluation clinique et subir un électrocardiogramme, s’il y a lieu.
- Les arythmies cardiaques devraient être prises en charge de façon adéquate. Si elles persistent, les professionnels de la santé devraient considérer les bienfaits thérapeutiques et les risques du traitement par Imbruvicaet suivre les directives relatives à l’ajustement posologique dans la monographie de produit.
Référence
- Footnote 1
-
Imbruvica (ibrutinib) [monographie de produit]. Toronto (Ont): Janssen Inc. 2018
Résumé semestriel de l'innocuité des vaccins
Santé Canada et l'Agence de la santé publique du Canada (ASPC) partagent la responsabilité de la surveillance de l'innocuité des vaccins au Canada.
Les titulaires d'autorisation de mise en marché sont tenus de déclarer les effets secondaires suivant l'immunisation considérés graves au Programme Canada Vigilance de Santé Canada. Le Programme Canada Vigilance reçoit également des déclarations volontaires des professionnels de la santé et des consommateurs.
Les autorités de santé publique provinciales et territoriales déclarent les effets secondaires suivant l'immunisation (ESSI) provenant des programmes d'immunisation financés par l'État au Système canadien de surveillance des effets secondaires suivant l'immunisation (SCSESSI) de l'ASPC afin de surveiller l'innocuité des programmes d'immunisation.
Rapport pour la période du 1er juillet au 31 décembre 2017
Messages clés :
- Aucun nouveau signal d'innocuité (problème d'innocuité potentiel) n'a été identifié pendant cette période.
- Du 1er juillet 2017 au 31 décembre 2017, le Programme Canada Vigilance a reçu 270 déclarationsFootnote * d'effets secondaires suivant l'immunisation soupçonnés d'avoir été causés par des vaccins.
Le présent résumé semestriel de l'innocuité des vaccins fait un compte rendu des déclarations d’effets secondaires suivant l'immunisation reçues par le Programme Canada Vigilance entre le 1er juillet et le 31 décembre 2017. Pour voir les rapports publiés par le SCSESSI, consulter le site Web du SCSESSI.
- Du 1er juillet 2017 au 31 décembre 2017, le Programme Canada Vigilance a reçu 270 déclarationsFootnote * d'effets secondaires suivant l'immunisation soupçonnés d'avoir été causés par des vaccins.

Figure 1 - Équivalent textuel
La figure montre le nombre total de déclarations d'effets secondaires suivant l'immunisation reçues du 1er juillet 2017 au 31 décembre 2017, selon le type de déclarant
| Type de déclarant | Pourcentage(%) |
| Médecin | 24.44 |
| Pharmacien(ne) | 30.37 |
| Autre professionnel de la santé | 19.63 |
| Consommateurs ou autres non-professionnel de la santé | 25.19 |
| Inconnu | 0.37 |
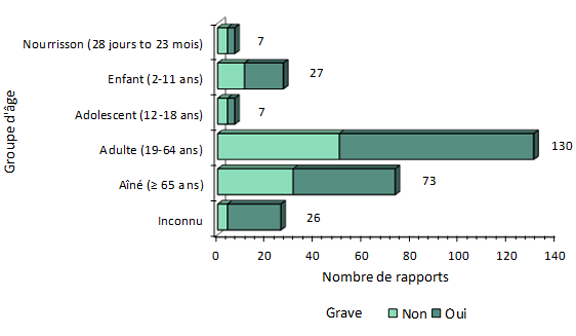
Figure 2 - Équivalent textuel
La figure montre le nombre total de déclarations d'effets secondaires suivant l'immunisation reçues du 1er juillet 2017 au 31 décembre 2017, selon la gravité et le groupe d'âge
| âge | Grave | Nombre de déclarations |
| Nourrisson (28 jours à 23 mois) | Non | 4 |
| Nourrisson (28 jours à 23 mois) | Oui | 3 |
| Enfant (2-11 ans) | Non | 11 |
| Enfant (2-11 ans) | Oui | 16 |
| Adolescent (12-18 ans) | Non | 4 |
| Adolescent (12-18 ans) | Oui | 3 |
| Adulte (19-64 ans) | Non | 50 |
| Adulte (19-64 ans) | Oui | 80 |
| Aîné (≥ 65 ans) | Non | 31 |
| Aîné (≥ 65 ans) | Oui | 42 |
| Inconnu | Non | 4 |
| Inconnu | Oui | 22 |
- Il y avait 166 (61%) déclarations graves, qui ont toutes été évaluées individuellement. La plupart impliquaient des patients avec des problèmes de santé sous-jacents et n'étaient probablement pas liés à la vaccination.
- Le plus grand nombre de déclarations (graves et non graves) reçues impliquait les vaccins contre l'influenza (46%), suivi par le vaccin contre le zona (19%), et les vaccins antipneumococciques (12%). La majorité des déclarations pour les vaccins contre l’influenza sont survenues entre le 1er octobre, 2017 et le 31 décembre 2017, qui est prévu lors de la campagne de promotion de la vaccination contre l’influenza au Canada.
- Il y avait 6 déclarations pour lesquelles le résultat était le décès. Ces déclarations impliquaient des patients entre l’âge de 19 et 70 ans : 2 femmes, 3 hommes et 1 patient de genre inconnu. Une des déclarations provenait d’un professionnel de la santé et concernait le vaccin contre le zona. Les 5 autres déclarations concernaient les vaccins contre l’influenza et provenaient de la compagnie qui a extrait l’information des médias sociaux. L’information fournie n’était pas suffisante pour évaluer convenablement l’association causale avec les vaccins.
- Les effets secondaires (graves et non graves) signalés le plus fréquemment incluaient la fièvre, le malaise, l'érythème au site d'injection, la nausée et la douleur. Ces effets secondaires sont communs à la suite de la vaccination et sont signalés dans les monographies de produit canadiennes.
- Aucun nouveau signal d'innocuité (problème d'innocuité potentiel) n'a été identifié pendant cette période.
- Santé Canada, en collaboration avec l'Agence de la santé publique du Canada, continuera de surveiller étroitement l'innocuité des vaccins autorisés au Canada et prendra les mesures qui s'imposent si de nouveaux risques pour la santé sont identifiés.
Pour obtenir de plus amples renseignements, veuillez communiquer avec la Direction des produits de santé commercialisés.
Notez qu'en raison d'une mise à jour de l'information reçue par le Programme Canada Vigilance, il peut y avoir des différences dans le nombre de déclarations et les événements indésirables extraits à des dates différentes.
Portée
Cette publication mensuelle s’adresse principalement aux professionnels de la santé et contient des informations sur les produits pharmaceutiques, biologiques, les matériels médicaux et les produits de santé naturels. Elle fournit un résumé des informations clés concernant l’innocuité des produits de santé qui ont été publiés au cours du mois précédent par Santé Canada, ainsi qu’une sélection de nouveaux renseignements en matière d’innocuité sur les produits de santé, pour en accroître la sensibilisation. Les nouvelles informations contenues dans ce numéro ne sont pas exhaustives, mais représentent plutôt une sélection de problèmes d’innocuité cliniquement pertinents, justifiant une dissémination améliorée.
Pour signaler des effets indésirables
Programme Canada Vigilance
Téléphone : 1-866-234-2345
Télécopieur ou courrier : formulaire disponible sur MedEffet Canada
Des renseignements sur la marche à suivre pour déclarer un effet indésirable à Santé Canada sont publiés à la page Déclaration des effets indésirables ou des incidents liés aux matériels médicaux.
Liens utiles
- MedEffetMC Canada
- Base de données sur les rappels et les avis de sécurité
- Résumés des examens d’innocuité
- Nouveaux examens de l'innocuité ou de la sûreté
- Base de données en ligne des effets indésirables de Canada Vigilance
- Base de données sur les produits pharmaceutiques
- Liste des instruments médicaux homologués
- Base de données des produits de santé naturels homologués
- Registre des médicaments et des produits de santé
- Pénuries de médicaments Canada
Des suggestions?
Vos commentaires sont importants pour nous. Dites-nous ce que vous pensez en nous contactant à HC.infowatch-infovigilance.SC@canada.ca
Santé Canada
Direction des produits de santé commercialisés
Localisateur 1906C
Ottawa (Ontario) K1A 0K9
Téléphone : 613-954-6522
Télécopieur : 613-952-7738
Droit d’auteur
© 2018 Sa Majesté la Reine du Chef du Canada. Cette publication peut être reproduite sans autorisation à condition d'en indiquer la source en entier. Il est interdit de l'utiliser à des fins publicitaires. Santé Canada n'accepte pas la responsabilité de l'exactitude ou de l'authenticité des renseignements fournis dans les notifications.
On ne peut que soupçonner la plupart des effets indésirables (EI) des produits de santé à l'égard desquels on ne peut établir de lien prouvé de cause à effet. Les notifications spontanées d'EI ne peuvent servir pour déterminer l'incidence des EI, étant donné que les EI ne sont pas suffisamment signalés et l'étendue d'exposition des patients est inconnue.
En raison des contraintes de temps concernant la production de cette publication, les informations publiées peuvent ne pas refléter les informations les plus récentes.