Archivée - InfoVigilance sur les produits de santé – juin 2018

Télécharger le format de rechange
(Format PDF, 426 Ko, 7 pages)
Direction générale des produits de santé et des aliments
Direction des produits de santé commercialisés
Équipe de rédaction de l'InfoVigilance sur les produits de santé
ISSN 2368-8033
No cat 170364
Organisation : Santé Canada
Publiée : 2018-06-28
Contenu
- Produits de santé mentionnés dans ce numéro
- Annonce : Marketing et publicité des opioïdes - consultation
- Récapitulatif mensuel
- Nouveaux renseignements
- Portée
- Liens utiles
- Des suggestions?
- Droit d'auteur
Produits de santé mentionnés dans ce numéro
Produits pharmaceutiques et biologiques
- Agents de contraste à base de gadolinium
- Erfa-Tranexamic 100 mg/mL
- Isoniazide
- Lynparza (olaparib)
- Pradaxa (dabigatran étexilate)
- Propecia (finastéride)
- Proscar (finastéride)
- Vaccins de GlaxoSmithKline Inc.
Matériels médicaux
Autres
Annonce
Marketing et publicité des opioïdes - consultation
Conscient que la surprescription d'opioïdes a contribué à la crise des opioïdes qui sévit actuellement au Canada, le gouvernement du Canada prend des mesures pour examiner les pratiques commerciales de l'industrie pharmaceutique.
Une consultation publique au sujet de l'intention de restreindre la publicité sur les opioïdes est en cours du 19 juin au 18 juillet 2018. Les intervenants et les membres du public sont invités à partager des informations et des opinions concernant les avantages et les risques de la publicité sur les opioïdes et les restrictions potentielles.
Pour de plus amples renseignements et pour partager votre point de vue, consultez l'Avis d'intention de restreindre le marketing et la publicité des opioïdes.
Récapitulatif mensuel des renseignements sur l'innocuité des produits de santé
Voici une liste des avis concernant les produits de santé, des rappels de type I, ainsi que des résumés de l'examen de l'innocuité ou de la sûreté publiés en mai 2018 par Santé Canada.
Agents de contraste à base de gadolinium
Cet examen de l'innocuité a évalué le risque de dépôts de gadolinium dans le cerveau et d'effets indésirables neurologiques potentiels associés aux agents de contraste à base de gadolinium (ACBG) : Dotarem (gadotérate de méglumine), Gadovist (gadobutrol), Magnevist (gadopentétate de diméglumine), MultiHance (gadobénate de diméglumine), Omniscan (gadodiamide), Optimark (gadoversétamide), Primovist (gadoxétate disodique), ProHance (gadotéridol). L'examen mené par Santé Canada a conclu qu'il existe un lien entre l'administration répétée d'ACBG et le risque de dépôts de gadolinium dans le cerveau. Ce risque avait été considéré comme étant potentiellement plus grand chez les enfants, les femmes enceintes, et chez les patients à qui l'on a administré des doses répétées. Au moment de l'examen, aucun effet indésirable neurologique n'était associé à des dépôts de gadolinium dans le cerveau. Santé Canada collabore avec les fabricants afin d'apporter des modifications aux monographies de produit canadiennes, de façon à inclure des mises en garde supplémentaires.
Résumé de l'examen de l'innocuité – Agents de contraste à base de gadolinium
Erfa-Tranexamic 100 mg/mL (5 mL)
ERFA Canada 2012 Inc. a rappelé Erfa-Tranexamic 100 mg/mL (5 mL), lots P322A, P321A, P347A, P348A, P349A, en raison de la présence de particules dans les lots affectés.
Retrait de marché d'une drogue – Erfa-Tranexamic 100 mg/mL
Fils de suture crantés
Santé Canada a pris connaissance de cas d'occlusion de l'intestin grêle signalés à l'étranger en lien avec l'utilisation de fils de suture crantés (sans nœud) lors de diverses interventions chirurgicales pelviennes et abdominales. Les fils de suture crantés peuvent s'accrocher à l'intestin grêle et potentiellement causer une occlusion postopératoire. Il est conseillé aux professionnels de la santé de considérer les fils de suture crantés comme une cause possible des signes et symptômes d'occlusion de l'intestin grêle observés à la suite d'une intervention chirurgicale où la fermeture a été réalisée au moyen de ces dispositifs. Santé Canada travaille avec les fabricants des dispositifs médicaux concernés pour ajouter ces renseignements en matière d'innocuité sur l'étiquette des fils de suture crantés.
Communication des risques aux professionnels de la santé – Fils de suture crantés
Isoniazide
Cet examen de l'innocuité a évalué le risque de pancréatite associée à l'utilisation d'isoniazide. L'examen mené par Santé Canada a conclu qu'il existe un risque potentiel rare de pancréatite associée à l'utilisation de l'isoniazide. Santé Canada collabore avec le fabricant pour mettre à jour la monographie de produit pour tous les produits renfermant de l'isoniazide vendus au Canada, afin de faire état de ce risque.
Résumé de l'examen de l'innocuité – Isoniazide
Pradaxa (dabigatran étexilate)
Cet examen de l'innocuité a évalué le risque de lésions hépatiques associées à Pradaxa. L'examen mené par Santé Canada a conclu qu'il existerait un lien. Santé Canada collaborera avec le fabricant pour mettre à jour la monographie de produit canadienne de Pradaxa afin d'informer les professionnels de la santé et les patients de ce risque.
Résumé de l'examen de l'innocuité – Pradaxa (dabigatran étexilate)
Produits de santé non autorisés
Santé Canda a avisé les Canadiens que divers produits de santé non autorisés qui pourraient poser un risque grave pour la santé ont été vendus dans des points de vente au détail au Canada ou en ligne.
- Avis - Médicaments antibiotiques sur ordonnance non homologués
- Avis – Produit Botox et autres produits non autorisés
- Avis – Produits de kratom « Sāj »
- Mise à jour - Multiples produits de santé non autorisés
Système thérapeutique Enterra
Cet examen de la sûreté a évalué le manque potentiel d'efficacité associé à l'utilisation du Système thérapeutique Enterra. L'examen mené par Santé Canada a conclu que certains patients atteints de gastroparésie pourraient ne pas bénéficier de l'utilisation de l'instrument. Ce risque de manque potentiel d'efficacité est décrit dans la littérature médicale, en plus de figurer dans le mode d'emploi de l'instrument. Santé Canada continuera de surveiller les données sur la sûreté d'Enterra.
Résumé de l'examen de la sûreté – Système thérapeutique Enterra
Vaccins de GlaxoSmithKline Inc.
Des fuites ont été observées lors de l'utilisation de seringues à embout enrobé de céramique pour administrer plusieurs vaccins de GlaxoSmithKline Inc. (Boostrix, Boostrix-Polio, Engerix-B, Havrix, Havrix Junior, Infanrix-IPV, Infanrix-IPV/HIB, Infanrix-hexa, Twinrix et Twinrix Junior). Les fuites se sont produites durant la préparation ou l'administration du vaccin. L'administration de vaccins à partir de seringues qui fuient peut se traduire par un risque potentiel d'administration d'une dose insuffisante. On avise les professionnels de la santé de ne pas utiliser la seringue lorsqu'une fuite se produit durant la reconstitution. Lorsque la fuite se produit durant l'injection du vaccin et que le patient reçoit une dose inférieure à la dose standard, on devrait tenir compte des bienfaits et risques potentiels associés à la décision d'administrer une autre dose. L'introduction sur le marché canadien de seringues à embout enrobé de céramique améliorées est prévue en 2018. Toutefois, les seringues à embout enrobé de céramique actuelles et les seringues améliorées seront toutes deux commercialisées jusqu'à la fin de 2019.
Communication des risques aux professionnels de la santé – Vaccins de GlaxoSmithKline Inc.
Nouveaux renseignements sur l'innocuité des produits de santé
Les sujets suivants ont été sélectionnés dans le but d'accroître la sensibilisation et, dans certains cas, encourager la déclaration d'effets indésirables similaires.
Mises à jour de monographies de produit
Les mises à jour suivantes concernant l'innocuité, qui ont récemment été apportées aux monographies de produit canadiennes, ont été sélectionnées afin d'en accroître la sensibilisation. Une liste complète des mises à jour de l'étiquetage se trouve sur la page L'innocuité des monographies de produits pour les médicaments innovateurs de Santé Canada. Les monographies de produit canadiennes sont disponibles dans la Base de données sur les produits pharmaceutiques de Santé Canada.
Proscar et Propecia (finastéride)
Des nouveaux renseignements concernant le risque de troubles musculaires ont été ajoutés aux sections Effets indésirables rapportés après la commercialisation du produit et Renseignements pour le consommateur des monographies de produit canadiennes pour Proscar et Propecia.
Messages clés pour les professionnels de la santéNote de bas de page 1,Note de bas de page 2 :
- De rares cas de troubles musculaires tels que la rhabdomyolyse, la myopathie, la myalgie, la myasthénie et la hausse du taux de créatine kinase ont été signalés chez les patients traités avec le finastéride.
- Dans certains cas, ces effets étaient réversibles à l'arrêt du traitement avec le finastéride.
Références
- Note de bas de page 1
-
Propecia (finastéride) [monographie de produit]. Kirkland, (Qc): Merck Canada Inc.; 2018.
- Footnote 2
-
Proscar (finastéride) [monographie de produit]. Kirkland, (Qc): Merck Canada Inc.; 2018.
Avis d'autorisation de mise en marché avec conditions
Un avis de conformité avec conditions (AC-C) est une forme d'autorisation de mise en marché assortie de conditions et accordée à un produit qui s'appuie sur des preuves d'efficacité cliniques prometteuses à la suite d'un examen de la présentation par Santé Canada. La communication d'un AC-C vise à fournir des détails sur le produit et la nature de l'autorisation accordée.
Les professionnels de la santé sont invités à déclarer à Santé Canada tout effet indésirable présumé être associé à des produits de santé commercialisés, y compris aux médicaments autorisés en vertu de la Politique sur les AC-C.
Le contenu de ces avis reflète les informations actuelles au moment de la publication. Les conditions associées à un AC-C demeureront jusqu'à ce qu'elles aient été remplies et autorisées par Santé Canada conformément à la politique d'AC-C. Pour les informations les plus récentes, veuillez consulter la base de données des AC de Santé Canada.
Lynparza (olaparib) en comprimés: Autorisation avec conditions
Santé Canada a publié un avis de conformité en vertu de la politique d'Avis de conformité avec conditions concernant le produit appelé Lynparza (olaparib) comprimés, 100 mg et 150 mg, par voie orale. Lynparza en comprimés est indiqué en monothérapie pour le traitement d'entretien des patientes adultes atteintes d'un cancer épithélial de haut grade de l'ovaire, des trompes de Fallope ou d'un carcinome péritonéal primitif récidivant et sensible aux sels de platine, porteuses de BRCA de type sauvage, et qui sont en réponse (complète ou partielle) à une chimiothérapie à base de sels de platine. Les patients devraient être avisés de la nature conditionnelle de l'autorisation de mise en marché pour cette indication.
Pour obtenir les renseignements d'ordonnance complets et les renseignements destinés aux patients et aux soignants, veuillez consulter la monographie de produit canadienne de Lynparza en comprimés. La monographie de produit est accessible sur la base de données sur les produits pharmaceutiques de Santé Canada, sur le site Web d'AstraZeneca ou auprès d'AstraZeneca Canada Inc. au 1-800-461-3787. Veuillez communiquer avec la compagnie pour obtenir une copie de toute référence, pièce jointe ou annexe.
Le saviez-vousNote de bas de page 3,Note de bas de page 4?
Lynparza (olaparib) est également offert sous forme de capsules à 50 mg. Les préparations de Lynparza en capsules et en comprimés ne sont PAS bioéquivalentes et ne sont PAS interchangeables. Il existe un risque de confusion entre les capsules et les comprimés Lynparza qui pourrait entrainer l'utilisation par inadvertance de la mauvaise formulation. Afin d'éviter les erreurs de médication, les prescripteurs devraient préciser la forme posologique de Lynparza en capsules ou en comprimés sur chaque ordonnance. Les deux préparations ne doivent PAS être substituées milligramme pour milligramme en raison des différences entre chacune des préparations sur le plan de la posologie et de la biodisponibilité. Veuillez consulter la monographie de produit appropriée pour des renseignements précis sur la posologie.
| Lynparza capsules à 50 mg | Lynparza comprimés à 150 mg | Lynparza comprimés à 100 mg | ||
|---|---|---|---|---|
| Matin - 8 capsules | Soir - 8 capsules | Matin - 2 comprimés | Soir - 2 comprimés | À utiliser seulement pour la réduction de la dose des comprimés |
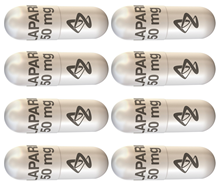 |
 |
 |
 |
 |
| 400 mg deux fois par jour
Dose quotidienne totale : 800 mg |
300 mg deux fois par jour
Dose quotidienne totale : 600 mg |
aucune donnée disponible | ||
Références
- Note de bas de page 3
-
Lynparza (capsules d'olaparib) [monographie de produit]. Mississauga (Ont.): AstraZeneca Canada Inc.; 2018.
- Note de bas de page 4
-
Lynparza (comprimés d'olaparib) [monographie de produit]. Mississauga (Ont.): AstraZeneca Canada Inc.; 2018.
Portée
Cette publication mensuelle s'adresse principalement aux professionnels de la santé et contient des informations sur les produits pharmaceutiques, biologiques, les matériels médicaux et les produits de santé naturels. Elle fournit un résumé des informations clés concernant l'innocuité des produits de santé qui ont été publiés au cours du mois précédent par Santé Canada, ainsi qu'une sélection de nouveaux renseignements en matière d'innocuité sur les produits de santé, pour en accroître la sensibilisation. Les nouvelles informations contenues dans ce numéro ne sont pas exhaustives, mais représentent plutôt une sélection de problèmes d'innocuité cliniquement pertinents, justifiant une dissémination améliorée.
Pour signaler des effets indésirables
Programme Canada Vigilance
Téléphone : 1-866-234-2345
Télécopieur ou courrier : formulaire disponible sur MedEffet Canada
Des renseignements sur la marche à suivre pour déclarer un effet indésirable à Santé Canada sont publiés à la page Déclaration des effets indésirables ou des incidents liés aux matériels médicaux.
Liens utiles
- MedEffetMC Canada
- Base de données sur les rappels et les avis de sécurité
- Résumés des examens d'innocuité
- Nouveaux examens de l'innocuité ou de la sûreté
- Base de données en ligne des effets indésirables de Canada Vigilance
- Base de données sur les produits pharmaceutiques
- Liste des instruments médicaux homologués
- Base de données des produits de santé naturels homologués
- Registre des médicaments et des produits de santé
- Pénuries de médicaments Canada
Des suggestions?
Vos commentaires sont importants pour nous. Dites-nous ce que vous pensez en nous contactant à HC.infowatch-infovigilance.SC@canada.ca
Santé CanadaDirection des produits de santé commercialisés
Localisateur 1906C
Ottawa (Ontario) K1A 0K9
Téléphone : 613-954-6522
Télécopieur : 613-952-7738
Droit d'auteur
© 2018 Sa Majesté la Reine du Chef du Canada. Cette publication peut être reproduite sans autorisation à condition d'en indiquer la source en entier. Il est interdit de l'utiliser à des fins publicitaires. Santé Canada n'accepte pas la responsabilité de l'exactitude ou de l'authenticité des renseignements fournis dans les notifications.
On ne peut que soupçonner la plupart des effets indésirables (EI) des produits de santé à l'égard desquels on ne peut établir de lien prouvé de cause à effet. Les notifications spontanées d'EI ne peuvent servir pour déterminer l'incidence des EI, étant donné que les EI ne sont pas suffisamment signalés et l'étendue d'exposition des patients est inconnue.
En raison des contraintes de temps concernant la production de cette publication, les informations publiées peuvent ne pas refléter les informations les plus récentes.