InfoVigilance sur les produits de santé : juin 2023
Télécharger le format de rechange
(Format PDF, 736 Ko, 10 pages)
Direction générale des produits de santé et des aliments
Direction des produits de santé commercialisés
Équipe de rédaction de l'InfoVigilance sur les produits de santé
ISSN : 2368-8033
Cat. : H167-1F-PDF
Pub. : 230001
Contenu
- Produits de santé mentionnés dans ce numéro
- Annonce
- Autorisations et communications : médicaments et vaccins contre la COVID-19
- Récapitulatif mensuel des renseignements sur l'innocuité des produits de santé
- Nouveaux renseignements sur l'innocuité des produits de santé
- Portée
- Pour signaler des effets indésirables
- Liens utiles
- Des suggestions?
- Droit d'auteur
Produits de santé mentionnés dans ce numéro
Produits pharmaceutiques et biologiques
- Auto-injecteurs d’épinéphrine Emerade
- Chlorure de sodium injectable à 0,9 %, USP
- Combinaison de sulfaméthoxazole et de triméthoprime
- Comprimés de nitroglycérine
- Evusheld (tixagévimab et cilgavimab)
- Mekinist (tramétinib)
- Mercaptopurine
- Proglycem (diazoxide)
- Tafinlar (mésylate de dabrafénib)
Instruments médicaux
Produits de santé naturels et sans ordonnance
Autres
Annonce
Portail des médicaments et produits de santé
En mai 2023, le Registre des médicaments et des produits de santé de Santé Canada a été remplacé par le Portail des médicaments et produits de santé (PMPS) afin de fournir aux Canadiens des renseignements fiables et opportuns sur les médicaments et les produits de santé autorisés par Santé Canada. Le PMPS comporte de nouvelles fonctionnalités, telles qu'une fonction de recherche améliorée, une meilleure accessibilité, et une amélioration des liens pour les informations réglementaires sur les produits de santé, y compris les résumés de l'examen de l'innocuité (REI).
Autorisations et communications : médicaments et vaccins contre la COVID-19
Les nouveaux renseignements ainsi que les communications récentes au sujet des vaccins et des traitements autorisés contre la COVID-19 sont inclus dans cette section.
Mise à jour sur la situation relative à la COVID-19 au Canada
L'Organisation mondiale de la Santé (OMS) a annoncé que la COVID-19 est désormais un enjeu de santé établi et permanent qui ne constitue plus une urgence de santé publique de portée internationale. Le gouvernement du Canada continuera de travailler en collaboration avec ses partenaires internationaux, l'OMS ainsi que les provinces et territoires canadiens afin de surveiller la situation relative à la COVID-19 et de réduire les répercussions du virus sur la santé et la société au Canada. A partir de juillet 2023, l'InfoVigilance sur les produits de santé ne comprendra plus de section distincte pour les communications relatives à la COVID-19. Ces communications seront désormais incluses dans la section récapitulatif mensuel ou dans la section de nouveaux renseignements, comme tous les autres produits.
Mise à jour sur la situation relative à la COVID-19 au Canada (5 mai 2023)
Evusheld (tixagévimab et cilgavimab)
Evusheld (tixagévimab et cilgavimab) peut ne pas être efficace contre certains sous-variants d'Omicron du SRAS-CoV-2 lorsqu'utilisé à titre de prophylaxie ou de traitement pour la COVID-19. Des données mises à jour sur la neutralisation ont été ajoutées à la monographie de produit canadienne.
Les professionnels de la santé doivent consulter régulièrement l'information apparaissant à la rubrique Résistance antivirale dans la monographie de produit, conjointement avec la littérature et les lignes directrices locales, pour des détails sur les variants spécifiques et la résistance. Ces informations continueront d'être mises à jour au fur et à mesure de l'émergence de données nouvelles.
Portail des vaccins et traitements pour la COVID-19: Evusheld (tixagévimab et cilgavimab)
Récapitulatif mensuel des renseignements sur l'innocuité des produits de santé
Voici une liste des avis concernant les produits de santé, des rappels de type I, ainsi que des résumés de l'examen de l'innocuité ou de la sûreté publiés en mai 2023 par Santé Canada.
Auto-injecteurs d’épinéphrine Emerade
Bausch Health, Canada inc. a rappelé tous les lots d’auto-injecteurs d’épinéphrine Emerade (0,3 mg et 0,5 mg) après que des analyses menées par l’entreprise aient cerné un possible risque que l’auto-injecteur ne se déclenche pas, ou se déclenche prématurément s’il tombe. Les lots de produits Emerade visés ont été distribués au Canada entre avril 2022 et mai 2023.
Avis : Auto-injecteurs d’épinéphrine Emerade
Chlorure de sodium injectable à 0,9 %, USP
Un lot de chlorure de sodium injectable à 0,9 %, USP a été rappelé car le sac de solution peut comporter des fuites.
Rappel type 1 : Chlorure de sodium injectable à 0,9 %, USP
Combinaison de sulfaméthoxazole et de triméthoprime
Cet examen de l'innocuité a évalué le risque de lymphohistiocytose hémophagocytaire (LH) liée à l'utilisation de produits contenant une combinaison de sulfaméthoxazole et de triméthoprime. L'examen des données disponibles réalisé par Santé Canada a révélé un lien possible. Santé Canada travaille avec les fabricants pour mettre à jour les monographies de produit canadiennes pour les produits contenant une combinaison de sulfaméthoxazole et de triméthoprime afin d'y inclure le risque de LH.
Résumé de l'examen de l'innocuité : Combinaison de sulfaméthoxazole et de triméthoprime
Comprimés de nitroglycérine
Le Canada fait face à une pénurie de comprimés de nitroglycérine, provoquée par une demande accrue attribuable à la pénurie de nitroglycérine en vaporisateur. En coopération avec ses partenaires, Santé Canada se penche sur les moyens de conserver les stocks existants, d'accélérer le réapprovisionnement des hôpitaux et des pharmacies, et d'accéder à des stocks autorisés à l'étranger, ou à des substituts, dans la mesure du possible.
Avis : Comprimés de nitroglycérine
Gélules multivitaminées pour enfants de Nature's Bounty
Nestlé Health Science a rappelé 12 lots de gélules multivitaminées de Nature's Bounty, car l'étiquette du produit ne précise pas que les gélules ne doivent pas être données aux enfants de moins de 4 ans. L'administration de ces produits aux enfants de cette tranche d'âge peut entraîner un risque d'étouffement. Les produits visés furent expédiés à plusieurs détaillants à travers le Canada entre janvier et mai 2023
Avis : Gélules multivitaminées pour enfants de Nature's Bounty
Mercaptopurine
Cet examen de l'innocuité a évalué le risque d'hypoglycémie liée à l'utilisation des produits contenant de la mercaptopurine. L'examen de Santé Canada a permis de conclure qu'il pourrait y avoir un lien entre l'utilisation de la mercaptopurine et le risque d'hypoglycémie chez les enfants (âgés de moins de 18 ans). Santé Canada travaille avec les fabricants pour mettre à jour la monographie de produit canadienne pour les produits contenant de la mercaptopurine afin d'y inclure le risque d'hypoglycémie chez les enfants.
Résumé de l'examen de l'innocuité : Mercaptopurine
Produits de santé non autorisés
Santé Canda a avisé les Canadiens que divers produits de santé non autorisés qui pourraient poser un risque grave pour la santé ont été vendus dans des points de vente au détail au Canada ou en ligne.
Avis : Capsules d'amoxicilline non autorisées
Avis : Médicaments abortifs et médicaments contraceptifs d'urgence vendus illégalement
Avis : Produits non homologués Kobayashi et Sante FX Neo
Avis : Produits non homologués pour améliorer la performance sexuelle
Avis : Produits non homologués pour éclaircir la peau
Avis : Suppléments d'entraînement non autorisés
Proglycem (diazoxide)
Cet examen de l'innocuité a évalué le risque d'entérocolite nécrosante chez les nouveau-nés et les nourrissons liée à l'utilisation de Proglycem (diazoxide). L'examen de Santé Canada a révélé un lien possible. Santé Canada travaille avec le fabricant à la mise à jour de la monographie de produit canadienne pour Proglycem afin d'y inclure le risque d'entérocolite nécrosante.
Résumé de l'examen de l'innocuité: Proglycem (diazoxide)
Nouveaux renseignements sur l'innocuité des produits de santé
Les sujets suivants ont été sélectionnés dans le but d'accroître la sensibilisation et d'encourager la déclaration d'effets indésirables.
Mises à jour de monographies de produit et de modes d'emploi des instruments médicaux
Les mises à jour suivantes concernant l'innocuité, qui ont récemment été apportées aux monographies de produits canadiennes et aux modes d'emploi des instruments médicaux, ont été sélectionnées afin d'en accroître la visibilité. Une liste complète des mises à jour de l'étiquetage concernant l'innocuité pour les produits pharmaceutiques innovateurs se trouve sur le site Web de Santé Canada. Les monographies de produit canadiennes sont disponibles dans la Base de données sur les produits pharmaceutiques de Santé Canada.
Tafinlar (mésylate de dabrafénib) et Mekinist (tramétinib)
Les sections Mises en garde et précautions et Renseignement sur le médicament à l'intention du patient des monographies de produit canadiennes pour Tafinlar et Mekinist ont été mises à jour avec le risque de lymphohistiocytose hémophagocytaire.
Messages clés à l'intention des professionnels de la santéNote de bas de page 1 Note de bas de page 2:
- Dans la pratique après la commercialisation, on a observé des cas de lymphohistiocytose hémophagocytaire (LH) dans le cadre d'un traitement combiné avec le dabrafénib et le tramétinib. Les patients doivent être surveillés de près.
- En présence de LH soupçonnée, le traitement doit être interrompu. Si le diagnostic de LH est confirmé, il faut abandonner le traitement et amorcer les mesures appropriées de prise en charge de la LH.
- Note de bas de page 1
-
Tafinlar (mésylate de dabrafénib) [monographie de produit]. Montréal (Qc): Novartis Pharmaceuticals Canada Inc, 2023.
- Note de bas de page 2
-
Mekinist (tramétinib) [monographie de produit]. Montréal (Qc): Novartis Pharmaceuticals Canada Inc, 2023.
Système SpaceOAR
Le système SpaceOAR est un espaceur périrectal résorbable à base de polyéthylène glycol (PEG) qui éloigne temporairement la paroi rectale antérieure de la prostate pendant la radiothérapie visant à traiter le cancer de la prostate, dans le but de réduire la dose de rayonnement délivrée à la paroi rectale antérieure. Les sections « Événements indésirables », « Mises en garde » et « Description du dispositif » figurant dans le mode d'emploi du système SpaceOAR ont été mises à jour afin d'inclure de nouveaux risques et de préciser les risques déjà mentionnés. La version mise à jour du mode d'emploi (version 51607315) sera en distribution d'ici février 2024.
Messages clés pour les professionnels de la santé :
Pour déterminer si le système SpaceOAR convient à chaque patient, il est conseillé aux professionnels de la santé de lire attentivement le mode d'emploi, qui a été mis à jour depuis l'homologation initiale au Canada. Les renseignements suivants ont été ajoutés ou approfondis :
Événements indésirables
Des complications potentielles qui peuvent être associées à l'utilisation du système SpaceOAR comprennent, sans s'y limiter :
- infection (y compris des abcès)
- urgence (par exemple, urinaire et rectale)
- constipation (aiguë, chronique ou secondaire à une obstruction de l'orifice de sortie)
- ténesme rectal/spasme musculaire
- fistule
- réactions allergiques (localisées ou plus graves, comme l'anaphylaxie)
- syncope
Mises en garde
Le produit SpaceOAR contient du PEG. L'utilisation de ce produit chez les patients présentant une sensibilité ou une allergie documentée au PEG n'a pas été étudiée. L'utilisation de SpaceOAR chez les patients allergiques au PEG peut potentiellement entraîner une réaction allergique (y compris l'anaphylaxie).
Description du dispositif
Les matériaux constituant le système SpaceOAR comprennent le PEG SG (polyéthylène glycol succinimidyl glutarate, poids moléculaire de 15 kDa), le phosphate disodique, l'acétate de trilysine, le borate de sodium et le phosphate monosodique.
Résumé de l'innocuité des vaccins
Santé Canada et l'Agence de la santé publique du Canada (ASPC) partagent la responsabilité de la surveillance de l'innocuité des vaccins au Canada.
Les détenteurs d'une autorisation de mise en marché sont tenus de déclarer les effets secondaires suivant l'immunisation (ESSI) considérés graves au Programme Canada Vigilance de Santé Canada. Le Programme Canada Vigilance reçoit également des déclarations volontaires des professionnels de la santé et des consommateurs.
Même si les hôpitaux doivent déclarer les effets indésirables graves d'un médicament documentés dans leur établissement, ils ne sont pas tenus de le faire dans le cas d'un vaccin s'ils ont transmis une déclaration d'ESSI à leur bureau local de santé publique. Ces déclarations sont transmises par les autorités de santé publique provinciales et territoriales au Système canadien de surveillance des effets secondaires suivant l'immunisation (SCSESSI) de l'ASPC.
Le présent résumé de l'innocuité des vaccins fait un compte rendu des déclarations d'ESSI reçues par le Programme Canada Vigilance entre le 1er janvier et le 31 décembre 2021 pour les vaccins. Il n'inclut pas les déclarations concernant les cas où le seul vaccin soupçonné d'avoir causé les ESSI est un vaccin contre la COVID-19. Pour de plus amples renseignements sur les effets indésirables qui ont été signalés après l'administration d'un vaccin contre la COVID-19 au Canada, veuillez consulter la page Web sur les manifestations cliniques inhabituelles à la suite de l'immunisation contre la COVID-19 au Canada.
Résumé pour la période du 1er janvier au 31 décembre 2021
Messages clés
- Du 1er janvier au 31 décembre 2021, le Programme Canada Vigilance a reçu 466 déclarations d'effets secondaires suivant l'immunisation (ESSI) soupçonnés d'avoir été causés par des vaccins.
- Il n'y a pas eu de changement important dans les caractéristiques (sexe et âge) de la population qui a subi les ESSI déclarés, ni dans les types de vaccins qui ont été les plus fréquemment déclarés, par rapport aux années précédentes. Il convient de souligner qu'en 2021, pour la première fois depuis 2013, les consommateurs ont transmis la majorité des déclarations.
- Aucun nouveau signal d'innocuité (problème d'innocuité potentiel) pour des vaccins autres que contre la COVID-19 n'a été identifié pendant cette période.
- En 2021, le Programme Canada Vigilance a reçu 466 déclarations d'ESSI soupçonnés d'avoir été causés par des vaccins. La majorité des déclarations était transmise par des consommateurs (figure 1), qui ont fait des signalements spontanés. C'est la première année depuis 2013 que les déclarations d'ESSI transmises au Programme Canada Vigilance proviennent principalement des consommateurs.
Figure 1 : Nombre total de déclarations reçues selon le type de déclarant 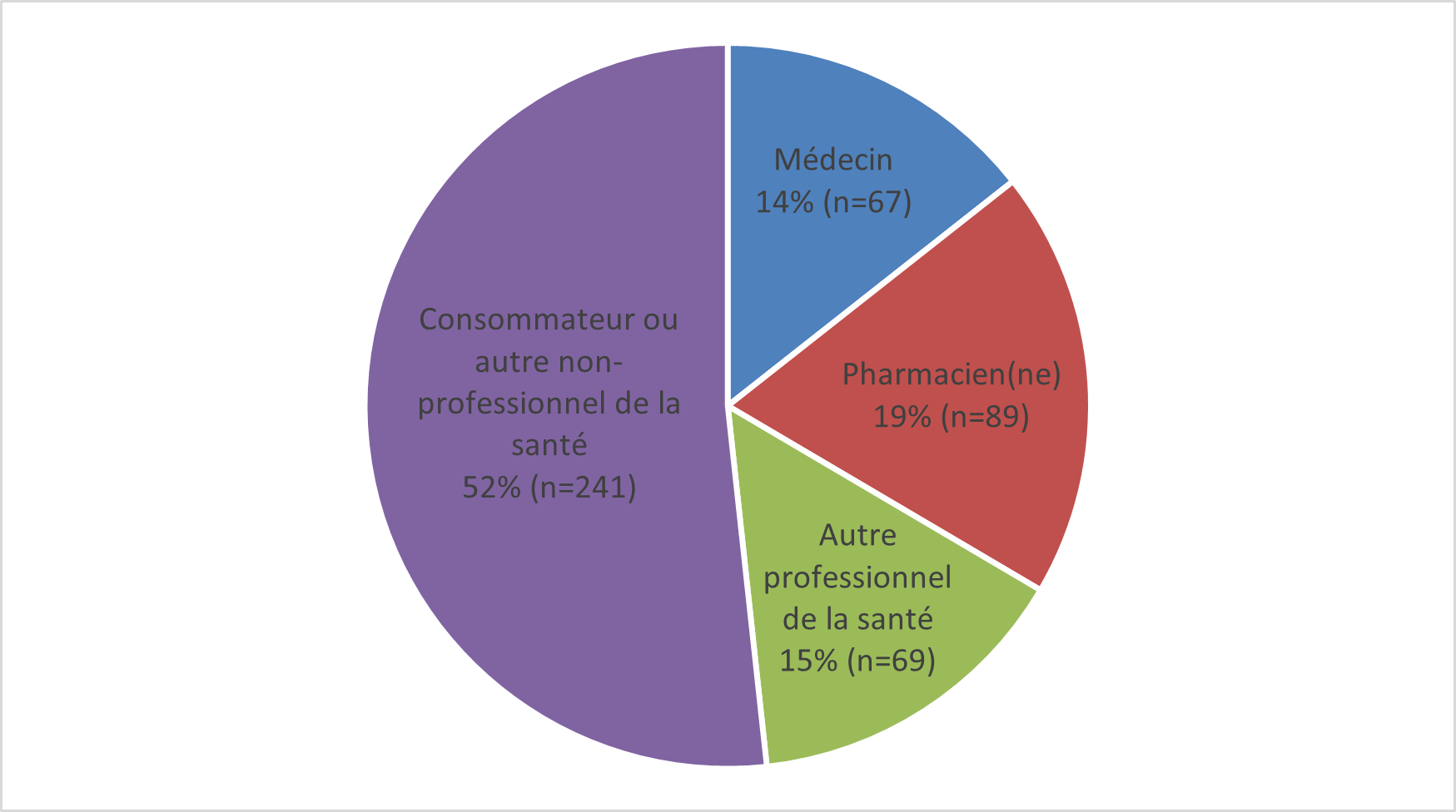
Figure 1 : Équivalent textuel
La figure montre le nombre total de déclarations reçues selon le type de déclarant Type de déclarant Pourcentage (%) Nombre de déclarations (n) Consommateur ou autre non-professionnel de la santé 52 241 Autre professionnel de la santé 15 69 Pharmacien(ne) 19 89 Médecin 14 67 - La majorité des déclarations concernait des adultes âgés de plus de 18 ans (219 sur 466, soit 47 %) (figure 2), semblablement à ce qui a été observé depuis 2013 (lorsque Santé Canada a commencé à publier des rapports périodiques sur les ESSI déclarés au Programme Canada Vigilance).
- La répartition des 466 déclarations selon le sexe se présente comme suit : 69 % de sexe féminin, 21 % de sexe masculin et 10 % de sexe inconnu. Cette tendance ressemble à ce qui a été observé précédemment.
Figure 2 : Nombre total de déclarations reçues selon le groupe d'âge 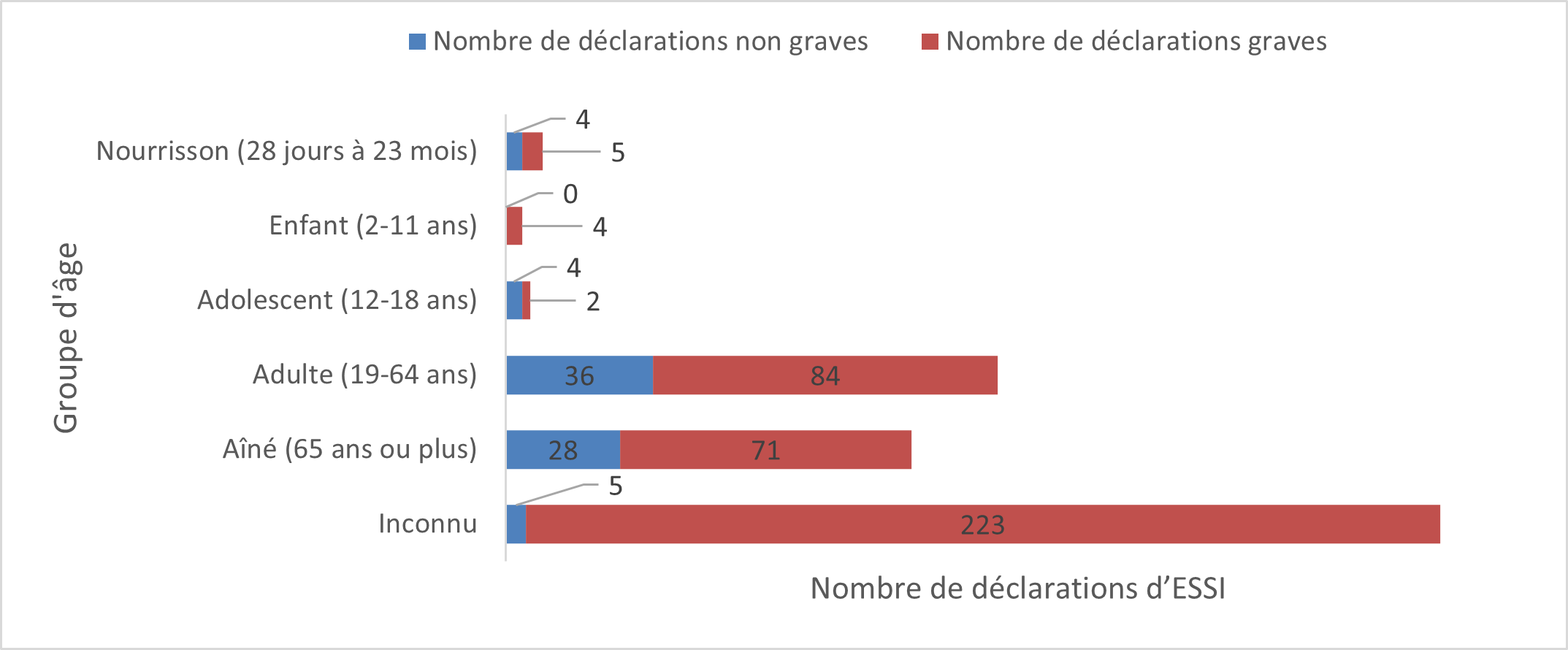
Figure 2 : Équivalent textuel
La figure montre le nombre total de déclarations reçues selon le groupe d'âge Groupe d'âge Nombre de déclarations non graves Nombre de déclarations graves Nourrisson (28 jours à 23 mois) 4 5 Enfant (2-11 ans) 0 4 Adolescent (12-18 ans) 4 2 Adulte (19-64 ans) 36 84 Aîné (65 ans ou plus) 28 71 Inconnu 5 223 - Le plus grand nombre de déclarations (d'effets graves et d'effets non graves) reçues concernait les vaccins contre le zona (283 déclarations), suivis par les vaccins contre l'influenza (86 déclarations), puis les vaccins contre le pneumocoque (44 déclarations) (figure 3). Cette tendance ressemble à ce qui a été observé précédemment.
Figure 3 : Nombre total de déclarations reçues selon le vaccin (certaines déclarations peuvent inclure plus d'un vaccin)Note de bas de page † 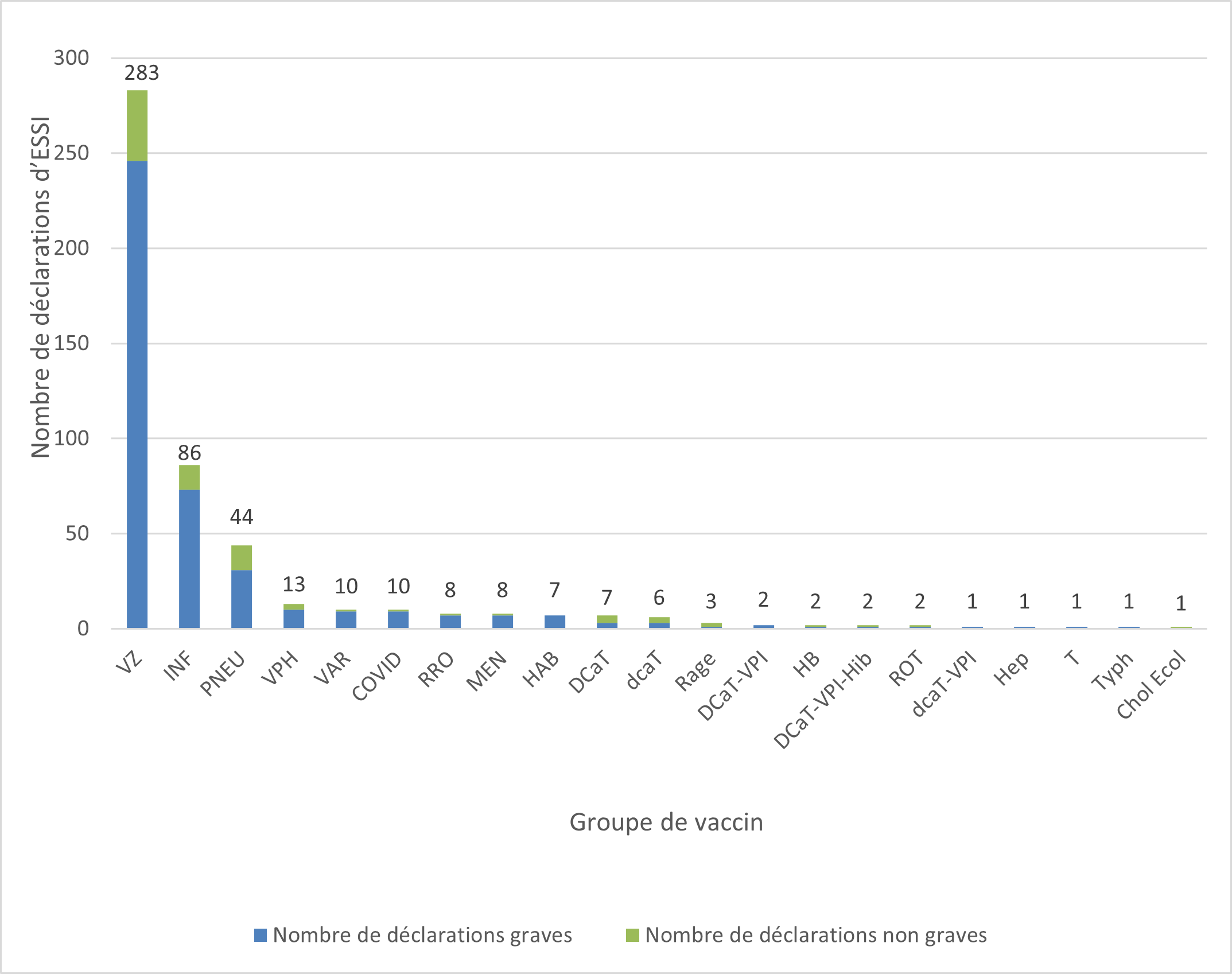
Figure 3 : Équivalent textuel
La figure montre le nombre total de déclarations reçues selon le vaccin (certaines déclarations peuvent inclure plus d'un vaccin) Type de vaccin Nombre de déclarations non graves Nombre de déclarations graves Zona VZ 37 246 Influenza INF 13 73 Pneumocoque PNEU 13 31 Virus du papillome humain VPH 3 10 Varicelle VAR 1 9 Vaccins pour la COVID-19 COVID 1 9 Rougeole, Rubéole et Oreillons RRO 1 7 Méningocoque MEN 1 7 Hépatite A et Hépatite B HAB 0 7 Diphtérie, Coqueluche acellulaire et Tétanos DCaT 4 3 Diphtérie (réduite), Coqueluche acellulaire et Tétanos dcaT 3 3 Rage Rage 2 1 Diphtérie, Coqueluche acellulaire, Tétanos et inactivé contre la poliomyélite DCaT-VPI 0 2 Hépatite B HB 1 1 Diphtérie, Coqueluche acellulaire, Tétanos, inactivé contre la poliomyélite et l'Hæmophilus influenzæ de type B DCaT-VPI-Hib 1 1 Rotavirus ROT 1 1 Diphtérie (réduite), Coqueluche acellulaire, Tétanos et inactivé contre la poliomyélite dcaT-VPI 0 1 Hépatite
* le type de vaccin contre l'hépatite n'a pas été signaléHep 0 1 Tétanos T 0 1 Typhoïde Typh 0 1 Choléra et la diarrhée du voyageur due à Escherichia Coli entérotoxinogène Chol Ecol 1 0 - Parmi les 466 déclarations, 389 (83 %) étaient des déclarations d'effets graves, dont :
- 246 étaient associées aux vaccins contre le zona. Les 5 effets secondaires graves les plus fréquemment signalés à la suite de l'administration de vaccins contre le zona étaient le zona, l'échec de la vaccination, la douleur, le rash et la fièvre. La plupart du temps, le zona et l'échec de la vaccination ont fait l'objet d'une même déclaration.
- 73 étaient associées aux vaccins contre l'influenza. Les 5 effets secondaires graves les plus fréquemment signalés à la suite de l'administration de vaccins contre l'influenza étaient la céphalée, la toux, la fatigue, la diarrhée et la rhinopharyngite.
- pour la majorité, il n'a pas été possible d'établir de lien avec le vaccin compte tenu de l'absence de renseignements médicaux concernant les sujets vaccinés, le statut vaccinal et l'effet indésirable. Plusieurs déclarations concernaient des patients ayant des problèmes de santé sous-jacents et/ou des médicaments concomitants, et les effets secondaires graves n'étaient probablement pas liés à la vaccination. Pour ce qui est des autres déclarations, les effets étaient signalés dans les monographies de produit des vaccins soupçonnés.
- Au total, il y a eu signalement d'un décès dans 9 déclarations : 2 pour des personnes de sexe masculin, 5 pour des personnes de sexe féminin et 2 pour des personnes dont l'information sur le sexe n'est pas connue. Deux cas sont survenus chez des personnes d'au moins 65 ans; pour les 7 autres, l'âge n'a pas été déclaré. Les vaccins mis en cause dans les déclarations étaient un vaccin contre le zona (6), un vaccin contre l'influenza (2) et un vaccin contre l'influenza co-administré avec un vaccin contre la COVID-19 (1). L'information fournie dans ces déclarations n'était pas suffisamment détaillée pour permettre d'établir un lien de causalité entre l'effet déclaré et le vaccin. Le pourcentage de cas mortels observés en 2021 (9 sur 466 déclarations, soit 2 %) concorde avec celui des déclarations des années précédentes.
Conclusion
- Aucun nouveau signal d'innocuité (problème d'innocuité potentiel) lié à des vaccins n'a été identifié pendant cette période.
- Les avantages des vaccins autorisés au Canada continuent de l'emporter sur les risques.
- Santé Canada, en collaboration avec l'ASPC, continuera de surveiller étroitement l'innocuité des vaccins autorisés au Canada.
Pour obtenir de plus amples renseignements, veuillez communiquer avec la Direction des produits de santé commercialisés.
Notez qu'en raison d'une mise à jour de l'information reçue par le Programme Canada Vigilance, il peut y avoir des différences dans le nombre de déclarations et les effets secondaires extraits à des dates différentes.
Portée
Cette publication mensuelle s'adresse principalement aux professionnels de la santé et contient des informations sur les produits pharmaceutiques, biologiques, les matériels médicaux et les produits de santé naturels. Elle fournit un résumé des informations clés concernant l'innocuité des produits de santé qui ont été publiés au cours du mois précédent par Santé Canada, ainsi qu'une sélection de nouveaux renseignements en matière d'innocuité sur les produits de santé, pour en accroître la sensibilisation. Les nouvelles informations contenues dans ce numéro ne sont pas exhaustives, mais représentent plutôt une sélection de problèmes d'innocuité cliniquement pertinents, justifiant une dissémination améliorée.
Pour signaler des effets indésirables
Programme Canada Vigilance
Téléphone : 1-866-234-2345
Télécopieur ou courrier : formulaire disponible sur MedEffet Canada
Des renseignements sur la marche à suivre pour déclarer un effet indésirable à Santé Canada sont publiés à la page Déclaration des effets indésirables ou des incidents liés aux matériels médicaux.
Liens utiles
- MedEffetMC Canada
- Base de données sur les rappels et les avis de sécurité
- Nouveaux examens de l'innocuité ou de la sûreté et de l'efficacité
- Base de données en ligne des effets indésirables de Canada Vigilance
- Base de données sur les produits pharmaceutiques
- Liste des instruments médicaux homologués
- Base de données des produits de santé naturels homologués
- Portail des médicaments et des produits de santé
- Pénuries de médicaments Canada
- Pénuries d'instruments médicaux : Liste des pénuries et des interruptions de la vente
- Mettons fin au marketing illégal des médicaments et des instruments médicaux
- Liste des drogues destinées aux importations et aux ventes exceptionnelles
- Maladie à coronavirus (COVID-19)
- Autorisation de médicament et de vaccin contre la COVID-19 : Liste des drogues et vaccins autorisés et des drogues à indication supplémentaire
- Portail des vaccins et traitements pour la COVID-19
- Effets secondaires signalés après la vaccination contre la COVID-19 au Canada
Des suggestions?
Vos commentaires sont importants pour nous. Dites-nous ce que vous pensez en nous contactant à : infowatch-infovigilance@hc-sc.gc.ca
Équipe de rédaction de l'InfoVigilance sur les produits de santé
Direction des produits de santé commercialisés
Santé Canada
Indice de l'adresse 1906C
Ottawa (ON) K1A 0K9
Téléphone : 613-954-6522
Téléimprimeur : 1-800-465-7735 (Service Canada)
Droit d'auteur
© 2023 Sa Majesté le Roi du Chef du Canada. Cette publication peut être reproduite sans autorisation à condition d'en indiquer la source en entier. Il est interdit de l'utiliser à des fins publicitaires. Santé Canada n'accepte pas la responsabilité de l'exactitude ou de l'authenticité des renseignements fournis dans les notifications.
On ne peut que soupçonner la plupart des effets indésirables (EI) des produits de santé à l'égard desquels on ne peut établir de lien prouvé de cause à effet. Les notifications spontanées d'EI ne peuvent servir pour déterminer l'incidence des EI, étant donné que les EI ne sont pas suffisamment signalés et l'étendue d'exposition des patients est inconnue.
En raison des contraintes de temps concernant la production de cette publication, les informations publiées peuvent ne pas refléter les informations les plus récentes.
- Note de bas de page †
-
Ce résumé ne tient pas compte des cas déclarés pour les vaccins contre la COVID-19, sauf si ceux-ci ont été co-administrés avec un autre vaccin, et que les deux sont soupçonnés d'avoir causé les ESSI.
