Guide d'utilisation du formulaire de modification et de notification d'une licence de mise en marché pour un produit de santé naturel
Publication autorisée par la Ministre de la Santé
Date d'entrée en vigueur : 11 avril 2018
Direction générale des produits de santé et des aliments
Santé Canada a pour mandat d'aider les Canadiens à conserver et à améliorer leur santé. Il s'assure d'offrir des services de santé de grande qualité, et cherche à réduire les risques pour la santé.
version PDF (2,873 KB)
Date de publication : June 4, 2018
La présente publication peut être reproduite sans autorisation pour usage personnel ou interne seulement, dans la mesure où la source est indiquée en entier.
Cat.: H164-232/2018F-PDF
ISBN: 978-0-660-25723-5
Pub.: 170510
Also available in English under the title:
Natural Health Product Licence Amendment and Notification Form User Guide
© Sa Majesté la Reine du chef du Canada, représentée par la ministre de la Santé, 2018
Pour obtenir plus d'information, veuillez communiquer avec :
Santé Canada
Indice de l'adresse 0900C2
Ottawa, ON K1A 0K9
Tel.: 613-957-2991
Sans frais: 1-866-225-0709
Fax: 613-941-5366
TTY: 1-800-465-7735
E-mail: publications@hc-sc.gc.ca
Table des matières
- Aperçu du formulaire de modification et de notification d'une licence de mise en marché pour un produit de santé naturel
- Recommandations pour des résultats optimaux
2.1 Généralités
2.2 Spécificités - Généralités concernant les formulaires de notification et de modification après la délivrance de la licence
3.1 Page d'accueil du FMN
3.2 Renseignements relatifs au demandeur - Mises à jour de l'entreprise
4.1 Page relative aux paramètres de l'entreprise
4.2 Identification de l'entreprise
4.3 Mises à jour de l'entreprise - Changements relatifs au produit
5.1 Page relative aux paramètres du produit
5.2 Recherche par NPN
5.3 Paramètres relatifs à l'entreprise
5.4 Paramètres relatifs aux sites
5.5 Paramètres du produit
5.6 Paramètres de qualité - Transfert de licences
- Finalisation du formulaire
- Enregistrement du formulaire en .pdf et en .xml
- Présentation du formulaire
Liste des figures
Figure 1 : Message d'avertissement d'expiration de la session
Figure 2 : Message indiquant l'expiration de la session
Figure 3 : Page par défaut d'expiration de la session
Figure 4 : Exemple de champ obligatoire et de message d'erreur
Figure 5 : Exemple du panneau de navigation et des autres options de navigation
Figure 6 : Page d'accueil du FMN
Figure 7 : Renseignements relatifs au demandeur
Figure 8 : Page des paramètres l'entreprise de la section « Mises à jour de l'entreprise »
Figure 9 : Page relative à l'identification de l'entreprise
Figure 10 : Page relative aux paramètres du produit
Figure 11 : Identification de licence de mise en marché
Figure 12 : Page de renseignements relatifs à l'exploitation
Figure 13 : Exemple de liste d'ingrédients médicinaux
Figure 14 : La recherche indique 0 résultat lorsque l'ingrédient médicinal est introuvable dans la BDIPSN
Figure 15 : Ingrédient médicinal associé à multiples entrées
Figure 16 : Page relative aux paramètres de modifications des ingrédients médicinaux et les champs d'information préalablement autorisé pour l'ingrédient « huile de poisson »
Figure 17 : Sélection du nom propre et du nom commun
Figure 18 : Exemple de la page Modifier l'ingrédient médicinal – matière d'origine pour l'ingrédient « huile de poisson »
Figure 19 : Exemple de liste d'ingrédients non médicinaux
Figure 20 : Tableau d'ingrédients non médicinaux après que la cellulose ait été ajouté, la gélatine supprimée et la glycérine modifiée
Figure 21 : Exemple de résultats de recherche de l'ingrédient « cellulose »
Figure 22 : Page de dose recommandée
Figure 23 : Sélection d'un ingrédient pour le formulaire pour les tissus d'origine animal
Figure 24 : Exemple de message pour information incomplète
1.0 Aperçu du formulaire de modification et de notification d'une licence de mise en marché pour un produit de santé naturel
Le formulaire de modification et de notification (FMN) est le seul formulaire à utiliser pour présenter des changements d'une licence de mise en marché pour un produit de santé naturel après sa délivrance auprès de la Direction des produits de santé naturels et sans ordonnance (DPSNSO). L'utilisation du FMN permet de s'assurer que seules les modifications des données énoncées dans les articles 11 et 12 du Règlement sur les produits de santé naturels(RPSN) sont présentées à la DPSNSO. Conformément à l'article 13 du RPSN, le FMN ne permet pas de faire part de changements fondamentaux concernant les produits de santé naturels, ni de modifications à déclaration non obligatoire, comme la modification de la taille du contenant et des conditions d'entreposage.
Le FMN facilite aussi la présentation de notifications qui peuvent affecter toutes ou plusieurs licences de produit détenues par le détenteur telles que des mises à jour de la compagnie et des transferts de licence.
Le FMN est conçu pour être rempli en ligne et peut être enregistré et rechargé à tout moment. Il est rattaché à la base de données des produits de santé naturels homologués et à la base de données des ingrédients de produits de santé naturels (BDIPSN), ce qui permet le remplissage automatique des renseignements relatifs à votre produit homologué et à ses ingrédients. Le FMN indique également les documents à fournir dans le dossier de présentation de modification et/ou notification après la délivrance de la licence.
Ce guide d'utilisation fournit des renseignements sur la manière de compléter et de présenter le FMN avec succès. Pour obtenir des renseignements supplémentaires non fournis dans ce guide, veuillez consulter le matériaux pertinent se retrouvant dans la liste des documents de référence - Législation et lignes directrices - Produits de santé naturels. Consulter le document d'orientation Gestion des demandes de licence de mise en marché (DLMM) des produits de santé naturels pour les définitions et plus de détails sur les informations relatives au produit telles que les extraits, l'activité, les matières d'origine, etc.
En outre, consulter le document d'orientation intitulé Procédures à suivre après la délivrance de la licence pour obtenir une interprétation des articles 11-13 et 16-21 du RPSN, ainsi que des renseignements sur les pièces jointes appropriés et le processus de présentation pour les modifications et les notifications.
Pour obtenir de l'aide technique, veuillez envoyer un courriel à NHP_Initiative_PSN@hc-sc.gc.ca.
2.0 Recommandations pour des résultats optimaux
L'application des recommandations ci-dessous, permettra d'obtenir des résultats optimaux lors de l'utilisation du FMN pour la préparation d'un dossier de présentation de la demande de modification et/ou notification après la délivrance de la licence.
2.1 Généralités
Lire l'intégralité du guide d'utilisation
Bien qu'il soit tentant de commencer à remplir le FMN immédiatement, il est fortement recommandé de lire ce guide d'utilisation avant toute chose. Cela vous permettra de recueillir les renseignements dont vous pourriez avoir besoin à l'avance, afin de les avoir à portée de main au moment de remplir le formulaire. Cela vous aidera également à trouver plus rapidement la réponse aux questions que vous pourriez vous poser en remplissant le formulaire.
Se familiariser avec les monographies
Avant de choisir une monographie sur le FMN, examinez-en les attributs en ligne (au moyen d'une recherche dans la BDIPSN) afin de comprendre les limites des conditions d'utilisation. Vous pourriez constater qu'une autre monographie correspond mieux à vos besoins ou qu'aucune monographie ne correspond aux caractéristiques de votre produit.
Se familiariser avec la base de données sur les ingrédients des produits de santé naturels (BDIPSN)
Le FMN extrait les renseignements relatifs aux ingrédients médicinaux et non médicinaux du produit directement de la BDIPSN. Cette fonction permet d'assurer la cohérence de représentation des ingrédients en autorisant uniquement les entrées approuvées dans la BDIPSN.
Si un ingrédient ne fournit pas automatiquement une liste d'options potentielles à sélectionner, le FMN affiche une fonction de recherche. Une recherche peut être nécessaire si la demande initiale a été présentée en utilisant un formulaire papier ou si une révision de l'ingrédient a été effectuée après l'homologation du produit. Pour mieux comprendre comment trouver votre ingrédient au moyen du FMN, il est utile de vous familiariser avec la BDIPSN et sa terminologie.
Répondre aux exigences du système
Bien que le FMN fonctionne dans la plupart des navigateurs, pour des résultats optimaux, nous recommandons d'utiliser l'un des navigateurs suivants : firefox 54 ou version supérieure ou Chrome 60 ou version supérieure. Pour sauvegarder le formulaire en format PDF, votre ordinateur doit aussi avoir Adobe Acrobat Reader DC (disponible gratuitement à www.adobe.com).
Sauvegarder votre travail – la session peut expirer
Toutes les données saisies lorsque votre session est active seront conservées. Si vous ne parvenez pas à remplir l'intégralité du formulaire au cours d'une session, il est important de sauvegarder votre travail. Les sessions expirent au bout de 29 minutes d'inactivité et les données non sauvegardées seront alors perdues. Un message d'avertissement s'affiche 5 minutes avant l'expiration de la session (voir la figure 1). Cliquez sur « Continuer la session » pour remettre le chronomètre à zéro.
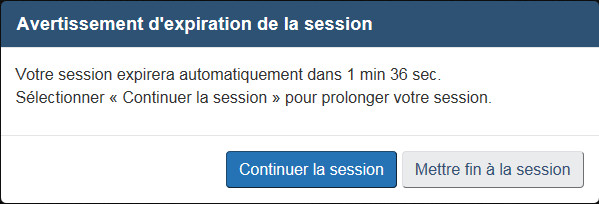
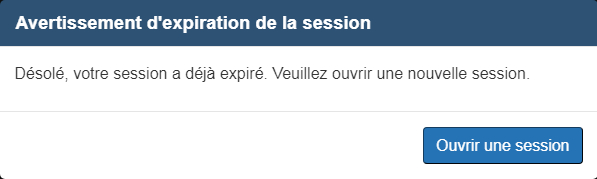
Si la session est inactive pendant plus de 29 minutes, un message indiquant l'expiration de la session s'affichera (voir la figure 2). sélectionnez « Ouvrir une session » pour fermer le message et revenir à la page d'expiration par défaut du formulaire (voir la figure 3). sélectionnez « Revenir à la page d'accueil » ou « Quitter » pour revenir à la page d'accueil du FMN. Si vous avez sauvegardé votre travail sur votre ordinateur, vous pouvez charger le formulaire ainsi sauvegardé et le reprendre. Sinon, sélectionnez l'une des options sous « Effectuer une nouvelle demande».

Valider vos informations au fur et à mesure
Lorsqu'applicable, il est recommandé de toujours sélectionner le bouton « Continuer » afin de valider le contenu rempli avant de passer à la section suivante. Le FMN applique continuellement des règles administratives afin de vérifier que les renseignements fournis sont aussi exacts et exhaustifs que possible. Lorsque vous avez rempli une partie du document, vérifiez que vous n'avez pas fait d'erreur avant de continuer, puis sélectionnez le bouton « Continuer » pour valider le contenu.
Il est recommandé de continuer sans mettre à jour l'information, uniquement si les renseignements nécessaires sont temporairement non disponibles. Sur la page résumé, le formulaire indique les sections incomplètes. Le formulaire ne peut pas être finalisé tant que tous les champs manquants ne sont pas remplis. Seuls les formulaires finalisés peuvent être présentés à la DPSNSO aux fins de traitement.
Sur tous les formulaires Web de la DPSNSO, les renseignements obligatoires sont représentés par des astérisques rouges (*) placées avant l'intitulé du champ, et le terme « obligatoire » figure entre parenthèses après l'intitulé du champ (voir la figure 4).
Lorsque les renseignements sont erronés ou qu'un champ obligatoire n'a pas été rempli, un message d'erreur s'affiche au-dessus du champ où se trouve l'information manquante ou erronée (voir la figure 4). Faites défiler la partie que vous venez de remplir pour déterminer quels sont les champs comportant une erreur. Assurez-vous d'examiner l'intégralité de la page et de corriger chaque erreur avant de sélectionner le bouton « Continuer » à nouveau. Le formulaire ne pourra pas être finalisé tant que ces champs ne seront pas remplis correctement.

Créer des modèles
Si vous envoyez plusieurs notifications et/ou modifications à la dPSNSO, il peut être judicieux d'enregistrer des modèles du formulaire. Pour chaque section du formulaire (Mises à jour de l'entreprise, Changements relatifs au produit, Transfert de licences), un exemplaire distinct du formulaire comportant les renseignements relatifs au demandeur peut être enregistré sur votre poste de travail afin d'être utilisé ultérieurement comme modèle. Le fait de charger un modèle plutôt que de remplir un nouveau formulaire vous évite d'avoir à remplir plusieurs fois les renseignements relatifs au demandeur.
Remarque : Vous devrez enregistrer le formulaire après avoir indiqué en premier le numéro de produit naturel (NPN) (Changements relatifs au produit) ou le nom de l'entreprise (Mises à jour de l'entreprise et/ou Transfert de licences) puis, par la suite, remplir les renseignements relatifs au demandeur. Cependant, une fois le modèle est chargé dans le FMN, vous pouvez toujours modifier le NPN ou le nom de l'entreprise sans effacer les renseignements relatifs au demandeur.
Remarque : Le fait de basculer entre les sections du formulaire « Changements relatifs au produit », « Mises à jour de l'entreprise » ou « Transfert de licences » a pour effet d'effacer toutes les données, y compris les renseignements relatifs au demandeur.
2.2 Spécificités
Parcourir le formulaire
Le FMN comporte plusieurs fonctions de navigation identiques sur l'intégralité du formulaire. Les renseignements suivants présentent ces fonctions et décrivent leur utilisation.
Remarque : Pendant une session active, il est fortement recommandé d'utiliser les fonctions de navigation du FMN plutôt que les boutons « Précédent » et « Suivant » du navigateur, étant donné que ces derniers pourraient engendres des changements imprévisibles dans le formulaire.
Panneau de navigation
Le panneau de navigation, situé sur le côté gauche du FMN, fonctionne comme une table des matières (voir la figure 5). Il présente les sections principales du formulaire en fonction des types de modifications sélectionnées sur la page des paramètres. Ce panneau permet à l'utilisateur de passer d'une section à une autre du formulaire. Utilisez le panneau de navigation si le formulaire ne vous fait pas passer automatiquement à la section suivante.
Paramètres, résumé, Sauvegarder et Quitter
La plupart des pages du FMN sont dotées des quatre options de navigation suivantes dans le coin supérieur droit du formulaire : Paramètres, sommaire, Sauvegarder et Quitter (voir la figure 5). Veuillez trouver une description de chacune de ces boutons ci-dessous.
Paramètres : À tout moment, lorsque vous remplissez le FMN, vous pouvez modifier les paramètres en cliquant sur le lien « Paramètres » dans le coin supérieur droit du formulaire ou en cliquant sur le lien « Modifications et/ou notifications » situé en haut du panneau de navigation. Cette action vous redirigera vers la page des paramètres, sur laquelle vous pouvez cocher (ou décocher) les options présentées. Cliquez sur « Modifier les paramètres » au bas du formulaire pour enregistrer vos choix. Le panneau de navigation s'actualise en fonction des modifications que vous avez apportées à la page des paramètres Pour continuer à remplir le formulaire, sélectionnez la section à laquelle vous souhaitez maintenant accéder dans le panneau de navigation.
Sommaire : À tout moment, lorsque vous remplissez le FMN, vous pouvez sélectionner « Sommaire » dans le coin supérieur droit du formulaire afin d'avoir un aperçu de ce à quoi ressemblera la demande de modification et/ou notification une fois remplie. Sur la page résumé, les modifications seront classées par types de changements après la délivrance de la licence (soit notification, soit modification de la licence).
Sauvegarder : En sélectionnant « Sauvegarder », vous pouvez sauvegarder un exemplaire du formulaire sur votre poste de travail. Le fichier sera enregistré dans le format XML. Pour rouvrir et continuer à travailler sur une session enregistré, vous devez sélectionner l'option « Charger un formulaire à partir d'un fichier » sur la page d'accueil du FMN et charger le fichier XML enregistré.
Quitter : Sélectionner « Quitter » pendant une session efface automatiquement tous les renseignements saisis précédemment et vous redirige vers la page d'accueil du FMN. Sélectionnez cette option uniquement si vous souhaitez remplir un nouveau formulaire sans valider ni enregistrer vos données ou si vous avez sauvegardé un exemplaire du formulaire rempli sur votre poste de travail.
Retour à la liste de données
Plusieurs subdivisions du formulaire, telle que la subdivision « Ingrédients médicinaux », afficheront un lien de navigation qui ramène à la liste de données (p.ex. Retour à la liste d'ingrédients médicinaux). Voir la figure 5 pour un exemple de cette fonction.
Modification de sélection
Plusieurs subdivisions du formulaire telle que la subdivision « Ingrédients médicinaux » afficheront aussi un lien « Modifier votre sélection ». Utilisez ce lien pour retourner à la page des paramètres de cette subdivision pour faire des changements. Voir la figure 5 pour un exemple de cette fonction.
3.0 Généralités concernant les formulaires de notification et de modification après la délivrance de la licence
3.1 Page d'accueil du FMN
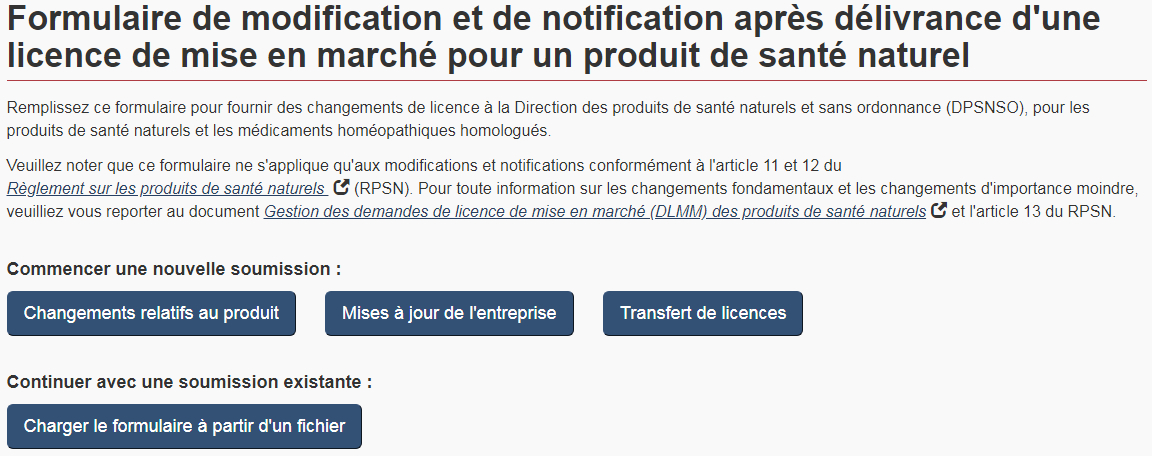
Afin de faciliter la présentation et le traitement des modifications et des notifications après la délivrance de la licence, le FMN se divise en trois sections distinctes et autonomes (voir la figure 6) :
- Mises à jour de l'entreprise: à utiliser pour faire part de modifications générales relatives à l'entreprise
- Changements relatifs au produit : à utiliser pour faire part de modifications spécifiques relatives à un produit
- Transferts de licences : à utiliser en cas de modifications découlant d'une fusion ou acquisition de l'entreprise
Effectuer une nouvelle demande de modification/notification
Pour effectuer une nouvelle demande, déterminez dans un premier temps le(s) type(s) de modifications que vous souhaitez faire, puis sélectionnez l'option la plus pertinente sur la page d'accueil du FMN. Une fois que votre choix est fait, le formulaire limite les options disponibles aux modifications correspondant à cette section. Par exemple, en cas de « Mises à jour de l'entreprise », seuls les renseignements généraux relatifs à l'entreprise peuvent être modifiés, tel que des renseignements relatifs au représentant officiel, l'adresse de l'entreprise, etc. Le fait de passer d'une section à une autre pendant une session active (p. ex. de la section « Mises à jour de l'entreprise » à la section « Changements relatifs au produit ») aura pour effet de supprimer tous les renseignements précédemment saisis.
Charger un formulaire à partir d'un fichier
Sélectionnez « Charger un formulaire à partir d'un fichier » pour charger une session ou un modèle déjà existants. Cette option est également utilisée pour charger un FMN finalisé pour examen.
3.2 Renseignements relatifs au demandeur
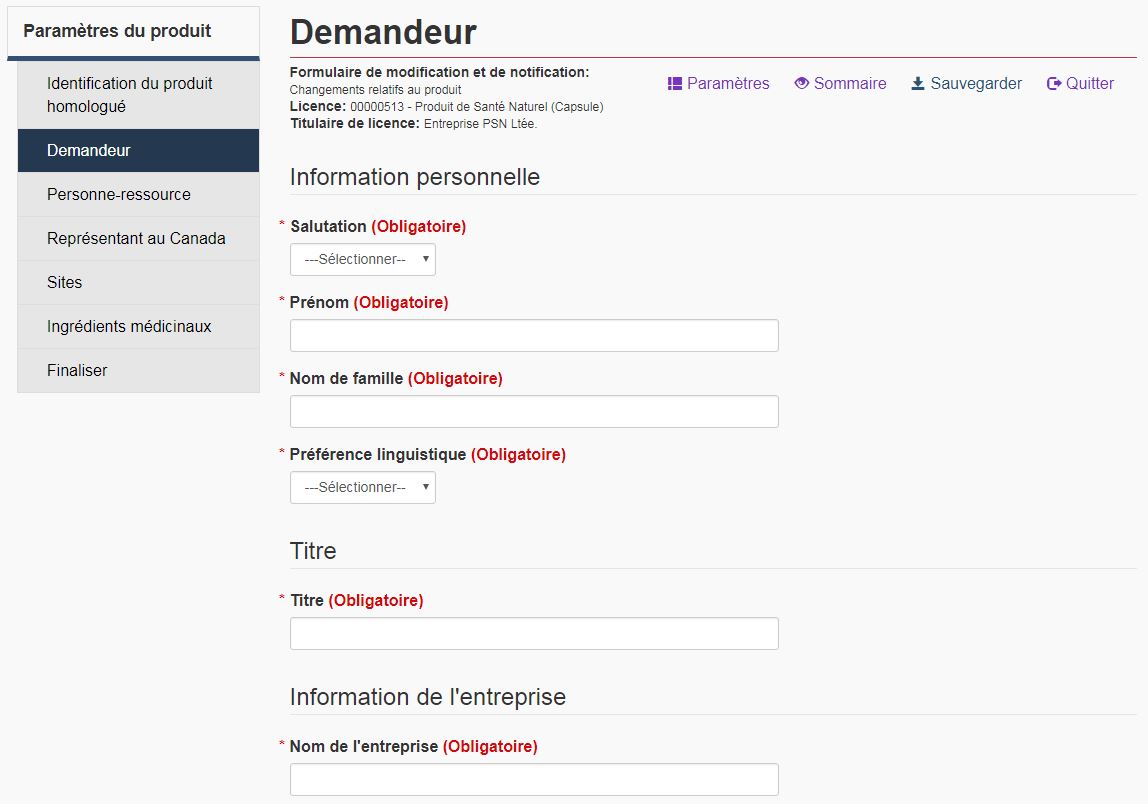
Pour chaque présentation, un demandeur doit être indiqué. Cette personne est, soit le titulaire de la licence (représentant officiel), soit une personne-ressource autorisée par le représentant officiel à présenter des modifications en son nom. Dans le cas des autres demandes, si le demandeur n'est pas une personne-ressource autorisée, un formulaire d'autorisation de la partie désignée doit être inclus dans le dossier de présentation de modification et/ou de notification après la délivrance de la licence. Sous « Renseignements relatifs au demandeur », le nom, le numéro de téléphone, l'adresse, la ville, le pays et l'adresse électronique sont obligatoires dans tous les cas. si le pays est « Canada » ou « États-Unis », le champ « Province/État » et le champ « Code postal » doivent également être remplis. Assurez-vous qu'il n'y a pas d'espace à la fin du code postal, sinon la validation sera impossible. Voir la figure 7 pour un exemple d'une page de demandeur.
Remarque : Voir « Créer des modèles » à la section 2.1 pour en savoir plus sur la procédure à suivre pour sauvegarder un modèle contenant les renseignements relatifs au demandeur. Cela est utile si vous devez remplir plusieurs FMN.
4.0 Mises à jour de l'entreprise
Sur la page d'accueil du FMN, sélectionnez « Mises à jour de l'entreprise » pour faire part des modifications générales relatives à l'entreprise à la dPSNSO. Il peut s'agir d'un changement de nom ou de l'adresse de l'entreprise, de représentant officiel ou des personnes-ressources de l'entreprise. Veuillez consulter la section 4.3 pour de plus amples détails sur les types de changements acceptables dans cette section.
Remarque : Si une mise à jour relative à l'entreprise est liée à un PSN homologué en particulier ou à un sous-ensemble de PSN homologués (par ex. changement de l'information du représentant au Canada), elle doit être soumise dans la section intitulée « Changements relatifs au produit » du FMN (veuillez consulter la section 5.0).
4.1 Page relative aux paramètres de l'entreprise
Une fois que la section « Mises à jour de l'entreprise » est sélectionnée de la page d'accueil, le FMN vous dirigera vers la page relative aux « paramètres de l'entreprise ». Sur cette page, sélectionnez les renseignements qui ont changé en cochant les cases correspondantes (voir la figure 8).
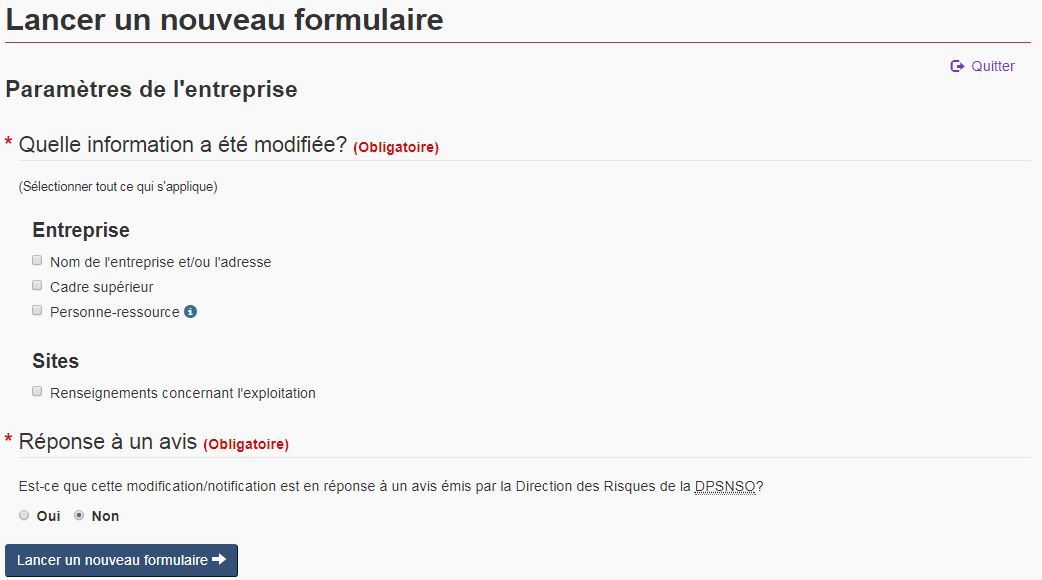
Les choix effectués sur cette page déterminent les sections du formulaire qui seront disponibles pour les modifications. Une fois vos choix effectués, cliquez sur « Lancer un nouveau formulaire » au bas de la page. Une fois l'entreprise identifiée (voir la section 4.2), les éléments sélectionnés sur la page des paramètres s'affichent dans le panneau de navigation et le formulaire vous fait accéder automatiquement à la première rubrique de vos choix.
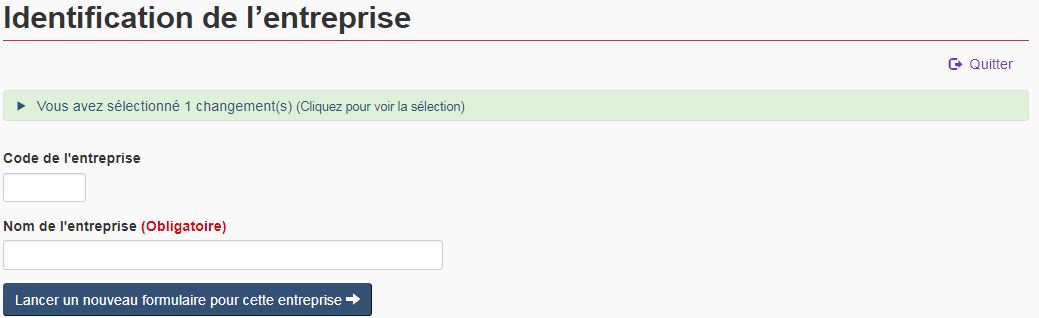
4.2 Identification de l'entreprise
Une fois que vous identifiez les modifications que vous souhaitez communiquer, le FMN passe à la page « Identification de l'entreprise ». Veuillez indiquer le code et le nom de l'entreprise pour laquelle des changements sont à déclarer (voir la figure 9).
4.3 Mises à jour de l'entreprise
Nom et/ou adresse de l'entreprise (titulaire de licence)
Sélectionner « Nom et/ou adresse de l'entreprise » à partir de la page « Paramètres de l'entreprise » pour mettre à jour le nom et/ou l'adresse de l'entreprise. Sélectionnez cette option uniquement si les modifications ne sont pas le résultat d'une fusion ou d'une acquisition.
Remarque : En cas de fusion ou d'acquisition qui entraîne le transfert des licences de mise en marché d'un titulaire de licence à un autre, veuillez remplir plutôt la section du FMN intitulée « Transferts de licences » (voir la section 6.0 pour obtenir plus d'information sur les transferts de licences).
Cadre Supérieur
Sélectionner « Cadre supérieur » à partir de la page « Paramètres de l'entreprise » pour mettre à jour l'information du cadre supérieur actuel ou pour remplacer le cadre supérieur actuel par un nouveau.
Coordonnées du cadre supérieur : Sélectionnez cette option pour modifier le titre, le nom (p. ex. nouveau nom de famille), et/ou les coordonnées du cadre supérieur actuel. Ne sélectionner pas cette option dans le cas où le cadre supérieur a été remplacé par un nouveau cadre supérieur.
Nouveau cadre supérieur : Sélectionnez cette option pour indiquer le nom et les coordonnées du nouveau cadre supérieur. Sélectionnez « Cette personne est également la personne-ressource responsable des demandes » si le représentant officiel est également la personne-ressource responsable de toutes les demandes.
Personne(s)-ressource
Sélectionner l'option « Personne(s)-ressource » à partir de la page « Paramètres de l'entreprise » pour ajouter, supprimer et/ou modifier les coordonnées des personnes-ressource de l'entreprise.
Ajouter une personne-ressource : Sélectionnez cette option pour ajouter une nouvelle personne-ressource pour l'entreprise. Au bas de la page, sélectionnez « Représentant au Canada » si cette nouvelle personne-ressource est également le représentant au Canada.
Supprimer une personne-ressource : Sélectionnez cette option pour informer la DPSNSO que la personne indiquée dans cette section n'est plus une personne-ressource de l'entreprise.
Modifier une personne-ressource : Sélectionnez cette option pour remplacer une personne-ressource ou pour modifier les coordonnées d'une personne-ressource existante (p. ex. son adresse, numéro de téléphone, etc.).
5.0 Changements relatifs au produit
Sur la page d'accueil du FMN, sélectionnez « Changements relatifs au produit » pour faire part d'un changement concernant un PSN après la délivrance de la licence. Ces changements comprennent la modification des personnes-ressource de l'entreprise, des renseignements relatifs au(x) site(s), du nom de marque, des conditions d'utilisation recommandées, des ingrédients non médicinaux, et des ingrédients médicinaux; qui n'entraîne pas de changements fondamentaux.
5.1 Page relative aux paramètres du produit
La première page de la section « Changements relatifs au produit » est la page « Paramètres du produit ». Sur cette page, sélectionnez les renseignements à mettre à jour en cochant les cases correspondantes. ensuite, indiquez si la présentation fait suite à un avis émis par la Division de la gestion des risques (voir la figure 10).

Les choix effectués sur cette page vont déterminer quelles sections du formulaire seront disponibles. Une fois vos choix effectués, cliquez sur « Lancer un nouveau formulaire » au bas de la page. Une fois le Numéro de produit naturel (NPN) sélectionné (voir la section 5.2), les éléments sélectionnés sur la page des paramètres s'affichent dans le panneau de navigation. Le formulaire vous fait accéder automatiquement à la première rubrique de vos choix.
5.2 Recherche par NPN
Saisissez le NPN de la licence de mise en marché que vous souhaitez modifier, puis appuyer sur la touche « Entrée » ou sélectionnez « Rechercher ». Les détails du produit s'affichent sous le champ de recherche. Vérifiez que les renseignements sont corrects, puis sélectionnez « Lancer un nouveau formulaire pour ce produit ».

Tel que vu à la figure 7, chaque page subséquente du FMN affichera les renseignements relatifs à la licence de mise en marché dans le coin supérieur gauche du formulaire, notamment le NPN, le nom de marque principal, la forme posologique et le nom de l'entreprise.
5.3 Paramètres relatifs à l'entreprise
Personne(s)-ressource
Cochez la case « Personne(s)-ressource » pour ajouter, retirer ou mettre à jour les coordonnées de la personne-ressource responsable de cette licence de mise en marché. Pour modifier les informations d'une personne-ressource actuelle, identifier le nom de cette personne et l'information à modifier. Continuez en entrant les informations qui changent. Pour retirer une personne-ressource actuelle, identifier simplement leur nom.
Remarque : Pour chaque nouvelle personne-ressource, un formulaire d'autorisation de la partie désignée est requis.
Représentant au Canada
Cochez la case « Représentant au Canada » pour réviser les coordonnées du représentant actuel ou pour le remplacer.
Remarque : La désignation d'un représentant au Canada est nécessaire uniquement lorsque le titulaire de licence n'est pas au Canada. La modification du représentant et de son adresse entraîne la modification de l'adresse de l'entreprise indiquée sur la licence.
5.4 Paramètres relatifs aux sites
Renseignements concernant l'exploitation
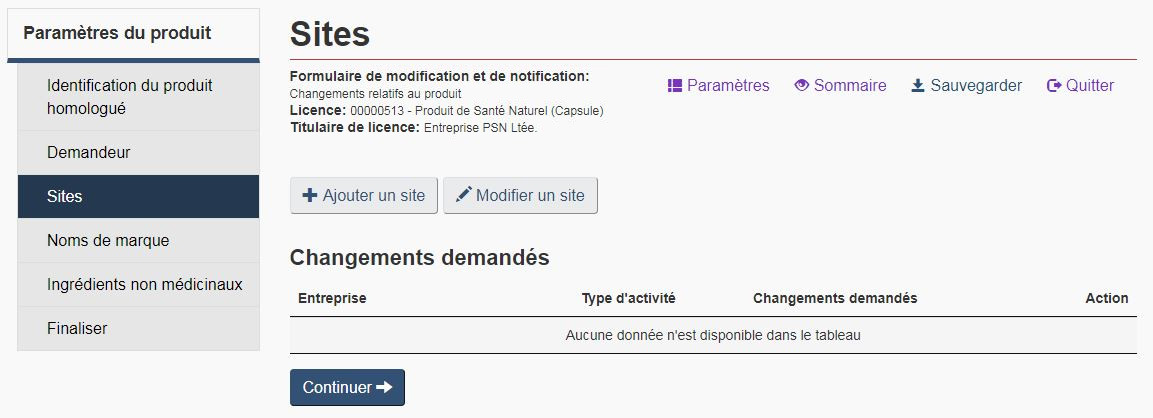
Cochez la case « Renseignements concernant l'exploitation » pour ajouter ou modifier des renseignements relatifs au(x) site(s) du produit homologué. Ces renseignements doivent être communiqués avant la mise sur le marché du produit, conformément à l'article 22 du Règlement sur les produits de santé naturels. Prendre note que même si les entrepôts n'ont pas besoin de licence d'exploitation, ils doivent tout de même être désignés en tant que sites.
Sur la page « Sites », sélectionnez « Ajouter un site » pour ajouter un site en entrant les renseignements relatifs au nouveau site sur la page « Ajouter un site ». Pour modifier les renseignements relatifs au(x) site(s) ou pour remplacer un site existant, entrez les renseignements relatifs au site actuel (numéro de licence d'exploitation et nom de l'entreprise) ainsi que les renseignements du nouveau site sur la page « Modifier un site » (voir la figure 12). Tous les renseignements relatifs au site doivent être fournis, même si seulement une partie des renseignements est changée.
5.5 Paramètres du produit
Changements des noms de marque
Cochez la case « Noms de marque » pour modifier les noms de marque actuels ou ajouter de nouveaux noms de marque à la licence de mise en marché.
Modification des ingrédients médicinaux
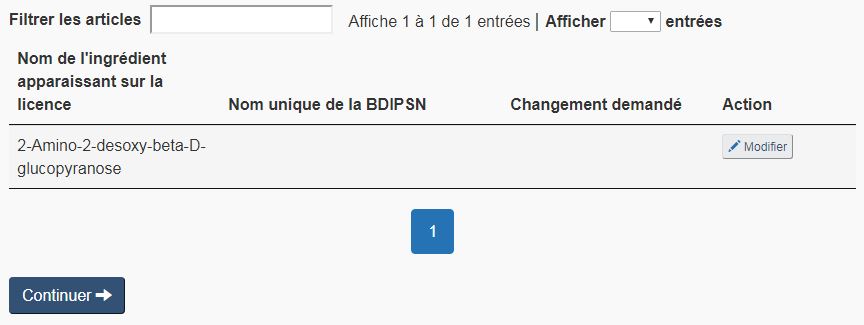
Cochez la case « Ingrédients médicinaux » pour modifier les renseignements suivants relatifs aux ingrédients médicinaux : nom propre ou nom commun (qui n'entraîne pas le remplacement de l'ingrédient médicinal), matière d'origine, substance synthétique ou non, extrait, activité, solvants, et/ou tissu d'origine animale. La figure 13 montre un exemple de liste d'ingrédients médicinaux.
Modification d'un ingrédient: Pour effectuer une demande de modification d'ingrédient médicinal, sélectionner le bouton « Modifier » approprié dans la liste d'ingrédients médicinaux (voir la figure 13). Une fois l'ingrédient médicinal sélectionné, le FMN se remplit automatiquement avec les renseignements de la BDIPSN sur cet ingrédient. L'une des trois situations suivantes peut survenir :
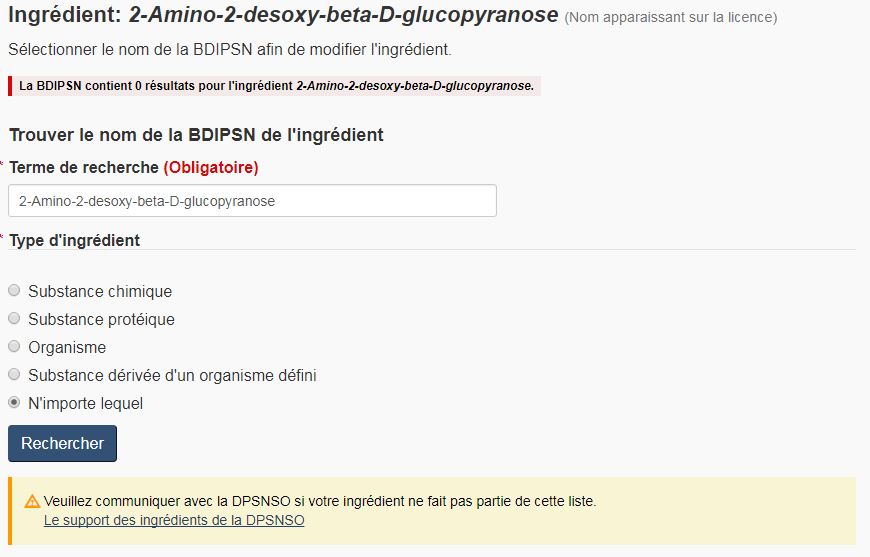
- Le nom de l'ingrédient est introuvable. La figure 13 présente un exemple d'ingrédient médicinal qui n'a pas été désigné de la même façon que les noms propres et communs approuvés dans la BDIPSN. La figure 14 illustre ce qui se passe lorsque le demandeur clique sur « Modifier ». Pour continuer à remplir le formulaire, il faut faire une nouvelle recherche en utilisant un nom différent. Par exemple, dans la figure 14, l'ajout des accents permet de trouver le bon ingrédient. Une fois l'ingrédient trouvé, cochez « Sélectionnez » à côté de l'ingrédient correspondant et passez à la page suivante du formulaire.
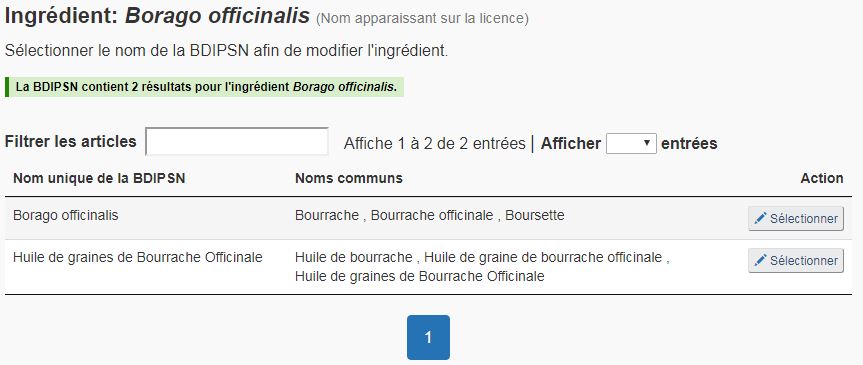
- Le nom de l'ingrédient sur la licence est associé à plusieurs entrées dans la BDIPSN. Le demandeur doit sélectionner l'ingrédient médicinal pertinent dans la liste des résultats (voir la figure 15). L'ingrédient correct doit être sélectionné. Si la DPSNSO juge que l'ingrédient médicinal sur le FMN ne correspond pas à l'ingrédient médicinal indiqué sur la licence du produit, elle considérera qu'il s'agit d'une modification fondamentale et rejettera la présentation.
- Le nom de l'ingrédient saisi ne correspond qu'à une seule entrée dans la BDIPSN. Le FMN vous fera passer automatiquement à la page suivante du formulaire « Modifier les paramètres de l'ingrédient médicinal » (voir la figure 16).
Pour faire une demande de mise à jour des ingrédients médicinaux ou des ingrédients non médicinaux dans la BDIPSN, utilisez le Formulaire de demande concernant la base de données sur les ingrédients des produits de santé naturels. Les ingrédients médicinaux sont soumis à un processus d'examen plus rigoureux, qui a lieu lorsque la DPSNSO reçoit le formulaire susmentionné. Veuillez consulter le Guide sur le Formulaire de demande concernant la Base de données sur les ingrédients des produits de santé naturels pour en savoir plus sur son utilisation.
Remarque : Tant que les changements souhaités ne sont pas ajoutés à la BDIPSN, ils ne peuvent pas être ajoutés au FMN.
Page relative aux paramètres de modifications des ingrédients médicinaux
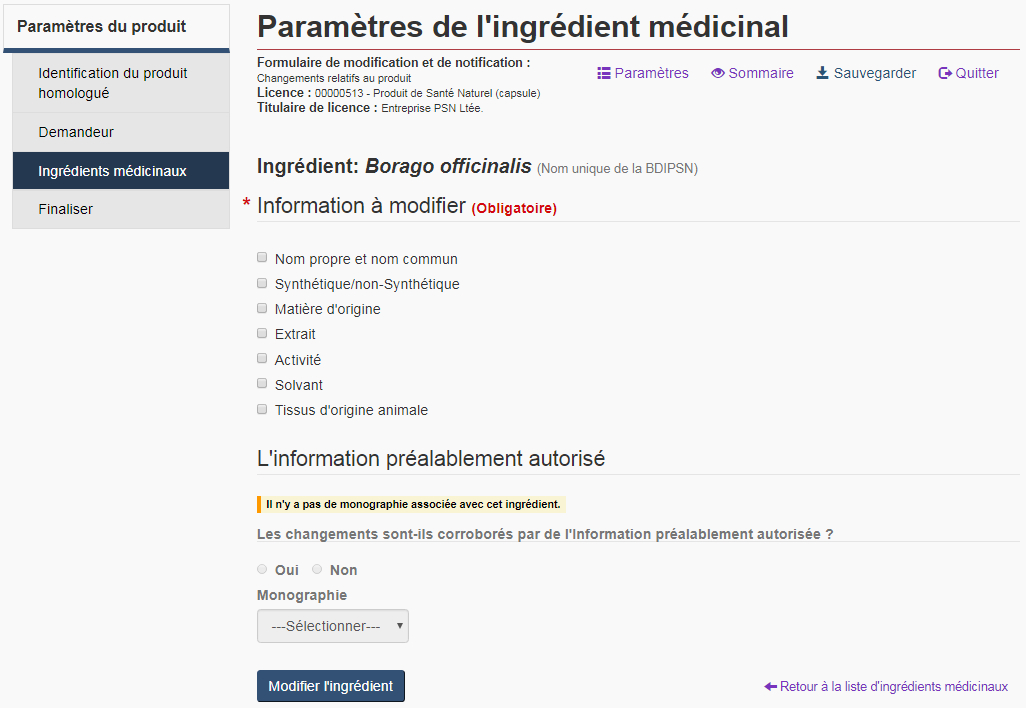
Pour chaque ingrédient médicinal à modifier, le formulaire affiche une page « Paramètres de l'ingrédient médicinal », qui comprend une liste des paramètres pouvant être modifiés et l'option d'identifier si l'information a été préalablement autorisée (voir la figure 16). Pour en savoir plus sur chaque paramètre relatif aux ingrédients médicinaux et sur l'information préalablement autorisée, consultez les sections « Paramètres des ingrédients médicinaux » et « Informations préalablement autorisées (IPA) » ci-dessous.
Paramètres des ingrédients médicinaux
Lorsque vous présentez un changement relatif aux ingrédients médicinaux du produit, chaque sélection sur la page de « Paramètres de l'ingrédient médicinal » génère une sous-section, dont l'onglet s'affiche dans la partie supérieure du formulaire. Utilisez ces onglets pour passer d'une sous-section à l'autre ou sélectionnez le bouton « Continuer » au bas du formulaire une fois la section remplie (recommandé).
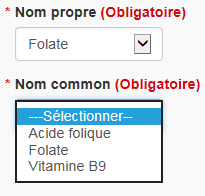
Nom propre et nom commun : Cochez la case « Nom propre et nom commun » pour changer le nom propre et/ou le nom commun actuel d'un ingrédient. Tous les noms propres ou communs acceptables sont pré-remplis à partir de la BDIPSN. Les deux noms de l'ingrédient doivent être sélectionnés dans les listes déroulantes (voir la figure 17).
Nom propre : Pour la plupart des ingrédients médicinaux, il ne sera possible de sélectionner qu'un seul nom propre. Pour modifier le nom propre, un autre nom propre doit être sélectionné dans la liste déroulante, si plus d'un nom est disponible.
Nom commun : Pour la plupart des ingrédients médicinaux, plusieurs noms communs sont disponibles. Pour modifier le nom commun, un autre nom commun doit être sélectionné dans la liste déroulante.
Substance synthétique /non-synthétique : Sélectionnez cette option si l'ingrédient médicinal passe de synthétique à non synthétique ou vice-versa. Sur la page « Modifier les ingrédients – Synthétique/non-synthétique », sélectionner « synthétiquement dérivé » si l'ingrédient est maintenant de nature synthétique; autrement, sélectionner « dérivé non-synthétique ».
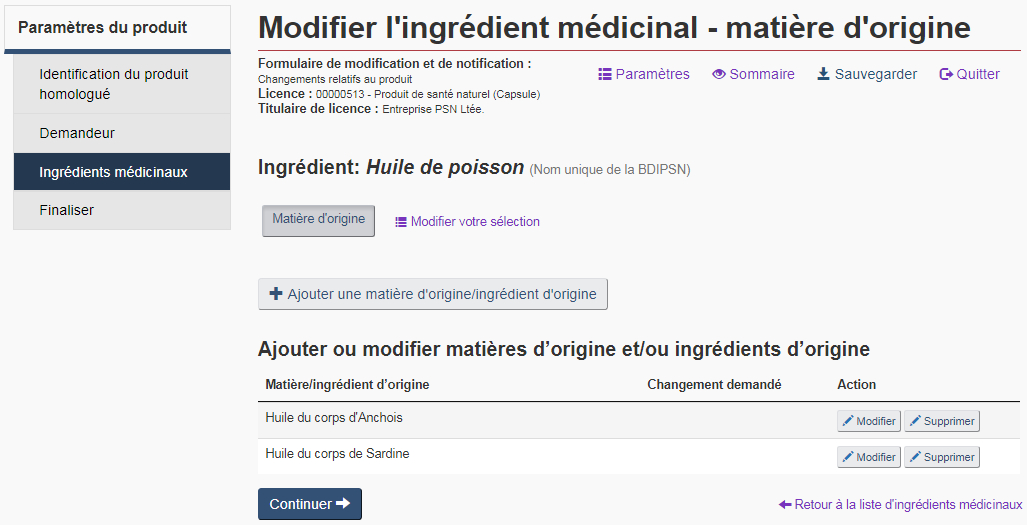
Matière d'origine : Sélectionnez l'option « Matière d'origine » si l'origine de l'ingrédient médicinal a changé. Des matières d'origine et ingrédients d'origine peuvent être ajoutés, changés, ou supprimés à partir de la page « Modifier l'ingrédient médicinal – matière d'origine » (voir la figure 18).
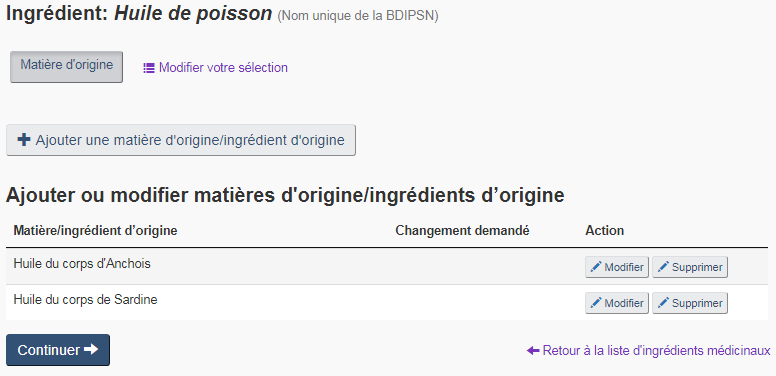
Matières d'origine : Les matières d'origine sont l'association d'un organisme et d'une partie d'organisme. Si plusieurs matières d'origine doivent être ajoutées pour le même ingrédient, cliquez sur le bouton « + Ajouter une matière d'origine/ingrédient d'origine » sur la page « Modifier l'ingrédient médicinal – matière d'origine » de cet ingrédient.
Ingrédients d'origine : Le cas échéant, dans la liste déroulante, sélectionnez l'ingrédient d'origine à partir duquel l'ingrédient a été isolé. Dans le cas des ingrédients ayant des ingrédients d'origine et des matières d'origine, vous devez choisir un élément dans au moins un des deux champs.
Souche : Dans le cas des probiotiques, des bactéries et des champignons, un champ supplémentaire intitulé « Souche » s'affiche et permet d'indiquer le numéro de souche bactérienne. Ce champ est obligatoire pour les probiotiques, mais pas pour les bactéries et les champignons. Dans le cas de tous les autres ingrédients, cette section n'est pas requise.
Extrait : Pour ajouter ou modifier les renseignements relatifs à un extrait, vérifiez que l'ingrédient déterminé sur la page « Modifier l'ingrédient médicinal » est correct et sélectionnez « Extrait » dans la liste des paramètres de l'ingrédient médicinal. Sur la page « Extrait », indiquez le rapport, la quantité brute équivalente, l'unité de mesure, la matière d'origine et le rapport de frais à séché. Les renseignements sur les extraits ne seront pas pré-remplis à l'aide de la BDPSNH. Par conséquent, pour obtenir un ensemble de données complet aux fins d'examen, tous les champs sont obligatoires, même si seul un sous-ensemble de renseignements change.
Activité : Sur la page des « Paramètres de l'ingrédient médicinal », sélectionnez « Activité » pour ajouter, changer, ou supprimé la concentration du principe actif ou du/des composé(s) marqueur de l'ingrédient. Dans le cas des produits homéopathiques, cette section indique la quantité par unité posologique et peut ne pas pouvoir être modifiée.
Solvant : Sélectionnez « Solvant » sur la page des « Paramètres de l'ingrédient médicinal » uniquement si le solvant utilisé dans l'extrait a été modifié. Sur la page « Modifier le solvant », le solvant utilisé dans la préparation de l'extrait doit être sélectionné dans la liste déroulante.
Tissus d'origine animale : (propre à un ingrédient médicinal) Sélectionnez cette option si la modification d'un ingrédient médicinal entraîne la modification du tissu d'origine animale du produit. Sélectionner « Oui » si l'ingrédient contient maintenant des tissus animaux; autrement choisir « Non ».
Remarque : Si la modification d'un ingrédient médicinal entraîne la modification du tissu d'origine animale du produit, un formulaire pour les tissus d'origine animale doit être rempli pour cet ingrédient. Pour ajouter un de ces formulaires, cocher la case « Formulaire pour les tissus d'origine animale » sur la page « Paramètres du produit ». Voir la section « Formulaire pour les tissus d'origine animale » ci-dessous pour en savoir plus sur la façon de remplir cette section.
Informations préalablement autorisés (IPA)
En cas de changements relatifs au produit ayant des répercussions sur l'innocuité, l'efficacité ou la qualité du PSN, le demandeur doit indiquer si les changements sont étayés par des informations préalablement autorisés. Les IPA sont des renseignements examinés par la DPSNSO, jugés acceptables et apportant la preuve de l'innocuité et de l'efficacité d'un ingrédient médicinal et de la qualité d'un PSN. Les IPA sont entre autres les monographies et les normes d'étiquetage de la DPSNSO, les normes d'étiquetage abrégé, et les monographies de catégorie IV et normes d'étiquetage de la Direction des produits thérapeutiques.
Les informations préalablement autorisés peuvent être utilisées pour accélérer l'évaluation du produit et constituent une source fiable d'information sur les produits à l'intention des consommateurs. En cas de modification, la réponse relative aux informations préalablement autorisés détermine si la demande sera traitée en tant que demande de classe I, II ou III. Pour en savoir plus sur les informations préalablement autorisés et les différents types de classes de traitement des demandes, consultez le politique de gestion des demandes de licence de mise en marché.
Il est nécessaire d'indiquer, en cochant « Oui » ou « Non », si des informations préalablement autorisés existent pour un ingrédient donné. Si le(s) changement(s) apporté(s) à l'ingrédient sont étayé(s) par des informations préalablement autorisés, sélectionnez « Oui » et indiquez quelle monographie appuie le(s) changement(s) dans la liste déroulante.
S'il n'existe pas d'information préalablement autorisé relatifs à l'ingrédient, un message l'indiquant s'affiche dans la section de « L'information préalablement autorisé », et les champs seront grisés et non disponibles à l'édition (voir la figure 16).
Remarque : Si les modifications sont étayées par des informations préalablement autorisés, le demandeur devra alors compléter une déclaration relative à la monographie et l'inclure dans leur dossier de présentation. Si les changements ne sont pas étayés par des informations préalablement autorisés, le demandeur devra alors présenter des données à l'appui en plus du formulaire finalisé.
Ingrédients non médicinaux
Vous pouvez supprimer ou modifier des ingrédients non médicinaux existants ou en ajouter de nouveaux, en cochant la case « Ingrédients non médicinaux ». Vous pouvez modifier les ingrédients non médicinaux à votre guise, tant que ces modifications n'entraînent pas de changements de la forme posologique. La figure 19 montre un exemple de liste d'ingrédients non médicinaux et des différentes mesures qui peuvent être prises pour modifier la liste.
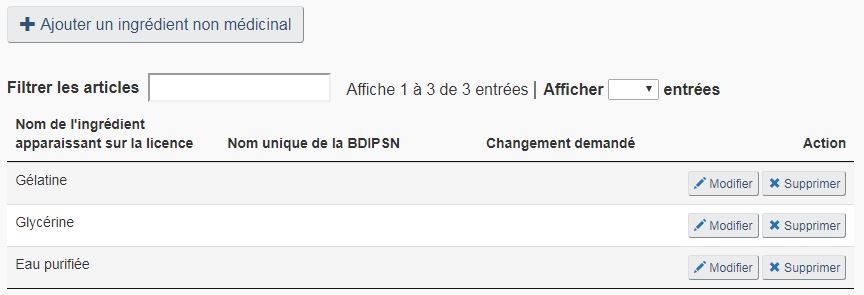
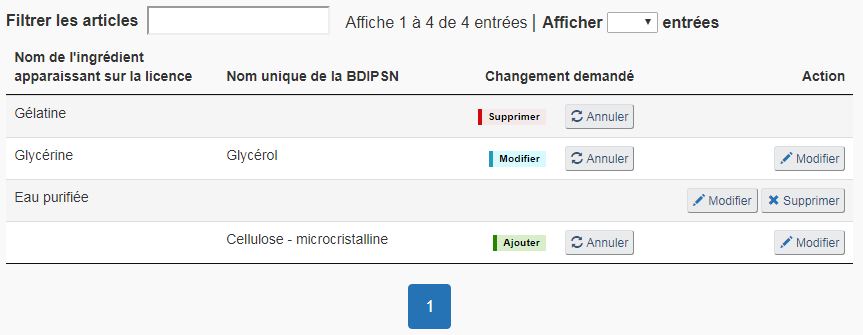
Supprimer un ingrédient : Sur la page « Ingrédients non médicinaux », sélectionnez « Supprimer » correspondant à l'ingrédient non médicinal du produit que vous souhaitez supprimer (voir la figure 19). Une fois sélectionné, l'ingrédient correspondant recevra une marque rouge « Supprimé » sous la colonne « Changement demandé » pour indiquer que l'ingrédient correspondant doit être retiré de la formulation du produit (voir la figure 20).
Modifier un ingrédient : Pour modifier un ingrédient non médicinal existant, sélectionnez « Modifier » correspondant (voir la figure 19). Sélectionner cette option pour modifier le nom commun, les fins, le statut de tissu d'origine animal et/ou la quantité de l'ingrédient sélectionné. Une fois modifié, l'ingrédient correspondant recevra une marque bleue « Modifié » sous la colonne « Changement demandé » (voir la figure 20).
Ajouter un ingrédient : Pour ajouter un nouvel ingrédient non médicinal, sélectionnez « + Ajouter un ingrédient » sur la page « Ingrédients non médicinaux » (voir la figure 19). Une fois ajouté, l'ingrédient correspondant apparaitra dans un nouveau rang de la liste d'ingrédients non médicinaux et recevra une marque verte « Ajouté » sous la colonne « Changement demandé » (voir la figure 20). Voir la section « Rechercher dans la BDIPSN » ci-dessous pour une description du procédé de recherche et de sélection d'un nouvel ingrédient non médicinal.
Annuler les modifications : Une fois une demande de changement effectuée, le bouton « Annuler » apparaitra juste à côté de la demande de changement. Toute demande de changement peut être annulée en sélectionnant « Annuler » à côté du changement correspondant (voir la figure 20).
Rechercher dans la base de données des ingrédients (BDIPSN) : L'outil de recherche des ingrédients est conçu pour vous permettre de rechercher et de récupérer des données dans la BDIPSN. Cet outil peut être utilisé pour chercher des ingrédients médicinaux et non médicinaux. Les champs suivants font objet de la recherche :
- Nom unique de la BDIPSN;
- Nom(s) propre(s);
- Nom(s) commun(s);
- Synonyme(s);
- Synonyme(s) taxonomique(s) (taxons); et
- Numéros de registre du Chemical Abstracts Service (no CAS).
Pour utiliser l'outil de recherche, sélectionnez « Rechercher dans la BDIPSN ». Pour rechercher un ingrédient, sélectionnez un type d'ingrédient ou sélectionnez « Tous », saisissez un mot-clé, puis cliquez sur « Rechercher ».
Saisie d'un mot-clé : Saisissez uniquement les mots-clés simples. Les opérateurs tels que « et » et « ou » peuvent perturber la recherche. Tous les renseignements saisis seront traités comme des mots uniques.
Utilisation de caractères de substitution : Il est possible d'utiliser des caractères de substitution. utilisez « * » ou « % » pour zéro ou pour désigner une suite de caractères ininterrompue, et utilisez « _ » pour désigner un caractère unique. Par exemple, si vous lancez la recherche « *ail séché » ou « %ail séché », les résultats de la recherche comprendront « Bulbe d'ail séché ». Pour en savoir plus, veuillez consulter le Guide sur la terminologie normalisée du Système Produits de santé naturels en direct.
Sélection du type d'ingrédient : Si vous connaissez le type de l'ingrédient que vous recherchez, cochez la case pertinente. Autrement, conserver l'option de défaut, « Tous » pour faire une recherche à travers tous les types. Pour obtenir des définitions détaillés sur les types d'ingrédients, veuillez consulter le Guide sur la terminologie normalisée du Système Produits de santé naturels en direct.
Lancement d'une recherche : Sélectionnez « Recherche » ou « Entrée » pour lancer une recherche.
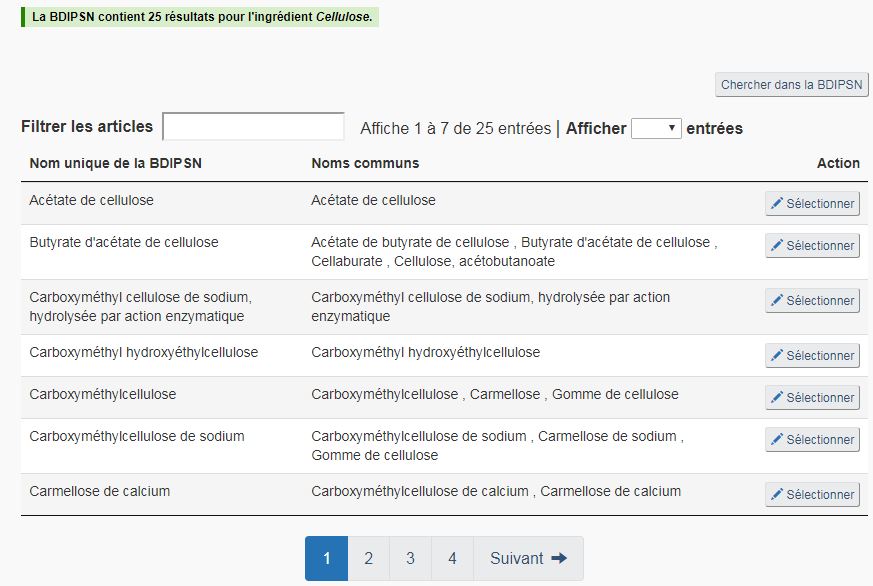
Sélection d'un ingrédient : Lorsque la recherche aboutit, et que l'ingrédient cible figure parmi les résultats de recherche, cliquez sur « Sélectionner » à côté du nom de l'ingrédient. Remplissez les renseignements obligatoires relatifs à l'ingrédient et cliquez sur « Continuer ». Le nouvel ingrédient apparaît désormais dans le tableau relatif aux ingrédients non médicinaux de la page « Paramètres des ingrédients non médicinaux ». la figure 21 ci-dessous présente un exemple de résultats de recherche d'un ingrédient.
Échec de la recherche : L'échec d'une recherche ne signifie pas nécessairement que l'ingrédient recherché n'est pas présent dans la BDIPSN. Les éléments suivants peuvent être à l'origine de l'échec de la recherche :
- Fautes d'orthographe;
- Mauvaise utilisation des caractères de substitution; et/ou
- Utilisation d'une variante orthographique différente de l'orthographe utilisée dans la BDIPSN. Cette situation peut se produire s'il existe différentes orthographes d'un terme parmi l'anglais américain, canadien et britannique, ou s'il existe plusieurs orthographes d'un nom binominal latin.
Le résultat « Aucun ingrédient trouvé » n'est fiable qu'après avoir effectué une recherche suffisamment étoffée et pertinente.
Remarque : Il convient de remarquer que s'il est impossible de trouver un nom ou un terme à l'aide de l'outil de recherche ou dans les listes déroulantes, l'utilisateur doit remplir un formulaire de demande concernant la BDIPSN pour demander à ce que les renseignements manquants soient ajoutés à la base de données (voir le Guide sur le formulaire de demande concernant la BDIPSN).
Dose recommandée
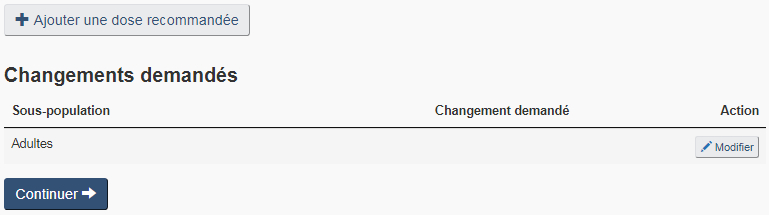
Cochez la case « Dose recommandée » sur la page « Paramètres du produit » pour ajouter une dose recommandée ou modifier n'importe des renseignements relatifs à la dose recommandée actuelle : sous-population, dose maximale et minimale, fréquence d'administration et mode d'emploi. Se référer à la figure 22 pour un exemple de page de « Dose recommandée ».
Durée d'utilisation
Cochez la case « Durée d'utilisation » sur la page « Paramètres du produit » pour modifier ou ajouter un énoncé sur la durée d'utilisation de la licence de mise en marché. Il convient de noter que la durée d'utilisation actuelle ne s'affiche pas automatiquement sur le formulaire, car ce renseignement n'est pas fourni dans la BDPSNH. Par conséquent, si des modifications sont apportées à un énoncé sur la durée d'utilisation existante, vous devez indiquer la durée d'utilisation actuelle ainsi que la durée d'utilisation modifiée.
Risque
Cochez la case « Risque » sur la page « Paramètres du produit » pour modifier, supprimer ou ajouter un ou plusieurs énoncés de risque à la licence de mise en marché. Pour ajouter un énoncé de risque, sélectionnez « Ajouter un risque » sur la page « Risque ». Sur la page « Ajouter un risque », sélectionner la catégorie de risque appropriée : les mises en garde et les avertissements, les contre-indications, et les réactions indésirables connus. Entrez l'énoncé de risque dans le champ « Nouvelle(s) énoncé(s) de risque ». Pour les modifier, sélectionnez le bouton « Modifier » à côté des énoncés de risque correspondantes. Sur la page « Modifier les risques », copiez et collez les renseignements sur les risques qui changent dans le champ relatif aux « Renseignements modifiés sur les risques » et continuez à modifier l'énoncé.
Usage ou fins recommandés
Cochez la case « Usage ou fins recommandés » sur la page « Paramètres du produit » pour modifier ou ajouter un usage ou des fins recommandés à la licence de mise en marché.
Veuillez noter que l'usage ou les fins recommandés actuels sera automatiquement remplie dans le FMN car cette information est fournie dans le BDPSNH. Par conséquent, l'usage ou les fins recommandés existants (le cas échéant) peut être modifié et un usage ou des fins recommandés nouveaux peut être ajoutés, si nécessaire.
Pour modifier un usage ou des fins recommandés existants, cliquez « Modifier » et saisissez le texte modifié. Pour des modifications simples, le texte actuel peut être copié depuis la section précédente et collé dans le champ.
Pour ajouter un usage ou de fins recommandés nouveaux, cliquez « Ajouter un usage ou fins recommandés », puis saisissez le nouveau texte.
Tout changement apporté à l'usage ou fins recommandés, apparaitra dans le tableau sur la page principale « Usage ou fins recommandés ». Si un changement a été effectué par erreur, sélectionnez « Annuler » de la rangé correspondante pour le supprimer.
Formulaire pour les tissus d'origine animale
Un formulaire pour les tissus d'origine animale nouveau ou révisé est requis lorsqu'un changement d'ingrédients médicinaux ou non médicinaux entraîne des tissus d'origine animale nouveaux ou modifiés dans le produit ou l'ajout d'un nouveau tissu d'origine animale. Il est également requis si un tissu d'origine animale différent ou nouveau est utilisé pendant le traitement, mais n'entre pas dans la composition du produit final.
Pour modifier ou ajouter des formulaires pour les tissus d'origine animale, cochez la case « Formulaire pour les tissus d'origine animale » sur la page « Paramètres relatifs à un produit ». Pour remplir un nouveau formulaire, sélectionnez « Ajouter un formulaire pour les tissus d'origine animale » sur la page « Formulaire pour les tissus d'origine animale ». Vous serez alors dirigé sur la page « Ajouter un formulaire pour les tissus d'origine animale », qui contient le formulaire.
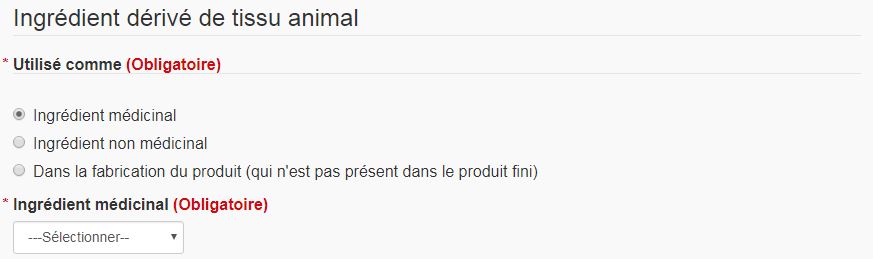
Pour remplir le formulaire pour les tissus d'origine animale, indiquez si l'ingrédient est médicinal, non médicinal ou utilisé pendant le traitement, mais n'entre pas dans la composition du produit final (Voir la figure 23). Si l'ingrédient est médicinal ou non médicinal, sélectionnez-le dans la liste déroulante qui s'affiche (si vous devez faire votre choix entre plusieurs possibilités). Si un seul choix est possible, le formulaire sélectionne automatiquement l'ingrédient. Les ingrédients doivent correspondre aux ingrédients entrant dans la composition du produit. Si l'ingrédient est utilisé pendant le traitement, mais n'entre pas dans la composition du produit final, le nom de l'ingrédient doit être saisi dans le champ de texte prévu. Remplissez le reste du formulaire, puis sélectionnez « Continuer » pour revenir à la page « Formulaire pour les tissus d'origine animale ». Le tableau « Modifications demandées » devrait désormais comprendre les renseignements relatifs au nouveau formulaire pour les tissus d'origine animale.
Si au moins un formulaire pour les tissus d'origine animale a été rempli, une déclaration relative au formulaire pour les tissus d'origine animale sera jointe à la section « Attestation » de la page de validation. Cochez la case « J'accepte » pour accepter la déclaration générale et la déclaration relative au formulaire pour les tissus d'origine animale.
5.6 Paramètres de qualité
Méthodes d'essai
Sur la page « Paramètres du produit », sélectionnez « Méthodes d'essai » afin de charger la page « Modifier les méthodes d'essai ». Indiquez la méthode d'essai à modifier ainsi que la nouvelle méthode d'essai. Étant donné que la méthode d'essai n'est pas indiquée sur la licence de mise en marché, la méthode d'essai actuelle et la nouvelle méthode d'essai doivent être saisies dans les champs de texte fourni. si plusieurs méthodes d'essai doivent être modifiées, sélectionnez « Ajouter une méthode d'essai ». Une version révisée des spécifications pour les produits finis contenant les changements proposés doit accompagner le dossier de présentation.
6.0 Transfert de licences
Utilisez la section « Transfert de licences » du FMN pour informer la DPSNSO du changement de propriété d'une ou de plusieurs licence(s) de mise en marché (NPN). Ce changement peut découler d'une fusion ou d'une acquisition de la compagnie à qui appartient le NPN.
Un avis de transfert de licences doit être présenté à la DPSNSO, qui doit en accuser réception avant d'apporter d'autres modifications à la (aux) licence(s) de mise en marché. Une fois que la DPSNSO a accusé réception de l'avis de transfert de licences, le nouveau titulaire de licence peut faire part d'autres notifications ou modifications au moyen de la section « Changements relatifs au produit du FMN ».
Remplir un avis de transfert de licences suit les étapes suivantes :
- Sélectionner « Transfert de licences » à la page d'accueil du FMN
- Identifier le titulaire de licence actuel
- Fournir les renseignements relatifs au demandeur
- Fournir les renseignements relatifs au nouveau titulaire de licence
Pour tout avis de transfert de licence, le demandeur doit joindre une lettre signée par le titulaire actuel de la licence ainsi qu'une lettre signée par le nouveau titulaire de la licence autorisant le transfert de licence(s). Les deux lettres doivent indiquer les licences de produit à transférer, y compris les NPN et les noms de marque principaux.
7.0 Finalisation du formulaire
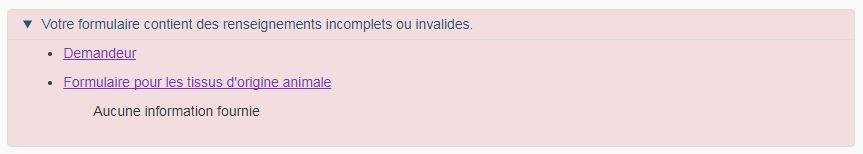
Une fois tous les changements saisis, vous accédez à la page de résumé du FMN. En cas d'erreurs ou d'omissions, celles-ci seront répertoriées dans la partie supérieure de la page de résumé (voir la figure 24). Le formulaire ne sera pas validé tant que toutes les erreurs ne seront pas corrigées. Vous pouvez corriger les erreurs en cliquant sur le lien dans le message d'erreur pour accéder à la section correspondante où l'erreur s'est produite. Lorsque toutes les erreurs sont corrigées, la déclaration s'affiche au bas de la page de résumé.
Avant de finaliser le formulaire, passez en revue le résumé des changements et lisez la déclaration au bas de la page. Afin de finaliser le formulaire, cochez la case « J'accepte » pour signer la déclaration. Une fois les renseignements vérifiés, le formulaire est validé et verrouillé, afin d'empêcher les modifications ultérieures. Un numéro de suivi unique ainsi qu'un code unique de déclaration seront générés. Ces derniers sont utilisés pour vérifier que la déclaration a bien été lue et signée, que le formulaire a été finalisé, et est prêt à présenter.
8.0 Enregistrement du formulaire en .pdf et en .xml
Le FMN doit être présenté à la DPSNSO aussi bien dans le format .xml qu'en format .pdf. Pour enregistrer le fichier au format .xml, sélectionnez « Sauvegarder » dans le coin supérieur à droite de la page, et enregistrez-le sur votre poste de travail. Pour enregistrer le fichier au format .pdf, sélectionnez « Imprimer » dans le coin supérieur droit de la page et sélectionnez « PDF Adobe » dans le menu « Sélectionner l'imprimante ». Enregistrez la version PDF sur votre poste de travail.
Lorsque vous enregistrez le fichier, un nom de fichier est automatiquement attribué en fonction du type de changement(s) présenté(s). Si la présentation concerne un changement relatif à l'entreprise ou un transfert de licence (NPN), le nom de fichier commencera par le nom de l'entreprise fourni. En cas de changements relatifs au produit, le nom du fichier commencera par le NPN fourni. Dans le cas où la soumission est en réponse à un avis émis par la Division de la gestion des risques, le nom par défaut du fichier commencera par RISQ. Veuillez conserver le début du nom du fichier. Tout ce qui suit le nom de l'entreprise, le NPN, ou la mention RISQ peut être changé selon les besoins. Pour plus de certitude, veuillez-vous assurer de sauvegarder les fichiers .xml et .pdf du même fMN sous le même nom.
9.0 Présentation du formulaire
Une fois le formulaire finalisé et enregistré dans les formats .xml et .pdf, il est prêt à être présenté à la DPSNSO. Les versions .xml et .pdf du formulaire ainsi que tout autre documentation requise (par exemple : l'étiquette modifiée, la déclaration relative à la monographie, la fiche des spécifications du produit fini, etc.) doivent être incluses dans le dossier de présentation. Veuillez-vous référer à la section “Documents requis” de la page de validation pour obtenir une liste personalisée des documents requis. Pour de plus amples informations sur la documentation requise, veuillez consulter le guide Procédures à suivre après la délivrance de la licence.
La DPSNSO accepte les dossiers de présentation complets au moyen de la conversation sur Connexion postelMC. Cette méthode est fortement encouragée pour assurer que vos modifications et notifications soient traités le plus tôt possible à leur réception. Pour utiliser Connexion postelMC, vous devrez être enregistrés comme partenaire commercial. Pour en savoir plus sur Connexion postelMC et comment vous enregistrer comme partenaire commercial, consultez le Guide de l'utilisateur sur les modalités des communications électroniques avec la Direction des produits de santé naturels et sans ordonnance.
Il est également possible de présenter des dossiers de modification et / ou de notification après la délivrance de la licence par la poste ou par messagerie, de la même manière que les nouvelles demandes.
Détails de la page
- Date de modification :