Ligne directrice sur la modification du statut d’un ingrédient médicinal pour qu’il passe de « sur ordonnance » à « sans ordonnance » : Soumettre une demande de modification
Sur cette page
- 6. Classification d’un produit résultant d’une présentation de modification réussie
- 7. Comprendre les processus généraux de modification
- 8. Demande d’une réunion préalable à la présentation
- 9. Assemblage de PDN ou SPDN (toutes les modifications)
- 10. Formatage et dépôt d’une PDN ou d’un SPDN (toutes les modifications)
- 11. Payer les frais (toutes les modifications)
- 12. Santé Canada évalue la PDN ou le SPDN
- 13. Santé Canada consulte le public
- 14. Santé Canada annonce son intention de modifier la LDO
- 15. Santé Canada émet une DIN (modifications de médicament sur ordonnance à MVSO seulement)
- 16. Dépôt d’une demande de licence de mise en marché (modifications de médicament sur ordonnance à PSN seulement)
- 17. Santé Canada vérifie la DLMM
- 18. Santé Canada modifie la LDO et délivre l’autorisation du produit
6. Classification d’un produit résultant d’une présentation de modification réussie
Le demandeur devrait déterminer si le produit qu’il propose serait classé comme PSN ou MVSO, si la présentation de modification était réussie. Cette détermination aidera le demandeur à déterminer quel processus s’applique à sa situation : le processus de modification de médicament sur ordonnance à MVSO ou le processus de modification de médicament sur ordonnance à PSN.
Le demandeur devrait vérifier si, à la suite d’une présentation de modification réussie, le produit proposé répondrait à la définition de PSN telle qu’établie dans le RPSN. Si c’est le cas, une présentation de modification réussie aurait pour conséquence de classer le produit comme un PSN. Sinon, il serait classé comme MVSO selon le RAD.
Pour déterminer si les ingrédients du produit proposé sont acceptables dans un PSN, le demandeur devrait consulter la définition de « produit de santé naturel » dans le RPSN, les annexes 1 et 2 du RPSN ainsi que la Base de données sur les ingrédients de produits de santé naturels (BDIPSN).
7. Comprendre les processus généraux de modification
Cette section donne une vue d’ensemble des processus de modification de médicament sur ordonnance à MVSO et de médicament sur ordonnance à PSN, et est suivie des sections 8 à 19 qui donnent des indications supplémentaires sur les étapes du processus.
7.1 Processus 1 : une présentation de modification réussie de produit sur ordonnance à MVSO
Voici le processus principal d’une modification de médicament sur ordonnance à MVSO qui conduit à la délivrance ou à la mise à jour d’une autorisation de produit :
- Le demandeur prépare le dossier de données pour la réunion préalable à la présentation (PND ou SPDN) pour Santé Canada et demande une réunion préalable à la présentation. (Voir la section 8 pour plus de détails.)
- Le demandeur rencontre Santé Canada à une réunion préalable à la présentation afin de présenter l’ensemble des données relatives à la modification proposée et d’en discuter. Cette réunion peut amener le demandeur à réaliser des études complémentaires.
- Le demandeur assemble la version finale de la PDN ou du SPDN comprenant les données nécessaires sur l’innocuité, l’efficacité et la qualité, l’étiquetage du produit, et une « Évaluation des principes et des facteurs de la LDO ». (Section 9)
- Le demandeur dépose la PDN ou le SPDN auprès de Santé Canada sous la forme appropriée et paie les frais applicables. (Sections 10 et 11)
- Santé Canada vérifie si la présentation est complète. S’il ne manque rien, la présentation est examinée.
- Santé Canada évalue la présentation incluant l’information soumise dans l’Évaluation des principes and des facteurs de la LDP. Si l’évaluation de Santé Canada est positive, le processus se poursuit. (Section 12)
- Santé Canada affiche un « avis de consultation » public sur le site Web canada.ca dans lequel il expose sa proposition de retirer l’ingrédient médicinal, ou de retirer l’ingrédient médicinal pour certaines conditions d’utilisation, de la LDO et suspend la PDN ou le SPDN. (Section 13)
- Santé Canada examine les commentaires fournis par le public et les autres intervenants au cours de la consultation sur la LDO. (Section 13)
- Après avoir analysé les commentaires, si Santé Canada décide d’aller de l’avant, il publie un « avis d’intention de modification » qui indique quand la modification de la LDO aura lieu. (Section 14)
- Santé Canada attribue une identification numérique de drogue (DIN) au produit proposé, si nécessaire. (Section 15)
- Santé Canada modifie la LDO et affiche un « avis de modification » à cet effet. (Section 18)
- Santé Canada émet un avis de conformité (AC) pour le MVSO. (Section 18.1)
- Si, en plus de l’AC, les LEPP appropriées ont été délivrées aux personnes menant des activités liées au produit (p. ex. fabrication, importation), le produit peut être vendu au Canada conformément au RAD. (Section 19.4.1)
Organigramme 1 : un processus de modification réussi de médicament sur ordonnance à MVSO
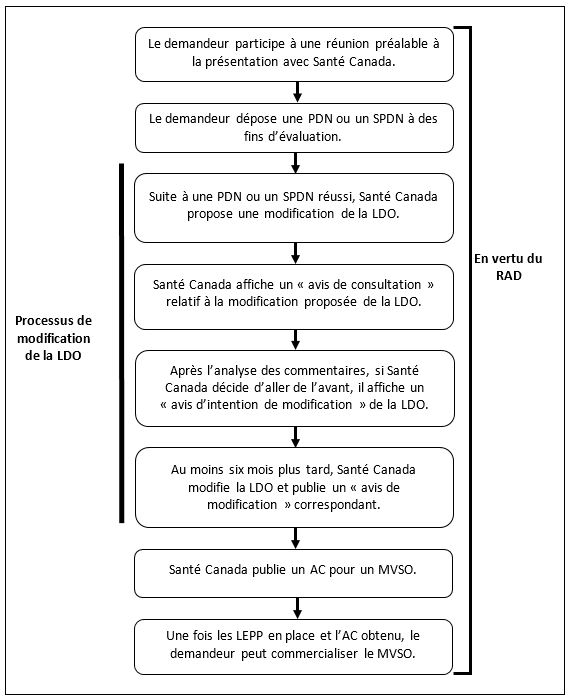
Équivalent textuel
Les étapes du processus qui vient d’être décrit (section 7.1) sont illustrées dans un diagramme. En outre, l’image montre que toutes les étapes de ce processus relèvent du RAD et que les étapes 7, 8, 9 et 11 font partie du processus relatif à la LDO.
7.2 Processus 2 : une présentation de modification réussie de médicament sur ordonnance à PSN
Voici le processus principal d’une modification de médicament sur ordonnance à PSN qui conduit à la délivrance d’une autorisation de produit. Notez que les neuf premières étapes de ce processus sont les mêmes que celles d’une modification d’un médicament sur ordonnance à un MVSO.
- Le demandeur prépare le dossier de données pour la réunion préalable à la présentation pour Santé Canada et demande une réunion préalable à la présentation. (Voir la section 8 pour plus de détails.)
- Le demandeur rencontre Santé Canada à une réunion préalable à la présentation afin de présenter l’ensemble des données relatives à la modification proposée et d’en discuter. Cette réunion peut amener le demandeur à réaliser des études complémentaires.
- Le demandeur assemble la version finale de la PDN ou du SPDN comprenant les données nécessaires sur l’innocuité, l’efficacité et la qualité, l’étiquetage du produit, et une « Évaluation des principes et des facteurs de la LDO ». (Section 9)
- Le demandeur dépose la PDN ou le SPDN auprès de Santé Canada sous la forme appropriée et paie les frais applicables. (Sections 10 et 11)
- Santé Canada vérifie si la présentation est complète. S’il ne manque rien, la présentation est examinée.
- Santé Canada évalue la présentation incluant l’information soumise dans l’Évaluation des principes and des facteurs de la LDP. Si l’évaluation de Santé Canada est positive, le processus se poursuit. (Section 12)
- Santé Canada affiche un « avis de consultation » public sur le site Web canada.ca dans lequel il expose sa proposition de retirer l’ingrédient médicinal, ou de retirer l’ingrédient médicinal pour certaines conditions d’utilisation, de la LDO et suspend la PDN ou le SPDN. (Section 13)
- Santé Canada examine les commentaires fournis par le public et les autres intervenants au cours de la consultation. (Section 13)
- Après avoir analysé les commentaires, si Santé Canada décide d’aller de l’avant, il publie un « avis d’intention de modification » qui indique quand la modification de la LDO aura lieu. (Section 14)
- Le demandeur dépose ensuite une DLMM conformément au RPSN, reflétant les informations de la PDN et du SPDN en prévision de la modification de la LDO. (Section 16)
- Santé Canada vérifie la DLMM. (Section 17)
- Santé Canada modifie la LDO et affiche un « avis de modification ». (Section 18)
- Santé Canada publie un avis de non-conformité (ANC) pour la PDN ou le SPDN et, le cas échéant, annule le ou les DIN parce que le produit n’est plus une drogue en vertu du RAD. (Section 18.2)
- Si le demandeur a satisfait aux exigences du RPSN, Santé Canada délivre la licence de mise en marché et le numéro de produit naturel (NPN) du produit. (Section 18.2)
- Si, en plus de la licence de mise en marché et du NPN, la licence d’exploitation appropriée a été délivrée à ceux qui mènent des activités liées au produit (c.-à-d. fabrication, importation, emballage ou étiquetage), le produit peut être vendu au Canada conformément au RPSN. (Section 19.4.2)
Organigramme 2 : un processus de modification réussi de médicament sur ordonnance à PSN
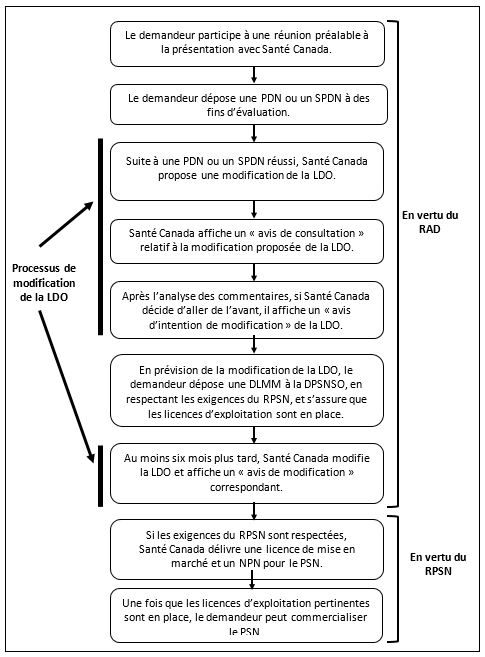
Équivalent textuel
Les étapes du processus qui vient d’être décrit (section 7.2) sont illustrées dans un diagramme. De plus, l’image montre que les étapes 1 à 9, 12 et 13 de ce processus relèvent du RAD; les étapes 14 et 15 relèvent du RPSN; et les étapes 7, 8, 9 et 12 font partie du processus relatif à la LDO.
7.3 Processus 3 : l’évaluation de la demande aboutit à une décision négative
Ce ne sont pas toutes les présentations de modification qui seront réussies. Le processus 3 décrit les étapes qui suivront si le demandeur n’a pas réussi à démontrer à Santé Canada dans la PDN ou le SPDN que
- le produit satisfait aux exigences d’innocuité, d’efficacité et de qualité; et/ou
- les principes et facteurs de la LDO ne s’appliquent pas au produit.
Processus 3 :
- Si le demandeur ne réussit pas à démontrer ce qui précède, Santé Canada émet un avis d’insuffisance (AI) ou un ANC.
- Le demandeur répond à l’AI/ANC ou retire sa demande.
- Si le demandeur répond, Santé Canada évalue la réponse.
- Si la réponse ne règle pas les problèmes de façon satisfaisante, Santé Canada délivre un avis d’insuffisance-retrait (AI-R) ou un avis de non-conformité-retrait (ANC-R). Il n’y a aucun changement à apporter à la LDO.
- Si la réponse règle les problèmes de façon satisfaisante, le processus de modification (tel que décrit dans le processus 1 pour les présentations de modifications réussies de médicament sur ordonnance à MVSO ou le processus 2 pour les présentations de modifications réussies de médicament sur ordonnance à PSN) se poursuivra.
Pour plus d’informations sur les AI, ANC, AI-R et ANC-R, veuillez consulter la ligne directrice « Gestion des présentations et des demandes de drogues ».
Voici d’autres exemples de cas où une modification peut échouer :
- Une présentation (PDN ou SPDN) incomplète
- Des objections importantes de la part des parties prenantes sont soulevées au cours de la consultation sur la LDO et ne peuvent être traitées de manière appropriée par ailleurs (par exemple, des données supplémentaires démontrant de nouvelles préoccupations en matière d’innocuité/la nécessité d’une surveillance par le praticien)
- Une DLMM incomplète ou un manquement aux exigences du RPSN dans la deuxième partie du processus de modification de médicament sur ordonnance à PSN
Organigramme 3 : évaluation d’une demande menant à une décision négative
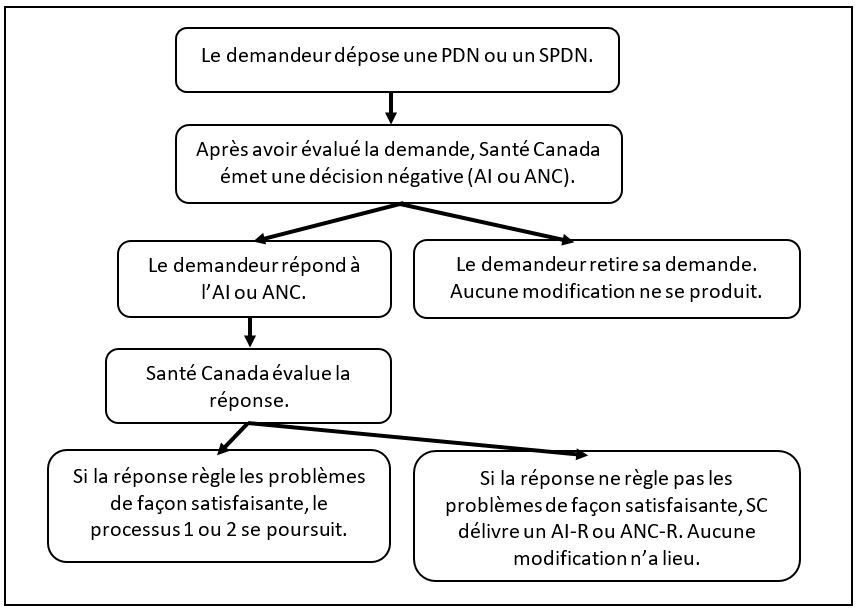
Équivalent textuel
Les étapes décrites au début de la section 7.3 sont illustrées dans un diagramme.
8. Demande d’une réunion préalable à la présentation
Avant de déposer une PDN ou un SPDN, le demandeur est fortement encouragé à demander une réunion préalable à la présentation avec Santé Canada afin de discuter des questions que le demandeur a liées à la pertinence de ses données probantes à l’appui de la modification proposée. Par exemple, avant d’entreprendre des essais cliniques ou des études d’utilisation des consommateurs, le demandeur devrait rencontrer Santé Canada. Notez qu’il est possible pour une entreprise d’avoir plus d’une réunion préalable à la présentation.
Pour obtenir des renseignements sur les réunions préalables à la présentation d’une PDN ou d’un SPDN, le demandeur devrait consulter la section 7 de la ligne directrice « Gestion des présentations et des demandes de drogues ».
| Type de modification : | À la réunion préalable à la présentation, le demandeur rencontrera : |
|---|---|
Modifications de médicament sur ordonnance à PSN |
|
Modifications de médicament sur ordonnance à MVSO |
|
9. Assemblage de PDN ou SPDN (toutes les modifications)
Type de présentation
Le demandeur assemble le dossier de PDN ou de SPDN demandant la modification. Le type de présentation requis dépend de la situation.
Situations nécessitant une PDN
- Si la modification proposée concerne un médicament sur ordonnance du « titre 1 » actuellement autorisé, le demandeur dépose une PDN relative au produit proposé comme produit sans ordonnance, car ce changement représente une modification des conditions d’utilisation (c’est-à-dire, dans un contexte de vente sans ordonnance / sans la surveillance d’un praticien) conformément à l’article C.08.002 du RAD.
- S’il n’y a pas de médicament sur ordonnance actuellement autorisé, le demandeur dépose une PDN conformément à l’article C.08.002 du RAD.
- Si la modification proposée a pour conséquence que :
- le médicament sur ordonnance du « titre 8 » actuellement autorisé du demandeur devient un PSN ou un MVSO avec des modifications aux conditions d’utilisation par rapport à celles qui sont autorisées pour le médicament sur ordonnance; et
- le médicament sur ordonnance reste sur le marché pour certaines de ses autres conditions d’utilisation,
le demandeur dépose une PDN, conformément à l’article C.08.002 du RAD, par rapport au produit proposé comme produit sans ordonnance, car il s’agira d’un produit supplémentaire introduit sur le marché. De cette façon, les modifications futures du produit sans ordonnance peuvent être suivies en fonction de la nouvelle autorisation, séparément de l’autorisation du médicament sur ordonnance. (Notez que si la présentation de modification devait réussir, le demandeur dépose également un SPDN relatif à son médicament sur ordonnance actuellement autorisé afin de refléter le retrait de certaines de ses conditions d’utilisation.)
Situations nécessitant un SPDN
- Si la modification proposée a pour conséquence que :
- le médicament sur ordonnance de « titre 8 » actuellement autorisé du demandeur devient un PSN ou une MVSO, avec ou sans modification des conditions d’utilisation; et
- le médicament sur ordonnance n’existe plus sur le marché,
le demandeur dépose un SPDN, conformément à l’article C.08.003 du RAD.
Contenu de la demande
Dans la PDN ou le SPDN, le demandeur inclut le contenu suivant :
- les informations nécessaires sur l’innocuité, l’efficacité et la qualité du produit proposé
- l’évaluation du demandeur des principes et des facteurs de la LDO
- l’étiquetage proposé
9.1 Données probantes sur l’innocuité, l’efficacité et la qualité
Pour les modifications de médicament sur ordonnance à PSN ou MVSO, le demandeur dépose une PDN ou un SPDN dans lequel il fournit les données probantes démontrant l’innocuité, l’efficacité et la qualité du produit proposé. La quantité de données probantes dépendra du type de modification proposé par le demandeur, comme indiqué ci-dessous.
9.1.1 Le demandeur propose une modification d’un médicament sur ordonnance autorisé, sans modification
En général, dans ce type de modification, l’innocuité, l’efficacité et la qualité du produit ont déjà été démontrées dans les présentations pour le médicament sur ordonnance autorisé. Par conséquent, le demandeur présente généralement moins de données probantes que pour d’autres types de modifications. (La seule condition d’utilisation qui change est le contexte dans lequel le produit est vendu.)
Au minimum, le demandeur fournit les éléments suivants :
- la plus récente monographie de produit ou information posologique autorisée par Santé Canada pour le médicament sur ordonnance, ainsi qu’une version annotée des changements proposés
- toute information disponible après la mise sur le marché
- toute donnée d’essai clinique plus récente, si elle est disponible, portant sur l’innocuité du médicament dans des conditions d’utilisation semblables, ainsi que les aperçus/sommaires cliniques et non cliniques appropriés
- les études d’utilisation des consommateurs
9.1.2 Le demandeur propose la modification d’un médicament sur ordonnance autorisé qui inclut des modifications de ses conditions d’utilisation
Les conditions d’utilisation d’un médicament sur ordonnance autorisé sont précisées dans la monographie du produit ou dans les renseignements pour le professionnel de la santé. Si le demandeur propose des modifications des conditions d’utilisation dans le cadre de la modification, des données probantes supplémentaires seront requises. Des exemples de la façon dont le PSN ou le MVSO proposé pourrait différer du médicament autorisé sur ordonnance comprennent des changements à l’indication, à la dose maximale unique ou quotidienne, à la force de l’unité posologique, à la voie d’administration, à la forme posologique, à la fabrication, à la formulation et à la population cible.
La nature des modifications apportées au produit et les conditions d’utilisation détermineront les données probantes requises. Le cas échéant, le demandeur peut s’appuyer sur les données déjà présentées à Santé Canada pour le médicament sur ordonnance autorisé.
Le demandeur est encouragé à demander conseil à la DPSNSO pour les modifications de médicament sur ordonnance à MVSO et au bureau d’examen de la DPT concerné pour les modifications de médicament sur ordonnance à PSN concernant la nécessité et la portée des données qui seraient requises.
9.1.3 Le demandeur propose une modification et ne possède pas de médicament sur ordonnance autorisé connexe
Dans ces cas, le demandeur fournit un ensemble complet de données pour démontrer l’innocuité, l’efficacité et la qualité du produit proposé.
9.1.4 Données périmées
Les demandeurs devraient savoir que s’ils s’appuient dans leur demande sur des études d’innocuité, d’efficacité ou de qualité qui ont été générées par des enquêtes qui ne répondent pas aux normes actuelles d’évaluation de l’innocuité, de l’efficacité ou de la qualité, des données supplémentaires peuvent être requises. Les demandeurs sont encouragés à discuter de ce type de problème avec Santé Canada à une réunion préalable à la présentation.
9.1.5 Informations supplémentaires
Pour plus d’informations sur les données probantes d’innocuité, d’efficacité et de qualité requises, le demandeur devrait consulter :
- les lignes directrices applicables qui sont disponibles sur le site Web « Lignes directrices – Demandes et présentations – Médicaments »
- Santé Canada (par exemple, à une réunion préalable à la présentation)
- les sections 9.1.1 à 9.1.4 du présent document
9.2 Évaluation des principes et des facteurs de la LDO
Le demandeur suit les conseils fournis aux annexes B, C et D pour compléter leur Évaluation des principes and des facteurs de la LDO. C'est l'un des éléments clés pour le succès d'une présentation de modification. Le modèle du document d’évaluation se trouve à l’annexe E. Le demandeur inclut l’évaluation complétée dans la PDN ou le SPDN.
9.3 Étiquetage en vue de l’inclusion dans la PDN ou le SPDN
Pour les modifications de médicament sur ordonnance à PSN et de médicament sur ordonnance à MVSO, le demandeur suit toutes les exigences concernant l’étiquetage des MVSO lorsqu’il prépare les étiquettes à inclure dans la PDN ou le SPDN.
Le demandeur peut consulter le site Web du gouvernement du Canada pour obtenir des lignes directrices pertinentes sur l’étiquetage.
Comme indiqué à l’annexe C, le demandeur mène ses études d’utilisation des consommateurs en utilisant une étiquette qui reflète étroitement l’étiquette définitive que les consommateurs verront sur le marché. Cela permettra d’atteindre l’objectif consistant à faire en sorte que les données issues des études d’utilisation des consommateurs reflètent avec précision la manière dont les consommateurs seront en mesure de comprendre et d’appliquer les informations de l’étiquetage « définitif ».
Pour les modifications de médicament sur ordonnance à MVSO, l’étiquetage doit inclure un Tableau canadien d’information sur les médicaments (TCIM). Pour des informations sur les formats et les flexibilités du TCIM, le demandeur peut consulter la ligne directrice « Les exigences d’étiquetage pour les médicaments vendus sans ordonnance ».
Pour les modifications de médicament sur ordonnance à PSN, le demandeur a deux options :
- Le demandeur peut utiliser l’étiquetage avec un tableau d’information sur le produit ou un tableau d'information sur les médicaments dans ses études d’utilisation des consommateurs et pour l’inclusion dans la PDN ou le SPDN, si ce tableau doit figurer sur l’étiquette définitive du PSN.
- Le demandeur peut utiliser l’étiquetage sans tableau d’information sur le produit ou tableau d’information sur les médicaments dans ses études sur d’utilisation des consommateurs et pour la PDN ou le SPDN, si le demandeur n’a pas l’intention d’inclure un tableau d'information sur l’étiquette définitive du PSN.
10. Formatage et dépôt d’une PDN ou d’un SPDN (toutes les modifications)
En ce qui concerne la forme de la présentation, le demandeur suit les instructions de la section 8 de « Gestion des présentations et des demandes de drogues » ainsi que les lignes directrices qui y sont référencées. En outre, le demandeur inclut l’Évaluation des principes et des facteurs de la LDO dans le module 1.0.7, les études d’utilisation des consommateurs dans le module 5 et le résumé des études d’utilisation des consommateurs dans le module 2.
Si un médicament sur ordonnance autorisé fait l’objet d’une modification et qu’il a été autorisé à la suite d’une présentation sur papier, Santé Canada encourage le demandeur à présenter à nouveau les données probantes relatives à l’autorisation du médicament sur ordonnance sous forme électronique afin d’accélérer l’examen.
Les informations sur les procédures de dépôt des demandes figurent dans le document d’orientation « Gestion des présentations et des demandes de drogues ».
11. Payer les frais (toutes les modifications)
Tous les demandeurs paient les frais de recouvrement des coûts pour l’évaluation des informations présentées à l’appui de leur PDN ou SPDN. Notez que c’est le contenu de la PDN et du SPDN qui détermine le montant des frais et la norme de rendement associée, et non le fait qu’il s’agisse d’une PDN ou d’un SPDN. Par exemple, en 2021, la redevance était de 224 242 $ pour une modification qui nécessitait des données cliniques ou non cliniques ainsi que des données sur la chimie et la fabrication et qui n’incluait pas de substance active nouvelle. Les frais pertinents pour l’évaluation des produits se trouvent à l’annexe 1 de l’« Arrêté sur les prix à payer à l’égard des drogues et instruments médicaux », DORS/2019-124.
Pour de plus amples informations sur les frais, veuillez consulter la ligne directrice intitulée « Les frais d’évaluation des médicaments à usage humain et des désinfectants assimilés à une drogue ». Notez qu’en haut de ce site Web, le demandeur trouvera des liens (les encadrés) vers d’autres sections du document qui fournissent des informations sur les catégories de frais et les mesures d’atténuation des frais.
12. Santé Canada évalue la PDN ou le SPDN
Santé Canada évalue la PDN ou le SPDN, y compris l’Évaluation des principes and des facteurs de la LDO du demandeur, afin de déterminer si le demandeur a réussi à démontrer que :
- le produit répond aux exigences d’innocuité, d’efficacité et de qualité du RAD pour l’autorisation du produit; et
- les principes et facteurs de la LDO ne s’appliquent pas au produit.
Plus précisément, les agents d’évaluation des MVSO de la DPSNSO évaluent les PDN ou les SPDN pour les modifications de médicament sur ordonnance à MVSO et les agents d’évaluation des bureaux pertinents de la DPT évaluent les PDN ou les SPDN pour les modifications de médicament sur ordonnance à PSN.
Les normes de rendement pour l’évaluation de la PDN ou du SPDN dans le cadre du RAD sont indiquées à l’annexe 3 de la ligne directrice « Gestion des présentations et des demandes de drogues ».
13. Santé Canada consulte le public
Si l’évaluation décrite à la section 12 aboutit à une conclusion positive, Santé Canada lance le processus de modification de la LDO.
Vous trouverez de plus amples informations sur la LDO et le processus de modification de la LDO dans la ligne directrice intitulée « Questions et réponses - la Liste des drogues sur ordonnance ».
Pour les modifications, Santé Canada consulte le public et les autres parties prenantes sur les modifications de la LDO en publiant un « avis de consultation » sur le site Web canada.ca. Dans l’avis de consultation, Santé Canada donne les grandes lignes de la modification proposée pour retirer l’ingrédient médicinal ou retirer l’ingrédient pour certaines conditions d’utilisation de la LDO. Dans le second scénario, par exemple, un ingrédient médicinal peut être retiré de la LDO pour certaines indications seulement ou à des doses plus faibles.
Au même moment, Santé Canada place la PDN ou le SPDN en « suspension liée au changement de statut de vente » (c’est-à-dire une pause temporaire dans la progression de la présentation) en attendant le résultat de la consultation et du processus de modification de la LDO.
Après la consultation publique, Santé Canada analyse les commentaires reçus. Selon la nature des commentaires et les questions soulevées, l’analyse pourrait amener Santé Canada à décider de :
- procéder à la modification proposée;
- changer la modification proposée; ou
- ne pas poursuivre la modification proposée.
Si les résultats de l’analyse permettent d’aller de l’avant, l’étape suivante sera la publication d’un avis d’intention de modification.
Si la proposition doit être modifiée, Santé Canada poursuit le processus de modification de la LDO avec une version modifiée de la modification proposée ou mène une nouvelle consultation selon la nature de la modification. Par le passé, les modifications allaient de changements mineurs dans la formulation du qualificatif à un remaniement important de la proposition. Santé Canada communique ces plans au demandeur avant de publier l’avis d’intention de modification ou le nouvel avis de consultation.
Si, à la suite de l’analyse, Santé Canada décide de ne pas poursuivre la modification, il communique avec le demandeur et émet un avis au public indiquant que Santé Canada ne modifiera pas la LDO.
14. Santé Canada annonce son intention de modifier la LDO
Lorsque l’analyse des commentaires de la consultation amène Santé Canada à passer à l’étape suivante du processus lié à la LDO, le Ministère affiche un « avis d’intention de modification ». Cet avis précise la date à laquelle la modification de la LDO interviendra, généralement après une période de transition minimale de six mois. La période de transition est conforme à l’accord international sur les obstacles techniques au commerce (OTC) et donne aux détenteurs d’autorisations de mise en marché des autres produits concernés le temps de se conformer aux nouvelles exigences réglementaires à venir (par exemple, revoir l’étiquetage).
15. Santé Canada émet une DIN (modifications de médicament sur ordonnance à MVSO seulement)
Après l’affichage de l’avis d’intention de modifier la LDO, Santé Canada émet au demandeur un formulaire de déclaration des médicaments (FDM) avec la DIN attribuée, le cas échéant. Une nouvelle DIN est requise avec l’AC, si l’une des situations suivantes s’applique :
- Une DIN n’a pas été attribuée précédemment au produit.
- Le demandeur sollicite la modification pour certaines conditions d’utilisation du médicament sur ordonnance, de sorte qu’après la modification, il y aura à la fois le médicament sur ordonnance et le MVSO sur le marché. La nouvelle DIN serait relative au nouveau MVSO.
- Une DIN était déjà attribuée, mais la modification change une ou plusieurs des caractéristiques du médicament énumérées aux paragraphes C.01.014.1(2)(a) à (f) du RAD et après la modification, il n’y aura que le MVSO sur le marché.
En ce qui concerne la dernière situation, notez que le demandeur présente un « avis de cessation de la vente » à Santé Canada pour la DIN attribuée précédemment. La notification doit être envoyée dans les 30 jours suivant la cessation de la vente. Santé Canada annule alors la DIN attribuée précédemment.
16. Dépôt d’une demande de licence de mise en marché (modifications de médicament sur ordonnance à PSN seulement)
Après que Santé Canada a affiché l’avis d’intention de modification, le demandeur dépose une deuxième demande. Cette fois, le demandeur présente une demande de licence de mise en marché (formulaire Web de DLMM) pour obtenir une licence de mise en marché et le NPN. Ce dépôt peut avoir lieu pendant ou après la période de transition, car Santé Canada est disposé à envisager la DLMM avant de modifier la LDO, mais les décisions ne seront prises dans le cadre du RPSN qu’après la modification de la LDO.
Le demandeur dépose un formulaire Web de DLMM comme indiqué dans la « Politique de gestion des demandes d’homologation de produits de santé naturels ». Il n’y a pas de frais pour l’évaluation de la DLMM.
Le demandeur complète le formulaire Web de DLMM en saisissant avec exactitude les informations de l’étiquetage mis au point au cours de l’évaluation de la PDN ou du SPDN. Notez que l’étiquetage inclut la monographie du produit. En outre, le demandeur indique dans la lettre d’accompagnement du formulaire Web de DLMM que « les données probantes à l’appui de la licence de mise en marché d’un PSN sont contenues dans le numéro de contrôle de la présentation de modification [insérer le numéro de contrôle attribué à la PDN ou au SPDN] ». Le demandeur n’a pas besoin de présenter à nouveau les données probantes qui ont été présentées dans le cadre de la PDN ou du SPDN ni l’Évaluation des principes et des facteurs de la LDO.
17. Santé Canada vérifie la DLMM
La DPSNSO de Santé Canada vérifie le formulaire Web de DLMM. Si le demandeur fait tout ce qui suit :
- fait sa demande dans les 60 jours suivant la publication de l’avis d’intention de modification;
- reflète de façon appropriée l’étiquetage définitif de la PDN ou du SPDN dans le formulaire Web de DLMM; et
- respecte toutes les exigences du RPSN,
la DPSNSO peut alors délivrer la licence de mise en marché et le NPN lorsque la LDO est modifiée. Un demandeur qui présente le formulaire Web de DLMM à une date ultérieure peut ne pas recevoir son NPN avant un certain temps après la modification de la LDO.
18. Santé Canada modifie la LDO et délivre l’autorisation du produit
Une fois la période de transition terminée, Santé Canada modifie la LDO et publie l’« avis de modification » sur le site Web canada.ca pour annoncer que la modification de la LDO a eu lieu.
18.1 Modifications de médicament sur ordonnance à MVSO
À ce moment-là, Santé Canada délivre au demandeur un AC pour le MVSO.
18.2 Modifications de médicament sur ordonnance à PSN
À ce moment-là, Santé Canada délivre un ANC à l’égard de la PDN ou du SPDN en suspension et, le cas échéant, annule le ou les DIN parce que le produit n’est plus une drogue réglementée par le RAD (voir le paragraphe C.01.014.6 (1) (c) du RAD). Il s’agit désormais d’un produit soumis au RPSN.
Le demandeur a alors la possibilité de retirer sa demande ou de répondre à l’ANC en reconnaissant que le produit n’est plus un médicament au sens du RAD. Dans ce dernier cas, après avoir reçu une réponse à l’ANC, Santé Canada délivre l’ANC-R réitérant que le produit n’est plus un médicament en vertu du RAD.
De plus, si toutes les conditions énoncées à la section 17 de la présente ligne directrice sont remplies, Santé Canada délivre une licence de mise en marché et un NPN pour le PSN proposé.
Détails de la page
- Date de modification :