Élaboration d’une stratégie nationale sur les médicaments onéreux pour le traitement des maladies rares : Un document de travail pour solliciter la participation des Canadiens
TABLE DES MATIÈRES
Télécharger le format de rechange
(834 KB, 18 pages)
- Qu'est-ce qu'une maladie rare?
- De quelle manière accède-t-on aux médicaments pour le traitement des maladies rares et comment sont-ils payés?
- Pourquoi les médicaments pour le traitement des maladies rares sont-ils si chers?
- Comment les régimes d'assurance-médicaments publics et privés décident-ils des médicaments à couvrir?
- Pourquoi avons-nous besoin d'une stratégie nationale sur les médicaments onéreux pour le traitement des maladies rares?
- Trois enjeux clés pour l'élaboration d'une stratégie nationale :
- Comment améliorer l'accès des patients aux médicaments onéreux pour le traitement des maladies rares et garantir un accès cohérent partout au pays.
- Comment faire en sorte que les décisions relatives à la couverture des médicaments onéreux pour le traitement des maladies rares soient fondées sur les meilleures preuves disponibles.
- Comment garantir que les dépenses en médicaments onéreux pour le traitement des maladies rares ne mettent pas de pression sur la viabilité du système de santé canadien.
- Prochaines étapes : Solliciter la participation des Canadiens à contribuer à l'élaboration d'une stratégie nationale
Qu'est-ce qu'une maladie rare?
De temps en temps, vous entendez une histoire personnelle, ou voyez un article aux nouvelles, sur une personne vivant avec une maladie rare. Le patient de ce récit est souvent un enfant, même un nourrisson, mais les gens peuvent être touchés à tout âge. La maladie elle-même est peu connue de la plupart des gens, même si l'histoire ne l'est pas : il existe un médicament qui pourrait sauver la vie du patient ou améliorer considérablement sa qualité de vie, mais il coûte des centaines de milliers de dollars, parfois des millions, et n'est pas couvert par l'assurance-maladie. La famille ne peut pas se le permettre.
Les maladies rares ne sont pas rares en tant que groupe : on estime qu'il y en a entre 6 000 et 8 000 dans le monde.Footnote 1 Elles sont considérées comme rares parce qu'elles touchent chacune un petit nombre de personnes, allant d'une poignée d'individus à quelques milliers.
Les maladies rares sont souvent chroniques, peuvent être gravement débilitantes et peuvent mettre la vie en danger. Il n'existe pas de définition commune acceptée au niveau international ou même national, de ce qu'est une maladie rare. Au Canada, l'organisation Canadienne des maladies rares définit une maladie rare comme une maladie qui touche moins d'une personne sur 2 000Footnote 2 , ce qui est également le chiffre utilisé par l'Union européenne.Footnote 3 Les Instituts nationaux de la santé et des services sociaux des États-Unis définissent une maladie rare comme toute affection qui touche moins de 200 000 personnes aux États-Unis.Footnote 4 En raison de cette absence de définition et de la difficulté d'obtenir un bon diagnostic, il est difficile de dire combien de personnes au Canada vivent avec une maladie rare. Les estimations varient considérablement; une estimation est qu'un Canadien sur 12 vit avec une maladie rareFootnote 1, tandis qu'une autre évalue le nombre total à un million de personnes.Footnote 5
Même en l'absence d'une définition largement acceptée, les maladies rares ont plusieurs choses en commun :
- Environ 80 % des maladies rares ont une base génétique.
- Environ la moitié des personnes atteintes de maladies rares sont des enfants dont la maladie est reconnue par un dépistage prénatal, à la naissance ou peu après.
- De nombreux enfants atteints de maladies rares meurent avant leur premier anniversaire.
- Les personnes atteintes de maladies rares dépendent souvent de nombreux soins médicaux et peuvent avoir une espérance de vie limitée.
De quelle manière accède-t-on aux médicaments onéreux pour le traitement des maladies rares et comment sont-ils payés?
Le fait d'avoir accès en temps utile à des traitements sûrs et efficaces peut améliorer considérablement la santé et la qualité de vie globale d'une personne atteinte d'une maladie rare. Dans certains cas, cela peut même faire la différence entre la vie et la mort. À l'heure actuelle, les Canadiens atteints de maladies rares peuvent avoir accès aux médicaments dont ils ont besoin de plusieurs façons :
- Par le biais des régimes d'assurance-médicaments publics : Ceux-ci ont tendance à se concentrer sur la couverture de certaines populations, telles que les aînés, les personnes bénéficiant de l'aide sociale ou les personnes souffrant de maladies spécifiques.
- Par le biais de régimes d'assurance-médicaments privés : La majorité d'entre eux sont des régimes d'employeur, bien qu'il soit possible pour les particuliers de payer une assurance-médicaments privée. L'assurance privée peut limiter le montant couvert pour un médicament particulier chaque année ou pendant la vie d'un patient.
- En payant de sa poche : Les médicaments pour le traitement des maladies rares étant si chers, les patients ne peuvent généralement pas se permettre de payer de leur poche. Certains s'en sortent grâce à des collectes de fonds auprès de la communauté.
- Par le biais d'un programme de soutien aux patients : Ces programmes peuvent être offerts par les compagnies pharmaceutiques sur une base compassionnelle pour permettre l'accès à un médicament dans les cas où il n'est pas couvert par les régimes d'assurance-médicaments publics ou privés.
- En s'inscrivant à un essai clinique ou par le biais du Programme d'accès spécial de Santé Canada : Les essais cliniques et le Programme d'accès spécial donnent accès à des médicaments qui sont encore en cours de développement ou dont la vente n'est pas encore autorisée au Canada.
Pourquoi les médicaments pour le traitement des maladies rares sont-ils si chers?
Il n'existe que peu ou pas de traitements pour les maladies rares. Lorsque des traitements sont disponibles, ils ont tendance à être extrêmement onéreux, allant de 100 000 $ à plus de 2 millions de dollars par patient et par an, souvent à vie. En 2019, plus de la moitié (56 %) de tous les médicaments onéreux pour le traitement des maladies rares disponibles au Canada coûtaient plus de 200 000 $ par patient et par an. Au cours des cinq dernières années, le nombre de médicaments onéreux sur le marché qui coûtent plus de 200 000 $ par an a augmenté : en 2015 et 2016, 36 % des médicaments onéreux approuvés au Canada coûtaient plus de 200 000 $ par an; en 2017, ce pourcentage était de 55 %, en 2018, de 82 % et de 73 % en 2019.Footnote 6 Ce défi n'est pas unique au Canada, car tous les pays paient des prix extrêmement élevés pour les médicaments destinés à soigner les maladies rares.
Un certain nombre de raisons ont été avancées pour expliquer le coût élevé de ces médicaments, notamment la petite taille du marché, les coûts élevés de la recherche et du développement et les options de traitement limitées. Toutefois, il n'existe pas d'informations claires sur le coût de la mise sur le marché et le prix des médicaments, bien que certaines recherches indiquent que ces coûts sont inférieurs pour les médicaments pour le traitement des maladies rares par rapport aux coûts des médicaments classiques.Footnote 7
Comment les régimes d'assurance-médicaments publics et privés décident-ils des médicaments à couvrir?
Avant qu'un médicament ne soit autorisé à être vendu au Canada, il doit être évalué par Santé Canada, afin de s'assurer qu'il répond à des normes élevées de sécurité, d'efficacité et de qualité.Footnote 8 Santé Canada travaille avec les fabricants de produits pharmaceutiques et ses partenaires réglementaires pour simplifier les processus réglementaires, améliorer les objectifs de rendement et adopter de nouvelles voies réglementaires souples pour les nouvelles technologies. Ces efforts visent à garantir que des médicaments tels que les médicaments orphelins puissent être mis sur le marché canadien plus rapidement.
Une fois qu'un médicament est autorisé par Santé Canada, il peut être vendu et acheté, et les régimes d'assurance-médicaments publics et privés peuvent décider s'ils couvriront le médicament pour leurs membres. Chaque régime d'assurance-médicaments public ou privé décide pour lui-même s'il paiera le médicament pour ses membres, et sous quelles conditions.
Le Conseil d'examen du prix des médicaments brevetés (CEPMB), un organisme de réglementation, joue un rôle dans l'établissement des prix des médicaments vendus au Canada lorsqu'il évalue indépendamment les prix pour déterminer si les Canadiens sont soumis à des prix excessifs.
La figure 1 illustre les principales étapes et les principaux acteurs dans le choix des médicaments couverts au Canada et la manière dont ils sont couverts.
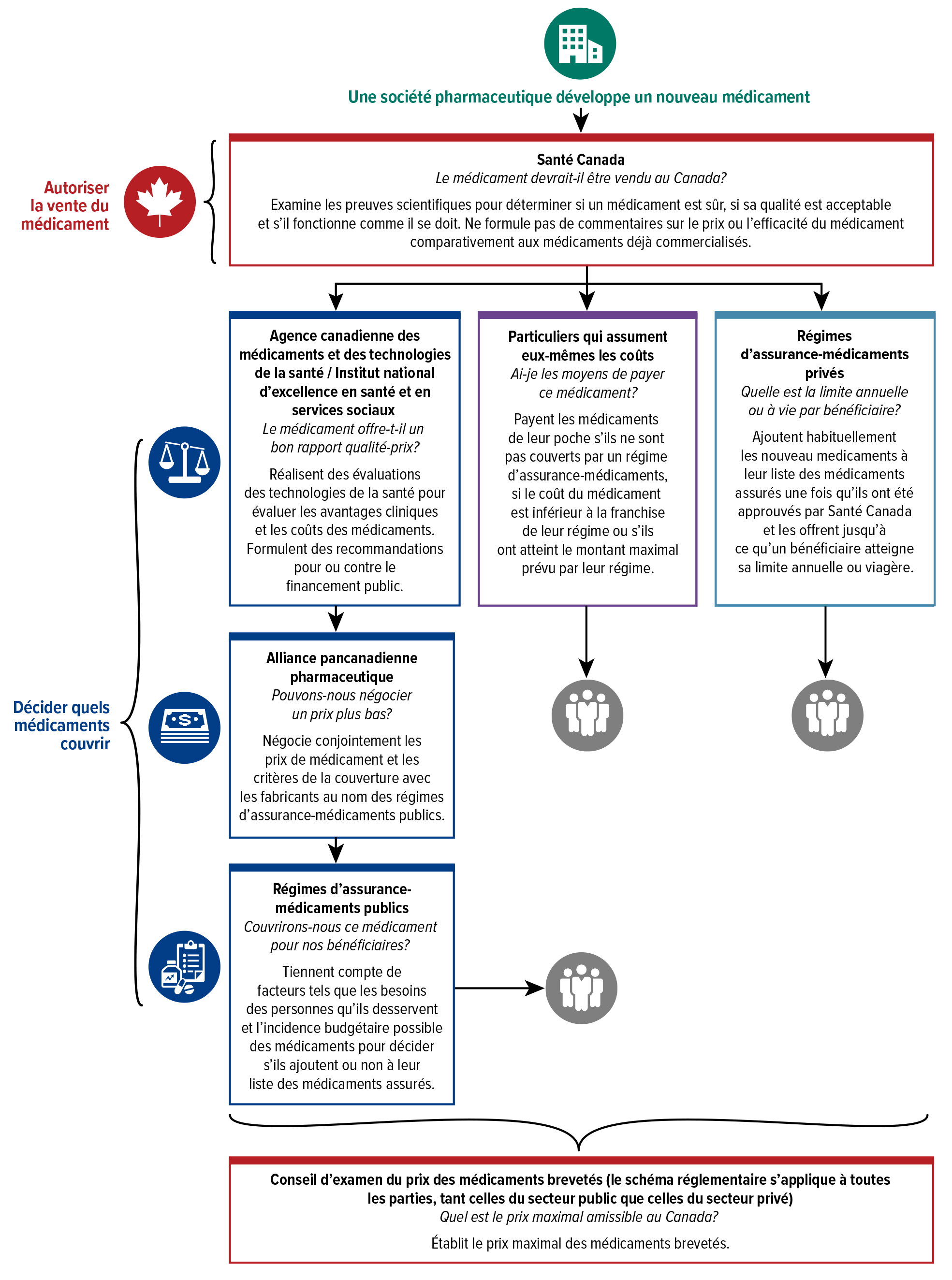
Figure 1 : Principales étapes et intervenants clés au Canada qui décident de la façon dont les médicaments sont couverts
Avant d’autoriser la vente d’un médicament au Canada, Santé Canada doit l’évaluer afin de s’assurer qu’il répond à des normes élevées d’innocuité, d’efficacité et de qualité . Toutefois, chaque régime d’assurance-médicaments public ou privé décide lui-même s’il paiera le médicament pour ses membres et sous quelles conditions. Les régimes publics d’assurance-médicaments (et certains régimes privés) le font en s’appuyant sur l’expertise d’organismes d’évaluation des technologies de la santé, comme l’Agence canadienne des médicaments et des technologies de la santé (ACMTS), l’Institut national d’excellence en santé et services sociaux (INESSS), et parfois en faisant appel à des comités d’experts provinciaux. Ces processus d’examen complexes peuvent durer plusieurs années; afin d’accélérer l’accès aux nouveaux médicaments, Santé Canada travaille à la rationalisation de ses processus de réglementation en améliorant le rendement pour atteindre les objectifs fixés. De nouvelles voies réglementaires agiles sont également en cours d’élaboration pour les nouvelles technologies. Par exemple, au cours des deux dernières années, Santé Canada a travaillé à l’harmonisation de ses processus d’examen avec les organismes d’évaluation des technologies de la santé. Il incombe à l’Alliance pancanadienne pharmaceutique (APP) de négocier le prix et les modalités de la couverture du médicament avec le fabricant au nom des régimes publics d’assurance-médicaments. Le Conseil d’examen du prix des médicaments brevetés (CEPMB), un organisme de réglementation, joue également un rôle dans l’établissement des prix – mais seulement après la commercialisation des médicaments – en évaluant de façon indépendante les prix des médicaments brevetés afin de déterminer si les Canadiens se voient imposer des prix excessifs. Une fois les négociations terminées, les régimes publics d’assurance-médicaments fédéraux, provinciaux et territoriaux prennent leurs propres décisions quant à la façon de payer le médicament, y compris l’établissement des conditions d’utilisation (par exemple, parfois, un médecin doit fournir des renseignements cliniques supplémentaires au gouvernement pour autoriser la couverture d’un patient). Plutôt que d’accorder l’approbation générale d’un médicament onéreux pour le traitement d’une maladie rare, les régimes peuvent examiner le cas de chaque patient. Les régimes privés d’assurance-médicaments prennent également leurs propres décisions en ce qui a trait aux médicaments qu’ils couvrent. Ces décisions peuvent différer des régimes publics d’assurance-médicaments et d’autres régimes privés, selon les clients servis et les commanditaires des régimes (soit généralement les employeurs). Dans le cas où un patient pourrait bénéficier d’un médicament non autorisé à la vente au Canada, les médecins peuvent présenter une demande au Programme d’accès spécial de Santé Canada. Le programme permet aux médecins d’avoir accès à des médicaments non commercialisés au Canada (mais qui sont approuvés dans d’autres administrations) pour traiter des patients atteints d’affections sérieuses ou mettant leur vie en danger quand les thérapies classiques n’ont pas réussi, sont inappropriées ou ne sont pas offertes au pays. Dans le cadre du programme, le fabricant détermine le coût du médicament. Dans certains cas, les médicaments sont gratuits; s’il y a des frais, ils sont couverts soit par des assureurs publics ou privés, soit, dans certains cas, par les patients ou leur famille.
Régimes d'assurance-médicaments publics
Il existe plus de 100 régimes d'assurance-médicaments gérés par les gouvernements fédéral, provinciaux et territoriaux, qui visent à améliorer l'accès aux médicaments sur ordonnance, principalement pour les personnes qui, autrement, ne pourraient pas se les payer. Chaque régime est différent, mais adapté à des groupes spécifiques tels que les aînés, les enfants, les personnes à faibles revenus ou les personnes souffrant de graves problèmes de santé.Footnote 9 Chaque province et territoire dispose de son propre régime d'assurance-médicaments public qui couvre des populations définies. Le gouvernement fédéral administre également des régimes d'assurance-médicaments pour diverses populations, notamment les Premières Nations inscrites et les populations inuites reconnues, les détenus fédéraux, les membres des Forces canadiennes, les anciens combattants, les réfugiés réinstallés et les demandeurs d'asile.
Les régimes d'assurance-médicaments publics prennent des décisions concernant la couverture en s'appuyant sur les conseils d'experts d'organismes tels que l'Agence canadienne des médicaments et des technologies de la santé (ACMTS) , l'Institut national d'excellence en santé et services sociaux (INESSS) et parfois de comités d'experts provinciaux. Ces organisations évaluent le bon fonctionnement d'un médicament (ou d'un dispositif) et son rapport coût-efficacité. Ils peuvent également se pencher sur « les répercussions éthiques, juridiques et sociales de technologies de la santé sur la santé des patients et le système de santé. »Footnote 10 Ces processus d'examen complexes peuvent prendre plusieurs années, ce qui est préoccupant pour les patients qui cherchent un traitement. Pour accélérer l'accès aux nouveaux médicaments, Santé Canada collabore avec l'ACMTS et l'INESSS afin d'effectuer des examens alignés des nouveaux médicaments simultanément plutôt que de façon séquentielle. Une fois que l'ACMTS et l'INESSS ont formulé leurs recommandations, les régimes d'assurance-médicaments publics les examinent et décident si un médicament doit être couvert et dans quelles conditions.
Si les régimes d'assurance-médicaments publics décident de payer un médicament, l'Alliance pancanadienne pharmaceutique (APP) négocie le prix et les conditions de couverture du médicament avec le fabricant.
Une fois les évaluations et les négociations terminées, les régimes d'assurance-médicaments publics fédéraux, provinciaux et territoriaux prennent leurs décisions finales quant au paiement du médicament, y compris l'établissement des conditions de son utilisation (parfois, par exemple, un médecin doit fournir des informations cliniques supplémentaires pour que le gouvernement autorise la couverture d'un patient). Plutôt que de donner une approbation générale pour un médicament onéreux pour le traitement d'une maladie rare, les régimes peuvent examiner le cas de chaque patient individuellement.
Régimes d'assurance-médicaments privés
Les régimes d'assurance-médicaments privés prennent également leurs propres décisions quant aux médicaments qu'ils couvrent, qui peuvent être différentes de celles des régimes publics et des autres régimes privés, en fonction des clients desservis et des accords conclus avec les promoteurs de régime (qui sont généralement des employeurs).
Programme d'accès spécial
Dans le cas où un patient pourrait bénéficier d'un médicament dont la vente n'est pas autorisée au Canada, les médecins peuvent soumettre une demande au Programme d'accès spécial de Santé Canada.Footnote 11 Ce programme permet aux médecins de prescrire et d'avoir accès à des médicaments qui ne sont pas sur le marché au Canada (mais qui sont approuvés dans d'autres juridictions) pour traiter des patients souffrant de maladies graves ou mettant leur vie en danger lorsque d'autres thérapies ont échoué, ne conviennent pas ou ne sont pas disponibles au Canada. Dans le cadre de ce programme, le fabricant détermine le coût du médicament. Dans certains cas, les médicaments sont gratuits; s'il y a des frais, ils sont couverts par les régimes d'assurance-médicaments publics ou privés ou, dans certains cas, par les patients et leur famille.
Pourquoi avons-nous besoin d'une stratégie nationale sur les médicaments onéreux pour le traitement des maladies rares?
Les maladies rares peuvent causer beaucoup de souffrance aux personnes qui en sont atteintes et d'angoisse pour leurs familles. Pendant des générations, il n'existait pratiquement aucun traitement pour les maladies rares. Aujourd'hui encore, moins de 10 % des maladies rares bénéficient d'un traitement. Toutefois, les politiques visant à encourager la recherche sur les maladies rares et les avancées génétiques et biomédicales réalisées au cours des deux dernières décennies commencent à changer la donne, apportant de l'espoir aux patients et à leurs familles. En même temps, ces innovations soulèvent la question difficile des coûts pour les gouvernements et les assureurs privés, les chercheurs, les fabricants de produits pharmaceutiques et les autres intervenants.
Le principal défi est le coût élevé de la plupart des médicaments pour le traitement des maladies rares, qui, comme mentionné ci-dessus, peut se situer entre 100 000 $ et plus de deux millions de dollars par personne par année. Si les fabricants de produits pharmaceutiques prennent des risques en développant des thérapies innovantes pour le traitement des maladies rares et ont besoin d'un retour sur investissement, ces coûts dépassent largement ce que les patients ou leurs familles peuvent se permettre et ils exercent une pression importante sur les régimes d'assurance-médicaments publics et privés et sur le système de santé.
Une stratégie nationale sur les médicaments onéreux pour le traitement des maladies rares, avec des priorités et des processus convenus, aidera les patients à mieux accéder aux médicaments dont ils ont besoin. En consolidant les efforts, une stratégie devrait également permettre aux gouvernements et aux bailleurs de fonds de prendre des décisions plus opportunes concernant la couverture, de planifier plus efficacement et d'alléger la pression sur les régimes d'assurance-médicaments publics et privés et sur le système de santé dans tout le pays.
Un autre objectif important d'une stratégie nationale serait de promouvoir une plus grande collaboration entre les gouvernements fédéral, provinciaux et territoriaux sur le modèle des travaux de l'Alliance pancanadienne pharmaceutique, afin de réduire davantage les coûts et d'accroître l'accès. En prenant des décisions communes fondées sur des principes prédéterminés, les gouvernements pourraient renforcer leur pouvoir de négociation tout en simplifiant le processus permettant aux fabricants de produits pharmaceutiques de faire financer leurs produits par les régimes d'assurance-médicaments. Un processus commun de suivi et d'évaluation de l'impact réel des nouveaux médicaments donnerait aux gouvernements des informations qui les aideraient à déterminer si un médicament répond aux attentes. À plus long terme, une stratégie nationale pourrait stimuler la recherche innovante pour des percées dans les traitements des maladies rares.
Une collaboration plus étroite pourrait également améliorer la cohérence de l'accès aux médicaments pour traiter les maladies rares : si tous les bailleurs de fonds s'accordaient sur les médicaments à couvrir, les Canadiens s'inquiéteraient moins des différences d'accès en fonction de leur lieu de résidence et du type de régime d'assurance-médicaments dont ils disposent.
Un autre avantage d'une stratégie nationale pourrait être de relever certains des défis auxquels sont confrontés les traitements des maladies rares au fur et à mesure de leur mise au point, de la découverte à la recherche et au développement canadiens, à la traduction clinique et enfin à la commercialisation. Des actions telles que l'accroissement des connaissances et de l'expertise nationales, la collecte de preuves concrètes de l'effet des médicaments sur les patients une fois qu'ils sont utilisés, la facilitation du partage des données et des informations et le soutien aux chercheurs ou aux entreprises en phase de démarrage pour qu'ils développent et fabriquent leurs médicaments au Canada, pourraient améliorer considérablement l'accès et réduire les coûts.
Le Conseil consultatif sur la mise en œuvre d'un régime national d'assurance-médicamentsFootnote 9 (encadré 1) et le Comité permanent de la santé de la Chambre des communesFootnote 5 (encadré 2) ont tous deux récemment conclu qu'une nouvelle approche était nécessaire pour fournir et payer les médicaments onéreux pour le traitement des maladies rares, sur la base des appels lancés de longue date par les patients, les groupes de patients, les médecins, les chercheurs, les représentants de l'industrie et d'autres intervenants en faveur d'une manière différente de procéder. Une stratégie nationale constituera la base de ce changement.
Encadré 1 : Conseil consultatif sur la mise en œuvre d’un régime national d’assurance-médicaments
Annoncé dans le budget de 2018, le Conseil consultatif sur la mise en œuvre d’un régime national d’assurance-médicaments a mené un dialogue national sur la façon de mettre en place un régime national d’assurance-médicaments abordable au Canada. Le rapport final du Conseil a été remis en juin 2019 et comprend des recommandations pour le gouvernement canadien afin de développer une stratégie nationale formelle sur les médicaments onéreux pour le traitement des maladies rares et d’établir une voie distincte et un groupe d’experts national pour travailler avec les patients et leurs cliniciens pour déterminer quels médicaments contre les maladies rares devraient être financés pour quels patients.
Encadré 2 : Comité permanent de la santé
En 2018-2019, le Comité permanent de la santé a mené une étude sur les obstacles à l’accès aux traitements et aux médicaments pour les Canadiens atteints de maladies et de troubles rares. Le rapport final, qui a été présenté à la Chambre des communes en 2019, a reconnu que le principal obstacle limitant l’accès des patients à ces médicaments est leur prix. Le rapport contient 19 recommandations, dont des appels à la mise en place de processus et d’options coordonnés pour la couverture des coûts des médicaments pour le traitement des maladies rares.
Trois enjeux clés pour l'élaboration d'une stratégie nationale
Les dispositions visant à financer et à donner accès aux médicaments onéreux nécessitent une approche différente de celle des autres médicaments. Les médicaments pour le traitement des maladies rares ne constituent pas seulement une autre option de traitement. Pour de nombreuses personnes atteintes de maladies rares, un médicament peut être la seule option, qu'il offre une amélioration progressive de la qualité de vie ou qu'il sauve des vies. L'efficacité et les risques des médicaments pour traiter les maladies rares doivent être mis en balance avec leur prix élevé, qui absorbe une part croissante des budgets publics de santé. C'est pourquoi une stratégie nationale comportera inévitablement des considérations différentes de celles généralement associées aux nouveaux médicaments pour traiter des maladies pour lesquelles il existe un éventail d'options de traitement. La manière de juger du bénéfice pour les patients et le niveau de risque qu'il est raisonnable de prendre seront également différents.
Pour améliorer les chances de succès dans la recherche de traitements contre les maladies rares et pour évaluer au mieux leur sécurité et leur efficacité, il convient d'encourager le travail en collaboration et le partage des connaissances à tous les niveaux. Santé Canada, par exemple, entretient déjà de solides relations avec les organismes de réglementation internationaux et continuera à établir de nouveaux partenariats et accords de partage du travail. Les chercheurs, cliniciens et scientifiques canadiens pourraient travailler avec leurs collègues internationaux pour partager des données et mettre en commun les résultats de la recherche à différents stades du développement des médicaments; les gouvernements fédéral, provinciaux et territoriaux pourraient mettre en commun et coordonner leurs ressources et leurs investissements dans la biofabrication et la recherche et le développement, en plus de négocier ensemble pour renforcer leur pouvoir de négociation. Ces efforts visant à renforcer les capacités au Canada pour soutenir le développement de médicaments pour le traitement des maladies rares pourraient contribuer à stimuler l'innovation et à améliorer l'accès aux thérapies pour les maladies rares qui touchent les Canadiens. Il pourrait même être possible de collaborer avec d'autres pays afin de partager des informations non confidentielles et d'éclairer les négociations avec les fabricants de produits pharmaceutiques.
S'appuyer sur les efforts existants permet d'accroître l'impact collectif
Toute une série d'efforts sont en cours au sein des gouvernements fédéral, provinciaux et territoriaux, en collaboration avec de nombreux partenaires, pour traiter les questions clés liées aux médicaments onéreux pour le traitement des maladies rares. Il s'agit notamment des travaux de Santé Canada visant à rendre les processus réglementaires plus efficaces et mieux à même de répondre aux besoins du système de soins de santé, notamment aux besoins des personnes atteintes de maladies rares.Footnote 12 Par exemple, depuis 2017, Santé Canada a renforcé la façon dont elle collabore avec les organismes de réglementation du monde entier pour l'examen scientifique des médicaments et des dispositifs médicaux, y compris les thérapies pour le traitement des maladies rares. Cela a facilité l'approbation de trois nouveaux traitements.
En réponse à l'examen ciblé du secteur de la santé et des biosciences par le gouvernement du Canada en 2018, Santé Canada réduit également les obstacles réglementaires afin d'accroître la disponibilité des options de traitement, y compris les thérapies avancées et les médicaments personnalisés, qui pourraient profiter aux personnes atteintes de maladies rares. Ensemble, ces efforts contribueront à donner aux gens un meilleur accès aux médicaments et aux dispositifs dont ils ont besoin.
En 2019, le gouvernement du Canada a annoncé des modifications au Règlement sur les médicaments brevetés, qui fournissent au Conseil d'examen du prix des médicaments brevetés de nouvelles informations et de nouveaux outils pour protéger les Canadiens contre les prix excessifs des médicaments brevetés, y compris ceux permettant de traiter les maladies rares. Ces modifications entreront en vigueur le 1er juillet 2021.
Enfin, un groupe de travail provincial/territorial sur les médicaments onéreux pour le traitement des maladies rares a discuté ces dernières années d'un processus complémentaire pour ces traitements.
Afin d'accroître l'impact collectif, la stratégie nationale sur les médicaments onéreux pour le traitement des maladies rares ne fera pas double emploi avec ces initiatives existantes, mais se concentrera plutôt sur des domaines qui complètent ceux déjà en cours.
Ce document de travail sur une stratégie nationale sur les médicaments onéreux pour le traitement des maladies rares explore trois enjeux clés :
- Comment améliorer l'accès des patients aux médicaments onéreux pour le traitement des maladies rares et garantir un accès cohérent partout au pays.
- Comment faire en sorte que les décisions relatives au financement des médicaments onéreux pour le traitement des maladies rares soient fondées sur les meilleures preuves disponibles.
- Comment garantir que les dépenses en médicaments onéreux pour le traitement des maladies rares ne mettent pas de pression sur la viabilité du système de santé canadien.
Les sections suivantes explorent ces enjeux et certaines options pour y répondre. Elles sont destinées à servir de point de départ à la discussion - si vous avez d'autres idées, n'hésitez pas à nous en faire part.
Enjeu 1 : Comment améliorer l'accès des patients aux médicaments onéreux pour le traitement des maladies rares et garantir un accès cohérent partout au pays.
Les patients atteints de maladies rares vivent dans toutes les régions du pays, mais l'accès à des médicaments onéreux pour les traiter varie grandement selon l'endroit où ils vivent et la façon dont leurs médicaments sont payés.
Les gouvernements fédéral, provinciaux et territoriaux et les régimes d'assurance-médicaments privés prennent des décisions distinctes - et souvent différentes - concernant les traitements des maladies rares qu'ils vont payer. Il en résulte que les patients ont des chances différentes d'obtenir un médicament en fonction de leur lieu de résidence ou de leur régime d'assurance. Les programmes de soutien aux patients parrainés par l'industrie et les essais cliniques comblent en partie cette lacune, mais ils ne fournissent des médicaments qu'à certains patients et n'offrent aucune garantie quant à la durée de cet accès.
Il est difficile d'obtenir une couverture cohérente lorsqu'il y a tant de payeurs différents, qu'il n'existe pas de cadre ou de lignes directrices nationales pour évaluer la valeur et l'efficacité des médicaments pour le traitement des maladies rares et que de nombreuses décisions de financement sont prises au cas par cas. Ces incohérences font qu'il est difficile pour les patients, leurs familles et les médecins de savoir où et comment avoir accès à ces médicaments.
Les options pour améliorer l'accès et la cohérence nationale pour les personnes atteintes de maladies rares comprennent :
- Un cadre unique pour la prise de décision sur les médicaments onéreux - Obtenir que les gouvernements fédéral, provinciaux et territoriaux s'accordent sur une approche unique de principe pour décider 1) quels médicaments onéreux pour le traitement des maladies rares doivent être couverts et 2) quels patients doivent être couverts dans quelles conditions créerait une plus grande cohérence dans tout le pays ainsi qu'une prévisibilité pour les patients.
- Un organisme de coordination transparent - La création d'un organisme de coordination pour améliorer la communication et la collaboration entre les principaux acteurs (y compris les régimes d'assurance-médicaments privés et publics) permettrait d'assurer la cohérence des décisions concernant les médicaments à payer, de garantir le respect des conditions convenues pour un accès cohérent aux médicaments et de communiquer clairement les raisons et les décisions, ainsi que les informations sur le processus et les délais.
- Mobilisation des patients et des cliniciens - Mobiliser les patients, les groupes de patients et les cliniciens afin de mieux faire connaître les politiques et les programmes liés à l'accès aux médicaments onéreux pour le traitement des maladies rares.
- Soutien coordonné à la recherche sur les maladies rares au Canada - Bien que chaque maladie rare soit différente, il existe des défis et des facteurs communs qui affectent la recherche et la découverte de traitements. Un soutien coordonné de la recherche au niveau national pourrait accroître les connaissances sur les maladies rares qui touchent les Canadiens et mener à de nouvelles découvertes, permettant ainsi de mettre ces traitements à la disposition des patients canadiens.
1a. Comment rendre cohérent l'accès aux médicaments onéreux pour le traitement des maladies rares afin d'améliorer l’accès des patients à ces traitements?
1b. Laquelle des options proposées, ou combinaison d’options, serait la plus efficace pour améliorer l’accès et la cohérence?
1c. Veuillez expliquer la ou les options que vous avez sélectionnées ci-dessus.
Enjeu 2 : Comment faire en sorte que les décisions relatives à la couverture des médicaments onéreux pour le traitement des maladies rares soient fondées sur les meilleures preuves disponibles.
Les preuves de l'efficacité des médicaments onéreux pour le traitement des maladies rares sont souvent limitées, ce qui rend plus difficile le choix des médicaments qui doivent être couverts.
Au fil des décennies, les cliniciens et les scientifiques ont élaboré des normes solides pour tester les nouveaux médicaments afin d'en garantir la sécurité et l'efficacité. Les essais contrôlés randomisés permettent à des centaines, voire des milliers de volontaires, de prendre un nouveau médicament et d'en observer attentivement les effets. Mais avec si peu de patients atteints de maladies rares, les grands essais sont souvent impossibles. En outre, si l'on peut raisonnablement s'attendre à ce que le médicament fasse une grande différence pour les personnes gravement malades, il peut être considéré comme non éthique de faire attendre les patients pour obtenir suffisamment de preuves. Par conséquent, les décisions d'approbation et de financement de ces médicaments peuvent devoir être basées sur des preuves limitées et des avantages et risques incertains pour la santé.
Les limites de la qualité et de la disponibilité des preuves pour les thérapies des maladies rares ont conduit les régulateurs à adopter des approches de surveillance plus adaptées à ces maladies.Footnote 12 Cela comprend des voies d'examen accélérées et exceptionnelles dans le cadre du processus réglementaire, des incitations et l'accès à des orientations réglementaires précoces pour la conception d'essais destinés à de petites populations. Santé Canada utilise sa politique d'avis de conformité avec conditions pour accélérer les examens d'un sous-ensemble de médicaments destinés à traiter des maladies graves, mortelles ou très débilitantes pour lesquelles il n'existe pas de traitement disponible. Par exemple, lorsque les premières données montrent qu'un médicament est prometteur, l'organisme de réglementation peut accorder une autorisation de mise sur le marché avec des conditions qui obligent le fabricant à surveiller le produit une fois qu'il est utilisé et à effectuer des essais supplémentaires. Santé Canada prévoit également de modifier la réglementation afin d'étendre l'utilisation des conditions d'approbation des médicaments et des dispositifs, ce qui permettra de recueillir des informations plus précises, qui pourraient servir à étayer d'autres recherches et décisions de couverture à l'avenir.
Même si des mesures sont mises en place pour mettre ces produits sur le marché rapidement, des données incertaines peuvent rendre difficile de déterminer si les nouveaux traitements apportent un bénéfice suffisamment important au patient pour mériter le prix - ce qui laisse les régimes d'assurance-médicaments publics et privés dans la position difficile de payer des traitements onéreux qui peuvent ne pas fonctionner très bien. Mais lorsqu'aucun autre traitement n'est disponible, les patients veulent naturellement avoir la possibilité d'essayer tout ce qui pourrait contribuer à améliorer leur qualité de vie. L'absence de preuves solides sur les avantages d'un médicament contre une maladie rare peut donc entraîner à la fois une forte pression pour payer des médicaments onéreux, même lorsque les avantages sont minimes ou que les preuves sont limitées, et, dans le même temps, retarder ou limiter l'accès à des thérapies qui pourraient être bénéfiques.
Les options pour relever le défi de couvrir les médicaments avec des preuves limitées comprennent :
- Modèles d'approbation et de couverture innovants - L'approbation et le financement des médicaments destinés à traiter les maladies rares pourraient être liés à leur efficacité, ce qui signifie que le paiement dépendrait de l'obtention de résultats précis par les patients, que les fabricants suivraient grâce à des études à long terme et à des rapports réguliers sur l'efficacité et la sécurité de leur médicament. Cela nécessiterait un accord sur le niveau de bénéfice suffisant ainsi que des indicateurs clairs et objectifs pour mesurer le bénéfice (ce qui pourrait être difficile à développer). Si les données montraient de mauvaises performances à long terme, les paiements seraient réduits ou interrompus.
- Un groupe d'experts national - Le groupe serait habilité à 1) étudier les données et les preuves pour faire des recommandations éclairées sur les personnes qui devraient bénéficier avec des médicaments onéreux pour les maladies rares et 2) surveiller la manière dont les médicaments sont utilisés, leur efficacité et formuler des recommandations sur la poursuite du financement.
- Un système de données national - Ce système permettrait de saisir des informations plus complètes et plus cohérentes sur la prévalence des maladies rares au Canada, sur la manière dont les Canadiens utilisent les traitements pour les maladies rares et sur leur efficacité.
- Réseaux nationaux et internationaux indépendants - Ces réseaux s'appuieraient sur les partenariats existants pour faciliter le partage des connaissances et des données sur l'expérience réelle des patients, de manière indépendante et sans conflit d'intérêts.
2a. Comment peut-on prendre des décisions sur la couverture des médicaments onéreux pour le traitement des maladies rares lorsque les preuves sont limitées?
2b. Laquelle des options proposées, ou combinaison d’options, serait la plus efficace pour renforcer la base de preuves?
2c. Veuillez expliquer la ou les options que vous avez sélectionnées ci-dessus.
Enjeu 3 : Comment faire en sorte que les dépenses en médicaments onéreux pour le traitement des maladies rares ne mettent pas de pression sur la viabilité du système de santé canadien.
La plupart des médicaments pour le traitement des maladies rares sont très chers et peuvent compromettre la viabilité à long terme des régimes d'assurance-médicaments publics et privés.
Les médicaments pour le traitement des maladies rares constituent le segment du marché pharmaceutique qui connaît la croissance la plus rapide au Canada, avec un taux de croissance annualisé de 32 % et représentant près d'un dixième des ventes de produits pharmaceutiques canadiens.Footnote 6 On estime que les ventes ont été multipliées par plusieurs au cours des dernières années, ce qui constitue l'un des nombreux facteurs qui mettent de plus en plus à rude épreuve les budgets de santé (qui ont de nombreuses priorités concurrentes).
L'Alliance pancanadienne pharmaceutique a été créée pour négocier des prix équitables pour les médicaments au nom des gouvernements fédéral, provinciaux et territoriaux. Cependant, même avec ce pouvoir d'achat conjoint, il est extrêmement difficile de négocier des prix équitables pour les médicaments pour le traitement des maladies rares : les prix sont élevés, la concurrence sur le marché est rare, les maladies sont graves et les patients et les soignants sont impatients d'y avoir accès.
En raison du manque d'options de traitement pour la plupart des maladies rares, il est important d'investir dans l'innovation, la recherche et le développement de traitements efficaces pour ces maladies. L'innovation et la découverte doivent permettre aux entreprises pharmaceutiques d'obtenir un retour sur investissement raisonnable sans affecter l'accès des patients ou entraîner des dépenses si élevées qu'elles menacent la viabilité globale du système de soins de santé.
Les options pour contrôler l'impact des médicaments onéreux sur les budgets des systèmes de santé comprennent :
- Partage des coûts et mise en commun des risques - Collaboration avec d'autres payeurs pour aider chacun à négocier de meilleurs accords avec les fabricants de produits pharmaceutiques (et éventuellement aider à mettre sur le marché des médicaments qui ne seraient pas commercialement viables autrement).
- Investissements initiaux pour réduire le risque dans les premiers stades du développement - Plutôt que de compter uniquement sur le prix pour dédommager les fabricants de médicaments pour la recherche et le développement, le coût du développement de nouveaux médicaments pour le traitement des maladies rares pourrait être partagé entre les bailleurs de fonds de la recherche et les entreprises afin de réduire le risque et de diminuer les dépenses. Cela pourrait inclure un investissement initial des gouvernements et des organismes de bienfaisance dans le domaine de la santé pour la recherche, le développement et la production de traitements contre les maladies rares. Des accords négociés avec les fabricants pourraient limiter les prix ultérieurement.
- Payer pour le rendement - Exploration de modèles de financement innovants liés au bon fonctionnement d'un médicament, y compris la défiscalisation des médicaments qui n'offrent que des avantages marginaux ou non prouvés.
- Soutien à l'innovation « fabriquée au Canada » - Développement de la capacité nationale innovatrice ou générique pour soutenir tous les éléments de la découverte, de la recherche et du développement de médicaments, jusqu'à la fabrication, les essais, l'approbation et la vente. Cela permettrait de maintenir les coûts à un niveau inférieur à celui qui serait atteint si les chercheurs vendaient leur découverte à une multinationale pour la mettre sur le marché.
- Collaboration internationale - Collaboration avec d'autres pays pour partager des informations non confidentielles afin d'éclairer les négociations et de favoriser une meilleure tarification.
3a. Laquelle des options proposées, ou combinaison d’options, serait la plus efficace pour fournir des traitements contre les maladies rares aux patients?
3b. Veuillez expliquer la ou les options que vous avez sélectionnées ci-dessus.
4. Avez-vous d’autres idées qui pourraient contribuer à améliorer l’accès et réduire les couts des médicaments pour le traitement des maladies rares?
Prochaines étapes : Solliciter la participation des Canadiens à contribuer à l'élaboration d'une stratégie nationale
Alors que le Canada étudie la meilleure façon de créer une stratégie nationale sur les médicaments onéreux pour le traitement des maladies rares, il est important que les Canadiens aient leur mot à dire pour contribuer à son élaboration.
Si vous avez des points de vue sur l'une ou plusieurs des questions de ce document de travail, vous pouvez le partager de trois façons :
- Remplissez le questionnaire en ligne.
- Participez à une séance de discussion publique virtuelle.
- Envoyez vos commentaires par courriel ou par la poste.
En plus de recueillir les commentaires des Canadiens, Santé Canada travaille en étroite collaboration avec les représentants provinciaux et territoriaux pour élaborer une stratégie qui fonctionnera dans le contexte du système de santé canadien et respectera le rôle des provinces et des territoires dans la prestation des soins de santé.
Au cours des prochains mois, Santé Canada s'entretiendra également avec des organisations autochtones et des intervenants en santé afin de recueillir leurs points de vue sur ce qui fonctionne le mieux pour leurs communautés.
Au cours des prochaines semaines, des réunions virtuelles seront organisées avec les principaux intervenants afin de recueillir leurs commentaires, notamment :
- Les patients, leurs familles et les soignants
- Les groupes de patients
- Les fournisseurs de soins de santé
- Les autres partenaires du système de soins de santé (p. ex., l'APP, l'ACMTS, l'INESSS, le CEPMB, les Instituts canadiens d'information sur la santé et l'Inforoute Santé du Canada)
- Les universitaires et les chercheurs (y compris l'Institut canadien de recherche en santé)
- L'industrie pharmaceutique
- Les assureurs privés
- Les milieux d'affaires et les syndicats
Tous ces éléments contribueront à l'élaboration et à la mise en œuvre d'une stratégie nationale sur les médicaments onéreux pour le traitement des maladies rares, que le gouvernement entend lancer d'ici 2022-2023.
RÉFÉRENCES
Remarques
- Remarques 1
-
Santé Canada. « À propos des médicaments orphelins et des maladies rares au Canada ». Consulté le 30 décembre 2020 sur : https://www.canada.ca/fr/sante-canada/services/licences-autorisation-et-enregistrement-medicaments-et-produits-sante/approche-canada-reglementation-medicaments-maladies-rares/medicaments-orphelines-maladies-rares.html
- Remarques 2
-
Canadian Organization for Rare Disorders. « About CORD - Key Facts ». Consulté le 30 décembre 2020 sur : https://www.raredisorders.ca/about-cord/
- Remarques 3
-
Union européenne. « Health Research and Innovation: Rare Diseases ». Consulté le 30 décembre 2020 sur : https://ec.europa.eu/info/research-and-innovation/research-area/health-research-and-innovation/rare-diseases_en#:~:text=In%20the%20EU%2C%20a%20rare,million%20people%20in%20the%20EU
- Remarques 4
-
Institut national de la santé, centre d'information sur les maladies génétiques et les taux. « FAQs About Rare Diseases ». Consulté le 30 décembre 2020 sur : https://rarediseases.info.nih.gov/diseases/pages/31/faqs-about-rare-diseases
- Remarques 5
-
Comité permanent de la santé, (2019). « Améliorer l'accès aux traitements pour les Canadiens atteints de maladies et de troubles rares ». Consulté le 30 décembre 2020 à l'adresse suivante : https://www.ourcommons.ca/Content/Committee/421/HESA/Reports/RP10349306/hesarp22/hesarp22-f.pdf
- Remarques 6
-
Conseil d'examen du prix des médicaments brevetés, (2020). « Aperçu des dépenses en médicaments
onéreux pour les maladies rares » (présentation). Consulté le 30 décembre 2020 sur : https://www.canada.ca/content/dam/pmprb-cepmb/documents/consultations/draft-guidelines/2020/Webinaire1-MOMR-taille-marche-FR.pdf
- Remarques 7
-
Berdud et al. « Establishing a reasonable price for an orphan drug". Cost Eff Resour Alloc (2020) 18:31
https://resource-allocation.biomedcentral.com/articles/10.1186/s12962-020-00223-x
- Remarques 8
-
Santé Canada. « Notre rôle dans la fourniture de médicaments aux patients. » Consulté le 30 décembre 2020 à l'adresse suivante : https://www.canada.ca/fr/sante-canada/services/licences-autorisation-et-enregistrement-medicaments-et-produits-sante/approche-canada-reglementation-medicaments-maladies-rares/notre-role.html
- Remarques 9
-
Conseil consultatif sur la mise en œuvre d'un régime national d'assurance-médicaments, (2019). Une ordonnance pour le Canada : l'assurance-médicaments pour tous. Consulté le 30 décembre 2020 à l'adresse suivante : https://www.canada.ca/fr/sante-canada/organisation/a-propos-sante-canada/mobilisation-publique/organismes-consultatifs-externes/mise-en-oeuvre-regime-assurance-medicaments/rapport-final.html
- Remarques 10
-
Agence canadienne des médicaments et des technologies de la santé. « Health Technology Assessment Service » Consulté le 30 décembre 2020 sur : https://www.cadth.ca/about-cadth/what-we-do/products-services/hta
- Remarques 11
-
Santé Canada. « Programme d'accès spécial ». Consulté le 30 décembre 2020 à l'adresse suivante : https://www.canada.ca/fr/sante-canada/services/medicaments-produits-sante/acces-special/medicaments.html
- Remarques 12
-
Santé Canada. « Approche du Canada en matière de réglementation des médicaments utilisés pour soigner les maladies rares ». Consulté le 30 décembre 2020 à l'adresse : https://www.canada.ca/fr/sante-canada/services/licences-autorisation-et-enregistrement-medicaments-et-produits-sante/approche-canada-reglementation-medicaments-maladies-rares.html
