InfoVigilance sur les produits de santé: janvier 2025

Télécharger le format de rechange
(Format PDF, 653 Ko, 11 pages)
Direction générale des produits de santé et des aliments
Direction des produits de santé commercialisés
Équipe de rédaction de l'InfoVigilance sur les produits de santé
ISSN: 2368-8033
Cat.: H167-1F-PDF
Pub.: 240001
Contenu
- Récapitulatif mensuel des renseignements sur l'innocuité des produits de santé
- Betahistine et TEVA-Betahistine
- Inhibiteurs de la HMG-CoA réductase - atorvastatine, fluvastatine, lovastatine, pravastatine, rosuvastatine et simvastatine
- PMS-Cinacalcet
- Produits de santé non homologués
- Thérapies par lymphocytes T à récepteur antigénique chimérique (CAR-T) - Breyanzi (lisocabtagène maraleucel), Carvykti (ciltacabtagène autoleucel), Kymriah (tisagenlecleucel), Tecartus (brexucabtagène autoleucel) et Yescarta (axicabtagène ciloleucel)
- Nouveaux renseignements sur l'innocuité des produits de santé
- Portée
- Pour signaler des effets indésirables
- Liens utiles
- Contactez-nous
Récapitulatif mensuel des renseignements sur l'innocuité des produits de santé
Voici une liste des avis concernant les produits de santé, des rappels de médicaments de type I, ainsi que des résumés de l'examen de l'innocuité ou de la sûreté publiés en décembre 2024 par Santé Canada.
Betahistine et TEVA-Betahistine
Les lots concernés de comprimés de Betahistine et TEVA-Betahistine ont été rappelés car ils dépassent ou peuvent dépasser la limite d'apport acceptable provisoire pour la N-nitroso-bétahistine.
Inhibiteurs de la HMG-CoA réductase - atorvastatine, fluvastatine, lovastatine, pravastatine, rosuvastatine et simvastatine
Cet examen de l'innocuité a évalué le risque de myasthénie grave, y compris la myasthénie oculaire, liée à la prise d'inhibiteurs de la HMG-CoA réductase. L'examen de Santé Canada a permis d'établir un lien possible. Santé Canada travaillera avec les fabricants pour mettre à jour les monographies canadiennes de tous les produits à base de statines qui ne mentionnent actuellement pas ce risque.
PMS-Cinacalcet
Les lots affectés de PMS-cinacalcet ont été rappelés car ils pourraient dépasser la limite acceptable établie pour le N-Nitroso-cinacalcet.
Produits de santé non homologués
Santé Canada a avisé les Canadiens que divers produits de santé non autorisés qui pourraient poser un risque grave pour la santé ont été vendus dans des points de vente au détail au Canada ou en ligne.
- Avis: Produits non homologués pour améliorer la performance sexuelle
- Avis: Produits non homologués pour éclaircir la peau et traiter des affections cutanées
Thérapies par lymphocytes T à récepteur antigénique chimérique (CAR-T) - Breyanzi (lisocabtagène maraleucel), Carvykti (ciltacabtagène autoleucel), Kymriah (tisagenlecleucel), Tecartus (brexucabtagène autoleucel) et Yescarta (axicabtagène ciloleucel)
Cet examen de l'innocuité a évalué le risque de tumeurs malignes secondaires liées aux lymphocytes T après une thérapie CAR-T. L'examen de Santé Canada a permis d'établir un lien possible. Santé Canada travaille avec les fabricants pour mettre à jour les monographies de produits canadiennes des thérapies CAR-T afin d'y inclure ce risque.
Nouveaux renseignements sur l'innocuité des produits de santé
Les sujets suivants ont été inclus dans le but d'accroître la sensibilisation et d'encourager la déclaration d'effets indésirables.
Résumé sur l'innocuité des produits de santé
Les systèmes de déclaration après la mise en marché aident à cerner et à analyser de nouvelles informations sur l'innocuité des produits de santé, de sorte que les mesures appropriées soient prises pour réduire au minimum les risques pour la santé humaine. Les effets indésirables (EI) soupçonnés d'être associés à l'utilisation de produits de santé peuvent être signalés au Programme Canada Vigilance (PCV) de Santé Canada qui a la responsabilité de surveiller l'innocuité des produits de santé au Canada. Les détenteurs d'une autorisation de mise en marché et les hôpitaux doivent transmettre les déclarations d'EI au PCV. Le PCV reçoit aussi des déclarations soumises de façon volontaire de la part des membres de la collectivité (consommateurs, patients et professionnels de la santé ne pratiquant pas dans les hôpitaux).
Le présent rapport résume les renseignements sur les cas d'EI survenus au pays pour les produits pharmaceutiques, les produits de santé naturels, les médicaments biologiques, les produits radiopharmaceutiques, les désinfectants, et les agents d'assainissement aux propriétés désinfectantes reçus par le PCV en 2023. Les données présentées reflètent les opinions et observations du déclarant et ne reflètent aucune évaluation de Santé Canada concernant l'association entre le produit de santé et la ou les réactions.
Pour obtenir de plus amples renseignements, veuillez contacter la direction des produits de santé commercialisés.
Données sur les EI de 2023
- 213 089 déclarations d'EI reçues par le PCV du 1er janvier au 31 décembre 2023. Ces déclarations représentent 75 515 cas survenus au pays.Note de bas de page *
- 74% des cas ont été jugés graves
- 24% ont nécessité une hospitalisation
- 3% décrivaient un état présentant un danger de mort
- 9% signalaient un décès
- 11 problèmes d'innocuité potentiels ont été identifiés à partir de déclarations d'EI pour les produits de santé au cours de cette période, et 4 d'entre eux ont été considérés comme des signaux d'innocuité.
- Les déclarations d'EI reçues en 2023 ont également contribué à la validation et à l'évaluation des signaux d'innocuité provenant d'autres sources (p. ex., de nouvelles informations sur l'innocuité provenant d'agences réglementaires étrangères et de détenteurs d'une autorisation de mise en marché, ainsi que de la littérature médicale et scientifique).
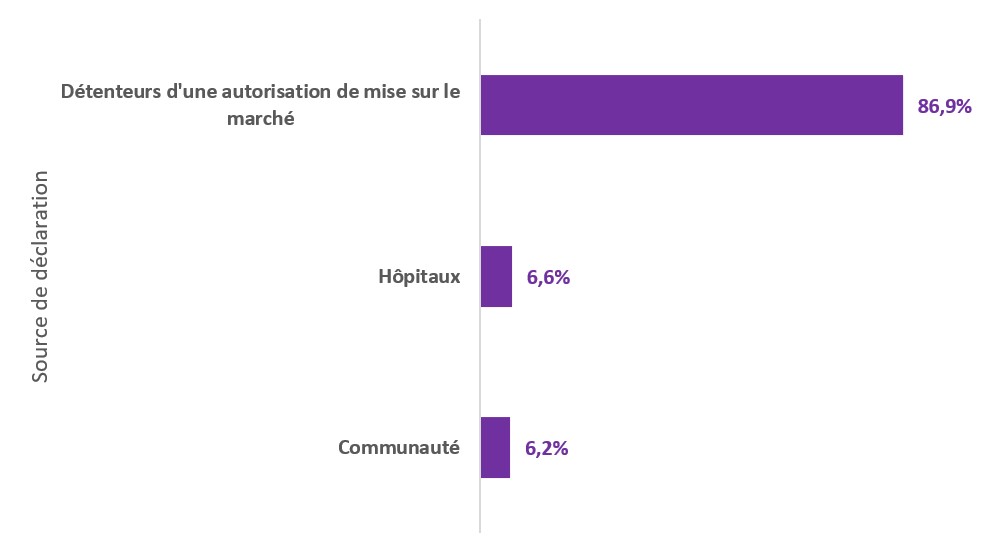
Figure 1 - Équivalent textuel
| Source de déclaration | Pourcentage |
|---|---|
| Détenteurs d'une autorisation de mise sur le marché | 86,9% |
| Hôpitaux | 6,6% |
| Communauté | 6,2% |
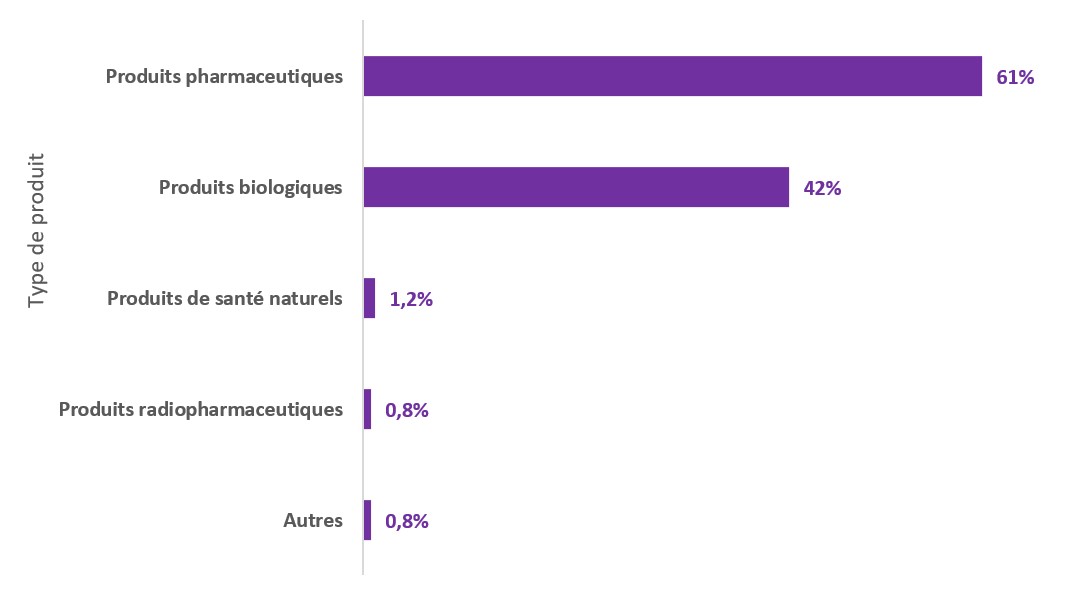
Figure 2 - Équivalent textuel
| Type de produit | Pourcentage |
|---|---|
| Produits pharmaceutiques | 61% |
| Produits biologiques | 42% |
| Produits de santé naturels | 1,2% |
| Produits radiopharmaceutiques | 0,8% |
| Autres | 0,8% |
Répartition des cas d'EI par type de déclarant
- 22% provenant d'un médecin
- 8% provenant d'un pharmacien
- 45% provenant d'autres professionnels de la santé
- 25% provenant d'un consommateur / autre
Répartition des cas d'EI selon le sexe
- 58% de sexe féminin
- 38% de sexe masculin
- 4% de sexe inconnu
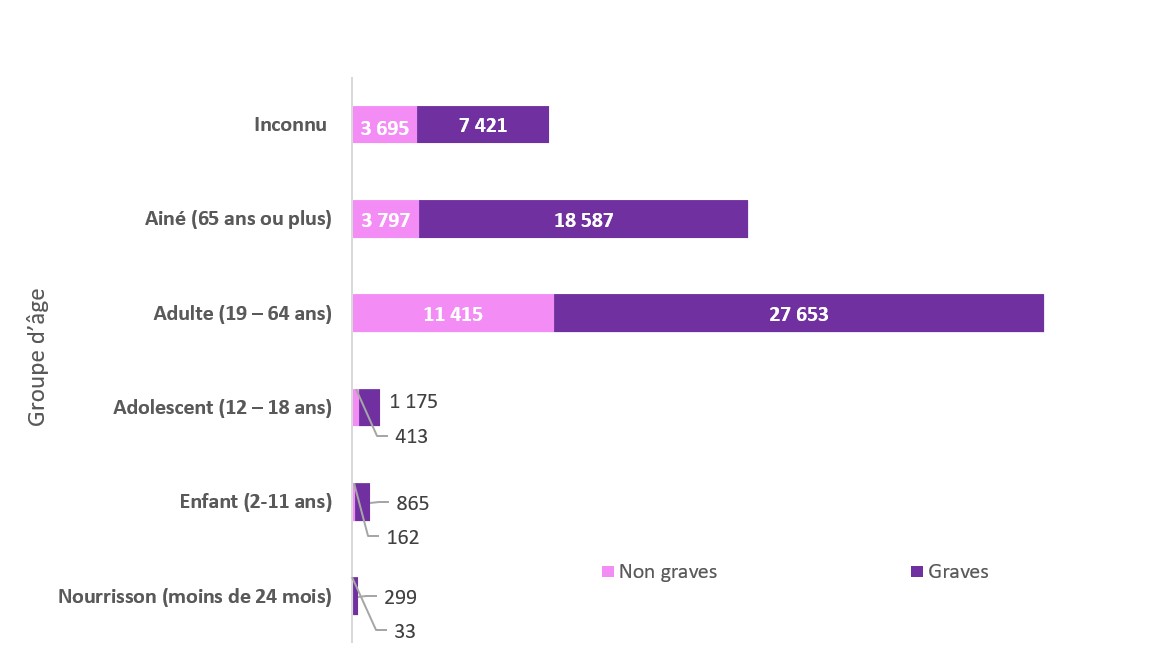
Figure 3 - Équivalent textuel
| Groupe d'âge | Nombres de cas d'effets indésirables non graves | Nombres de cas d'effets indésirables graves |
|---|---|---|
| Inconnu | 3 695 | 7 421 |
| Ainé (65 ans ou plus) | 3 797 | 18 587 |
| Adulte (19 – 64 ans) | 11 415 | 27 653 |
| Adolescent (12 – 18 ans) | 413 | 1 175 |
| Enfant (2-11 ans) | 162 | 865 |
| Nourrisson (moins de 24 mois) | 33 | 299 |
| Groupe anatomique, thérapeutique et chimique (ATC) | % de déclarations |
|---|---|
| Immunosuppresseurs | 45% |
| Antinéoplasiques | 17% |
| Psycholeptiques | 5% |
| Analgésiques | 3% |
| Médicaments pour les maladies obstructives des voies respiratoires | 3% |
| Classe par système et par organe | % de déclarations |
|---|---|
| Troubles généraux et anomalies au site d'administration | 57% |
| Lésions, intoxication et complications d'interventions | 30% |
| Infections and infestations | 23% |
| Affections gastro-intestinales | 21% |
| Affections du système nerveux | 17% |
Résumé sur l'innocuité des vaccins
Santé Canada et l'Agence de la santé publique du Canada (ASPC) partagent la responsabilité de la surveillance de l'innocuité des vaccins au Canada. Les détenteurs d'une autorisation de mise en marché sont tenus de déclarer les effets secondaires suivant l'immunisation (ESSI) considérés graves au Programme Canada Vigilance (PCV) de Santé Canada. Le PCV reçoit également des déclarations volontaires des professionnels de la santé et des consommateurs. Même si les hôpitaux doivent déclarer les effets indésirables graves d'un médicament documentés dans leur établissement, ils ne sont pas tenus de le faire dans le cas d'un vaccin s'ils ont transmis une déclaration d'ESSI à leur bureau local de santé publique. Ces déclarations sont transmises par les autorités de santé publique provinciales et territoriales au Système canadien de surveillance des effets secondaires suivant l'immunisation (SCSESSI) de l'ASPC.
Pour obtenir de plus amples renseignements, veuillez contacter la direction des produits de santé commercialisés.
Données sur les ESSI de 2023
- 483 déclarations d'ESSI ont été reçues par le PCV du 1er janvier au 31 décembre 2023.Note de bas de page †
- 76% des déclarations ont été jugées graves
- 13% ont nécessité une hospitalisation
- 3% décrivaient un état présentant un danger de mort
- 3% signalaient un décèsNote de bas de page ‡
- Aucun nouveau signal d'innocuité n'a été identifié pour des vaccins pendant cette période. Note de bas de page §
Répartition des déclarations par type de déclarant
- 14% provenant d'un médecin
- 19% provenant d'un pharmacien
- 20% provenant d'autres professionnels de la santé
- 47% provenant d'un consommateur/autre
Répartition des déclarations selon le sexe
- 63% de sexe féminin
- 28% de sexe masculin
- 9% de sexe inconnu
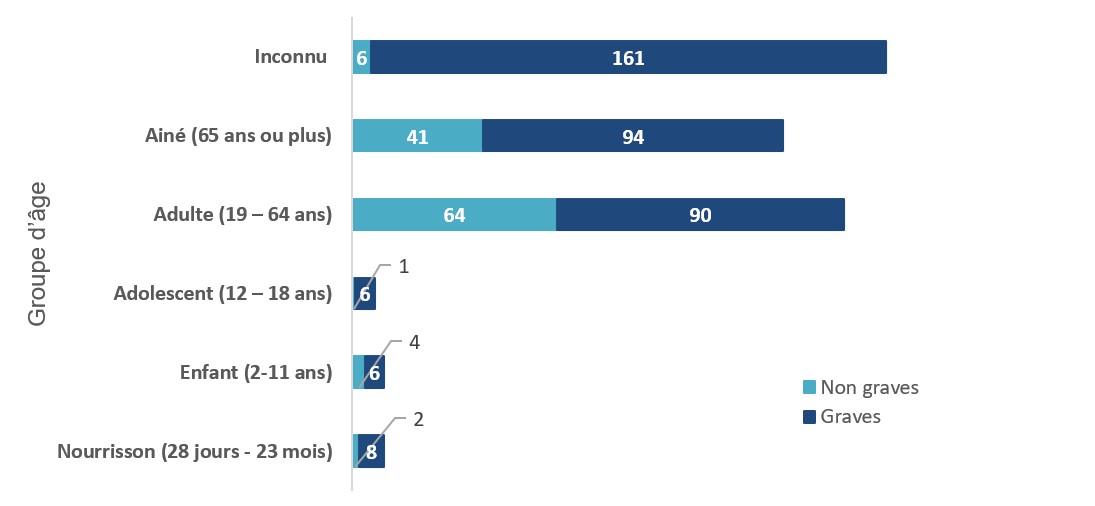
Figure 1 - Équivalent textuel
| Groupe d'âge | Nombre de déclarations d'effets non graves | Nombre de déclarations d'effets graves |
|---|---|---|
| Inconnu | 6 | 161 |
| Ainé (65 ans ou plus) | 41 | 94 |
| Adulte (19 – 64 ans) | 64 | 90 |
| Adolescent (12 – 18 ans) | 1 | 6 |
| Enfant (2-11 ans) | 4 | 6 |
| Nourrisson (28 jours - 23 mois) | 2 | 8 |
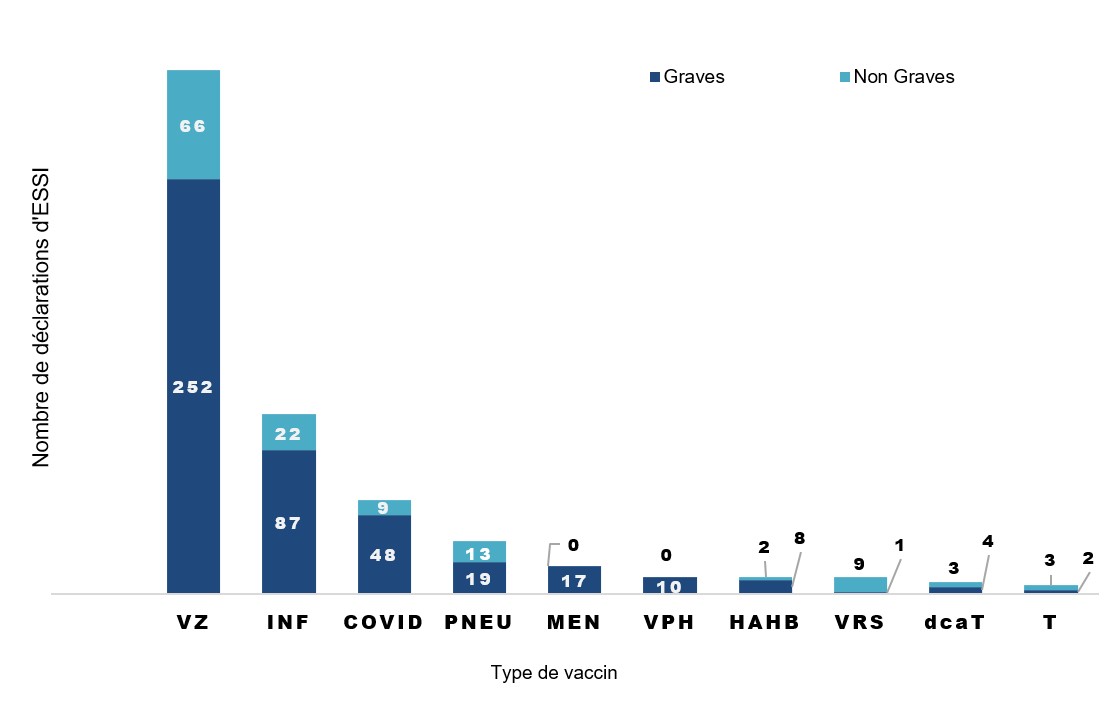
Les données concernant la COVID représentent les déclarations d'ESSI dans lesquelles un vaccin contre la COVID était signalé en association avec un autre vaccin.
Figure 2 - Équivalent textuel
| Groupes de vaccin | Nombre de déclarations d'effets non graves | Nombre de déclarations d'effets graves | |
|---|---|---|---|
| Zona | VZ | 66 | 252 |
| Influenza | INF | 22 | 87 |
| COVID-19 | COVID | 9 | 48 |
| Pneumocoque | PNEU | 13 | 19 |
| Méningocoque | MEN | 0 | 17 |
| Virus du papillome humain | VPH | 0 | 10 |
| Hépatite A et Hépatite B | HAHB | 2 | 8 |
| Virus respiratoire syncytial | VRS | 9 | 1 |
| Diphtérie (réduite), Coqueluche acellulaire et Tétanos | dcaT | 3 | 4 |
| Tétanos | T | 3 | 2 |
Constatations clés
- Vaccins contre le zona: les 5 ESSI les plus fréquemment signalés étaient le zona, l'échec de la vaccination, la douleur, la fièvre et douleur dans les extrémités. La plupart des événements de zona ont été signalés en même temps que l'échec de la vaccination.
- Vaccins contre l'influenza: les 5 ESSI les plus fréquemment signalés étaient la dyspnée, la douleur, la pneumonie, la fatigue et les maux de tête.
- Pour tous les vaccins: d'autres termes fréquemment signalés comprenaient les vomissements, l'érythème et le prurit.
Résumé des données sur les effets indésirables des produits à base de cannabis
Santé Canada est responsable de surveiller les risques liés aux produits du cannabis au Canada. Les titulaires de licence qui vendent ou distribuent des produits à base de cannabis doivent signaler tous les effets indésirables (EI) graves impliquant ces produits à Santé Canada, comme indiqué dans le Guide sur la déclaration des effets indésirables du cannabis. Les consommateurs, les patients, les professionnels de la santé, les cliniques de cannabis médical et autres individus sont également encouragés à déclarer volontairement tout EI impliquant le cannabis.
Pour obtenir de plus amples renseignements, veuillez contacter le Bureau de la science et de la surveillance du cannabis.
Données sur les EI de 2023
Le 10 janvier 2025, Santé Canada a publié un nouveau rapport qui donne un aperçu des EI liés au cannabis signalés à Santé Canada en 2023. Ce rapport annuel est conçu pour aider les intervenants à mieux comprendre le cadre de vigilance de Santé Canada, qui est utilisé pour les produits du cannabis, et les données d'EI concernant le cannabis.
Dans le cadre de cette publication, les résultats principaux concernant les effets secondaires liés au cannabis ont également été mis à jour. Cet outil présente des données sur les indicateurs clés des EI liés au cannabis recueillis par Santé Canada de 2018 à 2023, permettant aux utilisateurs d'explorer et d'interagir avec les données à un niveau global.
Mises à jour de monographies de produits
Les mises à jour suivantes concernant l'innocuité, qui ont récemment été apportées aux monographies de produits canadiennes, ont été incluses afin d'en accroître la sensibilisation. Une liste complète des mises à jour de l'étiquetage pour les produits pharmaceutiques se trouve sur la page L'innocuité des monographies de produits pour les médicaments innovateurs de Santé Canada. Les monographies de produits canadiennes sont disponibles dans la Base de données sur les produits pharmaceutiques de Santé Canada.
Contrave (chlorhydrate de naltrexone et chlorhydrate de bupropion), Wellbutrin (chlorhydrate de bupropion) et Zyban (chlorhydrate de bupropion)
Les sections « Mises en garde et précautions », « Effets indésirables (Effets indésirables observés après la mise en marché) », « Posologie et Administration » et « Renseignements destinés aux patients » des monographies de produits canadiennes pour Contrave, Wellbutrin et Zyban ont été mises à jour avec des informations au sujet du risque de démasquage du syndrome de Brugada.
Messages clés à l'intention des professionnels de la santé:Note de bas de page 1 Note de bas de page 2 Note de bas de page 3
- Des cas isolés de démasquage du syndrome de Brugada avec le bupropion, ont été rapportés après la commercialisation. Le syndrome de Brugada est un trouble caractérisé par une syncope, des modifications caractéristiques de l'ECG, telles qu'un bloc de branche droit et un sus-décalage du segment ST dans les dérivations précordiales droites, ainsi qu'un risque d'arrêt cardiaque et de mort subite.
- Il est conseillé d'éviter l'utilisation de produits contenant du bupropion chez les patients atteints du syndrome de Brugada. Si l'utilisation de produits contenant du bupropion est envisagée chez des patients atteints du syndrome de Brugada ou chez des patients présentant un risque de syndrome de Brugada (par exemple, des patients présentant une syncope inexpliquée, patients ayant des antécédents familiaux d'arrêt cardiaque ou de mort subite), une évaluation par un cardiologue doit être réalisée avant d'initier le traitement, afin d'évaluer l'adéquation du traitement et de déterminer la stratégie la plus appropriée pour la surveillance des effets cardiaques.
- Les patients doivent être informés des signes et symptômes du syndrome de Brugada.
- En cas de démasquage du syndrome de Brugada, il convient d'interrompre le traitement par les produits contenant du bupropion.
Nolvadex-D (citrate de tamoxifène)
Les sections « Mises en garde et précautions » et « Renseignements destinés aux patient(e)s » de la monographie de produit canadienne pour Nolvadex-DNote de bas de page ** ont été mises à jour avec le risque d'allongement de l'intervalle QTc chez les patientes présentant des risques sous-jacents d'allongement de l'intervalle QT et d'affections cardiaques concomitantes.
Messages clés à l'intention des professionnels de la santé:Note de bas de page 4
- À la dose recommandée, Nolvadex-D peut entraîner un allongement de l'intervalle QTc sur l'électrocardiogramme (ECG) chez les patientes présentant des risques sous-jacents d'allongement de l'intervalle QT et d'affections cardiaques concomitantes.
- Il est recommandé d'effectuer une surveillance par ECG et de vérifier les électrolytes avant et durant le traitement chez ces patientes.

Portée
Cette publication mensuelle s'adresse principalement aux professionnels de la santé et contient des informations sur les produits pharmaceutiques, biologiques, les matériels médicaux et les produits de santé naturels. Elle fournit un résumé des informations clés concernant l'innocuité des produits de santé qui ont été publiés au cours du mois précédent par Santé Canada, ainsi qu'une sélection de nouveaux renseignements en matière d'innocuité sur les produits de santé, pour en accroître la sensibilisation. Les nouvelles informations contenues dans ce numéro ne sont pas exhaustives, mais représentent plutôt une sélection de problèmes d'innocuité cliniquement pertinents, justifiant une dissémination améliorée.
Pour signaler des effets indésirables
Programme Canada Vigilance
Téléphone: 1-866-234-2345
Télécopieur ou courrier: formulaire disponible sur MedEffet Canada
Des renseignements sur la marche à suivre pour déclarer un effet indésirable à Santé Canada sont publiés à la page Déclaration des effets indésirables ou des incidents liés aux matériels médicaux.
Liens utiles
- MedEffetMC Canada
- Base de données sur les rappels et les avis de sécurité
- Nouveaux examens de l'innocuité ou de la sûreté et de l'efficacité
- Base de données en ligne des effets indésirables de Canada Vigilance
- Base de données sur les produits pharmaceutiques
- Liste des instruments médicaux homologués
- Base de données des produits de santé naturels homologués
- Portail des médicaments et des produits de santé
- Pénuries de médicaments Canada
- Pénuries d'instruments médicaux
- Portail des vaccins et traitements pour la COVID-19
Contactez-nous
Vos commentaires sont importants pour nous. Dites-nous ce que vous pensez en nous contactant à: infowatch-infovigilance@hc-sc.gc.ca
Équipe de rédaction de l'InfoVigilance sur les produits de santé
Direction des produits de santé commercialisés
Santé Canada
Indice de l'adresse 1906C
Ottawa (ON) K1A 0K9
Références
- Note de bas de page 1
-
Contrave (chlorydrate de naltrexone et chlorhydrate de bupropion) [monographie de produit]. Laval (Qc): Bausch Health, Canada Inc.; 2023.
- Note de bas de page 2
-
Wellbutrin (chlorhydrate de bupropion) [monographie de produit]. Laval (Qc): Bausch Health, Inc.; 2024.
- Note de bas de page 3
-
Zyban (chlorhydrate de bupropion) [monographie de produit]. Laval (Qc): Bausch Health, Canada Inc.; 2023.
- Note de bas de page 4
-
Nolvadex-D (citrate de tamoxifène) [monographie de produit]. Mississauga (Ont.): AstraZeneca Canada Inc., 2024.
Notes de bas de page
- Note de bas de page 1
-
Un cas comprend toutes les informations décrivant le ou les EI subis par un patient à un moment donné et soupçonné d'être lié à l'utilisation d'un ou de plusieurs produits de santé. Un cas peut comprendre une déclaration initiale d'EI et éventuellement plusieurs déclarations de suivi fournissant des informations supplémentaires. Des cas en double peuvent exister si un rapport d'EI concernant le même événement a été reçu de différents déclarants.
- Note de bas de page 2
-
Ces résultats excluent les déclarations d'ESSI dans lesquelles un vaccin contre la COVID-19 était le seul vaccin soupçonné. Pour des informations sur les évènements indésirables signalés par des personnes après avoir reçu un vaccin contre la COVID-19 comme seul vaccin soupçonné au Canada en 2023, veuillez consulter la page web Manifestations cliniques inhabituelles à la suite de l'immunisation contre la COVID-19 au Canada au https://sante-infobase.canada.ca/covid-19/securite-vaccins/
- Note de bas de page 3
-
Les informations fournies dans ces déclarations d'ESSI n'étaient pas suffisamment détaillées pour évaluer l'association causale entre l'évènement signalé et le vaccin.
- Note de bas de page 4
-
Les évènements graves signalés étaient soit déjà répertoriés dans les monographies de produits du vaccin concerné, soit jugés peu susceptibles d'être liés à la vaccination en raison de la présence de problèmes de santé sous-jacents et/ou de médicaments concomitants qui auraient pu contribuer aux évènements.
- Note de bas de page 5
-
Au moment de la publication, la mise à jour de la monographie de produit canadienne pour Nolvadex-D a été complétée. Les mises à jour pour les autres produits à base de citrate de tamoxifène suivront.