Données sur les effets indésirables du cannabis : Rapport annuel de 2023
Effets indésirables associés au cannabis déclarés à Santé Canada entre le 1er janvier 2023 et le 31 décembre 2023, comparés aux données de l'année précédente (du 1er janvier 2022 au 31 décembre 2022).
Sur cette page
- Points forts
- Introduction
- Effets indésirables du cannabis
- Analyse comparative entre les sexes et les genres plus des données sur les effets indésirables de 2023
- Évaluation clinique des cas graves et importants sur le plan médical
- Avis aux lecteurs
- Signaler un effet indésirable associé à un produit du cannabis
- Nous joindre
Points forts
En 2023, Santé Canada a reçu 128 déclarationsNote de bas de page 1 d'effets indésirables (comprend les déclarations en double, par exemple lorsque plusieurs personnes déclarent le même effet indésirable) associés au cannabis comme substance suspecte.
Sur les 128 déclarations, 56 étaient des cas uniquesNote de bas de page 2 associés à des produits du cannabis légaux.
Parmi les 56 cas uniques mettant en cause des produits du cannabis légaux :
- 45 % concernaient des femmes et 39 % des hommes
- 59 % concernaient du cannabis consommé à des fins médicales (autodéclarées)
- 64 % concernaient des extraits de cannabis
- 27 % des cas concernaient des adultes de 18 à 44 ans et 23 % ne contenaient pas d'information concernant l'âge
- 52 % des cas ont été signalés comme étant graves, et la raison la plus fréquemment invoquée était « autre » (affection importante sur le plan médical)
207 événements indésirables signalés dans les 56 cas uniques ont fait l'objet d'une évaluation de la causalité; 96 ont été jugés comme étant certainement, probablement ou possiblement liés au(x) produit(s) du cannabis suspect(s). Les événements indésirables les plus fréquemment signalés dans l'ensemble des cas concernant des produits du cannabis légaux pour lesquels une relation de causalité a été établie sont :
- céphalée (n = 7)
- vomissements (n = 5)
- sensation vertigineuse (n = 5)
- agitation (n=3)
- perte de conscience (n = 3)
- anxiété (n = 3)
En 2023, il n'y a pas eu de cas suspects de maladie pulmonaire associée au vapotage (MPAV).
De nombreux résultats sont restés constants entre 2022 et 2023, mais certains changements ont été observés, notamment :
- une diminution du nombre total de cas (graves et non graves)
- un changement dans les raisons de la gravité indiquées par les déclarants
- les types d'événements indésirables signalés et, dans certains cas, les types de personnes impliquées dans les cas d'effets indésirables (p. ex. la distribution par sexes)
Santé Canada continue de surveiller, d'évaluer et de signaler les effets indésirables associés au cannabis, et les résultats continueront d'être utilisés pour préparer des documents éducatifs fondés sur des données probantes concernant les risques pour la santé et la sécurité associés au cannabis, notamment des communications sur les risques et des ressources éducatives.
Introduction
Le présent rapport décrit les résultats des rapports de cas nationaux d'effets indésirables associés au cannabis saisis dans la base de données de Canada Vigilance de Santé Canada et analysés par le Bureau de la science et de la surveillance du cannabis de la Direction générale des substances contrôlées et du cannabis de Santé Canada. Ce travail fait partie du Cadre de vigilance du cannabis mis en place depuis l'entrée en vigueur de la Loi sur le cannabis et du Règlement sur le cannabis (17 octobre 2018).
Ce rapport annuel de données présente un résumé de toutes les déclarations de cas nationaux d'effets indésirables signalés à Santé Canada entre le 1er janvier 2023 et le 31 décembre 2023 qui sont soupçonnés d'être associés à un produit du cannabis destiné à la consommation humaine tel que défini par la Loi sur le cannabis ou son règlement.
Aux fins du présent rapport :
- Produit du cannabis légal : Désigne le cannabis d'une seule des catégories visées à l'annexe 4 de la Loi - ou de tout accessoire contenant de ce cannabis, une fois emballé et étiqueté pour la vente au détail aux consommateurs. Ce terme ne comprend pas :
- le cannabis destiné à un animal
- les produits de santé contenant du cannabis ou à utiliser avec du cannabis
- un accessoire de cannabis qui contient du cannabis destiné à un animal
- Effet indésirable : Désigne une réaction nocive et non voulue à un produit du cannabis ou à un accessoire qui en contient.
- Effet indésirable grave : Désigne un effet indésirable qui nécessite ou prolonge une hospitalisation, entraîne une malformation congénitale, une invalidité ou une incapacité persistante ou importante, met la vie en danger ou entraîne la mort.
Les titulaires de licence qui vendent ou distribuent un produit du cannabis doivent présenter à Santé Canada un rapport détaillé dans les 15 jours suivant la date à laquelle ils prennent connaissance d'un effet indésirable grave au produit du cannabis. Ce rapport doit contenir toutes les données qu'ils ont en leur possession associées à la consommation du produit du cannabis par l'individu touché.
Les groupes suivants peuvent également transmettre volontairement des déclarations d'effets indésirables à Santé Canada :
- Patients
- Consommateurs
- Professionnels de la santé
- Cliniques de cannabis médical
- Autres déclarants, tels que les détaillants autorisés par les provinces et les territoires
Les rapports d'effets indésirables peuvent également être reçues par les détenteurs d'une autorisation de mise sur le marché de produits de santé autorisés qui déclarent des effets indésirables associés à d'autres produits de santé suspects (comme des médicaments sur ordonnance ou en vente libre, ou des produits de santé naturels) pour lesquels le cannabis est également suspecté.
Les signalements d'effets indésirables du cannabis peuvent concerner les éléments suivants :
- Produit du cannabis de source illégale
- Produit du cannabis légal
- Produit du cannabis cultivéNote de bas de page 3 ou produitNote de bas de page 4 à domicile à des fins personnelles
- non défini (cannabis en tant que substance, sans précision)
Aux fins du présent rapport, les rapports de cas concernant un produit du cannabis légal (c.-à-d. identifiable par la marque du produit ou le titulaire de licence) sont classés en fonction de l'utilisation prévue des produits du cannabis, comme suit :
- Consommation de cannabis à des fins non médicales : Si le rapport de cas d'effets indésirables ne mentionne aucune raison d'utilisation ou d'indication thérapeutique, ne fournit que des détails minimaux ou n'indique qu'une utilisation prévue à des fins non médicales, il est classé dans la catégorie « cannabis utilisé à des fins non médicales ».
- Consommation de cannabis à des fins médicales : Comprend les rapports de cas décrits comme étant associés à la consommation de cannabis conformément à un document d'autorisation médicale fourni par un professionnel de la santé, ou les cas indiquant une consommation de cannabis à des fins médicales ou thérapeutiques, sans mention d'un document d'autorisation médicale. Cette définition correspond à la définition de l'utilisation médicale qui figure dans l'Enquête canadienne sur le cannabis. Celle-ci a une portée plus large que la définition de la consommation de cannabis à des fins médicales figurant dans le Règlement sur le cannabis, laquelle n'inclut que la consommation du cannabis en vertu d'un document d'autorisation médicale rempli par un professionnel de la santé.
Les rapports de cas d'effets indésirables sont recueillis et conservés dans la base de données de Canada Vigilance. La plupart des rapports de cas d'effets indésirables sont signalés spontanément à Santé Canada par des consommateurs, des patients, des professionnels de la santé ou des titulaires de licence (appelés « détenteurs d'une autorisation de mise sur le marché » dans la base de données de Canada Vigilance). Toutefois, ils peuvent également provenir d'études de recherche, notamment :
- des études de cas publiées
- des études observationnelles (non interventionnelles, en situation réelle)
- des études interventionnelles humaines portant sur le cannabis qui ne répondent pas à la définition d'un essai clinique (p. ex. des études sur la recherche non thérapeutique sur le cannabis)
- d'autres systèmes organisés de collecte de données (p. ex. des registres de patients)
Bien que les rapports provenant d'essais cliniques puissent figurer dans l'ensemble des données de Canada Vigilance, ils sont toutefois exclus du présent rapport de données, car ils relèvent du cadre des essais cliniques en vertu de la Loi sur les aliments et drogues et de son règlement.
Santé Canada effectue une surveillance, une détection et une évaluation en temps réel des cas d'effets indésirables liés aux produits du cannabis conformément au Cadre de vigilance du cannabis. Santé Canada surveille également les cas concernant le cannabis en tant que substance pour des questions plus larges d'importance pour la santé publique, notamment les suivantes :
- Maladies pulmonaires associées au vapotage
- Cas concernant des populations pédiatriques
- Autres problèmes d'innocuité émergents potentiels
Le présent rapport a pour but de fournir un bref résumé des déclarations d'effets indésirables associés au cannabis, ainsi qu'une analyse descriptive des types d'effets indésirables concernant des produits du cannabis légaux transmis à Santé Canada entre le 1er janvier 2023 et le 31 décembre 2023.
Outre l'analyse descriptive des cas de 2023, des comparaisons avec le rapport de la période de déclaration précédente (du 1er janvier 2022 au 31 décembre 2022) ont été effectuées, le cas échéant. Ces comparaisons sont largement descriptives et l'importance des différences n'a pas été examinée d'un point de vue statistique dans la plupart des cas en raison de la nature limitée des données. Il convient donc de faire preuve de prudence lors de l'interprétation de ces changements dans les résultats au cours des deux périodes de déclaration.
Les données des autres périodes de déclaration, notamment les tendances entre les périodes, sont également accessibles au public :
- Résultats principaux : Effets secondaires liés au cannabis
- Données sur les effets indésirables du cannabis
Il est à noter que ce rapport ne couvre pas les données sur les effets indésirables associés aux produits de santé, y compris les médicaments contenant du cannabis, qui sont régis par la Loi sur les aliments et drogues et son règlement.
Considérations
Certaines mises en garde doivent être prises en compte lors de l'interprétation des données sur les effets indésirables figurant dans ce rapport.
L'inclusion d'une déclaration particulière dans la base de données ne signifie pas nécessairement qu'il y a une relation de cause à effet entre le produit du cannabis visé et l'événement indésirable déclaré. Des études scientifiques supplémentaires sont nécessaires pour établir une relation de causalité.
Les effets indésirables sont généralement signalés spontanément à Santé Canada et ne peuvent pas être utilisés pour déterminer l'incidence ou la prévalence des effets indésirables du cannabis dans la population générale.
Les effets indésirables graves sont davantage représentés dans cet ensemble de données, car les titulaires de licence ont l'obligation réglementaire de les déclarer à Santé Canada en vertu de l'article 248.1 du Règlement sur le cannabis. Le signalement des effets indésirables non graves par les titulaires de licence à Santé Canada sous forme de rapports de cas individuels est volontaireNote de bas de page 5; par conséquent, les cas non graves sont probablement sous-déclarés et sous-représentés dans cet ensemble de données.
Les déclarations des effets indésirables des produits du cannabis sont volontaires pour les personnes et établissements suivants :
- Hôpitaux
- Consommateurs
- Cliniques de cannabis médical
- Professionnels de la santé
- Détaillants autorisés par une province ou un territoire
Par conséquent, les cas signalés par les déclarants volontaires, qu'ils soient graves ou non graves, sont probablement sous-déclarés.
Les personnes qui subissent des effets indésirables graves ou qui utilisent des produits à base de cannabis à des fins médicales peuvent être plus motivées à les signaler ou à consulter un médecin.
Plusieurs facteurs peuvent influencer le nombre et la qualité des cas déclarés à Santé Canada, notamment :
- la couverture médiatique
- la raison de la consommation de cannabis
- les antécédents médicaux du consommateur ou du patient
- la durée de mise en marché d'un produit
- la connaissance de la possibilité de signaler les cas, ainsi que la motivation et la capacité à le faire
- la méthode de signalement (systèmes de déclaration spontanés ou systèmes de collecte de données organisés)
Ce rapport comprend de l'information sur le cannabis à des fins médicales et non médicales, toutefois, le nombre de cas pourrait ne pas correspondre directement à ce qui est présenté dans le présent rapport de données en raison des différentes dates d'extraction de la base de données de Canada Vigilance (p. ex. le rapport intitulé Effets indésirables des produits de santé - rapport annuel 2022).
Effets indésirables du cannabis
Effets indésirables associés au cannabis en tant que substance
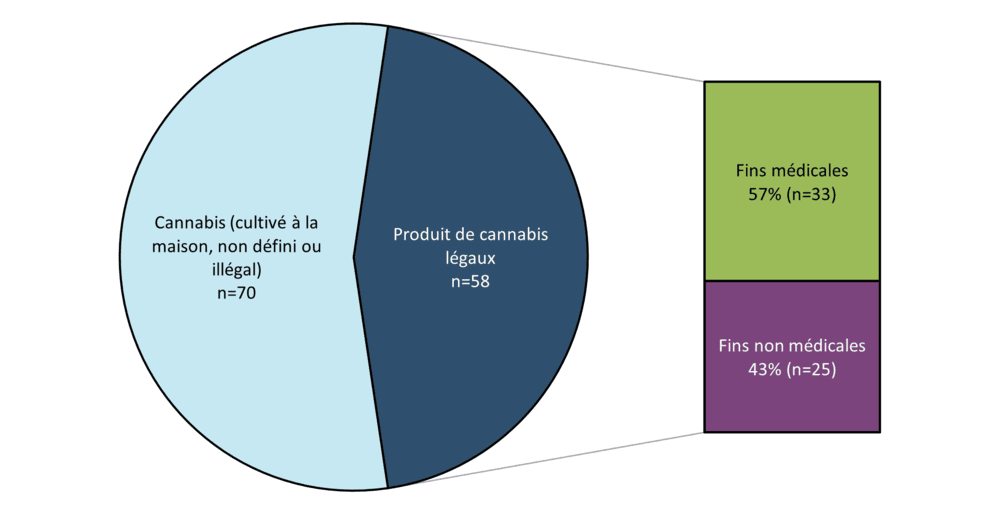
Figure 1 - Équivalent textuel
| Nombre de rapports | Proportion (en %) | ||
|---|---|---|---|
| Cannabis cultivé à la maison, non défini ou illégal | 70 | 55 | |
| Produit de cannabis légaux - Fins médicales | 33 | 26 | |
| Produit de cannabis légaux - Fins non médicales | 25 | 20 | |
| Total | 128 | 100 | |
Mises en garde
- Cette figure représente l'ensemble des déclarations saisies dans la base de données de Canada Vigilance en 2023 dans lesquelles le cannabis en tant que substance est mis en cause, y compris les déclarations en double lorsque les détails du cas sont les mêmes, mais que les déclarants diffèrent (n = 23)
- Les cas sont classés au sein de Canada Vigilance selon s'ils concernent l'utilisation de produits du cannabis légaux utilisés à des fins médicales ou non médicales (une classification par cas). Les cas qui ne mettent pas en cause de produits du cannabis provenant de sources légales n'ont pas de classification attribuée et restent classés comme substance seulement (cannabis non défini ou illégal)
- En vertu de la Loi sur le cannabis et du Règlement sur le cannabis, les adultes sont autorisés à cultiver jusqu'à un maximum de quatre plants de cannabis à des fins personnelles. Toutefois, ce cannabis ne peut pas être légalement emballé et étiqueté pour la vente au détail. Par conséquent, les déclarations d'effets indésirables associées à du cannabis cultivé à domicile sont séparées des rapports concernant des produits du cannabis légaux
Au total, 128 déclarations (incluant les doublesNote de bas de page 6) concernant le cannabis en tant que substance suspecte ont été transmises à Santé Canada entre le 1er janvier 2023 et le 31 décembre 2023, dont :
- 55 % (70 / 128 rapports) concernaient du cannabis provenant d'une source inconnue ou illégale. Ces rapports mentionnaient du « cannabis » ou de la « marijuana » sans détails précis
- 41 % (29 / 128 rapports) concernaient non seulement du cannabis, mais d'autres substances ou produits de santé dont la consommation était soupçonnée (c.-à-d. l'utilisation de plusieurs substances ou médicaments), ce qui représente une augmentation par rapport aux 19 % de 2022
- 45 % (58/ 128 rapports) concernaient des produits du cannabis légaux, dont la plupart étaient autodéclarés comme étant utilisés à des fins médicales (57 %, 33 / 128 rapports)
- aucun rapport concernant du cannabis cultivé à domicile n'a été transmis en 2023
Cas de maladie pulmonaire associée au vapotage (MPAV)
Santé Canada continue de surveiller les rapports de cas soupçonnés de MPAV.
Aucun cas soupçonné de MPAV concernant du cannabis n'a été saisi dans la base de données de Canada Vigilance en 2023.
Pour obtenir de plus amples renseignements sur les MPAV au Canada :
- Maladie pulmonaire associée au vapotage
- Avis de santé publique : Épidémie de maladie pulmonaire associée au vapotage (MPAV) de septembre 2019 à août 2021 au Canada
Cas pédiatriques (moins de 18 ans)
En 2023, 44 rapports de cas pédiatriques (moins de 18 ans) d'effets indésirables associés à du cannabis ont été recensés, une augmentation par rapport aux 39 déclarations de 2022, dont :
- 52 % (23 / 44 rapports) concernaient du cannabis de source inconnue
- 43 % (19 / 44 rapports) concernaient du cannabis provenant d'une source illégale identifiable ou suspectée
- 4,5 % (2 / 44 rapports) concernaient des produits du cannabis légaux
En ce qui concerne les voies d'administration :
- 41 % (18 / 44 rapports) concernaient du cannabis consommé par voie orale, le plus souvent sous forme de produit (14 / 18 rapports)
- 27 % (12 / 44 rapports) concernaient l'inhalation comme voie d'administration, principalement du cannabis fumé (11 / 12 rapports)
- 14 rapports où la voie d'administration était inconnue
Santé Canada surveille également les rapports de cas d'ingestion accidentelle de cannabis dans la population pédiatrique. 36 % (16 / 44 rapports) concernaient une exposition accidentelle ou non intentionnelle au cannabis, et toutes les déclarations concernaient du cannabis provenant d'une source inconnue ou illégale. Ces rapports proviennent souvent du Système canadien de surveillance des données sur les intoxications et de l'étude du Programme canadien de surveillance pédiatrique sur la consommation du cannabis à des fins non médicales chez les enfants et les adolescents.
Santé Canada continue de surveiller les expositions pédiatriques soupçonnées d'être associées au cannabis et d'adopter des stratégies appropriées d'atténuation des risques, le cas échéant. En mars 2023, Santé Canada a lancé une campagne de sensibilisation publique sur la prévention et l'identification des empoisonnements au cannabis chez les enfants. En mai 2023, Santé Canada a publié un avis public mis à jour sur l'ingestion accidentelle de produits comestibles du cannabis par des enfants. Liens vers les avis :
- Le cannabis au Canada : Renseignez-vous sur les faits
- Avis public : Ingestion accidentelle de produits de cannabis comestibles illicites de contrefaçon causant de graves méfaits aux enfants
Les rapports de cas concernant des produits du cannabis à des fins médicales et non médicales autodéclarées provenant du marché légal et régi par la Loi sur le cannabis et son règlement constituent le fondement des autres parties du présent rapport annuel.
Effets indésirables associés aux produits du cannabis légaux
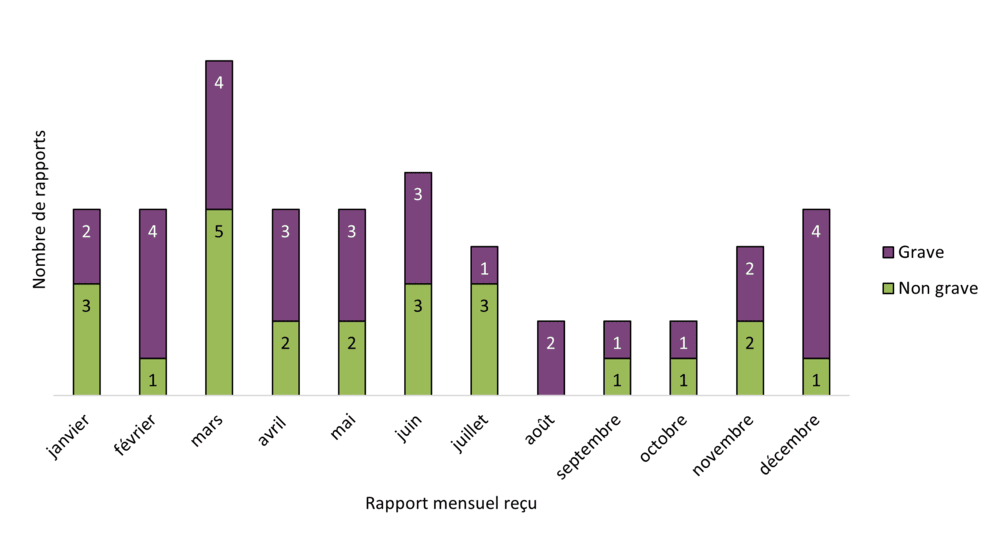
Figure 2 - Équivalent textuel
| Mois de réception du rapport | Nombre de rapport par gravité | ||
|---|---|---|---|
| Non grave | Grave | Total | |
| janvier | 3 | 2 | 5 |
| février | 1 | 4 | 5 |
| mars | 5 | 4 | 9 |
| avril | 2 | 3 | 5 |
| mai | 2 | 3 | 5 |
| juin | 3 | 3 | 6 |
| juillet | 3 | 1 | 4 |
| août | 0 | 2 | 2 |
| septembre | 1 | 1 | 2 |
| octobre | 1 | 1 | 2 |
| novembre | 2 | 2 | 4 |
| décembre | 1 | 4 | 5 |
| Total | 24 | 30 | 54 |
Mises en garde
- Cette figure comprend des déclarations en double où les détails sont les mêmes, mais les déclarants diffèrent (n = 2)
- La gravité est fondée sur la déclaration initiale et peut être modifiée si des renseignements supplémentaires sont transmis à Santé Canada
- Cette figure exclut 4 cas pour lesquels la gravité était inconnue. En 2023, Santé Canada a ajouté cette nouvelle catégorie afin de représenter les cas transmis au moyen d'autres formulaires de déclaration qui pourraient ne pas offrir l'option d'indiquer la gravité. Par conséquent, ces cas peuvent être saisis différemment dans d'autres bases de données
- Les déclarations sont présentées selon la date initiale de réception par la base de données de Canada Vigilance. La date réelle de l'effet indésirable peut ne pas correspondre au mois où la déclaration a été reçue (décalage entre l'événement et la déclaration)
Aucune tendance temporelle nette n'a été observée à l'égard du nombre total de rapports de cas d'effets indésirables associés à des produits du cannabis légaux transmis à Santé Canada en 2023. Le nombre moyen de déclarations transmises à Santé Canada par mois au cours de la période de référence était d'environ 4,5, allant de 2 à 9 cas par mois.
Certaines tendances descriptives ont été observées en 2023 par rapport à 2022. Le nombre total de déclarations (graves et non graves) et le nombre moyen de signalements d'effets indésirables graves et non graves par mois ont diminué en 2023 (nombre total de signalements : de 95 à 54; nombre moyen de signalements par mois : de 7,9 à 4,5). De plus, le nombre total de déclarations graves transmises à Santé Canada a diminué (de 72 en 2022 à 30 en 2023), tandis que le nombre total de déclarations non graves a légèrement augmenté (de 23 en 2022 à 24 en 2023).
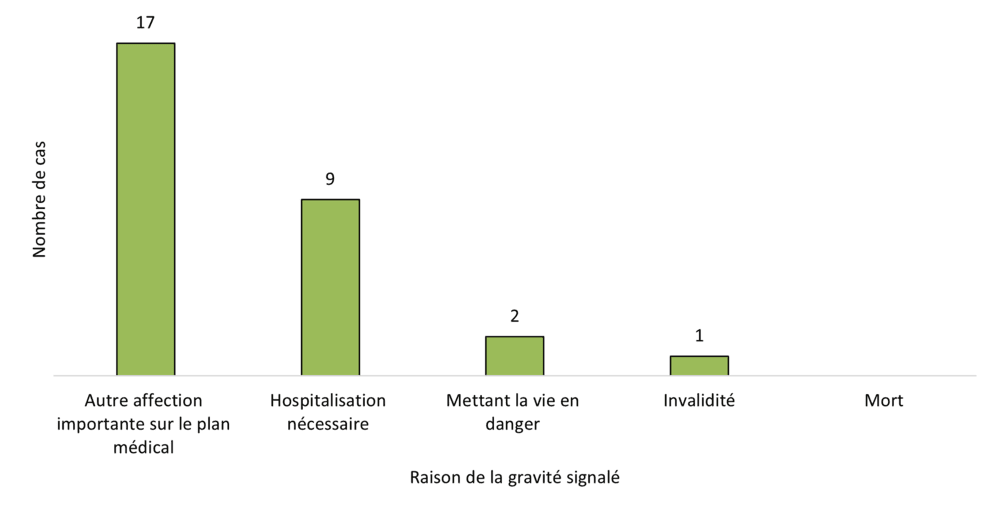
Figure 3 - Équivalent textuel
| Raison de la gravité signalée | Nombre de cas |
|---|---|
| Autre affection importante sur le plan médical | 17 |
| Hospitalisation nécessaire | 9 |
| Mettant la vie en danger | 2 |
| Invalidité | 1 |
| Mort | 0 |
| Total | 29 |
Mises en garde
- Cette figure comprend des cas uniques où le déclarant a indiqué que l'effet indésirable était grave (n = 29)
- Elle exclut 4 cas pour lesquels la gravité était inconnue. En 2023, Santé Canada a ajouté cette nouvelle catégorie afin de représenter les cas transmis au moyen d'autres formulaires de déclaration qui pourraient ne pas offrir l'option d'indiquer la gravité. Par conséquent, ces cas peuvent être saisis différemment dans d'autres bases de données
- Chaque cas grave peut avoir plu d'une raison de gravité puisque le déclarant peut en choisir plusieurs.
En 2023, tous les cas graves signalés à Santé Canada comportaient une seule raison de gravité, pour un total de 29 réponses couvrant quatre catégories sélectionnées par les déclarants (Figure 3). La raison de la gravité la plus fréquemment citée était « autre affection importante sur le plan médical » (59 %, 17 / 29 cas), suivie par « hospitalisation nécessaire » (31 %, 9 / 29 cas). La catégorie « autre affection importante sur le plan médical » comprend les événements qui ne mettent pas immédiatement la vie en danger ou n'entraînent pas le décès ou l'hospitalisation, mais qui peuvent mettre le patient en danger ou nécessiter une intervention médicale (p. ex. l'intervention des services ambulatoires, des visites aux urgences, des visites ambulatoires avec un professionnel de la santé ou des interventions médicales à domicile) pour prévenir un résultat grave. En 2022, la raison la plus fréquemment invoquée pour expliquer la gravité de l'effet indésirable était également « autre affection importante sur le plan médical » (59 %, 41 / 69 cas).
Aucun cas mortel associé à des produits du cannabis légaux n'a été signalé en 2023. En comparaison, deux cas mortels ont été signalés en 2022. Deux cas ont été signalés comme « mettant la vie en danger » (une diminution par rapport à quatre cas en 2022) et un cas a déclaré une « incapacité » (une augmentation par rapport à 0 cas en 2022).
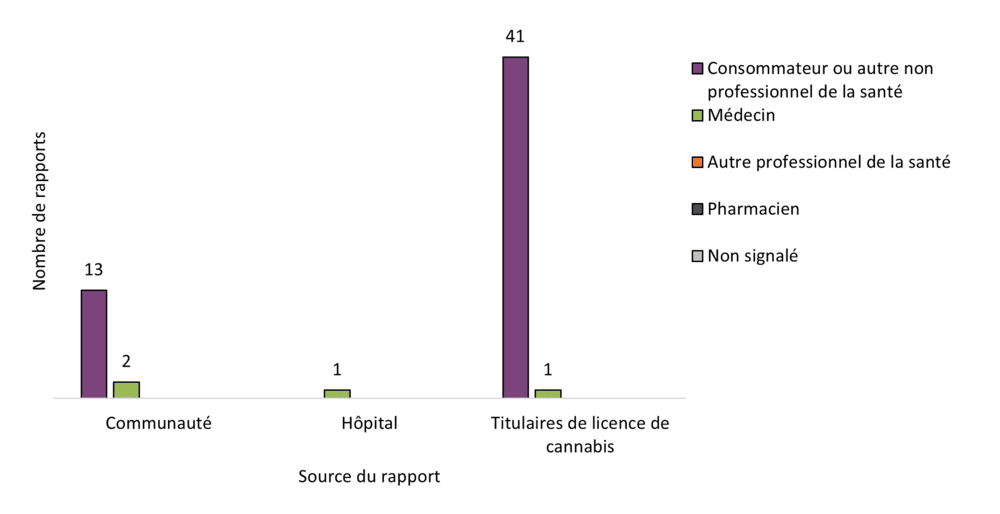
Figure 4 - Équivalent textuel
| Source du rapport | Type de déclarant initial | |||||
|---|---|---|---|---|---|---|
| Consommateur ou autre non professionnel de la santé | Médecin | Autre professionnel de la santé | Pharmacien | Non signalé | Total | |
| Communauté | 13 | 2 | 0 | 0 | 0 | 15 |
| Hôpital | 0 | 1 | 0 | 0 | 0 | 1 |
| Titulaires de licence de cannabis | 41 | 1 | 0 | 0 | 0 | 42 |
| Total | 54 | 4 | 0 | 0 | 0 | 58 |
Mises en garde
- Cette figure comprend des déclarations en double dans lesquelles les détails du cas sont les mêmes, mais où les déclarants diffèrent (n = 2)
- Les signalements des professionnels de la santé sont considérés comme médicalement confirmés, conformément aux lignes directrices internationalesNote de bas de page 7; ils sont donc différents des signalements des consommateurs
- Dans cette figure, chaque source de déclaration a été subdivisée en fonction du type de déclarant initial (consommateur ou professionnel de la santé [médecins, pharmaciens ou autres professionnels de la santé])
- La source de la déclaration indique la personne qui a fait le signalement à Santé Canada (communauté, hôpital ou détenteur d'une autorisation de mise sur le marché [dans les cas concernant des produits du cannabis légaux, le terme « titulaire de licence » est employé])
La plupart des déclarations d'effets indésirables mettant en cause des produits du cannabis légaux ont été transmises à Santé Canada par des titulaires de licence de cannabis (72 %, 42 / 58 rapports). Parmi les déclarations des titulaires de licence de cannabis, le principal type de déclarant initial était les consommateurs (98 %, 41 / 42 rapports). Les consommateurs représentaient également le principal type de déclarant initial provenant de la communauté (c.-à-d. les déclarations transmises directement à Santé Canada). Ces tendances descriptives en matière de déclaration sont conformes aux observations de 2022, à savoir que les consommateurs sont plus portés à déclarer les effets indésirables directement aux titulaires de licence, lesquels les soumettent ensuite à Santé Canada conformément à leurs obligations en matière de déclaration. De plus, le nombre de déclarations d'effets indésirables graves et non graves provenant des professionnels de la santé a continué de diminuer (2018-2019 : n = 36; 2020 : n = 18; 2021 : n = 8; 2022 : n = 10; 2023 : n = 4). Une déclaration d'effet indésirable lié au cannabis légal a été transmise par un hôpital en 2023, ce qui représente une augmentation par rapport à 2022.
En vertu de la Loi visant à protéger les Canadiens contre les drogues dangereuses (c.-à-d. la Loi de Vanessa), depuis le 16 décembre 2019, les hôpitaux sont tenus de signaler à Santé Canada tous les effets indésirables graves associés à des drogues suspectes (y compris les médicaments contenant du cannabis), consommées avec ou sans autres produits suspects. Les cas concernant une autre drogue suspecte ou un autre produit du cannabis suspect doivent également être signalés à Santé Canada. Toutefois, en vertu de la Loi sur le cannabis et de son règlement, les hôpitaux peuvent envisager de déclarer, sur une base volontaire, les effets indésirables associés uniquement au cannabis comme seul produit suspect.
Données démographiques
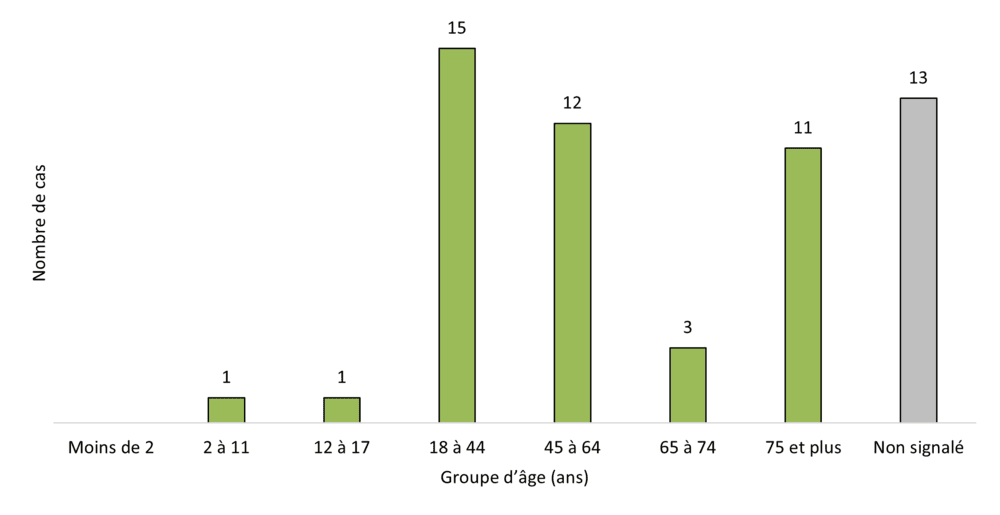
Figure 5 - Équivalent textuel
| Groupe d'âge (années) | Nombre de cas |
|---|---|
| Moins de 2 | 0 |
| 2 à 11 | 1 |
| 12 à 17 | 1 |
| 18 à 44 | 15 |
| 45 à 64 | 12 |
| 65 à 74 | 3 |
| 75 et plus | 11 |
| Non signalé | 13 |
| Total | 56 |
Mises en garde
- Cette figure exclut des déclarations en double dans lesquelles les détails du cas sont les mêmes, mais où les déclarants diffèrent (n = 2)
- Lorsque, pour un cas donné, l'année de naissance et la date à laquelle l'effet est survenu figurent dans le rapport, l'âge est calculé en fonction de ces chiffres (c'est-à-dire, âge = date de la réaction - année de naissance)
- Lorsque l'année de naissance est indiquée, mais la date à laquelle l'effet est survenu ne l'est pas, la date à laquelle le rapport a été transmis est utilisée pour calculer l'âge
L'âge moyen des personnes ayant présenté un effet indésirable lié à des produits du cannabis légaux en 2023 était d'environ 51,6 ans (intervalle de confiance [IC] à 95 % : 44,6 à 58,6), la fourchette d'âge variant entre 8 ans et 93 ans. Cette moyenne concorde avec celle de 2022, qui était de 52 ans (IC à 95 % : 46 à 57), la fourchette d'âge variant entre 3 ans et 97 ans.
Lorsqu'ils sont classés selon les groupes d'âge de la base de données Vigilyze (Vigibase) de l'Organisation mondiale de la Santé (OMS), la plupart des cas concernent des personnes âgées de 18 à 44 ans (27 %, 15 / 56 cas). Ces données concordent avec celles de 2022 (18 à 44 ans : 22 %, 20 / 92 cas). Les adultes de 65 ans et plus représentaient 25 % des cas (14 / 56 cas) en tant que catégorie composite, soit une augmentation par rapport aux 21 % de 2022. Deux cas pédiatriques (moins de 18 ans) concernant des produits du cannabis légaux (l'un d'eux étant autorisé à des fins médicales) ont été signalés à Santé Canada en 2023, ce qui est similaire aux données de 2022 (n = 2).
En 2023, de nombreux cas ne contenaient pas d'information concernant l'âge (23 %, 13 / 56 cas), une proportion comparable à celle de 2022 (38 %, 35 / 92 cas).
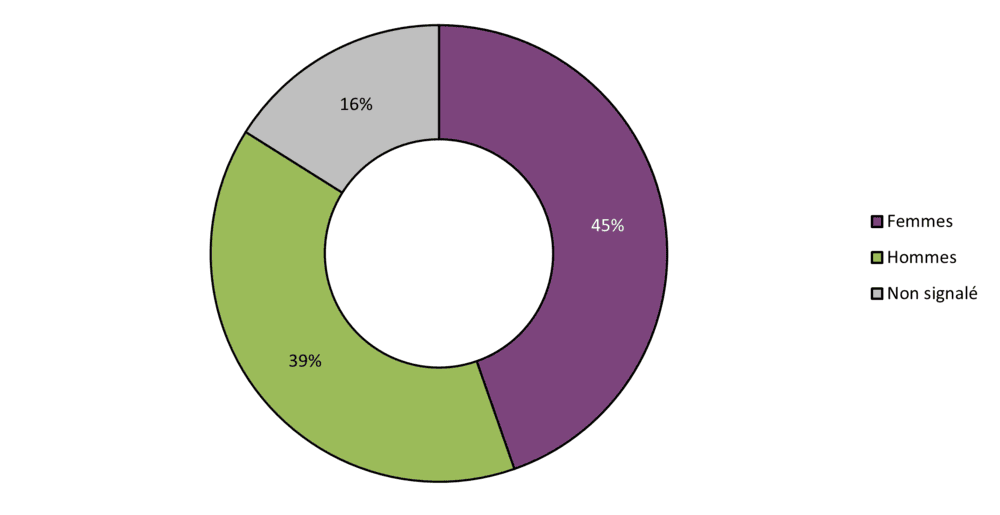
Figure 6 - Équivalent textuel
| Sexe | Nombre de cas | Proportion (en %) |
|---|---|---|
| Femmes | 25 | 45 |
| Hommes | 22 | 39 |
| Non signalé | 9 | 16 |
| Total | 56 | 100 |
Mises en garde
- Cette figure exclut des déclarations en double dans lesquelles les détails du cas sont les mêmes, mais où les déclarants diffèrent (n = 2)
La plupart des cas d'effets indésirables signalés à Santé Canada en 2023 concernaient des femmes (45 %, 22 / 56 cas), tandis que 39 % concernaient des hommes (22 / 56 cas). La répartition des cas par sexe était différente à celle de 2022, en ce sens que les hommes représentaient une plus grande proportion des cas que les femmes (femmes : 28 %; hommes : 40 %). Le nombre de cas pour lesquels le sexe n'était pas déclaré a diminué à 16 %, comparativement à 32 % en 2022, 28 % en 2021 et 8 % en 2020).
Le sexe et l'âge peuvent être absents des rapports pour plusieurs raisons, notamment parce que les consommateurs ne veulent pas divulguer cette information aux titulaires de licence ou à Santé Canada ou parce que les cas proviennent d'autres formulaires de déclaration, comme le Formulaire de déclaration relative au cannabis, qui ne saisit pas ce type de renseignement démographique.
Produits du cannabis suspects
La plupart des cas d'effets indésirables signalés en 2023 étaient associés à des produits du cannabis légaux comme seul produit suspect (84 %, 47 / 56 cas). Aucun produit de santé n'a été déclaré comme co-suspect. Les produits de santé peuvent comprendre :
- les produits de santé naturels
- les médicaments sur ordonnance ou en vente libre
- d'autres types de produits de santé réglementés par la Loi sur les aliments et drogues
Cependant, 39 % des cas (22 / 56 cas) étaient associés à au moins un produit concomitant. Un produit concomitant est un produit utilisé au moment de l'effet indésirable, mais qui n'est pas considéré par le déclarant comme étant à l'origine de l'effet indésirable. Il peut s'agir :
- de produits de santé
- de substances illégales
- d'autres substances réglementées (p. ex. alcool, tabac ou autres produits de vapotage tels que la nicotine ou les arômes)
Une minime proportion de cas (11 %, 6 / 56 cas), deux produits du cannabis suspects ou plus ont été signalés, l'intervalle variant entre deux et trois produits du cannabis, semblablement à 2022 (7 %, 6 / 92 cas). Il convient de noter que les produits suspects sont désignés comme tels par le déclarant et que le rôle d'autres facteurs, incluant d'autres produits ou substances, ne peut pas toujours être exclu. Ces considérations font partie de l'évaluation clinique dans la partie du résumé clinique du présent rapport.
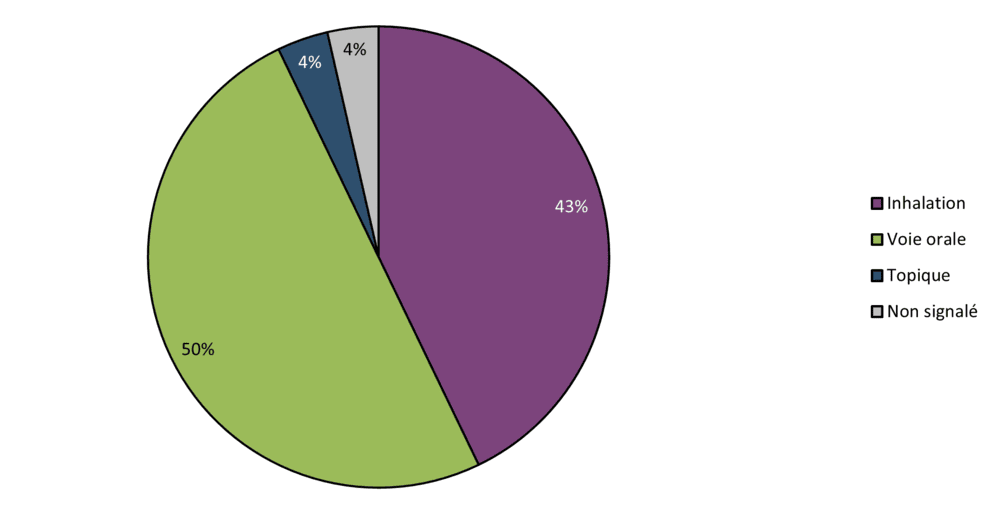
Figure 7 - Équivalent textuel
| Voie d'administration | Nombre de cas | Proportion (en %) |
|---|---|---|
| Inhalation | 24 | 43 |
| Voie orale | 28 | 50 |
| Topique | 2 | 4 |
| Non signalé | 2 | 4 |
| Total | 56 | 100 |
Mises en garde
- Cette figure décrit la voie d'administration des produits du cannabis suspects associés aux cas, qui est codée séparément de la forme posologique (c.-à-d. qu'un produit à base d'huile de cannabis peut être ingéré ou appliqué topiquement sur la peau)
- Cette figure exclut des déclarations en double dans lesquelles les détails du cas sont les mêmes, mais où les déclarants diffèrent (n = 2)
- Les cas peuvent être associés à plus d'un produit du cannabis suspect; par conséquent, plusieurs voies d'administration peuvent être indiquées pour un seul cas
- L'inhalation fait référence à la consommation de cannabis par les voies respiratoires sous forme de fumée ou par vaporisation, parmi d'autres
- L'administration par voie orale fait référence à la consommation de cannabis par la bouche et peut comprendre l'ingestion, l'administration buccale, l'administration sublinguale, etc., ce qui signifie que l'absorption peut se produire dans le tractus gastro-intestinal ainsi que directement dans la circulation sanguine à travers les tissus des muqueuses buccales
Les produits de cannabis suspects associés à des cas d'effets indésirables concernaient presque à égalité le cannabis consommé par voie orale (50 %, 28 / 56 cas) et par inhalation (43 %, 25 / 56 cas). L'application topique a été en cause dans 4 % des cas (2 / 56 cas). Aucun cas associé à la voie d'administration sublinguale n'a été signalé. La voie d'administration était inconnue dans 4 % des cas (2 / 56 cas). Ces résultats sont semblables à ceux de 2022, où la consommation par inhalation était presque égale à l'administration par voie orale (47 % contre 46 % respectivement).
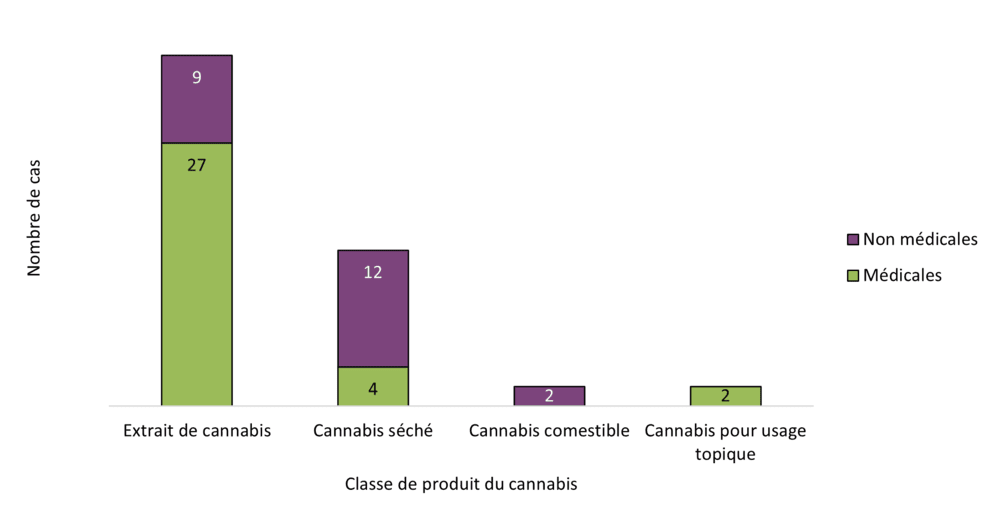
Figure 8 - Équivalent textuel
| Classe de produit du cannabis | Raison d'utilisation | ||
|---|---|---|---|
| Médicales | Non médicales | Total | |
| Extrait de cannabis | 27 | 9 | 36 |
| Cannabis séché | 4 | 12 | 16 |
| Cannabis comestible | 0 | 2 | 2 |
| Cannabis pour usage topique | 2 | 0 | 2 |
| Total | 33 | 23 | 56 |
Mises en garde
- Cette figure exclut des déclarations en double dans lesquelles les détails du cas sont les mêmes, mais où les déclarants diffèrent (n = 2)
Un plus grand nombre de cas d'effets indésirables signalés en 2023 étaient associés à des produits du cannabis utilisés à des fins médicales autodéclarées qu'à des fins non médicales (59 %, 33 / 56 cas et 41 %, 23 / 56 cas, respectivement). Une grande proportion des cas mettant en cause des produits du cannabis à des fins médicales étaient graves (76 %, 25 / 33 cas). En revanche, la plupart des cas concernant des produits du cannabis utilisés à des fins non médicales étaient non graves (83 %, 19 / 23 cas).
Les cas étaient associés à quatre grandes catégories de produits du cannabis légaux (figure 8) :
- Extraits de cannabis (n = 36)
- Cannabis séché (n = 16)
- Cannabis comestible (n = 2)
- Cannabis pour usage topique (n = 2)
Aucun cas en 2023 n'a été signalé comme étant associé au cannabis frais. La plupart des cas concernant des produits à base d'extraits de cannabis ont été utilisés à des fins médicales (75 %, 27 / 36 cas), contrairement au cannabis séché (25 %, 4 / 16 cas). Ces observations descriptives sont conformes à celles faites en 2022.
Aucun cas concernant la transformation de produits du cannabis légaux en produits du cannabis comestibles préparés à domicile n'a été signalé en 2023.
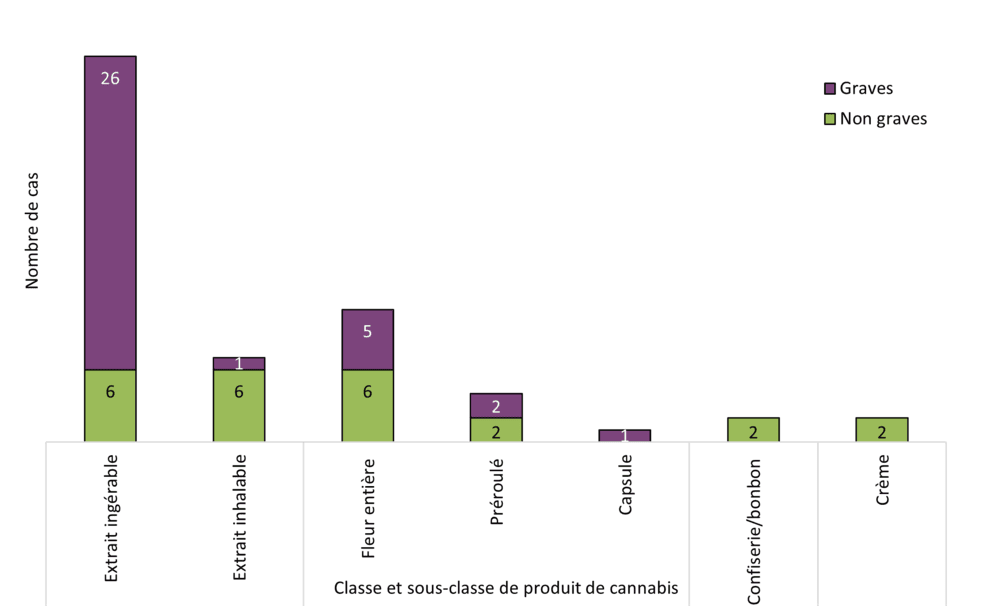
Figure 9 - Équivalent textuel
| Classe de produit de cannabis | Sous-classe de produit de cannabis | Nombre total de produits par gravité | ||
|---|---|---|---|---|
| Non graves | Graves | Total | ||
| Extrait de cannabis | Extrait ingérable | 6 | 26 | 32 |
| Extrait inhalable | 6 | 1 | 7 | |
| Cannabis séché | Fleur entière | 6 | 5 | 11 |
| Préroulé | 2 | 2 | 4 | |
| Capsule | 0 | 1 | 1 | |
| Cannabis comestible | Confiserie/bonbon | 2 | 0 | 2 |
| Cannabis pour usage topique | Crème | 2 | 0 | 2 |
| Total | 24 | 35 | 59 | |
Mises en garde
- Cette figure a été établie par Santé Canada à l'aide d'une catégorisation manuelle des cas en fonction de leur sous-catégorie de produits du cannabis suspects
- Cette figure exclut des déclarations en double dans lesquelles les détails du cas sont les mêmes, mais où les déclarants diffèrent (n = 2)
- Cette figure exclut 4 cas pour lesquels la gravité était inconnue. En 2023, Santé Canada a ajouté cette nouvelle catégorie afin de représenter les cas signalés au moyen d'autres formulaires de déclaration qui pourraient ne pas offrir l'option d'indiquer la gravité. Par conséquent, ces cas peuvent être saisis différemment dans d'autres bases de données
- Les cas peuvent concerner plusieurs produits du cannabis suspects déclarés dans différentes sous-catégories. Pour cette raison, le nombre total indiqué dans le tableau selon le nombre de produits suspects par sous-catégorie et par gravité peut dépasser le nombre de cas uniques
- La catégorie d'extrait de cannabis englobe un groupe de formes de produits diverses, comprenant les liquides ou gouttes par voie orale, les gélules, les capsules ou comprimés, les vaporisateurs sublinguaux, les bandes solubles ou les extraits hautement concentrés comme le shatter, la cire, la colophane, la résine ou les liquides de vapotage
- Le cannabis séché comprend les fleurs séchées entières, les fleurs moulues et les joints préroulés
- Les produits du cannabis comestibles comprennent les formats de type alimentaire (chocolat, confiserie, menthes) et les boissons
- Les vaporisateurs oraux (ingérables) sont notés séparément des extraits liquides ingérables qui, en raison de leur utilisation sublinguale ou oromucosale (c.-à-d. à l'intérieur de la bouche), peuvent être absorbés directement dans la circulation sanguine
Les extraits de cannabis étaient l'une des catégories de produits du cannabis les plus fréquemment signalés parmi les cas d'effets indésirables, avec le cannabis séché. Dans la catégorie des extraits de cannabis, les huiles ingérables en formats liquides (huiles embouteillées avec compte-gouttes, gélules) et les extraits inhalables (liquides de vapotage, résine) étaient les sous-catégories les plus souvent en cause. Ces observations correspondent à celles de 2022; les huiles ingérables sous forme liquide étaient également la sous-catégorie de produits la plus fréquemment en cause.
Lorsqu'on désagrège les données par sous-catégorie, les groupes d'âge des jeunes adultes et des adultes d'âge moyen (de 18 à 64 ans) ont été plus souvent impliqués dans des cas d'effets indésirables causés par des extraits inhalables (p. ex. liquides de vapotage), des fleurs entières, du cannabis pour usage topique et des produits comestibles qui contiennent du cannabis, tandis que les adultes plus âgés (65 ans et plus) ont été plus fréquemment impliqués dans des cas d'effets indésirables causés par des huiles ingérables sous forme liquide. Ce constat est dans l'ensemble conforme aux données de 2022; les groupes d'âge des jeunes adultes et des adultes d'âge moyen (de 18 à 64 ans) ont été plus souvent impliqués dans des cas d'effets indésirables causés par des liquides de vapotage et des vaporisateurs oraux, tandis que les adultes plus âgés (65 ans et plus) ont été plus fréquemment impliqués dans des cas d'effets indésirables causés par des huiles ingérables sous forme liquide et des gélules.
Types d'événements individuels signalés
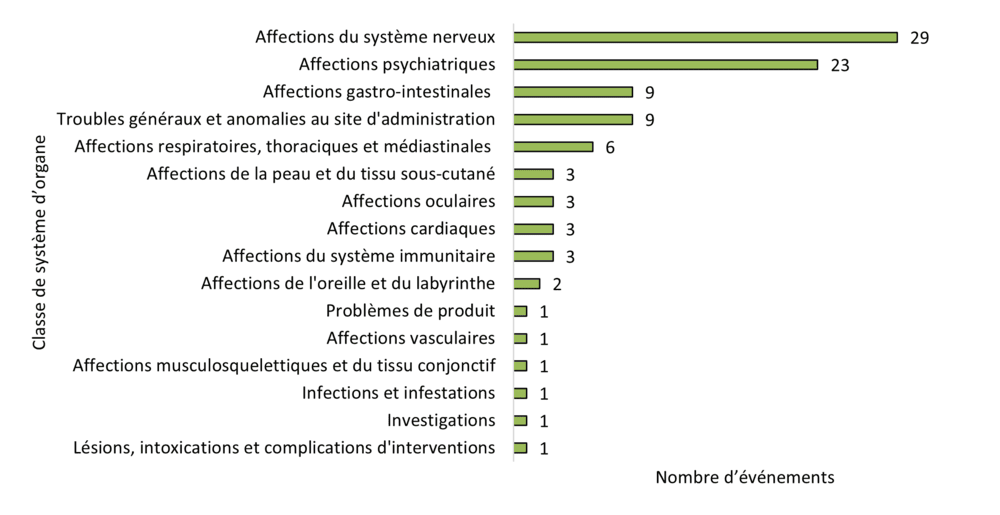
Figure 10 - Équivalent textuel
| Classe de système d'organe | Nombre d'événements |
|---|---|
| Affections du système nerveux | 29 |
| Affections psychiatriques | 23 |
| Affections gastro-intestinales | 9 |
| Troubles généraux et anomalies au site d'administration | 9 |
| Affections respiratoires, thoraciques et médiastinales | 6 |
| Affections de la peau et du tissu sous-cutané | 3 |
| Affections cardiaques Affections oculaires | 3 |
| Affections cardiaques | 3 |
| Affections du système immunitaire | 3 |
| Affections de l'oreille et du labyrinthe | 2 |
| Problèmes de produit | 1 |
| Affections vasculaires | 1 |
| Affections musculosquelettiques et du tissu conjonctif | 1 |
| Infections et infestations | 1 |
| Investigations | 1 |
| Lésions, intoxications et complications d'interventions | 1 |
Mises en garde
- Cette figure porte sur les classes de système d'organe (System Organ Class [SOC]) dans tous les cas d'effets indésirables pour lesquels Santé Canada a effectué une évaluation de la causalité qui a établi que le produit suspect était certainement, probablement ou possiblement lié à l'événement signalé
- Cette figure exclut des déclarations en double dans lesquelles les détails du cas sont les mêmes, mais où les déclarants diffèrent (n = 2)
- Chaque cas peut décrire un ou plusieurs événements médicaux individuels, indiquant un signe, des symptômes, des maladies, des diagnostics, des enquêtes et des procédures
- Les événements sont codés selon le Dictionnaire médical des affaires réglementaires (MedDRA) [en anglais], qui fournit une terminologie médicale normalisée en regroupements hiérarchiques. Le groupe du niveau le plus élevé est les SOC
- Un cas d'effets indésirables peut être représenté dans plusieurs SOC et est influencé par la façon dont les événements individuels (signes, symptômes, observations ou diagnostics) sont signalés
En 2023, Santé Canada a évalué un total de 207 événements indésirables pour en déterminer la causalité. De ce nombre, 96 événements indésirables individuels ont été évalués comme étant certainement, probablement ou possiblement liés au produit de cannabis suspect des cas. D'autres événements ont été examinés, mais ils n'ont pas été évalués ou ont été jugés peu susceptibles d'être liés au cannabis.
Lorsqu'elles sont regroupées au niveau le plus large (c.-à-d. les SOC), les cinq catégories les plus fréquentes sont les suivantes :
- affections du système nerveux (30 %, 29 / 96 événements)
- affections psychiatriques (24 %, 23 / 96 événements)
- affections gastro-intestinales (9 %, 9 / 96 événements)
- troubles généraux et anomalies au site d'administration (9 %, 9 / 96 événements)
- affections respiratoires, thoraciques et médiastinales (6 %, 6 / 96 événements)
Ces 5 principales SOC pour 2023 sont les mêmes que celles déclarées en 2022; seul l'ordre d'importance change.
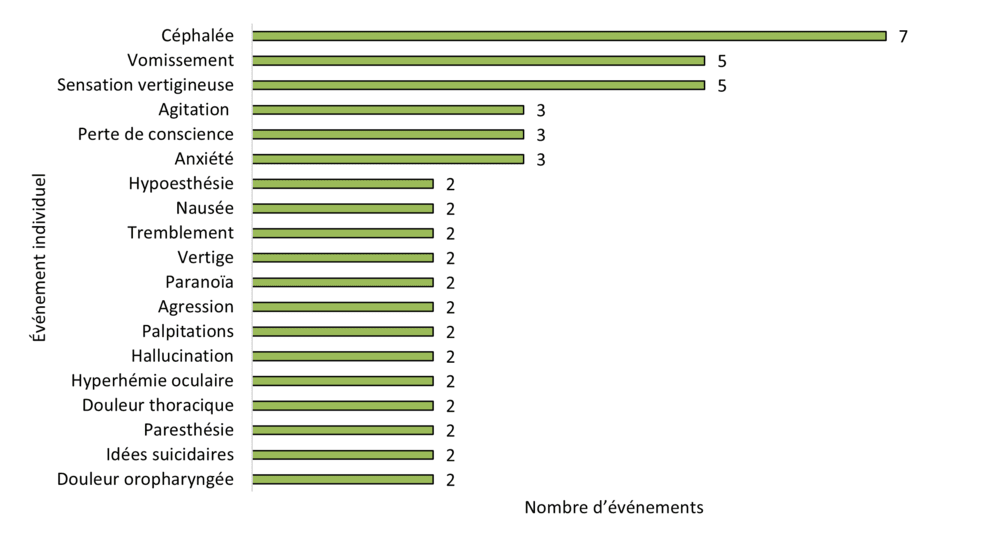
Figure 11 - Équivalent textuel
| Événement individuel | Nombre d'événements |
|---|---|
| Céphalée | 7 |
| Vomissement | 5 |
| Sensation vertigineuse | 5 |
| Agitation | 3 |
| Perte de conscience | 3 |
| Anxiété | 3 |
| Hypoesthésie | 2 |
| Nausée | 2 |
| Tremblement | 2 |
| Vertige | 2 |
| Paranoïa | 2 |
| Agression | 2 |
| Palpitations | 2 |
| Hallucination | 2 |
| Hyperhémie oculaire | 2 |
| Douleur thoracique | 2 |
| Paresthésie | 2 |
| Idées suicidaires | 2 |
| Douleur oropharyngée | 2 |
Mises en garde
- Cette figure porte sur les événements individuels les plus fréquemment signalés dans tous les cas d'effets indésirables pour lesquels le produit suspect a été évalué par Santé Canada comme étant certainement, probablement ou possiblement lié à l'événement signalé (c.-à-d. l'évaluation de la causalité). Les autres événements individuels déclarés moins fréquemment n'apparaissent pas dans cette figure
- Cette figure exclut des déclarations en double dans lesquelles les détails du cas sont les mêmes, mais où les déclarants diffèrent (n = 2)
- Les événements individuels sont codés en utilisant la terminologie MedDRA basée sur le compte rendu textuel du rapport de cas
- Puisque chaque cas peut être associé à plusieurs événements individuels déclarés, le nombre d'événements médicaux individuels dépasse le nombre total de cas individuels
- Plusieurs types d'hallucinations ont été combinés pour créer une catégorie générale hallucinations. Cette catégorie inclut notamment les hallucinations auditives, les hallucinations visuelles, les hallucinations mixtes, les hallucinations hypnagogiques et les hallucinations psychiques
Comme l'illustre la figure 11, les événements individuels les plus fréquemment signalés et évalués par Santé Canada comme étant certainement, probablement ou possiblement liés au produit du cannabis suspect pour les cas reçus en 2023 sont les suivants :
- céphalée (7 %, 7 / 96 événements)
- vomissements (5 %, 5 / 96 événements)
- sensation vertigineuse (5 %, 5 / 96 événements)
- agitation (5 %, 5 / 96 événements)
- anxiété (3 %, 3 / 96 événements)
- perte de conscience (3 %, 3 / 96 événements)
Les céphalées ont également été l'événement individuel le plus souvent signalé en 2022. Toutefois, les 4 autres événements de 2022 diffèrent de ceux signalés en 2023. Ceux-ci comprenaient des convulsions, des hallucinations, de la dyspnée et des inefficacités médicamenteuses.
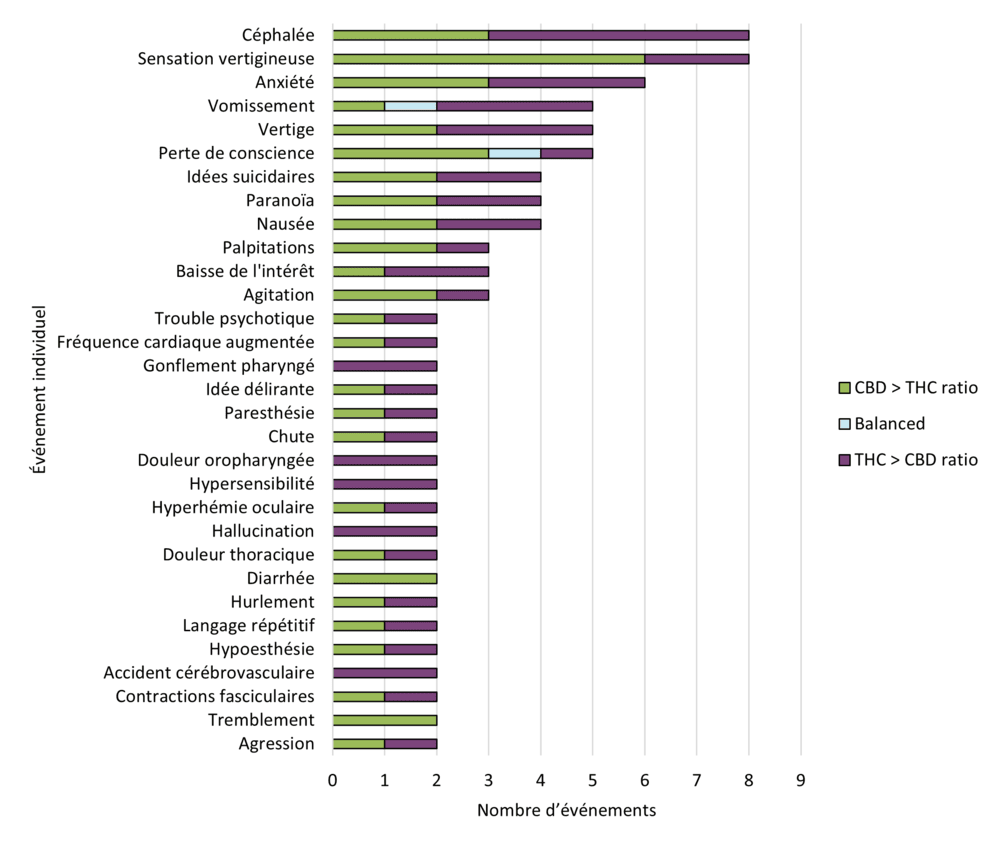
Figure 12 - Équivalent textuel
| Événement individuel | Dominance du cannabinoïde | Total (hors cas non classés) | ||
|---|---|---|---|---|
| CBD > THC ratio | Équilibré | THC > CBD ratio | ||
| Céphalée | 3 | 0 | 5 | 8 |
| Sensation vertigineuse | 6 | 0 | 2 | 8 |
| Anxiété | 3 | 0 | 3 | 6 |
| Vomissement | 1 | 1 | 3 | 5 |
| Vertige | 2 | 0 | 3 | 5 |
| Perte de conscience | 3 | 1 | 1 | 5 |
| Idées suicidaires | 2 | 0 | 2 | 4 |
| Paranoïa | 2 | 0 | 2 | 4 |
| Nausée | 2 | 0 | 2 | 4 |
| Palpitations | 2 | 0 | 1 | 3 |
| Baisse de l'intérêt | 1 | 0 | 2 | 3 |
| Agitation | 2 | 0 | 1 | 3 |
| Trouble psychotique | 1 | 0 | 1 | 2 |
| Fréquence cardiaque augmentée | 1 | 0 | 1 | 2 |
| Gonflement pharyngé | 0 | 0 | 2 | 2 |
| Idée délirante | 1 | 0 | 1 | 2 |
| Paresthésie | 1 | 0 | 1 | 2 |
| Chute | 1 | 0 | 1 | 2 |
| Douleur oropharyngée | 0 | 0 | 2 | 2 |
| Hypersensibilité | 0 | 0 | 2 | 2 |
| Hyperhémie oculaire | 1 | 0 | 1 | 2 |
| Hallucination | 0 | 0 | 2 | 2 |
| Douleur thoracique | 1 | 0 | 1 | 2 |
| Diarrhée | 2 | 0 | 0 | 2 |
| Hurlement | 1 | 0 | 1 | 2 |
| Langage répétitif | 1 | 0 | 1 | 2 |
| Hypoesthésie | 1 | 0 | 1 | 2 |
| Accident cérébrovasculaire | 0 | 0 | 2 | 2 |
| Contractions fasciculaires | 1 | 0 | 1 | 2 |
| Tremblement | 2 | 0 | 0 | 2 |
| Agression | 1 | 0 | 1 | 2 |
Mises en garde
- Cette figure porte sur les événements individuels les plus fréquemment déclarés dans tous les cas d'effets indésirables après stratification selon le rapport des cannabinoïdes et pour lesquels le produit suspect a été évalué par Santé Canada comme étant certainement, probablement ou possiblement lié à l'événement signalé (c.-à-d. l'évaluation de la causalité). Elle exclut les cas n'ayant pas suffisamment d'informations sur le rapport des cannabinoïdes (c.-à-d. non classés); par conséquent, les événements de cette figure peuvent différer de ceux observés dans la figure 11. D'autres événements ont été signalés pendant la période de déclaration, mais ne font pas partie de cette figure en raison de l'espace limité.
- Cette figure exclut des déclarations en double dans lesquelles les détails du cas sont les mêmes, mais où les déclarants diffèrent (n = 2)
- Cette figure a été créée manuellement par Santé Canada, qui a classé chaque produit de cannabis suspect selon le rapport des cannabinoïdes, en fonction des détails disponibles sur le produit. Tous les événements individuels dans un cas sont en outre attribués à tous les produits du cannabis suspects signalés et à leur rapport des cannabinoïdes (pondérés de manière égale pour tous les événements). Par conséquent, la corrélation entre le rapport des cannabinoïdes et les événements individuels peut être surestimée.
- La catégorie « équilibré » correspond à un rapport THC : CBD compris entre 1,2 : 1 et 1 : 1,2.
Dans l'ensemble, les cas d'effets indésirables survenus en 2023 concernaient plus fréquemment des produits présentant un rapport THC : CBD plus élevé (c.-à-d. supérieur à 1,2 : 1) que des produits contenant un rapport CBD : THC plus élevé (c.-à-d. supérieur à 1,2 : 1). Comme l'illustre la figure 12, certains événements médicaux individuels semblent plus fréquemment signalés avec des produits contenant plus de THC que de CBD, tandis que d'autres sont plus fréquemment signalés avec des produits contenant plus de CBD que de THC.
Par exemple, les événements suivants ont été plus fréquemment signalés avec les produits contenant plus de THC que de CBD :
- céphalée
- vomissement
- hallucination
- hypersensibilité
- gonflement pharyngé
- douleur oropharyngée
- accident cérébrovasculaire
Dans le cas des produits contenant plus de CBD que de THC, les effets suivants ont été plus souvent cités :
- sensation vertigineuse
- perte de conscience
- diarrhée
- tremblement
Puisqu'il s'agit d'événements signalés, il est possible que d'autres facteurs aient contribué à ces événements, notamment :
- le dosage
- la voie d'administration
- la connaissance des effets du cannabis et des cannabinoïdes
- l'exposition antérieure au cannabis (p. ex. les personnes qui consomment du cannabis pour la première fois)
- divers facteurs liés à la déclaration, tels que la motivation à déclarer, la tolérance au risque, la connaissance de la possibilité de déclarer un effet indésirable
- l'âge et l'état de santé des patients (y compris les problèmes de santé préexistants et l'utilisation de médicaments concomitants)
Quoi qu'il en soit, la capacité à tirer des conclusions est limitée en raison de la nature complexe des données disponibles.
L'analyse comparative fondée sur le sexe et le genre plus (ACSG plus) des données d'effets indésirables de 2023
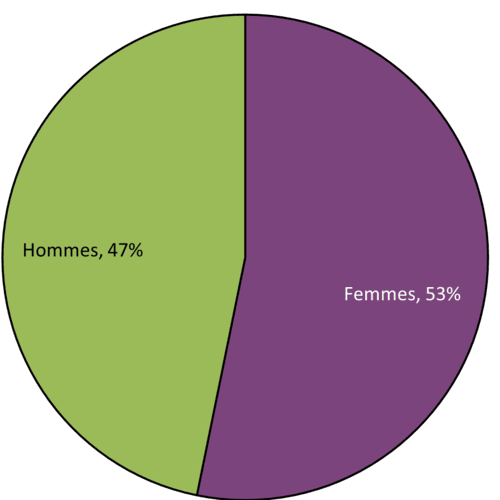
Figure 13 - Équivalent textuel
| Sexe | Nombre de cas | Proportion (en %) |
|---|---|---|
| Femmes | 25 | 53 |
| Hommes | 22 | 47 |
| Total | 47 | 100 |
Au total, 47 cas d'effets indésirables comportaient une désignation du sexe en 2023. 53 % (25 / 47 cas) concernaient des femmes. Les femmes étaient impliquées dans 65 % (17 / 26 cas) de tous les cas graves dont le sexe est déclaré, et 62 % des cas (18 / 29 cas) ont déclaré avoir consommé du cannabis à des fins médicales. Les cas non graves et l'utilisation à des fins non médicales concernaient plus souvent les hommes que les femmes.
Les femmes impliquées dans les cas d'effets indésirables associés aux produits du cannabis étaient généralement plus âgées que les hommes. Lorsque l'âge était déclaré (42 / 47 cas), l'âge moyen des femmes était de 55,1 ans (IC à 95 % : 45,0 à 65,2) et celui des hommes de 47,1 ans (IC à 95 % : 35,8 à 58,3).
Moins de 65 ans :
Femmes, n = 14; hommes, n = 13
65 ans et plus :
Femmes, n = 9; hommes, n = 5
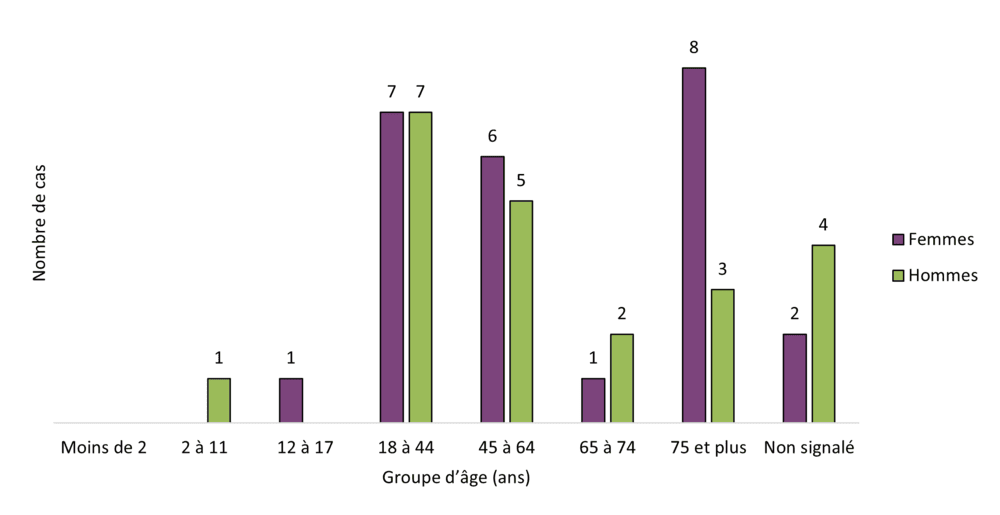
Figure 14 - Équivalent textuel
| Groupe d'âge (ans) | Nombre de cas | |
|---|---|---|
| Femmes | Hommes | |
| Moins de 2 | 0 | 0 |
| 2 à 11 | 0 | 1 |
| 12 à 17 | 1 | 0 |
| 18 à 44 | 7 | 7 |
| 45 à 64 | 6 | 5 |
| 65 à 74 | 1 | 2 |
| 75 et plus | 8 | 3 |
| Non signalé | 2 | 4 |
| Total | 25 | 22 |
Les cas d'effets indésirables causés par des extraits de cannabis (huiles et gélules) et du cannabis pour usage topique concernaient plus souvent des femmes que des hommes. À l'inverse, le cannabis séché et les produits comestibles concernaient plus souvent des hommes que des femmes.
| Femmes | Hommes |
|---|---|
| Anxiété (n=4) | Céphalée (n=6) |
| Céphalée (n=4) | Douleur oropharyngée (n=3) |
| Sensation vertigineuse (n=4) | Vomissement (n=3) |
Évaluation clinique des cas graves et importants sur le plan médical
Résumé des effets indésirables graves et importants sur le plan médical
Tous les événements individuels répertoriés dans un cas d'effets indésirables graves signalé à Santé Canada font l'objet d'une évaluation de la causalité. La causalité des événements individuels est basée sur les informations rapportées lors de la déclaration initiale ainsi que dans les suivis, lorsque cela est possible. Les cas peuvent ne pas contenir suffisamment de renseignements pour évaluer le lien de causalité entre les événements et l'exposition aux produits du cannabis. L'évaluation de la causalité est une investigation clinique des cas et constitue une pratique courante en pharmacovigilance visant à déterminer la probabilité d'association entre le ou les produit(s) et le ou les événement(s) indésirable(s). Cette pratique permet de déterminer les risques soupçonnés qui peuvent nécessiter une enquête ou des mesures supplémentaires de la part de l'autorité réglementaire (p. ex. Santé Canada) ou du titulaire de licence.
| Causalité attribuée | Nombre d'événements |
|---|---|
| Certain | 0 |
| Probable | 16 |
| Possible | 87 |
| Improbable | 26 |
| Non évaluable | 25 |
| Total | 154 |
Dans l'ensemble, une causalité « possible » a été attribuée à la plupart des cas (56 %, 87 / 154 événements), ce qui signifie qu'il est possible que le produit du cannabis ait pu contribuer à l'effet indésirable, mais que la contribution d'autres facteurs n'a pas pu être exclue (p. ex. médicaments concomitants ou comorbidités).
Aucun événement ne s'est vu attribuer une causalité « certaine », pour laquelle un niveau de preuve rigoureux est requis, notamment une confirmation en laboratoire et une confirmation médicale. En outre, le cas ne doit pas comporter d'autres explications.
La causalité « probable » a été attribuée à 16 / 154 événements (10 %), ce qui signifie qu'il y avait suffisamment de renseignements permettant de juger que le produit du cannabis a probablement contribué à l'effet indésirable et que la contribution d'autres facteurs était considérée comme peu probable.
Les 16 événements auxquels on a attribué une causalité « probable » correspondaient à 4 cas :
- Trois étaient associés à des produits d'extraits de cannabis légaux à ingérer (gélules, n = 1; huiles, n = 1)
- Un concernait du cannabis séché
Tous ces cas ont indiqué que le cannabis était le seul produit suspect. Aucun autre produit de santé n'a été déclaré comme co-suspect; 1 cas ont déclaré l'utilisation de produits de santé concomitants. En outre, 3 cas sur 4 avaient signalé des problèmes de santé préexistants, et 3 cas sur 4 utilisaient des produits du cannabis à des fins médicales autodéclarées (les indications de consommation comprenaient des migraines et des troubles du sommeil).
Parmi les cas, 25 événements sur 154 ont été jugés « non évaluables » (16 %), ce qui signifie que les informations étaient insuffisantes pour établir un lien de causalité entre le produit du cannabis et l'effet indésirable signalé.
Dans 26 événements sur 154, le lien de causalité a été qualifié d'« improbable » (17 %), ce qui signifie que le produit de cannabis n'a pas été jugé comme ayant joué un rôle dans l'effet indésirable signalé (d'autres facteurs probables ont été déterminés).
Risques importants identifiés au cours de la période de déclaration
Au cours de cette période de déclaration, aucun cas grave ou important sur le plan médical n'a été classé comme présentant un nouveau risque important identifié par Santé Canada. Un risque identifié signifie que l'association entre une drogue (p. ex. le cannabis) et un événement a été prouvée et que ce risque pourrait avoir des répercussions pour la santé publiqueNote de bas de page 8.
La plupart des cas graves ou importants sur le plan médical avec une causalité « probable » concernaient des risques déterminés connus (c.-à-d. caractérisés dans le document Renseignements destinés aux professionnels de la santé de Santé Canada; dernière mise à jour : printemps 2018). Notamment les suivants :
- Réactions neurologiques (p. ex. céphalée, étourdissement)
- Réactions psychiatriques (p. ex. panique, anxiété, hallucinations)
- Réactions respiratoires non infectieuses (p. ex. irritation de la gorge)
- Réactions cardiovasculaires (p. ex. fibrillation auriculaire, palpitations, tachycardie)
- Hypersensibilité ou les réactions allergiques (p. ex. réactions d'hypersensibilité systémiques)
Risques importants soupçonnés au cours de la période de déclaration
Un risque important soupçonné d'interaction entre le cannabis et un médicament entraînant le syndrome sérotoninergique a été observé dans les données sur les effets indésirables des produits du cannabis au cours de cette période de déclaration.
Un risque soupçonné signifie que l'on suspecte une association entre une drogue (p. ex. le cannabis) et un événement qui n'a pas encore été prouvé, et que ce risque pourrait avoir des répercussions pour la santé publiqueNote de bas de page 9.
De plus, un risque d'arythmie lié à l'utilisation de produits du cannabis a été déterminé à la fin de 2022. En 2023, Santé Canada a terminé une évaluation préliminaire des signaux et effectue actuellement une évaluation des signaux sur cette question, puis recommandera les mesures appropriées, au besoin.
Risque d'interaction entre le cannabis (THC, CBD, équilibré) et la venlafaxine entraînant le syndrome sérotoninergique
Ce risque potentiel d'interaction médicamenteuse a été déterminé en 2023 et une évaluation préliminaire du signal a été effectuée. Cette interaction médicamenteuse qui entraîne un syndrome sérotoninergique bénin n'a pas encore été identifiée dans la littérature et constitue un nouveau signal d'innocuité. Un seul cas national a été identifié dans lequel l'interaction cannabis - chlorhydrate de venlafaxine a donné lieu à un cas présumé de syndrome sérotoninergique. Aucune déclaration concernant une interaction similaire n'a été identifiée sur Vigilyze de l'OMS. Dans ce cas particulier, il a été déterminé que cette interaction entre le cannabis et un médicament entraînant le syndrome sérotoninergique était probable. L'évaluation préliminaire des signaux a permis de déterminer trois voies pharmacologiques hypothétiques par lesquelles le produit du cannabis contenant du THC et du CBD pourrait entraîner le syndrome sérotoninergique lorsqu'il est administré conjointement avec du chlorhydrate de venlafaxine. La première voie proposée est que le cannabidiol est un inhibiteur potentiel de l'enzyme CYP2D6 et que le chlorhydrate de venlafaxine est métabolisé principalement par le CYP2D6, par conséquent, l'utilisation concomitante de venlafaxine et de cannabis peut théoriquement augmenter la concentration plasmatique de chlorhydrate de venlafaxine, ce qui peut entraîner le syndrome sérotoninergique. La deuxième voie proposée est que le THC peut inhiber la monoamine oxydase (MAO), comme le démontrent des expériences in vivo. L'inhibition potentielle de la MAO peut entraîner une augmentation de la sérotonine et pourrait ainsi causer le syndrome sérotoninergique. Enfin, le CBD pourrait inhiber les pompes d'efflux de la glycoprotéine P, ce qui pourrait diminuer l'efflux du chlorhydrate de venlafaxine et par conséquent augmenter sa concentration et la quantité de sérotonine dans le corps. Santé Canada continuera de surveiller le risque soupçonné de syndrome sérotoninergique causé par des interactions médicamenteuses avec les produits du cannabis à partir des déclarations d'effets indésirables, des organismes de réglementation internationaux et de la documentation scientifique, dont les rapports de cas publiés. À mesure que d'autres renseignements seront disponibles, Santé Canada réévaluera ce signal et prendra les mesures appropriées au besoin.
Risque d'arythmie associé à la consommation de produits du cannabis (THC, CBD, équilibré)
Ce risque important a été relevé à la fin de l'année 2022 et Santé Canada a terminé une évaluation préliminaire des signaux. Une recherche dans la base de données de Canada Vigilance a révélé 35 cas d'arythmie cardiaque associés à la consommation de cannabis, dont 25 cas ont été signalés comme étant graves.
La causalité a été évaluée à l'aide des critères du Centre de surveillance d'Uppsala de l'OMS pour ces 25 cas; deux ont été évalués comme « improbable », 19 ont été évalués comme « possible » et quatre ont été évalués comme « probable ». Une recherche dans la base de données Vigilyze de l'OMS a permis d'identifier 145 cas étrangers d'arythmies cardiaques associées à la consommation du cannabis. Le risque d'arythmie associée à la consommation du cannabis a été mentionné dans le document de Santé Canada intitulé « Renseignements destinés aux professionnels de la santé : Le cannabis (marijuana, marihuana) et les cannabinoïdes » comme un effet indésirable potentiel de la consommation du cannabis. Santé Canada effectue actuellement un suivi de cette évaluation préliminaire des signaux au moyen d'une évaluation approfondie des signaux.
Surveillance continue des signaux d'innocuité
- Santé Canada continuera de surveiller toute nouvelle littérature et tout rapport d'effets indésirables concernant les risques suivants :
- Risque de formation de caillots dans les vaisseaux sanguins chez les personnes qui consomment à la fois des produits du cannabis et des contraceptifs oraux combinés contenant des œstrogènes
- Risque d'aspergillose chez les personnes immunocompétentes qui consomment du cannabis séché
- Risque d'hallucinations chez les personnes consommant des produits contenant du cannabidiol
- Risque d'épisodes d'hypoglycémie chez les personnes consommant du cannabis
- Risque d'interactions entre le cannabis et un médicament (warfarine, topiramate, clobazam, métronidazole, lorazépam, antidépresseurs, etc.)
Cas mortels survenus au cours de la période de déclaration
Aucun cas mortel n'a été signalé au cours de la période de déclaration.
Avis aux lecteurs
Les rapports de cas d'effets indésirables associés au cannabis transmis à Santé Canada sont reçus et saisis dans la base de données de Canada Vigilance. La Direction des produits de santé commercialisés (DPSC) et la Direction générale des produits de santé et des aliments (DGPSA) recueillent, surveillent et analysent les effets indésirables saisis dans la base de données de Canada Vigilance, entre autres activités. De plus, elles codent et hébergent les déclarations d'effets indésirables du cannabis. La Direction générale des substances contrôlées et du cannabis (DGSCC) est responsable de la surveillance, de la détection, de la hiérarchisation, de l'évaluation et de la préparation de rapports cumulatifs sur les effets indésirables associés au cannabis (pharmacovigilance).
Les déclarations volontaires du public peuvent être transmises à partir du formulaire de déclaration en ligne, en composant le numéro sans frais ou en remplissant le formulaire à imprimer et à transmettre par télécopie électronique ou par courrier à Santé Canada. Les rapports obligatoires sont soumis par les titulaires de licence conformément à leurs obligations réglementaires de déclaration des effets indésirables graves en vertu du Règlement sur le cannabis et sont transmis par télécopieur ou par courrier, à moins que l'entreprise ne soit enregistrée pour transmettre des rapports électroniques directement à la base de données de Canada Vigilance (un format particulier doit être respecté). Les plaintes relatives au cannabis et les problèmes liés à la qualité des produits peuvent également être transmis à l'aide du Formulaire de déclaration relative au cannabis de Santé Canada. Les incidents concernant des accessoires de cannabis (p. ex. un problème ou une défaillance mécanique, physique ou électrique d'un accessoire de cannabis et les blessures associées) peuvent être signalés au moyen du Rapport d'incident concernant un produit de consommation - Formulaire pour les consommateurs, disponible auprès de la Direction générale de la santé environnementale et de la sécurité des consommateurs.
Tous les cas d'effets indésirables associés au cannabis sont codés de la manière suivante :
- Les rapports de cas sont traduits en données électroniques dans la base de données de Canada Vigilance. Tous les événements individuels sont codés à l'aide du MedDRA, qui est élaboré, géré et mis à jour par l'International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (ICH) pour fournir un ensemble international de termes médicaux normalisés en ce qui concerne les symptômes, les signes, les maladies, les syndromes et les diagnostics.
- Les rapports de cas concernant le cannabis en tant que substance dont le rôle est suspecté sont codés comme « cannabis sativa » pour ce qui est du principe actif, indépendamment du statut du produit de cannabis (légal, illégal, non précisé, indéterminé).
- Les rapports de cas concernant un produit du cannabis légal dans un rôle suspect (déterminé soit par le nom du produit, soit par le titulaire de licence) sont classés en fonction de l'utilisation prévue, soit un produit de cannabis utilisé à des fins médicales (« cannabis médical ») ou utilisé à des fins non médicales (« cannabis non médical »), selon les renseignements fournis dans le rapport. Utilisation de cannabis à des fins médicales : Comprend les rapports dans lesquels il est indiqué que le consommateur détient un document d'autorisation médicale; ou, un but ou une indication médicale ou thérapeutique déclarée, sans mention d'un document d'autorisation médicale. Si le rapport ne mentionne pas de raison d'utilisation, ne donne que des détails minimaux ou si l'utilisation prévue est à des fins non médicales, le rapport est classé dans la catégorie « cannabis non médical ».
- La gravité des rapports de cas est codée selon le critère de gravité sélectionné dans la déclaration :
- Décès
- Mettant la vie en danger
- Admission à l'hôpital
- Séjour prolongé à l'hôpital
- Incapacité
- Anomalie congénitale
- Autres affections médicales importantes peuvent également être sélectionnées par le déclarant
- Selon les lignes directrices internationales de pharmacovigilance (lignes directrices de l'ICHNote de bas de page 9), les affections importantes sur le plan médical peuvent également être considérées comme graves dans certaines circonstances et sont donc une option à choisir lors de la déclaration d'effets indésirables à Santé Canada et tout cas d'effets indésirables défini comme tel est examiné de manière approfondie. Toutefois, ces cas ne s'inscrivent techniquement pas dans la définition réglementaire d'un effet indésirable grave en vertu du Règlement sur le cannabis.
Santé Canada effectue une surveillance systématique, une détection, une évaluation et des activités connexes pour toutes les déclarations d'effets indésirables, ce qui comprend :
- l'examination de tous les nouveaux rapports de cas liés au cannabis pour vérifier qu'ils :
- sont correctement codés selon le MedDRA
- sont classés comme cannabis à des fins médicales ou non médicales (catégories légales)
- présentent le nom exact des produits
- la transmission à la Direction de la conformité pour vérification de tous les cas où une non-conformité est suspectée (p. ex. présence visible de moisissure, goût métallique, odeur inhabituelle)
- les rapports non graves sont examinés par Santé Canada et ceux qui sont considérés comme des événements importants sur le plan médical sont inclus pour une évaluation plus approfondie (évaluation de la causalité)
- tous les cas graves et importants sur le plan médical font l'objet d'une enquête et d'une évaluation plus approfondies, notamment :
- un suivi pour obtenir des renseignements supplémentaires sur les détails du produit ou les détails cliniques des cas afin de faciliter l'évaluation
- une évaluation sommaire (c'est-à-dire initiale) de la causalité de chaque événement signalé dans le rapport de cas. L'évaluation de la causalité repose principalement sur le système du Centre de surveillance d'Uppsala de l'OMS pour l'évaluation normalisée de la causalité des cas (en anglais seulement)
- une évaluation individuelle complète de la causalité pour tous les cas mortels ou mettant la vie en danger, qui sont considérés comme des rapports prioritaires
- tous les cas concernant de nouveaux effets indésirables ou inattendus présentant un intérêt font l'objet d'une évaluation préliminaire afin de déterminer s'ils doivent faire l'objet d'une évaluation plus approfondie (hiérarchisation des signaux)
- une évaluation en série de cas (évaluation des signaux) est effectuée lorsqu'un groupe de cas ou de cas connexes présentent de nouveaux effets indésirables d'intérêt (Ces évaluations complètes comprennent la détermination de la plausibilité biologique sur la base de la documentation publiée ainsi que des données nationales et internationales sur les effets indésirables [Vigibase de l'OMS] et recommandent une stratégie appropriée d'atténuation des risques, au besoin.)
Signaler un effet indésirable associé à un produit du cannabis
Les titulaires de licence doivent déclarer les effets indésirables graves associés à un produit du cannabis, conformément au Règlement sur le cannabis. Ils sont également encouragés à signaler volontairement les effets indésirables non graves associés à un produit du cannabis. Pour plus de renseignements, veuillez consulter le Document d'orientation relatif à la déclaration des effets indésirables à l'intention des titulaires de licence.
Signalez les effets indésirables des produits du cannabis
Les consommateurs et les professionnels de la santé sont encouragés à signaler tous les effets indésirables liés à un produit du cannabis directement à Santé Canada. Les consommateurs et les professionnels de la santé peuvent également envoyer un rapport au titulaire de licence du produit du cannabis.
Nous joindre
Tout commentaire ou toute question sur ce rapport, y compris toute demande concernant les données utilisées à l'appui de ce rapport, doit être envoyé à l'adresse cannabis_oss-cannabis_bss@hc-sc.gc.ca.
Note de bas de page
- Note de bas de page 1
-
Le terme « rapport » indique que les doubles sont comptabilisés lorsque les détails du cas sont les mêmes, mais que les déclarants diffèrent (par exemple, le signalement du même cas dans des rapports distincts par un titulaire de licence et un consommateur). Dans le présent rapport de données, cette terminologie est utilisée lorsque l'indicateur dont il est question dépend des renseignements indiqués dans chaque déclaration (par exemple, le type de déclarant et la date du signalement).
- Note de bas de page 2
-
Le terme « cas » indique que les déclarations en double ont été retirées. Dans le présent rapport de données, cette terminologie est utilisée lorsque l'indicateur dont il est question ne dépend pas des renseignements fournis dans chaque signalement (par exemple, la gravité, la raison de la gravité, les données démographiques, les événements signalés). La plupart des sections et des figures renvoient à des cas plutôt qu'à des signalements.
- Note de bas de page 3
-
En vertu de la Loi sur le cannabis et du Règlement sur le cannabis, les adultes sont autorisés à cultiver jusqu'à un maximum de quatre plants de cannabis à des fins personnelles. Cette quantité s'ajoute aux plantes qui peuvent être autorisées pour la production personnelle et désignée à des fins médicales, ce qui varie entre les provinces et les territoires. Toutefois, les règles entourant la culture à domicile à des fins non médicales peuvent varier en fonction des règles et règlements de chaque province ou territoire.
- Note de bas de page 4
-
En vertu de la Loi sur le cannabis et de son règlement, les adultes sont autorisés à fabriquer à domicile et à des fins personnelles des produits à partir du cannabis qu'ils ont cultivé légalement ou qu'ils ont obtenu auprès d'autres sources légales.
- Note de bas de page 5
-
Conformément à l'alinéa 248.1(1)b) du Règlement sur le cannabis, tous les effets indésirables, y compris les effets indésirables non graves, doivent être consignés dans un rapport de synthèse annuel par le titulaire de licence, dont Santé Canada peut demander la communication.
- Note de bas de page 6
-
Des cas peuvent être dupliqués si une déclaration d'effets indésirables concernant le même événement a été reçue de différents déclarants (p. ex. d'un professionnel de la santé, d'un consommateur, d'un hôpital ou d'un fabricant).
- Note de bas de page 7
-
Organisation mondiale de la Santé (2012). Safety monitoring of medicinal products. Reporting system for the general public. Disponible à l'adresse suivante : https://www.who.int/publications/i/item/9789241503198 (en anglais seulement).
- Note de bas de page 8
-
Agence européenne des médicaments. (2017). Guideline on good pharmacovigilance practices (GVP): Annex I - Definitions (Rev 4). https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-good-pharmacovigilance-practices-annex-i-definitions-rev-4_en.pdf (en anglais seulement).
- Note de bas de page 9
-
Agence européenne des médicaments (2004). ICH Topic E2D: Post Approval Safety Data Management Step 5. https://www.ema.europa.eu/en/documents/scientific-guideline/international-conference-harmonisation-technical-requirements-registration-pharmaceuticals-human-use_en-12.pdf (en anglais seulement).