Comment Santé Canada inspecte les établissements d’instruments médicaux : À propos des inspections
Sur cette page
- Fonctionnement de l’inspection
- Pouvoir d’inspection de Santé Canada
- Emplacement des inspections et moment où elles ont lieu
- Processus d’inspection
- Mesures prises par Santé Canada pour veiller à la conformité
Fonctionnement de l’inspection
Toute personne titulaire d’une licence d’établissement d’instruments médicaux (LEIM) peut être soumise à une inspection de Santé Canada visant à s’assurer qu’elle respecte la Loi et le Règlement. Ces inspections appuient notre programme national de conformité et d’application de la loi.
Lors de ces inspections, l’inspecteur vérifie si votre établissement (entreprise) respecte les parties de la Loi et du Règlement qui s’appliquent à vous. Les entreprises peuvent être des fabricants, des importateurs, des distributeurs, des personnes, des partenariats et des associations.
À la suite de l’inspection, l’entreprise est évaluée conforme ou non conforme à la Loi et au Règlement par l’inspecteur. L’inspecteur détermine la cote en fonction du risque associé aux constatations faites lors de l’inspection.
- Conforme : Au moment de l’inspection, l’entreprise a démontré que les activités qu’elle mène sont conformes à la Loi et au Règlement. Une cote conforme ne signifie pas qu’aucune observation n’a été notée ou qu’aucune mesure corrective n’est nécessaire.
- Non conforme : Au moment de l’inspection, l’entreprise n’a pas démontré que les activités qu’elle mène sont conformes à la Loi et au Règlement.
Veuillez consulter le document suivant pour obtenir des renseignements sur les niveaux de risque :
Objet de l’inspection
Les inspections portent principalement sur les activités que vous menez en vertu de votre LEIM.
Les inspecteurs de Santé Canada examineront les procédures et les procédés que vous utilisez pour déceler les risques pour la sûreté et l’efficacité, ainsi que les mesures qui sont prises à leur égard. Ils vérifieront également les exigences en matière d’étiquetage et d’homologation qui régissent vos activités liées à l’importation, à la publicité et à la vente d’instruments médicaux.
Des inspections distinctes appelées audits sont effectuées pour évaluer le respect de la norme sur les systèmes de gestion de la qualité (ISO 13485), qui est exigée pour l’homologation d’un instrument médical. Ces audits sont réalisés par des organisations d’audit du Programme d’audit unique des matériels médicaux (PAUMM). Ce type d’inspection s’applique à vous si vous :
- concevez ou fabriquez des instruments de classe II, III ou IV
- possédez un certificat de système de gestion de la qualité ISO 13485 délivré par une organisation d’audit en vertu du PAUMM
Même si votre système de gestion de la qualité a fait l’objet d’audits, il se peut que les inspecteurs de Santé Canada vérifient si les instruments de classe II, III ou IV que vous importez ou vendez :
- font l’objet d’une homologation d’instrument médical
- sont étiquetés correctement
Pouvoir d’inspection de Santé Canada
Aux termes du paragraphe 22(1) de la Loi, Santé Canada désigne des inspecteurs pour appliquer la Loi et veiller à ce qu’elle soit respectée. L’article 23 de la Loi énonce également les pouvoirs accordés aux inspecteurs afin qu’ils puissent exercer leur rôle.
Bien que les inspecteurs se penchent principalement sur les activités liées à la licence d’établissement, l’article 23 leur donne l’autorité d’examiner tout non-respect de la Loi et du Règlement et de prendre des mesures à cet égard. Les inspecteurs décident des mesures à prendre selon les risques pour la santé et la sécurité que posent l’écart, la lacune ou le manquement observé.
Le paragraphe 23(3) de la Loi permet à un inspecteur d’entrer dans tout lieu visé au paragraphe 23(1) en y accédant à distance par des moyens de télécommunication. Les principes qui s’appliquent aux inspections effectuées à distance sont les mêmes que pour les inspections en personne.
Lorsque l’accès au lieu se fait en personne, vous pourriez recevoir ou non un avis avant l’inspection. Toutefois, dans le cas d’une inspection à distance par des moyens de télécommunication, vous, le propriétaire ou la personne responsable serez informé de l’entrée. La Politique d’accès à distance aux locaux d’une partie réglementée pour vérifier la conformité (POL-0138) fournit des renseignements supplémentaires sur les inspections réalisées par des moyens de télécommunication.
Emplacement des inspections et moment où elles ont lieu
Les inspections sont effectuées sur place ou à distance par des moyens de télécommunication. Les inspections sur place sont effectuées en personne à votre établissement ou à un emplacement tiers. Les inspections à distance sont effectuées par des moyens de télécommunication comme les vidéoconférences. Une inspection peut comprendre une inspection à distance et une visite sur place.
Santé Canada inspecte les entreprises situées au Canada (« inspections domestiques ») et à l’extérieur du Canada (« inspections à l’étranger ») qui détiennent une licence.
Nous utilisons une approche fondée sur les risques pour planifier les inspections des entreprises situées au Canada. Cette approche tient compte des facteurs comme les antécédents en matière de conformité et la classification des instruments médicaux.
Types d’inspections
Il existe cinq types d’inspections :
Nouvelle inspection :
- La première inspection d’une entreprise ayant récemment obtenu une licence pour vérifier que ses activités sont menées conformément aux exigences de la Loi et du Règlement.
Régulière :
- Le type d’inspections le plus fréquent
- Planifiée périodiquement après la première inspection d’une entreprise
- L’inspecteur évalue la conformité à toutes les exigences de la Loi et du Règlement
- Consultez la Liste de vérification des dispositions du Règlement qui s’appliquent à vous, pour en savoir plus.
Réévaluation :
- L’inspection d’une entreprise ayant reçu une cote conforme avec des observations
- L’inspecteur décide qu’une inspection doit être faite plus tôt que normalement prévu
- Les réévaluations ont généralement lieu dans les 12 mois suivant l’inspection précédente
Réinspection :
- L’inspection d’une entreprise ayant reçu une cote de non-conformité lors d’une inspection précédente
- L’inspecteur se penche principalement sur les observations relevées lors de l’inspection précédente qui a mené à une cote de non-conformité
- Les réinspections ont généralement lieu dans les 12 mois suivant l’inspection précédente
Inspection ciblée :
- L’inspection (non planifiée) d’une entreprise effectuée à la suite de la réception de renseignements provenant d’autres sources (par exemple, partenaires en matière de réglementation, consommateurs, partenaires de directions à l’interne)
- A lieu quand une évaluation préliminaire des renseignements porte à croire qu’il existe un risque inacceptable pour la santé et la sécurité des Canadiens en lien avec les activités associées à la LEIM
Durée des inspections
Les inspections des petites entreprises sont généralement effectuées en une journée. Les inspections des grandes entreprises peuvent prendre de 2 à 5 jours.
Nota : Les inspections seront faites de façon différente si vous dirigez une entreprise « virtuelle » ou en ligne et que vos instruments médicaux ne sont pas physiquement entreposés dans un bâtiment.
Si vous menez des activités à plusieurs endroits, l’inspecteur peut aussi inspecter les autres sites figurant sur votre demande de LEIM. L’inspection prendra alors plus de temps, puisque les inspections sont généralement effectuées par un seul inspecteur.
Au besoin, l’inspecteur principal peut demander à d’autres inspecteurs de participer à l’inspection. De plus, le paragraphe 23(7) de la Loi permet aux inspecteurs d’être accompagnés de toute autre personne qu’ils jugent nécessaire pour les aider à exercer leurs pouvoirs ou leurs fonctions.
Processus d’inspection
Les inspecteurs effectuent les inspections selon le processus décrit ci-après.
Processus d'inspection des instruments médicaux
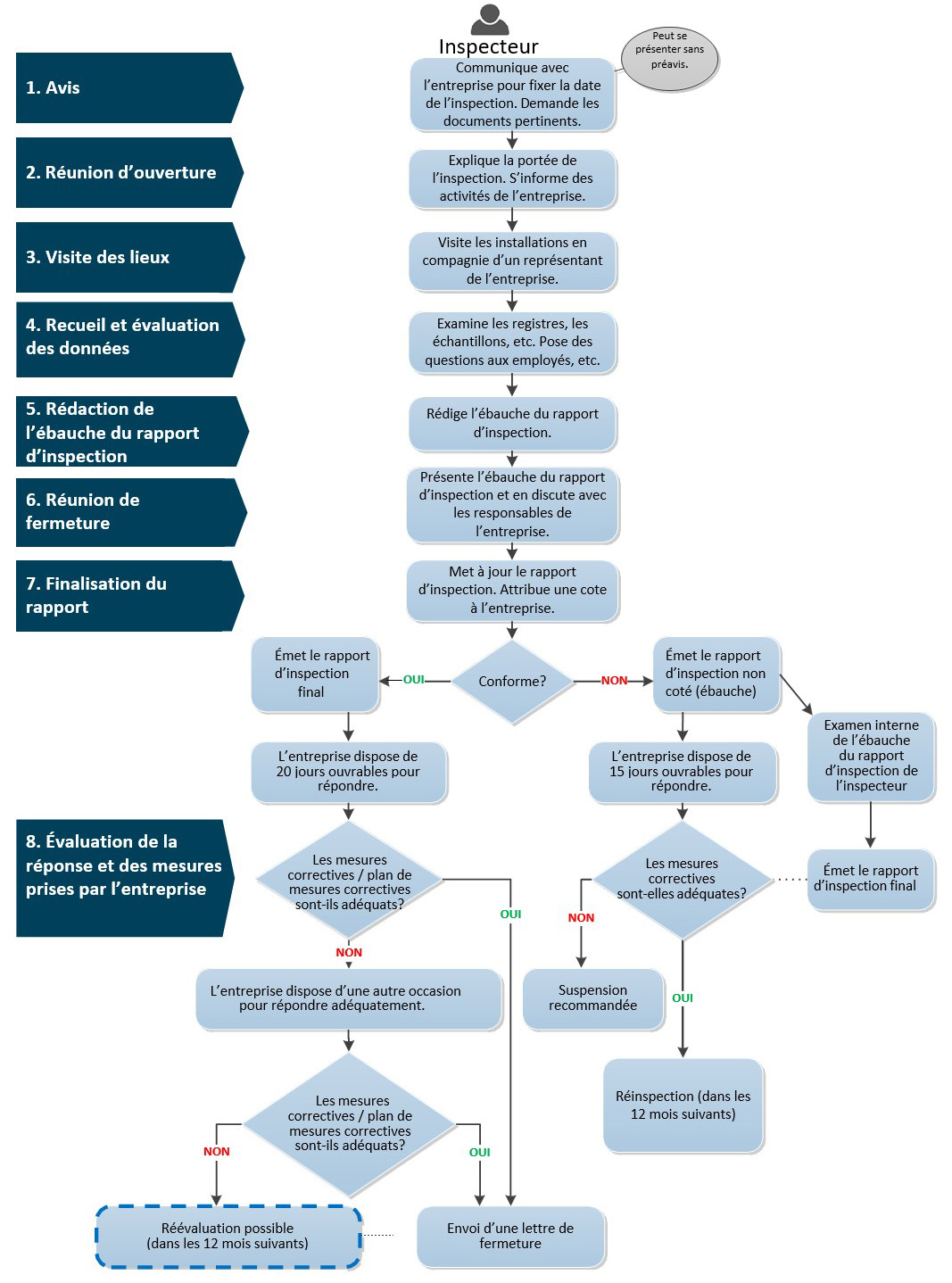
Équivalent textuel
Ce schéma est divisé en deux sections. La section de gauche indique les étapes du processus d’inspection et la section de droite décrit les tâches de l’inspecteur.
- À l’étape 1 « Avis », l’inspecteur communique avec l’entreprise pour fixer la date de l’inspection et demande aussi les documents pertinents. L’inspecteur peut se présenter sans préavis.
- À l’étape 2 « Réunion d’ouverture », l’inspecteur explique à l’entreprise la portée de l’inspection. Il pose aussi des questions sur les activités de l’entreprise. Cette étape peut être effectuée en personne ou à distance.
- À l’étape 3 « Visite des lieux », l’inspecteur visite les installations en compagnie d’un représentant de l’entreprise. La visite peut aussi se faire par vidéoconférence pour une inspection à distance.
- À l’étape 4 « Recueil et évaluation des données », l’inspecteur examine les registres, les échantillons, etc., et pose des questions aux employés.
- À l’étape 5 « Rédaction de l’ébauche du rapport d’inspection », l’inspecteur rédige l’ébauche du rapport d’inspection.
- À l’étape 6 « Réunion de fermeture », l’inspecteur présente l’ébauche du rapport d’inspection et en discute avec les responsables de l’entreprise.
- À l’étape 7 « Finalisation du rapport », l’inspecteur met à jour le rapport d’inspection et attribue une cote à l’entreprise. Cette étape est divisée en deux volets, l’un se rapportant à une situation de conformité et l’autre se rapportant à une situation de non‑conformité. Si la cote est conforme, un rapport d’inspection final est émis à l’entreprise et celle-ci dispose de 20 jours ouvrables pour répondre au rapport d’inspection. Si la cote proposée est non-conforme, un rapport d’inspection ébauche non coté est émis à l’entreprise et celle-ci dispose de 15 jours ouvrables pour répondre. Durant cette période de 15 jours, un examen interne de l’ébauche du rapport d’inspection non coté de l’inspecteur est effectué par Santé Canada. Le rapport d’inspection final, avec une cote d’inspection confirmée, est émis à l’entreprise suite à cet examen.
- À l’étape 8 « Évaluation de la réponse et des mesures prises par l’entreprise », l’inspecteur évalue la réponse au rapport d’inspection. Dans le cas d’une entreprise en situation de conformité, si les mesures correctives ou le plan de mesures correctives sont adéquats, l’inspecteur envoie une lettre de fermeture qui conclut l’inspection. Si les mesures correctives ou le plan de mesures correctives ne sont pas adéquats, l’inspecteur donne à l’entreprise une autre occasion pour répondre de façon satisfaisante. Si les mesures correctives ou le plan de mesures correctives sont alors adéquats, une lettre de fermeture est envoyée à l’entreprise. Si les mesures correctives ou le plan de mesures correctives sont encore inadéquats, l’entreprise pourrait être réévaluée dans les 12 mois.
Dans le cas d’une entreprise en situation de non‑conformité, si les mesures correctives de l’entreprise à l’égard des lacunes qui ont contribué à la cote de non-conformité sont considérées adéquates, l’entreprise fera l’objet d’une réinspection dans les 12 mois suivants. Si les mesures correctives de l’entreprise à l’égard des lacunes qui ont contribué à la cote de non-conformité sont considérées inadéquates, l’inspecteur recommande la suspension de la licence d’établissement.
Ainsi se termine le schéma de processus.
Étape 1 : Avis à l’entreprise et planification de l’inspection
Avant l’inspection, l’inspecteur communiquera avec vous par téléphone ou par courriel pour :
- décrire le but de l’inspection, confirmer le type d’inspection et préciser si l’inspection sera effectuée sur place ou à distance par vidéoconférence
- vérifier les renseignements figurant sur votre LEIM, comme vos activités, les types et les classes d’instruments que vous offrez à la vente, le type de clients à qui vous vendez des instruments et tout autre site associé aux activités de votre LEIM
- déterminer si les instruments médicaux seront disponibles sur place et, si ce n’est pas le cas, demander des échantillons pour aider à vérifier l’étiquette et l’homologation de l’instrument
- confirmer si votre entreprise est située dans une maison d’habitation
- demander des détails sur l’accessibilité de vos dossiers (électroniques ou papier) et sur les capacités technologiques de votre entreprise pour l’accès à distance
- confirmer la ou les dates et les lieux de l’inspection sur place ou les dates et les périodes désignées pour les réunions virtuelles si votre inspection est effectuée à distance
Nota : L’inspecteur peut choisir de se présenter :
- sans préavis si cela peut permettre d’avoir un portrait plus exact de votre conformité
- sans s’annoncer s’il n’a pas réussi à vous joindre par téléphone ou par courriel
Il se pourrait que l’inspecteur vous demande de fournir :
- une liste de tous les instruments médicaux que vous vendez au moment de l’inspection
- les noms des fabricants pour les instruments que vous vendez
- les noms des fournisseurs pour les instruments que vous vendez
- un exemplaire des procédures que vous avez attestées avoir mises en œuvre dans votre demande de LEIM ou votre plus récente demande de renouvellement de licence d’établissement d’instruments médicaux (consultez la Liste de vérification pour les inspections pour connaître les procédures que vous devrez fournir)
Une fois que la date d’inspection aura été déterminée, l’inspecteur confirmera les détails par écrit.
Nota : Lorsqu’il examinera vos procédures, l’inspecteur vérifiera si elles :
- décrivent la façon de réaliser une tâche ou des tâches
- expliquent la manière d’effectuer le travail, la personne qui devrait le faire et les circonstances où elle doit le faire
- indiquent la personne à qui des autorisations ou des responsabilités ont été attribuées et précisent les autorisations ou les responsabilités dont il s’agit
- contiennent une liste des fournitures, du matériel et des registres nécessaires pour effectuer le travail
Étape 2 : Réunion d’ouverture de l’inspection
L’inspecteur vous rencontrera afin de :
- décrire les objectifs du programme d’inspection
- définir la portée de l’inspection
- confirmer les renseignements qu’il possède sur l’entreprise, tels que le nom et les coordonnées de la personne-ressource
- connaître la nature des activités de l’entreprise
- décrire les étapes du processus d’inspection
- expliquer le système de classification des risques pour les observations et la cote d’inspection globale
- vous informer de la publication des résultats sur la page Web des inspections relatives aux instruments médicaux
Étape 3 : Visite des lieux
L’inspecteur vous demandera de lui faire visiter les installations (en personne ou de façon virtuelle) pour avoir un aperçu des activités qui y sont menées et des instruments vendus par l’entreprise. Pendant la visite, l’inspecteur peut demander de voir les aires suivantes :
- expédition et réception
- entreposage
- fabrication
- laboratoire d’essai ou de contrôle de la qualité
- retours ou entretien
- quarantaine
- services des ventes et du marketing
Il se peut également que l’inspecteur pose des questions au personnel des différents services de l’entreprise.
Étape 4 : Recueil et évaluation des données
L’inspecteur évaluera votre conformité en se fondant sur les entrevues, la visite des lieux et l’examen des procédures de l’entreprise. L’inspecteur recueillera et examinera également des échantillons des registres et des instruments médicaux de votre entreprise. Lors de cet examen, il tiendra compte des gammes de produits de l’entreprise et de la classification de vos instruments (c’est-à-dire, classe I, II, III ou IV).
Le nombre d’échantillons qui seront examinés dépendra de plusieurs facteurs :
- les mesures de contrôle en place et leur efficacité
- le degré de conformité de votre entreprise lors d’inspections antérieures
- le nombre d’instruments que votre entreprise offre sur le marché
Santé Canada considère les données examinées (c’est-à-dire, entrevues, visite, échantillons) comme des « preuves tangibles » de la conformité de votre entreprise à un moment précis, parce que ces preuves sont fondées sur des faits que l’inspecteur :
- a obtenu par observation, mesure ou essai ou bien par d’autres moyens
- peut prouver comme étant exacts
Tout écart, toute lacune ou tout manquement à la Loi ou au Règlement observé lors de l’examen des preuves sera noté par l’inspecteur comme une observation. Les inspecteurs classent les observations en fonction de leur risque :
- Risque 1 : critique (risque élevé)
- Risque 2 : majeur (risque modéré)
- Risque 3 : mineur (risque faible)
Nota : Pour en savoir plus sur la classification des risques, veuillez consulter le document suivant :
Pendant l’inspection, l’inspecteur vous fera part des écarts, des lacunes ou des manquements qu’il aura notés. Si l’inspecteur relève un écart, une lacune ou un manquement posant un risque critique ou majeur et pouvant donner lieu à l’attribution d’une cote de non-conformité à l’inspection, il vous en informera immédiatement. L’inspecteur vous demandera d’agir immédiatement pour donner suite à ces observations.
L’inspecteur peut aussi prendre les mesures appropriées de conformité et d’application de la loi. L’inspecteur s’assurera que ces mesures sont conformes aux documents suivants :
- Politique de conformité et d’application de la loi pour les produits de santé (POL-0001)
- Lignes directrices sur la conformité et l’application de la loi à l’égard des instruments médicaux (GUI-0073)
Nota : Vous êtes invité à prendre des mesures pour corriger les écarts, les lacunes ou les manquements dont l’inspecteur vous fait part. Si ceux-ci sont corrigés avant la réunion de fermeture, l’inspecteur l’indiquera dans le rapport d’inspection.
Étape 5 : Rédaction de l’ébauche du rapport d’inspection
L’inspecteur rédigera l’ébauche du rapport d’inspection en se fondant sur les preuves de conformité de votre entreprise. Le rapport d’inspection comprendra le niveau de risque associée aux écarts, aux lacunes ou aux manquements notés lors de l’inspection, le cas échéant. De même, si l’inspecteur a établi que vos activités sont conformes à la Loi et le Règlement, la cote de conformité sera indiquée dans le rapport. Une cote de non-conformité ne figurera pas dans l’ébauche du rapport.
Nota : Santé Canada s’assurera que toute situation jugée non conforme est clairement définie et étayée par la Loi et le Règlement. Reportez-vous à la Liste de vérification des dispositions du Règlement qui s’appliquent à vous pour connaître les exigences auxquelles vous devez vous conformer selon les activités que vous menez (c’est-à-dire, fabrication, importation ou distribution).
Étape 6 : Réunion de fermeture
L’inspecteur tiendra une réunion de fermeture avec vous. Lors de cette rencontre, l’inspecteur :
- vous remettra un exemplaire de l’ébauche du rapport d’inspection fondé sur l’évaluation de vos activités
- vérifiera que vous comprenez les observations notées et les niveaux de risque
- vous indiquera les registres et les documents qui pourront être requis pour satisfaire aux exigences de la Loi ou du Règlement
- discutera avec vous des mesures à prendre pour corriger les écarts, les lacunes ou les manquements notés lors de l’inspection et éviter qu’ils ne se reproduisent
Nota : Afin de respecter son engagement en matière d’ouverture et de transparence, Santé Canada publiera ses premières constatations sur la page Web Inspections relatives aux instruments médicaux.
Si la cote « non conforme » est recommandée, l’inspecteur vous remettra une lettre avec l’ébauche du rapport d’inspection et vous demandera de répondre dans les 15 jours ouvrables. Dans cette lettre :
- on vous demandera de prendre immédiatement des mesures correctives et préventives pour les observations critiques et majeures qui ont contribué à la cote de non-conformité proposée
- on vous avisera que Santé Canada examinera l’ébauche du rapport d’inspection et vous fera parvenir un rapport d’inspection final dans lequel la cote de non-conformité sera confirmée ou changée
On vous demandera d’expliquer les mesures que vous avez prises à l’égard des observations associées à un risque critique (risque 1) et majeur (risque 2) qui ont contribué à la recommandation d’une cote de non-conformité. Nous vous encourageons à poser des questions afin de bien comprendre les observations notées par l’inspecteur.
Étape 7 : Finalisation du rapport d’inspection
L’inspecteur mettra à jour le rapport afin d’indiquer les écarts, les lacunes ou les manquements pour lesquels vous avez pris des mesures correctives. L’inspecteur vous fera ensuite parvenir le rapport d’inspection final qui confirme la cote attribuée à la suite de l’inspection avec une lettre d’accompagnement, dans laquelle seront indiqués les prochaines mesures que vous devriez prendre et le temps dont vous disposez pour le faire. La lettre vous expliquera également la manière de faire part à Santé Canada de tout désaccord envers un ou des éléments du rapport d’inspection.
Nota : Afin de respecter son engagement en matière d’ouverture et de transparence, Santé Canada publiera un sommaire du rapport d’inspection qui peut être consulté en ligne à partir de la page Inspections relatives aux instruments médicaux. Ce sommaire contient un résumé des observations de l’inspection.
Vous devrez donner suite au rapport d’inspection dans les délais suivants :
- Cote « conforme » – Réponse dans un délai de 20 jours ouvrables suivant la date d’émission du rapport d’inspection final
- Cote « non conforme » – Réponse dans un délai de 15 jours ouvrables suivant la date d’émission de l’ébauche du rapport d’inspection
Nota : Pour obtenir une LEIM, les entreprises doivent notamment disposer de procédures écrites pour les différentes activités qu’elles mènent. Veuillez consulter la section Articles 44 à 51 : Licence d’établissement du présent guide pour connaître les exigences relatives à l’obtention d’une licence, y compris les procédures obligatoires.
Lorsque vous avez rempli la demande de licence, on vous a demandé de confirmer que toutes les procédures requises étaient en place dans votre entreprise.
Au cours de l’inspection, une procédure écrite est considérée comme manquante si :
- vous avez fait une fausse attestation dans votre demande de LEIM ou de renouvellement de licence annuel en cochant la case indiquant qu’une procédure précise est en place, mais vous n’avez pas pu fournir cette procédure au moment de l’inspection ou
- vous n’avez pas pu fournir au moment de l’inspection une procédure requise en raison de vos activités
- Par exemple, si vous effectuez l’installation d’instruments médicaux de classe II, III ou IV, vous devez avoir une procédure écrite pour l’installation d’instruments médicaux conformément à l’alinéa 45i) du Règlement (même si vous n’avez pas coché la case sur la demande ou le renouvellement annuel de la licence)
La réponse que vous enverrez à Santé Canada dépendra de la cote que vous aurez reçue (conforme ou non conforme).
Si votre entreprise reçoit une cote de conformité, vous devrez y répondre en fournissant un plan de mesures correctives qui :
- contient la liste des mesures que vous avez prises pour corriger chaque observation et éviter qu’elles ne se reproduisent
- fournit un échéancier pour la mise en place des mesures correctives et préventives qui ne peuvent pas être prises immédiatement
- comprend des documents appuyant les mesures correctives et préventives que vous avez prises
Les mesures sont jugées adéquates si elles corrigent les lacunes et permettent d’éviter qu’elles se reproduisent.
Nota : Pour obtenir de l’aide afin de préparer votre plan de mesures correctives, consultez le Modèle pour un plan de mesures correctives. Si on vous a demandé d’inclure des documents à l’appui de votre plan de mesures correctives, l’inspecteur examinera et évaluera également ces documents. S’ils ne sont pas adéquats, vous devrez soumettre de nouveaux documents. L’inspecteur peut réévaluer votre entreprise si les documents soumis de nouveau sont toujours inadéquats. Cette réévaluation est normalement effectuée dans les 12 mois suivants.
Si votre entreprise reçoit une cote de non-conformité, vous devrez répondre en :
- dressant la liste des mesures que vous avez prises pour corriger les observations présentant un risque critique (risque 1) et majeur (risque 2) qui ont contribué à la cote de non-conformité
- incluant des documents appuyant les mesures correctives et préventives que vous avez prises
- Les mesures correctives sont jugées adéquates si elles corrigent les lacunes et permettent d’éviter qu’elles se reproduisent
- fournissant un plan de mesures correctives assorti d’un échéancier pour l’exécution de toute mesure visant à donner suite aux observations restantes
Étape 8 : Évaluation de la réponse et des mesures prises par l’entreprise
L’inspecteur examinera votre réponse écrite au rapport d’inspection pour s’assurer que les mesures correctives et/ou le plan de mesures correctives sont adéquats.
Entreprise ayant reçu une cote de conformité :
Si vos mesures correctives et/ou votre plan de mesures correctives sont :
- Adéquats : L’inspecteur vous fera parvenir une lettre mettant officiellement fin à l’inspection.
- Inadéquats : Vous aurez une autre chance de répondre. Si vos mesures correctives ou votre plan de mesures correctives demeurent inadéquats, l’inspecteur pourrait réévaluer votre entreprise. Cette réévaluation est normalement effectuée dans les 12 mois suivants.
Si vous ne fournissez pas de mesures correctives ou de plan de mesures correctives (s’il n’y a aucune réponse de votre part), d’autres mesures de conformité et d’application de la loi peuvent être prises, conformément aux documents suivants :
- Politique de conformité et d’application de la loi pour les produits de santé (POL-0001)
- Lignes directrices sur la conformité et l’application de la loi à l’égard des instruments médicaux (GUI-0073)
Entreprise ayant reçu une cote de non-conformité :
Si vous avez pris des mesures correctives pour corriger les observations qui ont contribué à la cote de non-conformité, et que les mesures correctives sont :
- Adéquates : L’inspecteur planifiera une réinspection dans les 12 mois suivants afin d’évaluer les mesures que vous aurez prises.
- Inadéquates : L’inspecteur recommandera à l’Unité des licences d’établissement d’instruments médicaux de Santé Canada de suspendre votre licence.
L’inspecteur indiquera à l’Unité des licences d’établissement d’instruments médicaux si votre réponse est adéquate ou inadéquate.
Nota : Santé Canada vous fera parvenir une lettre de « proposition de suspension » si :
- votre entreprise reçoit une cote de non-conformité et
- les mesures correctives et préventives prises ne donnent pas suite aux observations
Vous aurez alors la possibilité de répondre à la proposition de suspension de votre licence.
Mesures prises par Santé Canada pour veiller à la conformité
Conformément à la Politique de conformité et d’application de la loi pour les produits de santé (POL-0001), Santé Canada préfère que vous preniez volontairement des mesures correctives pour respecter la réglementation. Si vous en êtes incapable ou que vous ne voulez pas le faire, Santé Canada prendra des mesures pour veiller à la conformité.
Au moment de déterminer les mesures d’application de la loi à prendre, nous tiendrons compte des facteurs suivants :
- le risque pour la santé
- votre degré de coopération pendant et après l’inspection, et votre réponse écrite à l’inspection
- vos antécédents en matière de conformité
Si vous êtes une entreprise canadienne, Santé Canada peut :
- demander un arrêt des ventes de votre produit
- demander un rappel de votre produit
- ordonner un rappel de votre produit
- vous ordonner de fournir des renseignements ou des documents
- procéder à une détention de vos importations
- prendre le contrôle de vos articles non conformes (saisie administrative)
- suspendre votre licence
- recommander au ministère de la Justice d’entamer une poursuite judiciaire
Si vous n’êtes pas une entreprise canadienne, Santé Canada peut :
- demander un arrêt des ventes de votre produit
- demander un rappel de votre produit
- suspendre votre licence
- recommander un refus d’entrée de votre produit au Canada
Toutes les mesures de conformité et d’application de la loi prises par les inspecteurs seront conformes aux documents suivants :
- Politique de conformité et d’application de la loi pour les produits de santé (POL-0001)
- Lignes directrices sur la conformité et l’application de la loi à l’égard des instruments médicaux (GUI-0073)
Les inspecteurs peuvent prendre des mesures de conformité et d’application de la loi à n’importe quel moment.