Module 2 : Processus de déclaration à Santé Canada

Télécharger le format de rechange
(Format PowerPoint, 3,4 Mo, 41 pages)
Organisation : Santé Canada
Publiée : 2019-12-13
Module 2 - Résultats d’apprentissage
La fin du module 2 vous permettra de :
- décrire les considérations relatives à la déclaration obligatoire
- décrire les options de déclaration à Santé Canada
- faire la distinction entre les notions suivantes :
- Réaction indésirable grave à un médicament (RIM grave)
- Incident relatif aux instruments médicaux (IIM)
- Incident médicamenteux
- Réaction indésirable (RI) ou effet indésirable (EI)
- Problème relatif aux instruments médicaux (PIM)
- décrire l'information contenue dans le document d'orientation
- décrire la déclaration volontaire des EI et des PIM à Santé Canada
Module 2 - Sujets abordés
- Considérations relatives à la déclaration obligatoire
- Présentation de déclarations à Santé Canada
- Exemples de cas
- Document d’orientation
- Déclaration volontaire à Santé Canada
- Éléments essentiels à retenir
- Abréviations
- Ressources
Modèle théorique de la déclaration par les hôpitaux des RIM graves et des IIM
Le module 2 décrit les processus de déclaration à Santé Canada.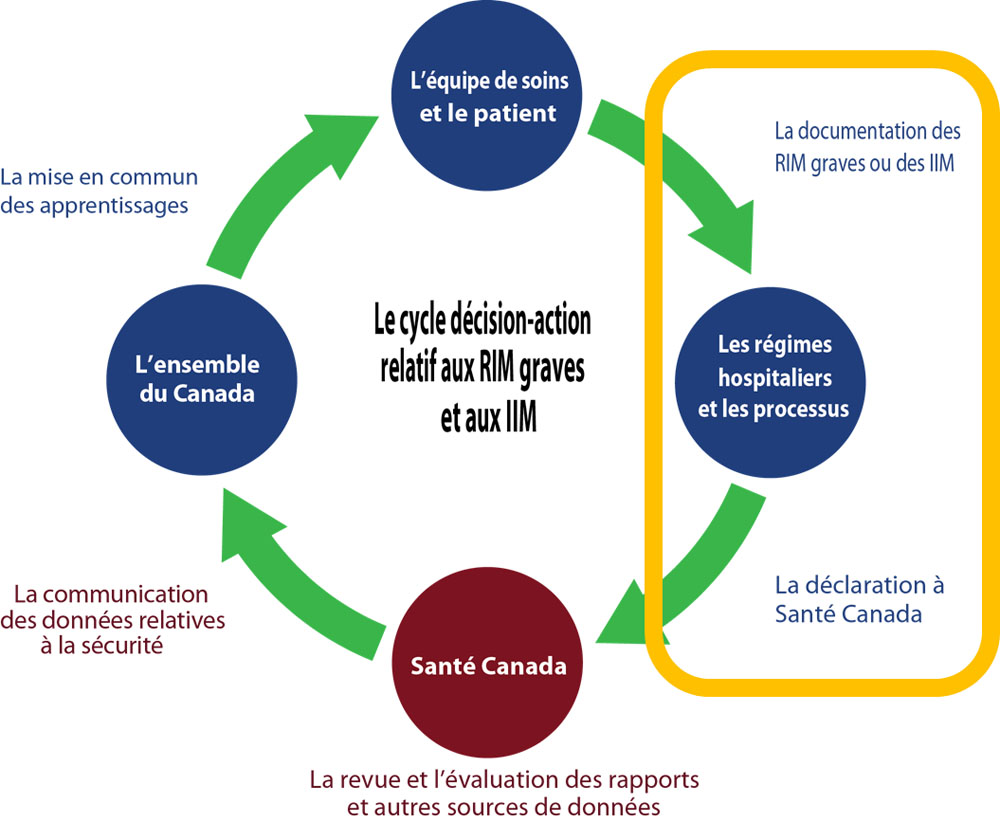
Source : Le cycle décision-action lié aux RIM graves et aux IIM. ISMP Canada, Organisation des normes en santé (HSO), ICSP; 2019
Équivalent textuel
Un diagramme circulaire illustre le cycle décision-action relatif aux déclarations par les hôpitaux au sujet de RIM graves et aux IIM. En résumé, ce graphique illustre que l'équipe soignante et les patient documentent les RIM graves ou les IIM. Signaler un cas de RIM grave ou d'IIM à Santé Canada est soutenu par les systèmes et les processus hospitaliers. Santé Canada communiques les conclusions de sécurité à tous les canadiens, incluant les hôpitaux. Ceci conclue le cycle décision-action.
Le diagramme superpose une forme rectangulaire jaune autour d'une partie du cycle décision-action afin de mettre l'accent sur :
- Documenter les RIM graves ou IIM
- Signaler à Santé Canada
Considérations relatives à la déclaration obligatoire
Considérations relatives aux hôpitaux
- Les systèmes, processus, politiques, procédures et formulaires des hôpitaux pourraient devoir être mis à jour pour refléter les exigences relatives à la déclaration obligatoire des RIM graves et des IIM à Santé Canada.
- Les hôpitaux doivent :
- élaborer et tenir à jour des politiques et des procédures internes
afin de se conformer aux exigences de déclaration obligatoire
des RIM graves et des IIM à Santé Canada - déterminer et communiquer les rôles et responsabilités internes du
personnel afin de satisfaire aux exigences de déclaration obligatoire
- élaborer et tenir à jour des politiques et des procédures internes
- Les exigences de déclaration obligatoire s'appliquent à l'hôpital et non aux fournisseurs de soins de santé qui y travaillent. Toutefois, les fournisseurs de soins de santé auront un rôle important à jouer dans la détection et la consignation des RIM graves et des IIM.
Considérations relatives aux fournisseurs de soins de santé
- Les fournisseurs de soins de santé ont un rôle à jouer dans la détection et la consignation des RIM graves et des IIM, conformément aux processus définis par l'hôpital.
- Santé Canada s'intéresse aux déclarations d'une RIM grave ou d'un IIM, même si :
- son association avec le médicament ou l'instrument médical n'est que présumée ;
- la causalité n'est pas confirmée ;
- la RIM ou l'IIM n’a pas causé de blessure grave, mais a le potentiel d’en causer une s’il devait se reproduire (seulement dans le cas des IIM) ; et/ou
- tous les détails ne sont pas connus.
Conseils pour détecter une RIM grave ou un IIM
- Une blessure grave causée par un médicament ou un instrument médical peut être confondue avec le symptôme d'une maladie.
- Un niveau élevé de suspicion, la sensibilisation clinique et le dialogue avec le patient sont des éléments clés dans la détection d'une RIM grave ou d'un IIM. Les conseils suivants peuvent vous aider :
- Renseignez-vous sur les antécédents médicaux du patient
- Envisagez une RIM grave ou un IIM, si l’une des situations suivantes survient :
- un changement inattendu dans l'état clinique du patient
- le patient présente un nouveau problème de santé
- un besoin urgent de traitements, d'interventions ou de chirurgies supplémentaires
- le besoin soudain d'un antidote électif (p. ex., naloxone, épinéphrine, glucagon)
- une ordonnance médicale pour un changement radical de traitement (p. ex., arrêt brusque du traitement)
- Une RIM grave ou un IIM peut survenir peu de temps après le début du traitement ou beaucoup plus tard
Considérations relatives à la déclaration à l'industrie ou aux fournisseurs
- La réglementation sur la déclaration obligatoire n'oblige pas les hôpitaux à faire des déclarations à l'industrie ou aux fournisseurs, toutefois, elles sont fortement encouragées.
- La déclaration rapide et volontaire à l'industrie ou aux fournisseurs par les hôpitaux permet à l'industrie ou aux fournisseurs de mener des enquêtes pour déterminer les causes et les mesures correctives en temps opportun.
- IIM : L'hôpital doit informer l'industrie ou les fournisseurs d'un IIM dès que possible. Les fabricants ou importateurs sont tenus de déterminer les causes et les mesures correctives.
- Les hôpitaux devraient envisager d'inclure la déclaration à l'industrie/aux fournisseurs dans leurs politiques et procédures de déclaration internes.
- Les hôpitaux devraient envisager de saisir l'instrument médical en cause dans un IIM ; il est important que l'industrie/les fournisseurs disposent de l'instrument pour effectuer des recherches et des analyses plus approfondies.
- IIM : L'hôpital doit informer l'industrie ou les fournisseurs d'un IIM dès que possible. Les fabricants ou importateurs sont tenus de déterminer les causes et les mesures correctives.
- La communication entre toutes les parties est un mécanisme efficace pour s'assurer d'améliorer les produits et la sécurité des patients.
Présentation de déclarations à Santé Canada
Présentation de déclarations de RIM graves et d’IIM à Santé Canada
- Les systèmes variant d'un hôpital à l'autre, Santé Canada demeure souple et peut recevoir des déclarations dans divers formats au moyen de multiples méthodes de présentation sécurisées.
- Si vous souhaitez transmettre vos déclarations à Santé Canada par voie électronique, veuillez envoyer un courriel au Programme Canada Vigilance à l'adresse hc.canada.vigilance.sc@canada.ca.
- Santé Canada appuie les présentations de déclaration au moyen d'un protocole de transfert de fichier sécurisé (sFTP) et continue d'explorer les options de système à système.
- Les formulaires de déclaration des RIM graves et des IIM, accompagnés d'instructions, sont disponibles sur le site Web de Santé Canada :
Réaction indésirable grave à un médicament (RIM grave)
- Une réaction nocive et non intentionnelle à une drogue qui est provoquée par toute dose de celle-ci et qui
- nécessite ou prolonge l’hospitalisation,
- entraîne une malformation congénitale ou une invalidité ou incapacité persistante ou importante,
- met la vie en danger ou
- entraîne la mort.Note de bas de page 1
Exemples de RIM graves
- Lésions rénales causées par un diurétique (« pilule d'eau ») qui nécessitent une dialyse
- Lésions pulmonaires causées par un médicament de chimiothérapie qui nécessitent une oxygénothérapie à long terme
- Réaction allergique à un antibiotique qui met la vie en danger
Nouveau formulaire de déclaration obligatoire des RIM graves
Le nouveau formulaire de déclaration des RIM graves, accompagnés d'instructions, est disponible sur le site Web de Santé Canada.
Incident relatif aux instruments médicaux (IIM)
- Un incident lié à une défaillance d’un instrument médical, à une dégradation de l’efficacité d’un tel instrument, ou à un étiquetage ou un mode d’emploi défectueux, qui a entraîné le décès ou une détérioration grave de l’état de santé d’un patient, d’un utilisateur ou de toute autre personne, ou qui serait susceptible de le faire s’il se reproduisait.Note de bas de page 1
Exemples d’IIM
- Une pompe à perfusion s'est arrêtée en raison d'un mauvais fonctionnement, mais sans déclencher d’alarme. Le patient a reçu une sous-perfusion d’antibiotiques ; un choc septique s‘en est suivi et a prolongé le séjour du patient aux soins intensifs de l'hôpital.
- Un défibrillateur externe n'a pas fourni le niveau d'énergie programmé à un patient en raison d'un dysfonctionnement. Le patient n'a pas été réanimé.
Remarque : Si le patient était réanimé, on considérerait que cela pourrait lui causer une blessure grave (s’il n’y avait pas eu l’intervention opportune d’un fournisseur de soins de santé) et devrait également faire l'objet d'une déclaration.
Nouveau formulaire de déclaration obligatoire des IIM
Le formulaire de déclaration des PIM a été créé aux fins de multiples déclarations :
- Déclaration obligatoire pour :
- Les hôpitaux,
- le Programme d’accès spécial (PAS),
- l’autorisation d’essai expérimental (AEE)
- Déclaration volontaire au Réseau sentinelle canadien pour les matériels médicaux (ResSCMM) par les institutions participantes
Le nouveau formulaire de déclaration des IIM, accompagnés d'instructions, est disponible sur le site Web de Santé Canada.
Exemples de cas
Exemple de cas 1 : L’hôpital est-il tenu de déclarer l’événement?
Un patient traité par warfarine, entre autres médicaments, s’est présenté à l’urgence en raison d’une hémorragie digestive potentiellement mortelle. Le patient a dû être hospitalisé pour que l’on puisse stabiliser son état.
Justification :
- Affection mettant en danger la vie du patient
- Affection ayant entraîné une hospitalisation
- La RIM satisfait aux critères de « gravité »
Exemple de cas 2 : L’hôpital est-il tenu de déclarer l’événement?
Un patient ayant reçu un diagnostic de lymphome de Hodgkin était traité par doxorubicine, par bléomycine, par vincristine et par dacarbazine. Après le cycle 3, le patient a été hospitalisé en raison d’une toux sèche et d’un essoufflement à l’effort. Une fibrose pulmonaire provoquée par la bléomycine était soupçonnée.
Justification :
- Affection mettant en danger la vie du patient
- Affection ayant entraîné une hospitalisation
- La RIM satisfait aux critères de « gravité »
Remarque : Cette RIM satisfait aussi aux critères de « gravité » puisque la fibrose pulmonaire provoquée par la bléomycine peut être considérée comme une invalidité persistante ou importante, car elle peut avoir des répercussions sur la qualité de vie du patient (il peut s’écouler beaucoup de temps avant que la fonction pulmonaire s’améliore).
Exemple de cas 3 : L’hôpital est-il tenu de déclarer l’événement?
Un patient a récemment commencé à prendre de la warfarine anticoagulante par voie orale, et son rapport international normalisé (RIN) fait l’objet d’une surveillance à la clinique d’anticoagulation externe d’un hôpital. Le patient a dit avoir saigné du nez entre les rendez-vous à la clinique. Compte tenu du RIN du patient, la dose de warfarine a été modifiée. Le RIN du patient continuera d’être vérifié à l’hôpital.
Justification :
Bien que le patient puisse être exposé à un risque accru d'un autre saignement (avec un RIN élevé et une hémorragie nasale récente), la RIM ne satisfaisait pas aux critères de « gravité ».
Exemple de cas 4 : L’hôpital est-il tenu de déclarer l’événement?
Un patient était traité par doxorubicine et par cyclophosphamide, et il a développé une neutropénie. Après avoir évalué la gravité de la neutropénie, il a été décidé de poursuivre la chimiothérapie à une dose réduite avec le soutien d’un facteur de croissance.
Justification :
Même si le patient peut présenter un risque accru de contracter une infection potentiellement mortelle, la RIM ne met pas la vie en danger de manière immédiate.
Remarque : Cette RIM devrait être déclarée si le patient développait une neutropénie fébrile qui nécessiterait une hospitalisation pour subir un traitement (p.ex., un traitement antimicrobien afin de prévenir les complications infectieuses provoquées par la neutropénie fébrile).
Exemple de cas 5 : L’hôpital est-il tenu de déclarer l’événement?
Un patient a eu des étourdissements et des sueurs après une dose d'insuline. Le patient avait besoin de comprimés de glucose pour récupérer. On a découvert qu'une insuline à action rapide avait été administrée au lieu de l'insuline à action prolongée habituelle du patient.
Justification :
- Un incident médicamenteux, aussi appelé erreur médicamenteuse, est une erreur liée aux médicaments ou un problème qui pourrait causer une erreur de médicament.
- Les incidents médicamenteux sont généralement évitables et comprennent des erreurs telles que l'administration du mauvais médicament ou de la mauvaise dose ou l'utilisation de la mauvaise voie d'administration.
Remarque : La déclaration des incidents liés aux médicaments et son apprentissage se font dans le cadre d'un programme distinct et complémentaire : le Système canadien de déclaration et de prévention des incidents médicamenteux (SCDPIM).
Source : Le rôle de Santé Canada dans la gestion et la prévention des incidents médicamenteux néfastes
Exemple de cas 6 : L’hôpital est-il tenu de déclarer l’événement?
Des patientes qui ont subi une ablation endométriale de l’utérus ont souffert de brûlures aux organes adjacents ; ce type de brûlures attribuable à une paroi utérine mince constitue un effet secondaire non prévu de l’ablation. Le fabricant n’a pas modifié l’étiquette de l’instrument d’ablation pour avertir les utilisateurs de cet effet secondaire (qui peut se produire lorsque l’instrument fonctionne conformément aux spécifications).
Justification :
- Détérioration grave de l’état de santé d’un patient
- IIM devant être déclaré
Exemple de cas 7 : L’hôpital est-il tenu de déclarer l’événement?
Un professionnel de la santé a signalé que, pendant l’implantation d’une valve cardiaque, le manchon de suture s’est révélé défectueux. La valve a été mise de côté, une autre valve a été implantée et le temps de pompage pendant l’intervention a été prolongé. Cette défectuosité aurait pu causer une blessure grave.
Justification :
- Risque de décès ou de détérioration grave de l'état de santé de ce patient en raison du temps prolongé de l'intervention chirurgicale et du fait que ce défaut aurait pu être omis avant la fermeture chirurgicale d'autres patients entraînant un échec en urgence
- IIM devant être déclaré
Exemple de cas 8 : L’hôpital est-il tenu de déclarer l’événement?
Un fabricant met sur le marché un lot de bandes réactives pour glycémie hors spécifications. Le patient utilise les bandes conformément aux directives ; cependant, les relevés fournissent des valeurs inexactes qui entraînent un dosage d’insuline erroné, et donc un choc hypoglycémique et l’hospitalisation.
Justification :
- Détérioration grave de l’état de santé d’un patient
- IIM devant être déclaré
Exemple de cas 9 : L’hôpital est-il tenu de déclarer l’événement?
L’utilisateur a effectué un essai d’insufflation avant d’installer un cathéter à ballonnet chez un patient, conformément aux directives qui accompagnent l’instrument. L’utilisateur a décelé une anomalie lors de l’insufflation, et un autre cathéter à ballonnet a été utilisé.
Justification :
Cette défectuosité de l'instrument sera toujours décelée par l'utilisateur avant son installation chez un patient et constitue une défectuosité potentielle prévue dans les directives d'utilisation de l'instrument.
Si l'utilisateur effectue le test avant l'utilisation, conformément aux directives, le patient ne risque pas de subir de blessure.
Exemple de cas 10 : L’hôpital est-il tenu de déclarer l’événement?
Un patient meurt après un traitement de dialyse. Le patient avait une insuffisance rénale chronique au stade ultime et en est décédé.
Justification :
Lorsque l’hôpital apprend que la cause d’un incident est certainement due à l’état d’un patient, l’incident n’a pas à être déclaré. L’état du patient peut exister avant l’utilisation de l’instrument ou se produire durant l’utilisation de l’instrument. Un incident causé par l’état d’un patient ne répond pas aux exigences de la définition d’IIM.
Obligation de déclaration des hôpitaux des RIM graves et des IIM : Document d’orientation
- Introduction
- Les règlements et leur objet
- Objet
- Définitions d’une RIM grave et d’un IIM
- Rôles et responsabilités
- Rôle des hôpitaux et des professionnels de la santé
- Autres types d’établissements (p.ex., cliniques privées, foyers de soins infirmiers, cliniques externes)
- Obligation de déclaration de l’hôpital dans d’autres situations (exemples)
- Applicabilité des dispositions réglementaires en fonction du type de produit
- Produits thérapeutiques et instruments médicaux visés
- Produits thérapeutiques et instruments médicaux non visés
- Détermination de l’applicabilité pour les produits mixtes
- RIM graves et IIM à déclarer par les hôpitaux
- Facteurs relatifs à la déclaration de RIM graves / IIM
- Exemples de RIM graves / IIM
- Résultats associés aux IIM
- Évaluation de la causalité / enquêtes effectuées par les hôpitaux
- Exemples de documents
- Exigences en matière de renseignements pour les déclarations de RIM graves et les déclarations d’IIM
- Éléments de données sur les RIM graves / IIM
- Quand et comment présenter une déclaration de RIM grave ou une déclaration d’IIM
- Délai pour la présentation d’une déclaration
- Demandes de suivi de Santé Canada
- Comment présenter une déclaration (méthodes et formats de présentation)
- Liens vers les formulaires de déclaration de RIM/IIM
- Faire appel à un tiers pour présenter une déclaration
- Rétroaction
- Confidentialité des renseignements personnels
- Considérations relatives à la protection de la vie privée lors de la présentation de déclarations
- Autres considérations relatives aux déclarations
- Présentation des déclarations aux fabricants
- Présentation des déclarations au ResSCMM
- Conformité et application de la loi
- Mesures de conformité et d’application de la loi de Santé Canada pour les hôpitaux
Annexes
- Annexe 1 : Abréviations, définitions et terminologie
- Annexe 2 : Autorisation relative à la présentation de déclarations par un tiers
- Annexe 3 : Exigences de déclaration applicables aux produits thérapeutiques qui ne sont pas assujettis aux nouveaux règlements pour les hôpitaux
- Annexe 4 : Guide de référence rapide
Déclaration volontaire à Santé Canada
Déclaration volontaire des effets indésirables (EI) et des problèmes liés à un instrument médical (PIM)
- Santé Canada acquiert des connaissances sur l'innocuité des produits de santé après leur commercialisation. Ces données, indispensables à l‘efficacité de leur utilisation clinique, proviennent de diverses sources, notamment des déclarations de RIM graves et d’IIM.
- La déclaration volontaire d’EI et de PIM soupçonnés par des professionnels de la santé et des consommateurs constitue une autre méthode pour surveiller l'innocuité et l'efficacité des produits de santé commercialisés.
Effet indésirable (EI)
- Une réaction nocive et inattendue à un produit de santé.Note de bas de page 2
Exemples d’EI
- Diminution de la fonction rénale causée par un diurétique (« pilule d’eau »)
- Diminution de la capacité pulmonaire causée par un médicament de chimiothérapie
- Réaction allergique à un antibiotique
Problème lié à un instrument médical (PIM)
- Un problème lié à un instrument médical peut relever de causes diverses :
- un étiquetage ou un mode d’emploi inadéquat
- une défaillance de l’instrument ou une dégradation de son efficacité
- un défaut, réel ou potentiel, susceptible de compromettre la performance ou la sûreté du produitNote de bas de page 2
Remarque : La déclaration des PIM comprend tout type de problème lié aux instruments médicaux ; elle ne correspond pas nécessairement à la définition d'un IIM.
Exemples de PIM
- Les tubulures ont fui, ce qui a retardé le traitement, mais le patient n'a subi aucune blessure grave
- L'aiguille s'est cassée lors d'une prise de sang, mais elle a été retirée en ne laissant qu’une blessure mineure au patient
Programme Canada Vigilance
Le Programme Canada Vigilance est un programme national de surveillance après la mise en marché qui recueille et évalue les déclarations d’EI et de PIM présumés associés aux produits commercialisés au Canada.
Déclaration volontaire d’EI liés aux produits de santé
- Formulaire de déclaration en ligne
- Par téléphone : 1 866 234-2345 (sans frais)
- Par télécopieur ou par la poste : télécharger, imprimer et remplir le Formulaire de déclaration des effets secondaires
(veuillez lire les instructions avant de remplir le formulaire)- Par télécopieur : 1 866 678-6789 (sans frais)
- Par la poste : bureau de Canada Vigilance (en utilisant l’étiquette préaffranchie)
Déclaration volontaire de PIM
- Le Réseau sentinelle canadien pour les matériels médicaux(ResSCMM) est un programme proactif de surveillance qui encourage la présentation de déclarations sur les PIM par tous les types d’établissements.
- Seules les institutions participantes du ResSCMM déclarent volontairement les PIM qui surviennent dans leur organisation directement par le biais du Programme Canada Vigilance.
- Les consommateurs, les professionnels de la santé et les institutions qui ne participent pas au ResSCMM sont encouragés à déclarer volontairement les incidents liés aux instruments médicaux directement à Santé Canada en remplissant le Formulaire de plainte d’un produit de santé par l’entremise de la Direction générale des opérations réglementaires et de l’application de la loi.
Déclaration des EI et des PIM à Santé Canada
La page Web intitulée Déclarer un effet indésirable ou un incident lié à un instrument médical donne accès à plus de renseignements et de formulaires.
Éléments essentiels à retenir
- Les systèmes, processus, politiques, procédures et formulaires des hôpitaux pourraient devoir être mis à jour pour refléter les exigences relatives à la déclaration obligatoire des RIM graves et des IIM à Santé Canada.
- Les professionnels de la santé ont un rôle important à jouer dans la déclaration des RIM graves et des IIM.
- Santé Canada est disposé à accepter différents formats pour les déclarations de RIM graves et d'IIM, sachant que les systèmes hospitaliers varient.
- Il est important de comprendre les différences entre les RIM graves, les IIM, les incidents médicamenteux, les EI et les PIM et la façon de les déclarer.
- Le document d'orientation offre de l'information pour aider les hôpitaux à respecter les exigences réglementaires relatives à la déclaration des RIM graves et des IIM à Santé Canada.
- Santé Canada valorise la déclaration volontaire et dispose de programmes pour l'appuyer.
Abréviations
- AEE :
- Autorisation d'essai expérimental
- EI :
- Effet indésirable
- IIM :
- Incident lié aux instruments médicaux
- PAS :
- Programme d'accès spécial
- PIM :
- Problème relatif aux instruments médicaux
- ResSCMM :
- Réseau sentinelle canadien pour les matériels médicaux
- RIM :
- Réaction indésirable à un médicament
- SCDPIM :
- Système canadien de déclaration et de prévention des incidents médicamenteux
- sFTP :
- Protocole de transfert de fichier sécurisé
Ressources
- Demandes d’autorisation d’essai expérimental pour les instruments médicaux ligne directrice – Sommaire
- Réseau sentinelle canadien pour les matériels médicaux
- Système canadien de déclaration et de prévention des incidents médicamenteux
- Programme Canada Vigilance
- MedEffet de Santé Canada
- Déclaration obligatoire des réactions indésirables graves à un médicament et des incidents liés aux instruments médicaux par les hôpitaux : document d’orientation
- Le rôle de Santé Canada dans la gestion et la prévention des incidents médicamenteux néfastes
- Formulaire de plainte d’un produit de santé
- Règlement sur les instruments médicaux
- Instruments médicaux – Programme d’accès spécial
- Formulaire de déclaration des effets secondaires
- Loi visant à protéger les Canadiens contre les drogues dangereuses (Loi de Vanessa)
- Règlement modifiant le Règlement sur les aliments et drogues
- Règlement modifiant le Règlement sur les instruments médicaux
- Déclarer un effet indésirable ou un incident lié à un instrument médical
Pour de plus amples renseignements, veuillez communiquer avec le Programme Canada Vigilance :
Courriel : hc.canada.vigilance.sc@canada.ca
Téléphone : 1 866 234-2345
Remerciements
- Tous les documents ont été élaborés par les parties collaboratrices suivantes : Santé Canada, l’Institut pour l’utilisation sécuritaire des médicaments du Canada (ISMP Canada), l’Organisation de normes en santé (HSO) et l’Institut canadien pour la sécurité des patients (ICSP).
- Toute personne souhaitant les utiliser doit citer Santé Canada comme le propriétaire et la source des documents : Formation à l’appui de la déclaration obligatoire, Santé Canada, 2019.
- Note de bas de page 1
-
Déclaration obligatoire des réactions indésirables graves à un médicament et des incidents liés aux instruments médicaux par les hôpitaux - Document d’orientation
- Note de bas de page 2
-
Déclarer un effet indésirable ou un incident lié à un instrument médical