Archivée - InfoVigilance sur les produits de santé – novembre 2019

Télécharger le format de rechange
(Format PDF, 695 Ko, 9 pages)
Direction générale des produits de santé et des aliments
Direction des produits de santé commercialisés
Organisation : Équipe de rédaction de l'InfoVigilance sur les produits de santé
ISSN: 2368-8033
Cat.: H167-1F-PDF
Pub.: 190001
Contenu
- Produits de santé mentionnés dans ce numéro
- Récapitulatif mensuel
- Nouveaux renseignements
- Nouvelles de Santé Canada : Préparation à la déclaration obligatoire
- Portée
- Liens utiles
- Des suggestions?
- Droit d'auteur
Produits de santé mentionnés dans ce numéro
Produits pharmaceutiques et biologiques
- Balversa (erdafitinib)
- Bavencio (avélumab)
- EpiPen et EpiPen Jr (épinéphrine)
- Lemtrada (alemtuzumab)
- Ranitidine
- Xarelto (rivaroxaban)
Matériels médicaux
Produits de santé naturels
Autres
Récapitulatif mensuel des renseignements sur l'innocuité des produits de santé
Voici une liste des avis concernant les produits de santé, des rappels de type I, ainsi que des résumés de l'examen de l'innocuité ou de la sûreté publiés en octobre 2019 par Santé Canada.
EpiPen et EpiPen Jr (épinéphrine)
Il arrive, quoique très rarement, que certains dispositifs EpiPen (0,3 mg) et EpiPen Jr (0,15 mg) ne sortent pas facilement de leurs tubes de rangement ou n'en sortent pas du tout. Le problème est lié au tube de rangement et non au dispositif ni au médicament qu'il contient. L'entreprise a déterminé la cause du problème et a adopté des mesures correctives. Les produits ne seront pas rappelés pour le moment étant donné que les pharmaciens et les consommateurs peuvent facilement atténuer le risque en vérifiant, avant qu'une situation d'urgence ne survienne, que les auto-injecteurs peuvent facilement sortir du tube de rangement.
Avis - EpiPen et EpiPen Jr (épinéphrine)
Lemtrada (alemtuzumab)
Des cas potentiellement mortels et mortels ont été signalés chez des patients atteints de sclérose en plaques récurrente-rémittente recevant Lemtrada (alemtuzumab). Cela comprend des déclarations d'hépatite auto-immune et de lymphohistiocytose hémophagocytaire ainsi que des réactions cardiovasculaires graves associées. La monographie de produit canadienne a été mise à jour pour comprendre une révision de l'indication d'utilisation et des données sur l'innocuité.
Communication des risques aux professionnels de la santé - Lemtrada (alemtuzumab)
Moniteur de surveillance fœtale Avalon
Cet examen de la sûreté a évalué le risque d'inexactitude dans la surveillance de la fréquence cardiaque fœtale associée au moniteur de surveillance fœtale Avalon. L'examen des renseignements disponibles réalisé par Santé Canada a révélé que la surveillance de la fréquence cardiaque fœtale est parfois associée à des mesures inexactes; cependant, il n'y avait pas suffisamment de données pour déterminer s'il existe un lien entre l'utilisation du moniteur et les incidents déclarés. Il n'y avait aucun signe de mauvais fonctionnement de l'instrument lors de ces incidents. Bien que les instructions d'utilisation du moniteur de surveillance fœtale Avalon comprennent des renseignements détaillés sur l'utilisation correcte de l'instrument, les instructions les plus importantes ne sont pas mises en évidence. Par conséquent, il est possible que les utilisateurs ne soient pas au courant de certaines étapes clés pendant l'utilisation de l'appareil, ce qui pourrait fausser les données relatives à la surveillance de la fréquence cardiaque fœtale. Santé Canada a travaillé avec le fabricant afin qu'il mette à jour les instructions d'utilisation, pour que les instructions les plus importantes soient mises en évidence de façon appropriée. Santé Canada a également communiqué cette information aux professionnels de la santé.
Communication des risques aux professionnels de la santé - Moniteur de surveillance fœtale Avalon
Résumé de l'examen de la sûreté - Moniteur de surveillance fœtale Avalon
Passion X et Passion Fem
Tous les lots de « Passion X » et « Passion Fem » ont été rappelés du commerce de détail parce qu'ils contiennent du sildénafil non déclaré. Les produits sont commercialisés pour aider à soutenir les aspects émotionnels de la santé sexuelle. De plus, Santé Canada a suspendu toutes les licences de produits de santé sexuelle de Pharm Canada Inc., ce qui signifie qu'aucune personne ou entreprise n'est autorisée à vendre ces produits au Canada.
Avis - Passion X et Passion Fem
Produits de santé de l'étranger
Les organismes de réglementation des États-Unis, de Singapour, de l'Australie et de Hong Kong ont découvert que ces produits de santé de l'étranger contiennent des ingrédients pharmaceutiques non déclarés qui peuvent présenter des risques graves pour la santé. La vente de ces produits n'est pas autorisée au Canada, et ils ne sont pas offerts sur le marché canadien. Toutefois, il se peut que des Canadiens en aient acheté lors d'un voyage à l'étranger ou par Internet.
Alerte concernant des produits de l'étranger
Produits de santé non autorisés
Santé Canda a avisé les Canadiens que divers produits de santé non autorisés qui pourraient poser un risque grave pour la santé ont été vendus dans des points de vente au détail au Canada ou en ligne.
Dentifrice « Yunnan Baiyao » de LinkGlobal Food inc.
Enceintes hyperbares à parois souples
Multiples produits de santé non autorisés
Produits de Vikings Nutrition pour améliorer la performance sexuelle, favoriser la perte de poids ou faciliter le sommeil
Ranitidine
Santé Canada est en train d'évaluer la présence d'une impureté, la N-nitrosodiméthylamine (NDMA), dans certains médicaments contenant de la ranitidine. D'après les données probantes connues, la NDMA pourrait être présente dans les produits de ranitidine, peu importe le fabricant. Les entreprises faisant la promotion des produits contenant de la ranitidine ont, à la demande de Santé Canada, cessé la distribution de ces produits jusqu'à ce qu'il soit prouvé qu'ils ne contiennent pas de NDMA à des concentrations dépassant celles qui sont acceptables. La mise à jour fournit un tableau avec des renseignements détaillés concernant les lots visés.
Xarelto (rivaroxaban)
Cet examen de l'innocuité a évalué le risque de lésions hépatiques associées au Xarelto (rivaroxaban). Après avoir complété un examen en 2015, Santé Canada a publié un article dans le numéro d'août 2015 d'InfoVigilance sur les produits de santé afin de résumer la compréhension du Département concernant les risques de lésions hépatiques associées à l'utilisation de Xarelto. En 2019, Santé Canada a examiné toutes les nouvelles données probantes accessibles concernant le risque potentiel de lésions hépatiques associées à l'utilisation de Xarelto. L'examen de Santé Canada des données accessibles n'a pas permis d'établir de lien clair entre l'utilisation de Xarelto et le risque de lésions hépatiques. Santé Canada continuera de surveiller les renseignements sur l'innocuité de Xarelto, comme il le fait à l'égard de tous les produits de santé sur le marché canadien.
Résumé de l'examen de l'innocuité - Xarelto (rivaroxaban)
Nouveaux renseignements sur l'innocuité des produits de santé
Les sujets suivants ont été sélectionnés dans le but d'accroître la sensibilisation et, dans certains cas, encourager la déclaration d'effets indésirables similaires.
Résumé semestriel de l'innocuité des vaccins
Santé Canada et l'Agence de la santé publique du Canada (ASPC) partagent la responsabilité de la surveillance de l'innocuité des vaccins au Canada.
Les détenteurs d'une autorisation de mise en marché sont tenus de déclarer les effets secondaires suivant l'immunisation considérés graves au Programme Canada Vigilance de Santé Canada. Le Programme Canada Vigilance reçoit également des déclarations volontaires des professionnels de la santé et des consommateurs.
Les autorités de santé publique provinciales et territoriales déclarent les effets secondaires suivant l'immunisation (ESSI) provenant des programmes d'immunisation financés par l'État au Système canadien de surveillance des effets secondaires suivant l'immunisation (SCSESSI) de l'ASPC afin de surveiller l'innocuité des programmes d'immunisation.
Rapport pour la période du 1er janvier au 30 juin 2019
Messages clés:
- Aucun nouveau signal d'innocuité (problème d'innocuité potentiel) n'a été identifié pendant cette période.
- Du 1er janvier 2019 au 30 juin 2019, le Programme Canada Vigilance a reçu 594 déclarationsFootnote 1 d'effets secondaires suivant l'immunisation soupçonnés d'avoir été causés par des vaccins.
Le présent résumé semestriel de l'innocuité des vaccins fait un compte rendu des déclarations d'ESSI reçues par le Programme Canada Vigilance entre le 1er janvier et le 30 juin 2019. Pour voir les rapports publiés par le SCSESSI, consulter le site Web du SCSESSI.
- Du 1er janvier 2019 au 30 juin 2019, le Programme Canada Vigilance a reçu 594 déclarationsFootnote 1 d'effets secondaires suivant l'immunisation soupçonnés d'avoir été causés par des vaccins.
- La plus grande proportion de déclarations provient de la déclaration spontanée (figure 1). La source des déclarations est présentée à la figure 2 (à noter : 3 déclarations avec type de déclarant inconnu n'ont pas été incluses dans le graphique).

Figure 1 : Nombre total de déclarations reçues selon le type de déclaration
| Type de déclaration | Pourcentage (%) |
|---|---|
| Autre | 1,68 |
| Publiée | 5,56 |
| Spontanée | 87,71 |
| Étude | 5,05 |
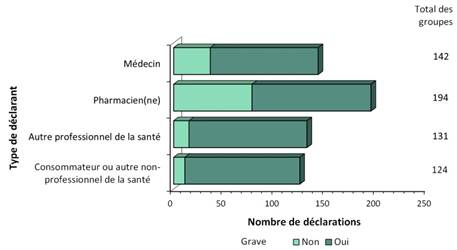
Figure 2 : Nombre total de déclarations reçues selon le type de déclarant
| Type de déclarant | Nombre de déclarations non graves | Nombre de déclarations graves |
|---|---|---|
| Consommateur ou autre non-professionnel de la santé | 11 | 113 |
| Autre professionnel de la santé | 15 | 116 |
| Pharmacien(ne) | 77 | 117 |
| Médecin | 36 | 106 |
La majorité des déclarations impliquait des femmes (figure 3) et le groupe d'âge le plus fréquent était le groupe d'adultes âgés de 19 à 64 ans (figure 4).

Figure 3 : Nombre total de déclarations reçues selon le sexe
| Sexe | Pourcentage (%) |
|---|---|
| Sexe féminin | 55,39 |
| Sexe masculin | 29,46 |
| Sexe Inconnu | 15,15 |

Figure 4 : Nombre total de déclarations reçues selon le groupe d'âge
| Âge | Nombre de déclarations non graves | Nombre de déclarations graves |
|---|---|---|
| Nourrisson (28 jours à 23 mois) | 4 | 32 |
| Enfant (2-11 ans) | 2 | 24 |
| Adolescent (12-18 ans) | 1 | 7 |
| Adulte (19-64 ans) | 67 | 149 |
| Aîné (≥ 65 ans) | 62 | 117 |
| Inconnu | 6 | 123 |
Il y avait 452 (76%) déclarations graves. La plupart impliquaient des patients avec des problèmes de santé sous-jacents et les effets secondaires graves n'étaient probablement pas liés à la vaccination.
Le plus grand nombre de déclarations (graves et non graves) reçues impliquait le vaccin contre le zona (306 déclarations, 52%), suivi par les vaccins antipneumococciques (133 déclarations, 22%), et les vaccins contre l'influenza (55 déclarations, 9%).

Figure 5: Nombre total de déclarations reçues selon le vaccin (certaines déclarations peuvent inclure plus d'un vaccin)
| Type de vaccin | Nombre de déclarations non graves | Nombre de déclarations graves | |
|---|---|---|---|
| Vaccin Bacille de Calmette-Guérin | BCG | 0 | 1 |
| Vaccin contre le choléra et la diarrhée du voyageur due à Escherichia Coli entérotoxinogène | Chol Ecol | 1 | 2 |
| Vaccin contenant les anatoxines diphtérique et tétanique et un vaccin anticoquelucheux acellulaire | DCaT | 4 | 28 |
| Vaccin contre l'hépatite A | HA | 0 | 4 |
| Vaccin contre l'hépatite A et l'hépatite B | HAB | 1 | 7 |
| Vaccin contre l'hépatite B | HB | 0 | 1 |
| Vaccin contre l'Haemophilus influenza de type b | Hib | 0 | 1 |
| Vaccin contre le virus du papillome humain | VPH | 6 | 25 |
| Vaccin contre le zona | VZ | 99 | 207 |
| Vaccin contre l'influenza | INF | 10 | 45 |
| Vaccin contre l'encéphalite japonaise | EJ | 3 | 0 |
| Vaccin contre le méningocoque de sérogroupe C, A, Y, W-135 | MEN | 0 | 20 |
| Vaccin multicomposant contre le méningocoque du sérogroupe B | MEN-B | 0 | 9 |
| Vaccin contre la rougeole, la rubéole et les oreillons | RRO | 2 | 26 |
| Vaccin contre la rougeole, la rubéole, les oreillons et la varicelle | RROV | 1 | 3 |
| Vaccin contre le pneumocoque | PNEU | 12 | 121 |
| Vaccin antipoliomyélitique | POL | 0 | 1 |
| Vaccin contre la rage | Rage | 1 | 0 |
| Vaccin contre le rotavirus | ROT | 1 | 14 |
| Vaccin contenant l'anatoxine tétanique et une dose réduite d'anatoxine diphtérique | TD | 2 | 4 |
| Vaccin contenant l'anatoxine tétanique, une dose réduite d'anatoxine diphtérique et un vaccin anticoquelucheux acellulaire | dcaT | 1 | 6 |
| Vaccins contre la typhoïde | TYPH | 2 | 1 |
| Vaccin contre la varicelle | VAR | 3 | 11 |
| Vaccin contre la fièvre jaune | FJ | 2 | 2 |
La majorité des déclarations concernant le vaccin contre le zona (306 déclarations) était pour Shingrix (292 déclarations). Parmi ces 292 déclarations pour Shingrix, 57 étaient décrites comme des cas venant des médias sociaux ou digitaux récupérés par les détenteurs d'une autorisation de mise en marché (DAMM). Aucune déclaration venant des médias sociaux ou digitaux n'a pu être évaluée de façon convenable afin de déterminer s'il existe une association causale avec le vaccin en raison d'un manque d'information.
Le décès a été signalé dans 7 déclarations. Deux déclarations impliquaient des hommes, 2 des femmes et 3 étaient de sexe inconnu. L'âge n'a pas été fourni pour 2 déclarations. Pour les autres déclarations, 3 impliquaient des personnes âgées, une impliquait un adulte et la dernière, un nourrisson. Les vaccins impliqués dans les déclarations étaient : vaccins contenant l'anatoxine tétanique et une dose réduite d'anatoxine diphtérique [Td] (2), vaccin contenant les anatoxines diphtérique et tétanique et un vaccin anticoquelucheux acellulaire [DCaT] (1), vaccin contre le virus du papillome humain [VPH] (1), vaccin contre l'influenza (1), vaccin contre la rougeole, la rubéole, les oreillons et la varicelle [RROV] (1), et vaccin contre le pneumocoque (1). L'information fournie dans ces déclarations n'était pas suffisante pour évaluer convenablement l'association causale avec le vaccin.
Les effets secondaires (graves et non graves) signalés le plus fréquemment incluaient l'échec de la vaccination, la fièvre, le zona, les maux de tête et la douleur. Ces effets secondaires ont été surtout déclarés pour Shingrix. Les effets secondaires liés à l'échec de la vaccination et au zona provenaient des médias sociaux ou digitaux extraits par les DAMM. Aucune déclaration venant des médias sociaux ou digitaux n'a pu être évaluée de façon convenable afin de déterminer s'il existe une association causale avec le vaccin, en raison du manque d'au moins 2 des renseignements suivants : les doses reçues (première ou deuxième dose, ou les deux), le délai d'apparition, les conditions préexistantes et concomitantes avant l'administration du vaccin, les antécédents médicaux, les traitements concomitants, le traitement correctif et la confirmation médicale/ tests et résultats médicaux des effets secondaires.
Aucun nouveau signal d'innocuité (problème d'innocuité potentiel) n'a été identifié pendant cette période.
Les avantages des vaccins autorisés au Canada continuent de l'emporter sur les risques.
Santé Canada, en collaboration avec l'Agence de la santé publique du Canada (ASPC), continuera de surveiller étroitement l'innocuité des vaccins autorisés au Canada.
Pour obtenir de plus amples renseignements, veuillez communiquer avec la Direction des produits de santé commercialisés.
Notez qu'en raison d'une mise à jour de l'information reçue par le Programme Canada Vigilance, il peut y avoir des différences dans le nombre de déclarations et les effets secondaires extraits à des dates différentes.
Avis d'autorisation de mise en marché avec conditions
Un avis de conformité avec conditions (AC-C) est une forme d'autorisation de mise en marché assortie de conditions et accordée à un produit qui s'appuie sur des preuves d'efficacité cliniques prometteuses à la suite d'un examen de la présentation par Santé Canada. La communication d'un AC-C vise à fournir des détails sur le produit et la nature de l'autorisation accordée.
Les professionnels de la santé sont invités à déclarer à Santé Canada tout effet indésirable présumé être associé à des produits de santé commercialisés, y compris aux médicaments autorisés en vertu de la Politique sur les AC-C.
Le contenu de ces avis reflète les informations actuelles au moment de la publication. Les conditions associées à un AC-C demeureront jusqu'à ce qu'elles aient été remplies et autorisées par Santé Canada conformément à la politique d'AC-C. Pour les informations les plus récentes, veuillez consulter la base de données des AC de Santé Canada.
Balversa (erdafitinib) : Autorisation avec conditions
Santé Canada a publié un avis de conformité en vertu de la politique d'Avis de conformité avec conditions concernant le produit appelé Balversa (erdafitinib), comprimés oraux à 3 mg, à 4 mg et à 5 mg. Balversa est indiqué pour le traitement des patients adultes atteints de carcinome urothélial localement avancé ou métastatique :
- dont les récepteurs tumoraux du facteur de croissance des fibroblastes 2 ou 3 (FGFR2 ou FGFR3) présentent des altérations génétiques sensibles au traitement et
- chez qui la maladie a progressé pendant ou après au moins une chimiothérapie antérieure, y compris au cours des 12 mois suivant une chimiothérapie néoadjuvante ou adjuvante.
Les patients devraient être avisés de la nature conditionnelle de l'autorisation de mise en marché pour cette indication.
Pour obtenir les renseignements d'ordonnance complets et les renseignements destinés aux patients et aux soignants, veuillez consulter la monographie de produit canadienne de Balversa. La monographie de produit est accessible sur la base de données sur les produits pharmaceutiques de Santé Canada, sur le site Web de Janssen Inc. ou auprès de Janssen Inc. au 1-800-567-3331 ou au 1-800-387-8781. Veuillez communiquer avec la compagnie pour obtenir une copie de toute référence, pièce jointe ou annexe.
Bavencio (avélumab) : Autorisation avec conditions
Santé Canada a publié un avis de conformité en vertu de la politique d'Avis de conformité avec conditions pour une extension de l'indication concernant le produit appelé BavencioFootnote * (avélumab), solution pour perfusion intraveineuse, fiole à usage unique de 20 mg/mL. L'extension de l'indication de Bavencio est pour le traitement des patients adultes atteints de carcinome à cellules de Merkel (CCM) métastatique. Les patients devraient être avisés de la nature conditionnelle de l'autorisation de mise en marché pour cette indication.
Pour obtenir les renseignements d'ordonnance complets et les renseignements destinés aux patients et aux soignants, veuillez consulter la monographie de produit canadienne de Bavencio. La monographie de produit est accessible sur la base de données sur les produits pharmaceutiques de Santé Canada, sur le site Web de EMD Serono ou auprès de EMD Serono, au 1-888-737-6668. Veuillez communiquer avec la compagnie pour obtenir une copie de toute référence, pièce jointe ou annexe.
Nouvelles de Santé Canada
Préparation à la déclaration obligatoire
Le 16 décembre 2019, une nouvelle réglementation exigera des hôpitaux qu'ils déclarent les réactions indésirables graves aux médicaments et les incidents associés aux instruments médicaux à Santé Canada.
Santé Canada a attribué à chaque hôpital visé par la réglementation un identifiant unique. Les établissements qui fournissent cet identifiant d'établissement n'auront pas à fournir leurs coordonnées sur les formulaires de déclaration de réactions et d'incidents. Les hôpitaux peuvent obtenir cet identifiant en envoyant une demande au programme Canada Vigilance (hc.canada.vigilance.sc@canada.ca).
Les hôpitaux pourront présenter leurs déclarations à Santé Canada par voie électronique (p.ex., par protocole de transfert de fichier sécurisé [SFTP]), au moyen d'applications en ligne, par télécopieur ou par la poste. Le SFTP est un moyen sûr et efficace d'envoyer des déclarations à Santé Canada. Cette méthode permet l'envoi d'un seul fichier ou d'un lot de fichiers PDF, MS Word, MS Excel et XML. Dans le cas des transferts par SFTP, les hôpitaux doivent compléter un processus d'enregistrement, après quoi ils recevront une procédure d'utilisation du SFTP. Pour vous enregistrer, veuillez envoyer une demande au programme Canada Vigilance (hc.canada.vigilance.sc@canada.ca).
Les hôpitaux peuvent faire appel à un tiers, comme une autorité régionale de la santé, un autre programme de déclaration ou un autre agent, pour présenter les déclarations à Santé Canada en leur nom. Pour ce faire, l'hôpital et le tiers doivent conclure une entente qui autorise la collecte de renseignements par le tiers au nom de l'hôpital et qui assure la présentation de déclarations conformes aux exigences de la réglementation. Cette entente doit être signée par les représentants de l'hôpital et du tiers, et remise à Santé Canada.
Pour en savoir plus, veuillez consulter le document d'orientation de Santé Canada intitulé « Déclaration obligatoire des réactions indésirables graves à un médicament et des incidents liés aux instruments médicaux par les hôpitaux » ou la page Canada.ca/medicament-instrument-declaration.
Portée
Cette publication mensuelle s'adresse principalement aux professionnels de la santé et contient des informations sur les produits pharmaceutiques, biologiques, les matériels médicaux et les produits de santé naturels. Elle fournit un résumé des informations clés concernant l'innocuité des produits de santé qui ont été publiés au cours du mois précédent par Santé Canada, ainsi qu'une sélection de nouveaux renseignements en matière d'innocuité sur les produits de santé, pour en accroître la sensibilisation. Les nouvelles informations contenues dans ce numéro ne sont pas exhaustives, mais représentent plutôt une sélection de problèmes d'innocuité cliniquement pertinents, justifiant une dissémination améliorée.
Pour signaler des effets indésirables
Programme Canada Vigilance
Téléphone : 1-866-234-2345
Télécopieur ou courrier : formulaire disponible sur MedEffet Canada
Des renseignements sur la marche à suivre pour déclarer un effet indésirable à Santé Canada sont publiés à la page Déclaration des effets indésirables ou des incidents liés aux matériels médicaux.
Liens utiles
- MedEffetMC Canada
- Base de données sur les rappels et les avis de sécurité
- Nouveaux examens de l'innocuité ou de la sûreté
- Base de données en ligne des effets indésirables de Canada Vigilance
- Base de données sur les produits pharmaceutiques
- Liste des instruments médicaux homologués
- Base de données des produits de santé naturels homologués
- Registre des médicaments et des produits de santé
- Pénuries de médicaments Canada
- Tendances annuelles dans les déclarations de cas d'effets indésirables et des incidents liés aux matériels médicaux
- Mettons fin au marketing illégal des médicaments et des instruments médicaux
Des suggestions?
Vos commentaires sont importants pour nous. Dites-nous ce que vous pensez en nous contactant à HC.infowatch-infovigilance.SC@canada.ca
Santé Canada
Direction des produits de santé commercialisés
Localisateur 1906C
Ottawa (Ontario) K1A 0K9
Téléphone : 613-954-6522
Télécopieur : 613-952-7738
Droit d'auteur
©2019 Sa Majesté la Reine du Chef du Canada. Cette publication peut être reproduite sans autorisation à condition d'en indiquer la source en entier. Il est interdit de l'utiliser à des fins publicitaires. Santé Canada n'accepte pas la responsabilité de l'exactitude ou de l'authenticité des renseignements fournis dans les notifications.
On ne peut que soupçonner la plupart des effets indésirables (EI) des produits de santé à l'égard desquels on ne peut établir de lien prouvé de cause à effet. Les notifications spontanées d'EI ne peuvent servir pour déterminer l'incidence des EI, étant donné que les EI ne sont pas suffisamment signalés et l'étendue d'exposition des patients est inconnue.
En raison des contraintes de temps concernant la production de cette publication, les informations publiées peuvent ne pas refléter les informations les plus récentes.
Footnotes
- Footnote *
-
La monographie de produit actualisée de Bavencio qui comprend cette indication AC-C est datée de novembre 2019.
- Footnote 1
-
Glossaire des champs de la base de données en ligne des effets indésirables de Canada Vigilance