InfoVigilance sur les produits de santé – juin 2019

Télécharger le format de rechange
(PDF format, 657 KB, 9 pages)
Direction générale des produits de santé et des aliments Direction des produits de santé commercialisés
Organization:Équipe de rédaction de l'InfoVigilance sur les produits de santé
ISSN: 2368-8033
Cat.: H167-1F-PDF
Pub.: 190001
Contenu
- Produits de santé mentionnés dans ce numéro
- Annonce : Santé Canada met les Canadiens en garde contre le risque de cancer associé au produit médicamenteux en vente libre violet de gentiane
- Récapitulatif mensuel
- Nouveaux renseignements
- Portée
- Liens utiles
- Des suggestions?
- Droit d'auteur
Produits de santé mentionnés dans ce numéro
Produits pharmaceutiques et biologiques
Actemra (tocilizumab)
pms-Methotrexate (méthotrexate)
Solution pour dialyse péritonéale Extraneal
Violet de gentiane, produit médicamenteux en vente libre
Matériels médicaux
Ballonnets enrobés de paclitaxel et endoprothèses à élution de paclitaxel
Dispositifs de perfusion de la pompe Alaris
Implants mammaires Biocell
Système de photophérèse Cellex
Violet de gentiane, instruments médicaux
Produits de santé naturels
Produits de santé fabriqués par Konsar Future Nutrition Inc.
Autres
Produits de santé de l'étranger
Produits de santé non autorisés
Thérapies cellulaires non autorisées
Annonce
Santé Canada met les Canadiens en garde contre le risque de cancer associé au produit médicamenteux en vente libre violet de gentiane
Santé Canada a réalisé 2 évaluations des risques pour la santé sur les produits contenant du violet de gentiane et le risque de cancer. L'une portait sur un produit médicamenteux en vente libre (Gentiane Violet Liquid Topical), et l'autre, sur des instruments médicaux (pansements antibactériens Hydrofera en mousse). L'évaluation de Santé Canada du produit médicamenteux en vente libre a conclu qu'il existe un risque de cancer, en raison d'une exposition par voie orale. L'évaluation des instruments médicaux contenant du violet de gentiane n'a pas identifié un risque de cancer.
L'évaluation des risques associés au produit médicamenteux en vente libre réalisée par Santé Canada a permis de conclure que, selon des articles scientifiques décrivant des études animales, il est possible que le violet de gentiane cause le cancer. Il n'y avait qu'un seul produit médicamenteux en vente libre contenant du violet de gentiane commercialisé au Canada, Gentiane Violet Liquid Topical. En mai 2019, le fabricant a volontairement cessé de commercialiser son produit au Canada, et l'homologation du produit a été annulée.
L'évaluation des risques associés aux instruments médicaux homologués contenant du violet de gentiane (pansements antibactériens Hydrofera en mousse) réalisée par Santé Canada, compte tenu de l'exposition limitée au violet de gentiane, n'a pas identifié un risque de cancer. Toutefois, le fabricant n'a fourni à Santé Canada aucune preuve pour étayer l'innocuité de ces instruments chez les femmes enceintes et les femmes allaitantes. Par mesure de précaution, Santé Canada a collaboré avec le fabricant pour renforcer l'information sur l'innocuité des instruments afin de mieux informer les utilisateurs.
Résumé de l'examen de l'innocuité
Mise à jour
Récapitulatif mensuel des renseignements sur l'innocuité des produits de santé
Voici une liste des avis concernant les produits de santé, des rappels de type I, ainsi que des résumés de l'examen de l'innocuité ou de la sûreté publiés en mai 2019 par Santé Canada.
Actemra (tocilizumab)
De graves lésions hépatiques d'origine médicamenteuse, ayant entraîné dans certains cas une insuffisance hépatique aiguë nécessitant une greffe, ont été signalées chez des patients traités par Actemra. Il est conseillé aux professionnels de la santé de ne pas recommander le traitement par Actemra chez les patients présentant une hépatopathie évolutive ou une insuffisance hépatique. De plus, il est conseillé aux professionnels de la santé de consulter la monographie de produit approuvée au Canada pour connaître les ajustements posologiques recommandés (réduction, interruption ou abandon du traitement) chez les patients présentant une hausse des enzymes hépatiques. Les patients devraient communiquer avec un professionnel de la santé s'ils éprouvent des signes de lésions hépatiques. Santé Canada travaille actuellement avec le fabricant afin d'inclure ces nouveaux renseignements sur l'innocuité dans la monographie canadienne du produit.
Communication des risques aux professionnels de la santé - Actemra (tocilizumab)
Ballonnets enrobés de paclitaxel et endoprothèses à élution de paclitaxel
Une méta-analyse publiée dans le Journal of the American Heart Association a relevé un risque accru possible de mortalité après l'utilisation de ballonnets enrobés de paclitaxel (BEP) et d'endoprothèses à élution de paclitaxel (EEP) pour le traitement de la maladie artérielle périphérique (MAP). Il est conseillé aux professionnels de la santé de poursuivre la surveillance des patients qui ont été traités pour une MAP à l'aide de BEP et d'EEP selon les normes de soins en vigueur, de déterminer si les avantages de l'utilisation de ces dispositifs l'emportent sur les risques, et de suivre les recommandations additionnelles fournies dans la communication. Santé Canada a également demandé aux fabricants de mettre à jour l'étiquetage des dispositifs contenant du paclitaxel pour y inclure des renseignements sur ce risque potentiel.
Dispositifs de perfusion de la pompe Alaris
Becton Dickinson (BD) a rappelé des lots additionnels des dispositifs de perfusion de la pompe Alaris en raison d'un défaut de fabrication qui peut causer une administration involontaire pouvant entraîner une perfusion excessive. La liste datant du 28 avril 2019 des produits touchés a été élargie afin d'inclure tous les codes de modèles et numéros de lots avec une date d'expiration entre 05/2019 et 08/2020. BD a également confirmé que les lots touchés ont été distribués au début d'août 2018 et non novembre 2018, comme indiqué précédemment.
Implants mammaires Biocell
L'examen de la sûreté de Santé Canada a évalué le risque de lymphome anaplasique à grandes cellules associé aux implants mammaires (LAGC-AIM). Cet examen de la sûreté a révélé qu'il y avait un risque accru de LAGC-AIM avec l'utilisation d'implants mammaires plus texturés (macro-texturés) comparativement aux implants moins texturés ou lisses. Les implants mammaires Biocell fabriqués par Allergan sont les seuls implants macro-texturés actuellement disponibles au Canada. Santé Canada a suspendu les homologations détenues par Allergan pour leurs implants mammaires texturés Biocell. Santé Canada travaillera avec tous les fabricants d'implants mammaires pour rendre plus rigoureuses les instructions d'utilisation de tous les implants concernant le risque de LAGC-AIM. Santé Canada a également communiqué cette information aux Canadiens.
Mise à jour - Implants mammaires Biocell
Résumé de l'examen de la sûreté - Implants mammaires Biocell
Produits de santé fabriqués par Konsar Future Nutrition Inc.
Tous les produits fabriqués par Konsar Future Nutrition Inc. peuvent présenter de graves risques pour la santé. Santé Canada a procédé à l'inspection du site de fabrication (situé à Dollard-des-Ormeaux, au Québec) et a constaté de graves problèmes d'insalubrité et de contrôle de la qualité. Par conséquent, Santé Canada a suspendu la licence d'exploitation de l'entreprise et l'ensemble de ses 101 licences de mise en marché.
Avis - Produits de santé fabriqués par Konsar Future Nutrition Inc.
Produits de santé de l'étranger
Les organismes de réglementation des États-Unis, de Singapour et de l'Australie ont découvert que ces produits de santé de l'étranger contiennent des ingrédients pharmaceutiques non déclarés qui peuvent poser de graves risques pour la santé. La vente de ces produits n'est pas autorisée au Canada, et ils ne se trouvent pas sur le marché canadien. Toutefois, il se peut que des Canadiens en aient acheté lors d'un voyage à l'étranger ou par Internet.
Alerte concernant des produits de l'étranger
Produits de santé non autorisés
Santé Canda a avisé les Canadiens que divers produits de santé non autorisés qui pourraient poser un risque grave pour la santé ont été vendus dans des points de vente au détail au Canada ou en ligne.
Avis - Plusieurs produits de santé non autorisés au Sunrise Lee Chinese Herbs Centre à Calgary, en Alberta
Avis - « Popper » non autorisé
Avis - Produits non autorisés (Partie 1)
Avis - Produits non autorisés (Partie 2)
Solution pour dialyse péritonéale Extraneal
Deux lots de la solution pour dialyse péritonéale Extraneal ont été rappelés à titre préventif en raison de concentrations élevées d'hydroxyde de sodium. L'utilisation du produit touché chez les patients pourrait causer la péritonite chimique. Le rappel a visé les lots qui ont été distribués par Baxter du 14 mars 2019 au 20 mars 2019. À la suite de la communication initiale, Baxter Corporation a publié une mise à jour qui avise ses clients que l'un des lots faisant objet d'un rappel (Extraneal 2L/2L Twinbag, code de produit JB9912, numéro de lot W9B28T0), pourrait potentiellement avoir été distribué le 21 mars 2019, en plus du 14 au 20 mars 2019.
Mise à jour - Solution pour dialyse péritonéale Extraneal
Système de photophérèse Cellex
Cet examen de la sûreté a évalué le risque de thromboembolie veineuse et d'embolie pulmonaire associées au système de photophérèse Cellex (CPS). Suite à l'examen de la sureté, Santé Canada a conclu que la majorité des événements thromboemboliques signalés étaient survenus après l'utilisation du CPS dans le traitement de la maladie du greffon contre l'hôte (GvHD), une affection pour laquelle le CPS n'est pas indiqué. Santé Canada a demandé au fabricant du CPS de mettre à jour le mode d'emploi afin d'y ajouter un avertissement indiquant que l'utilisation du CPS chez les patients atteints de la GvHD n'est pas autorisée au Canada.
Résumé de l'examen de la sûreté - Système de photophérèse Cellex
Thérapies cellulaires non autorisées
Santé Canada a avisé les Canadiens que certaines cliniques et certains professionnels de la santé offrent des thérapies cellulaires non autorisées, comme celles à base de cellules souches, dont les allégations santé ne sont pas fondées, en laissant entendre que ces traitements sont sans danger. Les traitements non autorisés (c'est-à-dire que leur innocuité et leur efficacité n'ont pas été prouvées) peuvent comporter des risques qui mettent la vie en danger ou altèrent la qualité de vie, comme des infections graves. Santé Canada a publié une déclaration de principe qui précise le régime d'emploi autorisé de ces produits.
Mise à jour - Thérapies cellulaires non autorisées
Nouveaux renseignements sur l'innocuité des produits de santé
Les sujets suivants ont été sélectionnés dans le but d'accroître la sensibilisation et, dans certains cas, encourager la déclaration d'effets indésirables similaires.
Résumé semestriel de l'innocuité des vaccins
Santé Canada et l'Agence de la santé publique du Canada (ASPC) partagent la responsabilité de la surveillance de l'innocuité des vaccins au Canada.
Les détenteurs d'une autorisation de mise en marché sont tenus de déclarer les effets secondaires suivant l'immunisation considérés graves au Programme Canada Vigilance de Santé Canada. Le Programme Canada Vigilance reçoit également des déclarations volontaires des professionnels de la santé et des consommateurs.
Les autorités de santé publique provinciales et territoriales déclarent les effets secondaires suivant l'immunisation (ESSI) provenant des programmes d'immunisation financés par l'État au Système canadien de surveillance des effets secondaires suivant l'immunisation (SCSESSI) de l'ASPC afin de surveiller l'innocuité des programmes d'immunisation.
Rapport pour la période du 1er juillet au 31 décembre 2018
Messages clés :
- Aucun nouveau signal d'innocuité (problème d'innocuité potentiel) n'a été identifié pendant cette période.
- Du 1er juillet 2018 au 31 décembre 2018, le Programme Canada Vigilance a reçu 592 déclarations Note de bas de page a d'effets secondaires suivant l'immunisation soupçonnés d'avoir été causés par des vaccins.
Le présent résumé semestriel de l'innocuité des vaccins fait un compte rendu des déclarations d'ESSI reçues par le Programme Canada Vigilance entre le 1er juillet et le 31 décembre 2018. Pour accéder aux rapports publiés par le SCSESSI, veuillez consulter le site Web du SCSESSI.
- Du 1er juillet 2018 au 31 décembre 2018, le Programme Canada Vigilance a reçu 592 déclarationsNote de bas de page a d'effets secondaires suivant l'immunisation soupçonnés d'avoir été causés par des vaccins.
- La plus grande proportion de déclarations provient de la déclaration spontanée (figure 1). La source des déclarations est présentée à la figure 2 (à noter : 4 déclarations avec type de déclarant inconnu n'ont pas été incluses dans le graphique).
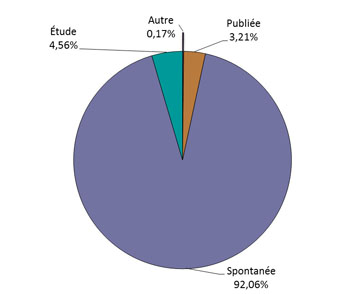
Figure 1 - Équivalent textuel
La figure montre le pourcentage de déclarations d'effets secondaires suivant l'immunisation reçues du 1er juillet 2018 au 31 décembre 2018, selon le type de déclaration.
| Type de déclaration | Pourcentage (%) |
|---|---|
| Autre | 0,17 |
| Publiée | 3,21 |
| Spontanée | 92,06 |
| Étude | 4,56 |
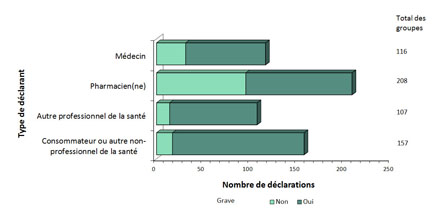
Figure 2 - Équivalent textuel
La figure montre le nombre total de déclarations d'effets secondaires suivant l'immunisation reçues du 1er juillet au 31 décembre 2018, selon le type de déclarant et la gravité.
| Type de déclarant | Nombre de déclarations non graves | Nombre de déclarations graves |
|---|---|---|
| Consommateur ou autre non-professionnel de la santé | 17 | 140 |
| Autre professionnel de la santé | 14 | 93 |
| Pharmacien(ne) | 95 | 113 |
| Médecin | 31 | 85 |
- La majorité des déclarations impliquait des femmes (figure 3) et le groupe d'âge le plus fréquent était les adultes âgés de 19 à 64 ans (figure 4).
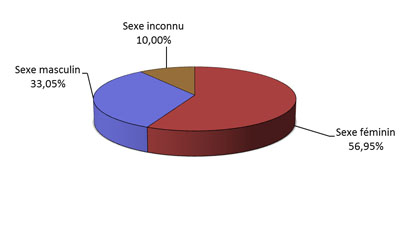
Figure 3 - Équivalent textuel
La figure montre le pourcentage de déclarations d'effets secondaires suivant l'immunisation reçues du 1er juillet au 31 décembre 2018, selon le sexe du patient.
| Sexe | Pourcentage (%) |
|---|---|
| Sexe féminin | 56,95 |
| Sexe masculin | 33,05 |
| Sexe Inconnu | 10,00 |
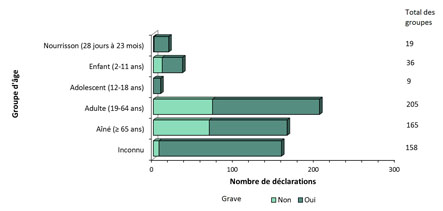
Figure 4 - Équivalent textuel
La figure montre le nombre total de déclarations d'effets secondaires suivant l'immunisation reçues du 1er juillet au 31 décembre 2018, selon la gravité et le groupe d'âge.
| Âge | Nombre de déclarations non graves | Nombre de déclarations graves |
|---|---|---|
| Adolescent (12-18 ans) | 0 | 9 |
| Adulte (19-64 ans) | 73 | 132 |
| Enfant (2-11 ans) | 11 | 25 |
| Aîné (≥ 65 ans) | 69 | 96 |
| Nourrisson (28 jours à 23 mois) | 1 | 18 |
| Inconnu | 7 | 151 |
- Il y avait 431 (73%) déclarations graves. La plupart impliquaient des patients avec des problèmes de santé sous-jacents et les effets secondaires graves n'étaient probablement pas liés à la vaccination.
- Le plus grand nombre de déclarations (graves et non graves) reçues impliquait le vaccin contre le zona (309 déclarations; 48%), suivi par les vaccins contre l'influenza (136 déclarations; 21%), et les vaccins antipneumococciques (62 déclarations; 10%).
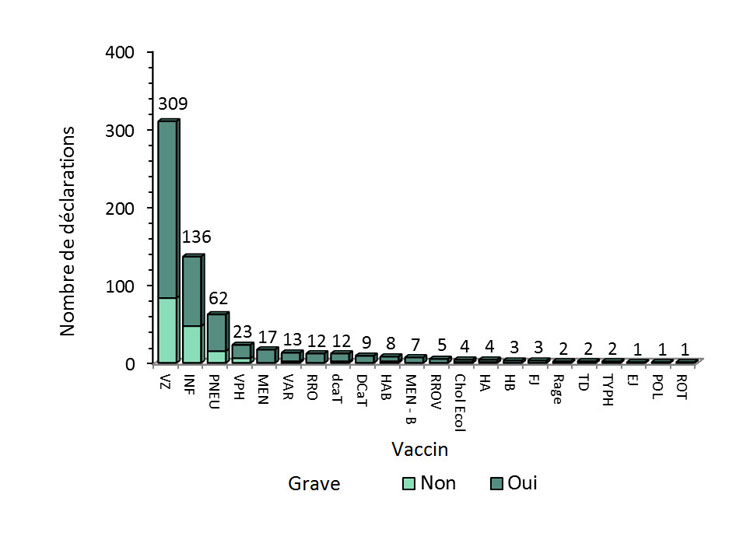
Figure 5 - Équivalent textuel
La figure montre le nombre total de déclarations d'effets secondaires suivant l'immunisation reçues du 1er juillet au 31 décembre 2018, selon la gravité et le type de vaccin.| Type de vaccin | Nombre de déclarations non graves | Nombre de déclarations graves | |
|---|---|---|---|
| Vaccin contre le choléra et la diarrhée du voyageur due à Escherichia Coli entérotoxinogène | Chol Ecol | 1 | 3 |
| Vaccin contenant les anatoxines diphtérique et tétanique et un vaccin anticoquelucheux acellulaire | DCaT | 0 | 9 |
| Vaccin contre l'hépatite A | HA | 1 | 3 |
| Vaccin contre l'hépatite A et l'hépatite B | HAB | 2 | 6 |
| Vaccin contre l'hépatite B | HB | 0 | 3 |
| Vaccin contre le virus du papillome humain | VPH | 6 | 17 |
| Vaccin contre le zona | VZ | 83 | 226 |
| Vaccin contre l'influenza | INF | 47 | 89 |
| Vaccin contre l'encéphalite japonaise | EJ | 1 | 0 |
| Vaccin contre le méningocoque de sérogroupe C, A, Y, W-135 | MEN | 0 | 17 |
| Vaccin multicomposant contre le méningocoque du sérogroupe B | MEN-B | 0 | 7 |
| Vaccin contre la rougeole, la rubéole et les oreillons | RRO | 0 | 12 |
| Vaccin contre la rougeole, la rubéole, les oreillons et la varicelle | RROV | 0 | 5 |
| Vaccin contre le pneumocoque | PNEU | 15 | 47 |
| Vaccin antipoliomyélitique | POL | 0 | 1 |
| Vaccin contre la rage | Rage | 1 | 1 |
| Vaccin contre le rotavirus | ROT | 0 | 1 |
| Vaccin contenant l'anatoxine tétanique et une dose réduite d'anatoxine diphtérique | TD | 1 | 1 |
| Vaccin contenant l'anatoxine tétanique, une dose réduite d'anatoxine diphtérique et un vaccin anticoquelucheux acellulaire | dcaT | 2 | 10 |
| Vaccins parentales et oraux contre la typhoïde | TYPH | 0 | 2 |
| Vaccin contre la varicelle | VAR | 2 | 11 |
| Vaccin contre la fièvre jaune | FJ | 0 | 3 |
- La majorité des déclarations concernant le vaccin contre le zona (309 déclarations) était pour Shingrix (290 déclarations). De ces 290 déclarations pour Shingrix, 84 étaient décrites comme des cas venant des médias sociaux ou digitaux récupérés par les détenteurs d'une autorisation de mise en marché (DAMM). Aucune déclaration venant des médias sociaux ou digitaux n'a pu être évaluée de façon convenable afin de déterminer s'il existe une association causale avec le vaccin en raison d'un manque d'information.
- Le décès a été signalé dans 10 déclarations. Cinq déclarations impliquaient des hommes, 3 des femmes et 2 étaient de sexe inconnu. L'âge n'a pas été fourni pour 5 déclarations. Pour les 5 autres déclarations, 3 impliquaient des personnes âgées, une impliquait un adulte et la dernière, un nourrisson. Les vaccins impliqués dans les déclarations étaient : Pediacel (1), Prevnar 13 (1), Zostavax (1), Gardasil 9 (1), vaccins contre l'influenza (2), Shingrix (2), et Gardasil (2). Les 2 déclarations concernant Gardasil provenaient possiblement d'un cas évalué en 2015 Note de bas de page b. L'information fournie dans ces déclarations n'était pas suffisante pour évaluer convenablement l'association causale avec le vaccin.
- Les effets secondaires (graves et non graves) signalés les plus fréquemment incluaient l'échec de la vaccination, le zona, la fièvre, la fatigue et la douleur. Ces effets secondaires ont été surtout déclarés pour Shingrix. Les effets secondaires liés à l'échec de la vaccination et au zona proviennent des médias sociaux ou digitaux extraits par les DAMM. Aucune déclaration venant des médias sociaux ou digitaux n'a pu être évaluée de façon convenable afin de déterminer s'il existe une association causale avec le vaccin, en raison du manque d'au moins 2 des renseignements suivants : les doses reçues (première ou deuxième dose, ou les deux); le délai d'apparition; les conditions préexistantes et concomitantes avant l'administration du vaccin; les antécédents médicaux; les traitements concomitants; le traitement correctif et la confirmation médicale/ tests/résultats médicaux.
- Aucun nouveau signal d'innocuité (problème d'innocuité potentiel) n'a été identifié pendant cette période.
- Les avantages des vaccins autorisés au Canada continuent de l'emporter sur les risques.
- Santé Canada, en collaboration avec l'Agence de la santé publique du Canada (ASPC), continuera de surveiller étroitement l'innocuité des vaccins autorisés au Canada.
Pour obtenir de plus amples renseignements, veuillez communiquer avec la Direction des produits de santé commercialisés.
Notez qu'en raison d'une mise à jour de l'information reçue par le Programme Canada Vigilance, il peut y avoir des différences dans le nombre de déclarations et les effets secondaires extraits à des dates différentes.
Mises à jour de monographies de produit
Les mises à jour suivantes concernant l'innocuité, qui ont récemment été apportées aux monographies de produit canadiennes, ont été sélectionnées afin d'en accroître la sensibilisation. Une liste complète des mises à jour de l'étiquetage se trouve sur la page L'innocuité des monographies de produits pour les médicaments innovateurs de Santé Canada. Les monographies de produit canadiennes sont disponibles dans la Base de données sur les produits pharmaceutiques de Santé Canada.
pms-Methotrexate (méthotrexate)
Les renseignements suivants ont été inclus dans les sections Contre-indications, Mises en garde et précautions et Renseignements destinés aux patients de la monographie de produit canadienne pour pms-Methotrexate. Santé Canada travaille actuellement avec les fabricants afin d'harmoniser et de mettre à jour les monographies de produit canadiennes pour les autres produits contenant du méthotrexate sur le marché canadien.
Messages clés pour les professionnels de la santé1 :
- Le méthotrexate est contre-indiqué chez les patients atteints d'insuffisance rénale sévère, y compris une maladie rénale en phase terminale avec ou sans dialyse.
- L'hémorragie alvéolaire pulmonaire a été signalée suite à l'utilisation du méthotrexate. Cet évènement peut également être associé à une vascularite et à d'autres comorbidités. Des investigations rapides doivent être envisagées lorsqu'une hémorragie alvéolaire pulmonaire est soupçonnée.
Référence
- Références 1
-
pms-Methotrexate (méthotrexate) [monographie de produit]. Montréal (Qc) : Pharmascience Inc.; 2019.
Portée
Cette publication mensuelle s'adresse principalement aux professionnels de la santé et contient des informations sur les produits pharmaceutiques, biologiques, les matériels médicaux et les produits de santé naturels. Elle fournit un résumé des informations clés concernant l'innocuité des produits de santé qui ont été publiés au cours du mois précédent par Santé Canada, ainsi qu'une sélection de nouveaux renseignements en matière d'innocuité sur les produits de santé, pour en accroître la sensibilisation. Les nouvelles informations contenues dans ce numéro ne sont pas exhaustives, mais représentent plutôt une sélection de problèmes d'innocuité cliniquement pertinents, justifiant une dissémination améliorée.
Pour signaler des effets indésirables
Téléphone : 1-866-234-2345
Télécopieur ou courrier : formulaire disponible sur MedEffet Canada
Des renseignements sur la marche à suivre pour déclarer un effet indésirable à Santé Canada sont publiés à la page Déclaration des effets indésirables ou des incidents liés aux matériels médicaux.
Liens utiles
- MedEffetMC Canada
- Base de données sur les rappels et les avis de sécurité
- Nouveaux examens de l'innocuité ou de la sûreté
- Base de données en ligne des effets indésirables de Canada Vigilance
- Base de données sur les produits pharmaceutiques
- Liste des instruments médicaux homologués
- Base de données des produits de santé naturels homologués
- Registre des médicaments et des produits de santé
- Pénuries de médicaments Canada
- Tendances annuelles dans les déclarations de cas d'effets indésirables et des incidents liés aux matériels médicaux
Des suggestions?
Vos commentaires sont importants pour nous. Dites-nous ce que vous pensez en nous contactant à HC.infowatch-infovigilance.SC@canada.ca
Santé Canada
Direction des produits de santé commercialisés
Localisateur 1906C
Ottawa (Ontario) K1A 0K9
Téléphone : 613-954-6522
Télécopieur : 613-952-7738
Droit d'auteur
©2019 Sa Majesté la Reine du Chef du Canada. Cette publication peut être reproduite sans autorisation à condition d'en indiquer la source en entier. Il est interdit de l'utiliser à des fins publicitaires. Santé Canada n'accepte pas la responsabilité de l'exactitude ou de l'authenticité des renseignements fournis dans les notifications.
On ne peut que soupçonner la plupart des effets indésirables (EI) des produits de santé à l'égard desquels on ne peut établir de lien prouvé de cause à effet. Les notifications spontanées d'EI ne peuvent servir pour déterminer l'incidence des EI, étant donné que les EI ne sont pas suffisamment signalés et l'étendue d'exposition des patients est inconnue.
En raison des contraintes de temps concernant la production de cette publication, les informations publiées peuvent ne pas refléter les informations les plus récentes.
Notes de bas de page
- Note de bas de page 1
-
Glossaire des champs de la base de données en ligne des effets indésirables de Canada Vigilance
- Note de bas de page 2
-
Résumé de l'examen de l'innocuité pour Gardasil en 2015 est disponible au lien suivant : https://www.canada.ca/fr/sante-canada/services/medicaments-produits-sante/medeffet-canada/examens-innocuite/resume-examen-innocuite-gardasil-vaccin-quadrivalent-contre-virus-papillome-humain-types-6-11-16-18.html