Données sur les effets indésirables du cannabis : Rapport annuel de 2020
Télécharger en format PDF
(796.4 Ko, 29 pages)
Organisation : Santé Canada
Date publiée : Decembre 2022
Cat. : H131-1E-PDF
ISBN : 2817-0555
Pub. : 220663
Effets indésirables associés au cannabis signalés à Santé Canada entre le 1er janvier 2020 et le 31 décembre 2020.
Contenu
- Points forts
- 1.0 Introduction
- 2.0 Cas d'effets indésirables associés au cannabis
- 2.1 Rapports d'effets indésirables associés au cannabis en tant que substance
- 2.2 Cas d'effets indésirables associés à des produits de cannabis légaux à des fins médicales ou non médicales
- 2.3 Données démographiques
- 2.4 Produits de cannabis suspects
- L'analyse comparative fondée sur le sexe et le genre plus (ACSG plus) des données d’effets indésirables de 2020
- 3.0 Évaluation clinique des cas graves et importants sur le plan médical
- 4.0 Avis aux lecteurs
- 5.0 Signaler un effet indésirable impliquant un produit de cannabis
- 6.0 Nous joindre
Points forts
- Il s'agit du deuxième rapport annuel concernant les rapports d'effets indésirables associés au cannabis qui ont été soumis à la base de données Canada Vigilance et analysés par la Direction générale des substances contrôlées et du cannabis de Santé Canada.
- Le présent rapport a pour but de présenter un survol des données sur les rapports d'effets indésirables recueillies par Santé Canada au cours de la deuxième année depuis l'entrée en vigueur de la Loi sur le cannabis et à ses règlements, couvrant la période de déclaration du 1er janvier 2020 au 31 décembre 2020, et des comparaisons à la première année de légalisation (du 17 octobre 2018 au 31 décembre 2019).
- Entre le 1er janvier 2020 et le 31 décembre 2020, 287 rapports d'effets indésirables associés au cannabis en tant que substance (y compris les cas de polyconsommation de substances) ont été signalés à la base de données de Canada Vigilance de Santé Canada.
- Sur les 159 cas d'effets indésirables associés aux produits légaux du cannabis en 2020, 121 ont été signalés à Santé Canada comme étant graves et la raison la plus fréquemment invoquée était « autre » (affection importante sur le plan médical).
- La majorité des cas de 2020 concernant des produits légaux du cannabis provenaient de consommateurs (88 %) et ont été soumis à Santé Canada par des titulaires de licence pour le cannabis (86 %); 11 % ont été signalés à Santé Canada par des professionnels de la santé.
- En 2020, les cas concernant des produits légaux du cannabis impliquaient souvent des adultes âgés de 65 à 74 ans (22 %) et des femmes (57 %).
- En 2020, la plupart des cas impliquaient des produits légaux du cannabis utilisés à des fins médicales (77 %) et la classe de produit la plus souvent impliquée était les extraits liquides ingérables (75 %) (c'est-à-dire des huiles et des gélules ingérables).
- En 2020, les événements médicaux les plus fréquemment signalés dans l'ensemble des cas concernant des produits légaux du cannabis ont été les suivants : hallucination (n = 52), étourdissements (n = 13), nausées (n = 12), humeur euphorique (n = 10), sensations anormales (n = 10) et insomnies (n = 10).
- Certains événements médicaux ont été plus fréquemment signalés avec des produits légaux du cannabis à prédominance de THC ou à concentration supérieure de THC, tandis que d'autres sont plus fréquemment signalés avec des produits légaux du cannabis à prédominance de CBD ou à concentration supérieure de CBD.
- Entre la première et deuxième année de la légalisation, certains résultats sont différents alors que d'autres sont restés constants. Toutefois, à l'heure actuelle, toutes conclusions tirées de ces résultats sont préliminaires et d'autres années de données sont nécessaires pour effectuer une analyse adéquate des tendances et pour évaluer tout changement à long terme dans les résultats.
- En 2020, un cas suspect de maladie pulmonaire associée au vapotage (MPAV) qui impliquait des produits légaux de cannabis a été signalé et deux cas suspects qui impliquaient du cannabis non défini ont été signalés. Cependant, aucun de ces cas n'est considéré comme un cas de MPAV confirmé ou probable selon la définition de cas établie par l'Agence de la santé publique du Canada (ASPC).
- Santé Canada continuera de surveiller, d'évaluer et de signaler les effets indésirables associés au cannabis et les résultats seront utilisés pour fournir des renseignements fondés sur des données probantes concernant les risques pour la santé et la sécurité associés au cannabis, y compris des communications sur les risques et des ressources éducatives.
1.0 Introduction
Ce rapport décrit les résultats des rapports de cas nationaux d'effets indésirables associés au cannabis soumis à la base de données Canada Vigilance de Santé Canada et analysés par le Bureau de la science et de la surveillance du cannabis de la Direction générale des substances contrôlées et du cannabis (DGSCC). Ces travaux s'inscrivent dans le Cadre de vigilance du cannabis mis en place depuis l'entrée en vigueur de la Loi sur le cannabis et du Règlement sur le cannabis (17 octobre 2018).
Ce deuxième rapport annuel présente un résumé de toutes les déclarations de cas nationaux d'effets indésirables signalés à Santé Canada entre le 1er janvier 2020 et le 31 décembre 2020 et qui sont soupçonnés d'être associés à un produit du cannabis destiné à la consommation humaine tel que défini par la Loi sur le cannabis et à ses règlements :
Produit du cannabis : Désigne le cannabis d'une seule des catégories visées à l'annexe 4 de la Loi – ou de tout accessoire contenant de ce cannabis, une fois emballé et étiqueté pour la vente au détail aux consommateurs. Ce terme ne comprend pas :
- le cannabis destiné à un animal,
- un accessoire de cannabis qui contient du cannabis destiné à un animal,
- les produits de santé contenant du cannabis ou à utiliser avec du cannabis.
Comme l'énonce l'article 248 du Règlement sur le cannabis, les titulaires de licence qui vendent ou distribuent des produits du cannabis doivent fournir à Santé Canada, dans les quinze jours suivant la date à laquelle ils ont pris connaissance d'un effet indésirable grave au produit de cannabis, un rapport détaillé faisant état des données qu'ils ont en leur possession concernant l'utilisation du produit de cannabis par l'individu touché. En vertu du Règlement,
- un effet indésirable est défini comme « une réaction nocive et non voulue à un produit du cannabis »
- un effet indésirable grave est défini comme étant une « réaction nocive et non voulue à un produit de cannabis qui nécessite ou prolonge une hospitalisation, entraîne une malformation congénitale, une invalidité ou une incapacité persistante ou importante, met la vie en danger ou entraîne la mort »
Les consommateurs, les patients, les professionnels de la santé, les cliniques de cannabis médical et les autres déclarants, comme les détaillants autorisés par les provinces et les territoires, soumettent volontairement les rapports d'effets indésirables impliquant des produits de cannabis à Santé Canada. Des rapports d'effets indésirables peuvent également être reçus par les détenteurs d'une autorisation de mise sur le marché de produits de santé autorisés qui déclarent des effets indésirables associés à d'autres produits de santé suspects (comme des médicaments sur ordonnance ou en vente libre, ou des produits de santé naturels) dans lesquels le cannabis est également suspecté. Les effets indésirables du cannabis peuvent concerner le cannabis : (i) un produit du cannabis transformé par un titulaire de licence fédérale, (ii) cultivé à domicileNote de bas de page 1, (iii) non défini (cannabis en tant que substance sans précision), ou (iv) de source illégale.
Aux fins du présent rapport, les déclarations de cas impliquant un produit de cannabis légal (c'est-à-dire identifiable par la marque du produit et/ou le titulaire de licence) sont classées en fonction de l'utilisation prévue des produits de cannabis, comme décrit dans le rapport de cas :
- Utilisation de cannabis à des fins médicales : Comprend des rapports de cas dans lesquels il est indiqué que le consommateur détient un document d'autorisation médicale; ou des rapports de cas dans lesquels un but médical ou thérapeutique est déclaré pour la consommation du cannabis, sans la mention d'un document d'autorisation médicale. Cette définition correspond à la définition de l'utilisation médicale qui figure dans l'Enquête canadienne sur le cannabis. Cette définition a une portée plus large que la définition réglementaire de l'utilisation du cannabis à des fins médicales dans le Règlement sur le cannabis, c'est-à-dire un document médical rempli par un professionnel de la santé (médecin, infirmière praticienne) et autorisant l'utilisation du cannabis à des fins médicales.
- Utilisation de cannabis à des fins non médicales : Si le rapport de cas ne mentionne aucune raison d'utilisation ou d'indication thérapeutique, ne fournit que des détails minimaux ou n'indique qu'une utilisation prévue à des fins non médicales, le rapport de cas est classé dans la catégorie « cannabis utilisé à des fins non médicales ».
Les rapports de cas sur les effets indésirables sont recueillis et conservés dans la base de données de Canada Vigilance. La majorité des rapports d'effets indésirables sont signalés spontanément à Santé Canada (type de rapport =spontané) par des consommateurs, des patients, des professionnels de la santé ou des titulaires de licence (appelés « détenteurs d'une autorisation de mise sur le marché » dans la base de données Canada Vigilance). Toutefois, ils peuvent également provenir d'études (type de rapport=étude), notamment d'études observationnelles dans le monde réel, d'études humaines portant sur le cannabis qui ne répondent pas à la définition d'un essai clinique, ou d'autres systèmes organisés de collecte de données (par exemple, des enquêtes auprès de patients ou de prestataires de soins de santé).
Conformément au Cadre de vigilance du cannabis, Santé Canada mène des activités de surveillance, de détection et d'évaluation en temps réel et des activités connexes pour les cas d'effets indésirables impliquant des produits du cannabis. Santé Canada surveille également les cas impliquant le cannabis en tant que substance pour des questions plus larges d'importance pour la santé publique, comme les MPAV, les cas impliquant des populations pédiatriques et d'autres problèmes d'innocuité émergents potentiels.
Le présent rapport a pour but de fournir un bref résumé des rapports d'effets indésirables impliquant le cannabis, ainsi qu'une analyse descriptive des types d'effets indésirables concernant les produits de cannabis en vertu de la Loi sur le cannabis et du Règlement sur le cannabis, soumis à Santé Canada entre le 1er janvier 2020 et le 31 décembre 2020. Cette période de déclaration reflète la deuxième année complète de légalisation et la première année après la mise en œuvre des modifications apportées au Règlement sur le cannabis. Au cours de cette période, de nouvelles catégories de produits de cannabis (c.-à-d. les extraits de cannabis [autres que les huiles de cannabis ingérables], le cannabis comestible et le cannabis pour usage topique) qui n'étaient pas légalement disponibles sur le marché Canadien durant la période de déclaration précédente sont devenues disponibles pour la vente légale aux Canadiens.
Outre l'analyse descriptive des cas de la période de déclaration de 2020 et des comparaisons avec le rapport de la période de déclaration précédente (du 17 octobre 2018 au 31 décembre 2019) ont été effectuées, le cas échéant. Ces comparaisons sont largement descriptives et l'importance des différences n'a pas été mise à l'essai dans la plupart des cas en raison de la nature limitée des données depuis la légalisation à ce jour. Il convient donc de faire preuve de prudence dans l'interprétation de ces changements des résultats au cours des deux périodes de déclaration.
Il est à noter que ce rapport ne couvre pas les données sur les effets indésirables associés aux produits de santé, y compris les médicaments contenant du cannabis, qui sont régis par la Loi sur les aliments et drogues et son Règlement. Un résumé des effets indésirables associés à d'autres produits de santé reçus par Canada Vigilance en 2020 est décrit dans le bulletin InfoVigilance de Santé Canada : Effets indésirables des produits de santé - rapport annuel 2020
1.1 Considérations
Certaines mises en garde doivent être prises en compte lors de l'interprétation des données sur les effets indésirables figurant dans ce rapport :
- Les effets indésirables sont généralement déclarés spontanément à Santé Canada et ne peuvent être utilisés pour déterminer l'incidence ou la prévalence des effets indésirables du cannabis dans la population générale.
- Les effets indésirables graves sont davantage représentés dans cet ensemble de données car les titulaires de licence sont obligés de les déclarer à Santé Canada en vertu du Règlement sur le cannabis. Le signalement des effets indésirables non graves par les titulaires de licence à Santé Canada sous forme de rapports de cas individuels est volontaireNote de bas de page 2; par conséquent, ces cas sont probablement sous-déclarés et sous-représentés dans cet ensemble de données.
- Les déclarations des effets indésirables, qu'ils soient graves ou non graves, associés aux produits du cannabis par les déclarants volontaires, tels que les consommateurs, les professionnels de la santé, les hôpitaux, les cliniques de cannabis médical et les détaillants, sont probablement sous-déclarées.
- Les personnes qui subissent des effets indésirables graves ou qui utilisent des produits à base de cannabis à des fins médicales peuvent être plus motivées à les signaler ou à consulter un médecin.
- Plusieurs facteurs peuvent influencer le nombre de cas déclarés à Santé Canada, notamment : les antécédents médicaux du consommateur/patient, la raison de la consommation de cannabis, la durée de commercialisation d'un produit, la couverture médiatique, la connaissance de la possibilité de signaler les cas et la méthode de signalement (systèmes de déclaration spontanés ou systèmes de collecte de données organisés).
- Ce rapport comprend de l'information sur le cannabis à des fins médicales et non médicales, toutefois, le nombre de cas pourrait ne pas correspondre directement à ce qui est présenté dans le présent rapport sommaire annuel en raison des différentes dates d'extraction de la base de données de Canada Vigilance.
2.0 Cas d'effets indésirables associés au cannabis
2.1 Rapports d'effets indésirables associés au cannabis en tant que substance
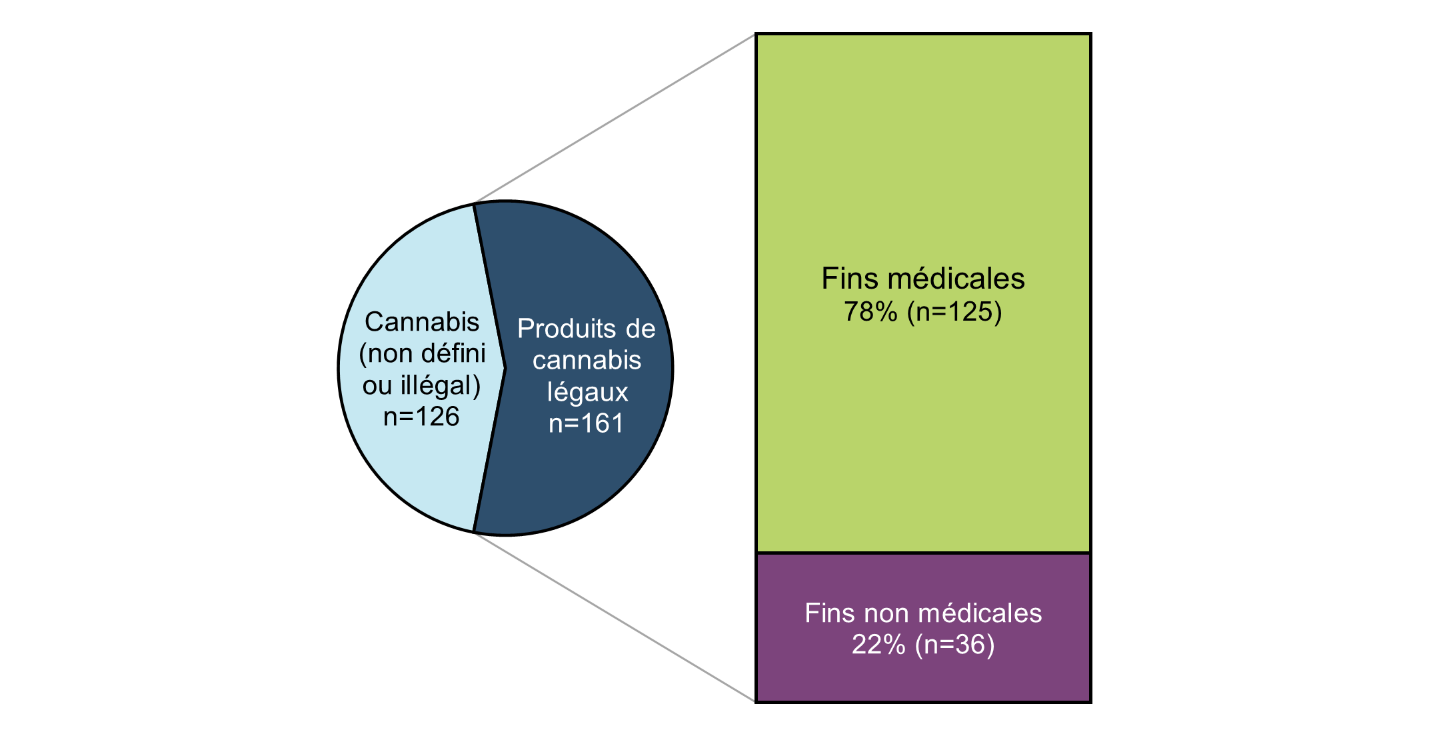
Figure 1 - Équivalent textuel
| Nombre total de rapports | Proportion (en %) de tous les rapports | |
|---|---|---|
| Cannabis non défini ou illégal | 126 | 44 |
| Produit de cannabis légal - Fins médicales | 125 | 44 |
| Produit de cannabis légal - Fins non médicales | 36 | 13 |
| Total général | 287 | 100 |
Mises en garde :
- Les rapports d'effets indésirables sont classés au sein de Canada Vigilance en fonction de s'ils impliquent l'utilisation de produits de cannabis légaux utilisés à des fins médicales ou non médicales (une classification par cas); les cas qui n'impliquent pas de produits de cannabis provenant de sources légales n'ont pas de classification attribuée et restent classés en tant que substance seulement (cannabis non défini ou illégal).
- Ce chiffre représente toutes les déclarations soumises à la base de données Canada Vigilance, y compris les déclarations en double lorsque les détails du cas sont les mêmes, mais que les déclarants diffèrent (n = 17).
Un total de 287 déclarations associées au cannabis comme substance suspecte ont été déclarées à Santé Canada entre le 1er janvier 2020 et le 31 décembre 2020. Plus de la moitié de ces déclarations concernaient des produits de cannabis légaux (56 %, n = 161), dont la plupart ont été déclarés comme étant utilisés à des fins médicales (78 %, n = 125). Parmi les cas impliquant du cannabis illégal ou non défini (n=126) (par exemple, les rapports qui impliquent le « cannabis » ou la « marijuana » sans détail précis), 27 % (n = 34) impliquaient d'autres substances également suspectées (c'est-à-dire l'utilisation de plusieurs substances) ou des produits de santé.
Trois cas suspects de MPAV impliquant du cannabis ont été signalés à la base de données Canada Vigilance en 2020. Il était suspecté que l'un de ces cas impliquait plusieurs produits de cannabis légaux, tandis que les deux autres cas étaient suspectés d'impliquer du cannabis non défini ou illégal. Cependant, aucun de ces rapports ne correspondait à la définition d'un cas confirmé ou probable de MPAV, tel que défini par l'Agence de santé publique du Canada (ASPC). Une analyse épidémiologique complète de tous les cas confirmés et probables de MPAV signalés à l'ASPC entre septembre 2019 et décembre 2020 est maintenant disponible. Vous trouverez de plus amples informations sur les MPAV au Canada sur la page Web Maladie pulmonaire associée au vapotage de l'ASPC.
De plus, Santé Canada est au courant de plusieurs cas d'ingestion accidentelle de cannabis survenus dans la population pédiatrique. Ces cas comprennent souvent du cannabis non défini ou illégal et proviennent de plusieurs systèmes de surveillance canadiens, dont le Système canadien de surveillance des données sur les intoxications et l'étude du Programme canadien de surveillance pédiatrique sur la consommation de cannabis à des fins non médicales (récréatives) chez les enfants et les adolescents. En août 2020, Santé Canada a publié un Avis public sur l'ingestion accidentelle de produits comestibles du cannabis par des enfants. Une mise à jour de l'Avis public a été publiée le 8 avril 2022.
Au moment de l'extraction des données, 44 cas pédiatriques d'effets indésirables impliquant du cannabis illégal ou non défini ont été signalés à la base de données Canada Vigilance en 2020. Aucun des cas pédiatriques d'ingestion accidentelle dans cet ensemble de données n'a été confirmé comme ayant impliqué des produits de cannabis légaux.
Les rapports de cas impliquant des produits de cannabis à des fins médicales et non médicales autodéclarées provenant du marché légal forment la base des autres parties du présent rapport annuel.
2.2 Cas d'effets indésirables associés à des produits de cannabis légaux à des fins médicales ou non médicales
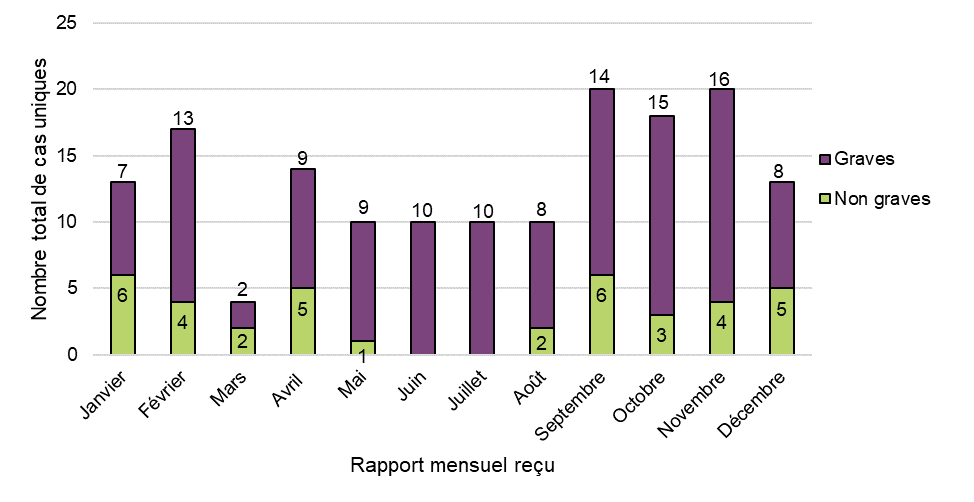
Figure 2 - Équivalent textuel
| Mois de réception du rapport | Nombre total de cas par gravité | ||
|---|---|---|---|
| Non grave | Grave | Total général | |
| Janvier | 6 | 7 | 13 |
| Février | 4 | 13 | 17 |
| Mars | 2 | 2 | 4 |
| Avril | 5 | 9 | 14 |
| Mai | 1 | 9 | 10 |
| Juin | 0 | 10 | 10 |
| Juillet | 0 | 10 | 10 |
| Août | 2 | 8 | 10 |
| Septembre | 6 | 14 | 20 |
| Octobre | 3 | 15 | 18 |
| Novembre | 4 | 16 | 20 |
| Décembre | 5 | 8 | 13 |
| Total général | 38 | 121 | 159 |
Mises en garde :
- Les cas sont présentés selon la date initiale de réception par la base de données Canada Vigilance. La date réelle de l'effet indésirable peut ne pas correspondre au mois où le cas a été reçu (délai entre l'événement et la déclaration).
- La gravité est fondée sur la déclaration initiale et peut être modifiée si des renseignements supplémentaires sont soumis à Santé Canada.
Aucune tendance temporelle n'a été observée dans le nombre total de cas d'effets indésirables impliquant des produits de cannabis légaux signalés à Santé Canada en 2020, y compris le nombre de cas graves et de cas non graves sur une base cumulative ou d'un mois à l'autre. Le nombre moyen de cas par mois au cours de la période de référence était d'environ 13, allant de 4 à 20 cas par mois.
Certaines tendances descriptives ont été observées entre les périodes de signalement. Par rapport à la période de référence précédente (d'octobre 2018 à décembre 2019), le nombre total de cas dans l'ensemble et, par la suite, le nombre moyen de cas par mois ont augmenté en 2020 (nombre total de cas : de 151 à 159; nombre moyen de cas par mois : de 10 à 13) bien que la période de référence précédente ait couvert une période de référence plus longue (14,5 mois contre 12 mois). De plus, le nombre total de cas graves signalés à Santé Canada a augmenté de 57 % entre les périodes de déclaration, passant de 77 cas en 2018-2019 à 121 cas en 2020. En revanche, le nombre total de signalements d'effets indésirables non graves a diminué de 49 %, passant de 74 en 2018-2019 à 38 en 2020.
Comme indiqué ci-dessous, l'augmentation du nombre de cas graves pourrait s'expliquer par une augmentation du nombre de cas importants sur le plan médical. Les titulaires de licence peuvent soumettre des cas importants sur le plan médical en tant que déclarations sérieuses (« autre affection importante »), comme l'encourage le Guide sur la déclaration des effets indésirables du cannabis de Santé Canada et conformément aux lignes directrices de l'International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (ICH) pour la déclaration accélérée (E2A), dont Santé Canada est membre.
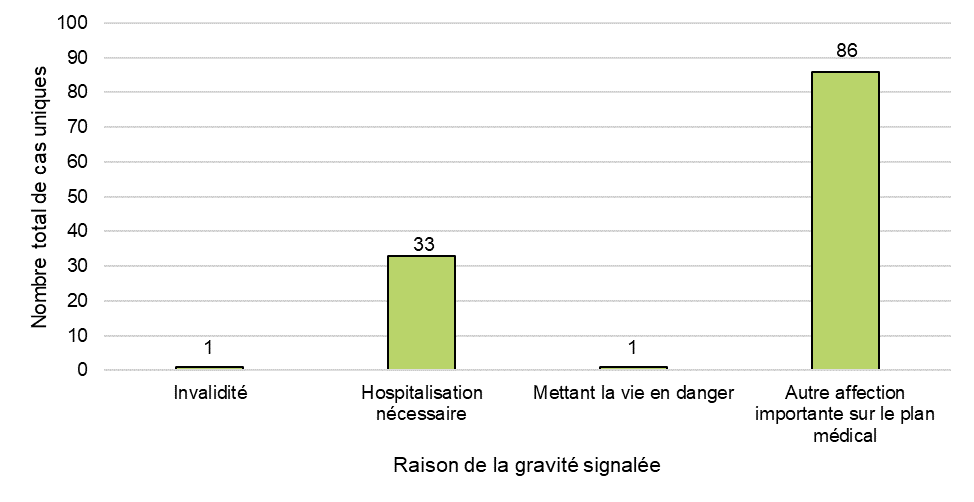
Figure 3 - Équivalent textuel
| Raison de la gravité signalée | Nombre total de cas uniques |
|---|---|
| Invalidité | 1 |
| Hospitalisation nécessaire | 33 |
| Mettant la vie en danger | 1 |
| Autre affection importante | 86 |
| Total général | 121 |
Mises en garde :
- Chaque cas grave peut avoir plus d'une raison de gravité puisque le déclarant peut en choisir plusieurs.
Un total de 121 cas graves ont été signalés à Santé Canada en 2020, avec un total de 121 réponses pour la gravité sélectionnées par les déclarants (figure 3). La raison de la gravité la plus fréquemment citée parmi les cas de 2020 était « autre affection importante » (71 %, n = 86). « Autre affection importante » comprend les événements qui ne mettent pas immédiatement la vie en danger ou n'entraînent pas le décès ou l'hospitalisation, mais qui peuvent mettre le patient en danger ou nécessiter une intervention (par exemple, des services ambulatoires, des visites aux urgences, des visites ambulatoires avec un professionnel de la santé ou des interventions médicales à domicile) pour prévenir un résultat grave. En revanche, 35 % (n = 27) des cas ont été déclarés comme « autre affection importante » au cours de la période de déclaration précédente. Le motif de gravité le plus souvent signalé au cours de la période de déclaration précédente était « hospitalisation nécessaire » (55 %, n = 43), qui représentait 27 % (n = 33) des cas graves en 2020.
Comme pour la période de signalement précédente, aucun décès n'a été signalé en 2020 parmi les cas impliquant des produits légaux du cannabis utilisés à des fins médicales ou non médicales. Un cas a été signalé comme « mettant la vie en danger » (une diminution par rapport aux sept cas de la période précédente) et un cas a été déclaré comme « invalidant » (comme l'année précédente).
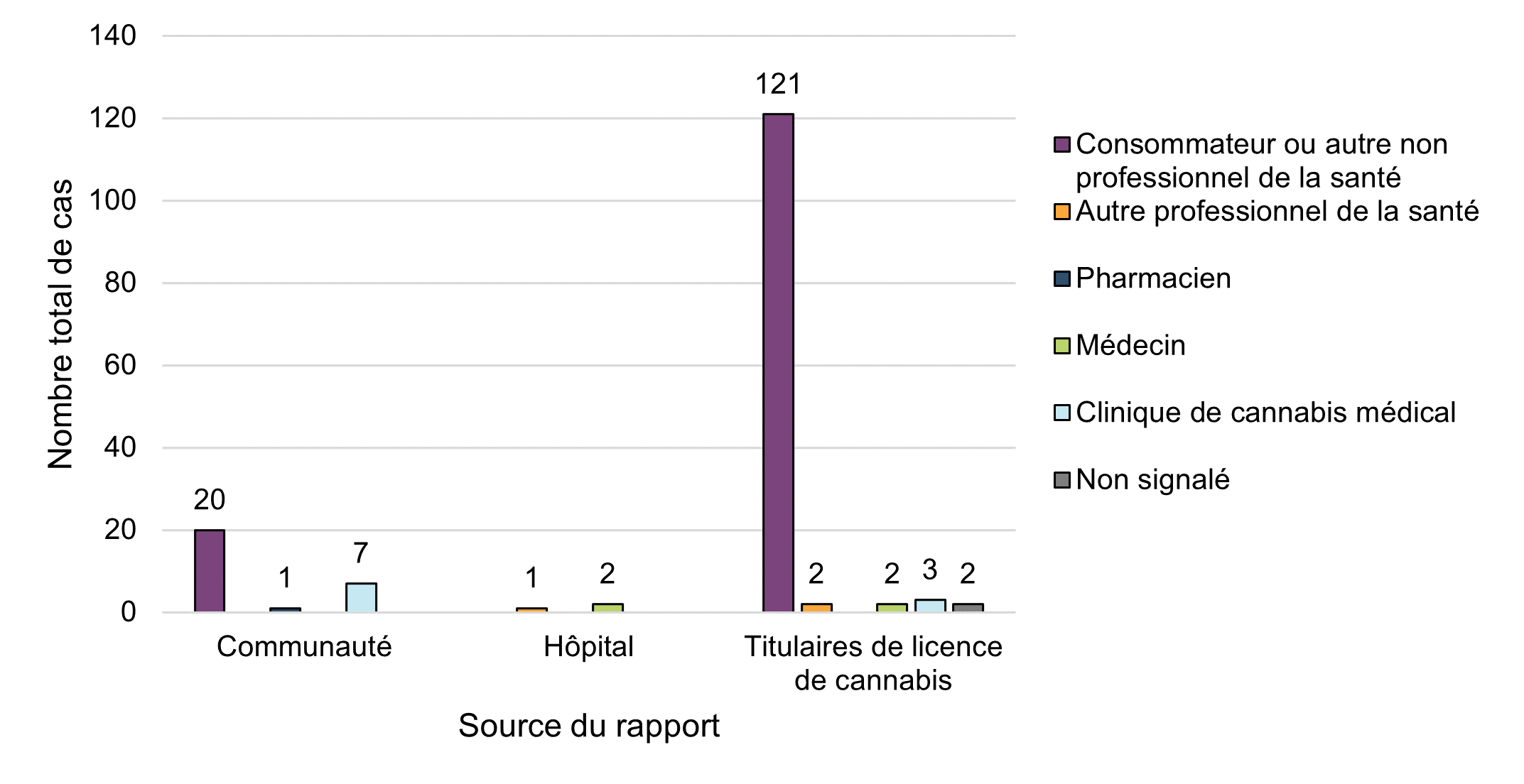
Figure 4 - Équivalent textuel
| Source du rapport | Type de déclarant initial | ||||||
|---|---|---|---|---|---|---|---|
| Consommateur ou autre non professionnel de la santé | Autre professionnel de la santé | Pharmacien | Médecin | Clinique de cannabis médical | Non signalé | Total général | |
| Communauté | 20 | 0 | 1 | 0 | 7 | 0 | 28 |
| Hôpital | 0 | 1 | 0 | 2 | 0 | 0 | 3 |
| Titulaires de licence de cannabis | 121 | 2 | 0 | 2 | 3 | 2 | 130 |
| Total général | 141 | 3 | 1 | 4 | 10 | 2 | 161 |
Mises en garde :
- Ce chiffre comprend les rapports de double où les détails du cas sont les mêmes, mais les déclarants diffèrent (n = 2).
- La source de la déclaration indique l'endroit d'où le rapport a été soumis à Santé Canada (communauté, hôpital ou titulaire de licence de cannabis [soit, « détenteur d'une autorisation de mise sur le marché » dans la base de données de Canada Vigilance]).
- Dans cette figure, chaque source de déclaration a été subdivisée en fonction du type de déclarant initial (consommateur, professionnels de la santé [médecins, pharmaciens ou autres], cliniques de cannabis médical).
- Les signalements des professionnels de la santé sont considérés comme « médicalement confirmés » conformément aux directives internationalesNote de bas de page 3; ils sont donc différents des signalements des consommateurs.
- Les rapports des cliniques de cannabis médical sont considérés comme « médicalement confirmés » car ils relèvent d'une pratique médicale et d'une surveillance médicale par les cliniques où les patients utilisent du cannabis à des fins médicales.
La majorité des déclarations d'effets indésirables impliquant des produits légaux du cannabis utilisés à des fins médicales ou non médicales ont été soumises à Santé Canada par des détenteurs d'une autorisation de mise sur le marché (titulaires de licence) (81 %, n = 130), suivies par des déclarants volontaires de la communauté (17 %, n = 28).
La plupart des déclarations d'effets indésirables qui ont été soumises à Santé Canada par des titulaires de licence et d'autres personnes de la communauté provenaient de deux principaux types de déclarations initiales : consommateurs (88 %, n = 141), tandis que 11 % (n = 18) ont été signalés par des professionnels de la santé, la majorité provenant de cliniques de cannabis médical (n = 10). Ces tendances descriptives en matière de déclaration sont conformes aux observations de la période de déclaration précédente, à savoir que les consommateurs semblent plus portés à déclarer les effets indésirables directement aux détenteurs d'une autorisation de mise sur le marché qui les soumettent ensuite à Santé Canada conformément à leurs obligations en matière de déclaration. Les professionnels de la santé ont tendance à signaler des effets indésirables au nom de leurs patients directement à Santé Canada. Le nombre de rapports d'effets indésirables identifiant des produits de cannabis légaux provenant des hôpitaux est resté limité en 2020 (2 %, n=3).
En vertu de la Loi visant à protéger les Canadiens contre les drogues dangereuses, à compter du 16 décembre 2019, les hôpitaux sont tenus de signaler à Santé Canada toutes les réactions indésirables graves associées à des drogues suspectes (y compris les médicaments contenant du cannabis) consommées avec ou sans autres produits suspects. Toutefois, en vertu de la Loi sur le cannabis et à ses Règlements, les hôpitaux, étant des déclarants volontaires, peuvent déclarer à Santé Canada des effets indésirables impliquant uniquement le cannabis comme seul produit suspect, sur une base volontaire.
2.3 Données démographiques
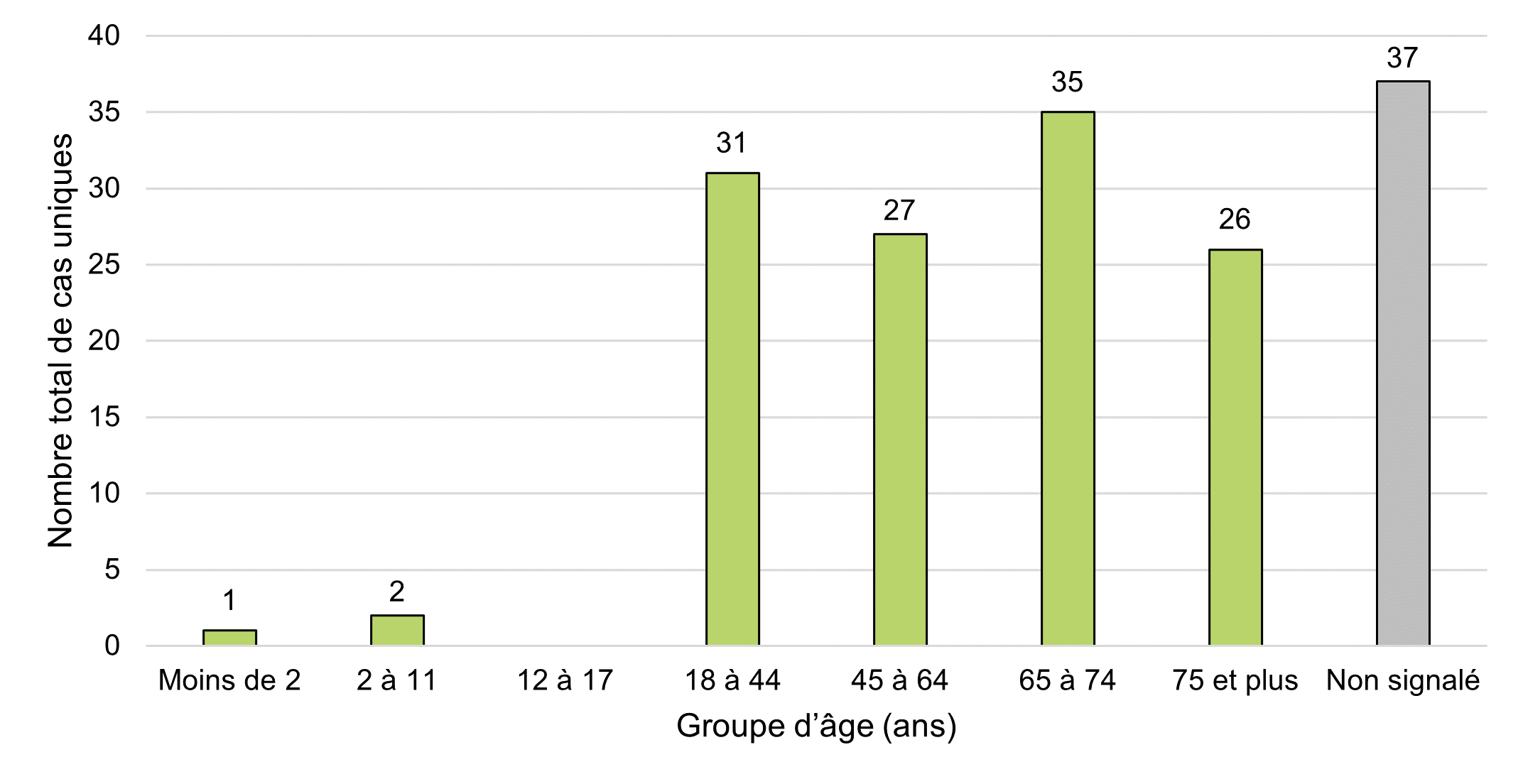
Figure 5 - Équivalent textuel
| Groupe d'âge (ans) | Nombre total de cas uniques |
|---|---|
| Moins de 2 | 1 |
| 2 à 11 | 2 |
| 12 à 17 | 0 |
| 18 à 44 | 31 |
| 45 à 64 | 27 |
| 65 à 74 | 35 |
| 75 et plus | 26 |
| Non signalé | 37 |
| Total général | 159 |
Mises en garde :
- Lorsque, pour un cas donné, l'année de naissance et la date de survenue de la réaction figurent dans le rapport, l'âge est calculé.
- Lorsque l'année de naissance est indiquée, mais non la date de survenue de la réaction, la date à laquelle le rapport a été soumis est utilisée pour calculer l'âge.
L'âge moyen des cas ayant présenté un effet indésirable lié à des produits de cannabis légaux et signalés à Santé Canada en 2020 était d'environ 59 ans (IC à 95 % : 56 à 63), la fourchette d'âge variant entre cinq mois et 91 ans. Ce chiffre n'est pas très différent de celui de la période de déclaration précédente pour laquelle l'âge moyen des cas était de 56 ans (IC à 95 % : 52 à 59), la fourchette d'âge variant entre quatre et 93 ans.
Lorsqu'ils sont classés selon les groupes d'âge de la base de données Vigilyze de l'Organisation mondiale de la Santé (Vigibase), la plupart des cas concernent des personnes âgées de 65 à 74 ans (22 %, n = 35). Ce chiffre diffère de celui de la période de déclaration précédente pour laquelle le groupe d'âge dominant était celui des 18 à 44 ans (25 %, n = 37). Les cas d'effets indésirables en 2020 ont impliqué de manière égale les adultes âgés de <65 ans et ceux âgés de ≥65 ans (38 % ou n = 61 pour chaque tranche d'âge). Il y a plusieurs cas dont on ne disposait d'aucune information concernant l'âge (23 %, n = 37). Ce chiffre est semblable à celui de la période de déclaration précédente (22 %, n = 33).
Ce chiffre reflète un changement par rapport à la période de déclaration précédente pour laquelle les personnes âgées de moins de 65 ans représentaient environ la moitié (50 %, n = 75) de tous les cas, comparativement aux personnes âgées de 65 ans ou plus, qui représentaient seulement 28 % (n = 43) des cas d'effets indésirables. En général, la répartition des cas entre ces groupes d'âge était plus équilibrée en 2020 qu'au cours de la période de déclaration précédente.
Au cours des deux périodes de déclaration, peu de cas impliquant des enfants qui utilisent des produits de cannabis légaux à des fins médicales (n = 2 en 2018-2019 ; n = 3 en 2020) ont été signalés à Santé Canada.
Malgré une répartition égale du nombre total de cas d'effets indésirables entre les groupes d'âge plus jeunes et plus âgés en 2020, les cas graves étaient légèrement plus fréquents chez les adultes plus âgés (≥ 65 ans). Parmi les cas graves (n = 121) signalés à Santé Canada en 2020, 44 % (n = 53) sont survenus chez des adultes plus âgés, 40 % (n = 48) chez des adultes de moins de 65 ans. Le groupe d'âge de 65 ans ou plus représente les adultes âgés chez lesquels la polypharmacie ou les troubles de santé préexistants ou les affections concomitantes sont plus fréquents, ce qui peut également augmenter le risque d'effets indésirables.
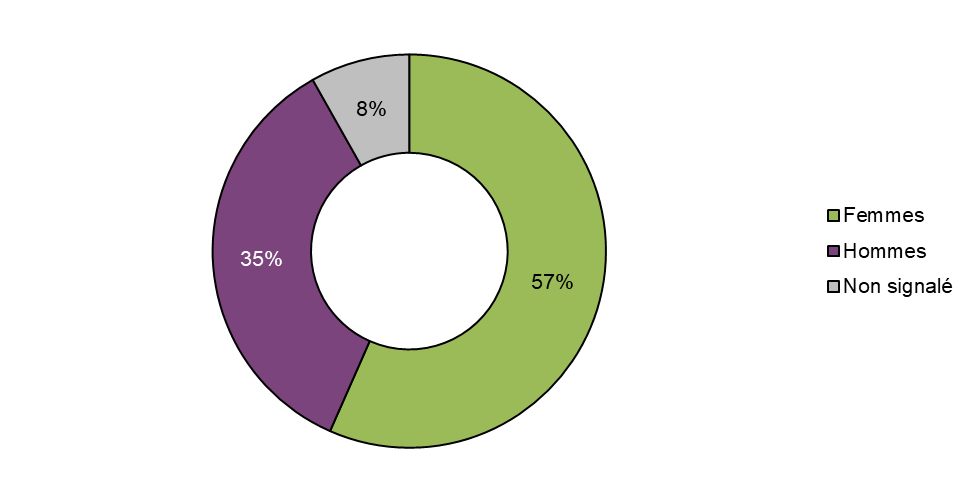
Figure 6 - Équivalent textuel
| Sexe | Nombre total de cas uniques | Proportion (en %) du total |
|---|---|---|
| Femmes | 90 | 57 |
| Hommes | 56 | 35 |
| Non signalé | 13 | 8 |
| Total général | 159 | 100 |
Plus de la moitié des cas d'effets indésirables signalés à Santé Canada en 2020 concernaient des femmes (57 %, n = 90), tandis qu'environ un tiers des cas concernaient des hommes (35 %, n = 56). La répartition des cas par sexe était semblable à celle de la période de déclaration précédente (femmes : 55 %; hommes : 39 %); toutefois, le nombre de cas pour lesquels le sexe n'était pas déclaré est passé de 6 % en 2018-2019 à 8 % en 2020.
Le sexe (et l'âge) peuvent être absents des rapports pour plusieurs raisons, notamment parce que les consommateurs ne veulent pas divulguer cette information aux titulaires de licence ou à Santé Canada ou parce que les cas proviennent d'autres formulaires de déclaration, comme le Formulaire de déclaration relative au cannabis, qui ne saisit pas ce type de renseignements démographiques.
2.4 Produits de cannabis suspects
La majorité des cas d'effets indésirables signalés à Santé Canada en 2020 qui étaient associés à des produits de cannabis légaux désignaient le cannabis comme le seul produit suspect (94 %, n=150), ce qui signifie qu'aucun autre produit n'a été signalé comme co-suspect. Les autres produits peuvent comprendre des médicaments sur ordonnance ou en vente libre, des produits de santé naturels ou d'autres types de produits de santé réglementés par la Loi sur les aliments et drogues. Cependant, la majorité des cas (96 %, n = 153) étaient associés à au moins un produit concomitant (c'est-à-dire un produit utilisé au moment de l'effet indésirable mais qui n'est pas considéré comme suspect). Les produits concomitants peuvent être des médicaments sur ordonnance ou en vente libre, des vaccins, des produits biologiques, des dispositifs médicaux, des produits de santé naturels, d'autres substances réglementées (par exemple, alcool, tabac, autres produits de vapotage (par exemple, nicotine ou arômes)) ou des substances illégales.
Dans certains cas (n = 27) signalés à Santé Canada en 2020, deux produits de cannabis suspects ou plus ont été signalés, l'intervalle variant entre deux et quatre produits de cannabis. En comparaison, au cours de la période de déclaration précédente, 25 rapports de cas ont été soumis dont deux produits de cannabis suspects ou plus ont été cités, l'intervalle variant entre deux et sept produits de cannabis. Il convient de noter que tous les produits suspects sont désignés comme tels par le déclarant et que le rôle d'autres facteurs, incluant d'autres produits ou substances, ne peuvent pas toujours être exclu. Ces considérations font partie de l'évaluation clinique dans la partie du résumé clinique du présent rapport.
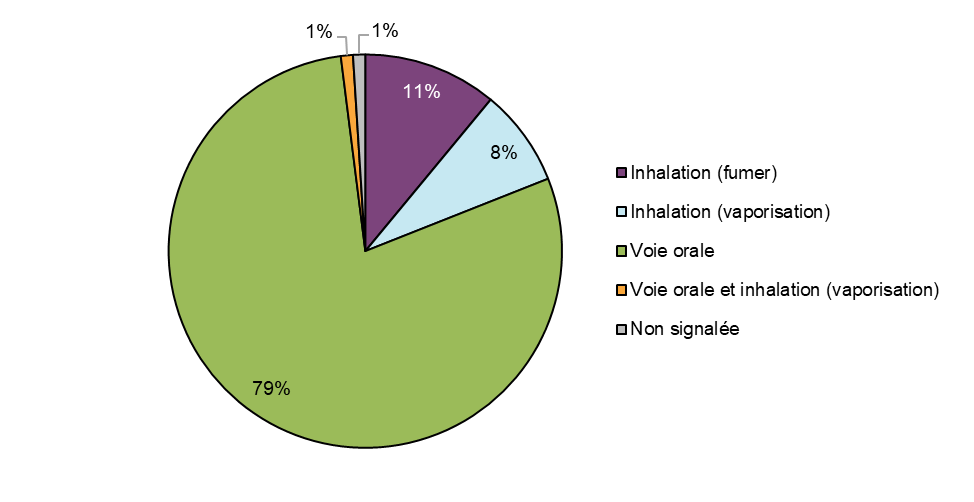
Figure 7 - Équivalent textuel
| Voie d'administration | Nombre total de cas uniques | Proportion (en %) du total |
|---|---|---|
| Inhalation (fumer) | 18 | 11 |
| Inhalation (vaporisation) | 13 | 8 |
| Voie orale | 125 | 79 |
| Voie orale et inhalation (vaporisation) | 1 | 1 |
| Non signalée | 2 | 1 |
| Total général | 159 | 100 |
Mises en garde :
- Cette figure décrit la voie d'administration des produits de cannabis suspects associés aux cas, qui est codée séparément de la forme posologique (c'est-à-dire qu'un produit à base d'huile de cannabis peut être ingéré, appliqué localement sur la peau, etc.).
- L'administration par voie orale fait référence à la consommation de cannabis par la bouche et peut comprendre l'ingestion, l'administration buccale, l'administration sublinguale, etc., ce qui signifie que l'absorption peut se produire dans le tractus gastro-intestinal ainsi que directement dans la circulation sanguine à travers les tissus des muqueuses buccales.
- L'inhalation fait référence à la consommation de cannabis par les voies respiratoires sous forme de fumée ou par vaporisation, parmi d'autres.
- Les cas peuvent être associés à plus d'un produit de cannabis suspect; par conséquent, plusieurs voies d'administration peuvent être indiquées pour un seul cas.
Les produits de cannabis suspects associés à des cas d'effets indésirables ont été le plus souvent consommés par voie orale sous forme d'extraits de cannabis (79 %, n = 125), puis par inhalation (19 %, n = 31), 11 % des répondants ayant fumé du cannabis séché (11 %, n = 18) et 8 % (n = 13) ayant vaporisé du cannabis. La plupart des cas ont été associés à l'inhalation d'extraits de cannabis vaporisés (85 %, n = 11), suivie par la vaporisation de cannabis séché (15 %, n = 2). Un cas a été associé à une administration par voie orale et par inhalation. Les comparaisons entre les deux périodes de déclaration sont limitées, car les extraits de cannabis (à l'exception des huiles de cannabis destinées à être ingérées) n'étaient pas légalement disponibles sur le marché au cours de la période de déclaration précédente.
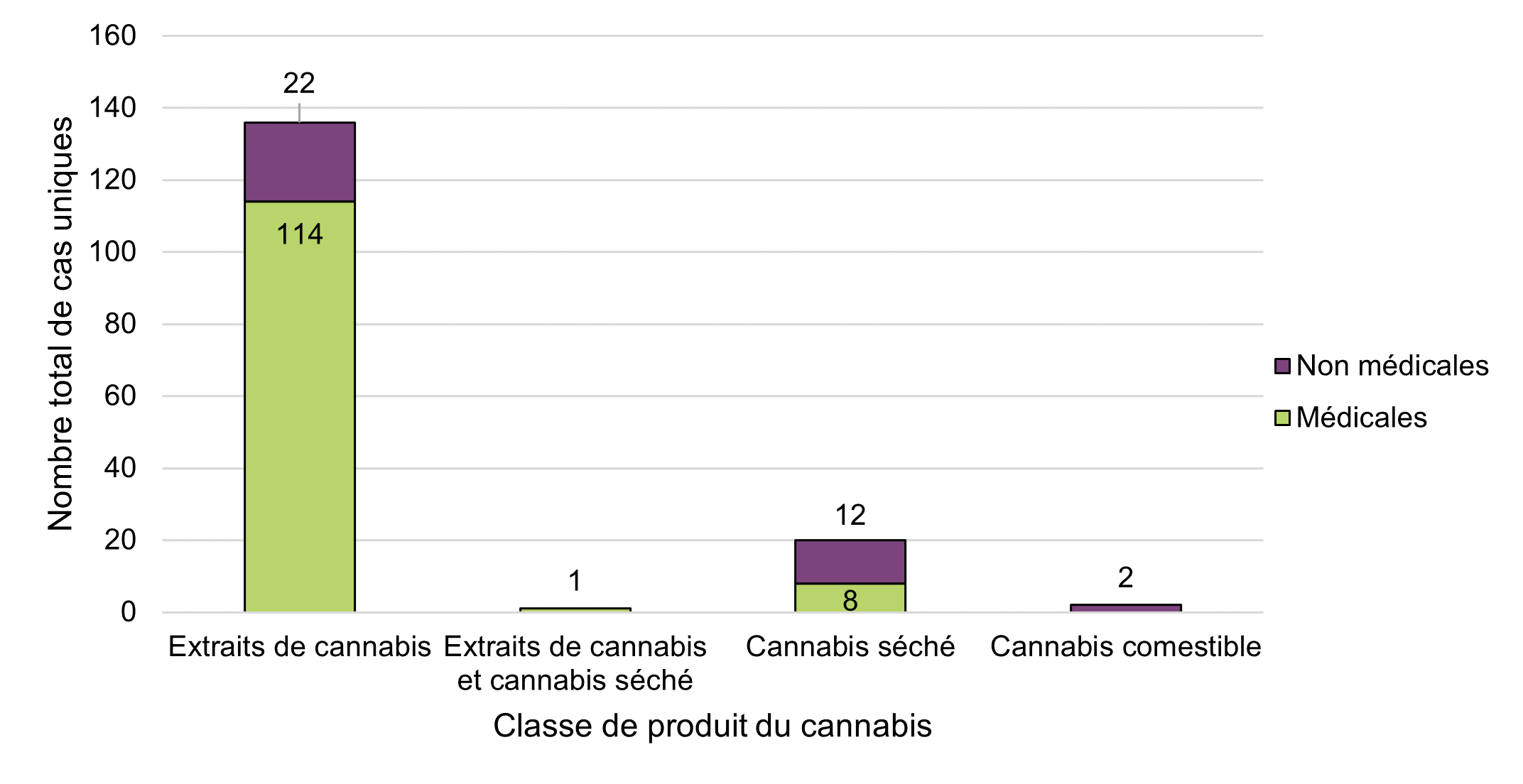
Figure 8 - Équivalent textuel
| Classe de produit du cannabis | Raisons de la consommation | ||
|---|---|---|---|
| Médicales | Non médicales | Total général | |
| Extraits de cannabis | 114 | 22 | 136 |
| Extraits de cannabis et cannabis séché | 1 | 0 | 1 |
| Cannabis séché | 8 | 12 | 20 |
| Cannabis comestible | 0 | 2 | 2 |
| Total général | 123 | 36 | 159 |
La majorité des cas d'effets indésirables signalés à Santé Canada en 2020 étaient associés à des produits du cannabis utilisés à des fins médicales (77 %, n = 123), par rapport à des fins non médicales (23 %, n = 36). La majorité des cas impliquant des produits de cannabis à des fins médicales étaient graves (86 %, n = 106). En revanche, la majorité des cas impliquant des produits du cannabis utilisés à des fins non médicales étaient non graves (58 %, n = 21).
En général, les cas étaient associés à trois classes de produits légaux du cannabis: les extraits de cannabis (n = 136), le cannabis séché (n = 20) et le cannabis comestible (n = 2) (figure 8). Aucun cas en 2020 n'a été signalé comme étant associé aux topiques de cannabis ou au cannabis frais. La majorité des cas impliquant des produits à base d'extraits de cannabis ont été déclarés comme étant utilisés à des fins médicales (84 %, n = 114). À l'inverse, 60 % (n = 12) des cas impliquant du cannabis séché ont été signalés comme étant utilisés à des fins non médicales. Les extraits de cannabis ont été associés à 91 % (n = 117) des cas graves et 68 % (n = 25) des cas non graves en 2020 (données non présentées). Ces observations descriptives sont conformes aux observations de la période de déclaration précédente, malgré l'expansion et la disponibilité d'autres produits de cannabis légaux à partir de la fin de l'année 2019 (produits de cannabis comestibles, extraits de cannabis [autres que les huiles] et cannabis pour usage topique).
Il est à noter que certains consommateurs ou patients peuvent préférer des produits à base d'huile de cannabis ingérable pour une ou plusieurs raisons telles que : éviter d'inhaler du cannabis; pour la possibilité d'échantillonner ou de titrer une dose spécifique mesurée; pour la durée de l'effet; pour la concentration en cannabinoïdes ou pour d'autres raisons. Cependant, les produits du cannabis consommés par voie orale (ingérés) sont soumis à un métabolisme de premier passage dans le foie et ont un délai d'apparition ainsi qu'une durée d'effet plus longs, ce qui peut augmenter le risque d'interactions possibles entre le cannabis et les produits de santé ou d'autres substances en cas d'utilisation concomitante, contribuant ainsi à un risque accru de subir des effets indésirables.
* Comprend les extraits chimiques créés par l'utilisation de solvants et les extraits physiques créés par l'utilisation de la pression ou du froid/de la glace.
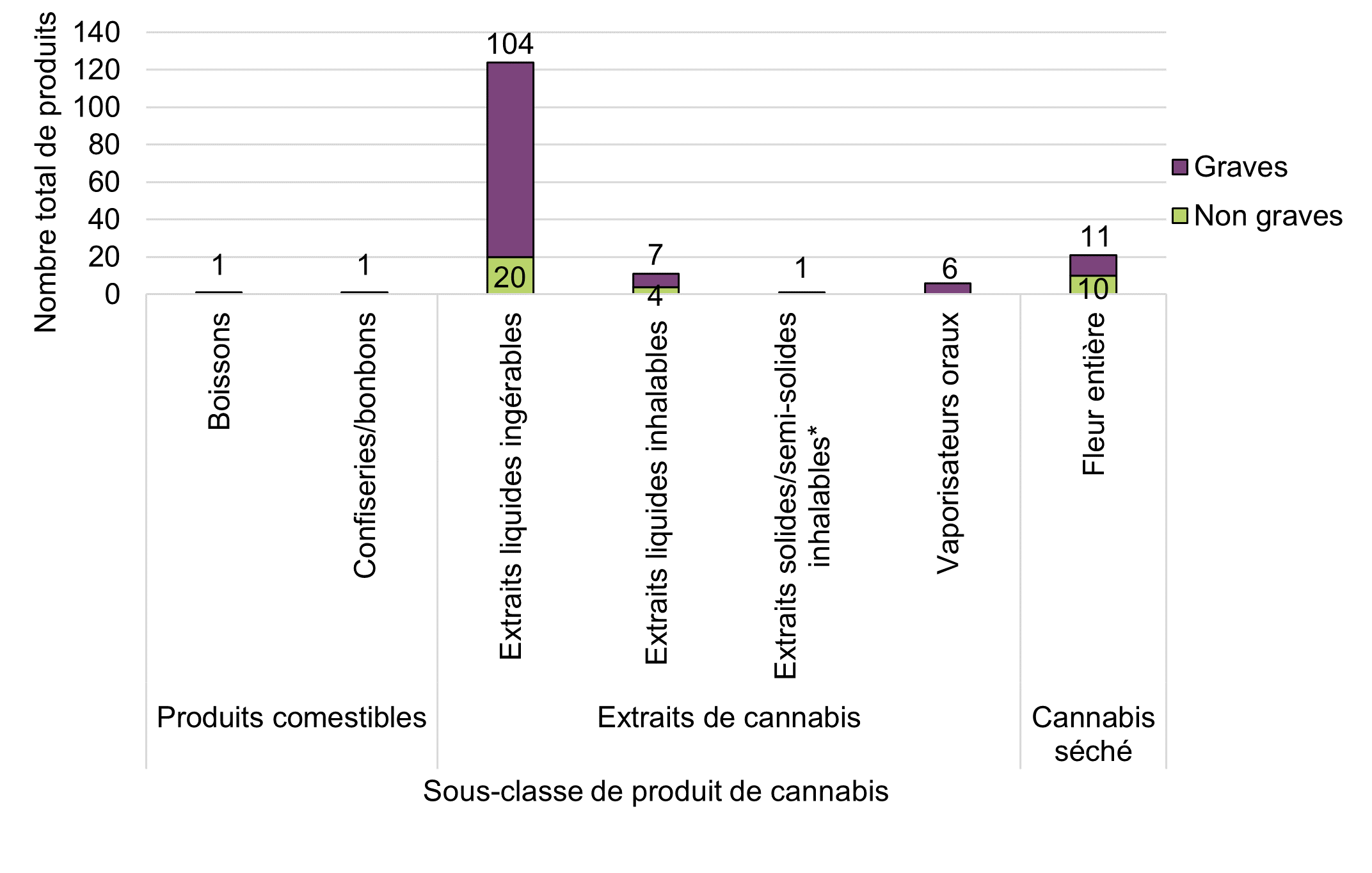
Figure 9 - Équivalent textuel
| Classe de produit de cannabis | Sous-classe de produit de cannabis | Nombre total de produits par gravité | ||
|---|---|---|---|---|
| Non graves | Graves | Total général | ||
| Produits comestibles | Boissons | 1 | 0 | 1 |
| Confectionaries/candies (e.g., mints, chocolates) | 1 | 0 | 1 | |
| Extraits de cannabis | Extraits liquides ingérables (par exemple, huiles en bouteille, capsules, teintures) | 20 | 104 | 124 |
| Extraits liquides inhalables (par exemple, liquides de vapotage) | 4 | 7 | 11 | |
| Extraits solides/semi-solides inhalables (par exemple, rosin, miel, budder, ambre, hachisch)*Note de bas de page * | 1 | 0 | 1 | |
| Vaporisateurs oraux | 0 | 6 | 6 | |
| Cannabis séché | Fleur entière | 10 | 11 | 21 |
| Total général | 37 | 128 | 165 | |
|
||||
Mises en garde :
- Ce chiffre a été établi par Santé Canada à l'aide d'une catégorisation manuelle des cas en fonction de leur sous-catégorie de produits de cannabis suspects.
- Les cas peuvent avoir plusieurs produits suspects de cannabis déclarés dans différentes sous-classes de cannabis. Pour cette raison, le nombre total indiqué dans le tableau selon le nombre de produits suspects par sous-classe et par gravité peut dépasser le nombre total de cas uniques.
- La classe d'extrait de cannabis implique un groupe de formes de produits diverses, comprenant les liquides/gouttes par voie orale, les gélules, les capsules/comprimés, les vaporisateurs sublinguaux, les bandes solubles ou les extraits hautement concentrés comme le shatter, la cire, la rosin, la résine ou les liquides de vaporisation. Le cannabis séché comprend les fleurs séchées entières, les fleurs moulues et les joints préroulés. Les produits de cannabis comestibles comprennent les formats de type alimentaire (chocolat, confiserie, menthe) et les boissons.
- Les extraits solides ou semi-solides inhalables peuvent comprendre des extraits produits par des méthodes chimiques ou physiques.
- Les vaporisateurs oraux (ingérables) sont notés séparément des extraits liquides ingérables qui, en raison de leur utilisation sublinguale/oromucosale (c'est-à-dire à l'intérieur de la joue), peuvent être absorbés directement dans la circulation sanguine.
Comme indiqué ci-dessus, les extraits de cannabis étaient la classe de produits de cannabis la plus fréquemment signalée parmi les cas d'effets indésirables. Dans la catégorie des extraits de cannabis, les huiles ingérables sous forme liquide (huiles en bouteille avec compte-gouttes) et en gélules étaient les plus fréquemment impliquées, représentant 65 % (n = 88) et 26 % (n = 36) des cas d'effets indésirables impliquant des extraits de cannabis par rapport aux extraits liquides inhalables (liquides de vapotage [8 %, n = 11]) ou aux extraits solides/semi-solides inhalables (rosin [<1 %, n = 1]). En général, les cas impliquant des extraits de cannabis liquides consommés par voie orale étaient « à prédominance de CBD » ou « à concentration supérieure de CBD », et les cas impliquant des produits de cannabis séchés étaient généralement « à prédominance de THC »Note de bas de page 4.
Conformément à la période de déclaration précédente, les cas impliquant des adultes plus âgés (65 ans et plus) ont exclusivement déclaré avoir consommé des extraits de cannabis, tandis que les cas impliquant des adultes plus jeunes ont déclaré avoir consommé à la fois du cannabis séché et des extraits de cannabis. Lorsqu'on les ventile par type de sous-produit, seuls les groupes d'âge des adultes jeunes et d'âge moyen (de 18 à 64 ans) ont été impliqués dans des cas d'effets indésirables avec des liquides de vapotage, tandis que les adultes plus âgés (65 ans et plus) ont été plus fréquemment impliqués dans des cas d'effets indésirables avec des huiles ingérables sous forme liquide et des gélules que les groupes d'âge plus jeunes.
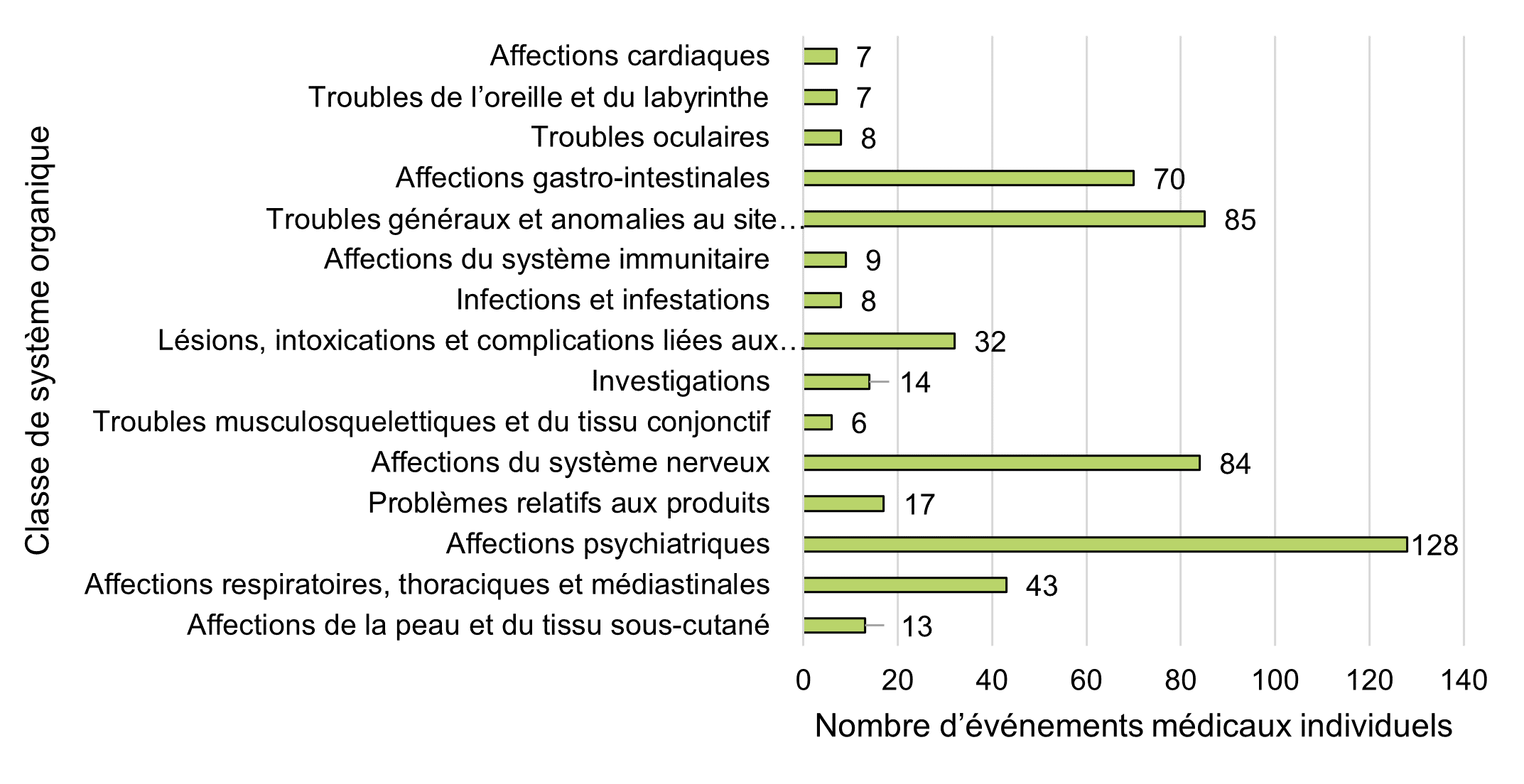
Figure 10 - Équivalent textuel
| Classe de système d'organe | Nombre d'événements médicaux individuels |
|---|---|
| Affections cardiaques | 7 |
| Troubles de l'oreille et du labyrinthe | 7 |
| Troubles oculaires | 8 |
| Affections gastro-intestinales | 70 |
| Troubles généraux et anomalies au site d'administration | 85 |
| Affections du système immunitaire | 9 |
| Infections et infestations | 8 |
| Lésions, intoxications et complications liées aux procédures | 32 |
| Investigations | 14 |
| Troubles musculosquelettiques et du tissu conjonctif | 6 |
| Affections du système nerveux | 84 |
| Problèmes relatifs aux produits | 17 |
| Affections psychiatriques | 128 |
| Affections respiratoires, thoraciques et médiastinales | 43 |
| Affections de la peau et du tissu sous-cutané | 13 |
Mises en garde :
- Cette figure porte sur les 15 principales classes de systèmes organiques signalées dans tous les cas d'effets indésirables.
- Chaque cas peut décrire un ou plusieurs événements médicaux individuels, indiquant un signe, des symptômes, des maladies, des diagnostics, des enquêtes et des procédures.
- Les événements sont codés selon le Dictionnaire médical des affaires réglementaires (MedDRA) (en anglais), qui fournit une terminologie médicale normalisée en regroupements hiérarchiques. Le groupe du niveau le plus élevé est la classe de système organique (System Organ Class [SOC]).
- Un cas d'effets indésirables peut être représenté dans plusieurs classes de systèmes organiques et est influencé par la façon dont les événements médicaux individuels (signes, symptômes, observations ou diagnostics) sont signalés.
Au total, 557 événements médicaux individuels (représentant 248 types uniques de catégories d'événements médicaux individuels) ont été déclarés dans 159 cas en 2020. Lorsqu'elles sont regroupées au niveau le plus large (c'est-à-dire la classe de système organique), les cinq catégories les plus fréquentes sont les suivantes :
- Troubles psychiatriques (23 %, n = 128)
- Troubles généraux et anomalies au site d'administration (15 %, n = 85)
- Affections du système nerveux (15 %, n = 84)
- Troubles gastro-intestinaux (13 %, n = 70)
- Affections respiratoires, thoraciques et médiastinales (8 %, n = 43)
Les cinq principales classes de systèmes organiques pour 2020 correspondent aux cinq principales classes de systèmes organiques déclarées dans la période de déclaration précédente. Cependant, l'année précédente, les troubles du système nerveux étaient la classe de système organique la plus fréquemment déclarée, suivis par les troubles psychiatriques.
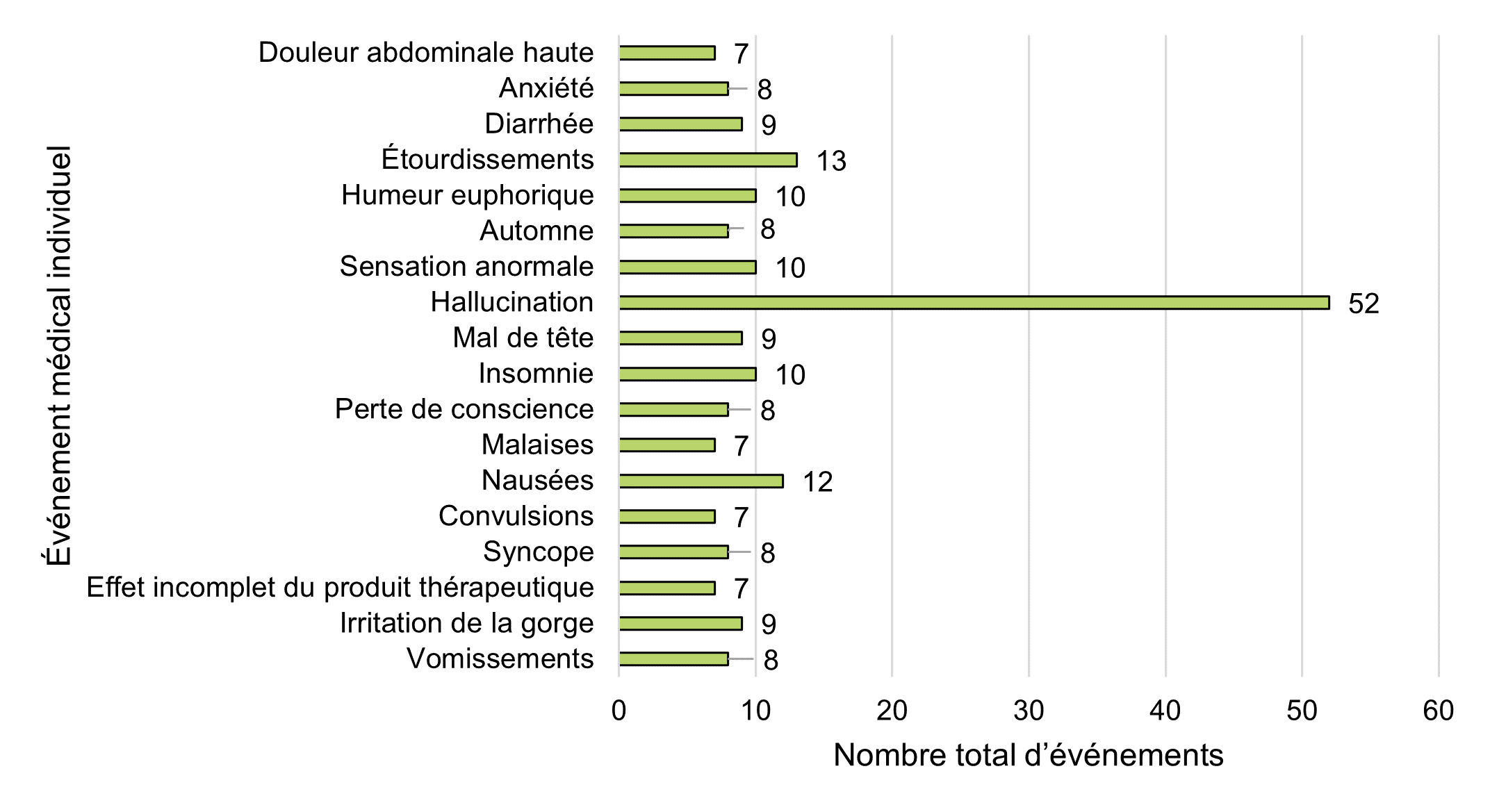
Figure 11 - Équivalent textuel
| Événement médical individuel | Nombre total d'événements |
|---|---|
| Douleur abdominale haute | 7 |
| Anxiété | 8 |
| Diarrhée | 9 |
| Étourdissements | 13 |
| Humeur euphorique | 10 |
| Automne | 8 |
| Sensation anormale | 10 |
| Hallucination | 52 |
| Maux de tête | 9 |
| Insomnie | 10 |
| Perte de conscience | 8 |
| Malaises | 7 |
| Nausées | 12 |
| Convulsions | 7 |
| Syncope | 8 |
| Effet incomplet du produit thérapeutique | 7 |
| Irritation de la gorge | 9 |
| Vomissements | 8 |
Mises en garde :
- Cette figure porte sur les 15 principaux événements médicaux individuels déclarés parmi tous les effets indésirables. Plus de 15 événements sont reflétés dans cette figure, car plusieurs événements ont été observés un nombre égal de fois. Les autres événements médicaux individuels rapportés moins fréquemment n'apparaissent pas dans cette figure.
- Les événements médicaux individuels sont codés en utilisant la terminologie MedDRA basée sur le compte rendu du rapport de cas.
- Puisque chaque cas peut avoir plusieurs événements médicaux individuels rapportés, le nombre d'événements médicaux individuels dépasse le nombre total de cas uniques.
- Plusieurs types d'hallucinations ont été combinés pour créer une catégorie générale pour les hallucinations. Il s'agissait d'hallucinations auditives, d'hallucinations visuelles, d'hallucinations mixtes, d'hallucinations hypnagogiques et de pseudo-hallucinations.
Comme le montre la figure 11, les événements médicaux individuels les plus fréquemment signalés en 2020 sont les suivants :
- Hallucination (n = 52)
- Étourdissements (n = 13)
- Nausées (n = 12)
- Humeur euphorique (n = 10)
- Sentiment anormal (n = 10)
- Insomnie (n = 10)
Au cours de la période de référence précédente, les maux de tête étaient l'événement médical individuel le plus fréquemment signalé, suivis des nausées et des hallucinations.
Parmi les autres événements d'intérêt, citons les interactions médicamenteuses (n = 5) et aux problèmes liés à la qualité des produits suspectés (n = 4). Ces deux types d'événements ont diminué depuis la période de référence précédente (de n = 8 cas chacun). Il convient de noter qu'il est souvent difficile de valider une interaction médicamenteuse en tant qu'événement médical en raison des limites de la quantité et de la qualité des informations fournies. Certains cas peuvent être évocateurs d'une interaction médicamenteuse (par les signes et les symptômes), mais ne précisent pas le médicament, tandis que d'autres peuvent le déclarer, mais ne pas fournir suffisamment d'informations pour discerner si une interaction s'est réellement produite. Sur les cinq cas d'interaction médicamenteuse potentielle signalés en 2020, seul un cas a été médicalement confirmé (signalé par un professionnel de la santé). Problèmes de qualité de produits suspectés sont souvent trop peu détaillés, ce qui rend difficile la confirmation qu'un problème de qualité du produit a été impliqué dans l'effet indésirable. Toutes les plaintes suspectes concernant la qualité sont transmises à la Direction de la conformité de la DGSCC pour un examen plus approfondi.
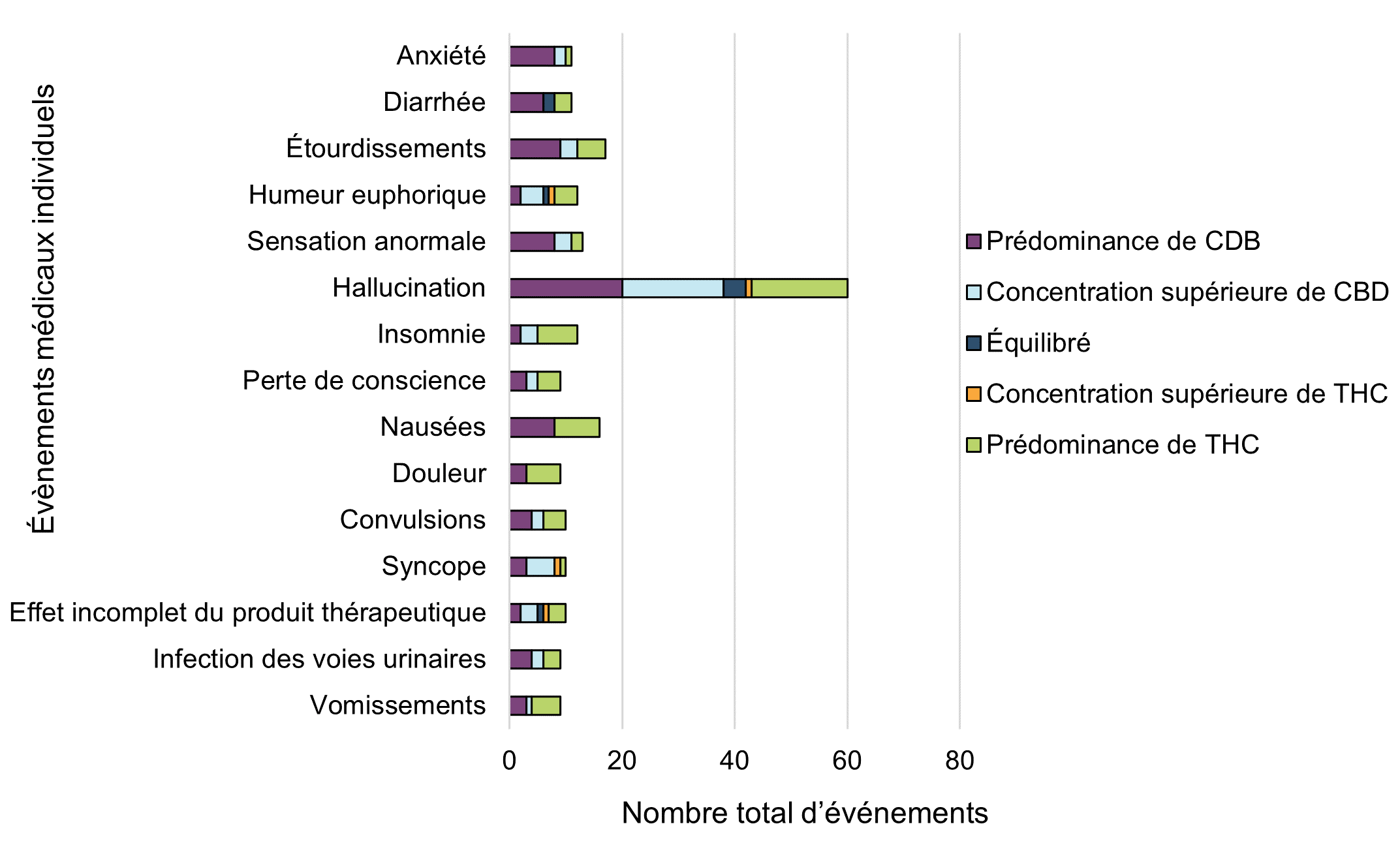
Figure 12 - Équivalent textuel
| Évènements médicaux individuels | Dominance du cannabinoïde | Total général (hors cas non classés) | ||||
|---|---|---|---|---|---|---|
| Prédominance de CDB | Concentration supérieure de CBD | Équilibré | Concentration supérieure de THC | Prédominance de THC/th> | ||
| Anxiété | 8 | 2 | 0 | 0 | 1 | 11 |
| Diarrhée | 6 | 0 | 2 | 0 | 3 | 11 |
| Étourdissements | 9 | 3 | 0 | 0 | 5 | 17 |
| Humeur euphorique | 2 | 4 | 1 | 1 | 4 | 12 |
| Sensation anormale | 8 | 3 | 0 | 0 | 2 | 13 |
| Hallucination | 20 | 18 | 4 | 1 | 17 | 60 |
| Insomnie | 2 | 3 | 0 | 0 | 7 | 12 |
| Perte de conscience | 3 | 2 | 0 | 0 | 4 | 9 |
| Nausées | 8 | 0 | 0 | 0 | 8 | 16 |
| Douleur | 3 | 0 | 0 | 0 | 6 | 9 |
| Convulsions | 4 | 2 | 0 | 0 | 4 | 10 |
| Syncope | 3 | 5 | 0 | 1 | 1 | 10 |
| Effet incomplet du produit thérapeutique | 2 | 3 | 1 | 1 | 3 | 10 |
| Infection des voies urinaires | 4 | 2 | 0 | 0 | 3 | 9 |
| Vomissements | 3 | 1 | 0 | 0 | 5 | 9 |
Mises en garde :
- Cette figure porte sur les 15 principaux événements médicaux individuels après stratification par dominance de cannabinoïdes. Cette figure exclut les cas n'ayant pas suffisamment d'informations pour l'attribution d'une dominance de cannabinoïde (c'est-à-dire non classés); par conséquent, les 15 premiers événements de cette figure peuvent différer de ceux observés dans la figure 11. D'autres événements médicaux individuels ont été signalés pendant la période de déclaration, mais ne font pas partie de cette figure.
- Cette figure a été créée manuellement par Santé Canada en classant chaque produit de cannabis suspect selon la dominance du cannabinoïde sur la base des détails disponibles sur le produit et en attribuant tous les événements médicaux individuels dans un cas à tous les produits de cannabis suspects signalés et leur dominance du cannabinoïde (pondérés de manière égale pour tous les événements). Par conséquent, la corrélation entre la dominance du cannabinoïde et les événements médicaux individuels peut être surestimée et ne reflète pas la causalité.
Dans l'ensemble, les produits à prédominance ou à concentration supérieure de CBD ont été plus fréquemment signalés que les produits à prédominance ou à concentration supérieure de THC dans toutes les déclarations de cas d'effets indésirables soumises à Santé Canada en 2020. Ceci correspond aux observations de la période de déclaration précédente où les données sur les effets indésirables étaient surtout associées aux produits d'huile de cannabis à prédominance ou à concentration supérieure de CBD.
Comme souligné à la figure 12, certains événements médicaux individuels semblent être plus fréquemment signalés avec des produits à prédominance de THC ou à concentration supérieure de THC, tandis que d'autres sont plus fréquemment signalés avec des produits à prédominance de CBD ou à concentration supérieure de CBD. Par exemple, les événements médicaux associés à l'insomnie ou à la douleur semblent être plus fréquemment signalés avec des produits à prédominance de THC ou à concentration supérieure de THC, tandis que l'anxiété et la diarrhée sont plus fréquemment signalées avec des produits à prédominance de CBD ou à concentration supérieure de CBD. Il est intéressant de noter que les vertiges, les pertes de conscience, les syncopes et les hallucinations ont été plus fréquemment signalés avec les produits à prédominance de CBD ou à concentration supérieure de CBD.
Il est aussi important de noter qu'il s'agit uniquement d'événements rapportés et que d'autres facteurs peuvent contribuer à ces événements, notamment : l'âge et l'état de santé des patients (y compris les problèmes de santé préexistants et l'utilisation de médicaments concomitants); l'exposition antérieure au cannabis (par exemple, les consommateurs qui consomment du cannabis pour la première fois); le dosage; la voie d'administration; et la connaissance des effets du cannabis et des cannabinoïdes. D'autres années de données sont nécessaires pour tirer des conclusions plus solides.
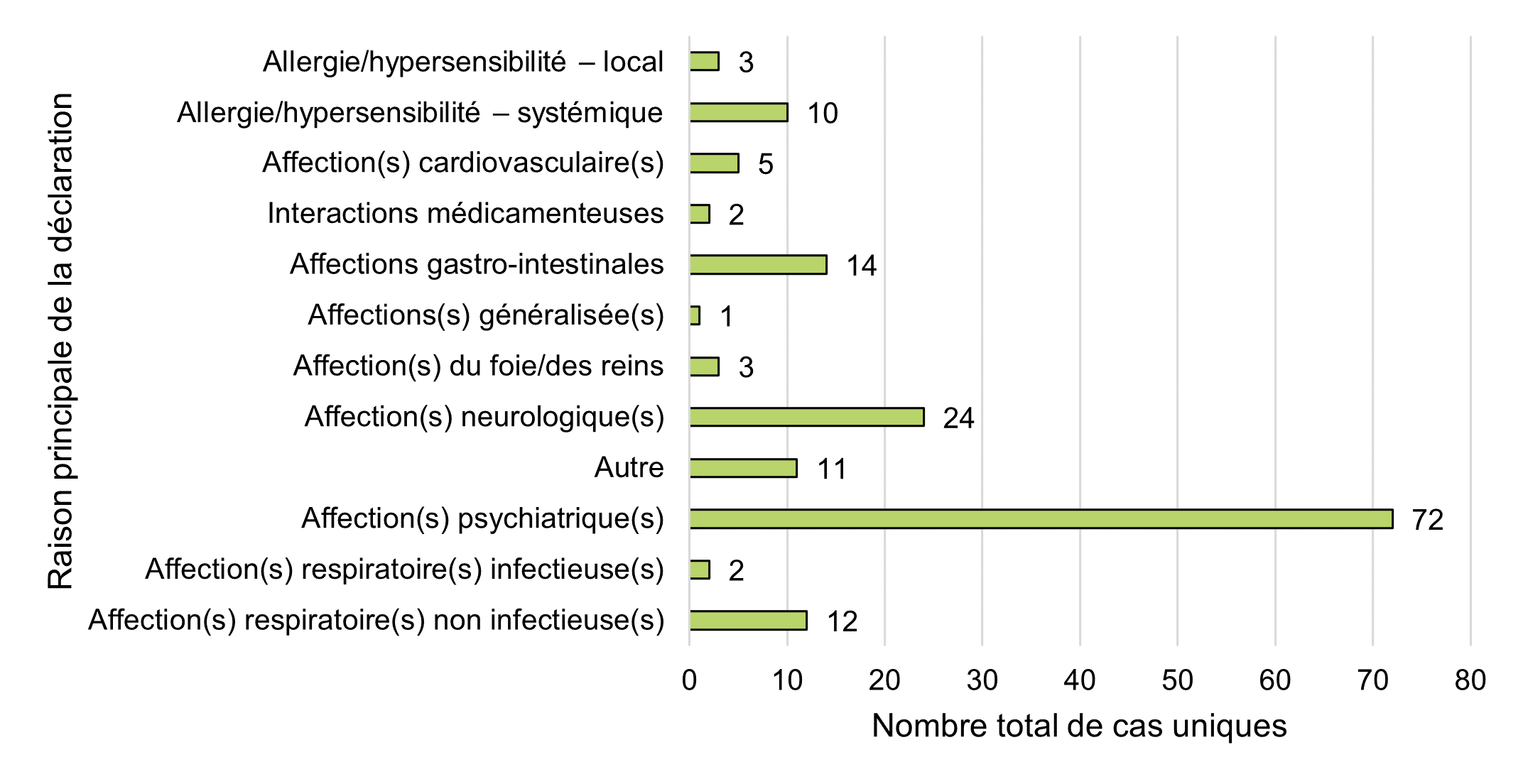
Figure 13 - Équivalent textuel
| Raison principale de la déclaration | Nombre total de cas uniques |
|---|---|
| Allergie/hypersensibilité – local | 3 |
| Allergie/hypersensibilité – systémique | 10 |
| Affection(s) cardiovasculaire(s) | 5 |
| Interactions médicamenteuses | 2 |
| Affections gastro-intestinales | 14 |
| Affections(s) généralisée(s) | 1 |
| Affection(s) du foie/des reins | 3 |
| Affection(s) neurologique(s) | 24 |
| Autre | 11 |
| Affection(s) psychiatrique(s) | 72 |
| Affection(s) respiratoire(s) infectieuse(s) | 2 |
| Affection(s) respiratoire(s) non infectieuse(s) | 12 |
| Total général | 159 |
Mises en garde :
- Ces données ont été créées manuellement par Santé Canada en attribuant une raison médicale principale au niveau du cas sur la base des détails généraux (y compris le texte du compte rendu), plutôt que par niveau d'événement médical individuel (fréquence).
- Dans le cas où il y avait plusieurs raisons, l'événement le plus grave était sélectionné.
Comme décrit ci-dessus, la répartition des événements médicaux individuels par SOC est utile pour la présentation générale des données; cependant, elle n'est pas toujours suffisante pour représenter les conditions cliniques ou les événements qui peuvent avoir une incidence sur plusieurs systèmes (c'est-à-dire qui touchent à plusieurs SOC), ce qui est important pour la surveillance continue et la détection de nouveaux signaux d'innocuité. À ce titre, Santé Canada procède aussi à un examen manuel des détails des cas afin d'attribuer à chacun d'eux une raison principale de déclaration. Cela permet à Santé Canada de cibler et de mettre en évidence les cas présentant un intérêt sur le plan clinique qui peuvent toucher à plusieurs SOCNote de bas de page 5, ou qui peuvent s'inscrire dans des catégories généralisées de SOC peut-être moins précisesNote de bas de page 6, afin de faciliter la surveillance des signaux et la détermination des cas pour une évaluation plus approfondie.
Selon cette méthodologie, les affections psychiatriques, neurologiques (système nerveux), gastro-intestinales et allergiques/liées à une hypersensibilité (systémiques et localisées) étaient la raison principale la plus fréquente de déclaration des cas, ce qui correspond généralement aux SOC (selon la fréquence des événements médicaux individuels présentés à la figure 11).
Les affections respiratoires (non infectieuses) figuraient parmi les cinq principaux motifs de déclaration dans les rapports sur les effets indésirables de 2020; toutefois, cette catégorie ne figurait pas parmi les cinq principaux motifs de la période de déclaration précédente et n'était pas facilement observable dans les événements médicaux individuels par SOC (fréquence). Plus de la moitié des cas (58 %, n = 7) pour lesquels on a désigné cette raison principale concernaient du cannabis séché (fleur entière). Quatre autres cas concernaient des extraits de cannabis inhalés (liquides de vapotage, n = 3; rosin, n = 1), qui sont devenus légaux pendant cette période de déclaration. Un autre cas concernait un extrait de cannabis ingérable (huile). Tous les cas ont été considérés comme non graves.
En outre, l'interaction médicamenteuse a été signalée comme un événement médical individuel dans cinq cas (ne figure pas parmi les 15 premiers événements de la figure 11); cependant, elle n'a été désignée comme raison principale que dans deux cas de la figure 13, en raison du manque de détails et d'informations dans les trois cas restants. De même, aucun cas n'a identifié les problèmes de qualité de produit comme une raison principale de déclaration, mais un cas l'a répertorié comme un événement médical individuel, en raison de la quantité limitée de détails et de données disponibles.
L'analyse comparative fondée sur le sexe et le genre plus (ACSG plus) des données d’effets indésirables de 2020
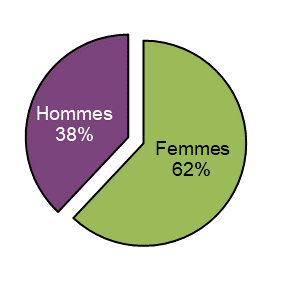
Figure 14 - Équivalent textuel
| Sexe | Nombre total de cas uniques | Proportion (en %) du total |
|---|---|---|
| Femmes | 90 | 62 |
| Hommes | 56 | 38 |
| Total général | 146 | 100 |
Un total de 146 cas d'effets indésirables comportait une désignation du sexe. Parmi ces cas, 62 % (n = 90) concernaient des femmes. Les femmes étaient impliquées dans 66 % de tous les cas graves dont le sexe est déclaré. Quatre-vingt-neuf pour cent (89 %) des femmes et 68 % des hommes ont consommé du cannabis à des fins médicales.
Les femmes impliquées dans les cas d'effets indésirables associés aux produits de cannabis étaient plus âgées que les hommes. L'âge moyen des femmes était de 64,2 ans (IC à 95 % : 60,6 à 67,9) et celui des hommes de 51,2 ans (IC à 95 % : 44,4 à 58,0).
Moins de 65 ans :
Femmes, n = 31
Hommes, n = 28
65 ans et plus :
Femmes, n = 46
Hommes, n = 15
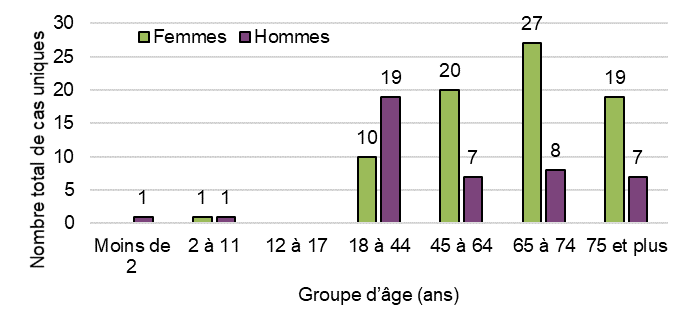
Figure 15 - Équivalent textuel
| Groupe d'âge (ans) | Nombre total de cas uniques | |
|---|---|---|
| Femmes | Hommes | |
| Moins de 2 | 0 | 1 |
| 2 à 11 | 1 | 1 |
| 12 à 17 | 0 | 0 |
| 18 à 44 | 10 | 19 |
| 45 à 64 | 20 | 7 |
| 65 à 74 | 27 | 8 |
| 75 et plus | 19 | 7 |
| Total général | 77 | 43 |
Les cas d'effets indésirables liés à l'inhalation de cannabis séché (fleur entière) et de liquides à inhaler concernent plus souvent des hommes que des femmes. À l'inverse, les extraits de cannabis ingérables sous forme liquide (huiles en bouteille), les gélules et les vaporisateurs oraux concernaient plus fréquemment les femmes que les hommes.
Les femmes étaient plus souvent impliquées que les hommes dans les cas d'effets indésirables où plusieurs produits de cannabis suspects étaient signalés (16 contre 9 cas avec plusieurs produits, respectivement).
Les trois principaux événements médicaux individuels rapportés, par sexe, sont les suivants :
| Femmes | Hommes |
|---|---|
| HallucinationNote de bas de page * (n=37) | HallucinationNote de bas de page * (n=14) |
| Étourdissements (n=12) | Chute (n=5) |
| Nausées (n=9) | Troubles psychotiques (n=5) |
|
|
3.0 Évaluation clinique des cas graves et importants sur le plan médical
3.1 Résumé des effets indésirables graves et importants sur le plan médical
- Tous les cas d'effets indésirables signalés comme graves à Santé Canada ont été évalués pour en déterminer la causalité (n = 121). Quatre cas supplémentaires, signalés comme non graves, mais jugés importants sur le plan médical par la DGSCC, ont également fait l'objet d'une évaluation de la causalité, ce qui porte à 125 le nombre total de cas pouvant faire l'objet d'une évaluation de la causalité pendant la période considérée.
| Causalité attribuée | Nombre de cas |
|---|---|
| Certain | 0 |
| Probable | 11 |
| Possible | 95 |
| Improbable | 5 |
| Non évaluable | 14 |
| Total général | 125 |
- La causalité des effets indésirables est basée sur les informations rapportées lors de la déclaration initiale ainsi que dans les suivis, lorsque cela est possible. Pour certains cas, il se peut que les informations fournies lors de la déclaration initiale ainsi que dans les suivis ne soient pas suffisantes pour évaluer de manière approfondie le lien de causalité entre les événements et l'exposition aux produits du cannabis. L'évaluation de la causalité est une enquête clinique des cas et une pratique courante en pharmacovigilance pour déterminer la probabilité d'une association entre les produits et les effets indésirables. Cette pratique permet de déterminer les problèmes d'innocuité potentiels qui peuvent nécessiter une enquête ou des mesures supplémentaires de la part de l'autorité réglementaire ou du titulaire de licence.
- Dans l'ensemble, une causalité « possible » (76 %, n = 95) a été attribuée à la majorité des cas, ce qui signifie qu'il est possible que le produit du cannabis ait pu contribuer à l'effet indésirable, mais que la contribution d'autres facteurs n'a pas pu être exclue (par exemple, médicaments concomitants, comorbidités, etc.).
- Dans 11 cas, la causalité a été qualifiée de « probable » (9 %), ce qui signifie qu'il y avait suffisamment de renseignements permettant de juger que le produit du cannabis avait probablement contribué à l'effet indésirable et que la contribution d'autres facteurs était considérée comme peu probable.
- Quatorze cas ont été jugés « non évaluables » (11 %), ce qui signifie que les informations étaient insuffisantes pour établir un lien de causalité entre le produit de cannabis et l'effet indésirable signalé.
- Dans cinq cas, le lien de causalité a été qualifié d'« improbable » (4 %), ce qui signifie que le produit de cannabis n'a pas été jugé comme ayant joué un rôle dans l'effet indésirable signalé (d'autres facteurs probables ont été déterminés).
- Une causalité de « certain » pour lequel un niveau de preuve rigoureux est requis, y compris une confirmation médicale et de laboratoire et qui ne doit pas comporter d'autres explications, a été attribuée à aucun cas.
- Parmi les 11 cas auxquels on a attribué une causalité « probable », tous concernaient des produits d'extraits de cannabis légaux à ingérer (gélules, n = 5; huiles, n = 6). Les produits de cannabis suspects présentaient des concentrations variables de cannabinoïdes (5 produits à prédominance de CBD, 2 à concentration supérieure de CBD, 2 à prédominance de THC, 1 à concentration supérieure de THC et 1 produit équilibré) et d'autres ingrédients (par exemple, des solvants). Parmi ces cas, 10 sur 11 ont signalé le cannabis comme seul produit suspect, ce qui signifie qu'aucun autre produit de santé n'a été signalé comme co-suspect.
- Parmi les cas « probables », la plupart des patients avaient des problèmes de santé préexistants et ont rapporté qu'ils utilisent des produits à base de cannabis à des fins médicales (par exemple, douleurs liées au cancer, à l'arthrite et à d'autres troubles chroniques) (82 %, n = 9). Cependant, les détails de ces cas ont confirmé l'existence d'une association probable avec l'utilisation de produits à base de cannabis (par exemple, un délai acceptable entre l'exposition et les événements; une désensibilisation positive).
3.2 Risques importants identifiés au cours de la période de déclaration
- Au cours de cette période de déclaration, aucun des cas graves ou médicalement importants n'a été classé comme nouveau risque important déterminé par la DGSCC.
- La plupart des cas graves ou médicalement importants avec une causalité « probable » impliquaient des risques déterminés connus (c'est-à-dire caractérisés dans le document Renseignements destinés aux professionnels de la santé de Santé Canada; dernière mise à jour : Printemps 2018). Notamment :
- L'hypersensibilité ou les réactions allergiques (par exemple, les réactions d'hypersensibilité localisées ou systémiques comme le prurit, l'urticaire, l'œdème, l'anaphylaxie)
- Les réactions psychiatriques (par exemple, anxiété, hallucinations)
- Les réactions neurologiques (par exemple, maux de tête, vertiges)
- Les réactions gastro-intestinales (par exemple, nausées, vomissements, douleurs à l'estomac)
3.3 Risques potentiels importants pendant la période de déclaration
Les « risques potentiels importants »Note de bas de page 7 observés dans les données sur les effets indésirables des produits de cannabis au cours de la période de déclaration sont les suivants :
- Risque de pression intraoculaire élevée/aggravation du glaucome associé à l'utilisation de produits de cannabis à prédominance de CBD : Ce signal a été considéré comme nouveau/ inattendu (c'est-à-dire qu'il n'a pas été bien caractérisé auparavant); par conséquent, une évaluation approfondie (série de cas), qui comprenait un examen des rapports de cas nationaux et étrangers d'effets indésirables ainsi que des données de la littérature publiée (rapports de cas et littérature scientifique), a été réalisée. L'examen par la DGSCC des informations disponibles a révélé qu'il existe actuellement des preuves limitées au niveau des cas de glaucome aggravé ou d'augmentation de la pression oculaire (n = 3 cas à l'échelle du pays) avec la consommation orale de produits de cannabis à prédominance de CBD. Aucune relation dose-réponse ne peut être déterminée à partir des cas du Canada, pour lesquels il manquait des détails importants (c'est-à-dire les médicaments concomitants et les antécédents médicaux). Cependant, des preuves publiées limitées provenant de petites études cliniques suggèrent que l'administration orale de THC peut provoquer une réduction transitoire de la pression intraoculaire alors que l'administration orale de CBD, en revanche, peut provoquer une augmentation transitoire de la pression intraoculaire, comme décrit dans le document Renseignements destinés aux professionnels de la santé. Pour l'instant, seul un risque potentiel peut être établi entre l'utilisation de ces produits à base de cannabis et le risque d'augmentation de la pression intraoculaire/aggravation du glaucome. Bien que les preuves soient limitées, cet effet sur la santé est considéré comme important et des preuves supplémentaires pourraient renforcer ce signal d'innocuité.
- Risque d'interaction entre le cannabis et un médicament : Au cours de cette période de déclaration, pour cinq cas, on a soupçonné une interaction entre le cannabis et un médicament; cependant, dans trois cas, les informations n'étaient pas suffisantes pour déterminer s'il y avait eu interaction. Dans les deux autres cas, un seul a été confirmé médicalement, à savoir une interaction suspectée entre une huile de cannabis produit équilibrée et du métronidazole. Cette interaction a été jugée « possible » par le médecin déclarant et la DGSCC. Le deuxième cas n'a pas été confirmé médicalement, mais il s'agissait d'une interaction présumée entre un produit sous forme de gélule de cannabis à base de CBD et du lorazépam. Cette interaction a été jugée « possible » en raison d'une relation temporelle acceptable et d'une plausibilité pharmacologique. Il manquait à ce rapport des détails importants pour attribuer une association causale plus forte et élucider pleinement si une interaction médicamenteuse s'est réellement produite ou non. Cependant, les données de la littérature scientifique indiquent que les cannabinoïdes peuvent moduler les enzymes du métabolisme des médicaments (par exemple, le THC peut induire le CYP1A2 et le CBD peut agir comme inhibiteur puissant du CYP3A4 et du CYP2D6); il existe donc un risque possible d'interaction entre les cannabinoïdes et certains médicaments dont l'importance clinique peut varier en fonction du produit (par exemple, la concentration de THC et de CBD), de la dose, de la voie d'administration et des facteurs de risque du patient. Comme le souligne le document Renseignements destinés aux professionnels de la santé de Santé Canada, l'affaiblissement des facultés par le THC peut être exacerbé par la consommation d'autres dépresseurs du système nerveux central. En tant que tel, le signal d'interaction entre le cannabis et les médicaments reste un risque potentiel important que la DGSCC continuera de surveiller à l'avenir.
- Risque d'hallucinations associé aux produits à base de CBD : Alors que l'on sait que les hallucinations sont associées au THC en raison de ses propriétés psychotropes, comme décrit dans le document Renseignements destinés aux professionnels de la santé, les cas d'hallucinations suite à l'utilisation de produits à prédominance ou à concentration supérieure de CBD sont considérés comme nouveaux/imprévus puisque le CBD n'est pas connu pour être psychotrope. Au cours de cette période de déclaration, il y a eu 34 cas suspects d'hallucinations (hallucinations auditives, hallucinations visuelles, hallucinations mixtes, hallucinations hypnagogiques ou pseudo-hallucinations) impliquant des produits à prédominance de CBD ou à concentration supérieure de CBD. Il est important de noter que même si ces produits sont à prédominance ou à concentration supérieure de CBD, ils peuvent tout de même contenir de petites quantités de THC. Ainsi la dose/fréquence d'utilisation de ces derniers peut augmenter l'exposition au THC en quantité suffisante pour déclencher un effet psychotrope comme des hallucinations. La majorité de ces cas sont survenus chez des adultes âgés de 65 ans et plus ayant déclaré des problèmes de santé préexistants et d'autres facteurs de risque. Au moment de la rédaction de ce rapport, la DGSCC était en train d'examiner ce signal.
3.4 Informations manquantes pendant la période de déclaration
Cette section met en évidence les risques potentiels identifiés sur une base préliminaire avec des informations disponibles limitées qui continuent à être surveillés.
- Aggravation d'une maladie auto-immune : Un cas d'aggravation d'une maladie auto-immune a été rapporté, mais les informations disponibles pour une évaluation plus approfondie étaient limitées.
4.0 Avis aux lecteurs
Les rapports d'effets indésirables associés au cannabis soumis à Santé Canada sont reçus et saisis dans la base de données de Canada Vigilance. La Direction des produits de santé commercialisés (DPSC) de la Direction générale des produits de santé et des aliments (DGPSA) recueille, surveille et analyse les effets indésirables soumis à la base de données de Canada Vigilance, entre autres activités, code et héberge les déclarations d'effets indésirables du cannabis. La Direction générale des substances contrôlées et du cannabis (DGSCC) est responsable de la surveillance, de la détection, de la hiérarchisation, de l'évaluation et de la préparation de rapports cumulatifs sur les effets indésirables associés au cannabis (pharmacovigilance).
Les déclarations volontaires du public peuvent être transmises à partir du formulaire de déclaration en ligne, en composant le numéro sans frais ou en remplissant le formulaire à imprimer à transmettre par télécopie électronique ou par courrier à Santé Canada. Les rapports obligatoires sont soumis par les titulaires de licence afin de respecter leurs obligations réglementaires de déclaration des effets indésirables graves en vertu du Règlement sur le cannabis et sont soumis par télécopieur ou par courrier, à moins que l'entreprise ne soit enregistrée pour soumettre des rapports électroniques directement à la base de données de Canada Vigilance (un format particulier doit être respecté). Les plaintes relatives au cannabis ou les problèmes de qualité des produits peuvent également être transmis à l'aide du Formulaire de déclaration relative au cannabis de Santé Canada. Les incidents impliquant des accessoires de cannabis (par exemple, un problème ou une défaillance mécanique, physique ou électrique d'un accessoire de cannabis et les blessures associées) peuvent être signalés au moyen du Rapport d'incident concernant un produit de consommation - Formulaire à l'intention des consommateurs, disponible auprès de la Direction générale de la santé environnementale et de la sécurité des consommateurs.
Tous les cas d'effets indésirables liés au cannabis sont codés de la manière suivante :
- Les rapports de cas sont traduits en données électroniques dans la base de données de Canada Vigilance. Tous les événements médicaux individuels sont codés à l'aide du MedDRA, qui est élaboré, géré et mis à jour par la Conférence internationale sur l'harmonisation (ICH) pour fournir un ensemble international de termes médicaux normalisés en ce qui concerne les symptômes, les signes, les maladies, les syndromes et les diagnostics.
- Les rapports de cas concernant le cannabis en tant que substance dont le rôle est suspecté sont codés comme « cannabis sativa » pour ce qui est du principe actif, indépendamment du statut du produit de cannabis (légal, illégal, non précisé, indéterminé).
- Les rapports de cas concernant un produit de cannabis légal dans un rôle suspect (déterminé soit par le nom du produit, soit par le titulaire de licence) sont classés en fonction de l'utilisation prévue, soit un produit de cannabis utilisé à des fins médicales (« cannabis médical ») ou utilisé à des fins non médicales (« cannabis non médical »), selon les renseignements fournis dans le rapport. Utilisation de cannabis à des fins médicales : Comprend les rapports dans lesquels il est indiqué que le consommateur détient un document d'autorisation médicale; ou, un but ou une indication médicale ou thérapeutique déclarée, sans mention d'un document d'autorisation médicale. Si le rapport ne mentionne pas de raison d'utilisation, ne donne que des détails minimaux ou si l'utilisation prévue est à des fins non médicales, le rapport est classé dans la catégorie « cannabis non médical ».
- La gravité des rapports de cas est codée selon le critère de gravité sélectionné dans la déclaration : décès, danger pour la vie, admission à l'hôpital, séjour prolongé à l'hôpital, invalidité ou anomalie congénitale; grave – d'autres affections médicales importantes peuvent également être sélectionnées par le déclarant.
- Selon les lignes directrices internationales de pharmacovigilance (lignes directrices de l'ICHNote de bas de page 8), les affections importantes sur le plan médical peuvent également être considérées comme graves dans certaines circonstances et sont donc une option à choisir lors de la déclaration d'effets indésirables à Santé Canada et tout cas d'effets indésirables défini comme tel est examiné de manière approfondie. Toutefois, ces cas ne s'inscrivent techniquement pas dans la définition réglementaire d'un effet indésirable grave en vertu du Règlement sur le cannabis.
- La dominance des cannabinoïdes est une valeur attribuée par Santé Canada à chaque produit de cannabis suspect dans tous les cas, sur la base des renseignements disponibles. Dans le cas où les concentrations sont manquantes, en utilisant le nom du produit, les concentrations de cannabinoïdes sont vérifiées en fonction des renseignements en ligne sur le site Web du titulaire de licence, les sites Web des magasins provinciaux, ou d'autres ressources accessibles. Dans le cas où un produit ne peut être déterminé (par exemple, huile de cannabis inconnue par le titulaire de la licence) et que les concentrations de cannabinoïdes ne sont pas rapportées, la dominance des cannabinoïdes est alors attribuée comme « non évaluable ».
Les critères utilisés pour attribuer la dominance des cannabinoïdes sont les suivants :
- « Prédominance de THC » : rapport THC : CDB supérieur à 1,5:1
- « THC en concentration supérieure » : rapport THC : CDB entre 1,5:1 et 1,2:1
- « Équilibré » : rapport THC : CBD entre 1,2:1 et 1:1,2
- « CBD en concentration supérieure » : rapport THC : CDB compris entre 1:1,2 et 1:1,5
- « Prédominance de CBD » : rapport THC : CBD supérieur à 1:1,5
Santé Canada effectue une surveillance systématique, une détection, une évaluation et des activités connexes pour toutes les déclarations d'effets indésirables, ce qui comprend :
- L'examen de tous les nouveaux rapports de cas de cannabis pour vérifier qu'ils sont correctement codés selon le MedDRA, qu'ils sont classés comme cannabis à des fins médicales ou non médicales (classes légales) et que les noms des produits sont exacts.
- Les cas où une non-conformité est suspectée (c'est-à-dire présence visible de moisissure, goût métallique, odeur inhabituelle, etc.) sont transmis à la Direction de la conformité pour vérification.
- Les rapports non graves sont examinés par Santé Canada et ceux qui sont considérés comme des événements importants sur le plan médical sont inclus pour une évaluation plus approfondie (évaluation de la causalité).
- Tous les cas graves et importants sur le plan médical font l'objet d'une enquête et d'une évaluation plus approfondies :
- un suivi est effectué pour obtenir des renseignements supplémentaires sur les détails du produit ou les détails cliniques des cas afin de faciliter l'évaluation;
- une évaluation sommaire de la causalité est effectuée pour tous les cas graves et importants sur le plan médical de routine;
- tous les cas de décès ou mettant la vie en danger sont considérés comme des rapports prioritaires et font l'objet d'une évaluation individuelle complète de la causalité;
- l'évaluation de la causalité est principalement fondée sur le système de causalité de l'Organisation mondiale de la Santé (Centre de surveillance d'Uppsala de l'Organisation mondiale de la Santé)
- Tous les cas concernant de nouveaux effets indésirables ou inattendus présentant un intérêt font l'objet d'une évaluation préliminaire afin de déterminer s'ils doivent faire l'objet d'une évaluation plus approfondie (hiérarchisation des signaux).
- Une évaluation en série de cas (évaluation des signaux) est effectuée lorsqu'un groupe de cas ou de cas connexes présentant de nouveaux effets indésirables d'intérêt. Ces évaluations exhaustives comprennent la détermination de la plausibilité biologique sur la base de la littérature publiée ainsi que des données nationales et internationales sur les effets indésirables (VigiBase de l'OMS).
5.0 Signaler un effet indésirable impliquant un produit de cannabis
Les titulaires de licence doivent déclarer les effets indésirables graves, conformément au Règlement sur le cannabis, impliquant un produit de cannabis et sont encouragés à signaler volontairement les effets indésirables non graves impliquant un produit de cannabis. Vous trouverez de plus amples informations dans le Document d'orientation relatif à la déclaration des effets indésirables à l'intention des titulaires de licence.
Les consommateurs et les professionnels de la santé sont encouragés à signaler tous les effets indésirables lié à un produit de cannabis directement à la DGSCC. Les consommateurs et les professionnels de la santé peuvent également envoyer un rapport au titulaire de licence du produit de cannabis.
6.0 Nous joindre
Tout commentaire ou toute question sur ce rapport, y compris toute demande concernant les données utilisées à l'appui de ce rapport, doit être adressé à cannabis_oss-cannabis_bss@hc-sc.gc.ca.
Notes de bas de page
- Notes de bas de page 1
En vertu de la Loi sur le cannabis et ses règlements, les adultes sont autorisés à cultiver légalement jusqu'à quatre plantes de cannabis au maximum. Cela s'ajoute aux plantes qui peuvent être autorisées pour une production personnelle et désignée à des fins médicales. Toutefois, les règles entourant la culture à domicile à des fins non médicales peuvent varier en fonction des règles et règlements de chaque province ou territoire.
- Notes de bas de page 2
-
Conformément à l'article 248 du Règlement sur le cannabis, tous les effets indésirables, y compris les effets indésirables non graves, doivent être consignés dans un rapport de synthèse annuel par le titulaire de licence, dont Santé Canada peut demander la communication.
- Notes de bas de page 3
Organisation mondiale de la Santé (2012). Safety monitoring of medicinal products. Reporting system for the general public. Disponible ici : https://www.who.int/publications/i/item/9789241503198 (en anglais seulement).
- Notes de bas de page 4
Les catégories à prédominance de CBD, à concentration supérieure de CBD, à prédominance de THC, à concentration supérieure de THC et équilibrée ont été attribuées manuellement par Santé Canada. Consulter la section 4 : Avis aux lecteurs pour plus de détails pour plus de détails.
- Notes de bas de page 5
Par exemple, les allergies ou réactions d'hypersensibilité pourraient comprendre plusieurs SOC, y compris la SOC des affections de la peau et du tissu sous-cutané, la SOC des affections du système immunitaire, et peuvent en toucher d'autres comme la SOC des affections cardiaques, la SOC des investigations et la SOC des affections gastro-intestinales en cas d'anaphylaxie.
- Notes de bas de page 6
Par exemple, l'interaction médicamenteuse est classée dans la SOC « Troubles généraux et anomalies au site d'administration ».
- Notes de bas de page 7
Risque pour lequel on soupçonne un lien, sans qu'il y ait confirmation sur la base de renseignements actuels, et qui nécessite une surveillance continue.
- Notes de bas de page 8
https://www.ema.europa.eu/en/documents/scientific-guideline/international-conference-harmonisation-technical-requirements-registration-pharmaceuticals-human-use_en-12.pdf (en anglais seulement)
