InfoVigilance sur les produits de santé : septembre 2021
Télécharger en format PDF
(1.37 Mo, 10 pages)
Direction générale des produits de santé et des aliments
Direction des produits de santé commercialisés
Équipe de rédaction de l'InfoVigilance sur les produits de santé
ISSN : 2368-8033
Cat. : H167-1F-PDF
Pub. : 210001
Contenu
- Produits de santé mentionnés dans ce numéro
- Maladie à coronavirus (COVID-19)
- Autorisations et communications - médicaments et vaccins contre la COVID-19
- Récapitulatif mensuel
- Nouveaux renseignements
- Portée
- Liens utiles
- Des suggestions?
- Droit d'auteur
Produits de santé mentionnés dans ce numéro
Produits pharmaceutiques et biologiques
Comirnaty (Vaccin contre la COVID-19 de Pfizer-BioNTech)
Fluoroquinolones
Losartan
PMS-Progesterone
Spikevax (COVID-19 Vaccine Moderna)
Vaxzevria (Vaccin d'AstraZeneca contre la COVID-19)
Veklury (remdésivir)
Instruments médicaux
Gels et lotions à ultrasons fabriqués par Eco-Med Pharmaceuticals Inc.
Produits de santé naturels et sans ordonnance
Désinfectants pour les mains qui pourraient présenter des risques pour
la santé
Eco-Med Prevent + désinfectant pour les mains
Autres
Ivermectine
Produits de santé non autorisés
Maladie à coronavirus (COVID-19)
Pour obtenir les renseignements les plus à jour au sujet de la COVID-19, consultez le site Web Maladie à coronavirus (COVID-19) du gouvernement du Canada, Canada.ca/le-coronavirus. Le site Web comporte des sections dédiées aux professionnels de la santé et à l' industrie au sujet des produits de santé.
Le portail des vaccins et traitements pour la COVID-19 fournit des renseignements pour les consommateurs, pour les professionnels de la santé et pour les chercheurs sur les vaccins et traitements autorisés pour la COVID-19.
Pour l'information sur les effets secondaires suivant l'immunisation que certaines personnes ont signalés après avoir reçu un vaccin contre la COVID-19 au Canada, sur de nouveaux signaux concernant l'innocuité ou sur d'autres mises à jour concernant l'innocuité, consultez la page Web Sécurité des vaccins contre la COVID-19. Cette page est mise à jour de façon hebdomadaire.
Autorisations et communications - Médicaments et vaccins contre la COVID-19
Les communications récentes au sujet des vaccins et des traitements autorisés contre la COVID-19 sont incluses dans cette section.
Avis de conformité à l'égard des médicaments et vaccins contre la COVID-19
Le 16 septembre 2020, la ministre de la Santé a signé l'Arrêté d'urgence concernant l'importation, la vente et la publicité de drogues à utiliser relativement à la COVID-19 (l'arrêté d'urgence) pour accélérer l'autorisation des médicaments et vaccins contre la COVID-19. L'arrêté d'urgence a pris fin le 16 septembre 2021, et les produits autorisés en vertu de l'arrêté d'urgence peuvent maintenant être transférés vers le Règlement sur les aliments et drogues (RAD) après que les détenteurs d'une autorisation de mise sur le marché auront soumis une présentation de drogue nouvelle pour examen par Santé Canada. Le RAD a été modifié de manière à offrir la même souplesse que l'arrêté d'urgence (p.ex., présentations en continu, modalités de surveillance et de prépositionnement). Les autorisations délivrées au titre du RAD offriront aux entreprises des avantages supplémentaires, notamment en ce qui concerne la protection des données. Les nouveaux produits contre la COVID-19 peuvent faire l'objet d'une demande directe au titre du RAD.
Les vaccins contre la COVID-19 de Pfizer-BioNTech et de Moderna, qui avaient initialement été autorisés en vertu de l'arrêté d'urgence, ont maintenant reçu des avis de conformité (AC) en vertu du RAD. Ces autorisations ne reflètent aucun changement touchant le profil d'innocuité ou d'efficacité de ces produits ou leur mode d'administration; elles correspondent plutôt à une transition dans le mécanisme de réglementation qui vise à maintenir l'accès des Canadiens à ces produits pour se protéger et se faire traiter contre la COVID-19.
Changement du nom de marque des médicaments et vaccins contre la COVID-19
Le nom de marque des vaccins contre la COVID-19 ci-dessous a été modifié en septembre 2021 à la suite de la délivrance d'un AC ou d'une mise à jour de l'étiquetage autorisé en vertu de l'arrêté d'urgence :
Nouveau nom de marque |
Date de délivrance de l'AC |
Ancien nom de marque (conformément à l'autorisation délivrée en vertu de l'arrêté d'urgence) |
Date de l'autorisation délivrée en vertu de l'arrêté d'urgence |
Comirnaty |
16 septembre 2021 |
Vaccin contre la COVID-19 de Pfizer-BioNTech |
9 décembre 2020 |
Spikevax |
16 septembre 2021 |
COVID-19 Vaccine Moderna |
23 décembre 2020 |
Vaxzevria |
À venirFootnote * |
Vaccin d'AstraZeneca contre la COVID-19 |
26 février 2021 |
|
|||
Les monographies de produit canadiennes des vaccins et des traitements autorisés contre la COVID-19 sont accessibles par le portail des vaccins et traitements pour la COVID-19 ou par la Base de données sur les produits pharmaceutiques en ligne de Santé Canada.
Veklury (remdésivir)
Cet examen de l'innocuité a évalué le risque de bradycardie sinusale associée à Veklury (remdésivir). Au terme de son examen des renseignements disponibles, Santé Canada a conclu qu'il pourrait exister un lien. Le Ministère travaillera avec le fabricant du Veklury pour mettre à jour la monographie de produit canadienne afin d'y inclure le risque potentiel de bradycardie sinusale.
Résumé de l'examen de l'innocuité - Veklury (remdésivir)
Récapitulatif mensuel des renseignements sur l'innocuité des produits de santé
Voici une liste des avis concernant les produits de santé, des rappels de type I , ainsi que des résumés de l'examen de l'innocuité ou de la sûreté publiés en août 2021 par Santé Canada.
Pour des avis concernant les produits de santé en lien avec les vaccins et les traitements contre la COVID-19, veuillez consulter la section Autorisations et communications - Médicaments et vaccins contre la COVID-19.
Certains désinfectants pour les mains qui pourraient présenter des risques pour la santé
Santé Canada a avisé la population canadienne que certains désinfectants pour les mains ont été retirés du marché parce qu'ils contenaient des ingrédients qui ne sont pas autorisés par Santé Canada, parce qu'ils n'étaient pas correctement étiquetés, n'étaient pas autorisés, ou parce que des renseignements importants ne figuraient pas sur l'étiquette.
Avis - Certains désinfectants pour les mains qui pourraient présenter des risques pour la santé
Fluoroquinolones
Cet examen de l'innocuité a évalué le risque de régurgitation valvulaire associée aux fluoroquinolones inhalées et systémiques (produits contenant de la ciprofloxacine, de la lévofloxacine, de la moxifloxacine et de la norfloxacine). L'examen des renseignements disponibles mené par Santé Canada n'a pas permis d'établir un lien. Santé Canada continuera de surveiller les données d'innocuité concernant les fluoroquinolones.
Résumé de l'examen de l'innocuité - Fluoroquinolones
Ivermectine
Santé Canada a reçu des signalements préoccupants concernant l'utilisation d'ivermectine à usage vétérinaire pour prévenir ou traiter la COVID-19. Santé Canada a avisé la population canadienne de ne pas prendre d'ivermectine (pour usage vétérinaire ou humain) pour la prévention ou le traitement de la COVID-19.
Losartan
Teva Canada Ltd. et Sivem Pharmaceuticals ULC ont rappelé 7 lots, et Sandoz Canada inc. et Sanis Health inc. ont rappelé tous les lots de comprimés de losartan sur prescription, en concentrations de 25 mg, de 50 mg et de 100 mg, puisque des examens ont décelé une impureté azide supérieure à la limite acceptable.
PMS-Progesterone
Pharmascience Inc. a rappelé un lot (numéro 1318593, expiration 10/2022) de capsules PMS-Progesterone à 100 mg parce que les bouteilles peuvent contenir des capsules de progestérone en gélatine Akorn à 100 mg plutôt que les capsules en gélatine PMS-Progesterone à 100 mg voulues ou en plus de ces dernières. Les capsules Akorn contiennent de l'huile d'arachide, un ingrédient qui ne figure pas sur l'étiquette des capsules de PMS-Progesterone à 100 mg.
Produits de santé fabriqués par Eco-Med Pharmaceuticals Inc.
Santé Canada a conseillé aux Canadiens de cesser d'utiliser et de jeter tous les produits fabriqués par Eco-Med Pharmaceuticals Inc. (gels à ultrasons, lotions de transmission et de massage, désinfectants pour les mains et antiseptiques de premiers soins) en raison d'une contamination bactérienne possible par Burkholderia stabilis. Santé Canada a aussi communiqué cette information aux professionnels de la santé.
Avis - Produits de santé fabriqués par Eco-Med Pharmaceuticals Inc.
Communication des risques aux professionnels de la santé - Gels et
lotions à ultrasons fabriqués par Eco-Med Pharmaceuticals Inc.
Rappel d'instruments médicaux - EcoGel 200 Ultrasound Gel - MediChoice
(M500812)
Retrait de marché d'une drogue - Eco-Med Prevent + désinfectant pour
les mains
Produits de santé non autorisés
Santé Canda a avisé les Canadiens que divers produits de santé non autorisés qui pourraient poser un risque grave pour la santé ont été vendus dans des points de vente au détail au Canada ou en ligne.
Avis - Divers produits de santé non homologués
Nouveaux renseignements sur l'innocuité des produits de santé
Le sujet suivant a été sélectionné dans le but d'accroître la sensibilisation et, dans certains cas, encourager la déclaration d'effets indésirables.
Effets indésirables des produits de santé - rapport annuel 2020
Introduction
Les systèmes de déclaration spontanée et proactive après la mise en marché
aident à cerner et à analyser les nouveaux renseignements sur l'innocuité
des produits de santé, de sorte que les mesures appropriées soient prises
pour réduire au minimum les risques pour la santé humaine. Au Canada, les
effets indésirables (EI) et les incidents liés aux instruments médicaux
(IIM) soupçonnés d'être associés à l'utilisation de produits de santé
peuvent être signalés au Programme Canada Vigilance (PCV). Le présent article résume les renseignements reçus par le PCV en
2020 sur les cas d'EI survenus au pays qui ont été déclarés en lien avec
des produits pharmaceutiques, des produits de santé naturels, des
médicaments biologiques Note de bas de page *, des produits radiopharmaceutiques, des désinfectants, des agents
d'assainissement aux propriétés désinfectantes, et des produits du
cannabis; ces renseignements ont été versés dans la base de données en ligne des effets indésirables de Canada Vigilance. Bien que les cas d'EI survenus à l'étranger soient inclus dans la base de
données interne du PCV, ils ne sont pas discutés dans le présent article.
Cas et déclarations d'effets indésirables survenus au pays
En 2020, Santé Canada a reçu 186 099 déclarations d'EI après la mise en
marché survenus au pays. Ces déclarations représentaient 79 345 cas d'EI.
Un cas regroupe l'ensemble des renseignements décrivant le ou les EI subis
par un patient à un moment donné qui sont soupçonnés d'être associés à
l'utilisation d'un ou de plusieurs produits de santé; par conséquent, un
cas peut englober une déclaration d'EI initiale et plusieurs déclarations
de suivi qui fournissent plus d'information sur le ou les EI en question.
Des cas peuvent être dupliqués si des déclarations d'EI concernant un même
EI sont reçues de différentes sources (p. ex., professionnels de la santé,
consommateurs, hôpitaux, fabricants). Le tableau 1 présente les cas d'EI
survenus au pays, signalés en 2020, par type de produit.
Type de produit |
Nbre (%) de déclarations |
Produits pharmaceutiques |
46 567 (58,7) |
Produits biologiquesFootnote * |
31 111 (39,2) |
Produits de santé naturels |
488 (0,6) |
Produits radiopharmaceutiques |
466 (0,6) |
Cannabis thérapeutique |
121 (0,2) |
Cannabis non thérapeutique |
40 (0,0) |
AutresFootnote † |
552 (0,7) |
Total |
79 345 (100) |
Notes de bas de page
| |
Au Canada, les détenteurs d'une autorisation de mise sur le marché (DAMM) et les hôpitaux doivent transmettre au PCV des déclarations d'EI conformément aux exigences de la Loi sur les aliments et drogues et de ses règlements d'application. Dans le cas d'EI graves survenus au Canada, les DAMM doivent faire parvenir une déclaration dans les 15 jours suivant la date à laquelle ils ont été informés de l'incident. Les hôpitaux doivent soumettre, dans les 30 jours suivant la consignation, toutes les déclarations d'EI graves liés à un produit thérapeutique qui sont survenus dans leur établissement. Les membres de la collectivité (consommateurs, patients et professionnels de la santé ne pratiquant pas dans les hôpitaux) peuvent soumettre de façon volontaire des déclarations d'EI en tout temps.
En 2020, 86,8 % de tous les cas d'EI survenus au pays qui ont été déclarés au PCV l'ont été par des DAMM; 6,9 % ont été déclarés par des hôpitaux (figure 1). Les autres cas ont été en grande partie déclarés directement par des membres de la collectivité (6,1 %). La plupart des cas d'EI survenus au pays déclarés directement à Santé Canada ou par l'entremise d'un DAMM provenaient des professionnels de la santé, notamment des médecins, des pharmaciens, des infirmières ou des dentistes (figure 2).
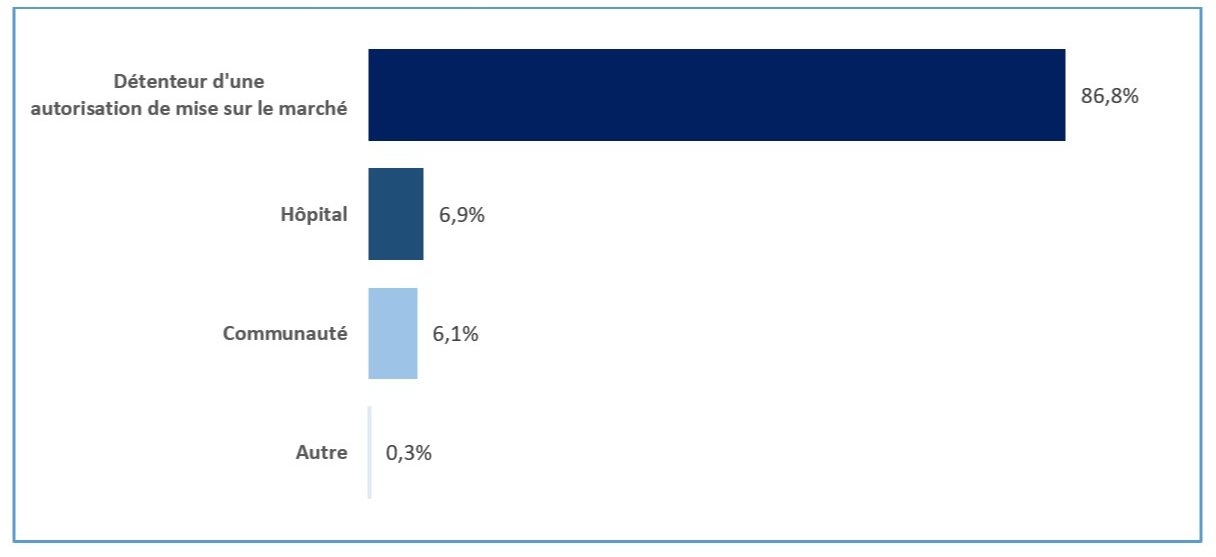
Figure 1 - Équivalent textuel
Source |
Pourcentage de nombre de cas |
Détenteurs d'une autorisation de mise en marché |
86,8% |
Hôpital |
6,9% |
Communauté |
6,1% |
Autre |
0,3% |
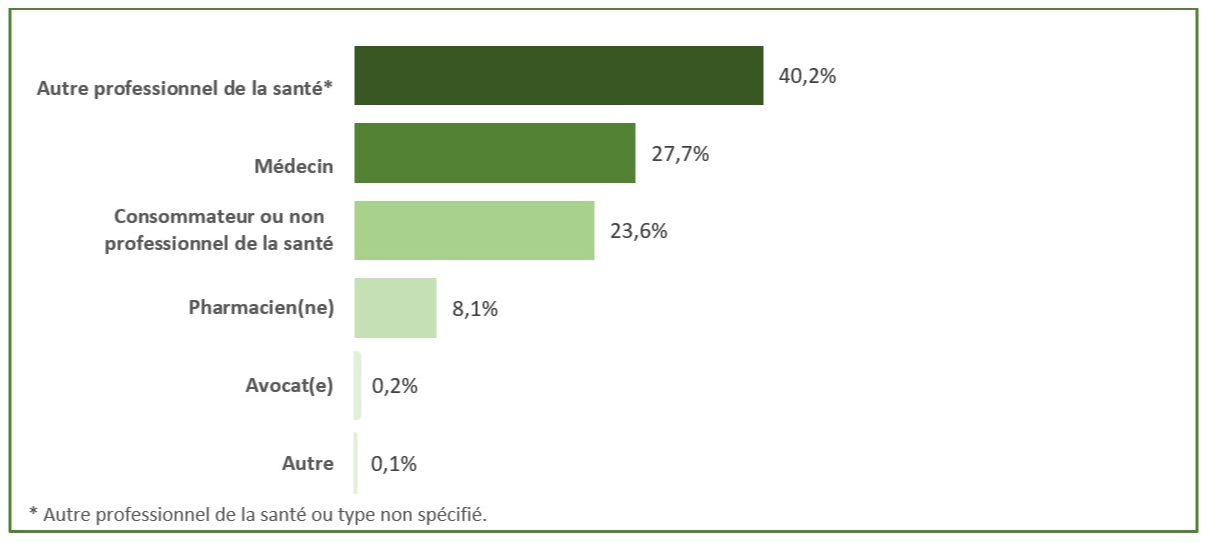
Figure 2 - Équivalent textuel
Type de déclarant |
Pourcentage de nombre de cas |
Autre professionnel de la santéNote de bas de page * |
40,2% |
Médecin |
27,7% |
Consommateur ou autre non-professionnel de la santé |
23,6% |
Pharmacien(ne) |
8,1% |
Avocat(e) |
0,2% |
Autre |
0,1% |
Notes de bas de page
|
|
Répartition selon le sexe et l'âge
La répartition des 79 345 cas par sexe allait comme suit : 58,5 % de sexe
féminin, 37,1 % de sexe masculin et 4,3 % de sexe inconnu ou non déclaré.
Elle correspond aux résultats observés à l'échelle mondiale Note de bas de page †. La répartition par tranche d'âge était de 3,9 % chez les enfants (< 19
ans), 51,6 % chez les adultes (19 à 64 ans) et 24,6 % chez les aînés (≥ 65
ans); l'âge était inconnu ou n'avait pas été déclaré dans 19,9 % des cas.
Produits soupçonnés et effets indésirables
Le tableau 2 présente les 10 groupes de produits soupçonnés les plus fréquemment mis en cause dans
les cas d'EI survenus au pays . Ces groupes correspondent aux critères du Système de classification anatomique, thérapeutique et chimique (ATC)
de l'Organisation mondiale de la santé.
Produit de santé (groupe ATC) |
Nbre (%) de déclarationsNote de bas de page † |
Immunosuppresseurs (L04) |
49 119 (31,9) |
Antinéoplasiques (L01) |
21 613 (14,0) |
Médicaments pour les maladies obstructives des voies respiratoires (R03) |
10 829 (7,0) |
Analgésiques (N02) |
7 591 (4,9) |
PsycholeptiquesNote de bas de page ‡ (N05) |
5 500 (3,6) |
Antiépileptiques (N03) |
4 325 (2,8) |
Corticoïdes à usage systémique (H02) |
3 869 (2,5) |
Antidiarrhéiques, anti-inflammatoires intestinaux/agents anti-infectieux (A07) |
3 560 (2,3) |
Antibactériens à usage systémique (J01) |
2 979 (1,9) |
Anti inflammatoires et antirhumatismaux (M01) |
2 723 (1,8) |
| |
Le tableau 3 présente les 10 EI survenus au pays les plus fréquemment signalés au PCV d'après les codes de classe par système et par organe (SOC) . Les EI sont codés selon la terminologie du Dictionnaire médical des affaires réglementaires (MedDRA). Les EI les plus couramment déclarés ont été les troubles généraux et les anomalies au point d'administration, qui comprennent les troubles touchant plusieurs systèmes ou sites de l'organisme (p. ex., médicament inefficace, fatigue, fièvre, œdème, douleur, réactions au point d'administration). Figuraient en deuxième lieu, les troubles gastro-intestinaux.
Classe par système et par organe |
Nbre (%) de déclarationsNote de bas de page † |
Troubles généraux et anomalies au site d'administration |
77 209 (22,7) |
Affections gastro-intestinales |
32 661 (9,6) |
Lésions, intoxications et complications d'interventions |
30 268 (8,9) |
Investigations |
27 926 (8,2) |
Affections musculosquelettiques et du tissu conjonctif |
25 904 (7,6) |
Affections respiratoires, thoraciques et médiastinales |
22 326 (6,6) |
Infections et infestations |
21 896 (6,5) |
Affections du système nerveux |
20 913 (6,2) |
Affections de la peau et du tissu sous-cutané |
16 377 (4,8) |
Affections psychiatriques |
12 209 (3,6) |
|
|
Raison de la gravité
Des 79 345 cas d'EI, 69,6 % ont été jugés graves Note de bas de page ‡. Plusieurs raisons de la gravité peuvent être déclarées pour un même cas.
En 2020, 22,5 % des cas d'EI indiquaient qu'une hospitalisation avait été
exigée, 2,8 % décrivaient un état présentant un danger de mort, et 6,8 %
indiquaient que le patient était décédé.
Investigations sur les effets indésirables déclarés
Il est difficile de comparer les risques associés aux produits de santé
uniquement en fonction du volume de déclarations soumises. Plusieurs
facteurs peuvent influer sur les déclarations d'EI, tels que les risques
connus d'un produit, le temps écoulé depuis sa mise en marché, le nombre
d'utilisations, la publicité concernant un EI, les mesures réglementaires
prises pour réduire les risques, et/ou les méthodes de collecte de données.
Par exemple, les EI rares et graves peuvent être déclarés plus souvent dans
les systèmes organisés de collecte de données Note de bas de page § que dans les systèmes de déclaration volontaire, ce qui peut avoir une
incidence sur la tendance des déclarations. En général, les évènements
indésirables sont sous-déclarés dans les systèmes de déclaration spontanée
comme le PCV.
Les déclarations d'EI sont examinées dans le cadre d'une stratégie de surveillance de routine. Lorsqu'un EI déclaré est connu et inclus dans la monographie du produit, il n'est pas considéré comme un nouveau signal, à moins d'un changement sur le plan de la fréquence ou de gravité. Les EI signalés après la mise en marché peuvent être attribués à un large éventail de facteurs, notamment des effets pharmacologiques du produit qui étaient jusque-là inconnus, des effets idiosyncrasiques, des interactions médicamenteuses (p. ex., médicament-médicament, médicament-maladie, médicament-produit de santé naturel), ou des facteurs liés à certains groupes de patients, des facteurs propres au patient (p. ex., facteurs pharmacogénomiques), des incidents médicamenteux et d'autres facteurs qui pourraient avoir été trop rares pour être reconnus dans les essais cliniques.
Les déclarations d'EI, ainsi que d'autres sources de renseignements provenant de sources nationales et internationales, aident à l'identification et l'analyse de nouveaux renseignements sur l'innocuité, et orientent les décisions prises par Santé Canada concernant les mesures à prendre. Par exemple, une association causale entre le produit et l'EI peut inciter une action de Santé Canada. La même chose s'applique si de nouveaux risques sont déterminés à partir d'un groupe d'EI semblable, ou à partir de déclarations d'EI ayant révélé des lacunes en matière d'étiquetage ou des problèmes sur le plan de la qualité du produit.
En 2020, les renseignements reliés aux médicaments reçus et évalués par Santé Canada ont abouti à 1 034 mesures, lesquelles comprenaient la communication de nouveaux renseignements sur l'innocuité aux Canadiens et aux professionnels de la santé, la recommandation de modifications à apporter à l'étiquetage, ou le retrait de médicaments du marché. Les nouveaux renseignements importants sur l'innocuité sont communiqués aux professionnels de la santé et au public canadiens par l'entremise de la base de données des rappels et des avis de sécurité sur le site Web Canadiens en santé. Les nouveaux renseignements sur l'innocuité sont aussi diffusés par le système de notification par courriel Avis électronique MedEffetMC. De plus, Santé Canada a publié 20 résumés de ses examens de l'innocuité, lesquels décrivent les observations de Santé Canada et les mesures de gestion des risques visant les problèmes d'innocuité potentiels.
Effets indésirables survenus au pays à la suite de l'utilisation de
produits de santé contre la COVID-19, y compris les vaccins
En 2020, Santé Canada a reçu 7 cas d'EI liés à des produits autorisés et non autorisés
pour le traitement de la COVID-19 (c.-à-d. le remdésivir, autorisé le 27
juillet 2020, et les médicaments utilisés pour une indication ne figurant
pas sur leur étiquette, en l'occurrence le traitement de la COVID-19,
notamment le sulfate d'hydroxychloroquine, le tocilizumab, les
immunoglobulines, l'azithromycine et la ceftriaxone, ainsi que la
méthylprednisolone et la prednisone). Santé Canada a aussi reçu 2 cas d'EI
liés à un vaccin contre la COVID-19 (Vaccin contre la COVID-19 de
Pfizer-BioNTech, autorisé le 9 décembre 2020). Un résumé à jour des EI
déclarés à la suite de la vaccination contre la COVID-19 au Canada, y
compris de ceux déclarés au Système canadien de surveillance des effets
secondaires suivant l'immunisation (SCSESSI) géré par l'Agence de la santé
publique du Canada, peut être consulté en ligne.
Conclusion
Chaque année, le PCV reçoit des milliers de déclarations qui aident à mieux comprendre l'innocuité des produits de santé commercialisés. Santé Canada souhaite remercier tous ceux qui ont contribué à fournir des renseignements et encourage le soutien continu à la surveillance post-commercialisation par la déclaration des EI et des IIM. Tous les EI et les IIM soupçonnés d'être associés à l'utilisation de produits de santé devraient être déclarés au PCV. Chaque déclaration compte, et ensemble elles racontent une histoire.
Portée
Cette publication mensuelle s'adresse principalement aux professionnels de la santé et contient des informations sur les produits pharmaceutiques, biologiques, les matériels médicaux et les produits de santé naturels. Elle fournit un résumé des informations clés concernant l'innocuité des produits de santé qui ont été publiés au cours du mois précédent par Santé Canada, ainsi qu'une sélection de nouveaux renseignements en matière d'innocuité sur les produits de santé, pour en accroître la sensibilisation. Les nouvelles informations contenues dans ce numéro ne sont pas exhaustives, mais représentent plutôt une sélection de problèmes d'innocuité cliniquement pertinents, justifiant une dissémination améliorée.
Pour signaler des effets indésirables
Programme Canada Vigilance
Téléphone : 1-866-234-2345
Télécopieur ou courrier : formulaire disponible sur MedEffet Canada
Des renseignements sur la marche à suivre pour déclarer un effet indésirable à Santé Canada sont publiés à la page Déclaration des effets indésirables ou des incidents liés aux matériels médicaux .
Liens utiles
- MedEffetMC Canada
- Base de données sur les rappels et les avis de sécurité
- Nouveaux examens de l'innocuité ou de la sûreté et de l'efficacité
- Base de données en ligne des effets indésirables de Canada Vigilance
- Base de données sur les produits pharmaceutiques
- Liste des instruments médicaux homologués
- Base de données des produits de santé naturels homologués
- Registre des médicaments et des produits de santé
- Pénuries de médicaments Canada
- Mettons fin au marketing illégal des médicaments et des instruments médicaux
- Liste des drogues destinées aux importations et aux ventes exceptionnelles
- Autorisation de médicament et de vaccin contre la COVID-19 : Liste des drogues et vaccins autorisés et des drogues à indication supplémentaire
- Effets secondaires signalés après la vaccination
Des suggestions?
Vos commentaires sont importants pour nous. Dites-nous ce que vous pensez en nous contactant à infowatch-infovigilance@hc-sc.gc.ca
Santé Canada
Direction des produits de santé commercialisés
Localisateur 1906C
Ottawa (Ontario) K1A 0K9
Téléphone : 613-954-6522
Télécopieur : 613-952-7738
Droit d'auteur
©2021 Sa Majesté la Reine du Chef du Canada. Cette publication peut être reproduite sans autorisation à condition d'en indiquer la source en entier. Il est interdit de l'utiliser à des fins publicitaires. Santé Canada n'accepte pas la responsabilité de l'exactitude ou de l'authenticité des renseignements fournis dans les notifications.
On ne peut que soupçonner la plupart des effets indésirables (EI) des produits de santé à l'égard desquels on ne peut établir de lien prouvé de cause à effet. Les notifications spontanées d'EI ne peuvent servir pour déterminer l'incidence des EI, étant donné que les EI ne sont pas suffisamment signalés et l'étendue d'exposition des patients est inconnue.
En raison des contraintes de temps concernant la production de cette publication, les informations publiées peuvent ne pas refléter les informations les plus récentes.
Notes de bas de page
- Note de bas de page *
-
Les produits biologiques comprennent des produits biotechnologiques; des vaccins; des produits de fractionnement du sang; du sang et des composants sanguins humains; des cellules, des tissus et des organes humains; et des spermatozoïdes et des ovules.
- Note de bas de page †
-
Watson S, Caster O, Rochon PA, et al. Reported adverse drug reactions in women and men: Aggregated evidence from globally collected individual case reports during half a century. EClinicalMedicine 2019;17, 100188, ISSN 2589-5370. https://doi.org/10.1016/j.eclinm.2019.10.001.
- Note de bas de page ‡
-
La Loi sur les aliments et drogues et ses règlements d'application définissent une « réaction indésirable grave » comme suit : « Réaction nocive et non intentionnelle à une drogue qui est provoquée par l'administration de toute dose de celle-ci, qui nécessite ou prolonge l'hospitalisation, entraîne une malformation congénitale ou une invalidité ou incapacité persistante ou importante, met la vie en danger ou entraîne la mort. » D'autres situations peuvent aussi être désignées comme graves, « par exemple lorsque surviennent d'importants évènements médicaux qui peuvent ne pas présenter un danger de mort immédiat, provoquer la mort ou nécessiter l'hospitalisation, mais qui peuvent compromettre la santé du patient ou nécessiter une intervention en vue de prévenir l'une des conséquences énumérées dans la définition des Règlements. »
- Note de bas de page §
-
Les systèmes organisés de collecte de données englobent les registres de patients, les enquêtes, et les programmes de soutien des patients et de prises en charge des maladies.
