InfoVigilance sur les produits de santé : octobre 2023
Télécharger le format de rechange
(359 Ko, 4 pages)
Direction générale des produits de santé et des aliments
Direction des produits de santé commercialisés
Équipe de rédaction de l'InfoVigilance sur les produits de santé
Publiée : 2023-09-27
Pub. : 230001
Cat. : H167-1F-PDF
ISSN : 2368-8033
Contenu
- Produits de santé mentionnés dans ce numéro
- Récapitulatif mensuel des renseignements sur l'innocuité des produits de santé
- Nouveaux renseignements sur l'innocuité des produits de santé
- Portée
- Pour signaler des effets indésirables
- Liens utiles
- Des suggestions?
Produits de santé mentionnés dans ce numéro
Produits pharmaceutiques et biologiques
- Allergenic extract allergène non-pollinique
- Fosamax (alendronate monosodique)
- Fosavance (alendronate monosodique et cholécalciférol)
- Produits à base de lévothyroxine sodique
- Sulfate d'atropine injectable USP
Instruments médicaux
Produits de santé naturels et sans ordonnance
Autres
Récapitulatif mensuel des renseignements sur l'innocuité des produits de santé
Voici une liste des avis concernant les produits de santé, des rappels de type I, ainsi que des résumés de l'examen de l'innocuité ou de la sûreté publiés en septembre 2023 par Santé Canada.
Allergenic extract allergène non-pollinique
Certains lots d'Allergenic extract allergène non-pollinique (noix de pécan) ont été rappelés car les lots affectés peuvent donner un résultat faussement négatif pour le test cutané (allergie aux noix de pécan).
- Rappel type 1 : Allergenic extract allergène non-pollinique, 2023-09-07
- Rappel type 1 : Allergenic extract allergène non-pollinique, 2023-09-29
Produits de santé non homologués
Santé Canda a avisé les Canadiens que divers produits de santé non autorisés qui pourraient poser un risque grave pour la santé ont été vendus dans des points de vente au détail au Canada ou en ligne.
- Avis : Produits de santé non homologués saisis dans un magasin Tokyo Beauty and Healthcare à Richmond (Colombie-Britannique)
- Avis : Produits non homologués pour améliorer la performance sexuelle
- Avis : Produits non homologués pour éclaircir la peau et traiter des affections cutanées
Sulfate d'atropine injectable USP
Un lot de Sulfate d'atropine injectable USP a été rappelé car le lot concerné peut contenir des particules de verre.
Nouveaux renseignements sur l'innocuité des produits de santé
Les sujets suivants ont été sélectionnés dans le but d'accroître la sensibilisation et d'encourager la déclaration d'effets indésirables.
Innocuité en bref
Utilisation de probiotiques chez les enfants prématurés
Au Canada, les produits de santé naturels (PSN) contenant des probiotiques sont autorisés en vertu du Règlement sur les produits de santé naturels. Ces produits, qui contiennent des micro-organismes vivants (bactéries et/ou levures à souche unique et/ou à souches multiples), sont indiqués pour aider à soutenir la santé intestinale/gastro-intestinale et à favoriser une bonne flore intestinale chez les personnes auxquelles ils sont destinésNote de bas de page 1. Les PSN contenant des probiotiques sont contre-indiqués pour certains groupes vulnérables, notamment les personnes immunodéprimées, en raison du risque d'infection (p. ex., bactériémie, fongémie, septicémie)Note de bas de page 1,Note de bas de page 2,Note de bas de page 3.
Les détenteurs d'une autorisation de mise en marché (DAMM) de PSN contenant des probiotiques doivent respecter des normes de qualité spécifiques (comme énoncé dans la monographie sur les probiotiques) au moment de l'autorisation. Ces normes de qualité doivent continuer d'être maintenues par la suite par les DAMM ou les fabricants de ces produits. Ces normes portent sur l'identité des souches, les impuretés microbiennes, les contaminants chimiques, la résistance aux antibiotiques, la production de facteurs de virulence, et l'activité toxinogèneNote de bas de page 1,Note de bas de page 4. Les normes de qualité établies par Santé Canada en ce qui concerne les PSN contenant des probiotiques ont été spécifiquement adaptées pour les indications autorisées et les personnes pour lesquelles ils sont destinés.
En date d'octobre 2023, Santé Canada a reçu 5 déclarations d'effets indésirables graves (dont 3 décès) survenus au Canada chez des enfants prématurés ayant reçu un PSN contenant des probiotiques à l'hôpital pour prévenir l'entérocolite nécrosante. Cette pratique est considérée comme non conforme à l'étiquette, car les PSN contenant des probiotiques ne sont pas autorisés chez les enfants prématurés. Des septicémies et des bactériémies ont été constatées chez les 3 nouveau-nés décédés. Suite à une évaluation menée par Santé Canada, un lien de causalité n'a pu être établi entre l'exposition aux probiotiques et les effets indésirables pour les 5 cas déclarés.
Bien que les utilisations non conformes à l'étiquette de produits de santé naturels, y compris ceux contenant des probiotiques, relèvent de la pratique de la médecine, Santé Canada souhaite rappeler aux professionnels de la santé qu'aucun PSN contenant des probiotiques n'est autorisé à l'heure actuelle pour une utilisation chez les enfants prématurés ni pour la prévention de l'entérocolite nécrosante. L'innocuité et l'efficacité des probiotiques pour cette sous-population et pour cette indication n'ont pas été démontrées par des éléments de preuve soumises à et examinées par Santé Canada. Le ministère communique ces renseignements pour aider les professionnels de la santé à peser les risques et les avantages au moment de choisir les traitements qui conviennent le mieux à leurs patients.
Les professionnels de la santé sont encouragés à signaler au Programme Canada Vigilance tout effet indésirable qui pourrait être associé à l'utilisation de probiotiques, y compris, sans s'y limiter, les effets indésirables associés aux utilisations non conformes à l'étiquette chez des enfants prématurés.
Santé Canada continuera de surveiller l'innocuité des probiotiques, comme il le fait à l'égard de tous les produits de santé sur le marché canadien, afin de cerner et d'évaluer les dangers possibles. Santé Canada prendra rapidement les mesures qui s'imposent si de nouveaux risques pour la santé sont portés à son attention.
Systèmes de gestion de l'insuline Omnipod et risque de détachement du Pod et de déformation de l'aiguille
Les systèmes de gestion de l'insuline Omnipod et Omnipod DASH (Omnipod) sont utilisés pour l'administration d'insuline par voie sous-cutanée à des débits fixes ou variables pour assurer la maîtrise de la glycémie chez les personnes atteintes de diabète sucré qui nécessitent de l'insuline. Ces systèmes sont autorisés au Canada en tant qu'instruments médicaux de classe III.
Omnipod comporte 2 parties :
- le « Pod », à savoir un dispositif jetable à usage unique qui est rempli d'insuline et qui est placé directement sur le corps pendant une période allant jusqu'à 72 heures (3 jours) pour administrer un maximum de 200 unités d'insuline;
- le « Gestionnaire personnel de diabète » (GPD), à savoir un système de commande à distance qui permet de gérer l'administration d'insuline par le Pod.
Depuis que Santé Canada a effectué l'examen du système Omnipod en 2018, le Ministère a continué de surveiller les déclarations d'événements indésirables associés au système. Grâce à cette surveillance continue, Santé Canada a enquêté sur de nouvelles plaintes concernant le décollement du Pod ou la déformation de l'aiguille du Pod lors de l'insertion de celle-ci dans la peau.
L'enquête de Santé Canada a révélé que ces risques sont souvent associés à une mauvaise utilisation du Pod, notamment le port du Pod pendant une période plus longue que celle qui est recommandée ou l'insertion du Pod dans un site de perfusion non recommandé. Bien que l'étiquette du dispositif fournisse des instructions détaillées sur l'emplacement, l'insertion, le remplacement et l'entretien du produit, y compris les mises en garde et les précautions visant à aider à atténuer les risques, ces renseignements peuvent être négligés par les patients. Le manque de compréhension des exigences à respecter pour utiliser le dispositif de manière sûre et adéquate peut entraîner une interruption de l'administration de l'insuline au patient, ce qui pourrait conduire à des événements indésirables, notamment une hyperglycémie, une acidocétose diabétique ou un coma diabétique.
Reconnaissant le rôle important des fournisseurs de soins de santé dans l'accompagnement des patients qui doivent apprendre à utiliser des nouveaux systèmes de gestion du diabète, Santé Canada aimerait mettre en évidence certains aspects des instructions du fabricant pour faciliter la prestation de conseils aux patients.
Le fabricant recommande aux patients de faire ce qui suit :
- Choisissez un site adéquat pour l'application du Pod sur le corps. Les sites idéaux ont une couche de tissu adipeux et sont faciles d'accès et bien visibles, par exemple, l'abdomen, la hanche, l'arrière du haut du bras, le haut de la cuisse ou le bas du dos. Éviter les sites où une ceinture ou une bande élastique à la taille pourrait frotter contre le Pod ou le déloger.
- Changer de site chaque fois qu'un nouveau Pod est appliqué. Le nouveau site de perfusion doit se situer à au moins 2,5 cm (un pouce) du site précédent.
- Respecter les instructions étape par étape du fabricant lors de l'application et de la vérification du Pod.
- Vérifier souvent que le Pod et la canule souple sont fixés fermement et bien en place. Une canule lâche ou détachée peut entraîner une interruption de l'administration d'insuline.
- Remplacer le Pod au moins toutes les 48 à 72 heures (2 à 3 jours) ou après l'administration de 200 unités d'insuline, voire plus souvent selon les directives du fournisseur de soins de santé.
Santé Canada continuera de surveiller l'innocuité du système Omnipod et prendra les mesures qui s'imposent si de nouveaux renseignements en matière de risques pour la santé sont portés à son attention. Les professionnels de la santé sont encouragés à signaler à Santé Canada tout cas d'effet indésirable soupçonné d'être associé à l'utilisation d'Omnipod.
Mises à jour de monographies de produit
Les mises à jour suivantes concernant l'innocuité, qui ont récemment été apportées aux monographies de produits canadiennes, ont été sélectionnées afin d'en accroître la sensibilisation. Une liste complète des mises à jour de l'étiquetage pour les produits pharmaceutiques se trouve sur la page L'innocuité des monographies de produits pour les médicaments innovateurs de Santé Canada. Les monographies de produits canadiennes sont disponibles dans la Base de données sur les produits pharmaceutiques de Santé Canada.
Fosamax (alendronate monosodique) et Fosavance (alendronate monosodique et cholécalciférol)
Les sections Mises en garde et précautions, Effets indésirables (Effets indésirables observés après la mise en marché) et Renseignement sur le médicament pour le patient des monographies de produits canadiennes pour Fosamax et Fosavance ont été mises à jour avec de l'information concernant le risque de fractures liées à des traumatismes de faible énergie observées dans les os autres que le fémur. Bien que des fractures fémorales atypiques aient déjà été signalées dans les monographies de produits, de nouvelles données post-commercialisation montrent que des fractures de présentation atypique surviennent dans los os autres que le fémur.
Messages clés à l'intention des professionnels de la santé:Note de bas de page 5,Note de bas de page 6
- Des fractures sous-trochantériennes, de l'extrémité supérieure de la diaphyse fémorale et d'autres os liées à des traumatismes de faible énergie ont été rapportées chez certains patients qui prenaient de l'alendronate depuis une longue période (dans la plupart des cas, les fractures sont survenues 18 mois à 10 ans après l'instauration du traitement).
- Dans certains cas, il s'agissait de fractures de fatigue (dont certaines ont été signalées comme des fractures par insuffisance) qui sont survenues en l'absence de traumatisme apparent ou qui ont été causées par une force externe légère.
Produits à base de lévothyroxine sodique
Les sections Mises en garde et précautions, Interactions médicamenteuses, et Renseignement sur le médicament à l'intention du patient des monographies de produits canadiennes de produits à base de lévothyroxine sodiqueNote de bas de page * ont été ou seront mises à jour avec le risque d'interférence de la biotine avec les tests immunologiques de la fonction thyroïdienne basés sur la biotine/streptavidine.
Message clés pour les professionnels de la santé:Note de bas de page 7,Note de bas de page 8,Note de bas de page 9
- La biotine sérique peut interférer avec les dosages immunologiques de la fonction thyroïdienne à base d'interaction biotine/streptavidine, entraînant des résultats d'épreuves faussement réduits ou faussement élevés. Le risque d'interférence augmente avec les doses plus élevées de biotine.
- Lorsque possible, on recommande aux patients de s'abstenir de prendre des suppléments de biotine pendant au moins 2 jours avant le prélèvement d'échantillons.
- Lors de l'interprétation des résultats des épreuves de laboratoire, on doit tenir compte de la possibilité d'interférence par la biotine, surtout en l'absence de concordance avec la présentation clinique observée.
Résumé de l'innocuité des vaccins
Santé Canada et l'Agence de la santé publique du Canada (ASPC) partagent la responsabilité de la surveillance de l'innocuité des vaccins au Canada.
Les détenteurs d'une autorisation de mise en marché sont tenus de déclarer les effets secondaires suivant l'immunisation (ESSI) considérés graves au Programme Canada Vigilance de Santé Canada. Le Programme Canada Vigilance reçoit également des déclarations volontaires des professionnels de la santé et des consommateurs.
Même si les hôpitaux doivent déclarer les effets indésirables graves d'un médicament documentés dans leur établissement, ils ne sont pas tenus de le faire dans le cas d'un vaccin s'ils ont transmis une déclaration d'ESSI à leur bureau local de santé publique. Ces déclarations sont transmises par les autorités de santé publique provinciales et territoriales au Système canadien de surveillance des effets secondaires suivant l'immunisation (SCSESSI) de l'ASPC.
Le présent résumé de l'innocuité des vaccins fait un compte rendu des déclarations d'ESSI reçues par le Programme Canada Vigilance entre le 1er janvier et le 31 décembre 2022 pour les vaccins. Il n'inclut pas les déclarations concernant les cas où le seul vaccin soupçonné d'avoir causé les ESSI est un vaccin contre la COVID-19. Pour de plus amples renseignements sur les effets indésirables qui ont été signalés après l'administration d'un vaccin contre la COVID-19 au Canada, veuillez consulter la page Web sur les manifestations cliniques inhabituelles à la suite de l'immunisation contre la COVID-19 au Canada.
Résumé pour la période du 1er janvier au 31 décembre 2022
Messages clés
- Du 1er janvier au 31 décembre 2022, le Programme Canada Vigilance a reçu 402 déclarations d'effets secondaires suivant l'immunisation (ESSI) soupçonnés d'avoir été causés par des vaccins.
- Il n'y a pas eu de changement important dans les caractéristiques (sexe et âge) de la population qui a subi les ESSI déclarés, ni dans les types de vaccins qui ont été les plus fréquemment déclarés, par rapport aux années précédentes.
- Aucun nouveau signal d'innocuité (problème d'innocuité potentiel) n'a été identifié pour des vaccins autres que contre la COVID-19 pendant cette période.
- En 2022, le Programme Canada Vigilance a reçu 402 déclarations d'ESSI soupçonnés d'avoir été causés par des vaccins. La majorité des déclarations était transmise par des consommateurs (figure 1), qui ont fait des signalements spontanés.
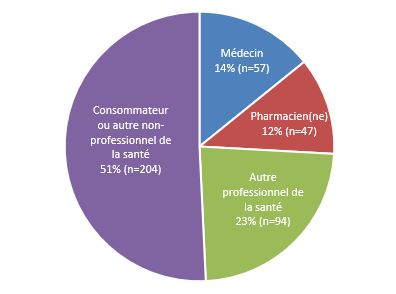
Figure 1 - Équivalent textuel
La figure montre le nombre total de déclarations reçues selon le type de déclarant
| Type de déclarant | Pourcentage (%) | Nombre de déclarations (n) |
|---|---|---|
| Consommateur ou autre non-professionnel de la santé | 51 | 204 |
| Autre professionnel de la santé | 23 | 94 |
| Pharmacien(ne) | 12 | 47 |
| Médecin | 14 | 57 |
- La majorité des déclarations concernait des adultes âgés de plus de 18 ans (189 sur 402, soit 47 %) (figure 2), semblablement à ce qui a été observé depuis 2013 lorsque Santé Canada a commencé à publier des rapports périodiques sur les ESSI déclarés au Programme Canada Vigilance.
- La répartition des 402 déclarations selon le sexe se présente comme suit : 59 % de sexe féminin, 25 % de sexe masculin et 16 % de sexe inconnu. Cette tendance ressemble à ce qui a été observé précédemment.
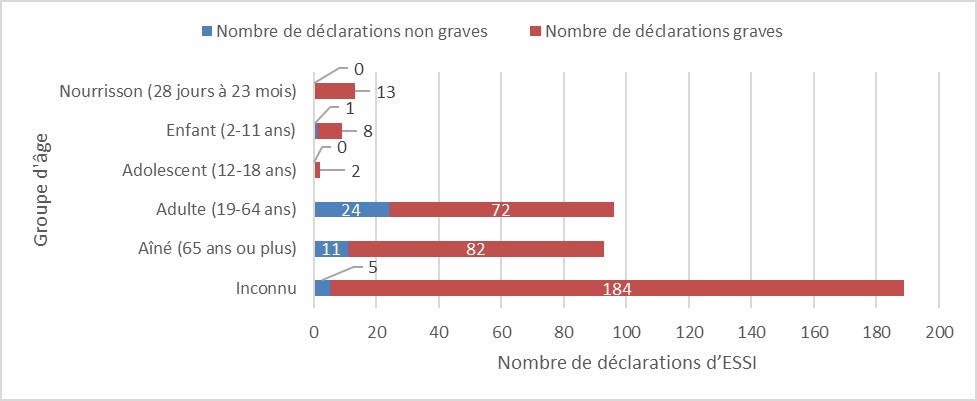
Figure 2 - Équivalent textuel
La figure montre le nombre total de déclarations reçues selon le groupe d'âge
| Groupe d'âge | Nombre de déclarations non graves | Nombre de déclarations graves |
|---|---|---|
| Nourrisson (28 jours à 23 mois) | 0 | 13 |
| Enfant (2-11 ans) | 1 | 8 |
| Adolescent (12-18 ans) | 0 | 2 |
| Adulte (19-64 ans) | 24 | 72 |
| Aîné (65 ans ou plus) | 11 | 82 |
| Inconnu | 5 | 184 |
- Le plus grand nombre de déclarations (d'effets graves et d'effets non graves) reçues concernait les vaccins contre le zona (239 déclarations), suivis par les vaccins contre l'influenza (93 déclarations), puis les vaccins contre le pneumocoque (41 déclarations) (figure 3). Cette tendance ressemble à ce qui a été observé précédemment.
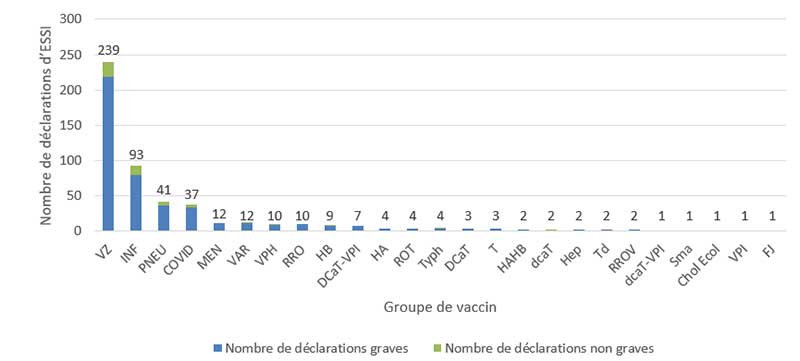
Figure 3 - Équivalent textuel
| Type de vaccin | Nombre de déclarations non graves | Nombre de déclarations graves | |
|---|---|---|---|
| Zona | VZ | 20 | 219 |
| Influenza | INF | 13 | 80 |
| Pneumocoque | PNEU | 5 | 36 |
| Vaccins pour la COVID-19 | COVID | 3 | 34 |
| Méningocoque | MEN | 0 | 12 |
| Varicelle | VAR | 1 | 11 |
| Virus du papillome humain | VPH | 1 | 9 |
| Rougeole, Rubéole et Oreillons | RRO | 0 | 10 |
| Hépatite B | HB | 2 | 7 |
| Diphtérie, Coqueluche acellulaire, Tétanos et inactivé contre la poliomyélite | DCaT-VPI | 0 | 7 |
| Hépatite A | HA | 0 | 4 |
| Rotavirus | ROT | 0 | 4 |
| Typhoïde | Typh | 1 | 3 |
| Diphtérie, Coqueluche acellulaire et Tétanos | DCaT | 0 | 3 |
| Tétanos | T | 0 | 3 |
| Hépatite A et Hépatite B | HAHB | 0 | 2 |
| Diphtérie (réduite), Coqueluche acellulaire et Tétanos | dcaT | 1 | 1 |
| Hépatite * le type de vaccin contre l'hépatite n'a pas été signalé | Hep | 0 | 2 |
| Tétanos, Diphtérie (réduite) | Td | 0 | 2 |
| Rougeole, Rubéole, Oreillons et Varicelle | RROV | 0 | 2 |
| Diphtérie (réduite), Coqueluche acellulaire, Tétanos et inactivé contre la poliomyélite | dcaT-VPI | 0 | 1 |
| Variole | Sma | 0 | 1 |
| Choléra et la diarrhée du voyageur due à Escherichia Coli entérotoxinogène | Chol Ecol | 0 | 1 |
| Antipoliomyélitique inactivé | VPI | 0 | 1 |
| Fièvre jaune | FJ | 1 | 0 |
- Parmi les 402 déclarations, 361 (90 %) étaient des déclarations d'effets graves, dont :
- 219 déclarations d'effets graves étaient associées aux vaccins contre le zona. Les 5 effets secondaires graves les plus fréquemment signalés à la suite de l'administration de vaccins contre le zona étaient le zona, l'échec de la vaccination, la douleur, le zona ophtalmique et la fièvre. La plupart des cas de zona et de zona ophtalmique ont fait l'objet d'une même déclaration avec l'échec de la vaccination.
- 80 déclarations d'effets graves étaient associées aux vaccins contre l'influenza. Les 5 effets secondaires graves les plus fréquemment signalés à la suite de l'administration de vaccins contre l'influenza étaient, la toux, la fièvre, la pneumonie, la fatigue et la céphalée.
- pour la majorité des déclarations d'effets graves, il n'a pas été possible d'établir de lien avec le vaccin compte tenu de l'absence de renseignements médicaux concernant les sujets vaccinés, le statut vaccinal et l'effet indésirable. Pour les déclarations qui incluaient des renseignements médicaux, il a été déterminé que les effets secondaires signalés n'étaient probablement pas liés à la vaccination en raison des problèmes de santé sous-jacents et/ou des médicaments concomitants qui pourraient avoir contribué à l'événement. Pour certaines déclarations, les effets décrits étaient signalés dans les monographies de produit des vaccins soupçonnés.
- Au total, il y a eu signalement d'un décès dans 16 déclarations : 3 pour des personnes de sexe masculin, 7 pour des personnes de sexe féminin et 6 pour des personnes dont l'information sur le sexe n'est pas connue. Quatre cas sont survenus chez des personnes d'au moins 65 ans; 1 cas a été signalé chez une personne âgée de 18 à 64 ans, 1 cas a été signalé chez un nourrisson; pour les 10 autres, l'âge n'a pas été déclaré. Les vaccins mis en cause dans les déclarations étaient un vaccin contre le zona (11), un vaccin contre l'influenza (2), un vaccin contre l'influenza co-administré avec un vaccin contre la COVID-19 (2) et le vaccin contre la rougeole, la rubéole et les oreillons co-administré avec un vaccin contre le zona et le vaccin contre la varicelle (1). Le pourcentage de cas de décès déclarés en 2022 (16 sur 402, soit 4 %) est plus élevé que ce qui a été déclaré en 2021 (2 %). Bien que ces décès soient survenus après la vaccination avec les vaccins soupçonnés, un lien de causalité entre le vaccin et l'événement signalé n'a pu être établi, en raison du manque de détails fournis dans les déclarations.
Conclusion
- Aucun nouveau signal d'innocuité (problème d'innocuité potentiel) lié à des vaccins n'a été identifié pendant cette période.
- Les avantages des vaccins autorisés au Canada continuent de l'emporter sur les risques.
- Santé Canada, en collaboration avec l'ASPC, continuera de surveiller étroitement l'innocuité des vaccins autorisés au Canada.
Pour obtenir de plus amples renseignements, veuillez communiquer avec la Direction des produits de santé commercialisés.
Notez qu'en raison d'une mise à jour de l'information reçue par le Programme Canada Vigilance, il peut y avoir des différences dans le nombre de déclarations et les effets secondaires extraits à des dates différentes.
Portée
Cette publication mensuelle s'adresse principalement aux professionnels de la santé et contient des informations sur les produits pharmaceutiques, biologiques, les matériels médicaux et les produits de santé naturels. Elle fournit un résumé des informations clés concernant l'innocuité des produits de santé qui ont été publiés au cours du mois précédent par Santé Canada, ainsi qu'une sélection de nouveaux renseignements en matière d'innocuité sur les produits de santé, pour en accroître la sensibilisation. Les nouvelles informations contenues dans ce numéro ne sont pas exhaustives, mais représentent plutôt une sélection de problèmes d'innocuité cliniquement pertinents, justifiant une dissémination améliorée.
Pour signaler des effets indésirables
Programme Canada Vigilance
Téléphone : 1-866-234-2345
Télécopieur ou courrier : formulaire disponible sur MedEffet Canada
Des renseignements sur la marche à suivre pour déclarer un effet indésirable à Santé Canada sont publiés à la page Déclaration des effets indésirables ou des incidents liés aux matériels médicaux.
Liens utiles
- MedEffetMC Canada
- Base de données sur les rappels et les avis de sécurité
- Nouveaux examens de l'innocuité ou de la sûreté et de l'efficacité
- Base de données en ligne des effets indésirables de Canada Vigilance
- Base de données sur les produits pharmaceutiques
- Liste des instruments médicaux homologués
- Base de données des produits de santé naturels homologués
- Portail des médicaments et des produits de santé
- Pénuries de médicaments Canada
- Pénuries d'instruments médicaux : Liste des pénuries et des interruptions de la vente
- Mettons fin au marketing illégal des médicaments et des instruments médicaux
- Liste des drogues destinées aux importations et aux ventes exceptionnelles
- Maladie à coronavirus (COVID-19)
- Autorisation de médicament et de vaccin contre la COVID-19 : Liste des drogues et vaccins autorisés et des drogues à indication supplémentaire
- Portail des vaccins et traitements pour la COVID-19
- Effets secondaires signalés après la vaccination contre la COVID-19 au Canada
Des suggestions?
Vos commentaires sont importants pour nous. Dites-nous ce que vous pensez en nous contactant à : infowatch-infovigilance@hc-sc.gc.ca.
Équipe de rédaction de l'InfoVigilance sur les produits de santé
Direction des produits de santé commercialisés
Santé Canada
Indice de l'adresse 1906C
Ottawa (ON) K1A 0K9
Téléphone : 613-954-6522
Téléimprimeur : 1-800-465-7735 (Service Canada)
Note de bas de page
- Note de bas de page 1
-
Probiotiques [monographie]. Ottawa (Ont.) : Santé Canada; 27 janvier 2023 (consulté le 12 octobre 2023).
- Note de bas de page 2
-
Costa RL, Moreira J, Lorenzo A, et al. Infectious complications following probiotic ingestion: a potentially underestimated problem? A systematic review of reports and case series. (en anglais seulementURL: https://bmccomplementmedtherapies.biomedcentral.com/articles/10.1186/s12906-018-2394-3) BMC Complement Altern Med 2018;18:329.
- Note de bas de page 3
-
Hojsak I, Fabiano V, Pop TL, et al. Guidance on the use of probiotics in clinical practice in children with selected clinical conditions and in specific vulnerable groups. (en anglais seulement URL: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5969308) Acta Paediatr. 2018;107(6):927–37.
- Note de bas de page 4
-
Santé Canada. Ligne directrice sur la qualité des produits de santé naturels. Version 3.1. Publiée le 1er mai 2015 (consulté le 12 octobre 2023).
- Note de bas de page 5
-
Fosamax (alendronate monosodique) [monographie de produit]. Kirkland (Qc): Organon Canada Inc.; 2023.
- Note de bas de page 6
-
Fosavance (alendronate monosodique et cholécalciférol) [monographie de produit]. Kirkland (Qc): Organon Canada Inc.; 2023.
- Note de bas de page 7
-
Eltroxin (lévothyroxine sodique) [monographie de produit]. Oakville (Ont.): Aspen Pharmacare Canada Inc.; 2023.
- Note de bas de page 8
-
Euthyrox (lévothyroxine sodique) [monographie de produit]. Mississauga (Ont.): EMD Serono, une division d'EMD Inc.; 2023.
- Note de bas de page 9
-
Synthroid (lévothyroxine sodique) [monographie de produit]. Etobicoke (Ont.): BGP Pharma ULC; 2023.
