Rapport annuel 2023

ISSN 1495 – 057X
Numéro de catalogue :
H78F-PDF
Version PDF (1,2 Mo)
Table des matières
- Aperçu statistique de 2023
- Lettre au Ministre
- Message du président
- À propos du Conseil d’examen du prix des médicaments brevetés
- Activités d’examen des prix
- Tendances relatives aux prix des produits pharmaceutiques
- Dépenses de recherche et développement
- Initiative de recherche du système national d’information sur l’utilisation des médicaments prescrits
- Glossaire
Aperçu statistique de 2023
Mandat d’examen des prix
- En 2023, 1 146 médicaments brevetés destinés à l’usage humain ont été déclarés au CEPMB, dont 86 nouveaux médicaments.
- Cinq engagements de baisser volontairement le prix d’un médicament ou de verser les recettes excédentaires potentielles au gouvernement du Canada ont été acceptés en 2023.
- Les engagements relatifs aux recettes excédentaires potentielles ont entraîné le versement de paiements de plus de 2,1 millions de dollars au gouvernement du Canada.
Mandat de production de rapports
Tendances observées au chapitre des prix
- Le prix courant national des médicaments brevetés a augmenté de 0,7 % en 2023, tandis que l’indice des prix à la consommation a connu une hausse de 3,9 %.
- Les ratios des prix courants canadiens étaient plus élevés que ceux de tous les pays du CEPMB11 et se situaient au quatrième rang des prix les plus élevés parmi les 31 pays de l’Organisation de coopération et du développement économiques (OCDE).
Tendances observées au chapitre des ventes
- Les ventes de médicaments brevetés au Canada ont atteint 19,9 milliards de dollars en 2023, soit une augmentation de 8,2 % par rapport à l’année précédente.
- Les médicaments brevetés représentaient 47 % des ventes totales de médicaments au Canada en 2023.
Recherche et développementNote de bas de page 1 (R-D):
- Le ratio des dépenses de R-D par rapport aux recettes tirées des ventes pour tous les titulaires de droits au Canada était de 3,7 % en 2023, soit une augmentation par rapport au ratio de 3,1 % enregistré en 2022.
- Les titulaires de droits ont déclaré des dépenses totales de R-D de 1 069,3 millions de dollars, ce qui représente une augmentation de 17,0 % par rapport à 2022.
Lettre au Ministre
Le 21 octobre 2024
L’honorable Mark Holland, C.P., député
Ministre de la Santé
Chambre des communes
Ottawa (Ontario)
K1A 0A6
Monsieur le Ministre,
J’ai le plaisir de vous présenter, conformément aux articles 89 et 100 de la Loi sur les brevets, le Rapport annuel du Conseil d’examen du prix des médicaments brevetés pour l’exercice terminé le 31 décembre 2023.
Veuillez agréer, Monsieur le Ministre, l’expression de mes sentiments les meilleurs.
Thomas J. Digby
Président
Message du président

Le Conseil d’examen du prix des médicaments brevetés (CEPMB) est un organisme indépendant qui détient des pouvoirs quasi judiciaires. Il a été créé par le Parlement en 1987 en vertu de la Loi sur les brevets (la Loi). Le mandat du CEPMB consiste à protéger et à informer les Canadiens et Canadiennes en s’assurant que les médicaments brevetés ne sont pas vendus au Canada à des prix excessifs et en rendant compte des tendances observées au chapitre des prix des produits pharmaceutiques.
Le présent rapport annuel marque la première année de la nomination d’un nouveau Conseil du CEPMB et témoigne d’une période de restructuration au sein du CEPMB. En 2023, le Conseil a lancé la première des trois phases d’une approche visant à élaborer de nouvelles Lignes directrices, qui tiendront compte du Règlement sur les médicaments brevetés modifié, entré en vigueur en juillet 2022. Cette première phase a permis de lancer des consultations publiques sur l’élaboration des Lignes directrices au moyen d’un document d’orientation visant à encourager une conversation productive avec les groupes intéressés. Les consultations ont été suivies d’une table ronde de deux jours sur les politiques, où les groupes ont été invités à présenter leurs commentaires en personne. Ces discussions ont jeté les bases des deux prochaines phases d’élaboration, qui auront lieu en 2024 et en 2025. Entre-temps, le CEPMB exerce ses activités en suivant les Lignes directrices provisoires publiées en septembre 2023.
Si vous avez l’habitude de lire le rapport annuel du CEPMB, vous trouverez la présente édition différente de celle de l’année dernière, tant sur le plan des analyses présentées que de l’organisation du document. Le CEPMB a apporté ces changements afin de produire un rapport annuel concis et pertinent pour ses lecteurs et touchant au cœur de son mandat. Au cours de votre lecture, je vous encourage à consulter les liens et les remarques au sujet de la méthode, qui vous permettront d’accéder à des renseignements supplémentaires et à d’autres rapports susceptibles de vous intéresser.
Malgré ces changements, nous continuons d’observer des tendances constantes dans le marché pharmaceutique. L’arrivée sur le marché de nouveaux médicaments brevetés à prix plus élevé a été le principal facteur derrière l’augmentation de près de 50 $ par personne de la valeur des ventes de médicaments brevetés cette année, qui est passée de 465 $ à 514 $. Les prix courants canadiens des médicaments brevetés en 2023 étaient plus élevés que ceux des 11 pays figurant en annexe du Règlement et utilisés aux fins de comparaison par le CEPMB (« CEPMB11 »), et occupaient le quatrième rang parmi les pays de l’OCDE. Environ 84 % des ventes de médicaments brevetés au Canada concernaient des médicaments dont le prix courant était plus élevé que le prix médian des pays du CEPMB11, tandis que 25 % étaient pour des médicaments dont le prix courant était supérieur au prix le plus élevé parmi les pays du CEPMB11. Les titulaires de droits ont dépensé davantage en recherche et développement (R-D) en 2023 comparativement à 2022, bien que le ratio de dépenses de R-D par rapport aux ventes de médicaments brevetés au Canada demeure considérablement inférieur à celui des pays du CEPMB11.
Le CEPMB fait partie intégrante d’un écosystème pharmaceutique durable au Canada, et nous sommes conscients de l’importance de ce rôle à mesure que nous approchons du lancement des nouvelles Lignes directrices, qui est prévu pour l’année à venir. Tout au long de ce processus, notre priorité consiste à assurer une harmonisation claire et uniforme avec notre mandat et à faire preuve d’un engagement réceptif à l’égard de ceux qui sont touchés par le processus d’examen des prix, afin de présenter des Lignes directrices définitives qui nous permettent de nous acquitter de nos responsabilités auprès du peuple canadien.
Thomas J. Digby
Président
À propos du Conseil d’examen du prix des médicaments brevetés
Le Conseil d’examen du prix des médicaments brevetés (CEPMB) est un organisme quasi judiciaire indépendant, créé par le Parlement en 1987 en vertu de la Loi sur les brevets (la Loi).
Le CEPMB est un organisme administratif quasi judiciaire qui remplit un double mandat. Dans le cadre de son mandat d’examen des prix, il s’assure que les prix des médicaments brevetés vendus au Canada ne sont pas excessifs. Dans le cadre de son mandat de production de rapports, le CEPMB publie un rapport annuel contenant des renseignements sur les tendances observées au chapitre des ventes et des prix des produits pharmaceutiques, ainsi que sur les dépenses en recherche et développement (R-D) des titulaires de droits.
De plus, à la demande du ministre de la Santé en vertu de l’article 90 de la Loi, le CEPMB effectue une analyse des tendances en matière de prix, d’utilisation et de coûts des médicaments brevetés et non brevetés dans le cadre de l’initiative de recherche du Système national d’information sur l’utilisation des médicaments prescrits (SNIUMP). Les rapports produits dans le cadre de cette initiative fournissent aux payeurs de produits pharmaceutiques et aux décideurs les renseignements nécessaires pour prendre des décisions fondées sur des données probantes concernant le remboursement et l’établissement des prix.
Le CEPMB fait partie du portefeuille de la Santé, qui comprend également Santé Canada, l’Agence de la santé publique du Canada, les Instituts de recherche en santé du Canada et l’Agence canadienne d’inspection des aliments. Le portefeuille de la Santé aide le ministre de la Santé à maintenir et à améliorer la santé de la population canadienne. En raison de ses responsabilités quasi judiciaires, le CEPMB exerce son mandat en toute indépendance du ministre de la Santé, qui est responsable de l’application des articles de la Loi se rapportant au CEPMB.
Le CEPMB contribue à assurer la viabilité des dépenses en produits pharmaceutiques au Canada au moyen des mesures suivantes :
- En examinant de façon efficace les prix des médicaments brevetés et en intervenant dans les cas où le Conseil détermine qu’un prix est excessif;
- En fournissant aux intervenants des renseignements sur les prix, les coûts et l’utilisation pour soutenir la prise de décisions éclairées en matière de prix, d’achat et de remboursement.
Quelle est la place du CEPMB au sein de l’écosystème des soins de santé au Canada?
Le mandat du CEPMB est une composante indépendante d’un écosystème complexe qui assure la gestion des médicaments approuvés au Canada et qui comprend des organismes liés à la santé comme :
This includes healthcare-related bodies, such as:
- Santé Canada, qui autorise la commercialisation des médicaments au Canada après avoir vérifié leur innocuité, leur efficacité et leur qualité;
- L’Agence des médicaments du Canada (AMC, anciennement l’Agence canadienne des médicaments et des technologies de la santé), qui évalue les technologies de la santé et met sur pied des comités d’experts chargés de formuler des recommandations quant aux nouveaux médicaments qui devraient être admissibles au remboursement dans le cadre des régimes publics d’assurance-médicaments, ainsi que l’Institut national d’excellence en santé et en services sociaux (INESSS), qui évalue les médicaments dans le but de faire des recommandations sur le remboursement par les régimes publics au Québec;
- L’Alliance pancanadienne pharmaceutique (APP), qui négocie les prix courants au nom des régimes publics d’assurance-médicaments partout au Canada (fédéraux et provinciaux, y compris ceux du Québec);
- Les régimes publics fédéral, provinciaux et territoriaux d’assurance-médicaments, qui autorisent l’inscription des médicaments sur leur liste de médicaments admissibles à un remboursement.
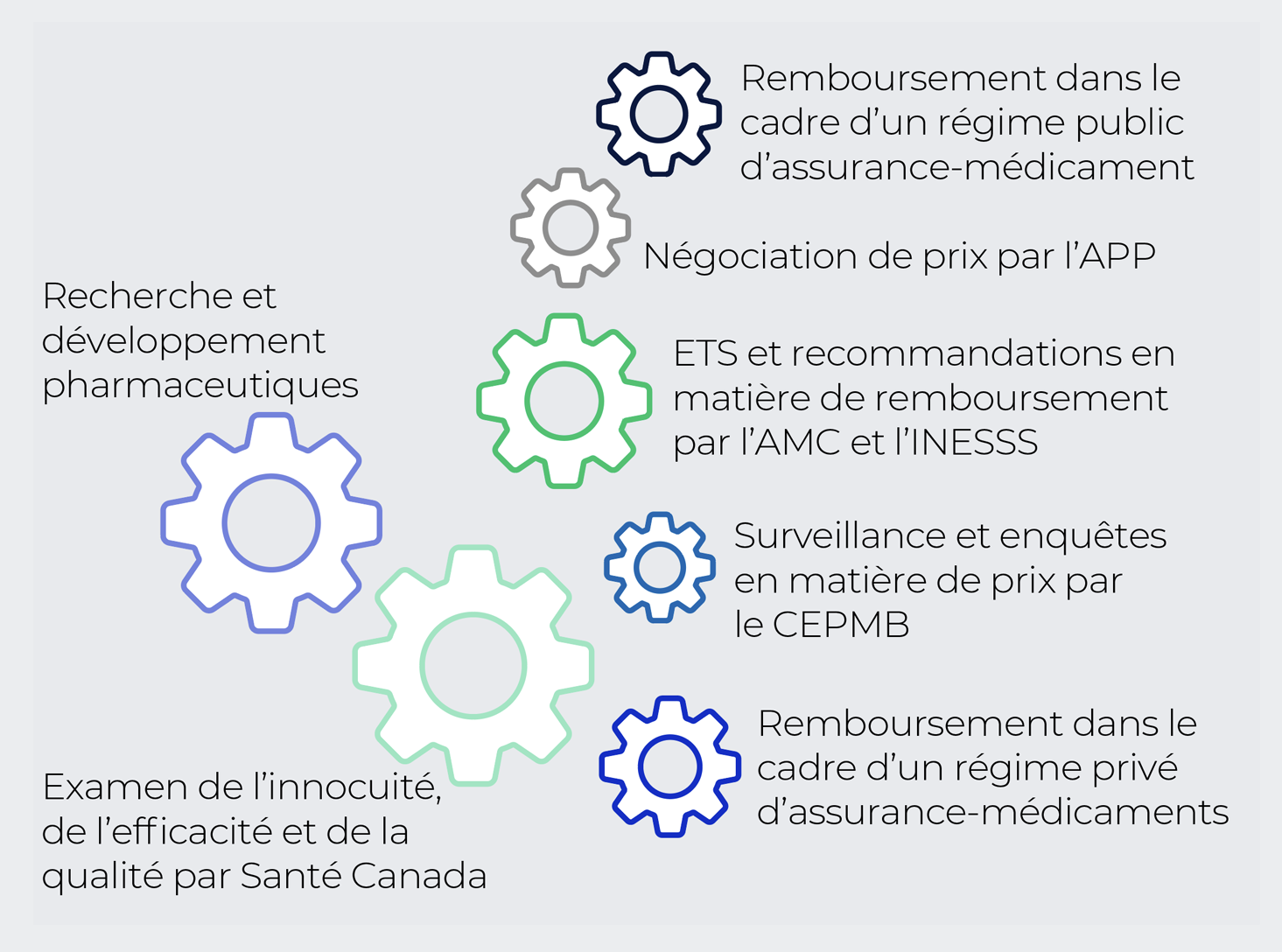
Description de la figure
Ce diagramme illustre l’écosystème des médicaments sur ordonnance au Canada, dans lequel évoluent de nombreux intervenants, représentés par des engrenages :
- Recherche et développement pharmaceutiques;
- Examen de l’innocuité, de l’efficacité et de la qualité par Santé Canada;
- Surveillance et enquêtes en matière de prix par le CEPMB;
- Remboursement dans le cadre d’un régime privé d’assurance-médicaments;
- Évaluations des technologies de la santé (ETS) et recommandations en matière de remboursement par l’Agence des médicaments du Canada (AMC) et l’Institut national d’excellence en santé et en services sociaux (INESSS);
- Négociation de prix par l’Alliance pharmaceutique pancanadienne (APP);
- Remboursement dans le cadre d’un régime public d’assurance-médicaments.
AMC : Agence des médicaments du Canada (anciennement l’Agence canadienne des médicaments et des technologies de la santé); INESSS : Institut national d’excellence en santé et en services sociaux; ETS : évaluation des technologies de la santé; APP : Alliance pancanadienne pharmaceutique
Le saviez-vous?
Depuis 1987, les coûts des produits pharmaceutiques au Canada ont augmenté à un taux annuel moyen de 6,6 %, dépassant la plupart des autres coûts liés aux soins de santé et augmentant à un rythme correspondant à environ 3 fois le taux d’inflation. Les dépenses pharmaceutiques représentent 13,9 % des dépenses totales en soins de santéi.
En 2023, les dépenses liées à l’ensemble des médicaments sur ordonnance au Canada étaient estimées à un peu plus de 41 milliards de dollars, dont 43 % ont été payées par le secteur public, 37 % par des assureurs privés et 20 % par la population canadienne elle-mêmei.
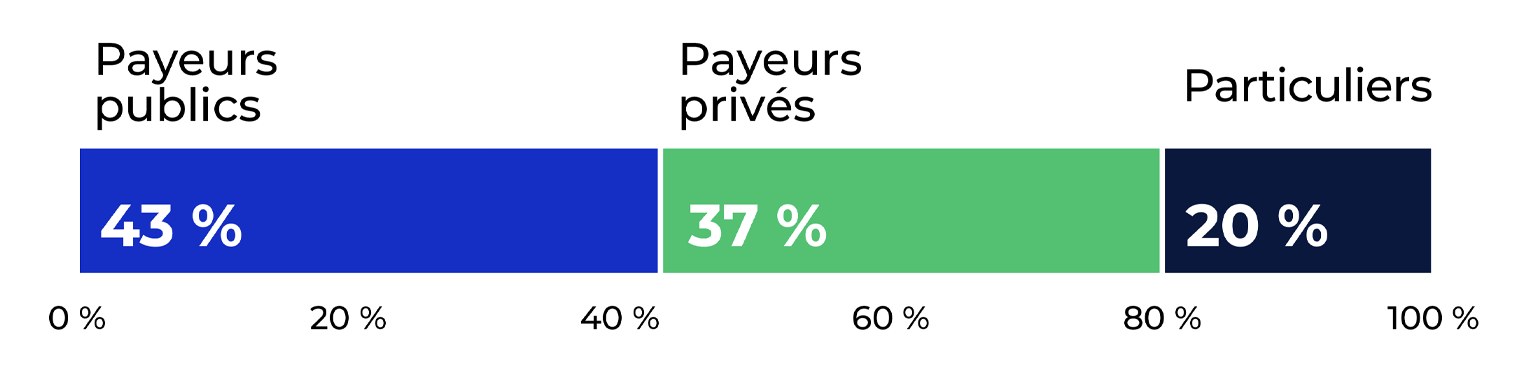
Description de la figure
Ce graphique montre la distribution des ventes de médicaments sur ordonnance par payeur pour 2023. Une proportion de 43 % des ventes a été payée par les payeurs publics, de 37 % par les payeurs privés, et de 20 % par les particuliers.
Source des données : Institut canadien d’information sur la santé (ICIS), Tendances des dépenses nationales de santé, 2023
Notes
i Institut canadien d’information sur la santé (ICIS), Tendances des dépenses nationales de santé, 2023 (novembre 2023)
ii Le Conference Board du Canada, Comprendre l’écart 2.0 (mai 2022)
iii Statistique Canada, Accès et recours aux produits pharmaceutiques pendant la pandémie (novembre 2022)
iv Morgan SG, Lee A. 2017. Cost-related non-adherence to prescribed medicines among older adults: a cross-sectional analysis of a survey in 11 developed countries. BMJ Open 2017;7:e014287. DOI : 10.1136/bmjopen-2016-014287 (en anglais seulement)
En 2022, le Conference Board du Canada estimait que 2,8 % des Canadiens et Canadiennes (environ 1,1 million de personnes) ne bénéficiaient d’aucune couverture pour leurs médicaments sur ordonnanceii. Cet écart s’est réduit au cours des cinq dernières années, en grande partie grâce au lancement du programme Assurance-santé Plus de l’Ontario, mais cela ne tient pas compte des millions de Canadiens et Canadiennes qui ont une couverture insuffisante pour leurs médicaments sur ordonnance. Les deux tiers (67 %) des Canadiens et Canadiennes ont pris ou se sont vu prescrire des médicaments en 2021, et pourtant un cinquième (21 %) de la population totale a déclaré ne bénéficier d’aucune couverture pour ses médicaments sur ordonnanceiii. Ce pourcentage fluctuait à l’échelle des provinces et était supérieur au sein des groupes racisés (29 %).
Ainsi, près d’un cinquième (18 %) de la population canadienne a payé 500 $ ou plus en médicaments sur ordonnance en 2021, et près de 1 personne canadienne sur 10 (9 %) a indiqué omettre de prendre des doses, reporter l’exécution d’ordonnances, ou ne pas respecter d’une quelconque façon un traitement prescrit en raison des coûtsiii. En ce qui concerne les personnes âgées, le Canada affiche l’un des taux les plus élevés d’inobservance du traitement en raison des coûts parmi les pays de comparaisoniv.
Compétence
Examen des prix
1 146 médicaments brevetés ont été déclarés au CEMPB en 2023.
Le CEPMB examine le prix auquel les titulaires de droits (entreprises) vendent leurs produits aux grossistes, aux hôpitaux, aux pharmacies et aux autres grands distributeurs pour s’assurer que ce prix n’est pas excessif. Ce prix est parfois appelé prix « départ-usine ».
Le CEPMB examine le prix des médicaments brevetés seulement, ce qui signifie que les médicaments non brevetés ne relèvent pas de sa compétence. Un brevet est une forme de propriété intellectuelle qui protège une invention en conférant à son titulaire le droit d’empêcher d’autres personnes de fabriquer, d’utiliser ou de vendre son invention pendant la durée de vie du brevet. Un médicament breveté, dans le contexte du CEPMB, désigne une « invention liée à un médicament », lorsque celle-ci « est destinée à des médicaments ou à la préparation ou à la production de médicaments, ou susceptible d’être utilisée à de telles fins ».
La Loi exige que les titulaires de droits informent le CEPMB de leur intention de vendre un nouveau médicament breveté. Un titulaire de droit s’entend de toute partie « ayant […] droit à l’avantage d’un brevet » peu importe si elle est propriétaire ou titulaire de ce brevet et indépendamment du fait qu’il s’agisse d’un médicament de marque ou générique. Les titulaires de droits doivent présenter des renseignements relatifs au prix et à la valeur de leurs ventes de tout nouveau médicament breveté au moment de son lancement et régulièrement par la suite, jusqu’à ce que tous les brevets arrivent à échéance. Les titulaires de droit ne sont pas tenus de faire approuver au préalable les prix de vente pour être en mesure de commercialiser leurs médicaments. Cependant, la Loi exige que le CEPMB s’assure que les médicaments brevetés ne sont pas vendus au Canada à des prix excessifs.
Le personnel du Conseil examine les prix demandés par les titulaires de droits pour chaque concentration et chaque forme d’un médicament breveté. Si le prix semble potentiellement excessif, le titulaire de droits peut volontairement réduire son prix ou rembourser les recettes excédentaires éventuelles au moyen d’un paiement versé au gouvernement du Canada dans le cadre d’un engagement volontaire. Si tel n’est pas le choix effectué, le président peut décider si une audience concernant l’affaire est dans l’intérêt du public. Lors de cette dernière, un comité, se composant de membres du Conseil, agira à titre d’arbitre neutre entre le personnel du Conseil et le titulaire de droits. Si, après avoir entendu la preuve et tenu compte des facteurs énoncés à l’article 85 de la Loi, le comité d’audience conclut que le prix du médicament breveté est ou était excessif dans un marché canadien, quel qu’il soit, il peut délivrer une ordonnance demandant la réduction du prix. Il peut également exiger que le titulaire de droits verse un montant au gouvernement du Canada pour rembourser les recettes excessives qu’il a encaissées et, si le comité conclut à la présence d’une politique de prix excessif, il peut doubler le montant à verser au gouvernement.
Production de rapports
Comme l’exige la Loi, le CEPMB rend compte chaque année au Parlement, par l’entremise du ministre de la Santé, de ses activités au cours de la dernière année, des tendances observées au chapitre des prix de tous les médicaments, et des dépenses de R-D déclarées au CEPMB par les titulaires de droits pharmaceutiques.
De plus, à la suite d’une demande du ministre fédéral de la Santé en vertu de l’article 90 de la Loi, le CEPMB prépare à l’intention du ministre des rapports qui renferment des analyses critiques des tendances en matière de prix, d’utilisation et de coûts des médicaments sur ordonnance brevetés et non brevetés. Ces rapports sont préparés par le groupe responsable de l’initiative de recherche du SNIUMP du CEPMB et sont également publiés en ligne.
Communications et sensibilisation
Le CEPMB adopte une approche proactive et un langage clair à l’égard de ses activités de communication externes. Il s’agit notamment de campagnes ciblées sur les médias sociaux et d’activités de mobilisation plus conventionnelles (p. ex. courriel) auprès de médias d’information nationaux, internationaux et spécialisés. Le CEPMB recherche activement d’autres possibilités de tirer parti des nouveaux médias pour communiquer avec la population canadienne.
Le CEPMB reconnaît l’importance de l’ouverture et de la transparence alors que nous continuons de travailler à la modernisation de la manière dont nous nous acquittons de notre mandat. Pour demeurer concentré sur l’obtention de résultats, nous communiquons régulièrement, au moyen de différents canaux, des informations sur les progrès réalisés, notamment les échéanciers prévus et les jalons clés. Le dialogue avec les groupes concernés demeure au cœur de notre démarche de communication à volets multiples.
Gouvernance
Le CEPMB est composé d’au plus cinq membres siégeant à temps partiel et qui sont appuyés dans leur travail par des fonctionnaires (personnel). Les membres du Conseil, dont un président et une vice présidente, sont nommés par le gouverneur en conseil. Le président du Conseil, nommé chef de la direction du CEPMB en vertu de la Loi, est chargé de la gouverne et de la supervision des activités du CEPMB. Selon la Loi, la vice-présidente, en cas d’absence ou d’empêchement du président, ou de vacance de son poste, assume la présidence.
Les membres du Conseil, y compris le président, sont collectivement responsables de la mise en œuvre des dispositions applicables de la Loi. Ensemble, ils établissent les lignes directrices, les règles, les règlements administratifs et les autres politiques du CEPMB comme le prévoit la Loi (article 96) et consultent, au besoin, les ministres fédéraux et provinciaux responsables de la santé, ainsi que les représentants de groupes de consommateurs, de l’industrie pharmaceutique et d’autres intervenants.
Membres du Conseil
Pour de plus amples renseignements, voir la page structure organisationnelle du site Web du CEPMB.
Président
Thomas J. Digby

Thomas Digby a été nommé président du Conseil le 27 janvier 2023.
Thomas Digby est avocat et compte plus de 25 années d’expérience en droit de la propriété intellectuelle au Canada et aux États-Unis, dans le domaine des produits pharmaceutiques. Il a travaillé en étroite collaboration avec diverses jeunes entreprises de biotechnologie et leurs investisseurs en capital de risque. Il a également travaillé pendant 10 ans chez Novartis, chef de file mondial.
Vice-présidente
Anie Perrault

Anie Perrault a été nommée vice-présidente du Conseil le 10 août 2023.
Mme Perrault est avocate de formation et possède plus de 30 ans d’expérience professionnelle dans les secteurs public et privé. Sa carrière a mis l’accent sur les communications et les affaires publiques en lien avec la recherche génomique et la biotechnologie, et elle a occupé plusieurs postes stratégiques à l’échelle nationale dans ce domaine. Elle a été directrice générale de BIOQuébec de 2013 à 2022 et vice-présidente, Communications de Génome Canada de 2001 à 2006.
Membres
Peter Moreland-Giraldeau

Peter Moreland-Giraldeau a été nommé au Conseil le 6 octobre 2023.
M. Moreland-Giraldeau est avocat en droit administratif et travaille actuellement comme avocat-conseil à l’Appeals Commission for Alberta Workers’ Compensation. Il est titulaire d’un baccalauréat en droit de l’Université de Leicester et d’une maîtrise en droit (LL.M.) de l’Université de la Colombie-Britannique.
Dre Emily Reynen

La Dre Emily Reynen a été nommée au Conseil le 20 octobre 2023.
La Dre Reynen est titulaire d’un diplôme de premier cycle et d’un doctorat en pharmacie de la Faculté de pharmacie Leslie Dan de l’Université de Toronto. Elle détient également un diplôme en médecine de la Faculté de médecine de l’Université McGill. Elle pratique actuellement comme intensiviste à l’Hôpital général de Belleville - Quinte Health Care, et est professeure associée adjointe à l’Université Queen’s.
Structure organisationnelle et personnel
Organigramme du CEPMB (août 2024)

Description de la figure
L’organigramme illustre la structure hiérarchique de haut niveau au sein du CEPMB, et présente les membres du Conseil et de la haute direction, en date d’août 2024. Conseil : président — Thomas J. Digby; vice-présidente — Anie Perrault; membres — Peter Moreland-Giraldeau et Dre Emily Reynen. Haute direction : directeur général — Guillaume Couillard; directrice et avocate générale — Isabel Jaen Raasch; directrice, Secrétariat du Conseil et Communications — Mélissa Lyonnais; directeur principal/directrice principale, Politiques et analyse économique — poste vacant; directrice principale, Réglementation et liaison auprès des brevetés — Stéphanie Plouffe; directeur principal, Services généraux et DPI — Devon Menard.
Directeur général
Le directeur général (auparavant le directeur exécutif) avise le Conseil, supervise le travail du personnel et en assume le leadership.
Réglementation et liaison auprès des brevetés
La Direction de la réglementation et de la liaison auprès des brevetés fait l’examen des prix des médicaments brevetés vendus au Canada, s’assure que les titulaires de droits respectent leurs obligations en matière de présentation de rapports, encourage les titulaires de droits à se conformer volontairement aux Lignes directrices du CEPMB, veille à la bonne application des politiques connexes et fait enquête sur les plaintes reçues concernant les prix de certains médicaments brevetés.
Politiques et analyse économique
La Direction des politiques et de l’analyse économique formule des avis politiques et stratégiques; dirige des consultations et présente des recommandations concernant des modifications possibles aux Lignes directrices du CEPMB; effectue des recherches et des analyses sur les prix des médicaments, les évolutions sur le marché pharmaceutique et les tendances en matière de R-D; et présente au ministre de la Santé des rapports visant à fournir de l’information crédible, impartiale et centralisée à l’appui de politiques fondées sur des données probantes.
Direction des services généraux
La Direction des services généraux offre des conseils et des services en matière de gestion des ressources humaines, des installations, de l’approvisionnement, de la santé et sécurité au travail, de la technologie et de la gestion de l’information. Elle coordonne les activités relatives à la Loi sur l’accès à l’information et à la Loi sur la protection des renseignements personnels et est responsable de la planification stratégique et de la production de rapports. Elle s’occupe également de la planification financière de même que des rapports, de la comptabilité, des audits, de l’évaluation et de la liaison auprès des agences centrales fédérales relativement à ces questions.
Secrétariat du Conseil
Le Secrétariat du Conseil gère les réunions et les audiences du Conseil, y compris les comptes rendus officiels des délibérations.
Avocate générale
L’avocate générale fournit des avis juridiques au CEPMB, dirige l’équipe des services juridiques qui représente les membres du personnel du Conseil au cours des audiences devant le Conseil et assure la liaison avec l’avocat du procureur général dans les affaires liées au CEPMB devant les tribunaux fédéraux et provinciaux.
Budget
En 2023-2024, le CEPMB disposait d’un budget de 17,1 millions de dollars et d’un effectif approuvé de 81 équivalents temps plein.
Tableau 1. Budget et dotation
| 2022-23 | 2023-24 | 2024-25 | |
|---|---|---|---|
| Budget* | 17 003 213 $ |
17 093 674 $ |
17 746 047 $ |
| Salaires et avantages sociaux | 10 164 617 $ |
10 257 961 $ |
10 910 335 $ |
| Fonctionnement | 2 375 235 $ |
2 372 352 $ |
2 372 352 $ |
| Affectation à but spécial† | 4 463 361 $ |
4 463 361 $ |
4 463 361 $ |
| Équivalents temps plein (ETP) | 85 |
84 |
81 |
Notes
* Les montants du budget sont fondés sur le Budget principal des dépenses.
† L’affectation à but spécial est réservée aux coûts externes liés à la tenue d’audiences publiques (conseillers juridiques, témoins experts, etc.). Les fonds non dépensés sont retournés au Trésor.
Activités d’examen des prix
Le CEPMB travaille dans l’intérêt de la population canadienne en veillant à ce que les prix des médicaments brevetés vendus au Canada ne soient pas excessifs. Il le fait en examinant les prix auxquels les titulaires de droits vendent chaque médicament breveté et en veillant à ce que les titulaires de droits réduisent leurs prix et remboursent leurs recettes excédentaires, le cas échéant. La présente section fournit un résumé des exigences en matière de rapports que doivent respecter les titulaires de droits, ainsi qu’un résumé des examens de prix, des engagements, des audiences et des affaires liées au CEPMB qui étaient devant les tribunaux en 2023.
Exigences en matière de rapport
Les titulaires de droits sont tenus par la loi de produire des renseignements sur la vente de leurs médicaments au CanadaNote de bas de page 2. La Loi et le Règlement sur les médicaments brevetés (le Règlement) établissent les renseignements requis et le personnel du Conseil examine de façon continue les renseignements sur les prix jusqu’à ce que tous les brevets pertinents arrivent à échéance.
Les modifications apportées au Règlement en vertu de la Loi, qui sont entrées en vigueur le 1er juillet 2022, ont donné lieu à la mise en œuvre d’un nouveau groupe de pays pour lesquels les titulaires de droits doivent fournir des renseignements sur les prix de comparaison ainsi qu’à la réduction des exigences en matière de déclaration pour les médicaments à faible risque de prix excessif. Un groupe élargi qui compte 11 pays de référence (le « CEPMB11 ») est maintenant utilisé au lieu du groupe précédent qui comptait sept pays (CEPMB7). Les États-Unis et la Suisse ont ainsi été retirés du groupe précédent, et l’Australie, la Belgique, le Japon, les Pays-Bas, la Norvège et l’Espagne y ont été ajoutés.
Le Compendium des politiques, des Lignes directrices et des procédures (les Lignes directrices) fournit des détails sur les tests appliqués aux prix et les mécanismes de tri utilisés par le personnel dans le cadre de son examen et de son enquête sur les prix des médicaments brevetés jusqu’au 1er juillet 2022. Le Conseil travaille à l’élaboration de nouvelles Lignes directrices, et d’ici à ce que celles-ci soient mises en œuvre, les Lignes directrices provisoires modifiées et publiées par le Conseil le 27 septembre 2023 demeureront en vigueur. Les modifications aux Lignes directrices provisoires proposent une approche accélérée d’évaluation des prix des nouveaux médicaments, incluant tout médicament sans prix moyen maximal potentiel (PMMP) ou prix moyen non excessif (PMNE) en date du 1er juillet 2022. Les nouveaux médicaments sont considérés comme ayant été examinés si leur prix courant est inférieur au prix international médian pour les pays du CEPMB11. Les nouveaux médicaments qui ne répondent pas à ce critère continueront d’être soumis à un examen jusqu’à l’entrée en vigueur des nouvelles lignes directrices.
Les Lignes directrices provisoires modifiées sont des mesures qui s’appliquent pendant une période temporaire et ne constituent pas des lignes directrices complètes. Il s’agit plutôt d’un processus simple et temporaire qui permet aux titulaires de droits de prédire, dans une certaine mesure, comment les prix à l’étranger qu’ils fournissent aux fins de comparaison avec ceux du CEPMB11 influenceront l’ampleur de l’examen administratif interne du prix des médicaments effectué par le CEPMB, et cela, en l’absence de lignes directrices complètes.
Les Lignes directrices ne sont pas contraignantes et sont élaborées en consultation avec les intervenants, notamment les ministres fédéraux et provinciaux responsables de la santé, les groupes de consommateurs, les professionnels de la santé et l’industrie pharmaceutique.
Défaut de soumettre les données sur les prix et sur les ventes
Le défaut de soumettre survient lorsqu’un titulaire de droits omet de présenter au CEPMB les renseignements exigés sur les prix et les ventes de médicaments ou sur les investissements en recherche et développement au Canada, comme l’exigent la Loi et le Règlement. Le Conseil n’a pas été appelé à rendre des ordonnances pour défaut de présenter ses rapports en 2023Note de bas de page 3.
Examen des prix
Le CEPMB examine le prix canadien de chaque concentration et de chaque forme posologique d’un médicament breveté déclaré par les titulaires de droits conformément au Règlement. Dans la plupart des cas, cette unité est conforme au numéro d’identification du médicament (DIN) attribué par Santé Canada au moment où la vente au Canada du médicament est approuvée.
Nouveaux médicaments brevetés déclarés au CEPMB en 2023
Aux fins du présent rapport, tout médicament breveté, ou nouvelle forme posologique ou concentration, lancé ou vendu sur le marché canadien avant l’attribution de son premier brevet entre le 1er décembre 2022 et le 1er décembre 2023 est réputé avoir été breveté en 2023.
En 2023, on a déclaré la vente de 86 nouveaux médicaments brevetés destinés à l’usage humain. Certains constituent une ou plusieurs concentrations d’un nouvel ingrédient médicinal et d’autres sont de nouvelles présentations de médicaments existants. Quatre des 86 nouveaux médicaments brevetés ont été vendus au Canada avant d’avoir obtenu le brevet canadien qui les a assujettis à la compétence du CEPMB.
Examen des prix des médicaments brevetés existants à usage humain en 2023
Aux fins du présent rapport, l’expression « médicaments brevetés existants » désigne tous les médicaments brevetés vendus sur le marché canadien et déclarés au CEPMB avant le 1er décembre 2022.
Au moment de la rédaction du présent rapport, il y avait 1 060 médicaments brevetés existants :
- Les prix de 553 médicaments brevetés ne faisaient pas l’objet d’une enquête;
- Les prix de 389 médicaments brevetés faisaient l’objet d’une enquête (y compris les enquêtes entamées avant le 1er juillet 2022);
- 111 médicaments brevetés ne comportaient pas de PMMP selon les Lignes directrices en vigueur avant le 1er juillet 2022;
- Les prix de 6 médicaments brevetés étaient assujettis à un engagementNote de bas de page 4;
- Le prix de 1 médicament breveté était assujetti à une entente de règlement et à une ordonnance.
Mises à jour en 2023
Au cours de l’année 2023, 2 des nouveaux médicaments déclarés comme faisant l’objet d’un examen et 97 des médicaments existants déclarés comme faisant l’objet d’une enquête dans le rapport annuel de 2022 se sont soldés par les résultats suivants :
- La clôture de l’enquête;
- Un engagement de la part du titulaire de droits à réduire le prix ou à payer les recettes excédentaires éventuelles au gouvernement du Canada (voir la section « Engagements »);
- Une audience publique dont l’objet est de déterminer si le prix du médicament est ou non excessif, y compris une ordonnance corrective rendue par le Conseil (voir la section « Audiences »).
Plaintes relatives aux médicaments brevetés en vente libre, aux médicaments génériques brevetés et aux médicaments brevetés à usage vétérinaire
La réduction des obligations de déclaration pour certains médicaments génériques (auparavant la réduction des obligations de déclaration ne s’appliquait qu’aux médicaments en vente libre et aux médicaments vétérinaires) est entrée en vigueur le 1er juillet 2022, comme le prévoit la modification du Règlement. Le personnel ne procède à l’examen des prix des médicaments brevetés en vente libre, des médicaments génériques brevetés et des médicaments brevetés à usage vétérinaire que lorsqu’une plainte pour prix excessif a été déposée. Aucune plainte concernant ces types de médicaments n’a été reçue en 2023.
Plaintes concernant les médicaments brevetés
Le CEPMB fait enquête sur les plaintes reçues de la part de Canadiens et Canadiennes qui jugent que le coût de leurs médicaments est trop élevé. Lorsqu’une plainte est reçue, le personnel détermine si le médicament est breveté et s’il relève de la compétence du CEPMB. S’il s’agit d’un médicament non breveté, le dossier est clos. S’il s’agit d’un médicament breveté, les renseignements sur les prix que le titulaire de droits est tenu de fournir au CEPMB sont réexaminés à la lumière de la plainte. Au total, le CEPMB a reçu 15 plaintes en 2023. Comme les Lignes directrices provisoires sont actuellement en vigueur, aucun examen fondé sur une plainte n’a été débuté.
Certificats de protection supplémentaire
Les modifications apportées à la section portant sur les médicaments brevetés de la Loi qui sont entrées en vigueur le 30 juin 2021, ont permis d’étendre la compétence du CEPMB aux médicaments protégés par un certificat de protection supplémentaire (CPS). Un CPS donne au titulaire du certificat les mêmes droits juridiques que procure le brevet pendant une période maximale de deux ans après l’échéance du brevet. Pour l’année 2023, 21 CPS, dont les dates d’expiration allaient de 2024 à 2037, ont été signalés au CEPMB, portant le total de CPS actifs signalés au CEPMB à 181. Chaque brevet dont la durée a été prolongée au moyen d’un CPS peut être lié à plusieurs médicaments brevetés. Au total, 37 médicaments brevetés ont été liés aux 21 CPS signalés en 2023.
Engagements et audiences
Engagements
Un engagement est une promesse par laquelle un titulaire de droits s’engage à ajuster son ou ses prix ou à payer les recettes excédentaires éventuelles au gouvernement du CanadaNote de bas de page 5. L’examen d’un engagement est une procédure administrative et ne constitue pas une admission ou une détermination par le CEPMB que le prix soumis par le détenteur de droits, ou utilisé pour calculer les recettes excédentaires éventuelles, n’est pas excessif. Cependant, le fait de recevoir un engagement peut être pris en considération par le président au moment de déterminer si une enquête devrait être close.
En 2023, le président a approuvé la clôture d’enquêtes après la réception de cinq engagements. En plus de la réduction du prix de certains médicaments, des recettes excédentaires éventuelles totalisant 2 155 258,53 $ ont été versées sous forme de paiement au Receveur général.
Tableau 2. Engagements approuvés par le président du CEPMB en 2023
| Médicament breveté (nom commercial)* | Titulaire de droits | Date de signature par le titulaire de droits | Réduction de prix | Paiement au gouvernement |
|---|---|---|---|---|
| Engagements approuvés en 2023 | ||||
Amikacine liposomale en suspension pour inhalation (vendu sous le nom commercial Arikayce) |
Insmed Inc. |
Oct. 2022† |
Oui |
- |
Tucatinib (vendu sous le nom commercial Tukysa) |
Seagen Canada Inc. |
Nov. 2022† |
Oui |
- |
Buprénorphine/naloxone (vendu sous le nom commercial Suboxone Film) et buprénorphine (vendu sous le nom commercial Sublocade) |
Indivior UK Ltd |
Nov. 2022† |
- |
948 354,84 $ |
Gilteritinib (vendu sous le nom commercial Xospata) |
Astellas Pharma Canada Inc. |
Mars 2023† |
- |
635 774,92 $ |
Clindamycin/benzoyl peroxide (vendu sous le nom commercial Clindoxyl Gel) |
GlaxoSmithKline Inc. |
Août 2023† |
Oui |
571 128,77 $ |
Total relatif aux engagements approuvés en date du 31 décembre 2023 |
2 155 258,53 $ |
|||
Notes
* Numéro d’identification du médicament (DIN)
† Ces engagements ont été présentés par les titulaires de droits respectifs en 2022, mais ont été approuvés par le président du CEPMB en 2023. Par conséquent, ils ne respectaient pas les critères d’inclusion dans le rapport annuel de 2022.
Audiences
Le CEPMB tient des audiences dans deux types d’instances, soit lorsqu’il doit déterminer s’il y a prix excessifs ou lorsqu’il y a défaut de soumettre ses rapports.
Prix excessifs
Le CEPMB peut tenir des audiences publiques pour déterminer si le prix d’un médicament est excessif. Pendant une audience, un comité d’audience composé d’au moins deux membres du Conseil entend les observations et les éléments de preuve des parties. Le comité d’audience détermine si un médicament breveté est ou a été vendu à un prix excessif dans un marché canadien en tenant compte des renseignements dont il dispose sur les facteurs énoncés à l’article 85 de la Loi. Si le comité d’audience juge que le prix du médicament est excessif, il peut rendre une ordonnance visant à réduire le prix maximum du médicament breveté en question (ou d’un autre médicament breveté du titulaire de droits) et à rembourser les recettes excédentaires obtenues en raison d’un prix excessif. Un contrôle judiciaire des décisions du Conseil peut être sollicité devant la Cour fédérale du Canada. Aucune audience sur les prix excessifs n’a été entamée en 2023 ni pendant la période du 1er janvier au 31 mars 2024.
Défaut de soumettre ses rapports
Le CEPMB peut tenir des audiences publiques pour déterminer si un titulaire de droits a omis de soumettre les renseignements exigés conformément à la Loi et au Règlement. Si le comité d’audience détermine que le titulaire de droits n’a pas respecté les exigences en matière de production de rapports, il peut ordonner au titulaire de droits de fournir les renseignements requis sur les prix et les ventes.
Il n’y a eu aucune audience sur le défaut de présenter ses rapports en 2023 ni pendant la période du 1er janvier au 31 mars 2024.
Sommaire
En 2023, les engagements relatifs aux recettes excédentaires éventuelles ont entraîné le versement de paiements totalisant 2 155 258,53 $ au gouvernement du Canada.
Depuis 1993, 175 engagements ont mené à la clôture d’enquêtes. En outre, 31 avis d’audience ont été délivrés, dont 14 se sont traduits par un règlement avant la tenue de l’audience sur le fond et 17 se sont soldés par la tenue d’une audience publique sur le fond en bonne et due forme (10 audiences étaient liées à des allégations de prix excessifs, et 7, à des allégations de défaut de présenter ses rapports). Ces mesures se sont traduites par des réductions de prix ou par des paiements versés au gouvernement du Canada. Plus de 243 millions de dollars ont été perçus en vertu d’engagements, de règlements et d’ordonnances du Conseil par l’entremise de paiements versés au gouvernement du Canada.
Affaires devant la Cour fédérale, la Cour d’appel fédérale et la Cour suprême du Canada ou d’autres tribunaux
T-906-20: le 18 janvier 2017, Galderma Canada Inc. a déposé une demande de contrôle judiciaire de la décision du Conseil datée du 19 décembre 2016. Selon cette dernière, le Conseil avait déterminé que le brevet canadien no 2 478 237 avait trait au médicament breveté adapalène vendu sous l’appellation commerciale Differin et avait ordonné à Galderma de déposer les renseignements exigés pour la période allant du 1er janvier 2010 au 14 mars 2016. La Cour fédérale a accueilli la demande de contrôle judiciaire de Galderma le 9 novembre 2017 et a annulé la décision du Conseil. Le 21 novembre 2017, le procureur général a interjeté appel de l’acceptation de la demande de contrôle judiciaire par la Cour fédérale. Le 28 juin 2019, la Cour d’appel fédérale a accueilli l’appel et a rendu sa décision renvoyant l’affaire au Conseil pour qu’elle fasse l’objet d’un réexamen. Dans sa décision de réexamen rendue le 7 mai 2020, le Conseil a de nouveau ordonné à Galderma de fournir les renseignements requis pour la période comprise entre le 1er janvier 2010 et le 14 mars 2016. Le 11 août 2020, Galderma Canada Inc. a déposé une demande de contrôle judiciaire de la décision du Conseil du 7 mai 2020 concernant le réexamen (T-906-20), et cette demande a été rejetée par la Cour fédérale le 11 janvier 2024. Le 9 février 2024, Galderma Canada Inc. a déposé un avis d’appel de la décision de la Cour fédérale du 11 janvier 2024 (A-61-24). L’appel est en instance.
A-61-24: le 9 février 2024, Galderma Canada Inc. a déposé un avis d’appel de la décision de la Cour fédérale du 11 janvier 2024 (voir le dossier T-906-20 ci-dessus). L’appel est en instance.
Tableau 3. Statut des audiences devant le Conseil en 2023 jusqu’au 31 mai 2024
| Médicament | Indication/utilisation | Titulaire de droits | Publication de l’avis d’audience | Statut |
|---|---|---|---|---|
- |
- |
- |
- |
- |
| Médicament | Indication/utilisation | Titulaire de droits | Publication de l’avis d’audience | Statut |
|---|---|---|---|---|
Adapalène (vendu sous les noms commerciaux Differin et Differin XP) |
Acne |
Galderma Canada Inc. |
(réexamen) |
Ordonnance du Conseil : 7 mai 2020. Galderma doit fournir les renseignements requis pour la période demandée. * Demande de contrôle judiciaire et litige précédent : voir ci-dessous. |
| Médicament | Indication/utilisation | Demandeur | Problème | Date de l’avis d’audience/statut |
|---|---|---|---|---|
Adapalène (vendu sous les noms commerciaux Differin et Differin XP) |
Acne |
Galderma Canada Inc. |
Défaut de soumettre ses rapports (questions relatives à la compétence du Conseil) |
Demande de contrôle judiciaire. Dossier de la Cour T 83 17 (concernant la décision du comité du Conseil du 19 décembre 2016) : décision rendue le 9 novembre 2017 annulant en partie la décision du comité du Conseil. Avis d’appel (Cour d’appel fédérale) déposé le 21 novembre 2017. Dossier de la Cour A-385-17. Décision rendue le 28 juin 2019. Affaire renvoyée pour réexamen par le Conseil. Décision de réexamen rendue le 7 mai 2020. Demande de contrôle judiciaire. Dossier de la Cour T-906-20 (concernant la décision du comité du Conseil du 7 mai 2020) déposée le 11 août 2020. Demande de contrôle judiciaire rejetée le 11 janvier 2024. Avis d’appel (Cour d’appel fédérale) déposé le 9 février 2024. Appel en instance. |
Tendances relatives aux prix des produits pharmaceutiques
Le CEPMB s’acquitte de son mandat en matière de production de rapports en fournissant des renseignements sur les tendances relatives aux prix des produits pharmaceutiques au Canada, d’après les renseignements fournis par le titulaire de droits sur ses ventes de médicaments brevetés, notamment les quantités vendues, les prix courants et nets, et les recettes nettes. La présente section fournit une analyse des tendances relatives aux prix, à l’utilisation et aux ventesNote de bas de page 6 de médicaments brevetés au Canada et sur les marchés internationaux, ainsi que des facteurs contribuant à ces tendancesNote de bas de page 7.
Dans la présente édition du rapport annuel, de nombreuses analyses sont fondées sur les prix courants canadiens plutôt que sur les prix de transaction moyens, qui étaient utilisés au cours des années précédentes. Les prix courants sont les prix courants accessibles au public, tandis que les prix de transaction moyens représentent une estimation du prix net calculé en divisant les ventes d’un médicament par le nombre d’unités venduesNote de bas de page 8. Les prix de transaction moyens peuvent comprendre des remises et des rabais accordés au départ de l’usine (prix accordé par le fabricant au premier acheteur), mais ne comprennent pas les remises et les rabais consentis à d’autres points de la chaîne d’approvisionnement ou par le biais de remboursements ou d’autres ententes avec des assureurs. Par conséquent, il est important de noter que ni le prix courant ni le prix net ne représentent le prix véritable payé par les Canadiens et Canadiennes assurés ou par les régimes publics ou privés d’assurance-médicaments, qui négocient souvent des remises avec les entreprises qui vendent le médicament, les distributeurs et les pharmacies.
Plusieurs raisons expliquent l’utilisation du prix courant dans les données présentées. Tout d’abord, la compétence du CEPMB se limite au prix départ-usine d’un médicament, comme il a été souligné dans des décisions récentes des tribunaux. Les données recueillies par le CEPMB auprès des titulaires de droits ne comprennent pas les prix confidentiels négociés par les payeurs au Canada.
Ensuite, les prix courants sont directement liés à l’écosystème pharmaceutique du Canada et sont pertinents pour toute la population canadienne. Il s’agit des prix que les Canadiens et Canadiennes non assurés paient à la pharmacie (avant les marges bénéficiaires accordées aux pharmacies), et des prix de base utilisés pour calculer le montant de la quote-part des Canadiens et Canadiennes, même si l’assureur a négocié une meilleure entente en coulisse.
Les prix courants sont également un point de convergence pour :
- les négociations de prix entre les assureurs et l’industrie;
- les ententes concernant la liste des produits dans les régimes d’assurance médicaments;
- les prix des grossistes distributeurs;
- le remboursement des services en pharmacie par les régimes d’assurance-médicaments.
Enfin, les renseignements sur les prix à l’étranger soumis au CEPMB par les titulaires de droits sont des prix courants. La comparaison des prix pratiqués au Canada avec ceux pratiqués à l’étranger est plus exacte si tous les prix appartiennent à la même catégorie.
L’utilisation du prix courant pour cette analyse permet d’assurer une meilleure uniformité des renseignements présentés ci-dessous dans les différentes figures, d’effectuer des comparaisons plus efficaces entre les différents pays et de garantir une meilleure compatibilité des données avec celles des autres sources publiques d’analyses sur les produits pharmaceutiques.
Avis de non-responsabilité
Bien que certaines statistiques présentées à la section « Tendances relatives aux prix des produits pharmaceutiques » soient en partie fondées sur des données obtenues sous licence à partir de la base de données MIDAS® appartenant à IQVIA Solutions Canada Inc. et/ou à ses sociétés affiliées (« IQVIA »), les énoncés, les résultats, les conclusions, les points de vue et les opinions présentés dans le présent rapport annuel sont exclusivement ceux du CEPMB et ne peuvent être attribués à IQVIA.
Tendances observées au chapitre des prix
Les prix courants des médicaments brevetés au Canada peuvent augmenter ou diminuer d’une année à l’autre, en fonction de différents facteurs relatifs au marché pharmaceutique. Pour déterminer cette tendance, le CEPMB utilise l’indice des prix des médicaments brevetés (IPMB). L’IPMB mesure la variation annuelle moyenne des prix courants des médicaments brevetés vendus au Canada. La moyenne est pondérée en fonction des ventes de chaque médicament et est fondée sur le prix courant et les renseignements sur les ventes soumis par le titulaire de droits pour une période de six moisNote de bas de page 9. Cette approche est semblable à celle utilisée par Statistique Canada pour calculer l’indice des prix à la consommation (IPC).
La figure 1 montre en parallèle la variation d’une année à l’autre de l’IPMB et de l’IPC, de 2004 à 2023. L’inflation générale des prix, mesurée au moyen de l’IPC, a été supérieure à l’augmentation moyenne des prix des médicaments brevetés presque chaque année depuis 2004. En 2023, l’IPC a augmenté de 3,9 %, alors que l’IPMB a augmenté de 0,7 %.
L’IPMB ne mesure que la croissance des ventes qui est directement attribuable aux variations de prix des médicaments brevetés. Il ne mesure pas les variations qui sont liées à l’utilisation de ces médicaments, aux pratiques de prescription, ni au lancement des nouveaux médicaments, et qui seront explorées ultérieurement dans la présente section.
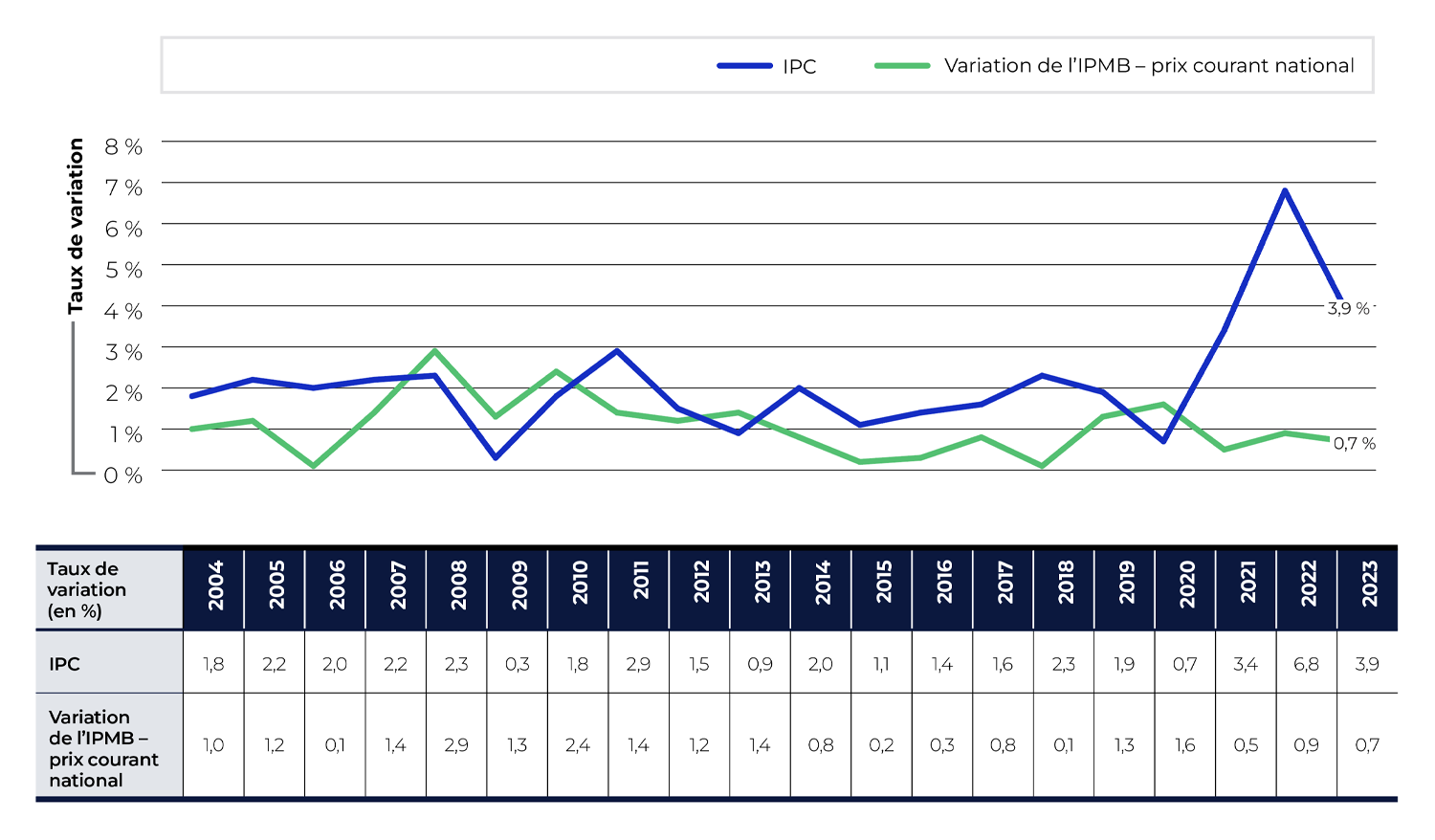
Description de la figure
Ce graphique linéaire montre le pourcentage de variation de l’IPMB et de l’IPC d’une année à l’autre pour la période de 2004 à 2023. L’IPMB est fondé sur le prix courant national au Canada.
| Taux de variation (en %) | IPC | Variation de l’IPMB – prix courant national |
|---|---|---|
2004 |
1,80 % |
1,00 % |
2005 |
2,20 % |
1,20 % |
2006 |
2,00 % |
0,10 % |
2007 |
2,20 % |
1,40 % |
2008 |
2,30 % |
2,90 % |
2009 |
0,30 % |
1,30 % |
2010 |
1,80 % |
2,40 % |
2011 |
2,90 % |
1,40 % |
2012 |
1,50 % |
1,20 % |
2013 |
0,90 % |
1,40 % |
2014 |
2,00 % |
0,80 % |
2015 |
1,10 % |
0,20 % |
2016 |
1,40 % |
0,30 % |
2017 |
1,60 % |
0,80 % |
2018 |
2,30 % |
0,10 % |
2019 |
1,90 % |
1,30 % |
2020 |
0,70 % |
1,60 % |
2021 |
3,40 % |
0,50 % |
2022 |
6,80 % |
0,90 % |
2023 |
3,90 % |
0,70 % |
Notes
Remarque : Pour tenir compte des données révisées fournies par les titulaires de droits, les indices de prix et de volume sont recalculés pour les cinq ans précédant l’année courante du rapport annuel.
Source des données : CEPMB; Statistique Canada
Comparaison des prix pratiqués au Canada avec ceux pratiqués à l’étranger
En plus de déclarer les prix pratiqués au Canada, les titulaires de droits sont tenus de fournir des renseignements sur les prix de leurs médicaments brevetés accessibles au publicNote de bas de page 10 pratiqués dans les 11 pays de comparaison (CEPMB11) : Australie, Belgique, France, Allemagne, Italie, Japon, Espagne, Suède, Norvège, Pays-Bas et Royaume-Uni.
Le CEPMB utilise ces renseignements dans ses examens des prix pour effectuer des comparaisons des prix pratiqués à l’étranger et dans ses rapports de comparaison des prix des médicaments brevetés pratiqués au Canada avec ceux pratiqués à l’étranger.
Variation des prix selon le pays
La figure 2 présente les taux annuels de variation des prix courants pratiqués au Canada et dans chacun des pays du CEPMB11. Cette analyse a été obtenue en appliquant la méthode de l’IPMB, avec une pondération fondée sur les ventes au Canada, aux données sur les prix à l’étranger soumises par les titulaires de droits au CEPMB.
En 2023, les prix courants au Canada ont connu une légère hausse de l’ordre de 0,7 %. Alors que les prix en Italie et aux Pays-Bas ont également augmenté, les prix dans tous les autres pays du CEPMB11 ont diminué, plus particulièrement en Australie (-4,0 %) et en Belgique (-3,3 %). Ces résultats concordent avec la tendance observée à long terme selon laquelle les prix des médicaments brevetés augmentent au fil du temps au Canada, alors qu’ils baissent graduellement dans la plupart des pays de comparaison du CEPMB11.
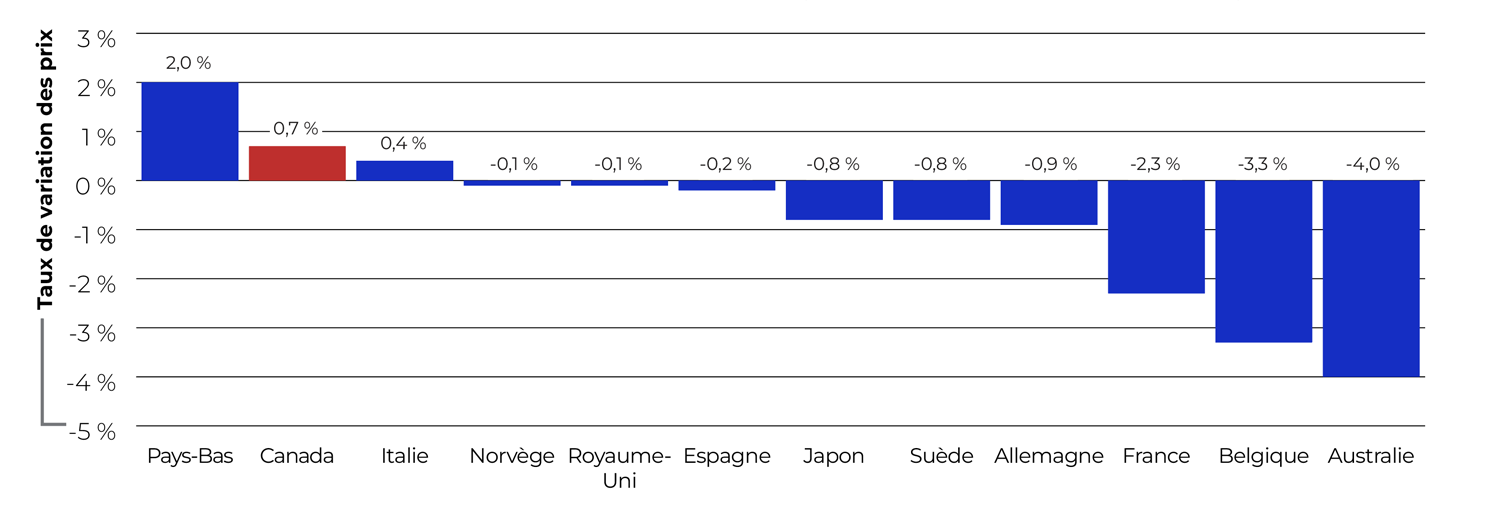
Description de la figure
Ce graphique à barres illustre les taux annuels de variation des prix courants des médicaments brevetés au Canada et pour chacun des pays de comparaison du CEPMB11.
| Pays | Taux annuel de variation des prix, 2023 |
|---|---|
Pays-Bas |
2,0 % |
Canada |
0,7 % |
Italie |
0,4 % |
Norvège |
-0,1 % |
Royaume-Uni |
-0,1 % |
Espagne |
-0,2 % |
Japon |
-0,8 % |
Suède |
-0,8 % |
Allemagne |
-0,9 % |
France |
-2,3 % |
Belgique |
-3,3 % |
Australie |
-4,0 % |
Notes
Source des données : CEPMB
Comparaisons bilatérales des prix
La figure 3 et le tableau 4 fournissent des comparaisons bilatérales des prix courants dans chacun des pays du CEPMB11 par rapport aux prix courants pratiqués au Canada. Les ratios des prix pratiqués à l’étranger par rapport aux prix canadiens sont exprimés sous forme d’indice : une valeur de 1,00 est attribuée au prix canadien, et le prix international est exprimé en fonction de cette valeur. Une valeur inférieure à 1,00 indique que le prix international moyen était inférieur au prix pratiqué au Canada. La variation de ces ratios d’une année à l’autre peut révéler une variation du prix canadien, une variation du prix international ou des variations des taux de change de deux pays.
Comme l’indique la figure 3, les prix courants canadiens étaient supérieurs à ceux de l’ensemble des pays du CEPMB11 en 2023.

Description de la figure
Ce graphique à barres illustre, au moyen des prix courants, les ratios moyens des prix pratiqués dans les pays de comparaison du CEPMB11 par rapport aux prix pratiqués au Canada en 2023.
| Pays | Ratio moyen des prix à l’étranger par rapport aux prix canadiens |
|---|---|
Canada |
1,00 |
Royaume-Uni |
0,98 |
Japon |
0,96 |
Espagne |
0,96 |
Italie |
0,93 |
Pays-Bas |
0,91 |
Allemagne |
0,90 |
Norvège |
0,84 |
Belgique |
0,82 |
Suède |
0,78 |
Australie |
0,71 |
France |
0,69 |
Notes
Remarque : Les prix courants au Canada et sur les marchés internationaux ont été utilisés pour cette analyse. Les résultats ne peuvent pas être comparés directement à ceux des rapports annuels antérieurs, qui utilisaient les prix de transaction moyens (prix nets) dans cette figure.
Source des données : CEPMB; base de données MIDAS®, 2023, IQVIA (tous droits réservés)
Si l’on tient compte des différences dans le coût de la vie à l’étranger au moyen de la parité des pouvoirs d’achat, on constate que la population canadienne a engagé des coûts de consommation plus élevés pour les médicaments brevetés achetés en 2023 par rapport aux résidents et résidentes de l’Australie, de la Belgique, de la France, de la Norvège et de la Suède, mais que ces coûts ont été moins élevés que ceux des résidents et résidentes de l’Allemagne, de l’Italie, du Japon, des Pays-Bas, de l’Espagne et du Royaume-Uni (tableau 4).
Il importe de noter qu’il n’est pas toujours possible de trouver un prix correspondant dans chaque pays de comparaison pour chacune des concentrations et des formes posologiques d’un médicament breveté vendu au Canada. Par exemple, parmi les 1 116 DIN des médicaments brevetés déclarés au CEPMB en 2023 et pour lesquels les données sur les ventes au Canada étaient disponibles au moment de l’analyse, on disposait d’un prix départ-usine accessible au public pour le Japon dans 40 % des cas seulement, alors que ce prix était disponible dans 65 % des cas pour l’Allemagne. Le tableau 4 illustre la fréquence de disponibilité d’un prix de comparaison pratiqué dans chacun des pays de comparaisonNote de bas de page 11.
Remarque au sujet de la méthode : Comparaison des prix aux taux de change du marché et en fonction de la parité des pouvoirs d’achat
Les tableaux 4 et 5 comparent les prix pratiqués dans les pays de comparaison aux prix pratiqués au Canada à l’aide de deux séries de ratios de prix, selon la méthode de conversion en dollars canadiens des prix exprimés dans la devise des différents pays.
Les ratios des prix sont des moyennes arithmétiques des ratios des prix, pondérées en fonction des ventes pour les DIN individuels, la pondération étant fondée sur les tendances des ventes au Canada. Les ratios peuvent ainsi aider à répondre à des questions comme celle-ci :
Combien la population canadienne aurait-elle payé, en plus ou en moins, ses médicaments brevetés en 2023 si elle les avait achetés aux prix pratiqués dans le pays X?
Par exemple, on peut voir au tableau 4 que le ratio des prix pratiqués en France par rapport au ratio des prix au Canada était de 0,69 pour les médicaments disponibles dans les deux pays en 2023. Cela signifie que les Canadiens et Canadiennes auraient payé leurs médicaments brevetés 31 % de moins en 2023 s’ils avaient pu les acheter aux prix pratiqués en France.
Le CEPMB présente les ratios des prix pratiqués à l’étranger par rapport aux prix pratiqués au Canada après avoir converti les prix en équivalents dollars canadiens à l’aide des moyennes des taux de change du marché (plus précisément, les moyennes mobiles des taux de change sur une période de 36 mois que le CEPMB utilise généralement lorsqu’il applique ses Lignes directrices). Les variations de ces ratios d’une année à l’autre peuvent être influencées par des variations dans les taux de change internationaux. Dans les tableaux 4 et 5, les ratios des prix sont également présentés après conversion de la devise à parité des pouvoirs d’achat. La parité des pouvoirs d’achat entre deux pays donnés permet de mesurer le coût relatif de la vie dans ces deux pays, exprimé dans leurs devises respectives. En pratique, le coût de la vie est calculé à l’aide d’un « panier » de produits et de services aux prix courants dans chaque pays.
Appliqués au calcul des taux des prix pratiqués à l’étranger par rapport aux prix pratiqués au Canada, les taux de parité des pouvoirs d’achat fournissent des statistiques qui permettent de répondre à des questions comme la suivante :
Quels autres produits et services la population canadienne aurait-elle dû sacrifier en plus ou en moins pour les médicaments brevetés achetés en 2023 si elle avait vécu dans le pays X?
Par exemple, le ratio des prix pratiqués en France par rapport à ceux pratiqués au Canada à parité du pouvoir d’achat était de 0,82 (tableau 4). Autrement dit, s’ils avaient vécu en France, les Canadiens et Canadiennes auraient eu à sacrifier 18 % moins de biens et services pour pouvoir se procurer les médicaments brevetés qu’ils ont achetés en 2023.
Comme les taux de parité des pouvoirs d’achat représentent le coût relatif de la vie, ils constituent un moyen simple de tenir compte des différences de prix, de revenus et d’autres valeurs monétaires dans la comparaison globale des prix en vigueur dans les différents pays. Les taux de parité des pouvoirs d’achat servent ici de point de référence, mais comme il s’agit d’estimations, ils ne devraient pas être interprétés comme étant directement représentatifs des prix payés dans l’un ou l’autre des pays.
Tableau 4. Ratios des prix courants à l’étranger par rapport aux prix courants canadiens, comparaisons bilatérales, Canada et pays du CEPMB11, 2023
| Canada | Australie | Belgique | France | Allemagne | Italie | Japon | Pays-Bas | Norvège | Espagne | Suède | Royaume-Uni | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
Aux taux de change du marché |
||||||||||||
Ratio des prix 2023 |
1,00 |
0,71 |
0,82 |
0,69 |
0,90 |
0,93 |
0,96 |
0,91 |
0,84 |
0,96 |
0,78 |
0,98 |
Ratio des prix 2022 |
1,00 |
0,73 |
0,83 |
0,70 |
0,91 |
0,92 |
1,06 |
0,92 |
0,85 |
0,95 |
0,80 |
0,97 |
À parité des pouvoirs d’achat |
||||||||||||
Ratio des prix 2023 |
1,00 |
0,66 |
0,98 |
0,82 |
1,06 |
1,28 |
1,13 |
1,07 |
0,87 |
1,32 |
0,82 |
1,00 |
Ratio des prix 2022 |
1,00 |
0,69 |
0,99 |
0,86 |
1,08 |
1,27 |
1,23 |
1,04 |
0,70 |
1,35 |
0,82 |
1,09 |
Nombre de médicaments brevetés comparativement à 2023 (DIN) |
1 116* |
498 |
567 |
497 |
721 |
619 |
441 |
680 |
689 |
660 |
547 |
707 |
Ventes (en millions de dollars) |
19 918,2 $ |
15 776,0 $ |
15 732,0 $ |
12 135,7 $ |
16 709,6 $ |
15 889,1 $ |
13 026,9 $ |
16 762,2 $ |
16 530,5 $ |
15 606,6 $ |
12 165,2 $ |
16 732,6 $ |
Notes
Remarque : Les prix courants au Canada et sur les marchés internationaux ont été utilisés pour la présente analyse. Les résultats ne peuvent pas être comparés directement à ceux des rapports annuels antérieurs, qui utilisaient les prix de transaction moyens (prix nets) dans ce tableau.
* Seuls les médicaments déclarés au CEPMB en 2023 dont les données relatives aux ventes au Canada étaient accessibles au moment de l’analyse ont été pris en compte dans la présente section. Il s’agit d’un sous-ensemble du nombre total de médicaments déclarés au CEPMB en 2023.
Source des données : CEPMB; base de données MIDAS®, 2023, IQVIA (tous droits réservés)
Les titulaires de droits ne déclarent que les données sur les ventes internationales pour les pays du CEPMB11 dans lesquels le médicament breveté est vendu. Pour évaluer comment se situe le Canada par rapport à un ensemble de pays plus vaste que le CEPMB11, on utilise dans la figure 4 les prix pratiqués au Canada et à l’étranger consignés dans la base de données MIDAS® d’IQVIA pour tous les pays de l’Organisation de coopération et de développement économiques (OCDE) pour lesquels des données sont disponibles. Les données de MIDAS reflètent les prix départ-usine et comprennent toutes les ventes dans les pharmacies et les hôpitauxNote de bas de page 12. L’analyse montre que les prix médians de l’OCDE sont, en moyenne, environ 17 % sous les niveaux de prix du Canada, qui se situent au quatrième rang parmi les 31 pays de comparaison.
Dans la figure 4, les ratios des prix pratiqués à l’étranger par rapport aux prix pratiqués au Canada sont calculés à l’aide de la même méthode bilatérale pondérée en fonction des ventes qui est utilisée pour produire les ratios présentés dans la figure 3, mais les résultats varient légèrement en raison de l’utilisation de sources de données différentes.
Remarque au sujet de la méthode : Comparaison des prix avec ceux de l’OCDE
La méthode du CEPMB met l’accent sur le marché canadien, ce qui peut entraîner des comparaisons de prix différentes de celles effectuées dans des études axées sur les États-Unis, notamment dans les constatations récentes présentées par RANDNote de bas de page 13.
Il est important de comprendre la méthode utilisée dans la présente analyse lorsqu’on effectue des comparaisons avec d’autres études :
Choix des médicaments : Pour des raisons de cohérence, l’analyse commence par la liste des médicaments brevetés au Canada, qui sont définis comme les médicaments pour lesquels des ventes ont été déclarées au CEPMB au cours de l’année visée. Dans cette liste, on sélectionne uniquement les médicaments sur ordonnance destinés à l’usage humain qui sont disponibles au Canada et dans les pays de comparaison, le Canada constituant l’élément de base.
Poids de l’indice des prix : Les ratios font l’objet d’un calcul bilatéral et d’une pondération pour tenir compte des tendances relatives aux ventes au Canada pour chaque médicament.
Dans le cas des études qui utilisent une approche différente pour le choix des médicaments et la pondération, des variations peuvent être observées tant sur le plan des ratios des prix que du classement à l’échelle internationale.
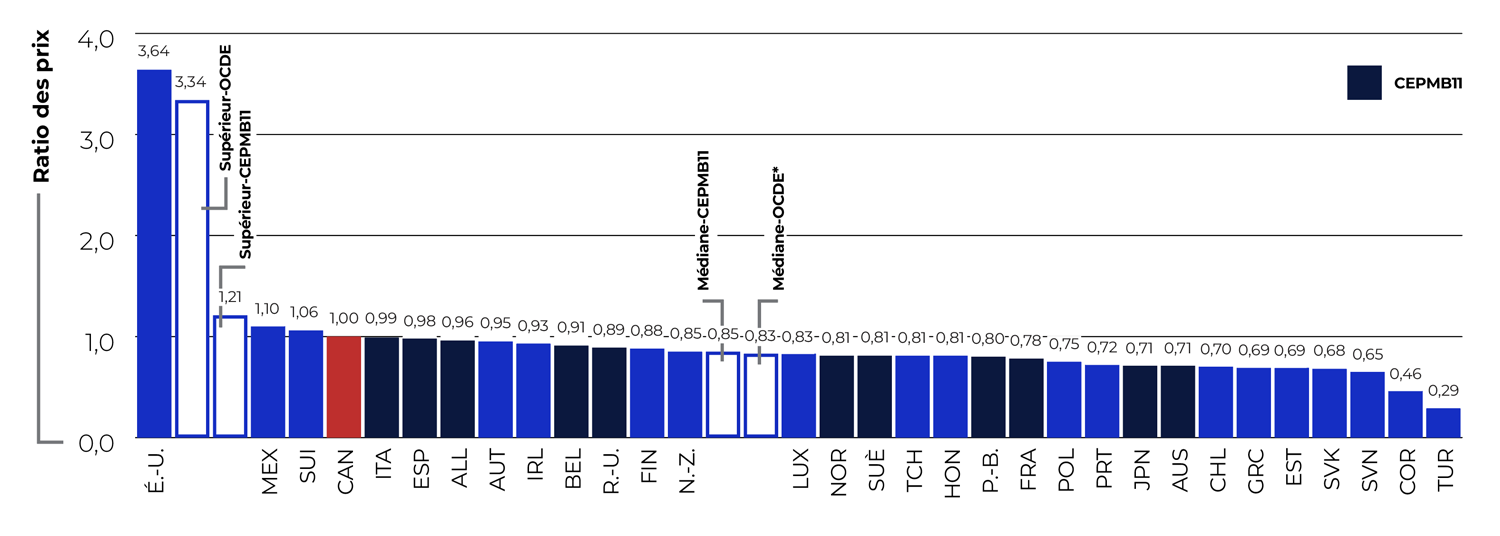
Description de la figure
Ce diagramme à barres présente le ratio moyen des prix des médicaments brevetés dans les pays de l’OCDE par rapport au prix du Canada en 2023. La comparaison a été réalisée au moyen des prix pratiqués au Canada et à l’étranger consignés dans la base de données MIDAS® d’IQVIA. La valeur médiane pour les pays du CEPMB, qui est calculée en fonction des prix des médicaments disponibles dans au moins trois marchés étrangers, était de 0,83. La médiane pour les pays de comparaison du CEPMB11 était de 0,85. Pour le prix le plus élevé des pays de l’OCDE, le ratio était de 3,34, tandis que pour le prix le plus élevé des pays du CEPMB11, il était de 1,21.
| Pays | Ratio moyen des prix à l’étranger par rapport aux prix canadiens |
|---|---|
États-Unis |
3,64 |
Mexique |
1,10 |
Suisse |
1,06 |
Canada |
1,00 |
Italie |
0,99 |
Espagne |
0,98 |
Allemagne |
0,96 |
Autriche |
0,95 |
Irlande |
0,93 |
Belgique |
0,91 |
Royaume-Uni |
0,89 |
Finlande |
0,88 |
Nouvelle-Zélande |
0,85 |
Luxembourg |
0,83 |
Norvège |
0,81 |
Suède |
0,81 |
République tchèque |
0,81 |
Hongrie |
0,81 |
Pays-Bas |
0,80 |
France |
0,78 |
Pologne |
0,75 |
Portugal |
0,72 |
Japon |
0,71 |
Australie |
0,71 |
Chili |
0,70 |
Grèce |
0,69 |
Estonie |
0,69 |
Slovaquie |
0,68 |
Slovénie |
0,65 |
Corée du Sud |
0,46 |
Turquie |
0,29 |
Notes
* Calculé en fonction des prix courants des médicaments disponibles dans au moins trois marchés étrangers.
Source des données : CEPMB; base de données MIDAS®, 2023, IQVIA (tous droits réservés)
Comparaisons multilatérales des prix
Le tableau 5 présente les ratios des prix pratiqués à l’étranger par rapport aux prix pratiqués au Canada, et ce, pour plusieurs mesures multilatérales des prix à l’étranger. Le prix international médian (PIM) correspond à la médiane des prix courants observés dans les pays du CEPMB11, tandis que le prix international le plus élevé (PIPE) correspond au prix courant le plus élevé pour le même groupe. D’autres ratios de prix multilatéraux comparent la moyenne la plus faible et la moyenne simple des prix pratiqués dans les pays du CEPMB11 par rapport aux prix courants pratiqués au Canada.
D’après les résultats obtenus en fonction des taux de change du marché, le ratio du PIM par rapport aux prix pratiqués au Canada était de 0,87 dans les pays du CEPMB11 en 2023, ce qui représente une légère diminution comparativement à 2022. Le ratio du PIPE par rapport aux prix canadiens était de 1,20 (figure 5).
Tableau 5. Ratios des prix courants à l’étranger par rapport aux prix courants canadiens, comparaisons multilatérales, 2023
| Prix médian | Prix le plus faible | Prix le plus élevé | Moyenne | |
|---|---|---|---|---|
| Ratio moyen des prix aux taux de change du marché | 0,87 | 0,62 | 1,20 | 0,87 |
| Ratio moyen des prix à parité des pouvoirs d’achat | 0,99 | 0,64 | 1,50 | 1,01 |
| Nombre de médicaments brevetés | 848 | 848 | 848 | 848 |
| Ventes (en millions de dollars) | 18 909,67 $ | 18 909,67 $ | 18 909,67 $ | 18 909,67 $ |
Notes
Remarque : Les prix courants au Canada et sur les marchés internationaux ont été utilisés pour cette analyse. Les résultats ne peuvent pas être comparés directement à ceux des rapports annuels antérieurs, qui utilisaient les prix de transaction moyens (prix nets) dans ce tableau.
Source des données : CEPMB
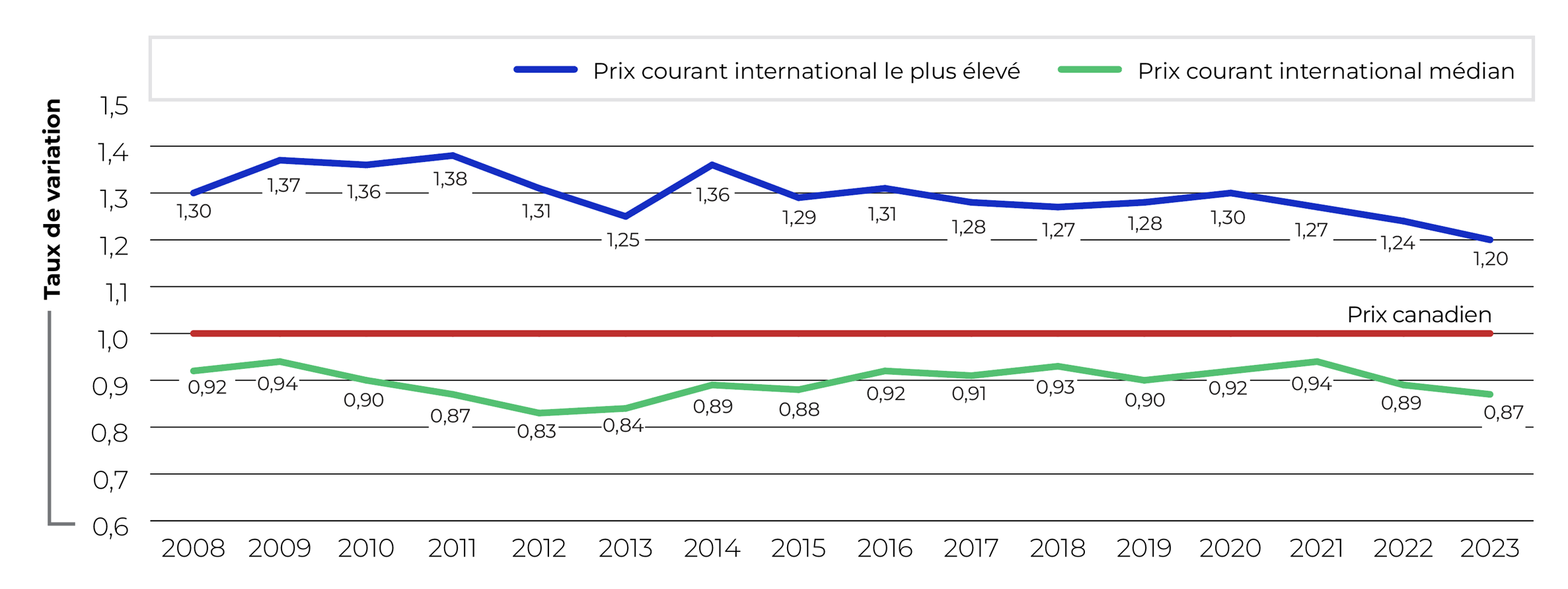
Description de la figure
Ce graphique linéaire présente les ratios moyens des prix à l’étranger par rapport au prix canadien de 2008 à 2023, une valeur de 1,00 étant attribuée au prix courant canadien. Deux lignes illustrent respectivement les tendances relatives au prix international le plus élevé (PIPE) et au prix courant international médian (PIM) des pays du CEPMB11.
| Année | Prix courant international médian | Prix courant international le plus élevé |
|---|---|---|
2008 |
0,92 |
1,30 |
2009 |
0,94 |
1,37 |
2010 |
0,90 |
1,36 |
2011 |
0,87 |
1,38 |
2012 |
0,83 |
1,31 |
2013 |
0,84 |
1,25 |
2014 |
0,89 |
1,36 |
2015 |
0,88 |
1,29 |
2016 |
0,92 |
1,31 |
2017 |
0,91 |
1,28 |
2018 |
0,93 |
1,27 |
2019 |
0,90 |
1,28 |
2020 |
0,92 |
1,30 |
2021 |
0,94 |
1,27 |
2022 |
0,89 |
1,24 |
2023 |
0,87 |
1,20 |
Notes
Remarque : Les prix courants au Canada et sur les marchés internationaux ont été utilisés pour cette analyse. Les résultats ne peuvent pas être comparés directement à ceux des rapports annuels antérieurs, qui utilisaient les prix de transaction moyens (prix nets) dans cette figure.
Les pays du CEPMB11 sont l’Australie, la Belgique, la France, l’Allemagne, l’Italie, le Japon, les Pays-Bas, la Norvège, l’Espagne, la Suède et le Royaume-Uni.
Source des données : CEPMB; base de données MIDAS®, 2008-2023, IQVIA (tous droits réservés)
La figure 6 fournit plus de détails sur les ratios des prix internationaux médians par rapport aux prix pratiqués au Canada en ce qui concerne les médicaments qui sous-tendent les ratios présentés au tableau 5. La figure 6a ventile les ventes de chaque médicament breveté réalisées en 2023 selon la valeur de son ratio PIM par rapport aux prix pratiqués au Canada (ou, pour être plus précis, selon la fourchette dans laquelle s’inscrit le ratio)Note de bas de page 14. Les médicaments brevetés dont les prix internationaux sont semblables à ceux pratiqués au Canada (ratios PIM par rapport aux prix pratiqués au Canada se situant entre 0,90 et 1,10) représentaient 29,2 % des ventes. Les médicaments dont les prix internationaux étaient au moins 10 % inférieurs aux prix pratiqués au Canada (ratios inférieurs à 0,90) représentaient 62,5 % des ventes.
La figure 6b présente la même analyse, mais avec le prix international le plus élevé (PIPE). Dans ce cas, les médicaments dont les ratios étaient supérieurs à 1,10 représentaient 55,9 % des ventes.
Figure 6. Distribution d’intervalle, part des ventes selon le ratio du prix courant, 2023

Description de la figure
Ce graphique à barres présente la distribution des ventes de médicaments brevetés en 2023, selon l’intervalle dans lequel se trouve le ratio du prix courant international médian par rapport au prix canadien. En deçà de 0,50 et au-delà de 1,50, les ratios sont indiqués par tranches de 0,05. À titre d’exemple, les médicaments dont le ratio du PIM par rapport au prix canadien était inférieur à 0,50 représentaient 2,5 % des ventes totales de médicaments brevetés.
| Ratio du PIM par rapport au prix canadien | Part des ventes |
|---|---|
> 1,50 |
1,6 % |
1,45–1,50 |
0,0 % |
1,40–1,45 |
0,2 % |
1,35–1,40 |
0,0 % |
1,30–1,35 |
0,7 % |
1,25–1,30 |
1,4 % |
1,20–1,25 |
0,9 % |
1,15–1,20 |
0,9 % |
1,10–1,15 |
2,4 % |
1,05–1,10 |
2,2 % |
1,00–1,05 |
5,3 % |
0,95–1,00 |
14,1 % |
0,90–0,95 |
7,6 % |
0,85–0,90 |
16,2 % |
0,80–0,85 |
14,1 % |
0,75–0,80 |
4,2 % |
0,70–0,75 |
9,1 % |
0,65–0,70 |
8,5 % |
0,60–0,65 |
5,2 % |
0,55–0,60 |
1,3 % |
0,50–0,55 |
1,4 % |
< 0,50 |
2,5 % |
Notes
Remarque : Les prix courants au Canada et sur les marchés internationaux ont été utilisés pour cette analyse. Les résultats ne peuvent pas être comparés directement à ceux des rapports annuels antérieurs, qui utilisaient les prix de transaction moyens (prix nets) dans cette figure.
Source des données : CEPMB
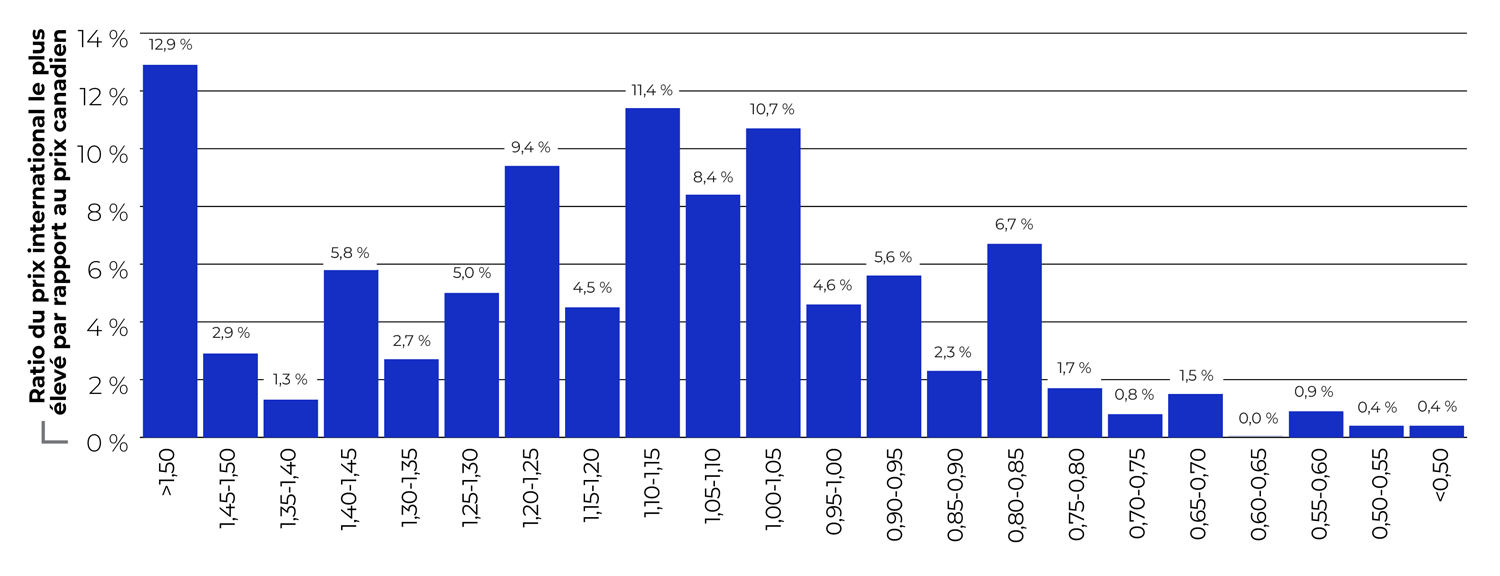
Description de la figure
Ce diagramme à barres présente la distribution des ventes de médicaments brevetés en 2023, selon l’intervalle dans lequel se trouve le ratio du prix courant international le plus élevé par rapport au prix canadien. En deçà de 0,50 et au-delà de 1,50, les ratios sont indiqués par tranches de 0,05. À titre d’exemple, les médicaments dont le ratio du prix international le plus élevé par rapport au prix canadien était inférieur à 0,50 représentaient 0,4 % des ventes totales de médicaments brevetés.
| Ratio du prix international le plus élevé par rapport au prix canadien | Part des ventes |
|---|---|
> 1,50 |
12,9 % |
1,45–1,50 |
2,9 % |
1,40–1,45 |
1,3 % |
1,35–1,40 |
5,8 % |
1,30–1,35 |
2,7 % |
1,25–1,30 |
5,0 % |
1,20–1,25 |
9,4 % |
1,15–1,20 |
4,5 % |
1,10–1,15 |
11,4 % |
1,05–1,10 |
8,4 % |
1,00–1,05 |
10,7 % |
0,95–1,00 |
4,6 % |
0,90–0,95 |
5,6 % |
0,85–0,90 |
2,3 % |
0,80–0,85 |
6,7 % |
0,75–0,80 |
1,7 % |
0,70–0,75 |
0,8 % |
0,65–0,70 |
1,5 % |
0,60–0,65 |
0,0 % |
0,55–0,60 |
0,9 % |
0,50–0,55 |
0,4 % |
< 0,50 |
0,4 % |
Notes
Source des données : CEPMB
Utilisation des médicaments brevetés
Les données sur les prix et sur la valeur des ventes utilisées pour calculer l’IPMB servent également à déterminer les tendances relatives aux quantités de médicaments brevetés vendus au Canada. Le CEPMB calcule à cette fin l’indice du volume des ventes de médicaments brevetés (IVVMB).
La figure 7 présente, pour les années 2004 à 2023, les taux moyens de croissance de l’utilisation des médicaments brevetés, mesurés par l’IVVMB. Les résultats montrent que les ventes de médicaments brevetés ont augmenté de 6,7 % en 2023, soit un taux légèrement supérieur à celui observé l’année précédente.
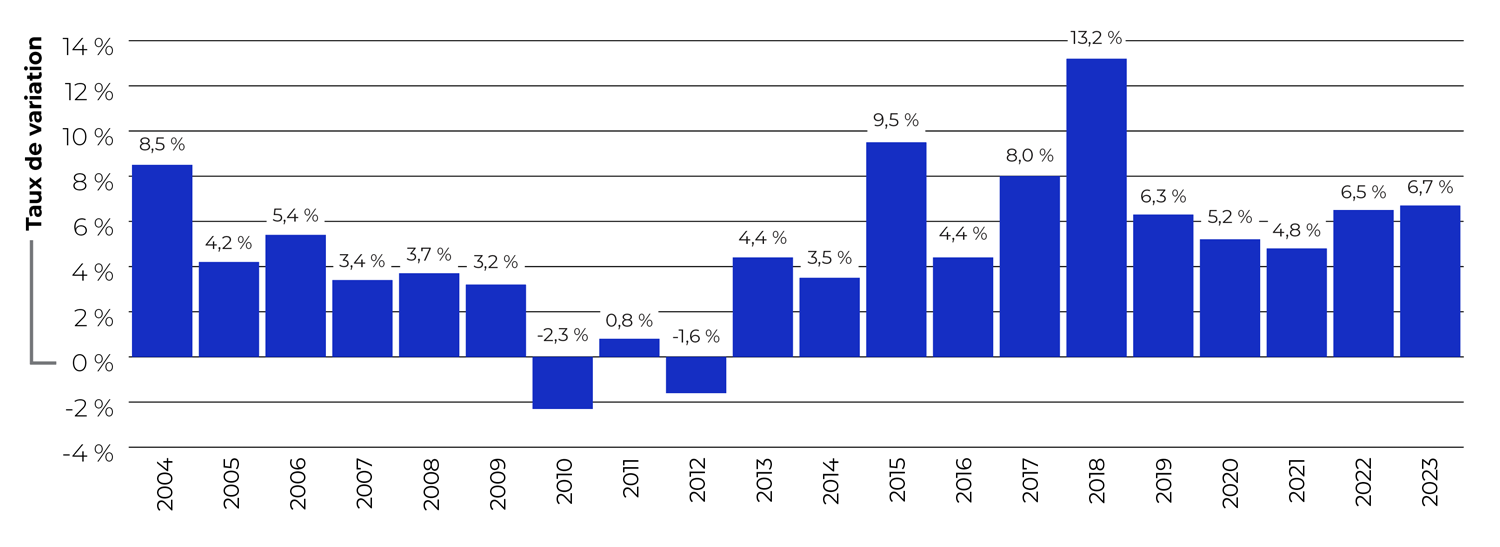
Description de la figure
Ce graphique à barres illustre les taux annuels moyens de croissance de l’utilisation, mesurés par l’indice du volume des ventes de médicaments brevetés (IVVMB), de 2004 à 2023.
| Année | Taux de variation |
|---|---|
2004 |
8,5 % |
2005 |
4,2 % |
2006 |
5,4 % |
2007 |
3,4 % |
2008 |
3,7 % |
2009 |
3,2 % |
2010 |
-2,3 % |
2011 |
0,8 % |
2012 |
-1,6 % |
2013 |
4,4 % |
2014 |
3,5 % |
2015 |
9,5 % |
2016 |
4,4 % |
2017 |
8,0 % |
2018 |
13,2 % |
2019 |
6,3 % |
2020 |
5,2 % |
2021 |
4,8 % |
2022 |
6,5 % |
2023 |
6,7 % |
Notes
Source des données : CEPMB
Tendances relatives aux ventes de médicaments brevetés
Le prix et l’utilisation ne représentent que deux des nombreux facteurs qui influencent les dépenses en médicaments brevetés au Canada. Un examen élargi des tendances relatives aux ventes peut donner une idée des facteurs qui ont influé sur la variation annuelle des ventes, de la façon dont les ventes se comparent à celles des années précédentes et de la situation du Canada par rapport aux marchés internationaux.
Tendances relatives aux ventes
Le peuple canadien a dépensé 1 510 millions de dollars supplémentaires en médicaments brevetés en 2023 par rapport à l’année précédente, ce qui porte les dépenses annuelles totales à 19,9 milliards de dollars. Cela représente une augmentation annuelle de 8,2 % comparativement au taux de croissance sur cinq ans de 3,7 % (tableau 6).
Tableau 6. Ventes de médicaments brevetés, 2019 à 2023
Année |
Médicaments brevetés |
Taux de croissance annuel composé sur cinq ans |
Ventes de médicaments brevetés sous forme de part des ventes de tous les médicaments* |
Ventes de médicaments brevetés par habitant |
Variation des ventes de médicaments brevetés par habitant |
Ventes de médicaments brevetés exprimées en pourcentage du PIB |
|
|---|---|---|---|---|---|---|---|
Ventes (en milliards de dollars) |
Variation des ventes |
||||||
2023 |
19,9 $ |
8,2 % |
3,7 % |
47,3 % |
513,60 % |
10,4 % |
0,670 % |
2022 |
18,4 $ |
5,7 % |
1,8 % |
49,0 % |
465,12 $ |
2,0 % |
0,666 % |
2021 |
17,4 $ |
-1,7 % |
2,2 % |
51,0 % |
456,14 $ |
-3,3 % |
0,758 % |
2020 |
17,7 $ |
3,0 % |
3,2 % |
55,4 % |
472,00 $ |
2,9 % |
0,801 % |
2019 |
17,2 $ |
3,5 % |
4,5 % |
57,5 % |
458,60 $ |
2,7 % |
0,748 % |
Notes
* Le dénominateur dans ce ratio comprend les ventes des médicaments de marque brevetés et non brevetés, et les ventes de médicaments génériques brevetés et non brevetés. Cette valeur se fonde sur les données tirées de la base de données MIDAS® d’IQVIA.
Source des données : CEPMB; base de données MIDAS®, 2019-2023, IQVIA (tous droits réservés)
La figure 8 fait état des tendances relatives aux ventes de médicaments brevetés pour les années 1990 à 2023. Les médicaments brevetés représentaient 47,3 % de toutes les ventes de médicaments au Canada en 2023, soit une baisse par rapport au sommet de 72,7 % enregistré en 2003 et une légère baisse par rapport au taux de 49,0 % enregistré en 2022. Comme le montre la figure 8a, ce pourcentage a généralement diminué depuis 2019, même si les dépenses globales en médicaments brevetés continuent d’afficher une tendance à la hausse. Cela signifie que les ventes de médicaments non brevetés et de médicaments génériques ont augmenté plus rapidement que les ventes de médicaments brevetés au cours des dernières années.
Les tendances relatives aux ventes par habitant et aux ventes exprimées en pourcentage du produit intérieur brut (PIB), qui sont présentées à la figure 8b, démontrent l’importance continue des médicaments brevetés dans l’économie canadienne. Depuis 1990, les ventes de médicaments brevetés par habitant sont passées de 61,60 $ à 513,57 $, alors que les ventes exprimées en pourcentage du PIB sont passées de 0,25 % à 0,68 %.
Figure 8. Tendances relatives aux ventes de médicaments brevetés, de 1990 à 2023

Description de la figure
Ce diagramme linéaire à barres illustre les ventes annuelles de médicaments brevetés et la part des médicaments brevetés de toutes les ventes de médicaments, de 1990 à 2023.
| Année | Ventes de médicaments brevetés (en milliards de dollars) | Part des ventes de médicaments brevetés |
|---|---|---|
1990 |
1,7 $ |
43 % |
1991 |
2,0 $ |
43 % |
1992 |
2,2 $ |
44 % |
1993 |
2,4 $ |
44 % |
1994 |
2,4 $ |
44 % |
1995 |
2,6 $ |
44 % |
1996 |
3,0 $ |
45 % |
1997 |
3,7 $ |
52 % |
1998 |
4,3 $ |
55 % |
1999 |
5,4 $ |
61 % |
2000 |
6,3 $ |
63 % |
2001 |
7,6 $ |
65 % |
2002 |
8,9 $ |
67 % |
2003 |
9,7 $ |
73 % |
2004 |
10,5 $ |
72 % |
2005 |
10,9 $ |
71 % |
2006 |
11,7 $ |
68 % |
2007 |
12,1 $ |
63 % |
2008 |
12,6 $ |
62 % |
2009 |
13,0 $ |
60 % |
2010 |
12,4 $ |
56 % |
2011 |
12,9 $ |
58 % |
2012 |
12,9 $ |
59 % |
2013 |
13,4 $ |
61 % |
2014 |
13,8 $ |
60 % |
2015 |
15,1 $ |
62 % |
2016 |
15,6 $ |
61 % |
2017 |
16,8 $ |
62 % |
2018 |
16,7 $ |
59 % |
2019 |
17,2 $ |
58 % |
2020 |
17,7 $ |
55 % |
2021 |
17,4 $ |
51 % |
2022 |
18,4 $ |
49 % |
2023 |
19,9 $ |
47 % |
Notes
Remarque : Pour tenir compte des données révisées fournies par les titulaires de droits, le CEPMB refait le calcul des ventes pour les cinq années précédant l’année courante du rapport annuel.
La part des médicaments brevetés de toutes les ventes de médicament repose sur un dénominateur comprenant les ventes de médicaments de marque brevetés et non brevetés, et les ventes de médicaments génériques brevetés et non brevetés. Cette valeur se fonde sur les données tirées de la base de données MIDAS® d’IQVIA.
Source des données : CEPMB; base de données MIDAS®, 1990-2023, IQVIA (tous droits réservés)
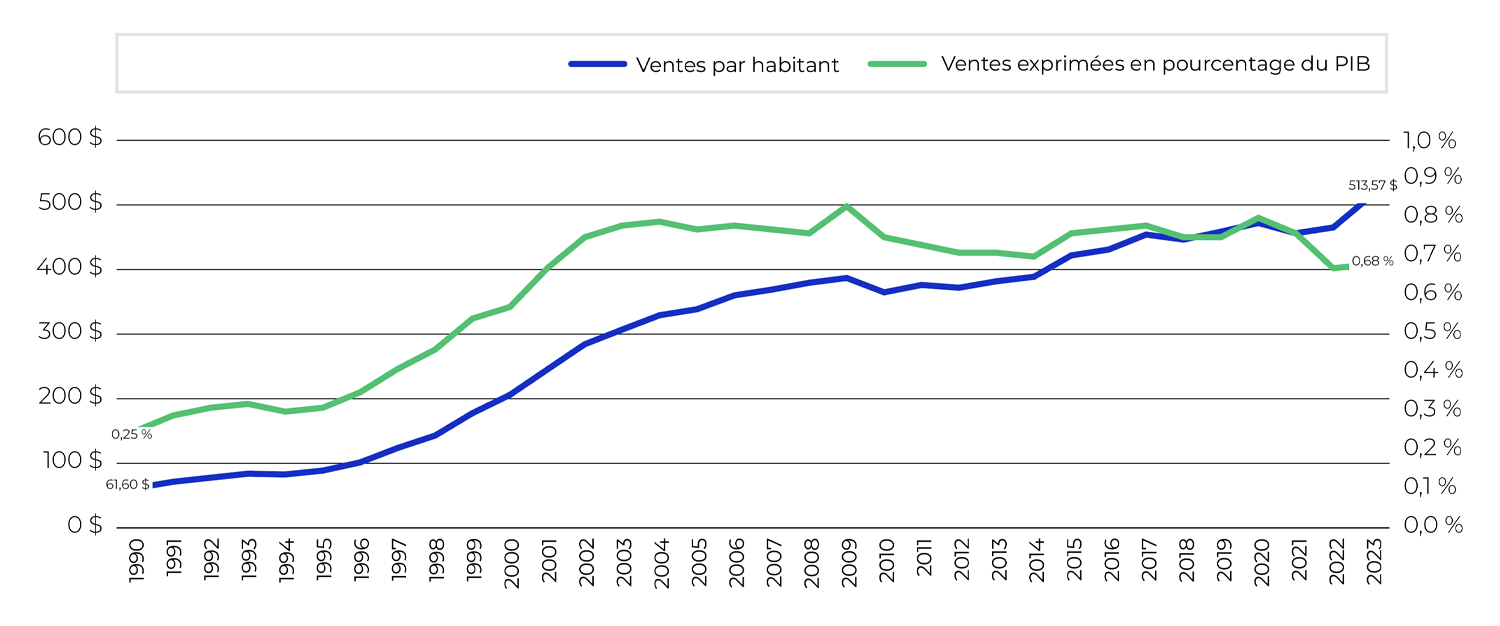
Description de la figure
Ce graphique linéaire illustre les ventes de médicaments brevetés par habitant et sous forme de pourcentage du PIB de 1990 à 2023.
| Année | Ventes par habitant | Ventes exprimées en pourcentage du PIB |
|---|---|---|
1990 |
61,60 $ |
0,25 % |
1991 |
71,40 $ |
0,29 % |
1992 |
77,70 $ |
0,31 % |
1993 |
83,90 $ |
0,32 % |
1994 |
82,80 $ |
0,30 % |
1995 |
88,70 $ |
0,31 % |
1996 |
101,40 $ |
0,35 % |
1997 |
123,70 $ |
0,41 % |
1998 |
142,90 $ |
0,46 % |
1999 |
177,60 $ |
0,54 % |
2000 |
205,90 $ |
0,57 % |
2001 |
245,20 $ |
0,67 % |
2002 |
284,30 $ |
0,75 % |
2003 |
307,00 $ |
0,78 % |
2004 |
329,20 $ |
0,79 % |
2005 |
338,50 $ |
0,77 % |
2006 |
360,00 $ |
0,78 % |
2007 |
368,90 $ |
0,77 % |
2008 |
379,50 $ |
0,76 % |
2009 |
386,90 $ |
0,83 % |
2010 |
364,70 $ |
0,75 % |
2011 |
376,10 $ |
0,73 % |
2012 |
371,80 $ |
0,71 % |
2013 |
381,80 $ |
0,71 % |
2014 |
388,70 $ |
0,70 % |
2015 |
421,80 $ |
0,76 % |
2016 |
430,94 $ |
0,77 % |
2017 |
454,09 $ |
0,78 % |
2018 |
446,30 $ |
0,75 % |
2019 |
458,60 $ |
0,75 % |
2020 |
472,00 $ |
0,80 % |
2021 |
456,14 $ |
0,76 % |
2022 |
465,12 $ |
0,67 % |
2023 |
513,57 $ |
0,68 % |
Notes
Source des données : CEPMB; Statistique Canada; OCDE
Facteurs influant sur la croissance des ventes
Les variations de prix des médicaments brevetés ont joué un rôle mineur dans la croissance annuelle des ventes de médicaments brevetés depuis 2018, ce qui donne à penser qu’en moyenne, les prix des médicaments brevetés actuels sont plutôt stables. Cependant, cela ne tient pas compte des hausses globales des coûts de traitement attribuables à l’arrivée sur le marché de nouveaux médicaments brevetés à coût élevé.
La figure 9 résume les principaux facteurs qui ont influé sur la variation annuelle des ventes de médicaments brevetés entre 2018 et 2023. Le passage à de nouveaux médicaments brevetés à coût élevé est l’élément qui a le plus contribué à la croissance des ventes au cours des dernières années. En 2023, l’utilisation de médicaments brevetés à coût élevé (effet de la combinaison de médicaments) a exercé une pression à la hausse sur les ventes de 1,7 milliard de dollars (9,2 %), tandis que des augmentations de la quantité de médicaments vendus (effet de volume) ont contribué à un effet de poussée supplémentaire de 825 millions de dollars (4,5 %).
Cette pression à la hausse a été compensée par une réorientation modérée de segment de marché, lorsque les ventes d’un certain nombre de médicaments les plus vendus ont cessé d’être déclarées au CEPMB. L’effet de la perte d’exclusivité a exercé un effet de traction de 1,03 milliard de dollars (-5,6 %) sur les ventes en 2023.
Remarque au sujet de la méthode : Facteurs influant sur la croissance des ventes
L’évolution de plusieurs facteurs clés influe sur la croissance des ventes de médicaments brevetés :
- Effet de volume : variations de la quantité de médicaments brevetés vendus. Cet effet porte sur les médicaments établis qui étaient offerts sur le marché pendant la période examinée. Les augmentations de la population, les variations de la répartition démographique (p. ex. des changements dans la répartition selon l’âge), les hausses de l’incidence de maladies, et les changements dans les habitudes de prescription sont parmi les facteurs qui peuvent contribuer à cet effet.
- Effet de la combinaison de médicaments : évolution de la quantité de médicaments brevetés à faible coût ou à coût élevé qui sont consommés. Cet effet s’applique à la fois aux nouveaux médicaments et à ceux qui étaient déjà sur le marché. L’adoption de nouveaux médicaments à coût élevé, le recours à de nouveaux médicaments pour traiter des affections pour lesquelles il n’existait pas encore de traitement efficace, et les changements dans les habitudes de prescription des médecins sont parmi les facteurs qui peuvent contribuer à ce changement.
- Effet du retrait : médicaments précédemment brevetés pour lesquels des recettes tirées de ventes ne sont plus déclarées au CEPMB, ou qui ne sont plus vendus au Canada.
- Effet de la perte d’exclusivité : médicaments ayant perdu l’exclusivité du marché et qui subissent un certain degré de concurrence des versions génériques, mais qui demeurent brevetés.
- Effet du prix : variation du prix des médicaments brevetés actuels. Cet effet s’applique autant aux hausses qu’aux baisses de prix des médicaments brevetés au cours de la période examinée.
Certains facteurs, comme l’effet de la combinaison de médicaments, exercent généralement une pression à la hausse sur les ventes, tandis que d’autres, comme l’effet de la perte d’exclusivité, peuvent avoir l’effet opposé.
L’analyse des facteurs de coût suit l’approche détaillée dans le rapport du CEPMB intitulé Les facteurs de coûts associés aux dépenses en médicaments d’ordonnance : Un rapport méthodologique, 2013.
Figure 9. Principaux moteurs de changement des ventes de médicaments brevetés, 2018 à 2023
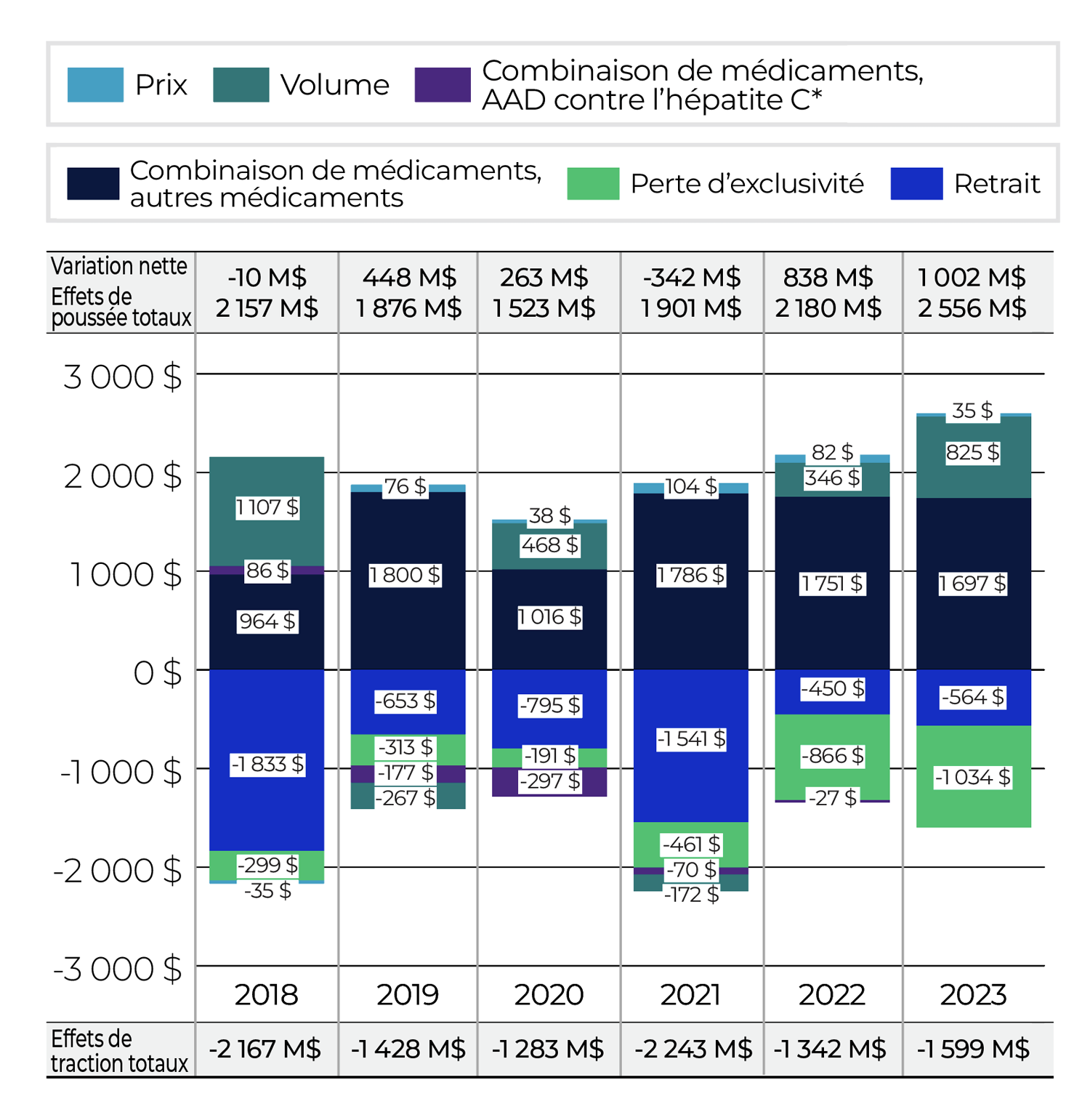
Description de la figure
Ce graphique à barres illustre les facteurs qui ont influé sur les taux de variation annuels au chapitre des ventes de médicaments brevetés de 2018 à 2023 en dollars absolus, ainsi que les effets de poussée (positifs) et de traction (négatifs) totaux. Les antiviraux à action directe (AAD) contre l’hépatite C sont présentés de façon distincte de l’effet de combinaison de médicaments en 2022 en raison de leur haute incidence, mais ils ont été inclus dans l’effet de combinaison en 2023.
Retrait |
Perte d’exclusivité |
Combinaison de médicaments, autres médicaments |
Combinaison de médicaments, AAD contre l’hépatite C |
Volume |
Prix |
Total des effets de traction |
Total des effets de poussée |
Variation nette |
|
|---|---|---|---|---|---|---|---|---|---|
2018 |
-1 833 $ |
-299 $ |
964 $ |
86 $ |
1 107 $ |
-35 $ |
-2 167 $ |
2 157 $ |
-10 $ |
2019 |
-653 $ |
-313 $ |
1 800 $ |
-177 $ |
-267 $ |
76 $ |
-1 428 $ |
1 876 $ |
448 $ |
2020 |
-795 $ |
-191 $ |
1 016 $ |
-297 $ |
468 $ |
38 $ |
-1 283 $ |
1 523 $ |
263 $ |
2021 |
-1 541 $ |
-461 $ |
1 786 $ |
-70 $ |
-172 $ |
104 $ |
-2 243 $ |
1 901 $ |
-342 $ |
2022 |
-450 $ |
-866 $ |
1 751 $ |
-27 $ |
346 $ |
82 $ |
-1 342 $ |
2 180 $ |
838 $ |
2023 |
-564 $ |
-1 034 $ |
1 697 $ |
– |
825 $ |
35 $ |
-1 599 $ |
2 556 $ |
1 002 $ |
Notes
Remarque : Lorsque plusieurs facteurs évoluent simultanément, cela crée un effet résiduel ou croisé, qui n’est pas déclaré séparément dans cette analyse, mais qui est comptabilisé dans la variation de coût total.
Les valeurs peuvent ne pas correspondre à la variation nette parce qu’elles ont été arrondies et qu’elles subissent un effet croisé.
Étant donné que le présent modèle utilise différentes mesures pour isoler les facteurs contribuant à la croissance, la variation nette indiquée ici peut différer légèrement de la variation globale sur le marché des médicaments brevetés indiquée au tableau 6.
* AAD : Antiviraux à action directe pour le traitement de l’hépatite C. À compter de 2023, « Combinaison de médicaments, AAD contre l’hépatite C » est inclus dans « Combinaison de médicaments, autres médicaments ».
Source des données : CEPMB
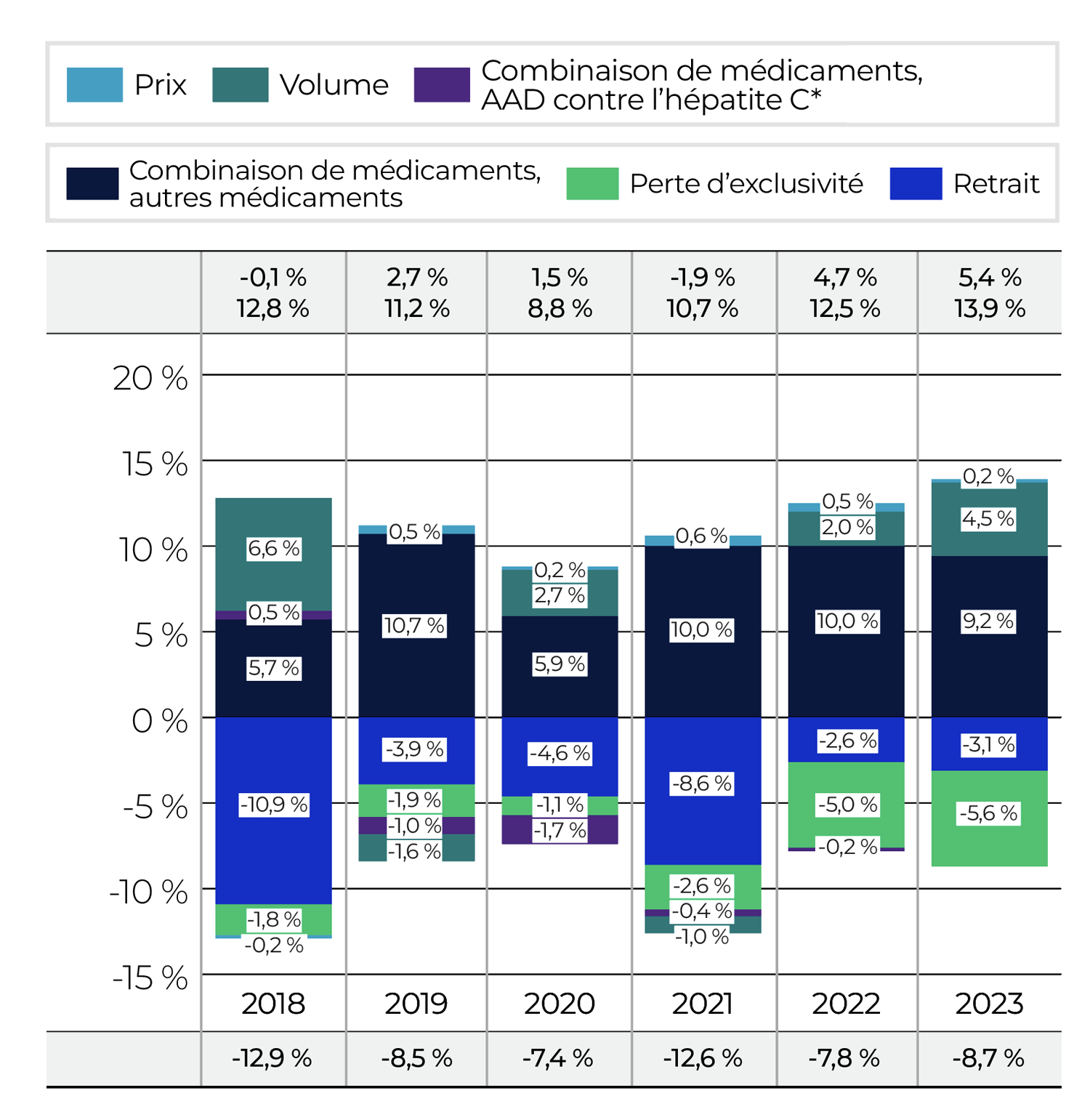
Description de la figure
Ce graphique à barres illustre les facteurs qui ont influé sur les taux de variation annuels au chapitre des ventes de médicaments brevetés de 2018 à 2023 sous forme de taux de croissance en pourcentage pour chaque facteur contributif, ainsi que les effets de poussée (positifs) et de traction (négatifs) totaux. Les antiviraux à action directe (AAD) contre l’hépatite C sont présentés de façon distincte de l’effet de combinaison de médicaments en 2022 en raison de leur haute incidence, mais ils ont été inclus dans l’effet de combinaison en 2023.
Retrait |
Perte d’exclusivité |
Combinaison de médicaments, autres médicaments |
Combinaison de médicaments, AAD contre l’hépatite C |
Volume |
Prix |
Total des effets de traction |
Total des effets de poussée |
Variation nette |
|
|---|---|---|---|---|---|---|---|---|---|
2018 |
-10,9 % |
-1,8 % |
5,7 % |
0,5 % |
6,6 % |
-0,2 % |
-12,9 % |
12,8 % |
-0,1 % |
2019 |
-3,9 % |
-1,9 % |
10,7 % |
-1,0 % |
-1,6 % |
0,5 % |
-8,5 % |
11,2 % |
2,7 % |
2020 |
-4,6 % |
-1,1 % |
5,9 % |
-1,7 % |
2,7 % |
0,2 % |
-7,4 % |
8,8 % |
1,5 % |
2021 |
-8,6 % |
-2,6 % |
10,0 % |
-0,4 % |
-1,0 % |
0,6 % |
-12,6 % |
10,7 % |
-1,9 % |
2022 |
-2,6 % |
-5,0 % |
10,0 % |
-0,2 % |
2,0 % |
0,5 % |
-7,8 % |
12,5 % |
4,7 % |
2023 |
-3,1 % |
-5,6 % |
9,2 % |
– |
4,5 % |
0,2 % |
-8,7 % |
13,9 % |
5,4 % |
Notes
Remarque : Lorsque plusieurs facteurs évoluent simultanément, cela crée un effet résiduel ou croisé, qui n’est pas déclaré séparément dans cette analyse, mais qui est comptabilisé dans la variation de coût total.
Les valeurs peuvent ne pas correspondre à la variation nette parce qu’elles ont été arrondies et qu’elles subissent un effet croisé.
Étant donné que le présent modèle utilise différentes mesures pour isoler les facteurs contribuant à la croissance, la variation nette indiquée ici peut différer légèrement de la variation globale sur le marché des médicaments brevetés indiquée au tableau 6.
* AAD : Antiviraux à action directe pour le traitement de l’hépatite C. À compter de 2023, « Combinaison de médicaments, AAD contre l’hépatite C » est inclus dans « Combinaison de médicaments, autres médicaments ».
Source des données : CEPMB
Ventes sur les marchés mondiaux
Pour comparer les tendances relatives aux ventes au Canada à celles observées sur les marchés internationaux, les figures et les tableaux suivants utilisent les données relatives aux ventes mondiales de l’ensemble des médicaments sur ordonnance d’IQVIANote de bas de page 15.
La figure 10 montre la part des ventes globales du Canada et d’autres marchés nationaux d’envergure, y compris les pays du CEPMB11Note de bas de page 16. Les ventes au Canada représentaient 2,0 % du marché mondial en 2023, faisant du Canada le neuvième marché national en importance pour les produits pharmaceutiques. Au cours des 10 dernières années, le Canada a systématiquement représenté de 2,0 % à 2,5 % du marché mondial.
Description de la figure
Ce diagramme circulaire présente la distribution des ventes des médicaments parmi les principaux marchés mondiaux en 2023.
Marché |
Part des ventes de médicaments, 2023 |
|---|---|
États-Unis |
44,6 % |
Reste du monde |
28,4 % |
Japon |
7,0 % |
Allemagne |
4,1 % |
France |
3,1 % |
Italie |
2,9 % |
Royaume-Uni |
2,4 % |
Espagne |
2,2 % |
Canada |
2,0 % |
Australie |
1,1 % |
Suisse |
0,6 % |
Belgique |
0,6 % |
Suède |
0,4 % |
Norvège |
0,2 % |
Pays-Bas |
0,3 % |
Notes
Source des données : Base de données MIDAS®, 2023, IQVIA (tous droits réservés)
La figure 11 compare les taux annuels de croissance des ventes de médicaments pour l’ensemble du marché pharmaceutique au Canada et dans l’ensemble des pays du CEPMB11. En 2023, les ventes ont augmenté à un rythme légèrement plus rapide au Canada que dans les pays du CEPMB11.
Le Canada représentait 2.0 % des ventes mondiales de produits pharmaceutiques en 2023, occupant la neuvième place en importance dans les marchés nationaux.

Description de la figure
Ce graphique linéaire présente le taux moyen annuel de variation des ventes de médicaments, aux taux de change constants du marché de 2023. On y trouve les taux du Canada, ainsi que les taux moyens et médians pour les pays du CEPMB11, de 2014 à 2023.
| Année | Taux de variation, Canada | Taux de variation, moyenne du CEPMB11 | Taux de variation, médiane du CEPMB11 |
|---|---|---|---|
2014 |
4,7 % |
3,4 % |
2,6 % |
2015 |
6,6 % |
7,3 % |
6,7 % |
2016 |
4,0 % |
5,7 % |
4,0 % |
2017 |
6,9 % |
4,0 % |
3,7 % |
2018 |
4,6 % |
4,6 % |
4,8 % |
2019 |
5,3 % |
5,5 % |
4,9 % |
2020 |
6,7 % |
4,2 % |
4,9 % |
2021 |
7,6 % |
6,5 % |
6,9 % |
2022 |
9,7 % |
8,9 % |
8,1 % |
2023 |
10,0 % |
7,8 % |
8,5 % |
Notes
Source des données : base de données MIDAS®, 2014-2023, IQVIA (tous droits réservés)
La comparaison des dépenses en médicaments entre les pays peut aussi être faite à l’aide de la proportion du revenu national consacrée à l’achat de médicaments. Les comparaisons faites sur cette base tiennent compte des différences au niveau des prix à l’échelle internationale, de l’utilisation globale, des choix thérapeutiques habituellement faits et du revenu national.
En 2021, les Canadiens et Canadiennes ont dépensé 1,7 % du produit intérieur brut sur des médicaments. Il s’agit de la troisième part la plus élevée parmi les pays du CEPMB11, derrière la Belgique et l’Allemagne.
Le tableau 7 présente une perspective historique et internationale du ratio des dépenses pharmaceutiques par rapport au PIB et par habitant, à l’aide des données de l’OCDENote de bas de page 17. Entre 2012 et 2021, le ratio des dépenses par rapport au PIB a diminué, passant de 1,84 % à 1,70 %. Les ratios de cinq autres pays du CEPMB11 — soit l’Australie, la Belgique, la France, les Pays-Bas et le Royaume-Uni — ont également diminué. En 2021, le Canada se classait au troisième rang des pays du CEPMB11 pour ce qui est des ventes de médicaments par habitant, derrière la Belgique et l’Allemagne.
Tableau 7. Dépenses en médicaments, exprimées en pourcentage du PIB et par habitant, Canada et pays du CEPMB11, 2012 et 2021
Pays |
Part : Dépenses en médicaments/PIB 2012 |
Part : Dépenses en médicaments/PIB 2021 |
Croissance : PIB 2012-2021 |
Dépenses en médicaments par habitant 2012 (PPA en $ US) |
Dépenses en médicaments par habitant 2021 (PPA en $ US) |
|---|---|---|---|---|---|
Canada |
1,84 % |
1,70 % |
45,3 % |
562 $ |
778 $ |
Australie |
1,33 % |
1,27 % |
65,0 % |
296 $ |
472 $ |
Belgique |
1,34 % |
1,19 % |
53,2 % |
650 $ |
943 $ |
France |
1,63 % |
1,54 % |
47,5 % |
492 $ |
S.O. |
Allemagne |
1,54 % |
1,79 % |
47,8 % |
481 $ |
870 $ |
Italie |
1,46 % |
1,61 % |
35,9 % |
429 $ |
623 $ |
Japon |
2,02 % |
2,05 % |
16,7 % |
525 $ |
717 $ |
Pays-Bas |
0,86 % |
0,77 % |
49,9 % |
334 $ |
360 $ |
Norvège |
0,67 % |
0,72 % |
46,1 % |
415 $ |
652 $ |
Espagne |
1,45 % |
1,56 % |
39,4 % |
341 $ |
742 $ |
Suède |
1,11 % |
1,04 % |
52,4 % |
439 $ |
593 $ |
Royaume-Uni |
1,21 % |
1,18 % |
45,0 % |
309 $ |
S.O. |
Notes
Remarque : Les dépenses en produits pharmaceutiques par habitant de la France et du Royaume-Uni pour l’année 2021 n’étaient pas disponibles dans la base de données de l’OCDE au moment de l’analyse.
* Ventes totales de produits pharmaceutiques sur le marché intérieur, d’après les prix de détail (le prix final payé par le client).
Source des données : OCDE
Dépenses de recherche et développement
La Loi exige que le CEPMB fasse le suivi et rende compte des dépenses de recherche et développement (R-D) pharmaceutiques, en vue d’améliorer les soins de santé à l’échelle mondiale et nationale et d’offrir davantage d’options de traitement. La présente section fournit des statistiques clés sur l’état actuel des investissements de R-D pharmaceutiques au Canada.
Analyse des dépenses en recherche et développement
Définition de dépenses de R-D
En vertu des articles 5 et 6 du Règlement, les titulaires de droits doivent inclure dans leurs rapports leurs dépenses de R-D qui auraient été admissibles au crédit d’impôt à l’investissement pour la recherche scientifique et le développement expérimental (RS-DE) aux termes de la Loi sur l’impôt sur le revenu qui est entrée en vigueur le 1er décembre 1987Note de bas de page 18.
Ainsi, les dépenses de R-D peuvent inclure les dépenses courantes, les coûts d’immobilisation et l’amortissement autorisé. Les dépenses courantes de R-D comprennent les dépenses autres qu’en capital directement associées à la recherche, dont a) les salaires; b) le matériel direct; c) les honoraires des entrepreneurs et des sous-traitants; d) d’autres coûts directs de production tels que les frais généraux; e) les paiements aux institutions désignées; f) les paiements aux organismes subventionnaires; g) les paiements à d’autres organismesNote de bas de page 19.
Parmi les dépenses de R-D pouvant être déclarées au CEPMB figurent la recherche sur les substances chimiques et biologiques, les procédés de fabrication, les essais précliniques et les essais cliniques de phases I à III. Bien que des sommes d’argent versées à des établissements désignés comme des universités et des instituts de recherche puissent également être admissibles, les subventions sans restrictions accordées à certains établissements d’enseignement et les investissements en capitaux propres dans des entreprises en démarrage ne sont généralement pas admissibles si les subventions ou les investissements peuvent être utilisés pour financer d’autres projets ou dépenses non liés à la RS-DE.
Les frais engagés pour les études de marché, la promotion des ventes, le contrôle de la qualité ou les essais systématiques de matériel, de dispositifs ou de produits ainsi que pour la collecte de données de routine n’étant pas admissibles au crédit d’impôt à l’investissement, ils ne doivent pas figurer dans les dépenses de R-D déclarées par les titulaires de droits.
Entreprises ayant présenté un rapport
Il convient de noter que les entreprises qui n’ont fait aucune vente de médicaments brevetés ne sont pas tenues de présenter un rapport sur leurs dépenses de R-D au CEPMB. Cela a deux conséquences.
D’abord, les dépenses de R-D déclarées au CEPMB ne sont pas représentatives de toute la recherche réalisée dans le secteur pharmaceutique au Canada. Les entreprises qui ne vendent que des médicaments non brevetés et les entreprises qui effectuent de la recherche mais ne vendent aucun médicament ne déclarent pas leurs dépenses en R-DNote de bas de page 20.
Ensuite, comme de nouveaux médicaments brevetés font leur entrée sur le marché canadien et que des brevets existants arrivent à échéance, il est possible que le nombre et l’identité des entreprises devant présenter leurs données de R-D varient d’une année à l’autre. En 2023, 104 entreprises ont déclaré des activités de R-D.
Exigences en matière de rapport
Les résultats statistiques de la présente section proviennent des données soumises au CEPMB par les titulaires de droits.
La Loi oblige les titulaires de droits à faire rapport au CEPMB des recettes brutes totales qu’ils tirent des ventes de tous leurs médicaments à usage humain et à usage vétérinaire (y compris les recettes tirées des ventes de médicaments non brevetés et les recettes découlant d’ententes de vente sous licence) ainsi que de leurs dépenses de R-D au Canada pour leurs différents médicaments (brevetés et non brevetés, à usage humain et à usage vétérinaire).
Pour garantir la juste interprétation des données de la part du personnel, chaque titulaire de droits est invité à vérifier et à confirmer l’exactitude du ratio de ses dépenses de R-D par rapport aux recettes tirées des ventes, avant la publication de cette information.
Défaut de soumettre ses rapports
Il incombe au titulaire de droits de s’assurer de soumettre des données sur la R-D complètes et exactes dans les délais prévus dans le Règlement. En cas de non-respect des exigences de présentation de rapport par un titulaire de droits, le Conseil peut rendre une ordonnance exigeant le respect de ces exigences. Aucune ordonnance de ce type n’a été rendue pour la période de déclaration de 2023.
Définition de recettes tirées des ventes
Aux fins du présent rapport, les recettes tirées des ventes s’entendent du produit brut total des ventes au Canada de tous les médicaments (brevetés et non brevetés, à usage humain et vétérinaire) ainsi que des recettes découlant d’ententes de vente sous licence (p. ex. redevances et droits versés aux titulaires de droits liés aux ventes effectuées au Canada par les titulaires de licence).
Recettes tirées des ventes et dépenses de R-D totales
Au Canada, le ratio des dépenses effectuées en R-D par rapport aux recettes tirées des ventes chez les titulaires de droits pharmaceutiques a affiché une baisse constante entre la fin des années 1990 et 2022. De 2022 à 2023, ce ratio est passé de 3,1 % à 3,7 %, mais il est demeuré inférieur au sommet de 11,7 % atteint en 1995.
Le tableau 8 donne un aperçu des recettes tirées des ventes et des dépenses de R-D déclarées au cours de la période de 2019 à 2023. Les recettes totales tirées des ventes signalées par les titulaires de droits se sont élevées à 29,2 milliards de dollars en 2023, ce qui représente une légère augmentation par rapport à 2022. De ce montant, moins de 1 % des recettes découlent d’un contrat de licence. Les dépenses de R-D ont totalisé 1 069,4 millions de dollars, ce qui représente une augmentation de 17,0 % par rapport à 2022, après une diminution de 1,0 % par rapport à l’année précédente.
Le ratio des dépenses de R-D par rapport aux recettes tirées des ventes des titulaires de droits était de 3,7 % en 2023. Cela représente une diminution de 68 % par rapport au sommet de 11,7 % enregistré en 1995.
Ratio des dépenses de R-D par rapport aux recettes tirées des ventes
Le tableau 8 et la figure 12 présentent également les ratios des dépenses de R-D par rapport aux recettes tirées des ventesNote de bas de page 21. Le ratio des dépenses de R-D par rapport aux recettes tirées des ventes était de 3,7 % en 2023, ce qui représente une augmentation par rapport à 2022. Le ratio global des dépenses de R-D par rapport aux recettes tirées des ventes a été inférieur à 10 % au cours des 23 dernières années, et ce, malgré l’engagement public des sociétés membres de Médicaments novateurs Canada de porter, avant 1996, leurs dépenses annuelles de R-D à 10 % des recettes tirées de leurs ventesNote de bas de page 22.
Tableau 8. Dépenses totales de R-D et ratios des dépenses de R-D par rapport aux recettes tirées des ventes des entreprises faisant rapport, 2019 à 2023
Année |
Nombre d’entreprises faisant rapport |
Dépenses de R-D de tous les titulaires de droits (en millions de dollars) |
Variation par rapport à l’année précédente |
Recettes tirées des ventes (en millions de dollars) |
Variation par rapport à l’année précédente |
Ratio des dépenses de R D par rapport aux recettes tirées des ventes |
|---|---|---|---|---|---|---|
2023 |
104 |
1 069,3 $ |
17,0 % |
29 204,2 $ |
0,2 % |
3,7 % |
2022 |
100 |
914,0 $ |
-1,0 % |
29 144,9 $ |
6,1 % |
3,1 % |
2021 |
100 |
922,9 $ |
12,2 % |
27 478,5 $ |
13,2 % |
3,4 % |
2020 |
99 |
822,9 $ |
-7,9 % |
24 278,2 $ |
5,1 % |
3,4 % |
2019 |
101 |
893,2 $ |
0,1 % |
23 101,0 $ |
1,9 % |
3,9 % |
Notes
Source des données : CEPMB

Description de la figure
Ce graphique linéaire présente le ratio des dépenses de R-D par rapport aux recettes tirées des ventes selon les titulaires de droits pharmaceutiques, de 1988 à 2023.
| Année | Ratio des dépenses de R-D par rapport aux recettes tirées des ventes pour les titulaires de droits |
|---|---|
1988 |
6,1 % |
1989 |
8,2 % |
1990 |
9,3 % |
1991 |
9,7 % |
1992 |
9,9 % |
1993 |
10,6 % |
1994 |
11,3 % |
1995 |
11,7 % |
1996 |
11,4 % |
1997 |
11,5 % |
1998 |
11,5 % |
1999 |
10,8 % |
2000 |
10,1 % |
2001 |
9,9 % |
2002 |
9,9 % |
2003 |
8,8 % |
2004 |
8,3 % |
2005 |
8,7 % |
2006 |
8,1 % |
2007 |
8,2 % |
2008 |
8,1 % |
2009 |
7,5 % |
2010 |
6,9 % |
2011 |
5,6 % |
2012 |
5,2 % |
2013 |
4,4 % |
2014 |
4,3 % |
2015 |
4,4 % |
2016 |
4,4 % |
2017 |
4,1 % |
2018 |
4,0 % |
2019 |
3,9 % |
2020 |
3,4 % |
2021 |
3,4 % |
2022 |
3,1 % |
2023 |
3,7 % |
Notes
Source des données : CEPMB
Dépenses courantes de R-D selon le type de recherche
Le tableau 9 présente des données sur la ventilation des dépenses courantes de R-D (c’est-à-dire les dépenses totales de R-D moins les dépenses en capital) en recherche fondamentale et appliquée ainsi que d’autres types de R-D admissiblesNote de bas de page 23. Les titulaires de droits ont fait état de dépenses de recherche fondamentale totalisant 111,8 millions de dollars en 2023 ou 10,8 % des dépenses courantes de R-D, soit une diminution de 15,3 % par rapport à l’année précédente. Une somme de 615,3 millions de dollars a été dépensée dans la recherche appliquée, soit 59,3 % des dépenses courantes de R-D. Les essais cliniques (de phase I à III) représentaient 76,0 % des dépenses de recherche appliquée.
Tableau 9. Dépenses courantes de R-D selon le type de recherche, 2023 et 2022
Type de recherche |
Dépenses : 2023 (en millions de dollars) |
Part : 2023 |
Dépenses : 2022 (en millions de dollars) |
Part : 2022 |
Variation annuelle des dépenses |
|---|---|---|---|---|---|
Fondamentale |
111,8 $ |
10,8 % |
132,0 $ |
14,9 % |
-15,3 % |
Substances chimiques |
61,4 $ |
5,9 % |
89,1 $ |
10,0 % |
-31,1 % |
Substances biologiques |
50,4 $ |
4,9 % |
42,9 $ |
4,9 % |
17,5 % |
Appliquée |
615,3 $ |
59,3 % |
484,4 $ |
54,9 % |
27,0 % |
Procédé de fabrication |
66,9 $ |
6,5 % |
38,1 $ |
4,3 % |
75,6 % |
Essai préclinique I |
37,9 $ |
6,7 % |
39,5 $ |
4,5 % |
-4,1 % |
Essai préclinique II |
39,9 $ |
3,8 % |
19,3 $ |
2,2 % |
106,7 % |
Essai clinique de phase I |
71,1 $ |
6,8 % |
45,2 $ |
5,1 % |
57,3 % |
Essai clinique de phase II |
89,4 $ |
8,6 % |
70,3 $ |
8,0 % |
27,2 % |
Essai clinique de phase III |
310,2 $ |
29,9 % |
272,0 $ |
30,8 % |
14,0 % |
Autre R-D admissible |
310,9 $ |
30,3 % |
266,4 $ |
30,2 % |
16,7 % |
Total* |
1 038,0 $ |
100 % |
882,8 $ |
100 % |
17,6 % |
Notes
Remarque : Les renseignements présentés dans ce tableau sont fondés sur les dépenses courantes de R-D. Les dépenses totales de R-D sont la somme des dépenses courantes et des dépenses en capital (équipement + amortissement).
* Les chiffres ayant été arrondis, leur somme peut ne pas correspondre aux totaux indiqués.
Source des données : CEPMB
Dépenses courantes de R-D selon le milieu de recherche
Les titulaires de droits peuvent inclure dans leurs dépenses de R-D la recherche qu’ils effectuent eux mêmes à l’interne ainsi que la recherche qu’ils font faire à l’externe, notamment par des universités, des hôpitaux et d’autres fabricants.
En 2023, les recherches effectuées à l’interne représentaient 48,3 % des dépenses courantes de recherche (tableau 10). La proportion de la R-D effectuée par d’autres entreprises pour le compte des titulaires de droits représentait 25,7 % de l’ensemble des dépenses courantes, tandis que la recherche effectuée par des universités et par des hôpitaux représentait 13,5 % des dépenses courantes.
Tableau 10. Dépenses courantes de R-D selon le milieu de recherche, 2023 et 2022
| Milieu de recherche | Dépenses : 2023 (en millions de dollars) | Part : 2023 | Dépenses : 2022 (en millions de dollars) | Part : 2022 | Variation annuelle des dépenses |
|---|---|---|---|---|---|
| À l’interne | |||||
Titulaires de droits |
501,4 $ |
48,3% |
446,6 $ |
50,6% |
12,3% |
| À l’externe | |||||
Universités et hôpitaux |
140,1 $ |
13,5% |
128,4 $ |
14,5% |
9,2% |
Autres entreprises |
266,7 $ |
25,7% |
203,8 $ |
23,1% |
30,9% |
Autres |
129,9 $ |
12,5% |
104,0 $ |
11,8% |
24,9% |
Total* |
1 038,0 $ |
100% |
882,8 $ |
100% |
17,6% |
Notes
Remarque : Les renseignements présentés dans ce tableau sont fondés sur les dépenses courantes de R-D. Les dépenses totales de R-D sont la somme des dépenses courantes et des dépenses en capital (équipement + amortissement).
* Les chiffres ayant été arrondis, leur somme peut ne pas correspondre aux totaux indiqués.
Source des données : CEPMB
Dépenses totales de R-D selon la provenance des fonds
Le tableau 11 présente des renseignements sur la provenance des fonds utilisés par les titulaires de droits pour financer leurs activités de R-D. En 2022, les titulaires ont financé à même leurs propres fonds la majeure partie de leur R-D (89,0 % des dépenses totales). Les fonds provenant du gouvernement ont servi à financer 0,4 % des dépenses totales.
Tableau 11. Ensemble des dépenses de R-D selon la provenance des fonds, 2023 et 2022
| Provenance des fonds | Dépenses : 2023 (en millions de dollars) | Part : 2023 | Dépenses : 2022 (en millions de dollars) | Part : 2022 | Variation annuelle des dépenses |
|---|---|---|---|---|---|
Fonds de l’entreprise |
951,9 $ |
89,0 % |
827,9 $ |
90,6 % |
15,0 % |
Gouvernements fédéral et provinciaux |
4,4 $ |
0,4 % |
5,0 $ |
0,6 % |
-12,2 % |
Autres |
113,0 $ |
10,6 % |
81,0 $ |
8,9 % |
39,4 % |
Total* |
1 069,3 $ |
100 % |
914,0 $ |
100 % |
17,0 % |
Notes
* Les chiffres ayant été arrondis, leur somme peut ne pas correspondre aux totaux indiqués.
Source des données : CEPMB
Dépenses courantes de R-D selon la région
Les tableaux 12 et 13 montrent les dépenses courantes de R-D selon la région. Comme par le passé, les dépenses ont été surtout engagées en Ontario et au Québec en 2023, ces deux provinces accaparant 81,2 % de la valeur totale des dépenses courantes de R-D. Entre 2022 et 2023, la valeur des dépenses de R-D a augmenté de 13,0 % dans les provinces de l’Atlantique, de 28,4 % au Québec et de 20,5 % en Ontario, tandis qu’elle a diminué de 3,8 % dans l’Ouest du pays.
Tableau 12. Dépenses courantes de R-D selon la région, 2023 et 2022
| Région | Dépenses : 2023 (en millions de dollars) | Part : 2023 | Dépenses : 2022 (en millions de dollars) | Part : 2022 | Variation annuelle des dépenses |
|---|---|---|---|---|---|
Provinces de l’Atlantique |
14,9 $ |
1,4 % |
13,2 $ |
1,5 % |
13,0 % |
Québec |
337,6 $ |
32,5 % |
262,9 $ |
29,8 % |
28,4 % |
Ontario |
505,9 $ |
48,7 % |
419,9 $ |
47,6 % |
20,5 % |
Provinces de l’Ouest |
179,6 $ |
17,3 % |
186,7 $ |
21,1 % |
-3,8 % |
Territoires |
0,1 $ |
0,0 % |
0,1 $ |
0,0 % |
-26,0 % |
Total* |
1 038,0 $ |
100 % |
882,8 $ |
100 % |
17,6 % |
Notes
Remarque : Les renseignements présentés dans ce tableau sont fondés sur les dépenses courantes de R-D. Les dépenses totales de R-D sont la somme des dépenses courantes et des dépenses en capital (équipement + amortissement).
* Les chiffres ayant été arrondis, leur somme peut ne pas correspondre aux totaux indiqués.
Source des données : CEPMB
Tableau 13. Dépenses courantes de R-D selon le milieu de recherche et la province ou le territoire, 2023
| Province | Titulaires de droits | Autres entreprises | Universités | Hôpitaux | Autres | |
|---|---|---|---|---|---|---|
Terre-Neuve-et-Labrador |
Dépenses (en milliers de dollars) |
568,91 $ |
359,06 $ |
9,00 $ |
41,55 $ |
100,16 $ |
Part |
52,7 % |
33,3 % |
0,8 % |
3,9 % |
9,3 % |
|
Île-du-Prince-Édouard |
Dépenses (en milliers de dollars) |
69,13 $ |
89,57 $ |
0,00 $ |
0,00 $ |
0,00 $ |
Part |
43,6 % |
56,4 % |
0,0 % |
0,0 % |
0,0 % |
|
Nouvelle-Écosse |
Dépenses (en milliers de dollars) |
1 152,37 $ |
2 439,90 $ |
1 002,23 $ |
1 337,43 $ |
4 108,81 $ |
Part |
11,5 % |
24,3 % |
9,9 % |
13,3 % |
40,9 % |
|
Nouveau-Brunswick |
Dépenses (en milliers de dollars) |
731,84 $ |
1 395,42 $ |
115,10 $ |
58,44 $ |
1 306,59 $ |
Part |
20,3 % |
38,7 % |
3,2 % |
1,6 % |
36,2 % |
|
Québec |
Dépenses (en milliers de dollars) |
103 959,89 $ |
116 174,41 $ |
21 438,50 $ |
24 269,71 $ |
71 739,36 $ |
Part |
30,8 % |
34,4 % |
6,4 % |
7,2 % |
21,3 % |
|
Ontario |
Dépenses (en milliers de dollars) |
286 178,25 $ |
110 843,89 $ |
34 068,16 $ |
39 454,19 $ |
35 384,63 $ |
Part |
56,6 % |
21,9 % |
6,7 % |
7,8 % |
6,9 % |
|
Manitoba |
Dépenses (en milliers de dollars) |
2 922,71 $ |
344,54 $ |
640,91 $ |
412,72 $ |
174,78 $ |
Part |
65,0 % |
7,7 % |
14,3 % |
9,2 % |
3,9 % |
|
Saskatchewan |
Dépenses (en milliers de dollars) |
533,30 $ |
346,43 $ |
850,69 $ |
0,00 $ |
53,48 $ |
Part |
29,9 % |
19,4 % |
47,7 % |
0,0 % |
3,0 % |
|
Alberta |
Dépenses (en milliers de dollars) |
68 463,81 $ |
12 175,10 $ |
3 940,90 $ |
4 516,92 $ |
8 453,95 $ |
Part |
70,2 % |
12,5 % |
4,0 % |
4,6 % |
8,7 % |
|
Colombie-Britannique |
Dépenses (en milliers de dollars) |
36 744,96 $ |
22 513,45 $ |
3 526,15 $ |
4 415,84 $ |
8 525,07 $ |
Part |
48,5 % |
29,7 % |
4,7 % |
5,8 % |
11,2 % |
|
Territoires |
Dépenses (en milliers de dollars) |
52,05 $ |
0,00 $ |
0,00 $ |
0,00 $ |
0,00 $ |
Part |
100,0 % |
0,0 % |
0,0 % |
0,0 % |
0,0 % |
|
Canada* |
Dépenses (en milliers de dollars) |
501 377,23 $ |
266 681,76 $ |
65 591,65 $ |
74 506,80 $ |
129 846,84 $ |
Part |
48,3 % |
25,7 % |
6,3 % |
7,2 % |
12,5 % |
|
Notes
Remarque : Pour chaque province et territoire, la part de chaque catégorie représente le pourcentage des dépenses totales de R-D pour la province ou le territoire donné (ou à l’échelle nationale pour l’ensemble des dépenses de R-D au Canada).
Les renseignements présentés dans ce tableau sont fondés sur les dépenses courantes de R-D. Les dépenses totales de R-D sont la somme des dépenses courantes et des dépenses en capital (équipement + amortissement).
* Les dépenses provinciales/territoriales peuvent ne pas correspondre aux totaux pour le Canada et la somme des parts indiquées sur chacune des lignes peut ne pas correspondre à 100 % puisque les chiffres ont été arrondis.
Source des données : CEPMB
Dépenses mondiales de R-D
Une multitude de facteurs déterminent l’endroit où est menée la R-D pharmaceutique, dont la présence, la qualité et la rentabilité des meilleures institutions scientifiques et l’accès aisé à une infrastructure de haute qualité pour les essais cliniques.
La figure 13 compare les ratios des dépenses de R-D par rapport aux recettes tirées des ventes de produits pharmaceutiques canadiens à ceux des pays du CEPMB11 pour les années 2001, 2011 et 2021. Ces trois années de données fournissent un aperçu des tendances observées sur le marché au cours des 20 dernières années. En 2021, le Canada affichait un ratio des dépenses de R-D par rapport aux recettes tirées des ventes de 3,4 %, une valeur qui est inférieure à celle de tous les pays de comparaison, et qui représente moins d’un cinquième du ratio obtenu avec l’ensemble des dépenses de R-D et des recettes tirées des ventes de tous les pays du CEPMB11 (19,6 %).
Les données utilisées pour calculer les ratios des dépenses de R-D par rapport aux recettes tirées des ventes des pays du CEPMB11 proviennent de la Fédération européenne des associations de l’industrie pharmaceutique (FEAIP), une association commerciale et une organisation de lobbying qui représente l’industrie pharmaceutique en Europe. Les données fournies par la FEAIP sont des données autodéclarées par des associations membres, et la façon dont leur définition d’un investissement dans la R-D se distingue de la définition des dépenses de R-D qui doivent être déclarées au CEPMB n’est pas indiquée clairement. Par conséquent, les ratios au Canada ne sont pas directement comparables à ceux déclarés pour les pays du CEPMB11.
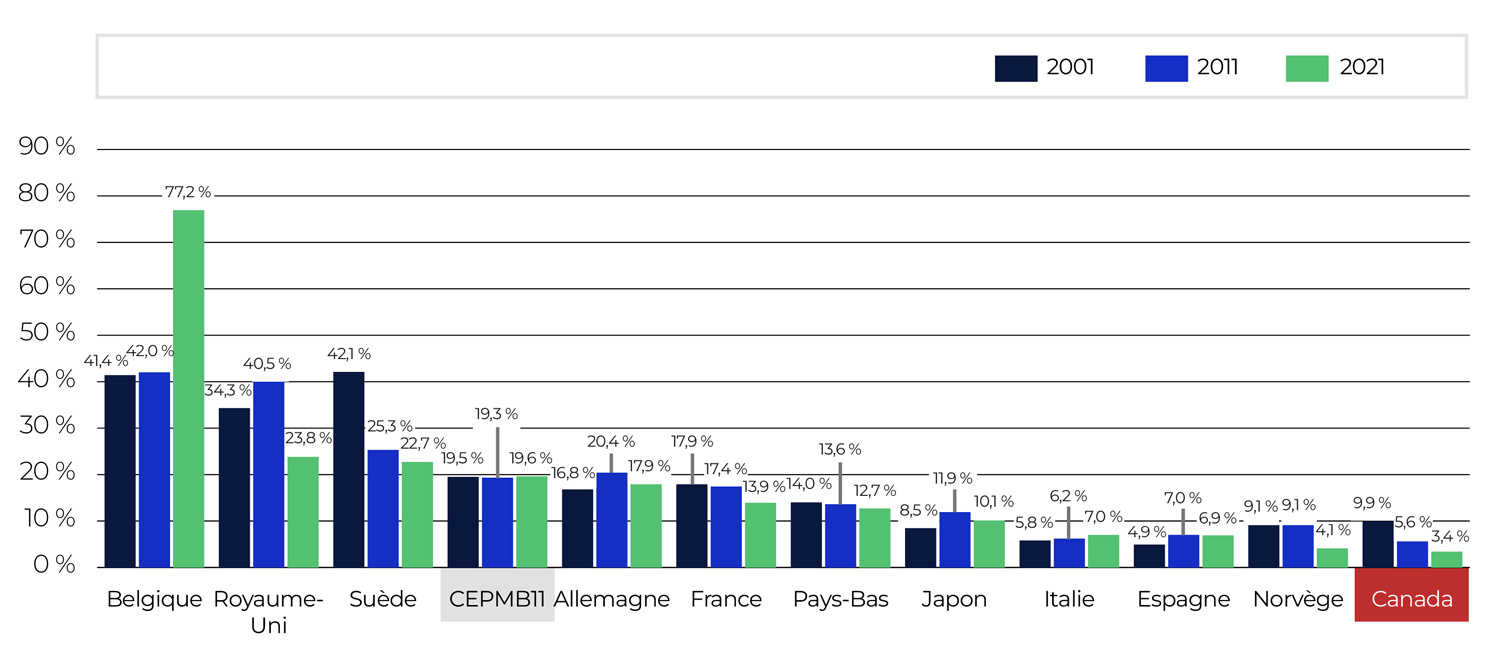
Description de la figure
Ce graphique à barres présente le ratio des dépenses de R-D par rapport aux recettes tirées des ventes au Canada et dans les pays de comparaison du CEPMB11, en 2001, 2011 et 2021.
| Ratio des dépenses de R-D par rapport aux recettes tirées des ventes, 2001 | Ratio des dépenses de R-D par rapport aux recettes tirées des ventes, 2011 | Ratio des dépenses de R-D par rapport aux recettes tirées des ventes, 2021 | |
|---|---|---|---|
Belgique |
41,4 % |
42,0 % |
77,2 % |
Royaume-Uni |
34,3 % |
40,5 % |
23,8 % |
Suède |
42,1 % |
25,3 % |
22,7 % |
CEPMB11 |
19,5 % |
19,3 % |
19,6 % |
Allemagne |
16,8 % |
20,4 % |
17,9 % |
France |
17,9 % |
17,4 % |
13,9 % |
Pays-Bas |
14,0 % |
13,6 % |
12,7 % |
Japon |
8,5 % |
11,9 % |
10,1 % |
Italie |
5,8 % |
6,2 % |
7,0 % |
Espagne |
4,9 % |
7,0 % |
6,9 % |
Norvège |
9,1 % |
9,1 % |
4,1 % |
Canada |
9,9 % |
5,6 % |
3,4 % |
Notes
Remarque : Les données pour l’Australie n’étaient pas disponibles.
Source des données : CEPMB; Fédération européenne des associations de l’industrie pharmaceutique (FEAIP) : L’industrie pharmaceutique dans les figures 2022; Japan Pharmaceutical Manufacturers Association (JPMA)
Initiative de recherche du Système national d’information sur l’utilisation des médicaments prescrits
Le Système national d’information sur l’utilisation des médicaments prescrits (SNIUMP) est une initiative de recherche qui permet de mieux comprendre l’utilisation des médicaments au Canada en fournissant au ministre de la Santé des rapports complets et exacts permettant d’orienter la prise de décisions et de favoriser la viabilité de notre système pharmaceutique. La présente section fournit des renseignements généraux sur cette initiative ainsi que des liens vers les rapports du SNIUMP soumis au ministre en 2023.
Contexte
À la demande du ministre de la Santé en vertu de l’article 90 de la Loi, le CEPMB doit fournir au ministre des rapports renfermant des renseignements essentiels sur les tendances en matière de prix, d’utilisation et de coûts afin que le système de soins de santé du Canada dispose de renseignements complets et exacts sur la consommation des médicaments et sur les sources de pression sur les coûts.
À la demande du ministre, les priorités et méthodes de recherche propres au SNIUMP concernant les rapports fournis au ministre par le CEPMB sont établies avec l’aide du Comité consultatif du SNIUMP pour faire en sorte qu’elles correspondent aux priorités de celui-ci. Le Comité consultatif, dont les membres sont nommés par le ministre, est constitué de représentants des régimes publics d’assurance médicaments de la Colombie-Britannique, de l’Alberta, de la Saskatchewan, du Manitoba, de l’Ontario, du Nouveau-Brunswick, de la Nouvelle-Écosse, de l’Île-du-Prince-Édouard, de Terre-Neuve-et-Labrador, du Yukon, du Programme des services de santé non assurés (SSNA) et de Santé Canada. Le Comité comprend également des observateurs de l’Institut canadien d’information sur la santé (ICIS), de l’Agence des médicaments du Canada (AMC, anciennement l’Agence canadienne des médicaments et des technologies de la santé), du ministère de la Santé et des Services sociaux du Québec (MSSS) et de l’Alliance pancanadienne pharmaceutique (APP).
Le SNIUMP fonctionne indépendamment des activités d’examen des prix du CEPMB et mène une partie de ses activités en partenariat avec l’ICIS. Les rapports du SNIUMP ne contiennent aucune information confidentielle ou protégée en vertu des articles 87 et 88 de la Loi.
Rapports
En 2023, le CEPMB a soumis au ministre de la Santé cinq études analytiques, cinq affiches et un article publié dans une revue spécialisée. Ces documents ainsi que des études antérieures sont accessibles sur le site Web du CEPMB.
Publications annuelles et séries de rapports
- CompassRx, 8e édition (janvier 2023)
- Rapport sur la situation du marché : Médicaments antidiabétiques, 2012-2021 (mai 2023)
- L’Observateur des médicaments émergents 2022 (juin 2023)
- Veille des médicaments mis en marché, 7e édition (août 2023)
- CompassRx, 9e édition (décembre 2023)
Présentations par affiches
- Les demandeurs manquants de la pandémie : Qui n’a pas fait de demande de remboursement au Canada pendant les deux premières années de la pandémie de COVID-19 et qu’est-ce que cela signifie pour les régimes publics et privés d’assurance-médicaments?
- Amélioration de l’offre en matière de médicaments génériques à l’échelle internationale entre 2010 et 2021
- Tendances concernant les médicaments en développement qui façonnent l’avenir de la mise au point de médicaments
- Les produits biosimilaires au Canada : Politiques visant à promouvoir la substitution et ce que cela signifie pour les payeurs
- L’avenir de la COVID-19 : Ce que réserve le marché des produits émergents
Articles de revues
- Is Canada missing out? An assessment of drugs approved internationally between 2016 and 2020 and not submitted for Health Canada review. CMAJ. 195(23):e820. doi: 10,1503/cmaj.230339. (juin 2023) [en anglais seulement]
Glossaire
Le Glossaire du Rapport annuel est disponible en ligne.