Gestion des demandes et du rendement en matière de licences d’établissement de produits pharmaceutiques (GUI-0127)

Télécharger le format de rechange
(Format PDF, 1,620 Mo, 34 pages)
Organisation : Santé Canada ou Agence de la santé publique du Canada
Publiée : 2020-03-18
- Date d’émission : 27 novembre 2019
- Date de mise en œuvre : 1 avril 2020
Santé Canada est le ministère fédéral qui assume la responsabilité d'aider les Canadiens à conserver et à améliorer leur santé. C'est dans cette perspective qu'il agit à titre d'organisme de réglementation, de catalyseur pour l'innovation, de bailleur de fonds et de fournisseur crédible d'information sur la santé. Le Ministère évalue l’innocuité des médicaments et de nombreux produits de consommation, aide à améliorer la salubrité des aliments, et fourni de l’information aux Canadiens pour les aider à prendre de saines décisions. Santé Canada collabore avec ses partenaires nationaux et internationaux pour s’assurer que notre système de soins de santé répond aux besoins des Canadiens.
This document is also available in English under the following title :
Management of applications and performance for drug establishment licences (GUI-127)
Pour obtenir de plus amples renseignements, veuillez communiquer avec :
- Santé Canada
- Indice de l'adresse 0900C2, Ottawa, Ontario, K1A 0K9
- Téléphone : 613-957-2991
- Ligne sans frais : 1-866-225-0709
- Télécopieur : 613-941-5366
- Téléimprimeur : 1-800-465-7735 (Service Canada)
- Courriel: publications@hc-sc.gc.ca
La présente publication est également accessible, sur demande, sous d’autres formes.
- Cat. : H164-284/2019F-PDF
- ISBN : 978-0-660-31750-2
- Pub. : 190186
© Sa Majesté la Reine du chef du Canada, représentée par le ministre de la santé, 2019
Date de publication : 2019-11-27
Cette publication peut être reproduite sans autorisation à des fins personnelles ou internes seulement, dans la mesure où la source est indiquée en entier.
Avertissement
Le présent document ne constitue pas une partie de la Loi sur les aliments et drogues (la Loi) ou de ses règlements d’application. En cas de contradiction ou d’incompatibilité entre la Loi ou les règlements d’application et le présent document, la Loi ou les règlements ont préséance. Le présent document est un document administratif destiné à faciliter la conformité des parties réglementées à la Loi, aux règlements et aux politiques administratives applicables.
Table des matières
- À propos du présent document
- Politiques en matière de demandes de LEPP
- Pratiques exemplaires en matière de demande
- Comment Santé Canada gère les demandes de LEPP
- Annexe A : Références
- Annexe B : Glossaire
- Annexe C : Insuffisances
Les icônes suivants sont utilisés dans ce document :
- Important :
- Renseignement clé ou avertissements que les gens doivent connaître.
- Renseignements Information :
- Renseignements additionnels des citations et des références juridiques.
- Conseil :
- Choses que les gens doivent faire ou comprendre.
À propos du présent document
1. Objectif
Le présent document décrit :
- les responsabilités des demandeurs dans le cadre du processus de demandes de licences d'établissement de produits pharmaceutiques (LEPP);
- la façon dont Santé Canada gère les demandes de LEPP.
Le présent guide n'interprète pas les exigences de la Loi sur les aliments et drogues (la Loi) ou du Règlement sur les aliments et drogues (le Règlement). Pour voir la liste des guides interprétant les diverses exigences de la Loi ou du le Règlement, consultez la section Annexe A : Références.
2. Portée
La portée du présent document englobe toutes les demandes de LEPP régies par les exigences du titre 1A de la partie C du le Règlement. Le document aborde également ce qui suit :
- politiques en matière de demandes de LEPP;
- pratiques exemplaires pour la soumission d'une demande de LEPP;
- processus et calendrier que respecte Santé Canada pour la gestion des demandes de LEPP.
Les processus qui ne sont pas directement liés à une demande de LEPP sont exclus du présent document comme par exemple les inspections régulières relatives aux bonnes pratiques de fabrication (BPF), qui permettent de vérifier la conformité des titulaires de LEPP aux exigences des BPF.
Politiques en matière de demandes de LEPP
Dans la présente section, les politiques en matière de demandes de LEPP s'appliquent à toutes les demandes de LEPP, à l'exception des demandes qui comprennent une requête d'évaluation d'un bâtiment étranger par un inspecteur de Santé Canada. Pour obtenir de plus amples renseignements sur l'évaluation sur place d'un bâtiment étranger par Santé Canada, veuillez consulter le document Comment démontrer la conformité des établissements étrangers avec les bonnes pratiques de fabrication des médicaments (GUI-0080)
3. Norme de service
La norme de rendement de Santé Canada pour l'examen des demandes de LEPP est de 250 jours civils de temps de Santé Canada.
4. Politique sur le temps de pause
Santé Canada utilise un « chronomètre » pour mesurer son rendement selon la norme de service de 250 jours civils.
4.1. Démarrage du chronomètre
Le chronomètre démarre à la date à laquelle Santé Canada reçoit une demande complète sur le plan administratif. Les critères devant être respectés pour qu'une demande soit jugée complète sur le plan administratif sont décrits à la section 13.1.
La date de réception de la demande correspond à l'un des éléments suivants :
- date indiquée dans le courriel;
- date indiquée sur la télécopie;
- date indiquée manuellement sur une demande reçue par la poste.
Une fois que la demande a été examinée et jugée complète sur le plan administratif, Santé Canada envoi un accusé de réception. Le numéro de la demande ainsi que la date de démarrage du chronomètre figurent dans cet accusé.
4.2. Mis en pause et reprise du chronomètre
Le chronomètre sera mis en pause pendant le processus d'examen si l'un des éléments déclencheurs tel que décrit aux sections 4.2.1 à 4.2.4 est observé.
Lorsqu'un élément déclencheur est observé, Santé Canada envoie un courriel à la personne-ressource de l'établissement canadien pour l'aviser de ce qui suit :
- que le chronomètre est mis en pause;
- la raison de la pause;
- les mesures que le demandeur doit prendre pour le redémarrage du chronomètre.
Le chronomètre reprend lorsque l'élément déclencheur est réglé. Lorsque le chronomètre reprend, cela signifie que l'application n'est plus avec le demandeur et quele chronomètre mesurant le temps de Santé Canada redémarre.
Santé Canada consigne la date à laquelle le chonomètre a été arrêté et non l'heure. Par conséquent, lorsque Santé Canada consigne la date de réception d'une réponse et que le chronomètre reprend, le temps de pause est calculé en jours. Si une réponse est reçue le même jour de la pause, le temps de pause est calculé comme étant « zéro jour ».
Voici une description des quatres différents éléments déclencheurs et de la méthode à suivre pour les régler et ainsi pouvoir redémarrer le chronomètre.
4.2.1. Insuffisances
Il est question d'insuffisance lorsqu'une demande ou partie d'une demande ne peut être traitée davantage par Santé Canada pour les raisons suivantes:
- elle ne satisfait pas aux exigences réglementaires du le Règlement;
- le but ou la portée de la demande n'est pas clair.
Lorsqu'une insuffisance est observée, un avis d'insuffisance est émis et le chronomètre est mis en pause. De plus amples renseignements sur les éléments qui entraînent un avis d'insuffisance sont présentés à l'Annexe C : Insuffisances. Des insuffisances peuvent être identifiées à diverses étapes du processus de révision des demandes de LEEP.
Le chronomètre redémarrera lorsque Santé Canada aura reçu une réponse à l'avis d'insuffisance.
4.2.2. Demandes visant à retarder une inspection
Une inspection peut être requise dans le cadre d'une demande. Si un demandeur demande le report d'une telle inspection et que Santé Canada consent à cette requête, le chronomètre sera alors mis en pause.
Le chronomètre est redémarré lorsque l'inspection débute.
4.2.3. Demande de rencontre
Un demandeur peut demander à rencontrer un représentant de Santé Canada pour discuter d'une demande. Si Santé Canada ne peut poursuivre le traitement d'une demande avant que la rencontre n'ai lieu, il joindra un avis indiquant que le chronomètre a été mis en pause.
Le chronomètre sera redémarré lorsque la rencontre prend fin.
4.2.4. Possibilité d'être entendu
Si Santé Canada propose de rendre une décision défavorable concernant une demande de LEPP, il transmet un avis au demandeur pour lui offir la possibilité d'être entendu. L'avis comporte l'échéancier pour fournir une réponse et indique que le chronomètre sera mis en pause.
Lorsque Santé Canada reçoit une réponse à l'avis, le chronomètre redémarrera. Si Santé Canada ne reçoit aucune réponse, le chronomètre redémarrera à la date indiquée dans l'avis. Si le demandeur ne souhaite pas avoir la possibilité d'être entendu, Santé Canada redémarrera le chronomètre lorsqu'une réponse du demandeur est reçue.
4.3. Calcul du temps de pause
Une fois qu'une décision est rendue pour toutes les requêtes dans la demande, le chronomètre est arrêté. Par exemple, si l'ajout d'un bâtiment étranger et d'un bâtiment canadien à la LEPP est demandé, le chronomètre est uniquement arrêté lorsqu'une décision est rendue pour les deux bâtiments.
La norme de service de 250 jours civils de Santé Canada est calculé en jours, en procédant comme suit : calculer la différence entre la date à laquelle le chronomètre a été arrêté et la date à laquelle le chronomètre a été démarré, puis soustraire le temps de pause (c.-à-d. temps du demandeur) pour obtenir le temps total de traitement de la demande.
5. Rejet des demandes incomplètes
Lorsqu'une insuffisance est observée, un premier avis est émis au demandeur, leur accordant 30 jours ouvrables pour répondre. Lorsqu'un avis d'insuffisance est émis, le chronomètre est mis en pause, comme il est indiqué à la section 4.2. Si aucune réponse à l'avis d'insuffisance n'est reçue, ou si la réponse reçue est inadéquate, un deuxième avis sera émis et un autre délai de 30 jours ouvrables sera alloué au demandeur pour répondre.
Si aucune réponse n'est reçue après le deuxième avis émis pour corriger la même insuffisance ou si la réponse reçue est inadéquate, la demande sera rejetée. Vous pouvez présenter une autre demande et recommencer le processus.
6. Date limite de dépôt des nouvelles preuves exigées (NERBY)
Chaque titulaire de LEPP doit soumettre une demande d'examen annuel de licence (EAL) au 1er avril de chaque année, conformément à l'article C.01A.009 du le Règlement. Il doit également soumettre des preuves de conformité aux BPF pour chaque bâtiment étranger figurant dans l'annexe des bâtiments étrangers de la LEPP. Comme il est indiqué dans la section 10 du document Document d'orientation sur les licences d'établissement de produits pharmaceutiques et les frais associés (GUI-0002), plutôt que de soumettre des preuves de conformité aux BPF avec leur demande d'EAL, les titulaires de LEPP peuvent signer un formulaire « Attestation et engagement B » fourni dans le package EAL. Le formulaire signé représente l'engagement du demandeur à soumettre une demande de modification contenant les preuves de conformité aux BPF acceptables (GUI-0080), avant la date limite pour le dépôt de nouvelles preuves indiquée dans la LEPP.
Le titulaire de LEPP peut continuer à importer des médicaments à partir des établissements étrangers dans le respect des exigences du le Règlement et de sa LEPP tant que le bâtiment étranger continue de figurer dans la licence. Lorsque le titulaire soumet une demande pour modifier sa LEPP pour mettre à jour la date limite de dépôt des nouvelles preuves exigées (NERBY) avant cette date limite, le bâtiment étranger continuera de figurer à l'annexe des bâtiments étrangers pendant que Santé Canada étudie la demande. Le titulaire de LEPP peut également présenter une demande de prolongation de la date limite de dépôt des nouvelles preuves exigées en suivant les instructions indiquées à la section 6 du document GUI-0080.
Si aucune demande de modification ou de prolongation de la date limite de la NDPD n'est soumise avant la date limite, si la demande est incomplète ou que les preuves sont jugées inacceptables ou incomplètes pendant le processus d'évaluation, le bâtiment étranger peut être retiré de l'annexe des bâtiments étrangers.
Après le retrait du bâtiment étranger de la LEPP, le détenteur de la LEPP n'est plus autorisé à importer à partir de ce bâtiment et en sera avisé par Santé Canada. Pour inscrire de nouveau le bâtiment à la LEPP, le détenteur de la LEPP doit soumettre une demande complète à Santé Canada. Cette demande sera assujettie à la norme de service de 250 jours civils pour l'examen des demandes de LEPP.
Comme il est indiqué dans le document GUI-0080, en général les dates limites pour le dépôt de nouvelles preuves ne sont pas fixées pour les bâtiments étrangers situés dans un pays visé par un accord de reconnaissance mutuelle (ARM).
7. Communication avec les demandeurs
Santé Canada communique principalement avec les demandeurs de LEPP par courriel. Santé Canada considère que les coordonnées indiquées dans la demande de LEPP sont les coordonnées des personnes-ressources approuvées pour l'entreprise. Les correspondances liées aux mises en pause du chronomètre seront envoyées à la personne-ressource du bâtiment canadien en utilisant les coordonnées fournies.
Pour s'assurer de recevoir l'ensemble de la correspondance au sujet de leur demande de LEPP, les demandeurs doivent :
- fournir une adresse de courriel exacte dans leur demande de LEPP et
- aviser Santé Canada de toute modification apportée à l'adresse de courriel ou à d'autres coordonnées.
Le détenteur de la LEPP peut mettre à jour ses coordonnées en remplissant le Formulaire pour la licence d'établissement pour les produits pharmaceutiques (FRM-0033) et en envoyant ce dernier à Santé Canada ( hc.el.applications-le.sc@canada.ca).
Il est important de s'assurer que les coordonnées sont à jour pour ne manquer aucun avis d'insuffisance ou de rejets. Santé Canada communiquera uniquement les renseignements propres à la licence aux personnes-ressources approuvées désignées par le demandeur. Santé Canada n'est pas responsable des délais dans le traitement de la demande ou d'autres problèmes découlant de coordonnées incorrectes.
8. Retrait de service en cas de non-paiement des frais
Si les frais associés à une demande de LEPP n'ont pas été payés avant la date d'échéance prescrite, Santé Canada a le pouvoir de retirer un service, une autorisation réglementaire et/ou un droit ou un avantage. Si Santé Canada utilise cette autorité pour suspendre l'examen d'une demande, la période pendant laquelle le service est retiré n'est pas prise en compte dans le calcul de la norme de service de 250 jours civils.
9. Communication des décisions
9.1. Demandes pour une nouvelle LEPP
Les demandes pour une nouvelle LEPP doivent indiquer tous les bâtiments canadiens et étrangers pour lesquels une licence est demandée. Lorsque possible, Santé Canada fera part de ses décisions au sujet de chaque section de la demande au fur et à mesure de son examen.
Les demandes pour une nouvelle LEPP ne doivent pas être séparées par bâtiment.
9.2. Demandes de modification
Santé Canada émet une seule décision par demande de modification d'une LEEP, peu importe le nombre de requêtes incluses dans la demande.
Par exemple, si une application contient des demandes de modifcations pour plusieurs bâtiments, une décision ne sera émise pour cette application qu'une fois l'inspection des BPF complétée pour tous les bâtiments et qu'une décision peut être prise pour tous les bâtiments.
Séparer les demandes de modification aidera à prévenir des situations où une décision pour un bâtiment étranger est retardée par une décision au sujet d'un autre bâtiment, lorsque que les deux bâtiments sont inclus dans la même application. Voir la section 11 pour en savoir davantage sur les pratiques exemplaires en matière de demande.
Bonnes pratiques en matière de demande
10. Préparer une demande de LEPP
La présence d'insuffisance dans une demande entrainera des délais dans le traitement de cette demande. Il est important que les demandeurs comprennent les exigences réglementaires associées aux demandes de LEPP et préparent leur demande avec soin en suivant les étapes ci-après.
- Étudier les documents figurants à l'Annexe A : Références, afin de comprendre les exigences réglementaires associées aux demandes de LEPP.
- Lire les instructions du formulaire FRM-0033, pour s'assurer de le compléter correctement.
Avant de soumettre une demande, veuillez envoyer un courriel au compte générique approprié si certains aspects concernant la demande ont besoin d'être clarifiés:
- Requêtes générales sur les LEPP : hc.del.questions-leppp.sc@canada.ca
- Requêtes liées aux frais : hc.criu-ufrc.sc@canada.ca
- Requêtes liées aux BPF des bâtiments étrangers : hc.foreign.site-etranger.sc@canada.ca
- Requêtes liées aux BPF des bâtiments canadiens : hc.drug.gmp.questions-bpf.medicaments.sc@canada.ca
Lettre de présentation
Soumettre une lettre de présentation avec la demande afin de clarifier ce qui est demandé dans cette dernière peut aider Santé Canada à traiter la demande plus efficacement, et peut aussi aider à éviter l'émission d'un avis d'insuffisance. Santé Canada recommande que les demandeurs incluent les renseignements suivants dans leur lettre :
- nom et numéro de la LEPP (s'il a été assigné);
- numéro de la demande (s'il a été assigné). Il est important de fournir ce numéro lors de la soumisson d'information supplémentaire au sujet d'une demande en traitement;
- contexte clair de la demande, notamment :
- information au sujet des fusions et des acquisitions,
- déménagement,
- traitement accéléré demandé,
- objet de la demande (p. ex. ajout d'un bâtiment étranger à la LEPP qui fabrique des produits biologiques et ajout d'une catégorie de médicament biologique au bâtiment canadien) :
- liste des documents fournis avec la demande,
- si les preuves de BPF sont soumises conformément au document GUI-0080, sommaire des preuves fournies;
- si des directives précises de Santé Canada ont été fournies avant de remplir la demande, inclure une copie de la correspondance (le cas échéant);
- si le bâtiment (canadien ou étranger) est responsable des activités d'emballage ou d'étiquetage indiquées ci-après, inclure les réponses à chacune des questions suivantes :
- Est-ce que le bâtiment procède à l'étiquetage du contenant principal?
- Le bâtiment place-t-il le contenant principal dans un contenant secondaire?
- Le bâtiment procède-t-il à l'étiquetage du contenant secondaire?
- Le bâtiment inclut-il un dépliant dans le contenant secondaire?
Santé Canada n'accélère le traitement d'une demande de LEPP ou ne la traite en priorité que si un tel traitement peut éviter la pénurie réelle ou imminente d'un produit pharmaceutique médicalement nécessaire, ou dans le cas d'un produit pharmaceutique se qualifiant pour une évaluation prioritaire selon la politique d'évaluation prioritaire de Santé Canada décrite dans la Ligne directrice à l'intention de l'industrie : Évaluation prioritaire des présentations de drogues.
- Pour être considéré comme médicalement nécessaire par Santé Canada, le produit pharmaceutique doit être autorisé au Canada et servir à prévenir, à traiter ou à diagnostiquer une maladie ou une affection grave ou mortelle pour laquelle il n'existe aucune autre option. Les inconvénients subis par les patients ne constituent pas un motif suffisant pour considérer un produit pharmaceutique comme médicalement nécessaire.
- Si le produit pharmaceutique répond à la définition de produit médicalement nécessaire ou si Santé Canada a accepté que la présentation de drogue fasse l'objet du processus d'évaluation prioritaire, veuillez soumettre la demande de LEPP en suivant les indications données à la section 11 et indiquer « Demande d'ÉVALUATION PRIORITAIRE : LEPP no xxxxxxx; nom de l'établissement » dans la ligne d'objet du courriel. Une copie de la lettre d'acceptation de Santé Canada pour l'évaluation prioritaire des présentations de drogues ou un formulaire FRM-0378 - Modèle pour déterminer la nécessité médicale d'un produit pharmaceutique dûment rempli* doit être fournie avec l'application.
Si une demande d'examen accéléré ou prioritaire d'une demande de LEPP est demandée pour une demande qui a déjà été soumise à Santé Canada, il faut s'assurer que la requête indique clairement le numéro de demande.
* Le formulaire FRM-0378 - Modèle pour déterminer la nécessité médicale d'un produit pharmaceutique peut être demandé en écrivant à l'adresse hc.del.questions-leppp.sc@canada.ca.
11. Directives pour soumettre une demande de modification d'une LEPP existante
Voir ci-dessous pour en apprendre davantage sur les pratiques exemplaires en matière de demande de modification d'une LEPP existante. Ces pratiques aideront les demandeurs à soumettre une demande de LEPP conformément au le Règlement et à limiter la portée de la demande pour en assurer le traitement efficace.
11.1. Modifications administratives
Les modifications administratives à apporter à une LEPP existante doivent toujours être soumises séparément des autres types de requêtes (p. ex., séparément des requêtes d'ajout d'activités, de catégories de produits pharmaceutiques, de formes posologiques).
Les modifications administratives comprennent les changements apportés ce qui suit :
- adresse postale ou de facturation;
- nom, numéro de téléphone, numéro de télécopieur et adresse courriel de la personne-ressource;
- renseignements au sujet de l'entrepôt.
11.2. B âtiments étrangers
Annexe des bâtiments étrangers
Veuillez soumettre une demande par bâtiment étranger, si le but de la demande est d'apporter une de ces modifications à L'Annexe des bâtiments étrangers de la LEPP :
- ajouter un bâtiment étranger;
- renouveler la date limite de dépôt de nouvelles preuves exigées (NERBY) pour un bâtiment étranger;
- modifier un bâtiment étranger.
Les demandeurs peuvent demander à ce que plusieurs modifications soient apportées au même bâtiment étranger, mais chaque demande devrait être pour un seul bâtiment étranger.
Toutefois, une exception est accordée à cette exigence lorsque la preuve de BPF est soumise au moyen d'un rapport d'inspection qui portent sur plusieurs bâtiments. Dans ce cas, ces derniers peuvent être regroupés dans une seule demande.
Si un bâtiment étranger est ajouté ou modifié, toutes les catégories de drogue, les activités, l'état de stérilité et les formes posologiques demandés pour le bâtiment étranger doivent également être autorisés pour le bâtiment canadien responsable des activités d'importation.
- Si ce n'est pas le cas, il faudra joindre une demande pour faire ajouter la catégorie de drogue, la forme posologique ou l'état de stérilité manquant à l'établissement canadien, sous la catégorie d'activité « importation ».
Annexe des bâtiments étrangers pour les ingrédients pharmaceutiques actifs (IPA)
Au moment de soumettre une demande de modification de L' Annexe concernant les bâtiments étrangers d'ingrédients pharmaceutiques actifs, une requête en vue d'ajouter plusieurs bâtiments étrangers peut être ajoutée à la même demande.
Pour ce qui est des médicaments importés sous forme posologique, si le détenteur de la LEPP présente une demande d'ajout de nouveau bâtiment étranger pour les IPA à sa LEPP :
- Le bâtiment étranger indiqué comme étant le fabricant de formes posologiques définitives doit être indiqué à L'Annexe des bâtiments étrangers.
- Si ce n'est pas le cas, le détenteur de la LEPP doit présenter une demande pour ajouter un fabricant de formes posologiques définitives à L'Annexe des bâtiments étrangers.
Exemple
Médecine Canada Inc. détient la LEPP 3-009999 et souhaite présenter une demande en vue d'ajouter Médecine IPA Inc. Mexique à son annexe des batiments étrangers relatifs aux IPAs. Médecine IPA Inc. Mexique est le fournisseur d'IPA pour Médecine Inc. Allemagne.
La LEPP 3-009999 comprend :
- Activité d'importation d'un produit pharmaceutique
- Liste à L'Annexe des bâtiments étrangers incluant Médecine Inc. É.-U.
- Liste à L'Annexe des bâtiments étrangers pour les IPA incluant Médecine IPA Inc. Allemagne.
Médecine Canada Inc. ne peut pas présenter de demande pour ajouter le bâtiment étranger Médecine IPA Inc. Mexique à sa LEPP si la demande indique que le fabricant de la forme posologique définitive est Médecine Inc. Allemagne, et ce, parce que Médecine Inc. Allemagne ne figure pas dans la liste des bâtiments étrangers de Médecine Inc.
La demande devrait aussi inclure le formulaire de la section 5 du FRM-0033 (Demande de licence d'établissement de produits pharmaceutiques) afin d'ajouter Médecine Inc. Allemagne en tant que fabricant de la forme posologique définitive.
11.3. Bâtiments canadiens
Les demandes de modification ou d'ajout de bâtiments canadiens à la LEPP devraient être soumises pour chaque bâtiment, séparément des autres demandes, à l'exception des cas indiqués ci-dessous.
Plusieurs modifications peuvent être demandées pour le même bâtiment dans une application.
Ajout de l'activité d'importation à la LEPP
La demande doit inclure une requête pour ajouter au moins un bâtiment étranger et une copie du tableau A : Sites étrangers qui exercent des activités relatives aux IPA requérant une licence au moment de présenter une modification pour :
- ajouter l'activité d'importation à un bâtiment existant figurant dans la LEPP;
- ajouter un nouveau bâtiment à la LEPP avec l'activité d'importation.
12. Soumission d'une demande de LEPP
Soumettre une demande de LEPP par voie électronique permet un traitement de la demande plus efficace. Pour que le processus de LEPP soit lancé, les demandes doivent être soumises au moyen d' une des méthodes suivantes.
12.1. Soumission par courriel
Pour soumettre une demande de LEPP par voie électronique, envoyez la demande et tous les documents à l'appui à l'adresse suivante : hc.el.applications-le.sc@canada.ca.
Une réponse générée automatiquement par le système sera envoyée pour confirmer que la demande a été envoyée à la boîte de courriel des établissements de Santé Canada. Il est recommandé aux demandeurs de sauvegarder le courriel et la réponse automatique aux fins de références futures.
Si une réponse automatique n'a pas été reçue, la demande n'a pas été envoyée. Veuillez l'envoyer de nouveau.
Bonnes Pratiques à respecter si une demande doit être envoyée dans plus d'un courriel
Si une demande doit être envoyée dans plus d'un courriel, reliez ces courriels au moyen de la ligne « Objet » du courriel. Respectez les pratiques exemplaires ci-dessous, pour vous assurer que Santé Canada puisse traiter efficacement chaque demande :
- Indiquez dans la ligne « Objet » du courriel que la demande est soumise en deux parties. Exemple :
- Objet du premier courriel : Partie 1 de 2 - LEPP 1234-A Renouvellement d'un bâtiment étranger
- Objet du deuxième courriel : Partie 2 de 2 - LEPP 1234-A Mot de passe pour le renouvellement du bâtiment étranger
Santé Canada considère avoir reçu la demande à la date de réception de la dernière partie de la demande.
12.2. Soumission par la poste ou télécopieur
Si une demande est soumise par la poste ou par télécopieur, dressez la liste de toutes les demandes et documents connexes dans une lettre de présentation.
Santé Canada n'accepte pas les demandes soumises sur des dispositifs de stockage portatifs, comme :
- clé USB (clé à bus série universel);
- disque dur externe;
- carte Secure Digital (SD).
Santé Canada peut accepter les demandes soumises via CD ou DVD.
Poste
Unité des licences d'établissement des médicaments
Immeuble Jeanne-Mance
200, promenade Eglantine
Indice de l'adresse 1913B
Ottawa (Ontario)
K1A 0K9
Comment Santé Canada gère les demandes de LEPP
13. Demandes qui ne sont pas visées par l'examen annuel de la LEPP
La présente section donne un aperçu du processus de demande de LEPP. Le processus peut varier selon le type de demande, mais, en général, une demande reçue par Santé Canada suivra les étapes qui figurent au diagramme 1.
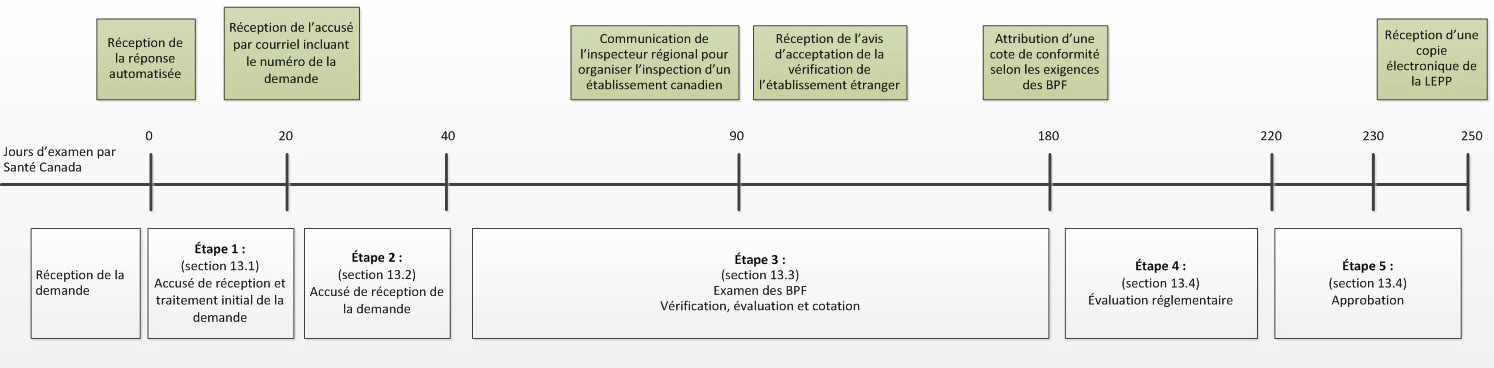
Diagramme 1 : Échéancier appliqué pour les demandes de licences d’établissement de produits pharmaceutiques
Le diagramme 1 représente les différentes étapes dans l’échéancier de 250 jours fixé pour les demandes de licences d’établissement de produits pharmaceutiques.
La réception de la demande marque le jours zéro du temps de Santé Canada.
Suite à la réception de la demande, les demandeurs recevront une réponse automatisé générée par le système.
- L’étape 1
- (décrite à la section 13.1) est le traitement initial de la demande suivi par l’accusé de réception de celle-ci qui a lieu entre le jour zéro et le jour 20. Une fois l’étape 1 complétée, le demandeur recevra un accusé de réception incluant le numéro de la demande par courriel.
- L’étape 2
- (décrite à la section 13.2) comprend l’examen préliminaire de la demande concernant la licence d’établissement de produits pharmaceutiques qui a lieu entre les jours 20 et 40.
- L’étape 3
- (décrite à la section 13.3) est l’examen des bonnes pratiques de fabrication qui inclus la vérification, l’évaluation et la cotation. Ceci se produit entre les jours 40 et 180.
Aux alentours du jour 90 :
- Le demandeur est contacté par l’inspecteur régional pour organiser l’inspection d’un établissement canadien, et/ou,
- Le demandeur reçoit l’avis d’acceptation de la demande en examen préliminaire des BPF pour l’établissement étranger.
À la fin de l’étape 3 (jour 180), le demandeur reçoit un courriel comprenant une cote de conformité pour l’établissement, basé sur la révision des preuves de bonnes pratiques de fabrication.
- L’étape 4
- (décrite à la section 13.4) est l’évaluation réglementaire qui a lieu entre le jour 180 et 220.
- L’étape 5
- (décrite à la section 13.4) est l’approbation, qui a lieu entre le jours 220 et 250. À la fin de l’étape 5 (jours 250), le demandeur recevra une copie électronique de sa licence d’établissement.
13.1. Accusé de réception et traitement initial de la demande
13.1.1. Critères de l'examen administratif initial
Toutes les demandes de LEPP sont examinées pour s'assurer qu'elles sont complètes sur le plan administratif en fonction des critères suivants :
FRM-0033 - Formulaire et instructions pour la licence d'établissement pour les produits pharmaceutiques
- Le document n'est pas corrompu.
- Si le document est verrouillé, un mot de passe a été fourni.
- Le FRM-0033 est dûment rempli et signé.
- Tous les documents et courriels mentionnés sont fournis.
- Les modifications demandées ont été vérifiées et confirmées.
- Tout renseignement supplémentaire nécessaire est fourni en cas de modification du nom ou de l'adresse d'un établissement étranger (le cas échéant).
- Lorsque le tableau A est soumis, il est vérifié que la section 5.1 du FRM-0033 est également soumise.
Tableau A
Une vérification est effectuée pour s'assurer que le tableau satisfait aux critères suivants:
- confirmation que la bonne version du tableau A a été fournie;
- confirmation que le tableau A concerne un établissement canadien;
- validation que tous les champs obligatoires sont remplis;
- vérification qu'aucun établissement étranger non conforme ne figure au tableau;
Pour obtenir de plus amples renseignements sur les colonnes devant être remplies dans le tableau A, veuillez consulter les directives dans le Tableau A : Sites étrangers qui exercent des activités relatives aux IPA requérant une licence du FRM-0033.
Fusions et transferts de titre
- Examen de la demande pour s'assurer que tous les documents propres à la situation et requis par Santé Canada sont fournis
13.1.2. Accusé de réception de la demande
Lorsqu'une demande est jugée complète sur le plan administratif, un numéro de référence lui est attribuée et le chronomètre est démarré.
- Un numéro sera attribué par courriel (dans l'accusé de réception) à toutes les demandes complètes sur le plan administratif suivant la soumission de la demande.
- Santé Canada vise a envoyer une courriel d'accusé de réception dans les 20 jours civils suivant la réception de la demande.
- Tous les demandeurs doivent faire référence au numéro de demande dans toutes leurs correspondance avec Santé Canada concernant la demande.
Ne fournissez pas de renseignements supplémentaires au sujet d'une demande avant d'avoir reçu un numéro de demande. Cela entraînera le rejet des renseignements supplémentaires.
13.1.3. Traitement des demandes administratives
Les demandes suivantes sont considérées administratives et ne nécessitent pas un examen complet. Le traitement de la demande est complété à l'étape du traitement administratif des demandes; par contre, il est à noter que ces demandes sont traitées à cette étape seulement si elles ne sont pas combinées à d'autres demandes.
Les demandeurs sont avisés de l'achèvement du traitement comme suit :
Demandes d'annulation
Une fois que l'examen de la demande d'annulation est terminé, le demandeur sera informé que la demande à été complétée ou que de plus amples renseignements sont requis avant que la LEPP puisse être annulée.
Demandes de retrait
Une fois que la demande de retrait a été traitée, le demandeur reçoit un courriel pour l'aviser que le retrait de la demande de LEPP a été effectué.
Demande de modification des coordonnées de la personne-ressource et de l'adresse postale, de l'adresse de facturation ou de l'adresse du siège social
Pour ce type de demande, un avis d'achèvement des modifications est envoyé par courriel au demandeur plutôt qu'un accusé de réception. Ce courriel confirme la réception de la demande et indique que les modifications demandées ont été traitées.
Demande de modifications à l'entrepôt
Pour ce type de demande, un « avis d'achèvement des modifications » est envoyé par courriel au demandeur plutôt qu'un accusé de réception. Ce courriel accuse réception de la demande et confirme que les modifications demandées ont été traitées; une copie de l'annexe de l'entrepôt à jour y est jointe (l'annexe sera ensuite envoyée par la poste à l'adresse indiquée au dossier).
13.2. Examen préliminaire de la LEPP
À l'étape de l'examen préliminaire de la LEPP, la demande et la lettre de présentation seront examinées pour s'assurer qu'elles sont complètes conformément au document GUI-0002.
Critères d'examen préliminaire
À l'étape de l'examen préliminaire, Santé Canada vérifie si la demande est complète selon les critère de l'examen préliminaire, notamment si elle respecte les critères suivants :
- tous les documents énumérés ont été fournis;
- le FRM-0033 est dûment rempli, et les sections et les documents nécessaires y sont joints;
- la demande de changement de nom du titulaire de la LEPP est accompagnée des documents à l'appui requis (le cas échéant);
- pour ce qui est d'une demande de modification d'une LEPP qui concerne un établissement étranger précis :
- La modification est cohérente avec la catégorie de médicaments, la forme pharmaceutique ou l'état de stérilité au titre de l'activité « importation »; ou la demande comprend une requête de modification de l'activité « importation » demandant un changement à l'élément manquant.
- Par exemple, si un bâtiment étranger est ajouté, et qu'il fabrique des produits pharmaceutiques stériles, le bâtiment canadien doit posséder une licence à laquelle l'activité d'importation de produits pharmaceutiques stériles est inscrite. Si cela n'est pas le cas, l'application doit contenir une demande de modification afin d'ajouter cette activité.
- Pour les demandes comprenant un bâtiment étranger situé dans un pays visé par un ARM :
- L'organisme de réglementation étranger a délivré une autorisation permettant au bâtiment étranger de mener des activités visées par une licence incluse dans la demande.
- Aucun écart n'est observé entre les renseignements fournis dans la demande et les renseignements se trouvant dans la base de données de Santé Canada.
Si une insuffisance est identifiée, Santé Canada enverra un avis par courriel indiquant l'insuffisance devant être résolue. Le chronomètre est mis en pause, conformément à la politique sur le chronomètre décrite à la section 4.
Il incombe au demandeur de soumettre une demande complète, claire et exacte. Si un demandeur souhaite modifier la portée d'une demande après l'étape de l'examen préliminaire de la LEPP, Santé Canada peut refuser d'accepter les modifications de la portée et une nouvelle application devra être soumise.
13.3. Examen des BPF
Après l'examen préliminaire de la LEPP, les sections suivantes de la demande font l'objet d'une évaluation des BPF.
- Demandes d'inspections canadiennes
- Demandes de certificats de conformité (CC) des partenaires réglementaires aux termes de l'ARM applicable
- Évaluation des preuves de BPF
13.3.1. Établissements situés au Canada et le respect des BPF des médicaments
Après l'examen préliminaire de la LEPP, une demande pour ajouter ou modifier un établissement situé au Canada sera assignée à la région concernée et fera l'objet d'une inspection des BPF des médicaments. Selon la nature de la demande, il se peut qu'un établissement situé au Canada ayant déjà fait l'objet d'une inspection ne soit pas obligé de se soumettre à une autre inspection.
Santé Canada s'efforce de communiquer avec le demandeur dans les 90 jours civils suivant la date de réception de la demande pour fixer la date d'inspection.
- Les demandeurs doivent être prêts à l'inspection des BPF.
- Les inspecteurs de Santé Canada peuvent inspecter les locaux d'un demandeur à n'importe quel moment après la réception d'une demande.
Toute demande visant à repousser la date d'inspection prévue qui provient d'une entreprise est évaluée par les inspecteurs de Santé Canada et entraînera la mise en pause du chronomètre.
La portée et la durée de l'inspection dépendent de ce qui suit :
- Activités évaluées;
- Catégories de médicaments et formes posologiques des produits manipulées sur place.
Les demandeurs peuvent consulter les documents des BPF des médicaments indiqués à l'Annexe A : Références afin de comprendre les exigences réglementaires du titre 2 qui s'appliquent à leurs activités,
Pas prêt pour une inspection?
Si un demandeur n'est pas prêt à faire l'objet d'une inspection au moment où l'inspecteur communique avec lui, il peut demander le retrait de sa demande. Si la demande n'est pas retirée, une inspection sera réalisée. Une préparation insuffisante peut entraîner l'émission d'une cote de non-conformité. Les cotes d'inspection sont publiées dans la base de données des inspections des médicaments et des produits de santé sur le site Web du gouvernement du Canada.
Cotes d'inspection après une inspection
La cote d'inspection indique si un site est conforme (C) ou non conforme (NC) avec les exigences de BPF.
L'inspecteur vise à publier le rapport d'inspection dans un délai de 180 jours civils après la date de réception de la demande. Les renseignements ci-après sont publiés dans la base de données des inspections des médicaments et des produits de santé sur le site Web du gouvernement du Canada.
- Cote d'inspection
- Sommaire des observations notées pendant l'inspection
- Résultat de l'inspection et mesures prises par Santé Canada
13.3.2. Conformité des bâtiments étrangers avec les BPF des medicaments
Après l'examen préliminaire de la LEPP, les demandes qui incluent une requête pour ajouter, renouveler ou modifier un bâtiments étranger feront l'objet d'un examen préliminaire des preuves de conformité aux BPF ainsi que d'une évaluation des preuves de conformité aux BPF.
Si le bâtiment étranger est situé dans un pays doté d'un ARM, il se peut que les preuves de conformité aux BPF ne soient pas nécessaires si les catégories de médicaments et les activités sont incluses dans la portée de l'ARM et qu'un CC valide est disponible. Santé Canada demandera au partenaire de l'ARM de lui fournir une copie du CC.
Santé Canada examinera l'exhaustivité et l'exactitude des preuves de conformité aux BPF, conformément au document GUI-0080.
Si un importateur n'est pas en mesure de soumettre des preuves de conformité aux BPF pour appuyer sa demande, Santé Canada acceptera les preuves soumises par le bâtiment étranger, conformément au GUI-0080. Si le bâtiment étranger n'a soumis aucune preuve de conformité à Santé Canada au moment où l'examen préliminaire des BPF commence, la demande sera jugée insuffisante et un avis d'insuffisance en examen préliminaire (AIEP) sera envoyé.
Examen préliminaire des preuves de conformité aux BPF
Au cours de l'examen préliminaire des BPF, les preuves de conformité aux BPF sont examinées afin de vérifier l'exhaustivité des renseignements, conformément aux exigences du GUI-0080. Une fois les preuves jugées acceptables pour une évaluation approfondie, le demandeur recevra un avis d'acceptation en examen préliminaire (AAEP).
Si des insuffisances relatives à la conformité aux BPF sont mises en évidence, Santé Canada enverra au demandeur un AIEP par courriel et indiquera les renseignements manquants ou inadéquats. De plus, la politique du temps de pause s'appliquera.
Une fois les preuves de conformité jugées acceptables pour une évaluation approfondie, le demandeur recevra un AAEP dans les 90 jours civils suivant la date de réception de la demande (en moyenne).
Si Santé Canada ne reçoit aucune réponse au sujet de l'AAEP ou que la réponse est incomplète/insuffisante, un avis de rejet en examen préliminaire sera envoyé au demandeur par courriel et la demande sera rejetée.
Le demandeur peut soumettre de nouveau une demande après avoir recueilli l'information demandée.
Évaluation des preuves de conformité aux BPF
L'évaluation des preuves de conformité aux BPF a pour but de déterminer si les preuves fournies démontrent la conformité aux titres 2 et 4 du le Règlement pour les catégories de médicaments, les activités et les formes pharmaceutiques figurant dans le FRM-0033 du demandeur.
Si des insuffisance relatives à la conformité aux BPF sont mises en évidence, Santé Canada enverra au demandeur un courriel et indiquera les renseignements manquants ou inadéquats. De plus, la politique du temps de pause s'appliquera. Des exemples d'insuffisances concernant les preuves de conformité aux BPF sont présentés à l'Annexe C : Éléments déclencheurs du temps de pause.
Une fois l'évaluation du dossier de preuves de conformité aux BPF terminée, une cote sera attribuée, en fonction des résultats de l'évaluation, et sera envoyée sous forme d'un « avis de conformité aux BPF ».
- Le présent avis de conformité aux BPF n'est pas une autorisation d'importation.
- Les activités d'importation depuis un établissement étranger ne pourront commencer qu'au moment de la délivrance d'une nouvelle LEPP ou d'une LEPP modifiée sur laquelle sera inscrit l'établissement étranger.
- Comme il est indiqué à la section 6, si le bâtiment étranger figure dans la LEPP, les activités peuvent se poursuivre conformément à ce qui est indiqué dans la LEPP.
Demande de CC et évaluation
Santé Canada a établi plusieurs ARM avec des organismes de réglementation issus d'autres pays. Si l'établissement étranger est situé dans un pays doté d'un ARM (pour des catégories de médicaments et des activités incluses dans la portée de l'ARM), Santé Canada demandera au partenaire de l'ARM de lui fournir un CC valide.
La liste des pays avec lesquels des ARM à jour ont été conclus se trouve à la page Web Accords de reconnaissance mutuelle (ARM) entre le Canada et la Communauté européenne (CE).
Une telle demande peut générer divers résultats, notamment :
- le partenaire de l'ARM fournit un CC à Santé Canada. Les renseignements qu'il contient sont alors comparés à la portée mentionnée dans la demande. Si la portée du CC comprend les formes pharmaceutiques, les activités et les catégories demandées par le demandeur, l'établissement étranger sera ajouté à L'Annexe sur les établissements étrangers de la LEPP de l'importateur;
- le partenaire de l'ARM fournit un CC à Santé Canada, mais sa portée ne comprend pas les activités, les catégories ou les formes pharmaceutiques inclues dans la demande. Le demandeur de la LEPP sera avisé des activités, des catégories ou des formes pharmaceutiques qui sont couvertes par le CC et qui sont, par le fait même, indiquées sur sa licence. Il faudra présenter une nouvelle demande comprenant des preuves de la conformité aux BPF pour ajouter/conserver les activités et/ou formes pharmaceutiques qui ne sont pas couvertes par le CC à l'établissement étranger sur la LEPP de l'importateur;
- le partenaire de l'ARM informe Santé Canada qu'il est impossible d'émettre un CC, puisque le permis, la licence ou l'autorisation de l'établissement étranger n'est plus valide. Dans ce cas, Santé Canada devra informer le demandeur que leur demande sera rejetée.
Pour en savoir davantage sur les CC, veuillez consulter le document GUI-0080.
13.4. Évaluation réglementaire et approbation
Au cours de l'étape de l'évaluation réglementaire et de la formulation des recommandations à l'égard de la licence, la demande est examinée par rapport aux exigences du le Règlement et aux lignes directrices du GUI-0002. Puis, les demandes pour lesquelles une délivrance ou une modification de la licence est recommandée sont envoyées à des fins d'approbation finale.
Lors de l'évaluation réglementaire de la demande, Santé Canada évalue les éléments suivant :
- examiner la demande et s'assurer que les insuffisances sont résolues;
- examiner la cote, la portée et les recommandations du rapport d'inspection des BPF;
- vérifier si la demande, l'évaluation, les recommandations et la réglementation sont harmonisées;
- vérifier si des modalités sont recommandées.
Si une insuffisance est observée, Santé Canada enverra un avis par courriel mettant en évidence les insuffisances devant être corrigées. Le chronomètre sera mis en pause.
En fonction de l'évaluation réglementaire, une recommandation à l'égard de la licence sera formulée. L'approbation finale d'une telle recommandation est donnée par le directeur de la Division de l'inspection des produits de santé et de l'octroi des permis de la Direction de la conformité des produits de santé.
Une recommandation est formulée lorsque toutes les requêtes comprises dans une demande sont prêtes à être traitées. Pour en savoir plus sur la portée des demandes recommandées par Santé Canada, veuillez consulter la section 9.
Lorsqu'une décision finale concernant la licence est rendue, celle-ci est communiquée au demandeur par courriel et via Poste Canada à l'adresse postale indiquée dans la demande.
Les demandeurs sont responsables d'aviser Santé Canada de tout changement dans leurs coordonnées, y compris dans leurs adresses postales, afin d'éviter tout problème au moment de l'envoi de documents. Santé Canada n'est pas responsable des problèmes liés à l'envoi de document sur support papier qui pourraient s'expliquer par le fait que des entreprises ont omis de fournir une adresse exacte et à jour.
14. Demande d'examen annuel de la licence
Cette section décrit comment Santé Canada gère les demandes par l'entremise du processus d'examen annuel des licences (EAL).
Chaque titulaire de LEPP doit soumettre une demande d'EAL avant le 1 er avril de chaque année. En raison du grand nombre de demandes reçues pendant une courte période et parce que le délai de traitement des demandes d'EAL varient davantage, le processus ci-dessous diffère de celui des demandes générales. Santé Canada a établi des jalons pour l'achèvement des tâches d'examen, tel qu'illustré ci-après.
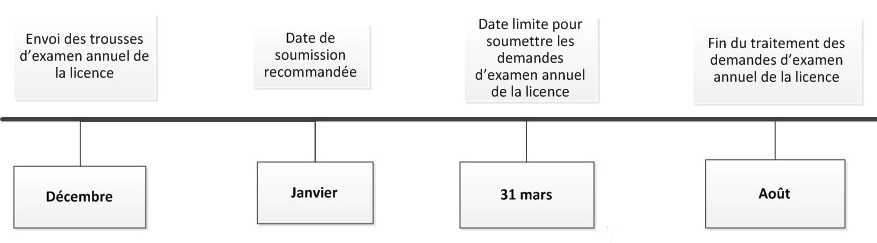
Diagramme 2 : Échéancier pour d’examen annuel des licences
Le diagramme 2 présente l’échéancier prévu pour la révision des demandes d’examen annuel des licences qui commence en décembre et se termine en août de l’année suivante.
En décembre, les trousses d’examen annuel de la licence sont envoyées.
En janvier, il est recommandé de soumettre les demandes d’examen annuel des licences.
Le 31 mars est la date limite pour soumettre les demandes d’examen annuel de la licence.
Le mois d’août marque la fin du traitement des demandes d’examen annuel de la licence.
14.1. Traitement initial
Santé Canada vérifie si la demande est complète en utilisant les critères d'examen préliminaire suivants (entre autres) :
- tous les documents et les formulaires requis sont inclus;
- les documents électroniques peuvent être ouverts et ne sont ni corrompus ni verrouillés;
- le formulaire de demande d'EAL contient toutes les pages requises;
- toutes les signatures requises sont présentes.
14.2. Accusé de réception de la demande
Au cours du processus initial, la demande d'EAL est jugée complète en fonction des critères d'examen préliminaire, un numéro de demande est créé et les renseignements administratifs (p. ex. les coordonnées, l'adresse postale et l'adresse de facturation) sont traités.
Un accusé de réception et un numéro de demande seront inclus dans le courriel visant à accuser réception de la demande. Les demandeurs doivent avoir en main leur numéro de demande lorsqu'ils communiquent avec Santé Canada.
Les demandeurs ne doivent pas envoyer de renseignements supplémentaires pour la même demande avant d'avoir reçu un numéro de demande.
14.3. Accusé de réception en cas de d'insuffisance
Si la demande d'EAL présente des insuffisances, Santé Canada enverra un avis d'insuffisance au demandeur par courriel, et la politique du temps de pause s'appliquera.
14.4. Examen et complétion de la demande d'EAL
Au cours de l'examen, il est important de s'assurer que seuls les changements acceptables ont été apportés dans le cadre de la demande d'EAL. Les changements approuvés seront mis à jour et intégrés dans la base de données.
Une fois l'examen terminé, un courriel sera envoyé au demandeur pour lui faire part des éléments suivants : l'examen annuel de la LEPP est terminé et les exigences réglementaires du le Règlement (C.01A.009) pour le maintien de la LEPP ont été respectées.
Une licence révisée est seulement émise si un changement apporté au cours de l'EAL a eu une incidence sur les renseignements figurant dans la section de la licence portant sur les établissements situés au Canada.
Annexe A : Références
Lois et règlements
- Loi sur les aliments et drogues (la Loi)
- Règlement sur les aliments et drogues (le Règlement)
- Loi sur les frais de service
Formulaires
Bonnes pratiques de fabrication
- Guide des bonnes pratiques de fabrication des médicaments (GUI-0001)
- Guide de classification des observations liées aux bonnes pratiques de fabrication des médicaments en fonction du risque (GUI-0023)
- Bonnes pratiques de fabrication des gaz médicaux (GUI-0031)
- Bonnes pratiques de fabrication (BPF) des ingrédients pharmaceutiques actifs (IPA) (GUI-0104)
- Guide sur les preuves de conformité aux BPF des médicaments provenant de sites étrangers (GUI-0080)
- Politique d'inspection BPF pour les établissements canadiens de drogues (POL-0011)
- Bonnes pratiques de fabrication des établissements de médicaments - Trousse préalable à l'application (Importateurs, distributeurs et grossistes)
Documents liés aux LEPP
- Document d'orientation sur les licences d'établissement de produits pharmaceutiques et les frais associés (GUI-0002)
- Lignes directrices concernant les sites alternatifs pour la rétention d'échantillons (GUI-0014)
Autres documents
- Politique sur la conformité et l'application de la loi (POL-0001)
- Directive sur les Bonnes pratiques de fabrication (BPF) des médicaments et les licences d'établissement (LE) (POL-0004)
- Ligne directrice à l'intention de l'industrie : Évaluation prioritaire des présentations de drogues
Annexe B : Glossaire
Acronymes
- AAEP
- Avis d'acceptation en examen préliminaire
- AIEP
- Avis d'insuffisance en examen préliminaire
- ARM
- Accord de reconnaissance mutuelle
- BPF
- Bonne pratique de fabrication
- CC
- Certificat de conformité
- DGORAL
- Direction générale des operations réglementaires et de l'application de la loi
- EAL
- Examen annuel de la licence
- IPA
- Ingrédient pharmaceutique actif
- IPSOP
- (Division) Inspection des produits de santé et octroi des permis
- La Loi
- Loi sur les aliments et drogues
- LEPP
- Licence d'établissement de produit pharmaceutique
- PFE
- Possibilité de se faire entendre
- le Règlement
- Règlement sur les aliments et drogues
Termes
- Ingrédient pharmaceutique actif (IPA)
- Tout ingrédient actif utilisé dans la fabrication d'un produit pharmaceutique. ( le Règlement C.01A.001)
- Certificat de conformité (CC)
- Certificat délivré par une autorité de réglementation attestant la conformité avec les BPF d'un bâtiment reconnu dans le pays de délivrance. Au Canada, un CC est émis par Santé Canada.
- Forme posologique
- Médicament qui a été traité au point où il peut maintenant être administré en dose individuel (à moins qu'il en soit indiqué autrement dans le le Règlement)
- Licence d'établissement de produit pharmaceutique (LEPP)
- Licence qui permet à une personne d'exercer des activités assujetties à une licence dans un bâtiment au Canada.
- Bâtiment étranger
- Site situé à l'extérieur du Canada où les activités suivantes exigeant une licence sont menées à l'égard d'un médicament vendu au Canada : fabrication, emballage-étiquetage ou analyse.
- Inspection
- Évaluation de la conformité en fonction des exigences applicables de la LAD et de ses règlements connexes réalisée par un inspecteur désigné
- Activité visée par une licence
- Activité pour laquelle une licence (LEPP) est requise (fabrication, emballage/étiquetage, importation, vente en gros et analyse)
- Accord de reconnaissance mutuelle (ARM)
- Accord international portant sur la reconnaissance mutuelle en matière de certification de la conformité aux bonnes pratiques de fabrication des drogues (le Règlement C.01A.001)
- Organisme de réglementation
- Organisme gouvernemental ou autre entité publique qui est habilité à contrôler l'utilisation ou la vente de médicaments dans un pays participant à un Accord de reconnaissance mutuelle (ARM) et qui peut prendre des mesures d'exécution pour veiller à ce que les médicaments commercialisés sur le territoire relevant de sa compétence satisfassent aux exigences légales. (le Règlement C.01A.001)
Annexe C : Insuffisances
Dans le cas où les exigences prévues par le Règlement ne sont pas respectées, un avis d'insuffisance sera envoyé au demandeur. Une insuffisance se produit lorsqu'une demande ne peut pas faire l'objet d'une évaluation approfondie de Santé Canada, puisqu'elle ne satisfait pas aux exigences réglementaires ou que son intention/portée n'est pas claire. Voici quelques exemples d'insuffisances :
- un manque de clarté en lien avec la portée de la demande. Par exemple : une demande de renouvellement est soumise pour un établissement étranger, mais les activités énumérées dans le FRM-0033 ne sont pas les mêmes que celles déjà approuvées pour l'établissement étranger. On ne sait pas si le demandeur souhaite ajouter de nouvelles activités pour l'établissement étranger ou s'il souhaite simplement faire un renouvellement pour les activités déjà approuvées. La meilleure option pour s'assurer que les demandes soumises ne présentent pas d'insuffisances est de préciser la portée de la demande dans une lettre de présentation;
- Les renseignements requis sur les IPA ne sont pas inclus dans la demande (tableau A);
- La demande ne comporte aucune preuve de la conformité aux BPF selon les exigences décrites dans le document GUI-0080. Voici quelques exemples :
- Il manque des preuves (y compris lorsque l'établissement étranger envoie les preuves au nom de l'importateur).
- Il manque des dates, des signatures ou des documents exigés.
- Les preuves sont lourdement censurées, et il n'est pas possible de tirer des conclusions concernant la conformité aux BPF.
- L'inspection de l'établissement étranger n'a pas été réalisée en fonction des normes canadiennes des BPF, conformément au GUI-0001.
- Lors de l'examen de la conformité aux BPF, il est établi que les preuves ne concernent pas les activités, les catégories ou les formes pharmaceutiques demandées.
- Il existe des preuves plus récentes pour l'établissement étranger que ce qui a été fourni.
- L'adresse de l'établissement étranger figurant dans le FRM-0033 ne correspond pas à celle indiquée dans le rapport d'inspection fourni.