Modernisation de la réglementation des aliments à usage diététique spécial et des aliments pour bébés : Titres 24 & 25 du Règlement sur les aliments et drogues
Consultation terminée
Ce document fait partie de la consultation sur la modernisation de la réglementation des aliments à usage diététique spécial et des aliments pour bébés. La consultation s'est déroulée du 28 novembre 2023 au 26 février 2024.
Tables des matières
- Liste des abréviations
- Résumé
- 1.0 Introduction
- 2.0 Contexte
- 3.0 Description du cadre modernisé proposé
- 4.0 Un titre pour les aliments à des fins diététiques spéciales
- 5.0 Un titre pour les aliments non destinés à des fins diététiques spéciales
- 6.0 Conclusion
- Annexe 1 : Lexique
- Annexe 2 : Questions de la consultation
Liste des abréviations
- ACIA
- Agence canadienne d'inspection des aliments
- AFDS
- Aliments à des fins diététiques spéciales
- AFMS
- Aliments à des fins médicales spéciales
- AMT
- Apport maximal tolérable
- ANF
- Aliments nutritifs formulés
- ANR
- Apport nutritionnel recommandé
- ANREF
- Apports nutritionnels de référence
- ARTFTE
- Aliments pour régime à très faible teneur en énergie
- AS
- Apports suffisants
- AUDS
- Aliments à usage diététique spécial
- Code de l'OMS
- Code de commercialisation des produits de remplacement du lait maternel de l'Organisation mondiale de la Santé
- Codex
- Commission du Codex Alimentarius
- FLH
- Fortifiants pour lait humain
- FSANZ
- Food Standards Australia New Zealand (normes alimentaires d'Australie et de Nouvelle-Zélande)
- LAMT
- Lettre d'autorisation de mise en marché temporaire
- LHPE
- Lait humain préemballé
- NASEM
- National Academy of Science, Engineering and Medicine (Académies nationales des sciences, d'ingénierie et de médecine)
- NIPN
- Nouvel ingrédient de préparation pour nourrissons
- PRL
- Préparations pour régime liquide
- RAD
- Règlement sur les aliments et drogues
- RRMC
- Apports liés à un risque réduit de maladies chroniques
- SAT
- Substituts de l'alimentation totale
- SN
- Suppléments nutritifs
- SR
- Substituts de repas
- SRF
- Substituts de repas formulés
- Symbole nutritionnel
- Symbole nutritionnel sur le devant de l'emballage
- TVN
- Tableau de la valeur nutritive
- UE
- Union européenne
- VQ
- Valeur quotidienne
Résumé
Ce document de préparation aux consultations présente la proposition de modernisation des titres 24 et 25 du Règlement sur les aliments et drogues (RAD), qui régissent les aliments à usage diététique spécial (AUDS) et les aliments pour bébés au Canada. La réglementation actuelle, élaborée il y a plusieurs dizaines d'années, est désuète et rigide, ce qui empêche d'intégrer les progrès scientifiques et de mettre à jour les apports recommandés. Cette rigidité pose des défis à l'innovation industrielle, limite la disponibilité des produits approuvés dans d'autres pays et rend le Canada plus vulnérable aux pénuries.
La modernisation de la réglementation continuerait à favoriser la sécurité et la suffisance nutritionnelle de ces aliments, tout en encourageant l'innovation et l'harmonisation avec les administrations internationales, dans la mesure du possible et dans le contexte réglementaire canadien. Elle créerait un marché plus compétitif et améliorerait l'accès des Canadiens aux produits nutritifs essentiels. Cette modernisation cadre avec la modification de 2019 de la Loi sur les aliments et drogues, qui introduit le terme « aliment à des fins diététiques spéciales » (AFDS), et soutient l'élaboration en cours d'un cadre réglementaire pour les essais cliniques chez les humains de ces produits.
L'initiative de modernisation propose une restructuration complète des exigences réglementaires. Un aspect essentiel est l'introduction d'une distinction claire entre les produits qui répondent à la définition d'AFDS et ceux qui n'y répondent pas. Les AFDS feraient l'objet d'une surveillance réglementaire renforcée, y compris d'une autorisation préalable à la mise en marché pour la plupart des AFDS pour bébés, et de dispositions d'interdiction de vente afin de protéger la santé publique. En outre, les exigences relatives à la composition, tant pour les produits qui sont des AFDS que pour ceux qui ne le sont pas, seraient mises à jour pour tenir compte des derniers apports nutritionnels de référence (ANREF) et seraient incorporées par renvoi lorsque possible. La proposition vise aussi à améliorer l'étiquetage des produits en exigeant des renseignements détaillés sur les étiquettes des AFDS pour une utilisation sûre et une distinction par rapport aux produits qui ne sont pas des AFDS.
En conclusion, la modernisation réglementaire proposée pour les titres 24 et 25 vise à répondre aux limites et aux défis actuels de la réglementation des AUDS et des aliments pour bébés. En favorisant la flexibilité, en s'alignant sur les progrès scientifiques et en encourageant l'innovation, la modernisation réglementaire continuera à garantir la sécurité des produits tout en améliorant l'accessibilité et la diversité des produits pour le marché canadien. Cette diversité aidera à atténuer le risque de pénurie afin de mieux soutenir la santé et le bien-être de tous les Canadiens, en particulier des groupes vulnérables qui dépendent de produits nutritifs spécialisés. L'engagement de Santé Canada à l'égard de la modernisation souligne son dévouement envers la santé publique, en s'assurant que les Canadiens ont accès à des aliments de haute qualité, salubres et nutritifs qui répondent à leurs besoins alimentaires uniques.
1.0 Introduction
Les titres 24 et 25 du Règlement sur les aliments et drogues (RAD) prescrivent les exigences pour les aliments à usage diététique spécialRéférence 1 (AUDS) et les aliments pour bébés (personnes âgées de moins d'un an). Le titre 24 définit les exigences relatives aux aliments destinés aux personnes âgées de plus d'un an, par le biais d'une liste prescrite de catégories de produits qui peuvent être présentées commeRéférence 2 des AUDS, y compris les préparations pour régime liquide (PRL), les substituts de repas (SR) et les suppléments nutritifs (SN). Le titre 25 réglemente les aliments pour bébés tels que les préparations pour nourrissons, les fortifiants pour lait humain (FLH) et les aliments conventionnels pour bébés tels que les céréales et les fruits en purée.
Bien que les règlements relatifs aux AUDS et aux aliments pour bébés visent à assurer l'innocuité et la suffisance nutritionnelle, ils sont prescriptifs et désuets. Pour se conformer à la réglementation, les AUDS doivent respecter les exigences en matière de composition qui sont restées inchangées depuis des décennies, malgré les progrès scientifiques et les mises à jour des apports recommandés qui ont eu lieuRéférence 3.
Les limites du cadre actuel posent des défis à l'industrie dans l'introduction de produits novateurs sur le marché canadien. Par conséquent, de nombreux produits disponibles dans d'autres pays ne sont pas autorisés à la vente au Canada, laissant le pays avec un approvisionnement moins diversifié qui pourrait être plus affecté par une pénurie. Cette vulnérabilité s'est manifestée en 2022, lorsque le Canada a ressenti l'impact de pénuries mondiales, notamment en ce qui concerne les préparations pour nourrissons et le FLH, ainsi que les produits alimentaires destinés aux personnes souffrant de troubles métaboliques héréditaires (communément appelés produits métaboliques).
Afin de remédier à ces pénuries, Santé Canada a publié une politique provisoire recommandant que l'Agence canadienne d'inspection des aliments (ACIA) exerce son pouvoir discrétionnaire d'application de la loi en ce qui concerne certaines dispositions du RAD. Cela a facilité l'importation de produits fabriqués selon des normes comparables à celles du Canada. Alors que la politique provisoire a contribué à fournir un accès à court terme à ces produits pour les groupes vulnérables, des solutions réglementaires durables sont nécessaires afin de réduire le risque de pénuries futures et d'atténuer l'impact lorsqu'elles se produisent.
En 2019, la Loi sur les aliments et drogues a été modifiée pour introduire le terme « aliment à des fins diététiques spéciales »Référence 4, (AFDS) ce qui a favorisé l'élaboration d'un cadre réglementaire permettant d'effectuer des essais cliniques chez les humains sur ces produits. Le terme AFDS a été spécifiquement établi pour définir avec précision la portée des réglementations globales applicables à certains aliments, tels que les préparations pour nourrissons, les fortifiants pour lait humain et d'autres aliments médicaux, pour lesquels des réglementations rigoureuses sont essentielles pour prévenir les effets néfastes sur la santé. Actuellement, les AFDS non conformes ainsi que les AFDS soumis à des exigences avant leur mise en marché, tels que les nouvelles préparations pour nourrissons ou celles ayant subi des changements majeurs, qui n'ont pas encore fait l'objet d'un examen préalable à la mise en marché par Santé Canada ne peuvent pas être utilisés dans le cadre d'essais cliniques. Cette initiative de modernisation vise à restructurer les exigences réglementaires de manière à agrémenter le développement en cours du cadre d'essai clinique des AFDS en distinguant les AFDS des produits qui ne répondent pas à la définition d'un AFDS.
Depuis l'élaboration du cadre réglementaire actuel, des instruments réglementaires modernes qui sont plus flexibles sont devenus disponibles, notamment l'autorité d'incorporation par renvoi. Cela permet d'adopter administrativement des modifications réglementaires, telles que des mises à jour des exigences en matière de composition, dès que l'évaluation scientifique et les consultations connexes sont terminées. Dans le contexte du cadre modernisé proposé, les exigences de composition, lorsque prescrites, refléteraient les derniers apports nutritionnels de référence (ANREF)Référence 5 et seraient publiées dans un document incorporé par renvoi lorsque possible, pour permettre d'apporter des modifications de façon administrative aux exigences de composition afin de les aligner sur de nouvelles données probantes scientifiques.
Reconnaissant l'importance d'un étiquetage clair et complet pour favoriser une utilisation sûre des AFDS, des exigences d'étiquetage révisées sont proposées pour ces produits afin de fournir plus d'informations sur l'étiquette du produit, contribuant ainsi à garantir une utilisation sûre et à les distinguer des produits alimentaires à plus faible risque tels que les aliments sans gluten. Les exigences en matière d'étiquetage pour les produits alimentaires à plus faible risque, tels que les SR et les SN, seraient également révisées afin de mieux s'aligner sur les exigences générales pour les aliments préemballés, y compris l'utilisation d'un tableau de la valeur nutritive (TVN).
Dans l'ensemble, cette proposition de modernisation de la réglementation vise à soutenir l'innovation, à améliorer l'alignement avec les administrations internationales et à réduire les obstacles à l'importation de ces aliments au Canada. Ce nouveau cadre de réglementation améliorerait l'accès des Canadiens à ces produits nutritionnels essentiels et favoriserait la diversité du marché afin de réduire le risque de pénurie.
1.1 Objectif
Le présent document de préparation aux consultations a pour objet de présenter la proposition de Santé Canada visant à moderniser le cadre réglementaire des AFDS et des aliments pour bébés afin de recueillir les commentaires des intervenants. Ces commentaires informeront la rédaction de règlements qui seront pré-publiés dans la Partie 1 de la Gazette du Canada aux fins de commentaires du public. La section 2.0 décrit le cadre réglementaire canadien actuel et ses limites, tout en offrant une perspective internationale sur des cadres similaires. Les sections 3 à 5 fournissent des détails sur le cadre modernisé proposé à l'intention des intervenants, complétées par une série de questions directrices à l'Annexe 2 : Questions de la consultation.
2.0 Contexte
2.1 Contexte canadien
2.1.1 Bref historique du titre 24 du Règlement sur les aliments et drogues
En 1974, le titre 24 a été ajouté au RAD, établissant la liste fermée des catégories d'AUDS autorisées dans l'article B.24.003, qui reste actuellement en vigueur. Au départ, cette liste n'incluait que les aliments « diététiques », tels que les aliments à teneur réduite en glucides, sans sucre, à teneur réduite en calories ou à faible teneur en sodium. Toutefois, en 1978, la liste fermée des catégories d'AUDS a été élargie pour inclure les PRL, les aliments représentés pour les régimes sans gluten, les régimes à teneur réduite en protéines et les régimes à faible teneur en acides aminés spécifiques. Cette modification comprenait également l'ajout de la définition d'AUDS et l'établissement d'exigences spécifiques en matière d'étiquetage et de composition pour chaque catégorie d'AUDS.
Les dernières modifications réglementaires majeures apportées au titre 24 ont eu lieu en 1995, lorsque les SR, les SN et les aliments conçus pour des régimes amaigrissants ont été ajoutés à la liste des catégories pouvant être représentées comme des AUDS. Cette modification a également abrogé certaines des anciennes catégories d'AUDS introduites en 1974 et qui ne correspondaient plus au cadre d'AUDS (par exemple, les aliments à teneur réduite en glucides, les aliments modifiés en matières grasses, les aliments faibles en gras, les aliments à teneur réduite en calories, etc.).
Bien que le marché ait évolué en raison des progrès scientifiques et de l'innovation, la liste des produits autorisés à être représentés en tant qu'AUDS ainsi que leurs exigences sont restées inchangées depuis 1995. En 2005, des modifications réglementaires ont été proposées pour les SR, les SN et les aliments préemballés conçus pour des régimes amaigrissants pour modifier les exigences en matière de composition; par contre, cette proposition réglementaire n'a pas été mise en œuvre et ces modifications réglementaires n'ont jamais été promulguées.
2.1.2 Problèmes liés au cadre réglementaire actuel: Titre 24, Règlement sur les aliments et drogues
Les problèmes liés au cadre d'AUDS canadien comprennent son champ d'application restreint, ses exigences inflexibles et désuètes en matière de composition et d'étiquetage, ainsi que son manque d'harmonisation avec les cadres réglementaires internationaux. Ces problèmes sont détaillés dans cette section.
a) Accès restreint en raison d'une liste fermée de catégories d'aliments à usage diététique spécial
Le titre 24 se caractérise par une liste fermée de catégories de produits pouvant être représentées en tant qu'AUDSRéférence 6. Cette liste exclut plusieurs produits disponibles dans d'autres administrations, notamment les boissons pré et postopératoires destinées à améliorer la récupération après une intervention chirurgicale, les produits métaboliques pour les troubles métaboliques héréditaires non liés au métabolisme des protéines (par exemple, la galactosémie) et d'autres aliments spécialement formulés pour répondre aux besoins nutritionnels particuliers des personnes souffrant d'affections médicales. La liste restreinte entrave l'accès à des produits nouveaux et novateurs au Canada, ce qui engendre des difficultés à répondre aux besoins des consommateurs.
b) Exigences de composition désuètes
Les exigences désuètes et prescriptives en matière de composition signifient que les produits dont les quantités de nutriments sont conformes aux dernières recommandations des Académies nationales des sciences, d'ingénierie et de médecine (NASEM), ainsi que ceux qui sont spécifiquement formulés pour des personnes ayant des besoins nutritionnels particuliers en raison d'affections médicales, ne sont pas conformes au RAD et ne peuvent pas être vendus au Canada sans une lettre d'autorisation de mise en marché temporaire (LAMT). Ces exigences désuètes ne sont pas alignées sur les normes en vigueur dans d'autres administrations, ce qui oblige les fabricants à mettre au point des formulations distinctes exclusivement pour le marché canadien ou à demander une LAMT. Les intervenants de l'industrie ont fait part de leurs difficultés à fabriquer des produits conformes aux fourchettes étroites de teneur en nutriments stipulées dans le RAD. Satisfaire aux exigences minimales à la fin de la durée de conservation sans excéder le maximum réglementaire pose des défis techniques considérables.
c) Exigences insuffisantes en matière d'étiquetage
Les exigences actuelles en matière d'étiquetage pour certains AUDS ne répondent pas aux besoins des consommateurs et ne permettent pas de prendre des décisions éclairées. Par exemple, les exigences en matière d'étiquetage nutritionnel pour les produits destinés à la population générale manquent de cohérence non seulement entre les catégories de produits, mais aussi avec d'autres aliments préemballés. Alors que la plupart des aliments préemballées conventionnels doivent afficher un TVN et, dans certains cas, un symbole nutritionnel sur le devant de l'emballage (symbole nutritionnel), ces informations sont interdites sur l'étiquette des SR et des SN. Si les consommateurs n'ont pas accès aux informations fournies par un TVN, il leur est difficile de faire des choix alimentaires plus sains et plus éclairés, y compris pour les personnes qui ont besoin de certaines informations pour gérer leur état de santé. Par exemple, les SR et les SN ne sont pas tenus d'indiquer la teneur en sucres sur l'étiquette, et les fabricants choisissent souvent de ne pas divulguer cette information. Il est donc difficile pour les personnes atteintes du diabète de prendre des décisions éclairées. Conséquemment, des consommateurs préoccupés ont contacté Santé Canada, exprimant leur désir de connaître la teneur en sucres de ces aliments.
En outre, les exigences en matière d'étiquetage pour les AUDS sont très différentes de celles en vigueur dans d'autres administrations. Cela ajoute un fardeau inutile et peut décourager les entreprises de distribuer leurs produits au Canada, ce qui pourrait limiter l'accès à des produits essentiels pour les Canadiens vulnérables.
d) Restrictions en matière de publicité désuètes
Les parties B et D du RAD prescrivent des restrictions en matière de publicité pour certains AUDS dont les PRL, les aliments présentés comme étant conçus pour un régime à très faible teneur en énergie (ARTFTE), les aliments enrichis destinés aux régimes à teneur réduite en protéines et en acides aminés et les aliments enrichis destinés à un régime sans gluten. Selon l'article 2 de la Loi sur les aliments et drogues, toute communication visant à promouvoir la vente d'un aliment est considérée comme une publicité. Cela signifie que tout moyen de promotion relève de la publicité et serait donc soumis à des restrictions pour ces catégories d'AUDS.
L'objectif de ces restrictions publicitaires était de veiller à ce que les consommateurs consultent leurs fournisseurs de soins de santé avant d'utiliser ces produits. Toutefois, ces restrictions ne sont plus adaptées à l'époque actuelle, où de nombreux individus participent activement aux décisions en matière de leurs soins de santé. En outre, les restrictions en matière de publicité sont devenues impraticables dans le contexte actuel de la publicité et de la distribution en ligne. En raison de ces restrictions, les fabricants et les distributeurs ne sont pas en mesure de faire de la publicité pour ces produits en utilisant les médias sociaux, notamment ils ne peuvent fournir des liens vers des marchés en ligne ou des informations sur la manière d'acheter ces produits. Ainsi, les consommateurs qui recherchent en ligne des produits adaptés à leurs besoins ne savent pas que ces types d'AUDS sont disponibles à l'achat. Cela rend difficile l'accès à une large gamme de produits, en particulier pour les personnes vivant dans des communautés éloignées ayant un accès limité aux magasins de détail.
e) Exigences désuètes pour les aliments présentés comme étant conçus pour un régime amaigrissant
Le titre 24 limite la représentation des aliments destinés à être consommés dans les régimes amaigrissants aux ARTFTE, aux SR, aux repas préemballés et aux aliments vendus par une clinique d'amaigrissement. Cette restriction vise à garantir que seuls les produits qui permettent de contrôler l'apport alimentaire tout en assurant un apport en nutriments adéquat peuvent être présentés comme des options appropriées pour les régimes amaigrissants. Par conséquent, ces aliments sont soumis à des exigences réglementaires supplémentaires, qui ne sont plus d'actualité.
Les ARTFTE doivent être utilisées sous surveillance médicale et ont des exigences détaillées en matière de composition qui sont basées sur des apports recommandés désuets. Une notification préalable à la mise en marché est requise avant la vente de ces aliments. Or, à ce jour, Santé Canada n'a reçu aucune notification, ce qui suggère que les exigences relatives à cette catégorie ne s'harmonisent pas avec ce qui est disponible sur le marché.
De même, les SR destinés aux régimes amaigrissants, ainsi que les repas préemballés et les aliments vendus dans une clinique d'amaigrissement doivent inclure un exemple de menu de sept jours qui répond à certaines exigences basées sur la version 1992 du Guide alimentaire canadien pour manger sainement. Ces aliments et le menu type qui les accompagne doivent respecter des exigences de composition fondées sur des apports recommandés désuets.
2.1.3 Bref historique du titre 25 du Règlement sur les aliments et drogues
En 1976, le titre 25 a été ajouté au RAD, établissant des exigences pour les aliments pour bébés, y compris les préparations pour nourrissons. Celui-ci a introduit des restrictions en sodium pour les aliments pour bébés et a établi des exigences en matière de composition pour les préparations pour nourrissons qui sont restées inchangées depuis leur promulgation.
Des modifications importantes ont été apportées au titre 25 en 1983, y compris l'ajout de dispositions permettant au ministre d'ordonner l'arrêt de la vente d'une préparation pour nourrissons potentiellement inadéquate ou non sécuritaire. En outre, le terme succédané de lait humain a été introduit pour s'harmoniser avec la terminologie internationale, réservant le terme préparation pour nourrissons comme nom usuel pour les succédanés de lait humain. Plusieurs années plus tard, en 2021, le titre 25 a également été élargi pour inclure n'importe quel produit vendu ou représenté en tant que succédané de lait, n'importe quel produit représenté comme ingrédient pouvant être utilisé dans un succédané de lait ainsi que des aliments contenant un succédané de lait.
La modification majeure la plus récente pour les préparations pour nourrissons a eu lieu en 1990 lorsque les exigences en matière de notification préalable à la mise en marché ont été introduites pour les nouvelles préparations pour nourrissons et celles ayant subi des changements majeurs. Le titre 25 a subi d'autres modifications importantes afin d'inclure l'ajout de dispositions pour les FLH. Avant cette modification réglementaire, les FLH ne pouvaient pas être vendus au Canada par contre, certains FLH étaient disponibles à la suite d'une évaluation de sécurité rigoureuse par Santé Canada.
2.1.4 Problèmes liés au cadre réglementaire actuel: Titre 25, Règlement sur les aliments et drogues
a) Problèmes de nomenclature et de définition des aliments pour bébés
Le RAD définit généralement les aliments pour bébés comme des aliments étiquetés ou annoncés comme étant destinés à être consommés par des nourrissonsRéférence 7. Cette définition englobe tous les aliments pour bébés, y compris les préparations pour nourrissons, les FLH et les aliments conventionnels destinés aux bébés âgés de 6 mois ou plus, tels que les céréales pour bébés et les fruits en purée.
Dans le cas des préparations pour nourrissons, le terme réglementaire prescrit est « succédané de lait humain ». Toutefois, la réglementation exige également l'utilisation du nom usuel « préparation pour nourrissons » sur les étiquettes des produits et dans la publicité. Cette double dénomination est excessivement compliquée et inutile. En outre, la définition de « succédané de lait humain » inclut les aliments présentés en tant qu'ingrédients dans un succédané de lait humain, mais ces ingrédients ne semblent pas être commercialisés au Canada. Les seuls ingrédients dont l'ajout est autorisé dans le mode d'emploi des préparations pour nourrissons sont l'eau et/ou une source de glucides.
Dans l'ensemble, la réglementation relative aux aliments pour bébés bénéficierait d'être plus claire et plus cohérente en termes de terminologie et de définitions, afin d'éviter les malentendus et de garantir que le cadre réglementaire s'aligne sur l'objectif visé et la catégorisation des aliments pour bébés.
b) Lacunes réglementaires pour certains aliments pour bébés
En raison de la nature désuète du cadre réglementaire existant pour les aliments pour bébés, un certain nombre d'aliments pour bébés disponibles dans d'autres pays ne sont pas pris en compte dans le titre 25 du RAD.
- Préparations pour nourrissons spécialisées
Les préparations pour nourrissons doivent être formulées de manière à répondre à des exigences spécifiques en matière de composition. Bien qu'il existe des dérogations à ces exigences de composition, elles sont limitées à des cas spécifiques, tels que les préparations pour nourrissons représentées pour les régimes modifiés en gras, à faible teneur en acides aminés, en minéraux, en vitamine D, ou toute combinaison de ces éléments. Ces exemptions ont une portée limitée et pourraient constituer des obstacles à l'accès aux préparations pour nourrissons spécialisées qui peuvent être bénéfiques, voire nécessaires, aux nourrissons ayant des besoins médicaux spécifiques. Par exemple, la réglementation actuelle ne permet pas de modifier les préparations pour nourrissons prématurés lorsque nécessaire dans des circonstances spécifiques (par exemple, faible poids à la naissance, poids extrêmement faible à la naissance, etc.). L'élimination d'obstacles inutiles rendrait l'approbation des produits nouveaux et novateurs moins compliquée et plus rationalisée.
- Lait humain préemballé
Le lait humain préemballé (LHPE) provenant des banques de lait canadiennes est soigneusement sélectionné, traité et emballé pour en garantir la salubrité, et il est actuellement utilisé dans les hôpitaux. Il sert de complément lorsque le lait maternel est insuffisant ou indisponible. Actuellement, la plupart du LHPE au Canada provient de quatre banques de lait humain à but non lucratif situées à Calgary, Montréal, Toronto et Vancouver. Santé Canada est également conscient d'entreprises commerciales de transformation de lait humain qui vendent leurs produits dans d'autres pays.
Le titre 25 ne contient pas de dispositions spécifiques pour le LHPE. Au lieu de cela, le LHPE est soumis aux exigences générales relatives aux aliments préemballés conventionnels énoncées dans la Loi sur les aliments et drogues et le RAD. L'absence d'exigences réglementaires spécifiques, y compris de dispositions relatives à la salubrité et à la qualité, ainsi que d'informations sur l'étiquette adaptées à l'utilisation sûre de ces produits, est préoccupante pour cette catégorie d'aliments destinés à une sous-population vulnérable.
- Autres aliments pour bébés
La réglementation actuelle ne tient pas compte de certains autres types d'aliments pour bébés, notamment les aliments médicaux pour bébés qui ne sont pas destinés à remplacer les préparations pour nourrissons et les composants complémentaires qui ne répondent pas à la définition d'un FLH, tels que les produits de type « modulaire » à macronutriment unique qui peuvent être mélangés à d'autres produits avant d'être utilisés (par exemple, les produits modulaires à base de protéines, de glucides ou de matières grasses). L'absence de dispositions réglementaires pour ces produits limite les options disponibles pour les bébés ayant des besoins alimentaires particuliers.
c) Incompatibilité avec le Code international de commercialisation des substituts du lait maternel de l'Organisation mondiale de la Santé
L'Organisation mondiale de la Santé a établi le Code international de commercialisation des substituts du lait maternelRéférence 8 (Code de l'OMS) en réponse au déclin mondial de l'allaitement maternel, influencé par des facteurs socioculturels et la promotion des préparations pour nourrissons. Adopté par l'Assemblée mondiale de la Santé en 1981, et mis à jour en 2017, le Code de l'OMS vise à assurer une alimentation sûre et adéquate aux nourrissons en protégeant et en encourageant l'allaitement maternel, tout en réglementant l'utilisation appropriée des substituts du lait maternelRéférence 9, si nécessaire, grâce à des pratiques de commercialisation et de distribution responsables.
En tant que signataire du Code de l'OMS, le Canada a l'obligation de soutenir et de promouvoir l'allaitement maternel, de faciliter l'allaitement des mères par des mesures législatives et sociales, et d'empêcher la promotion inappropriée des ventes d'aliments pour nourrissons qui peuvent être utilisés pour remplacer le lait humain. Cependant, le RAD ne reflète pas les recommandations du Code de l'OMS, notamment en ce qui concerne la restriction de la publicité ou d'autres formes de promotion, ainsi que l'obligation d'étiqueter les substituts du lait maternel afin de fournir les informations nécessaires sur l'utilisation appropriée du produit pour ne pas décourager l'allaitement maternel.
d) Exigences de composition désuètes
Les exigences actuelles en matière de composition des préparations pour nourrissons n'ont pas été modifiées depuis leur introduction dans la réglementation en 1976, malgré les progrès en matière de science de la nutrition et les mises à jour des apports recommandés. De même, les dispositions relatives à l'enrichissementRéférence 10 des produits céréaliers pour bébés, un aliment conventionnel pour bébés, n'ont pas été modifiées depuis leur introduction dans le RAD dans les années 1960. Ces dispositions ne sont pas fondées sur les recommandations actualisées en matière de nutriments pour les bébés et ne comprennent pas de niveaux maximaux pour les nutriments minéraux, malgré la vulnérabilité de cette sous-population.
En outre, la réglementation relative aux aliments conventionnels pour bébés fixe des limites de sodium pour une liste fermée de catégories de produits et les limites varient en fonction du type de produit. La justification de la différenciation des limites de sodium en fonction du type de produit n'est pas claire et la liste fermée n'englobe pas toutes les catégories d'aliments conventionnels pour bébés disponibles sur le marché.
e) Problématique avec la notification préalable à la mise sur le marché
En vertu de la réglementation actuelle, les parties réglementées doivent informer Santé Canada au moins 90 jours avant de vendre une nouvelle préparation pour nourrissons ou d'en faire la publicité. Toutefois, l'évaluation d'une demande de notification préalable à la mise sur le marché d'une nouvelle préparation pour nourrissons ou d'une préparation pour nourrissons existante ayant subi un changement majeur prend généralement plus de 90 jours. Cette durée prolongée comprend des pauses dans le processus d'évaluation pour permettre la soumission d'informations supplémentaires par les fabricants. Alors que les parties réglementées attendent généralement que Santé Canada achève son évaluation, aucune disposition de la réglementation actuelle n'empêche la vente d'une préparation pour nourrissons avant la fin de l'évaluation, ce qui introduit un risque potentiel pour la santé et la sécurité des nourrissons. Bien que les dispositions de cessation de vente permettent au ministre d'interrompre la vente de produits présentement sur le marché, ceci est une mesure réactionnaire.
f) Évaluation distincte volontaire des nouveaux ingrédients des préparations pour nourrissons
Les nouveaux ingrédients qui n'ont jamais été utilisés dans une préparation pour nourrissons doivent faire l'objet d'une détermination de nouveauté. S'il s'avère que l'ingrédient est nouveau, les informations nécessaires à l'évaluation d'un nouvel aliment doivent être fournies. Si l'ingrédient n'est pas considéré comme nouveau, Santé Canada procède à une évaluation volontaire du nouvel ingrédient de préparation pour nourrissons (NIPN) afin de déterminer s'il peut être utilisé en toute sécurité chez les nourrissons. Toutefois, l'absence d'exigences réglementaires relatives aux demandes d'autorisation de nouveaux ingrédients signifie qu'il n'y a pas d'obligation légale d'obtenir une autorisation distincte pour un nouvel ingrédient avant de l'incorporer dans une soumission d'avis préalable à la commercialisation de préparations pour nourrissons. L'évaluation du NIPN au cours de l'évaluation d'une préparation pour nourrissons introduit une complexité qui aurait pu être résolue avant la soumission de la demande d'évaluation de la préparation et prolonge l'échéance de l'évaluation. Par conséquent, la clarification des exigences et de la procédure relatives aux informations nutritionnelles aiderait à rationaliser l'évaluation. Il s'agirait notamment de clarifier les questions relatives à la propriété des données et aux informations exclusives entre le fabricant de la préparation pour nourrissons et le fabricant du NIPN.
2.1.5 Mesures temporaires pour remédier à un cadre réglementaire désuet
Au fil des ans, Santé Canada a mis en œuvre des mesures temporaires pour relever les défis liés au cadre réglementaire désuet. L'une de ces mesures est l'autorisation de mise en marché provisoire, qui a servi de mécanisme de transition entre la fin de l'évaluation scientifique de certaines modifications et la publication des modifications approuvées dans la Partie II de la Gazette du Canada. Bien que cet outil réglementaire n'est plus disponible sous le RAD et que les autorisations de mise en marché provisoire aient expirées, les changements qui ont été permis continuent d'être nécessaires pour répondre à d'importants besoins en matière de santé publique. Par exemple, des autorisations de mise en marché provisoire ont été délivrées pour augmenter les teneurs maximales en micronutriments dans les préparations pour nourrissons nés à terme et prématurés ainsi que dans les PRL, et pour exempter les PRL des exigences en matière de composition lorsqu'elles sont formulées spécifiquement pour des patients souffrant d'insuffisance rénale.
Les LAMT représentent un autre outil réglementaire sous le RAD qui a été utilisé par Santé Canada afin de permettre la vente de certains AUDS. Une LAMT autorise la vente temporaire d'un produit non-conforme au Canada afin de mener des études de commercialisation dans le monde réel pour éclairer une modification réglementaire. Au cours des dix dernières années, le Ministère a délivré des centaines de LAMT pour des AUDS afin d'éclairer cette initiative de modernisation réglementaire pour les AUDS. Il s'agit notamment de LAMT pour des SR et des SN pour faciliter la transition en toute sécurité de ces produits du cadre réglementaire des produits de santé naturels vers le cadre réglementaire des aliments. Des LAMT ont également été délivrées pour des AUDS destinés aux enfants, dont les besoins nutritionnels révisés ne sont pas pris en compte dans les exigences en matière de composition actuelles.
Santé Canada délivre aussi de façon périodique des énoncés de politique provisoire comme mesure temporaire afin de témoigner son intention que certains produits non-conformes au RAD demeurent disponibles jusqu'à ce que des modifications réglementaires puissent être apportées. Santé Canada a récemment publié deux énoncés de politique provisoire pour remédier aux exigences réglementaires désuètes concernant le lait humain préemballé (LHPE) et les produits métaboliques. Ces énoncés de politique signalent l'engagement du Ministère à moderniser les règlements pour ces types de produits. Par conséquent, des propositions concernant le LHPE et les produits métaboliques ont été incluses dans le cadre de cette initiative de modernisation. Lorsque les modifications réglementaires finales seront apportées, les politiques provisoires pour ces types de produits ne seront plus en vigueur.
Les mesures temporaires telles que les LAMT sont inefficaces, prennent du temps et imposent un fardeau administratif considérable à la fois à l'industrie et à Santé Canada. Les intervenants de l'industrie ont indiqué que le processus souvent long requis pour l'obtention d'approbations peut entraîner des retards dans la mise sur le marché des produits. En outre, les énoncés de politique provisoires qui s'appuient sur un pouvoir discrétionnaire d'application de la loi en matière de certaines dispositions peuvent donner l'impression d'une situation de concurrence inégale pour l'industrie.
2.1.6 Pénuries d'aliments à des fins diététiques spéciales
Une pénurie peut résulter d'une série de circonstances, notamment des perturbations dans la fabrication, des difficultés d'accès aux matières premières, le stockage, des hausses de la demande et des événements imprévus affectant la chaîne d'approvisionnement mondiale. Ces dernières années, les pénuries d'AFDS sont devenues une préoccupation majeure en raison de problèmes liés à la chaîne d'approvisionnement mondiale et de rappels de produits.
Le Canada est particulièrement vulnérable aux pénuries d'AFDS en raison de la petite taille de son marché et de sa dépendance à un nombre limité de fournisseurs. Cette vulnérabilité est aggravée par un cadre réglementaire désuet qui impose des restrictions inutiles à l'importation d'AFDS disponibles dans d'autres pays ayant des normes de sécurité similaires à celles du Canada.
Depuis le début de l'année 2022, le Canada connaît des pénuries d'AFDS, notamment de préparations pour nourrissons, de FLH et de produits métaboliques. Ces pénuries ont été attribuées au rappel de plusieurs préparations en poudre pour nourrissons et à la fermeture temporaire subséquente d'une importante installation de fabrication aux États-Unis, qui fournit une part significative de ces produits à l'échelle mondiale. Ce rappel et l'arrêt de la production ont encore exacerbé la pression mise sur une chaîne d'approvisionnement mise à l'épreuve par la pandémie de COVID-19 ainsi que l'invasion de l'Ukraine par la Russie.
Afin d'atténuer ces pénuries, Santé Canada a publié une politique provisoire recommandant que l'ACIA exerce temporairement son pouvoir discrétionnaire d'application de la loi pour l'importation de certains produits non conformes en provenance d'autres pays qui adhèrent à des normes de fabrication de haute qualité comparables à celles appliquées au Canada.
Les pénuries d'AFDS peuvent avoir de graves conséquences. Ces produits constituent une source critique d'énergie et de nutriments essentiels pour les Canadiens vulnérables. Les pénuries peuvent également entraîner une hausse des prix des réserves limitées disponibles. En outre, ces pénuries pèsent lourdement sur le système de santé, obligeant les fournisseurs de soins de santé à investir des ressources précieuses et du temps pour trouver des produits alternatifs adéquats. Ceci peut retarder ou restreindre l'accès aux AFDS, ce qui peut engendrer des effets néfastes sur la santé.
Les pénuries récentes de préparations pour nourrissons et d'autres AFDS ont mis en évidence la nécessité d'un approvisionnement plus diversifié et plus résilient pour ces produits, et la mise à jour de la réglementation pourrait contribuer à ce résultat. Bien que des mesures provisoires ont été utiles à court terme, des solutions réglementaires durables sont nécessaires. L'introduction de modifications réglementaires uniquement liées aux pénuries fournirait des mécanismes permettant de mieux faire face aux pénuries lorsqu'elles se produisent, mais ces modifications ne permettraient pas de minimiser efficacement le risque de nouvelles pénuries. La modernisation du cadre réglementaire actuel nécessite donc une approche rigoureuse qui répond également à certains des obstacles réglementaires sous-jacents qui contribuent au risque de pénuries. Il s'agirait par exemple d'actualiser les exigences de composition désuètes pour certains AFDS.
2.2 Mobilisation des intervenants et données du marché
Au fil des ans, les consommateurs, les professionnels de la santé et les intervenants de l'industrie ont constamment insistés que Santé Canada relève les défis associés au cadre réglementaire désuet des AUDS et des aliments pour bébés. Les commentaires fournis en réponse aux consultations multilatérales, un appel de données sur les AUDS ainsi que les données obtenues à partir d'articles et de publications scientifiques externes ont été utilisés pour élaborer la proposition de cadre réglementaire modernisé décrite dans le présent document.
2.2.1 Aliments à usage diététique spécial
En 2017, le Programme en sécurité alimentaire, nutrition et affaires réglementaires de l'Université de Toronto et la Société canadienne de nutrition ont organisé conjointement un atelier réunissant multiples intervenants qui sont des experts, notamment des professionnels de la santé, des chercheurs, des fonctionnaires de Santé Canada et des intervenants de l'industrie, afin de discuter des problèmes liés au cadre du titre 24. Cet atelier, intitulé « Comment optimiser les aliments à usage diététique spécial au Canada - Exigences nutritionnelles, innovation et réglementation »Référence 11, a examiné le contexte des réglementations mondiales, l'importance des AUDS pour la nutrition et la santé, ainsi que les prochaines étapes pour relever les défis et saisir les opportunités en matière de réglementation et d'utilisation des AUDS. Les participants à l'atelier étaient tous d'accord que les réglementations actuelles du titre 24 ne permettent pas la meilleure utilisation des recommandations nutritionnelles actuelles et de la recherche en science/technologie alimentaire, l'innovation, de répondre aux besoins des utilisateurs dans des contextes cliniques et non cliniques, ni de favoriser l'accès aux produits préférés. L'atelier a débouché sur la recommandation d'élaborer un cadre réglementaire pour les AUDS au Canada qui est moderne, sûr, souple, innovant et axé sur la santé.
En 2019, Santé Canada a demandé aux fabricants et aux distributeurs de lui fournir des données sur les AUDS vendus au Canada, sur les produits dont la vente est prévue au Canada dans un avenir prévisible, ainsi que sur les produits vendus dans d'autres administrations mais qui ne peuvent pas être vendus au Canada en vertu de la réglementation actuelle. Cinq répondants ont fourni des informations sur environ 100 produits, y compris des détails sur l'utilisation prévue du produit, des informations sur les ventes actuelles et prévues, et les étiquettes des produits.
Les répondants ont également été invités à faire part des difficultés qu'ils rencontrent avec la réglementation actuelle des AUDS. Un certain nombre d'irritants réglementaires ont été identifiés, notamment la liste fermée des catégories de produits autorisés à être représentés en tant qu'AUDS, les exigences de composition désuètes, les problèmes liés aux exigences d'étiquetage actuelles et le manque d'harmonisation par rapport aux exigences en matière de composition entre le Canada et ses principaux partenaires commerciaux. Ces problèmes créent des obstacles à la distribution des AUDS au Canada en empêchant l'utilisation de formulations et d'étiquettes mondiales et, par conséquent, empêchent l'accès des Canadiens aux AUDS novateurs.
En outre, un article publié en 2019Référence 12 par la Société professionnelle des affaires règlementaires met en évidence les possibilités pour le gouvernement canadien de moderniser sa réglementation sur les produits de nutrition médicale et de l'harmoniser avec les administrations internationales. L'article souligne les difficultés rencontrées par les patients pour accéder à ces produits en raison des lacunes du cadre réglementaire actuel. L'auteur suggère que, selon les précédents des systèmes internationaux de réglementation de ces produits, l'élément clé pour la modernisation du cadre canadien sera de remédier aux limites réglementaires inhérentes en matière de flexibilité, d'adaptabilité et de capacité d'interface avec d'autres systèmes de réglementation.
2.2.2 Préparations pour nourrissons
En mars 2017, une association de l'industrie a soumis un document de discussion à Santé Canada concernant divers aspects des documents d'orientation du Ministère sur les préparations pour nourrissons. Leurs commentaires comprenaient des recommandations sur des sujets tels que les informations requises pour l'établissement d'une nouvelle usine de fabrication, la notification préalable à la mise sur le marché des préparations pour nourrissons et le guide à l'intention de l'industrie sur les preuves scientifiques nécessaires pour établir la suffisance nutritionnelle des préparations pour nourrissons. L'association a également fait part de ses préoccupations concernant les délais actuels pour les exigences de notification préalable à la mise sur le marché, soulignant l'importance d'accorder suffisamment de temps et de planification pour introduire les produits sur le marché de façon efficace.
En mai 2018, Santé Canada a rencontré l'association de l'industrie et s'est engagé à examiner la faisabilité d'une collaboration avec les administrations internationales qui partagent des normes de fabrication similaires à celles du Canada afin d'alléger les fardeaux inutiles imposés à l'industrie.
En juin 2022, l'association de l'industrie a fait part de ses préoccupations au Conseil du Trésor du Canada, dans le cadre de l'initiative « Parlons des règlements fédéraux » du gouvernement du Canada, et plus particulièrement dans le cadre du projet de consultation en ligne « Éliminer les obstacles réglementaires intergouvernementaux ». La principale préoccupation de l'association concerne la discordance de la réglementation canadienne par rapport à celle des principaux partenaires commerciaux internationaux. Elle demande instamment au Ministère de mettre en œuvre des procédures fondées sur le risque pour les préparations pour nourrissons qui font l'objet de modifications simples et à faible risque. Cela permettrait une évaluation plus rapide par le biais d'une procédure accélérée, ce qui faciliterait en fin de compte l'entrée de ces produits sur le marché.
2.2.3 Pénuries d'aliments à des fins diététiques spéciales
En février 2023, Santé Canada a mené un sondage auprès des principaux intervenants impliqués dans la réponse du Ministère aux pénuries de certains AFDS destinés aux bébés et aux enfants. L'objectif était de recueillir des commentaires détaillés sur la gestion des pénuries par le Ministère et sur l'efficacité de la politique provisoire mise en œuvre pour les atténuer. Les intervenants ont souligné l'importance d'élaborer un plan d'action exhaustif pour gérer efficacement les futures pénuries potentielles d'AFDS. Ils ont souligné la nécessité d'établir des règlements pour assurer un approvisionnement constant et fiable de préparations pour nourrissons et autres AFDS au Canada. En outre, les intervenants ont proposé l'élaboration d'un cadre réglementaire, similaire à celui utilisé pour gérer les pénuries de médicaments, afin d'aider à résoudre et à atténuer les problèmes potentiels liés aux pénuries d'AFDS à l'avenir.
Le sondage et les commentaires qui en ont découlé ont permis à Santé Canada d'évaluer l'efficacité de sa gestion des pénuries d'AFDS. Les recommandations et les préoccupations soulevées par les intervenants vont éclairer les efforts en cours pour améliorer les politiques, les réglementations et les stratégies de communication afin de mieux gérer et atténuer ces pénuries à l'avenir.
2.3 Contexte international
Santé Canada a procédé à un examen approfondi des cadres réglementaires comparables existant à l'échelle internationale. À l'instar de l'approche proposée par le Ministère, d'autres cadres établissent une distinction claire entre les « produits diététiques spéciaux » destinés aux populations plus vulnérables (c'est-à-dire, les AFDS) et ceux destinés à la libre-sélection par la population générale. Bien que la gamme de produits reconnus comme « diététiques spéciaux » varie, de nombreuses administrations ont établi des exigences distinctes et spécifiques pour ces produits, afin de refléter leur objectif et leur utilisation par les populations vulnérables.
Au cours de la dernière décennie, plusieurs administrations, dont l'Union européenne (UE), l'Australie et la Nouvelle-Zélande, se sont lancées dans des initiatives de modernisation de la réglementation relative aux AFDS. Santé Canada a l'occasion de combler les lacunes du cadre réglementaire actuel en tirant parti des mises à jour et des flexibilités similaires déjà mis en œuvre dans ces régions.
L'approche proposée pour la modernisation des titres 24 et 25 s'inspire des principes et des pratiques exemplaires établis par ces autres cadres, tout en tenant compte des besoins et du contexte réglementaire propres au Canada.
2.3.1 Commission du Codex Alimentarius
La Commission du Codex Alimentarius (Codex) est une organisation internationale créée par l'Organisation des Nations Unies pour l'alimentation et l'agriculture et l'Organisation mondiale de la Santé. Son objectif est d'élaborer des normes alimentaires internationales, des lignes directrices et des codes de pratique. Ces normes et lignes directrices visent à garantir que les aliments répondent à des exigences spécifiques en matière de composition nutritionnelle, d'étiquetage et d'allégations, facilitant ainsi le commerce international et garantissant une qualité et une sécurité constantes à travers les frontières.
Afin de s'aligner, dans la mesure du possible, sur les réglementations internationales et de promouvoir une qualité et une sécurité constantes des aliments diététiques spéciaux, Santé Canada a pris en considération diverses normes et lignes directrices pertinentes du CodexRéférence 13. Ces textes fournissent des recommandations pour l'étiquetage et la composition des aliments, y compris les préparations pour nourrissons, les aliments pour bébés, les aliments destinés à des fins médicales spéciales (AFMS) (qui englobent certaines catégories de produits considérés comme AUDS au Canada ainsi que d'autres types d'aliments médicaux non couverts par le cadre actuel du Canada) et les aliments destinés aux personnes intolérantes au gluten.
2.3.2 Union européenne
En 2013, l'UE a remplacé son cadre pour les aliments destinés à une alimentation particulière par l'introduction d'aliments destinés à des groupes spécifiques afin de renforcer les dispositions relatives aux aliments destinés aux populations vulnérables qui nécessitent une protection et d'assurer une catégorisation claire, l'harmonisation et la libre circulation de ces aliments dans l'UERéférence 14. Ce changement a été motivé par la nécessité de renforcer la protection des consommateurs en ce qui concerne le contenu et la commercialisation de ces produits, en rationalisant un système complexe et fragmenté qui a évolué pendant trois décennies. Ce cadre établit des exigences en matière d'étiquetage et de composition des préparations pour nourrissons, des préparations à base de céréales et autres aliments pour bébés, des AFMS et des substituts de la ration journalière totale pour contrôle du poids.
Certains aliments sont exclus de ce cadre car ils ont été jugés suffisamment couverts par des législations horizontales (par exemple, la législation alimentaire générale sur les allégations nutritionnelles et santéRéférence 15 et l'ajout de vitamines, de minéraux et de certaines autres substances aux alimentsRéférence 16). Les aliments exclus du cadre comprennent les laits pour tout-petits et les produits similaires destinés aux jeunes enfants, les aliments destinés aux sportifs, les autres aliments enrichis formulés pour les personnes vulnérables sur le plan nutritionnel, tels que ceux conçus pour remplacer un repas ou pour complémenter le régime alimentaire, ainsi que les aliments sans gluten/à très faible teneur en gluten et les aliments sans lactose.
2.3.3 Australie et Nouvelle-Zélande
La partie 2.9 du Code des normes alimentairesRéférence 17 d'Australie et de Nouvelle Zélande établi des exigences en matière de composition et d'étiquetage pour les aliments à usage spécifique, qui sont des produits alimentaires destinés aux individus et aux sous-groupes de populations vulnérables sur le plan physiologique. Il s'agit notamment des bébés, des jeunes enfants, des femmes enceintes et allaitantes, ainsi que des personnes souffrant de certaines affections médicales ou ayant des besoins diététiques particuliers. Les aliments à usage spécifique comprennent divers produits tels que les préparations pour nourrissons, les aliments pour bébés, les AFMS, les substituts de repas formulés, les suppléments nutritifs formulés et les suppléments nutritifs formulés pour sportifs. Bien que les substituts de repas formulés, les suppléments nutritifs formulés et les suppléments nutritifs pour sportifs formulés soient destinés à la population générale, ils sont inclus dans le cadre puisque les personnes qui consomment ces produits ont des besoins diététiques uniques qui peuvent différer des recommandations diététiques pour la population générale.
Les efforts de modernisation de la réglementation en Australie et en Nouvelle-Zélande se poursuivent, avec un accent particulier sur les préparations pour nourrissons, y compris celles destinées à des fins médicales. Depuis 2011, Normes alimentaires d'Australie et de Nouvelle Zélande (FSANZ) consulte activement sur les propositions de modification de ces réglementations. L'objectif de ces propositions est de clarifier l'environnement réglementaire, d'intégrer les dernières données scientifiques et d'aligner les réglementations sur les normes internationales dans la mesure du possible.
2.3.4 États-Unis
Contrairement au Canada et à de nombreuses autres administrations internationales, les États-Unis ne disposent pas d'un cadre réglementaire distinct pour les aliments diététiques spéciaux. Bien qu'il existe un cadre pour les AUDSRéférence 18, il est rarement utilisé, car la plupart des produits ont été classés en tant qu'aliments médicauxRéférence 19 dans les années 1990. Aux États-Unis, la définition des aliments médicaux se limite aux produits qui répondent aux besoins nutritionnels spécifiques d'une maladie ou d'une affection particulière, utilisés sous surveillance médicale et conçus pour la prise en charge diététique spécifique de cette maladie ou de cette affection.
Il existe un cadre réglementaire distinct pour les préparations pour nourrissons aux États-Unis, dans lequel des exigences en matière de composition et d'étiquetage sont prescrites. Au début de l'année 2023, l'Administration des aliments et drogues des États-Unis a annoncé qu'une étude sera menée par la NASEM afin d'examiner les défis qui entravent une réglementation efficace des préparations pour nourrissons. Cette étude contribuera à l'élaboration d'une stratégie nationale à long terme visant à améliorer la surveillance et la protection des consommateurs.
3.0 Description du cadre modernisé proposé
3.1 Objectifs
La modernisation de la réglementation vise à établir un cadre global qui englobe les produits actuellement réglementés par les titres 24 et 25 du RAD. Pour remédier aux limites du cadre réglementaire actuel, Santé Canada propose une approche modernisée axée sur le risque et, mieux harmonisée avec les administrations internationales. La proposition découle d'une évaluation approfondie des titres 24 et 25 visant à recenser les dispositions désuètes et les obstacles à l'accès aux produits nutritifs essentiels.
3.2 Restructuration des titres 24 et 25 du Règlement sur les aliments et drogues
L'initiative de modernisation proposée restructurerait les titres 24 et 25 du RAD, qui distinguent actuellement les produits en fonction de l'âge des consommateurs visés. L'objectif de la restructuration est de redéfinir les catégories de produits et d'établir des exigences fondées sur le profil de risque du produit et la vulnérabilité de la sous-population visée. L'approche proposée, à savoir un titre pour les AFDS et un autre pour les produits qui ne sont pas des AFDS, simplifierait le cadre réglementaire et établirait des exigences plus claires en matière de composition et d'étiquetage pour tous les produits, en fonction du risque.
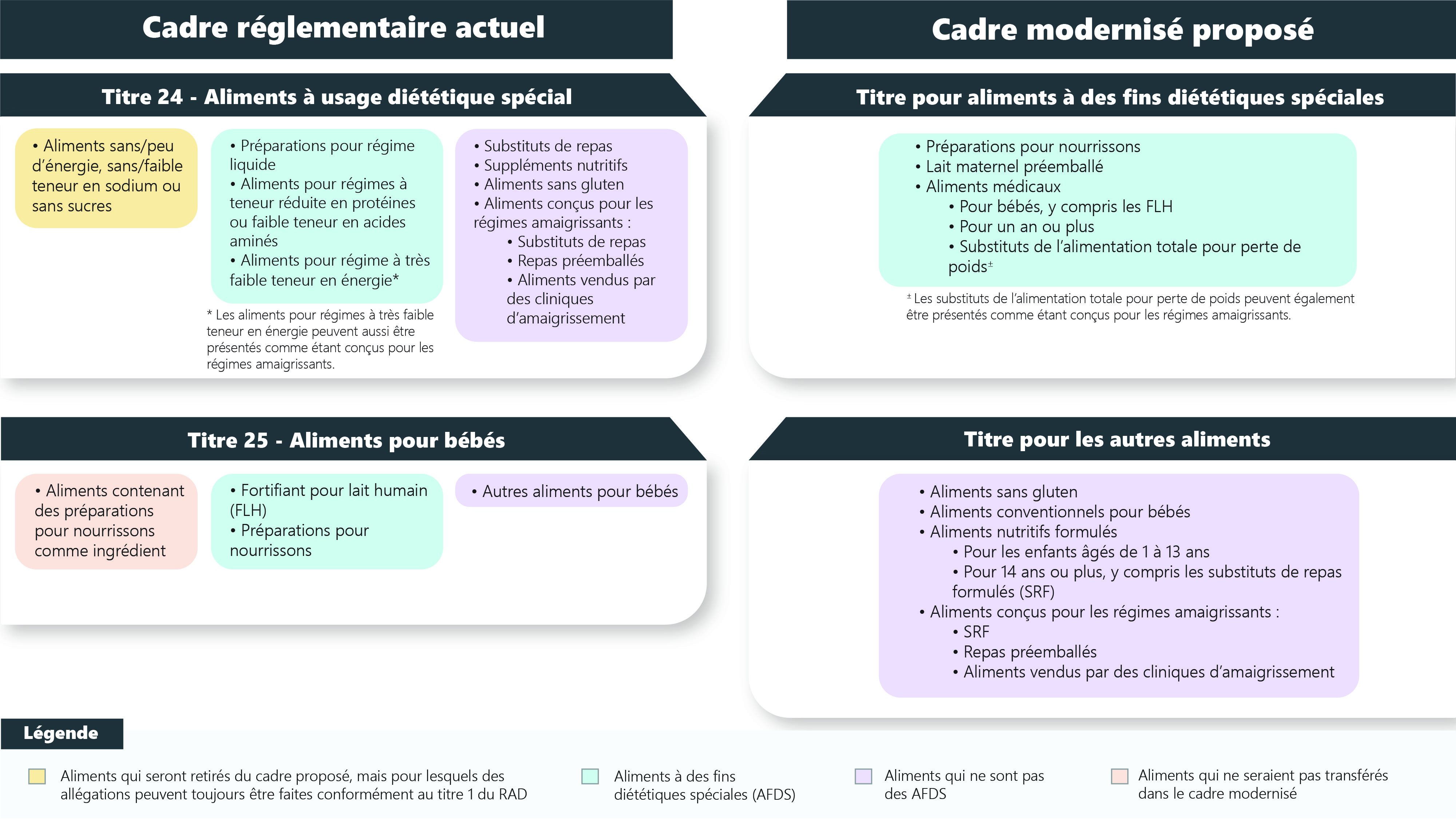
Figure 1 - Équivalent textuel
Cette figure représente le cadre réglementaire actuel des titres 24 et 25 du Règlement sur les aliments et drogues (RAD), ainsi que le cadre modernisé proposé.
Le cadre réglementaire actuel du titre 24 du RAD, aliments à usage diététique spécial (AUDS), comprend trois catégories d'aliments. La première catégorie comprend les aliments sans ou à faible teneur en énergie, sans ou à faible teneur en sodium, ou sans sucres. Ces aliments seraient retirés du cadre proposé, mais des allégations pourraient toujours être faites, conformément à la division 1 du RAD. La deuxième catégorie comprend les préparations pour régime liquide, les aliments destinés aux régimes à teneur réduite en protéines ou à faible teneur en acides aminés et les aliments destinés aux régimes à très faible teneur en énergie*. Ces aliments seraient pris en compte dans le cadre proposé pour les aliments à des fins diététiques spéciales (AFDS). La troisième catégorie comprend les substituts de repas, les suppléments nutritifs, les aliments sans gluten et les aliments destinés aux régimes amaigrissants, tels que les substituts de repas, les repas préemballés et les aliments vendus par les cliniques d'amaigrissement. Ces aliments seraient transférés dans un titre du RAD distinct de celui pour les AFDS.
Le cadre réglementaire actuel du titre 25 du RAD, aliments pour bébés, comprend trois catégories. La première catégorie comprend les aliments qui contiennent une préparation pour nourrissons comme ingrédient. Ces aliments ne seraient pas transférés dans le cadre modernisé. La deuxième catégorie comprend les fortifiants pour lait humain (FLH) et les préparations pour nourrissons. Ces aliments seraient pris en compte dans le cadre proposé pour les AFDS. La troisième catégorie comprend tous les autres aliments pour bébés. Ces aliments seraient transférés dans un titre du RAD distinct de celui pour les AFDS.
Le cadre modernisé proposé comprend un titre pour les AFDS et un titre pour les autres aliments. Les catégories d'aliments incluent dans le titre proposé pour les AFDS sont : les préparations pour nourrissons, le lait humain préemballé, les aliments médicaux pour bébé (y compris les FLH), les aliments médicaux pour un an ou plus, et les substituts de l'alimentation totale pour perte de poids±.
Les catégories d'aliments dans le titre proposé pour les autres aliments sont : les aliments sans gluten, les aliments conventionnels pour bébés, les aliments nutritifs formulés (pour les enfants de 1 à 13 ans et pour 14 ans ou plus, y compris les substituts de repas formulés), et les aliments conçus pour être utilisés dans les régimes amaigrissants (substituts de repas formulés, repas préemballés et aliments vendus par des cliniques d'amaigrissement).
* Les aliments destinés aux régimes à très faible teneur en énergie peuvent aussi être présentés comme étant conçus pour les régimes amaigrissants.
± Les substituts de l'alimentation totale pour perte de poids peuvent également être présentés comme étant conçus pour les régimes amaigrissants.
Afin de favoriser l'accès à des produits sûrs et d'offrir une nouvelle voie pour gérer les pénuries futures, la réglementation prévoirait un mécanisme d'importation exceptionnelle en cas de pénurie. Dans le cadre de ces dispositions, les entreprises seraient tenues de signaler les pénuries d'AFDS. Le terme désuet « AUDS » serait éliminé en raison de sa redondance et de son chevauchement avec le terme « AFDS ». En outre, l'expression « aliments médicaux » actuellement utilisée aux États-Unis serait adoptée pour désigner les produits destinés à la gestion diététique d'affections médicales et utilisés sous surveillance médicale.
Le titre proposé pour les AFDS engloberait des produits à plus haut risque destinés à des sous-populations vulnérables et exigerait une surveillance réglementaire renforcée. Cela comprend les préparations pour nourrissons, le LHPE et les aliments médicaux. Ce titre prescrirait des exigences en matière d'étiquetage qui se distinguent de celles des aliments préemballés destinés à la population générale. Dans la plupart des cas, une autorisation préalable à la mise en marché serait nécessaire pour les AFDS destinés aux bébés.
Les produits actuellement réglementés par les titres 24 et 25 qui ne relèvent pas de la catégorie des AFDS seraient présentés dans un titre distinct. Cela comprend les aliments conventionnels pour bébés, les aliments sans gluten, les aliments nutritifs formulés, les repas préemballés et les aliments vendus par une clinique d'amaigrissement. Ces produits sont destinés à une libre-sélection des consommateurs et ne sont pas destinés à être utilisés comme source unique ou primaire d'alimentation sous surveillance médicale. Les exigences réglementaires relatives à ces produits seraient mises à jour afin de les harmoniser aux recommandations actuelles en matière de nutriments et de répondre à la demande des consommateurs qui souhaitent que l'information nutritionnelle soit cohérente avec celles figurant sur d'autres aliments préemballés destinés à la population générale. La plupart des exigences en matière d'étiquetage nutritionnel propres à ces aliments seraient éliminées, et ces produits devraient porter un TVN et être soumis aux exigences applicables en matière de symbole nutritionnel sur le devant de l'emballage.
Même si l'approche visant la modernisation du cadre réglementaire des produits régis par les titres 24 et 25 est décrite dans les sections suivantes, certains détails, comme les exigences spécifiques relatives à la composition, seront mises à la disposition des intervenants afin qu'ils puissent donner leur rétroaction lors de la prépublication dans la Partie I de la Gazette du Canada.
Pour faciliter les modifications futures, le Ministère vise à incorporer par renvoi les exigences relatives à la composition de ces aliments, quand cela est jugé approprié. Cette approche contribuerait à la création d'un cadre réglementaire souple, dans lequel les exigences relatives à la composition peuvent être modifiées de façon administrative pour s'aligner sur les ANREF les plus récents et les avancées dans le domaine de la science de la nutrition, garantissant ainsi que le cadre reste réactif et conforme à l'évolution de la compréhension des besoins nutritionnels.
3.2.1 Catégories de produits exclues du cadre révisé
On propose de retirer certaines catégories d'aliments du cadre réglementaire. Premièrement, le cadre exclurait les aliments uniquement du fait qu'ils portent l'une des mentions ou allégations suivantes figurant dans la colonne 1 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive : « sans énergie », « peu d'énergie », « sans sodium ou sans sel », « faible teneur en sodium ou en sel » ou « sans sucres ». Même si ces aliments sont actuellement autorisés à être présentés comme des AUDSRéférence 20, le titre 24 n'établit pas d'exigences spécifiques à leur égard.
Deuxièmement, le cadre exclurait les aliments contenant des préparations pour nourrissons. Étant donné que ces aliments ne semblent pas être sur le marché et qu'on ne s'attend pas à ce qu'ils le soient, il n'est pas nécessaire de les conserver dans le cadre réglementaire modernisé.
3.2.2 Passage d'aliments à usage diététique spéciale à aliments à des fins diététiques spéciales
Les définitions d'AUDS et d'AFDS renvoient toutes deux à des aliments qui ont été spécialement transformés ou formulés pour répondre aux besoins particuliers d'une personne dont l'état physique ou physiologique découle d'une maladie ou d'un trouble (par exemple, les aliments médicaux comme les PRL, les produits métaboliques, etc.) Toutefois, les deux définitions comportent également des éléments uniques, tel que présenté à la figure 2. Les AUDS comprennent des aliments pour lesquels un effet particulier, notamment la perte de poids, doit être obtenu par leur consommation contrôlée (par exemple, les SR pour perte de poids), tandis que les AFDS comprennent les aliments destinés à être consommés comme source unique ou principale de nutrition d'une personne (par exemple, les préparations pour nourrissons).
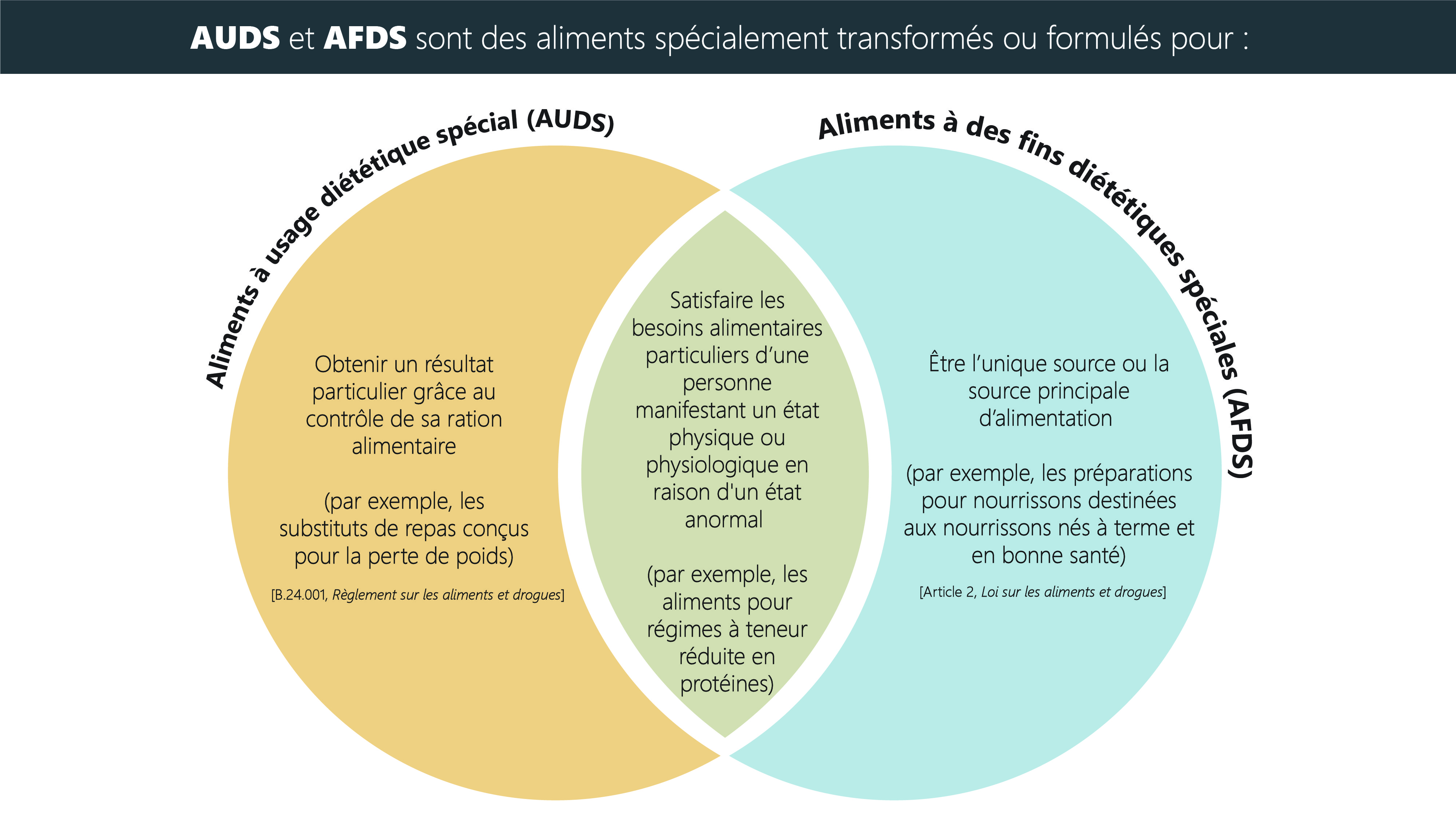
Figure 2 - Équivalent textuel
Voici un diagramme de Venn (deux cercles qui se chevauchent) qui indique les différences et les similitudes entre les définitions des aliments à usage diététique spécial (AUSD) dans l'article B.24.001 du Règlement sur les aliments et drogues et des aliments à des fins diététiques spéciales (AFDS) dans l'article 2 de la Loi sur les aliments et drogues. Comme indiqué dans la partie des cercles qui se chevauchent, la définition d'AUSD et la définition d'AFDS font toutes deux référence aux aliments qui répondent aux besoins d'une personne dont l'état physique ou physiologique est anormal (par exemple, les aliments pour les régimes à teneur réduite en protéines).
Les définitions d'AUDS et d'AFDS comportent toutes deux des éléments uniques. Les AUDS comprennent les aliments qui produisent un effet particulier par le biais d'une consommation contrôlée (par exemple, les substituts de repas pour perte de poids), tandis que les AFDS comprennent les aliments destinés à être consommés comme l'unique ou principale source d'alimentation (par exemple, les préparations pour nourrissons pour les nourrissons nés à terme et en bonne santé).
Le cadre modernisé propose de supprimer le terme AUDS et d'inclure un cadre pour réglementer les AFDS. Cette proposition cadrerait sur l'ajout, en 2019, du terme AFDS à la Loi sur les aliments et drogues et éliminerait toute confusion concernant ces termes qui se chevauchent. En passant d'AUDS à AFDS, la portée des produits relevant de ce cadre serait redéfinie; plus particulièrement, le cadre inclurait les produits destinés à être utilisés comme source unique ou principale de nutrition des personnes en bonne santé (par exemple, les préparations pour nourrissons).
3.2.3 Préciser les termes réglementaires actuels
Une clarification du terme « aliments pour bébés » est nécessaire puisque la nomenclature et la définition actuelles prêtent à confusion. On propose donc de réviser la définition réglementaire des aliments pour bébésRéférence 21 afin de régler les problèmes que pose la définition actuelle, dont la réglementation prévoit deux usages, en englobant tous les produits destinés aux bébés, y compris les préparations pour nourrissons et autres AFDS pour bébés, ainsi que les aliments conventionnels destinés aux bébés. La définition proposée suit. Il convient de noter qu'une nouvelle définition serait ajoutée à la réglementation pour les aliments conventionnels pour bébés, qui est proposée à la sous-section 5.1 Aliments conventionnels pour bébés.
a) Définition révisée
La définition révisée proposée pour les aliments pour bébés serait la suivante :
aliment pour bébés désigne tout aliment étiqueté ou annoncé comme pouvant être consommé par des bébés, y compris les aliments conventionnels pour bébés et les aliments à des fins diététiques spéciales
Il convient de noter que certaines exigences réglementaires relatives aux aliments pour bébés resteraient applicables à la fois aux aliments conventionnels et aux AFDS pour bébés. Cela comprend les dispositions relatives aux additifs alimentairesRéférence 22 qui sont actuellement incluses dans le titre 25 du RAD.
4.0 Un titre pour les aliments à des fins diététiques spéciales
L'initiative de modernisation proposée comprend la création d'un titre qui engloberait les produits actuellement réglementés par les titres 24 et 25 du RAD et qui répondent à la définition d'un AFDS. En outre, ce titre couvrirait les AFDS qui, actuellement, ne font pas l'objet de dispositions spécifiques dans le RAD.
Ce titre pour les AFDS inclurait les produits qui sont actuellement réglementés en tant qu'AUDS, comme les PRL, les ARTFTE ainsi que les aliments représentés pour les régimes restreints en protéines et à faible teneur en acides aminés (produits métaboliques liés aux protéines). Il engloberait aussi des produits qui ne sont pas couverts par le cadre actuel des AUDS, comme les aliments pour la dysphagie, les boissons enrichies pour la période préopératoire et la récupération postopératoire ainsi que les produits métaboliques pour les troubles non liés au métabolisme des protéines, comme la galactosémie et la dyslipidémie.
En ce qui concerne les aliments pour bébés, le titre pour les AFDS inclurait toutes les préparations pour nourrissons, c'est-à-dire celles destinées aux nourrissons en bonne santé et celles destinées aux nourrissons atteints de maladies ou de troubles ou ayant un état physique anormal (conditions médicales), ainsi que le LHPE et les aliments médicaux pour bébés. Les aliments médicaux pour bébés ne visent pas à remplacer les préparations pour nourrissons ou le lait humain et sont strictement destinés à une alimentation partielle. C'est le cas par exemple des FLH, dont les dispositions ont été ajoutées au RAD en 2021 et n'exigent pas de modifications importantes pour s'inscrire dans le cadre proposé. En outre, les produits à macronutriment unique qui peuvent être mélangés à d'autres produits avant d'être utilisés (par exemple, les modulaires de protéines, de glucides ou de lipides) et d'autres produits complémentaires (par exemple, les épaississants pour aliments) qui peuvent être ajoutés aux préparations pour nourrissons seraient inclus dans le titre pour les AFDS.
On propose les catégories suivantes d'AFDS pour ce titre, avec des détails sur chaque catégorie dans les sections suivantes :
- Préparation pour nourrissons
- Lait humain préemballé
- Aliments médicaux :
- Aliments médicaux pour bébés, y compris les FLH
- Aliments médicaux pour un an ou plus
- Substituts de l'alimentation totale pour perte de poids
4.1 Préparations pour nourrissons
Cette catégorie proposée inclurait les préparations pour nourrissons répondant aux exigences relatives à la composition standard (par exemple, les préparations pour nourrissons destinées aux nourrissons nés à terme et en bonne santé) ainsi que les préparations pour nourrissons qui dérogent des exigences relatives à la composition standard (par exemple, les préparations pour nourrissons destinées à être utilisées sous surveillance médicale telles que les préparations métaboliques pour nourrissons en cas de troubles métaboliques héréditaires).
4.1.1 Définition
On propose la définition suivante pour les préparations pour nourrissons :
préparation pour nourrissons désigne tout aliment étiqueté ou annoncé comme pouvant être utilisé comme un remplacement partiel ou total du lait humain et destiné à être consommé par des bébés
La définition proposée remplace le terme « succédané de lait humain » dans la définition existanteRéférence 23 par « préparation pour nourrissons » pour correspondre au nom usuel. En outre, la définition proposée ne renvoie plus aux aliments destinés à être utilisés comme ingrédients dans un succédané de lait humain.
L'eau ou une source de glucides sont les seules substances dont l'ajout aux préparations pour nourrissons est actuellement autorisé dans le mode d'emploi. Toutefois, comme il n'est plus recommandé d'ajouter une source de glucides aux préparations pour nourrissons, sauf sous surveillance médicale, on propose d'autoriser que la mention de l'eau dans le mode d'emploi.
4.1.2 Exigences relatives à la composition
Cette catégorie proposée de préparations pour nourrissons comprendrait les sous-catégories suivantes :
- Les préparations pour nourrissons qui répondent aux exigences relatives à la composition standard, comme les préparations pour nourrissons en bonne santé, les préparations pour nourrissons sans lactose et les préparations pour nourrissons entièrement ou partiellement hydrolysées.
- Les préparations pour nourrissons qui dérogent des exigences relatives à la composition standard pour répondre aux besoins des nourrissons ayant des problèmes de santé. Il peut s'agir de préparations pour nourrissons prématurés, de préparations métaboliques pour nourrissons en cas de troubles métaboliques héréditaires et de préparations pour nourrissons pour le rattrapage du retard de croissance.
Afin de s'assurer que les besoins nutritionnels des nourrissons souffrant d'affections particulières sont satisfaits, le cadre proposé permet que la composition des préparations pour nourrissons déroge des exigences relatives à la composition standard lorsque cela est justifié d'un point de vue médical. Au cours du processus d'autorisation préalable à la mise en marché, Santé Canada évaluera soigneusement la justification et les dérogations proposées par rapport aux exigences relatives à la composition afin de déterminer s'ils conviennent à la population cible.
Les exigences relatives à la composition des préparations pour nourrissons seront mises à jour afin d'intégrer les dernières données scientifiques et de s'harmoniser avec les administrations internationales. Afin de garantir la transparence et d'obtenir une rétroaction utile, la version préliminaire des exigences relatives à la composition des préparations pour nourrissons sera présentée lors d'un prochain processus de consultation.
a) Nouveaux ingrédients des préparations pour nourrissons (NIPN)
Pour relever les défis associés aux NIPN, un cadre réglementaire clair serait établi, dans lequel l'autorisation préalable à la mise en marché d'un NIPN serait requise avant de présenter une demande pour une préparation pour nourrissons contenant le NIPN. En séparant l'examen du NIPN du processus de présentation des demandes pour préparations pour nourrissons, le délai d'examen pour ces-dernières peut être amélioré puisque le NIPN aurait déjà reçu l'approbation de Santé Canada.
Les exigences relatives à l'autorisation préalable à la mise en marché pour les NIPN établiraient que le fabricant du NIPN serait responsable de la préparation et de la présentation des documentations nécessaires, plutôt que le fabricant de la préparation pour nourrissons. Si on estime que l'ingrédient en question est sûr pour une utilisation dans les préparations pour nourrissons, le fabricant peut alors présenter une demande d'autorisation pour un produit contenant l'ingrédient approuvé. Cette approche tient compte du fait que le fabricant de préparations pour nourrissons peut ne pas avoir accès aux renseignements exclusifs du fabricant du NIPN, ce qui garantit un processus d'examen plus efficient et plus efficace.
La définition suivante est proposée pour le NIPN :
nouvel ingrédient des préparations pour nourrissons (NIPN) désigne une substance :
- qui est destinée à être utilisée comme ingrédient alimentaire dans les préparations pour nourrissons;
- qui n'est pas ajoutée pour satisfaire aux exigences relatives à la composition des préparations pour nourrissons;
- qui n'est pas un additif alimentaire ou un nouvel aliment;
- dont l'innocuité dans les préparations pour nourrissons n'a pas été démontrée au Canada.
En outre, on propose de créer une liste d'ingrédients des préparations pour nourrissons qui ont été autorisés par Santé Canada, qui serait accessible au public sur le site Web du gouvernement du Canada. Cette liste constituerait également une ressource précieuse pour les demandeurs qui souhaitent ajouter un ingrédient à une préparation pour nourrissons, car ils pourraient facilement identifier quels ingrédients ont déjà été acceptés par Santé Canada à ajouter aux préparations pour nourrissons. En outre, le document d'orientation serait mis à jour pour combler les lacunes actuelles, notamment en établissant une distinction claire entre les NIPN et les nouveaux aliments pour nourrissons.
Ces modifications visent à améliorer la clarté et l'efficacité de l'ajout de NIPN aux préparations pour nourrissons destinées à la vente au Canada. En établissant un cadre réglementaire rigoureux, en présentant des orientations claires, en distinguant les évaluations des NIPN des présentations de demande d'autorisation pour les préparations pour nourrissons et en tenant une liste publique d'ingrédients des préparations pour nourrissons acceptés, Santé Canada pourrait faciliter l'introduction de NIPN sûrs de façon efficace tout en rationalisant le processus réglementaire pour les fabricants. Ces mesures contribueraient à garantir la transparence, à favoriser une prise de décision éclairée et à encourager l'innovation dans le développement des préparations pour nourrissons.
4.1.3 Exigences d'étiquetage
Les exigences d'étiquetage proposées pour les préparations pour nourrissons viseraient à garantir que des renseignements suffisants sont fournis aux responsables des soins pour permettre une utilisation et une préparation sûres de ces produits, tout en cadrant avec la Norme pour les préparations destinées aux nourrissons et les préparations données à des fins médicales spéciales aux nourrissonsRéférence 24 (norme Codex 72-1981) et avec le Code de l'OMS, le cas échéant, afin de réduire le fardeau des fabricants. Afin de rationaliser le processus d'examen et de minimiser les ambiguïtés, il est essentiel d'établir des exigences d'étiquetage complètes et transparentes pour ces produits. Cela permettra d'assurer un processus d'examen plus efficace en réduisant les échanges inutiles pour préciser les informations figurant sur l'étiquette.
a) Information nutritionnelle
Les exigences et interdictions actuelles en matière d'étiquetage nutritionnel pour les préparations pour nourrissons continueraient à s'appliquer, y compris l'interdiction d'utiliser un TVN et un symbole nutritionnel sur l'étiquette. Toutefois, des modifications mineures sont proposées en ce qui concerne les exigences désuètes. Il s'agirait notamment de supprimer l'obligation de déclarer la teneur en cendres du produitRéférence 25, ce qui peut être source de confusion pour les responsables des soins, car les cendres ne sont pas considérées comme un nutriment et leur déclaration n'est pas obligatoire dans plusieurs autres administrations.
En outre, pour plus de clarté et pour faciliter les activités de conformité et d'application, on propose d'harmoniser les unités de mesure des vitamines et des minéraux nutritifs dans l'information nutritionnelle figurant sur l'étiquette aux unités précisées dans les exigences relatives à la composition.
b) Mentions obligatoires sur l'étiquette
- Exigences relatives à l'espace principal
Les mentions obligatoires figurant sur l'espace principal aident les responsables des soins à prendre des décisions éclairées sur la préparation pour nourrissons la plus appropriée à sélectionner, par exemple en faisant la différence entre les préparations destinées aux nourrissons de 0 à 6 mois (souvent appelées préparations de départ) et celles destinées aux nourrissons de 6 à 12 mois (souvent appelées préparations de transition), les préparations standard ou spécialisées, les préparations liquides concentrées ou prêtes à l'emploi, et bien d'autres choses encore. Ainsi, l'information suivante devrait figurer sur l'espace principal d'une préparation pour nourrissons :
- Tranche d'âge de l'utilisateur prévu (par exemple, de 0 à 12 mois, 6 mois et plus)
- Pour les produits qui dérogent des exigences relatives à la composition standard : indication de la manière dont la composition déroge des exigences standard et de l'usage auquel le produit est destiné (par exemple, sans phénylalanine pour la gestion diététique de la phénylcétonurie chez les nourrissons)
- Mention ou symbole concernant l'ajout d'eau :
- Pour les préparations liquides concentrées pour nourrissons : « Ajouter de l'eau », ainsi qu'un symbole montrant l'ajout d'eau
- Pour les préparations pour nourrissons prêtes à l'emploi : « Ne pas ajouter d'eau »
- Indication du format du produit (par exemple, poudre, liquide concentré, liquide prêt à l'emploi, etc.)
- Indication de la source de protéines (par exemple, préparation pour nourrissons à base de lait de vache, préparation pour nourrissons à base de lait de chèvre, préparation pour nourrissons à base de soja, etc.)
L'obligation d'indiquer sur l'étiquette la source de protéines, la tranche d'âge de l'utilisateur prévu et une indication de la manière dont la composition déroge des exigences relatives à la composition standard est conforme aux recommandations de la norme Codex 72-1981, qui stipule que la source de protéines dans le produit doit être clairement indiquée sur l'étiquette et que le produit doit être étiqueté de manière à éviter tout risque de confusion entre les préparations pour nourrissons, les préparations de transition et les préparations pour fins médicales spéciales.
- Mode d'emploi, y compris la préparation, la conservation et la disposition
Des mentions obligatoires concernant la préparation, la conservation et la disposition du produit devraient également figurer sur l'étiquette du produit. Le fait de prescrire ces mentions dans la réglementation permettrait d'assurer une uniformité pour les responsables des soins. Plus précisément, on propose que l'étiquette comporte le mode d'emploi suivant ou des mentions semblables (en lettres et en images) :
- Nettoyer les surfaces de travail, le dessus du récipient de la préparation pour nourrissons et les mains avec du savon et de l'eau chaude avant de faire la préparation.
- Faire bouillir les biberons, les tétines, les ustensiles et le matériel de préparation dans de l'eau salubre pour les stériliser avant de les utiliser. Chaque bouteille doit être préparée individuellement.
- Pour préparer les préparations concentrées en poudre et en liquide :
- Pour les nourrissons en bonne santé et nés à terme : Faire bouillir de l'eau salubre pendant deux minutes. Refroidir à une température entre celle du corps et celle de la pièce (37 à 25 degrés Celsius).
- Pour les prématurés et les nourrissons ayant un poids insuffisant à la naissance âgés de moins de deux mois et les nourrissons dont le système immunitaire est affaibli : Faire bouillir de l'eau salubre pendant deux minutes. Laisser refroidir à 70 degrés Celsius (30 minutes).
- Il faut bien agiter la préparation juste avant la tétée et la servir à la température du corps (37 degrés Celsius).
- Si un biberon de préparation doit être conservé avant d'être utilisé, il doit être réfrigéré et utilisé dans les 24 heures suivant la préparation.
- Jeter la préparation qui n'a pas été consommée dans les deux heures suivant le début de la tétée.
- Ne pas conserver les récipients de préparation pour nourrissons à des températures excessives. Les récipients de lait en poudre ouverts doivent être utilisés dans un délai d'un mois. Les récipients de préparations concentrées liquides et les contenants de préparations prêtes à l'emploi ouverts doivent être utilisés dans les 24 heures.
Remarque : Le point 3b de cette liste ne s'applique pas aux préparations pour nourrissons dont l'étiquette comporte une contre-indication relative à l'utilisation de ces préparations chez les prématurés et les nourrissons ayant un poids insuffisant à la naissance âgés de moins de deux mois, ainsi que chez les nourrissons dont le système immunitaire est affaibli.
On propose que la mention suivante figure sur l'étiquette immédiatement avant le mode d'emploi :
- Pour toutes les préparations pour nourrissons : « La santé de votre bébé dépend du soin avec lequel vous suivez le mode d'emploi de préparation »
On propose aussi que les mentions suivantes figurent sur l'étiquette à proximité immédiate du mode d'emploi :
- Pour les préparations pour nourrissons concentrées en poudre ou en liquide : « Ne pas modifier les proportions de poudre ou de concentré, ni ajouter d'autres aliments, sauf sur avis médical »
- Pour les préparations pour nourrissons prêtes à l'emploi : « Ne pas diluer ou ajouter d'autres aliments, sauf sur avis médical »
Ces mentions obligatoires permettent de rappeler au responsable des soins que les préparations pour nourrissons doivent être préparées conformément au mode d'emploi figurant sur l'étiquette.
Cette proposition cadre avec les recommandations du Code de l'OMS et de la norme Codex 72-1981, qui stipulent que l'étiquette doit comporter des instructions adéquates pour la préparation et l'utilisation appropriées du produit, y compris sa conservation et sa disposition, ainsi qu'un avertissement sur les risques pour la santé d'une préparation inappropriée.
- Numéros de lots
On propose d'exiger que le numéro de lot figure sur l'étiquette de toutes les préparations pour nourrissons. Ces renseignements sont importants en cas de rappel de produits, afin que les produits concernés puissent être facilement identifiés par les détaillants et les responsables des soins, et retirés du marché.
- Protéger et promouvoir l'allaitement
On propose que l'étiquette des préparations pour nourrissons répondant aux exigences relatives à la composition standard soit tenue de porter une mention relative à l'avantage de l'allaitement maternel sous le titre « Avis important ». Cette mention ne serait pas requise pour les préparations pour nourrissons qui dérogent des exigences relatives à la composition standard, car ces produits sont destinés à des nourrissons dont les besoins en nutriments sont distincts et peuvent avoir une incidence sur leur capacité à consommer du lait humain en toute sécurité. Cette mention obligatoire est conforme au Code de l'OMS et à la norme Codex 72-1981.
L'interdiction de certaines images et de certains textes sur l'étiquette aiderait le Canada à se conformer au Code de l'OMS et à la norme Codex 72-1981. Ceux-ci recommandent d'interdire l'utilisation d'images ou de textes susceptibles d'idéaliser l'utilisation des préparations pour nourrissons (par exemple, des images de nourrissons ou de parents tenant des nourrissons dans leurs bras), car ils peuvent compromettre le message selon lequel l'allaitement maternel est la meilleure solution pour les bébés. Ils recommandent également d'interdire les mentions désignant un ingrédient des préparations pour nourrissons comme un composant clé du lait maternel, qui sont considérées comme trompeuses étant donné que le lait maternel contient de nombreux composants tout aussi importants les uns que les autres. On propose d'interdire les éléments suivants sur l'étiquette de toutes les préparations pour nourrissons :
- Des images de nourrissons, ou d'autres images ou textes, qui peuvent idéaliser l'utilisation des préparations pour nourrissons
- Les termes « humanisé », « maternisé », « oligosaccharide de lait humain », « oligosaccharide identique au lait humain » ou des termes, mots ou abréviations semblables
- Mentions comparant les préparations pour nourrissons ou leurs ingrédients au lait humain, y compris la comparaison du niveau d'un nutriment dans les préparations pour nourrissons à celui du même nutriment dans le lait humain
- Mises en garde
On propose que les mises en garde actuellement recommandées dans les lignes directrices de Santé Canada et celles recommandées au cours de l'examen préalable à la mise en marché soient ajoutées au RAD afin de garantir une formulation uniforme pour toutes les préparations pour nourrissons en ce qui concerne leur utilisation en toute sécurité. On propose que les mises en garde soient regroupées sur l'étiquette du produit sous le titre « Mises en garde ».
Les brûlures liées au chauffage des préparations pour nourrissons peuvent entraîner des visites aux urgences et mettre la vie en dangerRéférence 26. On propose donc d'inclure les éléments suivants sur l'étiquette :
- Une mention sur les risques associés au chauffage et réchauffage des préparations pour nourrissons au four à micro-ondes, comme « Ne jamais chauffer de préparations pour nourrissons au four à micro-ondes. Cela peut entraîner de graves brûlures »
- Une mention précisant qu'il faut vérifier la température de la préparation pour nourrissons avant de la donner pour éviter de brûler la bouche du bébé, comme « Déposer une goutte de préparation sur l'intérieur de votre poignet. Si vous ne sentez aucune différence de température, c'est que la température de la préparation convient »
On propose que les préparations pour nourrissons qui répondent aux exigences relatives à la composition standard soient tenues d'inclure une mention indiquant que la préparation pour nourrissons doit être utilisée uniquement sur l'avis d'un professionnel de la santé. Des mentions semblables figurent déjà sur les préparations pour nourrissons commercialisées au Canada, ce qui est conforme aux recommandations de la norme Codex 72-1981 et du Code de l'OMS.
On propose que les préparations pour nourrissons qui dérogent des exigences relatives à la composition standard soient tenues d'inclure une mention sur l'étiquette indiquant que la préparation pour nourrissons ne doit être utilisée que sous surveillance médicale. Ces préparations pour nourrissons sont formulées pour répondre aux besoins des nourrissons souffrant de problèmes médicaux. Ainsi, ils présentent peut-être des dangers pour les nourrissons nés à terme et en bonne santé.
On propose d'exiger que l'étiquette de toutes les préparations pour nourrissons sans lactose à base de lait comporte une contre-indication relative à l'utilisation de ces préparations chez les nourrissons atteints de galactosémie. Les préparations pour nourrissons à base de lait sans lactose contiennent encore une petite quantité de lactose résiduel. C'est pourquoi ces préparations sont contre-indiquées pour les nourrissons atteints de galactosémie.
On propose que l'étiquette de toutes les préparations en poudre pour nourrissons contenant des ingrédients sensibles à la chaleur (par exemple, des probiotiques) comporte une contre-indication relative à l'utilisation de ces préparations chez les prématurés et les nourrissons ayant un poids insuffisant à la naissance âgés de moins de deux mois, ainsi que chez les nourrissons dont le système immunitaire est affaibli. Pour ces nourrissons, l'utilisation d'eau préalablement bouillie et refroidie à 70 degrés Celsius est nécessaire pour préparer la préparation afin de tuer les bactéries qui pourraient être nocives pour les nourrissons immunodéprimés. Toutefois, les préparations pour nourrissons contenant des ingrédients thermosensibles sont souvent accompagnées d'un mode d'emploi indiquant que le produit doit être préparé avec de l'eau préalablement bouillie et refroidie à des températures plus basses.
- Interdiction concernant la stratégie de marque croisée
Une étude menée par Richter et coll. a montré que les parents mentionnaient fréquemment les ressemblances entre l'étiquetage des préparations pour nourrissons et celui du lait pour jeunes enfants (actuellement réglementé en tant que suppléments nutritifs pour enfants)Référence 27. Cela peut s'expliquer par la stratégie de marque croisée (par exemple, lorsque les étiquettes des suppléments nutritifs pour enfants présentent un schéma de couleurs ou un dessin semblable à celui des étiquettes des préparations pour nourrissons). Cette stratégie de commercialisation pose un défi aux responsables des soins qui ont de la difficulté à distinguer les préparations pour nourrissons des suppléments nutritifs pour enfants, ce qui peut faire en sorte que les nourrissons sont nourris avec des suppléments nutritifs pour enfants, ce qui pourrait présenter un risque pour la santé.
On propose de réglementer les suppléments nutritifs pour enfants en tant qu'aliments nutritifs formulés (ANF) pour enfants (voir la sous-section 5.3.1 Aliments nutritifs formulés pour enfants). On propose donc d'interdire la stratégie de marque croisée des préparations pour nourrissons et des ANF pour enfants.
- Exemption en matière d'étiquetage
Les préparations pour nourrissons qui dérogent des exigences relatives à la composition standard sont spécialement formulées pour répondre aux besoins précis des nourrissons ayant des problèmes de santé. Compte tenu de la nature et de l'objectif uniques de ces différences de composition, certaines des exigences en matière d'étiquetage peuvent ne pas être applicables ou nécessaires. On propose donc d'ajouter au règlement une disposition concernant les préparations pour nourrissons qui dérogent des exigences relatives à la composition standard afin qu'elles puissent déroger à certaines exigences d'étiquetage propres aux préparations pour nourrissons, lorsqu'il existe une raison valable.
- Modification du texte ou des images de l'étiquette
On propose que les modifications apportées au texte ou aux images figurant sur les étiquettes des préparations pour nourrissons fassent l'objet d'une notification préalable à Santé Canada, au moins 60 jours avant leur mise en œuvre. Cette mesure proactive garantirait que Santé Canada dispose de la version la plus récente des étiquettes de produits disponibles sur le marché. En outre, ce délai permet à Santé Canada de relever tout problème potentiel lié aux allégations et aux indications d'emploi.
4.1.4 Exigences réglementaires supplémentaires pour les préparations pour nourrissons
a) Allégations
On propose de maintenir pour toutes les préparations pour nourrissons les interdictions existantes à l'égard des allégations concernant la réduction du risque de maladie et les allégations thérapeutiquesRéférence 28, ainsi que les restrictions à l'égard des allégations concernant la valeur nutritiveRéférence 29 pour les aliments destinés exclusivement aux enfants de moins de 4 ans.
On propose aussi que les allégations santéRéférence 30 et/ou les indications d'emploi formulées pour toutes les préparations pour nourrissons soient étayées par des données probantes provenant d'études cliniques. Toutefois, certaines indications d'emploi déjà fermement établies dans la littérature scientifique et largement acceptées dans la pratique médicale ne nécessiteraient pas de justification supplémentaire. Par exemple, une préparation pour nourrissons spécifiquement formulée sans phénylalanine et destinée aux enfants ayant reçu un diagnostic de phénylcétonurie relèverait de cette catégorie. Cette mesure vise à garantir que les étiquettes et les publicités relatives aux préparations pour nourrissons ne contiennent pas d'allégations ou d'indications d'emploi trompeuses ou non fondées. En outre, on propose que le règlement prévoie des restrictions concernant la taille de police pour toute allégation figurant sur l'étiquette, afin de garantir qu'elle n'éclipse pas la mention relative à l'avantage de l'allaitement maternel ou les mises en garde obligatoires.
b) Autorisation préalable à la mise en marché
On propose d'exiger une autorisation préalable à la mise en marché avant la vente d'une nouvelle préparation pour nourrissons ou d'une préparation pour nourrissons ayant fait l'objet d'un changement majeur. Cette mesure remplacerait le processus actuel de notification préalable à la mise sur le marché et exigerait une autorisation écrite de Santé Canada avant la distribution d'un produit sur le marché canadien. Cette approche cadrerait avec l'approche actuelle pour le FLH qui a été intégrée au règlement en 2021.
Les renseignements requis pour la demande d'autorisation de mise en marché ne changeraient pas beaucoup par rapport à ce qu'exige actuellement le RAD pour la notification de mise sur le marché. Par exemple, on propose d'exiger la présentation de l'étiquette complète (comprenant le texte et les images) plutôt que le texte uniquement. Cela garantirait que toutes les images devant figurer sur l'étiquette seraient examinées par Santé Canada.
c) Restrictions en matière de publicité
Les publicités qui idéalisent l'utilisation des préparations pour nourrissons pourraient faire croire que l'alimentation au moyen de préparations pour nourrissons est supérieure à l'allaitement et compromettre le message selon lequel l'allaitement est préférable pour les bébés. Présenter un ingrédient des préparations pour nourrissons comme un composant clé du lait humain est trompeur, car de nombreux composants du lait humain sont tout aussi importants.
Interdire certains messages publicitaires aiderait le Canada à respecter le Code de l'OMS et ne découragerait pas l'allaitement maternel. On propose d'interdire les éléments suivants dans la publicité de toutes les préparations pour nourrissons :
- Les messages (mentions, images ou vidéos) qui laissent ou font croire que l'alimentation au moyen de préparations pour nourrissons est équivalente ou supérieure à l'allaitement, y compris les comparaisons entre les ingrédients des préparations pour nourrissons et les composants du lait maternel
- Toute image, texte ou vidéo susceptible d'idéaliser l'utilisation des préparations pour nourrissons
- Les messages qui mettent l'accent sur les problèmes d'allaitement ou sur le fait qu'il est plus facile d'utiliser des préparations pour nourrissons que d'allaiter
- Des termes comme « humanisé », « maternisé », « oligosaccharide de lait humain », « oligosaccharide identique au lait humain » ou des termes, mots ou abréviations semblables.
- Toute allégation santé ou indication d'emploi qui n'a pas été étayée par des données probantes provenant d'études cliniques acceptables dans le cadre de la demande d'autorisation de mise en marché des préparations pour nourrissons
En outre, les messages (mentions ou vidéos) contenus dans les publicités des préparations pour nourrissons devraient indiquer clairement l'avantage de l'allaitement maternel.
Ces restrictions en matière de publicité protégeraient les responsables des soins contre les publicités susceptibles d'avoir une incidence négative sur une décision éclairée concernant l'allaitement. Cette approche cadre avec les administrations internationales comme l'UE et l'Australie et la Nouvelle-Zélande, qui restreignent la publicité pour les préparations pour nourrissons conformément au Code de l'OMS. Alors que les restrictions en matière de publicité dans l'UE se font par l'entremise d'un règlementRéférence 31, l'Australie et la Nouvelle-Zélande ont conclu un accord volontaire avec l'industrieRéférence 32.
d) Restrictions de vente
Aucune restriction de vente n'est proposée pour les préparations pour nourrissons.
4.2 Lait humain préemballé
Le LHPE désigne le lait humain qui a été recueilli auprès d'individus, transformé et emballé en vue d'une consommation sûre par les bébés. Il est utilisé en milieu hospitalier pour nourrir les bébés qui ne réussissent pas à obtenir suffisamment de lait maternel et, en raison de son offre limitée, il est généralement réservé en priorité aux bébés malades ou prématurés dans les unités de soins intensifs néonatals. Même si le LHPE ne doit pas être la seule source d'alimentation en raison des pertes de nutriments qui se produisent au cours de la transformation, leur utilisation a démontré des avantages pour la santé de ces nourrissons (par exemple, moins de risque de développer une entérocolite nécrosante néonatale et de contracter des infections)Référence 33Référence 34.
Le LHPE serait une nouvelle catégorie d'AFDS qui n'est pas actuellement couverte par le titre 25. Alors que le LHPE est actuellement disponible au Canada qu'auprès d'un petit nombre de banques de lait humain, la nouvelle catégorie inclurait le LHPE provenant des banques de lait humain existantes et nouvelles, ainsi que des entreprises commerciales de transformation du lait humain qui pourraient à l'avenir vouloir vendre leur LHPE aux hôpitaux ou au détail au Canada. Le lait humain vendu directement d'un particulier à un autre serait interdit, car il n'est pas possible de mettre en œuvre les mesures de protection appropriées pour empêcher la vente de lait contaminé, qui pourrait nuire gravement à un bébé.
Enfin, les composants préemballés du lait humain (par exemple, la crème de lait humain) n'entreraient pas dans la catégorie du LHPE, mais seraient réglementés dans la catégorie des aliments médicaux pour bébés (voir la sous-section 4.3.1 Aliments médicaux pour bébés). En mettant en œuvre un règlement clair et complet pour le LHPE, Santé Canada peut mieux protéger le bien-être des bébés qui dépendent de ces produits spécialisés, tout en apportant des précisions et des conseils aux intervenants impliqués dans leur production, leur distribution et leur utilisation.
4.2.1 Définition
La définition suivante est proposée pour le LHPE :
lait humain préemballé désigne le lait humain tiré qui est traité et préemballé pour être consommé par un bébé qui n'est pas l'enfant de la personne qui fournit le lait exprimé
On propose que le LHPE soit soumis à un processus de traitement qui élimine les bactéries et les virus nocifs afin de garantir que le lait puisse être consommé sans danger par les bébés. Ce langage permet également la transformation du lait humain en formats ayant une durée de conservation plus longue (par exemple, en poudre et congelé).
4.2.2 Exigences relatives à la composition
La composition nutritionnelle du lait humain varie considérablement d'une personne à l'autre en raison de plusieurs facteurs, notamment le stade de lactation et la consommation d'aliments et de supplémentsRéférence 35. Le LHPE est produit par la mise en commun du lait humain provenant de nombreux individus; sa composition en nutriments peut donc varier. En outre, plusieurs étapes du processus de transformation du LHPE peuvent avoir une incidence sur la composition des nutriments (pasteurisation, congélation, décongélation et conservation, par exemple)Référence 34. Compte tenu de la variation naturelle de la composition du lait humain et de la difficulté de satisfaire à un ensemble d'exigences en matière de composition standard, on propose de ne pas établir d'exigences en matière de composition pour le LHPE.
Même si le LHPE peut être complété par un FLH à l'hôpital conformément à la pratique médicale et en fonction des circonstances individuelles, on propose que le LHPE ne contienne que du lait humain; aucun autre ingrédient (par exemple, vitamines et nutriments minéraux, additifs alimentaires) ne pourrait y être ajouté.
4.2.3 Exigences d'étiquetage
a) Information nutritionnelle
En tant qu'AFDS et compte tenu de la difficulté de générer des valeurs nutritionnelles précises lorsque la composition nutritionnelle du lait humain peut varier de manière significative, on propose d'interdire au LHPE de porter un TVN. Pour cette même raison, aucune autre forme d'information nutritionnelle n'est requise pour le LHPE. Toutefois, les producteurs peuvent volontairement déclarer les quantités d'énergie, de protéines, de lipides, de glucides, de vitamines et de minéraux nutritifs sur l'étiquette du produit s'ils sont en mesure de produire des données précises sur les nutriments propres au produit.
Le LHPE serait interdit de porter un symbole nutritionnel afin de cadrer avec l'interdiction existante concernant les aliments destinés aux bébés au paragraphe B.01.350(15).
b) Mentions obligatoires sur l'étiquette
Certaines mentions sont essentielles pour fournir aux professionnels de la santé et aux responsables des soins des renseignements sur l'utilisation sûre du LHPE. Les éléments suivants doivent figurer à n'importe quel endroit sur l'étiquette :
- Mode d'emploi, y compris la préparation, la conservation et la disposition
- Date d'expiration
- Numéro de lot
Des mentions obligatoires concernant la préparation, la conservation et la disposition du produit devraient figurer sur l'étiquette du produit. Elles sont décrites ci-dessous. Le fait de prescrire ces mentions dans le règlement permettrait d'assurer une uniformité pour le responsable des soins. Une date d'expiration est requise pour indiquer la date jusqu'à laquelle le produit conserve sa stabilité microbiologique. En outre, l'obligation d'indiquer le numéro de lot (ou l'identifiant du lot) sur l'étiquette est importante en cas de rappel.
- Mises en garde
Pour aider les responsables des soins à prendre des décisions éclairées concernant l'alimentation de leur bébé et pour garantir une utilisation sûre du LHPE, on propose que les mises en garde suivantes apparaissent sur l'espace principal du LHPE :
- « Ne constitue pas une source d'alimentation complète »
- « Ne remplace pas le lait maternel ou les préparations pour nourrissons »
- « Ne convient pas aux bébés de moins de 6 mois »
En raison des messages de santé publique insistants concernant le fait que le lait maternel est le meilleur aliment pour les bébés, les responsables des soins peuvent penser que le LHPE est équivalent ou supérieur au lait maternel ou aux préparations pour nourrissons. Tandis que le lait maternel et les préparations pour nourrissons sont des sources complètes de nutrition, le LHPE ne l'est pas. Les responsables des soins pourraient par erreur remplacer totalement le lait maternel ou les préparations pour nourrissons par le LHPE s'ils n'ont pas accès aux renseignements importants véhiculés par les mises en garde « Ne constitue pas une source d'alimentation complète » et « Ne remplace pas le lait maternel ou les préparations pour nourrissons ».
La mise en garde « Ne convient pas aux bébés de moins de 6 mois » vise à refléter la recommandation de Santé Canada concernant l'alimentation exclusive des nourrissons avec du lait maternel, ou des préparations pour nourrissons comme solution appropriée, de la naissance à 6 mois.
Ces mentions ne seraient pas nécessaires pour le LHPE utilisé uniquement dans les hôpitaux, car, dans ce contexte, le LHPE est prescrit par les professionnels de la santé en fonction des besoins nutritionnels du bébé et complété par du FLH si nécessaire. Ces produits peuvent être utilisés sous la surveillance d'un professionnel de la santé d'une manière qui ne correspond pas aux mises en garde proposées, selon un jugement clinique (par exemple, LHPE utilisé pour les bébés de moins de 6 mois).
On propose que les mises en garde suivantes soient regroupées n'importe où sur l'étiquette du LHPE sous le titre « Mises en garde » :
- Une mention sur les risques associés au chauffage et réchauffage du LHPE au four à micro-ondes, comme « Ne jamais chauffer ce produit au four à micro-ondes. Vous pourriez vous brûler gravement »
- Une mention précisant qu'il faut vérifier la température du lait humain préemballé avant de le donner pour éviter de brûler la bouche du bébé, comme « Déposer une goutte de produit sur l'intérieur de votre poignet. Si vous ne sentez aucune différence de température, c'est que la température du produit convient »
- Une mention indiquant que le produit ne doit être utilisé que sur l'avis d'un professionnel de la santé
Les deux premières mises en garde visent à prévenir les brûlures causées par la consommation de lait humain surchaufféRéférence 36.
Les avantages d'utiliser du LHPE en tant que substitut du lait maternel dépendent des circonstances individuelles. Comme l'indique la troisième mise en garde, un professionnel de la santé doit être consulté pour déterminer si l'utilisation de LHPE est appropriée pour un bébé donné.
- Interdiction concernant les mentions et les images idéalisant le lait humain préemballé
Les images ou les textes qui idéalisent l'utilisation du LHPE pourraient compromettre le message selon lequel l'allaitement maternel est préférable pour les bébés et donner l'impression que le LHPE est équivalent ou supérieur au lait maternel. On propose donc d'interdire sur l'étiquette les images de nourrissons et toute autre image ou texte susceptible d'idéaliser l'utilisation du LHPE.
4.2.4 Exigences réglementaires supplémentaires pour le lait humain préemballé
a) Allégations
On propose d'appliquer au LHPE les interdictions existantes à l'égard des allégations concernant la réduction du risque de maladie et les allégations thérapeutiques, ainsi que les restrictions à l'égard des allégations concernant la valeur nutritive pour les aliments destinés exclusivement aux enfants de moins de 4 ans. On propose aussi que les allégations santé ou les indications d'emploi formulées pour le LHPE soient étayées par des données probantes provenant d'études cliniques acceptables.
En outre, on propose que le règlement prévoie des restrictions en matière de taille de police pour toute allégation figurant sur l'étiquette, afin de garantir qu'elle n'éclipse pas les mises en garde obligatoires figurant dans l'espace principal.
b) Autorisation préalable à la mise en marché
La plupart du LHPE au Canada provient actuellement de quatre banques de lait canadiennes existantes qui ont mis en place des stratégies d'atténuation des risques et des procédures de contrôle de la qualité bien établies (par exemple, des procédures de sélection des fournisseurs de lait, de formation pour les fournisseurs de lait, de transformation du lait, de sécurité [microbienne et chimique]). Le LHPE provenant de ces banques de lait est réglementé en tant qu'aliments conventionnels et n'est pas soumis à une autorisation préalable à la mise en marché.
Reconnaissant que la transformation commerciale du lait humain est un marché émergent, on propose une autorisation préalable à la mise en marché pour le nouveau LHPE et le LHPE ayant subi des changements majeurs dans les établissements de transformation commerciale du lait humain. Une autorisation préalable à la mise en marché serait également requise pour les produits provenant de nouvelles banques de lait, tout en notant que le LHPE distribué par les quatre banques de lait canadiennes existantes serait exempté de ces exigences d'autorisation préalable à la mise en marché en raison de leur historique d'approvisionnement sûr.
L'autorisation préalable à la mise en marché exigerait une soumission à Santé Canada renfermant les renseignements suivants : procédures de sélection des fournisseurs de lait, formation des fournisseurs de lait, transformation du lait, sécurité (microbienne et chimique) et contrôles de qualité pour déterminer la teneur en énergie et en nutriments (le cas échéant). Cela permettrait à Santé Canada de déterminer si des stratégies d'atténuation des risques et des procédures de contrôle de la qualité suffisantes sont en place pour garantir la production de produits sûrs avant leur distribution au Canada.
c) Restrictions en matière de publicité
On propose d'interdire les éléments suivants dans la publicité de tout LHPE :
- Les messages (mentions, images ou vidéos) qui laissent ou font croire que le LHPE est une source unique d'alimentation ou un substitut au lait maternel ou aux préparations pour nourrissons
- Représentation de bébés de moins de 6 mois (exception : ne s'applique pas au LHPE utilisé uniquement dans les hôpitaux)
- Toute image, texte ou vidéo susceptible d'idéaliser l'utilisation du LHPE
- Toute allégation santé ou indication d'emploi qui n'a pas été étayée par des données probantes provenant d'études cliniques acceptables dans le cadre de la demande d'autorisation de mise en marché du LHPE
d) Restrictions de vente
Aucune restriction de vente n'est proposée pour le LHPE.
4.3 Aliments médicaux
Les aliments médicaux englobent une gamme variée de produits spécialement transformés ou formulés pour répondre aux besoins nutritionnels spécifiques des personnes ayant des problèmes de santé. Afin de renforcer l'harmonisation aux normes et aux règlements internationaux et d'améliorer l'accès aux produits disponibles dans d'autres pays, on propose d'adopter le terme « aliments médicaux » et de mettre en œuvre des exigences réglementaires pour ces aliments.
Le terme « aliments médicaux » renvoie aux produits destinés à la gestion diététique d'affections médicales et utilisés sous surveillance médicale.
Trois catégories sont proposées : les aliments médicaux pour bébés, les aliments médicaux pour un an ou plus, et les aliments médicaux représentés sous forme de substituts de l'alimentation totale (SAT) pour perte de poids. Cette catégorisation permettrait une approche plus ciblée des besoins nutritionnels spécifiques des différents groupes d'âge et des différentes utilisations prévues des produits. En outre, elle permet une plus grande surveillance réglementaire des aliments médicaux destinés aux bébés, qui constituent un groupe plus vulnérable.
4.3.1 Aliments médicaux pour bébés
Cette catégorie proposée vise à englober les AFDS pour bébés qui ne répondent pas à la définition d'une préparation pour nourrissons, c'est-à-dire que l'aliment n'est pas destiné à être utilisé en remplacement partiel ou total du lait maternel. Les aliments médicaux pour bébés sont utilisés pour compléter l'apport des sources de nutrition principales (c'est-à-dire, le lait maternel et les préparations pour nourrissons) et sont destinés à la gestion diététique d'une maladie, d'un trouble ou d'un état physique anormal. Ces produits comprennent notamment les FLH, les modulaires (par exemple, les modulaires de protéines, de glucides ou de lipides) et d'autres produits comme les épaississants alimentaires, les aliments métaboliques dans des formats alimentaires conventionnels et les aliments médicaux semi-solides à base d'acides aminés qui peuvent être utilisés pour compléter un régime alimentaire. Cette catégorie d'AFDS proposée engloberait un large éventail de types de produits afin d'appuyer l'innovation dans le domaine de la nutrition.
Les aliments médicaux pour bébés excluraient les préparations pour nourrissons destinées à être utilisées sous surveillance médicale, car ces produits sont mieux pris en compte dans la catégorie des préparations pour nourrissons afin de répondre efficacement aux divers besoins des nourrissons nourris avec des produits destinés à remplacer le lait humain.
On propose de maintenir les exigences réglementaires relatives aux FLH introduits dans le RAD en 2021. Ce règlement a également contribué à l'élaboration des exigences réglementaires proposées pour d'autres produits inclus dans la nouvelle définition des aliments médicaux pour bébés.
a) Définition
La définition suivante est proposée pour les aliments médicaux pour bébés :
aliment médical pour bébés désigne un aliment qui a été spécialement transformé ou formulé et qui est destiné à la gestion diététique des bébés, et à utiliser sous surveillance médicale. Il est destiné à l'alimentation partielle des bébés :
- dont la capacité à prendre, digérer, absorber, métaboliser ou excréter des aliments ordinaires ou certains nutriments qu'ils contiennent, ou des métabolites, est limitée ou altérée
- ayant d'autres besoins nutritionnels déterminés médicalement
dont la gestion diététique ne peut être raisonnablement assurée par la seule modification du régime alimentaire normal
Il convient de noter que la définition actuelle de « fortifiant pour lait humain » dans le règlement serait maintenue.
b) Exigences relatives à la composition
Certains aliments médicaux pour bébés, comme les modulaires et les épaississants, qui sont destinés à être ajoutés aux préparations pour nourrissons, peuvent ne pas nécessiter d'enrichissement pour l'usage auquel ils sont destinés. Toutefois, d'autres aliments médicaux pour bébés, comme les aliments métaboliques, peuvent nécessiter un enrichissement en nutriments spécifiques pour répondre aux besoins nutritionnels des bébés auxquels ils sont destinés. Par conséquent, les aliments médicaux pour bébés pourraient être enrichis. Toutefois, compte tenu de la grande variabilité des produits pour bébés destinés à être inclus dans cette catégorie, on propose de ne pas prescrire d'exigences relatives à la composition. Consulter la sous-section sur l'autorisation préalable à la mise en marché pour plus de détails.
c) Exigences d'étiquetage
- Information nutritionnelle
En tant qu'AFDS, les aliments médicaux pour bébés ne pourraient pas présenter un TVN ni un symbole nutritionnel. On propose que les exigences relatives à l'information nutritionnelle pour les FLHRéférence 37 soient appliquées à tous les aliments médicaux pour bébés. Il s'agit notamment des renseignements suivants :
- Une indication de la quantité, exprimée en grammes, de protéines, de lipides, de glucides disponibles et, le cas échéant, de fibres présente dans la quantité de l'aliment précisée dans le mode d'emploi
- Une indication de la valeur énergétique, exprimée en calories, dans la quantité de l'aliment spécifiée dans le mode d'emploi
- Une déclaration de la quantité, exprimée en milligrammes, microgrammes ou unités internationales, de l'ensemble des vitamines, des nutriments minéraux et des acides aminés énumérés à l'article 6 du tableau de l'article D.03.002 du RAD présente dans la quantité de l'aliment spécifiée dans le mode d'emploi
- Une indication de la quantité, exprimée en grammes, milligrammes, microgrammes ou unités internationales, de toute autre substance nutritive présente dans la quantité de l'aliment spécifiée dans le mode d'emploi
- Mentions obligatoires sur l'étiquette
Les mentions d'étiquetage sont essentielles pour fournir aux professionnels de la santé et aux responsables des soins les renseignements nécessaires à l'utilisation sûre et à la conservation adéquate des aliments. On propose d'appliquer les exigences en matière de mentions obligatoires sur l'étiquette des FLH à tous les aliments médicaux pour bébés. Il s'agit notamment des renseignements suivants :
- Directives pour la conservation de l'aliment avant et après l'ouverture de l'emballage
- Mode d'emploi, y compris la préparation et la conservation de l'aliment tel quel ou mélangé, le cas échéant
- Une mention indiquant que l'aliment ne doit être utilisé que sous surveillance médicale
- La date d'expiration
- Le numéro de lot
Les mentions obligatoires supplémentaires suivantes sont proposées pour tous les aliments médicaux pour bébés, y compris les FLH, car nombre de ces mentions sont obligatoires dans d'autres administrations et sont recommandées par la norme pour les mentions d'étiquetage et les allégations pour les aliments destinés à des fins médicales spéciales (norme Codex 180-1991) Référence 38:
- Une mention indiquant que le produit ne peut être utilisé comme source unique ou principale d'alimentation
- Une déclaration sur l'utilisation prévue de l'aliment
- Mises en garde
Les mises en garde suivantes sont proposées pour tous les aliments médicaux pour bébés, y compris les FLH, car elles sont recommandées par la norme Codex 180-1991 :
- Le cas échéant, une mention concernant les précautions et contre-indications adéquates
- Le cas échéant, un avertissement indiquant que le produit ne convient pas pour administration par voies parentérales
d) Exigences réglementaires supplémentaires
- Allégations
On propose d'appliquer aux aliments médicaux pour bébés les interdictions existantes à l'égard des allégations concernant la réduction du risque de maladie et les allégations thérapeutiques, ainsi que les restrictions à l'égard des allégations concernant la valeur nutritive pour les aliments destinés exclusivement aux enfants de moins de 4 ans.
On propose aussi que les allégations santé ou les indications d'emploi formulées pour tous les aliments médicaux pour bébés soient étayées par des données probantes provenant d'études cliniques acceptables. Toutefois, certaines indications d'emploi déjà fermement établies dans la littérature scientifique et largement acceptées dans la pratique médicale ne nécessiteraient pas de justification supplémentaire. En outre, on propose que le règlement prévoie des restrictions concernant la taille de police pour toute allégation figurant sur l'étiquette, afin de garantir qu'elle n'éclipse pas les mises en garde obligatoires.
- Autorisation préalable à la mise en marché
Afin de garantir la suffisance nutritionnelle et d'éviter les excès nutritionnels compte tenu de la grande variabilité de la composition de ces aliments, une autorisation préalable à la mise en marché serait requise pour tous les nouveaux aliments médicaux destinés aux bébés et pour ceux qui ont subi des changements majeurs, à l'exception des produits non enrichis comme les modulaires et les épaississants. En exigeant une autorisation préalable à la mise en marché, l'objectif est d'établir des mesures de protection appropriées et d'assurer la production de produits sûrs qui répondent aux besoins alimentaires spécifiques des bébés vulnérables.
- Restrictions en matière de publicité
Aucune restriction de publicité n'est proposée pour les aliments médicaux destinés aux bébés.
- Restrictions de vente
On propose d'appliquer la restriction de vente existante pour les FLHRéférence 39 à tous les aliments médicaux pour bébés soumis à une autorisation préalable à la mise en marché. Par exemple, les fabricants et les distributeurs seraient autorisés à vendre ces aliments aux particuliers que s'ils ont reçu une ordonnance écrite d'un professionnel de la santé et si le fabricant ou le distributeur a reçu une demande écrite d'un hôpital.
4.3.2 Aliments médicaux pour un an ou plus
Les catégories de produits d'AUDS dans le titre 24 qui correspondent à la catégorie proposée d'aliments médicaux pour un an ou plus sont les suivantes : PRL, ARTFTE et aliments représentés pour les régimes à teneur réduite en protéines ou faible teneur en acides aminés.
Les exigences proposées pour les aliments médicaux destinés aux personnes âgées d'un an ou plus s'appuieraient principalement sur les exigences réglementaires en vigueur pour la catégorie des PRL et tiendraient compte des mises à jour fondées sur les derniers ANREF et de l'harmonisation aux pratiques exemplaires internationales et les normes mondiales, le cas échéant.
On propose également que les aliments médicaux soient autorisés à représenter en tant que SAT pour perte de poids, ce qui remplacerait la catégorie d'AUDS existante d'ARTFTE. Ces produits sont destinés à être utilisés sous surveillance médicale par des personnes en surpoids ou obèses et sont soumis à des dispositions réglementaires supplémentaires, décrites à la fin de cette section.
a) Définition
La définition suivante est proposée pour les aliments médicaux pour un an ou plus :
aliment médical pour un an ou plus désigne un aliment qui a été spécialement transformé ou formulé et qui est destiné à la gestion diététique de personnes âgées d'un an ou plus, à utiliser sous surveillance médicale. Il est destiné à l'alimentation exclusive ou partielle de personnes :
- dont la capacité à prendre, digérer, absorber, métaboliser ou excréter des aliments ordinaires ou certains nutriments qu'ils contiennent, ou des métabolites, est limitée ou altérée
- ayant d'autres besoins nutritionnels déterminés médicalement
dont la gestion diététique ne peut être raisonnablement assurée par la seule modification du régime alimentaire normal
b) Exigences relatives à la composition
Les exigences relatives à la composition proposées pour les aliments médicaux pour un an ou plus visent à offrir une certaine souplesse afin de tenir compte de l'évolution rapide des données scientifiques et des divers types d'aliments médicaux destinés à traiter différentes affections médicales ou maladies. Ces exigences seraient incorporées par renvoi, ce qui permettrait d'apporter des modifications administrativement. Cela permettrait d'actualiser rapidement la composition de ces produits tout en assurant l'harmonisation à l'évolution des ANREF et d'autres progrès scientifiques dans ce domaine.
Les aliments médicaux sont destinés à l'alimentation exclusive ou partielle de personnes pour une durée indéterminée, allant de quelques jours à une vie entière. Les personnes qui consomment des aliments médicaux comme source unique ou principale de nutrition comptent sur ces aliments pour satisfaire à leurs besoins en nutriments pendant la durée de leur utilisation. Par conséquent, ces aliments doivent contenir des nutriments dans une fourchette acceptable pour satisfaire les besoins minimaux en nutriments d'un individu sans dépasser les niveaux d'apport sécuritaires. Les exigences minimales et maximales en matière de micronutriments s'appliquent aux produits qui constituent une source unique ou primaire de nutrition.
Les aliments médicaux qui ne sont pas destinés à être utilisés comme source unique d'alimentation sont consommés en même temps que d'autres aliments, ce qui réduit le risque d'un apport insuffisant. Toutefois, il peut subsister un risque d'apport excessif de nutriments si des aliments incomplets sur le plan nutritionnel sont enrichis avec des niveaux élevés de nutriments. Les exigences maximales en matière de micronutriments s'appliquent donc à ces produits.
On propose d'établir des exigences relatives à la composition pour les sous-catégories suivantes d'aliments médicaux pour un an ou plus :
- Aliments complets sur le plan nutritionnel, présentés comme source d'alimentation principale ou unique
- Aliments incomplets sur le plan nutritionnel, qui ne sont pas présentés comme source d'alimentation principale ou unique
Les aliments médicaux présentés comme étant complets sur le plan nutritionnel doivent répondre aux exigences prescrites en matière de macronutriments et fournir tous les micronutriments jugés obligatoires, dans des quantités conformes aux niveaux minimum et maximum prescrits.
Les aliments médicaux présentés comme étant incomplets sur le plan nutritionnel n'auraient pas d'exigences en macronutriments ni d'exigences par rapport aux niveaux minimums en micronutriments. Toutefois, ils peuvent être enrichis en micronutriments si les quantités ne dépassent pas les niveaux maximaux prescrits.
- Exemption en cas de justification médicale
Afin de garantir que le cadre proposé pour les aliments médicaux reste flexible et englobe le large éventail de produits innovants existants et futurs, ainsi que pour tenir compte des progrès scientifiques, une exemption au respect des exigences relatives à la composition serait prévue lorsque cela est justifié d'un point de vue médical.
Par exemple, les aliments médicaux pour les personnes souffrant d'une maladie rénale chronique sont spécifiquement formulés pour fournir un niveau plus faible de protéines et de nutriments minéraux spécifiques. Dans ce cas, il existe une base médicale pour déroger des exigences minimales relatives à la composition pour ces nutriments spécifiques. Pour atténuer les risques potentiels, l'étiquette de ces produits serait tenue de fournir des renseignements supplémentaires. Cette exemption s'appliquerait à la fois aux aliments médicaux complets et incomplets sur le plan nutritionnel.
En outre, cette exemption garantirait que la formulation de ces produits puisse répondre aux besoins alimentaires spécifiques des personnes ayant des problèmes de santé. En autorisant des exemptions justifiées scientifiquement, le cadre réglementaire reconnaît la nécessité d'approches nutritionnelles personnalisées dans la formulation d'aliments médicaux.
- L'énergie comme base des exigences relatives à la composition
On propose que les exigences relatives à la composition des aliments médicaux pour un an ou plus soient prescrites pour 100 kilocalories de l'aliment, indépendamment de l'apport recommandé de l'aliment. Cette approche cadre avec celle d'administrations internationales. Elle simplifie aussi les exigences actuelles relatives aux PRL, qui diffèrent selon l'apport énergétique journalier total recommandé, en tenant compte des commentaires des intervenants reçus dans le cadre de l'appel de données lancé auprès des fabricants et des distributeurs d'AUDS vendus au Canada.
- Exigences en macronutriments
On propose des exigences en macronutriments pour les protéines et les lipides similaires à celles pour les PRLRéférence 40 et qui ne s'appliquent qu'aux aliments médicaux présentés comme étant complets sur le plan nutritionnel. Ces exigences seraient révisées pour tenir compte des exigences actuelles relatives aux ANREF. Aucune exigence n'est proposée pour les glucides pour permettre la variabilité de la composition.
- Exigences en matière d'enrichissement
Les exigences actuelles en matière de micronutriments pour les PRL comprennent un minimum prescrit pour 18 micronutriments, avec un niveau maximum établi uniquement pour les vitamines A et D. Ces exigences sont fondées sur des apports recommandés désuets pour les hommes adultes, et l'approche utilisée pour établir ces niveaux n'est pas claire, notant que les exigences minimales fournissaient de 25 à 150 % de l'apport recommandé respectif. En outre, les exigences relatives à la composition des PRL s'appliquent aux produits complets sur le plan nutritionnel, ce qui crée une lacune importante pour les produits qui ne sont pas destinés à être utilisés comme source unique d'alimentation. Enfin, les exigences actuelles ne cadrent pas avec les exigences applicables aux produits qui relèvent de cette catégorie dans les administrations internationales, ce qui limite l'accès aux produits disponibles dans d'autres pays.
Enrichissement obligatoire en vitamines et en minéraux nutritifs
Les exigences en micronutriments proposées pour les aliments médicaux pour un an ou plus seraient fondés sur les ANREF actuels. Les nutriments obligatoires proposés seraient ceux pour lesquels un apport nutritionnel recommandé (ANR) ou un apport suffisant (AS) a été établi, avec des exceptions possibles. Ces nutriments comprennent les micronutriments actuellement obligatoires pour les PRL, ainsi que des micronutriments supplémentaires.
Les teneurs minimales proposées s'appliqueraient à tous les nutriments obligatoires, tandis que les teneurs maximales ne s'appliqueraient qu'aux nutriments pour lesquels un apport maximal tolérable (AMT) ou un apport lié à un risque réduit de maladie chronique (RRMC) a été fixé, précisant qu'un apport excessif à long terme est susceptible d'avoir des effets néfastes.
Des exigences en nutriments distinctes peuvent être établis pour différents groupes d'âge si cela est jugé nécessaire (par exemple, pour les enfants âgés de 1 à 13 ans).
Si l'aliment médical est complet sur le plan nutritionnel et présenté comme pouvant constituer une source unique ou principale d'alimentation, il doit contenir tous les nutriments obligatoires à des niveaux conformes aux exigences minimales et maximales prescrites.
Si l'aliment est incomplet sur le plan nutritionnel et n'est pas présenté comme pouvant constituer une source unique ou principale d'alimentation, il peut contenir un ou plusieurs micronutriments spécifiés à n'importe quelle teneur ne dépassant pas la teneur maximale prescrite.
Enrichissement facultatif de vitamines, minéraux et acides aminés
Outre les micronutriments obligatoires prescrits pour les aliments médicaux destinés aux personnes âgées d'un an ou plus, on propose d'autoriser l'enrichissement facultatif de certains nutriments, pour lesquels des teneurs minimales ne seraient pas prescrites. Il pourrait s'agir du bore, dont l'ajout aux aliments médicaux est autorisé dans d'autres administrations (UE et l'Australie et Nouvelle-Zélande). Comme dans le cas de l'enrichissement obligatoire de ces aliments, les teneurs maximales ne s'appliqueraient qu'aux nutriments pour lesquels un AMT ou RRMC a été fixé.
La disposition actuelle autorisant l'ajout d'acides aminés aux PRL serait maintenue pour tous les aliments médicaux pour un an ou plus et élargie pour permettre l'ajout d'autres acides aminés non essentiels ou non protéinogènes, comme l'ornithine et la citrulline, lesquels, comme il a été démontré, contribuent à la gestion diététique des maladies graves et peuvent présenter des avantages dans le contexte de certains problèmes médicaux. L'ajout d'acides aminés serait limité à l'amélioration de la qualité des protéines ou à l'atteinte d'un objectif médical.
c) Exigences d'étiquetage
Les exigences proposées en matière d'étiquetage garantiraient que les consommateurs et les fournisseurs de soins de santé disposent de renseignements suffisants pour permettre une utilisation et une préparation sûres de ces aliments. Les exigences d'étiquetage s'harmoniseraient, dans la mesure du possible, à celles d'autres administrations, afin de réduire les obstacles au marché canadien. Ensemble, ces exigences réglementaires actualisées aideront les Canadiens à accéder aux produits médicaux disponibles à l'échelle internationale.
- Information nutritionnelle
Les interdictions de présenter un TVN et un symbole nutritionnel qui s'appliquent actuellement aux PRL s'appliqueraient aux aliments médicaux.
On propose que les exigences actuelles en matière de déclaration de la teneur en nutriments et d'unités de mesure pour les PRL soient appliquées à tous les aliments médicaux pour un an ou plus. Cependant, pour plus de clarté et pour faciliter les activités de conformité et d'application, on propose d'harmoniser les unités de mesure des vitamines et des minéraux nutritifs dans l'information nutritionnelle aux unités précisées dans les exigences relatives à la composition. Cette harmonisation des unités entre la mention sur l'étiquette et les exigences relatives à la composition permettrait aux autorités réglementaires de vérifier facilement si la teneur en nutriments indiquée sur l'étiquette répond aux exigences spécifiées.
- Mentions obligatoires sur l'étiquette
Les mentions sont essentielles pour fournir aux professionnels de la santé et aux consommateurs les renseignements nécessaires à l'utilisation sûre et à la conservation adéquate des aliments. Les mentions obligatoires suivantes proposées sur l'étiquette sont conformes à la norme Codex 180-1991 et nombre de ces mentions sont obligatoires dans d'autres administrations :
- Une mention indiquant que le produit doit être utilisé sous surveillance médicale
- Une mention indiquant si le produit peut être utilisé comme source unique ou principale d'alimentation
- Si un produit déroge des exigences relatives à la composition, une mention décrivant cette dérogation
- La mention « Pour la gestion diététique de… », où l'espace vide doit être rempli par la maladie, le trouble ou l'état physique anormal pour lequel le produit est destiné
- Mode d'emploi, y compris la préparation, la conservation et la disposition
- La date d'expiration
- Le numéro de lot
Mises en garde
Les mises en garde suivantes sont proposées, conformément à la norme Codex 180-1991 :
- Le cas échéant, une mention concernant les précautions et contre-indications adéquates
- Un avertissement indiquant que le produit ne convient pas pour administration par voies parentérales
Exemptions d'étiquetage pour les produits métaboliques
Certains aliments médicaux sont spécialement formulés pour les personnes souffrant de maladies rares, comme des troubles métaboliques héréditaires; ces aliments sont connus sous le nom de produits métaboliques. En raison de la faible incidence des troubles métaboliques héréditaires, le marché des produits métaboliques est très restreint. Par conséquent, les fabricants combinent souvent des commandes provenant de plusieurs pays en une seule production. Cette approche permet non seulement d'utiliser une formulation normalisée, mais aussi d'emballer les produits avec des étiquettes uniformes en vue d'une distribution mondiale. Même si ces produits sont conformes aux exigences réglementaires (composition et étiquetage) du principal marché où ils sont vendus, il se peut qu'ils ne soient pas entièrement conformes à tous les règlements applicables du RAD.
Pour assurer une utilisation sûre et une distribution appropriée des produits métaboliques, les distributeurs ont mis en place un système ayant des mesures de protection rigoureuses, y compris l'obligation de fournir une preuve de diagnostic ou une communication écrite d'un fournisseur de soins de santé avant l'achat. Ce système vise à assurer que les produits ne parviennent qu'aux personnes qui en ont besoin et pour lesquelles ils sont sûrs et bénéfiques. En outre, il contribue à garantir que les personnes reçoivent tous les renseignements nécessaires de la part de leurs fournisseurs de soins de santé afin d'assurer que ces aliments sont utilisés de façon adéquate.
Santé Canada a récemment publié un énoncé de politique provisoire reconnaissant que le risque d'interrompre l'accès aux produits métaboliques pour les Canadiens ayant un trouble métabolique héréditaire l'emporte sur le risque de non-conformité à la réglementation en vigueur. La restriction de l'accès à ces produits pourrait représenter un risque considérable pour la santé des Canadiens vulnérables sur le plan médical qui comptent sur ces produits pour gérer des problèmes de santé graves. Par conséquent, une exemption d'étiquetage pour les aliments métaboliques est actuellement à l'étude afin de garantir la disponibilité continue de ces produits, même s'ils ne sont pas entièrement conformes aux exigences d'étiquetage applicables du RAD. Toutefois, les entreprises seraient toujours tenues de fournir des renseignements qui permettent de préparer et d'utiliser ces produits de façon sécuritaire. Il peut s'agir d'une liste d'ingrédients, d'information nutritionnelle et d'une date d'expiration.
d) Exigences réglementaires supplémentaires pour les aliments médicaux pour un an ou plus
- Allégations
On propose d'appliquer aux aliments médicaux pour un an ou plus les interdictions existantes à l'égard des allégations concernant la réduction du risque de maladie et les allégations thérapeutiques, ainsi que les restrictions à l'égard des allégations concernant la valeur nutritive pour les aliments destinés exclusivement aux enfants âgés de moins de 4 ans.
On propose aussi que les allégations santé ou les indications d'emploi formulées pour tous les aliments médicaux pour un an ou plus soient étayées par des données probantes provenant d'études cliniques acceptables. Toutefois, certaines indications d'emploi déjà fermement établies dans la littérature scientifique et largement acceptées dans la pratique médicale ne nécessiteraient pas de justification supplémentaire. En outre, on propose que le règlement prévoie des restrictions de taille de police pour toute allégation figurant sur l'étiquette, afin de garantir qu'elle n'éclipse pas les mises en garde obligatoires.
- Autorisation préalable à la mise en marché
Il n'y a actuellement aucune exigence préalable à la mise en marché pour les PRL dans le RAD. On propose de ne pas imposer d'exigences préalables à la mise en marché pour les aliments médicaux pour un an ou plus.
- Restrictions en matière de publicité
Santé Canada a réévalué les restrictions actuelles en matière de publicité pour de nombreux AUDS et reconnaît la nécessité d'actualiser l'approche afin de trouver un équilibre entre la protection des consommateurs et la facilitation de l'accès des consommateurs aux aliments médicaux, tout en permettant aux fabricants et aux distributeurs de promouvoir et de distribuer leurs produits efficacement. De nombreuses autres stratégies d'atténuation des risques seraient utilisées pour protéger la santé des consommateurs, y compris les mentions obligatoires sur l'étiquette; on propose donc que les restrictions actuelles en matière de publicité applicables à de nombreux AUDS ne s'appliquent pas aux aliments médicaux pour un an ou plus.
- Restrictions de vente
Aucune restriction de vente n'est proposée pour les aliments médicaux pour un an ou plus.
4.3.3 Aliments médicaux présentés comme substituts de l'alimentation totale pour perte de poids
Pour répondre aux besoins spécifiques des personnes qui souhaitent perdre du poids sous surveillance médicale par l'entremise d'un SAT, on propose de créer une sous-catégorie distincte d'aliments médicaux. Cette catégorie serait désignée comme des aliments médicaux représentés comme un SAT pour perte de poids et assortie d'exigences uniques décrites ci-dessous, à la place ou en plus des exigences réglementaires proposées pour les aliments médicaux pour un an ou plus. Cette proposition s'harmonise aux administrations internationales et remplacerait la catégorie des ARTFTE dans le titre 24.
a) Définition
La définition suivante est proposée pour le substitut de l'alimentation totale pour perte de poids :
substitut de l'alimentation totale pour perte de poids désigne un aliment médical spécialement formulé pour être utilisé dans des régimes à restriction énergétique pour perte de poids et qui constitue la source unique d'alimentation lorsqu'il est consommé conformément aux instructions
b) Suppression de la définition existante
La définition réglementaire de « régime à très faible teneur en énergie » dans le titre 24, qui renvoie à « un régime amaigrissant qui, lorsqu'il est suivi selon les indications, fournit moins de 900 kilocalories par jour », serait supprimée du cadre réglementaire pour tenir compte de la nouvelle définition proposée pour les SAT pour perte de poids.
c) Exigences relatives à la composition
En ce qui concerne les aliments médicaux présentés comme SAT pour perte de poids, on propose que le régime alimentaire restreint en énergie fournisse un minimum de 800 kcal par jour et un maximum de 1 200 kcal par jour, afin de s'harmoniser aux administrations internationales. Cette exigence vise à s'assurer qu'une personne consommant un aliment médical présenté comme un SAT pour perte de poids consommera suffisamment d'énergie, tout en réduisant son apport énergétique dans les quantités nécessaires pour parvenir à perdre du poids.
Cette sous-catégorie d'aliments médicaux serait soumise à des exigences distinctes relatives à la composition, qui seraient prescrites selon l'apport quotidien total. Cette approche est cohérente avec les exigences actuelles du titre 24 pour les ARTFTE. En ce qui concerne les macronutriments, des exigences minimales seraient fixées pour la quantité et la qualité des protéines, la quantité de glucides et les quantités d'acide linoléique et linolénique. En outre, des exigences en matière de micronutriments seraient fixées, sans possibilité de dérogation. L'alignement et l'harmonisation à l'échelle internationale à la Norme Codex pour les préparations alimentaires utilisées dans les régimes amaigrissants à valeur énergétique très faible (norme Codex-203-1995)Référence 41 seraient également envisagées.
d) Exigences d'étiquetage
- Information nutritionnelle
Les exigences relatives à la déclaration de la teneur en éléments nutritifs pour cette sous-catégorie d'aliments médicaux seraient conformes aux exigences applicables aux aliments médicaux destinés aux personnes âgées d'un an ou plus.
- Mentions obligatoires sur l'étiquette
Outre les mentions obligatoires sur l'étiquette pour les aliments médicaux destinés aux personnes âgées d'un an ou plus, les étiquettes des SAT pour perte de poids devraient comporter les éléments suivants :
- La mention « Pour la gestion diététique de l'obésité », à proximité du nom usuel de l'aliment
- La quantité journalière recommandée à consommer pour fournir la seule source de nutrition
- Une mention indiquant que l'aliment peut être utilisé comme source unique d'alimentation lorsqu'il est consommé conformément aux instructions
Mises en garde
Outre les mises en garde pour les aliments médicaux destinés aux personnes âgées d'un an ou plus, les étiquettes des SAT pour perte de poids devraient comporter l'élément suivant :
- Une mention indiquant que l'aliment n'est pas recommandé pour les femmes enceintes ou qui allaitent ou les personnes âgées de moins de 18 ans
e) Exigences réglementaires supplémentaires pour le substitut de l'alimentation totale pour perte de poids
- Allégations
On propose d'appliquer aux SAT pour perte de poids les interdictions existantes à l'égard des allégations concernant la réduction du risque de maladie et les allégations thérapeutiques pour les ARTFTE. On propose aussi que les allégations santé ou les indications d'emploi pour tous les SAT pour perte de poids soient étayées par des données probantes provenant d'études cliniques acceptables. En outre, on propose que le Règlement prévoie des restrictions en matière de taille de police pour toute allégation figurant sur l'étiquette, afin de garantir qu'elle n'éclipse pas la mise en garde obligatoire figurant dans l'espace principal.
- Autorisation préalable à la mise en marché
Une autorisation préalable à la mise en marché ne serait pas nécessaire pour ces produits, étant donné que des exigences en matière de composition seraient établies pour garantir la suffisance nutritionnelle en tant que source unique d'alimentation.
- Restrictions en matière de publicité
Aucune restriction en matière de publicité n'est proposée pour cette sous-catégorie d'aliments médicaux, ce qui serait conforme aux restrictions applicables aux aliments médicaux pour un an ou plus.
- Restrictions de vente
Aucune restriction de vente n'est proposée pour cette sous-catégorie d'aliments médicaux, ce qui serait conforme aux restrictions applicables aux aliments médicaux pour un an ou plus.
4.4 Exigences réglementaires proposées applicables aux aliments à des fins diététiques spéciales
Outre les exigences réglementaires propres à la catégorie proposée, tous les AFDS seraient soumis aux exigences réglementaires décrites dans les sous-sections suivantes.
4.4.1 Dispositions concernant les pénuries
Le cadre réglementaire proposé pour les AFDS vise à réduire les obstacles à l'accès à ces produits et améliorer l'harmonisation des règlements canadiens à ceux d'autres administrations afin d'atténuer le risque de pénurie d'AFDS. En plus de cet effort, on propose de prescrire des dispositions relatives à la pénurie dans le cadre réglementaire proposé pour les AFDS. Cette approche prend en compte les dispositions concernant les AFDS énoncées dans l'Arrêté d'urgence concernant les drogues, les instruments médicaux et les aliments à des fins diététiques spéciales dans le cadre de la COVID-19.
Ces dispositions cadreraient avec les mécanismes déjà en place pour gérer les pénuries de produits de santé, y compris les instruments médicaux et les médicaments, tout en comblant les lacunes réglementaires qui ont entravé l'avancement des dispositions relatives aux pénuries d'AFDS dans le Règlement modifiant certains règlements visant les drogues et les instruments médicaux (pénuries) de septembre 2021.
Les dispositions proposées concernant les pénuries permettraient à Santé Canada de disposer de moyens renforcés pour évaluer et traiter efficacement les pénuries d'AFDS. Cela renforcerait considérablement le soutien aux systèmes de soins de santé dans l'ensemble du pays. En aidant à surveiller, prévenir et atténuer les pénuries, ces dispositions réduiraient en fin de compte le temps que les professionnels de la santé et les patients consacrent à la recherche de produits de remplacement. En outre, elles joueraient un rôle crucial dans la prévention des conséquences négatives découlant de l'annulation ou du report de traitements, ou de l'utilisation de produits de remplacement moins efficaces.
a) Définition
On propose d'ajouter la définition suivante au RAD :
pénurie, en ce qui concerne un aliment à des fins diététiques spéciales, désigne une situation dans laquelle le fabricant d'un aliment à des fins diététiques spéciales n'est pas en mesure de répondre à la demande du produit au Canada
b) Signaler les pénuries
On propose que les fabricants d'AFDS soient tenus de signaler les pénuries ou les pénuries anticipées à Santé Canada. Il y a pénurie lorsque l'offre existante ne répond plus à la demande actuelle, tandis qu'une pénurie anticipée renvoie à une offre future qui n'est pas en mesure de répondre à la demande projetée. Des critères peuvent être établis pour déterminer à quel moment il est nécessaire de signaler une pénurie d'AFDS; par ailleurs, il peut être obligatoire de signaler toute pénurie d'AFDS à Santé Canada. En outre, la possibilité de signaler la cessation de la vente de produits est également envisagée, en particulier si la cessation de la vente est susceptible d'entraîner une pénurie.
Les exigences de déclaration comprendraient la notification à Santé Canada d'une pénurie ou d'une pénurie anticipée (dans les cinq jours ouvrables), la transmission de renseignements à jour sur la pénurie (dans les deux jours ouvrables suivant toute modification des renseignements initialement fournis) et la notification de la fin de la pénurie (dans les deux jours ouvrables suivant le rétablissement de la capacité du fabricant). Le ministre aurait le pouvoir de demander des renseignements spécifiques aux parties réglementées afin d'évaluer une pénurie d'AFDS ou d'y remédier. Ces renseignements serviraient à évaluer le niveau de risque et à déterminer les mesures à prendre pour prévenir ou atténuer la pénurie.
Une fois qu'une pénurie ou une pénurie anticipée est signalée à Santé Canada, le règlement proposé exigerait que cette information soit rapidement rendue publique sur le site Web du gouvernement du Canada, par l'entremise d'une liste en ligne d'AFDS qui ont été désignés comme étant manquants. Cet échange transparent de renseignements sur les pénuries permettrait aux fabricants de recenser efficacement les ruptures de stocks et aiderait les établissements de soins de santé à prendre des décisions éclairées en ce qui concerne les soins aux patients.
c) Importation exceptionnelle d'aliments à des fins diététiques spéciales non conformes
Les dispositions proposées en cas de pénurie introduiraient également un cadre d'importation exceptionnelle dans le RAD, ce qui contribuerait à garantir l'accès aux AFDS en cas de pénurie. Ce cadre permettrait l'importation et la vente exceptionnelles de produits qui ne répondent pas entièrement aux exigences réglementaires canadiennes, mais qui sont fabriqués selon des normes de qualité comparables. Les AFDS dont l'importation exceptionnelle est autorisée par Santé Canada figureront sur une liste d'AFDS désignés, disponible sur le site Web du Ministère.
Les fabricants et les importateurs d'AFDS désignés seraient tenus de fournir les renseignements essentiels sur l'étiquette dans les deux langues officielles, de sorte à permettre la préparation et l'utilisation sûres de l'aliment. Les renseignements requis peuvent comprendre : l'usage diététique spécial pour lequel l'aliment est présenté; une liste des ingrédients de l'aliment; les mises en garde; des instructions pour la préparation, l'utilisation et la conservation de l'aliment; la date d'expiration et le numéro de lot de l'aliment, s'il y a lieu.
4.4.2 Dispositions concernant la cessation de vente
Les changements proposés incluraient d'élargir la portée des dispositions concernant la cessation de vente existantesRéférence 42, actuellement applicables aux PRL, SR, ARTFTE, FLH et préparations pour nourrissons, afin d'englober tous les AFDS. Ces dispositions autorisent le ministre à demander aux fabricants des preuves écrites concernant leurs produits et à interrompre temporairement leur vente jusqu'à ce que les preuves demandées soient fournies. En outre, le ministre a le pouvoir d'évaluer l'adéquation des preuves soumises, ce qui entraîne la suspension des ventes si elles sont jugées insuffisantes.
En 2021, des exigences supplémentaires ont été ajoutées aux dispositions concernant la cessation de vente de FLH, précisant que le délai de mise en conformité ne doit pas être inférieur à 24 heures à compter de la demande, sauf si le ministre a des motifs raisonnables de croire qu'il existe un risque grave et imminent d'atteinte à la santé humaine. Ces exigences supplémentaires s'appliqueraient également à tous les AFDS.
Enfin, ces dispositions précisent que les preuves demandées visent principalement à établir la suffisance nutritionnelle du produit lorsqu'il est utilisé comme source unique d'alimentation. Dans le cas des préparations pour nourrissons et des FLH, les preuves relatives à la date d'expiration du produit sont également incluses. En outre, on propose d'élargir la portée des preuves demandées afin d'inclure des preuves relatives à d'autres paramètres concernant la sécurité du produit.
4.4.3 Cadre des essais cliniques
Dans le cadre de l'Examen réglementaire ciblé du Secrétariat du Conseil du Trésor du Canada et de la Feuille de route pour l'examen réglementaire du secteur de la santé et des biosciences subséquente, Santé Canada s'est engagé à moderniser la réglementation des essais cliniques pour diverses gammes de produits, y compris les AFDS. Au titre de ce cadre proposé axé sur le risque, les essais cliniques pour les AFDS assortis d'exigences d'examen préalable à la mise en marché, y compris l'autorisation et la notification préalables à la mise en marché, pourraient être effectués avant la délivrance d'une lettre d'autorisation ou d'une lettre confirmant qu'aucune question ne reste sans réponse, respectivement. En outre, on pourrait également autoriser l'utilisation des AFDS non conformes qui n'ont pas besoin d'examen préalable à la mise en marché dans le cadre d'un essai clinique au Canada.
Le cadre d'essais cliniques pour les AFDS est encore en cours d'élaboration. La modernisation proposée du cadre de réglementation pour les AFDS, telle que décrite dans le présent document de consultation, compléterait le cadre proposé pour les essais cliniques en précisant la classification des aliments en tant qu'AFDS et en mettant à jour leurs exigences réglementaires.
4.4.4 Exigences en matière d'examen préalable à la mise en marché pour les aliments à des fins diététiques spéciales pour bébés
Comme il a été décrit dans les sections précédentes, la grande majorité des AFDS pour bébés auraient besoin d'une autorisation préalable à la mise en marché avant la vente d'un nouveau produit ou d'un produit ayant subi des changements majeurs, à l'exception des aliments médicaux non enrichis pour bébés. Toutefois, les exigences relatives à la demande d'autorisation préalable à la mise en marché varieraient en fonction de la catégorie d'AFDS pour bébés. Des détails supplémentaires concernant ces exigences pour le LHPE et les aliments médicaux pour bébés, le cas échéant, seront proposés à une date ultérieure.
a) Changement majeur
Un changement majeur apporté à une préparation pour nourrissons ou à un FLH existant n'exige pas, à l'heure actuelle, de présenter des données sur une série de sujets importants comme la fabrication, le contrôle de la qualité, l'emballage et les tests de stabilité pour les dates d'expiration. Toutefois, ces renseignements sont souvent demandés au cours du processus d'évaluation afin de fournir le contexte nécessaire et de compléter l'évaluation.
On propose d'introduire cinq exigences supplémentaires pour soutenir l'autorisation préalable à la mise en marché d'un changement majeur apporté à une préparation pour nourrissons ou un FLH. Ces nouvelles exigences cadreraient avec les renseignements demandés pour les nouvelles préparations pour nourrissons et les nouveaux FLH, et consisteraient en ce qui suit :
- le nom et l'adresse de chaque établissement dans lequel la préparation pour nourrissons ou le FLH est fabriqué
- les spécifications nutritionnelles de la préparation pour nourrissons ou du FLH après l'intégration du changement majeur
- les détails des changements apportés au processus de fabrication de la préparation pour nourrissons ou du FLH et aux procédures de contrôle de la qualité utilisées tout au long du processus à la suite du changement majeur
- les résultats des tests effectués pour déterminer la date d'expiration de la préparation pour nourrissons ou du FLH après avoir apporté le changement majeur
- une description du type d'emballage qui sera utilisé pour la préparation pour nourrissons ou le FLH, si le changement majeur touche l'emballage
b) Définition révisée
On propose de réviser la définition actuelle d'un « changement majeur » afin de combler les lacunes de la définition actuelle du RAD. Cette révision consiste notamment à remplacer les termes « succédané de lait humain » et « fortifiant pour lait humain » par « aliment à des fins diététiques spéciales pour bébés », de remplacer le mot « transformation » par « fabrication » et d'inclure le mot « physique » pour traduire la possibilité de caractéristiques physiques inadéquates de la matrice de la préparation pour nourrissons (poudre ou liquide).
On propose la définition révisée suivante pour un changement majeur :
changement majeur désigne, relativement à un aliment à des fins diététiques spéciales pour bébés, un changement d'ingrédient ou de la quantité d'un ingrédient, ou la modification de la fabrication ou de l'emballage de l'aliment à des fins diététiques spéciales pour bébés, qui pourrait, selon l'expérience du fabricant ou la théorie généralement admise, altérer les concentrations ou compromettre la disponibilité des éléments nutritifs de l'aliment à des fins diététiques spéciales pour bébés, ou l'innocuité physique, microbiologique ou chimique de celui-ci.
4.4.5 Évaluation des délais de demandes
Constatant que Santé Canada élargirait les exigences en matière d'autorisation préalable à la mise en marché pour s'appliquer à la grande majorité des AFDS nouveaux pour bébés et ceux ayant subi un changement majeur, le Ministère étudie la possibilité d'introduire différents volets de demandes d'autorisation préalable à la mise en marché avec des délais spécifiques en fonction de leur complexité. Par exemple, les demandes moins complexes pourraient être placées dans un volet avec un délai plus court. Santé Canada a l'intention de proposer et de publier ces délais dans un document d'orientation.
Dans certains cas, lorsque Santé Canada reçoit une nouvelle demande ou une demande de changement majeur pour une préparation pour nourrissons, des précisions supplémentaires peuvent être nécessaires, ce qui entraîne une communication supplémentaire avec le fabricant et peut prolonger le processus d'évaluation. Le nombre de lettres indiquant des lacunes envoyées par Santé Canada pour obtenir tous les renseignements nécessaires à l'évaluation peut avoir une incidence importante sur la durée totale de l'évaluation. Pour remédier à cette situation, Santé Canada entend renforcer le processus de sélection afin de cerner les demandes qui ne contiennent pas suffisamment de renseignements, ce qui permettra de cibler rapidement les demandes de mauvaise qualité et de les fermer si les lacunes en matière de données ne peuvent pas être comblées dans un délai relativement court. Cette approche accorderait la priorité à l'évaluation des demandes de haute qualité, réduirait la correspondance avec les fabricants et raccourcirait en fin de compte le délai d'évaluation.
Santé Canada s'est engagé à mettre à jour la liste de vérification et les documents d'orientation à l'intention de l'industrie, afin que les fabricants disposent de renseignements complets pour préparer leurs dossiers de demande d'autorisation. Le Ministère continuera à aider les demandeurs par l'entremise de réunions préalables à la présentation, comme c'est le cas actuellement.
5.0 Un titre pour les aliments non destinés à des fins diététiques spéciales
Le cadre réglementaire actuel défini dans les titres 24 et 25 comprend plusieurs produits qui ne sont pas des AFDS. Cela inclut les SR, les SN, les aliments sans gluten, les repas préemballés et les aliments vendus par une clinique d'amaigrissement (titre 24) ainsi que les aliments conventionnels pour bébés (titre 25). Les exigences réglementaires relatives à ces produits relèveraient d'un titre distinct du RAD.
On propose les catégories de produits suivantes, des détails sur chaque catégorie étant décrits dans les sections suivantes :
- Aliments conventionnels pour bébés
- Aliments sans gluten
- Aliments nutritifs formulés (ANF)
- ANF pour enfants (1 à 13 ans)
- ANF pour 14 ans ou plus, y compris les produits présentés comme des substituts de repas formulés
- Aliments présentés en vue d'une utilisation dans les régimes amaigrissants
- Substituts de repas formulés
- Repas préemballés
- Aliments vendus par une clinique d'amaigrissement
5.1 Aliments conventionnels pour bébés
Santé Canada propose d'introduire l'expression « aliment conventionnel pour bébés » pour désigner une catégorie d'aliments pour nourrissons qui ne font pas partie des AFDS, comme les céréales pour bébés et les fruits en purée. Cette catégorie proposée distinguerait ces produits de la vaste catégorie d'aliments pour bébés actuellement définie dans le RAD, qui comprend tous les produits destinés aux bébés, y compris les AFDS.
On propose que la catégorie englobe les aliments étiquetés ou faisant l'objet d'une publicité conçus pour être consommés par des bébés âgés de 6 mois à moins d'un an, à l'exclusion des AFDS. Ces aliments sont soumis à la disposition existante qui interdit toute représentation sur l'étiquette concernant la consommation de l'aliment par un bébé âgé de moins de 6 moisRéférence 43. Les aliments qui ne sont pas étiquetés ou annoncés en vue d'une consommation par des bébés, comme les produits destinés exclusivement aux jeunes enfants âgés d'un an ou plus, seraient exclus.
5.1.1 Définition
On propose la définition suivante pour les aliments conventionnels pour bébés :
aliment conventionnel pour bébé désigne tout aliment étiqueté ou annoncé comme pouvant être consommé par des bébés, autre qu'un aliment à des fins diététiques spéciales
5.1.2 Exigences relatives à la composition
a) Exigences en matière d'enrichissement
Le RAD autorise l'ajout de certains nutriments aux produits céréaliers pour bébés. On propose que l'enrichissement des produits céréaliers pour bébés reste facultatif. La liste actuelle des vitamines et des minéraux nutritifs qui peuvent être ajoutés aux produits céréaliers pour bébés serait révisée. Les quantités actuelles de nutriments reposent sur les dispositions générales en matière d'enrichissementRéférence 44, qui ne sont pas propres aux besoins des bébés et ne prévoient pas de quantités maximales pour les nutriments minéraux. L'approche proposée fixerait des quantités minimales et maximales pour toutes les vitamines et tous les nutriments minéraux qui peuvent être ajoutés, en tenant compte des dernières recommandations en matière d'apport nutritionnel pour les bébés, des données probantes concernant les apports nutritionnels et des approches internationales.
b) Sodium
Le sodium est un minéral nutritif essentiel au maintien de la santé, mais une consommation excessive peut entraîner une hypertension artérielle, un facteur de risque majeur pour le développement de maladies cardiovasculaires. Les Canadiens, en particulier les enfants, les adolescents et les hommes, consomment trop de sodium. La préférence pour les aliments salés est un facteur important qui sous-tend la consommation excessive de sodium et le développement de cette préférence peut commencer dès l'enfanceRéférence 45Référence 46. Le RAD fixe actuellement des restrictions concernant l'ajout de chlorure de sodium et la teneur en sodium de certains aliments pour bébés.
On propose de maintenir l'interdiction d'ajouter du chlorure de sodium à tout aliment pour bébés contenant des fruits en purée, du jus de fruits, des boissons aux fruits ou des céréales.
On propose de supprimer l'exemption pour les desserts en purée telle qu'elle figure dans l'article B.25.003(2) du RAD. En revanche, les desserts seraient ajoutés à la liste des aliments pour bébés pour lesquels il est interdit d'ajouter du chlorure de sodium.
En ce qui concerne les limites de sodium, le tableau 1 montre les changements proposés aux catégories d'aliments et aux limites de sodium correspondantes énoncées dans le tableau 1 du titre 25 qui seraient incorporées par renvoi au RAD.
| Colonne I Catégorie d'aliments |
Colonne II Sodium total en milligrammes pour 100 grammes d'aliment |
|---|---|
| Biscottes, biscuits, collations déshydratéesNote * | 200 |
| Tous les autres aliments conventionnels pour bébés prêts à être consommésNote * | 100 |
|
|
Cette proposition simplifierait l'approche réglementaire actuelle et éliminerait les lacunes résultant de la liste fermée d'aliments en vigueur.
La limite de sodium proposée pour les biscottes, les biscuits et les collations déshydratées tient compte de la taille généralement réduite des portions (en poids) de ces aliments. Même si la limite proposée est inférieure aux objectifs maximaux facultatifs établis pour ces types d'aliments dans les Cibles volontaires de réduction du sodium pour les aliments transformés, 2020-2025 de Santé Canada, ces cibles s'appliquent aux aliments destinés aux tout-petits.
L'AS pour le sodium est plus de deux fois plus élevé pour la tranche d'âge des tout-petits (1 à 3 ans) que pour les bébés (7 à 12 mois), et les aliments présentés pour les tout-petits sont soumis à l'étiquetage nutritionnel sur le devant de l'emballage qui identifie les aliments élevés en sodium, tandis que cet étiquetage est interdit sur les produits préemballés destinés uniquement aux bébés âgés d'au moins 6 mois mais de moins d'un an. Dans ces conditions, il conviendrait de réduire la teneur en sodium des aliments conventionnels pour bébés par rapport à celle des aliments pour tout-petits.
c) Sucres
Santé Canada recommande que les aliments complémentaires pour bébés soient préparés et servis avec peu ou pas de sucres ajoutés. Sur les étiquettes des aliments, les ingrédients à base de sucres doivent être regroupés dans la liste des ingrédients afin d'aider les responsables des soins à comprendre leur proportion relative dans l'aliment par rapport aux autres ingrédients et à relever les sources de sucres non familières dans les aliments. En outre, le RAD exige que la teneur totale en sucres des aliments préemballés soit indiquée, en grammes, dans le TVN.
Même si une analyse du marché canadien indique que la plupart des aliments conventionnels pour bébés contiennent peu ou pas de sucres ajoutés, certaines catégories d'aliments étaient plus susceptibles de contenir des sucres ajoutés (par exemple, les biscottes ou les biscuits, les collations et les desserts pour bébés). Pour ces catégories d'aliments, Santé Canada envisage d'introduire des restrictions sur les sucres à limiter recensés par l'Organisation mondiale de la SantéRéférence 47.
d) Gras saturés
Étant donné que la restriction des apports en lipides n'est pas recommandée pour les enfants de moins de 2 ans, on ne propose pas de limiter la teneur en gras saturés.
5.1.3 Exigences d'étiquetage
a) Information nutritionnelle
On propose de maintenir les exigences actuelles d'étiquetage nutritionnel pour ces aliments, telles qu'elles sont définies dans les exigences en matière d'étiquetage nutritionnel pour les aliments préemballés dans la partie B du RAD. Cela inclut l'exigence de porter un TVN et l'interdiction d'utiliser un symbole nutritionnel sur l'étiquette.
5.2 Aliments sans gluten
Le gluten est le principal composant protéique du blé et se trouve également dans d'autres céréales comme l'orge et le seigle, ainsi que dans leurs souches hybrides. La maladie cœliaque est une affection chronique à médiation immunitaire déclenchée par l'exposition au gluten. L'exposition au gluten chez les personnes atteintes de la maladie cœliaque peut endommager la paroi de l'intestin grêle, ce qui entraîne une réduction de l'absorption des nutriments, notamment le fer, le folate, le calcium, la vitamine D, les protéines, les lipides et d'autres nutriments essentielsRéférence 48. Le seul moyen efficace de gérer cette maladie et de prévenir les complications est d'éviter strictement les sources de gluten dans le régime alimentaire.
Le titre 24 interdit de présenter un aliment comme étant sans gluten s'il contient une forme quelconque de protéine de glutenRéférence 49. Cette interdiction contribue à protéger la santé et la sécurité des personnes qui ont besoin d'utiliser des aliments sans gluten spécialement transformés ou formulés. Actuellement, seuls les aliments qui ont été spécialement transformés ou formulés pour répondre aux besoins des personnes tenues de suivre un régime sans gluten afin de protéger leur santé sont considérés comme des AUDS et sont autorisés à porter une mention « sans gluten ». Par exemple, le pain fabriqué avec des farines de substitution provenant de céréales qui ne sont pas considérées comme des sources de gluten peut être étiqueté sans gluten si toutes les autres exigences sont respectées.
Il est difficile de distinguer les aliments qui ont été spécialement transformés ou formulés sans gluten de ceux qui sont intrinsèquement sans gluten (par exemple, les craquelins fabriqués à partir de farine de riz). C'est pourquoi de nombreuses administrations internationales ont supprimé les aliments sans gluten de leurs cadres alimentaires diététiques spéciaux. Au lieu de cela, ces aliments sont réglementés en tant qu'aliments conventionnels, soumis à des exigences spécifiques d'étiquetage.
Il est important de noter que même les aliments qui ne contiennent pas d'ingrédients à base de gluten peuvent toutefois contenir du gluten en raison d'une contamination croisée au cours de la fabrication ou de la distribution. En 2012, des modifications réglementaires du RAD sont entrées en vigueur pour régler ce problème en renforçant les règles d'étiquetage pour les allergènes alimentaires, y compris les sources de gluten.
Dans le cadre modernisé proposé, les aliments sans gluten ne seraient pas considérés comme des AFDS, ce qui correspond mieux aux approches internationales. En outre, cela permettrait aux aliments sans gluten de continuer à appliquer les exigences actuelles en matière d'étiquetage pour les aliments préemballés conventionnels.
5.2.1 Exigences relatives à la composition
a) Exigences en matière d'enrichissement
Suivre un régime sans gluten peut augmenter le risque de carences en nutriments, en particulier pour certaines vitamines et certains minéraux qui doivent être ajoutés aux aliments de base contenant du gluten, mais pas aux aliments de substitution sans gluten. Par exemple, l'acide folique est obligatoire dans la farine blanche pour prévenir les anomalies du tube neural telles que le spina bifida, tandis que le calcium peut être ajouté volontairement à la farine blanche pour favoriser la santé des os.
Il n'y a pas d'obligation d'enrichissement pour les aliments de substitution sans gluten (par exemple, la farine sans gluten). Une exemption existe dans la partie D du RADRéférence 50, qui régit l'ajout de vitamines, de minéraux et d'acides aminés aux aliments. Cette exemption autorise l'enrichissement d'aliments sans gluten spécialement transformés ou formulés, pourvu qu'aucune norme spécifique ne soit prescrite dans le RAD et que ces aliments ne fassent pas l'objet d'une publicité auprès du grand public. Cette disposition ne précise pas les quantités d'enrichissement ni les nutriments spécifiques qui peuvent être ajoutés aux aliments enrichis sans gluten.
- Enrichissement facultatif en vitamines et minéraux nutritifs d'aliments sans gluten
Les intervenants de l'industrie ont fait part de leur confusion concernant la réglementation relative à l'enrichissement facultatif des aliments sans gluten, ce qui a incité l'ACIA à publier des directives en ligne. Selon ces directives, l'enrichissement des aliments sans gluten spécialement transformés ou formulés devrait viser à atteindre des teneurs en nutriments équivalentes à celles de la farine blanche, correspondant à la quantité de farine blanche remplacée. Les restrictions en matière de publicité visent à empêcher la publicité des aliments enrichis sans gluten comme étant supérieurs à leurs équivalents contenant du gluten.
L'exclusion des aliments sans gluten du cadre des AFDS nécessiterait des modifications de la disposition concernant l'enrichissement des aliments sans gluten. En supprimant l'obligation pour les aliments sans gluten d'être spécialement transformés ou formulés, les critères d'enrichissement peuvent s'appliquer à une gamme plus vaste d'aliments, ce qui accroît le risque d'enrichissement excessif dans l'approvisionnement alimentaire. Pour y remédier, de nouvelles restrictions seraient envisagées. Il pourrait s'agir de limiter l'enrichissement à certains aliments, comme les céréales et les produits de boulangerie, ou de spécifier les nutriments et les quantités qui peuvent être ajoutés aux aliments sans gluten pour obtenir une équivalence nutritionnelle.
5.2.2 Exigences d'étiquetage
a) Information nutritionnelle
La classification proposée des aliments sans gluten hors du cadre des AFDS signifierait que les exigences d'étiquetage nutritionnel pour les aliments conventionnels s'appliqueraient. Les aliments sans gluten continueront d'être tenus de fournir des renseignements sur la teneur en nutriments par l'intermédiaire d'un TVN et de se conformer aux exigences concernant l'étiquetage nutritionnel sur le devant de l'emballage, le cas échéant.
5.2.3 Exigences réglementaires supplémentaires pour les aliments sans gluten
a) Allégation d'absence de gluten sur l'étiquette
L'interdiction de présenter un aliment comme étant sans gluten s'il contient une forme quelconque de protéine de glutenRéférence 51 serait maintenue. Toutefois, en excluant les aliments sans gluten du cadre des AFDS, la gamme de produits autorisés à porter une allégation d'absence de gluten s'élargirait pour inclure les produits intrinsèquement sans gluten, et pas seulement ceux qui ont été spécialement transformés ou formulés pour être sans gluten. Cet élargissement pourrait simplifier les achats pour les personnes qui doivent suivre un régime sans gluten.
Par contre, il peut y avoir une crainte qu'élargir la gamme de produits autorisés à porter une allégation d'absence de gluten à tous les aliments, même s'il n'y a aucun risque de contamination avec du gluten (par exemple, une bouteille d'eau), pourrait avoir un effet halo de santé et influencer les décisions d'achat des consommateurs. Par conséquent, il peut être nécessaire de limiter l'utilisation de cette allégation à certain produits alimentaires où il existe une possibilité de teneur inhérente en gluten ou de contamination croisée.
b) Seuil concernant l'absence de gluten
L'article B.24.018 du RAD interdit l'utilisation d'allégations d'absence de gluten sur les aliments qui contiennent du gluten ou des protéines de gluten modifiées. Bien qu'aucun seuil spécifique ne soit mentionné dans le Règlement, Santé Canada considère que les aliments sans gluten préparés selon de bonnes pratiques de fabrication, dont la teneur en gluten ne dépasse pas 20 parties par million (ppm), répondent à l'objectif de santé et de sécurité de l'article B.24.018 lorsqu'une allégation « sans gluten » est faite. Ce seuil est confirmé par la Norme Codex pour les aliments diététiques ou de régime destinés aux personnes souffrant d'une intolérance au gluten (norme Codex 118-1979)Référence 52.
Afin de garantir la flexibilité et la capacité d'adaptation aux dernières données scientifiques et aux méthodes de détection du gluten, Santé Canada propose de maintenir cette recommandation dans les directives.
c) Restrictions en matière de publicité
Certains intervenants ont souligné que les restrictions en matière de publicité dissuadent les fabricants d'enrichir les aliments sans gluten. Afin de mieux faire connaître les aliments enrichis sans gluten et d'en faciliter l'accès, Santé Canada propose de supprimer les restrictions en matière de publicité pour ces produits.
5.3 Aliments nutritifs formulés
Cette catégorie proposée d'aliments nutritifs formulés (ANF) vise à englober les produits existants actuellement réglementés par le titre 24 en tant que SR et SN. Les SR sont destinés à remplacer un repas tandis que les SN sont destinés à compléter un régime alimentaire qui peut être insuffisant en énergie ou autres nutriments essentiels. Compte tenu de leurs objectifs semblables, on propose de fusionner ces deux catégories en une seule catégorie appelée ANF, avec la possibilité de les représenter en tant que substituts de repas formulés (SRF) lorsque certaines conditions sont satisfaites. Pour atteindre leur objectif, les ANF doivent fournir des quantités équilibrées de macronutriments et de micronutriments par rapport à l'énergie (kcal). En outre, les leçons retenues des LAMT émises pour ces produits, y compris les domaines communs de non-conformité réglementaire, ont contribué à l'élaboration de la proposition suivante.
Les produits destinés aux personnes qui ont généralement un régime alimentaire adéquat, comme ceux destinés aux personnes qui font de l'exercice (par exemple, les aliments pour sportifs), n'entrent pas dans la portée de ANF. Ces produits ne correspondent pas à l'objectif de cette catégorie, qui est de compléter un régime alimentaire qui peut être insuffisant en énergie ou en nutriments essentiels. Il serait plus approprié de classer ces produits dans la catégorie des aliments supplémentés, qui sont destinés à être consommés en plus d'un régime alimentaire typique qui répond déjà aux besoins nutritionnels de la plupart des Canadiens. En conséquence, les aliments supplémentés ont défini des quantités maximales pour les ingrédients supplémentaires, y compris les vitamines et les minéraux, qui témoignent de cette distinction.
Deux catégories sont proposées : Les ANF pour enfants et les ANF pour 14 ans ou plus. Même si de nombreuses exigences réglementaires s'appliquent aux deux catégories, les exigences prescrites relatives à la composition cadreraient avec les ANREF pour le groupe d'âge ciblé.
Les ANF pour 14 ans ou plus seraient subdivisés pour tenir compte de l'utilisation variée de ces produits, notamment en autorisant certains ANF à se présenter comme des substituts de repas, y compris ceux destinés à être utilisés dans le cadre de régimes amaigrissants. De même, les ANF pour enfants seraient subdivisés en deux sous-catégories, afin de tenir compte de la population cible des produits; toutefois, les ANF pour enfants ne seraient pas autorisés à être représentés en tant que SRF ou produits conçus pour être utilisés dans des régimes amaigrissants. Le tableau 2 fournit des informations sur les catégories et sous-catégories proposées pour les ANF.
| Categories | Aliments nutritifs formulés (ANF) | |||
|---|---|---|---|---|
| ANF pour enfants | ANF pour 14 ans ou plus | |||
| Sous-catégories | ANF pour 1 à 3 ans | ANF pour 1 à 13 ans | ANF fournissant de 150 à 199 kcal | ANF fournissant ≥200 kcal, ce qui inclut les produits représentés comme SRF, y compris ceux utilisés dans les régimes amaigrissants |
5.3.1 Aliments nutritifs formulés pour enfants
À l'heure actuelle, le titre 24 ne prévoit pas d'exigences relatives à la composition propres à l'âge pour les SN destinés aux enfants âgés d'un an ou plus. Au contraire, ces produits doivent répondre à des exigences relatives à la composition qui englobent les apports recommandés pour les adultes ou demander une LAMT pour permettre leur vente en dépit d'une non-conformité réglementaire causée par l'harmonisation aux ANREF pour les enfants. De nombreuses administrations internationales n'ont pas d'exigences prescrites pour ces produits, car leurs politiques d'enrichissement autorisent généralement leur fabrication en tant qu'aliments conventionnels.
Certaines administrations et organisations de santé estiment que les produits commercialisés sous les noms de « lait de croissance », « lait pour jeunes enfants » et « préparation pour jeunes enfants » ne sont pas nécessaires pour des enfants en bonne santé, soulignant qu'ils peuvent remplacer des aliments sains et qu'ils ne sont pas essentiels pour satisfaire les besoins en nutrimentsRéférence 53Référence 54. Santé Canada reconnaît qu'il peut y avoir des cas où ces produits sont utilisés par des enfants qui ne font pas l'objet d'une surveillance médicale comme un des moyens de compléter un régime alimentaire lorsqu'il est possiblement inadéquat en énergie et en nutriments essentiels. C'est pourquoi la présente proposition prévoit l'introduction d'une sous-catégorie pour les produits enrichis et à valeur énergétique équilibrée spécifiquement destinés aux enfants, dont les exigences relatives à la composition correspondent aux besoins nutritionnels de ce groupe d'âge particulier.
Pour répondre aux besoins nutritionnels spécifiques des jeunes enfants, deux sous-catégories d'ANF pour enfants sont proposées :
- ANF pour 1 à 3 ans
- ANF pour 1 à 13 ans
Alors que la plupart des exigences réglementaires pour les deux sous-catégories d'ANF pour enfants seraient les mêmes, il y aurait des variations dans les exigences en micronutriments entre ces deux sous-catégories. Cette distinction vise à englober la gamme de produits existants disponibles sur les marchés canadien et international, dans lesquels il existe des produits conçus exclusivement pour les enfants de 1 à 3 ans ou pour une sous-population pédiatrique plus large, y compris les enfants de 1 à 13 ans.
En établissant des exigences en micronutriments pour chaque sous-catégorie, les ANF peuvent être adaptés pour répondre aux besoins nutritionnels des jeunes enfants (1 à 3 ans) ou d'une tranche d'âge plus large (1 à 13 ans), conformément à la demande actuelle du marché. Cette approche permet de s'assurer que ces produits fournissent des nutriments adéquats tout en minimisant le risque d'excès de nutriments pour cette population vulnérable.
a) Définition
La définition suivante est proposée pour les ANF pour enfants :
aliment nutritif formulé pour enfants désigne un aliment formulé vendu ou présenté pour les enfants de 1 à 13 ans et conçu pour être consommé en complément d'un régime alimentaire lorsqu'il est possiblement insuffisant en énergie et en nutriments essentiels
b) Exigences relatives à la composition
Les exigences relatives à la composition des ANF pour les enfants seraient élaborées selon les derniers ANREF pédiatriques et seraient incorporées par renvoi au RAD.
- Exigences en énergie
On propose un minimum de 150 kcal par portion pour toutes les sous-catégories d'ANF pour enfants, ce qui cadrerait avec la teneur énergétique minimales actuelle des SN.
- Exigences en macronutriments
On propose de prescrire des exigences quantitatives pour les macronutriments afin de garantir que les ANF fournissent une alimentation équilibrée permettant de rencontrer l'utilisation prévue de ces produits. Les exigences actuelles en matière de macronutriments pour les SR et les SN seraient revues afin de tenir compte des ANREF actuels pour la sous-population pédiatrique et seraient incorporées par renvoi au RAD.
On propose que les ANF pour enfants soient tenus de respecter les exigences actuelles en matière de qualité de protéines pour les SN, conformément à l'alinéa B.24.201(1)(c).
- Exigences en matière d'enrichissement
Ajout obligatoire et facultatif de vitamines et minéraux nutritifs
Les ANF pour enfants sont destinés à compléter un régime alimentaire lorsqu'il peut être insuffisant en énergie ou en autres nutriments essentiels. Ces produits ne sont généralement pas consommés en plus d'un régime alimentaire normal, mais sont utilisés lorsque le régime alimentaire peut être insuffisant et remplacent donc les aliments habituellement consommés dans un régime normal. Il est donc important que ces produits fournissent un large éventail de nutriments afin de remplacer de manière adéquate la partie du régime alimentaire normal qui est déplacée.
Pour s'assurer que les besoins des consommateurs sont satisfaits lorsqu'ils utilisent des ANF au lieu d'aliments habituellement consommés dans le cadre d'un régime alimentaire normal, il est proposé que l'ajout de tous les micronutriments pour lesquels un ANR a été établi par la NASEM soit obligatoire. Si ces micronutriments ne sont pas présents dans les ANF, il pourrait y avoir un risque d'effets indésirables car il existe des preuves d'une relation de cause à effet entre l'apport de ces micronutriments et un indicateur d'adéquation, ainsi qu'une relation apport-réponse démontrée. D'autre part, il est proposé que l'ajout des micronutriments pour lesquels un AS a été établis par la NASEM soit facultatif. Si ces micronutriments ne sont pas présents dans l'ANF, le risque d'effets indésirables est faible puisque les carences sont soit rarement observées dans la population générale en bonne santé, ou uniquement provoquées artificiellement (par exemple, chez des individus nourris avec des régimes dépourvus du micronutriment en question). En outre, les ANF ne seront pas utilisés comme source unique de nutrition, de sorte que les consommateurs continueront à consommer ces micronutriments avec un AS à partir d'autres aliments ou suppléments.
Cette approche permet d'ajouter aux ANF pour enfants certains nutriments qui ne sont pas actuellement autorisés dans les SR ou les SN, comme la vitamine K et la choline. Certains nutriments actuellement facultatifs deviendraient obligatoires, comme le sélénium et le molybdène, tandis que d'autres qui sont obligatoires deviendraient facultatifs, comme l'acide pantothénique, la biotine, le manganèse et le sodium.
Quantités minimales de vitamines et de minéraux nutritifs
Pour les micronutriments qui sont facultatifs, on propose de ne pas prescrire de quantité minimale. Les quantités minimales prescrites pour les nutriments obligatoires s'appliqueraient à toutes les sources d'un nutriment, mais n'incluraient pas les excédents.
La quantité minimale en nutriments pour les ANF pour les enfants serait fixée à 15 % de l'ANR le plus élevé (le cas échéant) pour les groupes d'âge cibles respectifs, dans l'aliment tel que consommé. Ce niveau correspond à la quantité nécessaire pour obtenir une mention de « bonne source » pour la plupart des nutriments.
Quantités maximales de vitamines et de minéraux nutritifs
Les quantités maximales s'appliquent à toutes les sources du nutriment dans le produit, à l'exclusion de tout excédent. On propose que la quantité maximale pour la plupart des micronutriments soit fixée à 50 % de l'ANR ou de l'AS le plus élevé (le cas échéant) pour les groupes d'âge cibles respectifs, dans l'aliment tel que consommé. Cette approche vise à atténuer le risque d'effets indésirables causés par un apport excessif de nutriments, étant donné que de nombreux nutriments ont une fourchette étroite d'apports sûrs et peuvent entraîner des effets indésirables graves lorsqu'ils sont consommés de manière excessive. Pour la plupart des nutriments, 50 % de l'ANR ou de l'AS le plus élevé représentent moins de 25 % de l'AMT ou RRMC correspondant. Des ajustements à cette approche générale peuvent s'avérer nécessaires après la réalisation d'analyses de sécurité supplémentaires. Dans les cas où les nutriments ont des marges de sécurité plus étroites (c'est-à-dire, lorsque l'ANR ou l'AS le plus élevé est plus proche de l'AMT ou RRMC correspondant), des exceptions à l'approche générale peuvent être faites pour fixer des quantités maximales plus faibles.
Exception pour le potassium
En ce qui concerne la distinction proposée entre l'ajout obligatoire des micronutriments pour lesquels un ANR a été établi et l'ajout facultatif de micronutriments pour lesquels un AS a été établi, une exception est proposée pour le potassium. Même si le potassium n'a pas d'ANR établi, on propose que le potassium reste un nutriment dont l'ajout est obligatoire dans ces aliments. Cette décision est étayée par des données qui mettent en évidence la relation entre l'augmentation de l'apport en potassium et la diminution de la pression artérielle. Même si la littérature scientifique sur le lien entre l'apport en potassium et la pression artérielle chez l'enfant est limitée, compte tenu des données relatives à l'apport en potassium et à la régulation de la pression artérielle chez l'adulteRéférence 55, on propose de rendre le potassium obligatoire pour tous les ANF pour enfants.
Cependant, au lieu d'appliquer la même approche que celle utilisée pour les micronutriments avec un ANR, qui propose une quantité minimale de 15 % pour les ANF pour enfants, des quantités minimales plus faibles sont envisagées spécifiquement pour le potassium. La quantité minimale actuellement prescrite dans le RAD pour les SN est envisagée pour les ANF pour enfants, tandis que la quantité maximale proposée pour le potassium est de 50 % de l'AS.
Le tableau 3 présente un résumé des exigences en micronutriments proposés pour les ANF pour enfants.
| Sous-catégories d'ANF pour enfants | ||
|---|---|---|
| ANF pour 1 à 3 ans | ANF pour 1 à 13 ans | |
| Quantités minimales de micronutriments obligatoires | 15 % de l'ANR pour les enfants de 1 à 3 ans | 15 % de l'ANR le plus élevé pour les enfants de 1 à 13 ans |
| Quantités minimales de micronutriments facultatifs | S. O. | S. O. |
| Quantités maximales de micronutriments obligatoires et facultatifs | 50 % de l'ANR ou de l'AS pour les enfants de 1 à 3 ans | 50 % de l'ANR ou de l'AS le plus élevé pour les enfants de 1 à 13 ans |
Ajout facultatif d'acides aminés
L'utilisation de protéines d'origine végétale dans l'approvisionnement alimentaire est en augmentation. Il est difficile pour les produits qui utilisent des protéines d'origine végétale de répondre aux exigences actuelles de qualité des protéines pour les SR et les SN. Pour régler ce problème, on propose de permettre l'ajout des acides aminés essentiels aux ANF pour enfants afin d'améliorer la qualité des protéines et de répondre aux exigences en matière de qualité des protéines. Toutefois, la quantité d'acides aminés ajoutés ne peut excéder la quantité nécessaire pour répondre aux exigences de qualité des protéines. En outre, l'ajout d'acides aminés serait limité aux acides aminés essentiels sous forme L, car l'ajout d'acides aminés non essentiels n'améliore pas la qualité des protéines.
c) Exigences d'étiquetage
- Information nutritionnelle
On propose que les ANF pour enfants soient tenus de présenter un TVN. Ils seraient également soumis aux exigences générales en matière d'étiquetage des aliments préemballées, y compris l'utilisation d'un symbole nutritionnel lorsque le produit contient des gras saturés, des sucres ou du sodium à un niveau égal ou supérieur aux seuils spécifiés.
- Mentions obligatoires sur l'étiquette
Les ANF pour enfants devraient porter les mentions suivantes sur l'étiquette :
- Indication que le produit n'est pas destiné à être utilisé comme source unique d'alimentation
- Tranche d'âge de l'utilisateur prévu du produit (par exemple, pour 1 à 3 ans, pour 1 à 13 ans, ou pour les groupes d'âge compris dans cette tranche, comme 1 à 10 ans)
- Indication que le produit n'est pas destiné aux enfants de moins d'un an
- Indication que l'aliment est destiné à être l'un des moyens de compléter un régime alimentaire lorsque les apports d'énergie et de nutriments ne sont peut-être pas suffisants pour répondre aux besoins d'un individu
Ces mentions visent à clarifier l'utilisation prévue de l'aliment et à distinguer ces produits des préparations pour nourrissons et des aliments supplémentés.
- Mentions interdites sur l'étiquette
En ce qui concerne les préparations pour nourrissons, outre la tranche d'âge de l'utilisateur du produit (par exemple, 0 à 6 mois, 6 à 12 mois), les entreprises ajoutent souvent volontairement la mention « Étape 1 » ou « Étape 2 » pour aider le responsable des soins à distinguer les produits pour les bébés de 0 à 6 mois de ceux destinés aux bébés de 6 à 12 mois. Quant aux ANF pour enfants, on propose d'interdire l'étiquetage des produits faisant partie d'une gamme de préparations pour nourrissons échelonnées (par exemple, étape 3 ou 4). Cette stratégie de commercialisation pose un défi aux responsables des soins qui ont de la difficulté à distinguer les préparations pour nourrissons des ANF pour enfantsRéférence 56, ce qui peut faire en sorte que les nourrissons sont nourris avec des ANF pour enfants.
L'étiquetage des ANF pour enfants dans le cadre d'une gamme de préparations pour nourrissons échelonnées peut également laisser entendre que ces produits sont nécessaires, ou devraient être fournis, une fois que le nourrisson est sevré. Cependant, il n'y a pas de recommandation pour la consommation de ces produits par les enfants âgés de 12 mois ou plus.
d) Représentation et publicité
Les ANF pour enfants ne peuvent pas être présentés (c'est-à-dire, étiquetés ou annoncés) comme :
- Un substitut de repas: les enfants devraient manger une variété d'aliments recommandés par le Guide alimentaire canadien. L'utilisation des ANF comme substituts de repas pour enfants (destinés à remplacer un ou plusieurs repas quotidiens) peut entraîner le remplacement d'une proportion importante d'aliments sains dans le régime alimentaire, ce qui va à l'encontre des recommandations alimentaires. Les ANF pour enfants sont destinés à compléter un régime alimentaire lorsqu'il est peut-être insuffisant en énergie et en nutriments essentiels.
- Un ANF présenté en vue d'une utilisation dans un régime amaigrissant : lorsqu'on envisage de faire perdre du poids à un enfant, il est important de consulter un professionnel de la santé afin de s'assurer que son régime alimentaire lui fournit un apport nutritionnel adéquat pour sa croissance et son développement.
- Boisson végétale enrichie ou substitut du lait de vache: les boissons végétales enrichies sont soumises à des exigences spécifiques définies dans une politique provisoire. Cette politique soutient un enrichissement facultatif afin d'atteindre des niveaux comparables à ceux du lait de vache, ce qui permet à ces boissons de se positionner comme un substitut approprié au lait de vache.
- Un substitut du lait humain: les produits destinés à remplacer le lait humain entrent dans la catégorie réglementaire des préparations pour nourrissons et sont soumis à des exigences spécifiques relatives à la composition.
5.3.2 Aliments nutritifs formulés pour 14 ans ou plus
Les ANF pour 14 ans ou plus sont destinés à compléter un régime alimentaire qui peut être insuffisant en énergie et en nutriments essentiels. Cette proposition introduit deux sous-catégories distinctes d'ANF, déterminées par le contenu énergétique des produits : les ANF fournissant de 150 à 199 kcal par portion et les ANF fournissant ≥200 kcal par portion. Cette classification vise à garantir que les consommateurs peuvent avoir accès à des produits qui contribuent à satisfaire leurs besoins énergétiques tout en fournissant des nutriments essentiels dans des proportions appropriées.
En outre, les ANF fournissant ≥200 kcal par portion seraient autorisés à être commercialisés et vendus en tant que substituts de repas formulés (SRF), y compris ceux présentés comme pouvant être utilisés dans les régimes amaigrissants, lorsque certaines conditions sont satisfaites. Ces exigences supplémentaires visent à clarifier et à soutenir leur utilisation en tant que substituts de repas. Toutefois, les exigences relatives à la composition des SRF seraient conformes à celles des ANF qui fournissent ≥200 kcal par portion, comme il est indiqué dans la section suivante.
a) Définition
La définition suivante est proposée pour les ANF pour 14 ans ou plus :
aliment nutritif formulé pour 14 ans ou plus désigne un aliment formulé vendu ou présenté pour des personnes âgées de 14 ans ou plus, conçu pour être consommé en complément d'un régime alimentaire lorsqu'il peut être insuffisant en énergie et en nutriments essentiels ou en remplacement d'un ou de plusieurs repas quotidiens, mais pas de tous les repas quotidiens
b) Exigences relatives à la composition
Les exigences existantes relatives à la composition pour les SR et les SN seraient révisées afin de refléter les ANREF actuels pour 14 ans ou plus. Les exigences relatives à la composition seraient incorporées par renvoi au RAD. Les exigences relatives à la composition proposées ci-après s'appliqueraient à tous les ANF pour 14 ans ou plus, y compris ceux présentés sous forme de SRF, ainsi qu'à ceux présentés sous forme de SRF destinés à être utilisés dans les régimes amaigrissants.
- Exigences en énergie
On propose que toutes les sous-catégories d'ANF pour 14 ans ou plus fournissent un minimum de 150 kcal par portion, ce qui cadrerait avec les exigences énergétiques minimales actuelles pour les SN. Toutefois, comme indiqué précédemment, une sous-catégorie d'ANF pour 14 ans ou plus est proposée pour les produits qui fournissent ≥200 kcal par portion.
Seules les ANF pour 14 ans ou plus qui fournissent ≥200 kcal par portion seraient autorisées à être représentées en tant que SRF. Ce seuil proposé en énergie est inférieur de 25 kcal au seuil minimal actuel pour les SR. Cet ajustement vise à s'harmoniser aux exigences minimales en matière de SR dans d'autres administrations, en favorisant le commerce et en améliorant l'accès aux produits importés.
- Exigences en macronutriments
On propose de maintenir les exigences quantitatives pour les macronutriments afin de garantir que les ANF pour 14 ans ou plus fournissent une alimentation équilibrée permettant de rencontrer l'utilisation prévue de ces produits. Les exigences actuelles en macronutriments pour les SR et les SN seraient révisées afin de refléter les ANREF actuels.
On propose que les ANF pour 14 ans ou plus soient tenus de respecter les exigences actuelles en matière de qualité de protéines pour les SR, conformément à l'alinéa B.24.200(1)(e).
En outre, le respect des exigences en matière de macronutriments peut aider les consommateurs à distinguer les ANF des aliments supplémentés, qui peuvent fournir une variété de micronutriments, mais n'ont pas d'exigences spécifiques en matière de macronutriments.
- Exigences en matière d'enrichissement
Ajout obligatoire et facultatif de vitamines et minéraux nutritifs
Les ANF pour 14 ans ou plus sont destinés à compléter un régime alimentaire lorsqu'il peut être insuffisant en énergie ou en autres nutriments essentiels, ou dans certains cas, à remplacer un repas. Dans les deux cas, ces produits ne sont généralement pas consommés en plus d'un régime alimentaire normal, mais ils sont utilisés à la place d'aliments habituellement consommés dans le cadre d'un régime alimentaire normal. Il est donc important que ces produits fournissent un large éventail de nutriments afin de remplacer de manière adéquate la partie du régime alimentaire habituel qui est déplacée.
Comme pour les ANF pour enfants, on propose que l'ajout de tous les micronutriments pour lesquels un ANR a été établi par la NASEM soit obligatoire, tandis que l'ajout des micronutriments pour lesquels un AS a été établi soit facultatif. Cela signifie que certains micronutriments qui ne sont pas actuellement autorisés dans ces produits le seraient dans le cadre de la réglementation modernisée, comme la vitamine K et la choline. En outre, certains nutriments actuellement facultatifs deviendraient obligatoires, comme le sélénium et le molybdène, tandis que d'autres qui sont obligatoires deviendraient facultatifs, comme l'acide pantothénique, la biotine, le manganèse et le sodium.
Quantités minimales de vitamines et de minéraux nutritifs
Pour les micronutriments dont l'ajout est facultatif, on propose de ne pas prescrire de quantité minimale. Les quantités minimales prescrites pour les nutriments obligatoires s'appliqueraient à toutes les sources d'un nutriment, mais n'incluraient pas les excédents.
Les quantités minimales de nutriments obligatoires seraient fondées sur la teneur en calories de l'aliment, ce qui garantirait une source équilibrée d'alimentation (c'est-à-dire, que les ANF qui fournissent plus d'énergie doivent fournir plus de micronutriments). Plus précisément, les quantités minimales pour les ANF fournissant de 150 à 199 kcal par portion seraient fixées à 15 % de l'ANR le plus élevé pour les personnes âgées de 14 ans ou plus, dans l'aliment tel que consommé. Ce niveau correspond à la quantité nécessaire pour porter la mention de « bonne source » pour la plupart des nutriments. En revanche, les quantités minimales pour les ANF fournissant ≥200 kcal par portion, qui sont permis d'être présentés en tant que SRF, fourniraient au moins 25 % de l'ANR le plus élevé pour les groupes d'âge cibles applicables, dans l'aliment tel que consommé. Ces quantités supposent qu'une personne a généralement quatre occasions de manger par jour, dont trois repas et une collation, et qu'un ANF représenté en tant que SRF remplacerait une occasion de manger. Il est donc approprié que ces produits fournissent 25 % des besoins en micronutriments.
Quantités maximales de vitamines et de minéraux nutritifs
Ces quantités maximales s'appliquent à toutes les sources du nutriment dans le produit, à l'exclusion de tout excédent. On propose que la quantité maximale pour la plupart des micronutriments soit fixée à 50 % de l'ANR ou de l'AS le plus élevé (le cas échéant) pour les groupes d'âge cibles respectifs, dans l'aliment tel que consommé. Toutefois, dans les cas où les nutriments ont des marges de sécurité plus étroites (c'est-à-dire, lorsque l'ANR ou l'AS le plus élevé est plus proche de l'AMT ou RRMC correspondant), des exceptions à l'approche générale peuvent être faites pour fixer des quantités maximales plus faibles.
Exception pour le potassium
Comme on l'a noté pour les ANF pour enfants, même si le potassium n'a pas d'ANR établi, on propose que l'ajout de potassium soit obligatoire pour les ANF pour 14 ans ou plus. Cependant, au lieu d'appliquer la même approche que celle utilisée pour les micronutriments avec un ANR établi, des quantités minimales plus faibles sont envisagées spécifiquement pour le potassium. La quantité minimale actuellement prescrite dans le RAD pour les SN est envisagée pour les ANF fournissant de 150 à 199 kcal par portion, tandis que la quantité minimale actuellement prescrite pour les SR dans le RAD est envisagée pour les ANF fournissant ≥200 kcal par portion. Le montant maximal proposé pour le potassium est de 50 % de l'AS.
Le tableau 4 présente un résumé des exigences en micronutriments proposées pour les ANF pour 14 ans ou plus.
| Sous-catégories d'ANF pour 14 ans ou plus | ||
|---|---|---|
| ANF fournissant de 150 à 199 kcal par portion | ANF fournissant ≥200 kcal par portion | |
| Quantités minimales de micronutriments obligatoires | 15 % de l'ANR le plus élevé pour les personnes âgées de 14 ans ou plus | 25 % de l'ANR le plus élevé pour les personnes âgées de 14 ans ou plus |
| Quantités minimales de micronutriments facultatifs | S. O. | S. O. |
| Quantités maximales de micronutriments obligatoires et facultatifs | 50 % de l'ANR ou de l'AS le plus élevé pour les personnes âgées de 14 ans ou plus | |
Ajout facultatif d'acides aminés
On propose de permettre l'ajout des acides aminés essentiels aux ANF pour 14 ans ou plus afin d'améliorer la qualité des protéines et de répondre aux exigences en matière de qualité des protéines. Toutefois, la quantité d'acides aminés ajoutés ne peut excéder la quantité nécessaire pour répondre aux exigences de qualité des protéines. En outre, l'ajout d'acides aminés serait limité aux acides aminés essentiels sous forme L, car l'ajout d'acides aminés non essentiels n'améliore pas la qualité des protéines.
c) Exigences d'étiquetage
- Information nutritionnelle
On propose que les ANF pour 14 ans ou plus soient tenus de présenter un TVN. Ainsi, ils seraient également soumis aux exigences générales en matière d'étiquetage des aliments préemballées, y compris l'utilisation d'un symbole nutritionnel. Des analyses supplémentaires seront effectuées afin de déterminer comment le symbole nutritionnel sera appliqué à ces produits.
- Mentions obligatoires sur l'étiquette
Les ANF pour 14 ans ou plus, y compris ceux présentés comme SRF, devraient porter une mention indiquant que le produit n'est pas recommandé aux personnes de moins de 14 ans. Si un ANF est destiné aux enfants de moins de 14 ans, il convient d'appliquer les exigences propres aux ANF pour enfants, car celles-ci sont fondées sur les ANREF pédiatriques.
Aliments nutritifs formulés qui ne sont pas présentées comme des substituts de repas formulés
Quant aux ANF pour 14 ans ou plus qui ne sont pas présentés comme SRF, l'étiquette devrait indiquer que l'aliment est destiné à être l'un des moyens de compléter un régime alimentaire dans lequel les apports d'énergie et de nutriments ne sont peut-être pas suffisants pour répondre aux besoins d'un individu.
Les exigences relatives à la composition des ANF pour 14 ans ou plus sont fondées sur l'hypothèse qu'ils sont utilisés pour remplacer un repas ou compléter un régime alimentaire inadéquat en énergie et en nutriments essentiels. La consommation d'ANF parallèlement à un régime alimentaire déjà adéquat ou riche en énergie/nutriments pourrait conduire à un apport excessif de nutriments. Cette mention sur l'étiquette garantit que les ANF sont utilisés de manière appropriée pour favoriser une alimentation saine et répondre aux besoins des personnes ayant besoin d'un apport supplémentaire en énergie et en nutriments.
Substituts de repas formulés
On propose d'exiger que les produits présentés comme SRF portent une indication selon laquelle le produit n'est pas destiné à remplacer tous les repas quotidiens. Cette mention serait nécessaire parce que les exigences relatives à la composition proposées pour les ANF ne sont pas fondées sur l'utilisation du produit comme source unique d'alimentation. Il convient également de noter que les aliments destinés à être la source unique d'alimentation sont réglementés dans le cadre des AFDS et soumis à des exigences réglementaires différentes pour garantir une consommation sûre.
5.4 Aliments présentés en vue d'une utilisation dans les régimes amaigrissants
On propose de conserver, dans le cadre réglementaire modernisé, la disposition actuelle qui autorise la représentation de certains aliments en vue d'une utilisation dans les régimes amaigrissantsRéférence 57. Il s'agit notamment des aliments suivants :
- Substituts de l'alimentation totale pour perte de poids
- Substituts de repas formulés
- Repas préemballés
- Aliments vendus par une clinique d'amaigrissement à ses clients dans le cadre d'un programme d'amaigrissement supervisé par le personnel de la clinique
Alors que les SAT pour perte de poids sont une catégorie proposée d'AFDS, puisqu'ils sont destinés à être utilisés sous surveillance médicale et comme source unique d'alimentation, les trois autres catégories d'aliments qui seraient autorisées à être représentées en vue d'une utilisation dans les régimes amaigrissants ne seraient pas des AFDS, et ne seraient donc pas autorisées à être présentées en vue d'une utilisation comme source principale ou unique d'alimentation.
Les détails concernant ces trois catégories supplémentaires d'aliments qui seraient autorisées à être représentées en vue d'une utilisation dans les régimes amaigrissants sont présentés dans les trois sections suivantes, suivis d'une section décrivant les exigences réglementaires supplémentaires applicables à l'ensemble de ces aliments.
5.4.1 Substituts de repas formulés présentés en vue d'une utilisation dans les régimes amaigrissants
On propose que, conformément à l'approche actuelle, les SRF soient autorisés à être présentés en tant qu'adéquats pour les régimes amaigrissants, à condition qu'ils satisfassent aux exigences réglementaires supplémentaires applicables aux aliments présentés en vue d'une utilisation dans les régimes amaigrissants.
Les SRF destinés à une utilisation dans les régimes amaigrissants seraient soumis aux exigences relatives à la composition des ANF qui fournissent ≥200 kcal par portion, ainsi qu'aux exigences d'étiquetage des ANF qui se présentent comme des SRF, comme indiqué à la sous-section 5.3.2 Aliments nutritifs formulés pour 14 ans ou plus. En plus de ces exigences, les SRF présentés en vue d'une utilisation dans les régimes amaigrissants doivent satisfaire à des exigences réglementaires supplémentaires qui sont décrites à la sous-section 5.4.4 Exigences réglementaires supplémentaires pour les aliments présentés en vue d'une utilisation dans les régimes amaigrissants.
5.4.2 Repas préemballés
a) Définition révisée
La définition actuelle d'un repas préemballé se trouve dans le titre 1 du RAD et n'est pas spécifique aux repas préemballés qui sont présentés en vue d'une utilisation dans les régimes amaigrissants. Cette définition est fondée sur les recommandations alimentaires de la version de 1992 du Guide alimentaire canadien et comprend l'obligation de fournir au moins une portion de : a) viande, poisson, volaille, légumineuses, noix, graines, œufs ou lait ou produits laitiers autres que le beurre, la crème, la crème acidulée, la crème glacée, le lait glacé et le sorbet; et b) légumes, fruits ou produits céréaliers. Cependant, la version de 2019 du Guide alimentaire canadien a adopté une nouvelle approche à l'égard des lignes directrice en matière d'alimentation en s'éloignant des tailles de portions conventionnelles et des recommandations de portions spécifiques.
Dans le cadre des modifications réglementaires apportées au RAD pour l'étiquetage nutritionnel sur le devant de l'emballage, une définition révisée de repas préemballé a été proposée dans la Gazette du Canada, Partie I, volume 152, numéro 6. Toutefois, les intervenants de l'industrie ont fait remarquer que de nombreux repas préemballés destinés à une utilisation dans le cadre de régimes amaigrissants ne seraient plus considérés comme des repas préemballés dans le cadre de la définition proposée. Compte tenu de ces commentaires, Santé Canada a décidé de ne pas procéder aux modifications proposées à la définition et a indiqué le besoin de réévaluer les révisions proposées à la définition de repas préemballé dans le contexte de la modernisation du titre 24.
Depuis lors, le Ministère a réexaminé la définition d'un repas préemballé et, suivant les directives de la version de 2019 du Guide alimentaire canadien, propose qu'un repas préemballé ne prescrive pas de tailles de portions ou de portions spécifiques de groupes d'aliments. De plus, les commentaires des intervenants reçus dans le cadre du processus de consultation sur l'étiquetage nutritionnel sur le devant de l'emballage indiquaient que l'intention sous-jacente à l'exigence qu'un repas préemballé « ne requiert aucune autre préparation que le réchauffage » n'est pas clair. En réponse, et reconnaissant que certain produits, tels que les repas déshydratés, pourraient exiger l'ajout d'eau, il est proposé de restreindre la définition aux aliments qui n'exigent pas l'ajout d'ingrédients (autres que de l'eau), plutôt qu'aux aliments qui ne requièrent aucune autre préparation que le réchauffage. En outre, une partie du libellé de la définition a été mise à jour par souci d'uniformité avec les autres termes réglementaires nouvellement ajoutés, tel que « préemballé en portion individuelle », et avec la description des catégories d'aliments qui correspondent à celles de la définition d'un « plat principal ».
La définition révisée suivante est proposée pour les repas préemballés :
repas préemballé désigne un produit préemballé en portion individuelle qui ne requiert pas l'ajout d'ingrédients autres que de l'eau, pour sa préparation, qui est présenté comme un repas et qui
- contient des aliments d'au moins une des catégories suivantes:
- les produits laitiers ainsi que leurs substituts, autres que le beurre, la crème, la crème sure, la crème glacée, le lait glacé, le sorbet laitier et leurs substituts; ou
- les produits de viandes, les produits de volaille et produits d'animaux marins et d'eau douce visés au titre 21 ainsi que leurs substituts, dont les œufs, le tofu, les légumineuses, les fruits à écale, les graines, les beurres de fruits à écale ou de graines et les tartinades de légumineuses; et
- contient des aliments d'au moins une des catégories suivantes:
- les fruits et légumes, autres que les pickles, les cornichons, les achards (relish), les olives et les garnitures; ou
- les pains, les céréales à déjeuner, le riz et autres grains et les pâtes alimentaires
b) Exigences relatives à la composition
On propose que les repas préemballés présentés en vue d'une utilisation dans les régimes amaigrissants soient soumis à certaines exigences relatives à la composition afin de garantir un apport énergétique et protéique adéquat par une consommation contrôlée d'aliments.
- Exigences en énergie
À l'instar des SRF qui sont présentés en vue d'une utilisation dans les régimes amaigrissants, on propose que les repas préemballés qui sont présentés en vue d'une utilisation dans les régimes amaigrisssants soient tenus de fournir un minimum de 200 kcal par portion.
- Exigences en macronutriments
On propose que les exigences en glucides et en lipides ne soient pas prescrites, afin de favoriser la diversité des aliments représentés sous forme de repas préemballés en vue d'une utilisation dans les régimes amaigrissants. Toutefois, étant donné qu'un apport adéquat en protéines est un élément important d'un régime de réduction de poids, on propose que les repas préemballés en vue d'une utilisation dans les régimes amaigrissants soient tenus de respecter les exigences actuelles en matière de protéines pour les SR, conformément à l'alinéa B.24.200(1)(e).
- Exigences en matière d'enrichissement
Conformément à l'approche actuelle, on propose que les repas préemballés ne soient pas autorisés à être enrichis.
c) Exigences d'étiquetage
- Information nutritionnelle
On propose que ces aliments conservent leurs exigences actuelles en matière d'étiquetage nutritionnel pour les aliments préemballés décrites dans la partie B du RAD (c'est-à-dire, qu'ils présentent un TVN et un symbole nutritionnel lorsque le produit contient des gras saturés, des sucres ou du sodium à des niveaux égaux ou supérieurs aux seuils spécifiés).
5.4.3 Aliments vendus dans les cliniques d'amaigrissement
a) Définition
Il n'existe pas de définition réglementaire pour les aliments vendus par une clinique d'amaigrissement à ses clients dans le cadre d'un programme de perte de poids supervisé par le personnel de la clinique. Toutefois, compte tenu du niveau de détail fourni dans le nom de la catégorie de produits, l'introduction d'une définition pour cette catégorie d'aliments n'est pas nécessaire.
b) Exigences relatives à la composition
On propose de ne pas prescrire d'exigences relatives à la composition pour les aliments vendus dans les cliniques d'amaigrissement, afin de favoriser la diversité des options alimentaires pouvant être utilisées dans le cadre d'un programme de perte de poids. En outre, conformément à l'approche actuelle, on propose que les aliments vendus dans les cliniques d'amaigrissement ne soient pas autorisés à être enrichis.
c) Exigences d'étiquetage
- Information nutritionnelle
On propose que ces aliments conservent leurs exigences actuelles en matière d'étiquetage nutritionnel pour les aliments préemballés décrites dans la partie B du RAD (c'est-à-dire, qu'ils présentent un TVN et un symbole nutritionnel lorsque le produit contient des gras saturés, des sucres ou du sodium à des niveaux égaux ou supérieurs aux seuils spécifiés).
5.4.4 Exigences réglementaires supplémentaires pour les aliments présentés en vue d'une utilisation dans les régimes amaigrissants
Outre les exigences réglementaires propres aux catégories de produits décrites ci-dessus, les exigences réglementaires supplémentaires suivantes sont proposées pour tous les aliments présentés en vue d'une utilisation dans les régimes amaigrissants, à l'exception de la catégorie proposée dans le cadre des AFDS, c'est-à-dire les SAT pour perte de poids qui seraient formulés pour fournir une source unique d'alimentation et qui sont destinés à être utilisés sous surveillance médicale.
a) Exigences d'étiquetage
- Mentions obligatoires sur l'étiquette
On propose de maintenir les exigences actuelles pour les produits qui font des allégations relatives à la perte de poids, en exigeant la mention « Utile pour perdre du poids uniquement dans le cadre d'un régime à faible teneur en énergie » sur l'étiquette du produit.
On propose également que l'étiquette du produit comporte :
- Une mention indiquant que le produit n'est pas destiné à remplacer tous les repas quotidiens
- Une mention indiquant que le produit n'est pas recommandé aux personnes âgées de moins de 18 ans
Ces produits ne visent pas à remplacer tous les repas quotidiens. Les produits présentés comme une source principale ou unique d'alimentation sont réglementés par le cadre proposé pour les AFDS et sont soumis à des exigences différentes afin de garantir un apport nutritionnel sûr et adéquat. En outre, un aliment faisant l'objet d'une allégation relative à la perte de poids ne peut être destiné à une utilisation par des enfants ou des adolescents. Les personnes de moins de 18 ans qui envisagent de perdre du poids doivent consulter un professionnel de la santé afin de s'assurer que leur régime alimentaire leur apporte les nutriments nécessaires à leur croissance et à leur développement.
- Mentions interdites sur l'étiquette
Les étiquettes d'aliments présentés en vue d'une utilisation dans le cadre de régimes amaigrissants ne pourraient inclure des mentions faisant référence au rythme ou à la quantité de perte de poids qui peut résulter. Ces résultats sont très individuels et dépendent de facteurs comme l'apport quotidien total en calories du consommateur. En outre, un rythme sain ou une quantité saine de perte de poids doit être déterminé en consultation avec un professionnel de la santé. Restreindre ce type de mentions sur les étiquettes permettrait d'éviter les allégations trompeuses.
- Exemple de menu sur sept jours
On propose de maintenir l'obligation de fournir un menu-type de sept jours pour les aliments présentés en vue d'une utilisation dans les régimes amaigrissants. La présentation d'un menu est essentielle pour les produits présentés en vue de la perte de poids, puisque la perte de poids est obtenue par une réduction constante de l'apport énergétique plutôt que seulement par la consommation du produit. Le fait de suivre un menu sur sept jours aiderait les consommateurs à perdre du poids de manière saine en les guidant vers une consommation d'énergie réduite tout en garantissant l'apport de nutriments essentiels et des niveaux d'énergie adéquats. L'apport énergétique minimal de 1 200 kcal par jour serait maintenu; toutefois, il incomberait au fabricant de veiller à ce que le menu soit fondé sur les principes du Guide alimentaire canadien et sur une perte de poids saine, et de s'assurer que les besoins énergétiques et les besoins en macronutriments et micronutriments sont satisfaits sans dépasser les limites supérieures (c'est-à-dire, les apports quotidiens supérieurs à l'AMT ou RRMC) pour les groupes cibles.
Actuellement, l'étiquette du produit doit inclure un menu-type de sept jours. Toutefois, les fabricants ont fait part de leurs difficultés à se conformer à cette exigence, en raison de l'espace limité sur l'emballage. Cette exigence a été établie il y a plusieurs décennies et ne tient pas compte de l'utilisation généralisée et l'accessibilité d'Internet à l'heure actuelle. Par conséquent, les modifications proposées permettraient à l'étiquette du produit d'inclure un site Web où le menu-type de sept jours peut être consulté.
6.0 Conclusion
La proposition de modernisation des titres 24 et 25 du RAD constitue une étape importante pour garantir la sécurité, la suffisance nutritionnelle et l'accessibilité des AFDS et des autres aliments régis par ces titres au Canada. La réglementation existante s'est révélée désuète et rigide, ce qui limite la disponibilité des produits innovants approuvés dans d'autres pays et rend le Canada vulnérable aux pénuries.
Pour remédier à ces problèmes, l'initiative de modernisation propose une restructuration complète des exigences réglementaires. Un aspect essentiel est la distinction claire entre les AFDS et les produits qui n'en sont pas. Les AFDS feraient l'objet d'une surveillance réglementaire supplémentaire tout au long de leur cycle de vie, y compris d'une autorisation préalable à la mise en marché pour la plupart des AFDS pour bébés ainsi que des dispositions d'interdiction de vente pour tous les AFDS afin de s'assurer de protéger la santé publique. En outre, la proposition comprend des dispositions concernant les pénuries, qui obligent les parties réglementées à signaler les pénuries à Santé Canada et facilitent l'accès à des produits sûrs grâce à un cadre d'importation exceptionnel.
Cette proposition mettrait à jour les exigences relatives à la composition pour toutes les catégories de produits, le cas échéant, afin de refléter les plus récents ANREF. Lorsque jugé acceptable, ces exigences seraient incorporées par renvoi, permettant une approche plus souple dans laquelle les modifications futures pourraient être apportées administrativement pour témoigner des progrès scientifiques. En outre, les exigences relatives à la composition pour les AFDS permettraient des dérogations lorsque cela est justifié sur le plan médical, sous réserve d'un examen lors de l'autorisation préalable à la mise en marché pour la plupart des AFDS pour bébés.
La proposition vise également à améliorer les exigences en matière d'étiquetage des AFDS, en exigeant des renseignements détaillés sur le produit pour une utilisation sûre et une distinction par rapport aux produits qui ne sont pas des AFDS. L'étiquetage des produits qui ne sont pas des AFDS cadrerait mieux avec les exigences pour les aliments préemballés conventionnels, y compris l'utilisation du TVN et de symboles nutritionnels, le cas échéant. Les symboles nutritionnels sur le devant de l'emballage permettent aux Canadiens d'identifier plus facilement les aliments élevés en nutriments préoccupants pour la santé publique, notamment le sodium, le gras saturé et les sucres, afin qu'ils puissent prendre des décisions plus saines et mieux éclairées.
En outre, l'effort de modernisation cadre avec la modification de 2019 de la Loi sur les aliments et drogues, qui introduit le terme AFDS pour permettre l'élaboration d'un cadre réglementaire pour les essais cliniques chez l'humain de ces produits. En modernisant le Règlement, le Canada peut favoriser la recherche et le développement dans ce secteur essentiel et améliorer l'accès aux produits disponibles dans d'autres pays. En outre, l'harmonisation des exigences aux administrations internationales, lorsque cela est possible, et au contexte réglementaire canadien améliorerait l'accès des Canadiens aux produits nutritifs essentiels.
En conclusion, la modernisation réglementaire proposée pour les titres 24 et 25 du RAD démontre une approche exhaustive pour répondre aux limites et aux défis actuels de la réglementation des AUDS et des aliments pour bébés. En favorisant la flexibilité, en s'alignant sur les progrès scientifiques et en encourageant l'innovation, l'initiative de modernisation maintiendrait la sécurité des produits tout en augmentant leur accessibilité pour favoriser un marché plus diversifié. Cette diversité permettrait d'atténuer le risque de pénurie à l'avenir et d'assurer la santé et le bien-être de tous les Canadiens, en particulier des groupes vulnérables qui dépendent de produits nutritifs spécialisés. L'engagement de Santé Canada à l'égard de la modernisation réglementaire souligne son dévouement envers la santé publique, en s'assurant que les Canadiens continuent d'avoir accès à des aliments de haute qualité, sûrs et nutritifs répondant à leurs besoins alimentaires uniques.
Annexe 1 : Lexique
Apports nutritionnels de référence
Les ANREF sont un ensemble de valeurs nutritionnelles de référence scientifiquement fondées pour des populations en bonne santé. Ils ont été établis par des scientifiques canadiens et américains dans le cadre d'un processus d'examen supervisé par le NASEM, un organisme non gouvernemental indépendant situé aux États-Unis. Les gouvernements américain et canadien parrainent conjointement l'élaboration des ANREF depuis 1994.
Les ANREF constituent une part importante des données probantes qui sous-tendent les activités gouvernementales telles que l'élaboration de normes réglementaires, l'évaluation des apports alimentaires, l'évaluation de la sécurité des produits alimentaires et l'élaboration d'orientations en matière d'alimentation pour la population générale et pour des groupes de personnes à des stades spécifiques de la vie.
Les principaux types de valeurs de référence des ANREF sont le besoin moyen estimatif (BME), l'apport nutritionnel recommandé (ANR), l'apport suffisant (AS), l'apport maximal tolérable (AMT) et l'apport lié à une réduction du risque de maladie chronique (RRMC).
- Le BME est l'apport nutritionnel quotidien moyen estimé pour combler les besoins de la moitié des individus en bonne santé appartenant à un groupe donné, défini en fonction de l'étape de la vie et du sexe. Un critère spécifique d'apport suffisant est utilisé pour déterminer le BME. Le BME est utilisé pour calculer l'ANR.
- L'ANR est une estimation de l'apport nutritionnel quotidien moyen minimum permettant de combler les besoins nutritionnels de la quasi-totalité (97 à 98 %) des individus en bonne santé appartenant à un groupe donné, défini en fonction de l'étape de la vie et du sexe. L'utilisation principale de l'ANR est en tant qu'objectif de consommation usuelle chez les individus. Puisque l'ANR est calculé selon le BME, l'ANR peut seulement être fixé pour un nutriment particulier s'il y a suffisamment de données scientifiques pour établir un BME pour ce nutriment.
- L'AS est l'apport quotidien moyen recommandé en s'appuyant sur des observations, des expérimentations ou des estimations approximatives de l'apport nutritionnel chez un ou plusieurs groupes de personnes apparemment en bonne santé qui semblent conserver un statut nutritionnel adéquat. On fixe un AS lorsqu'on ne dispose pas de données scientifiques suffisantes pour fixer le BME qui permet ensuite de fixer l'ANR. L'AS est fondé sur beaucoup moins de données et intègre beaucoup plus de jugement qu'utilisé pour établir un BME et ensuite un ANR. L'élaboration d'un AS indique que plus d'études sont requises pour déterminer, avec une certaine confiance, la moyenne et la distribution des besoins pour ce nutriment spécifique. L'AS devrait être égale ou supérieur aux besoins de la plupart des individus en fonction d'une étape de la vie et d'un sexe spécifique. L'AS peut être utilisé en tant qu'objectif pour l'apport d'un individu lorsqu'un BME n'est pas disponible pour un nutriment.
- L'AMT est l'apport quotidien continu le plus élevé qui ne comporte vraisemblablement pas de risques d'effets indésirables pour la santé chez la plupart des membres d'un groupe donné, défini en fonction de l'étape de la vie pour lequel l'AMT a été élaboré. Le terme apport "tolérable" a été choisi pour éviter d'insinuer la possibilité d'un effet bénéfique. Au lieu, le terme est destiné à spécifier un niveau d'apport avec une forte probabilité d'être toléré biologiquement. L'AMT ne représente pas un apport de consommation recommandé. Le risque d'effets indésirables augmente à mesure que l'apport s'élève au-dessus de l'AMT.
- Le RMCC est le niveau d'apport le plus bas pour lequel on s'attend à une réduction du risque de maladies chroniques. Les valeurs RRMC ont été établies pour le sodium.
Annexe 2 : Questions de la consultation
Santé Canada invite les répondants à donner leur avis en répondant aux questions suivantes. Veuillez préciser vos réponses au besoin. Par exemple, si vous n'êtes pas d'accord avec une proposition, veuillez expliquer pourquoi.
Veuillez transmettre vos réponses aux questions de la consultation et toute autre rétroaction à bns-bsn@hc-sc.gc.ca et indiquer dans l'objet « Modernisation de la réglementation des aliments à usage diététique spécial et des aliments pour nourrissons ». Les formats acceptés sont Microsoft Word et PDF.
Données démographiques
- De quel point de vue répondez-vous à ce questionnaire? Sélectionnez l'une des options suivantes.
- Consommateur
- Association de consommateurs
- Industrie
- Association de l'industrie
- Universitaires ou instituts de recherche
- Professionnels de la santé
- Organismes de soins de santé, à l'exception des instituts de recherche
- Gouvernements provinciaux ou territoriaux (veuillez préciser)
- Santé Canada
- Autre ministère du gouvernement fédéral (veuillez préciser)
- Organisation non gouvernementale
- Partenaire commercial international
- Peuples autochtones
- Autre (veuillez préciser)
- Je préfère ne pas répondre
- Quoique non requis, veuillez fournir vos coordonnées afin que nous puissions communiquer avec vous si nous avons des questions ou si nous avons besoin de plus de détails, notamment sur les points suivants :
- Nom
- Titre (le cas échéant)
- Entreprise ou organisation (le cas échéant)
- Courriel
- Téléphone
Proposition de politique
- Êtes-vous favorable à la proposition visant à restructurer les titres 24 et 25 du RAD en un titre pour les AFDS et un autre pour les aliments qui ne sont pas des AFDS (par exemple, oui, non, en partie)? Veuillez expliquer votre réponse. Avez-vous d'autres commentaires? Quels sont les autres facteurs que Santé Canada devrait prendre en compte, le cas échéant?
- Êtes-vous favorable à la proposition concernant les préparations pour nourrissons (par exemple, oui, non, en partie)? Veuillez expliquer votre réponse. Avez-vous d'autres commentaires? Quels sont les autres facteurs que Santé Canada devrait prendre en compte, le cas échéant?
- Êtes-vous favorable à la proposition concernant le lait humain préemballé (par exemple, oui, non, en partie)? Veuillez expliquer votre réponse. Avez-vous d'autres commentaires? Quels sont les autres facteurs que Santé Canada devrait prendre en compte, le cas échéant?
- Êtes-vous favorable à la proposition concernant les aliments médicaux pour bébés (par exemple, oui, non, en partie)? Veuillez expliquer votre réponse. Avez-vous d'autres commentaires? Quels sont les autres facteurs que Santé Canada devrait prendre en compte, le cas échéant?
- Êtes-vous favorable à la proposition concernant les aliments médicaux pour un an ou plus (par exemple, oui, non, en partie)? Veuillez expliquer votre réponse. Avez-vous d'autres commentaires? Quels sont les autres facteurs que Santé Canada devrait prendre en compte, le cas échéant?
- Êtes-vous favorable à la proposition concernant les aliments médicaux présentés comme un substitut de l'alimentation totale pour la perte de poids (par exemple, oui, non, en partie)? Veuillez expliquer votre réponse. Avez-vous d'autres commentaires? Quels sont les autres facteurs que Santé Canada devrait prendre en compte, le cas échéant?
- Êtes-vous favorable à la proposition concernant les dispositions sur les pénuries applicables à tous les AFDS (par exemple, oui, non, en partie)? Veuillez expliquer votre réponse. Avez-vous d'autres commentaires? Quels sont les autres facteurs que Santé Canada devrait prendre en compte, le cas échéant?
- Êtes-vous favorable à la proposition concernant les dispositions sur la cessation de vente applicables à tous les AFDS (par exemple, oui, non, en partie)? Veuillez expliquer votre réponse. Avez-vous d'autres commentaires? Quels sont les autres facteurs que Santé Canada devrait prendre en compte, le cas échéant?
- Êtes-vous favorable à la proposition concernant les exigences préalables à la mise en marché pour les AFDS pour bébés (par exemple, oui, non, en partie)? Veuillez expliquer votre réponse. Avez-vous d'autres commentaires? Quels sont les autres facteurs que Santé Canada devrait prendre en compte, le cas échéant?
- Êtes-vous favorable à la proposition concernant les aliments conventionnels pour bébés (par exemple, oui, non, en partie)? Veuillez expliquer votre réponse. Avez-vous d'autres commentaires? Quels sont les autres facteurs que Santé Canada devrait prendre en compte, le cas échéant?
- Êtes-vous favorable à la proposition concernant les aliments sans gluten (par exemple, oui, non, en partie)? Veuillez expliquer votre réponse. Avez-vous d'autres commentaires? Quels sont les autres facteurs que Santé Canada devrait prendre en compte, le cas échéant?
- Êtes-vous favorable à la proposition concernant les aliments nutritifs formulés pour enfants (par exemple, oui, non, en partie)? Veuillez expliquer votre réponse. Avez-vous d'autres commentaires? Quels sont les autres facteurs que Santé Canada devrait prendre en compte, le cas échéant?
- Êtes-vous favorable à la proposition concernant les aliments nutritifs formulés pour 14 ans ou plus (par exemple, oui, non, en partie)? Veuillez expliquer votre réponse. Avez-vous d'autres commentaires? Quels sont les autres facteurs que Santé Canada devrait prendre en compte, le cas échéant?
- Êtes-vous favorable à la proposition concernant les aliments présentés en vue d'une utilisation dans les régimes amaigrissants (par exemple, oui, non, en partie)? Veuillez expliquer votre réponse. Avez-vous d'autres commentaires? Quels sont les autres facteurs que Santé Canada devrait prendre en compte, le cas échéant?
- Êtes-vous favorable à la proposition concernant les repas préemballés (par exemple, oui, non, en partie)? Veuillez expliquer votre réponse. Avez-vous d'autres commentaires? Quels sont les autres facteurs que Santé Canada devrait prendre en compte, le cas échéant?
Notes de bas de page
- Référence 1
-
AUDS désigne « un aliment qui a été spécialement transformé ou formulé pour satisfaire les besoins alimentaires particuliers d'une personne manifestant un état physique ou physiologique particulier suite à une maladie, une blessure ou un désordre fonctionnel, ou chez qui l'on cherche à obtenir un résultat particulier, y compris, sans s'y limiter, une perte de poids, grâce au contrôle de sa ration alimentaire » (B.24.001, Règlement sur les aliments et drogues)
- Référence 2
-
Dans le contexte du RAD, « représenté comme » désigne les produits qui sont étiquetés ou annoncés comme tels.
- Référence 3
-
Avant 1994, les apports nutritionnels recommandés (ANR) étaient utilisés lors de l'établissement des exigences en matière de composition. Le Canada est passé à l'utilisation des apports nutritionnels de référence (ANREF) à partir de 1994, par contre, les titres 24 et 25 du RAD n'ont pas été révisés pour tenir compte des ANREF.
- Référence 4
-
AFDS désigne « un aliment qui a été spécialement transformé ou formulé pour satisfaire les besoins alimentaires particuliers d'un individu manifestant un état physique ou physiologique particulier en raison d'une maladie, d'un désordre ou d'un état physique anormal, ou pour être l'unique source ou la source principale d'alimentation d'un individu » (Article 2, Loi sur les aliments et drogues)
- Référence 5
-
Veuillez consulter Annexe 1 : Lexique pour obtenir plus d'information sur les ANREF.
- Référence 6
-
B.24.003, Règlement sur les aliments et drogues
- Référence 7
-
B.25.001, Règlement sur les aliments et drogues
- Référence 8
-
Organisation mondiale de la santé. Code international de commercialisation des substituts du lait maternel. 27 janvier. https://www.who.int/fr/publications/i/item/9241541601
- Référence 9
-
Le Code de l'OMS s'applique aux substituts du lait maternel, y compris les préparations pour nourrissons et autre produits laitiers, les aliments et breuvages présentés comme un remplacement partiel ou total du lait maternel.
- Référence 10
-
Article D.03.002(1), Règlement sur les aliments et drogues
- Référence 11
-
Wiggins AKA, Grantham A, Anderson GH. Optimizing foods for special dietary use in canada: Key outcomes and recommendations from a tripartite workshop. Applied physiology, nutrition, and metabolism. 2019;44(11):1258-1265. https://cdnsciencepub.com/doi/full/10.1139/apnm-2019-0013 (Disponible en anglais seulement).
- Référence 12
-
Oosterveld D. 2019. Modernizing Canada's Medical Nutrition Regulations for Food. June 24. https://www.raps.org/News-and-Articles/News-Articles/2019/6/Modernizing-Canadas-Medical-Nutrition-Regulations (Disponible en anglais seulement).
- Référence 13
-
Cela comprend la norme générale pour les mentions d'étiquetage et les allégations concernant les aliments diététiques ou de régime préemballés (CXS-146-1985), ainsi que les normes spécifiques aux différentes catégories d'AUDS dont les préparations destinées aux nourrissons et les préparations données à des fins médicales spéciales aux nourrissons (CXS 72-1981), les préparations de suite (CXS 156-1987), les aliments transformés à base de céréales destinés aux nourrissons et enfants en bas âge (CXS 74-1981), les aliments pour nourrissons en conserve (CXS 73-1981), les aliments destinés à des fins médicales spéciales (CXS 180-1991), les préparations alimentaires utilisées dans les régimes alimentaires amaigrissants à valeur énergétique très faible (CXS 203-1995), les préparations alimentaires utilisées dans les régimes amaigrissants (CXS 181-1991), les AUDS destinés aux personnes souffrant d'une intolérance au gluten (CXS 118-1979), et les AUDS à faible teneur en sodium (CXS 53-1981).
- Référence 14
-
Union européenne. 2013. Règlement (UE) No 609/2013 concernant les denrées alimentaires destinées aux nourrissons et aux enfants en bas âge, les denrées alimentaires destinées à des fins médicales spéciales et les substituts de la ration journalière totale pour contrôle du poids. https://eur-lex.europa.eu/legal-content/FR/TXT/?uri=CELEX%3A32013R0609
- Référence 15
-
Union européenne. 2006a. Règlement (CE) no 1924/2006 du Parlement européen et du Conseil du 20 décembre 2006 concernant les allégations nutritionnelles et de santé portant sur les denrées alimentaires. https://eur-lex.europa.eu/eli/reg/2006/1924/2014-12-13
- Référence 16
-
Union européenne. 2006b. Règlement (CE) no 1925/2006 concernant l'adjonction de vitamines, de minéraux et de certaines substances aux denrées alimentaires. https://eur-lex.europa.eu/legal-content/FR/ALL/?uri=celex%3A32006R1925
- Référence 17
-
Normes Alimentaires d'Australie et de Nouvelle Zélande. 2021. Code des normes alimentaires. https://www.foodstandards.gov.au/code/Pages/default.aspx (Disponible en anglais seulement).
- Référence 18
-
Food and Drug Administration, Department of Health and Human Services. 1977. 21 CFR part 105. https://www.ecfr.gov/current/title-21/part-105 (Disponible en anglais seulement).
- Référence 19
-
Food and Drug Administration, Department of Health and Human Services. 2001. 21 CFR 101.9 https://www.ecfr.gov/current/title-21/part-101/section-101.9 (Disponible en anglais seulement).
- Référence 20
-
B.24.003(1.1), Règlement sur les aliments et drogues
- Référence 21
-
B.25.001, Règlement sur les aliments et drogues
- Référence 22
-
B.25.062, Règlement sur les aliments et drogues
- Référence 23
-
B.25.001, Règlement sur les aliments et drogues
- Référence 24
-
Organisation des Nations Unies pour l'alimentation et l'agriculture (FAO). 2007. « Norme pour les préparations destinées aux nourrissons et les préparations données à des fins médicales spéciales aux nourrissons CXS 72-1981 ». https://www.fao.org/fao-who-codexalimentarius/sh-proxy/en/?lnk=1&url=https%253A%252F%252Fworkspace.fao.org%252Fsites%252Fcodex%252FStandards%252FCXS%2B72-1981%252FCXS_072f.pdf
- Référence 25
-
Articles B.25.057(1)(a) and B.25.057(2)(c)(i), Règlement sur les aliments et drogues
- Référence 26
-
Chiang KV, Anstey EH, Abrams SA, Perrine CG. 2023. Infant burn injuries related to water heating for powdered infant formula preparation. Frontiers in pediatrics 11 (1125112). doi: 10.3389/fped.2023.1125112. (Disponible en anglais seulement).
- Référence 27
-
Richter APC, Duffy EW, Higgins ICA, Barrington C, Martin SL, Aquilina KH, Avendaño-Galdamez MI & Hall MG. 2023. Toddler milk perceptions and responses to front-of-package claims and product warnings : A qualitative study of caregivers of toddlers. Journal of the Academy of Nutrition and Dietetics. doi : https://doi.org/10.1016/j.jand.2023.06.281 (Disponible en anglais seulement).
- Référence 28
-
B.01.601(1)(c)(i), Règlement sur les aliments et drogues
- Référence 29
-
B.01.503(2), Règlement sur les aliments et drogues
- Référence 30
-
Une allégation santé est un énoncé ou toute autre représentation figurant sur l'étiquette ou dans la publicité d'un produit, qui indique de façon explicite ou implicite le lien qui existe entre la consommation d'un aliment ou d'un ingrédient dans un aliment et la santé d'une personne.
- Référence 31
-
Gouvernement du Royaume-Uni. 2022. Commission delegated Regulation (EU) 2016/127 (supplementing Regulation (EU) no 609/2013): Guidance. https://www.gov.uk/government/publications/infant-and-follow-on-formula-and-food-for-special-medical-purposes/commission-delegated-regulation-eu-2016127-supplementing-regulation-eu-no-6092013-guidance (Disponible en anglais seulement).
- Référence 32
-
Australian Government Department of Health and Aged Care. 2023. Marketing in Australia of infant formulas: Manufacturers and importers agreement. https://www.health.gov.au/topics/pregnancy-birth-and-baby/breastfeeding-infant-nutrition/marketing-infant-formula (Disponible en anglais seulement).
- Référence 33
-
Pound C US, Blair B. Pasteurized and unpasteurized donor human milk. 2020. Paediatrics & Child Health 25(8):549-550. doi : 10.1093/pch/pxaa118. (Disponible en anglais seulement).
- Référence 34
-
Sousa SG DI, Saraiva JA. 2016. Human milk composition and preservation : Evaluation of high-pressure processing as a nonthermal pasteurization technology. Critical Reviews in Food Science and Nutrition 56(6):1043-1060. doi : 10.1080/10408398.2012.753402. (Disponible en anglais seulement).
- Référence 35
-
Ballard O MA. 2013. Human milk composition: Nutrients and bioactive factors. Pediatr Clin North Am 60(1):49-74. doi: 10.1016/j.pcl.2012.10.002. (Disponible en anglais seulement).
- Référence 36
-
La Leche League International. 2023. Chauffer le lait humain au micro-ondes. https://llli.org/fr/breastfeeding-info/heating-human-milk/
- Référence 37
-
B.25.020(1)(a)-(d), Règlement sur les aliments et drogues
- Référence 38
-
Organisation des Nations Unies pour l'alimentation et l'agriculture (FA)). 1991. « Norme pour les mentions d'étiquetage et les allégations pour les aliments destinés à des fins médicales spéciales: Codex stan 180-1991 ». https://www.fao.org/fao-who-codexalimentarius/sh-proxy/fr/?lnk=1&url=https%253A%252F%252Fworkspace.fao.org%252Fsites%252Fcodex%252FStandards%252FCXS%2B180-1991%252FCXS_180f.pdf
- Référence 39
-
B.25.019, Règlement sur les aliments et drogues
- Référence 40
-
B.24.102(1)(a)-(b), Règlement sur les aliments et drogues
- Référence 41
-
Organisation des Nations Unies pour l'alimentation et l'agriculture (FAO). 1995. Norme pour les préparations alimentaires utilisées dans les régimes alimentaires amaigrissants à valeur énergétique très faible (CXS-203 1995). fao.org/fao-who-codexalimentarius/sh-proxy/fr/?lnk=1&url=https%253A%252F%252Fworkspace.fao.org%252Fsites%252Fcodex%252FStandards%252FCXS%2B203-1995%252FCXS_203f.pdf
- Référence 42
-
Des dispositions concernant la cessation de vente existent actuellement à l'article B.24.017 du titre 34 pour les PRL, SR, ARTFTE ainsi qu'à l'article B.25.018 du titre 25 pour les FLH, et à l'article B.25.060 pour les préparations pour nourrissons.
- Référence 43
-
B.25.061(1), Règlement sur les aliments et drogues
- Référence 44
-
D.01.010, D.01.011 et D.02.009, Règlement sur les aliments et drogues
- Référence 45
-
Liem DG. 2017. Infants' and children's salt taste perception and liking : A review. Nutrients 9(9):1011. doi : 10.3390/nu9091011. (Disponible en anglais seulement).
- Référence 46
-
Stein LJ, Cowart BJ, Beauchamp GK. 2012. The development of salty taste acceptance is related to dietary experience in human infants: A prospective study. The American Journal of Clinical Nutrition 95(1):123-129. doi : 10.3945/ajcn.111.014282. (Disponible en anglais seulement).
- Référence 47
-
Organisation mondiale de la santé. 2015. « Directive: Apport en sucres chez l'adulte et l'enfant ». https://www.who.int/publications/i/item/9789241549028
- Référence 48
-
Pulido O, Gillespie Z, Zarkadas M, et al. 2009. Introduction of oats in the diet of individuals with celiac disease: A systematic review. Advances in Food and Nutrition Research 57:235-85. https://www.researchgate.net/publication/26664127_Introduction_of_oats_in_the_diet_of_individuals_with_celiac_disease_a_systematic_review (Disponible en anglais seulement).
- Référence 49
-
Gluten : a) toute protéine de gluten provenant du grain de l'une des céréales suivantes ou du grain d'une souche hybridée créée à partir d'au moins une des céréales suivantes : (i) l'orge, (ii) l'avoine, (iii) le seigle, (iv) le triticale, (v) le blé; ou (b) toute protéine de gluten modifiée, y compris toute fraction de protéine de gluten, dérivée du grain de l'une des céréales visées à l'alinéa a) ou du grain d'une souche hybridée visée à cet alinéa. (B.01.010.1[1] du RAD)
- Référence 50
-
D.03.003, Règlement sur les aliments et drogues
- Référence 51
-
B.24.018, Règlement sur les aliments et drogues
- Référence 52
-
Organisation des Nations unies pour l'alimentation et l'agriculture. 2008. Norme pour les aliments diététiques ou de régime destinés aux personnes souffrant d'une intolérance au gluten (CXS 118-1979). https://www.fao.org/fao-who-codexalimentarius/sh-proxy/fr/?lnk=1&url=https%253A%252F%252Fworkspace.fao.org%252Fsites%252Fcodex%252FStandards%252FCXS%2B118-1979%252FCXS_118f_2015.pdf
- Référence 53
-
Alberta Health Services. 2022. Nutrition guideline: Health infant and young children milk. https://www.albertahealthservices.ca/assets/info/nutrition/if-nfs-ng-healthy-infants-other-milks-fluids-milk.pdf (Disponible en anglais seulement).
- Référence 54
-
Commission européenne. 2016. Rapport de la commission au parlement européen et au conseil sur les préparations pour enfants en bas âge. https://www.europarl.europa.eu/RegData/docs_autres_institutions/commission_europeenne/com/2016/0169/COM_COM(2016)0169_FR.pdf
- Référence 55
-
Académies nationales des sciences, de l'ingénierie et de la médecine (NASEM). Apports nutritionnels de référence pour le sodium et le potassium. 2019. doi : https://doi.org/10.17226/25353 (Disponible en anglais seulement).
- Référence 56
-
Berry NJ, Jones S and Iverson D. 2010. "It's all formula to me: women's understandings of toddler milk ads." Breastfeeding Review: Professional Publication of the Nursing Mothers' Association of Australia 21-30. https://pubmed.ncbi.nlm.nih.gov/20443436/ (Disponible en anglais seulement).
- Référence 57
-
B.24.003(3), Règlement sur les aliments et drogues