Archivée - InfoVigilance sur les produits de santé – janvier 2019

Télécharger le format de rechange
(Format PDF, 575 Ko, 11 pages)
Direction générale des produits de santé et des aliments
Direction des produits de santé commercialisés
Équipe de rédaction de l'InfoVigilance sur les produits de santé
ISSN : 2368-8033
Cat. : H167-1F-PDF
Pub. : 180664
Organisation : Santé Canada
Publiée : 2019-01-31
Contenu
- Produits de santé mentionnés dans ce numéro
- Annonce – Trelegy Ellipta
- Opioïdes – Mises à jour
- Récapitulatif mensuel
- Nouveaux renseignements
- Article de synthèse : Utilisation prolongée d'hydrochlorothiazide et risque de cancer de la peau non mélanique
- Résumé semestriel de l'innocuité des vaccins : Rapport pour la période du 1er janvier au 30 juin 2018
- Mise à jour de monographie de produit : Biaxin (clarithromycine)
- Mise à jour de monographie de produit : Lamictal (lamotrigine)
- Mise à jour de monographie de produit : Revlimid (lénalidomide)
- Portée
- Liens utiles
- Des suggestions?
- Droit d'auteur
Produits de santé mentionnés dans ce numéro
Produits pharmaceutiques et biologiques
- Acétaminophène, gouttes orales
- Biaxin (clarithromycine)
- Hydrochlorothiazide
- Inhibiteurs de la tyrosine kinase du récepteur du facteur de croissance de l'endothélium vasculaire
- Lamictal (lamotrigine)
- Médicaments à base de sartan
- Revlimid (lénalidomide)
- Système d'entretien de lentilles et Solution polyvalente de marque Equate
- Trelegy Ellipta
- Xarelto (rivaroxaban)
Produits de santé naturels
Autres
Annonce :
Trelegy Ellipta
Santé Canada a appris récemment que les professionnels de la santé pourraient avoir reçu des informations incompatibles avec la monographie de produit canadienne pour Trelegy Ellipta. Santé Canada désire rappeler aux professionnels de la santé que :
- Trelegy Ellipta est un inhalateur qui contient les ingrédients médicinaux suivantsFootnote 1 :
- Furoate de fluticasone, un corticostéroïde en inhalation (CSI)
- Uméclidinium, un antagoniste muscarinique à longue durée d'action (AMLA)
- Vilantérol, un bêta2-agoniste à longue durée d'action (BALA)
- Trelegy Ellipta est indiqué pour le traitement d'entretien uniquotidien et prolongé d'une maladie pulmonaire obstructive chronique (MPOC), y compris la bronchite chronique et/ou l'emphysème, qu'une association CSI-BALA ne permet pas de traiter adéquatementFootnote 1
- Trelegy Ellipta n'est pas indiqué pour le soulagement du bronchospasme aigu ou pour le traitement de l'asthmeFootnote 1
Les professionnels de la santé sont encouragés à contacter Santé Canada à MHPD_DPSC-Advertising_Reg_Publicite@hc-sc.gc.ca pour signaler toute information concernant les produits de santé soupçonnée d'être fausse ou trompeuse.
Référence
- Footnote 1
-
Trelegy Ellipta (furoate de fluticasone, uméclidinium et vilantérol) [monographie de produit]. Mississauga (Ont.): GlaxoSmithKline Inc.; 2018.
Opioïdes – Mises à jour
Maintenant en ligne – Un résumé de ce que Santé Canada a entendu en réponse à l'Avis d'intention de restreindre le marketing et la publicité des opioïdes
Le 19 juin 2018, la ministre de la Santé a publié un Avis d'intention pour restreindre le marketing et la publicité sur les opioïdes. Conformément à son engagement envers la transparence, Santé Canada a récemment publié un rapport sur ce que nous avons entendu qui résume les commentaires reçus. Le résumé est fondé sur plus de 40 commentaires de la part des professionnels de la santé et des associations, des patients, des universitaires et des représentants de l'industrie pharmaceutique concernant des restrictions supplémentaires en ce qui concerne le marketing et la publicité sur les opioïdes.
La rétroaction reçue servira à préparer aux étapes suivantes en vue d'une intervention du gouvernement fédéral. Santé Canada continuera de partager des mises à jour avec les Canadiens sur la page Web Restriction du marketing et de la publicité sur les opioïdes.
Récapitulatif mensuel des renseignements sur l'innocuité des produits de santé
Voici une liste des avis concernant les produits de santé, des rappels de type I , ainsi que des résumés de l'examen de l'innocuité ou de la sûreté publiés en décembre 2018 par Santé Canada.
Acétaminophène, gouttes orales
Laboratoire Riva Inc. et Laboratoires Trianon Inc. ont rappelé 5 types de gouttes d'acétaminophène à saveur de fraise pour nourrissons offerts en vente libre. Les produits sont de marque Biomedic, Option+, Personnelle, Selection et Laboratoires Trianon Inc. Ils font l'objet d'un rappel parce que le bouchon de sécurité à l'épreuve des enfants peut être défectueux. Ce rappel s'ajoute aux rappels précédents de sirops d'acétaminophène pour enfants pour le même problème.
- Avis – Acétaminophène, gouttes orales
- Retrait de marché d'une drogue - Acétaminophène 80mg / mL, Laboratoire Riva Inc. (2018-12-06)
- Retrait de marché d'une drogue – Acétaminophène 80mg / mL, Laboratoire Trianon Inc. (2018-12-06)
Inhibiteurs de la tyrosine kinase du récepteur du facteur de croissance de l'endothélium vasculaire
Cet examen de l'innocuité a évalué le risque de dissections artérielles et anévrismes artériels associés aux inhibiteurs de la tyrosine kinase du récepteur du facteur de croissance de l'endothélium vasculaire (ITK du récepteur du FCEV). À la suite de son examen, Santé Canada a conclu qu'il pourrait exister un lien entre l'utilisation des ITK du récepteur du FCEV et les dissections artérielles/anévrismes artériels. Santé Canada collabore avec les fabricants pour mettre à jour les monographies de produit canadiennes de tous les ITK du récepteur du FCEV afin de faire connaître ce risque.
Médicaments à base de sartan
Santé Canada a publié les résultats de son analyse de médicaments à base de sartan au Canada. Santé Canada a analysé 48 échantillons de certains médicaments à base de sartan (valsartan, candésartan, irbésartan, losartan et olmésartan), représentant 43 produits différents, et il n'a pas constaté de nouveau problème d'innocuité. Parmi les 48 échantillons, 6 échantillons de valsartan représentant 4 produits contenaient des concentrations d'impuretés qui étaient, en moyenne, plus élevées que ce qui est considéré comme raisonnablement sûr. Les 4 produits ont déjà été retirés du marché canadien.
Mise à jour – Médicaments à base de sartan
Produits de santé de l'étranger
La présence non déclarée de plomb et de mercure a été détectée dans le produit de santé de l'étranger Quizz capsules. La vente de ce produit n'est pas autorisée au Canada, et il n'est pas offert sur le marché canadien. Toutefois, il se peut que des Canadiens en aient acheté lors d'un voyage à l'étranger ou par Internet. Puisque ce produit a été associé à un cas d'intoxication par le plomb au Canada, Santé Canada avise les consommateurs de ne pas l'utiliser. Ce produit est vendu pour le traitement du diabète.
Alerte concernant des produits de l'étranger – Capsules Quizz de Trio Healthcare
Produits de santé fabriqués par Professional Botanicals Inc.
Tous les produits de santé fabriqués par Professional Botanicals Inc. pourraient poser de sérieux risques sur la santé. La compagnie est un fabricant à façon qui est aussi connue sous le nom de Healthy Botanicals Inc. Les observations effectuées par Santé Canada signalent que la compagnie fabriquait des produits dans des conditions non hygiéniques, sur un site qui n'avait pas été autorisé par Santé Canada. Santé Canada a saisi tous les produits, les ingrédients de médicaments d'ordonnance, ainsi que du matériel de fabrication sur le site et a suspendu 11 licences détenues par la compagnie, pour des produits naturels.
Avis – Produits de santé fabriqués par Professional Botanicals Inc.
Produits de santé non autorisés
Santé Canda a avisé les Canadiens que divers produits de santé non autorisés qui pourraient poser un risque grave pour la santé ont été vendus dans des points de vente au détail au Canada ou en ligne.
Système d'entretien de lentilles et Solution polyvalente de marque Equate
Un lot (Lot 150261) de ces deux produits a été rappelé en raison d'une erreur d'étiquetage. Bien que l'emballage extérieur du Système d'entretien de lentille de marque Equate est étiqueté correctement, la bouteille à l'intérieur de l'emballage est étiquetée de manière erronée comme « Solution polyvalente de marque Equate ». En raison de l'erreur d'étiquetage, l'entreprise rappelle les deux produits ayant une étiquette portant le numéro de lot 150261. Les bouteilles étiquetées comme Solution polyvalente Equate devraient contenir 0,0001 % m/v de solution désinfectante à base de polyhexanide. Les bouteilles mal étiquetées contiennent le Système d'entretien de lentilles Equate, qui est une solution désinfectante et nettoyante contenant 3,3 % peroxyde d'hydrogène et ne devrait pas être utilisée pour le rinçage.
Talc
L'ébauche d'évaluation préalable du talc de Santé Canada et d'Environnement et Changement climatique Canada propose que l'inhalation de poudre de talc libre peut causer des effets pulmonaires, tels que la toux, des troubles respiratoires, la diminution de la fonction pulmonaire, la fibrose, et que l'exposition de la région périnéale à certains produits contenant du talc est une cause possible du cancer de l'ovaire. On demande aux professionnels de la santé de rappeler à leurs patients d'éviter d'inhaler les poudres libres de talc, d'éviter d'exposer les organes génitaux féminins aux produits contenant du talc, de tenir la poudre pour bébé loin du visage des enfants afin d'éviter l'inhalation, de vérifier les étiquettes des produits pour savoir s'ils contiennent du talc et de choisir des solutions de rechange sans talc si l'utilisation de celui-ci les préoccupe.
Xarelto (rivaroxaban)
Une augmentation de la mortalité toutes causes confondues et de l'incidence des événements thromboemboliques et hémorragiques a été signalée au cours d'une étude clinique de phase III chez les patients traités par Xarelto qui avaient subi un remplacement valvulaire aortique transcathéter (RVAT). En raison de ces résultats provisoires, on a mis fin à l'étude clinique et entrepris une analyse approfondie de ses résultats. On rappelle aux professionnels de la santé que Xarelto n'est pas approuvé pour la thromboprophylaxie chez les patients porteurs de prothèses valvulaires cardiaques, y compris ceux qui ont subi un RVAT, et ne doit pas être utilisé chez ces patients. Chez les patients qui subissent un RVAT, on devrait cesser le traitement par Xarelto et administrer le traitement habituel.
Nouveaux renseignements sur l'innocuité des produits de santé
Les sujets suivants ont été sélectionnés dans le but d'accroître la sensibilisation et, dans certains cas, encourager la déclaration d'effets indésirables similaires.
Article de synthèse : Utilisation prolongée d'hydrochlorothiazide et risque de cancer de la peau non mélanique
L'hydrochlorothiazide (HCTZ) est un diurétique couramment utilisé au Canada dans le traitement de l'hypertension et de l'œdème.
Des études pharmaco-épidémiologiques récentes ont suggéré que l'HCTZ serait associée à une augmentation du risque de cancer de la peau non mélanique qui serait proportionnelle aux doses cumulatives utiliséesNote de bas de page 2,Note de bas de page 3.
Le cancer de la peau non mélanique est le cancer le plus souvent diagnostiqué au Canada, les deux types les plus fréquents étant le carcinome basocellulaire et le carcinome spinocellulaireNote de bas de page 4. Un Canadien sur 8 développera un carcinome basocellulaire au cours de sa vie, tandis que 1 Canadien sur 20 développera un carcinome spinocellulaireNote de bas de page 5. Le cancer de la peau non mélanique peut généralement être guéri s'il est traité à un stade précoce et les cas de cancer ayant entraîné le décès sont plutôt raresNote de bas de page 6. L'exposition au rayonnement ultraviolet, l'utilisation de médicaments photosensibilisants et l'immunosuppression sont des facteurs de risque importants de cancer de la peau non mélanique; le risque est particulièrement élevé chez les personnes qui ont un teint pâleNote de bas de page 4.
Il est établi que l'HCTZ augmente la sensibilité de la peau à la lumière du soleil et au rayonnement ultravioletNote de bas de page 7,Note de bas de page 8.
Santé Canada a effectué un examen des études pertinentes en utilisant les méthodes d'examen systématique et de méta-analyse afin de déterminer le degré d'association qui existe entre l'HCTZ et le cancer de la peau non mélanique. Le degré de certitude des données probantes a également été évalué au moyen de méthodes normalisées (l'approche GRADENote de bas de page 9).
Le regroupement des données tirées des étudesNote de bas de page 10 a montré que l'utilisation continue de l'HCTZ (dans le cadre d'une monothérapie ou d'un traitement d'association) pendant plusieurs années pourrait entraîner :
- 122 cas supplémentaires (intervalle de confiance à 95 % [IC], 112-133) de carcinome spinocellulaire pour 1 000 patients traités par l'HCTZ comparativement aux patients n'ayant pas été traités par l'HCTZ (méta-analyse de 3 études observationnelles, soit 2 études publiées et une étude non publiéeNote de bas de page 2,Note de bas de page 11,Note de bas de page 12; données probantes présentant un très faible degré de certitude);
- 31 cas supplémentaires (IC à 95 %, 24-37) de carcinome basocellulaire pour 1 000 patients traités par l'HCTZ comparativement aux patients n'ayant pas été traités par l'HCTZ (méta-analyse de 2 études observationnelles, soit une étude publiée et une étude non publiéeNote de bas de page 2,Note de bas de page 12; données probantes présentant un très faible degré de certitude).
Cependant, Santé Canada a relevé des limites méthodologiques importantes (p. ex., facteur de confusion attribuable à l'absence de données sur l'exposition au soleil et déséquilibre relatif à la durée de l'hypertension, etc.) dans les études examinées, qui se sont traduites par un degré de certitude très faible pour les estimations des effets nocifs susmentionnés. Selon l'approche GRADE, un très faible degré de certitude signifie qu'il est probable que le véritable effet observé soit considérablement différent. Néanmoins, les résultats mentionnés précédemment reflètent les meilleures données probantes disponibles actuellement.
À la lumière de cet examen, Santé Canada a conclu que l'utilisation prolongée de l'HCTZ est associée à un risque potentiel de cancer de la peau non mélanique. Compte tenu de la gravité de ce risque potentiel et de l'utilisation très répandue de ce médicament au Canada, Santé Canada adopte une approche prudente et travaille actuellement avec les fabricants pour mettre à jour les renseignements canadiens sur l'innocuité des produits afin d'informer les professionnels de la santé et le public de ce nouveau risque potentiel et des mesures préventives à prendre lors de l'administration de l'HCTZ.
Messages clés pour les professionnels de la santé :
- À la lumière de son examen des données probantes pertinentes, Santé Canada a conclu que l'utilisation prolongée de l'HCTZ est associée à un risque potentiel de cancer de la peau non mélanique. Cependant, il subsiste une incertitude en raison des limites relevées dans toutes les études examinées. L'action photosensibilisante de l'HCTZ pourrait être un mécanisme à l'origine de cet effet.
- Les patients qui prennent des produits contenant de l'HCTZ devraient être informés du risque potentiel de cancer de la peau non mélanique; ils devraient également être avisés d'examiner régulièrement leur peau pour détecter la présence de nouvelles lésions ou la modification de lésions existantes, et devraient signaler toute lésion suspecte.
- Conseillez aux patients de pratiquer systématiquement la sécurité au soleil en limitant leur temps d'exposition au soleil et en se protégeant du soleil (p.ex., utiliser un écran solaire avec un FPS d'au moins 30, porter des vêtements qui couvrent la peau et un chapeau). L'utilisation d'appareils de bronzage devrait être évitée.
- Des solutions de rechange à l'utilisation de l'HCTZ peuvent être envisagées chez les patients qui présentent un risque particulièrement élevé de cancer de la peau non mélanique (p. ex., teint pâle, antécédents personnels ou familiaux connus de cancer de la peau, traitement immunosuppresseur en cours).
Les professionnels de la santé sont invités à signaler à Santé Canada tout cas de carcinome basocellulaire ou de carcinome spinocellulaire soupçonné d'être associé à un traitement par l'HCTZ. Au nombre des renseignements à fournir dans les déclarations de cas figurent les doses, les dates de début et d'arrêt du traitement, les médicaments concomitants, les comorbidités, un mode de vie caractérisé par l'exposition au soleil ou l'utilisation d'appareils de bronzage, et la date d'apparition de l'effet indésirable. Ces renseignements permettront d'assurer une surveillance continue de ce problème d'innocuité potentiel.
Citation de l'article : Santé Canada. Utilisation prolongée de l'hydrochlorothiazide et risque de cancer de la peau non mélanique. InfoVigilance sur les produits de santé – janvier 2019.
Références
- Note de bas de page 2
-
Pedersen SA, Gaist D, Schmidt SAJ, et al. Hydrochlorothiazide use and risk of nonmelanoma skin cancer: A nationwide case-control study from Denmark . J Am Acad Dermatol 2018;78(4):673-81. [PubMed]
- Note de bas de page 3
-
Pottegård A, Hallas J, Olesen M et al. Hydrochlorothiazide use is strongly associated with risk of lip cancer . J Intern Med 2017;282(4):322-31. [PubMed]
- Note de bas de page 4
-
Guenther LC, Barber K, Searles GE, et al. Non-melanoma skin cancer in Canada Chapter 1: Introduction to the Guidelines . J Cutan Med Surg 2015;19(3):205-15. [PubMed]
- Note de bas de page 5
-
Cancer de la peau non mélanique. Ottawa (ON): Agence de la santé publique du Canada; 28 mai 2014. (consulté le 10 janvier 2019).
- Note de bas de page 6
-
Fahradyan A, Howell AC, Wolfswinkel EM, et al. Updates on the management of non-melanoma skin cancer (NMSC) . Healthcare (Basel) 2017;5(4):82. doi:10.3390/healthcare5040082 [PubMed]
- Note de bas de page 7
-
Addo HA, Ferguson J, Frain-Bell W. Thiazide-induced photosensitivity: a study of 33 subjects . Br J Dermatol 1987;116(6):749-60. [PubMed]
- Note de bas de page 8
-
Robinson HN, Morison WL, Hood AF. Thiazide diuretic therapy and chronic photosensitivity . Arch Dermatol 1985;121(4):522-4. [PubMed]
- Note de bas de page 9
-
Guyatt G, Oxman AD, Akl EA et al. GRADE guidelines: 1. Introduction-GRADE evidence profiles and summary of findings tables . J Clin Epidemiol 2011;64(4):383- 94. [PubMed]
- Note de bas de page 10
-
Santé Canada a les données.
- Note de bas de page 11
-
Friedman GD, Asgari MM, Warton EM, et al. Antihypertensive drugs and lip cancer in non-Hispanic whites . Arch Intern Med 2012;172(16):1246-51. [PubMed]
- Note de bas de page 12
-
Santé Canada a les données.
Résumé semestriel de l'innocuité des vaccins
Santé Canada et l'Agence de la santé publique du Canada (ASPC) partagent la responsabilité de la surveillance de l'innocuité des vaccins au Canada.
Les titulaires d'autorisation de mise en marché sont tenus de déclarer les effets secondaires suivant l'immunisation considérés graves au Programme Canada Vigilance de Santé Canada. Le Programme Canada Vigilance reçoit également des déclarations volontaires des professionnels de la santé et des consommateurs.
Les autorités de santé publique provinciales et territoriales déclarent les effets secondaires suivant l'immunisation (ESSI) provenant des programmes d'immunisation financés par l'État au Système canadien de surveillance des effets secondaires suivant l'immunisation (SCSESSI) de l'ASPC afin de surveiller l'innocuité des programmes d'immunisation.
Rapport pour la période du 1er janvier au 30 juin 2018
Messages clés :
- Aucun nouveau signal d'innocuité (problème d'innocuité potentiel) n'a été identifié pendant cette période.
- Du 1er janvier 2018 au 30 juin 2018, le Programme Canada Vigilance a reçu 331 déclarationsNote de fin de document a d'effets secondaires suivant l'immunisation soupçonnés d'avoir été causés par des vaccins.
Le présent résumé semestriel de l'innocuité des vaccins fait un compte rendu des déclarations d'effets secondaires suivant l'immunisation reçues par le Programme Canada Vigilance entre le 1er janvier et le 30 juin 2018. Pour voir les rapports publiés par le SCSESSI, consulter le site Web du SCSESSI.
- Du 1er janvier 2018 au 30 juin 2018, le Programme Canada Vigilance a reçu 331 déclarationsNote de fin de document a d'effets secondaires suivant l'immunisation soupçonnés d'avoir été causés par des vaccins.
Figure 1 : Nombre total de déclarations reçues selon le type de déclarantNote de fin de document b
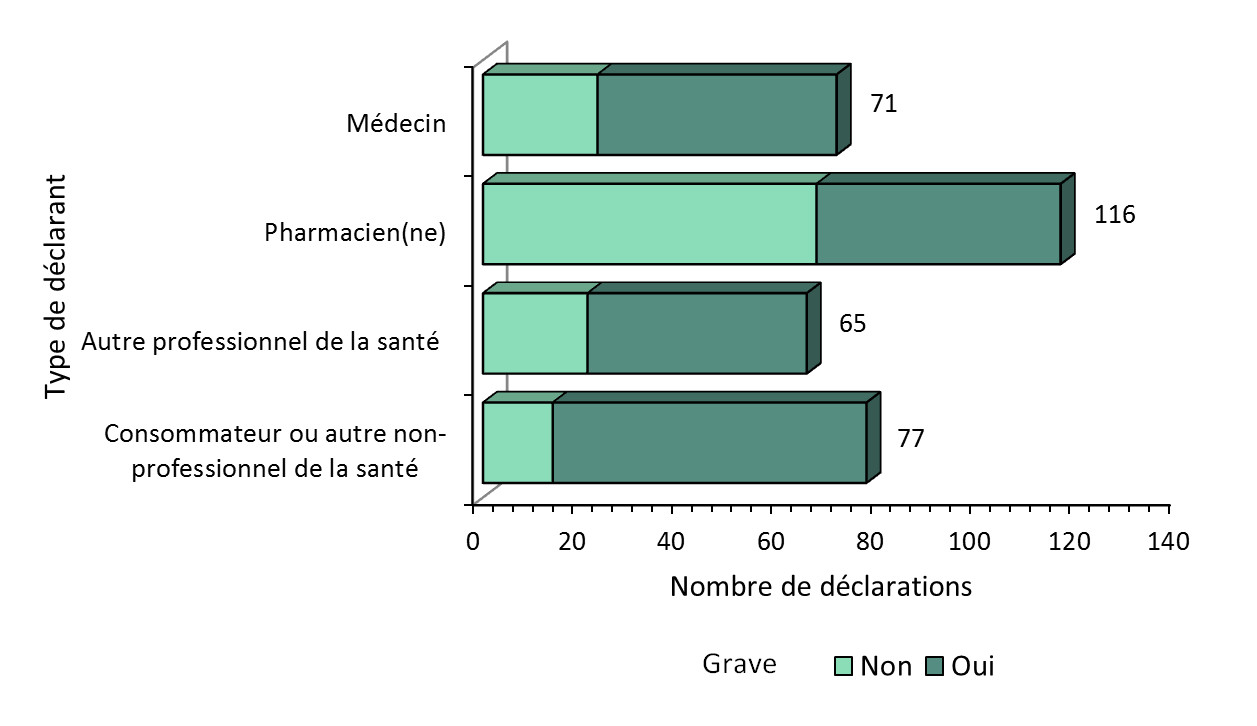
Figure 1 : Nombre total de déclarations reçues selon le type de déclarant - Équivalent textuel
La figure montre le nombre total de déclarations reçues du 1er janvier 2018 au 30 juin 2018, selon la gravité et le type de déclarant.
| Type de déclarant | Nombre de déclarations non graves | Nombre de déclarations graves |
|---|---|---|
| Médecin | 23 | 48 |
| Pharmacien(ne) | 67 | 49 |
| Autre professionnel de la santé | 21 | 44 |
| Consommateur ou autre non-professionnel de la santé | 14 | 63 |
Figure 2 : Nombre total de déclarations reçues par groupe d'âge
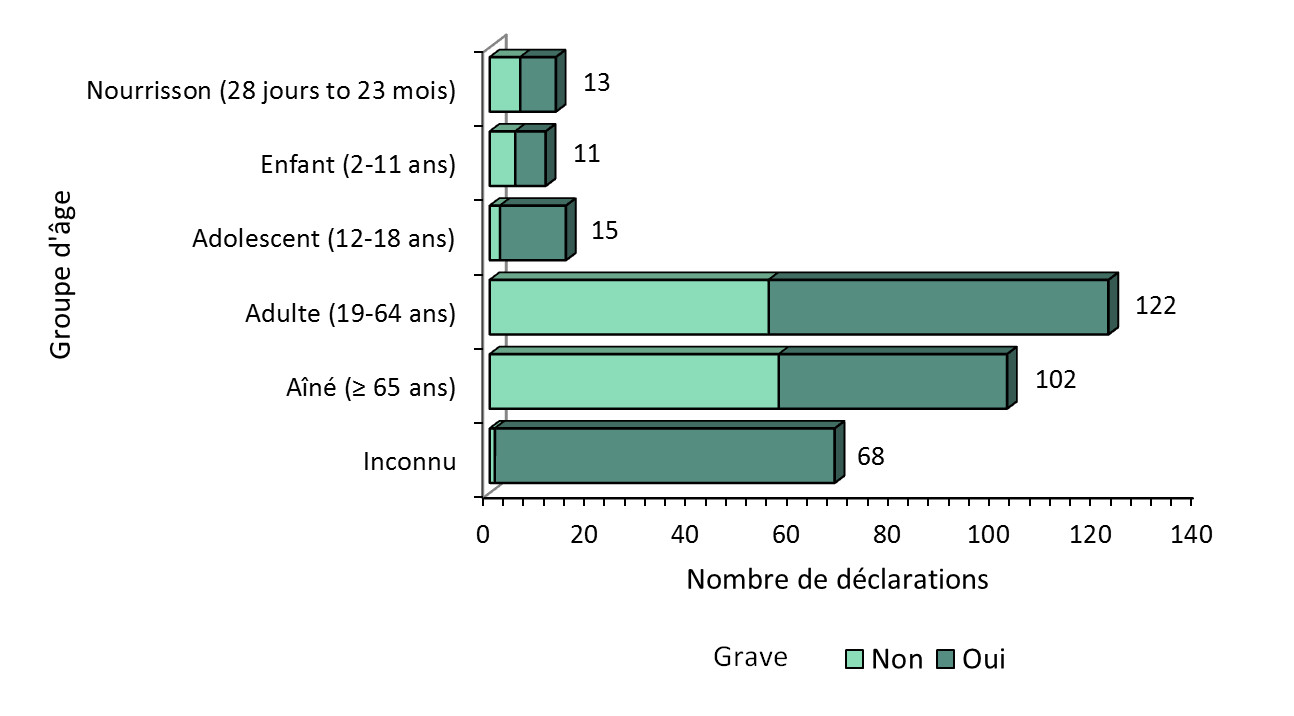
Figure 2 : Nombre total de déclarations reçues par groupe d'âge - Équivalent textuel
La figure montre le nombre total de déclarations reçues du 1er janvier 2018 au 30 juin 2018, selon la gravité et le groupe d'âge.
| Âge | Nombre de déclarations non graves | Nombre de déclarations graves |
|---|---|---|
| Nourrisson (28 jours à 23 mois) | 6 | 7 |
| Enfant (2-11 ans) | 5 | 6 |
| Adolescent (12-18 ans) | 2 | 13 |
| Adulte (19-64 ans) | 55 | 67 |
| Aîné (≥ 65 ans) | 57 | 45 |
| Inconnu | 1 | 67 |
- Il y avait 205 (62%) déclarations graves, qui ont toutes été évaluées individuellement. La plupart impliquaient des patients avec des problèmes de santé sous-jacents et n'étaient probablement pas liés à la vaccination.
- Le plus grand nombre de déclarations (graves et non graves) reçues impliquait le vaccin contre le zona (50%), suivi par les vaccins antipneumococciques (15%) et les vaccins contre l'influenza (9%).
- La majorité des 176 déclarations concernant le vaccin contre le zona étaient pour Shingrix (149 déclarations pour le Shingrix). Trente-six des 149 déclarations pour Shingrix venaient des médias sociaux. L'information fournie dans ces déclarations n'était pas suffisante pour évaluer convenablement l'association causale avec le vaccin.
- Le décès a été signalé dans 4 déclarations. Les 4 cas impliquaient des femmes : une déclaration concernait le vaccin contre l'influenza et une autre était une déclaration venant des médias sociaux pour Shingrix. Dans les 2 cas, la cause du décès était inconnue et l'information fournie n'était pas suffisante pour évaluer convenablement l'association causale avec le vaccin. Les 2 autres cas fatals impliquaient Gardasil; l'un avait été évalué précédemment en 2015. Le résumé de l'examen de l'innocuité est disponible sur le site Web de Santé Canada . Pour l'autre cas impliquant Gardasil, l'information fournie n'était pas suffisante pour évaluer convenablement l'association causale avec le vaccin.
- Les effets secondaires (graves et non graves) signalés le plus fréquemment incluaient le zona, l'échec de la vaccination, la fièvre, la fatigue et la douleur. Ces effets secondaires ont été surtout déclarés pour Shingrix.
- Les effets secondaires liés à l'échec de la vaccination et au zona proviennent principalement de la compagnie qui a extrait l'information des médias sociaux. L'information fournie n'était pas suffisante pour évaluer convenablement l'association causale avec le vaccin.
- Aucun nouveau signal d'innocuité (problème d'innocuité potentiel) n'a été identifié pendant cette période.
- Santé Canada, en collaboration avec l'Agence de la santé publique du Canada, continuera de surveiller étroitement l'innocuité des vaccins autorisés au Canada et prendra les mesures qui s'imposent si de nouveaux risques pour la santé sont identifiés.
Pour obtenir de plus amples renseignements, veuillez communiquer avec la Direction des produits de santé commercialisés.
Notez qu'en raison d'une mise à jour de l'information reçue par le Programme Canada Vigilance, il peut y avoir des différences dans le nombre de déclarations et les événements indésirables extraits à des dates différentes.
Mises à jour de monographies de produit
Les mises à jour suivantes concernant l'innocuité, qui ont récemment été apportées aux monographies de produit canadiennes, ont été sélectionnées afin d'en accroître la sensibilisation. Une liste complète des mises à jour de l'étiquetage se trouve sur la page L'innocuité des monographies de produits pour les médicaments innovateurs de Santé Canada. Les monographies de produit canadiennes sont disponibles dans la Base de données sur les produits pharmaceutiques de Santé Canada.
Biaxin BID, Biaxin XL, et Biaxin (clarithromycine)
L'utilisation de Biaxin BID, Biaxin XL, ou Biaxin en concomitance avec la dompéridone est maintenant contre-indiquée. Ces renseignements, ainsi que des mises à jour concernant le risque d'événement cardiovasculaire indésirable associé aux macrolides, ont été inclus dans les sections Contre-indications, Mises en garde et précautions, Interactions médicamenteuses et Renseignements sur le médicament pour le patient de la monographie de produit canadienne pour Biaxin BID, Biaxin XL, et Biaxin.
Messages clés pour les professionnels de la santéNote de bas de page 13:
- L'administration concomitante de clarithromycine et de dompéridone est contre-indiquée.
- Les études épidémiologiques évaluant le risque d'événement cardiovasculaire indésirable associé aux macrolides ont montré des résultats variables. Des études ont identifié des risques d'arythmie, d'infarctus du myocarde et de mortalité cardiovasculaire associés aux macrolides, y compris la clarithromycine. Il faut tenir compte de ces observations et les évaluer au regard des bienfaits escomptés du traitement lorsqu'on prescrit de la clarithromycine.
Référence
- Note de bas de page 13
-
Biaxin BID, Biaxin XL, et Biaxin (clarithromycine) [monographie de produit]. Etobicoke (Ont.): BGP Pharma ULC; 2018.
Lamictal (lamotrigine)
Le risque d'un ECG compatible avec le syndrome de Brugada a été inclus dans les sections Mises en garde et précautions et Renseignements pour le consommateur de la monographie de produit canadienne pour Lamictal.
Messages clés pour les professionnels de la santéNote de bas de page 14:
- Des cas d'anomalie arythmogène du segment ST-T et d'un tracé ECG compatible avec un syndrome de Brugada typique ont été signalés chez des patients traités par la lamotrigine.
- On doit envisager avec soin le recours à la lamotrigine chez des patients aux prises avec le syndrome de Brugada.
Référence
- Note de bas de page 14
-
Lamictal (lamotrigine) [monographie de produit]. Mississauga (Ont.): GlaxoSmithKline Inc.; 2018.
Revlimid (lénalidomide)
Le risque de leucoencéphalopathie multifocale progressive a été inclus dans les sections Mises en garde et précautions, Réactions indésirables (Réactions indésirables au médicament après sa mise en marché) et Renseignements pour le consommateur de la monographie de produit canadienne pour Revlimid.
Messages clés pour les professionnels de la santéNote de bas de page 15 :
- Des cas de leucoencéphalopathie multifocale progressive (LEMP), y compris des cas fatals, ont été signalés relativement à l’association de Revlimid et de traitements immunosuppresseurs, notamment par dexaméthasone.
- La LEMP devrait être considérée pour le diagnostic différentiel de patients chez qui des signes ou des symptômes neurologiques, cognitifs ou comportementaux sont apparus ou se sont aggravés. L’utilisation des mesures diagnostiques appropriées pour la LEMP est recommandée.
- Si l’on soupçonne une LEMP, on doit suspendre l’administration de lénalidomide jusqu’à ce que tout soupçon de LEMP ait été écarté.
- En cas de LEMP confirmée, le traitement par lénalidomide doit être cessé de façon permanente.
Référence
- Note de bas de page 15
-
Revlimid (lénalidomide) [monographie de produit]. Mississauga (Ont.): Celgene Inc.; 2018.
Nouvelles de Santé Canada
Plan d'action relatif aux instruments médicauxSanté Canada a élaboré un plan d'action pour accélérer ses efforts visant à renforcer la réglementation des instruments médicaux au Canada. Le plan propose des mesures visant à améliorer davantage la façon dont les instruments médicaux sont mis sur le marché ; à renforcer la surveillance et le suivi des appareils déjà utilisés ; et à fournir aux Canadiens plus d'information sur les instruments médicaux sur lesquels ils comptent.
Les nouvelles homologations de médicaments et d'instruments médicaux
Santé Canada met les Canadiens au courant des nouvelles homologations de médicaments et d'instruments médicaux de classe IV sur Twitter et LinkedIn en utilisant le mot-clic #Médicamentsetinstrumentsmédicaux. Dorénavant, il publiera aussi des mises à jour trimestrielles sur les médicaments et les instruments médicaux qui ont été homologués lors des trois mois précédents.
Consultation : Projet de règlement concernant le cannabis comestible, les extraits, et le cannabis pour usage topique
Santé Canada a lancé une consultation publique sur un projet de règlement portant sur les produits du cannabis additionnels, soit le cannabis comestible, les extraits de cannabis et le cannabis pour usage topique.
La consultation en ligne se poursuivra jusqu'au 20 février 2019.
Portée
Cette publication mensuelle s'adresse principalement aux professionnels de la santé et contient des informations sur les produits pharmaceutiques, biologiques, les matériels médicaux et les produits de santé naturels. Elle fournit un résumé des informations clés concernant l'innocuité des produits de santé qui ont été publiés au cours du mois précédent par Santé Canada, ainsi qu'une sélection de nouveaux renseignements en matière d'innocuité sur les produits de santé, pour en accroître la sensibilisation. Les nouvelles informations contenues dans ce numéro ne sont pas exhaustives, mais représentent plutôt une sélection de problèmes d'innocuité cliniquement pertinents, justifiant une dissémination améliorée.
Pour signaler des effets indésirables
Programme Canada Vigilance
Téléphone : 1-866-234-2345
Télécopieur ou courrier : formulaire disponible sur MedEffet Canada
Des renseignements sur la marche à suivre pour déclarer un effet indésirable à Santé Canada sont publiés à la page Déclaration des effets indésirables ou des incidents liés aux matériels médicaux.
Liens utiles
- MedEffetMC Canada
- Base de données sur les rappels et les avis de sécurité
- Nouveaux examens de l'innocuité ou de la sûreté
- Base de données en ligne des effets indésirables de Canada Vigilance
- Base de données sur les produits pharmaceutiques
- Liste des instruments médicaux homologués
- Base de données des produits de santé naturels homologués
- Registre des médicaments et des produits de santé
- Pénuries de médicaments Canada
- Tendances annuelles dans les déclarations de cas d'effets indésirables et des incidents liés aux matériels médicaux
Des suggestions?
Vos commentaires sont importants pour nous. Dites-nous ce que vous pensez en nous contactant à HC.infowatch-infovigilance.SC@canada.ca
Santé Canada
Direction des produits de santé commercialisés
Localisateur 1906C
Ottawa (Ontario) K1A 0K9
Téléphone : 613-954-6522
Télécopieur : 613-952-7738
Droit d'auteur
© 2019 Sa Majesté la Reine du Chef du Canada. Cette publication peut être reproduite sans autorisation à condition d'en indiquer la source en entier. Il est interdit de l'utiliser à des fins publicitaires. Santé Canada n'accepte pas la responsabilité de l'exactitude ou de l'authenticité des renseignements fournis dans les notifications.
On ne peut que soupçonner la plupart des effets indésirables (EI) des produits de santé à l'égard desquels on ne peut établir de lien prouvé de cause à effet. Les notifications spontanées d'EI ne peuvent servir pour déterminer l'incidence des EI, étant donné que les EI ne sont pas suffisamment signalés et l'étendue d'exposition des patients est inconnue.
En raison des contraintes de temps concernant la production de cette publication, les informations publiées peuvent ne pas refléter les informations les plus récentes.
Notes de fin de document
- Note de fin de document a
-
Glossaire des champs de la base de données en ligne des effets indésirables de Canada Vigilance
Retour à la première référence de la note de fin de document a
- Note de fin de document b
-
Deux déclarations avec type de déclarant inconnu n'ont pas été incluses dans le graphique