Vaccin contre l’hépatite B : Guide canadien d'immunisation
Pour les professionnels de la santé
Dernière mise à jour partielle du contenu (voir le Tableau des mises à jour des chapitres): mai 2022
Mai 2022 - Erratum :
Les notes de bas de page de la Figure 1 : Prise en charge des sujets exposés par voie percutanée ou muqueuse à une source infectée ou présentant un risque élevé et la description du texte accompagnant la figure ont été révisées pour être alignées sur la figure correspondante du Protocole d'immunisation du Québec, 5e édition (2009), dont elle a été adaptée.
Dernière révision complète du chapitre (voir le Tableau des mises à jour des chapitres): mars 2017
Sur cette page
- Principaux renseignements
- Épidémiologie
- Agents immunisants disponibles au Canada
- Immunogénicité, efficacité potentielle et efficacité réelle
- Indications
- Vaccination de populations particulières
- Tests sérologiques
- Administration du vaccin
- Entreposage et manipulation des agents immunisants
- Innocuité et effets secondaires
- Références choisies
Principaux renseignements (voir le texte pour plus de précisions)
Quoi
- Au Canada, la plupart des cas aigus d'hépatite B (HB) se déclarent chez les membres du même foyer non vaccinés d'un porteur de l'HB et chez les personnes d'au moins 25 ans qui contractent l'infection à la suite de rapports sexuels non protégés, du partage de matériel d'injection de drogues, ou d'interventions donnant lieu à une exposition percutanée. Une forte proportion des porteurs de l'HB au Canada sont des immigrants provenant de régions où cette maladie est endémique.
- La primo-infection par le virus de l'hépatite B (VHB) peut être asymptomatique dans une proportion de cas allant jusqu'à 50 % chez les adultes et 90 % chez les enfants.
- Les nourrissons, les jeunes enfants et les sujets immunodéprimés sont les plus susceptibles de devenir des porteurs chroniques du VHB.
- Le vaccin contre l'hépatite B (vaccin HB) a une efficacité pré-exposition de 95 à 100 %.
- Les réactions au vaccin HB, bénignes et transitoires, comprennent les suivantes : irritabilité, céphalées, fatigue, douleur et rougeur au point d'injection.
Responsables
- L'immunisation systématique contre l'hépatite B est recommandée chez tous les enfants.
- La prophylaxie pré-exposition par le vaccin HB est recommandée pour les groupes présentant un risque élevé.
- La prophylaxie post-exposition doit être offerte aux groupes suivants :
- bébés dont la mère est infectée par le VHB;
- sujets prédisposés ayant pu être exposés à du sang ou à des liquides organiques contaminés par le VHB;
- contacts familiaux et partenaires sexuels de sujets prédisposés atteints d'une hépatite B aiguë ou porteurs chroniques du VHB.
Comment
- Il existe un grand nombre de calendriers différents et de doses du vaccin à composant anti-hépatite B.
- Sauf quelques exceptions, les sujets chez qui le vaccin contre l'hépatite A (HA) et celui contre l'hépatite B (HB) sont indiqués doivent recevoir le vaccin combiné contre l'une et l'autre (vaccin HAHB).
Pourquoi
- Les individus atteints d'hépatite B aiguë peuvent devenir des porteurs chroniques et demeurer infectieux. L'infection chronique peut entraîner de graves hépatopathies.
- Les bébés de mères infectées sont les plus susceptibles de devenir des porteurs chroniques du VHB.
Les révisions importantes comprises dans le présent chapitre sont présentées dans le Tableau Mises à jour des chapitres du Guide canadien d'immunisation.
Épidémiologie
Description de la maladie
Agent infectieux
Le virus de l'hépatite B (VHB) est un virus à acide désoxyribonucléique (ADN) de la famille des Hepadnaviridiae. Plusieurs génotypes ont été décrits. Pour obtenir de plus amples renseignements sur le VHB, voir le site web du gouvernement du Canada.
Réservoir
Humains
Transmission
Le VHB se transmet par le contact percutané ou le contact des muqueuses avec des liquides biologiques infectieux. Sa transmission se produit par contact étroit avec des liquides organiques infectieux, notamment par le partage de matériel d'injection de drogues (p. ex. les aiguilles), lors de rapports sexuels, ou par les mères atteintes d'une infection aiguë ou porteuses du VHB qui transmettent l'infection à leur nouveau-né. Le risque de transmission du VHB par transfusion est extrêmement faible au Canada et aux États-Unis, étant donné que tout le sang et tous les produits sanguins sont maintenant soumis à des tests. La salive est considérée comme infectieuse dans les cas de morsure où la salive a pénétré dans la lésion ou lorsque la salive est visiblement teintée de sang. Près du tiers des cas d'infection par le VHB ne sont associés à aucun facteur de risque précis. La période d'incubation est de 45 à 180 jours (en moyenne 60 à 90 jours).
Deux antigènes sont importants dans l'évaluation des personnes infectées par le VHB et sont des marqueurs de portage de la maladie : l'antigène de surface de l'hépatite B (AgHBs), présent aussi bien dans l'infection aiguë que dans l'infection chronique, et l'antigène d'enveloppe de l'hépatite B (AgHBe), généralement associé à des charges virales supérieures, à une infectiosité accrue et à une réplication plus active du virus. L'AgHBs peut être décelé dans le sérum 30 à 60 jours après l'exposition, et persister jusqu'à la disparition de l'infection.
Les sujets au stade aigu de l'HB sont considérés comme infectieux. Dans la plupart des cas, des anticorps dirigés contre l'AgHBs (anticorps anti-HBs) apparaissent une fois l'AgHBs disparu et l'infection, résolue. Dans les cas d'hépatite B aiguë grave, des anti-HBs peuvent être présents en même temps que l'AgHBs. La présence des anti-HBs confère une immunité à long terme. En outre, chez les sujets ayant été exposés au virus, on observe également l'apparition d'anticorps dirigés contre l'antigène nucléocapsidique de l'hépatite B (anticorps anti-HBc). Ceci inclut les sujets actuellement infectés ainsi que les sujets ayant été infectés par le passé mais qui ont éliminé le virus. Les sujets qui présentent des anticorps anti-HBs et anti-HBc ne sont pas infectieux.
Certains sujets atteints d'une infection à VHB aiguë deviendront des porteurs chroniques. Ces sujets expriment l'AgHBs et peuvent également présenter l'AgHBe ainsi qu'une charge mesurable d'ADN du VHB dans leur sang. Ces cas sont infectieux. Pour de plus amples renseignements sur le dépistage de l'hépatite B, voir le site web du gouvernement du Canada.
Facteurs de risque
Ce sont les bébés nés de mères porteuses du VHB exposés au cours de l'accouchement qui courent le risque le plus élevé d'infection et de portage chronique subséquent. D'autres groupes courent aussi un risque accru : utilisateurs de drogues injectables, contacts familiaux de porteurs de l'hépatite B et personnes à risque de contracter des maladies transmissibles sexuellement. Au Canada, la plupart des cas aigus d'hépatite B se déclarent chez les membres du même foyer non vaccinés d'un porteur de l'hépatite B et chez les personnes d'au moins 25 ans qui contractent l'infection à la suite de rapports sexuels non protégés, du partage de matériel d'injection de drogues, ou d'interventions donnant lieu à une exposition percutanée. Les personnes subissant une dialyse sont également considérées comme à risque élevé. Une forte proportion des porteurs de l'hépatite B au Canada sont des immigrants provenant de régions où cette maladie est endémique.
Spectre de la maladie clinique
La primo-infection par le VHB peut être asymptomatique dans une proportion de cas allant jusqu'à 50 % chez les adultes et 90 % chez les enfants. Les symptômes, lorsqu'ils se manifestent, comprennent l'anorexie, des douleurs abdominales, des nausées, des vomissements et un ictère. La maladie aiguë peut durer jusqu'à 3 mois; elle est associée à un taux de létalité de 1 à 2 %, taux qui augmente avec l'âge. Les femmes enceintes courent un risque supérieur d'hépatite fulminante et de décès; le fœtus qu'elles portent est également exposé à des conséquences plus graves, notamment une naissance prématurée, l'asphyxie et le décès.
Bien que la plupart des personnes aient éliminé l'infection spontanément après quatre à huit semaines, le risque de devenir un porteur chronique est inversement proportionnel à l'âge auquel survient l'infection. Les nourrissons ont de 90 à 95 % de risques; les enfants de plus d'un an et de moins de cinq ans, de 25 à 50 % de risques; et les adolescents et adultes, de 3 à 10 % de risques d'être atteints d'une infection chronique. Le risque de devenir un porteur chronique est également plus élevé chez les personnes immunodéprimées et les adultes atteints de diabète, qui en outre peuvent courir un plus grand risque de contracter une maladie plus grave en raison de complications. Les porteurs chroniques sont à risque de développer une cirrhose et un carcinome hépatocellulaire.
Répartition de la maladie
Incidence et prévalence
À l'échelle mondiale
On estime à plus de deux milliards le nombre de personnes infectées par le virus de l'hépatite B dans le monde, dont environ 240 millions souffrent d'une infection chronique et 600 000 personnes meurent chaque année en raison de leur infection. Malgré la disponibilité de vaccins HB, le taux d'hospitalisation, de cancer et de décès liés à l'hépatite B a plus que doublé dans les dix dernières années.
L'hépatite B demeure fortement ou modérément endémique en Extrême-Orient, au Moyen-Orient, en Afrique, en Amérique du Sud, en Europe de l'Est et en Asie centrale, où les taux de portage chronique sont de 2 à 20 % dans la population générale. Pour une carte des pays et des régions à risque d'infection par le virus de l'hépatite B, voir l'Organisation mondiale de la Santé (OMS).
À l'échelle nationale
On considère qu'au Canada, l'hépatite B n'est que faiblement endémique. Moins de 5 % des résidents présenteraient des marqueurs d'une infection antérieure, et moins de 0,5 % sont porteurs du VHB. L'incidence de l'HB a diminué dans tous les groupes d'âge, un phénomène qui coïncide avec l'utilisation accrue du vaccin, et a pratiquement disparu dans les cohortes qui ont bénéficié des programmes d'immunisation systématique au Canada (voir le Tableau 1). Pour les derniers renseignements sur la répartition et l'épidémiologie de la maladie à l'échelle nationale, voir le rapport sur l'hépatite B et l'hépatite C au Canada : 2013.
| P/T | Année suivant l'introduction du programme pour les nourrissons à risque élevéNote de bas de page 1 | Programme de vaccination systématique en milieu scolaireNote de bas de page 2 | Programme de vaccination systématique des nourrissons ou à la naissance | Programmes universels actuels : âge au moment de la vaccination | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Catégorie | Durée | Nais-sance | 1 m. | 2 m. | 4 m. | 6 m. | 9 m. | 18 m. | 9 ans | 10 ans | 11 ans | 12 ans | |||
| N.-B. | 1984 | 4e | 1995-2005 | 1995 à ce jour |
1 dose | n.d. | 1 dose | n.d. | 1 dose | n.d. | n.d. | n.d. | n.d. | n.d. | n.d. |
| Î.-P.-É. | 1984 | 3e | 1995-2010 | 1995 à ce jour |
n.d. | n.d. | 1 dose | 1 dose | 1 dose | n.d. | n.d. | n.d. | n.d. | n.d. | n.d. |
| T.N.-O. | 1984 | 4e | 1995-2004 | 1995 à ce jour |
1 dose | 1 dose | n.d. | n.d. | 1 dose | n.d. | n.d. | n.d. | n.d. | n.d. | n.d. |
| C.-B. | 1984 | 6e | 1992-2001 | 2001 à ce jour |
n.d. | n.d. | 1 dose | 1 dose | 1 dose | n.d. | n.d. | n.d. | n.d. | n.d. | n.d. |
| Yn | 1983 | 4e | 1994-1998 | 1998 à ce jour |
n.d. | n.d. | 1 dose | 1 dose | 1 dose | n.d. | n.d. | n.d. | n.d. | n.d. | n.d. |
| Nt | 1984 | 4e | 1995-1999 | 1995 à ce jour |
1 dose | 1 dose | n.d. | n.d. | n.d. | 1 dose | n.d. | n.d. | n.d. | n.d. | n.d. |
| Qc | 1983 | 4eNote de bas de page 2 | 1994 à ce jour |
2013 à ce jour |
n.d. | n.d. | 1 dose | 1 dose | n.d. | n.d. | 1 dose | 2 doses | n.d. | n.d. | n.d. |
| Alb. | 1985 | 5e | 1995 à ce jour |
n.d. | n.d. | n.d. | n.d. | n.d. | n.d. | n.d. | n.d. | n.d. | 3 doses | n.d. | n.d. |
| Sask. | 1982 | 6e | 1995 à ce jour |
n.d. | n.d. | n.d. | n.d. | n.d. | n.d. | n.d. | n.d. | n.d. | n.d. | 2 doses | n.d. |
| Man. | 1985 | 4eNote de bas de page 3 | 1998 à ce jour |
n.d. | n.d. | n.d. | n.d. | n.d. | n.d. | n.d. | n.d. | 3 doses | n.d. | n.d. | n.d. |
| Ont. | 1984 | 7e | 1994 à ce jour |
n.d. | n.d. | n.d. | n.d. | n.d. | n.d. | n.d. | n.d. | n.d. | n.d. | n.d. | 2 doses |
| N.-É. | 1986 | 7eNote de bas de page 4 | 1995 à ce jour |
n.d. | n.d. | n.d. | n.d. | n.d. | n.d. | n.d. | n.d. | n.d. | n.d. | n.d. | 2 doses |
| T.-N.-L. | 1985 | 6eNote de bas de page 5 | 1995 à ce jour |
n.d. | n.d. | n.d. | n.d. | n.d. | n.d. | n.d. | n.d. | n.d. | n.d. | 2 doses | n.d. |
|
|||||||||||||||
Agents immunisants disponibles au Canada
Vaccins à composant anti-hépatite B
- ENGERIX-B (formulation pour adultes)et ENGERIX-B Pediatric (formulation pédiatrique) (vaccin recombinant contre l'hépatite B), GlaxoSmithKline Inc. (HB);
- INFANRIX hexa (vaccin adsorbé contenant les anatoxines diphtérique et tétanique, un vaccin anticoquelucheux acellulaire, un vaccin (recombinant) contre l'hépatite B, un vaccin antipoliomyélitique inactivé et un vaccin conjugué contre Haemophilus influenzae de type B), GlaxoSmithKline Inc. (DCaT-HB-VPI-Hib);
- RECOMBIVAX HB® (formulation pour adultes), RECOMBIVAX HB® Pediatric (formulation pédiatrique) et RECOMBIVAX HB® Adult dialysis (formulation pour adultes sous dialyse) (vaccin recombinant contre l'hépatite B), Merck Canada Inc. (HB);
- TWINRIX (formulation pour adultes) et TWINRIX Junior (formulation pédiatrique) (vaccin combiné contre l'HA et l'HB), GlaxoSmithKline Inc. (HAHB);
- PREHEVBRIOTM (vaccin recombinant contre l'hépatite B), VBI Vaccines Inc. (HB)*
* Le CCNI n'a pas encore délibéré sur l'utilisation de PREHEVBRIO. Le CCNI examinera ce vaccin et mettra à jour le chapitre en temps voulu. Veuillez consulter la monographie du produit disponible dans la Base de données sur les produits pharmaceutiques de Santé Canada pour obtenir plus de renseignements sur l'utilisation de ce vaccin.
Immunoglobulines anti-hépatite B
- HepaGam BMD (immunoglobuline anti-hépatite B [humaine]), KI BioPharma LLC. (IgHB);
- HyperHEP B® S/D (immunoglobuline anti-hépatite B [humaine]), Grifols Therapeutics LLC. (IgHB).
Les préparations d'immunoglobuline antihépatique B sont des solutions d'immunoglobuline contre l'hépatite B administrées par voie intramusculaire, qui sont préparées à partir d'un pool de plasma humain de donneurs ayant fait l'objet d'un dépistage contenant des titres élevés d'anticorps dirigés contre l'antigène de surface du virus de l'hépatite B. L'immunoglobuline antihépatique B offre une immunité passive immédiate de courte durée. Pour obtenir les renseignements thérapeutiques complets, voir le dépliant du produit ou l'information contenue dans la monographie de produit disponible dans la Base de données sur les produits pharmaceutiques de Santé Canada.
Voir le Contenu des agents immunisants autorisés au Canada de la partie 1 pour obtenir une liste des vaccins et des agents d'immunisation passive autorisés au Canada ainsi que des ingrédients qu'ils renferment.
Immunogénicité, efficacité potentielle et efficacité réelle
Immunogénicité
Les sujets qui présentent un titre d'anticorps anti-HBs d'au moins 10 UI/L (titre adéquat d'anti-HBs) après l'achèvement d'un calendrier recommandé (voir le Tableau 3) sont considérés comme protégés à vie. Les exceptions sont certains sujets immunodéprimés et les personnes atteintes de néphropathie chronique ou sous dialyse, qui peuvent nécessiter des doses de rappel périodiques si leurs titres d'anticorps anti-HBs sont inférieurs à 10 UI/L. Chez les personnes immunocompétentes, bien que les titres d'anticorps anti-HBs puissent devenir indétectables au fil du temps, une mémoire immunitaire persiste. En général, des titres élevés d'anticorps anti-HBs suivant la première immunisation prolongent la durée de la persistance des anticorps.
Des études ont mis en lumière l'immunogénicité du vaccin DCaT-HB-VPI-Hib pour les six antigènes contenus dans le vaccin. Les taux de séroprotection associés au vaccin HAHB ne sont pas inférieurs, et peuvent même être supérieurs, à ceux des vaccins monovalents contre l'HA et l'HB.
Le principal déterminant des taux de séroprotection obtenus par la vaccination contre l'HB est l'âge à la vaccination. Les enfants de moins de deux ans affichent un taux de réponse de 95 %, mais la meilleure réponse immunitaire (taux de séroprotection de 99 %) a été relevée chez les sujets de 5 à 15 ans. En règle générale, le taux de réponse chez les adultes diminue avec l'âge. En outre, le résultat de l'immunisation varie également selon le calendrier utilisé, la dose et l'état de santé de la personne vaccinée. Chez les sujets immunodéprimés, par exemple ceux infectés par le VIH, la réponse diminuera proportionnellement au degré d'immunodéficience. La réponse anticorps est également plus faible chez les patients atteints de diabète sucré (70 à 80 %), d'insuffisance rénale (60 à 70 %) et d'hépatopathie chronique (60 à 70 %). La plupart des gens sous dialyse chronique ne présentent pas de mémoire immunitaire. Il se peut également que les titres d'anticorps soient inférieurs chez les personnes obèses, les fumeurs et les personnes souffrant d'alcoolisme.
Efficacités potentielle et réelle
Pré-exposition
Lorsque le vaccin à composant anti-HB est fourni selon le calendrier recommandé, son efficacité est de 95 à 100 % pour prévenir l'infection chronique pendant au moins 30 ans suivant l'immunisation.
Post-exposition
Le vaccin HB associé à une dose d'IgHB, administré dans les 24 heures suivant la naissance, permet de prévenir la maladie chez 85 à 95 % des nouveau-nés exposés. Ce vaccin est hautement efficace dans la prévention lorsqu'il est administré dans un délai d'une semaine suivant l'exposition par voie percutanée ou muqueuse à du sang contaminé par le VHB ou dans un délai de deux semaines suivant des rapports sexuels avec des personnes infectées. Une dose unique d'IgHB est efficace à 75 % si elle est administrée dans les deux semaines suivant la dernière exposition sexuelle. On ne connaît pas les bienfaits des IgHB lorsqu'elles sont administrées plus de sept jours après l'exposition par voie percutanée ou muqueuse, ou plus de 14 jours après l'exposition sexuelle.
Indications
Immunisation pré-exposition
Nourrissons et enfants (âgés de moins de 18 ans)
Calendrier systématique
L'âge auquel le vaccin à composant anti-HB est offert varie selon la province ou le territoire. Le vaccin à composant anti-HB doit donc être fourni en fonction des calendriers d'immunisation, au moyen de la dose recommandée pour le produit (voir le Tableau 3). Dans les provinces/territoires où le vaccin HB n'est pas administré à la naissance ou durant la petite enfance, le vaccin à composant anti-HB doit être administré dès qu'un risque accru a été déterminé chez les enfants (voir le Tableau 2).
Si un vaccin monovalent contre l'HB est administré, le calendrier privilégié (tout particulièrement pour les nourrissons de moins de 12 mois) est le mois 0 (première dose), le mois 1 et le mois 6. Pour les nourrissons vaccinés à la naissance, la dose administrée à la naissance est le mois 0. L'intervalle minimal entre la première et la deuxième dose du vaccin est de quatre semaines, l'intervalle minimal entre la deuxième et la troisième dose est de deux mois, et l'intervalle minimal entre la première et la troisième dose est de quatre mois. Le vaccin monovalent contre l'HB est le produit de choix pour les enfants atteints d'affections qui nécessitent une dose plus forte de l'antigène de l'HB, notamment ceux qui souffrent d'insuffisance rénale chronique et qui sont immunodéprimés.
Si un vaccin combiné est fourni, l'un ou l'autre calendrier suivant peut être utilisé :
- le vaccin DCaT-HB-VPI-Hib (à l'âge de 2, 4 et 6 mois) et le vaccin DCaT-VPI-Hib (entre 12 et moins de 24 mois),
- le vaccin DCaT-HB-VPI-Hib (à l'âge de 2 et 4 mois et entre 12 et moins de 24 mois) et le vaccin DCaT-VPI-Hib (à 6 mois).
Le vaccin DCaT-HB-VPI-Hib peut être administré à l'âge de 2, 4 et 6 mois et entre l'âge de 12 et moins de 24 mois, mais il est peu probable que la quatrième dose confère une protection additionnelle importante, et elle augmentera le coût. Ce vaccin est indiqué pour les enfants âgés de six semaines à moins de 24 mois, mais au besoin, il peut être administré aux enfants de moins de 7 ans.
Chez les enfants présentant des indications relatives à l'immunisation contre l'HA et l'HB, un vaccin combiné HAHB est le produit recommandé. Une fois une série de vaccins HAHB commencée, il est préférable de la compléter par ce même vaccin.
Calendrier de vaccination de rattrapage
Le vaccin à composant anti-HB, moyennant la dose et le calendrier appropriés selon l'âge, doit être administré à tous les enfants et adolescents n'ayant pas suivi le programme de vaccination systématique (voir le Tableau 3).
Tableau 2 : Sujets chez qui le vaccin contre l'HB est recommandé pour la prophylaxie pré-exposition (pour la prophylaxie post-exposition, voir la section Immunisation post-exposition)
Tableau 2 : Sujets chez qui le vaccin contre l'HB est recommandé pour la prophylaxie pré-exposition
- Les adultes et les enfants qui ont immigré au Canada en provenance de pays à forte prévalence de l'HBFootnote 1.
- Les enfants nés au Canada dont les familles ont immigré au pays en provenance de régions à forte prévalence de l'HBFootnote 1 et qui pourraient être exposés au virus par l'intermédiaire de porteurs au sein de leur famille élargie ou lors de séjours dans leur pays d'origine.
- Les enfants et les travailleurs de garderies où se trouve un enfant ou un travailleur infecté par le VHB (cas aigu ou porteur).
- Les contacts familiaux et partenaires sexuels de cas aigus d'HB ou de porteurs du VHB.
- Les contacts familiaux ou les proches des enfants adoptés de pays où l'HB est endémiqueFootnote 1, si l'enfant adopté est positif pour l'AgHBs.
- Les populations ou les collectivités dans lesquelles l'HB est fortement endémique.
- Les résidents et le personnel d'établissements pour personnes atteintes de troubles du développement.
- Le personnel et les détenus d'établissements correctionnels.
- Les personnes dont les habitudes de vie les exposent à un risque d'infection, notamment :
- les personnes qui ont des rapports sexuels non protégés avec de nouveaux partenaires;
- les personnes qui ont eu plus d'un partenaire sexuel au cours des 6 mois précédents;
- les personnes ayant des antécédents d'infections transmissibles sexuellement;
- les personnes qui se présentent pour une évaluation ou un traitement en raison d'une infection transmissible sexuellement;
- les personnes qui s'adonnent à des pratiques sexuelles à haut risque;
- les utilisateurs de drogues injectables;
- les hommes ayant des relations sexuelles avec d'autres hommes (HARSAH).
- Les sujets atteints d'hépatopathie chronique, sans égard à la cause, dont ceux atteints d'hépatite C. Ces personnes ne sont pas nécessairement exposées à un risque accru d'HB, mais la maladie pourrait être plus grave dans leur cas.
- Les hémophiles et autres personnes appelées à recevoir de façon répétée du sang ou des produits sanguins.
- Les sujets atteints de néphropathie chronique, notamment ceux qui subissent une dialyse de longue durée (hémodialyse ou dialyse péritonéale).
- Les personnes ayant une immunodéficience congénitale.
- Les personnes qui ont subi une greffe de cellules souches hématopoïétiques (GCSH) ou qui attendent une transplantation d'un organe plein.
- Les personnes infectées par le VIH.
- Les voyageurs qui se rendent dans des régions où l'HB est endémiqueFootnote 1.
- Travailleurs de la santé, travailleurs des services d'urgence et autres personnes susceptibles d'être exposées dans le cadre de leur travail à du sang, à des produits sanguins et à des liquides organiques pouvant être contaminés par le VHB.
- Toute personne qui désire réduire son risque d'HB.
Adultes (18 ans et plus)
Les personnes qui courent un risque accru d'être exposées à l'HB ou de subir les complications de cette maladie doivent recevoir un vaccin HAHB ou monovalent (voir le Tableau 3). Il faut encourager toutes les personnes qui désirent réduire leur risque de contracter l'HB à se faire vacciner. Comme le taux de réponse chez les adultes diminue avec l'âge, l'immunisation à un plus jeune âge est recommandée.
À l'exception des personnes atteintes d'insuffisance rénale chronique ou de certaines affections liées à l'immunodépression qui ont besoin d'une dose plus forte de l'antigène de l'HB, les adultes présentant des indications relatives à l'immunisation contre l'HA et l'HB doivent recevoir le vaccin HAHB (voir le Tableau 3). Une fois une série de vaccins HAHB commencée, il est préférable de la compléter par ce même vaccin. Un vaccin monovalent HB peut être utilisé pour terminer une série vaccinale contre l'HB ayant commencé par un vaccin HAHB. Un vaccin HAHB peut être utilisé pour terminer une série de vaccins contre l'HB ayant commencé par un vaccin monovalent à l'aide du calendrier recommandé (0, 1 et 6 mois).
| Receveurs | Vaccin | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Monovalent HB | DCaT-HB-VPI-Hib | HAHB | |||||||||||||
| RECOMBIVAX HBMD | ENGERIXMD-B | INFANRIX hexaMD | TWINRIXMD | TWINRIXMD Junior | |||||||||||
| µg AgHBsNotes de bas de page 1 |
mLNotes de bas de page 2 | CalendrierFootnote 3 | µg AgHBsFootnote 1 |
mLNotes de bas de page 2 | CalendrierNotes de bas de page 3 | µg AgHBsFootnote 1 |
mLNotes de bas de page 2 | Calendrier | µg AgHBsFootnote 1 |
mLNotes de bas de page 2 | CalendrierNotes de bas de page 3 | µg AgHBsFootnote 1 |
mLNotes de bas de page 2 | CalendrierNotes de bas de page 3 | |
| Nourrissons et enfants | |||||||||||||||
| Nourrissons de moins de six mois nés de mères non infectées par le virus de l'HB | 5 | 0,5Footnote 4 | 0, 1, 6Footnote 5 | 10 | 0,5 | 0, 1, 6 ou 0, 1, 2, 12 |
10 | 0,5 | Mois : |
Non indiqué | Non indiqué | ||||
| Bébés de mères infectées par le VHBFootnote 6 | 5 | 0,5 | 0, 1, 6Footnote 5 | 10 | 0,5 | 0, 1, 6 ou 0, 1, 2, 12 |
Non indiqué avant l'âge de 6 semaines | Non indiqué | Non indiqué | ||||||
| De 6 à moins de 24 moisFootnote 7 | 5 | 0. 5Footnote 4 | 0, 1, 6Footnote 5 | 10 | 0,5 | 0, 1, 6 ou 0, 1, 2, 12 |
10 | 0,5 | Mois : (1re dose = mois 0) |
20 | 1,0 | 0, 6 à 12 | 10 | 0,5 | 0, 1, 6 |
| 24 mois à moins de 11 ans | 5 | 0,5Footnote 4 | 0, 1, 6Footnote 5 | 10 | 0,5 | 0, 1, 6 ou 0, 1, 2, 12 |
Peut être administré aux enfants âgés de 24 mois à moins de 7 ans, au besoin | 20 | 1,0 | 0, 6 à 12 | 10 | 0,5 | 0, 1, 6 | ||
| 11 à moins de 16 ans | 10 | 1,0 | 0, 4 à 6 | 20 | 1,0 | 0, 6 | Non indiqué | 20 | 1.0 | 0, 6 à 12 | 10 | 0,5 | 0, 1, 6 | ||
| 5 | 0,5 | 0, 1, 6Footnote 5 | 10Footnote 8 | 0,5 | 0, 1, 6 ou 0, 1, 2, 12 |
||||||||||
| 16 à moins de 19 ans | 5 | 0,5 | 0, 1, 6Footnote 5 | 10 | 0,5 | 0, 1, 6 ou 0, 1, 2, 12 |
Non indiqué | Non indiqué | 10 | 0,5 | 0, 1, 6 | ||||
| Enfants sous dialyse, atteints d'insuffisance rénale chronique, et parfois immunodéprimésFootnote 9, de moins de 16 ans | Doubler la dose en µg prévue pour un enfant sain du même âge | 0, 1, 6 ou 0, 1, 2, 12 |
Doubler la dose en µg prévue pour un enfant sain du même âge | 0, 1, 6 ou 0, 1, 2, 12 |
Non indiqué | Non indiqué | Non indiqué | ||||||||
| Sujets sous dialyse, atteints d'insuffisance rénale chronique, et parfois immunodéprimésFootnote 9, de 16 à moins de 20 ans | Doubler la dose en µg prévue pour un sujet sain du même âge | 0, 1, 6 ou 0, 1, 2, 12 |
40 | 2,0 | 0, 1, 2, 6 | Non indiqué | Non indiqué | Non indiqué | |||||||
| Adultes | |||||||||||||||
| 19 ans | 5 | 0,5 | 0, 1, 6Footnote 5 | 10 | 0,5 | 0, 1, 6 ou 0, 1, 2, 12 |
Non indiqué | 20 | 1,0 | 0, 1, 6 ou 0, jour 7, jour 21, mois 12 |
Non indiqué | ||||
| 20 ans et plus | 10 | 1,0 | 0, 1, 6Footnote 5 | 20 | 1,0 | 0, 1, 6 ou 0, 1, 2, 12 ou 0, jour 7, jour 21, mois 12 |
Non indiqué | 20 | 1,0 | 0, 1, 6 ou 0, jour 7, jour 21, mois 12 |
Non indiqué | ||||
| Adultes sous dialyse, atteints d'insuffisance rénale chronique, et parfois immunodéprimésFootnote 9, d'au moins 20 ans | 40Footnote 10 | 1,0 | 0, 1, 6 | 40 | 2,0 | 0, 1, 2, 6 | Non indiqué | Non indiqué | Non indiqué | ||||||
Abréviations : µg : microgrammes |
|||||||||||||||
Dose de vaccin plus élevée
Pour les personnes atteintes d'une néphropathie chronique et certaines personnes atteintes d'affections liées à l'immunodépression, une dose plus élevée du vaccin monovalent contre l'HB est recommandée. Il faut tenir compte de l'offre d'une dose plus forte du vaccin à des sujets souffrant d'une hépatopathie avancée qui ne démontre pas un titre adéquat d'anti-HBs après la première série de vaccination (voir le Tableau 3 pour connaître le calendrier).
La dose plus forte du vaccin monovalent HB est définie comme suit :
- chez les enfants âgés de 0 à moins de 16 ans, doubler la dose systématique (prévue pour leur âge) du vaccin monovalent HB;
- chez les jeunes de 16 à moins de 20 ans :
- dose de 40 microgrammes (µg) du vaccin ENGERIXMD-B; OU
- doubler la dose systématique (prévue pour leur âge) du vaccin RECOMBIVAX HBMD;
- pour les adultes de 20 ans et plus : dose de 40 µg du vaccin monovalent HB.
Voir le Calendrier d'administration des vaccins de la partie 1 pour plus de renseignements sur les retards dans les calendriers de vaccination et les calendriers de vaccination accélérés.
Pour d'autres renseignements contenus dans la monographie de produit, voir la Base de données sur les produits pharmaceutiques de Santé Canada.
Doses de rappel et revaccination
Il n'est pas recommandé d'administrer systématiquement des doses de rappel du vaccin HB aux sujets immunocompétents. Les personnes présentant un risque élevé d'infection par le VHB ou de complications (voir les tests sérologiques post-immunisation) qui n'obtiennent pas des titres d'anti-HBs d'au moins 10 UI/L après la première série de vaccins HB doivent en recevoir une deuxième série. Des doses supplémentaires de vaccin (jusqu'à trois doses) reçues lors d'une deuxième série d'immunisation produiront une réponse anticorps protectrice chez 50 à 70 % des adultes et enfants en bonne santé n'ayant pas répondu au vaccin au départ. Les sujets qui ne présentent pas de réponse avec trois doses supplémentaires de vaccin sont peu susceptibles de tirer profit de mesures d'immunisation additionnelles; ils doivent donc être conseillés au sujet d'autres mesures de réduction des risques.
Les sujets immunodéprimés et les personnes atteintes d'une néphropathie chronique qui ont répondu au départ au vaccin HB pourraient avoir besoin de doses de rappel de temps à autre si leurs titres d'anticorps anti-HBs sont inférieurs à 10 UI/L. Si une dose de vaccin plus élevée était indiquée pour la série vaccinale initiale, une dose supérieure du vaccin HB doit être utilisée pour toutes les immunisations ultérieures.
Immunisation post-exposition
Pour la prophylaxie post-exposition (PPE), le vaccin HB constitue l'intervention la plus importante, car il assure 90 % de la protection contre l'HB. Les IgHB, par leur immunité passive immédiate de courte durée, peuvent offrir un certain degré de protection supplémentaire. Une prophylaxie post-exposition (PPE) doit être offerte aux sujets prédisposés dans les situations suivantes :
- Bébés dont la mère est atteinte d'HB aiguë ou chronique;
- Exposition par voie percutanée ou muqueuse à du sang ou à des liquides organiques potentiellement contaminés par le VHB;
- Partenaires sexuels ou contacts familiaux de cas aigus d'HB ou de porteurs chroniques du VHB.
Bébés dont la mère est atteinte d'hépatite B aiguë ou chronique
Toutes les femmes enceintes devraient subir systématiquement un test de détection de l'AgHBs. Si un dépistage n'a pas été demandé pendant la grossesse, il doit être effectué de toute urgence au moment de l'accouchement. Si le statut de l'HB n'est pas établi chez la mère dans les 12 heures suivant l'accouchement, il faudrait envisager d'administrer le vaccin HB en attendant les résultats du test. Tout en tenant compte des facteurs de risque de la mère, on doit fournir l'IgHB s'il est soupçonné que la mère puisse être un cas aigu ou une porteuse chronique de l'AgHBs.
Tous les nouveau-nés dont la mère est infectée par l'HB doivent recevoir une dose du vaccin monovalent HB dans les 12 heures suivant leur naissance. Pour les nourrissons nés à terme, la deuxième et la troisième dose de la série de vaccin HB doivent être administrées à l'âge d'un et six mois, la dose à six mois peut également être administrée sous la forme du vaccin DCaT-HB-VPI-Hib. Tandis que le vaccin HB assure 90 % de la protection contre l'HB, les IgHB peuvent offrir un certain degré de protection supplémentaire. Une dose IM de 0,5 mL d'IgHB doit être administrée dès que possible aux bébés nés de mères infectées par l'HB, de préférence dans les 12 heures suivant la naissance. Bien que l'efficacité de l'IgHB diminue considérablement après 48 heures, elle peut tout de même être administrée jusqu'à sept jours après la naissance. L'IgHB peut être administrée en même temps que le vaccin contre l'hépatite B, mais à un point d'injection différent et à l'aide d'une aiguille et d'une seringue distinctes. Voir la section bébés prématurés pour obtenir de plus amples renseignements sur la PPE des bébés prématurés dont la mère est infectée par le virus.
Les bébés dont la mère est infectée ne doivent pas être soumis à un test de détection de l'AgHBs avant l'âge de neuf mois, afin d'éviter la détection d'anticorps anti-HBs passifs provenant de l'IgHB administrée à la naissance, et afin de maximiser la probabilité de détection d'une infection tardive par le virus de l'HB. Les épreuves de laboratoire doivent être menées au moins un mois et pas plus de quatre mois après l'administration de la dernière dose du vaccin. La présence de l'AgHBs signifie que l'enfant deviendra probablement porteur chronique. Si le nourrisson ne répond pas au vaccin (réponse négative pour l'antigène HBs et les anticorps anti-HBs), on doit administrer des doses additionnelles de vaccin, en procédant à des tests sérologiques répétés pour vérifier la réponse anticorps. Voir la section Doses de rappel et revaccination pour en savoir plus.
Exposition par voie percutanée (piqûre d'aiguille, morsure) ou muqueuse
La prise en charge d'une exposition potentielle à l'HB par voie percutanée ou muqueuse doit être fondée sur le statut de l'immunisation et des anticorps de la personne blessée et sur le statut infectieux (s'il est connu) de la personne source (voir la Figure 1 et la Figure 2). Les tests sur la personne source doivent être menés en accord avec les lignes directrices provinciales et territoriales. Si les résultats de l'évaluation effectuée chez la personne exposée et la source ne sont pas disponibles dans un délai de 48 heures, on devrait, aux fins du traitement, présumer que le sujet a pu être exposé. Dans les cas où cela est indiqué, des IgHB doivent être administrées aux sujets prédisposés dans les 48 heures suivant l'exposition (voir la Figure 1). L'efficacité de l'IgHB diminue considérablement après 48 heures, mais elle peut être administrée jusqu'à 7 jours après l'exposition. La dose d'IgHB pour les enfants plus âgés et les adultes est de 0,06 mL/kg de poids corporel par voie IM. Toutes les personnes à risque ou ayant été exposées au VHB doivent recevoir des conseils sur l'adoption de mesures de réduction du risque, jusqu'à ce que la série vaccinale soit terminée et que la présence de concentrations protectrices d'anti-HBs ait été établie.
Figure 1 : Prise en charge des sujets exposés par voie percutanée ou muqueuse à une source infectée ou présentant un risque élevéFigure 2 - Note de bas de page 1
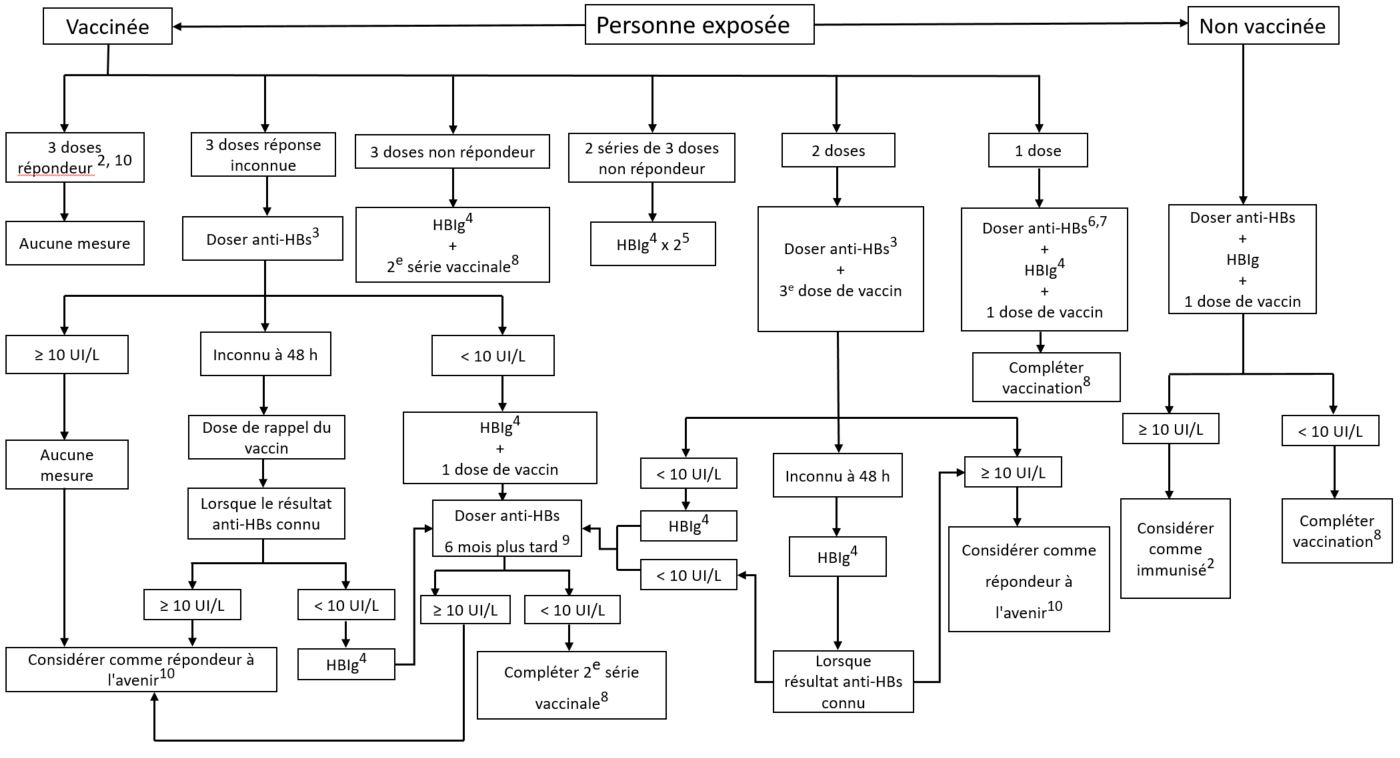
- Aucune intervention n'est requise si le sujet exposé est connu pour avoir été immunisé à la suite d'une infection par l'HB ou si il présente un titre d'anticorps d'au moins 10 UI/L après la fin de la série de vaccins recommandée contre l'HB.
- Déterminer le titre d'anti-HBs le plus rapidement possible. Des IgHB doivent être administrées aux sujets prédisposés dans les 48 heures suivant l'exposition. Les bienfaits de l'IgHB administrée plus de sept jours suivant l'exposition sont inconnus.
- Il ne faut pas administrer d'IgHB si le sujet source subit un test dans les 48 heures et que le résultat est négatif. Voir la Figure 2 pour obtenir des renseignements au sujet de la prise en charge des sujets exposés par voie percutanée ou muqueuse à une source non infectée.
- Administrer la deuxième dose d'IgHB quatre semaines après la première.
- Terminer la série vaccinale, peu importe le titre des anti-HBs. Cette information peut rassurer le sujet exposé à propos du risque immédiat d'infection qu'il court.
- Ne pas administrer d'IgHB s'il est possible d'obtenir une sérologie pour les anti-HBs dans les 48 heures et qu'un titre adéquat d'anti-HBs (au moins 10 UI/L) est confirmé.
- Déterminer le titre d'anti-HBs un à six mois après la fin de la série vaccinale.
- Il faut attendre six mois avant de faire le dosage des anti-HBs afin de permettre le déclin des anticorps anti-HBs.
- À l'exception des personnes immunodéprimées ou atteintes d'insuffisance rénale chronique; le cas échéant, il peut être nécessaire de répéter les tests sérologiques.
Abréviations :
AgHBs : antigène de surface de l'HB
Anti-HBs : anticorps dirigé contre l'antigène HBs
HB : hépatite B
IgHB : immunoglobuline contre l'HB
UI/L : unités internationales par litre
Cette figure est tirée du Protocole d'immunisation du Québec, 5e édition, 2009, reproduite avec la permission du ministère de la Santé et des Services sociaux du Québec.
Figure 1 : Traitement des sujets exposés par voie percutanée ou muqueuse à une source infectée ou présentant un risque élevé - Équivalent textuel
L'image ci-dessus présente un algorithme à propos de la prise en charge de personnes ayant subi une exposition percutanée ou une exposition des muqueuses à une source d'hépatite B (HB) infectée ou présentant un risque élevé. Cet algorithme est fondé sur l'immunisation et le statut des anticorps de la personne touchée et sur l'état infectieux de la source, s'il est connu. Selon la remarque dans le bas de l'algorithme, une source connue est considérée comme présentant « un risque élevé si la personne est originaire d'une région où l'HB est hautement endémique, a des relations sexuelles avec différents partenaires, a un conjoint infecté par l'HB ou à haut risque de l'être, vit dans la même maisonnée qu'une personne infectée, consomme des drogues injectables ou a reçu du sang ou des produits sanguins avant 1970. Dans la mesure du possible, la source devrait être testée. Dans le cas d'une source inconnue, les circonstances personnelles peuvent fournir une indication du degré de risque. »
Aucune intervention n'est requise si la personne exposée a été immunisée à la suite d'une infection par l'HB ou si elle présente un titre d'anticorps d'au moins 10 UI/L après la fin de la série de vaccins recommandée contre l'HB. On ne peut pas présumer que les personnes immunodéprimées, celles atteintes d'insuffisance rénale chronique ou celles subissant une dialyse sont immunisées contre cette maladie pour le reste de leur vie; elles doivent donc subir des tests sérologiques advenant une exposition ultérieure au virus de l'HB.
Dans les cas où cela est indiqué, l'immunoglobuline contre l'hépatite B (HBIg) devrait être administrée aux personnes à risque dans les 48 heures suivant leur exposition. On ne connaît pas les bienfaits de l'HBIg administrée plus de sept jours suivant l'exposition. Son administration doit être omise si la source est testée dans les 48 heures et que le résultat est négatif.
L'algorithme classe les personnes exposées dans les groupes de personnes vaccinées et non vaccinées.
Le groupe de personnes vaccinées est divisé en six catégories.
La première catégorie comprend les personnes ayant présenté une réponse aux trois doses du vaccin ainsi qu'un titre attesté d'anticorps anti-hépatite B (anti-HBs) d’au moins 10 UI/L lors de tests préalables. Aucune intervention n'est requise si le sujet exposé est connu pour avoir été immunisé à la suite d'une infection par l'HB ou s’il présente un titre d'anticorps d'au moins 10 UI/L après la fin de la série de vaccins recommandée contre l'HB. Elles sont considérées immunisées et aucune mesure supplémentaire n'est requise, à moins qu'elles ne sont immunodéprimées, qu'elles souffrent d'insuffisances rénales chroniques ou qu'elles sont sous dialyse; le cas échéant, il peut être nécessaire de répéter les tests sérologiques.
La deuxième catégorie comprend les personnes dont on ignore la réponse à trois doses antérieures de vaccin. Pour ces dernières, un test d'anticorps anti-HBs est requis dans les plus brefs délais, et celles-ci doivent être vaccinées en fonction de leurs résultats sérologiques :
- Si le titre est d'au moins 10 UI/L, aucune mesure supplémentaire n'est requise. Il faut considérer la personne comme répondeuse dans le futur, à moins qu'elle ne soit immunodéprimée, qu'elle souffre d'insuffisance rénale chronique ou qu'elle soit sous dialyse; le cas échéant, il peut être nécessaire de répéter les tests sérologiques.
- Si le titre est inférieur à 10 UI/L, l'HBIg et une dose du vaccin devraient être administrées. L'administration de HBIg peut être omise si la source présentant un risque élevé peut être testée dans les 48 heures et que le résultat est négatif, auquel cas l'algorithme de la source non infectée (Figure 2) serait suivi. Il faut attendre six mois avant de refaire un nouveau test des anti-HBs afin de permettre le déclin des anticorps anti-HBs. Si le titre d'anticorps est d'au moins 10 UI/L, il faut considérer la personne comme répondeuse dans le futur, à moins qu'elle ne soit immunodéprimée, qu'elle souffre d'insuffisance rénale chronique ou qu'elle soit sous dialyse; le cas échéant, il peut être nécessaire de répéter les tests sérologiques. Si le titre d'anticorps reste inférieur à 10 UI/L lors d'un nouveau test, l'algorithme demande une deuxième série de vaccination.
- Si le titre n'est pas connu dans les 48 heures, les individus doivent recevoir une dose de rappel du vaccin HB. Lorsque les résultats des tests anti-HBs sont connus : les personnes ayant un titre d'au moins 10 UI/L ne nécessitent aucune action supplémentaire et peuvent être considérées comme répondeuses dans le futur, à moins qu'elles ne soient immunodéprimées, qu'elles souffrent d'insuffisance rénale chronique ou qu'elles soient sous dialyse; le cas échéant, il peut être nécessaire de répéter les tests sérologiques. Les personnes ayant un titre inférieur à 10 UI/L doivent recevoir des HBIg, sauf si la source présentant un risque élevé peut être testée dans les 48 heures et que le résultat est négatif; le cas échéant, l'administration de HBIg peut être omise. Si l'administration d'HBIg est indiquée, la personne doit subir un nouveau test de dépistage des anticorps anti-HBs après 6 mois pour permettre aux anticorps anti-HBIg de s'estomper. Si le titre d'anticorps de l'individu reste inférieur à 10 UI/L, l'algorithme demande une deuxième série de vaccination.
La troisième catégorie comprend les personnes qui ont reçu trois doses du vaccin, mais qui n'ont présenté aucune réponse. Ces personnes doivent recevoir des HBIg, sauf si la source présentant un risque élevé peut être testée dans les 48 heures et que le résultat est négatif; le cas échéant, l'administration des HBIg peut être omise. Toutes les personnes devraient recevoir une deuxième série de vaccins et si l'administration d'HBIg est indiquée, la détermination du titre d'anti-HBs devrait avoir lieu de un à six mois après la fin de la série vaccinale.
La quatrième catégorie comprend les personnes qui ne réagissent pas après l'administration de deux séries de trois doses de vaccin. Ces individus nécessitent une intervention avec deux doses de HBIg, à moins que la source présentant un risque élevé puisse être testée dans les 48 heures et que le résultat soit négatif; le cas échéant, l'administration de HBIg peut être omise. Si l'administration de HBIg est indiquée, il faut administrer la deuxième dose de HBIg un mois après la première.
La cinquième catégorie comprend toutes les personnes ayant reçu deux doses du vaccin contre l'HB. Elles devraient subir un test d'anticorps anti-HBs dès que possible et recevoir une troisième dose du vaccin. Des mesures d'immunisation supplémentaires peuvent s'avérer nécessaires selon le résultat sérologique :
- Si le titre est d'au moins 10 UI/L, aucune autre action n'est requise. Il faut considérer la personne comme répondeuse dans le futur, à moins qu'elle ne soit immunodéprimée, qu'elle souffre d'insuffisance rénale chronique ou qu'elle soit sous dialyse; le cas échéant, il peut être nécessaire de répéter les tests sérologiques.
- Si le titre d'anticorps est inférieur à 10 UI/L, des HBIg doivent être administrées, sauf si la personne à risque élevé peut être testée dans les 48 heures et que le résultat est négatif; le cas échéant, l'administration des HBIg peut être omise. Un nouveau test du titre d'anti-HBs doit être reporté de 6 mois pour permettre aux anticorps anti-HBIg de s'estomper. Si le titre d'anticorps reste inférieur à 10 UI/L lors du nouveau test, l'algorithme demande une deuxième série de vaccination. Si le titre d'anticorps est d'au moins 10 UI/L lors du nouveau test, il faut considérer la personne comme répondeuse dans le futur, à moins qu'elle ne soit immunodéprimée, qu'elle souffre d'insuffisance rénale chronique ou qu'elle soit sous dialyse; le cas échéant, un nouveau test sérologique peut être nécessaire.
- Si le titre est inconnu dans les 48 heures, les individus doivent recevoir des HBIg, sauf si la source présentant un risque élevé peut être testée dans les 48 heures et que le résultat est négatif; le cas échéant, l'administration de HBIg peut être omise. Lorsque les résultats des tests anti-HBs sont connus : les personnes dont le titre est d'au moins 10 UI/L ne nécessitent aucune action supplémentaire; les personnes dont le titre est inférieur à 10 UI/L doivent subir un nouveau test anti-HBs après 6 mois pour permettre aux anticorps anti-HBIg de s'estomper. Si le titre d'anticorps individuel reste inférieur à 10 UI/L, l'algorithme demande une deuxième série de vaccination.
La sixième catégorie de l'algorithme comprend les individus vaccinés avec une seule dose de vaccin contre l'hépatite B. L'étape suivante avec ces personnes est de tester les anti-HBs. Ces personnes devront compléter leur série de vaccins quel que soit le titre d'anti-HBs. L'administration de HBIg peut être omise si le résultat du test d'anti-HBs peut être obtenu rapidement dans les 48 heures et est d'au moins 10 IU/L ou si la source présentant un risque élevé peut être testée dans les 48 heures et que le résultat est négatif. Si l'administration de l'HBIg est indiquée, il est recommandé de l'administrer en même temps qu'une dose de vaccin HB. Le titre anti-HBs doit être déterminé 1 à 6 mois après la fin de la série vaccinale.
Le groupe de personnes non vaccinées devrait subir un test d'anticorps anti-HBs et se voir administrer des HBIg ainsi qu'une dose unique du vaccin. Si le titre est d'au moins 10 UI/L, il faut considérer la personne immunisée. Aucune intervention n'est requise si le sujet exposé est connu pour avoir été immunisé à la suite d'une infection par l'HB ou s’il présente un titre d'anticorps d'au moins 10 UI/L après la fin de la série de vaccins recommandée contre l'HB. Si la concentration d'anticorps se trouve en-dessous de 10 UI/L, la série de vaccins devrait être terminée et la concentration d'anti-HB devrait être déterminée de 1 à 6 mois suivant la série de vaccins.
La figure a été adaptée du Protocole d'immunisation du Québec, 5e édition, 2009, et a été publiée avec la permission du ministère de la Santé et des Services sociaux du Québec.
Figure 2 : Prise en charge des sujets exposés par voie percutanée ou muqueuse à une source non infectée ou à faible risque
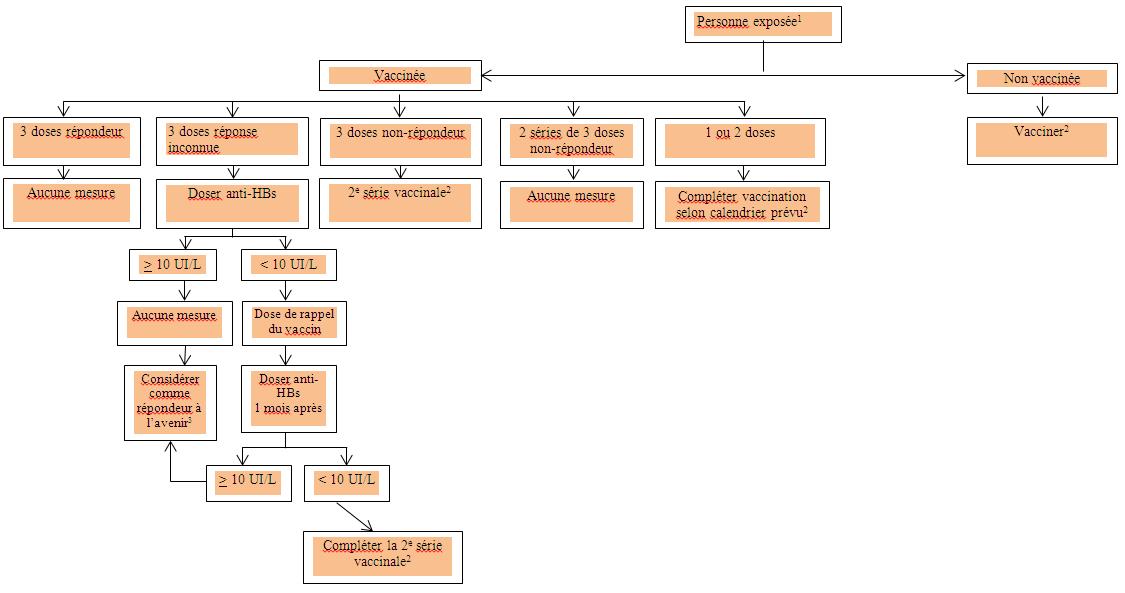
- Aucune intervention n'est requise dans le cas d'un sujet exposé dont on sait qu'il a acquis une immunité à la suite d'une infection par le VHB.
- Déterminer le titre d'anti-HBs un à six mois après la fin de la série vaccinale
- À l'exception des personnes immunodéprimées, atteintes d'insuffisance rénale chronique, ou sous une dialyse chronique, auxquels cas il peut être nécessaire de répéter les tests sérologiques.
Abréviations :
AgHBs : antigène de surface de l'HB
Anti-HBs : anticorps dirigé contre l'antigène HBs
HB : hépatite B
IgHB : immunoglobuline contre l'HB
UI/L : unités internationales par litre
Cette figure est tirée du Protocole d'immunisation du Québec, 5e édition, 2009, reproduite avec la permission du ministère de la Santé et des Services sociaux du Québec.
Figure 2 : Traitement des sujets exposés par voie percutanée ou muqueuse à une source non infectée ou présentant un faible risque - Équivalent textuel
L'image ci-dessus présente un algorithme à propos de la prise en charge de personnes ayant subi une exposition percutanée ou une exposition des muqueuses à une source d' HB non infectée ou présentant un faible risque. L'algorithme classe ces personnes dans les groupes de personnes vaccinées, exposées et non vaccinées. Aucune intervention n'est requise dans le cas d'un sujet exposé dont on sait qu'il a acquis une immunité à la suite d'une infection par le VHB. Le groupe de personnes vaccinées est divisé en cinq catégories.
La première catégorie comprend les personnes ayant répondu à trois doses du vaccin, pour lesquelles aucune mesure supplémentaire n'est requise.
La deuxième catégorie comprend les personnes dont on ignore la réponse à trois doses du vaccin, pour lesquelles un test d'anticorps anti-HBs est requis. Selon les résultats du test, si le titre d'anticorps anti-HBs est d'au moins 10 UI/L, aucune mesure supplémentaire n'est requise. Cependant, les personnes présentant un titre inférieur à 10 UI/L nécessitent une dose unique de rappel du vaccin, et leur réponse immunitaire est testée un mois plus tard. Si le titre d'anticorps est toujours inférieur à 10 UI/L, une deuxième série de vaccins devrait être prise en considération, puis le titre d'anticorps anti-HBs devrait être déterminé un à six mois après l'administration des vaccins.
La troisième catégorie comprend les personnes n'ayant pas répondu à trois doses du vaccin. Toutes ces personnes devraient recevoir une deuxième série de vaccins, puis la concentration d'anticorps anti-HBs devrait être déterminée un à six mois après l'administration des vaccins.
La quatrième catégorie comprend les personnes n'ayant pas répondu aux deux séries de trois doses du vaccin contre l'hépatite B; aucune mesure supplémentaire n'est requise.
La cinquième catégorie comprend les personnes ayant reçu une dose ou deux doses du vaccin. Ces personnes doivent être vaccinées comme prévu; puis leur titre d'anticorps anti-HBs déterminé un à six mois plus tard.
Les personnes non vaccinées doivent être vaccinées; puis leur titre d'anticorps anti-HBs déterminé un à six mois plus tard après l'achèvement de la série de vaccins.
« La figure a été adaptée du Protocole d'immunisation du Québec, 5e édition, 2009, et a été publiée avec la permission du ministère de la Santé et des Services sociaux du Québec. »
Partenaires sexuels et contacts familiaux de cas d'hépatite B
Tous les partenaires sexuels et contacts familiaux non immuns et non infectés de cas aigus et de porteurs chroniques d'antigènes HBs doivent recevoir le vaccin HB et subir des tests permettant de vérifier la réponse anticorps un à six mois après la fin de la série vaccinale.
À l'exception des bébés dont la mère est infectée par le virus HB, il n'est pas indiqué d'administrer des IgHB aux contacts familiaux de cas aigus ou de porteurs chroniques de l'AgHBs. Pour les rapports sexuels avec un cas aigu ou un porteur chronique de l'HB, une dose unique d'IgHB (0,06 mL/kg de poids corporel) doit être administrée par voie IM dans les 48 heures suivant l'exposition. L'efficacité de l'IgHB diminue considérablement après 48 heures; l'immunoglobuline peut toutefois être administrée jusqu'à 14 jours après la dernière relation sexuelle. Dans les cas où il y a manifestement eu exposition au sang d'une personne infectée (p. ex. partage de brosses à dents ou de rasoirs), il faut procéder comme dans le cas d'une exposition par voie percutanée ou muqueuse.
Vaccination de populations particulières
Personnes dont le dossier de vaccination est incomplet
On a mis en évidence des données prouvant une protection à long terme contre le VHB chez les sujets vaccinés selon un calendrier de vaccination recommandé. Indépendamment de leurs titres d'anticorps anti-HBs, les enfants et adultes qui ne disposent pas de documents adéquats sur l'immunisation doivent être considérés comme prédisposés et recevoir le vaccin et les doses indiquées selon leur âge et leurs facteurs de risque. Voir le chapitre Immunisation des personnes dont le dossier de vaccination est incomplet de la partie 3 pour obtenir de plus amples renseignements.
Grossesse et allaitement
Toutes les femmes enceintes devraient subir systématiquement un test de détection de l'AgHBs. Pour les femmes enceintes non immunisées qui ne présentent pas de marqueurs d'infection par le VHB, mais qui sont exposées à un risque élevé d'HB, il faudrait envisager une vaccination complète à la première occasion. L'HB aiguë peut entraîner des symptômes graves chez la femme enceinte et une infection chronique chez le nouveau-né. Des tests sérologiques post-immunisation doivent être effectués au terme de la série vaccinale. Le vaccin HB peut être administré sans danger pendant la grossesse et l'allaitement, lorsque cela est indiqué.
L'innocuité du vaccin HAHB administré durant la grossesse n'a fait l'objet d'aucune étude; cependant, aucune raison théorique ne permet de soupçonner un risque accru d'événements indésirables chez la mère ou le bébé. Voir le chapitre Vaccin contre l'hépatite A de la partie 4 pour obtenir des renseignements sur la vaccination contre l'HA des femmes enceintes ou qui allaitent. Voir le chapitre Immunisation durant la grossesse et l'allaitement de la partie 3 pour obtenir de plus amples renseignements sur la vaccination contre l'HB des femmes enceintes ou qui allaitent.
Bébés prématurés
Nourrissons prématurés de mères négatives pour l'AgHBs
Il se pourrait que la réponse au vaccin HB soit diminuée chez les bébés nés prématurément dont le poids à la naissance est inférieur à 2 000 g. Là où la première dose du vaccin HB est systématiquement administrée à la naissance, l'immunisation systématique contre l'HB chez les bébés nés de mères dont on sait qu'elles sont négatives pour l'AgHBs doit être reportée jusqu'à ce que le bébé ait atteint 2 000 g ou avant qu'il ne quitte l'hôpital, le premier des deux prévalant.
Nourrissons prématurés de mères positives pour l'AgHBs
Tous les bébés prématurés, indépendamment de leur poids, dont la mère est positive pour l'AgHBs doivent recevoir la première dose du vaccin monovalent HB et les IgHB dans les 12 heures suivant leur naissance.
Les nourrissons prématurés pesant 2 000 grammes ou plus à la naissance nécessitent trois doses du vaccin HB : à la naissance et à l'âge d'un et six mois. Le vaccin monovalent HB doit être administré à la naissance et à un mois; le vaccin DCaT-HB-VPI-Hib peut être utilisé au mois 6.
Les nourrissons prématurés pesant moins de 2 000 grammes à la naissance doivent recevoir 4 doses du vaccin HB : à la naissance et à l'âge de 1, 2 et 6 mois. Le vaccin monovalent HB doit être administré à la naissance et au mois 1; le vaccin DCaT-HB-VPI-Hib peut être utilisé aux mois 2 et 6.
Voir le Tableau 4 et la section Immunisation post-exposition pour obtenir de plus amples renseignements.
Les nourrissons prématurés, en particulier ceux qui pèsent moins de 1 500 grammes à la naissance, présentent un risque accru d'apnée et de bradycardie après la vaccination par rapport à ceux nés à terme. Les nourrissons prématurés hospitalisés devraient faire l'objet d'une surveillance cardiaque et respiratoire continue pendant les 48 heures suivant leur première vaccination. Voir le chapitre sur l'Immunisation des nourrissons prématurés de la partie 3 pour obtenir des renseignements supplémentaires à propos de la vaccination chez les nourrissons prématurés.
| Statut de l'AgHBs chez la mère | Recommandation |
|---|---|
| Positif |
|
| Négatif |
|
| Inconnu |
|
Abréviations : Anticorps anti-HBs : anticorps dirigé contre l'antigène de surface de l'HB |
|
Personnes atteintes de maladies chroniques
Pour plus de renseignements sur la vaccination des personnes atteintes de maladies chroniques, voir le chapitre Immunisation des personnes atteintes de maladies chroniques de la partie 3.
Néphropathie chronique et patients sous dialyse
Les sujets atteints de néphropathie chronique peuvent répondre de façon sous-optimale au vaccin HB et présentent un déclin plus rapide de titres d'anticorps anti-HBs; on leur recommande donc une immunisation avec une dose du vaccin plus élevée. Les sujets subissant une dialyse chronique présentent également un risque accru d'infection par l'HB. Chez les personnes atteintes de néphropathie chronique, les titres d'anti-HBs doivent être évalués chaque année et des doses du vaccin plus élevée doivent être administrées si nécessaire.
Troubles neurologiques
Les personnes ayant un trouble du spectre autistique ou une maladie démyélinisante (y compris la sclérose en plaques) doivent recevoir tous les vaccins systématiquement recommandés, y compris le vaccin à composant anti-HB.
Hépatopathie chronique
L'immunisation contre l'HB est recommandée pour tous les sujets non immuns atteints d'hépatopathie chronique, notamment ceux infectés par le virus de l'hépatite C, car la maladie pourrait être plus grave dans leur cas. La vaccination devrait être terminée dans les premiers stades de la maladie, car la réponse immunitaire au vaccin est sous-optimale dans la forme avancée de la maladie. On peut recourir à des tests sérologiques post-immunisation pour confirmer la réponse au vaccin.
Les sujets souffrant d'une hépatopathie avancée, notamment ceux qui sont atteints d'une maladie causée par l'hépatite C, doivent être soumis à des tests sérologiques post-immunisation, et il faudrait envisager d'offrir une dose du vaccin plus élevée aux sujets qui ne démontrent pas un titre adéquat d'anti-HBs.
Troubles hématologiques bénins
Les personnes souffrant de troubles hémorragiques ou recevant des perfusions répétées de sang ou de produits sanguins sont considérées comme exposées à un risque accru de contracter l'HB; c'est pourquoi elles doivent recevoir le vaccin HB.
Sujets immunodéprimés
Le vaccin HB peut être administré aux sujets immunodéprimés (voir Tableau 3) et des doses de rappel doivent être fournies si leurs titres d'anticorps anti-HBs sont inférieurs à 10 UI/L. Lorsqu'on envisage de vacciner une personne immunodéprimée, une consultation auprès du médecin traitant peut être utile. Pour les cas complexes, il est recommandé de consulter un médecin spécialisé en immunisation et en immunodéficience.
À la suite de la primovaccination, la surveillance annuelle initiale des niveaux d'anticorps contre l'HB peut être envisagée, alors que le moment et la fréquence optimaux des tests sérologiques post-immunisation supplémentaires doivent être fondés sur la gravité de l'état d'immunodéficience et sur la question de savoir si le risque d'HB est toujours présent. Certains sujets immunodéprimés peuvent nécessiter des doses de vaccin plus élevée, des doses de rappel et des tests sérologiques post-immunisation. Voir les sections tests sérologiques post-immunisation et doses de rappel et revaccination pour obtenir de plus amples renseignements sur l'immunisation des personnes dont la réponse immunitaire au vaccin est sous-optimale. Voir le chapitre Immunisation des sujets immunodéprimés de la partie 3 pour obtenir davantage de renseignements.
Voyageurs
Le risque de contracter l'HB chez les voyageurs non immuns qui se rendent dans des pays en développement se situe, selon les estimations, dans un intervalle de 0,2 à 0,6/1 000 par mois, et il pourrait grimper chez les voyageurs qui s'adonnent à des activités à risque élevé et chez ceux qui travaillent dans un contexte de soins de santé. On devrait recommander le vaccin HB aux voyageurs qui prévoient séjourner dans des régions où l'HB est fortement endémique ou travailler dans des établissements de soins de santé, et aux voyageurs qui auront vraisemblablement des contacts avec du sang ou des contacts sexuels avec les résidents de ces régions. On recommande une immunisation complète contre l'HB pour les enfants qui vivront dans des régions où l'HB est endémique. Voir la carte des pays et des régions à risque d'infection par le virus de l'HB de l'OMS.
Il n'est pas nécessaire de demander des tests sérologiques chez la plupart des voyageurs en bonne santé qui ont déjà été vaccinés. Voir les tests sérologiques post-immunisation pour en savoir plus au sujet des groupes pour lesquels les dits tests sont recommandés.
Un vaccin HAHB peut être administré aux voyageurs sensibles à la fois au VHA et au VHB, le cas échéant. Dans le cas des voyageurs qui consultent moins de 21 jours avant le départ, il y a lieu d'administrer séparément les vaccins monovalents HA et HB, et le reste des deux séries vaccinales au retour. Voir le chapitre Vaccin contre l'hépatite A de la partie 4 et le chapitre Immunisation des voyageurs de la partie 3 pour obtenir de plus amples renseignements.
Nouveaux arrivants au Canada
Les fournisseurs de soins de santé qui examinent des nouveaux arrivants au Canada devraient évaluer leur état vaccinal et mettre à jour leurs vaccins, au besoin. Dans bien des pays, le vaccin HB est peu utilisé.
Toute personne venant d'un pays où l'HB est endémique devrait subir une évaluation de son statut à l'égard de l'HB et recevoir le vaccin HB si elle n'est pas déjà immunisée et n'est pas infectée. Les personnes nées dans des pays en développement sont plus susceptibles d'être porteuses du VHB, et il est donc nécessaire de vacciner les personnes avec qui elles ont des contacts sexuels et leurs contacts familiaux, selon l'examen des résultats de leurs tests sérologiques. Le vaccin HB est recommandé pour toutes les personnes qui vivent dans une famille ayant immigré au Canada en provenance de régions où l'HB est en forte prévalence, et qui pourraient être exposées à des porteurs du VHB au sein de leur famille élargie ou durant des séjours dans leur pays d'origine.
Les enfants adoptés de pays à forte prévalence de l'HB devraient être soumis à des tests de détection de l'AgHBs et, en cas de résultats positifs, les contacts familiaux et les contacts proches des familles d'adoption devraient être vaccinés avant l'adoption ou le plus tôt possible par la suite. Les adultes se déplaçant dans ces pays pour aller chercher les enfants devraient être vaccinés avant leur départ. Voir le chapitre Immunisation des personnes nouvellement arrivées au Canada de la partie 3 pour obtenir davantage de renseignements.
Travailleurs
La vaccination HB et des tests sérologiques post-immunisation sont recommandés pour les personnes qui courent un risque accru d'infection du fait qu'elles sont exposées, dans le cadre de leur travail, à du sang, des produits sanguins et des liquides organiques susceptibles d'être contaminés par le VHB. Dans ce groupe, on trouve tous les travailleurs de la santé et autres travailleurs (p. ex. personnel des établissements correctionnels ou des centres pour personnes atteintes de troubles du développement) qui pourraient être exposés à du sang ou à des produits sanguins, ou qui courent un risque de blessure due à un instrument contaminé par du sang, ou un risque de morsure ou de traumatisme pénétrant. Une telle vaccination est également recommandée pour les travailleurs d'établissements où se trouve un enfant ou un travailleur infecté par le VHB (cas aigu ou porteur). Comme le statut de l'HB chez les enfants dans les milieux de garde est généralement inconnu, on doit envisager la vaccination de tous les travailleurs des garderies. Les étudiants de toutes ces disciplines doivent avoir terminé leur série vaccinale avant l'exposition professionnelle.
Bien qu'il n'existe pas de données permettant de quantifier leur risque, on recommande également aux travailleurs des services d'urgence, par exemple les policiers et les pompiers qui peuvent présenter un risque accru d'exposition au VHB, de se faire vacciner. Le risque pour les travailleurs qui n'ont aucun contact avec du sang, des produits sanguins ou des liquides organiques n'est pas supérieur à celui de la population en général.
Pour les travailleurs dont la vaccination est insuffisante, ou qui déclarent avoir été vaccinés contre l'HB mais dont le dossier de vaccination est incomplet, voir le chapitre Personnes dont le dossier de vaccination est incomplet de la partie 3. Si un travailleur pour qui le vaccin HB est recommandé dispose de documents attestant l'administration de la série vaccinale complète contre l'HB, mais pas de documents prouvant des tests de détection des anticorps anti-HB après l'immunisation, des tests sérologiques doivent être effectués. De plus :
- si un titre adéquat d'anti-HBs est confirmé, il ne faut pas refaire de tests sérologiques et il n'est pas nécessaire d'administrer une dose de rappel du vaccin, sauf chez les sujets immunodéprimés et les personnes atteintes d'une néphropathie chronique ou qui subissent une dialyse;
- si des tests de détection d'anticorps anti-HBs sont effectués un à six mois après la vaccination et que le titre d'anti-HBs est inférieur à 10 UI/L, le travailleur doit alors recevoir une deuxième série vaccinale, suivie de tests sérologiques post-immunisation;
- si des tests de détection d'anticorps anti-HBs sont effectués plus de six mois après la vaccination et que le titre d'anti-HBs est inférieur à 10 UI/L, le travailleur doit recevoir une dose de rappel, suivie de tests sérologiques post-immunisation. En cas d'absence de réponse anamnestique à la suite de la dose de rappel, une deuxième série vaccinale HB doit être administrée et être suivie de tests sérologiques post-immunisation.
Les travailleurs qui disposent de données indiquant une absence de réponse à deux séries du vaccin HB (sujets chez lesquels aucun titre adéquat d'anti-HBs n'est démontré) ne bénéficieront probablement pas d'une autre vaccination, et ils auront besoin d'une immunisation passive après une exposition potentielle au virus.
Après une exposition potentielle au virus de l'HB, les travailleurs possédant un document prouvant un titre adéquat d'anti-HBs ne doivent pas subir de tests sérologiques post-immunisation, sauf s'ils sont immunodéprimés ou s'ils souffrent d'une néphropathie chronique. Ces travailleurs doivent subir un test de détection d'anticorps anti-HBs après une exposition potentielle au VHB et recevoir un vaccin supplémentaire ainsi que des IgHB si leur titre est inférieur à 10 UI/L.
Voir la Figure 1 et la Figure 2 pour obtenir de plus amples renseignements sur la PPE recommandée. Voir les sections Tests sérologiques et Doses de rappel et revaccination. Pour plus de renseignements sur la vaccination des travailleurs, voir le chapitre Immunisation des travailleurs de la partie 3.
Tests sérologiques
Pré-immunisation
Soins prénataux
Toutes les femmes enceintes doivent subir un test de détection de l'AgHBs. Dans le cas d'une femme enceinte non immunisée qui ne présente pas de marqueurs d'infection aiguë ou chronique par le VHB, mais qui est exposée à un risque élevé d'HB, il faudrait envisager une série vaccinale complète à la première occasion pendant la grossesse, puis vérifier la réponse anticorps.
Groupes à risque élevé
On recommande de procéder systématiquement à des tests sérologiques de détection de l'AgHBs ou du titre d'anticorps anti-HBs avant la vaccination pour les personnes présentant un risque élevé d'infection, y compris les personnes susceptibles d'être exposées par voie percutanée ou muqueuse au virus de l'HB. Les enfants adoptés de pays ou de familles où l'HB est fortement prévalent devraient être soumis à des tests de détection de l'AgHBs. En cas de résultats positifs, il est conseillé de vacciner les contacts familiaux ou les proches de la famille adoptive qui sont en contact avec l'enfant, avant l'adoption ou le plus tôt possible par la suite.
Post-immunisation
Nourrissons
Les bébés dont la mère est infectée par l'HB doivent subir un test de dépistage dès l'âge de neuf mois. Les tests doivent être effectués un à quatre mois après l'administration de la dernière dose du vaccin. Pour en savoir plus, voir la section tests sérologiques post-immunisation des bébés dont la mère est atteinte d'HB aiguë ou chronique.
Groupes à risque élevé
On recommande de procéder à des tests sérologiques post-immunisation du titre d'anticorps anti-HBs, de un à six mois après avoir terminé la série vaccinale, pour les groupes suivants :
- les sujets immunodéprimés;
- les sujets atteints de néphropathie chronique ou sous dialyse; les sujets atteints d'une hépatopathie au stade avancé;
- les candidats et bénéficiaires d'une transplantation d'organe plein;
- les femmes enceintes exposées à un risque élevé d'HB;
- les sujets susceptibles d'être exposés par voie percutanée ou muqueuse. Chez les personnes qui ont reçu une PPE assurée par l'injection d'IgHB, la détermination du titre d'anticorps anti-HBs doit être reportée de six mois;
- les partenaires sexuels et contacts familiaux de cas aigus d'HB ou de porteurs chroniques du VHB. Chez les personnes qui ont reçu une PPE assurée par l'injection d'IgHB, la détermination du titre d'anticorps anti-HBs doit être reportée de six mois;
- les travailleurs qui ont besoin d'une confirmation de l'immunité en raison d'un risque d'exposition professionnelle.
Une surveillance périodique du titre d'anticorps anti-HBs après l'immunisation est indiquée pour les groupes suivants :
- Chez les sujets immunodéprimés. La surveillance annuelle initiale des niveaux d'anticorps contre l'HB peut être envisagée au départ, alors que le moment et la fréquence optimaux des tests sérologiques supplémentaires doivent être fondés sur la gravité de l'état d'immunodéficience et sur la question de savoir si le risque d'HB est toujours présent.
- Chez les sujets atteints de néphropathie chronique ou sous dialyse. Les niveaux d'anticorps contre l'HB doivent être surveillés chaque année.
Administration du vaccin
Dose
Voir le Tableau 3 pour connaître les doses recommandées des différents vaccins.
Voie d'administration
Le vaccin à composant anti-HB doit être administré par voie IM.
Pour plus de renseignements sur le counseling précédant et suivant la vaccination, les techniques de préparation et d'administration de vaccins, ainsi que la prévention et le contrôle des infections, voir le chapitre Méthodes d'administration des vaccins de la partie 1.
Interchangeabilité des vaccins
On peut utiliser des vaccins monovalents HB de façon interchangeable, selon la posologie et le calendrier recommandés.
Voir le chapitre Principes de l'interchangeabilité des vaccins de la partie 1 pour obtenir de plus amples renseignements sur l'interchangeabilité des vaccins.
Administration simultanée de vaccins
Les vaccins à composant anti-HB peuvent être administrés en même temps que d'autres vaccins ou avec des IgHB. Dans le cas de vaccins administrés par voie parentérale au cours de la même visite, les points d'injection ne doivent pas être les mêmes, et une aiguille et une seringue différentes doivent être utilisées.
Voir le chapitre Calendrier d'administration des vaccins de la partie 1 pour obtenir plus de précisions sur l'administration simultanée de vaccins.
Entreposage et manipulation des agents immunisants
Voir le chapitre Manipulation et entreposage des agents immunisants de la partie 1 pour les recommandations relatives à l'entreposage et à la manipulation des vaccins à composant anti-HB.
Innocuité et effets secondaires
Effets secondaires courants et localisés
Vaccin HB
Le vaccin HB est bien toléré. Les réactions sont généralement bénignes et transitoires, et comprennent ce qui suit : irritabilité, céphalées, fatigue et réactions au point d'injection (p. ex. douleur et rougeur) chez 10 % ou plus des receveurs.
Vaccin HAHB
L'administration du vaccin HAHB n'est pas associée à une fréquence accrue d'effets secondaires par rapport au vaccin HA administré seul ou en même temps que le vaccin HB à un point d'injection différent. Lorsque la formulation pour adultes du vaccin HAHB est administrée selon le calendrier à deux doses, on n'a pas remarqué de fréquence plus élevée d'effets secondaires par rapport à ceux qui surviennent après l'administration de la formulation pédiatrique du vaccin.
Vaccin DCaT-HB-VPI-Hib
Les réactions sont généralement bénignes et transitoires, et comprennent les suivantes : fièvre, irritabilité, agitation et réactions au point d'injection (p. ex. rougeur, enflure et douleur).
IgHB
On observe parfois des céphalées, des diarrhées, de la fièvre, de l'urticaire, de l'angioneurose cutanée et des réactions au point d'injection (p. ex. douleur et sensibilité).
Effets secondaires moins fréquents et graves
Les manifestations cliniques secondaires graves sont rares après l'immunisation contre l'HB et, dans la plupart des cas, les données sont insuffisantes pour établir un lien de causalité. On a déjà observé des réactions anaphylactiques consécutives à l'administration d'un vaccin à composant anti-HB ou à l'injection d'IgHB, mais seulement dans de très rares cas.
Autres effets secondaires et affections signalées
Bien que certains aient prétendu ou déclaré avoir observé des effets secondaires graves et l'apparition de maladies chroniques (syndrome de fatigue chronique, sclérose en plaques, syndrome de Guillain-Barré, arthrite rhumatoïde, la mort subite du nourrisson, etc.) à l'issue de l'administration du vaccin HB, les différentes études effectuées n'ont pas révélé de lien causal.
Conseils pour la déclaration des manifestations cliniques inhabituelles (MCI) à la suite d'une immunisation
Les vaccinateurs sont priés de signaler aux responsables de la santé publique locaux tout effet secondaire grave ou inattendu temporellement associé à la vaccination. Un effet secondaire suivant l'immunisation (ESSI) inattendu peut être un effet secondaire qui ne figure pas dans les renseignements disponibles sur le produit, mais qui peut être dû à l'immunisation, ou encore une modification de la fréquence d'un ESSI connu.
Pour plus de renseignements sur la déclaration des ESSI, voir la Déclaration de manifestations cliniques inhabituelles (MCI) à la suite d'une immunisation au Canada et le chapitre Effets secondaires suivant l'immunisation de la partie 2.
Contre-indications et précautions
Les vaccins à composant anti-HB et les IgHB sont contre-indiqués chez les personnes ayant déjà eu une réaction anaphylactique au produit et chez les personnes ayant une hypersensibilité immédiate ou anaphylactique établie à l'un ou l'autre des composants du produit. Voir le chapitre Contenu des agents immunisants utilisés au Canada de la partie 1 pour obtenir une liste des vaccins et des agents d'immunisation passive offerts au Canada ainsi que des ingrédients qu'ils renferment.
Des protéines de levure sont utilisées dans la fabrication des vaccins HB et HAHB. L'hypersensibilité aux levures est très rare et les antécédents personnels d'allergie aux levures ne sont généralement pas fiables. Dans les cas où l'on soupçonne une hypersensibilité ou une allergie non anaphylactique aux composants du vaccin, il est indiqué de mener une enquête, ce qui pourrait supposer de procéder à l'immunisation dans un milieu contrôlé. Il est conseillé de consulter un allergologue.
L'innocuité du vaccin HAHB administré durant la grossesse n'a jamais fait l'objet d'essais cliniques; cependant, aucune raison théorique ne permet de soupçonner un risque accru d'événements indésirables chez la mère ou le bébé.
Chez les personnes atteintes d'une maladie aiguë d'intensité modérée ou grave, l'administration systématique du vaccin à composant anti-HB doit être reportée. Si le vaccin HB est recommandé pour le traitement post-exposition, le rapport risques/avantages doit être évalué et une consultation peut être requise. Dans le cas d'une maladie aiguë mineure, avec ou sans fièvre, la personne peut être vaccinée.
Voir le chapitre Contre-indications, précautions à prendre et préoccupations de la partie 2 pour obtenir de plus amples renseignements.
Références choisies
Agence de la santé publique du Canada. Un protocole intégré pour la prise en charge des travailleurs de la santé exposés à des pathogènes transmissibles par le sang. Relevé des maladies transmissibles au Canada 1997;23S2.
American Academy of Pediatrics. In: Pickering LK, Baker CJ, Kimberlin DW, et al. (éd.). Red Book: 2009 Report of the Committee on Infectious Diseases. 28e éd. Elk Grove Village, IL: American Academy of Pediatrics; 2009.
Andonov A, Butler G, Ling R, Pritchard LM, Baril JG, Gale-Rowe M, et al. Soins primaires de l'hépatite B – Aide-Mémoire (VHB-AM). Accès : http://www.phac-aspc.gc.ca/publicat/hep/hbv-vhb/index-fra.php. Agence de la santé publique du Canada; 2013.
Ascherio A, Zhang S, Hernan M, et al. Hepatitis B vaccination and the risk of multiple sclerosis. N Engl J Med 2001;344:327-32.
Banatvala J, Van Damme P, Oehen S, et al. Lifelong protection against hepatitis B: the role of vaccine immunogenicity in immune memory. Vaccine 2001;19:877-85.
Cangene Corp. Monographie de produit – HepaGam BMD. Avril 2009.
Centers for Disease Control and Prevention (CDC). The Pink Book: Epidemiology and Prevention of Vaccine Preventable Diseases, 13e éd. révisée, 2015. Consulté en septembre 2015.
Centers for Disease Control and Prevention (CDC). Postvaccination serologic testing results for infants aged ≤24 months exposed to hepatitis B virus at birth – United States, 2008-2011. Morb Mortal Wkly Rep 2012 Sep 28;61:768-71.
Comité consultatif de la médecine tropicale et de la médecine des voyages. Déclaration concernant l'adoption internationale. Relevé des maladies transmissibles au Canada 2010;36(DCC-15):1-17.
Comité consultatif de la médecine tropicale et de la médecine des voyages. Déclaration sur les vaccins contre l'hépatite à l'intention des voyageurs. Relevé des maladies transmissibles au Canada 2008;34(DCC-2):1-24
Comité consultatif national de l'immunisation. Mise à jour des recommandations concernant l'utilisation du vaccin contre l'hépatite B. Février 2017. Accès: https://www.canada.ca/fr/sante-publique/services/publications/vie-saine/mise-a-jour-recommandations-utilisation-vaccin-hepatite-b.html
Confavreux C, Suissa S, Saddier P, et al. Vaccinations and the risk of relapse of multiple sclerosis. N Engl J Med 2001;344:319-26.
Duval B, Boulianne N, De Serres G. Should children with isolated anti-HBs or anti-HBc be immunized against hepatitis B virus? JAMA 1997;287:1064.
Duval B, Gîlca V, Boulianne N, et al. Comparative long-term immunogenicity of two recombinant hepatitis B vaccines and the effect of a booster dose given after 5 years in a low endemicity country. Pediatr Infect Dis J 2005;24:213-8.
Duval B, Gîlca V, Boulianne N, et al. Immunogenicity of two paediatric doses of monovalent hepatitis B or combined hepatitis A and B vaccine in 8-10-year-old children. Vaccine 2005;23(31):4082-87.
FitzSimons D, François G, Hall A, et al. Long-term efficacy of hepatitis B vaccine, booster policy, and impact of hepatitis B virus mutant. Vaccine 2005;23:4158-66.
Flynn P, Cunningham C, Rudy B, et al. Hepatitis B Vaccination in HIV-Infected Youth: A Randomized Trial of Three Regimens. J Acquir Immune Defic Syndr 2011;56(4):325-32.
Gîlca V, De Serres G, Boulianne N, et al. Antibody kinetics among 8-10 years old respondents to hepatitis B vaccination in a low endemic country and the effect of a booster dose given 5 or 10 years later. Vaccine 2009;27(43):6048-53.
GlaxoSmithKline Inc. Monographie de produit – ENGERIXMD-B. Septembre 2008.
GlaxoSmithKline Inc. Monographie de produit – TWINRIXMD. Septembre 2008.
GlaxoSmithKline Inc. Monographie de produit – INFANRIX hexaMD. Juillet 2008.
Jarrosson L, Kolopp-Sarda M, Aguilar P, et al. Most humoral non-responders to hepatitis B vaccines develop HBV-specific cellular immune responses. Vaccine 2004;22:3789-96.
Losonsky GA, Wasserman SS, Stephens I, et al. Hepatitis B vaccination of premature infants: a reassessment of current recommendations for delayed immunization. Pediatrics 1999;103(2):E14.
McMahon B, Bruden DL, Petersen K, et al. Antibody levels and protection after hepatitis B vaccination: results of a 15-year follow-up. Ann Intern Med 2005;142:333-41.
Merck Frosst Canada Ltée. Monographie de produit – RECOMBIVAX HBMD. Mars 2009.
Comité consultatif national de l'immunisation. Déclaration sur l'usage recommandé des vaccins pentavalents et hexavalents. Relevé des maladies transmissibles au Canada 2007;33(DCC-1):1-15.
Navas E, Salleras L, Gisbert R, et al. Efficiency of the incorporation of the hepatitis A vaccine as a combined A+B vaccine to the hepatitis B vaccination programme of preadolescents in schools. Vaccine 2005;23(17-18):2185-9.
Roberton D, Marshall H, Nolan T, et al. Reactogenicity and immunogenicity profile of a two-dose combined hepatitis A and B vaccine in 1-11-year-old children. Vaccine 2005(43);23:5099-105.
Shefer A, Atkinson W, Friedman C, et al. Immunization of Health-Care Personnel: Recommendations of the Advisory Committee on Immunization Practices. Morb Mortal Wkly Rep 2011;60:1-46.
Talecris Biotherapeutics Inc. Monographie de produit – HyperHEP BMD S/D. Septembre 2006.
Watson B, West DJ, Chilkatowsky A, et al. Persistence of immunologic memory for 13 years in recipients of a recombinant hepatitis B vaccine. Vaccine 2001;19:3164-8.
Zhongjie S, Yang Y, Wang H, et al. Breastfeeding of Newborns by Mothers Carrying Hepatitis B Virus: A Meta-analysis and Systematic Review. Arch Pediatri Adolesc Med 2011;165(9):837-46.
Signaler un problème ou une erreur sur cette page
- Date de modification :