Anatoxine tétanique : Guide canadien d'immunisation
Pour les professionnels de la santé
Mis à jour : octobre 2014
Sur cette page
- Principaux renseignements
- Épidémiologie
- Préparations autorisées au Canada
- Efficacité potentielle, efficacité réelle et immunogénicité
- Indications
- Administration du vaccin
- Tests sérologiques
- Conditions d'entreposage
- Administration simultanée d'autres vaccins
- Innocuité et effets secondaires du vaccin et des immunoglobulines
- Autres considérations
- Références choisies
Principaux renseignements (Consulter le texte pour plus de précisions)
- Quoi
-
- Le tétanos (trismus) sévit dans le monde entier, mais la maladie est rare au Canada en raison de l'immunisation contre cette infection.
- L'anatoxine tétanique n'est offerte qu'en vaccins combinés.
- Une série primaire et des doses de rappel, y compris des doses de rappel post-exposition, sont recommandées afin de développer et de maintenir de fortes concentrations d'anticorps contre le tétanos en cas d'exposition aux spores de Clostridium tetani et de production de toxines qui en résulte. Chez les sujets non vaccinés ou vaccinés de façon inappropriée, l'administration d'immunoglobulines antitétaniques est recommandée après l'exposition dans certaines situations.
- Après une série primaire complète (au moins 3 doses), plus de 99 % des vaccinés produisent des concentrations d'anticorps qui leur confèrent une protection contre le tétanos, mais l'immunité diminue avec le temps.
- L'érythème, l'œdème et la douleur au point d'injection sont les principaux effets secondaires des vaccins contenant l'anatoxine tétanique.
- Qui
-
- Les vaccins contenant l'anatoxine tétanique sont recommandés :
- pour la vaccination systématique des bébés et des enfants;
- pour la vaccination des enfants qui n'ont pu être vaccinés contre le tétanos conformément au calendrier de vaccination systématique;
- pour la vaccination des adultes n'ayant pas été vaccinés par le passé ou dont l'immunisation est incomplète;
- pour la vaccination de rappel systématique des adolescents et des adultes;
- pour la prophylaxie post-exposition dans certains traitements des plaies.
- Les vaccins contenant l'anatoxine tétanique sont recommandés :
- Comment
-
- Vaccination systématique des nourrissons et des enfants contre le tétanos : administrer le vaccin DCaT-VPI-Hib à l'âge de 2, 4 et 6 mois et entre l'âge de 12 et 23 mois (habituellement à 18 mois). Si l'on amorce la vaccination des nourrissons contre l'hépatite B, on peut administrer le vaccin DCaT-HB-VPI-Hib. Par la suite, administrer une dose de rappel du vaccin DCaT-VPI ou dcaT-VPI à l'âge de 4 à 6 ans (entrée à l'école) et une dose de rappel du vaccin dcaT 10 ans plus tard, à l'âge de 14 à 16 ans.
- Adultes déjà immunisés avec le vaccin contenant l'anatoxine tétanique :administrer une dose du vaccin dcaT si le patient n'a pas déjà été vacciné à l'âge adulte (18 ans ou plus) et une dose de rappel du vaccin Td aux 10 ans.
- Post-exposition et traitement des plaies : L'administration d'un vaccin contenant l'anatoxine tétanique pour le traitement des plaies, avec ou sans immunoglobuline antitétanique, dépend de la nature de la plaie et des antécédents de vaccination.
- Les vaccins contenant l'anatoxine tétanique peuvent être donnés en même temps que d'autres vaccins administrés systématiquement, mais il faut utiliser un point d'injection différent ainsi qu'une aiguille et une seringue distinctes.
- Pourquoi
-
- Le tétanos sévit dans le monde entier.
- De nombreux Canadiens, et particulièrement ceux qui sont âgés ou nés à l'étranger, n'ont pas de concentrations protectrices de l'antitoxine tétanique.
- Le taux de mortalité clinique chez les sujets non vaccinés est compris entre 10 % et plus de 80 % et est le plus élevé chez les nourrissons et les personnes âgées.
Épidémiologie
Description de la maladie
Agent infectieux
Le tétanos (trismus) est causé par une neurotoxine produite par la bactérie Clostridium tetani.
Réservoir
Les spores de C. tetani sont très répandues dans le sol à l'échelle mondiale; elles ont également été détectées dans les intestins des animaux et de l'humain.
Transmission
Les spores de C. tetani pénètrent habituellement dans l'organisme par une lésion ayant été contaminée par de la terre, des excréments d'origine animale ou humaine, ou de la poussière. Les spores de C. tetani germeront pour donner naissance à des bacilles dans des conditions d'anaérobiose, telles qu'un tissu nécrotique. Les bacilles produisent une neurotoxine puissante. La période d'incubation dure généralement de 3 à 21 jours (intervalle de 1 jour à plusieurs mois). Étant donné que le tétanos est causé par une neurotoxine, il ne se transmet pas de personne à personne.
Facteurs de risque
Des cas liés à des lacérations (cas les plus fréquents), à l'injection de drogues et à des morsures d'animaux ont été signalés, de même que des cas plus rares de contamination après une chirurgie intestinale ou après la broncho-aspiration de sol et d'excréments. Il est également possible de contracter le tétanos par de petites lésions en apparence banales, notamment en présence d'un tissu nécrotique. Le tétanos est souvent associé à un traumatisme contondant ou à des plaies punctiformes profondes. Chez les personnes ayant reçu une série vaccinale complète, le tétanos est rare et habituellement léger.
Spectre de la maladie clinique
Le tétanos est caractérisé par des spasmes musculaires généralement descendants, commençant au niveau des muscles de la mâchoire. À mesure que la maladie évolue, les spasmes deviennent de plus en plus longs et fréquents, ce qui peut entraîner de graves complications et mener à la mort si la victime ne reçoit pas les soins nécessaires. Le taux de mortalité clinique chez les sujets non vaccinés est compris entre 10 % et plus de 80 % et est le plus élevé chez les nourrissons et les personnes âgées.
Répartition de la maladie
Incidence et prévalence
À l'échelle mondiale
Le tétanos sévit dans le monde entier, mais il est plus fréquent dans les régions agricoles et dans les régions à forte densité de population. Au total, 9 683 cas de tétanos ont été signalés à l'Organisation mondiale de la Santé (OMS) en 2010. Le tétanos est relativement rare dans la plupart des pays développés en raison des programmes d'immunisation mis en place depuis longtemps. Bien que le tétanos des nouveau-nés ait été éliminé en Amérique du Nord, la maladie demeure un enjeu important à l'échelle mondiale.
À l'échelle nationale
Le tétanos est rare au Canada (se reporter à la Figure 1). Entre 1990 et 2010, le nombre de cas signalés annuellement oscillait entre 1 et 10, la moyenne se situant à 4 par année. Au cours de cette période, les personnes de 60 ans ou plus représentaient 48 % des cas, dont 59 % étaient des hommes. Aucun cas n'a été signalé chez des nouveau-nés. On ignorait quel était le statut vaccinal des cas signalés. Seuls huit décès dus au tétanos ont été signalés depuis 1990, les deux derniers étant survenus en 2009. Nous disposons de peu de données sur les concentrations protectrices de l'antitoxine tétanique au sein de la population canadienne. Selon une enquête sérologique menée à Toronto chez des donneurs de sang adultes, les concentrations de l'antitoxine tétanique ne sont pas suffisantes pour assurer une protection chez 17,5 % d'entre eux. Les facteurs associés à une immunité insuffisante vis-à-vis du tétanos sont notamment l'augmentation de l'âge, la naissance à l'extérieur du Canada et l'absence de dossiers de vaccination.
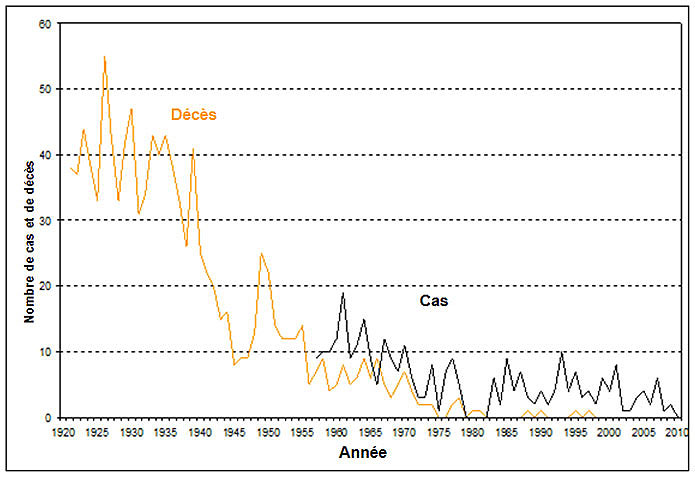
Figure 1 : Tétanos - Nombre de cas et de décès, Canada, 1921-2010 : Équivalent textuel
L'image est un graphique illustrant le nombre de cas et de décès au Canada attribués au tétanos de 1921 à 2010. L'axe des x représente les années de 1920 à 2010 et l'axe des y le nombre de cas et de décès, de « 0 » (partie inférieure) à « 60 » (partie supérieure). La ligne orange dans le graphique représente les décès dus au tétanos, alors que la ligne noire représente la tendance des cas de tétanos au fil des ans. La tendance laisse supposer que le nombre de décès a augmenté et est passé d'environ 37 en 1921 à 43 en 1923. Les décès ont diminué pour s'établir à 33 en 1926 avant d'atteindre un autre sommet en 1927 et de chuter brusquement à 33 en 1929. Un autre sommet de 47 cas a été atteint par la suite en 1930. Un autre déclin soudain portant le nombre de cas à 31 s'est produit en 1932, suivi d'une hausse du nombre de décès de 1934 à 1936. En 1938, ce nombre est tombé à environ 26, puis a atteint un autre sommet de 41 en 1939. Un déclin soudain a par la suite eu lieu, ce qui s'est traduit par moins de 9 décès en 1945. Après une autre hausse des décès dus au tétanos atteignant un sommet de 25 aux alentours de 1950, la chute en flèche a entraîné de moins en moins de décès et le nombre est tombé à 5 en 1956. Il est demeuré inférieur à 10 depuis. Aucun décès n'a été déclaré jusqu'en 1975 ni de 1982 à 1987, en 1991 et en 1993, et aucun depuis 1998 jusqu'à la fin de la période de déclaration.
La ligne noire dans le graphique qui représente le nombre de cas montre des maximums en baisse après moins de 10 cas déclarés initialement aux alentours de 1957. Le premier maximum d'environ 19 cas s'est produit aux alentours de 1961. Après un autre déclin faisant passer le nombre de cas à 9 en 1963, le maximum suivant s'est produit aux alentours de 1964. Après quelques fluctuations, le nombre de cas est tombé à 3 en 1973, puis à 2 en 1975. Après être passés à environ 9 en 1978, pour la première fois, les cas déclarés sont tombés à 0 en 1980. Aucun rapport n'est disponible pour les années 1981 et 1982. Cependant, en 1983, on observe une tendance à la hausse éphémère, puis près de 9 cas sont déclarés en 1985. En 1994, 10 cas sont déclarés. De 1990 à 2010, le nombre de cas déclarés annuellement variait de 1 à 10 et la moyenne était de 4 par année.
Préparations autorisées au Canada
L'anatoxine tétanique n'est offerte qu'en vaccins combinés.
Vaccins contenant l'anatoxine tétanique
- ADACELMD (vaccin adsorbé contenant l'anatoxine tétanique, une dose réduite d'anatoxine diphtérique et un vaccin anticoquelucheux acellulaire à contenu antigénique réduit), Sanofi Pasteur Ltée).
- ADACELMD-POLIO (vaccin adsorbé contenant l'anatoxine tétanique, une dose réduite d'anatoxine diphtérique et un vaccin anticoquelucheux acellulaire à contenu réduit combinés à un vaccin antipoliomyélitique inactivé), Sanofi Pasteur Ltée (dcaT-VPI).
- BOOSTRIXMD (vaccin adsorbé contenant l'anatoxine tétanique, une dose réduite d'anatoxine diphtérique et un vaccin anticoquelucheux acellulaire à contenu réduit), GlaxoSmithKline Inc. (dcaT).
- BOOSTRIXMD-POLIO (vaccin adsorbé contenant l'anatoxine tétanique, une dose réduite d'anatoxine diphtérique et un vaccin anticoquelucheux acellulaire à contenu réduit combinés à un vaccin antipoliomyélitique inactivé), GlaxoSmithKline Inc. (dcaT-VPI).
- INFANRIXMD-IPV/Hib (vaccin adsorbé contenant les anatoxines diphtérique et tétanique, un vaccin anticoquelucheux acellulaire, un vaccin antipoliomyélitique inactivé et un vaccin conjugué contre Haemophilus influenzae de type b), GlaxoSmithKline Inc. (DCaT-HB-VPI-Hib).
- INFANRIX hexaMC (vaccin adsorbé contenant les anatoxines diphtérique et tétanique, un vaccin anticoquelucheux acellulaire, un vaccin [recombinant] contre l'hépatite B, un vaccin antipoliomyélitique inactivé et un vaccin conjugué contre Haemophilus influenzae de type b), GlaxoSmithKline Inc. (DCaT-HB-VPI-Hib).
- PEDIACELMD (vaccin adsorbé contenant les anatoxines diphtérique et tétanique et un vaccin anticoquelucheux acellulaire combinés à un vaccin antipoliomyélitique inactivé et à un vaccin conjugué contre Haemophilus influenzae de type b), Sanofi Pasteur Ltée (DCaT-VPI-Hib).
- QUADRACELMD (vaccin adsorbé contenant les anatoxines diphtérique et tétanique et un vaccin anticoquelucheux acellulaire combinés à un vaccin antipoliomyélitique inactivé), Sanofi Pasteur Ltée (DCaT-VPI).
- Td ADSORBÉES (vaccin adsorbé contenant l'anatoxine tétanique et une dose réduite d'anatoxine diphtérique), Sanofi Pasteur Ltée (Td).
Immunoglobuline antitétanique
- HYPERTETMDS/D (immunoglobuline antitétanique [humaine] traitée par solvant/détergent), Grifols Therapeutics Inc. (TIg)
- HyperTETMD (immunoglobuline antitétanique [humaine] traitée par solvant/détergent), Grifols Therapeutics LLC. (TIg)*
*Le CCNI n'a pas encore délibéré sur l'utilisation de HyperTETMD. Le CCNI examinera cet agent immunisant et mettra à jour le chapitre en temps voulu. Pour obtenir de plus amples renseignements sur l'utilisation provisoire de cet agent immunisant, veuillez consulter la monographie du produit disponible dans la Base de données sur les produits pharmaceutiques de Santé Canada.
L'immunoglobuline antitétanique est une solution d'immunoglobuline contre le tétanos administrée par voie intramusculaire et préparée à partir d'un pool de plasma humain provenant de donneurs immunisés avec l'anatoxine tétanique, ayant fait l'objet d'un dépistage.
Pour obtenir les renseignements thérapeutiques complets, veuillez consulter le dépliant du produit ou l'information contenue dans la monographie de produit autorisée par Santé Canada, disponible dans la Base de données sur les produits pharmaceutiques. Veuillez consulter le chapitre sur les Contenu des agents immunisants autorisés au Canada de la partie 1 pour connaître la liste de tous les vaccins et agents d'immunisation passive autorisés au Canada ainsi que de leurs constituants.
Efficacité potentielle, Efficacité réelle et immunogénicité
Efficacité potentielle et efficacité réelle
Des concentrations protectrices d'antitoxines s'observent chez presque tous les nourrissons et enfants en bonne santé qui ont reçu la vaccination primaire contre le tétanos. L'efficacité des schémas habituels d'administration de doses de rappel chez l'adulte avant l'exposition et après une blessure n'a pas été évaluée dans le cadre d'essais aléatoires, mais elle a été démontrée dans des études par observation. Les cas de tétanos chez des personnes entièrement immunisées dont la dernière dose a été administrée au cours des 10 dernières années sont extrêmement rares.
Immunogénicité
Selon les essais cliniques, un mois après la fin d'une série primaire de trois doses, au moins 99 % des vaccinés présentaient des titres d'anticorps protecteurs.
Indications
Nourrissons et enfants (de 2 mois à 17 ans)
L'administration du vaccin contenant l'anatoxine tétanique dans le cadre de la vaccination systématique des nourrissons est recommandée à partir de l'âge de 2 mois. Le vaccin DCaT-VPI, avec ou sans composant contre Hib, est autorisé pour les enfants de moins de 7 ans. Le vaccin DCaT-HB-VPI-Hib est autorisé chez les enfants âgés de 6 semaines à 23 mois, et il peut au besoin être administré à des enfants âgés de 24 mois à moins de 7 ans. Le vaccin DCaT-VPI ou dcaT-VPI devrait être utilisé comme dose de rappel pour les enfants de 4 à 6 ans. Les enfants âgés de 7 ans ou plus devraient recevoir la formule pour adolescents/adultes du vaccin contre la diphtérie, le tétanos et la coqueluche avec ou sans composant antipoliomyélitique (dcaT ou dcaT-VPI), car il contient moins d'anatoxine diphtérique que les préparations administrées aux jeunes enfants et est moins susceptible de provoquer des réactions chez les enfants plus âgés. Le vaccin dcaT devrait être administré aux adolescents de 14 à 16 ans comme première dose de rappel après 10 ans; le vaccin dcaT-VPI devrait être utilisé si le VPI est également indiqué.
Adultes (de 18 ans et plus)
Les adultes n'ayant pas reçu la série primaire du vaccin contenant l'anatoxine tétanique (au moins 3 doses) devraient compléter leur vaccination systémique avec un vaccin à composant Td, y compris une dose du vaccin dcaT-VPI. Selon de nouvelles données, la dose de rappel du vaccin Td tous les 10 ans pourrait ne pas être nécessaire. Tant qu'un examen complet des documents n'aura pas été effectué, une dose de rappel du vaccin Td est recommandée tous les 10 ans.
Veuillez consulter les sections Calendrier et Doses de rappel et revaccination. Consulter les chapitres Anatoxine diphtérique, Vaccin contre la coqueluche, Vaccin contre la poliomyélite, Vaccin contre Haemophilus influenzae de type b et Vaccin contre l'hépatite B de la partie 4 pour obtenir de plus amples renseignements.
Personnes dont le dossier de vaccination est incomplet
Les enfants et adultes qui ne disposent pas de documents adéquats sur l'immunisation devraient être considérés comme non immunisés et recevoir le vaccin et les doses indiquées selon leur âge et leurs facteurs de risque. Le dosage sérique des antitoxines diphtérique et tétanique peut indiquer s'il y a lieu de poursuivre l'immunisation. Veuillez consulter le chapitre Immunisation des personnes dont le dossier de vaccination est incomplet de la partie 3 pour obtenir davantage de renseignements généraux.
Grossesse et allaitement
L'immunisation avec le dcaT pendant la grossesse s'est révélée sans danger et efficace dans la prévention de l'infection néonatale et infantile par la coqueluche. Le tétanos des nouveau-nés peut survenir chez les nourrissons dont la mère n'était pas immunisée, lorsque l'accouchement a lieu dans des conditions hygiéniques inadéquates. Pour l'administration du vaccin dcaT pendant la grossesse, veuillez consulter le chapitre Vaccin contre la coqueluche de la partie 4. Veuillez consulter le chapitre Immunisation durant la grossesse et l'allaitement de la partie 3 pour obtenir davantage de renseignements généraux.
Bébés prématurés
Les bébés prématurés dans un état clinique stable devraient recevoir une préparation contenant l'anatoxine tétanique au même âge chronologique et selon le même calendrier que les nourrissons nés à terme. Les prématurés (en particulier ceux qui pèsent moins de 1 500 grammes à la naissance) présentent un risque accru d'apnée et de bradycardie après la vaccination. Les bébés prématurés hospitalisés devraient faire l'objet d'une surveillance cardiaque et respiratoire continue pendant les 48 heures suivant leur première immunisation. Veuillez consulter le chapitre Immunisation des bébés prématurés de la partie 3 pour obtenir davantage de renseignements généraux.
Personnes ou résidents d'un établissement de santé
Les résidents des établissements de soins de longue durée devraient recevoir tous les vaccins de façon systématique prévus pour leur âge et leur niveau individuel de risque, y compris un vaccin contenant l'anatoxine tétanique. Veuillez consulter le chapitre Immunisation des personnes ou des patients/résidents dans les établissements de santé de la partie 3 pour obtenir davantage de renseignements généraux.
Sujets immunodéprimés
Les préparations contre la diphtérie, le tétanos, la coqueluche, la poliomyélite et Hib peuvent être administrées chez les sujets immunodéprimés. Lorsqu'on envisage l'immunisation d'un sujet immunodéprimé, il peut être utile de consulter le médecin traitant du sujet et de se reporter aux lignes directrices énoncées à la section Sujets immunodéprimés du chapitre Anatoxine diphtérique et le chapitre Vaccin contre Haemophilus Influenzae de type B de la partie 4. Il est conseillé de recommander les cas complexes à un médecin qui possède une expertise en vaccination ou en immunodéficience.
Veuillez consulter le chapitre Vaccin contre Haemophilus influenza de type b de la partie 4 pour obtenir davantage de renseignements. Consulter le chapitre Immunisation des personnes immunodéprimées de la partie 3 pour obtenir davantage de renseignements généraux.
Personnes aux prises avec une maladie chronique
Troubles neurologiques
Les personnes atteintes de troubles neurologiques apparus avant l'immunisation doivent recevoir tous les vaccins recommandés de façon systématique, y compris les préparations contenant l'anatoxine tétanique. Des cas de syndrome de Guillain-Barré (SGB) ont été signalés très rarement seulement après l'administration d'un vaccin contenant l'anatoxine tétanique, et les bienfaits du vaccin l'emportent normalement sur ce risque très faible. Veuillez consulter le chapitre Contre-indications et précautions de la partie 2 pour obtenir davantage de renseignements. Consulter le chapitre Immunisation des personnes atteintes d'une maladie chronique de la partie 3 pour obtenir davantage de renseignements généraux.
Voyageurs
Les voyageurs non immunisés ou non complètement immunisés devraient recevoir le vaccin contre la diphtérie, le tétanos, la coqueluche, la poliomyélite et Hib selon ce qui convient à leur âge. Veuillez consulter les chapitres Anatoxine diphtérique et Vaccin contre la poliomyélite de la partie 4 pour obtenir des renseignements sur les autres composants des vaccins combinés contenant l'anatoxine tétanique. Veuillez consulter le chapitre Immunisation des voyageurs de la partie 3 pour obtenir davantage de renseignements généraux.
Nouveaux arrivants au Canada
Les fournisseurs de soins de santé qui examinent des nouveaux arrivants au pays devraient évaluer leur statut vaccinal et mettre à jour leurs vaccins. Veuillez consulter le chapitre Immunisation des personnes nouvellement arrivées au Canada de la partie 3 pour obtenir davantage de renseignements généraux.
Travailleurs
Tous les travailleurs de la santé devraient être immunisés contre le tétanos et recevoir une dose de rappel du vaccin Td tous les 10 ans, tel qu'il est recommandé pour tous les adultes. Tous les travailleurs de la santé et des services à l'enfance, peu importe leur âge, devraient recevoir une dose unique du vaccin dcaT s'ils n'ont pas déjà reçu ce vaccin à l'âge adulte, afin d'être immunisés contre la coqueluche, même s'ils n'ont pas besoin d'une dose de rappel du vaccin contre le tétanos et la diphtérie. Veuillez consulter le chapitre Immunisation des travailleurs de la partie 3 pour obtenir davantage de renseignements généraux.
Prophylaxie post-exposition
Les principaux objectifs de la prophylaxie post-exposition consistent à éliminer les sources de la toxinogénèse et à neutraliser les toxines pouvant avoir été libérées. Le meilleur moyen d'atteindre le premier objectif est de nettoyer rigoureusement les plaies le plus tôt possible. Pour atteindre le second objectif, c'est-à-dire neutraliser les toxines, il faut fournir ou induire de fortes concentrations d'anticorps antitétaniques circulants. Pour que des concentrations efficaces d'anticorps neutralisants soient présentes dans l'organisme au moment de la blessure, il faut que la série vaccinale antitétanique ait déjà été administrée en entier ou une administration immédiate d'immunoglobulines antitétaniques (TIg).
Il est important de s'assurer du nombre de doses d'un vaccin contenant l'anatoxine tétanique qu'une personne blessée a déjà reçues, si elle a manifesté des symptômes graves suivant toute administration antérieure d'une dose et de s'assurer également du délai écoulé depuis la dernière dose. La prophylaxie post-exposition des sujets non immunisés ou partiellement immunisés (incertain ou moins de 3 doses) présentant une plaie qui n'est pas mineure et qui n'est pas propre devrait consister en l'administration d'immunoglobuline antitétanique et d'un vaccin contenant l'anatoxine tétanique (en fonction de l'âge et des antécédents de vaccination), en utilisant un point d'injection différent ainsi qu'une aiguille et une seringue distinctes. L'immunoglobuline antitétanique confère une protection passive immédiate jusqu'à ce que la personne exposée développe une réponse immunitaire au vaccin contenant l'anatoxine tétanique. La série de vaccins devrait être administrée par la suite sauf indication contraire. Veuillez consulter le Tableau 1 pour obtenir davantage de renseignements.
Certaines personnes immunisées (3 doses ou plus) peuvent devoir recevoir une dose de rappel d'un vaccin contenant l'anatoxine tétanique, selon le temps qui s'est écoulé depuis la dernière dose de rappel et le type de plaie. Une dose de rappel de vaccin contenant l'anatoxine tétanique est recommandée si 10 ans ou plus se sont écoulés pour les personnes présentant des plaies mineures propres et si 5 ans ou plus se sont écoulés pour les personnes présentant d'autres types de plaies.
Les personnes présentant une blessure susceptible d'être infectée par le bacille tétanique et qui ont eu une forte réaction au point d'injection après l'administration d'un vaccin contenant l'anatoxine tétanique ont souvent des taux sériques d'antitoxines très élevés et ne devraient pas recevoir les doses de rappel systématiques ou d'urgence de vaccin contenant l'anatoxine tétanique pour 10 ans après la dernière dose. Une blessure susceptible d'être infectée par le bacille tétanique peut être définie par une blessure fortement contaminée par des matières susceptibles de contenir des spores du bacille tétanique (c.-à-d. sol, excréments d'origine animale ou humaine) ou une blessure présentant du tissu nécrotique.
Certaines personnes présentant un déficit immunitaire humoral (p. ex. infection à VIH, agammaglobulinémie ou hypogammaglobulinémie) pourraient ne pas répondre adéquatement au vaccin contenant l'anatoxine tétanique. Les personnes atteintes d'un déficit immunitaire humoral présentant une plaie qui n'est pas mineure et qui n'est pas propre devraient recevoir à la fois de TIg et un vaccin contenant l'anatoxine tétanique, peu importe le temps écoulé depuis la dernière dose de rappel. Le Tableau 1 présente un résumé des recommandations concernant l'utilisation d'agents immunisants lors du traitement des plaies.
| Antécédents de vaccination contre le tétanos | Plaies mineures et propres | Autres plaies | ||
|---|---|---|---|---|
| Vaccin contenant l'anatoxine tétaniqueTableau 1 - Note de bas de page * | TIg | Vaccin contenant l'anatoxine tétaniqueTableau 1 - Note de bas de page * | TIgTableau 1 - Note de bas de page ** | |
| Incertain ou moins de 3 doses d'une série vaccinaleTableau 1 - Note de bas de page † | Oui | Non | Oui | Oui |
| 3 doses ou plus d'une série vaccinale et moins de 5 ans depuis la dernière dose de rappel | Non | Non | Non | NonTableau 1 - Note de bas de page ¶ |
| 3 doses ou plus d'une série vaccinale et plus de 5 ans depuis la dernière dose de rappel, mais moins de 10 ans | Non | Non | Oui | NonTableau 1 - Note de bas de page ¶ |
| 3 doses ou plus d'une série vaccinale et plus de 10 ans depuis la dernière dose de rappel | Oui | Non | Oui | NonTableau 1 - Note de bas de page ¶ |
Les personnes qui se sont rétablies du tétanos devraient recevoir le vaccin contenant l'anatoxine tétanique tel qu'on le recommande aux personnes n'ayant jamais souffert de la maladie. Comme le tétanos est causé par des toxines produites par le bacille tétanique et non par la bactérie elle-même, le rétablissement du tétanos ne confère pas l'immunité.
Immunoglobuline antitétanique (Ig) pour la prophylaxie
L'immunoglobuline antitétanique confère une protection passive immédiate à la personne exposée, jusqu'à ce que celle-ci puisse développer une réponse immunitaire à l'anatoxine tétanique. La dose recommandée chez les adultes et les enfants de 7 ans ou plus est de 250 unités par injection intramusculaire profonde. Chez les petits enfants de moins de 7 ans, la dose prévue est de 4 unités/kg. Il peut toutefois être bon d'administrer tout le contenu de la fiole ou de la seringue (250 unités) quelle que soit la taille de l'enfant, car en théorie, le micro-organisme responsable du tétanos produit chez l'enfant la même quantité de toxine que chez l'adulte.
Immunoglobuline antitétanique (TIg) pour le traitement du tétanos
Lorsqu'elles sont utilisées pour traiter le tétanos, les TIg devraient être administrées par voie intramusculaire afin de neutraliser la toxine tétanique dans les liquides organiques. Les TIg n'ont aucun effet sur les molécules de la toxine qui se sont déjà fixées au tissu nerveux. La dose thérapeutique optimale n'a pas encore été déterminée.
Les injections intramusculaires sont administrées de préférence dans le muscle deltoïde de la partie supérieure du bras ou dans le muscle latéral de la cuisse. Le muscle fessier ne devrait pas servir de point d'injection compte tenu du risque de blessure du nerf sciatique.
Veuillez consulter le chapitre Effets secondaires suivant l'immunisation pour obtenir davantage de renseignements.
Pour obtenir les renseignements thérapeutiques complets, veuillez consulter le dépliant du produit ou l'information contenue dans la monographie de produit autorisée par Santé Canada, disponible dans la Base de données sur les produits pharmaceutiques.
Administration du vaccin
Dose, voie d'administration et calendrier
Dose
Chaque dose de vaccin contenant l'anatoxine tétanique est de 0,5 ml.
Voie d'administration
Les vaccins contenant l'anatoxine tétanique doivent être administrés par voie intramusculaire. Veuillez consulter le chapitre Méthodes d'administration des vaccins de la partie 1 pour obtenir davantage de renseignements.
Calendrier
Nourrissons et enfants (de 2 mois à 6 ans)
Vaccination systématique des nourrissons contre le tétanos : Le vaccin DCaT-VPI-Hib devrait être administré à l'âge de 2, 4 et 6 mois et entre l'âge de 12 et 23 mois (habituellement à 18 mois).
Si l'on amorce la vaccination des nourrissons contre l'hépatite B, on peut administrer le vaccin DCaT-HB-VPI-Hib au lieu de donner séparément le vaccin contre l'hépatite B et le DCaT-VPI-Hib. Le vaccin DCaT-HB-VPI-Hib est autorisé chez les enfants âgés de 6 semaines à 23 mois et, au besoin, peut être donné aux enfants âgés de 24 mois à moins de 7 ans. Le vaccin DCaT-HB-VPI-Hib peut être administré à l'âge de 2, 4 et 6 mois et entre l'âge de 12 et 23 mois, mais il est peu probable que la quatrième dose confère une protection supplémentaire importante contre l'hépatite B et elle augmentera le coût. Des calendriers de remplacement peuvent être employés :
- DCaT-HB-VPI-Hib (2, 4 et 6 mois) et DCaT-VPI-Hib (de 12 à 23 mois);
- DCaT-HB-VPI-Hib (2, 4 et de 12 à 23 mois) et DCaT-VPI-Hib (6 mois).
Lorsqu'une protection rapide est nécessaire pour un nourrisson, on peut administrer la première dose du vaccin DCaT-VPI-Hib ou DCaT-HB-VPI-Hib à l'âge de 6 semaines. On peut administrer les 3 premières doses à intervalles de 4 semaines, et la quatrième dose, idéalement 12 mois après la troisième. La quatrième dose peut être administrée au minimum 6 mois après la troisième dose dans certaines situations (p. ex. voyage), mais elle doit être administrée à l'âge de 12 mois ou plus pour assurer une immunité durable.
Les enfants de moins de 7 ans n'ayant pas été immunisés dans les premiers mois de leur vie devraient recevoir 3 doses du vaccin DCaT-VPI (avec ou sans composant contre Hib) à 8 semaines d'intervalle, suivies d'une dose du vaccin DCaT-VPI administrée de 6 à 12 mois après la troisième dose. Une dose de rappel du vaccin DCaT-VPI ou dcaT-VPI devrait être administrée à l'âge de 4 à 6 ans (entrée à l'école). La dose de rappel prévue à l'âge de 4 à 6 ans n'est pas requise si la quatrième dose du vaccin contenant l'anatoxine tétanique a été administrée après le quatrième anniversaire de l'enfant.
Lorsqu'une protection rapide est nécessaire pour un enfant de moins de 7 ans n'ayant pas été immunisé dans sa petite enfance, on peut donner les trois premières doses à 4 semaines d'intervalle et la quatrième dose, idéalement, 12 mois après la troisième. La quatrième dose peut être administrée au minimum 6 mois après la troisième dose dans certaines situations (p. ex. voyage).
Les enfants qui ont reçu une série primaire d'un vaccin contenant l'anatoxine tétanique et une dose de rappel de 6 à 12 mois plus tard selon les indications ci-dessus devraient recevoir une dose de rappel du vaccin DCaT-VPI ou dcaT-VPI à l'âge de 4 à 6 ans (entrée à l'école), ainsi qu'une dose de rappel du vaccin dcaT 10 ans plus tard, à l'âge de 14 à 16 ans. La dose de rappel prévue à l'âge de 4 à 6 ans n'est pas requise si la quatrième dose du vaccin contenant l'anatoxine tétanique a été administrée après le quatrième anniversaire de l'enfant.
Enfants et adolescents (de 7 à 17 ans)
Les enfants de 7 ans ou plus n'ayant pas été immunisés devraient recevoir trois doses du vaccin dcaT-VPI, les deux premières à 8 semaines d'intervalle, la troisième étant administrée de 6 à 12 mois après la deuxième. Une dose de rappel du vaccin dcaT devrait être administrée 10 ans après la dernière dose.
Adultes (de 18 ans et plus)
Les adultes n'ayant pas reçu la série primaire (au moins 3 doses) d'un vaccin contenant l'anatoxine tétanique devraient compléter leur vaccination systémique avec un vaccin à composant Td, y compris 1 dose du vaccin dcaT-VPI.
Doses de rappel et revaccination
Une dose de rappel du vaccin DCaT-VPI ou du vaccin dcaT-VPI devrait être administrée entre l'âge de 4 et 6 ans (âge préscolaire). Les adolescents devraient recevoir de façon systématique une dose de rappel du vaccin dcaT à l'âge de 14 à 16 ans. Actuellement, il est recommandé de recevoir des doses de rappel du vaccin Td tous les 10 ans. Selon de nouvelles données, il pourrait ne pas être nécessaire de recevoir une dose de rappel du vaccin Td aux 10 ans; cet élément est actuellement en cours d'examen. Les adultes qui n'ont pas reçu le vaccin contre la coqueluche à l'âge adulte devraient recevoir une dose du vaccin dcaT, qui peut être administré quel que soit l'intervalle depuis la dernière dose du vaccin contenant les anatoxines tétanique et diphtérique. Veuillez consulter le chapitre Calendrier.
Tests sérologiques
Les tests sérologiques ne sont recommandés ni avant ni après l'administration d'un vaccin contenant l'anatoxine tétanique.
Conditions d'entreposage
Les préparations contenant l'anatoxine tétanique doivent être conservées dans un réfrigérateur à une température de +2 °C à +8 °C et ne doivent pas être congelées. Veuillez consulter le chapitre Manipulation et entreposage des agents immunisants de la partie 1 pour obtenir davantage de renseignements généraux.
Administration simultanée d'autres vaccins
Les vaccins contenant l'anatoxine tétanique peuvent être donnés en même temps que d'autres vaccins administrés systématiquement, mais il faut utiliser un point d'injection différent ainsi qu'une aiguille et une seringue distinctes. Veuillez consulter le chapitre Calendrier d'administration des vaccins de la partie 1 pour obtenir davantage de renseignements généraux.
Innocuité et effets secondaires du vaccin et des immunoglobulines
Veuillez consulter le chapitre Effets secondaires suivant l'immunisation de la partie 2 pour obtenir davantage de renseignements généraux. Consulter les chapitres Anatoxine diphtérique, Vaccin contre la coqueluche, Vaccin contre la poliomyélite, Vaccin contre Haemophilus influenzae de type b et Vaccin contre l'hépatite B de la partie 4 pour obtenir davantage de renseignements sur les autres composants des vaccins combinés contenant l'anatoxine tétanique.
Effets secondaires fréquents et effets secondaires locaux
Vaccins contenant l'anatoxine tétanique
L'érythème, l'œdème et la douleur au point d'injection sont les principaux effets secondaires des vaccins pour enfants combinés contenant l'anatoxine tétanique. Un nodule peut être palpable au point d'injection pendant plusieurs semaines. Des cas d'abcès au point d'injection ont également été signalés. Ces incidents sont les plus souvent liés à l'administration du vaccin par voie sous-cutanée par erreur.
Dans les essais cliniques, des effets secondaires au point d'injection tels qu'une sensibilité, un érythème, une tuméfaction ou toute combinaison ont été signalés chez 10 % à 40 % des enfants après chacune des trois premières doses de vaccin contenant l'anatoxine tétanique. Des réactions générales légères, telles que de la fièvre, de l'irritabilité, une humeur maussade ou toute combinaison, ont été fréquemment signalées (8 % à 29 %), de même que de la somnolence (40 % à 52 %).
Dans 2 études cliniques, on a observé des cas d'œdème (de plus de 5 cm) et d'érythème chez 15 à 20 % des vaccinés après la quatrième ou la cinquième dose du vaccin DCaT. Des cas d'œdème grave (de plus de 10 cm de diamètre), pouvant affecter toute la partie proximale du membre, ont été observés chez 2 à 6 % des enfants. Bien que ces réactions survenues au point d'injection aient entraîné un œdème considérable, la douleur était généralement limitée. Selon certaines données, un œdème grave était plus susceptible de se produire après la cinquième dose d'un vaccin DCaT chez les enfants qui avaient présenté un tel œdème après la quatrième dose. La présence, au point d'injection, d'une réaction importante à une dose antérieure ne constitue pas une contre-indication au maintien du calendrier recommandé.
Les réactions couramment observées chez les adultes ayant reçu une dose de rappel du vaccin dcaT étaient notamment les suivantes : douleur, rougeur et œdème au point d'injection, céphalées et fatigue. La fièvre et les frissons étaient également courants. Les effets secondaires observés après l'administration du vaccin Td étaient semblables. De façon générale, les effets secondaires étaient moins fréquents chez les adultes que chez les adolescents. La longueur de l'intervalle séparant l'administration des doses du vaccin DCaT ou d'une dose du vaccin dT pendant l'enfance et l'administration du vaccin dcaT n'a aucune incidence sur la fréquence des effets secondaires généraux ou des effets secondaires au point d'injection.
TIg
Il peut y avoir une légère sensibilité au point d'injection et une faible augmentation de la température après l'injection de TIg.
Effets secondaires moins courants et plus sérieux ou graves
Vaccins contenant l'anatoxine tétanique
Les effets secondaires graves sont rares après l'immunisation par un vaccin contenant l'anatoxine tétanique et, dans la plupart des cas, les données sont insuffisantes pour établir un lien de causalité. Des réactions générales graves, comme une urticaire généralisée, une anaphylaxie ou des complications neurologiques, ont été rarement signalées.
De rares cas de maladie sérique, de neuropathie du plexus brachial, d'encéphalomyélite et de myélite transverse ont été signalés en association avec la vaccination antitétanique.
Des réactions graves au point d'injection, de type Arthus, sont occasionnellement signalées après l'administration d'un vaccin contenant l'anatoxine diphtérique ou l'anatoxine tétanique. Il peut y avoir un œdème important et douloureux autour du point d'injection, touchant souvent le bras entre l'épaule et le coude, généralement de 2 à 8 heures après l'injection. De telles réactions sont le plus souvent signalées chez les adultes, en particulier chez ceux qui ont reçu des doses fréquentes d'un vaccin contenant l'anatoxine diphtérique ou l'anatoxine tétanique, ou les deux. Les personnes chez qui l'on observe de graves réactions au point d'injection présentent habituellement de très fortes concentrations sériques d'antitoxines et ne devraient pas recevoir d'autres doses systématiques du vaccin Td avant au moins 10 ans.
TIg
De rares cas d'œdème angioneurotique, de syndrome néphrotique et d'anaphylaxie ont été observés après l'injection.
Autres effets secondaires et affectations signalés
Des cas de trismus (incapacité à ouvrir la bouche normalement) associés à l'administration d'anatoxine tétanique ont rarement été signalés. La pathogenèse de ce phénomène n'a pas été élucidée, et elle pourrait être attribuable à un biais de déclaration. Il est à noter que, dans ces cas, l'issue était favorable.
Des cas de syndrome de Guillain-Barré (SGB) ou de polynévrite ont été signalés après l'administration de vaccins contenant l'anatoxine tétanique, et on a recensé un cas de syndrome de Guillain-Barré récidivant après chacune des trois doses de vaccin. Les études menées dans la population n'ont toutefois pas appuyé l'existence d'une relation de cause à effet.
Conseils pour la déclaration des manifestations cliniques inhabituelles suivant l'immunisation
Les fournisseurs de vaccins sont priés de signaler aux responsables de la santé publique locaux tout effet secondaire grave ou inattendu qu'ils estiment être temporellement associé à la vaccination. Une manifestation clinique inhabituelle (MCI) inattendue suivant l'immunisation est un effet secondaire qui ne figure pas dans les renseignements disponibles sur le produit, mais qui peut être causée par l'immunisation, ou encore une modification de la fréquence d'une manifestation clinique inhabituelle suivant l'immunisation connue. Veuillez consulter le guide Déclaration de manifestations cliniques inhabituelles (MCI) à la suite d'une immunisation au Canada et le chapitre Effets secondaires suivant l'immunisation de la partie 2 pour obtenir des renseignements supplémentaires sur la déclaration des MCI.
Contre-indications et précautions
Les vaccins contenant l'anatoxine tétanique sont contre-indiqués chez les personnes ayant déjà eu une réaction anaphylactique au vaccin et chez les personnes ayant une hypersensibilité immédiate ou anaphylactique établie à l'un ou l'autre des composants du vaccin ou de son contenant. Veuillez consulter le chapitre sur le Contenu des agents immunisants autorisés au Canada de la partie 1 pour connaître la liste de tous les vaccins et agents d'immunisation passive autorisés au Canada ainsi que de leurs constituants.
Si l'administration d'immunoglobuline antitétanique est indiquée, il faut user de prudence avec les personnes qui ont déjà eu une réaction allergique systémique après avoir reçu une préparation d'Ig humaines.
L'hypersensibilité à la levure est très rare et des antécédents personnels d'allergie à la levure ne sont pas fiables généralement. Dans les cas où on soupçonne une hypersensibilité ou une allergie non anaphylactique aux composants vaccinaux, une enquête est recommandée, qui peut comprendre l'immunisation dans un milieu contrôlé. Il est conseillé de consulter un allergologue.
L'administration du vaccin contenant l'anatoxine tétanique devrait être retardée chez les personnes atteintes d'une maladie aiguë grave. Dans le cas d'une maladie aiguë mineure, avec ou sans fièvre, la personne peut être vaccinée.
Il est prudent de ne pas administrer de doses subséquentes d'un vaccin contenant l'anatoxine tétanique aux sujets qui développent le syndrome de Guillain-Barré dans les six semaines suivant l'administration d'un tel vaccin. Les sujets qui développent le syndrome de Guillain-Barré en dehors d'un intervalle de six semaines peuvent recevoir des vaccins subséquents contenant l'anatoxine tétanique. Si le sujet a été infecté à Campylobacter (cette infection a été associée au syndrome de Guillain-Barré) et a reçu un vaccin contenant les anatoxines tétanique et diphtérique au cours des six semaines précédant l'apparition du syndrome de Guillain-Barré, il est conseillé de consulter un spécialiste des maladies infectieuses.
Les personnes qui présentent une réaction grave au point d'injection après avoir reçu une dose d'un vaccin contenant l'anatoxine tétanique ne devraient pas recevoir de nouvelle dose avant au moins 10 ans.
Veuillez consulter le chapitre Contre-indications et précautions de la partie 2 pour obtenir davantage de renseignements généraux.
Autres considérations
Interchangeabilité des vaccins
La série vaccinale primaire consistant en l'administration de trois doses d'un vaccin contenant l'anatoxine tétanique devrait être effectuée avec un vaccin adéquat provenant du même fabricant dans la mesure du possible. Toutefois, si l'on ignore quel vaccin a été administré initialement ou si celui-ci n'est pas disponible, un autre vaccin combiné provenant d'un fabricant différent peut être utilisé pour terminer la série vaccinale primaire. D'après l'opinion d'experts, un produit adéquat de n'importe quel fabricant peut être utilisé pour toutes les doses de rappel. Veuillez consulter le chapitre Principes de l'interchangeabilité des vaccins de la partie 1 pour obtenir davantage de renseignements généraux.
Références choisies
- Centers for Disease Control and Prevention. ACIP Provisional Recommendations for Health Care Personnel on use of Tetanus Toxoid, Reduced Diphtheria Toxoid and Acellular Pertussis Vaccine (Tdap) and use of Postexposure Antimicrobial Prophylaxis.
- Centers for Disease Control and Prevention. Prevention of Pertussis, Tetanus, and Diphtheria Among Pregnant and Postpartum Women and Their Infants. Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Morb Mortal Wkly Rep. 2008;57(RR-4):1-49.
- Centers for Disease Control and Prevention. The Pink Book: Epidemiology and Prevention of Vaccine Preventable Diseases. Updated 11th ed.; May 2009.
- Centers for Disease Control and Prevention. Updated Recommendations for Use of Tetanus Toxoid, Reduced Diphtheria Toxoid and Acellular Pertussis (Tdap) Vaccine from the Advisory Committee on Immunization Practices, 2010. MMWR Morb Mortal Wkly Rep. 2011;60(1):13-15.
- Centers for Disease Control and Prevention. Updated Recommendations for Use of Tetanus Toxoid, Reduced Diphtheria Toxoid, and Acellular Pertussis (Tdap) Vaccine in Adults Aged 65 Years and Older - Advisory Committee on Immunization Practices (ACIP), 2012.
- Comité consultatif national de l'immunisation. Intervalle dans l'administration des vaccins contre la diphtérie, le tétanos et la coqueluche. Relevé des maladies transmissibles au Canada, vol. 31 (DCC-9), p. 17-22, 2005.
- Comité consultatif national de l'immunisation. Déclaration sur l'usage recommandé des vaccins pentavalents et hexavalents. Relevé des maladies transmissibles au Canada, vol. 33 (DCC-1), p. 1-16, 2007.
- David, S., Hemsley, C., Pasquali, P., et al. Surveillance accrue des effets secondaires associés aux vaccins : rattrapage pour le dCaT chez les élèves du secondaire au Yukon. Relevé des maladies transmissibles au Canada, vol. 31(11), p. 117-126, 2005.
- Fiorillo L, Robinson JL. Localized tetanus in a child. Ann. Emerg. Med. 1999;33(4):460-63.
- Gautret P, Wilder-Smith A. Vaccination against tetanus, diphtheria, pertussis and poliomyelitis in adult travellers. Travel Med. Infect. Dis. 2010;8:155-60.
- GlaxoSmithKline Inc. Monographie de produit - BOOSTRIXMD, octobre 2009.
- GlaxoSmithKline Inc. Monographie de produit - BOOSTRIXMD-POLIO, juin 2008.
- GlaxoSmithKline Inc. Monographie de produit - INFANRIX hexaMD, juillet 2008.
- Grifols Therapeuctics LLC. Monographie de produit - HyperTETMD. Septembre 2021.
- Jacobs R, Lowe R, Lanier B. Adverse reactions to tetanus toxoid. JAMA 1982;247(1):40-2.
- Katz K, Walmsley S. Postoperative tetanus: a case report. CMAJ 2000;163(5):571-73.
- Martin-Munoz M, Pereira M, Posadas S, et al. Anaphylactic reaction to diphtheria-tetanus vaccine in a child: specific IgE/IgG determinations and cross-reactivity studies. Vaccine 2002;20(27-28):3409-12.
- Mayaud C, Loupi E, Charara O, et al. Trismus et vaccination antitétanique. Arch. Pediatr. 1999;6(7):752-54.
- McQuillan G, Kruszon-Moran D, Deforest A, et al. Serologic immunity to diphtheria and tetanus in the United States. Ann. Intern. Med. 2002;136(9):660-66.
- Okaïs C, Gay C, Seon F, et al. Disease-specific adverse events following nonlive vaccines: A paradoxical placebo effect or a nocebo phenomenon? Vaccine 2011; 31 mai. (Publié en ligne avant impression.)
- Pascual F, McGinley E, Zanardi L, et al. Tetanus surveillance - United States, 1998-2000. MMWR Surveill. Summ. 2003;52(3):1-8.
- Pichichero ME, DeTora LM, Johnson DR. An adolescent and adult formulation combined tetanus, diphtheria and five-component pertussis vaccine. Expert Rev. Vaccines 2006 Avril;5(2):175-87.
- Pollard JD, Selby G. Relapsing neuropathy due to tetanus toxoid: report of a case. J. Neurol. Sci. 1978;37:113-125.
- Sanofi Pasteur Ltd. Monographie de produit - ADACELMD, août 2009.
- Sanofi Pasteur Ltd. Monographie de produit - ADACELMD-POLIO, octobre 2010.
- Sanofi Pasteur Ltd. Monographie de produit - PEDIACELMD, janvier 2009.
- Sanofi Pasteur Ltd. Monographie de produit - QUADRACELMD, juillet 2008.
- Sanofi Pasteur Ltd. Monographie de produit - Td adsorbées, juillet 2010.
- Shimoni Z, Dobrousin A, Cohen J, et al. Tetanus in an immunised patient. BMJ 1999;319(7216):1049.
- Shin D, Park J, Jung PJ, et al. A case of maternal tetanus in Korea. J Korean Med. Sci. 2002;17(2):260-62.
- Talecris Biotherapeutics Inc. Monographie de produit - HYPERTETMDS/D. Juin 2005.
- Wassilak S, Roper M, Murphy T, et al. Tetanus toxoid. In: Plotkin SA, Orenstein WA, éd. Vaccines. 4e édition. Philadelphia: W.B. Saunders 2004;745-81.
- Yuan L, Lau W, Thipphawong J, et al. Diphtheria and tetanus immunity among blood donors in Toronto. CMAJ 1997;156(7):985-90.