Anatoxine diphtérique : Guide canadien d'immunisation
Pour les professionnels de la santé
Dernière mise à jour partielle du contenu (voir le tableau des mises à jour) : novembre 2016
Dernière révision complète du chapitre (voir le tableau des mises à jour) : décembre 2014
Sur cette page
- Principaux renseignements
- Épidémiologie
- Préparations autorisées au Canada
- Efficacité potentielle, efficacité réelle et immunogénicité
- Indications
- Administration du vaccin
- Tests sérologiques
- Conditions d'entreposage
- Administration simultanée d'autres vaccins
- Innocuité et effets secondaires du vaccin et de l'anatoxine diphtérique
- Autres considérations
- Références choisies
Principaux renseignements (Consulter le texte pour plus de précisions)
- Quoi
-
- La diphtérie est rare au Canada. On en observe des cas un peu partout dans le monde et elle est endémique dans de nombreux pays en développement.
- Le taux de létalité est d'environ 5 à 10 %; le taux de mortalité est le plus élevé chez les très jeunes et chez les personnes âgées, de même que dans les pays où la maladie n'est pas endémique étant donné que le diagnostic y est souvent posé tardivement.
- Les vaccins contenant l'anatoxine diphtérique ne sont offerts qu'en vaccins combinés.
- Les vaccins contenant l'anatoxine diphtérique peuvent être utilisés pour une immunisation post-exposition contre la diphtérie chez les personnes réceptives.
- En cas d'urgence, on peut se procurer de l'antitoxine diphtérique pour le traitement de la diphtérie auprès des responsables de la santé publique locaux.
- Après une série primaire complète (au moins 3 doses), plus de 97 % des vaccinés produisent des concentrations d'anticorps qui leur confèrent une protection contre la diphtérie.
- L'érythème, l'œdème et la douleur au point d'injection sont les principaux effets secondaires des vaccins contenant l'anatoxine diphtérique.
- Qui
-
- Les vaccins contenant l'anatoxine diphtérique sont recommandés :
- pour la vaccination systématique des bébés et des enfants;
- pour la vaccination des enfants qui n'ont pu être vaccinés contre la diphtérie conformément au calendrier de vaccination systématique;
- pour la vaccination des adultes n'ayant pas été vaccinés par le passé ou dont l'immunisation est incomplète;
- pour la vaccination de rappel systématique des adolescents et des adultes.
- Les vaccins contenant l'anatoxine diphtérique sont recommandés :
- Comment
-
- Vaccination systématique des nourrissons et des enfants contre la diphtérie : Administrer le vaccin DCaT-VPI-Hib à l'âge de 2, 4 et 6 mois et entre l'âge de 12 et 23 mois (habituellement à 18 mois). Si on amorce la vaccination des nourrissons contre l'hépatite B, on peut administrer le vaccin DCaT-HB-VPI-Hib. Par la suite, administrer une dose de rappel du vaccin DCaT-VPI ou dcaT-VPI à l'âge de 4 à 6 ans (entrée à l'école) et une dose de rappel du vaccin dcaT 10 ans plus tard, à l'âge de 14 à 16 ans.
- Adultes déjà immunisés avec le vaccin contenant l'anatoxine diphtérique : Administrer une dose du vaccin dcaT si le patient n'a pas déjà reçu ce vaccin à l'âge adulte (18 ans ou plus), et administrer des doses de rappel d'un vaccin Td aux 10 ans.
- Les vaccins contenant l'anatoxine diphtérique peuvent être donnés en même temps que d'autres vaccins administrés systématiquement, mais il faut utiliser un point d'injection différent ainsi qu'une aiguille et une seringue distinctes.
- Pourquoi
-
- On observe des cas de diphtérie un peu partout dans le monde et la maladie est endémique dans de nombreux pays en développement.
- Les voyageurs non vaccinés ou dont la vaccination est inadéquate qui se rendent dans des régions où la diphtérie est endémique courent un risque accru de contracter la maladie.
- Des cas occasionnels de diphtérie importée sont détectés dans les pays industrialisés, comme le Canada.
- L'issue de la maladie est mortelle dans 5 à 10 % des cas.
Épidémiologie
Description de la maladie
Agent infectieux
La diphtérie est causée par des souches de la bactérie Corynebacterium diphtheriae productrices d'exotoxine.
Réservoir
Les humains
Transmission
La diphtérie se transmet de personne à personne par l'entremise des sécrétions respiratoires, ou plus rarement par contact avec des articles souillés par les sécrétions de personnes infectées. La période d'incubation dure environ 2 à 5 jours (intervalle de 1 à 10 jours). La période de contagiosité chez les personnes non traitées ne dépasse habituellement pas 2 semaines et dure rarement plus de 4 semaines. Les porteurs chroniques sont colonisés au niveau de la peau et du rhinopharynx par C. diphtheriae sans présenter de symptômes, et peuvent excréter le microorganisme pendant 6 mois, voire plus longtemps.
Facteurs de risque
Les voyageurs non vaccinés ou dont la vaccination est inadéquate qui se rendent dans des régions où la diphtérie est endémique courent un risque accru de contracter la maladie. Le lecteur trouvera une liste des pays où la diphtérie est endémique sur le site Web des Centers for Disease Control and Prevention (site Web seulement disponible en anglais) des États-Unis ou dans la version actuelle du Health Information for International Travel Yellow Book (site Web seulement disponible en anglais) des CDC.
Profil saisonnier et temporel
Les cas de diphtérie sont plus fréquents à l'hiver et au printemps dans les climats tempérés.
Spectre de la maladie clinique
La diphtérie respiratoire affecte les muqueuses des voies respiratoires supérieures. Les symptômes sont notamment une légère fièvre, un mal de gorge, de la difficulté à avaler, une sensation de malaise et une perte d'appétit. Le tableau clinique peut évoluer entraînant une détresse respiratoire aiguë, une obstruction des voies respiratoires supérieures et une asphyxie chez les jeunes enfants. Une membrane gris-blanc adhérente et asymétrique apparaît généralement sur les amygdales et la muqueuse de l'oropharynx au cours des 2 ou 3 premiers jours. La dissémination de la toxine diphtérique peut provoquer des complications systémiques, comme une myocardite et une atteinte du système nerveux central. Le taux de létalité, d'environ 5 à 10 %, est le plus élevé chez les non-vaccinés tant chez les très jeunes que chez les personnes âgées, de même que dans les pays où la maladie n'est pas endémique étant donné que le diagnostic y est souvent posé tardivement. Des cas d'infection cutanée localisée (diphtérie cutanée) peuvent survenir, mais ils sont rarement associés à des complications systémiques.
Répartition de la maladie
Incidence et prévalence
À l'échelle mondiale
La diphtérie est présente partout dans le monde; elle est endémique dans de nombreux pays en développement, ainsi qu'en Albanie, en Russie et dans d'autres pays de l'ancienne Union soviétique. Dans d'autres pays, des cas occasionnels de diphtérie importée sont détectés. Dans des pays où la couverture vaccinale est faible, un retour en force de la diphtérie a été signalé. Au total, 4 187 cas de diphtérie ont été signalés à l'Organisation mondiale de la Santé (OMS) en 2010.
À l'échelle nationale
La vaccination systématique des nourrissons et des enfants contre la diphtérie a provoqué une importante chute du nombre de cas signalés (veuillez consulter la Figure 1). Un faible nombre de souches toxicogènes du bacille de la diphtérie sont détectées chaque année (de 0 à 5 isolats), mais la diphtérie classique est rare. Des enquêtes sérologiques portant sur des populations adultes en bonne santé au Canada indiquent qu'environ 20 % des personnes (voire plus dans certains groupes d'âge) ne possèdent pas de concentrations protectrices d'anticorps contre la diphtérie; des doses de rappel à l'âge adulte sont nécessaires.
Figure 1 : Diphtérie - Cas déclarés et incidence, Canada, 1924-2008
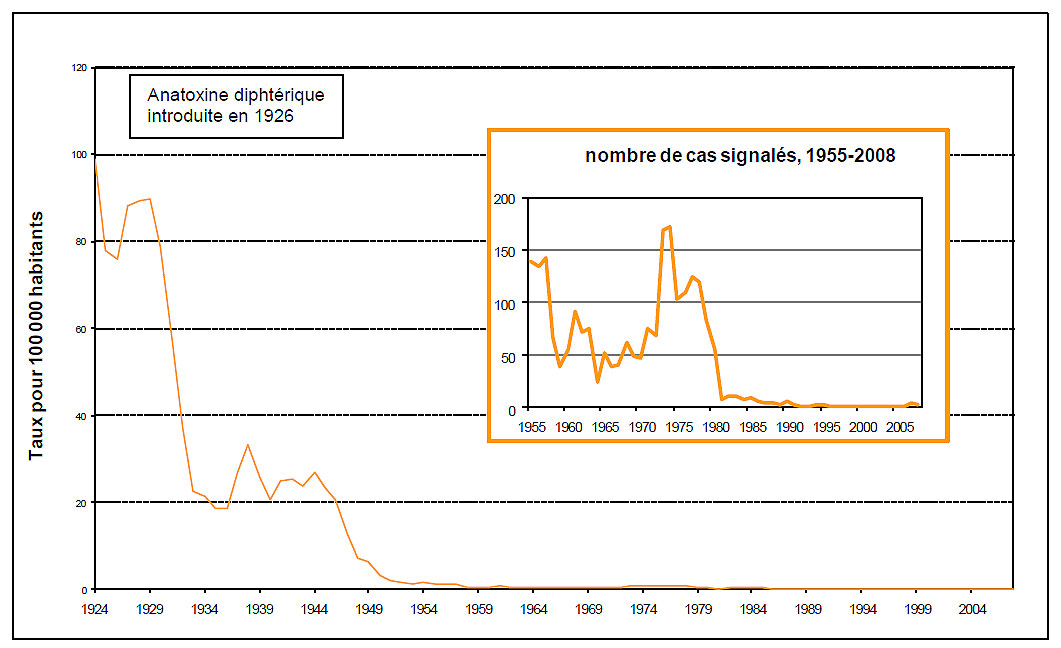
Figure 1 - Note de bas de page
Sources des données démographiques : Statistique Canada, Population par sexe et par âge, 1921-1971, estimations annuelles révisées de la population pour le Canada et les provinces (91-512 au catalogue)
Statistique Canada, Estimations de la population 0-90+ Juillet, Canada-Provinces, 1971-2008.xls
Figure 1 : Diphtérie - Cas déclarés et incidence, Canada, 1924-2008 - Équivalent textuel
L'image comprend deux graphiques présentant les cas déclarés de diphtérie et l'incidence de la diphtérie au Canada. Le plus grand graphique illustre la tendance de l'incidence de la diphtérie au fil des ans, l'axe des x représentant la période entre 1924 et 2004, exprimée en années. L'axe des y représente le taux pour 100 000 habitants, de « 0 » (partie inférieure) à « 120 » (partie supérieure). La ligne orange à l'intérieur du graphique qui montre les taux d'incidence représente la tendance depuis 1924, lorsque le taux était près de 98 pour 100 000 habitants. Bien que ce taux soit tombé à environ 75 en 1926, il a rapidement atteint un sommet de 90 en 1927. Il est évident que l'introduction de l'anatoxine diphtérique en 1926 en entraîné un déclin très important de l'incidence à partir de 1929 ou aux alentours. Le taux a chuté à moins de 20 en 1936. Un autre sommet d'à peu près 32 a été atteint aux alentours de 1938, puis le taux d'incidence a chuté à 20 en 1941. Bien qu'il ait continué à fluctuer aux alentours de 25 jusqu'en 1944, il a commencé à décliner par la suite, atteignant 10 pour 100 000 habitants en 1947 et près de 0 en 1969. Il est demeuré à environ 0 jusqu'en 1984. Aucun rapport du taux d'incidence n'est disponible depuis 1984.
La ligne orange foncé du petit graphique illustrant les cas déclarés de diphtérie montre la tendance depuis 1955, jusqu'en 2008. L'axe des x du graphique représente la période entre 1955 et 2008, exprimée en années. L'axe des y représente le nombre de cas déclarés, de « 0 » (partie inférieure) à « 200 » (partie supérieure). Commençant à environ 137 en 1955, le sommet initial semble avoir été atteint aux alentours de 1957, suivi d'un déclin rapide pour atteindre environ 37 en 1960. Le nombre de cas est passé à près de 90 en 1962. Un autre déclin passager peut être observé aux alentours de 1965, c'est-à-dire lorsque le nombre de cas a chuté à 25. Les cas de diphtérie ont augmenté régulièrement au cours de la décennie suivante, atteignant un niveau record de près de 175 en 1974. Ils sont ensuite tombés à 100 en 1975. À l'exception d'une autre augmentation portant le nombre de cas à 125 en 1977, ce nombre a chuté brusquement à moins de 100 en 1982. Le nombre de cas de diphtérie a continué d'être en baisse, atteignant 0 en 1990 et se situant près de 0 depuis.
Les remarques au bas de la figure indiquent les sources des données démographiques, notamment : « Statistique Canada, Population par sexe et par âge, 1921-1971, estimations annuelles révisées de la population pour le Canada et les provinces (91-512 au catalogue) et Statistics Canada, Population estimates 0-90+ July Canada - Provinces 1971-2008.xls ».
Éclosions récentes
Le risque de retour en force de la diphtérie, si les taux d'immunisation devaient décliner, a été mis en évidence au cours des années 1990 dans la Communauté des États indépendants (ancienne Union soviétique), où plus de 140 000 cas et 4 000 décès ont été signalés.
Préparations autorisées au Canada
Vaccins contenant l'anatoxine diphtérique
- ADACELMD : (Vaccin adsorbé contenant l'anatoxine tétanique, une dose réduite d'anatoxine diphtérique et un vaccin acellulaire contre la coqueluche à contenu antigénique réduit), Sanofi Pasteur Ltd. (dcaT).
- ADACELMD-POLIO : (Vaccin adsorbé contenant l'anatoxine tétanique, une dose réduite d'anatoxine diphtérique et un vaccin acellulaire contre la coqueluche à contenu antigénique réduit combinés à un vaccin antipoliomyélitique inactivé), Sanofi Pasteur Ltd. (dcaT-VPI).
- BOOSTRIXMD :(Vaccin adsorbé contenant l'anatoxine tétanique, une dose réduite d'anatoxine diphtérique et un vaccin acellulaire contre la coqueluche à contenu antigénique réduit), GlaxoSmithKline Inc. (dcaT).
- BOOSTRIXMD-POLIO : (Vaccin adsorbé contenant l'anatoxine tétanique, une dose réduite d'anatoxine diphtérique et un vaccin acellulaire contre la coqueluche à contenu antigénique réduit combinés à un vaccin antipoliomyélitique inactivé), GlaxoSmithKline Inc. (dcaT-VPI).
- INFANRIXMD-IPV/Hib : (Vaccin adsorbé contenant les anatoxines diphtérique et tétanique, un vaccin acellulaire contre la coqueluche, un vaccin antipoliomyélitique inactivé et un vaccin conjugué contre Haemophilus influenzae de type b), GlaxoSmithKline Inc. (DCaT-HB-VPI-Hib).
- INFANRIX hexaMD : (Vaccin adsorbé contenant les anatoxines diphtérique et tétanique, un vaccin acellulaire contre la coqueluche, un vaccin (recombinant) contre l'hépatite B, un vaccin antipoliomyélitique inactivé et un vaccin conjugué contre Haemophilus influenzae de type b), GlaxoSmithKline Inc. (DCaT-HB-VPI-Hib).
- PEDIACELMD : (Vaccin adsorbé contenant les anatoxines diphtérique et tétanique et un vaccin acellulaire contre la coqueluche combinés à un vaccin antipoliomyélitique inactivé et à un vaccin conjugué contre Haemophilus influenzae de type b), Sanofi Pasteur Ltd. (DCaT-VPI-Hib).
- QUADRACELMD : (Vaccin adsorbé contenant les anatoxines diphtérique et tétanique et un vaccin acellulaire contre la coqueluche combinés à un vaccin antipoliomyélitique inactivé), Sanofi Pasteur Ltd. (DCaT-VPI).
- Td ADSORBÉES : (Vaccin adsorbé contenant l'anatoxine tétanique et une dose réduite d'anatoxine diphtérique, Sanofi Pasteur Ltd. (Td).
L'anatoxine diphtérique n'est offerte qu'en vaccins combinés. La quantité d'anatoxine diphtérique varie selon le produit. Les préparations contenant de fortes concentrations d'anatoxine diphtérique (désignées par la lettre « D ») sont administrées pour la primovaccination des nourrissons et des enfants de moins de sept ans (formule pédiatrique). Les préparations contenant de faibles concentrations (désignées par les lettres « d » et la mention « dose réduite ») peuvent être administrées en dose de rappel aux enfants de quatre ans à moins de sept ans et sont le produit recommandé pour les enfants plus âgés, les adolescents et les adultes (formule pour adolescents et adultes).
Anatoxine diphtérique
- SÉRUM ANTIDIPHTÉRIQUE : Immunoglobulines purifiées obtenues du plasma de chevaux hyperimmunisés avec l'anatoxine diphtérique, Institut Butantan (AtxD).
AtxD est une préparation d'immunoglobulines spécifiques administrée par voie intramusculaire ou intraveineuse, qui peut être procurer auprès des responsables de la santé publique locaux en cas d'urgence.
Pour obtenir les renseignements thérapeutiques complets, veuillez consulter le dépliant du produit ou l'information contenue dans la monographie de produit autorisée par Santé Canada, disponible dans la Base de données sur les produits pharmaceutiques. Veuillez consulter le Tableau 1 et le Tableau 2 du chapitre Contenu des agents immunisants autorisés au Canada de la partie 1 pour voir la liste de tous les vaccins et agents d'immunisation passive autorisés au Canada et les ingrédients qu'ils renferment.
Efficacité potentielle, efficacité réelle et immunogénicité
L'anatoxine diphtérique protège contre les effets généraux de la toxine diphtérique, mais non directement contre l'infection. Le portage de C. diphtheriae est possible chez les personnes immunisées, mais le taux de portage est inférieur dans les populations vaccinées. Après une série primaire complète, plus de 97 % des vaccinés produisent des concentrations d'anticorps qui leur confèrent une protection contre la toxine diphtérique. Dans les études évaluant la réponse à la vaccination de rappel, 100 % des vaccinés présentaient des concentrations d'anticorps protecteurs 1 mois après la dose de rappel. On pense que l'antitoxine persiste à des concentrations protectrices pendant 10 ans ou plus.
Indications
Nourrissons et enfants (de 2 mois à 17 ans)
L'administration du vaccin contenant l'anatoxine diphtérique dans le cadre de la vaccination systématique des nourrissons est recommandée à partir de l'âge de 2 mois. Le vaccin DCaT-VPI (avec ou sans composant contre Hib) est autorisé pour une utilisation chez les enfants de moins de 7 ans. Le vaccin DCaT-HB-VPI-Hib est autorisé chez les enfants âgés de 6 semaines à 23 mois et il peut au besoin être administré à des enfants âgés de 24 mois à moins de 7 ans. Le vaccin DCaT-VPI ou dcaT-VPI doit être administré comme dose de rappel chez les enfants de 4 à 6 ans. Les enfants âgés de 7 ans ou plus devraient recevoir la formule pour adolescents/adultes du vaccin contre la diphtérie, le tétanos et la coqueluche avec ou sans composant antipoliomyélitique (dcaT ou dcaT-VPI), car il contient moins d'anatoxine diphtérique que les préparations administrées aux jeunes enfants et est moins susceptible de provoquer des réactions chez les enfants plus âgés. Le vaccin dcaT devrait être administré aux adolescents de 14 à 16 ans comme première dose de rappel après 10 ans; le vaccin dcaT-VPI devrait être utilisé si le VPI est également indiqué.
Adultes (de 18 ans et plus)
Les adultes n'ayant pas reçu la série primaire du vaccin contenant l'anatoxine diphtérique (au moins 3 doses) devraient compléter leur vaccination systémique avec un vaccin à composant Td, y compris 1 dose du vaccin dcaT-VPI. Selon de nouvelles données, il pourrait ne pas être nécessaire de recevoir une dose de rappel du vaccin Td tous les 10 ans. Jusqu’à ce qu’une revue complète de la littérature soit effectuée, il est recommandé de recevoir 1 dose de rappel du vaccin Td tous les 10 ans.
Veuillez consulter les sections Calendrier et Doses de rappel et revaccination. Consulter les chapitres Anatoxine tétanique, Vaccin contre la coqueluche, Vaccin contre la poliomyélite, Vaccin contre Haemophilus influenzae de type b et Vaccin contre l'hépatite B de la partie 4 pour obtenir de plus amples renseignements.
Personnes dont le dossier de vaccination est incomplet
Les enfants et adultes qui ne disposent pas de documents adéquats sur l'immunisation devraient être considérés comme non immunisés et recevoir le vaccin et les doses indiquées selon leur âge et leurs facteurs de risque. S'il est disponible, le dosage sérique des antitoxines diphtérique et tétanique peut indiquer s'il y a lieu de poursuivre l'immunisation. Veuillez consulter le chapitre Immunisation des enfants et des adultes dont le dossier de vaccination est incomplet de la partie 3 pour obtenir davantage de renseignements généraux.
Grossesse et allaitement
L'immunisation avec le dcaT pendant la grossesse s'est révélée sans danger et efficace dans la prévention de l'infection néonatale et infantile par la coqueluche. Veuillez consulter le chapitre Vaccin contre la coqueluche de la partie 4 pour obtenir davantage de renseignements. Veuillez consulter le chapitre Immunisation durant la grossesse et l'allaitement de la partie 3 pour obtenir davantage de renseignements.
Enfants prématurés
Les bébés prématurés dans un état clinique stable devraient recevoir un vaccin contenant l'anatoxine diphtérique au même âge chronologique et selon le même calendrier que les enfants nés à terme. Les prématurés (en particulier ceux qui pèsent moins de 1 500 grammes à la naissance) présentent un risque accru d'apnée et de bradycardie après la vaccination. Les prématurés hospitalisés doivent faire l'objet d'une surveillance cardiaque et respiratoire continue pendant les 48 heures suivant leur première immunisation. Veuillez consulter le chapitre Immunisation des bébés prématurés de la partie 3 pour obtenir davantage de renseignements généraux.
Personnes et résidents d'un établissement de santé
Les résidents des établissements de soins de longue durée devraient recevoir tous les vaccins courants prévus pour leur âge et leur niveau individuel de risque, y compris un vaccin contenant l'anatoxine diphtérique. Veuillez consulter le chapitre Immunisation des patients/résidents dans les établissements de santé dans les établissements de santé de la partie 3 pour obtenir davantage de renseignements généraux.
Sujets immunodéprimés
Le vaccin contre la diphtérie, le tétanos, la coqueluche, la poliomyélite et Hib peut être administré à des sujets immunodéprimés. Lorsqu'on envisage de vacciner une personne immunodéprimée, une consultation auprès du médecin traitant peut être utile. Il est conseillé de recommander les cas complexes à un médecin qui possède une expertise en vaccination ou en immunodéficience. Veuillez consulter le chapitre Immunisation des sujets immunodéprimés de la partie 3 pour obtenir d'avantage de renseignements généraux.
Personnes aux prises avec une maladie chronique
Troubles neurologiques
Les personnes atteintes de troubles neurologiques apparus avant l'immunisation doivent recevoir tous les vaccins recommandés de façon systématique. Veuillez consulter les chapitres Anatoxine tétanique et Vaccin contre la coqueluche de la partie 4 pour obtenir des renseignements sur les autres composants des vaccins combinés contenant l'anatoxine diphtérique. Consulter le chapitre Immunisation des personnes aux prises avec une maladie chronique de la partie 3 pour obtenir davantage de renseignements généraux.
Voyageurs
Les voyageurs non immunisés ou non complètement immunisés devraient recevoir le vaccin contre la diphtérie, le tétanos, la coqueluche, la poliomyélite et Hib selon ce qui convient à leur âge. Dans le cas des parents qui apportent leur nourrisson en voyage, la première dose du vaccin DCaT-VPI-Hib ou du vaccin DCaT-HB-VPI-Hib peut être administrée à l'âge de 6 semaines (voir Calendrier). Les voyageurs d'âge adulte ayant déjà été immunisés devraient recevoir une dose de rappel d'une préparation contenant les anatoxines diphtérique et tétanique tous les 10 ans. Dans le cas des adultes qui n'ont pas déjà reçu une dose du vaccin anticoquelucheux acellulaire à l'âge adulte, il est recommandé de remplacer la dose de rappel d'anatoxines Td par le vaccin dcaT. Certains voyageurs pourraient aussi avoir besoin d'une dose de rappel du vaccin contre la poliomyélite. Veuillez consulter le chapitre Vaccin contre la poliomyélite de la partie 4 pour obtenir davantage de renseignements. Consulter le chapitre Immunisation des voyageurs de la partie 3 pour obtenir davantage de renseignements généraux.
Nouveaux arrivants au Canada
Les professionnels de soins de santé qui examinent des nouveaux arrivants au pays devraient évaluer leur statut vaccinal et mettre à jour leurs vaccins. Veuillez consulter le chapitre Immunisation des nouveaux arrivants au Canada de la partie 3 pour obtenir davantage de renseignements généraux.
Travailleurs
Tous les travailleurs de la santé devraient être immunisés contre la diphtérie et recevoir une dose de rappel du vaccin Td tous les 10 ans, tel qu'on le recommande pour tous les adultes. Tous les travailleurs de la santé et des services à l'enfance, peu importe leur âge, devraient recevoir une dose unique du vaccin dcaT s'ils n'ont pas déjà reçu ce vaccin à l'âge adulte, afin d'être immunisés contre la coqueluche, même s'ils n'ont pas besoin d'une dose de rappel du vaccin contre le tétanos et la diphtérie. Veuillez consulter le chapitre Immunisation des travailleurs de la partie 3 pour obtenir davantage de renseignements généraux.
Immunisation post-exposition
Vaccin contenant l'anatoxine diphtérique
Les personnes qui ont été en contact étroit (p. ex. à la maison, en classe) avec un cas de diphtérie devraient recevoir une dose d'un vaccin contenant l'anatoxine diphtérique adaptée à leur âge, à moins que l'on sache qu'elles ont été complètement immunisées et qu'elles ont reçu leur dernière dose de rappel au cours des 10 années précédentes. Les doses restantes d'anatoxine diphtérique pour assurer l'immunisation complète devraient être administrées à tous les contacts qui n'étaient pas immunisés auparavant ou qui ne l'étaient que partiellement.
Anatoxine diphtérique (d'origine équine)
Prophylaxie
L'administration de l'antitoxine diphtérique n'est pas recommandée à titre de prophylaxie chez les personnes ayant été en contact étroit avec un cas de diphtérie, que ces personnes aient été immunisées auparavant ou non, étant donné le risque élevé de réaction allergique au sérum équin et l'absence de données relativement à un bienfait accru lié à l'administration de l'antitoxine chez des contacts ayant reçu un traitement prophylactique antimicrobien.
Traitement
En cas d'urgence, on peut se procurer de l'antitoxine diphtérique pour le traitement de la diphtérie auprès des responsables de la santé publique locaux. L'antitoxine devrait être administrée lorsqu'on soupçonne un cas de diphtérie à la lumière des signes cliniques observés, avant confirmation bactériologique. Les méthodes utilisées pour déterminer s'il existe une sensibilité au sérum équin et pour déterminer la dose et la voie d'administration sont indiquées dans le dépliant du produit du fabricant. Si les tests de sensibilité sont positifs, il faut effectuer une désensibilisation en suivant les recommandations du fabricant. L'administration par voie intramusculaire est habituellement suffisamment efficace, mais il faut parfois recourir à une administration par voie intraveineuse.
Les personnes qui se sont rétablies de la diphtérie devraient recevoir le vaccin contenant l'anatoxine diphtérique, tel qu'on le recommande pour les personnes n'ayant jamais souffert de la maladie. Comme les symptômes de la diphtérie sont, dans une grande mesure, provoqués par les toxines produites par la bactérie et non par la bactérie même, le rétablissement de la diphtérie ne confère pas nécessairement une immunité.
Veuillez consulter la section Innocuité et effets secondaires du vaccin et de l'anatoxine diphtérique pour obtenir de l'information sur l'innocuité du produit.
Pour obtenir les renseignements thérapeutiques complets, veuillez consulter le dépliant du produit ou l'information contenue dans la monographie de produit autorisée par Santé Canada, disponible dans la Base de données sur les produits pharmaceutiques.
Administration du vaccin
Dose, voie d'administration et calendrier
Dose
Chaque dose de vaccin contenant l'anatoxine diphtérique est de 0,5 ml.
Voie d'administration
Les vaccins contenant l'anatoxine diphtérique doivent être administrés par voie intramusculaire. Veuillez consulter le chapitre Méthodes d'administration des vaccins de la partie 1 pour obtenir davantage de renseignements.
Calendrier
Nourrissons et enfants (de 2 mois à 6 ans)
Vaccination systématique des nourrissons contre la diphtérie : Le vaccin DCaT-VPI-Hib devrait être administré à l'âge de 2, 4 et 6 mois et entre l'âge de 12 et 23 mois (habituellement à 18 mois).
Si l'on amorce la vaccination des nourrissons contre l'hépatite B, on peut administrer le vaccin DCaT-HB-VPI-Hib au lieu de donner séparément le vaccin contre l'hépatite B et le DCaT-VPI-Hib. Le vaccin DCaT-HB-VPI-Hib est autorisé chez les enfants âgés de 6 semaines à 23 mois et il peut au besoin être administré à des enfants âgés de 24 mois à moins de 7 ans. Le vaccin DCaT-HB-VPI-Hib peut être administré à l'âge de 2, 4 et 6 mois et entre l'âge de 12 et 23 mois, mais il est peu probable que la quatrième dose confère une protection supplémentaire importante contre l'hépatite B et elle augmentera le coût. D'autres calendriers peuvent être utilisés :
- vaccin DCaT-HB-VPI-Hib (à l'âge de 2, 4 et 6 mois) et vaccin DCaT-VPI-Hib (entre 12 et 23 mois);
- vaccin DCaT-HB-VPI-Hib (à l'âge de 2 et 4 mois et entre 12 et 23 mois) et vaccin DCaT-VPI-Hib (à l'âge de 6 mois).
Lorsqu'une protection rapide est nécessaire pour un nourrisson, on peut donner la première dose du vaccin DCaT-VPI-Hib ou DCaT-HB-VPI-Hib à l'âge de 6 semaines. On peut donner les 3 premières doses à intervalles de 4 semaines, et la quatrième dose, idéalement 12 mois après la troisième. La quatrième dose peut être administrée au minimum 6 mois après la troisième dose dans certaines situations (p. ex. voyage), mais elle doit être administrée à l'âge de 12 mois ou plus pour assurer une immunité durable.
Les enfants de moins de 7 ans n'ayant pas été immunisés dans les premiers mois de leur vie : Il faudrait administrer 3 doses du vaccin DCaT-VPI (avec ou sans composant contre Hib, selon l'âge de l'enfant) à 8 semaines d'intervalle, suivies d'une dose du vaccin DCaT-VPI administrée 6 à 12 mois après la troisième dose. Une dose de rappel du vaccin DCaT-VPI ou dcaT-VPI devrait être administrée à l'âge de 4 à 6 ans (entrée à l'école). La dose de rappel prévue à l'âge de 4 à 6 ans n'est pas requise si la quatrième dose du vaccin contenant l'anatoxine tétanique a été administrée après le quatrième anniversaire de l'enfant.
Lorsqu'une protection rapide est nécessaire pour un enfant de moins de 7 ans n'ayant pas été immunisé dans sa petite enfance, on peut donner les 3 premières doses à 4 semaines d'intervalle et la quatrième dose, idéalement, 12 mois après la troisième. La quatrième dose peut être administrée au minimum 6 mois après la troisième dose dans certaines situations (p. ex. voyage).
Les enfants qui ont reçu une série primaire d'un vaccin contenant l'anatoxine diphtérique et une dose rappel 6 à 12 mois plus tard : Selon les indications ci-dessus, ils devraient recevoir une dose de rappel du vaccin DCaT-VPI ou dcaT-VPI à l'âge de 4 à 6 ans (entrée à l'école), ainsi qu'une dose de rappel du vaccin dcaT 10 ans plus tard, à l'âge de 14 à 16 ans. La dose de rappel prévue à l'âge de 4 à 6 ans n'est pas requise si la quatrième dose du vaccin contenant l'anatoxine diphtérique a été administrée après le quatrième anniversaire de l'enfant.
Enfants et adolescents (de 7 à 17 ans)
Les enfants de 7 ans ou plus n'ayant pas été immunisés devraient recevoir 3 doses du vaccin dcaT-VPI, les 2 premières à 8 semaines d'intervalle, la troisième étant administrée de 6 à 12 mois après la deuxième. Une dose de rappel du vaccin dcaT devrait être administrée 10 ans après la dernière dose.
Adultes (de 18 ans et plus)
Les adultes n'ayant pas reçu la série primaire du vaccin contenant l'anatoxine diphtérique (au moins 3 doses) devraient compléter leur vaccination systémique avec un vaccin à composant Td, y compris une dose du vaccin dcaT-VPI.
Doses de rappel et revaccination
Une dose de rappel à l'âge préscolaire du vaccin DCaT-VPI ou du vaccin dcaT-VPI devrait être administrée entre l'âge de 4 et 6 ans. Les adolescents devraient recevoir de façon systématique une dose de rappel du vaccin dcaT à l'âge de 14 à 16 ans.
Selon de nouvelles données, il pourrait ne pas être nécessaire de recevoir des doses de rappel du vaccin Td aux 10 ans. Jusqu’à ce qu’une revue complète de la littérature soit effectuée, il est toujours recommandé de recevoir des doses de rappel du vaccin Td tous les 10 ans. Les adultes qui n'ont pas reçu le vaccin contre la coqueluche à l'âge adulte devraient recevoir une dose du vaccin dcaT, qui peut être administrée quel que soit l'intervalle depuis la dernière dose du vaccin contenant les anatoxines tétanique et diphtérique. Veuillez consulter la section Calendrier.
Tests sérologiques
Les tests sérologiques ne sont recommandés ni avant ni après l'administration d'un vaccin contenant l'anatoxine diphtérique.
Conditions d'entreposage
Entreposer les préparations contenant l'anatoxine diphtérique dans un réfrigérateur à une température de +2 °C à +8 °C; ne pas congeler. Veuillez consulter le chapitre Manipulation et entreposage des agents immunisants de la partie 1 pour obtenir davantage de renseignements généraux.
Administration simultanée d'autres vaccins
Les vaccins contenant l'anatoxine diphtérique peuvent être donnés en même temps que d'autres vaccins administrés systématiquement, mais il faut utiliser un point d'injection différent ainsi qu'une aiguille et une seringue distinctes. Veuillez consulter le chapitre Calendrier d'administration des vaccins de la partie 1 pour obtenir davantage de renseignements généraux.
Innocuité et effets secondaires du vaccin et de l'anatoxine diphtérique
Veuillez consulter le chapitre Effets secondaires suivant l'immunisation de la partie 2 pour obtenir davantage de renseignements généraux. Consulter les chapitres Anatoxine tétanique, Vaccin contre la coqueluche, Vaccin contre la poliomyélite, Vaccin contre Haemophilus influenzae de type b et Vaccin contre l'hépatite B de la partie 4 pour obtenir de plus amples renseignements sur les autres composants des vaccins combinés contenant l'anatoxine diphtérique.
Effets secondaires fréquents et effets secondaires locaux
Vaccins contenant l'anatoxine diphtérique
L'érythème, l'œdème et la douleur au point d'injection sont les principaux effets secondaires des vaccins pédiatriques combinés contenant l'anatoxine diphtérique. Un nodule peut être palpable au point d'injection pendant plusieurs semaines. Des cas d'abcès au point d'injection ont également été signalés.
Dans les essais cliniques, des effets secondaires au point d'injection tels qu'une sensibilité, un érythème ou de l'œdème ou toute combinaison de ces effets ont été signalés chez 10 à 40 % des enfants après chacune des 3 premières doses du vaccin contenant l'anatoxine diphtérique. Des réactions générales légères, telles que de la fièvre, de l'irritabilité une humeur maussade, ou toute combinaison de ces effets, ont été fréquemment signalées (de 8 à 29 %), de même que de la somnolence (de 40 à 52 %).
Dans deux études cliniques, on a observé des cas d'œdème (de plus de 5 cm) et d'érythème chez 15 à 20 % des vaccinés après la quatrième ou la cinquième dose du vaccin DCaT. Des cas d'œdème sévère (de plus de 10 cm de diamètre), pouvant affecter toute la partie proximale du membre, ont été observés chez 2 à 6 % des enfants. Bien que ces réactions survenues au point d'injection aient entraîné un œdème considérable, la douleur était généralement limitée. Selon certaines données, un œdème sévère était plus susceptible de se produire après la cinquième dose d'un vaccin DCaT chez les enfants qui avaient présenté un tel œdème après la quatrième dose. La survenue, au point d'injection, d'une réaction importante à une dose antérieure ne constitue toutefois pas une contre-indication au maintien du calendrier recommandé.
Les réactions couramment observées chez les adultes ayant reçu une dose de rappel du vaccin dcaT étaient notamment les suivantes : douleur, rougeur et œdème au point d'injection, céphalées et fatigue. La fièvre et les frissons étaient également courants. Les effets secondaires observés après l'administration du vaccin Td étaient semblables. De façon générale, les effets secondaires étaient moins fréquents chez les adultes que chez les adolescents. La longueur de l'intervalle séparant l'administration des doses du vaccin DCaT ou d'une dose du vaccin dT pendant l'enfance et l'administration du vaccin dcaT n'a aucune incidence sur la fréquence des effets secondaires généraux ou des effets secondaires au point d'injection.
AtxD
L'antitoxine diphtérique peut déclencher des réactions allergiques de gravité variable, notamment : prurit, douleur, œdème, rougeur cutanée; urticaire; toux sèche ou enrouement; nausées ou vomissements; crise asthmatiforme. La fréquence de ces réactions est variable, et celles-ci surviennent au cours des 24 premières heures suivant l'administration de l'AtxD. Les personnes ayant déjà reçu du sérum d'origine équine pourraient courir un plus grand risque d'effets secondaires.
Effets secondaires moins fréquents et manifestations cliniques inhabituelles graves ou sévères
Vaccins contenant l'anatoxine diphtérique
Les manifestations cliniques inhabituelles graves sont rares après l'immunisation par un vaccin contenant l'anatoxine diphtérique et, dans la plupart des cas, les données sont insuffisantes pour établir un lien de causalité. Des réactions générales sévères, comme une urticaire généralisée, une anaphylaxie ou des complications neurologiques, ont été rarement signalées.
Des réactions graves au point d'injection (de type Arthus) sont occasionnellement signalées après l'administration d'un vaccin contenant l'anatoxine diphtérique ou l'anatoxine tétanique. Il peut y avoir un œdème important et douloureux autour du point d'injection, touchant souvent le bras entre l'épaule et le coude, généralement de 2 à 8 heures après l'injection. De telles réactions sont le plus souvent signalées chez les adultes, en particulier chez ceux qui ont reçu des doses fréquentes d'anatoxine diphtérique ou d'anatoxine tétanique, ou les deux. Les personnes chez qui l'on observe de graves réactions au point d'injection présentent habituellement de très fortes concentrations sériques d'antitoxines et ne devraient pas recevoir d'autres doses de rappel (systématiques) du vaccin Td avant au moins 10 ans. Une personne enceinte ayant des antécédents de réaction au site d'injection de type Arthus au cours des 10 dernières années doit être adressée à un spécialiste avant de se faire revacciner avec le vaccin dcaT.
AtxD
Les réactions graves sont rares. On a observé un choc anaphylactique mortel chez 1 personne sur 50 000 ayant reçu de l'AtxD. Une maladie sérique (fièvre, urticaire, arthralgie, adénomégalie et, plus rarement, atteinte neurologique ou rénale) peut survenir entre 5 et 24 jours après l'administration d'AtxD chez environ 8 % des vaccinés.
Autres effets secondaires et affections signalées
Des cas de syndrome de Guillain-Barré (SGB) ou de polynévrite ont été signalés après l'administration d'un vaccin contenant l'anatoxine diphtérique. Bien que les données semblent indiquer l'existence d'une relation de cause à effet entre l'administration de l'anatoxine tétanique et le SGB, peu de données appuient l'existence d'une association indépendante entre l'administration d'anatoxine diphtérique et le SGB.
Conseils pour la déclaration des manifestations cliniques inhabituelles suivant l'immunisation (MCI)
Les fournisseurs de vaccins sont priés de signaler aux responsables de la santé publique locaux tout effet secondaire grave ou inattendu qu'ils estiment être temporellement associé à la vaccination, afin qu'une enquête approfondie puisse être menée. Une manifestation clinique inhabituelle (MCI) inattendue suivant l'immunisation est un effet secondaire qui ne figure pas dans les renseignements disponibles sur le produit, mais qui peut être causé par l'immunisation, ou par une augmentation de la fréquence même de la MCI connue. Veuillez consulter le guide Déclaration de manifestations cliniques inhabituelles (MCI) à la suite d'une immunisation au Canada et le chapitre Effets secondaires suivant l'immunisation de la partie 2 pour obtenir des renseignements supplémentaires sur la déclaration des MCI.
Contre-indications et précautions
Les vaccins contenant l'anatoxine diphtérique sont contre-indiqués chez les personnes ayant déjà eu une réaction anaphylactique au vaccin et chez les personnes ayant une hypersensibilité immédiate ou anaphylactique établie à l'un ou l'autre des composants du vaccin ou de son contenant. Veuillez consulter le Tableau 1 et le Tableau 2 du chapitre Contenu des agents immunisants autorisés au Canada de la partie 1 pour voir la liste de tous les vaccins et agents d'immunisation passive autorisés au Canada et les ingrédients qu'ils renferment.
L'hypersensibilité à la levure est très rare et des antécédents personnels d'allergie à la levure ne sont pas fiables généralement. Dans les cas où l'on soupçonne une hypersensibilité ou une allergie non anaphylactique à un composant vaccinal, il est indiqué de mener une enquête dans le cadre de laquelle on pourrait effectuer la vaccination dans un milieu sous surveillance. Il est conseillé de consulter un allergologue.
L'administration du vaccin contenant l'anatoxine diphtérique devrait être retardée chez les personnes atteintes d'une maladie aiguë modérée ou grave. Dans le cas d'une maladie aiguë mineure (avec ou sans fièvre), la personne peut être vaccinée.
Il est prudent de ne pas administrer de doses subséquentes d'un vaccin contenant l'anatoxine tétanique aux sujets qui développent le syndrome de Guillain-Barré dans les six semaines suivant l'administration d'un tel vaccin. Les sujets qui développent le syndrome de Guillain-Barré en dehors d'un intervalle de six semaines peuvent recevoir des vaccins subséquents contenant l'anatoxine tétanique. Si le sujet a été infecté à Campylobacter (cette infection a été associée au syndrome de Guillain-Barré) et a reçu un vaccin contenant les anatoxines tétanique et diphtérique au cours des six semaines précédant l'apparition du syndrome de Guillain-Barré, il est conseillé de consulter un spécialiste des maladies infectieuses.
Les personnes qui présentent une réaction grave au point d'injection après avoir reçu une dose d'un vaccin contenant l'anatoxine tétanique ne devraient pas recevoir une nouvelle dose avant au moins 10 ans.
Veuillez consulter le chapitre Contre-indications et précautions de la partie 2.
Autres considérations
Interchangeabilité des vaccins
La série vaccinale primaire consistant en l'administration de trois doses de vaccins contenant l'anatoxine diphtérique devrait être effectuée avec un vaccin adéquat provenant du même fabricant dans la mesure du possible. Toutefois, si l'on ignore quel vaccin a été administré initialement ou si celui-ci n'est pas disponible, un autre vaccin combiné provenant d'un fabricant différent peut être utilisé pour terminer la série vaccinale primaire. D'après l'opinion d'experts, un produit adéquat de n'importe quel fabricant peut être utilisé pour toutes les doses de rappel. Veuillez consulter le chapitre Principes de l'interchangeabilité des vaccins de la partie 1 pour obtenir davantage de renseignements généraux.
Références choisies
- Centers for Disease Control and Prevention. ACIP Provisional Recommendations for Health Care Personnel on use of Tetanus Toxoid, Reduced Diphtheria Toxoid and Acellular Pertussis Vaccine (Tdap) and use of Postexposure Antimicrobial Prophylaxis.
- Centers for Disease Control and Prevention. Notice to Readers: FDA Approval of Diphtheria and Tetanus Toxoids and Acellular Pertussis Vaccine Adsorbed, (INFANRIXMD) for Fifth Consecutive DTaP Vaccine Dose. MMWR Morb Mortal Wkly Rep. 2003 Sep 26;52(38):921.
- Centers for Disease Control and Prevention. Prevention of Pertussis, Tetanus, and Diphtheria Among Pregnant and Postpartum Women and Their Infants. Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Morb Mortal Wkly Rep. 2008;57(RR-4):1-49.
- Centers for Disease Control and Prevention. The Pink Book: Epidemiology and Prevention of Vaccine Preventable Diseases. Updated 11th ed.; May 2009.
- Centers for Disease Control and Prevention. Health Information for International Travel 2012. The Yellow Book.
- Centers for Disease Control and Prevention. Update: Guillain-Barré syndrome among recipients of MenactraMD meningococcal conjugate vaccine--United States, June 2005-September 2006. MMWR 2006;55:1120-24.
- Centers for Disease Control and Prevention. Updated Recommendations for Use of Tetanus Toxoid, Reduced Diphtheria Toxoid and Acellular Pertussis (Tdap) Vaccine from the Advisory Committee on Immunization Practices, 2010. MMWR Morb Mortal Wkly Rep. 2011;60(1):13-15.
- Centers for Disease Control and Prevention. Updated Recommendations for Use of Tetanus Toxoid, Reduced Diphtheria Toxoid, and Acellular Pertussis (Tdap) Vaccine in Adults Aged 65 Years and Older -- Advisory Committee on Immunization Practices (ACIP), 2012.
- Comité consultatif national de l'immunisation. Intervalle dans l'administration des vaccins contre la diphtérie, le tétanos et la coqueluche. Relevé des maladies transmissibles au Canada, vol. 31 (DCC-9), 2005.
- Comité consultatif national de l'immunisation. Déclaration sur l'usage recommandé des vaccins pentavalents et hexavalents. Relevé des maladies transmissibles au Canada, vol. 33 (DCC-1), p. 1-16, 2007.
- David, S., Hemsley, C., Pasquali, P., et al. Surveillance accrue des effets secondaires associés aux vaccins : rattrapage pour le dCaT chez les élèves du secondaire au Yukon. Relevé des maladies transmissibles au Canada, vol. 31(11), p. 117-126, 2005.
- Decker MD, Edwards KM, Steinhoff MC, et al. Comparison of 13 acellular pertussis vaccines: adverse reactions. Pediatrics 1995;96(l):557-66.
- Dittmann S, Wharton M, Vitek C, et al. Successful control of epidemic diphtheria in the states of the former Union of Soviet Socialist Republics: lessons learned. J Infect Dis 2000;181(Suppl 1):S10-22.
- Galazka A, Robertson S. Immunization against diphtheria with special emphasis on immunization of adults.
- Gautret P, Wilder-Smith A. Vaccination against tetanus, diphtheria, pertussis and poliomyelitis in adult travellers. Travel Med Infect Dis 2010;8:155-60.
- GlaxoSmithKline Inc. Monographie de produit - BOOSTRIXMD, octobre 2009.
- GlaxoSmithKline Inc. Monographie de produit - BOOSTRIXMD-POLIO, juin 2008.
- GlaxoSmithKline Inc. Monographie de produit - INFANRIX hexaMD, juillet 2008.
- Halperin S, Sweet L, Baxendale D, et al. How soon after a prior tetanus-diphtheria vaccination can one give adult formulation tetanus-diphtheria-acellular pertussis vaccine? Pediatr Infect Dis J 2006;25(3):195-200.
- Instituto Butantan. Product Leaflet - ANTIDIPHTHERIA SERUM, sans date.
- Institute of Medicine. Adverse Events Associated with Childhood Vaccines: Evidence Bearing on Causality, Washington, DC, National Academy Press, 1994.
- Kretsinger K, Broder KR, Cortese MM, et al. Centers for Disease Control and Prevention; Advisory Committee on Immunization Practices; Healthcare Infection Control Practices Advisory Committee. Preventing tetanus, diphtheria, and pertussis among adults: use of tetanus toxoid, reduced diphtheria toxoid and acellular pertussis vaccine recommendations of the Advisory Committee on Immunization Practices (ACIP) and recommendation of ACIP, supported by the Healthcare Infection Control Practices Advisory Committee (HICPAC), for use of Tdap among health-care personnel. MMWR Recomm Rep 2006 Dec 15;55(RR-17):1-37.
- Langley JM, Predy G, Guasparina R, et al. An adolescent-adult formulation tetanus and diphtheria toxoids adsorbed combined with acellular pertussis vaccine has comparable immunogenicity but less reactogenicity in children 4-6 years of age than a pediatric formulation acellular pertussis vaccine and diphtheria and tetanus toxoids adsorbed combined with inactivated poliomyelitis vaccine. Vaccine 2007;25:1121-25.
- Plotkin SA, Orenstein WA. Vaccines,4th edition. Philadelphia: W.B. Saunders Company, 2003:211-228.
- Rennels MB. Extensive swelling reactions occurring after booster doses of diphtheria-tetanus-acellular pertussis vaccines. Semin Pediatr Infect Dis. 2003 Jul;14(3):196-8.
- Rennels MB, Black S, Woo EJ, et al. Safety of a fifth dose of diphtheria and tetanus toxoid and acellular pertussis vaccine in children experiencing extensive, local reactions to the fourth dose. Pediatr Infect Dis J.2008 May;27(5):464-5.
- Sanofi Pasteur Ltée. Monographie de produit - ADACELMD, août 2009.
- Sanofi Pasteur Ltée. Monographie de produit - ADACELMD-POLIO, octobre 2010.
- Sanofi Pasteur Ltée. Monographie de produit - PEDIACELMD, janvier 2009.
- Sanofi Pasteur Ltée. Monographie de produit - QUADRACELMD, juillet 2008.
- Sanofi Pasteur Ltée. Monographie de produit - Td adsorbées, juillet 2010.
- Varughese P. La diphtérie au Canada - Résumé de surveillance. Rapport hebdomadaire des maladies au Canada 1978;4:65-8.