Lignes directrices : Règlement sur les aliments supplémentés
Juillet 2022
Table des matières
- Résumé
- 1.0 Introduction
- 2.0 Transition des produits au Règlement sur les aliments supplémentés
- 2.1 Aliments supplémentés ayant des lettres d'autorisation de mise en marché temporaire
- 2.2 Demande de lettre d'autorisation de mise en marché temporaire présentée avant l'entrée en vigueur du Règlement sur les aliments supplémentés
- 2.3 Exigences relatives aux aliments supplémentés pendant la période de transition
- 2.4 Modification apportée aux produits pendant la période de transition
- 2.5 Produits commercialisés après l'entrée en vigueur du Règlement sur les aliments supplémentés
- 3.0 Directives pour la mise en œuvre du Règlement sur les aliments supplémentés
- 4.0 Exigences relatives à la conformité au Règlement sur les aliments supplémentés
- 4.1 Catégories autorisées d'aliments en vertu du Règlement sur les aliments supplémentés
- 4.2 Ingrédients supplémentaires et leurs conditions d'utilisation
- 4.2.1 Renseignements inclus dans la Liste des ingrédients supplémentaires autorisés
- 4.2.2 Quantités minimales d'ingrédients supplémentaires
- 4.2.3 Teneurs maximales d'ingrédients supplémentaires
- 4.2.4 Mises en garde relatives aux ingrédients supplémentaires
- 4.2.5 Excédents pour les ingrédients supplémentaires
- 4.2.6 Déficits pour les ingrédients supplémentaires
- 4.2.7 Ajout direct ou indirect d'ingrédients supplémentaires
- 4.2.8 Ingrédients supplémentaires composés de deux parties
- 4.2.9 Normes de qualité relatives aux ingrédients supplémentaires
- 4.2.10 Vitamines et minéraux nutritifs
- 4.2.11 Acides aminés
- 4.2.12 Autres ingrédients supplémentaires
- 4.2.13 Autres substances à considérer comme ingrédients supplémentaires
- 4.2.14 Ingrédients qui ne sont pas considérés comme des ingrédients supplémentaires
- 4.3 Étiquetage des aliments supplémentés
- 4.3.1 Exigences d'étiquetage propres aux aliments supplémentés
- 4.3.2 Étiquetage nutritionnel sur le devant de l'emballage
- 4.3.3 Mention des éléments nutritifs à l'extérieur du tableau des renseignements sur les aliments supplémentés
- 4.3.4 Mention des ingrédients supplémentaires à l'extérieur du tableau des renseignements sur les aliments supplémentés
- 4.3.5 Assortiments
- 4.3.6 Recueil de modèles de tableaux des renseignements sur les aliments supplémentés, d'identifiants des aliments supplémentés avec mise en garde et de listes des mises en garde
- 4.3.7 Allergènes prioritaires, sources de gluten et sulfites
- 4.3.8 Noms d'aliments supplémentés par rapport aux noms d'aliments normalisés
- 4.4 Exigences réglementaires et directives relatives à l'utilisation des déclarations et des allégations liées à la nutrition et à la santé sur les aliments supplémentés
- 4.4.1 Allégations santé générales
- 4.4.2 Allégations relatives à la teneur en éléments nutritifs
- 4.4.3 Types d'allégations santé et exigences réglementaires associées
- 4.4.4 Justification des allégations santé
- 4.4.5 Lignes directrices générales au sujet des allégations santé
- 4.4.6 Déclarations relatives aux acides aminés sur les aliments supplémentés
- 4.4.7 Restrictions particulières à l'utilisation d'allégations et autres déclarations sur les aliments supplémentés
- 5.0 Conformité et application du Règlement sur les aliments supplémentés
- 6.0 Voie d'accès au marché pour de nouveaux produits qui ne sont pas conformes à la Liste des catégories autorisées d'aliments supplémentés et/ou à la Liste des ingrédients supplémentaires autorisés
- 7.0 Ressources disponibles
- 8.0 Coordonnées
- 9.0 Glossaire et abréviations
- Annexe 1 : Documents incorporés par renvoi dans le Règlement sur les aliments supplémentés
- Annexe 2 : Est-ce que mon produit est un aliment supplémenté (AS)?
- Annexe 3 : Ingrédients dont la présence est interdite dans les aliments, y compris les aliments supplémentés
- Annexe 4 : Vitamines et minéraux nutritifs - Approche pour établir les teneurs maximales et autres conditions d'utilisation
- Annexe 5 : Acides aminés - Approche relative à l'établissement des teneurs maximales et des conditions d'utilisation
- Annexe 6 : Taurine - Approche relative à l'établissement de la teneur maximale et autres conditions d'utilisation
- Annexe 7 : Lignes directrices pertinentes de Santé Canada et autres ressources
- Références citées
Liste des tableaux
- Tableau 1 : Exemples illustrant les exigences réglementaires applicables aux différents types d'aliments préemballés ainsi qu'aux produits de santé naturels
- Tableau 2 : Description des aliments préemballés de la Liste des catégories autorisées d'aliments supplémentés
- Tableau 3 : Exemple d'exigences de la Liste des ingrédients supplémentaires autorisés pour la vitamine A (Rétinol)
- Tableau 4 : Vitamines et minéraux nutritifs dont l'ajout aux aliments supplémentés est interdit
- Tableau 5 : Acides aminés dont l'ajout aux aliments supplémentés est interdit
- Tableau 6 : Sources associées au calcul des teneurs maximales en vitamines et en minéraux
- Tableau 7 : Acides aminés essentiels et non essentiels associés à la synthèse des protéines
Listes des Figures
- Figure 1 : Tableau des renseignements sur les aliments supplémentés
- Figure 2 : Déclaration de vitamine A (bêta-carotène et rétinol) dans le TRAS
- Figure 3 : Exemple de liste de mises en garde sur une étiquette d'AS
- Figure 4 : Modèle normalisé bilingue d'un identifiant des aliments supplémentés avec mise en garde
Résumé
Les aliments supplémentés (AS) sont des aliments préemballés auxquels on a ajouté des ingrédients supplémentaires (IS). Le titre 29 de la partie B du Règlement sur les aliments et drogues (RAD) a été créé pour établir les exigences spécifiques pour les AS. D'autres modifications ont été apportées au titre 1 de la partie B et à la partie D du RAD. Les documents incorporés par renvoi dans le RAD précisent les exigences supplémentaires relatives aux AS, qu'un produit doit respecter comme condition de vente pour être sur le marché. Auparavant, les produits qui satisfaisaient aux conditions établies en matière de composition et d'étiquetage pouvaient accéder au marché au moyen de lettres d'autorisation de mise en marché temporaire (LAMT). Les nouvelles exigences réglementaires dans le RAD établissent un cadre réglementaire souple axé sur les risques pour les AS.
Les AS qui satisfont aux exigences du Règlement modifiant le Règlement sur les aliments et drogues et le Règlement sur le cannabis (aliments supplémentés) (DORS/0169), ci-après appelé le Règlement sur les aliments supplémentés, et aux documents incorporés par renvoi, ainsi qu'à toutes les dispositions applicables du RAD, seront admissibles à un accès au marché sans qu'il soit nécessaire d'obtenir une autorisation préalable à la mise en marché de Santé Canada.
Le présent document a pour but de fournir aux intervenants des renseignements pour faciliter la compréhension du Règlement sur les aliments supplémentés. Il précise les catégories d'aliments qui peuvent être considérés comme des AS, les IS et leurs teneurs maximales autorisées pour l'ajout, ainsi que toutes les conditions d'utilisation connexes. Le document fournit également des détails sur les aliments qui ne sont pas acceptables en tant qu'AS, les ingrédients qui ne peuvent pas être ajoutés dans les AS, et sur l'établissement des exigences en matière de composition des AS.
En vertu des dispositions transitoires du Règlement sur les aliments supplémentés, les produits ayant une LAMT ou un avis écrit relativement à l'accès au marché pourront bénéficier d'une période de transition suivant l'entrée en vigueur du règlement. La transition permet aux fabricants ou aux distributeurs d'AS de continuer à avoir accès au marché et leur donne suffisamment de temps pour apporter les changements nécessaires afin de se conformer aux exigences du Règlement sur les aliments supplémentés. Santé Canada a continué d'accepter les demandes de LAMT pour de nouveaux AS reçues avant le 21 juillet, 2022, la date d'entrée en vigueur du Règlement sur les aliments supplémentés. Ces demandes font l'objet d'un examen et, si toutes les conditions énoncées dans les dispositions transitoires sont satisfaites, Santé Canada délivrera un avis écrit au demandeur pour la vente de leurs produits. Ces produits bénéficieront également d'une période de transition afin de se conformer au Règlement sur les aliments supplémentés pourvu qu'ils continuent de se conformer aux dispositions transitoires.
Les intervenants peuvent demander à Santé Canada d'effectuer une évaluation préalable à la mise en marché pour les aliments ou les ingrédients, qui ne satisfont pas aux exigences relatives aux conditions d'utilisation énoncées dans les documents incorporés par renvoi, afin de déterminer leur acceptabilité. Le présent document décrit quand cela est nécessaire et donne un aperçu du processus d'évaluation préalable à la mise en marché.
Ces lignes directrices donnent des précisions sur les exigences réglementaires qui s'appliquent aux aliments supplémentés dans le Règlement sur les aliments supplémentés.
1.0 Introduction
La Loi sur les aliments et drogues (LAD) et le Règlement sur les aliments et drogues (RAD) visent à protéger la santé et la sécurité des Canadiens en ce qui a trait à la salubrité des aliments et des médicaments sur le marché canadien.
1.1 Énoncés de politique
Le Règlement modifiant le Règlement sur les aliments et drogues et le Règlement sur le cannabis (aliments supplémentés) (DORS/2022-0169), ci-après appelé le Règlement sur les aliments supplémentés, établit en vertu de la LAD, a introduit dans le RAD un cadre réglementaire pour la vente d'aliments supplémentés (AS) au Canada. Ces dispositions permettent la vente d'AS sûrs au Canada et se veulent souples et adaptables à l'innovation et aux nouvelles données scientifiques.
1.2 Portée
Ces lignes directrices s'adressent aux intervenants, y compris les fabricants et les distributeurs d'aliments destinés à la vente au Canada afin de faciliter la compréhension du Règlement sur les aliments supplémentés, qui est entré en vigueur le 21 juillet 2022.
Le Règlement sur les aliments supplémentés devrait être lu conjointement avec d'autres dispositions du RAD qui s'appliquent aux produits préemballés ainsi que de la LAD et les documents incorporés par renvoi relatifs aux AS dans le RAD (Liste des ingrédients supplémentaires autorisés. Liste des catégoriesautorisées d'aliments supplémentés, Répertoire des modèles de tableaux des renseignements sur les aliments supplémentés et Répertoire des spécifications sur l'identifiant des aliments supplémentés avec mise en garde), énumérés à l'annexe 1. Pour tenir compte des nouvelles exigences spécifiques aux AS énoncées dans le RAD, certaines modifications corrélatives ont dû être apportées aux dispositions existantes du RAD (par exemple, étendre les dispositions en matière d'étiquetage de la partie B de la division 1 qui s'appliquent au tableau de la valeur nutritive pour inclure le tableau des renseignements sur les aliments supplémentés). Le présent document ne donne pas de précisions sur ces modifications corrélatives. La page Web Aliments supplémentés de Santé Canada comprend des renseignements et des ressources liés aux exigences pour ces aliments.
Il incombe aux fabricants et aux distributeurs de se conformer à toutes les exigences législatives et réglementaires applicables. En cas de divergence entre les lignes directrices et les dispositions du RAD ou des documents incorporés par renvoi, le règlement et les documents incorporés par renvoi ont préséance.
Dans le présent document, le terme « doit » est utilisé pour exprimer une exigence, c'est-à-dire une disposition du RAD que le fabricant ou le distributeur est tenu de satisfaire; « devrait » est utilisé pour exprimer une recommandation ou ce qui est conseillé, mais non requis; et « peut » est utilisé pour exprimer une option ou ce qui est permis selon les limites du présent document.
1.3 Contexte
Le Règlement sur les aliments supplémentés publié dans la Partie II de la Gazette du Canada, le 20 juillet 2022, modifie le RAD afin de permettre la vente de certains aliments dans lesquelles ont été ajoutés des vitamines, des minéraux nutritifs, des acides aminés ou d'autres substances qui n'étaient pas autorisés par les dispositions existantes.
Auparavant, un certain nombre de produits sous forme d'aliments contenant des vitamines, des minéraux nutritifs, des acides aminés et d'autres substances qui n'étaient pas conformes au RAD ont été mis sur le marché en tant que produits de santé naturels (PSN) en vertu du Règlement sur les produits de santé naturels (RPSN). En tant que PSN, ces produits ont individuellement fait l'objet d'une évaluation préalable à la mise en marché et d'une licence. Toutefois, Santé Canada a déterminé, en se fondant sur la perception du public, les antécédents d'utilisation, la présentation des produits auprès des consommateurs et le format du produit, que bon nombre de ces produits correspondent à la définition d'un aliment, conformément au document Ligne directrice : Classification des produits situés à la frontière entre les aliments et les produits de santé naturels : produits sous forme d'aliments. En octobre 2011, la ministre de la Santé a annoncé son intention de réglementer les boissons énergisantes contenant de la caféine (BEC), qui étaient autrefois des PSN, en tant qu'aliments. En avril 2012, il a été annoncé aux intervenants que d'autres PSN qui correspondent à la définition d'un aliment seraient également réglementés à titre d'aliments.
Étant donné que ces produits n'étaient pas conformes au RAD en tant qu'aliments, des lettres d'autorisation de mise en marché temporaire (LAMT) ont été délivrées conformément à l'article B.01.054 du RAD, à titre de mesure provisoire afin de permettre la vente de produits jugés sécuritaires tout en comblant les lacunes en matière de données nécessaires pour appuyer l'élaboration Règlement sur les aliments supplémentés. Les produits ont fait l'objet d'un examen au cas par cas et ont reçu des LAMT sous certaines conditions et selon une composition de produits déterminée relative aux ingrédients supplémentaires (IS) et en fonction des exigences en matière d'étiquetage. Dans le cadre des conditions relatives aux LAMT, les fabricants ou les distributeurs étaient tenus de fournir à Santé Canada des rapports de recherche, des données annuelles sur les ventes et, le cas échéant, des rapports annuels d'incidents liés à la consommation de leurs AS pendant qu'ils demeuraient sur le marché. Ces données, ainsi que la documentation scientifique et d'autres renseignements dont dispose Santé Canada, ont servi à établir les modifications réglementaires au RAD en ce qui a trait aux AS. Le 26 juin 2021, Santé Canada a prépublié le Règlement sur les aliments supplémentés dans la Partie I de la Gazette du Canada pour consultation publique et pour obtenir des commentaires des intervenants et des Canadiens intéressés jusqu'au 24 septembre 2021. Santé Canada a examiné et analysé les commentaires reçus au cours de la période de consultation et a apporté des modifications, qui étaient étayées par des éléments de preuve, avant de finaliser le règlement.
2.0 Transition des produits au Règlement sur les aliments supplémentés
Avant la publication du Règlement sur les aliments supplémentés, les AS pouvaient avoir accès au marché si les fabricants ou les distributeurs avaient reçu une LAMT pour leurs produits. Les LAMT contiennent des conditions strictes en matière de composition et d'étiquetage que doivent respecter leurs produits alors qu'ils sont sur le marché canadien, selon les critères énoncés dans le Document d'orientation particulier à une catégorie - Autorisation de mise en marché temporaire : Aliments supplémentés, ou le Document d'orientation particulier à une catégorie - Autorisation de mise en marché temporaire - Boissons énergisantes contenant de la caféine, le cas échéant.
Avec l'entrée en vigueur du Règlement sur les aliments supplémentés, les LAMT émis pour les AS ne sont plus valides. Toutefois, les fabricants ou les distributeurs d'AS qui détenaient une LAMT valide pour leurs produits à l'entrée en vigueur du règlement ont jusqu'au 31 décembre 2025 pour se conformer au Règlement sur les aliments supplémentés, sous réserve des conditions applicables des dispositions transitoires. La même période de transition est fournie aux fabricants ou aux distributeurs d'aliments qui ont présenté une demande de LAMT avant l'entrée en vigueur et qui ont reçu un avis écrit du ministre autorisant la vente de l'aliment. Cette date est conforme à l'énoncé de politique conjointe de Santé Canada et de l'Agence canadienne d'inspection des aliments (ACIA) sur la Coordination de l'étiquetage des aliments. La période de transition permet aux fabricants ou aux distributeurs d'AS de continuer à avoir accès au marché et leur donne suffisamment de temps pour apporter les changements nécessaires afin de se conformer aux exigences du Règlement sur les aliments supplémentés.
Les sections ci-dessous fournissent des renseignements supplémentaires sur les dispositions transitoires applicables aux produits existants ayant une LAMT qui a expiré le 21 juillet 2022 et aux produits pour lesquels une demande de LAMT a été soumise avant l'entrée en vigueur du présent règlement.
2.1 Aliments supplémentés ayant des lettres d'autorisation de mise en marché temporaire
Les AS ayant des LAMT valides avant l'entrée en vigueur du Règlement sur les aliments supplémentés sont énumérés au tableau 1 - Listes des aliments supplémentés ayant reçu des lettres d'autorisation de mise en marché temporaire qui ont expiré le 21 juillet 2022 - du document Listes des aliments ayant reçu des lettres d'autorisation de mise en marché temporaire. Les produits énumérés au tableau 1 sont classés par catégorie pour refléter les critères de classification du document Ligne directrice : Classification des produits situés à la frontière entre les aliments et les produits de santé naturels : les produits sous forme d'aliments, qui ont été utilisés pendant la transition des produits du cadre des PSN vers le cadre des aliments.
Les fabricants ou les distributeurs de ces AS sont autorisés à continuer de vendre leurs produits au Canada et ont jusqu'au 31 décembre 2025 pour faire la transition de leurs produits afin de se conformer au Règlement sur les aliments supplémentés. Les dispositions transitoires établissent les conditions spécifiques déjà énoncées dans la LAMT qui s'appliquent aux fabricants ou aux distributeurs pendant la transition. Sous réserve de la modification de l'article 35 des dispositions transitoires, toutes les conditions qui s'appliquent doivent être respectées pendant la durée de la période de transition ou jusqu'à ce que les fabricants ou les distributeurs apportent des modifications afin de se conformer au règlement. Une autre raison qui peut disqualifier un fabricant ou un distributeur est si le ministre les avise que la consommation de leur produit n'est pas sécuritaire.
Les produits autorisés qui relèvent des dispositions transitoires doivent satisfaire à toutes les dispositions applicables du RAD dans leur version antérieure à l'entrée en vigueur du Règlement sur les aliments supplémentés, à l'exception des variations par rapport à certaines exigences du RAD autorisées par la LAMT, ainsi que certaines exigences qui ont été modifiées par le Règlement modifiant le Règlement sur les aliments et drogues (étiquetage nutritionnel, autres dispositions d'étiquetage et colorants alimentaires) DORS/2016-305. Toutes les exemptions du RAD précisées dans la LAMT demeureront valides tout au long de la période de transition (consulter la section 2.3).
Les tableaux 3 et 4 du document Listes des aliments ayant reçu des lettres d'autorisation de mise en marché temporaire comprennent les produits autres que les AS qui ont reçu des LAMT. Ces produits sont considérés comme n'étant pas visés par le Règlement sur les aliments supplémentés et continuent d'être assujettis aux conditions et aux exigences de leurs LAMT.
2.2 Demande de lettre d'autorisation de mise en marché temporaire présentée avant l'entrée en vigueur du Règlement sur les aliments supplémentés
Santé Canada a continué d'accepter les demandes de LAMT pour les nouveaux AS jusqu' au 20 juillet 2022. Les fabricants ou les distributeurs ont demandé des LAMT pour leurs produits conformément aux critères du Document d'orientation - Autorisation de mise en marché temporaire : Aliments supplémentés ou du Document d'orientation particulier à une catégorie - Autorisation de mise en marché temporaire - Boissons énergisantes contenant de la caféine, selon le cas.
Conformément aux exigences des dispositions transitoires, Santé Canada examine les demandes de LAMT qui ont été soumises avant le 21 juillet 2022. Les fabricants et les distributeurs recevront un avis écrit les autorisant à vendre les produits qui répondent aux conditions énoncées dans les dispositions transitoires, y compris celles du document Seuils maximaux relatifs aux mises en garde et autres conditions d'utilisation, qui est incorporé par renvoi dans les dispositions transitoires du règlement. L'avis écrit contient les détails liés aux conditions qui s'appliquent aux produits figurant dans la demande. Sous réserve de la modification de l'article 35 (tel qu'il est indiqué à la section 2.1) et toutes les conditions applicables aux dispositions transitoires, ils ont jusqu'au 31 décembre 2025 pour se conformer au Règlement sur les aliments supplémentés ou jusqu'à ce qu'ils apportent des modifications pour se conformer aux nouvelles exigences.
2.3 Exigences relatives aux aliments supplémentés pendant la période de transition
Les fabricants et les distributeurs d'AS qui sont assujettis aux dispositions transitoires conformément aux sections 2.1 et 2.2 doivent satisfaire à toutes les exigences applicables en matière de composition, d'étiquetage et d'allégations pour leurs produits. Celles-ci comprennent les exigences applicables du RAD et celles contenues dans les dispositions transitoires.
Pendant la période de transition, les fabricants et les distributeurs d'AS qui relèvent de la disposition transitoire conformément aux sections 2.1 et 2.2 :
- doivent respecter toutes les conditions indiquées en détail dans les dispositions transitoires, y compris à toutes les conditions d'utilisation, telles que les exigences d'étiquetage, et toutes les mises en garde applicables pour leurs produits;
- pour les AS dont les LAMT ont expiré le 21 juillet 2022, cela comprend les conditions précises des dispositions transitoires qui s'appliquent à ceux-ci, et qui étaient précédemment dans leur LAMT;
- pour les AS assujettis à un avis écrit, cela comprend toutes les conditions applicables des dispositions transitoires, y compris celles qui sont précisées dans le document Seuils maximaux relatifs aux mises en garde et autres conditions d'utilisation;
- ne doivent pas modifier les IS contenus dans leurs produits;
- sont autorisés à se conformer à certaines dispositions du RAD qui ont été modifiées par la réglementation sur l'étiquetage nutritionnel de 2016 telles qu'elles étaient le 13 décembre 2016. Il s'agit de s'assurer que les AS ayant une version plus ancienne du tableau de la valeur nutritive (TVN) et de la liste des ingrédients n'ont pas à modifier l'étiquette avant la transition au Règlement sur les aliments supplémentés;
- sont autorisés à continuer à se prévaloir des exemptions prévues dans la LAMT expirée ou dans le cadre des dispositions transitoires.
Les fabricants ou les distributeurs peuvent choisir de se conformer pleinement aux exigences du Règlement sur les aliments supplémentés à tout moment avant la fin de la période de transition. Toutefois, la modification d'un produit, y compris de son étiquette, en vue de se conformer partiellement aux exigences entraînerait la perte de la période de transition, ce qui fait que l'aliment serait considéré comme non conforme.
Certaines des conditions des LAMT pour les AS ne s'appliquent plus. Les dispositions transitoires du Règlement sur les aliments supplémentés précisent les conditions qui s'appliquent toujours. L'exigence de fournir des données sur les ventes, des rapports d'incidents liés à la consommation des produits avec des mises en garde, ainsi que des données de recherche sur les habitudes de consommation des Canadiens et leur compréhension des renseignements sur l'étiquette de l'AS visait à informer l'élaboration du cadre réglementaire. Avec la publication du Règlement sur les aliments supplémentés, ces données ne sont plus requises et, par conséquent, cette condition de la LAMT n'a pas été incluse dans le cadre des dispositions transitoires.
2.4 Modification apportée aux produits pendant la période de transition
Les fabricants et les distributeurs de produits qui relèvent des dispositions transitoires doivent satisfaire aux conditions de la transition, telles qu'elles sont décrites dans leur LAMT expirée ou avis écrit, pendant la période de transition. Cela signifie que toute modification de la taille du contenant ou des IS dans la formulation du produit, c'est-à-dire l'ajout d'un nouvel IS, ou l'élimination ou la modification du niveau d'un IS, entraînerait la perte de la période de transition pour ce produit. Dans de tels cas, le fabricant ou le distributeur doit se conformer pleinement à toutes les exigences du Règlement sur les aliments supplémentés, qui comprend la Liste des catégories autorisées d'aliments supplémentés et la Liste des ingrédients supplémentaires autorisés. Toutefois, les modifications relatives à d'autres ingrédients qui n'étaient pas incluses dans l'autorisation du produit, et telles qu'elles ont été autorisées par les dispositions transitoires (c.-à-d. les ingrédients alimentaires autorisés à être ajoutés à l'aliment conformément à la LAD et au RAD dans leurs versions avant l'entrée en vigueur du Règlement sur les aliments supplémentés) sont autorisées pendant la période de transition. Par exemple, la substitution d'un additif alimentaire approuvé par un autre additif alimentaire approuvé dans des produits qui sont assujettis à une LAMT expirée ou avis écrit serait autorisée pendant la période de transition.
Les fabricants ou les distributeurs qui apportent d'autres modifications à l'étiquette de leurs produits, comme un changement de nom de marque ou de saveur, n'entraîneraient probablement pas une perte de la période de transition. Toutefois, ils sont invités à communiquer avec Santé Canada pour discuter des modifications afin de s'assurer que la base de données de Santé Canada sur ces produits, utilisée par l'ACIA, reflète ces modifications. Cela permettra de s'assurer que les produits qui sont autorisés pendant la période de transition sont identifiables et ne sont pas assujettis à l'application de la loi par l'ACIA pour non-conformité au Règlement sur les aliments supplémentés.
2.5 Produits commercialisés après l'entrée en vigueur du Règlement sur les aliments supplémentés
Tous les nouveaux AS, autres que ceux décrits aux sections 2.1 et 2.2, qui entreront sur le marché au Canada, devront se conformer immédiatement au Règlement sur les aliments supplémentés. Cela signifie que les fabricants ou les distributeurs n'auront pas besoin d'une LAMT pour les nouveaux produits qui répondent à toutes les exigences réglementaires (c.-à-d. qu'ils appartiennent à une catégorie d'aliments autorisés, qu'ils contiennent un IS autorisé, qu'ils satisfont à toutes les conditions applicables aux IS ajoutés et qu'ils répondent à toutes les exigences applicables du Règlement sur les aliments supplémentés et au RAD). Ces produits peuvent être mis immédiatement sur le marché et ne nécessitent pas de période de transition, car ils doivent déjà être conformes au Règlement sur les aliments supplémentés.
3.0 Directives pour la mise en œuvre du Règlement sur les aliments supplémentés
3.1 Aliments réglementés en vertu du Règlement sur les aliments supplémentés
Les produits auxquels ont été ajoutés des vitamines, des minéraux, des acides aminés et d'autres substances peuvent être soumis à des exigences réglementaires différentes (voir Tableau 1).
L'ajout de vitamines, de minéraux nutritifs et d'acides aminés aux produits préemballés est soumis à des dispositions et à des interdictions précises du RAD. Pour certains aliments, l'intention sous-jacente à l'addition d'une vitamine, d'un minéral nutritif ou d'un acide aminé est l'enrichissement. Avec l'enrichissement, des éléments nutritifs précis doivent ou peuvent être ajoutés aux aliments pour atteindre un but nutritionnel (par exemple, prévenir les carences nutritionnelles dans la population ou rétablir ou améliorer la qualité nutritionnelle des aliments). L'ajout d'éléments nutritifs peut être obligatoire, par exemple, l'ajout de vitamine D au lait pour aider à prévenir la carence en vitamine D, pouvant mener au rachitisme chez les enfants et à l'ostéomalacie (ramollissement des os) chez les adultes; ou volontaire, par exemple, l'ajout de thiamine, de niacine, de vitamine B6, d'acide folique, d'acide pantothénique, de magnésium, de fer et de zinc aux céréales à déjeuner.
Le Règlement sur les aliments supplémentés permet également l'ajout de vitamines, de minéraux nutritifs, d'acides aminés et d'autres substances spécifiques aux produits préemballés; toutefois, l'ajout n'est pas destiné à satisfaire un usage nutritionnel mentionné à la section 3.2 a). Les AS contiennent des IS qui peuvent présenter un risque pour la santé s'ils sont consommés en excès par la population générale ou par des populations vulnérables comme les enfants ou les femmes enceintes ou qui allaitent. Le Règlement sur les aliments supplémentés énonce des règles spécifiques pour les AS en ce qui concerne les catégories d'aliments, la composition, l'étiquetage et les déclarations.
L'annexe 2 - Mon produit correspond-il à un aliment supplémenté? fournit aux intervenants un diagramme simplifié pour les aider à déterminer si le Règlement sur les aliments supplémentés s'applique à leur produit.
Certains produits préemballés contenant des vitamines, des minéraux nutritifs, des acides aminés ou d'autres ingrédients peuvent présenter des caractéristiques communes à la fois des aliments et des PSN. Pour ces produits, le cadre réglementaire approprié peut ne pas sembler évident à première vue. Les PSN sont assujettis au RPSN et ne sont pas considérés comme des aliments. Pour aider les fabricants ou les distributeurs à classer leurs produits, Santé Canada a publié le document Ligne directrice : Classification des produits situés à la frontière entre les aliments et les produits de santé naturels : produits sous forme d'aliments. Les fabricants ou les distributeurs devraient consulter le document d'orientation sur la classification s'il y a incertitude quant à savoir si leur produit est considéré comme un aliment ou un PSN. De plus, une demande de détermination de la classification peut être adressée à la Direction des aliments en envoyant un courriel à l'Unité de la gestion des demandes et de l'information (UGDI) à l'adresse smiu-ugdi@hc-sc.gc.ca, en inscrivant le mot « classification » dans la ligne d'objet.
| Aliments conventionnelsNote de bas de page 1 | Aliments enrichisNote de bas de page 2 | Aliments supplémentés | Produits de santé naturels | |
|---|---|---|---|---|
| Description | Produits sous forme d'aliments pouvant être consommés à volonté (c.-à-d. ad libitum) et ne contenant pas de vitamines, de minéraux nutritifs ou d'acides aminés ajoutés. | Produits sous forme d'aliments qui doivent contenir ou sont autorisés à contenir des vitamines, des minéraux nutritifs et des acides aminés ajoutés à des fins nutritionnelles (p. ex. récupérer les nutriments perdus pendant la transformation ou empêcher ou corriger une carence dans la population). | Produits sous forme d'aliments qui sont autorisés à contenir des vitamines, des minéraux nutritifs, des acides aminés ou d'autres ingrédients ajoutés pour des raisons autres qu'à des fins nutritionnelles (c.-à-d. à des fins d'enrichissement). Les AS ont des conditions d'utilisation (p. ex. étiquette avec mises en garde). Ces produits peuvent ne pas convenir à la consommation ad libitum ou aux populations vulnérables, comme les enfants, les femmes enceintes ou qui allaitent. | Produits en formats posologiques qui ne sont pas typiques des aliments (p. ex. capsules, comprimés, poudres, teintures), qui sont susceptibles d'être considérés comme des PSN. Ces produits sont assujettis à des limites de consommation, peuvent ne pas convenir à la population en général et peuvent porter une étiquette avec mises en garde. |
| Exemples | Fromage, vinaigre, huiles de cuisson | Farine blanche, lait, céréales à déjeuner | Boissons ou barres auxquelles on a ajouté des vitamines et des minéraux nutritifs | Comprimés de multivitamines |
| Cadre réglementaire applicable | Ils doivent respecter toutes les dispositions applicables du RAD. | Ils doivent respecter toutes les dispositions applicables du RAD, y compris celles de la partie D. L'article D.03.002 du RAD fournit une liste des aliments autorisés à contenir des vitamines, des minéraux nutritifs et des acides aminés ajoutés. | Ils doivent respecter toutes les dispositions applicables du RAD, y compris celles figurant au titre 29 de la partie B. | Le RAD ne s'applique pas, car ces produits ne sont pas considérés comme des aliments; ils doivent respecter toutes les dispositions applicables du RPSN. |
3.2 Aliments exclus du Règlement sur les aliments supplémentés
Tous les AS doivent satisfaire à la définition de produits préemballés définis au paragraphe B.01.001(1) du RAD; toutefois, tous les produits préemballés ne sont pas des AS. Un nombre limité de catégories d'aliments sont admissibles à titre d'AS, conformément à la Liste des catégories autorisées d'aliments supplémentés. De plus amples renseignements sur les catégories d'aliments qui sont autorisées à titre d'AS sont fournis à la section 4.1 du présent document. En outre, les aliments suivants ne sont pas admissibles en tant qu'AS parce qu'ils sont assujettis à d'autres dispositions du RAD ou parce qu'ils présentent un niveau de risque plus élevé pour les consommateurs s'ils sont supplémentés, comme les aliments destinés à certaines populations vulnérables (p. ex. les jeunes enfants) :
- a) Aliments pour lesquels l'ajout de nutriments est requis ou autorisé à des fins d'enrichissement
L'ajout de vitamines, de minéraux nutritifs et d'acides aminés est requis ou permis dans le RAD pour certains aliments afin d'atteindre les objectifs suivants :
- récupérer les nutriments perdus pendant la transformation, l'entreposage ou la manipulation;
- rendre un aliment de substitution équivalent sur le plan nutritionnel à l'aliment qu'il est destiné à remplacer;
- en réponse à un besoin en santé publique, lorsqu'un risque de carence a été déterminé;
- assurer la composition en éléments nutritifs appropriée des aliments destinés à un usage diététique spécial (p. ex. les substituts de repas et les suppléments nutritionnels).
Le tableau de l'article D.03.002 du RAD contient une liste des aliments qui doivent contenir ou qui sont autorisés à contenir des vitamines, des minéraux nutritifs et des acides aminés ajoutés. Étant donné que les dispositions relatives à l'enrichissement existent déjà dans l'ensemble des parties B et D du RAD et que l'ajout de nutriments est fondé sur des objectifs nutritionnels, ces aliments ne sont pas admissibles en tant qu'AS, sous réserve des exceptions décrites ci-dessous. Toutefois, le Règlement sur les aliments supplémentés ne restreint pas l'utilisation d'aliments enrichis en tant qu'ingrédients dans la fabrication d'AS (par exemple, l'utilisation de jus enrichis dans la fabrication d'un AS est autorisée).
Exceptions :
Certains aliments pour lesquels l'ajout de nutriments à des fins d'enrichissement est requis ou permis peuvent également être admissibles en tant qu'AS et seraient admissibles sous réserve des conditions d'utilisation qui s'appliquent à tous les AS. Les aliments visés aux articles 2 et 14 du tableau de l'article D.03.002 du RAD sont destinés en tant qu'AS, ils ne doivent pas être représentés et formulés en fonction des dispositions en matière d'enrichissement qui s'appliquent, c.-à-d. les produits ne peuvent être des AS et des aliments enrichis en même temps.
Pour l'article 26 du tableau de l'article D.03.002 du RAD, l'ajout de fluor est autorisé à des fins d'enrichissement pour l'eau minérale, l'eau de source, et l'eau en contenants scellée. Comme le fluor n'est pas un IS autorisé, ces aliments peuvent être formulés et représentés à la fois conformément aux dispositions du Règlement sur les aliments supplémentés ainsi qu'à d'autres dispositions sur l'enrichissement applicables.
De plus, Santé Canada a déjà émis des autorisations de mise en marché provisoire (AMP) pour les aliments afin de répondre à d'importants besoins en santé publique. Cela comprend l'ajout de calcium, avec ou sans vitamine D, au jus d'orange et au jus d'orange et de mandarine vendus en tant que tel, sous forme liquide, concentrée ou reconstituée. Bien que les périodes d'autorisation de mise en marché provisoire aient expiré, Santé Canada a adopté une Politique temporaire sur l'utilisation des autorisations de mise en marché provisoires périmées relatives à l'enrichissement des aliments. Si ces produits sont destinés à être des AS, ils doivent satisfaire aux exigences du Règlement sur les aliments supplémentés et ne doivent pas être représentés et formulés conformément aux conditions de l'AMP expirée, c.-à-d. le produit ne peut pas être à la fois un AS et un aliment enrichi.
- b) Aliments à usage diététique spécial
Les aliments à usage diététique spécial sont spécialement transformés ou formulés pour satisfaire les besoins alimentaires particuliers d'une personne manifestant un état physique ou physiologique particulier à la suite d'une maladie, d'une blessure ou d'un désordre fonctionnel, ou chez qui l'on cherche à obtenir un résultat particulier, y compris, sans s'y limiter, une perte de poids, grâce au contrôle de sa ration alimentaire. Le titre 24 de la partie B du RAD énonce les exigences relatives à la composition, à l'étiquetage et à la mise en marché applicables pour les aliments à usage diététique spécial. Par conséquent, les aliments assujettis aux exigences du titre 24 ne peuvent pas être des AS.
Exception :
Les aliments sans gluten sont une catégorie d'aliments du titre 24 de la partie B du RAD qui n'est pas assujettie à des exigences particulières en matière de composition ou d'étiquetage (mis à part ne pas contenir de protéine de gluten). Les produits sans gluten qui satisfont à toutes les exigences du Règlement sur les aliments supplémentés peuvent être des AS. Toutefois, un aliment qui est à la fois un aliment sans gluten et un aliment à usage diététique spécial visé dans l'un des alinéas B.24.003(1)f) à f.2) et h) à j) du RAD n'est pas autorisé à être un AS. De plus, bien que l'article D.03.003 du RAD permet l'enrichissement d'aliments sans gluten, les aliments sans gluten enrichis ne peuvent pas être des AS.
- c) Aliments pour bébés et aliments destinés aux enfants de moins de 4 ans, aux femmes enceintes ou qui allaitent
Les aliments pour bébés sont réglementés en vertu du titre 25 du RAD, qui précise les exigences en matière de composition et d'étiquetage. Ces aliments ne sont pas admissibles en tant qu'AS.
Les jeunes enfants de 1 à 3 ans connaissent une croissance plus rapide que les enfants plus âgés, ce qui les rend plus vulnérables aux déséquilibres en nutriments. Pour cette raison, les aliments destinés aux enfants de moins de 4 ans ne sont pas autorisés à être considérés comme des AS.
Les femmes enceintes et les femmes qui allaitent constituent un groupe se trouvant à une étape de la vie particulièrement vulnérable. Plusieurs IS n'ont jamais été évalués quant à leur innocuité en tant qu'ingrédients alimentaires chez les femmes enceintes ou qui allaitent et ne sont pas autorisés pour une telle utilisation. Par conséquent, les aliments étiquetés ou annoncés à des fins de consommation auprès de ces populations ne sont pas autorisés à être considérés comme des AS.
- d) Aliments préemballés non transformés ou peu transformés
Les aliments qui n'ont pas été transformés ou les aliments qui ont été transformés de façon minimale ne sont pas autorisés à être considérés comme des AS. Les aliments qui ont été transformés de façon minimale comprennent les fruits et légumes crus qui ont été pelés, tranchés, hachés ou râpés avant d'être emballés pour la vente. Les aliments préemballés figurant dans la liste ci-dessous ne sont pas autorisés à être considérés comme des AS :
- de la viande, un sous-produit de viande, de la viande de volaille ou un sous-produit de viande de volaille, cru et composé d'un seul ingrédient;
- produits d'animaux marins ou d'animaux d'eau douce crus et composés d'un seul ingrédient;
- fruits ou légumes frais, congelés, en conserve ou séchés, entiers ou coupés;
- des noix, des céréales, des légumineuses et des graines;
- des œufs entiers, y compris les œufs liquides, congelés ou séchés (y compris les œufs cuits) ou les mélanges d'œufs entiers.
- e) Boissons alcooliques
Les boissons alcoolisées dont la teneur en alcool est supérieure à 0,5 % ne sont pas autorisées à être considérées comme des AS. Les fabricants ou les distributeurs d'AS doivent s'assurer que la teneur en alcool de leur produit ne dépasse pas 0,5 % pendant la durée de conservation du produit.
- f) Aliments spéciaux
Un aliment spécial est défini au paragraphe B.01.012(1) du RAD et désigne un aliment qui a une signification religieuse particulière et qui est utilisé dans des cérémonies religieuses; ou est un aliment importé qui n'est pas largement utilisé par l'ensemble de la population canadienne et pour lequel aucun substitut n'est facilement disponible au Canada. Un aliment ne répondra plus à la définition d'aliments spéciaux s'il satisfait aux exigences du Règlement sur les aliments supplémentés. Pour de plus amples renseignements sur les aliments spéciaux, veuillez consulter le site Web de l'ACIA sur l'étiquetage bilingue des aliments.
- g) Aliments nouveaux
Un aliment nouveau est défini au titre 28 de la partie B du RAD comme suit :
- substance, y compris un micro-organisme, qui ne présente pas d'antécédents d'innocuité comme aliment;
- aliment qui a été fabriqué, préparé, conservé ou emballé au moyen d'un procédé qui :
- (i) n'a pas été appliqué auparavant à l'aliment,
- (ii) fait subir à l'aliment un changement majeur;
- aliment dérivé d'un végétal, d'un animal ou d'un micro-organisme qui, ayant été modifié génétiquement, selon le cas :
- (i) présente des caractères qui n'avaient pas été observés auparavant,
- (ii) ne présente plus des caractères qui avaient été observés auparavant,
- (iii) présente un ou plusieurs caractères qui ne se trouvent plus dans les limites prévues pour ce végétal, cet animal ou ce micro-organisme.
Les aliments nouveaux sont réglementés en vertu du titre 28 de la partie B du RAD et doivent ainsi faire l'objet d'une évaluation préalable à la mise en marché avant d'être autorisés pour la vente au Canada. Si l'évaluation préalable à la mise en marché conclut que les aliments sont sécuritaires, les aliments nouveaux reçoivent une lettre de non-objection, et dans ce cas, ils peuvent être utilisés comme ingrédients dans les aliments, y compris les AS. Les autorisations d'aliments nouveaux sont fournies sans condition d'utilisation, de sorte que les données doivent démontrer la sécurité pour une utilisation générale comme aliment. Pour de plus amples renseignements, veuillez vous référer au site Web sur les aliments nouveaux. Veuillez consulter la section 4.2.14.3 pour obtenir des renseignements sur la détermination d'un aliment nouveau, et la section 6.1 pour des considérations sur les modalités concernant les demandes préalables à la mise en marché des ingrédients à ajouter aux AS en tant qu'IS.
4.0 Exigences relatives à la conformité au Règlement sur les aliments supplémentés
Comme pour tout aliment, il incombe au fabricant ou au distributeur de s'assurer qu'un aliment proposé à la vente au Canada est conforme à toutes les dispositions législatives et réglementaires applicables, y compris, sans toutefois s'y limiter, aux exigences de la LAD et de la Loi sur la salubrité des aliments au Canada (LSAC), ainsi qu'aux règlements associés à ces lois. Cela comprend, par exemple, de veiller au respect des exigences en matière d'étiquetage des aliments, les dispositions relatives à l'utilisation d'additifs alimentaires et les interdictions énoncées à l'article 4 de la LAD, lequel interdit la vente d'un aliment contenant une substance toxique ou nocive. Les parties 1 et 2 de la Liste des contaminants et des autres substances adultérantes dans les aliments, incorporées par renvoi au titre 15 de la partie B du RAD, énoncent les substances et les contaminants qui sont interdits dans les aliments, ou les teneurs maximales pour ces substances ou contaminants. Les concentrations maximales pour certains contaminants dans les aliments sont également indiquées dans la Liste des concentrations maximales établies à l'égard de divers contaminants chimiques dans les aliments, qui est tenue à jour sur le site Web de Santé Canada. L'annexe 3 comprend une liste d'ingrédients additionnels qui sont jugés inappropriés en vue de leur ajout aux aliments, y compris aux AS.
L'ajout d'un IS à un AS n'est pas considéré comme un ajout de substance toxique ou nocive ou une falsification de l'aliment, contrairement à l'article 4 de la LAD, si l'ingrédient en question est ajouté selon ses conditions d'utilisation particulières. Toutefois, un produit préemballé, autre qu'un AS, est falsifié si une substance figurant à la colonne 1 de la Liste des ingrédients supplémentaires autorisés y a été ajoutée, autrement qu'en conformité avec le RAD (p. ex. à des fins d'additif alimentaire approuvé). De plus, un AS ne peut être ajouté comme ingrédient à un autre produit préemballé que si ce produit est également un AS qui satisfait au Règlement sur les aliments supplémentés.
Les AS doivent également respecter toutes les exigences du Règlement sur les aliments supplémentés relatives aux catégories d'aliments qui sont autorisées à titre d'AS (section 4.1), aux IS et à leurs conditions d'utilisation (section 4.2), à l'étiquetage (section 4.3) et aux déclarations (section 4.4).
4.1 Catégories autorisées d'aliments en vertu du Règlement sur les aliments supplémentés
Seuls les aliments appartenant à des catégories d'aliments figurant dans la Liste des catégories autorisées d'aliments supplémentés peuvent être des AS.
Le Tableau 2 ci-dessous fournit une description des catégories d'aliments décrites dans la Liste des catégories autorisées d'aliments supplémentés. Il incombe au fabricant ou au distributeur de s'assurer que son produit satisfait aux exigences de la Liste et aux critères de chaque catégorie décrite ci-dessous. Les descriptions du Tableau 2 donnent un aperçu du type d'aliments qui appartient à chaque catégorie autorisée et donnent un aperçu des exclusions d'aliments qui n'entrent pas dans le champ d'application de chaque catégorie. Les fabricants ou les distributeurs sont invités à communiquer avec l'UGDI de la Direction des aliments (smiu-ugdi@hc-sc.gc.ca) pour savoir si leur produit entre dans le champ d'application d'une catégorie de la Liste des catégories autorisées d'aliments supplémentés.
Un produit ne peut être un aliment supplémenté s'il n'appartient pas à une catégorie autorisée d'aliments. Afin de commercialiser un produit appartenant à une catégorie d'aliments qui ne fait pas partie de la Liste des catégories autorisées d'aliments supplémentés, veuillez consulter la section 6.0 pour obtenir des renseignements sur le processus de modification de la Liste.
4.1.1 Description des catégories d'aliments de la Liste des catégories autorisées d'aliments supplémentés
Un certain nombre d'aliments abordés dans le RAD doivent respecter des normes de composition et d'identité prescrites. Les aliments faisant l'objet de normes prescrites liées à la composition et à l'identité doivent respecter tous les aspects des spécifications de ces normes. Il n'existe pas de normes d'identité ou de composition pour les AS; par conséquent, tout AS qui pourrait être confondu avec un aliment normalisé doit être étiqueté de manière à indiquer clairement en quoi il diffère de l'aliment normalisé en utilisant un nom usuel modifié. Les noms des catégories d'aliments figurant dans la Liste des catégories autorisées d'aliments supplémentés ne sont pas considérés comme des noms usuels. Pour obtenir des renseignements sur les noms usuels, veuillez consulter la section 4.3.6. De plus, les aliments visés à la section 3.2 ne peuvent pas être considérés comme des AS à moins d'une exception explicite.
Les produits appartenant aux catégories du Tableau 2 peuvent partager des caractéristiques avec les aliments et les produits de santé naturels. Les fabricants ou les distributeurs sont invités à consulter le document Ligne directrice : Classification des produits situés à la frontière entre les aliments et les produits de santé naturels: produits sous forme d'aliments pour déterminer si leur produit est un aliment ou un produit de santé naturel ou demander une détermination de la classification conformément à la section 3.1.
Certaines catégories d'aliments, telles qu'elles figurent dans la Liste des catégories autorisées d'aliments supplémentés, comprennent les concentrés et les mélanges à reconstituer sous forme de boissons. Les AS appartenant à ces catégories d'aliments doivent satisfaire aux exigences de leur catégorie respective et de la Liste des ingrédients supplémentaires autorisés tels qu'ils sont consommés. Comme les AS sont assujettis à des exigences d'étiquetage particulières, les confiseries à une bouchée préemballés vendues individuellement sont exclus des catégories autorisées de la Liste, puisqu'elles sont exemptées des exigences d'étiquetage énoncées dans le RAD et dans le Règlement sur la salubrité des aliments au Canada (RSAC). Des renseignements supplémentaires sur les confiseries à une bouchée sont disponibles sur la page Web de l'ACIA.
| Numéro de l'article | Catégories d'aliments | Description |
|---|---|---|
| (1) | Boissons à base d'eau gazéifiées ou non gazéifiéesNote de bas de page 1 | Boissons prêtes à boire à base d'eau gazéifiée ou non gazéifiée, y compris leurs concentrés et leurs mélanges à reconstituer sous forme de boissons. Les boissons telles que consommées doivent être à base d'eau, c'est-à-dire que l'eau doit constituer plus de 50 % de la boisson. Les produits sous forme de mélanges secs doivent être emballés de manière à permettre des portions contrôlées. Par souci de clarté, cette catégorie englobe également les types de produits suivants :
Exclusions :
|
| (2) | Boissons aux fruits (à base de concentré de fruits), boissons aux légumes (à base de concentré de légumes), boissons aux fruits et aux légumes (à base de concentrés de fruits et de légumes), nectars de fruits, boissons fouettées à base de fruits, boissons fouettées à base de légumes ou boissons fouettées à base de fruits et légumesNote de bas de page 2 | Boissons prêtes à boire obtenues à partir de concentrés de fruits et/ou de légumes, qui sont fabriquées sous forme de concentrés congelés à reconstituer. Les nectars de fruits, les boissons aux légumes, les bases et les mélanges pour boissons aux légumes et les mélanges de jus de légumes Boissons prêtes à boire qui sont fabriquées en mélangeant ou en mettant en purée des fruits et légumes avec du jus, de l'eau ou d'autres ingrédients pour obtenir une consistance épaisse. Exclusions :
|
| (3) | JusNote de bas de page 2 | Jus et mélanges de jus obtenus à partir de fruits ou de légumes et de concentrés préparés par l'ajout d'eau au jus duquel l'eau avait été retirée |
| (4) | Thé, café et infusions à base de plantes préemballés, à portion individuelle | Thé de Camellia sinensis et/ou d'autres infusions à base de plantes préemballés en portion individuelle et disponibles sous forme de sachet de thé. Café moulu préemballé en portion individuelle, qui doit être infusé, c.-à-d. dosettes de café. Exclusions :
|
| (5) | Barres | Produits pressés, extrudés, cuits ou autrement formés en barres, qui comprennent :
Exclusions :
|
| (6) | Bonbons durs, mous et semi-mousNote de bas de page 3 | Bonbons qui sont sous une forme dure, molle ou semi-molle. Cela inclut les produits qui sont des friandises sucrées, qui pourraient ou non comprendre une garniture, leurs équivalents diététiques, et des produits qui pourraient contenir du cacao. Comprend les bonbons gélifiés qui sont représentés comme aliments. Exclusions :
|
| (7) | Confiseries au chocolatNote de bas de page 3 | Confiseries au chocolat dérivées d'un ou de plusieurs produits du cacao. Les produits de cette catégorie peuvent être sous diverses formes, p. ex. barres, morceaux, bouchées et carrés. Exclusions :
|
| (8) | Gommes à mâcherNote de bas de page 3 | Produits à base de gomme naturelle ou synthétique contenant des arômes, des édulcorants (p. ex. sucrose), des composés d'arômes et des additifs alimentaires. Cela comprend la gomme à bulles et des produits de gomme rafraîchisseurs d'haleine. Exclusions :
|
| (9) | Bâtonnets glacés | Produits glacés aromatisés à base d'eau. Cela comprend les sucettes glacées et les tubes glacés. Exclusions :
|
|
||
4.2 Ingrédients supplémentaires et leurs conditions d'utilisation
Les IS autorisés à être ajoutés aux AS sont précisés dans la Liste des ingrédients supplémentaires autorisés de même que leurs conditions d'utilisation. Un AS peut contenir un ou plusieurs IS autorisés dans la Liste pourvu que les conditions soient satisfaites pour tous les IS ajoutés au AS. Un produit ne peut pas être un AS si les conditions d'utilisation d'un ou de plusieurs IS qu'il contient ne sont pas remplies, même s'il appartient à une catégorie autorisée.
Les AS sont assujettis aux mêmes restrictions et aux mêmes interdictions générales que les autres aliments concernant l'ajout d'ingrédients aux aliments. L'ajout d'IS est assujetti à des restrictions et à des exigences supplémentaires. Il s'agit des conditions d'utilisation et sont énoncées dans la Liste des ingrédients supplémentaires autorisés et résumées ci-dessous. Veuillez consulter la section 6.0 pour obtenir des renseignements sur le processus de demande de modification à la Liste.
4.2.1 Renseignements inclus dans la Liste des ingrédients supplémentaires autorisés
La Liste des ingrédients supplémentaires autorisés comprend les renseignements suivants :
- Colonne 1 - Description : Cette colonne indique le nom de l'IS qui peut être ajouté aux AS. Sauf indication contraire, l'IS doit être déclaré sur l'étiquette tel qu'il est indiqué dans la colonne 5. Les IS sont regroupés en quatre parties dans la Liste, plus précisément partie I - Vitamines, partie II - Minéraux nutritifs, partie III - Acides aminés, et partie IV - Autres ingrédients supplémentaires. Dans chaque partie de la Liste, les IS sont énumérés par ordre alphabétique.
- Colonne 2 - Autorisé dans : Cette colonne décrit la catégorie d'aliments, selon la Liste des catégories autorisées d'aliments supplémentés, à laquelle l'IS indiqué à la colonne 1 peut être ajouté. L'ajout d'un IS est autorisé uniquement pour la catégorie d'aliments précisée dans cette colonne.
- Colonne 3 - Teneur maximale et unités par portion indiquée : Cette colonne indique la teneur maximale qui ne doit pas être dépassée pour chaque IS correspondant indiqué à la colonne 1, lorsqu'il est ajouté à un produit appartenant à la catégorie d'aliments de la colonne 2 de la Liste des ingrédients supplémentaires autorisés. Les teneurs maximales s'appliquent à la quantité déclarée sur l'étiquette, qui doit inclure les contributions de toutes les sources ajoutées et naturelles du produit. Sauf indication contraire, la quantité d'un IS doit être exprimée sur l'étiquette en utilisant la même unité que celle précisée pour la teneur maximale de la colonne 3.
- Colonne 4 - Mises en garde qui doivent figurer sur l'étiquette : Cette colonne indique les mises en garde qui sont requises sur l'étiquette, le cas échéant, pour les IS correspondant indiqués à la colonne 1, ainsi que les seuils au-dessus desquels ces déclarations sont requises. Les seuils sont fixés conformément à la quantité déclarée sur l'étiquette.
- Colonne 5 - Autre : Cette colonne indique toute autre condition d'utilisation liée aux IS. Cela comprend, selon le cas, les conditions relatives aux formes de l'ingrédient autorisé pour l'ajout (p. ex. l'utilisation de l'acide nicotinique comme source de niacine n'est pas autorisée), les spécifications de l'ingrédient et/ou les exigences supplémentaires liées à l'étiquetage ou aux déclarations.
| Ingrédient supplémentaire | Conditions d'utilisation | |||
|---|---|---|---|---|
| Colonne 1 Description |
Colonne 2 Autorisé dans |
Colonne 3Note de bas de page ii Teneur maximale et unités par portion indiquée |
Colonne 4Note de bas de page iii Note de bas de page iv Mises en garde qui doivent figurer sur l'étiquette |
Colonne 5 Autre |
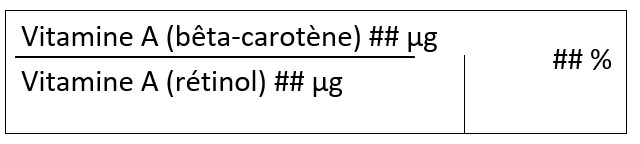
| Vitamine A (Rétinol) | Aliments appartenant à une catégorie figurant dans la Liste des catégories autorisées d'aliments supplémentés, autres que ceux appartenant à la catégorie 1, qui contiennent de la caféine ajoutée et une teneur totale en caféine provenant de toutes les sources supérieures à 150 ppm | 745 µg |
(a) Tous les produits contenant de la vitamine A (rétinol) doivent comporter les mises en garde suivantes :
(b) Si la teneur en vitamine A (rétinol) déclarée sur l'étiquette est supérieure à 149 µg par portion, la mise en garde suivante doit remplacer (a)(ii) :
(c) Si la teneur en vitamine A (rétinol) déclarée sur l'étiquette est supérieure à 149 µg par portion, la mise en garde supplémentaire suivante est nécessaire :
|
(a) Lorsque le rétinol et/ou ses dérivés et le bêta-carotène sont présents dans l'aliment supplémenté, les exigences suivantes s'appliquent :
|
| Explication | ||||
| Fait référence à l'IS vitamine A (rétinol) et doit être exprimée dans le Tableau des renseignements sur les aliments supplémentés en tant que tel | Fait référence aux aliments auxquels on peut ajouter de la vitamine A (rétinol), qui sont toutes les catégories d'aliments autorisées, à l'exception des aliments appartenant à la catégorie 1, qui contiennent de la caféine ajoutée et une teneur totale en caféine provenant de toutes les sources supérieures à 150 ppm. Comme il n'y a pas d'autres utilisations permises pour de la vitamine A (rétinol), il n'est pas permis de l'ajouter à d'autres aliments comme IS. |
Fait référence à la teneur maximale en vitamine A (rétinol) qui peut être déclarée sur l'étiquette par portion lorsqu'elle est ajoutée comme IS aux aliments autorisés à la colonne 2. La teneur maximale s'applique aux contributions provenant de sources ajoutées et naturelles. | Fait référence aux mises en garde qui sont requises aux niveaux de seuil déterminés. Les produits contenant une quantité quelconque de vitamine A (rétinol) ajoutée comme IS doivent déclarer sur l'étiquette les mises en garde indiquées au point (a). Si la teneur totale en vitamine A (rétinol) déclarée sur l'étiquette est supérieure à 149 µg par portion, la mise en garde modifiée indiquée au point (b)(i) est requise au lieu de la mise en garde indiquée au point (a)(ii). En outre, la mise en garde indiquée au point (c)(i) est exigée en plus des mises en garde indiquées aux points (a)(i), (b)(i). Voir la section 4.2.4.1 pour obtenir des renseignements sur le calcul du nombre approprié de portions à inclure dans la mise en garde indiquée au point (c)(i). |
Il s'agit de conditions d'utilisation supplémentaires, selon le cas pour l'utilisation d'un IS dans les AS. Dans le cas de la vitamine A (rétinol), il existe des conditions d'utilisation additionnelles lorsque le rétinol et/ou ses dérivés et le bêta-carotène sont présents dans l'AS. Voir la section 4.3.1.1 pour de plus amples renseignements sur la déclaration de la vitamine A (rétinol) et de la vitamine A (bêta-carotène) sur l'étiquette. |
|
||||
4.2.2 Quantités minimales d'ingrédients supplémentaires
La Liste des ingrédients supplémentaires autorisés ne contient aucun niveau minimal d'ajouts pour les IS. Puisque les IS ne sont pas ajoutés aux AS à des fins nutritionnelles, il n'y a pas de seuil minimal requis pour l'ajout.
4.2.3 Teneurs maximales d'ingrédients supplémentaires
Les IS figurant dans la Liste des ingrédients supplémentaires autorisés comprennent une teneur maximale, qui est établie selon une approche fondée sur le risque. Ces quantités ne sont pas liées aux besoins nutritionnels et elles ne représentent pas des seuils recommandés pour l'ajout. En général, les teneurs maximales s'appliquent à la quantité déclarée sur l'étiquette, qui doit comprendre les contributions de toutes les sources ajoutées et naturelles du produit (p. ex. les teneurs ajoutées sous forme d'IS, d'autres ingrédients alimentaires ajoutés et les quantités d'IS naturellement présentes dans d'autres ingrédients). Pour les acides aminés en particulier, la teneur déclarée sur l'étiquette doit être fondée sur la teneur totale d'acides aminés libres de toutes les sources, c'est-à-dire d'acides aminés libres ajoutés et naturels (p. ex. dans le jus de fruits). Par conséquent, pour les acides aminés, la teneur déclarée sur l'étiquette exclut les acides aminés liés aux protéines naturellement présentes (c.-à-d. les acides aminés présents dans le produit en tant que protéines intactes) et les peptides (p. ex. l'aspartame).
Pour obtenir des détails sur la façon dont les teneurs maximales ont été établies, consulter l'Annexe 4 (vitamines et minéraux nutritifs) et l'Annexe 5 (acides aminés).
4.2.4 Mises en garde relatives aux ingrédients supplémentaires
La déclaration d'IS au-dessus de certains seuils peut nécessiter l'affichage de mises en garde sur l'étiquette d'un AS afin d'informer les consommateurs des risques pour la santé liés à la consommation excessive ou à la consommation par des populations vulnérables. La colonne 4 de la Liste des ingrédients supplémentaires autorisés indique, pour chaque IS, les seuils au-dessus desquels diverses mises en garde peuvent être nécessaires. Certains IS nécessitent les mises en garde applicables à tout niveau. L'Annexe 4 et l'Annexe 5 contiennent plus de détails sur la détermination des seuils pour les mises en garde concernant les vitamines et les minéraux nutritifs, et pour les acides aminés, respectivement.
Un produit peut contenir un ou plusieurs IS ajoutés; par conséquent, l'exigence relative aux mises en garde doit être établie en comparant la quantité de chaque IS sur l'étiquette aux seuils relatifs aux mises en garde. Si plusieurs IS nécessitent la même mise en garde, celle-ci ne doit apparaître qu'une seule fois sur l'étiquette. Ce point est également décrit dans la note de bas de page iv de la Liste.
L'exigence relative aux mises en garde pour un IS peut varier selon la catégorie autorisée d'aliments à laquelle l'IS est ajouté, p. ex. les exigences pour les vitamines et les minéraux nutritifs varient lorsque ceux-ci sont ajoutés aux boissons contenant de la caféine ajoutée pour une teneur totale de plus de 150 ppm de caféine provenant de toutes les sources par rapport aux autres catégories d'aliments. Ces exigences sont décrites dans la Liste des ingrédients supplémentaires autorisés. Pour les AS qui ne dépassent pas le seuil le plus faible précisé à la colonne 4 pour n'importe quel IS, il n'est pas nécessaire d'afficher des mises en garde sur l'étiquette.
Il incombe au fabricant ou au distributeur de s'assurer que toutes les mises en garde requises apparaissent sur l'étiquette du produit. Quand elles sont requises, les mises en garde doivent être regroupées, sous le titre « Attention » normalisé en caractères gras sur l'étiquette d'un AS (consulter la section 4.3.1 pour obtenir plus de détails).
4.2.4.1 Mise en garde concernant le nombre maximal de portions
La teneur déclarée sur l'étiquette d'un IS dans une portion d'un AS ne doit pas dépasser la teneur maximale relative à cet IS précisée à la colonne 3 de la Liste des ingrédients supplémentaires autorisés. Cependant, comme il est indiqué à la colonne 4 de la Liste, les produits contenant une teneur d'IS supérieure à un certain seuil nécessitent la mise en garde « Ne pas [manger/boire] plus de X contenant(s) ou portion(s) par jour », où X représente un nombre de portions ne dépassant pas la teneur maximale relative à cet IS, fondé sur la teneur déclarée sur l'étiquette.
- Le nombre maximal de portions (X) qui peut être indiqué sur l'étiquette est calculé en divisant la teneur maximale établie pour l'IS par la teneur en cet IS par portion indiquée. Le résultat doit être arrondi au chiffre inférieur, car il ne serait pas approprié d'indiquer des portions partielles sur l'étiquette.
X portions = teneur maximale d'IS ÷ teneur déclarée sur l'étiquette par portion indiquée
Par exemple, une barre d'AS contenant de la vitamine C en tant qu'IS, dont la teneur en vitamine C déclarée sur l'étiquette de 280 mg par portion, nécessiterait une mise en garde concernant le nombre maximal de portions puisque la quantité déclarée sur l'étiquette dépasse le seuil de 151 mg de cette mise en garde figurant sur la Liste. La mise en garde doit indiquer 2 (ou moins) portions puisque la consommation de plus de deux portions (756 mg ÷ 280 mg = 2,7 portions) entraînerait des apports supérieurs à la teneur maximale.
- Si plusieurs IS nécessitent une mise en garde relative au nombre maximal de portions, c.-à-d. que plus d'un IS contenu dans la préparation dépasse son seuil maximal pour cette mise en garde, le nombre de portions (X) le plus prudent doit être indiqué sur l'étiquette.
Par exemple, si une barre d'AS contient de la vitamine C en tant qu'IS et que la teneur déclarée sur l'étiquette est de 280 mg par portion, la mise en garde doit indiquer « Ne pas manger plus de 2 portions par jour ». Toutefois, si la même barre contient également du calcium comme IS à une teneur déclarée de 200 mg par portion, alors une quantité supérieure à une portion de la barre entraînerait une quantité de calcium dépassant la teneur maximale (293 mg). Par conséquent, la mise en garde sur l'étiquette de la barre doit indiquer « Ne pas manger plus de 1 portion par jour ».
- L'utilisation de mises en garde plus prudentes que celles qui sont exigées en fonction de la quantité déclarée sur l'étiquette est également acceptable sur l'étiquette.
Par exemple, si le nombre maximal de portions (X) pour un produit est établi à 3, les mentions « Ne pas manger plus de 1 portion par jour » ou « Ne pas manger plus de 2 portions par jour » seraient également acceptables.
- Si une portion d'un produit est équivalente à un contenant, le mot « contenant » ou tout autre terme descriptif approprié peut être utilisé dans l'énoncé de mise en garde au lieu de « portion », à condition que le contenant soit équivalent à une portion.
Par exemple, pour une boisson dans une cannette de 473 ml, puisqu'une canette peut être équivalente à une portion, la mention « Ne pas boire plus de 1 canette par jour » serait acceptable.
4.2.4.2 Mises en garde déconseillant l'utilisation par certains groupes de population
Les IS au-dessus de certains seuils peuvent nécessiter un ou plusieurs des énoncés distincts ou combinés suivants qui commencent par « Déconseillé aux ». En voici des exemples :
- « Déconseillé aux individus de moins de 14 ans »;
- « Déconseillé aux femmes enceintes ou qui allaitent »;
- « Déconseillé aux individus de moins de 14 ans ou aux femmes enceintes ou qui allaitent »;
- « Déconseillé aux individus de moins de 14 ans, aux femmes enceintes ou qui allaitent, ou aux personnes sensibles à la caféine ».
Lorsque plusieurs de ces énoncés sont requis, ils doivent être regroupés afin d'éviter que l'élément « Déconseillé aux » ou que tout groupe de population ne soit pas répété, et les autres éléments doivent être joints au moyen d'une conjonction ou d'un signe de ponctuation.
- Exemple 1 : Lorsque plus d'une mise en garde pour des groupes de population distincts, c'est-à-dire « Déconseillé aux individus de moins de 14 ans » et « Déconseillé aux femmes enceintes ou qui allaitent » est nécessaire, l'élément commun « Déconseillé aux » doit être regroupé dans un énoncé combiné, comme « Déconseillé aux individus de moins de 14 ans ou aux femmes enceintes ou qui allaitantent ».
- Exemple 2 : Lorsque plus d'une mise en garde qui comprend les mêmes groupes de population, l'énoncé combiné doit être utilisé sur l'étiquette. Par exemple, la mise en garde « Déconseillé aux individus de moins de 14 ans » et la mise en garde combinée « Déconseillé aux individus de moins de 14 ans ou aux femmes enceintes ou qui allaitent » englobent le groupe de population des moins de 14 ans; toutefois, lorsque l'ajout de l'IS exige les deux énoncés, seul l'énoncé combiné doit être utilisé sur l'étiquette.
Un IS peut ne pas convenir à la consommation par des personnes de moins d'un certain âge, ce qui entraîne l'exigence d'une mise en garde liée à l'âge sur l'étiquette. L'énoncé de mise en garde lié à l'âge, qu'il s'agisse d'un énoncé distinct ou d'un énoncé combiné figurant sur l'étiquette, doit inclure l'âge le plus restrictif (âge le plus élevé) qui s'applique. Par exemple, si un produit contient un IS exigeant l'énoncé de mise en garde lié à l'âge « Déconseillé aux individus de moins de 14 ans » et un IS exigeant l'énoncé de mise en garde lié à l'âge « Déconseillé aux individus de moins de 18 ans », l'énoncé comportant l'âge le plus restrictif, c'est-à-dire « de moins de 18 ans », doit être utilisé. Cette mise en garde ne doit apparaître qu'une seule fois sur l'étiquette, même si elle est requise par plus d'un IS, soit seule, soit dans le cadre d'une mise en garde combinée. Les mises en garde ne doivent pas indiquer plusieurs âges.
4.2.4.3 Mise en garde relative à l'utilisation d'autres aliments supplémentés ou suppléments
Pour la plupart des IS, les mises en garde suivantes sont requises aux mêmes seuils :
- « Ne pas [manger/boire] le même jour que d'autres aliments supplémentés qui contiennent [les mêmes ingrédients supplémentaires/(ou énumérer des ingrédients spécifiques)] »
- « Ne pas [manger/ boire] le même jour que d'autres suppléments contenant [les mêmes ingrédients supplémentaires/(ou énumérer des ingrédients spécifiques)] »
Par conséquent, elles sont énumérées comme énoncé combiné « Ne pas [manger/boire] le même jour que d'autres aliments supplémentés ou suppléments qui contiennent [les mêmes ingrédients supplémentaires/(ou énumérer des ingrédients spécifiques)] », dans la Liste des ingrédients supplémentaires autorisés. Pour certains IS (c.-à-d. vitamine A [rétinol]), un des énoncés est requis à un seuil inférieur; toutefois, lorsque les deux sont nécessaires, seul l'énoncé combiné doit figurer sur l'étiquette, car il serait superflu d'inclure sur l'étiquette un énoncé combiné et distinct concernant l'utilisation de suppléments ou d'aliments supplémentés.
4.2.5 Excédents pour les ingrédients supplémentaires
Les teneurs maximales d'IS précisées dans la Liste des ingrédients supplémentaires autorisés ne tiennent pas compte des excédents.
Il incombe au fabricant de veiller à ce que l'excédent ajouté pour un IS soit conforme aux bonnes pratiques de fabrication, à condition qu'un tel excédent ne présente pas de risque pour la santé et ne soit pas trompeur.
L'excédent d'un IS doit être fondé sur la quantité minimale de l'ingrédient qui doit être ajouté afin de s'assurer que la déclaration sur l'étiquette est respectée, dans les limites de tolérance acceptable, tout au long de la durée de conservation d'un produit. La quantité de l'excédent nécessaire pour un IS en particulier dépend d'un certain nombre de variables, y compris de la matrice alimentaire, de la méthode de fabrication, du type d'emballage, des conditions d'entreposage et de la durée de conservation. Une étude de stabilité des aliments peut aider le fabricant à déterminer la quantité minimale d'IS à ajouter pendant la fabrication afin de satisfaire à la quantité déclarée sur l'étiquette jusqu'à la fin de la durée de conservation et d'éviter les ajouts excessifs. Les fabricants doivent être en mesure de justifier la quantité de l'excédent et de s'assurer que le contenu de l'ingrédient respecte la quantité déclarée sur l'étiquette, qu'il n'est pas susceptible d'entraîner des ajouts excessifs et qu'il ne présentera pas de risque pour la santé des consommateurs.
Le document Conformité des ingrédients supplémentaires déclarés sur les étiquettes des aliments fournit de de plus amples renseignements sur les IS pour lesquels les excédents sont autorisés. Pour demander une copie de ce document, veuillez envoyer un courriel à supplementedfoods-alimentssupplementes@hc-sc.gc.ca avec la ligne d'objet « Demande de conformité des ingrédients supplémentaires déclarés sur les étiquettes des aliments »
4.2.6 Déficits pour les ingrédients supplémentaires
Pour certains IS, les excédents ne sont pas autorisés. Pour ces IS, le produit ne doit pas contenir plus que la teneur déclarée sur l'étiquette tout au long de sa durée de conservation. Pour y parvenir, les fabricants devraient s'assurer que la teneur déclarée sur l'étiquette représente la teneur de l'IS au début de la durée de conservation. Afin de tenir compte de la dégradation au long de la durée de conservation, les déficits quant à la teneur déclarée sur l'étiquette sont autorisés. Il incombe au fabricant de s'assurer que les déficits, lorsqu'ils sont autorisés, sont conformes aux bonnes pratiques de fabrication, à condition qu'un tel déficit ne présente pas de risque pour la santé et ne soit pas trompeur.
Le document Conformité des ingrédients supplémentaires déclarés sur les étiquettes des aliments, mentionné dans la section 4.2.5, fournit de de plus amples renseignements sur les IS pour lesquels les déficits sont autorisés.
4.2.7 Ajout direct ou indirect d'ingrédients supplémentaires
L'ajout d'IS est assujetti aux conditions d'utilisation énoncées dans la Liste des ingrédients supplémentaires autorisés, que l'ingrédient soit ajouté directement ou indirectement. Si un AS est utilisé comme ingrédient dans un autre AS, les IS retrouvés dans le premier AS sont considérés comme étant également des IS dans l'AS final. Par exemple, un aliment supplémenté sous forme de jus utilisé comme ingrédient dans un mélange de jus serait acceptable; toutefois, le mélange de jus fini doit se conformer au Règlement sur les aliments supplémentés. L'ajout d'un AS comme ingrédient à un aliment qui n'est pas lui-même un aliment supplémenté (c.-à-d. qui appartient à une catégorie autorisée d'aliments et se conforme aux conditions d'utilisation pour ce qui est de tous les IS), n'est pas autorisé. L'article B.29.004 du RAD énonce les exigences relatives aux AS devant être utilisés uniquement comme ingrédients dans la fabrication d'autres AS destinés à la vente aux consommateurs.
4.2.8 Ingrédients supplémentaires composés de deux parties
Les ingrédients ajoutés aux AS en tant qu'IS peuvent être constitués de deux parties, qui pourraient toutes deux être des IS. Lorsque les deux parties de l'ingrédient figurent dans la Liste des ingrédients supplémentaires autorisés, elles sont toutes deux considérées comme des IS et sont assujetties aux conditions d'utilisation comme IS. Toutefois, si les deux parties de l'ingrédient sont des éléments nutritifs (c.-à-d. vitamines, minéraux nutritifs ou acides aminés), une exemption peut s'appliquer. Il s'agit le plus souvent de sels, comme le glutamate de potassium, qui est une source de deux éléments nutritifs, à savoir le potassium et l'acide glutamique.
Lorsque les deux parties de l'ingrédient sont des éléments nutritifs figurant dans la Liste des ingrédients supplémentaires autorisés et sont déclarées dans la section « Supplémenté en » du Tableau des renseignements sur les aliments supplémentés (TRAS) (voir section 4.3.1), les deux sont considérées comme des IS et sont assujetties aux conditions d'utilisation énoncées dans la Liste (p. ex. ajout de glutamate de potassium comme source supplémentaire de potassium et d'acide glutamique).
Si une seule partie de l'ingrédient composé de deux éléments nutritifs est déclarée dans la section « Supplémenté en » du TRAS, alors seule cette partie est considérée comme IS et est soumise aux conditions d'utilisation en tant qu'IS (p. ex. l'ajout de phosphate de calcium comme source de calcium). Pour faciliter l'ajout d'IS (p. ex. calcium), l'autre partie (p. ex. phosphore) est ajoutée comme faisant partie de cet ingrédient, mais n'est pas considérée comme un IS. Toutefois, si la partie de l'ingrédient qui n'est pas mentionnée dans la section « Supplémenté en » du TRAS (p. ex. le phosphore) fait l'objet d'une allégation ou est déclarée ailleurs sur l'étiquette (sauf dans le cas d'un élément nutritif de base qui doit être mentionné à la section 1 du TRAS conformément à l'article B.29.002 du RAD [voir section 4.3.1.1.a]), il serait considéré comme un IS. Dans ce cas, l'autre partie (p. ex. le phosphore) est considérée comme étant ajoutée à des fins fonctionnelles plutôt qu'à titre de sel accessoire pour fournir l'IS (p. ex. le calcium).
4.2.9 Normes de qualité relatives aux ingrédients supplémentaires
Les vitamines, les minéraux nutritifs et les acides aminés ajoutés aux AS, tout comme les autres ingrédients alimentaires, doivent être de qualité alimentaire. Les ingrédients qui satisfont à des normes de qualité reconnues à l'échelle internationale, comme celles énoncées dans les versions les plus récentes du Food Chemicals Codex, des normes alimentaires internationales du Codex Alimentarius, de la pharmacopée des États-Unis ou de la pharmacopée européenne, satisfont à cette exigence. Bien qu'il puisse y avoir des spécifications dans les normes de qualité susmentionnées pour les IS autorisés autres que les vitamines, les minéraux nutritifs et les acides aminés, ils doivent être conformes à toutes les exigences qui peuvent être décrites spécifiquement dans la Liste des ingrédients supplémentaires autorisés. Ces ingrédients sont autorisés en fonction de ce qui a été évalué dans le cadre de l'évaluation de l'innocuité par la Direction des aliments et jugés acceptables pour être utilisés dans les AS, dans certaines conditions d'utilisation, le cas échéant. Parmi les paramètres de qualité requis, on peut citer les types acceptables de solvants d'extraction, la normalisation ou la pureté minimale des constituants et les limites d'impuretés.
Les préparations des IS ajoutés aux AS doivent respecter les dispositions réglementaires applicables. Par exemple, les extraits enrichis de caféine ajoutés à titre de « caféine » ne doivent pas être des ingrédients alimentaires nouveaux; l'utilisation d'additifs alimentaires, y compris le support ou les extraits de solvant, doit être conforme aux Listes des additifs alimentaires autorisés; et les préparations ne doivent contenir aucune substance qui contrevient à l'article 4 de la LAD. De plus, le produit ne doit pas inclure d'ingrédients dont l'utilisation dans les aliments n'est pas acceptable.
4.2.10 Vitamines et minéraux nutritifs
La Liste des ingrédients supplémentaires autorisés comprend les vitamines et les minéraux nutritifs qui peuvent être ajoutés aux AS, ainsi que leurs teneurs maximales et autres conditions d'utilisation. Ces teneurs maximales ont été établies en fonction des données scientifiques disponibles afin de s'assurer que leur ajout n'entraîne pas d'apports excessifs qui pourraient causer des effets indésirables sur la santé. Pour de plus amples renseignements sur la façon dont les teneurs maximales de vitamines et de minéraux ont été établies, consulter l'Annexe 4.
4.2.10.1 Vitamines et minéraux nutritifs dont l'ajout aux aliments supplémentés est interdit
L'ajout aux AS des vitamines et des minéraux énumérés au Tableau 4 ci-dessous n'est actuellement pas acceptable, peu importe la teneur. Ces nutriments comportent des risques pour la population générale ou une population vulnérable particulière chez laquelle il est peu probable que la mise en garde sur l'étiquette soit un outil efficace d'atténuation des risques.
| Vitamine ou minéral | Justification | Référence |
|---|---|---|
| Acide folique | Chez 53 % à 73 % de la population canadienne, les valeurs sanguines reflètent des apports en acide folique supérieurs à l'apport maximal tolérable (AMT) Note de bas de page 3 établi par le National Academies of Sciences, Engineering, and Medicine (NASEM), anciennement connu sous le nom d'Institute of Medicine (IOM). Masquer une carence en vitamine B12 et retarder son diagnostic sont les effets indésirables liés au dépassement de l'AMT. | (NASEM, 1998), (MacFarlane et coll., 2011) |
| Fer | Un apport supplémentaire en fer pourrait constituer un danger pour les personnes atteintes d'hémochromatose non diagnostiquée. L'hémochromatose est un trouble héréditaire du métabolisme du fer touchant une personne de descendance nord-européenne sur 200 à 300. Ce trouble entraîne des taux élevés d'absorption du fer, lequel peut s'accumuler dans le corps et causer des dépôts dans les tissus et les organes. | (Les diététistes du Canada, 2015) |
| Manganèse | Le 95e centile des apports estimés de manganèse sont égaux ou supérieurs à l'AMT pour les enfants âgés de 4 à 8 ans, les garçons âgés de 14 à 18 ans et les hommes âgés de 19 à 30 ans. Les concentrations élevées de manganèse dans le sang et la neurotoxicité ont été sélectionnées par le NASEM en tant qu'effets indésirables critiques afin d'établir l'AMT relatif au manganèse. | (NASEM, 2001), (Enquête sur la santé dans les collectivités canadiennes (ESCC), 2015) |
| Acide nicotinique (une forme de niacine) | Des effets indésirables connus sont attribués à l'apport excessif d'acide nicotinique, une forme de niacine. Les bouffées vasomotrices constituent l'effet indésirable associé au dépassement de l'AMT établi par le NASEM. Cependant, la niacinamide, une autre forme de niacine, peut être utilisée en toute sécurité dans les aliments. | (NASEM, 1998) |
| Vitamine K | Les changements à l'apport en vitamine K peuvent constituer un danger pour les personnes prenant des agents anticoagulants. Ce risque pourrait être atténué par une mise en garde; toutefois, les mises en garde exhaustives sur l'étiquette, comme les déclarations relatives aux problèmes de santé, aux médicaments ou à la durée d'utilisation, ne conviennent pas aux aliments. | (NASEM, 2001) |
Iode
L'iode n'est actuellement pas acceptable pour l'ajout à des AS selon les apports au 95e centile, estimés à partir d'échantillons d'urine uniques (Enquête canadienne sur les mesures de la santé, deuxième cycle [2009-2011]), dépassant l'AMT établi par le NASEM pour les enfants âgés de 4 à 8 ans et certaines populations adultes. L'effet indésirable associé au dépassement de l'AMT est le dysfonctionnement thyroïdien.
Cependant, des estimations plus récentes de l'apport en iode obtenues à partir de deux échantillons d'urine ponctuels quotidiens (Enquête canadienne sur les mesures de la santé, cinquième cycle [2016-2017]) sont maintenant disponibles, ce qui permet d'estimer plus précisément les apports en iode comparativement aux échantillons d'urine ponctuels uniques.
À la lumière de ces nouvelles données, Santé Canada réévaluera sa position sur l'iode en tant qu'IS. Si l'on constate que l'iode peut être consommé en toute sécurité en tant qu'IS ajouté aux AS, une proposition sera faite pour ajouter l'iode à la Liste des ingrédients supplémentaires autorisés conformément à la section 6.4.
4.2.10.2 Vitamines et minéraux nutritifs dont l'ajout aux aliments supplémentés est acceptable
Les teneurs maximales en vitamines et en minéraux nutritifs, lorsqu'ils sont utilisés comme IS, ont été établies pour protéger les groupes d'âge-sexe les plus vulnérables. L'approche et les méthodes utilisées pour déterminer les groupes d'âge-sexe les plus vulnérables sont décrites à l'Annexe 4. Deux ensembles de teneurs maximales en vitamines et en minéraux nutritifs ont été établis pour les AS :
- a) Quantités maximales pour les aliments supplémentés autres que les boissons contenant de la caféine et une quantité totale de caféine provenant de toutes les sources de plus de 150 ppm
L'ajout de vitamines et de minéraux nutritifs comme IS à ces AS peut nécessiter des mises en garde si la quantité déclarée sur l'étiquette dépasse les seuils précisés dans la Liste des ingrédients supplémentaires autorisés pour cet IS. Les mises en garde sont nécessaires pour informer les consommateurs des risques d'un apport excessif. La section 4.2.4 contient des renseignements sur les mises en garde qui peuvent être exigées sur l'étiquette de l'AS pour les vitamines et les minéraux nutritifs. Voir l'Annexe 4 pour connaître les raisons justifiant l'exigence de mises en garde concernant les vitamines et les minéraux nutritifs.
- b) Quantités maximales pour les boissons contenant de la caféine et une quantité totale de caféine provenant de toutes les sources de plus de 150 ppm
Des quantités maximales distinctes ont été établies pour l'ajout de vitamines et de minéraux nutritifs en tant qu'IS dans ces AS. Si l'ajout d'une vitamine ou d'un minéral nutritif n'est pas explicitement autorisé conformément à la colonne 2 de la Liste des ingrédients supplémentaires autorisés pour ces AS, il ne faut pas l'ajouter, peu importe si la même vitamine ou le même minéral nutritif est autorisé pour l'ajout dans d'autres catégories d'AS. Par exemple, la vitamine A (rétinol) peut être ajoutée à tous les aliments supplémentés, à l'exception des boissons qui contiennent de la caféine ajoutée et une quantité totale de caféine provenant de toutes les sources de plus de 150 ppm.
Les teneurs maximales fixées pour les vitamines et les minéraux nutritifs pour ces AS sont prudentes, car des variables supplémentaires, décrites à l'Annexe 4, ont été prises en compte dans leur calcul. L'ajout de vitamines et de minéraux nutritifs à ces produits n'entraîne pas l'exigence d'afficher une mise en garde. Toutefois, ces AS exigent des mises en garde engendrées par l'ajout d'autres IS (p. ex. de la caféine) comme il est indiqué dans la Liste des ingrédients supplémentaires autorisés.
4.2.11 Acides aminés
La Liste des ingrédients supplémentaires autorisés précise les acides aminés qui peuvent être ajoutés aux AS, y compris leurs teneurs maximales et autres conditions d'utilisation. Les teneurs maximales pour les acides aminés standards participant à la synthèse des protéines sont établies à l'aide d'une approche fondée sur le risque pour s'assurer que la consommation d'AS n'entraîne pas d'apports excessifs d'acides aminés supplémentaires. Pour obtenir des détails sur la façon dont les teneurs maximales en acides aminés ont été établies, consulter l'Annexe 5. Voir la section 4.4.6 pour obtenir des renseignements sur les allégations concernant les acides aminés pour les AS.
4.2.11.1 Acides aminés dont l'ajout aux aliments supplémentés est interdit
À l'heure actuelle, seuls les L-isomères des acides aminés (acides aminés L) sont considérés comme appropriés pour l'ajout aux AS, selon la Liste des ingrédients supplémentaires autorisés. La plupart des D-isomères des acides aminés fournissent peu ou pas de soutien nutritionnel aux humains (Friedman et Levin, 2012) et plusieurs peuvent avoir des effets biologiques ou toxiques différents par rapport aux L-isomères (Gu et coll., 2020).
L'ajout des acides aminés énumérés dans le tableau ci-dessous aux AS est actuellement interdit, peu importe la quantité.
| Acide aminé | Justification | Référence |
|---|---|---|
| Tryptophane | L'ajout de tryptophane ou d'autres acides aminés essentiels aux aliments pour des raisons autres que les besoins nutritifs peut accroître le risque de déséquilibre pour les personnes ayant un faible apport en protéines (voir l'Annexe 5 pour obtenir de plus amples renseignements). Les excès les plus élevés de tryptophane par rapport aux exigences parmi tous les acides aminés essentiels dans le régime de base au 5e centile de l'apport de la sous-population la plus vulnérable. Par conséquent, toute supplémentation augmenterait cet excès relatif, ce qui pourrait entraîner des déséquilibres. De plus, le tryptophane agit comme précurseur du neurotransmetteur sérotonine, ce qui peut entrainer des interactions avec certains médicaments. Étant donné que le tryptophane est permis pour l'ajout à certains aliments, comme il est indiqué au paragraphe D.03.002 du RAD, l'industrie est encouragée à discuter avec Santé Canada des options réglementaires pour leurs produits particuliers. | (ESCC, 2015), (Kikuchi et coll., 2021) |
4.2.11.2 Acides aminés dont l'ajout aux aliments supplémentés est autorisé
La Liste des ingrédients supplémentaires autorisés indique les teneurs maximales et autres conditions d'utilisation relatives aux 20 acides aminés standards associés à la synthèse des protéines.
L'ajout de ces-acides aminés sous forme libre, hydratée ou anhydre, ou sous forme de chlorhydrate ou de sel minéral (p. ex. sel de sodium ou de potassium) aux aliments appartenant à la Liste des catégories autorisées d'aliments supplémentés est autorisé. Voir la section 4.2.8 pour plus de renseignements sur les ingrédients supplémentaires composés de deux parties.
Contrairement aux vitamines et aux minéraux nutritifs, il n'y a qu'un seul ensemble de teneurs maximales pour les acides aminés qui s'applique à toutes les catégories de la Liste des catégories autorisées d'aliments supplémentés.
Les teneurs maximales pour les acides aminés s'appliquent aux teneurs déclarées sur l'étiquette. La teneur déclarée doit inclure la quantité en acide aminé libre dans un AS provenant de la teneur ajoutée sous forme d'IS, la teneur provenant des ingrédients alimentaires et la teneur en acides aminés libres naturellement présents (p. ex. dans le jus de fruits). Les teneurs en acides aminés liés aux protéines naturellement présentes dans l'AS (c.-à-d. les acides aminés présents dans le produit en tant que protéine intacte) ne compteraient pas pour la déclaration de l'acide aminé. De plus, les peptides à chaîne courte et les autres métabolites ou dérivés d'acides aminés ne devraient pas être pris en compte au cours de la détermination de la valeur déclarée ou de la comparaison avec les teneurs maximales pour les acides aminés uniques. Les peptides à chaîne courte, les métabolites ou les dérivés d'acides aminés (p. ex. N-acétyl-L-cystéine) peuvent avoir une absorption et un métabolisme différents et des usages physiologiques ou thérapeutiques différents (p. ex. en tant que produit de santé naturel) par rapport aux acides aminés uniques.
En fonction de la quantité déclarée d'un acide aminé ajouté dans un AS, des mises en garde peuvent être nécessaires pour informer les intervenants des risques en fonction des seuils indiqués dans la colonne 4 de la Liste des ingrédients supplémentaires autorisés. Voir la section 4.2.4 pour obtenir des renseignements sur les mises en garde.
Certains acides aminés (L-cystéine et L-méthionine; L-phénylalanine et L-tyrosine) ont une quantité maximale combinée, comme indiqué dans la colonne 3 de la Liste des ingrédients supplémentaires autorisés. Dans ces cas, lorsque les deux acides aminés sont déclarés sur l'étiquette, la somme des teneurs déclarées ne doit pas dépasser la teneur maximale indiquée dans la colonne 3 de la Liste. Par exemple, lorsque la L-cystéine et la L-méthionine sont ajoutées en tant qu'IS, leur niveau total déclaré sur l'étiquette ne doit pas dépasser la teneur maximale combinée de 413 mg.
Voir l'Annexe 5 pour connaître les justifications relatives à l'exigence de mises en garde pour les acides aminés.
4.2.12 Autres ingrédients supplémentaires
4.2.12.1 Caféine
Le Canada a longtemps autorisé l'utilisation de la caféine comme additif alimentaire pour caractériser les boissons de type cola et les boissons aromatisées et sucrées à base d'eau gazéifiée autres que les boissons de type cola. Plus récemment, les AS préemballés auxquels de la caféine a été ajoutée ont été autorisés à titre temporaire, à condition que cet ajout satisfasse aux exigences établies en matière de composition et d'étiquetage. La population générale connaît peut-être moins bien que les AS, comme les boissons ou la gomme à mâcher, peuvent contenir de la caféine ou la contenir à des niveaux plus élevés qu'autorisés auparavant. Une approche fondée sur les risques est justifiée pour aider les Canadiens à consommer ces produits de manière sécuritaire. Par conséquent, il est indiqué de surveiller ces nouvelles utilisations de la caféine en tant qu'AS.
La caféine peut être ajoutée en tant qu'IS à certains aliments appartenant aux catégories précisées d'aliments autorisés, tel qu'il est indiqué à la colonne 2 de la Liste des ingrédients supplémentaires autorisés, et conformément aux teneurs maximales et aux conditions d'utilisation indiquées dans les colonnes 3 à 5 de la Liste.
4.2.12.1.1 Conditions d'utilisation relatives à la caféine comme ingrédient supplémentaire
- a) Ajout de caféine aux boissons pouvant aller jusqu'à 150 ppm
Conformément à la Liste des ingrédients supplémentaires autorisés, l'ajout de caféine est autorisé dans les boissons à base d'eau non gazéifiée appartenant à l'article 1 de la Liste des catégories autorisées d'aliments supplémentés. Les boissons à base d'eau non gazéifiée appartenant à l'article 1 de la Liste et contenant de la caféine ajoutée ainsi qu'une quantité totale de caféine provenant de toutes les sources d'au plus 150 ppm doivent porter la mention « Contient de la caféine » sur l'espace principal (EP) de l'étiquette. Il existe d'autres conditions d'utilisation liées aux types de produits et à l'étiquetage pour les AS appartenant à cette catégorie qui sont précisées dans la Liste des ingrédients supplémentaires autorisés, comme les restrictions relatives à la composition du produit, p. ex. ces produits, tels que consommés, ne doivent pas contenir 25 % ou plus de jus, de purée, de pulpe ou de nectar, individuellement ou en combinaison.
L'ajout de caféine aux boissons de type cola et aux boissons aromatisées sucrées non alcoolisées et édulcorées à base d'eau gazéifiée, autres que les boissons de type cola, continue d'être assujetti à la réglementation sur les additifs alimentaires, tel qu'il est indiqué dans la Liste des additifs alimentaires autorisés ayant d'autres utilisations acceptées (Listes des additifs alimentaires autorises). En vertu du Règlement sur les aliments supplémentés, l'ajout de caféine ou de citrate de caféine à des boissons autres que les boissons gazeuses ou à des boissons gazéifiées à des niveaux supérieurs à 150 ppm sera considéré comme un IS et non comme un additif alimentaire. Pour la durée de la période de transition pour le Règlement sur les aliments supplémentés (voir section 2.0), le niveau maximal autorisé d'utilisation de la caféine comme additif alimentaire dans les boissons de type cola est de 200 ppm. Toutefois, une fois la période de transition terminée, l'ajout de caféine à ces boissons en tant qu'additif alimentaire sera limité à une concentration maximale de caféine de 150 ppm. Cette harmonisation avec la période de transition pour les AS vise à réduire au minimum les répercussions sur l'industrie qui pourrait avoir besoin de reformuler les boissons de type cola si elle souhaite utiliser la caféine ou le citrate de caféine comme additif alimentaire et non en tant qu'IS. L'intention du ministère à cet égard et les modifications subséquentes seront publiées sur le site Web du gouvernement du Canada et s'harmonisent avec la gestion de la caféine décrite à la section b) ci-dessous.
Dans la Liste des ingrédients supplémentaires autorisés, l'unité utilisée pour décrire la teneur maximale dans les boissons diffère de celle qui doit être déclarée sur l'étiquette, c'est-à-dire que la quantité maximale est fournie en ppm. Toutefois, la quantité doit être exprimée en milligramme (mg) sur l'étiquette.
- b) Ajout de caféine aux boissons où la concentration totale de caféine provenant de toutes les sources est supérieure à 150 ppm
L'ajout de caféine à des boissons à base d'eau gazéifiée ou non gazéifiée pour une teneur totale de caféine provenant de toutes les sources de plus de 150 ppm (et jusqu'à 400 ppm) est autorisé à l'article 1 de la Liste des catégories autorisées d'aliments supplémentés. La quantité totale de caféine dans les boissons contenant de la caféine ajoutée ne doit pas dépasser 400 ppm, ou plus de 180 mg par portion, dans les boissons telles que consommées.
Ces AS doivent porter des mises en garde conformément à la Liste des ingrédients supplémentaires autorisés. Voir section 4.2.4 pour obtenir des renseignements sur les mises en garde. Si la teneur totale en caféine est supérieure au seuil indiqué dans la colonne 4 de la Liste, la mise en garde additionnelles concernant le nombre maximal de portions par jour est requise sur l'étiquette. La section 4.2.4.1 fournit des renseignements sur la détermination du nombre approprié de portions.
De plus, les boissons contenant de la caféine ajoutée et une teneur totale de caféine provenant de toutes les sources de plus de 150 ppm doivent porter la mention « Teneur élevée en caféine » sur l'étiquette. Les caractéristiques d'étiquetage de cette déclaration ne sont pas prescrites, mais elles doivent respecter les exigences générales (p. ex. les exigences de lisibilité) pour toutes les déclarations d'étiquetage obligatoires décrites dans la LAD, la LSAC et aux règlements associés à ces lois. Il y a des restrictions sur les déclarations pour les AS qui portent l'énoncé « Teneur élevée en caféine » sur leur étiquette, comme il est décrit à la section 4.4.7.3.
- c) Ajout de caféine à des aliments autres que les boissons
En vertu de la Liste des ingrédients supplémentaires autorisés, l'ajout de caféine à certaines catégories d'aliments autres que les boissons est autorisé. Si la teneur totale en caféine de ces produits est supérieure à 56 mg par portion, les mises en garde indiquées dans la colonne 4 de la liste sont requises (voir section 4.2.4).
De plus, la colonne 5 de la Liste précise les exigences supplémentaires en matière d'étiquetage, comme il est indiqué ci-dessous :
- Les produits qui contiennent jusqu'à 56 mg de caféine par portion doivent porter la mention « Contient de la caféine » sur l'EP.
- Les produits qui contiennent plus de 56 mg de caféine par portion doivent porter la mention « Teneur élevée en caféine » sur l'EP.
4.2.12.1.2 Caféine ajoutée et ingrédients contenant de la caféine
Les inscriptions relatives à la caféine dans la Liste des ingrédients supplémentaires autorisés s'appliquent aux produits qui contiennent différentes formes de caféine ajoutée en tant qu'IS. La caféine artificielle, la caféine provenant de sources naturelles, ainsi que certains extraits contenant de la caféine peuvent représenter des formes de caféine ajoutée. En ce qui concerne les extraits contenant de la caféine, on détermine au cas par cas s'ils sont considérés comme étant de la caféine ajoutée. Pour qu'un ingrédient soit considéré comme un aromatisant, il doit être utilisé dans le but de fournir une saveur et sa composition, y compris sa teneur en caféine, doit être compatible avec celle de l'ingrédient dont le but est d'apporter une saveur caractéristique. Les extraits, s'ils sont enrichis en caféine, ou s'ils sont ajoutés en quantités supérieures à celles normalement présentes s'ils étaient utilisés comme aromatisants afin d'augmenter la teneur en caféine de l'aliment, sont susceptibles d'être des formes de caféine ajoutée.
Inversement, les ingrédients qui contiennent de la caféine comme constituant naturel et qui ne sont pas traités dans le but d'être enrichis en caféine ne sont probablement pas des formes de caféine ajoutée. Des exemples de tels ingrédients comprennent le café ou le thé infusé, le chocolat et certains arômes. Les AS qui ne contiennent aucune forme de caféine ajoutée ne sont pas assujettis aux conditions de la Liste; il faut toutefois noter que lorsque l'AS contient de la caféine ajoutée, les teneurs maximales et autres conditions d'utilisation sont fondées sur la somme de toutes les sources de caféine (voir section 4.2.4.1).
4.2.12.2 Taurine
La taurine est autorisée dans les AS comme IS jusqu'à une teneur maximale de 2 000 mg, comme il est précisé dans la colonne 3 de la Liste des ingrédients supplémentaires autorisés. La consommation d'AS contenant de la taurine au delà de certains seuils par la population générale est inappropriée sans mise en garde. La colonne 4 de la liste indique les seuils de taurine auxquels des mises en garde particulières sont requises. De plus amples renseignements sur la quantité maximale et les autres conditions d'utilisation, le cas échéant, se trouvent à l'Annexe 6.
4.2.13 Autres substances à considérer comme ingrédients supplémentaires
Des ingrédients autres que ceux décrits ci-dessus peuvent être éligibles à titre d'IS dans les AS, notamment des ingrédients à base de plantes ou autres, comme ceux que l'on trouve dans les produits de santé naturels. Ces substances, ou certains niveaux de ces substances peuvent ne pas avoir d'antécédents d'innocuité en tant qu'aliments. Cependant, un ingrédient nouveau destiné à être utilisé comme IS n'a pas à subir d'évaluation en tant qu'un aliment nouveau (voir section 6.1). Santé Canada peut déterminer les conditions d'utilisation en tant qu'IS, en tenant compte des renseignements sur la fabrication et la chimie des ingrédients, des données toxicologiques et nutritionnelles et de la pertinence de tout outil d'atténuation des risques, comme les mises en garde sur l'étiquette.
Voir la section 6.0 pour obtenir des renseignements sur le processus de demande de modification à la Liste concernant l'ajout d'un nouvel IS.
4.2.14 Ingrédients qui ne sont pas considérés comme des ingrédients supplémentaires
Seuls les ingrédients utilisés conformément à leurs teneurs maximales et leurs conditions d'utilisation énumérées dans la Liste des ingrédients supplémentaires autorisés sont considérés comme des IS. L'utilisation d'un IS indiqué dans la colonne 1 de la liste d'une manière qui n'est pas conforme aux conditions d'utilisation précisées n'est pas considérée comme étant un IS. Certaines substances permises en tant qu'IS peuvent également être utilisées à d'autres fins, sous réserve d'autres dispositions du RAD. Par exemple, certains ingrédients peuvent être utilisés comme additifs alimentaires, aromatisants ou substituts de sel. Lorsqu'ils sont utilisés seulement à des fins saisies par d'autres dispositions, ces ingrédients ne sont pas considérés comme étant des IS et n'ont pas à respecter les conditions d'utilisation décrites dans la Liste des ingrédients supplémentaires autorisés. Leur utilisation continuera d'être réglementée en vertu des dispositions actuelles du RAD et leur utilisation dans les aliments serait acceptable, y compris dans les AS, à condition qu'ils soient conformes aux exigences applicables du règlement.
Pour les produits qui ont reçu des LAMT en tant qu'AS, certains ingrédients qui ont été évalués au cas par cas pour leur ajout à ces produits peuvent ne pas être énumérés dans la Liste des ingrédients supplémentaires autorisés, notamment la L-théanine, l'inositol et le glucuronolactone. Ces ingrédients sont considérés comme étant des ingrédients alimentaires acceptables (c.-à-d. pas des IS) et leur ajout aux aliments, y compris aux AS, est assujetti aux dispositions actuelles du RAD. Toutefois, au-delà de certains niveaux, leur utilisation sécuritaire dans les aliments est inconnue ou n'a pas été établie. L'autorisation d'utilisation de ces ingrédients pourrait être demandée soit en suivant le processus de demande comme aliment nouveau (titre 28, partie B du RAD; voir section 4.2.14.3) si elle est destinée à une utilisation générale dans l'alimentation ou comme IS si l'utilisation sécuritaire de l'ingrédient est destinée à être utilisée dans des catégories d'aliments admissibles comme aliment supplémenté et si son utilisation exige l'établissement de conditions d'utilisation. Pour obtenir des renseignements sur la façon d'ajouter un nouvel ingrédient à la Liste des ingrédients supplémentaires autorisés, voir section 6.0 pour modifier la Liste.
4.2.14.1 Additifs alimentaires
Au Canada, les additifs alimentaires sont réglementés par la LAD, le RAD et les autorisations de mise en marché (AM) émises par le ministre de la Santé. Les additifs alimentaires approuvés et leurs conditions d'utilisation autorisées sont indiqués dans les 15 Listes des additifs alimentaires autorisés qui sont incorporées par renvoi dans les 15 AM correspondantes et publiées sur le site Web du gouvernement du Canada. L'utilisation d'additifs alimentaires dans les AS doit être conforme à ces Listes des additifs alimentaires autorisés. Les additifs alimentaires sont habituellement organisés en fonction des classes fonctionnelles des additifs alimentaires et précisent l'aliment ou les aliments dans lesquels un additif peut être utilisé, la quantité maximale dans cet aliment et toute autre condition particulière d'utilisation. Comme dans le cas des aliments conventionnels, les fabricants d'AS qui souhaitent utiliser un additif alimentaire non approuvé, un additif alimentaire approuvé dans une nouvelle catégorie d'aliments ou à un niveau qui n'est pas actuellement permis doivent faire une demande d'autorisation concernant les additifs alimentaires conformément à l'article B.16.002 du RAD pour obtenir une modification aux Listes des additifs alimentaires autorisés avant de pouvoir l'utiliser dans les aliments. Santé Canada évaluera la demande afin de déterminer si l'utilisation de l'additif alimentaire demandée devrait être ajoutée avant d'effectuer une consultation sur toute modification proposée aux Listes.
4.2.14.2 Ingrédients aromatisants alimentaires
Les ingrédients aromatisants utilisés dans les aliments doivent être utilisés pour fournir de la saveur. La composition des ingrédients aromatisants alimentaires doit être conforme à celle de la substance dont le but est de donner une saveur caractéristique. Les ingrédients aromatisants doivent être de qualité alimentaire. Il existe des normes d'identité et de composition pour certaines préparations aromatisantes au titre 10 du RAD. Il existe également des normes pour les ingrédients aromatisants qui ont été évaluées par le Comité mixte FAO/OMS d'experts des additifs alimentaires ainsi que des spécifications qui sont prescrites dans la dernière édition du Food Chemicals Codex.
Le RAD n'exige pas l'évaluation préalable à la mise en marché de la plupart des ingrédients aromatisants et il n'y a pas de liste « positive » des aromatisants autorisés dans le RAD. Toutefois, la LAD interdit la vente d'aliments falsifiés et la partie 1 de la Liste des contaminants et des autres substances adultérantes dans les aliments comprend certains ingrédients aromatisants qui falsifieraient un aliment. Ces substances ne sont pas autorisées dans les aliments à aucun niveau d'utilisation. En fin de compte, il incombe au vendeur de s'assurer que les ingrédients aromatisants dans ses produits alimentaires ne contreviennent pas à l'article 4 de la LAD.
4.2.14.3 Aliments nouveaux
Les aliments nouveaux sont habituellement utilisés à des fins alimentaires traditionnelles (p. ex. besoins nutritionnels, hydratation) et sont assujettis aux exigences du titre 28 de la partie B du RAD. Les requérants qui sont incertains à savoir si un ingrédient est considéré comme nouveau ou non sont invités à solliciter un avis auprès de la Section des aliments nouveaux de la Direction des aliments de Santé Canada. Il est possible de demander un formulaire d'information sur la détermination du caractère nouveau par courriel à l'UGDI de la Direction des aliments (hc.smiu-ugdi.sc@canada.ca) en inscrivant « Formulaire d'information sur la détermination du caractère nouveau » dans l'objet du message.
Pour obtenir de plus amples renseignements sur la détermination et l'évaluation du caractère nouveau, consulter le site Web de Santé Canada et les Lignes directrices sur l'évaluation de l'innocuité des aliments nouveaux dérivés des végétaux et des microorganismes, respectivement. Santé Canada a publié une Liste des déterminations d'aliments et d'ingrédients alimentaires qui ne sont pas nouveaux, que les intervenants peuvent consulter au sujet des ingrédients pour lesquels une détermination de la nouveauté a été demandée et le résultat était qu'il ne s'agit pas d'un aliment nouveau.
4.3 Étiquetage des aliments supplémentés
Toutes les exigences relatives à l'étiquetage et à la publicité de la LAD, de la LSAC et des règlements associés à ces lois s'appliquent aux AS. Les AS sont assujettis aux exigences générales en matière d'étiquetage relatives aux produits préemballés, notamment l'étiquetage bilingue, le nom usuel, le pays d'origine, la datation et les directives d'entreposage, le nom et principal lieu d'affaires, la liste d'ingrédients et d'allergènes, les numéros de lot, la quantité nette et la lisibilité et l'emplacement de ces renseignements.
À l'exception des exigences relatives au tableau de la valeur nutritive (TVN), les AS sont également assujettis aux exigences réglementaires énoncées dans les modifications finales au RAD (Règlement modifiant le Règlement sur les aliments et drogues (étiquetage nutritionnel, autres dispositions d'étiquetage et colorants alimentaires) (DORS/2016-305) - appelé Règlement sur l'étiquetage nutritionnel de 2016, publiées dans la Partie II de la Gazette du Canada le 14 décembre 2016. Les AS n'auront pas à respecter les dispositions modifiées relatives au TVN, mais devront cependant se conformer aux dispositions du TRAS du Règlement sur les aliments supplémentés (voir section 4.3.1). Pour obtenir des renseignements et des directives sur les récentes mises à jour des exigences en matière d'étiquetage des aliments, consulter la page Web de Santé Canada Règlements et conformité - étiquetage nutritionnel. La période de transition pour les modifications susmentionnées sur l'étiquetage nutritionnel a pris fin le 14 décembre 2021. Toutefois, l'ACIA concentre ses efforts sur la sensibilisation et la promotion de la conformité au cours de la première année (jusqu'au 14 décembre 2022). Les AS qui bénéficient de la période de transition (voir section 2.0) n'ont pas à se conformer au Règlement sur l'étiquetage nutritionnel de 2016 avant la fin de la période de transition liée aux AS.
Les AS sont également soumis aux modifications finales du RAD concernant l'étiquetage nutritionnel sur le devant de L'emballages et d'autres aspects de l'étiquetage, intitulées Règlement modifiant le Règlement sur les aliments et drogues (symboles nutritionnels, autres dispositions d'étiquetage, vitamine D et graisses ou huiles hydrogénées) (DORS/2022-0168).
4.3.1 Exigences d'étiquetage propres aux aliments supplémentés
Il y a des exigences particulières d'étiquetage pour les AS en vertu du Règlement sur les aliments supplémentés. L'étiquetage des AS fournit aux consommateurs des renseignements pour distinguer ces produits des aliments conventionnels, de mieux comprendre les risques associés à la consommation de certains AS et de prendre des décisions éclairées concernant leur consommation. Les exigences particulières en matière d'étiquetage pour les AS sont décrites ci-dessous.
4.3.1.1 Tableau des renseignements sur les aliments supplémentés
Le Règlement sur les aliments supplémentés exige que les AS portent un TRAS normalisé. Le TRAS a un format semblable à celui du TVN, comporte bon nombre des mêmes exigences que ce dernier concernant les principaux nutriments et fournit des renseignements supplémentaires propres aux IS. Plus précisément, le TRAS doit indiquer la quantité et, le cas échéant, le pourcentage de valeurs quotidiennes (% VQ) des principaux nutriments. De plus, le TRAS doit inclure la quantité de chaque IS, exprimée dans l'unité applicable indiquée à la colonne 3 de la Liste des ingrédients supplémentaires autorisés. Pour les IS qui ont une VQ établie (c'est-à-dire, vitamines et minéraux nutritifs), la quantité doit également être exprimée en % VQ.
Un TRAS typique est illustré à la Figure 1 et se compose de trois sections principales :
- Section 1 : Comme pour un TVN, le TRAS doit afficher des renseignements obligatoires comme la taille de la portion, les calories et les quantités de nutriments principaux (lipides, glucides, protéines, cholestérol, sodium, potassium, calcium et fer) en unités métriques et en % VQ. Comme pour le TVN, le TRAS peut également afficher d'autres nutriments, volontairement ou sur une base obligatoire, lorsqu'ils font l'objet d'une déclaration. Toutefois, s'il y a une source supplémentaire du même nutriment, il doit être déclaré sous la rubrique « Supplémenté en » (section 3 du TRAS) au lieu de la section 1 du TRAS (p. ex. bien que le calcium soit un nutriment principal, dans le cas où il est ajouté comme IS, il doit être déclaré sous la rubrique « Supplémenté en » seulement). La déclaration doit correspondre à la quantité totale du nutriment dans le produit.
- Section 2 : Tout comme le TVN, le TRAS porte la mention « 5 % ou moins c'est peu, 15 % ou plus c'est beaucoup » au bas de la première section du tableau. Cette mention permet aux consommateurs de constater si un aliment contient peu ou beaucoup d'un nutriment en particulier comme les sucres, le sodium et le potassium.
- Section 3 : La section « Supplémenté en » doit afficher les quantités totales (naturellement présentes + ajoutées + provenant d'autres sources) des IS présents dans l'aliment. Pour les IS qui ont une VQ établie, c'est-à-dire les vitamines et les minéraux nutritifs, la quantité de cet IS doit également être exprimée en % VQ.

Figure - Équivalent textuel
À la première ligne dans le haut du tableau des renseignements sur les aliments supplémentés, le titre Info-aliment supplémenté figure en caractères gras et gros, aligné à gauche, et le titre Supplemented Food Facts apparaît immédiatement en-dessous aussi en caractères gras et gros. Sur la ligne suivante se trouve l'indication Per 1 bottle, parenthèse ouvrante, 500 mL, parenthèse fermante. Sur la ligne suivante se trouve l'indication pour 1 bouteille, parenthèse ouvrante, 500 mL, parenthèse fermante. Sous cette dernière indication, un filet s'étend sur la largeur du tableau. À la ligne suivante, le terme Calories figure en gras, aligné à gauche suivi de 160, également en gras. Aligné à droite sur la même ligne se trouve le sous-titre présenté ainsi : symbole du pourcentage suivi de Daily Value en gras. Immédiatement en-dessous figure le symbole du pourcentage suivi de valeur quotidienne aussi en caractères gras. Le pourcentage de Daily Value et la pourcentage suivi de la valeur quotidienne sont accompagnés d'un astérisque qui renvoie à une note complémentaire figurant plus bas dans le tableau. Sous l'indication des Calories se trouve un filet gras qui ne s'étend pas sur toute la largeur du tableau.
Sur la ligne suivante, alignée à gauche, se trouve la séquence Fat, barre oblique, Lipides en caractères gras, laquelle est suivie de 0 et d'un g en lettres minuscules. Alignés à droite sur la même ligne se trouve le nombre 0 suivi du symbole du pourcentage. En retrait sur la ligne suivante se trouve la séquence Saturated, barre oblique, saturés suivie de 0 et d'un g en lettres minuscules. En retrait sur la ligne suivante se trouve un symbole d'addition suivi de la séquence Trans, barre oblique, trans suivie de 0 puis d'un g en lettres minuscules. Alignés à droite et centrés verticalement par rapport à saturés et à trans alignés à gauche se trouvent un 0 suivi du symbole du pourcentage. Sous l'indication des lipides trans, un filet maigre s'étend sur la largeur du tableau.
La séquence Carbohydrate, barre oblique, Glucides figure sur la ligne suivante suivie de 41 puis d'un g en lettres minuscules. En retrait sur la ligne suivante se trouve la séquence Fibre, barre oblique Fibres suivie de 0 puis d'un g en lettres minuscules. Aligné à droite sur la même ligne se trouve le nombre 0 suivi d'un symbole du pourcentage. En retrait sur la ligne suivante se trouve la séquence Sugars, barre oblique, Sucres suivie de 41 et d'un g en lettres minuscules. Sur la même ligne, aligné à droite, se trouve le nombre 41 suivi du symbole de pourcentage. Sous l'indication des sucres, un filet maigre s'étend sur la largeur du tableau.
Sur la ligne suivante figure la séquence Protein, barre oblique, Protéines en caractères gras suivie de 0 puis d'un g en lettres minuscules. Sous l'indication des protéines, un filet maigre s'étend sur la largeur du tableau.
Sur la prochaine ligne, la séquence Cholesterol, barre oblique, Cholestérol figure en caractères gras suivie de 0 puis des lettres mg en lettres minuscules. Sous l'indication du cholestérol, un filet maigre s'étend sur la largeur du tableau.
À la prochaine ligne, le terme Sodium figure en caractères gras suivi de 150 puis des lettres mg en lettres minuscules. Sur la même ligne, aligné à droite, se trouve le nombre 7 suivi du symbole de pourcentage. Sous l'indication du sodium, un filet gras s'étend sur la largeur du tableau.
Le terme Potassium figure sur la ligne suivante, lequel est suivi de 0 puis des lettres mg en lettres minuscules. Sur la même ligne, aligné à droite, se trouve un 0 suivi du symbole de pourcentage. Sous l'indication du potassium, un filet maigre s'étend sur la largeur du tableau.
Le terme Calcium figure sur la ligne suivante, lequel est suivi de 0 puis des lettres mg en lettres minuscules. Sur la même ligne, aligné à droite, se trouve un 0 suivi du symbole de pourcentage. Sous l'indication du calcium, un filet maigre s'étend sur la largeur du tableau.
La séquence Iron, barre oblique, Fer figure sur la ligne suivante, laquelle est suivie de 0 puis des lettres mg en lettres minuscules. Sur la même ligne, aligné à droite, se trouve un 0 suivi du symbole de pourcentage. Sous les renseignements au sujet du fer, un filet gras s'étend sur la largeur du tableau.
La note complémentaire sur le pourcentage de la valeur quotidienne figure sur la ligne suivante alignée à gauche. Cette note est constituée d'un astérisque suivi de la séquence suivante : 5 suivi du symbole de pourcentage et de la mention or less is a little, 15 suivi du symbole de pourcentage et de la mention or more is a lot. Se trouve ensuite sur la ligne suivante un astérisque et la séquence suivante : 5 suivi du symbole de pourcentage et de la mention ou moins c'est peu, 15 suivi du symbole de pourcentage et de la mention ou plus c'est beaucoup. Les termes a little et a lot ainsi que peu et beaucoup sont en caractères gras. Sous la note complémentaire sur le pourcentage de la valeur quotidienne, un filet gras s'étend sur la largeur du tableau.
Le sous-titre Supplemented with, barre oblique, Supplémenté en, en caractères gras figure sur la ligne suivante, aligné à gauche, suivi d'un symbole de croix en exposant qui renvoie à une note complémentaire figurant dans le bas du tableau. Sous l'indication Supplemented with, un filet maigre s'étend sur la largeur du tableau.
La séquence Niacin, barre oblique, Niacine figure sur la ligne suivante, laquelle est suivie de 7 puis des lettres mg en lettres minuscules. Sur la même ligne, aligné à droite, se trouve le nombre 44 suivi du symbole de pourcentage. Sous les renseignements au sujet de la niacine, un filet maigre s'étend sur la largeur du tableau.
La séquence Pantothenate, barre oblique, Pantothénate figure sur la ligne suivante, laquelle est suivie de 8 puis des lettres mg en lettres minuscules. Sur la même ligne, aligné à droite, se trouve le nombre 160 suivi du symbole de pourcentage. Sous les renseignements au sujet de la pantothénate, un filet maigre s'étend sur la largeur du tableau.
La séquence Vitamin B6, 6 étant en indice, barre oblique et Vitamine B6, 6 étant en indice, figure sur la ligne suivante, laquelle est suivie de 1 puis des lettres mg en lettres minuscules. Sur la même ligne, aligné à droite, se trouve le nombre 59 suivi du symbole de pourcentage. Sous les renseignements au sujet de la vitamine B6, un filet maigre s'étend sur la largeur du tableau.
La séquence Vitamin B12, 12 étant en indice, barre oblique et Vitamine B12, 12 étant en indice, figure sur la ligne suivante, laquelle est suivie de 4 puis du symbole µ et d'un g en lettre minuscule. Sur la même ligne, aligné à droite, se trouve le nombre 59 suivi du symbole de pourcentage. Sous les renseignements au sujet de la vitamine B12, un filet maigre s'étend sur la largeur du tableau.
La séquence Vitamin C, barre oblique, Vitamine C figure sur la ligne suivante, laquelle est suivie de 225 puis des lettres mg en lettres minuscules. Sur la même ligne, aligné à droite, se trouve le nombre 250 suivi du symbole de pourcentage. Sous les renseignements au sujet de la vitamine C, un filet maigre s'étend sur la largeur du tableau.
La séquence Vitamin E, barre oblique, Vitamine E figure sur la ligne suivante, laquelle est suivie de 2 puis des lettres mg en lettres minuscules. Sur la même ligne, aligné à droite, se trouve le nombre 13 suivi du symbole de pourcentage. Sous les renseignements au sujet de la vitamine E, un filet maigre s'étend sur la largeur du tableau.
La séquence Magnesium, barre oblique, Magnésium figure sur la ligne suivante, laquelle est suivie de 20 puis des lettres mg en lettres minuscules. Sur la même ligne, aligné à droite, se trouve le nombre 5 suivi du symbole de pourcentage. Sous les renseignements au sujet du magnésium, un filet maigre s'étend sur la largeur du tableau.
Le terme Zinc figure sur la ligne suivante, lequel est suivi de 5 puis des lettres mg en lettres minuscules. Sur la même ligne, aligné à droite, se trouve le nombre 5 suivi du symbole de pourcentage. Sous les renseignements au sujet du zinc, un filet maigre s'étend sur la largeur du tableau.
La note complémentaire sur les ingrédients supplémentaires figure sur les deux lignes suivantes. Cette note est constituée d'un symbole de croix en exposant suivi de la séquence suivante : Includes naturally occurring and supplemental amounts. Sur la deuxième ligne se trouve un symbole de croix en exposant suivi de la séquence suivante : Comprend les quantités naturelles et supplémentées.
- a) Renseignements principaux et complémentaires déclarés dans le tableau des renseignements sur les aliments supplémentés
Comme dans le cas du TVN, la section 1 du TRAS, illustré à la Figure 1, indique les renseignements principaux qui doivent toujours figurer dans le TRAS et l'ordre dans lequel ils doivent être présentés. Il existe des exceptions liées aux formats simplifiés, y compris ceux des AS préemballés en portion individuelle et dans de petits emballages. Les renseignements requis et la façon de les exprimer se trouvent dans le tableau de l'article B.29.002 du RAD.
Des renseignements complémentaires peuvent être volontairement fournis, ou doivent être fournis dans la section 1 du TRAS si le règlement l'exige expressément (p. ex. pour les nutriments qui font l'objet d'une allégation). Si ces renseignements sont inclus dans la section 1 du TRAS, ils doivent être déclarés conformément au tableau du paragraphe B.29.003(1) du RAD.
- b) Renseignements sur les ingrédients supplémentaires fournis dans le tableau des renseignements sur les aliments supplémentés
Tout IS autorisé en vertu de la Liste des ingrédients supplémentaires autorisés, lorsqu'il est ajouté à un AS, doit être déclaré quantitativement dans la section « Supplémenté en » (section 3) du TRAS. Cet IS déclaré à la section « Supplémenté en » ne doit pas être déclaré à la section 1 du TRAS. Tous les IS doivent être indiqués à la section 3 du TRAS dans le même ordre qu'ils apparaissent dans la Liste des ingrédients supplémentaires autorisés.
Les exigences particulières à la déclaration des IS dans le TRAS sont énumérées ci-dessous.
- Lorsqu'un IS est ajouté à un AS, la quantité totale d'IS doit être déclarée dans la section « Supplémenté en » (section 3 du TRAS). Pour les IS avec une VQ établie, le % VQ doit également être indiqué à côté de la quantité d'IS déclarée sur l'étiquette (voir Figure 1).
- Si la quantité d'IS ne provient d'aucune autre source, alors la quantité déclarée concerne la quantité totale d'IS ajoutée, à l'exclusion des excédents appliqués. Voir les sections 4.2.5 et 4.2.6 pour obtenir des renseignements sur les excédents et les déficits, respectivement.
- En général, si d'autres sources contribuent à la quantité totale d'IS, qu'elles soient naturelles et/ou ajoutées provenant d'autres sources, la quantité déclarée est le total de toutes les sources, à l'exclusion des excédents appliqués.
- Lorsqu'un IS ajouté à un AS est un acide aminé, la quantité totale d'acides aminés libres (supplémentaires + libres d'origine naturelle + provenant d'autres sources) doit être déclarée dans la section « Supplémenté en » (section 3 du TRAS). Cette quantité ne comprend pas les acides aminés liés aux protéines.
- Lorsqu'un IS ajouté à un AS est un nutriment principal (p. ex. calcium, potassium), la quantité doit être déclarée dans la section « Supplémenté en » (section 3 du TRAS) et le nutriment principal ne doit pas être déclaré quantitativement ou afficher un % VQ dans la section 1 du TVN. La déclaration doit être conforme à la section 1) ci-dessus.
Exigences particulières à la déclaration de la vitamine A dans le TRAS
La vitamine A provient de deux formes alimentaires principales : (i) le rétinol et les esters de rétinyle et (ii) le bêta-carotène, qui sont autorisés comme IS dans la Liste des ingrédients supplémentaires autorisés. Les deux formes de vitamine A peuvent être présentes dans les AS en tant qu'IS ou à partir de sources non supplémentées (p. ex. présentes naturellement dans d'autres ingrédients alimentaires).
- (i) Lorsque la vitamine A est présente comme source non supplémentaire seulement
Dans le cas des AS, lorsque le produit ne contient que des sources non supplémentaires de vitamine A (p. ex. du bêta-carotène provenant du jus de légumes ou du rétinol provenant du lait), la quantité totale de vitamine A qu'elles contribuent peut être déclarée volontairement comme de la « vitamine A » en équivalents d'activité de rétinol (ÉAR) Note de bas de page 4 à la section 1 du TRAS ainsi que dans le % VQ.
- (ii) Lorsqu'une ou plusieurs formes de vitamine A sont ajoutées comme IS
Lorsqu'ils sont ajoutés à titre d'IS, le rétinol (et ses dérivés) et le bêta-carotène sont déclarés de la manière suivante :
- a) Lorsque les deux formes sont ajoutées à titre d'IS, elles doivent être déclarées séparément dans la section « Supplémenté en » (section 3 du TRAS), dans les unités appropriées, conformément à la colonne 3 de la Liste des ingrédients supplémentaires autorisés :
(i) « Vitamine A (rétinol) » en microgrammes (µg), et
(ii) « Vitamine A (bêta-carotène) » en microgrammes (µg) - b) Lorsqu'une seule source de vitamine A est ajoutée en tant qu'IS (p. ex. du rétinol, mais aucun bêta-carotène), la forme ajoutée doit être déclarée dans la section « Supplémenté en » (section 3 du TRAS). Si l'autre source de vitamine A (dans ce cas, le bêta-carotène) est également présente à partir de sources non supplémentaires, elle doit être déclarée séparément dans la section « Supplémenté en » du TRAS, conformément à la sous-section (ii)(a)(ii), même s'il n'y a pas de source supplémentaire de cette forme dans l'AS.
Même si les quantités absolues de chaque forme de vitamine A sont déclarées séparément à la section 3 du TRAS, une déclaration combinée du % VQ est requise (voir Figure 2). La déclaration du % VQ est fondée sur la somme des deux formes de vitamine A, en unités d'ÉAR, puisque la VQ pour la vitamine A est fondée sur la quantité totale des deux formes.

Figure - Équivalent textuel
Aligné à gauche sur la première ligne est un exemple flou d'un ingrédient figurant avant la vitamine A dans le tableau des renseignements sur les aliments supplémentés. Sous cette indication, un filet maigre s'étend sur la largeur du tableau.
Sur la ligne suivante figure la séquence Vitamine A, parenthèse ouvrante, Bêta-carotène, parenthèse fermante, suivie de caractères génériques prévus pour indiquer la quantité de vitamine A sous forme de bêta-carotène en microgrammes. Sous cette indication, un filet maigre s'étend sur la largeur du tableau.
Sur la ligne suivante figure la séquence Vitamine A, parenthèse ouvrante, Rétinol, parenthèse fermante, suivie de caractères génériques prévus pour indiquer la quantité de vitamine A sous forme de rétinol en microgrammes. Sous cette indication, un filet maigre s'étend sur la largeur du tableau. Des caractères génériques sont prévus à droite pour indiquer le pourcentage combiné de la valeur quotidienne de la vitamine A sous forme de bêta-carotène et de rétinol.
La ligne suivante montre un exemple flou d'un ingrédient figurant après la vitamine A dans le tableau des renseignements sur les aliments supplémentés.
- c) Règles d'arrondissement
Dans le cas des nutriments déclarés à la section 1 du TRAS (voir section 4.3.3.3 (b)), les règles d'arrondissement applicables aux aliments conventionnels s'appliquent. Consulter l'Outil d'étiquetage de l'industrie sur les règles d'arrondissement de l'ACIA pour obtenir de plus amples renseignements.
Les règles d'arrondissement pour les IS sont énoncées à l'article 18 dans le tableau suivant le paragraphe B.29.002(10) du RAD. Contrairement aux règles d'arrondissement pour les aliments conventionnels, la valeur déclarée d'un IS doit être arrondie au nombre entier le plus proche et exprimée de la manière indiquée dans la colonne 3 de la Liste des ingrédients supplémentaires autorisés.
Dans les cas où des quantités d'origine naturelle sont déclarées en combinaison avec les quantités supplémentaires présentes dans la section « Supplémenté en » (section 3 du TRAS), les règles d'arrondissement pour les IS s'appliquent.
- d) Modèles de tableaux des renseignements sur les aliments supplémentés
Le règlement comprend des exigences sur i) la présentation, l'emplacement et l'orientation du TRAS sur l'étiquette, ii) les options de modèles de TRAS (p. ex. lorsqu'un AS doit être préparé selon les directives fournies sur l'emballage ou combiné à d'autres ingrédients, ou vendu sous forme d'assortiment d'AS du même type) et iii) d'autres méthodes de présentation et les exceptions liées aux petits emballages.
Une hiérarchie de modèles et de tailles de TRAS est établie dans le règlement, dont le choix serait fondé sur la même règle que celle relative au TVN; c'est-à-dire, un maximum de 15 % de la surface exposée disponible doit être réservé au TRAS. S'il n'est pas possible d'afficher le TRAS sur 15 % ou moins de la surface exposée disponible de l'emballage, le règlement autoriserait d'autres méthodes de présentation du TRAS qui permettrait de le placer sur une étiquette mobile, un encart inséré dans l'emballage, le verso d'une étiquette, une étiquette dépliante, un manchon, une surenveloppe ou un collier. Toutefois, en tant que nouvelle règle visant uniquement les AS, le TRAS ne serait pas permis sur un encart ou sur le verso de l'étiquette si une ou plusieurs mises en garde sont requises sur le produit, car les renseignements contenus dans le TRAS doivent être accessibles au consommateur au moment de l'achat.
Afin de faciliter la conception de l'étiquette et d'aider l'industrie alimentaire et de l'emballage à respecter les spécifications relatives aux modèles de TRAS, Santé Canada a élaboré un Répertoire des modèles de tableaux des renseignements sur les aliments supplémentés qui sera incorporé par renvoi dans le RAD. Ce répertoire décrit les divers modèles de TRAS, ainsi que les exigences associées et fournit des exemples graphiques de modèles qui seraient acceptables pour les AS.
De plus, Santé Canada a créé un recueil de modèles qui comprend les formats autorisés du TRAS (voir section 4.3.6)
- e) Exemption relative aux petits emballages
En ce qui concerne les petits emballages (article B.029.018 du RAD), les AS qui présentent une surface exposée disponible inférieure à 100 cm2 ne seraient pas assujettis à l'exigence de porter un TRAS, sauf lorsque l'étiquette doit porter une liste des mises en garde ou lorsque l'aliment fait l'objet de l'une des déclarations sur l'étiquette ou dans l'annonce faite par le fabricant de l'aliment ou sous ses ordres se rapportant à toute indication de la valeur énergétique d'un aliment ou de sa teneur en un élément nutritif ou d'un ingrédient supplémentaire, toute propriété liée à la nutrition ou à la santé, ou toute mention, nom, logo, symbole, sceau d'approbation ou marque relative à la santé. Toutefois, ces déclarations ne comprennent pas les déclarations relatives à la mention « sans sucre » pour un produit qui satisfait pleinement aux conditions pertinentes énoncées à l'article 37 de l'Étiquetage nutritionnel - Tableau des mentions et des allégations autorisées concernant la teneur nutritive qui est incorporé par renvoi dans le RAD. Ces indications ne contiennent pas non plus de renseignements obligatoires, comme des déclarations obligatoires qui devraient être affichées sur l'étiquette du produit (p. ex. « contient de la caféine ») conformément à une condition d'utilisation prescrite dans la Liste des ingrédients supplémentaires autorisés.
Les petits emballages qui ne sont pas tenus de porter un TRAS, doivent cependant comporter sur le recto des indications sur la manière dont les acheteurs ou les consommateurs peuvent obtenir les renseignements qui devraient autrement figurer dans le TRAS. Les indications doivent comporter une adresse postale, une adresse de site Web ou un numéro de téléphone sans frais, et doivent être présentées en caractères d'au moins 8 points. Pour les petits emballages qui portent une déclaration relative à la mention « sans sucre », la déclaration elle-même doit respecter les exigences de lisibilité spécifiées (paragraphe B.29.018(3)) et l'étiquette doit inclure la valeur énergétique de l'aliment exprimée en Calories par portion indiquée et la teneur en polyalcools exprimée en grammes par portion indiquée, en respectant les exigences relatives à l'emplacement.
En vertu de l'article B.29.019 du RAD, lorsque le TRAS est requis sur un petit emballage, seule une version abrégée de ce dernier est requise. Le TRAS doit inclure la valeur énergétique, la teneur de tout nutriment ou IS faisant l'objet d'une déclaration liée à toute propriété nutritionnelle ou liée à la santé, tout polyalcool ajouté et tout IS pour lequel une mise en garde est requise sur l'étiquette de cet aliment. De plus, le TRAS doit inclure la teneur en gras saturés, en sucres ou en sodium si elle est égale ou supérieure au seuil applicable visé pour le symbole nutritionnel sur le devant de l'emballage.
4.3.1.2 Liste des mises en garde
Certains IS ou certaines quantités d'IS ajoutées aux AS peuvent présenter un risque pour la santé des Canadiens s'ils sont consommés de façon excessive ou s'ils sont consommés par des sous-populations vulnérables comme les enfants et les femmes enceintes ou qui allaitent. Par conséquent, les AS dont la teneur déclarée en IS est supérieure à certains seuils établis, comme précisés dans la Liste des ingrédients supplémentaires autorisés, doivent porter des mises en garde sur l'étiquette afin d'informer les consommateurs des risques potentiels (voir section 4.2.4).
Afin que les renseignements sur les mises en garde soient plus évidents pour les consommateurs, les mises en garde doivent être regroupées sous le titre « Attention » normalisé en caractères gras, (les options acceptables sont également l'en-tête accompagné d'un deux points - c'est-à-dire « Attention : »), d'une manière semblable à la déclaration de la liste des ingrédients des aliments préemballés. Dans le cas d'un assortiment, la liste des mises en garde doit indiquer clairement à quels AS de l'assortiment s'appliquent la liste (voir la section 4.3.4 pour obtenir des renseignements sur les assortiments). La Figure 3 ci-dessous montre un exemple de liste de mises en garde sur une étiquette d'AS.
L'article B.29.020 du RAD précise les exigences relatives à la manière dont la liste de mises en garde sur les AS est affichée, qui comprend ce qui suit :
- la liste des mises en garde relatives à un AS doit toujours être adjacente au TRAS, dans la même langue (p. ex. si le TRAS est bilingue, la liste des mises en garde doit également être la version bilingue), et sans aucun texte intercalé entre le titre et la première mise en garde;
- la liste des mises en garde doit être fournie en français et en anglais;
- il existe des exigences propres à la dimension, à la lisibilité et à l'apparence de la liste des mises en garde sur l'étiquette, conformément aux exigences d'étiquetage relatives à la liste des ingrédients et aux allergènes (consulter l'article B.01.008.1 du RAD).

Figure - Équivalent textuel
Il s'agit d'une boîte rectangulaire blanche encadrée d'une mince ligne noire. Tout le texte à l'intérieur de la boîte est horizontal, de couleur noir et la première lettre de chaque phrase est en majuscule. Un symbole de puce sépare chaque mise en garde de la liste.
La première ligne commence par le mot Caution, en gras, suivi de deux points. Celui-ci est suivi de la mention Not recommended for those under 14 years old, pregnant or breastfeeding women or individuals sensitive to caffeine. Cette phrase est suivie d'une puce et de la mention Do not drink more than 1 serving per day. Cette phrase est suivie d'une puce et de la mention Do not drink on the same day as any other supplemented foods or supplements with the same supplemental ingredients.
Le texte en français commence à la ligne suivante par le mot Attention, en gras, suivi de deux points. Celui-ci est suivi de la mention Déconseillé aux individus de moins de 14 ans, aux femmes enceintes ou qui allaitent ou aux personnes sensibles à la caféine. Cette phrase est suivie d'une puce et de la mention Ne pas boire plus de 1 portion par jour. Cette phrase est suivie d'une puce et de la mention Ne pas boire le même jour que d'autres aliments supplémentés ou suppléments contenant les mêmes ingrédients supplémentaires.
4.3.1.3 Identifiant des aliments supplémentés avec mise en garde
Dans le cas des AS contenant un ou plusieurs IS qui nécessitent des mises en garde conformément à la Liste des ingrédients supplémentaires autorisés, un identifiant des aliments supplémentés avec mise en garde doit être affiché sur l'EP. Cela répond aux recherches auprès des consommateurs qui indiquent que les Canadiens trouvent utile de voir un étiquetage de mise en garde sur le devant des emballages des AS.
Santé Canada a limité l'utilisation de l'identifiant des aliments supplémentés avec mise en garde aux AS qui portent une mise en garde. Conformément à l'article B.29.024 du RAD, il est interdit d'étiqueter un AS avec l'identifiant des aliments supplémentés avec mise en garde à moins que l'aliment ne soit tenu d'afficher une ou plusieurs mises en garde sur l'étiquette. Cela permet de s'assurer que l'identifiant des aliments supplémentés avec mise en garde ou toute illustration graphique d'un aspect similaire ne sont pas utilisés pour promouvoir la consommation d'AS ou pour embrouiller les consommateurs quant à la signification de l'identifiant des aliments supplémentés avec mise en garde. En sensibilisant les consommateurs à cette information, ces derniers pourront distinguer plus facilement les AS qui nécessitent des mises en garde des autres AS et seront portés à chercher des renseignements supplémentaires sur l'étiquette afin de déterminer si le produit est approprié et sans danger pour eux.
L'identifiant des aliments supplémentés avec mise en garde doit être placé dans un endroit bien en vue et sans encombrement de l'EP, être affiché en noir et blanc et inclure un point d'exclamation sur le côté gauche, le ou les mots « Supplémenté » ou « Supplémenté / Supplemented », ainsi qu'une attribution à Santé Canada; tout cela entouré d'une bordure en ligne continue (voir Figure 4).
De plus, conformément à l'article B.29.025 du RAD, l'étiquette de l'AS ne doit pas comporter de représentation telle qu'un mot, une expression, une illustration, un signe, une marque, un symbole ou un dessin qui ressemble à l'identifiant des aliments supplémentés avec mise en garde. Cette interdiction ne s'applique pas à un symbole nutritionnel sur le devant de l'emballage lorsqu'il est exigé sur une étiquette d'un AS conformément au paragraphe B.29.025(2).

Figure - Équivalent textuel
Cette illustration représente un identifiant des aliments supplémentés avec mise en garde paraissant dans l'espace principal du produit préemballé. Cet identifiant est bilingue, le texte anglais précédant le texte français. Il s'agit d'une boîte rectangulaire blanche encadrée d'une mince ligne noire. Centré verticalement et du côté gauche de la boîte se trouve un gros point d'exclamation noir. À la droite du point d'exclamation se trouve une barre horizontale. Il y a un petit espace blanc entre le point d'exclamation et la barre et entre l'extrémité de la barre et la mince ligne noire du rectangle blanc. La barre est de couleur noire et indique le mot « Supplemented » suivi d'une barre oblique et du mot « Supplémenté ». Les deux mots, en blanc, figurent en caractères gras et en lettres minuscules, sauf pour ce qui est de la première lettre de chacun de ces mots qui figure en lettres majuscules. Les mots « Health Canada » sont suivis d'une barre oblique et des mots « Santé Canada ». L'ensemble de ces mots, en noir, se trouve centré en-dessous de la barre et figure en lettres minuscules, sauf pour ce qui est de la première lettre de chacun de ces mots qui figure en lettres majuscules.
Les modèles de l'identifiant des aliments supplémentés avec mise en garde autorisés sont précisés dans une nouvelle annexe du RAD (annexe K.2). Comme il est prescrit aux articles B.29.021 à B.29.023 du RAD, des exigences particulières existent quant à l'apparence, à l'emplacement et à la dimension de l'identifiant sur les étiquettes d'AS. La dimension de l'identifiant serait proportionnelle à la superficie de la principale surface exposée de l'emballage, et diminuerait selon celle-ci.
Afin d'aider les concepteurs d'étiquettes et l'industrie alimentaire et de l'emballage à respecter les spécifications liées à l'identifiant, la hiérarchie des modèles et des dimensions est précisée dans le Répertoire des spécifications sur l'identifiant des aliments supplémentés avec mise en garde.
De plus, Santé Canada a créé un recueil de modèles qui comprend les formats autorisés de l'identifiant des aliments supplémentés avec mise en garde (voir section 4.3.6).
4.3.2 Étiquetage nutritionnel sur le devant de l'emballage
Les AS vendus dans de petits emballages dont la surface exposée disponible est inférieure à 100 cm2 sont exemptés de l'obligation de porter un symbole nutritionnel sur le devant de l'emballage, sauf si l'AS fait l'objet d'une déclaration, sur l'étiquette ou dans toute annonce faite ou placée par le fabricant ou sous ses ordres, concernant : une déclaration de la valeur énergétique de l'AS ou de la quantité d'un nutriment ou d'un IS; toute propriété nutritionnelle ou liée à la santé; ou toute mention, nom, logo, symbole, sceau d'approbation ou marque liés à la santé. Dans ce cas, cependant, si l'identifiant de l'aliment supplémenté avec mise en garde est requis sur l'étiquette de l'AS, l'exemption pour les petits emballages par rapport au symbole nutritionnel sur le devant de l'emballage s'applique toujours. Par exemple, si un AS dans un petit emballage porte une allégation, est riche en sucre et nécessite des mises en garde et l'identifiant de l'aliment supplémenté avec mise en garde, l'étiquette devra comporter la liste des mises en garde, l'identifiant de l'aliment supplémenté avec mise en garde et le TRAS mais pas le symbole nutritionnel sur le devant de l'emballage.
4.3.3 Mention des éléments nutritifs à l'extérieur du tableau des renseignements sur les aliments supplémentés
Il est permis de déclarer de façon quantitative la valeur énergétique et la quantité d'éléments nutritifs par portion indiquée à l'extérieur du TRAS, sur les étiquettes ou dans les annonces de l'AS, à condition que les unités et les exigences linguistiques précisées à l'article B.01.301 du RAD soient respectées. Pour obtenir plus d'information, consulter l'Outil d'étiquetage pour l'industrie de l'ACIA sur les mentions quantitatives à l'extérieur du tableau de la valeur nutritive.
4.3.4 Mention des ingrédients supplémentaires à l'extérieur du tableau des renseignements sur les aliments supplémentés
Il est permis de déclarer des IS de façon quantitative à l'extérieur du TRAS, sur les étiquettes ou dans les annonces, en respectant les exigences relatives à toute déclaration concernant les IS, conformément aux articles B.29.026 à B.29.029, et conformément aux déclarations volontaires et aux allégations sur les aliments (consulter la section 4.4.7), et à condition que les unités et les exigences linguistiques précisées à l'article B.01.301 du RAD soient respectées.
4.3.5 Assortiments
Les produits préemballés contenant des assortiments d'AS sont autorisés en vertu du Règlement sur les aliments supplémentés. Les paragraphes B.29.005(2) et B.29.005(3) du RAD comprennent les exigences relatives à un produit préemballé contenant un assortiment d'AS du même type. Dans le cas d'un produit préemballé contenant un assortiment d'AS, l'emballage extérieur du produit doit comprendre le TRAS et, le cas échéant, une liste de mises en garde et un identifiant des aliments supplémentés avec mise en garde. Lorsque les renseignements pour chaque type d'AS contenu dans le produit sont différents et que la portion typique est constituée d'un seul de ces aliments, un format agrégé doit être utilisé pour présenter ces renseignements dans le TRAS pour chaque AS contenu dans le produit. Dans le cas où les renseignements contenus dans le TRAS pour tous les AS du même type dans l'assortiment sont les mêmes, un format standard, horizontal ou linéaire, selon le cas, en fonction de la surface d'affichage disponible du produit, est requis pour le TRAS. Pour les assortiments d'AS du même type, lorsqu'une portion est composée de plusieurs AS dans l'emballage, les informations peuvent être présentés pour chaque AS en utilisant un format agrégé ou une valeur composite en utilisant un format standard, horizontal ou linéaire, selon le cas, en fonction de la surface d'affichage disponible du produit. Les produits préemballés contenant des assortiments d'AS et d'autres aliments sont également autorisés. Toutes les autres exigences applicables en matière d'étiquetage, comme le TVN, s'appliqueraient aux autres aliments qui ne sont pas des AS dans l'assortiment.
4.3.6 Recueil de modèles de tableaux des renseignements sur les aliments supplémentés, d'identifiants des aliments supplémentés avec mise en garde et de listes des mises en garde
Pour aider les concepteurs d'étiquettes et les intervenants des secteurs de l'alimentation et de l'emballage à se conformer aux spécifications relatives au format, nous avons créé un recueil de modèles. Les modèles sont des illustrations graphiques en taille réelle des divers formats de tableaux des renseignements sur les aliments supplémentés et les formes d'identifiants d'aliments supplémentés avec mise en garde pour les aliments supplémentés autorisées par le RAD.
Pour ce qui est de la liste des mises en garde, il y a des variations qui pourraient répondre aux exigences graphiques détaillées dans le RAD. Deux exemples ont été fournis dans le recueil pour démontrer des variations acceptables.
Le recueil de modèles a été créé à l'aide d'Adobe InDesign CC 2020. Il est disponible dans les formats suivants:
- INDD pour les fichiers ouverts et modifiés dans InDesign CC 2020 (ou version plus récente)
- IDML pour les fichiers ouverts et modifiés dans les versions antérieures d'InDesign (CS4 et versions ultérieures)
Pour obtenir une copie électronique du document, veuillez envoyer un courriel à smiu-ugdi@hc-sc.gc.ca avec la ligne d'objet "Demande pour le recueil d'étiquetage pour les aliments supplémentés".
4.3.7 Allergènes prioritaires, sources de gluten et sulfites
Comme tous les aliments, les AS doivent être conformes aux exigences en matière d'étiquetage des aliments. Celles-ci comprennent les exigences d'étiquetage améliorées portant sur les allergènes prioritaires, les sources de gluten et les sulfites ajoutés précisées aux articles B.01.010.1 à B.01.010.3 du RAD.
Les fabricants d'AS sont fortement incités à inclure aux étiquettes des mises en garde sur les allergènes alimentaires afin d'alerter le consommateur de la présence fortuite possible d'allergènes prioritaires dans l'aliment (article B.01.010.4 du RAD). La page Web de Santé Canada, L'utilisation des mises en garde relatives aux allergènes alimentaires sur l'étiquette des aliments préemballés, fournit des conseils sur l'utilisation appropriée des mises en garde sur l'étiquette des aliments préemballés.
4.3.8 Noms d'aliments supplémentés par rapport aux noms d'aliments normalisés
Comme tous les aliments, les AS doivent respecter les exigences réglementaires concernant les noms usuels pour les aliments normalisés des titres 2 à 14 et 17 à 22 de la partie B du RAD. Pour de plus amples renseignements, veuillez vous référer aux directives de l'ACIA concernant le nom usuel sur les étiquettes des produits alimentaires. Il est précisé que le nom usuel pour les aliments normalisés modifié doit :
- indiquer clairement aux consommateurs que l'aliment ainsi décrit ne satisfait pas à la norme;
- expliquer aux consommateurs en quoi l'aliment ne satisfait pas à la norme, et ce, de façon claire et évidente.
Les noms de marque et les marques de commerce utilisés pour commercialiser un produit peuvent être utilisés en plus de ces derniers, et doivent être utilisés en conformité avec le paragraphe 5(1) de la LAD et du paragraphe 6(1) de la LSAC.
4.4 Exigences réglementaires et directives relatives à l'utilisation des déclarations et des allégations liées à la nutrition et à la santé sur les aliments supplémentés
Aux fins du présent document, les déclarations et allégations liées à la nutrition et à la santé font référence aux allégations relatives à la teneur en éléments nutritifs, à la santé (y compris les allégations fonctionnelles et celles liées à la réduction du risque de maladies et thérapeutiques), aux déclarations quantitatives, toute mention, tout logo, symbole, sceau d'approbation et à toute marque liés à la santé sur l'étiquette d'un aliment, ou dans l'annonce faite pour un aliment qui est faite ou placée à la discrétion du fabricant.
Comme pour tous les aliments, les déclarations et les allégations liées à la nutrition et à la santé peuvent être faites sur l'étiquette ou dans les annonces d'AS sur une base volontaire. Cependant, lorsqu'elles sont faites, elles doivent respecter les exigences réglementaires qui s'appliquent à eux et doivent se conformer à toute directive applicable. Afin de prendre des décisions éclairées au sujet de leur santé, les consommateurs devraient toujours recevoir une information juste et équilibrée sur les bienfaits et les risques associés aux produits annoncés.
En vertu du paragraphe 5(1) de la LAD et du paragraphe 6(1) de la LSAC, un aliment ne doit pas être annoncé d'une manière qui est fausse ou qui pourrait créer une fausse impression en ce qui concerne le caractère, la valeur, la quantité, la composition, le mérite ou l'innocuité du produit. Les exigences générales relatives aux déclarations et aux allégations relatives à la nutrition et à la santé figurant sur l'étiquette ou dans une annonce pour des aliments préemballés s'appliquent également aux AS. Afin de s'assurer que les consommateurs disposent des renseignements appropriés pour faire des choix alimentaires éclairés, et pour se conformer au paragraphe 5(1) de la LAD, des dispositions sur les aliments du RAD, du paragraphe 6(1) de la LSAC, et à toute directive applicable, Santé Canada recommande que les personnes qui vendent des aliments au moyen du commerce électronique mettent à la disposition des consommateurs les renseignements qui seraient autrement requis sur l'étiquette au moment de l'achat.
Ci-dessous se trouvent des directives générales sur l'utilisation des allégations liées à la nutrition et à la santé relatives aux AS ainsi que les exigences réglementaires associées.
4.4.1 Allégations santé générales
Les allégations santé générales sont des déclarations visant à promouvoir une bonne santé par une saine alimentation ou à fournir des lignes directrices alimentaires. Ces allégations sont générales et ne font pas référence à un effet précis sur la santé. Les déclarations qui comportent des termes tels que « santé », « équilibré » ou des déclarations ayant une signification semblable en sont des exemples.
Établir un lien entre l'aliment et l'un des énoncés d'orientation du Guide alimentaire canadien représente la meilleure façon d'expliquer les allégations comportant le terme « santé » figurant sur les aliments. Une mention se référant au mot « santé » sur l'étiquette d'un aliment ne serait pas acceptable sur les boissons dont la valeur énergétique provient principalement de sucres, puisque l'on recommande de limiter la consommation de boissons sucrées, y compris de jus de fruits. Le Guide alimentaire canadien recommande de consommer des légumes et des fruits plus souvent que du jus. De même, la consommation d'une variété d'aliments permet d'obtenir un apport quotidien équilibré en éléments nutritifs. Aucun aliment unique ne peut être qualifié « d'équilibré ». Une allégation laissant entendre que la consommation d'un produit permet d'obtenir un apport quotidien équilibré en éléments nutritifs est inacceptable. Pour éviter de créer des impressions fausses, trompeuses ou mensongères à propos d'un aliment et sa consommation, il est recommandé que le sens des mots descriptifs utilisés en relation avec un aliment soit clair. Des mots tels que « équilibré » peuvent créer une impression erronée s'ils ne sont pas clarifiés davantage.
4.4.2 Allégations relatives à la teneur en éléments nutritifs
Les allégations relatives à la teneur en éléments nutritifs sont des déclarations qui caractérisent la valeur énergétique d'un aliment ou la quantité d'un élément nutritif contenu dans un aliment, comme « sans », « réduite », « source » et « excellente source ». Les conditions liées à ces allégations sont précisées aux articles D.01.004 et D.02.002, ainsi que dans l'Étiquetage nutritionnel - Tableau des mentions et des allégations autorisées concernant la teneur nutritive qui est incorporé par renvoi dans le RAD. Les exigences particulières concernant les allégations relatives à la teneur en vitamines et des minéraux sont énoncées dans les lignes directrices de l'ACIA.
À moins qu'un règlement ne le permette, aucune autre allégation sur la teneur en éléments nutritifs ne peut être faite qui caractérise la valeur énergétique de l'aliment ou la quantité d'un élément nutritif présent dans l'aliment (consulter le paragraphe B.01.502(1) du RAD).
4.4.3 Types d'allégations santé et exigences réglementaires associées
Toute déclaration figurant sur l'étiquette ou utilisée dans l'annonce d'un produit qui affirme, suggère ou implique qu'il existe un lien entre la consommation d'un aliment ou d'un ingrédient d'un aliment et la santé d'une personne est considérée comme une allégation santé. Certaines étiquettes d'aliments portent des énoncés sur les bienfaits des aliments pour la santé, comme « Une alimentation saine pauvre en gras saturés et en gras trans peut réduire le risque de maladie du cœur ». Ce type d'énoncé est un exemple d'allégation santé.
Pour de plus amples renseignements sur les différents types d'allégations santé, consulter la page Allégations santé. Les allégations santé sont facultatives sur les aliments. Cependant, lorsqu'elles sont faites, les allégations doivent être véridiques et non trompeuses, conformément au paragraphe 5(1) de la LAD et au paragraphe 6(1) de la LSAC. Cela signifie que les fabricants et les importateurs doivent posséder des preuves scientifiques à l'appui d'une allégation santé avant de l'utiliser sur les étiquettes d'aliments ou dans les annonces.
Conformément à l'article 3 de la LAD, les allégations, explicites ou implicites, liées à des maladies et à des états de santé énumérées à l'annexe A.1 de la LAD sont interdites sur les aliments, y compris les AS, à moins qu'elles ne soient déjà autorisées dans le RAD (articles B.01.600 - B.01.603). Ces allégations sont assujetties à une évaluation préalable à la mise en marché qui impliquerait la préparation et l'envoi d'une demande d'approbation à la Direction des aliments de Santé Canada, conformément aux Guides pour la préparation de demandes d'approbation d'allégations santé. Si l'allégation est approuvée par Santé Canada, une modification réglementaire sera apportée afin de permettre expressément ladite allégation, laquelle sera ensuite ajoutée au tableau suivant l'article B.01.603 du RAD.
Comme dans le cas des aliments conventionnels, les allégations santé qui ne font pas référence à des maladies et à des conditions de santé énumérées à l'annexe A.1 de la LAD ne sont pas assujetties à l'évaluation préalable à la mise en marché obligatoire. Toutefois, une demande peut être présentée volontairement pour solliciter une évaluation des allégations santé par la Direction des aliments de Santé Canada (voir la section 4.4.4 pour plus de renseignements sur la justification des allégations santé). Pour toute allégation qui n'a pas été examinée et acceptée par Santé Canada, les fabricants et les distributeurs d'aliments doivent divulguer les données probantes à l'appui de ces allégations sur demande de l'ACIA.
4.4.4 Justification des allégations santé
Comme pour tous les aliments, les allégations santé utilisées sur les étiquettes d'AS ou dans les annonces doivent être justifiées selon les normes de preuve de Santé Canada relatives aux allégations santé sur les aliments, comme il est indiqué dans les Guides pour la préparation de demandes d'approbation d'allégations santé. Voir la section 4.4.7 pour connaître les exigences et les restrictions relatives aux allégations propres aux AS.
Les demandes d'approbation d'allégations santé préparées conformément aux Guides pour la préparation de demandes d'approbation d'allégations santé peuvent être envoyées à la Direction des aliments de Santé Canada afin d'obtenir un avis sur la validité d'une allégation. Les allégations santé évaluées et acceptées sont ajoutées à la liste des allégations santé évaluées et acceptées et peuvent être utilisées sur tous les aliments répondant aux conditions d'utilisation énoncées dans le résumé de l'évaluation applicable. D'autres allégations fonctionnelles acceptables sont publiées sur le site Web de l'ACIA. Pour faire l'une de ces allégations acceptées, le produit doit satisfaire à toutes les conditions d'utilisation requises.
Les allégations fonctionnelles pour les nutriments, y compris les IS qui sont des nutriments, peuvent être faites pour des AS et doivent être faites conformément aux conditions d'utilisation prévues dans le RAD (articles B.01.311, B.01.312, D.01.004, D.01.006, D.02.002 et D.02.004). Des renseignements supplémentaires sur les allégations nutritionnelles fonctionnelles et les conditions d'utilisation acceptables se trouvent sur le site Web de l'ACIA. Pour les nouvelles allégations nutritionnelles fonctionnelles, il existe un processus abrégé pour documenter les preuves à l'appui de celles qui répondent aux critères précisés (consulter l'information sur l'acceptabilité de nouvelles allégations nutritionnelles fonctionnelles). Les allégations fonctionnelles pour d'autres ingrédients, y compris les IS qui ne sont pas des nutriments, sont assujetties aux exigences et aux directives énoncées aux sections 4.4.3 et 4.4.5.
Afin de s'assurer que les lois, les règlements et les lignes directrices applicables sont respectés ou pour les fabricants ou les distributeurs qui ne sont pas certains de la nature de l'allégation qu'ils prévoient utiliser, consulter la Direction des aliments de Santé Canada. Les questions concernant les allégations santé peuvent être adressées à healthclaims-allegationssante@hc-sc.gc.ca. Les demandes de consultation préalables à une demande d'examen d'une allégation santé peuvent être adressées à smiu-ugdi@hc-sc.gc.ca.
4.4.5 Lignes directrices générales au sujet des allégations santé
Lorsqu'il s'agit de formuler une allégation santé véridique qui n'est ni trompeuse ni mensongère, conformément au paragraphe 5(1) de la LAD et au paragraphe 6(1) de la LSAC, rédiger un libellé approprié en accord avec les preuves à l'appui constitue un volet important.
Afin d'aider les consommateurs à comprendre les bienfaits allégués, les produits dont les allégations sont fondées doivent porter sur leur étiquette des déclarations qui :
- établissent un lien entre chaque effet allégué et une ou plusieurs substances particulières du produit;
- indiquent la quantité de substance ou de produit nécessaire pour obtenir l'effet allégué ainsi que la teneur de la substance contenue dans une portion de l'aliment. Lorsqu'une quantité quotidienne ou un apport quotidien recommandé a été établi pour la substance associée à l'effet allégué, ces valeurs peuvent être exprimées sous forme de pourcentage ou de fraction;
- expriment les effets allégués en termes précis plutôt qu'en termes généraux, de sorte que ces effets soient à la fois mesurables et quantifiables, attestant leur validité scientifique. Les allégations énonçant un effet particulier fournissent aux consommateurs des renseignements plus utiles et sont moins susceptibles d'être trompeuses ou mal comprises qu'une allégation portant sur un effet général ou de large étendue.
4.4.6 Déclarations relatives aux acides aminés sur les aliments supplémentés
En vertu du Règlement sur les aliments supplémentés, tous les AS sont exemptés du paragraphe B.01.305(2) du RAD. Cela signifie que les déclarations concernant les acides aminés utilisés à titre d'IS conformément à la Liste des ingrédients supplémentaires autorisés sont acceptables sur les étiquettes d'AS qui ne satisfont pas à l'exigence relative à une allégation « source de protéine ». Il n'est pas nécessaire, pour les AS portant une déclaration sur l'étiquette concernant les acides aminés ajoutés à titre d'IS, d'inclure une déclaration de la quantité d'histidine, d'isoleucine, de leucine, de lysine, de méthionine, de phénylalanine, de thréonine, de tryptophane et de valine contenue dans l'aliment, à moins que cet acide aminé particulier n'ait été ajouté en tant qu'IS. Pour connaître les restrictions qui s'appliquent aux allégations et aux déclarations portant sur la nutrition et la santé sur les AS, consulter la section 4.4.7.
Malgré l'exemption ci-dessus, les AS sont assujettis au paragraphe B.01.305(1) du RAD; ils doivent satisfaire aux conditions de l'allégation « source de protéine » énoncées dans l'Étiquetage nutritionnel - Tableau des mentions et des allégations autorisées concernant la teneur nutritive afin de pouvoir porter des déclarations ou des allégations concernant les protéines sur leur étiquette.
4.4.7 Restrictions particulières à l'utilisation d'allégations et autres déclarations sur les aliments supplémentés
Comme il a été mentionné à la section 4.4, les exigences générales relatives aux allégations sur les aliments préemballés s'appliquent aux AS. Toutefois, certaines déclarations, implicites ou explicites, ne sont pas permises sur l'étiquette ou dans les annonces de certains AS.
Dans les sections qui suivent, le terme « déclaration » désigne toute mention ou toute allégation relative à la nutrition et à la santé, qui indique expressément ou implicitement que l'aliment a des propriétés particulières liées à la nutrition ou à la sante, y compris les logos, les symboles, les noms de marque, les sceaux d'approbation et les marques, qui sont utilisées sur les étiquettes ou dans les annonces d'AS, sauf indication contraire.
4.4.7.1 Allégations non autorisées concernant les ingrédients supplémentaires pour lesquels une mise en garde est requise
Le paragraphe B.01.311(3) du RAD permet l'utilisation, sur l'étiquette ou dans l'annonce d'un aliment, d'une déclaration ou d'une allégation selon laquelle un nutriment contenu dans l'aliment est généralement reconnu comme aidant à entretenir les fonctions de l'organisme nécessaires au maintien d'une bonne santé et à la croissance et au développement normaux. Il est en outre précisé dans le document d'orientation que les allégations nutritionnelles fonctionnelles générales qui font référence à un nutriment comme contribuant au maintien de la santé et à la croissance et au développement normaux peuvent être faites à propos de tout nutriment (p. ex. « Le calcium contribue au maintien de la santé » et « le calcium contribue à la croissance et au développement »). De plus, les allégations concernant le ou les rôles particuliers de certains nutriments énumérés dans le Tableau des allégations nutritionnelles fonctionnelles acceptables (p. ex. « Le calcium aide à la formation et au maintien des os et des dents » peuvent être utilisées seules ou jumelées aux allégations nutritionnelles fonctionnelles générales.
Afin de fournir aux consommateurs des renseignements adéquats pour faire des choix éclairés au sujet des aliments qu'ils consomment, les paragraphes B.029.026(1) et B.29.026(2) du RAD exigent que, si un IS qui est un nutriment nécessite qu'une mise en garde soit indiquée sur l'étiquette conformément à la colonne 4 de la Liste des ingrédients supplémentaires autorisés, toute déclaration ou allégation à propos de ce nutriment qui est un IS comme aidant au maintien d'une bonne santé est interdite à moins qu'elle ne soit accompagnée d'une déclaration ou d'une allégation sur l'effet particulier de ce nutriment dans le maintien des fonctions de l'organisme, qui est nécessaire au maintien d'une bonne santé. L'énoncé ci-joint tient compte du rôle particulier scientifiquement reconnu que chaque nutriment a dans le maintien de la bonne santé, tel qu'il est indiqué dans le Tableau des allégations nutritionnelles fonctionnelles acceptables.
Cette interdiction ne s'applique pas aux IS qui sont des nutriments si leur ajout aux AS ne nécessite pas de mise en garde conformément à la colonne 4 de la Liste des ingrédients supplémentaires autorisés.
Par exemple, si la quantité déclarée de calcium ajouté à un AS est supérieure à 58 mg par portion, l'étiquette de cet aliment doit afficher une liste des mises en garde conformément à la colonne 4 de la Liste des ingrédients supplémentaires autorisés. Dans ce cas, l'allégation nutritionnelle fonctionnelle générale « Le calcium contribue au maintien de la santé » peut être utilisée sur l'étiquette de l'aliment ou dans l'annonce pour l'aliment, si elle est accompagnée d'une déclaration sur le rôle particulier du calcium dans le maintien des fonctions du corps, par exemple « Le calcium favorise la formation et le maintien de bons os et de dents saines ». Il serait également acceptable d'utiliser cette dernière allégation particulière seule.
À l'inverse, si la quantité déclarée de calcium ajouté en tant qu'IS dans un AS est inférieure à 58 mg, l'allégation générale « Le calcium contribue au maintien de la santé » peut être utilisée sur l'étiquette de l'AS, avec ou sans l'allégation fonctionnelle particulière « Le calcium favorise la formation et le maintien des os et de dents saines ».
Lorsque les deux énoncés apparaissent sur l'étiquette ou dans l'annonce d'un AS, ils doivent être en caractères de même taille et aussi bien en vue, et doivent apparaître l'un à côté de l'autre sans qu'aucun texte imprimé ou écrit ni aucun signe graphique ne soient intercalés entre eux. Si les deux déclarations sont faites dans une annonce radiophonique ou dans la partie audio d'une annonce télévisée pour l'AS, elles devraient être faites l'une après l'autre. Si elles sont faites dans la partie visuelle d'une annonce télévisée pour l'AS, elles doivent apparaître simultanément et pendant la même période, l'une à côté de l'autre, sans aucun texte imprimé, écrit ni aucun signe graphique ne soient intercalés et elles doivent être présentées en lettres de même taille et aussi bien en vue (paragraphe B.029.026(3) du RAD).
4.4.7.2 Allégations interdites sur les aliments supplémentés qui ne doivent pas être consommés par un certain groupe d'âge
Pour les AS qui doivent porter une mise en garde indiquant que l'aliment n'est pas destiné à être consommé par un groupe de personnes de moins de 18 ans (p. ex. individus de moins de 14 ans), une allégation ou une déclaration indiquant qu'un nutriment contenu dans l'aliment est habituellement reconnu comme une aide au maintien des fonctions de l'organisme nécessaires à la croissance et au développement normaux ne serait pas permise sur l'étiquette ou dans l'annonce d'un AS (article B.29.027 du RAD). Les bienfaits pour la santé qui font référence à la croissance et au développement sont habituellement plus pertinents pour les sous-populations plus jeunes et ne seraient pas appropriés lorsque les aliments ne sont pas recommandés pour ces sous-populations.
Par exemple, si la quantité de vitamine D déclarée sur l'étiquette d'un AS est supérieure à 7 µg par portion, la mise en garde « Déconseillé aux individus de moins de 14 ans » serait requise conformément à la colonne 4 de la Liste des ingrédients supplémentaires autorisés. Dans ce cas, l'allégation nutritionnelle fonctionnelle générale « La vitamine D contribue à la croissance et au développement normaux » et l'allégation fonctionnelle particulière sur le rôle de la vitamine D dans le maintien des fonctions de l'organisme telles qu'elles sont énumérées dans le Tableau des allégations nutritionnelles fonctionnelles acceptables (p. ex. La vitamine D aide à la formation des os et des dents) ne serait pas permise sur l'étiquette ou dans l'annonce de l'AS.
4.4.7.3 Allégations interdites sur les aliments supplémentés portant la mention « Teneur élevée en caféine »
En vertu du paragraphe B.29.028(1) du RAD sont interdites, sur l'étiquette ou dans l'annonce d'un AS qui doit porter la mention « Teneur élevée en caféine », comme indiqué à la colonne 5 de la Liste des ingrédients supplémentaires autorisés portant sur la caféine , toutes déclarations, implicites ou explicites, concernant les vitamines ou les minéraux nutritifs contenus dans les AS. Les déclarations qui affirment ou laissent entendre que l'AS est une source d'éléments nutritifs essentiels comme des vitamines et des minéraux nutritifs, ainsi que les allégations (générales et particulières) relatives à un nutriment contenu dans l'aliment comme une aide au maintien des fonctions de l'organisme nécessaires au maintien d'une bonne santé et à la croissance et au développement normaux, donnent l'impression que le produit peut être consommé à long terme dans le cadre d'un régime alimentaire quotidien. Ces déclarations ne conviennent pas aux produits à teneur élevée en caféine. Conformément au paragraphe B.29.028(2) du RAD, cette interdiction ne s'applique pas à la déclaration d'une vitamine dans la liste des ingrédients ou dans le TRAS, ni à la déclaration d'un minéral nutritif dans la liste des ingrédients, le symbole nutritionnel sur le devant de l'emballage ou dans le TRAS.
Dans la Liste des ingrédients supplémentaires autorisés, la colonne 2 exclut les produits qui font l'objet de l'une des déclarations suivantes, explicites ou implicites, sur l'étiquette d'un AS ou dans une annonce publicitaire pour un AS qui est tenu de porter la mention « Teneur élevée en caféine », comme indiqué dans la colonne 5 de la Liste portant sur la caféine :
- a) Toute déclaration relative aux bienfaits associés à la consommation d'un AS pour améliorer la performance physique (p. ex. l'endurance, la récupération, l'aérobie, l'anaérobie, la puissance, la force, la performance au cours de la pratique d'un sport) avant, pendant ou après l'activité physique. La consommation de produits à teneur élevée en caféine dans un contexte de performance physique n'est pas recommandée, car celle-ci pourrait entraîner des effets indésirables, qui peuvent être plus prononcés chez les personnes sensibles à la caféine ou celles qui sont peu exposées à la caféine. (Rodriguez et coll., 2009, Grinberg et coll., 2022);
- b) Toute déclaration quant à la capacité d'hydratation ou de remplacement d'électrolytes du produit. Par exemple, la mention « contient des électrolytes » est interdite. Les déclarations selon lesquelles les boissons à teneur élevée en caféine peuvent être utilisées pour l'hydratation ou le remplacement d'électrolytes ne correspondent pas aux types de produits dans lesquels la caféine est permise et aux conditions d'utilisation décrites dans la Liste des ingrédients supplémentaires autorisés (p. ex. un avertissement visant à limiter le nombre de portions pouvant être consommées par jour).
4.4.7.4 Restrictions relatives à la dimension des allégations acceptées pour les AS portant un identifiant des aliments supplémentés avec mise en garde
Conformément à l'article B.29.029 du RAD, toute déclaration figurant sur l'étiquette des AS qui portent un identifiant des aliments supplémentés avec mise en garde, conformément à l'article B.29.021 du RAD, est assujettie à des restrictions relatives à la dimension :
- a) Lorsque ladite déclaration est affichée dans un EP où un identifiant des aliments supplémentés avec mise en garde est présent :
- la hauteur des lettres majuscules de la déclaration ne doit pas être supérieure à deux fois la hauteur des lettres majuscules (en excluant les accents) de l'identifiant des aliments supplémentés avec mise en garde, à l'exception des lettres des mots « Santé Canada » et « Health Canada »;
- la hauteur de la hampe ascendante la plus élevée des lettres minuscules de la déclaration ne doit pas être supérieure à deux fois la hauteur des lettres majuscules de l'identifiant des aliments supplémentés avec mises en garde, à l'exception des lettres des mots « Santé Canada » et « Health Canada ».
- b) Lorsque l'indication est affichée sur une surface continue, autre que l'EP :
- la hauteur des lettres majuscules de la déclaration ne doit pas être supérieure à deux fois la hauteur des lettres majuscules, en excluant les accents, des mises en garde;
- la hauteur de la hampe ascendante la plus élevée des lettres minuscules de la déclaration ne doit pas être supérieure à deux fois la hauteur des lettres majuscules des mises en garde.
Les déclarations qui sont assujetties aux restrictions de taille sont celles qui sont faites ou placées à la discrétion du fabricant et qui sont précisées aux paragraphes B.29.029(2) et B.29.029(3) du RAD et sont les suivantes :
- a) toute déclaration de la valeur énergétique de l'AS ou de la quantité d'un nutriment ou d'un IS contenu dans l'AS, sauf lorsque ces déclarations sont faites dans le TRAS;
- b) toute déclaration qui indique expressément ou implicitement que l'AS ou toute substance qu'il contient a des propriétés particulières liées à la nutrition ou à la santé, y compris, sans s'y limiter, toute allégation ou déclaration figurant à la colonne 4 de l'Étiquetage nutritionnel - Tableau des mentions et des allégations autorisées ou à la colonne 1 du tableau suivant l'article B.01.603 ou mentionné à l'article B.01.0 6 ou à l'article D.02.004 du RAD;
- c) tout énoncé, logo, symbole, sceau d'approbation ou marque relatif à la santé, à l'exclusion du nom de marque ou du nom du produit de l'AS et toute déclaration devant figurer sur l'étiquette d'un AS conformément à la colonne 5 de la Liste des ingrédients supplémentaires autorisés.
5.0 Conformité et application du Règlement sur les aliments supplémentés
Il incombe au fabricant ou au distributeur d'aliments de veiller à ce qu'un aliment mis en vente au Canada soit conforme à toutes les règles qui s'appliquent à la vente de celui-ci, y compris, sans toutefois s'y limiter, aux exigences de la LAD et de la LSAC, ainsi qu'aux règlements associés à ces lois.
Des LAMT avaient été émises pour permettre la vente d'aliments sûrs mais non conformes, afin de générer des renseignements sur le marché à l'appui d'une modification au RAD visant à encadrer les aliments supplémentés. Les renseignements sur le marché recueillis par les détenteurs de LAMT comprenaient des données sur les ventes, des données de recherche sur les habitudes de consommation de ces aliments par les Canadiens, et sur le niveau de compréhension des consommateurs par rapport aux renseignements fournis sur l'étiquette du produit et l'utilisation qu'ils en font.
Dans le cas des AS dont l'étiquette doit porter des mises en garde, une exigence supplémentaire imposait que les détenteurs de LAMT fournissent des rapports annuels d'incidents liés à la consommation pendant toute la durée de l'AMT. Un résumé des incidents liés à la consommation des AS est publié sur le site Web de Santé Canada.
Ces renseignements, ainsi que la documentation scientifique et d'autres renseignements dont Santé Canada dispose, ont servi à l'élaboration du Règlement sur les aliments supplémentés.
En vertu du Règlement sur les aliments supplémentés, les fabricants ou les distributeurs d'AS ne sont pas tenus de recueillir et de fournir les résultats de recherche et les données sur le marché, relatives à leurs produits. Cela signifie également qu'il n'est plus nécessaire de signaler à Santé Canada les incidents liés à la consommation. Les incidents liés à la consommation d'AS doivent être gérés par l'ACIA, de la même manière que ceux liés aux aliments. L'ACIA pourrait prendre des mesures d'application de la loi, y compris le rappel des AS non conformes, le cas échéant.
Au Canada, la responsabilité en matière de surveillance réglementaire de la salubrité des aliments est partagée entre le gouvernement fédéral et les unités de santé provinciales ou les ministères provinciaux. Les préoccupations relatives à la salubrité et à l'étiquetage des aliments sont adressées à l'ACIA, sauf au Québec où le ministère de l'Agriculture, des Pêcheries et de l'Alimentation du Québec (MAPAQ) est l'organisme responsable de répondre à toutes les préoccupations des consommateurs. Les consommateurs qui désirent signaler des incidents liés à la consommation à l'ACIA peuvent le faire sur la page Web Découvrez où vous pouvez déposer une plainte ou signaler une préoccupation alimentaire. Au Québec, les consommateurs peuvent faire part de leurs préoccupations au sujet d'un aliment, y compris les AS, au moyen du formulaire en ligne du MAPAQ.
Les articles 82 à 85 du RSAC exigent que les fabricants ou les distributeurs disposent d'un système efficace de plainte, d'enquête, de notification et de rappel des aliments. Lorsqu'un aliment présente un risque de nuire à la santé ou n'est pas conforme au RSAC, il incombe au titulaire de la licence d'enquêter et, dans le cas où un risque de nuire à la santé est constaté, d'en aviser immédiatement l'ACIA et de prendre des mesures pour atténuer le risque. Des exigences supplémentaires relatives à la préparation, à la conservation et au maintien à jour des documents liés à la procédure de plainte relative aux aliments se trouvent sur la page Web de l'ACIA : Exigences réglementaires : Contrôles préventifs
Bien qu'il appartienne à Santé Canada d'élaborer Le Règlement sur les aliments supplémentés, l'ACIA est responsable de l'application de ce règlement. Santé Canada et l'ACIA s'emploient à faciliter la transition des AS existants vers une pleine conformité au Règlement sur les aliments supplémentés. Tous les nouveaux AS doivent être conformes aux règlements en vigueur; les produits considérés comme non conformes au règlement seront assujettis à des mesures d'application de la loi par l'ACIA. Les AS qui bénéficient de la période de transition pour se conformer au Règlement sur les aliments supplémentés, conformément à la section 2.0, doivent respecter toutes les règles du RAD, à l'exception des variations décrites dans leur autorisation (LAMT ou avis écrit).
6.0 Voie d'accès au marché pour de nouveaux produits qui ne sont pas conformes à la Liste des catégories autorisées d'aliments supplémentés et/ou à la Liste des ingrédients supplémentaires autorisés
Santé Canada réglemente les AS d'une manière qui permet une certaine souplesse, tout en assurant que les nouveaux produits sont sécuritaires. Seuls les produits qui respectent les règles de réglementation, y compris celles de la Liste des catégories autorisées d'aliments supplémentés et celles de la Liste des ingrédients supplémentaires autorisés, sont considérés comme conformes au Règlement sur les aliments supplémentés. Toutefois, les intervenants peuvent demander la modification de ces Listes, qui sont incorporées par renvoi dans le RAD, en présentant une demande préalable à la mise en marché à la Direction des aliments de Santé Canada. Si le résultat de l'évaluation appuie un changement potentiel à une Liste, le changement demandé peut être mis en œuvre dans la Liste applicable après un processus de consultation. Une fois qu'un changement est mis en œuvre dans les Listes, tout fabricant d'AS peut bénéficier du nouveau changement et n'est pas tenu de présenter une demande préalable à la mise en marché distincte. Une demande préalable à la mise en marché ne peut pas être déposée pour demander une modification des documents incorporés par renvoi dans les dispositions transitoires d'une manière statique (voir l'annexe 1). Les sections ci-dessous donnent un aperçu des exigences et du processus liés aux demandes préalables à la mise en marché.
6.1 Motifs de demandes préalables à la mise en marché
Les intervenants qui souhaitent demander une modification à la Liste des catégories autorisées d'aliments supplémentés et à la Liste des ingrédients supplémentaires autorisés, incorporées par renvoi dans le Règlement sur les aliments supplémentés, peuvent déposer une demande préalable à la mise en marché pour l'une ou l'autre des modifications suivantes :
- Ajout d'un nouvel ingrédient supplémentaire à la Liste des ingrédients supplémentaires autorisés;
- Modification de la Liste des ingrédients supplémentaires autorisés à l'égard d'un ingrédient supplémentaire déjà inscrit, y compris une augmentation ou une diminution de la quantité maximale autorisée, ajout ou retrait de catégories d'aliments dans lesquelles cet ingrédient peut être utilisé et la modification des conditions d'utilisation;
- Modification de la Liste des catégories autorisées d'aliments supplémentés, y compris l'ajout d'une nouvelle catégorie ou le retrait d'une catégorie.
Un ingrédient, tel qu'un ingrédient à base de plantes ou à base non végétale, peut répondre à la définition d'un aliment nouveau (voir section 3.2 g)). Le Règlement sur les aliments supplémentés a introduit une modification à la définition des aliments nouveaux du titre 28, partie B du RAD qui exclut les IS et les AS; ce qui les exclut des exigences de notification applicables aux aliments nouveaux. Par conséquent, si un fabricant détermine qu'il est plus approprié ou particulièrement avantageux qu'un ingrédient ou un aliment soit utilisé comme un IS ou un AS, il pourrait alors envisager de déposer une demande préalable à la mise en marché afin de modifier les documents incorporés par renvoi au titre 29, partie B, du RAD, plutôt que comme un aliment nouveau en vertu du titre 28.
Un IS ou un AS autorisé - leur utilisation étant exactement conforme aux conditions énoncées dans la Liste des catégories autorisées d'aliments supplémentés et la Liste des ingrédients supplémentés autorisés - ne répondrait plus à la définition d'un aliment nouveau. Cela ne signifie pas que l'utilisation du même ingrédient ou aliment en dehors de son utilisation autorisée en tant qu'IS ou AS serait également exemptée de la définition d'aliment nouveau. Pour une utilisation générale et sans restriction d'un ingrédient ou d'un aliment, un fabricant peut envisager de déposer une demande préalable à la mise en marché en tant qu'aliment nouveau en vertu du titre 28.
Un ingrédient évalué dans le cadre du paradigme général des aliments nouveaux devrait pouvoir être utilisé en toute sécurité, de sorte qu'il pourrait normalement être ajouté à n'importe quel aliment sans condition particulière, au-delà de celles qui existent déjà de façon générale pour les produits alimentaires. Ainsi, les aliments contenant l'ingrédient pourraient être consommés sans restriction par la population générale.
Un aliment nouveau approuvé, mais qui n'a pas été approuvé en tant qu'IS, pourrait être ajouté à un AS, mais ne pourrait pas être représenté en tant qu'IS, par exemple en étant inclus dans le TRAS sous la rubrique « Supplémenté avec » (voir section 4.3.1.1). Un aliment nouveau approuvé pourrait par la suite, à la demande d'un intervenant, être évalué en tant qu'IS afin d'être représenté comme tel, et dans ce cas, une demande préalable à la mise en marché doit être soumise conformément aux exigences en matière de données applicables.
6.2 Exigences en matière de données relatives aux demandes préalables à la mise en marché
Une demande de modification de la Liste des ingrédients supplémentaires autorisés ou de la Liste des catégories autorisées d'aliments supplémentés doit être appuyée par des renseignements précis, lesquels dépendront du type de modification demandé.
Les renseignements suivants doivent être fournis à l'appui d'une demande de modification de la Liste des ingrédients supplémentaires autorisés :
- Description de la modification proposée;
- Description de l'ingrédient, y compris son nom;
- Source de l'ingrédient et sa méthode de fabrication;
- Renseignements sur les propriétés physiques et chimiques de l'ingrédient;
- Renseignements sur la composition et les spécifications (chimiques et microbiologiques) de l'ingrédient ou fournir une justification détaillée;
- Quantité maximale de l'ingrédient proposée par portion;
- Conditions d'utilisation proposées de l'ingrédient;
- Données pour établir l'innocuité de l'ingrédient dans les conditions d'utilisation proposées.
Les renseignements suivants doivent être fournis à l'appui d'une demande de modification de la Liste des catégories autorisées d'aliments supplémentés :
- Description de la modification proposée;
- Description du produit proposé;
- Description de la catégorie proposée;
- Estimation des niveaux de consommation des aliments de la catégorie proposée;
- Renseignements sur les IS proposés pour être autorisés dans la catégorie.
En ce qui concerne les modifications apportées à une de ces deux Listes, on peut demander aux intervenants de fournir tout renseignement supplémentaire qui pourrait être pertinent à l'évaluation de la demande. Santé Canada a l'intention d'élaborer d'autres directives à l'intention des intervenants, avec des exigences détaillées en matière de données pour les demandes de modification aux Listes.
6.3 Processus de demande préalable à la mise en marché
Les intervenants qui souhaitent présenter une demande préalable à la mise en marché pour l'un des motifs énumérés à la section 6.1 peuvent communiquer avec l'Unité de la gestion des demandes et de l'information (UGDI) de la Direction des aliments (smiu-ugdi@hc-sc.gc.ca). Les intervenants sont invités à demander une consultation préalable à la demande de mise en marché auprès de la Direction des aliments pour obtenir des directives supplémentaires sur les exigences relatives à la demande afin qu'une demande complète puisse être déposée dès le départ, et ainsi possiblement réduire le nombre de demandes de clarification ou de renseignements supplémentaires au demandeur, ou empêcher que la demande ne soit rejetée parce qu'elle est incomplète. Pour organiser une consultation préalable à une demande de mise en marché concernant les AS, communiquez avec l'UGDI à l'adresse : smiu-ugdi@hc-sc.gc.ca.
6.4 Modification des listes incorporées par renvoi
Santé Canada examinera les demandes préalables à la mise en marché visant à modifier la Liste des catégories autorisées d'aliments supplémentés et la Liste des ingrédients supplémentaires autorisés reçues conformément aux sections 6.1 à 6.3. Si le résultat de l'évaluation préalable à la mise en marché appuie les modifications proposées, la proposition de modification des Listes incorporées par renvoi fera l'objet d'une consultation publique.
Les intervenants nationaux et internationaux seront informés des modifications proposées au moyen d'un avis de proposition (ADP) publié sur le site Web de Santé Canada. Les intervenants intéressés disposent d'une période de 60 à 75 jours à compter de la date de publication de l'ADP pour formuler des commentaires.
À la fin de la période de présentation des commentaires, toutes les rétroactions reçues seront prises en considération. Si aucun nouveau renseignement scientifique qui nécessiterait des révisions à la proposition n'est fourni, la Direction des aliments procédera alors à la modification officielle du document. L'avis est fourni au moyen d'un avis de modification (ADM) affiché sur le site Web de Santé Canada. L'ADM précisera les modifications apportées, lesquelles entreront en vigueur dès que les Listes seront modifiées.
De plus, la Direction des aliments continue de surveiller les nouvelles données scientifiques au fur et à mesure qu'elles deviennent disponibles, et elle effectuera des évaluations des risques pour la santé ou effectuera des mises à jour à l'évaluation de certains aliments, y compris des AS, lorsque cela est justifié. Une proposition de modification des Listes peut découler de nouvelles connaissances scientifiques, d'un risque sanitaire émergent ou des résultats des évaluations de risques, si un risque concernant les AS ou les IS est identifié. Un changement proposé par Santé Canada ferait également l'objet d'un ADP avant de procéder à une modification au moyen d'un ADM.
Pour obtenir de plus amples renseignements sur le processus d'incorporation par renvoi et les échéanciers associés, consulter le site Web du gouvernement du Canada.
7.0 Ressources disponibles
Des ressources supplémentaires visant à aider les intervenants de l'industrie des AS à respecter les exigences réglementaires pour ces aliments sont fournies à l'Annexe 7.
8.0 Coordonnées
Pour toutes questions relatives aux AS, veuillez contacter la Direction des aliments à l'adresse courriel supplementedfoods-alimentssupplementes@hc-sc.gc.ca. Pour les questions relatives au processus de demandes préalables à la mise en marché, veuillez vous référer à la section 6.3.
9.0 Glossaire et abréviations
Cette section fournit un glossaire des principaux termes et abréviations utilisés tout au long de ce document.
9.1 Glossaire
- Conditions d'utilisation :
- Fait référence aux exigences réglementaires pour un aliment supplémenté, liées aux catégories autorisées d'aliments, aux quantités maximales d'ingrédients supplémentaires et à la façon de les déclarer, aux mises en garde et à d'autres conditions, tel qu'indiqué dans la Liste des ingrédients supplémentaires autorisés et la Liste des catégories autorisées d'aliments supplémentés.
- Répertoire des modèles de tableaux des renseignements sur les aliments supplémentés:
- Fait référence au document intitulé Répertoire des modèles de tableaux des renseignements sur les aliments supplémentés, incorporé par renvoi dans le Règlement sur les aliments et drogues, et publié par le gouvernement du Canada sur son site Web, avec ses modifications successives.
- Répertoire des spécifications sur l'identifiant des aliments supplémentés avec mise en garde:
- Fait référence au document intitulé Répertoire des spécifications sur l'identifiant des aliments supplémentés avec mise en garde incorporé par renvoi dans le Règlement sur les aliments et drogues, et publié par le gouvernement du Canada sur son site Web, avec ses modifications successives.
- Liste des catégories autorisées d'aliments supplémentés:
- Fait référence au document intitulé Liste des catégories autorisées d'aliments supplémentés incorporé par renvoi dans le Règlement sur les aliments et drogues, publié par le gouvernement du Canada sur son site Web, avec ses modifications successives.
- Liste des ingrédients supplémentés autorisés :
- Fait référence au document intitulé Liste des ingrédients supplémentaires autorisés incorporé par renvoi dans le Règlement sur les aliments et drogues, publié par le gouvernement du Canada sur son site Web, avec ses modifications successives.
- Liste des mises en garde:
- Liste qui figure sur l'étiquette d'un aliment supplémenté conformément au paragraphe B.29.020(1) du RAD.
- Aliment supplémenté :
- Produit préemballé qui appartient à une catégorie d'aliments figurant à la colonne 1 de la Liste des catégories autorisées d'aliments supplémentés et auquel un ingrédient supplémentaire a été ajouté.
- Tableau des renseignements sur les aliments supplémentés :
- Désigne le tableau des faits relatifs aux aliments supplémentés qui doit figurer sur l'étiquette de ceux-ci.
- Identifiant des aliments supplémentés avec mise en garde :
- S'entend de l'identifiant de mise en garde pour les aliments supplémentés qui doit figurer sur l'espace principal d'un aliment supplémenté lorsqu'un ou plusieurs ingrédients supplémentaires déclenchent l'obligation pour l'aliment supplémenté d'afficher des mises en garde conformément à la Liste des ingrédients supplémentaires autorisés.
- Ingrédient supplémentaire :
- S'entend d'un élément nutritif, notamment d'une vitamine, d'un minéral nutritif ou d'un acide aminé, ou de toute autre substance qui figure à la colonne 1 de la Liste des ingrédients supplémentaires autorisés et qui est ajouté à titre d'ingrédient à un aliment conformément aux conditions d'utilisation applicables prévues aux colonnes 2 à 5.
- Seuils maximaux relatifs aux mises en garde et autres conditions d'utilisation :
- Fait référence au document intitulé Seuils maximaux relatifs aux mises en garde et autres conditions d'utilisation, incorporé par renvoi dans les dispositions transitoires, publié par le gouvernement du Canada sur son site Web, dans sa version en vigueur à la date d'entrée en vigueur du Règlement sur les aliments supplémentés.
- Listes LAMT :
- Fait référence à l'une ou à plusieurs des Listes suivantes, incorporées par renvoi dans les dispositions transitoires, publiées par le gouvernement du Canada sur son site Web, dans leur version en vigueur à la date d'entrée en vigueur du Règlement sur les aliments supplémentés : a) la Liste des boissons, des préparations pour boisson et des concentrés de boisson; b) la Liste des boissons énergisantes contenant de la caféine; et c) la Liste des aliments traditionnels.
9.2 Abréviations
Les abréviations suivantes sont utilisées dans tout le document.
- ACIA
- Agence canadienne d'inspection des aliments
- ADM
- Avis de modification
- ADP
- Avis de proposition
- AMT
- Autorisation de mise en marché temporaire
- AS
- Aliments supplémenté
- AMT
- Apport maximal tolérable
- BEC
- Boisson énergisante contenant de la caféine
- BME
- Besoin moyen estimatif
- EP
- Espace principal
- EFSA
- Autorité européenne de sécurité des aliments
- ESCC
- Enquête sur la santé dans les collectivités canadiennes
- GC I
- Partie I de la Gazette du Canada
- GC II
- Partie II de la Gazette du Canada
- IS
- Ingrédient supplémentaire
- LAD
- Loi sur les aliments et drogues
- LSAC
- Loi sur la salubrité des aliments au Canada
- LAMT
- Lettre d'autorisation de mise en marché temporaire
- MAPAQ
- Ministère de l'Agriculture, des Pêcheries et de l'Alimentation du Québec
- NASEM
- National Academies of Science, Engineering, and Medicine
- PSN
- Produit de santé naturel
- RAD
- Règlements sur les aliments et drogues
- RPSN
- Règlement sur les produits de santé naturels
- RSAC
- Règlement sur la salubrité des aliments au Canada
- TRAS
- Tableau des renseignements sur les aliments supplémentés
- UGDI
- Unité de la gestion des demandes et de l'information de la Direction des aliments
Annexe 1 : Documents incorporés par renvoi dans le Règlement sur les aliments supplémentés
Les documents énumérés ci-dessous sont incorporés par renvoi dans le RAD. Les documents 1 à 4 sont incorporés par renvoi de façon dynamique, c'est-à-dire avec leurs modifications successives. Ces documents techniques sont gérés administrativement par la Direction des aliments de Santé Canada, afin de permettre une certaine souplesse dans le processus de réponse à une demande préalable à la mise en marché d'un intervenant, ainsi qu'à de nouvelles preuves ou à de nouveaux risques pour la santé. Les documents 5 et 6 sont incorporés par renvoi de façon statique, c'est-à-dire lorsqu'ils sont lus le jour de l'entrée en vigueur du règlement. Ces deux documents ne sont pas à modifier car ils sont liés aux dispositions transitoires du règlement.
- Répertoire des spécifications sur l'identifiant des aliments supplémentés avec mise en garde
- Répertoire des modèles de tableaux des renseignements sur les aliments supplémentés
- Liste des catégories autorisées d'aliments supplémentés
- Liste des ingrédients supplémentaires autorisés
- Listes de LAMTNote de bas de page 5
- Seuils maximaux relatifs aux mises en garde et autres conditions d'utilisationNote de bas de page 5
La Liste des ingrédients supplémentaires autorisés et la Liste des catégories autorisées d'aliments supplémentés peuvent être modifiées de temps à autre en réponse à une demande de modification d'un intervenant, à la disponibilité de nouveaux renseignements scientifiques ou à un risque émergent pour la santé (consulter la section 6.0).

Figure - Équivalent textuel
L'annexe 2 est composée d'un organigramme pour aider les intervenants à déterminer si leurs produits entrent dans le champ d'application du règlement sur les aliments supplémentés. Sur le côté gauche de l'organigramme, il y a 7 questions auxquelles il faut répondre pour déterminer si le produit en question est un aliment supplémenté. Le côté droit et le bas du côté gauche de l'organigramme contiennent différents résultats possibles, en fonction de la réponse (oui ou non) fournie à chaque question.
Première question:
Le produit est-il préemballé et destiné à être vendu et présenté comme un aliment? Si vous n'êtes pas certain, consulter le document Ligne directrice : Classification des produits situés à la frontière entre les aliments et les produits de santé naturels : produits sous forme d'aliments. Si NON, le Règlement sur les aliments supplémentés s'applique seulement aux aliments préemballés. Si le produit est un produit de santé naturel, veuillez communiquer avec la Direction des produits de santé naturels et sans ordonnance. Si OUI, passez à la deuxième question.
Deuxième question:
L'aliment contient-il des vitamines, des minéraux nutritifs, des acides aminés ou d'autres substances ? si NON, le Règlement sur les aliments supplémentés ne s'applique pas. Le produit doit être conforme à toutes les règles applicables du RAD. Si OUI, passez à la troisième question.
Troisième question:
Les vitamines, minéraux nutritifs et acides aminés ajoutés sont-ils utilisés qu'à des fins nutritionnelles (c.-à-d. à des fins d'enrichissement)? Si OUI, les aliments enrichis ne sont pas considérés comme des aliments supplémentés; toutefois, certaines exceptions s'appliquent. Veuillez consulter la section 3.2 a) pour obtenir des renseignements sur les aliments enrichis, les exceptions applicables et l'utilisation d'aliments enrichis comme ingrédients dans les aliments supplémentés. Si NON, passez à la quatrième question.
Quatrième question:
Le produit est-il une boisson alcoolisée, un aliment spécial, un aliment à usage diététique spécial ou un aliment destiné aux nourrissons, aux enfants de moins de 4 ans, aux femmes enceintes ou qui allaitent? Si OUI, interdit en tant qu'aliment supplémenté. Voir la section 3.2 pour de plus amples renseignements, y compris l'exception applicable aux aliments sans gluten. Si NON, passez à la cinquième question.
Cinquième question:
L'aliment appartient-il à une catégorie d'aliments précisée à la colonne 1 de la Liste des catégories autorisées d'aliments supplémentés? Si NON, interdit en tant que catégorie autorisée d'aliments supplémentés. La section 4.1 décrit les catégories autorisées. Pour obtenir des renseignements sur la modification de la Liste des catégories autorisées d'aliments supplémentés, consulter la section 6. Si OUI, passez à la sixième question.
Sixième question:
L'aliment contient-il des vitamines, des minéraux, des acides aminés ou d'autres substances qui ne sont pas autorisés par le RAD ? Si NON, conforme au RAD. Si la substance est destinée à être ajoutée en tant qu'ingrédient supplémentaire, veuillez consulter la section 6 pour obtenir des renseignements sur la modification de la Liste des ingrédients. Si OUI, passez à la septième question.
Septième question:
Si la vitamine, le minéral nutritif, l'acide aminé ou toute autre substance est destiné à être ajouté comme ingrédient supplémentaire, respecte-t-il les critères énoncés dans les colonnes 2 à 5 de la Liste des ingrédients supplémentaires. Si NON, non conforme au Règlement sur les aliments supplémentés. Pour obtenir des renseignements sur la modification de la Liste des ingrédients supplémentaires autorisés, consulter la section 6. Si OUI, le produit est un aliment supplémenté et doit être conforme au Règlement sur les aliments supplémentés, ainsi qu'à toutes les autres dispositions applicables du RAD pour pouvoir être vendu sur le marché.
Annexe 3 : Ingrédients dont la présence est interdite dans les aliments, y compris les aliments supplémentés
En plus des interdictions et des concentrations maximales établies dans la Liste des contaminants et des autres substances adultérantes dans les aliments de Santé Canada et dans la Liste des concentrations maximales établies à l'égard de divers contaminants chimiques dans les aliments (voir section 4.0), les ingrédients figurant dans la liste ci-dessous sont des substances considérées comme impropres à la consommation en tant qu'aliments, y compris en tant qu'aliments supplémentés. La liste d'ingrédients ci-dessous n'est pas exhaustive et pourrait être modifiée à mesure que de nouveaux renseignements sont disponibles.
Ingrédients impropres à la consommation en tant qu'alimentsNote de bas de page 6
- Cascara sagrada (Frangula purshiana Cooper)
- Chaparral (Larrea tridentata [Sessé et Moc. ex DC.] Coville, L. divaricata Cav.)
- Éphédra (Ephedra spp.)
- Germandrée (Teucrium chamaedrys L.)
- Prêle (Equisetum spp.)
- Kawa-kawa (Piper methysticum G.Forst.)
- Khat (Catha edulis (Vahl) Endl.)
- Séné (Senna alexandrina Mill.)
- Arnica (Arnica montana L., aconit tue-loup, aconit léopard)
- Consoude (Symphytum spp.)
- Magnolia (Magnolia officinalis Rehder et E.H.Wilson)
- Racine de pleurésie (Asclepias tuberosa L.)
- Stephania (Stephania tetrandra S.Moore)
- Jasmin de Caroline (Gelsemium sempervirens [L.] J.St.-Hil.)
Annexe 4 : Vitamines et minéraux nutritifs - Approche pour établir les teneurs maximales et autres conditions d'utilisation
Santé Canada a établi les teneurs maximales et autres conditions d'utilisation des vitamines et des minéraux nutritifs dans les AS en utilisant une approche fondée sur le risque pour s'assurer que leur addition ne contribue pas à des apports excessifs.
1.0 Méthodes de calcul des teneurs maximales et autres conditions d'utilisation
La première étape de l'établissement des teneurs maximales consistait à déterminer la quantité quotidienne totale maximale pour chaque vitamine et minéral nutritif; par la suite, cette quantité représente la « quantité quotidienne sans danger ».
Pour la plupart des vitamines et des minéraux nutritifs, les apports maximaux tolérablesNote de bas de page 7 (AMT), établis par les National Academies of Science, Engineering and Medicine (NASEM), ont été utilisés comme quantité quotidienne sans danger. Lorsqu'aucune AMT n'avait été établie par les NASEM ou que d'autres renseignements étaient jugés plus appropriés, d'autres sources scientifiques ont été utilisées pour établir la quantité quotidienne sans danger.
Pour la majorité des nutriments, la quantité quotidienne sans danger, ainsi que l'apport de base, ont été utilisés pour calculer les quantités maximales de vitamines et de minéraux nutritifs pour tous les AS.
Pour chaque vitamine et nutriment minéral, les calculs des teneurs maximales ont été fondés sur les données provenant du groupe d'âge-sexe le plus vulnérable, c'est-à-dire le groupe ayant obtenu le résultat le plus faible après avoir soustrait les apports de référence de la quantité quotidienne sans danger.Note de bas de page 8 Pour la plupart des vitamines et des minéraux, l'apport de référence utilisé était le 95e centile de l'apport quotidien usuel provenant de l'Enquête sur la santé dans les collectivités canadiennes de 2015 (ESCC, 2015). L'utilisation du 95e centile de l'apport quotidien usuel permet de protéger les populations les plus vulnérables contre les risques de surconsommation de vitamines et de nutriments minéraux.
Pour quelques vitamines et minéraux nutritifs dont les données sur l'apport alimentaire n'étaient pas disponibles dans l'ESCC, les apports estimés ont été fondés sur les quantités déclarées par le NASEM. Pour certaines autres vitamines et certains autres minéraux, les données sur l'apport en suppléments de l'ESCC ont été considérées comme peu fiables en raison d'une variabilité d'échantillonnage extrême. Dans ces cas, les apports en nutriments provenant de suppléments ont été estimés en fonction de la composition des suppléments de multivitamines/minéraux les plus vendus au Canada selon les données de Nielsen de 2017.
Consulter le Tableau 6 de la présente annexe pour connaître les références utilisées pour le calcul de la quantité quotidienne sans danger et les données relatives à chaque vitamine et minéral.
1.1 Calcul des teneurs maximales en vitamines et en minéraux nutritifs
- a) Méthode de calcul des teneurs maximales relatives aux AS autres que les boissons contenant de la caféine ajoutée et une quantité totale de caféine supérieure à 150 ppm
Formule pour calculer la teneur maximaleNote de bas de page 9 :
(Quantité quotidienne sans danger - apport alimentaire au 95e centile) ÷ 2
Pour la plupart des vitamines et des nutriments minéraux, les quantités maximales ont été déterminées en soustrayant le 95e centile de l'apport alimentaire habituel de la quantité quotidienne sans danger. Les valeurs ainsi obtenues représentent la quantité quotidienne totale de cette vitamine ou de ce minéral qui pourrait être consommée dans les AS sans dépasser la quantité quotidienne sans danger. Un coefficient de sécurité de 2 a été appliqué aux valeurs obtenues afin d'atténuer le risque d'apports excessifs pour les consommateurs qui ne lisent pas ou ne suivent pas les mises en garde, et de tenir compte du fait que les excédents n'ont pas été pris en compte dans le calcul des teneurs maximales.
Cette formule ne tient pas compte des facteurs suivants :
- L'apport provenant de suppléments;
- La consommation de plusieurs portions par jour;
- La consommation par des individus de moins de 14 ans.
Par conséquent, des mises en garde supplémentaires sont requises au-delà de certains seuils afin d'atténuer les risques d'apports excessifs en vitamines et en minéraux ajoutés aux AS autres que les boissons décrites au point b).
- b) Méthode de calcul des teneurs maximales relatives aux boissons contenant de la caféine ajoutée et une quantité totale de caféine supérieure à 150 ppm
Formule pour calculer la teneur maximaleNote de bas de page 9 :
Quantité quotidienne sans danger - apport provenant d'aliments et de suppléments au 95e centile) ÷ 5
Pour la plupart des vitamines et des minéraux nutritifs, les quantités maximales dans les AS appartenant à l'article 1 de la Liste des catégori es autorisées des aliments supplémentés, qui contiennent de la caféine ajoutée et de la caféine provenant de toutes les sources de plus de 150 ppm, communément appelées boissons énergisantes contenant de la caféine, ont été déterminées en soustrayant l'apport provenant d'aliments et de suppléments au 95e centile de la quantité quotidienne sans danger, pour la plupart des vitamines et des nutriments minéraux. Les valeurs obtenues ont été divisées par 5 afin de tenir compte de la possibilité que des individus pourraient consommer plusieurs portions (c.-à-d. jusqu'à cinq portions) d'AS en une journée.
Aucune mise en garde supplémentaire n'est requise pour atténuer le risque d'apports excessifs en vitamine et en minéraux nutritifs, puisque la formule tient compte de l'apport provenant de suppléments ainsi que de la consommation de portions multiples.
Bien que la formule utilisée pour les AS de cette catégorie ne tienne pas compte de l'apport des individus de moins de 14 ans, la mise en garde « Déconseillé aux individus de moins de 14 ans » est toujours requise pour les AS de cette catégorie en raison de la présence de la caféine comme IS.
1.2 Justifications relatives à l'exigence de mise en garde pour les vitamines et les minéraux nutritifs
La Liste des ingrédients supplémentaires autorisés précise les seuils pour chaque vitamine et minéral nutritif au-dessus desquels des mises en garde sont requises.
- a) Mise en garde : « Ne pas manger ou ne pas boire plus de X portion(s) par jour »
Selon les recherches issues des AMT, une faible proportion de consommateurs pourrait consommer jusqu'à 5 portions d'AS par jour. Par conséquent, cette mise en garde est requise si la consommation quotidienne de 5 portions ou moins d'un AS entraîne un apport total supérieur à la teneur maximale de vitamine ou de minéraux nutritifs.
- b) Mise en garde : « Ne pas [manger/boire] ce produit le même jour que tout autre aliment supplémenté ou supplément contenant les mêmes ingrédients supplémentaires [ou énumérer des ingrédients spécifiques] »
La consommation d'un AS qui fournit des vitamines et des minéraux nutritifs à des teneurs nécessitant une mise en garde sur le nombre maximal de portions quotidiennes, en plus d'un supplément ou d'un autre AS contenant les mêmes vitamines et minéraux nutritifs, pourrait entraîner des apports dépassant les quantités maximales. Pour atténuer ce risque, les AS nécessitant une mise en garde sur le nombre maximal de portions quotidiennes doivent également porter une mise en garde relative à la combinaison d'apports des mêmes vitamines et minéraux nutritifs provenant d'autres sources (c.-à-d. suppléments et autres AS).
Pour la plupart des vitamines et des minéraux nutritifs, les seuils associés à cette mise en garde sont les mêmes que ceux qui s'appliquent à la mise en garde relative au nombre maximal de portions quotidiennes. Toutefois, en ce qui concerne la vitamine A et le zinc, certains groupes d'âge-sexe, par leur consommation d'aliments et de suppléments, obtiennent déjà des apports supérieurs à la quantité quotidienne sans danger. Par conséquent, afin de prévenir les apports excessifs en provenance des AS, la mise en garde « Ne pas [manger/boire] ce produit le même jour que tout autre supplément contenant les mêmes ingrédients supplémentaires [ou énumérer des ingrédients spécifiques] » est requise pour les produits contenant de la vitamine A et du zinc en tant qu'IS à n'importe quel niveau.
- c) Mise en garde : « Déconseillé aux individus de moins de 14 ans »
Cette mise en garde est requise pour les AS dont la teneur en vitamines et en nutriments minéraux est supérieure aux seuils jugés sans danger pour les personnes de moins de 14 ans.
Pour la plupart des vitamines et des minéraux nutritifs, le seuil maximal relatif à cette mise en garde est établi au-dessus de la teneur déterminée par la formule suivante, et à l'aide des données du groupe d'âge-sexe le plus vulnérable des personnes âgées de moins de 14 ans :
Formule pour calculer le seuil :
(Quantité quotidienne sans danger - apport alimentaire provenant des aliments et des suppléments) ÷ 5
Ces seuils représentent la quantité la plus élevée, par portion, qui pourrait être consommée par les personnes de moins de 14 ans sans obligation de mise en garde supplémentaire, car la formule tient compte de l'apport provenant de suppléments et d'une consommation pouvant aller jusqu'à 5 portions par jour.
Pour un certain nombre de vitamines et de minéraux nutritifs, le seuil calculé à l’aide de cette formule s’est avéré supérieur au seuil établi pour d’autres mises en garde. Dans ces cas, le seuil associé à cette mise en garde a été ajusté afin de correspondre au seuil inférieur relatif à d’autres mises en garde. Cette approche permet de s’assurer que les personnes de moins de 14 ans n’aient pas à lire et à comprendre de mise en garde pour consommer des AS en toute sécurité.
En ce qui concerne la vitamine A et le zinc, certains groupes d'âge-sexe de personnes de moins de 14 ans, par leur consommation d'aliments et de suppléments, obtiennent déjà des apports supérieurs à la quantité quotidienne sans danger. Par conséquent, la mise en garde est requise sur les produits contenant ces nutriments, peu importe la teneur.
d) Mise en garde : « Déconseillé aux femmes enceintes ou qui allaitent »
Pour toutes les vitamines et les minéraux nutritifs, à l'exception de la niacine, la quantité quotidienne sans danger utilisée pour calculer les teneurs maximales s'applique aux femmes enceintes et qui allaitent. En ce qui concerne la niacine, l'AMT établie par l'Autorité européenne de sécurité des aliments (EFSA) (consulter le Tableau 6 ci-dessous) a été utilisée comme quantité quotidienne sans danger, mais l'EFSA indique explicitement que l'AMT ne s'applique pas pendant la grossesse ou l'allaitement en raison de données inadéquates. Par conséquent, cette mise en garde est requise pour les produits dont la teneur en niacine est supérieure à 30 mg par portion, selon l'AMT le plus bas établi par le NASEM pour les femmes enceintes et qui allaitent. Les apports jusqu'à ce seuil ne sont pas susceptibles de présenter un risque d'effets indésirables sur la santé de cette population.
2.0 Informations supplémentaires sur l'approche relative aux teneurs maximales et des mises en garde pour les vitamines et les minéraux nutritifs
Les teneurs maximales ainsi que les conditions d'utilisation relatives à toutes les vitamines et à tous les minéraux nutritifs dont l'ajout aux AS est autorisé sont précisées dans la Liste des ingrédients supplémentaires autorisés. Dans certains cas, les teneurs maximales, les conditions d'utilisation ou les IS autorisés diffèrent de ceux qui font partie des exigences de l'AMT énoncées dans les documents de référence suivants : Document d'orientation particulier à une catégorie - Autorisation de mise en marché temporaire : Aliments supplémentés, et le Document d'orientation particulier à une catégorie - Autorisation de mise en marché temporaire - Boissons énergisantes contenant de la caféine. Les raisons de ces changements varient et sont résumées ci-dessous.
2.1 Données sur l'apport en nutriments
Les teneurs maximales relatives aux AS précisées dans la Liste des ingrédients supplémentaires autorisés ont été calculées à l'aide des données sur l'apport alimentaire de l'Enquête sur la santé dans les collectivités canadiennes (ESCC) de 2015, lesquelles comprennent des données sur l'apport en nutriments provenant des aliments et des suppléments. Cet ensemble de données fournit une estimation plus exacte de l'apport en suppléments des Canadiens comparativement à l'approche précédente qui fondait ses estimations sur les données de Nielsen relatives aux ventes de suppléments de multivitamines et minéraux au Canada.
2.2 Vitamines et minéraux nutritifs dont l'ajout aux aliments supplémentés est interdit
Le manganèse a été ajouté à la liste des vitamines et des minéraux nutritifs dont l'ajout aux AS n'est pas autorisé (veuillez consulter la section 4.2.10.1). Les données de l'ESCC de 2015 montrent qu'au 95e centile, les apports estimés de manganèse dépassent l'AMT chez les enfants de 4 à 8 ans, les hommes de 14 à 18 ans et les hommes de 19 à 30 ans, ce qui ne laisse aucune place à l'ajout de manganèse dans les AS.
2.3 Teneurs maximales relatives aux aliments supplémentés autres que les boissons contenant de la caféine ajoutée et une quantité totale de caféine supérieure à 150 ppm
La Liste des ingrédients supplémentaires autorisés précise les teneurs maximales pour toutes les catégories d'AS, autres que les AS appartenant à l'article 1 de la Liste des catégories autorisées d'aliments supplémentés, ceux qui contiennent de la caféine ajoutée et ceux dont la concentration totale en caféine est supérieure à 150 ppm de caféine, communément appelés boissons énergisantes contenant de la caféine (BEC) pendant la période des AMT. Ces teneurs ont été calculées selon la même approche que celle utilisée pour établir les teneurs maximales de l'ancienne option 2 pour la période des AMT (consulter la section 1.1.a) ci-dessus).
Selon l'approche actuelle, les seuils relatifs aux mises en garde sont comparables aux teneurs maximales de l'ancienne option 1. Pendant la période des AMT, les produits contenant des vitamines ou des minéraux nutritifs à des teneurs supérieures aux seuils maximaux de l'option 1 nécessitaient des mises en garde afin d'atténuer le risque d'apports excessifs en vitamines et en minéraux nutritifs.
2.4 Teneurs maximales relatives aux boissons contenant de la caféine ajoutée et une quantité totale de caféine supérieure à 150 ppm
La Liste des ingrédients supplémentaires autorisés précise les teneurs maximales en vitamines et en minéraux nutritifs autorisées dans les boissons contenant de la caféine ajoutée et une quantité totale de caféine supérieure à 150 ppm. L'approche visant à établir les teneurs maximales pour les AS de cette catégorie diffère de celle utilisée pendant la période d'AMT. L'approche a été révisée afin d'améliorer son harmonisation avec l'approche appliquée pour les autres AS (consulter la section 1.1.b) ci-dessus).
2.5 Approche pour calculer les teneurs maximales de vitamines B pour lesquelles aucun apport maximal tolérable n'a été établi
Aucune AMT n'a été établie par la NASEM pour la riboflavine, la thiamine, l'acide pantothénique, la vitamine B12 et la biotine. Au cours de la période des AMT, les teneurs maximales permises dans le Document d'orientation particulier à une catégorie -Autorisation de mise en marché temporaire -Boissons énergisantes contenant de la caféine pour la thiamine, la riboflavine et la vitamine B12 étaient fondées sur le seuil d'absorption maximale. Il s'agit du seuil au-dessus duquel l'absorption du nutriment par l'organisme diminue de façon significative. Dans le cas de l'acide pantothénique, Santé Canada a indiqué dans le Document d'orientation particulier à une catégorie -Autorisation de mise en marché temporaire -Boissons énergisantes contenant de la caféine que les quantités allant jusqu'à 100 mg étaient acceptables pendant la période d'AMT. Quant à la biotine, un seuil maximal a été établi à l'interne par Santé Canada. Bien qu'aucune teneur maximale n'ait été établie pour ces vitamines B relativement à d'autres catégories d'AS, les quantités ajoutées supérieures à celles qui se trouvent dans les AS commercialisés au moment de la publication des lignes directrices ont été évaluées au cas par cas lors de l'évaluation des demandes d'AMT.
Des teneurs maximales ont été établies pour ces vitamines B relativement à toutes les catégories d'AS dans le Règlement sur les aliments supplémentés. Les teneurs maximales établies dans la monographie des suppléments de multivitamines et minéraux de la Direction des produits de santé naturels et sans ordonnance (DPSNSO) ont été utilisées comme quantité quotidienne sans danger pour calculer les teneurs maximales liées à ces vitamines B (consulter la section 1 ci-dessus). En établissant des teneurs maximales pour toutes les catégories d'AS, on applique une approche uniforme et on évite que les quantités contenues dans les AS dépassent celles autorisées dans les suppléments.
2.6 Approche pour calculer les teneurs maximales en potassium
Le NASEM n'a pas établi d'apport maximal tolérable pour le potassium. Par conséquent, au cours de la période des AMT, des teneurs maximales en potassium pour les AS autres que des BEC ont été établies afin de protéger les populations vulnérables pour lesquelles l'excrétion du potassium est altérée (p. ex. les personnes atteintes d'une néphropathie chronique et les personnes qui prennent certains médicaments pouvant nuire à l'excrétion du potassium). La quantité quotidienne sans danger utilisée pour calculer les teneurs maximales était la plus faible quantité quotidienne de potassium recommandée dans les milieux cliniques lors de l'élaboration de régimes à faible teneur en potassium pour des personnes dont l'excrétion du potassium est altérée.
Depuis la publication des teneurs maximales pour la période des AMT, le NASEM (2019) a conclu qu'une supplémentation en potassium à court terme d'environ 2 500 mg/jour semble être sans danger pour les personnes généralement en bonne santé. Par conséquent, la quantité maximale de potassium a été calculée en utilisant ce seuil comme quantité quotidienne sans danger (consulter la section 1 ci-dessus). Toutefois, comme cette quantité ne s'applique qu'à la supplémentation à court terme, un coefficient de sécurité de 3 (au lieu de 2) est utilisé dans la formule pour déterminer la teneur maximale des AS autres que les boissons contenant de la caféine ajoutée et une quantité totale de caféine supérieure à 150 ppm.
2.7 Approche relative aux mises en garde liées aux vitamines et aux minéraux nutritifs
2.7.1 Regroupement des mises en garde
Au cours de la période de l'AMT, les deux déclarations suivantes étaient requises pour les AS dépassant certains seuils pour les vitamines et les minéraux nutritifs, conformément au Document d'orientation particulier à une catégorie - Autorisation de mise en marché temporaire : Aliments supplémentés :
- « Si vous prenez un supplément quotidien [qui contient les mêmes vitamines ou minéraux nutritifs], il est possible qu'en consommant ce produit votre apport en vitamines ou en minéraux nutritifs devienne excessif »;
- « Ne consommez pas ce produit avec d'autres aliments supplémentés [qui contiennent les mêmes vitamines ou minéraux nutritifs]. »
L'objectif de ces deux énoncés est de limiter la consommation des AS les jours où certains autres produits (c.-à-d. des suppléments ou d'autres AS) contenant les mêmes IS sont consommés. Par conséquent, par souci de simplicité, ces énoncés ont été combinés comme suit (voir section 4.2.4) :
- « Ne pas [manger/boire] ce produit le même jour que d'autres aliments supplémentés ou suppléments contenant les mêmes ingrédients supplémentaires [ou énumérer des ingrédients spécifiques] »
2.7.2 Seuil relatif à la mise en garde: [Ne pas [manger ou boire ce produit le même jour que d'autres suppléments contenant [les mêmes ingrédients supplémentaires/(ou énumérer des ingrédients spécifiques)]
Pendant la période visée par l'AMT, une déclaration de signification semblable (« Si vous prenez un supplément quotidien [qui contient les mêmes vitamines ou minéraux nutritifs], il est possible qu'en consommant ce produit votre apport en vitamines ou en minéraux nutritifs devienne excessif. ») était requise au-dessus des seuils de vitamines et de minéraux nutritifs qui pourraient entraîner des apports dépassant la quantité quotidienne sans danger lorsqu'ils sont combinés à un supplément. Dans le Règlement sur les aliments supplémentés, cette mise en garde est requise à des teneurs pouvant entraîner des apports qui dépassent les quantités maximales établies, lorsqu'ils sont combinés à un supplément. L'approche révisée conserve le coefficient de sécurité pour l'objectif, c'est-à-dire atténuer le risque que les consommateurs ne lisent pas ou ne suivent pas les mises en garde figurant sur l'étiquette et tenir compte des quantités supplémentaires de nutriments ajoutées.
2.7.3 Libellé de la mise en garde : [Déconseillé aux individus de moins de 14 ans]
Pendant la période visée par l'AMT, tous les produits contenant de la caféine ajoutée et une quantité totale de caféine de plus de 200 ppm (et moins de 400 ppm) devaient porter la mise en garde « Non recommandé pour les enfants… » et d'autres AS devaient porter la mise en garde « Non destiné aux enfants » ou « Pour adultes seulement » au-dessus de certains seuils pour les vitamines et les minéraux nutritifs.
Toutefois, des renseignements récents dont dispose Santé Canada, notamment provenant de la recherche effectuée pendant la période des AMT, ont révélé que certains enfants de moins de 14 ans consommaient quand même des AS qui font l'objet de ces mises en garde. Une source commune de confusion était l'âge auquel ces mises en garde s'appliquaient. Afin de clarifier la question, la mise en garde pour toutes les catégories d'AS a été révisée pour « Déconseillé aux individus de moins de 14 ans ».
2.7.4 Exigence relative à la mise en garde liée a la niacine : [Déconseillé aux femmes enceintes ou qui allaitent]
Au cours de la période de l'AMT, les teneurs maximales en niacine étaient calculées selon l'apport maximal établi par l'Autorité européenne de sécurité des aliments (EFSA) à titre de teneur quotidienne sans danger. Même si l'apport maximal établi par l'EFSA ne s'applique pas aux femmes enceintes ou qui allaitent, aucun étiquetage de mise en garde supplémentaire n'a été requis pendant la période d'AMT.
Au moment d'établir la teneur maximale en niacine dans le Règlement sur les aliments supplémentés, Santé Canada a révisé son approche et a déterminé qu'au-dessus d'un certain seuil, cette mise en garde sur la niacine était requise à titre préventif.
2.8 Recherche effectuée au cours de la période des autorisations de mise en marché temporaire
Les recherches effectuées pendant la période des AMT ont permis de recueillir des renseignements sur les habitudes de consommation associées aux AS, ce qui a permis de peaufiner l'approche visant à établir les teneurs maximales et à clarifier le libellé des mises en garde, comme il est décrit dans les sections ci-dessus.
2.8.1 Usage de suppléments
La recherche menée pendant la période des AMT a montré que plusieurs consommateurs d'AS consomment également des suppléments de multivitamines et minéraux. Selon une étude effectuée pendant la période des AMT, 34 % des consommateurs de BEC ont déclaré consommer un supplément de multivitamines et de minéraux par jour ou pratiquement chaque jour, tandis que d'autres études ont montré que 23 à 59 % des consommateurs d'AS, autres que les BEC, ont déclaré consommer des suppléments de multivitamines et de minéraux.
Ces résultats indiquent l'importance de prendre en compte l'apport en suppléments lors de l'établissement des teneurs maximales ou de l'utilisation d'une mise en garde contre la consommation d'AS en plus de suppléments contenant les mêmes IS.
2.8.2 Consommateurs les plus jeunes
Bien que la plupart des recherches ne portaient pas spécifiquement sur la consommation d'AS par des enfants aussi jeunes que 4 ans, les résultats d'une étude ont montré que des enfants d'à peine 4 ans consommaient l'AS en question. Ces données confirment qu'il faut protéger le groupe d'âge-sexe le plus vulnérable, soit 4 ans et plus, lors de l'établissement des teneurs maximales.
2.8.3 Nombre de portions par jour
Selon les recherches de l'AMT, une très faible proportion de répondants pourrait consommer au moins 5 BEC (et/ou d'autres AS) par jour. Ces données indiquent l'importance de tenir compte des personnes qui consomment jusqu'à 5 portions d'AS par jour lors de l'établissement des teneurs maximales.
| Élément nutritif | Quantité quotidienne sans danger | AS à l'exclusion des boissons contenant de la caféine ajoutée et une quantité totale de caféine supérieure à 150 ppm | AS contenant de la caféine ajoutée et une quantité totale de caféine supérieure à 150 ppm | |
|---|---|---|---|---|
| AlimentNote de bas de page * | AlimentNote de bas de page * | SupplémentsNote de bas de page * | ||
| Bêta-carotène | (UK EVM, 2003) | X | X | (Nielsen, 2017) Suppléments de multivitamines et minéraux les plus vendus au Canada |
| Biotine | (NNHPD, 2018) | (NASEM, 1998) estimation de l'apport alimentaire | (NASEM, 1998) estimation de l'apport alimentaire | (CCHS, 2015) apport en suppléments |
| Choline | (NASEM, 1998) | (CCHS, 2015) apport alimentaire | (CCHS, 2015) apport provenant d'aliments et de suppléments | |
| Niacine | (EFSA, 2006) | X | X | (CCHS, 2015) apport en suppléments |
| Acide pantothénique | (NNHPD, 2018) | (CCHS, 2015) apport alimentaire | (CCHS, 2015) apport provenant d'aliments et de suppléments | |
| Riboflavine | (NNHPD, 2018) | (CCHS, 2015) apport alimentaire | (CCHS, 2015) apport provenant d'aliments et de suppléments (pour la plupart des groupes d'âge-sexe) | |
| Thiamine | (NNHPD, 2018) | (CCHS, 2015) apport alimentaire | (CCHS, 2015) apport provenant d'aliments et de suppléments (pour la plupart des groupes d'âge-sexe) | |
| Vitamine A | (NASEM, 2001) | (CCHS, 2015) apport alimentaire | (CCHS, 2015) apport provenant d'aliments et de suppléments | |
| Vitamine B6 | (NASEM, 1998) | (CCHS, 2015) apport alimentaire | (CCHS, 2015) apport provenant d'aliments et de suppléments | |
| Vitamine B12 | (NNHPD, 2018) | (CCHS, 2015) apport alimentaire | (CCHS, 2015) apport provenant d'aliments et de suppléments (pour la plupart des groupes d'âge-sexe) | |
| Vitamine C | (NASEM, 2000) | (CCHS, 2015) apport alimentaire | (CCHS, 2015) apport provenant d'aliments et de suppléments | |
| Vitamine D | (NASEM, 2011) | (CCHS, 2015) apport alimentaire | (CCHS, 2015) apport provenant d'aliments et de suppléments | |
| Vitamine E | (EFSA, 2015) | X | X | (CCHS, 2015) apport en suppléments |
| Calcium | (NASEM, 2011) | (CCHS, 2015) apport alimentaire | (CCHS, 2015) apport provenant d'aliments et de suppléments | |
| Chrome | (EFSA, 2010) (WHO, 1996) | X | X | (CCHS, 2015) apport en suppléments |
| Cuivre | (NASEM, 2001) | (CCHS, 2015) apport alimentaire | (CCHS, 2015) apport provenant d'aliments et de suppléments (pour la plupart des groupes d'âge-sexe) | |
| Magnésium | (NASEM, 1997) | X | X | (CCHS, 2015) apport provenant de suppléments (pour la plupart des groupes d'âge-sexe) |
| Molybdène | (NASEM, 2001) | (NASEM, 2001) estimation de l'apport alimentaire | (NASEM, 2001) estimation de l'apport alimentaire | (CCHS, 2015) apport en suppléments |
| Phosphore | (NASEM, 1997) | (CCHS, 2015) apport alimentaire | (CCHS, 2015) apport provenant d'aliments et de suppléments (pour la plupart des groupes d'âge-sexe) | |
| Potassium | (NASEM, 2019) | X | X | (CCHS, 2015) apport en suppléments |
| Sélénium | (NASEM, 2000) | (CCHS, 2015) apport alimentaire | (CCHS, 2015) apport provenant d'aliments et de suppléments | |
| Zinc | (NASEM, 2001) | (CCHS, 2015) apport alimentaire | (CCHS, 2015) apport provenant d'aliments et de suppléments | |
|
||||
Annexe 5 : Acides aminés - Approche relative à l'établissement des teneurs maximales et des conditions d'utilisation
Santé Canada a établi des teneurs maximales et d'autres conditions d'utilisation relatives aux acides aminés dans les AS en utilisant une approche fondée sur le risque afin de s'assurer que la consommation de ces produits n'entraîne pas des apports excessifs en acides aminés supplémentaires, lesquels pourraient occasionner des effets indésirables sur la santé.
1.0 Justification relative à l'approche utilisée pour calculer les teneurs maximales en acides aminés
Bien qu'aucune teneur maximale en acides aminés n'ait été publiée lors de la période des AMT, Santé Canada avait indiqué dans ses lignes directrices que l'utilisation d'acides aminés et les quantités ajoutées dans les AS seraient évaluées au cas par cas, en tenant compte du profil de risque global que comporte chaque produit. Dans le cadre du processus d'évaluation des demandes d'AMT, Santé Canada avait établi à l'interne des teneurs maximales et des conditions d'utilisation pour les acides aminés, lesquelles comprenaient également des mises en garde.
Dans l'objectif d'accroître la transparence et d'alléger le fardeau réglementaire, les teneurs maximales d'acides aminés sont publiées dans la Liste des ingrédients supplémentaires autorisés. L'approche utilisée pour calculer les teneurs maximales et autres conditions d'utilisation est décrite ci-dessous, et vise à contribuer à assurer la sécurité des consommateurs, en particulier celle des sous-populations vulnérables. Par conséquent, les teneurs maximales indiquées dans la Liste des ingrédients supplémentaires autorisés ne sont pas nécessairement les mêmes que les teneurs maximales internes établies pendant la période d'AMT, lesquelles ont été publiés dans le document incorporé par renvoi Seuils maximaux relatifs aux mises en garde et autres conditions d'utilisation.
2.0 Approche utilisée pour calculer les teneurs maximales en acides aminés
Les quantités maximales ont été établies pour 20 acides aminés associés à la synthèse des protéines (consulter le Tableau 7) Parmi ces 20 acides aminés, neuf sont des acides aminés essentiels qui ne peuvent être produits par le corps humain, et qui doivent donc provenir de l'alimentation. Il est important d'obtenir un apport adéquat en acides aminés essentiels afin de répondre aux besoins nutritionnels humains favorisant une croissance normale, le maintien du fonctionnement physiologique et la régénération des tissus. (NASEM, 2002).
| Acides aminés non essentiels | Acides aminés essentiels |
|---|---|
|
|
L'ajout d'acides aminés individuels à l'alimentation, plutôt que de protéines entières, est préoccupant en raison de leur taux d'absorption beaucoup plus rapide, de l'augmentation marquée des concentrations sanguines qui y est associée (Pencharz et coll., 2008, Gropper et coll., 1993), et de la possibilité accrue de s'écarter des besoins nutritionnels.
Des études chez les animaux et certaines observations chez l'humain (Kurpad, 2018, Harper, 1958) ont montré que le déséquilibre lié aux acides aminés, causé par des quantités disproportionnées d'acides aminés essentiels, peut provoquer une diminution du taux de croissance et de l'appétit (Harper, 1970), une augmentation de l'accumulation de graisse dans le foie (Toohey, 2014) et une une carence liée à d'autres acides aminés (Salmon, 1958). La supplémentation en acides aminés individuels peut également entraîner des effets antagonistes, par exemple les acides aminés pourraient se faire concurrence lors de l'absorption cellulaire et l'excès d'un acide aminé découlant de cette situation diminuerait la disponibilité de son concurrent (Park, 2006). Les résultats de la recherche mettent l'accent sur l'importance de l'apport protéique total pour atténuer ces effets indésirables de la supplémentation en acides aminés (Food and Agriculture Organization of the United Nations (FAO) Expert Consultation, 2013, Anderson & Raiten, 1992, Imamura et coll., 2013, Xiao et coll., 2019) et les personnes ayant un faible apport en protéines peuvent être plus vulnérables à de tels effets indésirables.
Comme il peut être difficile pour certains consommateurs de savoir si leur régime est faible en protéines (p. ex. les personnes sous-alimentées en général, par opposition à celles à qui leur médecin a conseillé de suivre un régime à faible teneur en protéines), la mise en garde sur l'étiquette pourrait, à elle seule, ne pas être suffisante pour atténuer les risques.
Compte tenu des différentes considérations associées aux acides aminés supplémentaires par rapport aux protéines, ainsi que de l'approche utilisée pour calculer les teneurs maximales indiquée ci-dessous, les teneurs maximales en acides aminés s'appliquent à la quantité totale d'acides aminés libres dans le produit, y compris la quantité supplémentaire, les quantités provenant d'autres ingrédients alimentaires et les quantités naturellement présentes d'acides aminés libres. Les quantités maximales ne comprennent pas les acides aminés liés aux protéines ou aux peptides.
2.1 Teneurs maximales en acides aminés essentiels
Les teneurs maximales relatives aux acides aminés essentiels sont calculées de manière à ce que l'ajout d'un seul acide aminé essentiel n'entraîne pas un indice d'acide aminé supérieur à l'indice d'acide aminé le plus élevé qui existe dans l'apport alimentaire de base du groupe d'âge-sexe le plus vulnérable (p. ex. aucune modification importante des rapports d'acides aminés essentiels dans le régime alimentaire de base). L'indice d'acide aminé est le rapport entre la teneur en un acide aminé essentiel dans le régime alimentaire et le besoin en ce même acide aminé chez certains groupes d'âge, exprimé en milligrammes d'acides aminés par gramme de protéines requises. La formule suivante est utilisée pour calculer la teneur maximale en acides aminés essentiels :
-
Formule pour calculer la teneur maximale :
(ÉqSe - Ée Sq) ÷ Ée
Éq = Apport alimentaire quotidien en acide aminé essentiel ayant l'indice d'acide aminé le plus élevé (mg)
Ée = Besoin relatif à l'acide aminé essentiel ayant l'indice d'acide aminé le plus élevé dans le profil de référence (mg/g)
Sq = Apport alimentaire quotidien en acide aminé supplémentaire (mg)
Se = Besoin relatif à l'acide aminé supplémentaire dans le profil de référence (mg/g)
Dans cette formule, les variables tiennent compte des facteurs suivants :
- a) Groupe d'âge-sexe le plus vulnérable
Les femmes de plus de 70 ans sont considérées comme le groupe d'âge-sexe le plus vulnérable. Selon les données de l'ESCC de 2015, ce groupe présente le pourcentage le plus élevé de personnes (22 %) qui consomment des protéines en quantités insuffisantes à leur besoin moyen estimatif (BME) (CCHS, 2015). De plus, ce groupe présente le plus faible apport protéique globale de tous les groupes d'âge-sexe de 4 ans et plus.
- b) Apport alimentaire
L'apport alimentaire au 5e centile de l'apport a été utilisé comme valeur de référence, car la supplémentation en acides aminés peut avoir un risque plus élevé d'effets indésirables chez les personnes dont l'apport protéique est faible. Cette approche correspond à celle utilisée pour les autres nutriments, laquelle vise à protéger les personnes au 95e centile, ou celles dont la consommation est dans le premier 5 % pour chaque nutriment (consulter l'Annexe 4). Il a été déterminé que le L-Tryptophane avait l'indice d'acide aminé le plus élevé dans le régime alimentaire de base au 5e centile d'apport pour la sous-population la plus vulnérable.
- c) Profil de référence
Le profil de référence utilisé dans la formule ci-dessus est celui employé pour les enfants plus âgés, les adolescents et les adultes, conformément au rapport de la FAO de 2013, Dietary protein quality evaluation in human nutrition. (FAO Expert Consultation, 2013). Ce profil de référence tient compte des exigences relatives au maintien et à la croissance chez les adultes, les adolescents et les enfants aussi jeunes que 3 ans. On n'a pas tenu compte des profils de référence des groupes d'âge plus jeunes, car les AS ne sont pas destinés aux enfants de moins de 4 ans.
2.2 Teneurs maximales en acides aminés non essentiels
L'ajout d'acides aminés non essentiels ne change pas les rapports entre les acides aminés essentiels. Par conséquent, les teneurs maximales en acides aminés non essentiels correspondent généralement aux doses maximales précisées dans la monographie des suppléments à l'entraînement de la Direction des produits de santé naturels et sans ordonnance (DPSNSO). Afin de s'assurer que l'ajout de ces quantités aux AS serait approprié, l'indice des acides aminés essentiels a été calculé selon le régime alimentaire de base du groupe d'âge-sexe le plus vulnérable et comparé à l'indice des acides aminés du même régime auquel l'acide aminé non essentiel a été ajouté. À la lumière de cette analyse, pour la plupart des acides aminés non essentiels, l'ajout aux AS des quantités précisées dans la monographie des suppléments à l'entraînement de la DPSNSO est approprié, à quelques exceptions près, énumérées ci-dessous.
- Les acides aminés non-essentiels L-cystéine et L-tyrosine sont inclus dans le profil de référence des acides aminés soufrés et des acides aminés aromatiques, respectivement. Par conséquent, les teneurs maximales pour ces acides aminés non essentiels sont combinées aux teneurs maximales pour les acides aminés essentiels L - méthionine et L-phénylalanine, respectivement.
- La teneur maximale en L-arginine a été établie à un seuil au-dessus duquel des mises en garde exhaustives seraient nécessaires pour atténuer le risque chez les personnes atteintes de maladies cardiovasculaires. Les mises en garde exhaustives ne sont pas considérées comme un outil approprié d'atténuation des risques pour les aliments.
- La dose maximale de L-glutamine précisée dans la monographie des suppléments à l'entraînement de la DPSNSO pourrait avoir un effet plus important sur l'indice (le plus faible) d'acides aminés limitants chez le groupe d'âge-sexe le plus vulnérable. Par conséquent, la teneur maximale dans les AS est établie à un seuil qui ne réduirait pas de plus de 5 % l'indice d'acides aminés limitants chez le groupe le plus vulnérable, ce qui représente une quantité jugée tolérable pour les acides aminés essentiels à leur quantité maximale respective.
3.0 Approche relative aux mises en garde liées aux acides aminés
L'ajout d'acides aminés selon divers seuils entraîne l'exigence d'afficher des mises en garde sur l'étiquette des AS. Les seuils au-dessus desquels des mises en garde sont requises sont indiqués dans la Liste des ingrédients supplémentaires autorisés. Les justifications relatives à l'exigence de ces mentions sont présentées ci-dessous.
- a) Exigence relative à la mise en garde : « Ne pas [manger/boire] plus de X portion(s) par jour »
Cette mise en garde est requise afin de s'assurer que la consommation quotidienne de 5 portions ou moins d'un AS ne donne pas lieu à des apports totaux supérieurs à la teneur maximale en un acide aminé donné. Comme les recherches effectuées pendant la période des AMT indiquent qu'une faible proportion de consommateurs pourrait consommer jusqu'à 5 portions d'AS par jour (consulter section 2.8 de l'Annexe 4), les seuils maximaux ont été calculés en divisant la quantité maximale par 5.
- b) Exigence relative à la mise en garde : « Déconseillé aux individus de moins de 14 ans et aux femmes enceintes ou qui allaitent »
Il peut s'avérer nécessaire d'apposer ces mises en garde sur les AS, par mesure de précaution, afin de protéger certaines populations vulnérables contre les risques liés aux acides aminés ajoutés. En raison de données insuffisantes, le NASEM n'a pas établi d'apport maximal tolérable en acides aminés pour aucun groupe d'âge-sexe; toutefois, cela ne signifie pas qu'il n'y ait aucun risque associé à un apport excessif. Il a été démontré que la supplémentation en acides aminés en grandes quantités a des effets néfastes sur les animaux en croissance, et par conséquent, ces mises en garde peuvent aider à atténuer le risque pour les sous-populations vulnérables qui connaissent des taux accrus de croissance, comme les enfants et les nourrissons. Bien que les données disponibles sur l'innocuité des acides aminés soient axées sur les adultes, aucun risque particulier ou significatif n'a été identifié qui justifierait l'augmentation de la limite d'âge de 14 ans et plus pour les AS contenant des acides aminés ajoutés en quantité pouvant aller jusqu'aux teneurs maximales précisées.
Les seuils pour ces mises en garde ont été établis en tenant compte des utilisations identifiées et possibles comme ingrédients aromatisants pour les catégories d'AS. Les seuils pour la L-alanine, la L-arginine et la glycine ont été ajustés afin d'atténuer les risques possibles associés au dépassement de leurs quantités maximales à partir de toutes les sources potentielles d'apport alimentaire, et d'offrir une approche d'étiquetage plus uniforme et prévisible pour les AS.
- c) Exigence relative à la mise en garde : Ne pas [manger/boire] le même jour que d'autres aliments supplémentés ou suppléments contenant [les mêmes ingrédients supplémentaires/(ou énumérer des ingrédients spécifiques)]; »
Cette mise en garde n'est pas requise pour les acides aminés. Les teneurs maximales en acides aminés des AS sont prudentes par rapport aux teneurs auxquelles des effets indésirables ont été observés chez les humains dans la population adulte générale. Une faible proportion de la population canadienne pourrait être vulnérable à un apport excessif en acides aminés individuels (p. ex. 23 % des femmes de plus de 70 ans et de 5 à 15 % de plusieurs autres groupes d'âge-sexe ne répondent pas à leur BME en protéines). Cependant, les personnes dont l'apport en protéines est faible pourraient être moins susceptibles de consommer des acides aminés individuels provenant de sources multiples (p. ex. les suppléments à l'entraînement). Santé Canada continuera de surveiller les apports en acides aminés provenant des AS, ainsi que les nouvelles recherches sur les teneurs sans danger en acides aminés à mesure qu'elles seront disponibles, afin de déterminer si des exigences supplémentaires seront nécessaires pour atténuer les risques identifiés à l'avenir.
Annexe 6 : Taurine - Approche relative à l'établissement de la teneur maximale et autres conditions d'utilisation
L'ajout de la taurine aux AS est autorisé à une teneur maximale de 2 000 mg par portion déterminée, conformément à la Liste des ingrédients supplémentaires autorisés.
1.0 Teneur maximale en taurine pendant la période des autorisations de mise en marché temporaire
La teneur maximale en taurine autorisée pendant la période des AMT était de 3 000 mg/jour pour les BEC, comme il est indiqué dans le Document d'orientation particulier à une catégorie - Autorisation de mise en marché temporaire - Boissons énergisantes contenant de la caféine. Cette teneur était calculée selon la dose maximale précisée dans la monographie de la taurine de la DPSNSO et la teneur sans danger observée fondée sur les éléments probants soutenant l'absence d'effets indésirables liés à la taurine en apports supplémentaires pouvant aller jusqu'à 3 000 mg/jour (Shao & Hathcock, 2008). Aucune teneur maximale en taurine n'a été publiée pour les AS autres que celle associée aux BEC. L'ajout de la taurine à des AS autres que les BEC a été évalué au cas par cas en tenant compte du profil de risque global de chaque produit.
2.0 Approche relative au calcul de la teneur maximale en taurine
La teneur maximale en taurine autorisée pendant la période des AMT était de 3 000 mg/jour, comme il est indiqué dans le Document d'orientation particulier à une catégorie - Autorisation de mise en marché temporaire - Boissons énergisantes contenant de la caféine pourrait ne pas tenir compte des autres catégories d'AS pouvant également contenir de la taurine. Puisque des considérations semblables s'appliqueraient à la taurine contenue dans d'autres AS (p. ex. la teneur sans danger observée englobe toutes les sources supplémentaires de taurine), une teneur maximale unique est proposée pour toutes les catégories d'AS. Afin d'atténuer le risque de dépasser les teneurs sans danger en taurine en consommant plusieurs AS de différentes catégories qui pourraient en contenir, et ce, sans qu'il ne soit nécessaire d'apposer des mises en garde supplémentaires, la quantité maximale de taurine a été révisée à 2 000 mg/jour.
Bien que les études sur la taurine à des teneurs supérieures à 3 000 mg/jour comportent souvent des échantillons de taille relativement petite et soient de courte durée, Santé Canada n'a identifié aucune préoccupation toxicologique importante, et ce pour une quantité pouvant atteindre 10 000 mg de taurine par jour (Pearl et coll., 2014, La Vieille et coll., 2021). Par conséquent, la consommation occasionnelle de plusieurs portions de différents AS (p. ex. jusqu'à 5 portions) contenant chacune de la taurine jusqu'à concurrence de 2 000 mg/jour, n'entraînerait pas d'effets nocifs sur la santé et ne nécessiterait pas d'autres mises en garde, en plus de celles requises pour les BEC pendant la période d'AMT.
Annexe 7 : Lignes directrices pertinentes de Santé Canada et autres ressources
- Aliments Supplémentés
- Allégations nutritionnelles fonctionnelles
- Allégations santé
- Allégations santé évaluées et acceptées
- Annexe A.1 de la Loi sur les aliments et drogues
- Avis de proposition et Avis de modification de Santé Canada
- Communiquer avec l'ACIA
- Étiquetage et publicité concernant les aliments
- L'étiquetage nutritionnel sur le devant des emballages
- Demande de détermination de nouveauté pour les aliments ou ingrédients alimentaires
- Examen des allégations santé
- Guides pour la préparation de demandes d'approbation d'allégations santé
- Législation et lignes directrices : Document d'orientation particulier à une catégorie - Autorisation de mise en marché temporaire - Boissons énergisantes contenant de la caféine
- Législation et lignes directrices : Document d'orientation particulier à une catégorie - Autorisation de mise en marché temporaire : Aliments supplémentés
- Législation et lignes directrices : Classification des produits situés à la frontière entre les aliments et les produits de santé naturels : produits sous forme d'aliments
- Lignes directrices sur l'évaluation de l'innocuité des aliments nouveaux dérivés des végétaux et des microorganismes
- Listes des additifs alimentaires autorisés
- Liste des déterminations d'aliments et d'ingrédients alimentaires qui ne sont pas nouveaux
- Monographie des suppléments de multivitamines et minéraux
- Monographie des suppléments à l'entraînement
- Monographie de la taurine
- Monographie des suppléments à l'entraînement de la Base de données d'ingrédients de produits de santé naturels
- Processus de gestion des demandes visant les additifs alimentaires, les préparations pour nourrissons et les aliments nouveaux de la Direction des aliments
- Outil d'étiquetage pour l'industrie de l'ACIA
- Renseignements nutritionnels complémentaires
- Renseignements sur l'incorporation par renvoi
- Renseignements nutritionnels et Règles d'arrondissement
- Signalement des incidents liés à la consommation d'aliments supplémentés
- Signaler une préoccupation alimentaire liée à la salubrité ou l'étiquetage
- Utilisation des mises en garde relatives aux allergènes alimentaires sur l'étiquette des aliments préemballés
- Valeurs quotidiennes pour les vitamines et minéraux nutritifs (2016)
Références citées
- Autorité européenne de sécurité des aliments (EFSA). (2015). Scientific Opinion on Dietary Reference Values for vitamin E as α-tocopherol. EFSA Journal, 13 (7). https://doi.org/10.2903/j.efsa.2015.4149
- Autorité européenne de sécurité des aliments (EFSA) Panel on Food Additives and Nutrient Sources added to Food (ANS). (2010). Scientific Opinion on the safety of trivalent chromium as a nutrient added for nutritional purposes to foodstuffs for particular nutritional uses and foods intended for the general population (including food supplements). EFSA Journal, 8 (12), 1882. https://doi.org/10.2903/j.efsa.2010.1882
- Autorité européenne de sécurité des aliments (EFSA) Scientific Committee on Food. (2006). Tolerable Upper Intake Levels for Vitamins and Minerals. http://www.efsa.eu.int
- Canadian Community Health Survey (CCHS). (2015). CCHS, 2015. https://www Enquête sur la santé dans les collectivités canadiennes (ESCC). (2015). ESCC, 2015. https://www.canada.ca/fr/sante-canada/services/aliments-nutrition/surveillance-aliments-nutrition/sondages-sante-nutrition/enquete-sante-collectivites-canadiennes-escc/guide-reference-comprendre-utiliser-donnees-2015.html
- Diététistes du Canada - Pratique en nutrition reposant sur des données probantes (PEN). (2015). Hémochromatosis/hémochromatosis. https://www.pennutrition.com/KnowledgePathway.aspx?kpid=22567&trid=23247&trcatid=38
- Direction des produits de santé naturels et sans ordonnance (DPSNSO). (2018). Monographie des suppléments de multivitamines/minéraux. http://webprod.hc-sc.gc.ca/nhpid-bdipsn/atreq.do?atid=multi_vitmin_suppl&lang=fra
- FAO Expert Consultation. (2013). Dietary protein quality evaluation in human nutrition.
- Friedman, M., et Levin, C. E. (2012). Nutritional value of d-amino acids, d-peptides, and amino acid derivatives in mice. Methods in Molecular Biology, 794, 337-353. https://doi.org/10.1007/978-1-61779-331-8_23
- Grinberg, N., Benkhedda, K., Barber, J., Krahn, A. D., et La Vieille, S. (2022). Effects of Caffeinated Energy Drinks on Cardiovascular Responses during Exercise in Healthy Adults: A Systematic Review and Meta-analysis of Randomized Controlled Trials. Applied Physiology, Nutrition, and Metabolism = Physiologie Appliquée, Nutrition et Metabolisme. https://doi.org/10.1139/APNM-2021-0807
- Gropper, S. S., Gropper, D. M., et Acosta, P. B. (1993). Plasma Amino Acid Response to Ingestion of L-Amino Acids and Whole Protein. Journal of Pediatric Gastroenterology and Nutrition, 16(2), 143-150. https://doi.org/10.1097/00005176-199302000-00008
- Gu, S.-X., Wang, H.-F., Zhu, Y.-Y., et Chen, F.-E. (2020). Natural Occurrence, Biological Functions, and Analysis of D-Amino Acids. Pharmaceutical Fronts, 02(02), e79-e87. https://doi.org/10.1055/s-0040-1713820
- Harper, A. E. (1958). Balance and imbalance of amino acids. Annals of the New York Academy of Sciences, 69(5), 1025-1041.
- Harper, A. E. (1970). Effects of ingestion of disproportionate amounts of amino acids. Physiological Reviews, 50(3), 428-558.
- Imamura, W., Yoshimura, R., Takai, M., Yamahura, J., Kanamoto, R., et Kato, H. (2013). Adverse Effects of Excessive Leucine Intake Depend on Dietary Protein Intake: A Transcriptomic Analysis to Identify Useful Biomarkers. Journal of Nutritional Science and Vitaminology, 59(1), 45-55. https://doi.org/10.3177/jnsv.59.45
- Kikuchi, A. M., Tanabe, A., et Iwahori, Y. (2021). A systematic review of the effect of L-tryptophan supplementation on mood and emotional functioning. Journal of Dietary Supplements, 18(3), 316-333. https://doi.org/10.1080/19390211.2020.1746725
- Kurpad, A. (2018). 90th Anniversary Commentary: Amino Acid Imbalances: Still in the Balance. The Journal of Nutrition, 148(10), 1647-1649.
- La Vieille, S., Gillespie, Z., Bonvalot, Y., Benkhedda, K., Grinberg, N., Rotstein, J., Barber, J., et Krahn, A. D. (2021). Caffeinated energy drinks in the canadian context: Health risk assessment with a focus on cardiovascular effects. Applied Physiology, Nutrition and Metabolism, 46(9), 1019-1028. https://doi.org/10.1139/APNM-2021-0245/SUPPL_FILE/APNM-2021-0245SUPPLA.DOCX
- Liu, N.-K., et Xu, X.-M. (2006). β-Tubulin Is a More Suitable Internal Control than β -Actin in Western Blot Analysis of Spinal Cord Tissues after Traumatic Injury. Journal of Neurotrauma, 23(12), 1794-1801. https://doi.org/10.1089/neu.2006.23.1794
- Macfarlane, A. J., Greene-Finestone, L. S., et Shi, Y. (2011). Vitamin B-12 and homocysteine status in a folate-replete population: results from the Canadian Health Measures Survey. The American Journal of Clinical Nutrition, 94(4), 1079-1087. https://doi.org/10.3945/ajcn.111.020230
- National Academies of Sciences, Engineering, and Medicine (NASEM). (2019). Dietary Reference Intakes for Sodium and Potassium. In Dietary Reference Intakes for Sodium and Potassium. National Academies Press. https://doi.org/10.17226/25353
- National Academies of Sciences Engineering and Medicine (NASEM) formerly the Institute of Medicine (IOM). (1998). Dietary Reference Intakes for Thiamin, Riboflavin, Niacin, Vitamin B6, Folate, Vitamin B12, Pantothenic Acid, Biotin, and Choline. Dietary Reference Intakes for Thiamin, Riboflavin, Niacin, Vitamin B6, Folate, Vitamin B12, Pantothenic Acid, Biotin, and Choline. National Academies Press. https://doi.org/10.17226/6015
- National Academies of Sciences Engineering and Medicine (NASEM) formerly the Institute of Medicine (IOM). (2000). Dietary Reference Intakes for Vitamin C, Vitamin E, Selenium, and Carotenoids. In Dietary Reference Intakes for Vitamin C, Vitamin E, Selenium, and Carotenoids. National Academies Press. https://doi.org/10.17226/9810
- National Academies of Sciences Engineering and Medicine (NASEM) formerly the Institute of Medicine (IOM). (2002). Dietary Reference Intakes for Energy, Carbohydrates, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids. http://www.nap.edu.
- National Academies of Sciences Engineering and Medicine (NASEM) formerly the Institute of Medicine (IOM). (2011). Dietary Reference Intakes for Calcium and Vitamin D. National Academies Press. https://doi.org/10.17226/13050
- National Academies of Sciences Engineering and Medicine (NASEM) formerly the Institute of Medicine (IOM) Panel on Micronutrients. (2001). Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Zinc. National Academies Press. https://doi.org/10.17226/10026
- National Academies of Sciences Engineering and Medicine (NASEM) formerly the Institute of Medicine Institute of Medicine (IOM) Standing Committee on the Scientific Evaluation of Dietary Reference Intakes. (1997). Dietary Reference Intakes for Calcium, Phosphorus, Magnesium, Vitamin D and Fluoride. https://www.ncbi.nlm.nih.gov/books/NBK109829/
- Nielsen. (2017). Nielsen Market Track, National All Channels.
- Organisation mondiale de la santé (OMS). (1996). Trace elements in human nutrition and health. WHO. https://apps.who.int/iris/handle/10665/37931?locale-attribute=fr&
- Park, B. C. (2006). Amino acid imbalance-biochemical mechanism and nutritional aspects. Asian-Australasian Journal of Animal Sciences, volume 19 (numéro 9), pp. 1361-1368). Asian-Australasian Association of Animal Production Societies. https://doi.org/10.5713/ajas.2006.1361
- Pearl, P. L., Schreiber, J., Theodore, W. H., Mccarter, R., Barrios, E. S., Yu, J., Wiggs, E., He, J., et Gibson, K. M. (2014). Taurine trial in succinic semialdehyde dehydrogenase deficiency and elevated CNS GABA. Neurology, 82(11), 940-944. https://doi.org/10.1212/WNL.0000000000000210
- Pencharz, P. B., Elango, R., et Ball, R. O. (2008). An approach to defining the upper safe limits of amino acid intake. Journal of Nutrition, 138(10), 1996S-2002S. https://doi.org/10.1093/jn/138.10.1996s
- Rodriguez, N. R., Dimarco, N. M., et Langley, S. (2009). Position of the American Dietetic Association, Dietitians of Canada, and the American College of Sports Medicine: Nutrition and athletic performance. Journal of the American Dietetic Association, 109 (3), 509-527. https://doi.org/10.1016/j.jada.2009.01.005
- Salmon, W. D. (1958). The Significance of Amino Acid Imbalance in Nutrition. The American Journal of Clinical Nutrition, 6(5), 487-494.
- Shao, A., et Hathcock, J. N. (2008). Risk assessment for the amino acids taurine, l-glutamine and l-arginine. Regulatory Toxicology and Pharmacology, 50(3), 376-399. https://doi.org/10.1016/j.yrtph.2008.01.004
- Toohey, J.. (2014). Sulfur amino acids in diet-induced fatty liver: a new perspective based on recent findings. Molecules, 19(6), 8334-8349.
- United Kingdom Expert Group on Vitamins and Minerals Contents (UK EVM). (2003). Safe Upper Levels for Vitamins and Minerals.
- Xiao, C. W., Wood, C., et Bertinato, J. (2019). Dietary supplementation with l-lysine affects body weight and blood hematological and biochemical parameters in rats. Molecular Biology Reports, 46(1), 433-442. https://doi.org/10.1007/s11033-018-4492-1.canada.ca/en/health-canada/services/food-nutrition/food-nutrition-surveillance/health-nutrition-surveys/canadian-community-health-survey-cchs/reference-guide-understanding-using-data-2015.html?wbdisable=true
Note de bas de page
- Note de bas de page 1
-
Aliments ne contenant pas de nutriments ajoutés ou d'autres substances ajoutées, autres que celles utilisées pour obtenir un effet nutritif ou technique (p. ex. additifs alimentaires) ou des ingrédients aromatisants utilisés dans les aliments.
- Note de bas de page 2
-
Aliments nécessitant l'ajout de vitamines, de minéraux nutritifs ou d'acides aminés, ou auxquels l'ajout est autorisé, à des fins nutritionnelles, c.-à-d. prévenir des déficiences nutritionnelles ou rétablir ou améliorer leur qualité nutritionnelle (voir section 3.2a)).
- Note de bas de page 3
-
L'apport maximal tolérable est l'apport quotidien moyen le plus élevé qui ne comporte vraisemblablement pas de risque d'effets indésirables pour la santé chez la plupart des membres d'un groupe donné, défini en fonction de l'étape de la vie et du sexe.
- Note de bas de page 4
-
Conformément au RAD, un microgramme de rétinol équivaut à un ÉAR, alors que 12 microgrammes de bêta carotène équivaut à un ÉAR.
- Note de bas de page 5
-
Le document est statique avec la publication du Règlement sur les aliments supplémentés.
- Note de bas de page 6
-
Le gotu kola n'est pas inclus dans la liste des ingrédients dont la consommation en qualité d'aliments est inappropriée. Bien que le gotu kola peu transformé soit un aliment, cela ne signifie pas que l'utilisation d'ingrédients dérivés du gotu kola (p. ex. des extraits) est automatiquement autorisée pour un usage alimentaire. Pour obtenir de plus amples renseignements, communiquer avec la Direction des aliments de Santé Canada.
- Note de bas de page 7
-
L'apport maximal tolérable est l'apport quotidien moyen le plus élevé qui ne comporte vraisemblablement pas de risques d'effets indésirables pour la santé chez la plupart des membres d'un groupe donné, défini en fonction de l'étape de la vie et du sexe.
- Note de bas de page 8
-
L'apport alimentaire usuel est l'apport quotidien moyen à long terme d'un nutriment ou d'un aliment.
- Note de bas de page 9
-
Entrées basées sur le groupe âge-sexe le plus vulnérable, c'est-à-dire les personnes âgées de 14 ans et plus.