Faits saillants sur les médicaments et les instruments médicaux 2020 : Instruments médicaux
Sur cette page
- Instruments médicaux : 2020 en bref
- Instruments médicaux : quoi de neuf en 2020
- Instruments médicaux : réalisations de 2020
- Clics santé : Aperçu des instruments médicaux
- Instruments médicaux : Cycle de vie
Instruments médicaux : 2020 en bref
L'un des rôles de Santé Canada est de réglementer les instruments médicaux qui peuvent aider les Canadiens à maintenir et à améliorer leur santé. Les instruments médicaux sont utilisés pour le traitement, le diagnostic ou la prévention de maladies ou de conditions physiques anormales.
Au Canada, les instruments médicaux sont classés en quatre groupes, selon le niveau de risque associé à leur utilisation. Ces groupes sont appelés « classes » et sont numérotés de I à IV. Les instruments de classe I sont considérés comme des instruments à faible risque. Il peut s'agir, par exemple, d'un fauteuil roulant. Les instruments de classe IV sont ceux qui présentent le plus grand risque, par exemple, un défibrillateur.
En 2020, nous avons lancé une nouvelle Direction des instruments médicaux, qui est chargée de réglementer les instruments médicaux tout au long de leur cycle de vie. Cette nouvelle structure nous aide à nous adapter à la croissance et à l'évolution rapides du secteur des instruments médicaux, et nous a permis d'accroître notre capacité à réglementer ce secteur.
La pandémie de COVID-19 a créé un besoin urgent d'accès à des instruments médicaux sécuritaires, efficaces et de haute qualité. Notre réponse à la pandémie a abordé les problèmes critiques liés aux instruments médicaux tout au long du cycle de vie des produits.
Réponse à la pandémie de COVID-19
Nous avons introduit des mesures réglementaires innovantes et agiles dans le cadre de la réponse du gouvernement à la pandémie. Ces mesures ont permis d'accélérer l'examen réglementaire des instruments médicaux liés à la COVID-19 sans compromettre l'innocuité, l'efficacité et les normes de qualité.
En 2020, nous avons autorisé 545 instruments médicaux liés à la COVID-19 et 18 essais cliniques pour des instruments médicaux liés à COVID-19.
Pour en savoir plus sur notre réponse à la pandémie de COVID-19, consultez la rubrique « Instruments médicaux : réalisations de 2020 ».
Nouveaux instruments médicaux approuvés
En 2020 nous avons approuvé 332 nouveaux instruments médicaux dans les catégories de risque les plus élevées (classes III et IV). Ces instruments offrent aux patients et aux professionnels de la santé des options nouvelles et innovantes pour le traitement, la prévention et le diagnostic de divers problèmes de santé. Par exemple, nous avons approuvé le test rapide INSTI pour le VIH, le premier test de dépistage personnel à domicile pour le VIH approuvé au Canada.
Pour consulter la liste et la description des 55 nouveaux instruments médicaux de classe IV (risque le plus élevé) que nous avons approuvés en 2020, consultez la section « Approuvés en 2020 : Instruments médicaux ».
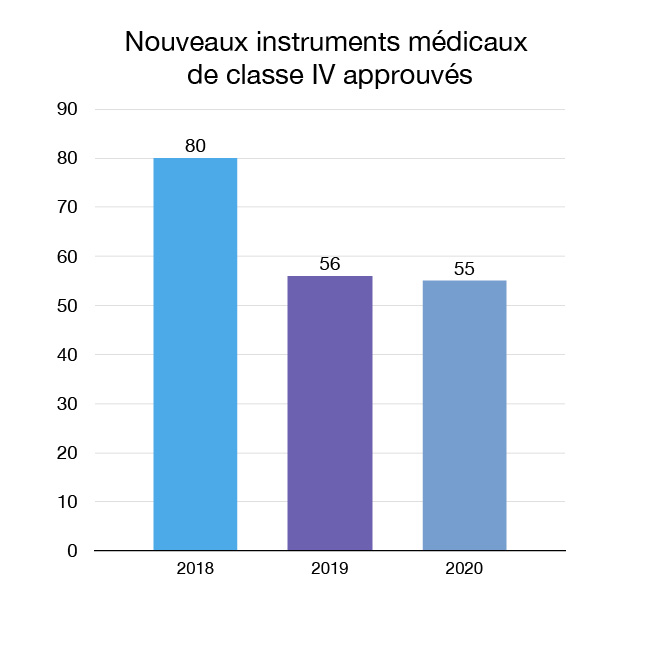
Figure 7 : Nouveaux instruments médicaux de classe IV approuvés : Équivalent textuel
| Année | Nouveaux instruments médicaux de classe IV approuvés |
|---|---|
| 2018 | 80 |
| 2019 | 56 |
| 2020 | 55 |
Essais expérimentaux (essais cliniques) et programme d'accès spécial
Nous examinons les demandes pour permettre aux entreprises d'effectuer des essais expérimentaux (essais cliniques) avec des instruments médicaux au Canada. De nouveaux essais signifient que les Canadiens pourraient avoir accès à des instruments plus innovants. En 2020, 122 nouvelles demandes d'autorisation d'essai expérimental pour des instruments médicaux ont été approuvées.
Nous avons autorisé des tests expérimentaux pour des stimulateurs cardiaques sans fil dans le cadre d'une étude mondiale, ainsi qu'un test de dépistage au point de service du VIH et de la syphilis destinée aux populations vulnérables et aux collectivités isolées. Nous avons également autorisé des essais expérimentaux d'instruments médicaux utilisant l'intelligence artificielle pour la détection précoce de la COVID-19 dans les poumons et pour l'évaluation des signes vitaux sans contact.
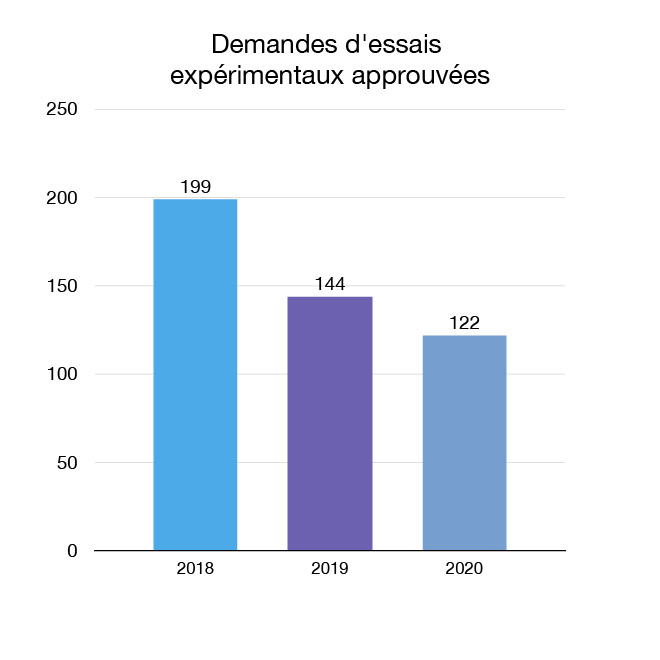
Figure 8 : Demandes d'essais expérimentaux approuvées : Équivalent textuel
| Année | Demandes d'essais expérimentaux approuvées |
|---|---|
| 2018 | 199 |
| 2019 | 144 |
| 2020 | 122 |
Grâce à notre Programme d'accès spécial, nous accordons aux professionnels de la santé l'accès à des instruments médicaux dont la vente n'a pas été approuvée au Canada, pour une utilisation d'urgence ou lorsque les autres solutions ne conviennent pas ou ne sont pas disponibles. En 2020, 2 693 demandes d'accès spécial à des instruments médicaux ont été autorisées. Il s'agit notamment de détecteurs portatifs destinés à faciliter le dépistage des patients atteints de la COVID-19 et de ventilateurs dont l'approvisionnement était insuffisant au début de la pandémie. Le Programme a également facilité la fourniture d'instruments médicaux dont le besoin était critique après les retards créés par la pandémie (par exemple, dans le transport).
En 2020, nous avons également autorisé :
- des instruments cardiovasculaires qui permettent des procédures moins invasives,
- des instruments pour le traitement des anévrismes récurrents complexes pour une utilisation compassionnelle,
- des instruments liés à la transplantation d'organes pour les jeunes patients,
- des incubateurs pour nourrissons compatibles avec l'IRM.
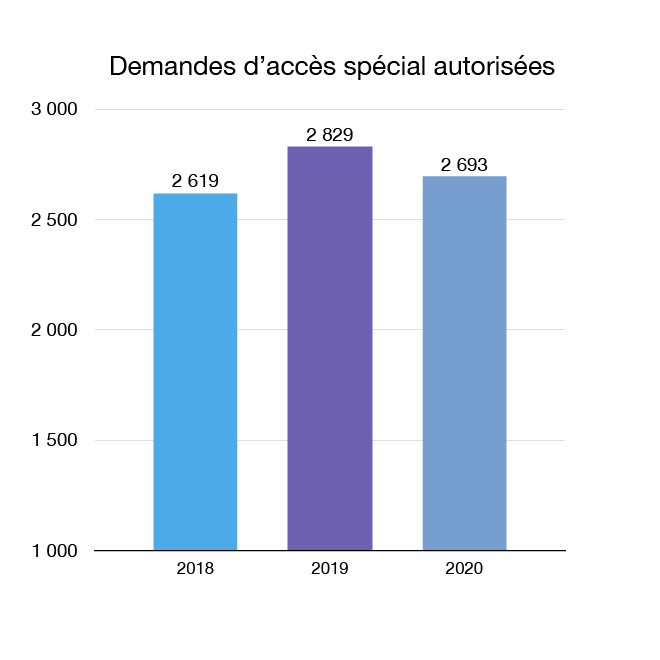
Figure 9 : Demandes d'accès spécial autorisées : Équivalent textuel
| Année | Demandes d'accès spécial autorisées |
|---|---|
| 2018 | 2 619 |
| 2019 | 2 829 |
| 2020 | 2 693 |
Surveillance
Après avoir approuvé la vente d'un instrument médical au Canada, nous continuons de surveiller et d'évaluer les rapports d'incidents soupçonnés touchant cet instrument.
En 2020, nous avons reçu 39 304 rapports d'incidents liés aux instruments médicaux et avons entrepris 2 actions liées aux instruments médicaux. Les rapports d'incident proviennent de sources nationales et internationales. Ces mesures peuvent comprendre la transmission de nouveaux renseignements relatifs à la sécurité aux Canadiens et aux professionnels de la santé ou la recommandation de modifications aux étiquettes, ou l'affirmation de notre compréhension actuelle de l'instrument. Par exemple, à la suite d'un récent examen des amalgames dentaires, nous avons signalé que les données les plus récentes ne montraient toujours pas de lien clair entre les amalgames dentaires et les méfaits du mercure. Dans les situations où un risque grave est établi, nous pouvons retirer un instrument médical du marché.
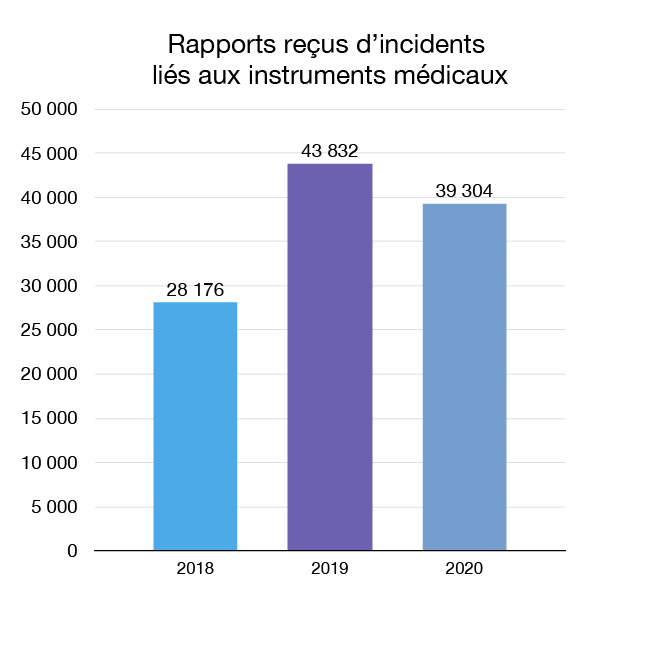
Figure 10 : Rapports reçus d'incidents liés aux instruments médicaux : Équivalent textuel
| Année | Rapports reçus d'incidents liés aux instruments médicaux |
|---|---|
| 2018 | 28 176 |
| 2019 | 43 832 |
| 2020 | 39 304 |
Pour savoir comment nous avons géré les problèmes d'innocuité liés aux instruments médicaux au Canada en 2020, consultez la section « Approuvés en 2020 : Instruments médicaux ».
Transparence du processus décisionnel
En 2020, nous avons continué à faire progresser nos efforts d'ouverture et de transparence en augmentant la quantité d'informations réglementaires sur la santé et la sécurité qui sont mises à la disposition des Canadiens. Nous avons publié 387 résumés de décisions réglementaires et un document de résumé des motifs de décision, qui expliquent les décisions de Santé Canada pour certains instruments médicaux demandant une autorisation de mise sur le marché.
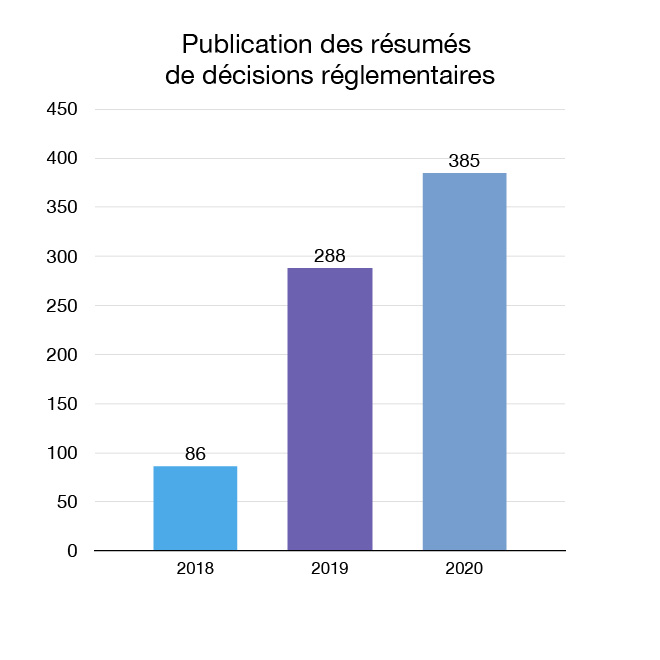
Figure 11 : Résumés de décisions réglementaires publiés : Équivalent textuel
| Année | Résumés de décisions réglementaires publiés |
|---|---|
| 2018 | 86 |
| 2019 | 288 |
| 2020 | 385 |
Nous avons publié 1 859 pages de renseignements cliniques au sujet de huit instruments médicaux par l'entremise de notre portail de renseignements cliniques. Ces renseignements cliniques sont fournis par les entreprises lorsqu'elles demandent l'autorisation de vendre un instrument médical au Canada. Ils sont rendus publics sur demande après que nous ayons décidé d'approuver ou non le produit.
Santé Canada publie également des résumés de ses examens de l'innocuité, qui décrivent les décisions de Santé Canada concernant les problèmes d'innocuité potentiels. En 2020, nous avons publié un résumé de ce type pour des instruments médicaux. Ces résumés complètent d'autres informations relatives à l'innocuité pour aider les Canadiens à prendre des décisions éclairées sur leurs choix d'instruments médicaux.
Ce chapitre sur les instruments médicaux contient plus de renseignements sur le travail que nous avons accompli en 2020. Pour obtenir des renseignements à jour sur nos activités, veuillez consulter la section intitulée « Clics santé : Aperçu des instruments médicaux » et nous suivre sur les médias sociaux.

Directeur générale,
Instruments médicaux

Directrice générale,
Produits de santé commercialisés
Instruments médicaux : quoi de neuf en 2020
En 2020, nous avons approuvé 55 nouveaux instruments médicaux de classe IV (risque le plus élevé). Vous trouverez d'autres renseignements dans la section intitulée « Approuvés en 2020 : Instruments médicaux ».
Instruments de gestion des fluides corporels et des tissus
- Système de transduction des cellules T (TCT) Prodigy de CliniMACS
- Système d'aspiration ultrasonique Sonopet iQ
Instruments pour la manipulation et la réparation des tissus cellulaires
- Membrane de collagène bicouche Chondro-Gide
- Myriad
- Puracol Plus
- Système d'implants bioinductifs Regeneten
Instruments cardiovasculaires
- Athletis Over-The-Wire PTA cathéter de dilatation à ballonnet
- Attain Stability Quad MRI SureScan 4798
- Cathéter à ballonnet PTA Ranger et Ranger SL Over-the-Wire enrobé de Paclitaxel
- Cathéter d'ablation IntellaNav StablePoint
- Cathéter d'électrophysiologie fixe EPstar
- Cathéter de dilatation à ballonnet Jade PTA
- Cathéter de dilatation à ballonnet Scoreflex PTA
- Cathéter de dilatation coronaire Sapphire II NC
- Cathéter de dilatation coronaire Scoreflex NC
- Cathéter de micronavigation QDot
- Cathéter orientable Agilis HisPro avec électrodes
- Cathéter retraité ViewFlex Xtra ICE
- Cobalt XT/Cobalt/Crome ICD et CRT-D IRM SureScan
- Conduit à valve aortique Konect Resilia
- Défibrillateur à thérapie de resynchronisation cardiaque (CRT-DS)
- Défibrillateur cardioverteur implantable (ICDS)
- Guide de stimulation temporaire de Wattson
- IntellaNav ST
- Micra AV MC1AVR1
- Sonde de stimulation endocardiaque Vega
- Système d'athérectomie coronaire orbitale Diamondback 360
- Système d'endoprothèse à élution d'évérolimus Xience Sierra Pro A
- Système d'endoprothèse coronaire Synergy Monorail à élution d'évérolimus et platine-chrome
- Système d'endoprothèse coronaire Synergy Monorail XD à élution d'évérolimus et platine-chrome
- Système d'endoprothèse vasculaire à élution médicamenteuse Eluvia Over-the-Wire
- Système de bobine Penumbra LP
- Système de dérivation de débit Surpass Evolve
- Système de programmation Smart Touch
- Système de protection cérébrale Sentinel
- Système de valve Lotus Edge
- Système TriClip
- Valve aortique transcathéter Evolut PRO+
- Zoll X Series Advanced
Instruments gastro-urologiques
- InterStim Micro SureScan IRM
Instruments hospitaliers généraux
- Cathéter d'électrophysiologie fixe EPstar avec lumière et câble d'électrophysiologie EPstar
- MiniMed 770G
- Pompe à insuline t: slim X2 avec technologie Control-IQ
Instruments médicaux de diagnostiques in vitro
- ADVIA Centaur HBC Total 2 (HBcT2) (dépistage chez les donneurs en vue d'une transplantation)
- ADVIA Centaur Quantitative HBsAg (QHBs)
- Atellica IM Quantitative HBsAg (QHBs)
- Autotest VIH INSTI
- Ensemble de contrôle du système PK CMV-PA
- Épreuve combinée VIH Ag/Ab Alinity S (donneurs vivants et cadavériques)
- Liaison XL Murex HCV AB
- Réactif et contrôles PK7400 TP HA
Instruments de neurologie
- Générateurs d'impulsions implantables Proclaim
- Percept PC
Instruments de chirurgie plastique et esthétique
- Implant mammaire cohésif Natrelle Inspira
Appareils radiologiques
- Système Acist HDi
Instruments médicaux : réalisations de 2020
Réponse à la pandémie de COVID-19
La pandémie de COVID-19 a eu de profondes répercussions sur la santé et le bien-être des Canadiens en 2020. Elle a créé une demande sans précédent sur le système de soins de santé du Canada et a entraîné un besoin urgent d'accès aux produits de santé.
La réponse de Santé Canada à la pandémie a porté sur des questions essentielles liées aux instruments médicaux tout au long du cycle de vie des produits, des essais expérimentaux (essais cliniques) à la surveillance en passant par l'autorisation des instruments médicaux.
Essais expérimentaux (essais cliniques)
En mai 2020, la ministre de la Santé a signé l'Arrêté d'urgence sur les essais cliniques d'instruments médicaux et de drogues en lien avec la COVID-19. Cette mesure temporaire a facilité un processus d'autorisation plus efficace pour les essais expérimentaux (essais cliniques) au Canada, en élargissant l'éventail des promoteurs qui peuvent soumettre une demande d'essai expérimental. Il offrait une plus grande flexibilité en matière d'exigences administratives, sans compromettre la sécurité des patients ou la validité des résultats des essais.
En outre, nous avons accéléré l'autorisation des essais relatifs à la COVID-19. Les demandes ont été examinées plus rapidement que d'habitude, afin d'accélérer l'accès sans compromettre la sécurité des patients. Nous avons travaillé avec des entreprises, des centres de recherche universitaires et des chercheurs qui avaient des produits en cours de développement, afin de les guider et de les aider à réaliser des essais cliniques au Canada.
En 2020, nous avons autorisé 18 essais cliniques pour des instruments médicaux liés à COVID-19.
Pour plus d'informations, veuillez consulter notre page Web Instruments médicaux contre la COVID-19 : Tenue d'essais cliniques.
Programme d'accès spécial
Le Programme d'accès spécial est destiné aux professionnels de la santé qui traitent des patients gravement malades pour lesquels les thérapies conventionnelles ont échoué, sont inadaptées ou ne sont pas disponibles. En 2020, la pandémie a créé des problèmes de chaîne d'approvisionnement, entraînant des pénuries d'instruments médicaux indispensables. Lorsque ceux-ci n'étaient pas disponibles au Canada, le programme a facilité l'accès rapide à des instruments médicaux susceptibles de répondre aux besoins urgents des professionnels de la santé et de leurs patients.
Pour plus d'informations, consultez les Programmes d'accès spécial de Santé Canada : Aperçu.
Pleins feux sur…
L'accès aux instruments médicaux durant la pandémie
Les Canadiens ont subi des pénuries d'instruments médicaux indispensables en raison de retards de fabrication et d'expédition engendrés par la pandémie. Grâce au mandat d'accès d'urgence du Programme d'accès spécial, l'équipe a travaillé directement avec les professionnels de la santé et les fabricants étrangers pour obtenir des informations sur des instruments de remplacement. Au début de l'année 2020, il s'agissait notamment d'échographes portatifs sans fil utilisés pour diagnostiquer une insuffisance respiratoire chez des patients soupçonnés d'être atteints de la COVID-19. Au fur et à mesure que la pandémie progressait, des ventilateurs et des accessoires respiratoires pour ventilateurs étaient également nécessaires. Santé Canada a déterminé la sécurité et l'efficacité de ces nouveaux instruments et a travaillé en étroite collaboration avec les professionnels de la santé et les fabricants pour assurer un accès et une livraison rapides.
« Les membres de l'équipe du Programme d'accès spécial aux instruments médicaux comprennent un superviseur, deux employés administratifs et une étudiante. Notre équipe a travaillé avec diligence avec les praticiens de la santé et les fabricants étrangers par téléphone et par courriel tout au long de la semaine de travail, ainsi que la fin de semaine avec notre ligne téléphonique d'urgence 24/7, pour fournir des conseils et obtenir suffisamment d'informations pour notre bureau d'évaluation. »
Leo Periard
Commis,
Instruments médicaux
Marina Whyte
Commis,
Instruments médicaux
Peggy Seely
Superviseure,
Instruments médicaux
Erica Pierre-Pierre
Étudiante,
Instruments médicaux
Instruments médicaux
Les instruments médicaux jouent un rôle important dans le diagnostic, le traitement, l'atténuation ou la prévention de la COVID-19. Les instruments médicaux typiques utilisés en lien avec la COVID-19 comprennent les masques, les respirateurs N95, les gants, les blouses, les ventilateurs et les instruments de dépistage.
Santé Canada a introduit des mesures réglementaires innovantes et agiles dans le cadre de la réponse du gouvernement à la pandémie. Celles-ci nous ont permis d'accélérer l'examen réglementaire des instruments médicaux utilisés avec la COVID-19, sans compromettre nos normes élevées en matière de sécurité, d'efficacité et de qualité. Ils ont également permis l'importation et la vente au Canada de certains instruments médicaux qui ne répondent peut-être pas entièrement aux exigences réglementaires.
Pour plus d'informations sur les arrêtés d'urgence qui ont été publiés pour répondre à la pandémie de COVID-19, consultez la rubrique « Message du chef principal de la réglementation ».
En 2020, nous avons approuvé 545 instruments médicaux pour des utilisations liés à la COVID-19 : Pour consulter les listes d'instruments médicaux autorisés, consultez la rubrique Instruments médicaux autorisés pour les utilisations liées à la COVID-19 : Aperçu.
Nous suivrons de près l'utilisation de ces produits dans le monde réel, évaluerons les problèmes potentiels d'innocuité et d'efficacité et prendrons des mesures en cas de problèmes.
Pleins feux sur…
Encourager l'impression 3D d'instruments médicaux
En mars 2020, la demande de certains instruments médicaux, y compris les équipements de protection individuelle (EPI), a dépassé l'offre disponible au Canada. Des centres de recherche, des établissements universitaires et d'autres secteurs industriels se sont intéressés à l'impression 3D d'équipements de protection individuelle pour pallier la pénurie. Nous avons joint d'urgence nos contacts dans l'industrie, les hôpitaux, les universités, les collèges et les installations de fabrication industrielle. Un réseau national d'experts en impression 3D a rapidement été créé, comprenant plus de 80 organisations à travers le Canada.
Grâce à ce réseau, nous avons partagé des informations techniques et réglementaires afin de garantir que les équipements de protection individuelle imprimés en 3D soient sûrs, efficaces et de haute qualité. Le réseau a permis une communication ouverte et transparente entre les organismes de réglementation, les médecins et les fabricants d'instruments médicaux non traditionnels. Grâce aux informations fournies de cette façon, nous avons publié des lignes directrices pour l'industrie sur l'impression 3D des équipements de protection individuelle en réponse à la COVID-19. Ces lignes directrices ont contribué à garantir la production d'équipements de protection individuelle sûrs, efficaces et de haute qualité pour les travailleurs de la santé canadiens.
« C'était incroyable non seulement de voir les Canadiens prêts à aider en temps de crise, mais aussi de voir la passion et le dévouement de tous ceux qui se sont mobilisés pour aider à relever la barre de la sécurité et de la qualité des équipements de protection individuelle imprimés en 3D pour nos travailleurs de la santé canadiens. »
Marc Lamoureux
Gestionnaire,
Instruments médicaux
Pleins feux sur…
Les respirateurs N95
Les respirateurs N95 à usage unique sont un type d'équipement de protection individuelle (EPI) qui protège les travailleurs de la santé des particules en suspension dans l'air. Ils sont considérés comme essentiels lorsqu'on travaille autour de pathogènes aériens comme le SRAS-CoV-2. Au fur et à mesure que la pandémie de COVID-19 se développait, la pénurie de respirateurs N95 au Canada a atteint un point critique où elle menaçait la capacité des travailleurs de la santé à prodiguer des soins aux patients atteints de COVID-19 sans risquer leur propre santé.
Les respirateurs N95 sont normalement jetés après une seule utilisation. Afin de remédier à la pénurie de respirateurs N95, Santé Canada a collaboré étroitement avec les intervenants. Nous avons travaillé rapidement pour établir les exigences réglementaires pour le retraitement des respirateurs N95. Nous avons invité l'industrie à proposer des solutions innovantes pour le retraitement des masques respiratoires N95 et avons fourni des conseils réglementaires lorsque requis. Des mesures réglementaires provisoires ont également été mises en place pour accélérer l'approbation des instruments médicaux qui répondent aux exigences réglementaires pour le retraitement sûr et efficace des respirateurs N95.
Si le retraitement des instruments à usage unique n'est pas un concept nouveau, le retraitement des masques N95 était une façon entièrement nouvelle de faire les choses. Nous avons échangé avec les autorités sanitaires et les prestataires de soins de santé afin de les rassurer sur le fait que les instruments médicaux approuvés pour le retraitement des respirateurs N95 répondaient aux normes réglementaires et constituaient une option lorsque de nouveaux respirateurs N95 n'étaient pas disponibles.
« Dans les premiers jours de la pandémie, les professionnels de la santé ont été confrontés à une situation critique, car les respirateurs N95 étaient en pénurie. J'ai été incroyablement touché par la façon dont nous nous sommes tous réunis et avons travaillé sans relâche pour résoudre ce problème important. »
Evelyn Soo
Directrice,
Produits thérapeutiques
Surveillance des instruments médicaux liés à la COVID-19
Nous avons surveillé l'innocuité et l'efficacité des instruments médicaux liés à la COVID-19, et pris des mesures lorsque requises pour protéger les Canadiens.
Notre travail comprenait les mesures suivantes :
- prendre des mesures proactives pour repérer les incidents liés aux instruments médicaux utilisés contre la COVID-19 (produits explicitement approuvés pour une utilisation contre la COVID-19 ainsi que ceux qui étaient utilisés « hors indication », ou en dehors de l'utilisation approuvée du produit),
- surveiller les détaillants et les publicités qui faisaient des allégations fausses, trompeuses et illégales concernant la COVID-19,
- publier des communications sur les risques concernant les problèmes potentiels d'innocuité et d'efficacité,
- travailler en étroite collaboration avec des partenaires internationaux pour surveiller la sécurité et l'efficacité des instruments médicaux contre la COVID-19 dans le monde réel.
Pénurie d'instruments médicaux
Au début de la pandémie, il était évident que la COVID-19 avait une incidence sur l'approvisionnement en instruments médicaux essentiels au Canada. Nous avons introduit des mesures réglementaires qui ont fourni davantage d'outils pour répondre de manière urgente aux pénuries d'instruments médicaux liées à la COVID-19. Nous avons également travaillé avec les provinces et les territoires, les entreprises et les fabricants, les fournisseurs de soins de santé et les groupes de patients pour renforcer la chaîne d'approvisionnement en instruments médicaux au Canada. Ces collaborations nous ont permis d'identifier, de prévenir et d'atténuer les pénuries pour les Canadiens.
Pour plus d'informations, consultez la section consacrée à la lutte contre les pénuries de produits essentiels.Communications et collaborations
Tout au long de la pandémie, Santé Canada a publié plusieurs pages Web pour fournir des informations aux Canadiens et aux partenaires réglementaires. Nos pages Web fournissent des informations sur les différents produits de santé que nous réglementons, y compris les essais cliniques autorisés, les instruments médicaux autorisés, les instruments de dépistage en cours d'évaluation et plus encore.
Nous avons également publié des pages Web qui ont fourni des informations essentielles à l'industrie des instruments médicaux sur notre réglementation des produits contre la COVID-19. Nous avons élaboré des lignes directrices pour aider l'industrie à développer des instruments médicaux pour aider pendant la crise.
Nous avons également publié un certain nombre de communications sur les risques à l'intention des Canadiens afin de leur fournir des informations importantes sur les instruments médicaux liés à la COVID-19.
Nous avons travaillé en étroite collaboration avec nos partenaires nationaux, notamment les gouvernements provinciaux et territoriaux, les fournisseurs de soins de santé et les groupes de patients. Nous avons cherché à connaître leur point de vue sur les priorités et les défis auxquels ils étaient confrontés au sein du système de soins de santé à la suite de la pandémie. Grâce à des webinaires, nous avons pu partager des informations avec les professionnels de la santé sur des sujets importants tels que l'approbation réglementaire du retraitement des respirateurs N95.
Nous avons collaboré avec les organismes de réglementation d'autres pays sur des questions liées aux essais expérimentaux (essais cliniques), à l'examen des instruments médicaux, aux évaluations des risques et aux pénuries potentielles d'instruments médicaux. Ces travaux ont contribué à s'assurer que les instruments médicaux soient sécuritaires et efficaces, et qu'ils soient disponibles rapidement pour les Canadiens. Nous avons également travaillé en étroite collaboration avec l'Organisation mondiale de la santé et le groupe de travail contre la COVID-19 (en anglais seulement) de l'Organisation panaméricaine de la santé. Ces partenariats nous ont permis d'harmoniser notre approche à la réponse mondiale à la pandémie de la COVID-19.
Pleins feux sur…
Le site Web pour l'industrie des produits de santé contre la COVID-19
Au début de la pandémie, Santé Canada a rapidement mis en place un site Web pour informer les intervenants des produits de santé sur les exigences réglementaires dans le contexte de la COVID-19. Le site Web communique aux intervenants des informations prioritaires, des lignes directrices et des conseils sur les produits de santé liés à la COVID-19, y compris les instruments médicaux (comme l'équipement de protection individuelle et les ventilateurs).
Il comprend des informations faciles d'accès sur les nouvelles mesures temporaires mises en place pour accélérer l'examen de ces produits. De cette manière, il soutient les intervenants traditionnels ainsi que les nouveaux venus dans le secteur qui ont besoin de conseils supplémentaires.
Le site Web a été maintenu et mis à jour tout au long de la pandémie, recevant près de 10 millions de visites entre son lancement en mars 2020 et la fin du mois de décembre. Avec une moyenne de 230 000 visites par semaine, il reste une ressource utile pour les intervenants.
« En mars 2020, nos équipes ont été confrontées à un volume incroyable de questions réglementaires liées à la COVID-19 de la part des intervenants. Conscients du besoin urgent de communiquer avec les intervenants, qu'ils soient nouveaux ou réguliers, nous avons créé un site Web qui servirait de centre d'informations principales. » Le site Web qui en a résulté a contribué à réduire le volume des demandes de renseignements et a permis à notre personnel de concentrer ses efforts sur les activités essentielles à la réponse à la COVID-19. »
Elizabeth Toller
Directrice exécutive,
Politiques, planification et affaires internationales
Nous avons commencé l'année 2021 au milieu de la deuxième vague de la pandémie. Nous poursuivrons ce travail essentiel afin que les Canadiens continuent d'avoir accès aux instruments médicaux liés à la COVID-19.
Innovation réglementaire
Le rythme actuel de l'innovation est sans précédent. Cela a donné naissance à de nouveaux produits de santé de plus en plus complexes et personnalisés. Nous avons besoin de nouvelles approches réglementaires pour mieux soutenir l'accès à ces technologies de la santé, tout en continuant à protéger la sécurité des patients.
Santé Canada a continué de privilégier l'innovation réglementaire en 2020. La pandémie de la COVID-19 a affecté le calendrier de ce travail. Cependant, elle a également été l'occasion de tester certaines mesures agiles temporaires. Nous utiliserons les leçons tirées de notre réponse réglementaire à la COVID-19 pour étayer notre travail d'innovation réglementaire, notamment :
- moderniser la réglementation des essais expérimentaux (essais cliniques) afin de créer un environnement favorable à des essais plus innovants,
- permettre l'accès à des produits thérapeutiques avancés qui ne correspondent pas à notre système actuel,
- octroyer des licences agiles pour les instruments médicaux, en utilisant des outils flexibles pour superviser les produits tout au long de leur cycle de vie, et
- mettre à jour la façon dont nous communiquons aux Canadiens les informations sur les produits de santé.
Pour plus d'informations, consultez la rubrique Innovation réglementaire pour les produits de santé.
Établir des partenariats internationaux
Depuis de nombreuses années, Santé Canada travaille en étroite collaboration avec les organismes de réglementation du monde entier sur les questions liées aux instruments médicaux. Cette coopération s'est poursuivie en 2020, tant sur les dossiers liés à la COVID-19 (voir la section « Instruments médicaux : réalisations de 2020 – répondre à la pandémie de COVID-19 ») et dans notre travail quotidien.
Nous avons poursuivi notre travail avec le Forum international des autorités de réglementation des instruments médicaux (en anglais seulement). Ce groupe d'organismes de réglementation des instruments médicaux travaille à l'harmonisation de la réglementation des instruments médicaux. Cette collaboration permet de mettre des instruments médicaux innovants plus rapidement à la disposition des patients du monde entier.
En 2020, nous avons coprésidé un groupe de travail du Forum international des autorités de réglementation des instruments médicaux sur la cybersécurité, qui a publié des principes et des pratiques sur la cybersécurité des instruments médicaux (en anglais seulement). Nous avons également participé à un nouveau groupe de travail sur les instruments médicaux munis d'intelligence artificielle.
Dans le cadre du Conseil de coopération en matière de réglementation, Santé Canada a continué de travailler avec la Food and Drug Administration des États-Unis, par l'intermédiaire du Forum international des autorités de réglementation des instruments médicaux, afin de mettre sur pied un programme d'examen unique des instruments médicaux. Ce programme améliorera l'accès des patients aux instruments médicaux, appuyera l'innovation et renforcera l'élaboration de normes. Santé Canada et la Food and Drug Administration ont collaboré à l'examen de l'instrument médical Affinity NT Oxygenator with Balance Biosurface, qui a été approuvé dans les deux pays.
Plan d'action sur les instruments médicaux
Le Plan d'action de Santé Canada sur les instruments médicaux a été lancé en 2018 dans le but de renforcer le système de réglementation des instruments médicaux. Au moyen du Plan d'action, nous visons à améliorer continuellement l'innocuité, l'efficacité et la qualité des instruments médicaux au Canada. En 2020, nous avons poursuivi nos efforts dans les trois volets du Plan d'action sur les instruments médicaux.
Améliorer la mise en marché des instruments médicaux au Canada
Nous avons continué de solliciter des conseils des communautés scientifique, médicale et des patients sur les questions actuelles et émergentes. Nous avons tenu des réunions des comités consultatifs scientifiques sur les instruments médicaux utilisés pour l'appareil cardiovasculaire et les produits de santé pour les femmes. Ces comités nous fournissent en permanence des conseils et des recommandations sur les questions de réglementation des instruments médicaux.
Renforcer la surveillance et le suivi des instruments médicaux
Pour améliorer la surveillance des instruments médicaux une fois qu'ils sont sur le marché, nous avons publié un règlement relativement à la surveillance des instruments médicaux après leur mise en marché. Ce règlement a mis en vigueur certaines dispositions de la Loi de Vanessa pour les instruments médicaux et a introduit des mesures supplémentaires pour recueillir des informations sur l'innocuité. Il renforce notre capacité à recueillir des informations après la mise sur le marché et à prendre des mesures appropriées lorsqu'un problème d'innocuité grave est identifié.
Mieux informer les Canadiens
En 2020, nous avons continué à faire progresser nos efforts d'ouverture et de transparence en augmentant la quantité d'informations réglementaires sur la santé et la sécurité qui sont mises à la disposition des Canadiens. Pour plus d'informations sur le portail d'informations cliniques et les résumés des décisions réglementaires, consultez la rubrique « Instruments médicaux : 2020 en bref ».
Déclaration obligatoire des incidents liés aux instruments médicaux
En 2020, Santé Canada a soutenu la mise en œuvre de la nouvelle réglementation sur la déclaration obligatoire par les hôpitaux, entrée en vigueur en décembre 2019. Cette réglementation permettra d'augmenter la quantité et d'améliorer la qualité des rapports d'incidents liés aux instruments médicaux. Les hôpitaux sont maintenant tenus de déclarer à Santé Canada tous les incidents liés aux instruments médicaux à l'intérieur d'un délai de 30 jours suivant la documentation de ces incidents par l'hôpital.
Santé Canada a conçu des outils pour soutenir les hôpitaux, notamment un document d'orientation, des modules d'éducation et du matériel promotionnel.
Le nombre de rapports sur les incidents liés aux instruments médicaux soumis à Santé Canada par les hôpitaux a augmenté de 620 % en 2020. Après la mise en œuvre de la déclaration obligatoire, plusieurs éléments de données du formulaire de déclaration sont devenus obligatoires afin de garantir que des détails importants soient fournis à Santé Canada. Ces informations supplémentaires visent à élargir les données utilisées par Santé Canada pour surveiller la sécurité et l'efficacité des instruments médicaux.
Clics santé : Aperçu des instruments médicaux
Pour demeurer au courant de nos activités :
- Suivez-nous sur Facebook
- Suivez-nous sur Twitter
- Suivez-nous sur YouTube
- Consultez les dernières nouvelles de Santé Canada sur notre site Web
- Trouvez d'autres renseignements liés à la santé sur le site Web du gouvernement du Canada
Vous pouvez également trouver des informations particulières sur les instruments médicaux en suivant les liens ci-dessous.
Instruments médicaux utilisés contre la COVID-19
Les listes d'instruments médicaux présentent les différents instruments médicaux dont l'utilisation a été autorisée dans le cadre de la pandémie de COVID-19.
Instruments médicaux autorisés pour les utilisations liées à la COVID-19 : Aperçu.
Santé Canada publie des informations actualisées sur les équipements de protection individuelle en lien avec la COVID-19.
Équipement de protection individuelle contre la COVID-19 (ÉPI)
La liste des essais cliniques autorisés montre les instruments médicaux utilisés contre la COVID-19 qui font actuellement l'objet d'essais cliniques autorisés par Santé Canada.
Nouveaux instruments médicaux approuvés
La Liste des instruments médicaux homologués en vigueur (MDALL) est une liste de toutes les homologations (licences) délivrées pour les instruments médicaux.
Liste des instruments médicaux homologués en vigueur
Recherchez les données sur les tests et les essais réalisés avec les instruments médicaux dans le but d'évaluer leur efficacité et leur sécurité.
Renseignements cliniques sur les médicaments et produits de santé
Les sommaires des décisions réglementaires décrivent l'objet d'une demande d'homologation d'un instrument médical, et les motifs expliquant la décision prise par Santé Canada de l'approuver ou de la rejeter.
Sommaire des décisions réglementaires
Les sommaires des motifs de décision détaillent les considérations réglementaires, sécuritaires, et reliées à l'efficacité et la qualité du produit prises en compte par Santé Canada lors de sa décision d'approuver certains instruments médicaux.
Surveillance des instruments médicaux
Déclaration d'un incident lié à un instrument médical
Programme Canada Vigilance
Vous pouvez déclarer les incidents liés aux instruments médicaux à votre professionnel de la santé, à un hôpital ou à l'entreprise qui a fabriqué le produit. Vous pouvez aussi les déclarer à Santé Canada par l'entremise du Programme Canada Vigilance ou par téléphone en composant le 1-866-234-2345.
La Base de données des rappels et des avis de sécurité comprend les rappels, les avis, les alertes de sécurité et les autres publications de Santé Canada.
Base de données des rappels et des avis de sécurité
Les résumés de l'examen de l'innocuité résument les examens des problèmes d'innocuité potentiels des instruments médicaux que nous avons réalisés.
Résumés de l'examen de l'innocuité
Les nouveaux examens de l'innocuité ou de la sûreté et de l'efficacité sont des tableaux qui présentent les examens en cours à Santé Canada.
Nouveaux examens de l'innocuité ou de la sûreté et de l'efficacité
L'InfoVigilance sur les produits de santé est une publication mensuelle destinée principalement aux professionnels de la santé. L'InfoVigilance sur les produits de santé fournit de l'information pertinente du point de vue clinique sur les produits de santé et leur innocuité.
InfoVigilance sur les produits de santé
Les tableaux récapitulatifs des plaintes en matière de publicité présentent les plaintes relatives à la publicité sur les produits de santé qui ont été déposées auprès de Santé Canada et les mesures que nous avons prises.
Plaintes relatives à la publicité des produits de santé
La base de données permet la recherche des résumés des incidents, des plaintes et des rappels liés aux instruments médicaux, y compris les incidents soupçonnés d'être liés à des instruments médicaux, et qui sont déclarés à Santé Canada. Ces incidents ont été soumis par des consommateurs et des professionnels de la santé ainsi que par les fabricants et importateurs d'instruments médicaux.
Instruments médicaux : Cycle de vie
Dans le cadre de sa mission d'aider les Canadiens à maintenir et à améliorer leur santé, Santé Canada évalue les instruments médicaux avant et après leur arrivée sur le marché canadien. Santé Canada s'investit tout au long du cycle de vie d'un instrument médical, y compris durant les essais expérimentaux (essais cliniques) et une fois que l'instrument est vendu au Canada.
Essais expérimentaux
Les essais cliniques sont menés par les promoteurs (fabricants ou importateurs) pour recueillir des renseignements sur l'innocuité et l'efficacité d'un instrument médical chez l'être humain. Les promoteurs d'essais expérimentaux soumettent leurs demandes pour effectuer des essais expérimentaux avec un instrument médical au Canada. Santé Canada examine ces demandes avant que l'essai soit mené au Canada.
Programme d'accès spécial
Les instruments médicaux qui ne sont pas approuvés au Canada peuvent être disponibles par l'entremise de notre Programme d'accès spécial. Dans ce programme, l'accès est donné à un praticien de la santé qui traite un patient particulier. L'accès peut être accordé en cas d'urgence lorsque les thérapies traditionnelles se sont révélées inefficaces, ne sont pas disponibles ou ne conviennent pas.
Demande et examen d'un instrument médical
Au Canada, les instruments médicaux sont répartis en quatre groupes en fonction du risque associé à leur utilisation. Ces groupes sont appelés des « classes » et sont numérotés de I à IV. Les instruments de classe I sont considérés comme des instruments à faible risque. Il peut s'agir, par exemple, d'un fauteuil roulant. Les instruments de classe IV sont ceux qui présentent le plus grand risque, par exemple, un défibrillateur.
Lorsqu'une entreprise décide qu'elle souhaite commercialiser un instrument médical de classe II, III ou IV au Canada, elle présente une demande à Santé Canada pour obtenir une nouvelle homologation d'instrument médical. La demande contient des informations scientifiques sur l'innocuité, l'efficacité et la qualité de l'instrument médical. Les instruments de classe I ne nécessitent pas de licence d'instrument médical, mais sont contrôlés par l'intermédiaire des licences d'établissement.
Les demandes concernant des instruments médicaux à haut risque sont examinées par nos scientifiques et nos ingénieurs. Parfois, nous consultons également des comités consultatifs ou des consultants externes. Les évaluateurs examinent les données soumises sur l'innocuité, l'efficacité et la qualité afin d'évaluer les avantages et les risques des instruments médicaux. Ils examinent également les renseignements au sujet de l'instrument médical qui seront fournis aux professionnels de la santé et aux consommateurs.
Voies d'examen accéléré : Examen prioritaire
La procédure d'examen prioritaire permet d'accélérer la prise de décision finale pour certains instruments médicaux, notamment ceux qui répondent à des besoins spécifiques en matière de soins de santé. Les instruments médicaux destinés à traiter des maladies ou des conditions graves, potentiellement mortelles ou très débilitantes peuvent faire l'objet d'un examen prioritaire. Les produits approuvés par l'intermédiaire de la procédure d'examen accélérée peuvent être mis à la disposition des patients plus rapidement, car leur délai d'examen est plus court.
Approbation des instruments médicaux
Après avoir examiné une présentation d'instrument médical, Santé Canada peut conclure que les avantages du produit l'emportent sur les risques et approuver la vente de l'instrument médical au Canada. Lorsqu'un nouvel instrument médical est approuvé, une licence d'instrument médical lui sera délivrée. Cela ne signifie pas que l'instrument médical sera immédiatement disponible au Canada, car de nombreux autres facteurs peuvent influencer le délai de mise en marché.
Surveillance
Il est impossible de savoir ou de prédire tous les problèmes potentiels d'un instrument médical dans le cadre d'études cliniques. Une fois qu'un produit est approuvé et disponible pour la vente au Canada, nous continuons de surveiller son utilisation dans le monde réel, c'est-à-dire auprès des citoyens canadiens en général. Nous évaluons les problèmes potentiels de sécurité et d'efficacité et prenons des mesures au besoin.
Collecte de renseignements
Santé Canada recueille des renseignements sur l'innocuité d'un produit après son approbation auprès de diverses sources. Les problèmes présumés déclarés après l'approbation de la vente des instruments médicaux constituent une source d'information. Il s'agit d'effets indésirables potentiellement causés par des instruments médicaux.
Vous pouvez déclarer les incidents liés aux instruments médicaux à votre professionnel de la santé, à un hôpital ou à l'entreprise qui a fabriqué le produit. Vous pouvez aussi les déclarer à Santé Canada par l'entremise du Programme Canada Vigilance ou par téléphone en composant le 1-866-234-2345.
Évaluation des signaux d'innocuité
Santé Canada évalue les données que nous recueillons pour déceler tout nouveau signal d'innocuité, qui sera ensuite examiné de plus près. Un « signal d'innocuité » peut être défini comme un renseignement sur un effet indésirable, nouveau ou connu, qui peut être associé à un instrument médical. Ces enquêtes sont appelées évaluations des signaux d'innocuité et elles peuvent donner lieu à des recommandations de mesures à prendre par l'entreprise, par Santé Canada ou par les deux. Ces mesures peuvent consister à informer le public et les professionnels de la santé de nouveaux renseignements relatifs à la sécurité ou à recommander des modifications aux étiquettes. Dans les situations les plus graves, nous pouvons retirer un instrument médical du marché.
Plaintes relatives à la publicité
Santé Canada réglemente également la publicité visant les instruments médicaux vendus au Canada pour s'assurer que les entreprises ne font pas de fausses allégations au sujet de leurs produits. Nous examinons les plaintes relatives à la publicité pour déterminer si une entreprise se conforme à nos exigences et nous prenons les mesures appropriées lorsqu'une non-conformité est constatée.