Faits saillants sur les médicaments et les instruments médicaux 2020 : Médicaments à usage humain
Sur cette page
- Médicaments à usage humain : 2020 en bref
- Médicaments à usage humain : quoi de neuf en 2020
- Médicaments à usage humain : réalisations de 2020
- Clics santé : Aperçu des médicaments à usage humain
- Médicaments à usage humain : Cycle de vie
Médicaments à usage humain : 2020 en bref
L'un des rôles de Santé Canada est de réglementer les médicaments pouvant aider les Canadiens à maintenir et à améliorer leur santé. Il s'agit notamment des médicaments délivrés sur ordonnance ou en vente libre, ainsi que des vaccins.
La pandémie de COVID-19 a créé un besoin urgent d'accès à des produits de santé sûrs, efficaces et de haute qualité. Notre réponse à la pandémie a abordé les problèmes critiques liés aux médicaments, ainsi qu'aux désinfectants et aux antiseptiques pour les mains, tout au long du cycle de vie des produits.
Réponse à la pandémie de COVID-19
Nous avons introduit des mesures réglementaires innovantes et agiles dans le cadre de la réponse du gouvernement à la pandémie. Ces mesures ont permis d'accélérer l'examen réglementaire des produits de santé liés à la COVID-19 sans compromettre les normes d'innocuité, d'efficacité et de qualité.
En 2020, nous avons autorisé 81 essais cliniques liés à des médicaments ou des vaccins contre la COVID-19. En raison de la pandémie, des centaines d'essais cliniques ont dû être modifiés afin d'éviter de contracter l'infection lors des visites sur les sites d'essai. Ces modifications ont permis le consentement et les visites à distance, la télémédecine, ainsi que différentes manières de distribuer et d'administrer les médicaments expérimentaux. La pandémie a également permis la décentralisation de certains essais cliniques.
Nous avons approuvé deux médicaments pour traiter la COVID-19, le Veklury (remdésivir) et le Bamlanivimab. Nous avons approuvé deux vaccins contre la COVID-19, soit le vaccin de Pfizer-BioNTech et le vaccin de Moderna contre la COVID-19. Au 31 décembre 2020, deux autres vaccins et un autre traitement étaient en cours d'examen. Nous avons surveillé l'innocuité et l'efficacité des produits de santé liés à la COVID-19, et pris des mesures le cas échéant. Nous avons également créé le portail sur les vaccins et les traitements contre la COVID-19, qui fournit des informations actualisées aux consommateurs, aux professionnels de la santé et aux chercheurs.
La réglementation des antiseptiques pour les mains et des désinfectants a été un élément important de notre réponse à la pandémie de COVID-19. En 2020, nous avons autorisé plus de 4 400 nouveaux produits antiseptiques pour les mains et environ 200 nouveaux désinfectants.
Pour en savoir plus sur notre réponse à la pandémie de COVID-19, consultez la rubrique « Médicaments à usage humain : réalisations de 2020 ».
Nouveaux médicaments approuvés
En 2020, nous avons approuvé 84 nouveaux médicaments, dont trois nouveaux médicaments (un traitement et deux vaccins) autorisés en vertu de l'Arrêté d'urgence concernant l'importation, la vente et la publicité de drogues à utiliser relativement à la COVID-19. Ceux-ci offrent aux patients plus d'options pour le traitement, la prévention et le diagnostic de divers problèmes de santé.
Quarante des nouveaux médicaments que nous avons approuvés en 2020 contenaient des ingrédients médicinaux qui n'avaient jamais été approuvés pour la vente au Canada; nous appelons ces substances des « nouvelles substances actives ». Quarante-deux pour cent de ces médicaments ont été approuvés au moyen d'un processus accéléré, y compris ceux qui ciblent des besoins de santé particuliers. Par exemple, Zolgensma est une thérapie génique unique pour le traitement de l'amyotrophie spinale. Il s'agit d'une maladie rare et d'une cause génétique majeure de mortalité infantile, pour laquelle il existe peu de thérapies. De plus, Givlaari a été approuvé pour le traitement de la porphyrie hépatique aiguë, une maladie héréditaire rare.
Il est également important d'offrir aux Canadiens un plus grand choix et des options plus abordables. Nous avons approuvé 138 nouveaux médicaments génériques et 16 nouveaux médicaments biosimilaires en 2020. Les médicaments génériques contiennent les mêmes ingrédients médicinaux que le médicament de marque et sont considérés comme bioéquivalents au médicament de marque. Les médicaments biosimilaires sont des médicaments biologiques qui entrent sur le marché après qu'un médicament déjà autorisé au Canada et dont la similarité avec le médicament biologique déjà autorisé a été démontrée. L'un des nouveaux médicaments (Sani-Cide EX3) et deux des médicaments génériques (clotrimazole et lopéramide) que nous avons approuvés en 2020 étaient destinés à un usage sans ordonnance (« en vente libre »).
Pour une liste et une description des nouveaux médicaments que nous avons autorisés en 2020, consultez la section « Approuvés en 2020 : Médicaments à usage humain ».
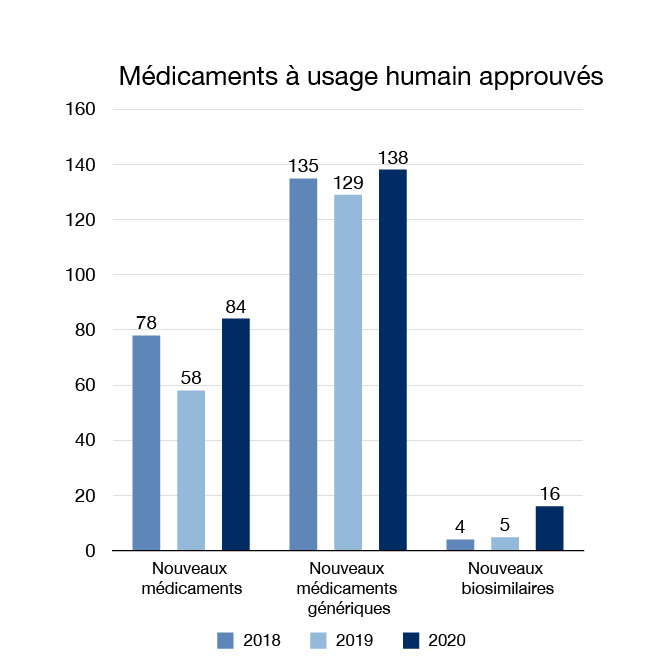
Figure 1 : Médicaments à usage humain approuvés : Équivalent textuel
| Année | Nouveaux médicaments approuvés | Nouveaux médicaments génériques approuvés | Nouveaux médicaments biosimilaires approuvés |
|---|---|---|---|
| 2018 | 78 | 135 | 4 |
| 2019 | 58 | 129 | 5 |
| 2020 | 84 | 138 | 16 |
Essais cliniques et programme d'accès spécial
Nous examinons les demandes pour permettre aux entreprises et aux chercheurs de mener des essais cliniques au Canada. Les nouveaux essais cliniques signifient que les Canadiens pourraient avoir accès à un plus grand nombre d'options de traitement innovantes. En 2020, 1 274 nouvelles demandes d'essais cliniques pour des médicaments ont été approuvées.
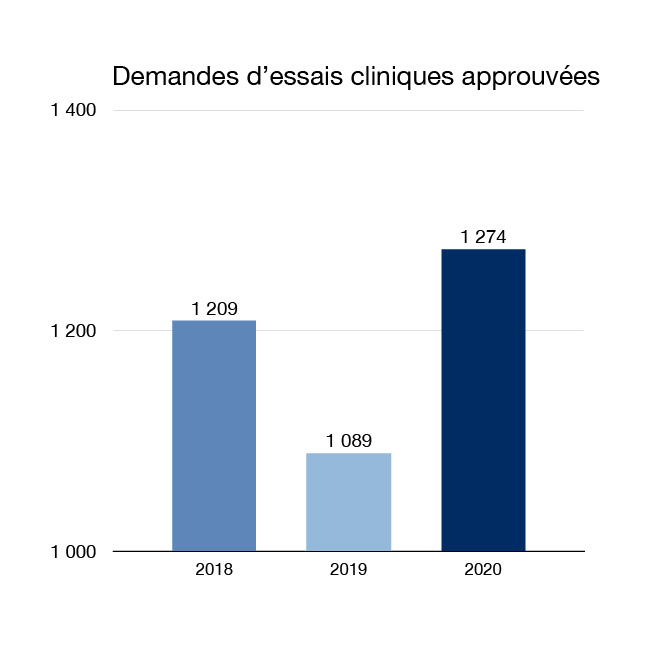
Figure 2 : Demandes d'essais cliniques approuvés : Équivalent textuel
| Année | Nombre de demandes d'essais cliniques approuvées |
|---|---|
| 2018 | 1 209 |
| 2019 | 1 089 |
| 2020 | 1 274 |
Grâce à notre Programme d'accès spécial, les Canadiens ont accès à des médicaments qui ne sont pas disponibles à la vente au Canada. Nous pouvons accorder l'accès à des médecins en cas d'urgence ou pour le traitement d'affections graves ou mettant la vie en danger. En 2020, 11 740 demandes pour avoir un accès spécial à des médicaments ont été autorisées. Il s'agit notamment d'un éventail de médicaments contre les infections, l'épilepsie, le cancer et les maladies rares. En 2020, l'étomidate, un médicament qui était disponible par l'intermédiaire du programme depuis plus de 20 ans, a reçu une autorisation de mise sur le marché et est passé du programme d'accès spécial au marché.
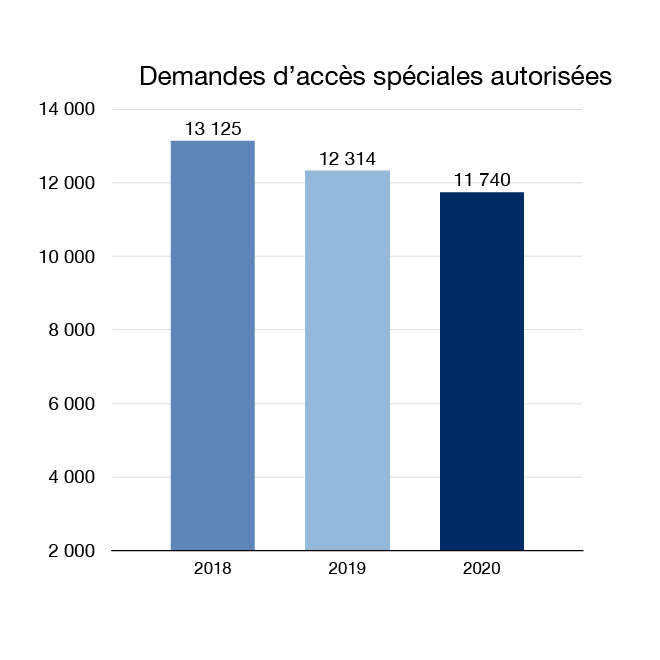
Figure 3 : Demandes d'accès spéciales autorisées : Équivalent textuel
| Année | Demandes d'accès spécial autorisées |
|---|---|
| 2018 | 13 125 |
| 2019 | 12 314 |
| 2020 | 11 740 |
Surveillance
Après avoir approuvé la vente d'un médicament au Canada, nous continuons de surveiller et d'évaluer les rapports d'effets indésirables soupçonnés.
En 2020, nous avons reçu 603 705 rapports de réactions indésirables à des médicaments à usage humain et avons entrepris 1 034 mesures relativement aux médicaments. Les signalements de réactions indésirables à des médicaments proviennent de sources nationales et internationales. Les mesures peuvent comprendre la transmission aux Canadiens et aux professionnels de la santé de nouveaux renseignements relatifs à l'innocuité ou la recommandation de modifications aux étiquettes. Dans les situations où un risque grave est établi, nous pouvons retirer un médicament du marché.
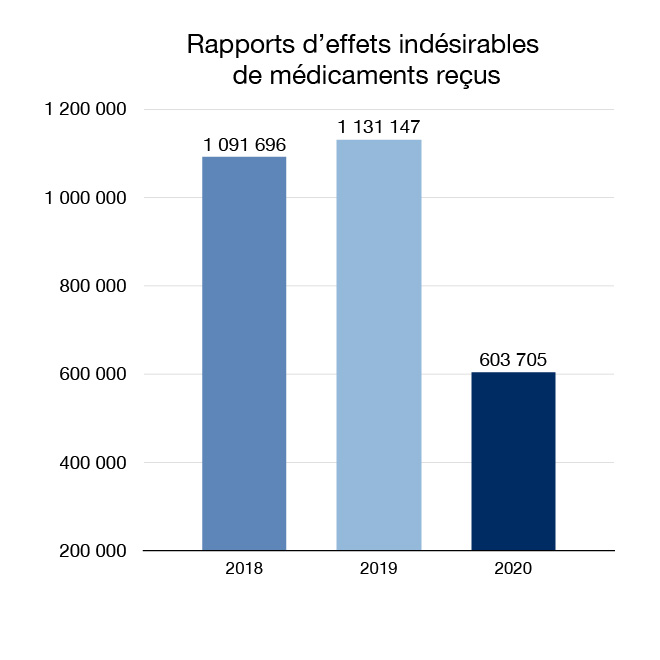
Figure 4 : Rapports d'effets indésirables de médicaments reçus : Équivalent textuel
| Année | Rapports d'effets indésirables de médicaments reçus |
|---|---|
| 2018 | 1 091 696 |
| 2019 | 1 131 147 |
| 2020 | 603 705 |
Pour savoir comment nous avons abordé les problèmes de sécurité qui se sont posés pour les médicaments au Canada en 2020, consultez la section « Approuvés en 2020 : Médicaments à usage humain ».
Transparence du processus décisionnel
En 2020, nous avons continué à faire progresser nos efforts d'ouverture et de transparence en augmentant la quantité d'informations réglementaires sur la santé et la sécurité qui sont mises à la disposition des Canadiens. Nous avons publié 143 sommaires des décisions réglementaires et 57 documents de sommaire des motifs de décision, qui expliquent les décisions de Santé Canada pour certains médicaments demandant une autorisation de mise sur le marché.
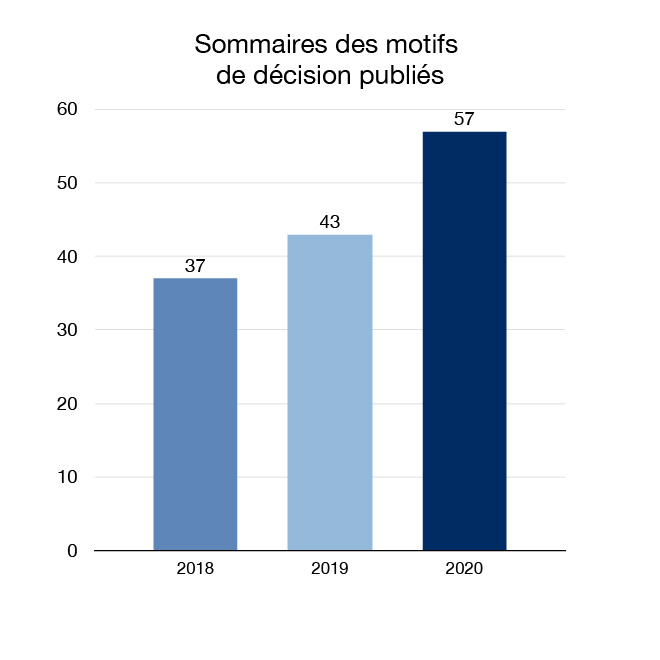
Figure 5 : Documents de sommaire des motifs de décision publiés : Équivalent textuel
| Année | Sommaires de documents de décision publiés |
|---|---|
| 2018 | 37 |
| 2019 | 43 |
| 2020 | 57 |
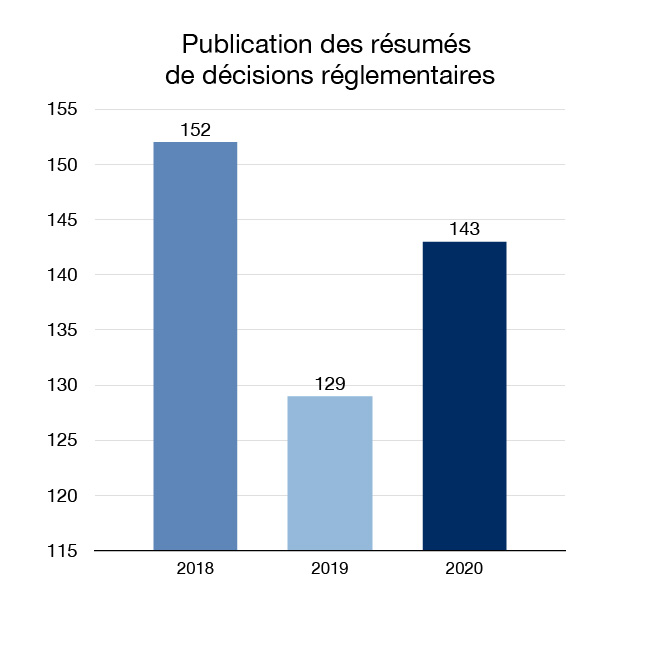
Figure 6 : Publication des résumés de décisions réglementaires : Équivalent textuel
| Année | Résumés de décisions réglementaires publiés |
|---|---|
| 2018 | 152 |
| 2019 | 129 |
| 2020 | 143 |
Nous avons publié 2 185 079 pages de renseignements cliniques au sujet de 79 médicaments par l'entremise de notre portail de renseignements cliniques. Ces renseignements cliniques sont fournis par les entreprises lorsqu'elles demandent l'autorisation de vendre un médicament au Canada, et sont rendues publiques après que nous ayons décidé d'approuver ou de rejeter le médicament.
Santé Canada publie également des résumés de ses examens de l'innocuité, qui décrivent les décisions de Santé Canada concernant les problèmes d'innocuité potentiels. En 2020, nous avons publié 19 résumés de ce type pour des médicaments à usage humain. Ces résumés complètent d'autres informations relatives à l'innocuité pour aider les Canadiens à prendre des décisions éclairées sur leurs choix de médicaments.
Ce chapitre sur les médicaments à usage humain contient plus de renseignements sur le travail que nous avons accompli en 2020. Pour obtenir des renseignements à jour sur nos activités, veuillez consulter la section intitulée « Clics santé : Aperçu des médicaments à usage humain » et nous suivre sur les médias sociaux.

Directeur général,
Produits thérapeutiques

Directrice générale,
Médicaments biologiques et radiopharmaceutiques

Directrice générale,
Produits de santé naturels et sans ordonnance

Directrice générale,
Produits de santé commercialisés
Médicaments à usage humain : quoi de neuf en 2020
En 2020, Santé Canada a approuvé 84 nouveaux médicaments, dont 16 biosimilaires. Vous trouverez d'autres renseignements dans la section intitulée « Approuvés en 2020 : Médicaments à usage humain ».
Système digestif et métabolisme
- Givlaari
- Ibsrela
- Mar-Trientine
- Rybelsus
- TrurapiNote de bas de page *
- Uceris
Anti-infectieux à usage systémique
- Amoxicilline sodique et clavulanate de potassium pour injection
- Anthim
- Bamlanivimab
- Cabenuva/Vocabria
- Menquadfi
- Vaccin contre la COVID-19 de Pfizer-BioNTech
- Vaccin de Moderna contre la COVID-19
- Veklury
- Vocarvi
- Xenlata
- Xofluza
Agents antinéoplasiques et immunomodulateurs
- AmgevitaNote de bas de page *
- AvsolaNote de bas de page *
- Daurismo
- Enspryng
- Gleolan
- HulioNote de bas de page *
- HyrimozNote de bas de page *
- IdacioNote de bas de page *
- Inqovi
- Inrebic
- KanjintiNote de bas de page *
- Mayzent
- NivestymNote de bas de page *
- Nubeqa
- NyvepriaNote de bas de page *
- Odomzo
- Piqray
- Polivy
- Qinlock
- RiximyoNote de bas de page *
- Rozlytrek (deux présentations)
- RuxienceNote de bas de page *
- Sarclisa
- Tukysa
- Verity-BCG
- Zeposia
- ZiextenzoNote de bas de page *
Sang et organes sanguinoformateurs
- Addnutriv
- Bivalirudine injectable
- Cablivi
- Essepna
- Inclunox, Inclunox HPNote de bas de page *
- Noromby, Noromby HPNote de bas de page *
- Reblozyl
- Redesca, Redesca HPNote de bas de page *
- Regiocit
- Tavalisse
Système cardiovasculaire
- Corzyna
Médicaments dermatologiques
- Duobrii
- Teva-betamethasone/calcipotriol
Système génito-urinaire et hormones sexuelles
- Bijuva
- Imvexxy
- Nexplanon
Système musculo-squelettique
- Zolgensma
Système nerveux
- Ajovy
- Dayvigo
- Firdapse
- Kynmobi
- Perseris
- Peyona
- Ruzurgi
- Spravato
- Suvexx
- Tomvi
- Vyndaqel
Système respiratoire
- Atectura Breezhaler
- Breezhaler Enerzair
Organes sensoriels
- Beovu
- Luxturna
Préparations hormonales systémiques excluant les hormones sexuelles et insulines
- Increlex
- OsnuvoNote de bas de page *
- Tirosint
Divers
- Galliapharm
- Itulatek
- Sani-Cide EX3
- Pertechnétate de sodium injectable 99mTc
Médicaments à usage humain : réalisations de 2020
Réponse à la pandémie de COVID-19
La pandémie de COVID-19 a eu de profondes répercussions sur la santé et le bien-être des Canadiens. Elle a créé une demande sans précédent sur le système de soins de santé du Canada et a entraîné un besoin urgent d'accès aux produits de santé.
La réponse de Santé Canada à la pandémie a porté sur des questions essentielles liées aux médicaments à usage humain tout au long du cycle de vie des produits, des essais cliniques à la surveillance en passant par l'autorisation des médicaments.

Directrice générale,
Équipe d'intervention réglementaire de la COVID-19
Pleins feux sur…
L'équipe d'intervention réglementaire de la COVID-19
L'équipe d'intervention réglementaire de la COVID-19 a été créée pour servir de point de contact pour les médicaments et les vaccins contre la COVID-19. L'équipe soutient les secteurs d'examen dans leurs échanges avec l'industrie et les autres intervenants. Elle collabore également avec des partenaires du gouvernement du Canada pour fournir la perspective réglementaire dans la réponse à la pandémie de COVID-19.
« Le dévouement et le travail acharné depuis le début de la pandémie ont été incroyables. Je suis très fière de ce que nous avons tous pu faire pour soutenir l'apport de tests, de traitements, de vaccins et d'autres produits aux Canadiens. »
Essais cliniques
En mai 2020, la ministre de la Santé a signé l'Arrêté d'urgence sur les essais cliniques d'instruments médicaux et de drogues en lien avec la COVID-19. Cette mesure temporaire a facilité un processus d'autorisation plus efficace et plus flexible pour les essais cliniques au Canada, permettant à des types plus larges d'essais cliniques liés à la COVID-19 de se dérouler plus efficacement. Elle offre un meilleur accès des patients aux médicaments potentiels contre la COVID-19, tout en respectant des exigences strictes en matière de sécurité des patients.
En outre, nous avons accéléré l'autorisation des essais liés à la COVID-19 et publié un avis sur la gestion des essais cliniques pendant la pandémie. Les demandes ont été examinées plus rapidement que d'habitude afin d'accélérer l'accès sans compromettre la sécurité des patients. Nous avons travaillé avec des entreprises, des centres de recherche universitaires et des chercheurs qui avaient des produits en cours de développement, afin de les guider et de les aider à réaliser des essais cliniques au Canada.
En 2020, nous avons autorisé 81 essais cliniques liés à des médicaments ou des vaccins contre la COVID-19.
Pour plus d'informations, veuillez consulter notre page Web Médicaments et vaccins pour la COVID-19 : essais cliniques pour les médicaments et les vaccins.
Programme d'accès spécial
Le Programme d'accès spécial est destiné aux professionnels de la santé qui traitent des patients gravement malades pour lesquels les thérapies conventionnelles ont échoué, sont inadaptées ou ne sont pas disponibles. Le Programme d'accès spécial a contribué à résoudre les pénuries critiques au sein du système de soins de santé pendant la pandémie. En outre, en 2020, nous avons modernisé la réglementation du programme en améliorant les processus utilisés par les prestataires de soins de santé et en réduisant le fardeau administratif lié aux demandes. Ces changements faciliteront l'accès des Canadiens aux médicaments non commercialisés pour le traitement de la COVID-19 et d'autres urgences médicales.
Pour plus d'informations, consultez les Programmes d'accès spécial de Santé Canada : Aperçu.
Pleins feux sur…
L'accès aux traitements durant la pandémie
La pandémie de COVID-19 a provoqué la fermeture des frontières et restreint le transport aérien. Par conséquence, certains patients ont eu des difficultés à accéder aux traitements médicaux nécessaires. Le Programme d'accès spécial a joué un rôle déterminant dans la prévention et la résolution des pénuries critiques au sein du système de soins de santé. Par exemple, avant la pandémie, le Programme a examiné les demandes de sangsues médicinales utilisées pour traiter la congestion veineuse après une opération chirurgicale. Cependant, en raison de la COVID-19, l'importation de sangsues de France vers le distributeur américain a nécessité des efforts extraordinaires de la part du Programme d'accès spécial. Le Programme a assuré la coordination avec divers ministères comme Santé Canada, l'Agence des services frontaliers du Canada et Affaires mondiales Canada, ainsi qu'avec des organismes de réglementation aux États-Unis et en France.
Ian MacKay
Gestionnaire,
Produits thérapeutiques
Médicaments et vaccins
Les médicaments et les vaccins joueront un rôle essentiel dans la capacité des Canadiens à se remettre en toute sécurité de la pandémie de COVID-19.
Santé Canada a introduit des mesures réglementaires innovantes et agiles dans le cadre de la réponse du gouvernement à la pandémie. Celles-ci nous ont permis d'accélérer l'examen réglementaire des médicaments et vaccins contre la COVID-19, sans compromettre nos normes élevées en matière d'innocuité, d'efficacité et de qualité.
Pour plus d'informations sur les arrêtés d'urgence qui ont été publiés pour affronter la pandémie de COVID-19, consultez la rubrique « Message du chef principal de la réglementation ».
En 2020, nous avons approuvé deux vaccins en vertu de l'Arrêté d'urgence concernant l'importation, la vente et la publicité de drogues à utiliser relativement à la COVID-19, le vaccin contre la COVID-19 de Pfizer-BioNTech et celui de Moderna. Nous avons aussi approuvé deux médicaments pour traiter la COVID-19, le Veklury et le Bamlanivimab. Au 31 décembre 2020, deux autres vaccins et un autre traitement étaient en cours d'examen.
Nous suivrons de près l'utilisation de ces produits dans le monde réel, évaluerons les problèmes potentiels d'innocuité et d'efficacité et prendrons des mesures en cas de problèmes.
Pleins feux sur…
Notre science
En 2020, le Dr Sean Li a publié un article scientifique intitulé « l'incidence des mutations de la protéine de spicule du SRAS-CoV-2 sur l'infectiosité et l'antigénicité » (en anglais seulement). Dans cet article scientifique, le Dr Li a examiné quelles mutations de la protéine de spicule du coronavirus entraînent une résistance aux anticorps neutralisants et l'importance de la glycosylation dans l'infectiosité. La protéine de spicule est le principal antigène de surface et la cible du développement des vaccins. Ces travaux contribuent au développement de vaccins et d'anticorps thérapeutiques.
Dr Sean Li
Chercheur scientifique,
Médicaments biologiques et radiopharmaceutiques
Désinfectants et antiseptiques pour les mains
La pandémie de COVID-19 a provoqué un besoin urgent de désinfectants et d'antiseptiques pour les mains. Ces produits ont été un élément important de la réponse de Santé Canada à la pandémie pour prévenir la propagation de la COVID-19. Afin d'augmenter l'offre et de nous assurer que les Canadiens ont accès à ces produits, nous avons notamment travaillé à :
- accélérer l'examen des désinfectants et des antiseptiques pour les mains,
- introduire des mesures provisoires telles que les suivantes :
- permettre l'importation de produits qui peuvent ne pas être entièrement conformes aux exigences réglementaires, mais qui ne compromettent pas la sécurité des Canadiens, afin d'accélérer l'accès aux désinfectants et aux antiseptiques pour les mains pour pallier les pénuries de produits,
- autoriser temporairement l'éthanol de qualité technique dans la production de désinfectants et d'antiseptiques pour les mains afin de remédier à une pénurie identifiée d'éthanol de qualité pharmaceutique,
- fournir des conseils sur l'obtention d'une licence pour la vente d'antiseptiques pour les mains à base d'alcool ou non, sur la production d'éthanol et d'alcool isopropylique pour s'assurer que l'alcool utilisé est sûr, ainsi que sur l'obtention d'une autorisation pour la fabrication et la vente de désinfectants,
- travailler avec les entreprises qui sont entrées sur le marché des antiseptiques pour les mains, comme les distilleries, pour les aider à s'orienter dans notre réglementation afin de fabriquer et de vendre leurs nouveaux produits,
- collaborer avec l'industrie des désinfectants pour informer les Canadiens des produits pouvant être utilisés pour lutter contre la propagation de la COVID-19.
En 2020, nous avons autorisé plus de 4 400 produits antiseptiques pour les mains et environ 200 désinfectants. Nous avons également élaboré une liste en ligne de désinfectants pour surfaces dures avec des preuves d'utilisation contre la COVID-19, qui comprenait plus de 500 produits au 31 décembre 2020.
Pour plus d'informations, consultez la page Désinfectants pour surfaces dures et les antiseptiques pour les mains (COVID-19).
Surveillance des produits de santé contre la COVID-19
Nous avons surveillé l'innocuité et l'efficacité des produits de santé liés à la COVID-19, et avons pris les mesures nécessaires pour protéger les Canadiens.
Nous avons notamment travaillé sur les médicaments et les vaccins à :
- collaborer avec l'Agence de la santé publique du Canada pour surveiller en permanence les vaccins contre la COVID-19 sur le marché canadien,
- prendre des mesures proactives pour repérer les effets indésirables liés aux médicaments et aux vaccins utilisés contre la COVID-19 (produits explicitement approuvés pour une utilisation contre la COVID-19 ainsi que ceux qui étaient utilisés « hors indication », ou en dehors de l'utilisation approuvée du produit),
- surveiller les détaillants et les publicités qui faisaient des allégations fausses, trompeuses et illégales concernant la COVID-19,
- publier des communications sur les risques concernant les problèmes potentiels d'innocuité et d'efficacité,
- travailler en étroite collaboration avec des partenaires internationaux pour surveiller l'innocuité et l'efficacité des traitements contre la COVID-19 dans le monde réel.
Nous avons travaillé sur les désinfectants et les antiseptiques pour les mains à :
- surveiller la sécurité des désinfectants et des antiseptiques pour les mains sur le marché au Canada,
- surveiller les détaillants et les publicités qui faisaient des allégations fausses, trompeuses et illégales concernant la COVID-19,
- publier des communications sur les risques liés à la sécurité des désinfectants et des antiseptiques pour les mains.
Pleins feux sur…
Surveillance des médicaments et vaccins contre la COVID-19
Le 9 décembre 2020 – le jour où Santé Canada a autorisé le vaccin contre la COVID-19 de Pfizer BioNTech – Santé Canada a été informé de deux rapports de réactions anaphylactoïdes survenues après l'immunisation le premier jour de la campagne d'immunisation de masse au Royaume-Uni. Grâce aux relations que nous entretenons avec nos partenaires réglementaires, nous avons pu recueillir des informations supplémentaires sur ces événements, ainsi que les points de vue d'autres autorités de réglementation qui examinaient également le vaccin dans leurs juridictions. En outre, nous avons demandé aux intervenants spécialisés dans les allergies et l'immunologie de nous conseiller sur la manière de réagir à ces nouvelles informations. Le 12 décembre 2020, avant le lancement de la campagne de vaccination de masse au Canada, nous avons émis un avis. Celui-ci mettait en garde les Canadiens allergiques à l'un des ingrédients du vaccin de ne pas le recevoir, et recommandait à ceux qui ont des allergies graves de consulter un professionnel de la santé avant de recevoir le vaccin. Il a également été conseillé aux professionnels de la santé de suivre les conseils et recommandations pour reconnaître et gérer les réactions allergiques graves après une vaccination. Cet avis était aligné aux conseils de la Société canadienne des allergologues, du Conseil consultatif national de l'immunisation et de la Société canadienne des allergies et de l'immunologie.
Sophie Sommerer
Directrice exécutive principale,
Produits de santé commercialisés
Pénuries de médicaments
Au début de la pandémie, il était évident que la COVID-19 avait une incidence sur l'approvisionnement en produits de santé essentiels au Canada. Nous avons travaillé avec nos partenaires au sein de Santé Canada pour introduire des mesures réglementaires fournissant davantage d'outils pour répondre de manière urgente aux pénuries de médicaments liées à la COVID-19. Nous avons également travaillé avec les provinces et les territoires, les entreprises et les fabricants, les fournisseurs de soins de santé et les groupes de patients pour renforcer la chaîne d'approvisionnement en médicaments. Ces collaborations nous ont permis d'identifier, de prévenir et d'atténuer les pénuries pour les Canadiens.
Pour plus d'informations, consultez la section Remédier aux pénuries critiques de produits.
Communications et collaborations
Tout au long de la pandémie, Santé Canada a publié plusieurs pages Web pour fournir des informations aux Canadiens et aux partenaires réglementaires. Nos pages Web fournissent des informations sur les différents produits de santé que nous réglementons, notamment les essais cliniques autorisés, les demandes de médicaments qui ont été soumises et approuvées, les désinfectants et les antiseptiques pour les mains qui ont été autorisés, et plus encore.
Nous avons également publié des pages Web qui ont fourni des informations essentielles à l'industrie des produits de santé sur notre réglementation des produits de santé pour la COVID-19. Nous avons élaboré des conseils pour aider l'industrie à développer des produits de santé pour aider pendant la crise.
Santé Canada a également publié plusieurs communications sur les risques à l'intention des Canadiens afin de fournir des renseignements importants sur les médicaments à usage humain, les désinfectants et les antiseptiques pour les mains.
Nous avons travaillé en étroite collaboration avec nos partenaires nationaux, notamment les gouvernements provinciaux et territoriaux, les organismes d'évaluation des technologies de la santé, les fournisseurs de soins de santé et les groupes de patients. Nous avons cherché à connaître leur point de vue sur les priorités et les défis auxquels ils étaient confrontés au sein du système de soins de santé à la suite de la pandémie. Grâce à des webinaires, nous avons pu partager des informations avec les professionnels de la santé sur des sujets importants tels que l'approbation réglementaire des traitements contre la COVID-19.
Nous avons collaboré avec les organismes de réglementation d'autres pays sur des questions liées aux essais cliniques, à l'examen des médicaments, aux évaluations des risques et aux pénuries potentielles de médicaments. Cet échange d'informations et d'expertise a permis de s'assurer que les produits de santé soient sécuritaires et efficaces, et qu'ils soient disponibles rapidement pour les Canadiens. Cela se fait dans le cadre du projet OPEN de l'Agence européenne des médicaments et par l'intermédiaire du Consortium Access. Nous avons également travaillé en étroite collaboration avec la Coalition internationale des autorités de réglementation des médicaments (en anglais seulement), l'Organisation mondiale de la santé (en anglais seulement) et le groupe de travail contre la COVID-19 (en anglais seulement) de l'Organisation panaméricaine de la santé. Ces partenariats nous ont permis d'aligner notre approche à la réponse mondiale à la COVID-19.
Pleins feux sur…
Le portail des vaccins et des traitements contre la COVID 19
Santé Canada s'engage à fournir aux Canadiens, aux praticiens de la santé et aux chercheurs des renseignements opportuns et fiables sur les vaccins et les traitements contre la COVID-19. À cette fin, nous avons créé le portail sur les vaccins et les traitements contre la COVID-19. Le portail est une interface conviviale et facile à naviguer qui fournit des informations sur chaque produit en un seul endroit. Il contient des informations sur le produit à l'intention des consommateurs, notamment sur son utilisation, ses précautions et ses effets indésirables, afin que les consommateurs puissent prendre des décisions éclairées. Le portail fournit aux praticiens et aux chercheurs en santé la justification de la décision de Santé Canada d'approuver le produit, une copie de l'étiquette canadienne, des conseils sur la façon d'administrer le produit, des renseignements cliniques et la façon dont nous continuons à surveiller son innocuité et son efficacité.
« Notre objectif était de fournir une interface conviviale et facile à naviguer afin que les consommateurs, les praticiens de la santé et les chercheurs puissent trouver des informations réglementaires opportunes et fiables et avoir confiance dans les produits autorisés pour la prévention et le traitement de la COVID-19. »
Shannon Laforce
Directrice exécutive,
Gestion des ressources et des opérations
Pleins feux sur…
Le site web pour l'industrie des produits de santé contre la COVID-19
Au début de la pandémie, Santé Canada a rapidement mis en place un site Web centralisé pour informer les intervenants des produits de santé sur les exigences réglementaires dans le contexte de la COVID-19. Le site Web communique aux intervenants des informations prioritaires, des lignes directrices et des conseils sur les produits de santé liés à la COVID-19, notamment les désinfectants et les antiseptiques pour les mains, ainsi que les médicaments et les vaccins.
Il comprend des informations faciles d'accès sur les nouvelles mesures temporaires mises en place pour accélérer l'examen de ces produits. De cette manière, il soutient les intervenants traditionnels ainsi que les nouveaux venus dans le secteur qui ont besoin de conseils supplémentaires.
Le site Web a été maintenu et mis à jour tout au long de la pandémie, recevant près de 10 millions de visites entre son lancement en mars 2020 et la fin du mois de décembre. Avec une moyenne de 230 000 visites par semaine, il reste une ressource utile pour les intervenants.
« En mars 2020, nos équipes ont été confrontées à un volume incroyable de questions réglementaires liées à la COVID-19 de la part des intervenants. Conscients du besoin urgent de communiquer avec les intervenants, qu'ils soient nouveaux ou réguliers, nous avons créé un site Web qui servirait de centre d'informations principales et aiderait à gérer le volume de demandes. »
Elizabeth Toller
Directrice exécutive,
Politiques, planification et affaires internationales
Nous avons commencé l'année 2021 au milieu de la deuxième vague de la pandémie. Nous poursuivrons ce travail essentiel afin que les Canadiens continuent d'avoir accès aux produits de santé liés à la COVID-19.
L'innovation réglementaire
Le rythme actuel de l'innovation est sans précédent. Cela a donné naissance à de nouveaux produits de santé de plus en plus complexes et personnalisés. Nous avons besoin de nouvelles approches réglementaires pour mieux soutenir l'accès à ces technologies de la santé, tout en continuant à protéger la sécurité des patients.
Santé Canada a continué de privilégier l'innovation réglementaire en 2020. La pandémie de COVID-19 a affecté le calendrier de ce travail. Cependant, elle a également été l'occasion de tester certaines mesures agiles temporaires. Nous utiliserons les leçons retenues de notre réponse réglementaire à la COVID-19 pour étayer notre travail d'innovation réglementaire, notamment :
- moderniser la réglementation des essais cliniques afin de créer un environnement favorable à des essais plus innovants,
- permettre l'accès à des produits thérapeutiques avancés qui ne correspondent pas à notre système actuel,
- octroyer des licences agiles pour les médicaments en utilisant des outils flexibles pour superviser les produits tout au long de leur cycle de vie, et
- mettre à jour la façon dont nous communiquons aux Canadiens les informations sur les produits de santé.
Pour plus d'informations, consultez la rubrique Innovation réglementaire pour les produits de santé.
Établir des partenariats internationaux
Depuis de nombreuses années, Santé Canada travaille en étroite collaboration avec les organismes de réglementation du monde entier sur les questions liées aux médicaments. Cette coopération s'est poursuivie en 2020, tant sur les dossiers liés à la COVID-19 (voir la section « Médicaments à usage humain : réalisations de 2020 – répondre à la pandémie de COVID-19 ») que dans notre travail quotidien.
Par exemple, nous nous sommes appuyés sur les initiatives d'examen en collaboration entre Santé Canada et d'autres organismes de réglementation. Il s'agit notamment du Consortium Access et du projet Orbis. Grâce au Consortium d'accès, nous travaillons avec des partenaires pour examiner ensemble les nouveaux médicaments afin de les mettre sur le marché rapidement et efficacement. Le projet Orbis (en anglais seulement) est une initiative du centre d'excellence en oncologie de la Food and Drug Administration des États-Unis. Le projet Orbis regroupe des organismes de réglementation de plusieurs pays pour qu'ils examinent en même temps des médicaments contre le cancer de manière à assurer aux patients un accès plus rapide aux traitements dont ils ont besoin.
Grâce à ces initiatives importantes de partage du travail, nous avons autorisé un certain nombre de nouveaux médicaments et de nouvelles utilisations de médicaments déjà approuvés en 2020. Deux exemples de nouveaux médicaments sont le Nubeqa pour le traitement du cancer de la prostate et le Xofluza pour le traitement de la grippe.
En communiquant les informations et l'expertise avec d'autres organismes de réglementation, nous avons également optimisé notre compréhension de la manière dont les médicaments sont utilisés après leur mise en vente. Ces informations sont appelées « données du monde probant » et sont utilisées par Santé Canada et d'autres organismes de réglementation pour prendre des décisions réglementaires relativement aux médicaments.
Nous avons mis à jour nos accords avec divers organismes de réglementation, notamment l'Agence européenne des médicaments de l'Union européenne, la Medicines and Healthcare products Regulatory Agency du Royaume-Uni et la Health Science Authority de Singapour. Ces accords permettent aux organismes de réglementation d'échanger des informations sur les présentations de médicaments, et nous ont aidés à aligner davantage nos approches sur celles de nos partenaires mondiaux.
Pleins feux sur…
La collaboration internationale pour l'innocuité des produits
Au cours de l'été 2018, plusieurs médicaments ont été rappelés au Canada et ailleurs dans le monde, en raison d'impuretés de nitrosamine. L'exposition à long terme à des impuretés de nitrosamine à un niveau supérieur à ce qui est considéré comme sécuritaire peut augmenter le risque de cancer. Pour mieux comprendre ce problème mondial, nous collaborons et échangeons des informations avec d'autres grands organismes de réglementation dans le monde. Santé Canada est également le président de deux groupes de travail internationaux sur les nitrosamines. Les groupes se réunissent régulièrement pour favoriser l'alignement mondiale sur les nouveaux développements, les positions techniques et réglementaires, ainsi que sur la gestion des risques liés aux nitrosamines. Ce travail a été essentiel pour fournir des attentes et des directives unifiées à l'industrie et minimiser le risque sanitaire pour les consommateurs.
Déclaration obligatoire des effets indésirables graves d'un médicament par les hôpitaux
En 2020, Santé Canada a soutenu la mise en œuvre de la nouvelle réglementation sur la déclaration obligatoire par les hôpitaux, entrée en vigueur en décembre 2019. Ces règlements devraient permettre d'augmenter la quantité et d'améliorer la qualité des rapports sur les effets indésirables graves des médicaments. Les hôpitaux sont maintenant tenus de déclarer à Santé Canada tous les effets indésirables graves constatés à l'hôpital à l'intérieur d'un délai de 30 jours.
Santé Canada a conçu des outils pour soutenir les hôpitaux, notamment un document d'orientation, des modules d'éducation et du matériel promotionnel.
Le nombre de rapports sur les effets indésirables des médicaments soumis à Santé Canada par les hôpitaux a augmenté de 336 % en 2020. Après la mise en œuvre de la déclaration obligatoire, plusieurs éléments de données du formulaire de déclaration sont devenus obligatoires afin de garantir que des détails importants soient fournis à Santé Canada. Ces informations supplémentaires visent à élargir les données utilisées par Santé Canada pour surveiller l'innocuité et l'efficacité des médicaments à usage humain.
Lutter contre la résistance aux antimicrobiens
Les antimicrobiens, tels que les antibiotiques et les antifongiques, sont essentiels aux soins de santé modernes. Cependant, l'utilisation généralisée de ces produits au cours des dernières décennies a entraîné une augmentation des niveaux de résistance aux antimicrobiens. Les antimicrobiens couramment utilisés perdent de leur efficacité à mesure que les agents pathogènes qu'ils ciblent (bactéries, virus, champignons et parasites) y deviennent résistants.
La résistance aux antimicrobiens est un défi mondial et une menace croissante pour la santé publique, le système de soins de santé, la prospérité économique et la sécurité sanitaire. Lorsqu'il y aura moins d'antimicrobiens efficaces disponibles, il sera plus difficile de protéger les Canadiens contre les maladies infectieuses courantes. La pandémie de COVID-19 fournit un exemple clair des défis créés par les infections difficiles à traiter.
Santé Canada continue de prendre des mesures importantes pour favoriser le développement de produits thérapeutiques nouveaux et innovants pour lutter contre la résistance aux antimicrobiens.
En 2020, nous avons lancé une consultation sur les mises à jour de la liste des agents pathogènes d'intérêt, en invitant un large éventail d'intervenants à nous faire part de leurs commentaires. Cette liste est un outil important permettant aux entreprises de savoir quels agents pathogènes ont le besoin le plus urgent d'options thérapeutiques supplémentaires. La liste fait ses preuves; cette année, nous avons approuvé Xenleta pour le traitement de la pneumonie acquise en communauté. Xenleta a reçu un statut d'examen prioritaire parce qu'il cible des agents pathogènes difficiles à traiter figurant sur notre liste de pathogènes d'intérêt.
Toujours en 2020, Santé Canada a accordé un financement à quatre entreprises qui ont réussi la première phase du défi Solutions innovatrices Canada, lancé en 2019. Ce financement appuie la mise au point de nouveaux outils pour que les fournisseurs de soins de santé puissent détecter ou diagnostiquer les bactéries résistantes aux antibiotiques chez les humains ou les animaux. Ces outils aideront à la prise de décision concernant les traitements possibles.
Nous continuons à travailler en étroite collaboration avec les organismes de réglementation d'autres pays, notamment par l'intermédiaire de la Coalition internationale des autorités de réglementation des médicaments. Cette coalition (en anglais seulement) a appelé les responsables de la santé mondiale à mettre en place des incitatifs à la recherche et au développement. Elle a aussi appelé, l'industrie pharmaceutique à continuer d'investir dans la recherche et le développement, et les médias à maintenir la question de la résistance aux antimicrobiens à la une.
Pour en savoir plus sur la résistance aux antimicrobiens liée aux animaux et aux médicaments vétérinaires, consultez la section « Médicaments à usage vétérinaire : réalisations de 2020 ».
Pleins feux sur…
La semaine mondiale pour un bon usage des antibiotiques du 18 au 24 Novembre 2020
Chaque année, Santé Canada se joint à l'Organisation mondiale de la santé, aux agences sanitaires internationales et à d'autres autorités nationales pour soutenir la Semaine mondiale pour un bon usage des antibiotiques. Cette initiative mondiale vise à sensibiliser à la résistance aux antimicrobiens et à encourager les pratiques exemplaires pour éviter la propagation d'infections résistantes aux médicaments chez les humains et les animaux. En 2020, nous avons accueilli un groupe de conférenciers internationaux pour discuter des difficultés liées à la recherche sur les antimicrobiens, le développement de thérapies et l'accès à celles-ci.
Médicaments destinés aux enfants
Les enfants sont différents des adultes, dans leur physiologie et leur anatomie. Ils peuvent donc réagir différemment aux produits de santé. Les médicaments doivent être étudiés dans les populations pédiatriques pour s'assurer qu'ils soient sûrs et efficaces. Toutefois, ces études sont complexes et difficiles. À l'heure actuelle, jusqu'à 80 % des médicaments prescrits aux enfants au Canada sont considérés comme « hors indication », c'est-à-dire qu'ils sont utilisés en dehors de l'utilisation approuvée du médicament.
Pour relever ces défis, Santé Canada a établi en 2020 le plan d'action sur les médicaments pédiatriques. L'objectif de ce plan est d'améliorer l'accès des enfants à des produits de santé sûrs et efficaces.
Les premiers travaux sur le plan ont commencé, et les activités consistent à :
- Collaborer avec les organismes de réglementation du monde entier, notamment l'Agence européenne des médicaments, la Food and Drug Administration des États-Unis et l'Organisation mondiale de la santé. Ces collaborations permettent de renforcer notre expertise pédiatrique et d'aligner nos activités.
- Collaborer avec le Centre de formulations pédiatriques Goodman du Centre hospitalier universitaire Sainte-Justine pour améliorer l'accès aux formulations pédiatriques au Canada.
- Analyser les moyens d'encourager les entreprises à tester les produits de santé dans les populations pédiatriques lorsqu'approprié, et à soumettre des données pédiatriques à Santé Canada.
- Élaborer une stratégie canadienne de données pédiatriques pour analyser la disponibilité des produits de santé destinés aux enfants, les tendances des essais pédiatriques et les problèmes d'innocuité des médicaments associés à la pédiatrie.
Médicaments sans ordonnance
Santé Canada est responsable de l'examen des médicaments sans ordonnance, aussi appelés produits « en vente libre », pour s'assurer qu'ils soient sûrs, efficaces et de haute qualité. Ces produits comprennent, sans s'y limiter :
- les antiseptiques,
- les analgésiques,
- les médicaments contre le rhume et la toux,
- les écrans solaires,
- les désinfectants pour surfaces dures.
La nature de notre examen des médicaments sans ordonnance dépend de plusieurs facteurs. Ces éléments comprennent les ingrédients, les allégations santé et les données probantes nécessaires pour appuyer l'innocuité, l'efficacité et la qualité du produit. Santé Canada attribue un numéro d'identification du médicament (DIN) à chaque médicament sans ordonnance autorisé. Les Canadiens devraient rechercher ce numéro sur l'étiquette du produit, qui indique que le médicament a répondu à nos exigences.
À l'heure actuelle, les produits qui contiennent un phytocannabinoïde produit par la plante de cannabis ou présent dans celle-ci ne peuvent être prescrits que par un professionnel de la santé à des fins médicinales. Nous sommes conscients que certains Canadiens s'intéressent aux utilisations thérapeutiques potentielles du cannabis à des fins telles que le soulagement de la douleur, sans qu'il soit nécessaire de recourir à la surveillance d'un praticien (c'est-à-dire dans des produits « en vente libre »). En 2019, Santé Canada a mené une consultation sur le marché potentiel de ces produits de santé. Nous avons publié un rapport sommaire en 2020, lequel comprend un aperçu des commentaires reçus des Canadiens.
Dans le cadre de cette consultation, nous avons également créé un Comité consultatif scientifique sur les produits de santé contenant du cannabis. Ce comité nous fournira des conseils scientifiques et cliniques indépendants sur les considérations appropriées en matière d'innocuité, d'efficacité et de qualité des produits de santé contenant du cannabis. Santé Canada utilisera ces informations pour étayer sa démarche réglementaire concernant ces produits.
Pleins feux sur…
Notre science
En 2020, nos chercheurs se sont associés pour évaluer les effets des excipients sur la structure et la dynamique des principes actifs dans les produits biologiques à base de protéines recombinantes. Dans les médicaments biologiques, les excipients sont des substances qui protègent ou améliorent la stabilité ou la biodisponibilité des ingrédients pharmaceutiques actifs (la ou les substances responsables de l'activité pharmaceutique ou de la prévention de la maladie). L'étude était intitulée « Effects of Excipients on the Structure and Dynamics of Filgrastim Monitored by Thermal Unfolding Studies by CD and NMR Spectroscopy » (en anglais seulement). Ces travaux contribuent au développement et à la réglementation des formulations pour les produits biologiques.
Dr Yves Aubin
Chercheur scientifique,
Médicaments biologiques et radiopharmaceutiques
Grant Frahm
Chimiste de recherche,
Médicaments biologiques et radiopharmaceutiques
Dr Houman Ghasriani
Chimiste de recherche,
Médicaments biologiques et radiopharmaceutiques
Dr Michael Johnston
Chercheur scientifique,
Médicaments biologiques et radiopharmaceutiques
Clics santé : Aperçu des médicaments à usage humain
Pour demeurer au courant de nos activités :
- Suivez-nous sur Facebook
- Suivez-nous sur Twitter
- Suivez-nous sur YouTube
- Consultez les dernières nouvelles de Santé Canada sur notre site Web
- Trouvez d'autres renseignements liés à la santé sur le site du gouvernement du Canada
Vous pouvez également trouver des informations particulières sur les médicaments en suivant les liens ci-dessous.
Médicaments et vaccins contre la COVID-19
Le portail des vaccins et des traitements contre la COVID-19 fournit des informations aux consommateurs, aux professionnels de la santé et aux chercheurs sur les vaccins et les traitements autorisés contre la COVID-19, ainsi que sur ceux qui sont en cours d'examen.
Portail des vaccins et des traitements contre la COVID-19
La Liste des drogues autorisées indique les médicaments qui sont autorisés à être utilisés dans le contexte de la pandémie de COVID-19.
La Liste des demandes reçues indique les médicaments qui font présentement l'objet d'un examen en vue d'une utilisation dans le contexte de la pandémie de COVID-19.
Autorisation de médicament et de vaccin contre la COVID-19 : Liste des demandes reçues
Santé Canada publie des informations actualisées sur l'utilisation des désinfectants pour les surfaces et les antiseptiques pour les mains, des nettoyants et des savons en lien avec la COVID-19.
Désinfectants, antiseptiques, nettoyants et savons (COVID-19)
La Liste des essais cliniques autorisés montre les médicaments contre la COVID-19, y compris les vaccins, qui font actuellement l'objet d'essais cliniques autorisés par Santé Canada.
Médicaments et vaccins pour la COVID-19 : Liste des essais cliniques autorisés
Nouveaux médicaments approuvés
Le Registre des médicaments et des produits de santé fournit aux consommateurs de l'information sur les médicaments commercialisés à l'heure actuelle au Canada.
Registre des médicaments et des produits de santé
La Base de données sur les produits pharmaceutiques est une liste de tous les médicaments dont la vente est approuvée au Canada. Dans la base de données, de nombreux médicaments sont accompagnés de leur monographie de produit qui décrit les conditions d'utilisation du produit.
Base de données des produits pharmaceutiques
Recherchez les données sur les tests et les essais réalisés avec les médicaments dans le but d'évaluer leur efficacité et leur innocuité.
Renseignements cliniques sur les médicaments et produits de santé
Les Listes de présentations en cours d'examen montrent les médicaments évalués à l'heure actuelle par Santé Canada.
Listes des présentations en cours d'examen
La Liste des présentations de médicaments génériques en cours d'examen montre les médicaments génériques évalués à l'heure actuelle par Santé Canada.
Liste des présentations de médicaments génériques en cours d'examen
La Base de données des avis de conformité répertorie les homologations (avis de conformité ou AC) délivrées pour les nouveaux médicaments.
Base de données des avis de conformité
Les sommaires des décisions réglementaires décrivent l'objet d'une présentation de médicament ainsi que les motifs expliquant la décision prise par Santé Canada de l'approuver ou de la rejeter.
Sommaire des décisions réglementaires
Les sommaires des motifs de décision détaillent les considérations réglementaires, sécuritaires et reliées à l'efficacité et la qualité du produit prises en compte par Santé Canada lors de sa décision d'approuver certaines présentations de médicament.
Pénuries de médicaments
Le site Web des Pénuries de médicaments au Canada fournit de l'information sur les pénuries de médicaments réelles et prévues ainsi que sur l'arrêt de la production.
Essais cliniques des médicaments
La base de données des essais cliniques fournit une liste d'informations spécifiques relatives aux essais cliniques de phase I, II et II, menés sur des patients, qui ont été approuvés pour des médicaments au Canada.
Surveillance des médicaments
Signaler un effet indésirable à un médicament
Vous pouvez déclarer les effets indésirables des médicaments à votre professionnel de la santé, à un hôpital ou à l'entreprise qui a fabriqué le produit. Vous pouvez aussi les déclarer à Santé Canada par l'entremise du Programme Canada Vigilance ou par téléphone en composant le 1-866-234-2345.
La Base de données des rappels et des avis de sécurité comprend les rappels, les avis, les alertes de sécurité et les autres publications de Santé Canada.
Base de données des rappels et des avis de sécurité
Les résumés de l'examen de l'innocuité sont des résumés des examens des problèmes d'innocuité potentiels des médicaments que nous avons réalisés.
Résumés de l'examen de l'innocuité
Les nouveaux examens de l'innocuité ou de la sûreté et de l'efficacité sont des tableaux qui présentent les examens en cours à Santé Canada.
Nouveaux examens de l'innocuité ou de la sûreté et de l'efficacité
L'InfoVigilance sur les produits de santé est une publication mensuelle destinée principalement aux professionnels de la santé. L'InfoVigilance sur les produits de santé fournit de l'information pertinente du point de vue clinique sur les produits de santé et leur innocuité.
InfoVigilance sur les produits de santé
Les tableaux récapitulatifs des plaintes en matière de publicité présentent les plaintes relatives à la publicité sur les produits de santé qui ont été déposées auprès de Santé Canada et les mesures que nous avons prises.
Plaintes relatives à la publicité des produits de santé
La Base de données en ligne des effets indésirables de Canada Vigilance contient de l'information sur les effets indésirables soupçonnés des produits de santé. Ces déclarations ont été soumises par des consommateurs et des professionnels de la santé ainsi que par des fabricants et des distributeurs de médicaments.
Base de données en ligne des effets indésirables de Canada Vigilance.
Médicaments à usage humain : Cycle de vie
Dans le cadre de la mission de Santé Canada qui consiste à aider les Canadiens à maintenir et à améliorer leur santé, nous évaluons les médicaments avant qu'ils n'arrivent sur le marché canadien et continuons de surveiller les données probantes du monde réel pendant qu'ils sont sur le marché. Santé Canada s'investit tout au long du cycle de vie d'un médicament à usage humain, y compris durant les essais cliniques et une fois que le médicament est vendu au Canada.
Essais cliniques
Les essais cliniques sont menés par les promoteurs (fabricants ou chercheurs) pour recueillir des renseignements sur l'innocuité et l'efficacité d'un médicament chez l'être humain. Les promoteurs d'essais cliniques soumettent leurs demandes pour mener un essai clinique sur un médicament au Canada. Santé Canada examine ces demandes avant que l'essai soit mené au Canada.
Programme d'accès spécial
Les médicaments qui ne sont pas approuvés au Canada peuvent être disponibles par l'entremise de notre Programme d'accès spécial. Par ce programme, l'accès est donné à un praticien de la santé qui traite un patient particulier. L'accès peut être accordé en cas d'urgence ou aux patients souffrant d'une condition grave ou mettant leur vie en danger, lorsque les thérapies traditionnelles se sont révélées inefficaces, ne sont pas disponibles ou ne conviennent pas.
Présentation et examen des médicaments
Lorsqu'une entreprise décide qu'elle souhaite commercialiser un médicament au Canada, elle dépose une présentation auprès de Santé Canada. Une présentation de drogue nouvelle contient des renseignements scientifiques détaillés sur l'innocuité, la qualité et l'efficacité du médicament.
Nos scientifiques et nos médecins-conseils procèdent à un examen approfondi des informations soumises. Parfois, nous consultons également des comités consultatifs ou des consultants externes. Les évaluateurs examinent les données sur l'innocuité, l'efficacité et la qualité afin d'évaluer les avantages et les risques du médicament. Ils examinent également les renseignements au sujet du médicament qui seront fournis aux professionnels de la santé et aux consommateurs.
Voies d'examen accéléré
Nous disposons de plusieurs processus d'examen qui peuvent fournir une voie accélérée pour certains médicaments, y compris ceux qui ciblent des besoins de soins de santé précis. Autrement dit, il existe plusieurs voies d'examen dont les cibles d'examen peuvent être plus courtes pour certains médicaments. Les produits approuvés par les voies d'examen accéléré peuvent être rendus accessibles aux patients plus tôt.
L'examen prioritaire : Les médicaments destinés à traiter des maladies ou des conditions graves, potentiellement mortelles ou très débilitantes peuvent faire l'objet d'un examen prioritaire. Les présentations de médicaments qui obtiennent le statut d'évaluation prioritaire sont soumises à un processus d'examen accéléré.
Avis de conformité avec conditions : Lorsqu'un nouveau médicament est approuvé, il reçoit un avis de conformité (AC). Un avis de conformité peut être émis avec conditions (AC-C) pour un médicament qui a démontré un avantage clinique prometteur, pour des maladies ou des conditions graves, potentiellement mortelles, ou très débilitantes. Le fabricant doit tout de même démontrer que le médicament a un profil d'innocuité acceptable et qu'il est de grande qualité, et il s'engage à entreprendre des études supplémentaires pour en vérifier les avantages cliniques. Les présentations qui sont examinées dans le cadre de cette voie sont soumises à un processus d'examen accéléré.
Approbation des médicaments
Après avoir examiné une présentation de drogue, Santé Canada peut conclure que les avantages du produit l'emportent sur les risques et approuver la vente du médicament au Canada. Lorsqu'un nouveau médicament est approuvé, il reçoit un avis de conformité (AC) et un numéro d'identification de médicament (DIN). Cela ne signifie pas que le médicament sera immédiatement disponible au Canada, car de nombreux autres facteurs peuvent influencer le délai de mise en marché.
Surveillance
Il est impossible de savoir ou de prédire tous les effets indésirables potentiels d'un médicament dans le cadre d'études cliniques. Une fois qu'un produit est approuvé et disponible pour la vente au Canada, nous continuons de surveiller son utilisation dans le monde réel, c'est-à-dire auprès des citoyens canadiens en général qui prennent peut-être d'autres médicaments. Nous évaluons les problèmes potentiels d'innocuité et d'efficacité, et prenons des mesures au besoin.
Collecte de renseignements
Santé Canada recueille des renseignements sur l'innocuité d'un produit après son approbation auprès de diverses sources. Les effets indésirables présumés déclarés après l'approbation de la vente des produits constituent une source d'information. Les réactions indésirables sont des effets non souhaités potentiellement causés par des médicaments.
Vous pouvez déclarer les effets indésirables des médicaments à votre professionnel de la santé, à un hôpital ou à l'entreprise qui a fabriqué le produit. Vous pouvez aussi les déclarer à Santé Canada par l'entremise du Programme Canada Vigilance ou par téléphone en composant le 1-866-234-2345.
Les plans de gestion des risques soumis par les fabricants dans le cadre de leurs présentations de médicaments sont d'autres sources d'information. Un plan de gestion des risques comprend des renseignements sur le profil d'innocuité d'un médicament ainsi que sur la prévention et la réduction des risques qui y sont associés. Il contient aussi des plans d'études et d'autres activités permettant d'en apprendre davantage à propos de l'innocuité et de l'efficacité du médicament.
Évaluation des signaux d'innocuité
Santé Canada évalue les données que nous recueillons pour déceler tout nouveau signal d'innocuité, qui sera ensuite examiné de plus près. Un « signal d'innocuité » peut être défini comme un renseignement sur un effet indésirable, nouveau ou connu, qui peut être associé à un médicament. Ces enquêtes sont appelées évaluations des signaux d'innocuité et elles peuvent donner lieu à des recommandations de mesures à prendre par l'entreprise, par Santé Canada ou par les deux. Ces mesures peuvent comprendre la transmission de nouveaux renseignements relatifs à l'innocuité aux Canadiens et aux professionnels de la santé ou la recommandation de modifications aux étiquettes. Dans les situations les plus graves, nous pouvons retirer un médicament du marché.
Plaintes relatives à la publicité
Santé Canada réglemente également la publicité visant les médicaments vendus au Canada pour s'assurer que les entreprises ne font pas de fausses allégations au sujet de leurs produits. Nous examinons les plaintes relatives à la publicité pour déterminer si une entreprise se conforme à nos exigences et nous prenons les mesures appropriées lorsqu'un cas de non-conformité est constaté. Nous pourrions demander à une entreprise de cesser de diffuser une publicité non conforme et de prendre des mesures pour éviter tout problème futur.
Note de bas de pages
- Note de bas de page 1
-
Nouveau médicament biosimilaire